Изобретение относится к области медицины и пригодно для лечения вирусных заболеваний кожи и слизистых оболочек, вызванных вирусом простого или опоясывающего герпеса, а также профилактики этих заболеваний у больных с нарушениями иммунной системы.
Создание препаратов для лечения вирусных поражений кожи и слизистых оболочек является особенно актуальным в настоящий период не только в связи со значительным ростом числа больных, но и отсутствием адекватных терапевтических средств. Ацикловир (или 9-(2-гидроксиэтоксиметил)гуанин), ингибируя процесс размножения вируса герпеса и не оказывая воздействия на клеточный метаболизм неинфицированных клеток, проявляет высокоизбирательный лечебный эффект.
В медицинской практике ацикловир применяется в виде различных лекарственных форм. Однако когда препарат предназначен для перорального введения в организм, одной из наиболее удобных для производства, хранения и употребления является твердая дозированная форма.
Ацикловир, как и большинство субстанций лекарственных средств, не обладает способностью к прямому таблетированию. Поэтому для получения твердой лекарственной формы ацикловира необходимо вводить в состав вспомогательные вещества в количествах, определяемых фармацевтической и терапевтической целесообразностью.
Известны различные фармацевтические композиции на основе ацикловира, выполненные в форме таблетки (Регистр лекарственных средств России. М.: Ремако, 1997). Однако конкретный качественный и количественный состав вспомогательных ингредиентов не приведен.
В патенте Российской федерации N 2106861, опубл. 1998, описана композиция, которая содержит, мас.%:
Активное соединение - 5,0-95,0
Фармацевтически приемлемая набухающая глина - 0,25-60,0
Целевые добавки - Остальное
В качестве активного соединения она может содержать вещества из разных фармакотерапевтических групп, в том числе ацикловир. В таблетку могут включаться целевые добавки, такие как связующие вещества и клеи, наполнители (например, микрокристаллическая целлюлоза), смазывающие добавки (например, соль стеариновой кислоты), и иные вспомогательные вещества (дезинтегрирующие, смачивающие (поверхностно-активные), вкусовые добавки и другие) в следующей концентрации, мас.%: наполнитель 0-95, предпочтительно 5-15, дезинтегрирующий агент 0-20, предпочтительно 0-5, связующие вещества и клеи 0-25, предпочтительно 0,5-2, смазывающая добавка 0,1-5, предпочтительно 0,25-2, иные вспомогательные вещества 0-15.
Поскольку набухающая глина (магнийалюмосиликатное соединение) обладает также связующим действием, введение в состав отдельного связующего компонента не является строго обязательным и имеет цель усилить прочность изготавливаемых таблеток. В качестве связующего компонента предлагается применять широкий ряд веществ, как, например, сахарозу, крахмальный клейстер, крахмальный растительный клей, крахмал, набухающий в холодной воде, желатин и другие. В конкретных примерах выполнения изобретения как связующее использовали повидон K30 (поливинилпирролидон со средней молекулярной массой 40000).
Присутствие в составе набухающей глины (магнийалюмосиликатного соединения) обеспечивает его легкую распадаемость в воде, в результате чего больной принимает препарат как вододиспергируемую таблетку, т.е. в виде водной дисперсии, что не всегда приемлемо, а применение данной композиции в качестве обычной таблетки предполагает нанесение пленочного покрытия. Кроме того, активное вещество должно быть предварительно переведено в тонкодисперсное состояние, и в таблетках с высокой дозой действующего соединения необходимо существенно повышать относительное содержание магнийалюмосиликатного соединения, что усложняет технологический процесс.
По совокупности существенных признаков наиболее близкой к заявляемой представляется фармацевтическая композиция в виде твердой дозированной формы, описанная в вышеуказанном патенте (патент РФ N 2106861), которая содержит следующие ингредиенты, мас.%:
Ацикловир - 72,6
Микрокристаллическая целлюлоза - 8,7
Кукурузный крахмал - 4,3
Натрийгликолат крахмала ("Эксплотаб") - 4,3
Сшитый полимер натрийкарбоксиметилцеллюлозы (Ac-Di-Sol) - 2,0
Лаурилсульфат натрия - 0,2
Поливинилпирролидон со средней молекулярной массой 40000 (Повидон K30) - 1,9
Коллидон CL (нерастворимый поливинилпирролидон) - 5,2
Стеарат магния - 0,8
Однако показатели качества указанной композиции нестабильны в ходе хранения, что существенно ограничивает срок годности препарата (до 18 месяцев). Кроме того, отсутствие в составе такого сильного дезинтегратора, как набухающая глина, существенно увеличивает время распадаемости таблетки, вследствие чего снижается скорость абсорбирования активного соединения в организме, его концентрация в крови и, соответственно, терапевтический эффект.
Способ получения данной композиции включает следующие этапы. Смесь действующего вещества с микрокристаллической целлюлозой, натрийгликолатом крахмала, структурированной натрийкарбоксиметилцеллюлозой (Ac-Di-Sol) и лаурилсульфатом натрия увлажняют 50% водно-спиртовым раствором повидона K 30, влажные гранулы сушат при температуре 50-80oC до остаточной влажности не более 4%, после просеивания смешивают с коллидоном CL и стеаратом магния и таблетируют. Однако применение в составе большого числа вспомогательных веществ усложняет технологический процесс.
Таким образом, по-прежнему актуальной является проблема создания противовирусного препарата на базе ацикловира, предназначенного для перорального применения в виде твердой дозированной формы, с быстрым высвобождением активного начала, который, безусловно, необходим для пополнения реестра лекарственных средств.
Техническим результатом, получаемым при реализации настоящего изобретения, является то, что новое противовирусное средство, предназначенное для перорального применения в виде твердой дозированной формы, устойчиво в течение достаточно длительного периода (не менее 3 лет) и при этом быстро распадается, тем самым легко высвобождая действующее вещество, что обеспечивает высокую скорость абсорбции ацикловира в желудочно-кишечном тракте, а также последовательность операций и их технологических параметров, позволяющих производить лекарственную форму требуемого качества, в частности с удовлетворительной прочностью.
Указанный технический результат достигается тем, что предлагаемое лекарственное средство с противовирусным действием, содержащее в качестве активного вещества ацикловир и в качестве вспомогательных веществ микрокристаллическую целлюлозу и соль стеариновой кислоты, дополнительно содержит поливинилпирролидон со средней молекулярной массой 2600 - 16000 и, необязательно, краситель при следующем соотношении ингредиентов, мас.%:
Ацикловир - 65,0-96,5
Микрокристаллическая целлюлоза - 3,0-28,8
Поливинилпирролидон со средней молекулярной массой 2600 - 16000 - 0,2-5,0
Соль стеариновой кислоты - 0,2-1,0
Краситель - 0-1,0
Заявляемое соотношение ингредиентов найдено экспериментально и обеспечивает соответствие качества композиции требованиям ГФ XI.
Введение в композицию низкомолекулярного поливинилпирролидона (со средней молекулярной массой 2600 - 16000) неожиданно позволило улучшить стабильность показателей качества и, таким образом, увеличить срок годности (свыше 3 лет) по сравнению с образцами, в которых низкомолекулярный поливинилпирролидон заменен на эквивалентное количество среднемолекулярного (средняя молекулярная масса свыше 20000) или высокомолекулярного поливинилпирролидона. Кроме того, включение в состав поливинилпирролидона с указанным интервалом молекулярной массы наряду с применением микрокристаллической целлюлозы и соли стеариновой кислоты в заявленных пределах существенно уменьшило время дезинтеграции лекарственной формы. Так, распадаемость таблеток с заявленным соотношением ингредиентов составила 1-3 минуты, что сравнимо с образцами, содержащими такой сильный дезинтегратор, как магнийалюмосиликатное соединение. Быстрая дезинтеграция заявленного состава и, соответственно, высокие показатели высвобождения действующего вещества - через 45 минут в среду растворения переходит более 96% ацикловира, существенно улучшили абсорбцию активного ингредиента. Предпочтительно применять поливинилпирролидон со средней молекулярной массой 9900 - 15300. Среднюю молекулярную массу поливинилпирролидона рассчитывали по значениям характеристической вязкости, которую, в свою очередь, вычисляют на основе измерений вязкости его водных растворов.
В качестве соли стеариновой кислоты могут быть использованы стеараты кальция, магния, цинка или других металлов.
Введение в состав лекарственной формы красителя значительно улучшает ее внешний вид за счет придания однородного приятного цвета. Оптимальная концентрация красителя в лекарственной форме составляет 0,01-1,0 маc.%. Нижний предел содержания красителя определяется наличием или отсутствием соответствующего эффекта, а верхний - экономической целесообразностью. В качестве красителя может быть применен индигокармин, тропеолин О или любой другой фармацевтически приемлемый краситель.
Несоблюдение найденных соотношений ингредиентов не дает возможности получить необходимое качество и стабильность композиции при хранении.
Предлагаемая фармацевтическая композиция выполняется в виде твердой лекарственной формы, предпочтительно в форме таблеток, что обеспечивает максимальную технологичность последующей фасовки и точность дозирования действующего вещества.
Способ получения заявляемого лекарственного средства, содержащего ацикловир и фармацевтически приемлемые вспомогательные вещества, включает смешение указанного активного вещества с наполнителем, увлажнение полученной смеси раствором низкомолекулярного поливинилпирролидона и, необязательно, красителя при массовом соотношении увлажнителя и активного вещества 1:(1,2-3,5) соответственно, влажное гранулирование, сушку до остаточной влажности 4-7%, сухое гранулирование, введение соли стеариновой кислоты и последующее формование гранул. Использование при получении гранулята заявляемого соотношения ацикловира и увлажнителя обеспечивает существенное повышение прочности таблетки. Соотношение рассчитывают на сухое активное вещество с учетом имеющейся в ацикловире влаги. В качестве увлажнителя можно применять раствор низкомолекулярного поливинилпирролидона в воде, спиртах или их смеси, в который при необходимости добавляют краситель.
Влажные гранулы сушат до остаточной влажности 4-7%. Более высокое влагосодержание вызывает слипание гранул, что затрудняет получение однородной смеси и проведение таблетирования, а при уменьшении влажности ухудшается прочность и возрастает отбраковка таблеток (сколы, расслоение). Предпочтительно вести сушку при температуре не выше 40oC.
Проведение после сушки сухого гранулирования улучшает адгезию между ингредиентами, что дополнительно повышает прочность ядра таблетки (до 17 кг, прочность на истирание не менее 99,4%).
Полученный фармацевтический состав соответствует требованиям ГФ XI (по внешнему виду, распадаемости, растворению и другим показателям), стабилен при хранении и имеет срок годности более 3 лет.
Фармакокинетические исследования заявляемого средства проводили на кроликах - самцах породы шиншилла после однократного введения препаратов per os в дозе 40 мг/кг. Найдено, что биодоступность нового состава статистически достоверно не отличалась от субстанции ацикловира, при этом концентрация ацикловира в крови через 1 час после введения эквивалентных доз действующего вещества была у предлагаемого состава на 13% больше, чем у субстанции.
Целью клинической апробации предлагаемого средства было изучение его клинической эффективности, переносимости и выявление возможных побочных действий при лечении больных простым, рецидивирующим герпесом (Herpes simplex) и опоясывающим лишаем (Herpes zoster). Клинические испытания были проведены на 30 больных (19 женщин и 11 мужчин) в возрасте от 16 до 75 лет с клиническими проявлениями герпетической инфекции на коже и слизистых оболочках, из них Herpes simplex был у 17 больных, генитальный герпес - у 4 больных и Herpes zoster - у 9 больных. Давность заболевания колебалась от 6 месяцев до 12 лет.
Предлагаемое средство назначали в виде монотерапии. При простом, рецидивирующем и генитальном герпесе по 200 мг (действующего вещества) 5 раз в день через каждые 4 часа в течение 5 дней, а при опоясывающем лишае - одномоментно по 800 мг каждые 4 часа 5 раз в день в течение 5 дней.
Терапевтическую активность оценивали по длительности острого периода (до момента образования корочек), полного заживления с отторжением корок, выраженности субъективных явлений (зуд, болезненность, жжение).
При лечении простого герпеса действие препарата проявлялось в короткий срок. Уже в первый день лечения отмечалось уменьшение, а порой и полное исчезновение зуда и жжения на коже в области высыпаний, а на 3-й - 4-й день отмечалось полное клиническое разрешение процесса. У больных рецидивирующим герпесом клинические проявления разрешались примерно в те же сроки, что и простого герпеса. Первоначально (на 2-3 день) снимались островоспалительные явления, а полное разрешение процесса наступало на 5-6 день. При генитальном герпесе вначале наблюдалось исчезновение неприятных ощущений (жжения, зуда), а затем к 4-5 дню от начала лечения - исчезновение клинических проявлений. У пациентов с Herpes zoster также наблюдался выраженный терапевтический эффект. К 8-10 дню от начала лечения уменьшались болезненность, жжение, гиперемия теряла яркую окраску, подсыхали везикулы.
В процессе лечения не было отмечено осложнений или побочных явлений. Анализ лабораторных исследований, проведенных в динамике, не выявил ни в одном случае каких-либо отклонений от нормы, т.е. предлагаемое средство не оказывает побочного или токсического действия на кроветворный аппарат и функцию почек.
Таким образом, данные проведенных клинических испытаний нового состава при лечении герпетической инфекции позволяют заключить, что предлагаемое средство обладает выраженной противовирусной активностью, эффективно при всех вышеуказанных формах герпеса, особенно при назначении его на ранней стадии заболевания, и может быть рекомендовано для широкого медицинского применения.
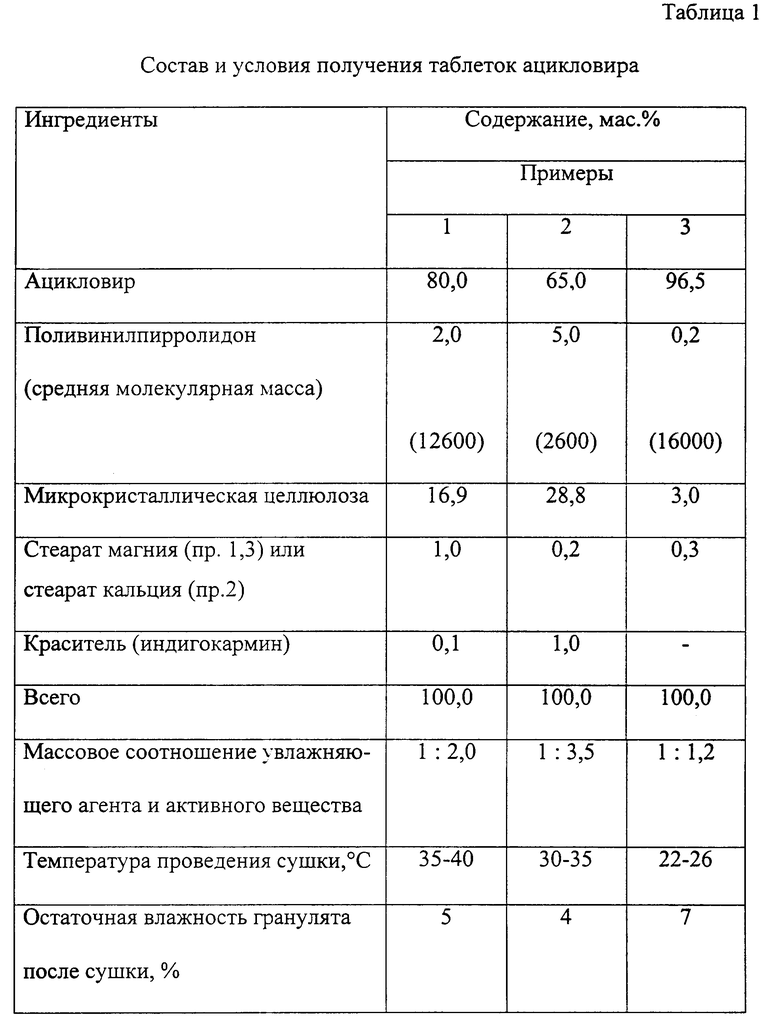
Изобретение иллюстрируется следующими примерами (см. таблицы 1 и 2).
Пример 1. Предварительно готовят раствор 4,83 г (2,0 мас.%) поливинилпирролидона со средней молекулярной массой 12600 и 0,242 г (0,1 мас.%) индигокармина в смеси дистиллированной воды и этанола (1:1) и увлажняют им смесь порошков ацикловира (204,5 г, влага - 5,5%; 80 мас.%) и микрокристаллической целлюлозы (40,8 г; 16,9 мас.%), перемешивают до равномерного распределения влаги и однородности окраски массы и гранулируют. Влажные гранулы сушат до остаточной влажности 5% при температуре 35-40oC. После сухого гранулирования к измельченному грануляту добавляют 2,4 г (1,0 мас.%) стеарата магния и смесь таблетируют. Полученные таблетки со средней массой 0,25 г удовлетворяют требованиям на фармацевтическое средство.
Примеры 2, 3 выполняют аналогично. Полученные таблетки удовлетворяют требованиям на фармацевтическое средство. Результаты и условия изготовления таблеток представлены в таблицах 1 и 2.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИГИПЕРТЕНЗИВНЫМ И ДИУРЕТИЧЕСКИМ ДЕЙСТВИЕМ, И СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2002 |
|
RU2201751C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КАРДИОСЕЛЕКТИВНЫЙ БЕТА-АДРЕНОБЛОКАТОР, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2190397C1 |
| ПРОТИВОГИСТАМИННОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2000 |
|
RU2164796C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2175230C1 |
| ФАРМАЦЕВТИЧЕСКАЯ ПРОТИВОЯЗВЕННАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2179022C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИГИПЕРТЕНЗИВНЫМ ДЕЙСТВИЕМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2000 |
|
RU2169005C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОМИКРОБНЫМ ДЕЙСТВИЕМ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2002 |
|
RU2230557C1 |
| ПРОТИВОВИРУСНЫЙ ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ | 2000 |
|
RU2179851C1 |
| АНТИБАКТЕРИАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2001 |
|
RU2182825C1 |
| АНТИАРИТМИЧЕСКАЯ, АНТИАНГИНАЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2002 |
|
RU2212236C1 |

Изобретение относится к медицине, в частности к фармакологии, касается противовирусного средства в виде твердой дозированной формы, содержащего ацикловир, микрокристаллическую целлюлозу, соль стеариновой кислоты, низкомолекулярный поливинилпирролидон и, необязательно, краситель в определенном соотношении, и способа его получения. Противовирусное средство получают путем смешения активного вещества с наполнителем, увлажнения смеси, влажного гранулирования, сушки, сухого гранулирования, введения соли стеариновой кислоты и последующего формования гранул. 2 с. и 4 з.п. ф-лы, 2 табл.
Ацикловир - 65,0 - 96,5
Микрокристаллическая целлюлоза - 3,0 - 28,8
Поливинилпирролидон со средней молекулярной массой 2600 - 16000 - 0,2 - 5,0
Соль стеариновой кислоты - 0,2 - 1,0
Краситель - 0 - 1,0
2. Противовирусное средство по п.1, отличающееся тем, что содержит поливинилпирролидон со средней молекулярной массой 9900 - 15300.
| ПРОТИВОВИРУСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО "ГЕРПЕВИР" ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 1998 |
|
RU2138265C1 |
| ПРОТИВОВИРУСНЫЙ ПРЕПАРАТ "ПОЛИРЕМ" | 1994 |
|
RU2071323C1 |
| СОСТАВ ДЛЯ ЛЕЧЕНИЯ ВИРУСНЫХ ЗАБОЛЕВАНИЙ КОЖИ | 1996 |
|
RU2105545C1 |
| Способ получения 2-амино-9-(2-оксиэтоксиметил)-9Н-пурина (его варианты) | 1984 |
|
SU1373323A3 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Устройство для подключения технологического шланга к патрубку компрессора | 1988 |
|
SU1523865A1 |
Даты
2000-12-10—Публикация
2000-04-27—Подача