Область техники
Настоящее изобретение относится к новым нитрооксипроизводным стероидов, их фармацевтическим составам для местного применения и к их применению для лечения заболеваний или нарушений кожи или слизистой оболочки.
Предшествующий уровень техники
Большая часть заболеваний или нарушений кожи или слизистой оболочки являются результатом воспаления, вызванного воспалительными агентами, такими как, но не ограничиваясь этим, бактериальные, грибковые, вирусные, паразитные, аутоиммунные, аллергические, гормональные и/или злокачественные воспалительные агенты. В большинстве случаев распространенные кожные заболевания или нарушения включают, но не ограничиваются этим, чувствительный к кортикостероидам дерматоз, атопический дерматит, воспаление, экзему, эритему, образование папул, шелушение, эрозию, выделение, образование струпьев, зуд, псориаз, буллезный эпидермолиз, эритему, гнойный гидраденит, бородавки, опрелость, окаймленную экзему, красный плоский лишай.
Дерматит и экзема являются результатом воспалительных процессов, в которые вовлечены верхние слои дермы и эпидермис кожи. Когда развивается экзема, кератиноциты в эпидермисе отделяются друг от друга, и жидкость накапливается там между ними в процессе, известном как межклеточный отек.
В хронических формах экземы или дерматита основное изменение включает утолщение эпидермиса, которое приводит к зуду, шероховатости и шелушению поверхности кожи. Потеря кожей воды приводит к воспалению рогового слоя, что позже приводит к потрескавшейся и воспаленной коже. Дерматит дополнительно классифицируют как контактный дерматит (аллергический или неаллергический), атопический дерматит и себорейная экзема. Неаллергический контактный дерматит возникает в ответ на раздражители кожи, такие как кислоты, щелочи, масла, детергенты и растворители.
Аллергический контактный дерматит возникает в результате сенсибилизации при повторном воздействии антигена. Аллергический контактный дерматит появляется на тех участках кожи, которые находятся в непосредственном контакте с антигеном. Атопический дерматит, который поражает главным образом младенцев, характеризуется сенсибилизацией кожи к широкому диапазону гетерогенных антигенов. Себорейная экзема поражает волосистую часть кожи головы и другие волосистые участки, лицо и разгибательные поверхности и является результатом действия дрожжей или бактерий, вызывающих воспаление. Большинство людей страдают от перхоти, что является мягкой формой себорейной экземы. Псориаз является основным аутосомным наследственным воспалительным заболеванием, характеризующимся увеличенной пролиферацией кератиноцитов, что приводит к образованию чешуйчатых бляшек, например, на коленях, локтях, ягодицах, которые эстетически неприятны и вызывают дискомфорт у страдающего субъекта.
Нарушения или заболевания кожи обычно лечат кремами, гелями или мазями, содержащими стероидные агенты и/или антибактериальные агенты и/или противогрибковые агенты.
Кортикостероиды для местного применения являются мощным инструментом для лечения кожных заболеваний.
В клинической практике, например, применение чрезвычайно сильнодействующих стероидов для местного применения обычно ограничено только двумя неделями, поскольку их применение может быть связано с побочными эффектами, такими как атрофия кожи, жжение, зуд, раздражение, сухость, фолликулит, гипертрихоз, акне, гипопигментация, периоральный дерматит, аллергический контактный дерматит, мацерация кожи и вторичная инфекция.
Хотя местное применение кортикостероидов минимизирует побочные эффекты по сравнению с системным применением, активные соединения еще абсорбируются в систему кровообращения, где они системно активны. Системная абсорбция применяющихся местно кортикостероидов может привести к обратимой супрессии системы гипоталамус-гипофиз-надпочечник (НРА), симптомам типа синдрома Кушинга, гипергликемии, влиянию на рост костей у детей и на плотность костей у пожилых, глазным осложнениям (образование катаракты и глаукома) и атрофии кожи. Кроме того, результатом применения местного стероида может явиться тахифилаксия.
Хотя современные глюкокортикостероиды являются намного более безопасными, чем те, которые вводились первоначально, объектом исследований все еще остается производство новых молекул и составов, имеющих улучшенную клиническую эффективность и уменьшенные побочные эффекты.
Было разработано множество протоколов, чтобы попытаться увеличить эффективность и/или действенность местных агентов, хотя до сих пор такие протоколы приводили к ограниченному успеху. Например, в попытке увеличить эффективность доставки предоставляются дерматологические агенты во множестве местных составов, таких как кремы, лосьоны, гели и т.д. Однако, несмотря на предоставление возможности прямого, локализованного применения дерматологического агента на поверхности кожи, эти местные составы не обеспечивают полного решения проблемы, поскольку обычно происходит только частичное улучшение даже при оптимальном составе, например, часто остаются не поддающиеся воздействию повреждения кожи, и/или время лечения заметно не укорачивается.
Патент США 4,335,121 раскрывает S-фторметиловый эфир 6α,9α-дифтор-17α-(1-оксопропокси)-11β-гидрокси-16α-метил-3-оксиандроста-1,4-диен-17β-карботиокислоты (известный под родовым названием флутиказон пропионат) и его производные, и эти соединения имеют хорошую противовоспалительную активность, в частности при местном применении.
ЕР 0929565 раскрывает сложные нитрооксиэфиры кортикостероидов, которые в числе системных применений могут быт использованы для лечения дерматологических заболеваний; в частности, патент раскрывает сложные нитрооксиэфиры кортикостероидов, в которых нитроксигруппа ковалентно связана через алкильную цепочку с глюкокортикоидным фрагментом. Этот документ сообщает, что эти нитропроизводные стероидов после системного введения показывали увеличенную эффективность и улучшенную системную переносимость, такую как улучшенная желудочная переносимость, уменьшенные сердечно-сосудистые побочные эффекты по сравнению с их исходными соединениями.
WO 03/064443 раскрывает нитрооксипроизводные кортикостероидов, в которых нитрооксигруппа ковалентно связана через ароматическое или гетероарильное кольцо, содержащее линкер, с глюкокортикоидным фрагментом. Документ сообщает, что эти нитрооксипроизводные стероидов после системного введения демонстрируют улучшенную фармакологическую активность и сниженные побочные эффекты по сравнению с их исходными соединениями.
WO 00/61604 раскрывает нитрооксипроизводные кортикостероидов, в которых нитрооксигруппа ковалентно связана через «антиоксидантный фрагмент» с глюкокортикоидным фрагментом, при этом такие «антиоксидантные фрагменты» являются соединениями, способными предотвратить производство свободных радикалов, и выбраны на основе тестов, описанных в патентной заявке. Документ сообщает, что эти соединения могут быть использованы для лечения патологий, связанных с условиями окислительного стресса, при которых соответствующие исходные соединения демонстрируют более низкую активность или более высокую токсичность.
Указанные выше документы не раскрывают активность нитрооксипроизводных кортикостероидов после топического введения и, в частности, не сообщают какой-либо информации, касающейся переносимости при местном применении этих соединений.
WO 97/34871 раскрывает стероиды, содержащие в качестве заместителей нитро- и нитрозогруппы, и их применение для лечения респираторных нарушений, в частности описана на пульмональной модели аллергической астмы и воспаления легких активность 9-фтор-11β-гидрокси-16α,17α-[(1-метилэтилиден)бис(окси)]прегна-1,4-диен-3,20-дион-21(4-нитроокси)-бутаноата. Патентная заявка не упоминает применение соединений в лечении кожных заболеваний.
Работа Hyun E. и соавт., British Journal of Pharmacology (2004) 143, 618-625 относится к изучению активности гидрокортизона 21-[4'-(нитрооксиметил)бензоат] на модели раздражительного острого дерматита, в этом исследовании оценивали образование отека и рекрутмента лейкоцитов, и результаты демонстрируют, что соединение имеет более высокую противовоспалительную активность, чем исходное соединение гидрокортизон. Документ не сообщает какой-либо информации, касающейся воздействия соединения на кожу после продолжительного лечения. Кроме того, для экспериментальной модели, описанной Hyun E. и соавт., не предсказывается применение для других дерматологических нарушений.
Раскрытие изобретения
Настоящее изобретение решает вышеуказанные проблемы, предоставляя новые нитрооксипроизводные кортикостероидов, имеющие улучшенный фармакологический профиль, улучшенные фармакокинетические и фармакодинамические свойства и сниженные побочные эффекты, в частности, соединения изобретения демонстрируют улучшенную переносимость при местном применении, такую как уменьшение побледнения кожи и атрофии кожи, быстрое начало действия и увеличенная эффективность по сравнению с существующими кортикостероидами для местного применения. В частности, нитрооксипроизводные кортикостероидов настоящего изобретения более эффективны, чем исходные лекарственные средства, в уменьшении местного воспаления, опосредованного вазодилатацией, что приводит к уменьшению отека и инфильтрации воспалительных медиаторов. Объектом настоящего изобретения являются соединения общей формулы (I)
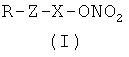 ,
,
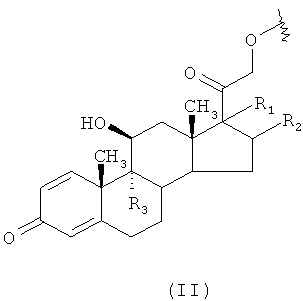
где R означает кортикостероидный остаток формулы (II):
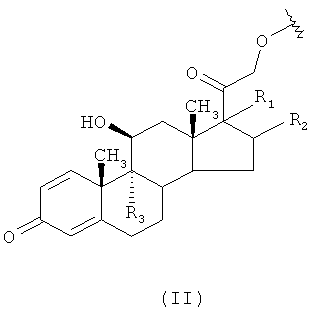 ,
,
где R1 означает -OC(O)OmRi, где m означает 0 или 1, Ri означает разветвленный или линейный C1-С10 алкил, предпочтительно Ri означает разветвленный или линейный C1-С6 алкил, предпочтительными Ri группами являются: метил, этил, н-пропил, н-бутил;
R2 означает атом водорода или -СН3;
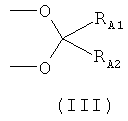
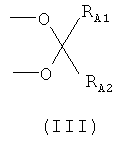
или R1 и R2, взятые вместе, являются группой формулы (III)
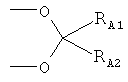 ,
,
где RA1 и RA2 независимо выбраны из Н, C1-С10 линейной или разветвленной алкильной цепи, предпочтительно (C1-C5) алкила; более предпочтительно RA1 и RA2 означают -СН3, и группа формулы (III) означает изопропилидендиокси;
R1 и R2 могут быть связаны с атомами углерода в 16 или 17 стероидной структуры в положении α или β;
R3 означает атом водорода или атом фтора;
предпочтительно в формуле (II) R1, R2 и R3 имеют следующие значения:
- R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III), где RA1 и RA2 означают -СН3, R3 означает атом фтора; или
- R1 означает -OC(O)OmRi в положении α, где m означает 1, и Ri означает этил, и R2 и R3 означают атомы водорода; или
- R1 означает -ОС(O)OmRi в положении α, где m означает 0, Ri означает н-бутил, R2 означает -СН3 в положении β, R3 означает атом фтора;
Z означает группу, способную связывать X, выбранную из группы, состоящей из: -С(O)-, -С(O)O- или
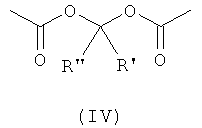 ,
,
где R' и R'' независимо выбраны из Н или линейного или разветвленного C1-C4 алкила; предпочтительно Z означает -С(O)- или -С(O)O-;
Х означает бивалентный радикал, имеющий следующие значения:
a) линейный или разветвленный C1-C20 алкилен, предпочтительно линейный или разветвленный C1-С10 алкилен, при необходимости замещенный одним или более заместителями, выбранными из группы, состоящей из: атомов галогена, гидрокси, -ONO2 или Т, где Т означает -ОС(O)(C1-C10алкил)-ONO2 или -O(C1-C10)алкил)-ONO2; предпочтительно Х означает линейный C1-С10 алкилен;
b) C5-C7 циклоалкиленовая группа, при необходимости замещенная линейной или разветвленной C1-C10 алкильной группой, предпочтительно СН3;
c)
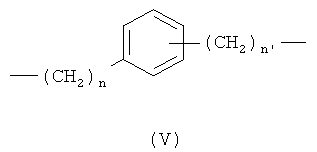
d)
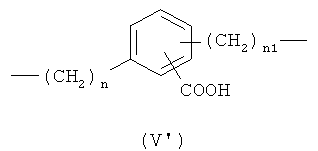 ,
,
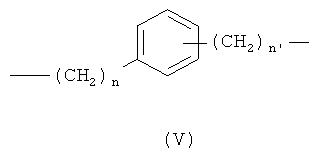
где n означает целое число от 0 до 20, предпочтительно n означает целое число от 0 до 5; более предпочтительно n означает 0 или 1;
n1 означает целое число от 1 до 20, предпочтительно n1 означает целое число от 1 до 5; более предпочтительно n1 означает 1;
е)
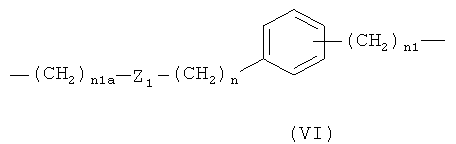 ,
,
где n1a означает целое число от 1 до 20, предпочтительно n1a означает целое число от 1 до 10;
Z1 означает -С(O)O- или -ОС(O)-; предпочтительно Z1 означает -С(O)O-;
n является таким, как определено выше;
n1 является таким, как определено выше;
предпочтительно в формуле (VI) n1a означает целое число от 1 до 10;
Z1 означает -С(O)O-, n означает 0 или 1 и n1 означает 1;
при условии, что когда Х выбирают из бивалентных радикалов, упомянутых под с)-е), -ONO2; группа формулы (I) связана с -(СН2)n 1-группой;
f)
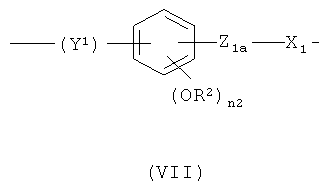 ,
,
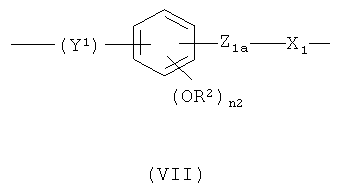
где Y1 означает -СН2-СН2-(СН2)n2a- или -CH=CH-(CH2)n 2a-, где n2a означает целое число от 0 до 10; предпочтительно n2a означает 0 или означает целое число от 1 до 6;
Z1a означает -ОС(O)- или -С(O)O-;
n2 означает 0 или 1; предпочтительно n2 означает 1;
R2 означает Н или СН3; предпочтительно R2 означает СН3;
X1 означает -(СН)n 1a-, где n1a является таким, как определено выше, или бивалентный радикал формулы (V), где n и n1 являются такими, как определено выше;
предпочтительно в формуле (VII) Y1 означает -СН-СН-(СН2)n 2a-, где n2a означает 0, Z1a означает -ОС(O)-, n2 означает 1, R2 означает СН3, X1 означает -(СН)n 1a-, где n1a означает целое число от 1 до 10;
при условии, что в формуле (VII) -ONO2 группа формулы (I) связана с X1 группой;
g)
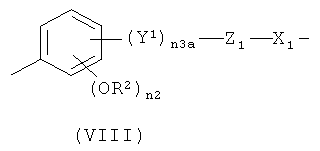 ,
,
где Y1 означает -СН2-СН2-(СН2)n 2a- или -СН=CH-(CH2)n 2a-, где n2a означает целое число от 0 до 10; предпочтительно n2a означает 0 или n2a означает целое число от 1 до 6;
n3a означает 0 или 1;
Z1 означает -С(O)O- или -ОС(O)-;
n2 означает 0 или 1; предпочтительно n2 означает 1;
R2 означает Н или СН3; предпочтительно R2 означает СН3;
X1 означает -(СН)n1a-, где n1a является таким, как указано выше, или бивалентный радикал формулы (V), где n и n1 являются такими, как определено выше;
предпочтительно в формуле (VIII) n3 означает 1, Y1 означает -СН=СН-(СН2)n 2a-, где n2 означает 0, Z1 означает -С(O)O-, n2 означает 1, R2 означает СН3, X1 означает -(СН)n 1a-, где n1a означает целое число от 1 до 10; или в формуле (VIII) n3a означает 0, Z1 означает -ОС(O)- или -С(O)O-, n2 означает 1, R2 означает СН3 и X1 означает -(СН)n 1a-, где n1a означает целое число от 1 до 10;
при условии, что в формуле (VIII) -ONO2 группа формулы (I) связана с X1 группой;
h)
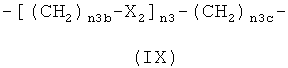 ,
,
где Х2 означает -О- или -S-, предпочтительно Х2 означает -O-;
n3 означает целое число от 1 до 6, предпочтительно от 1 до 4, и n3b означает целое число от 1 до 10, предпочтительно от 1 до 6, более предпочтительно n3b означает 1 или 2;
n3c означает целое число от 1 до 10, предпочтительно от 1 до 6, более предпочтительно n3c означает 2;
i)
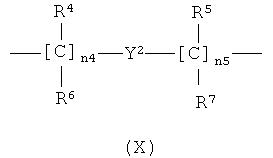 ,
,
где n4 означает целое число от 0 до 10;
n5 означает целое число от 1 до 10;
R4, R5, R6, R7 являются одинаковыми или различными и означают Н или линейный или разветвленный C1-C4 алкил, предпочтительно R4, R5, R6, R7 означают Н;
где -ONO2 группа формулы (I) связана с
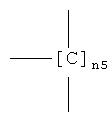 ,
,
где n5 является таким, как определено выше;
Y2 является гетероциклическим насыщенным, ненасыщенным или ароматическим 5- или 6-членным кольцом, содержащим один или более гетероатомов, выбранных из азота, кислорода, серы,
и выбран из
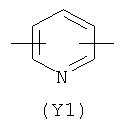 ,
,  ,
, 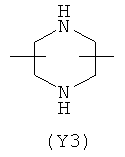 ,
, 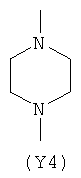 ,
, 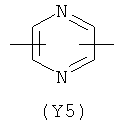 ,
,
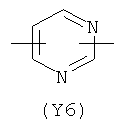 ,
, 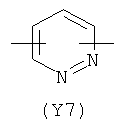 ,
, 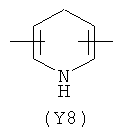 ,
, 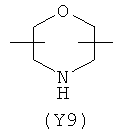 ,
, 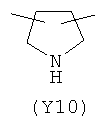 ,
,
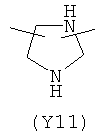 ,
, 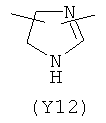 ,
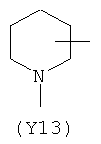
, 
при условии, что когда в формуле (I) Z означает -С(O)- и в формуле (II) R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III), где RA1 и RA2 означают -СН3, R3 означает атом фтора, тогда Х не имеет следующее значение:
а) линейный или разветвленный C1-C20 алкилен, предпочтительно линейный или разветвленный C1-C10 алкилен, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей из: атомы галогена, гидрокси, -ONO2 или Т, где Т означает -ОС(O)(C1-С10алкил)-ONO2; или -O(C1-C10алкил)-ONO2;
предпочтительно Х означает линейный C1-C10 алкилен;
предпочтительными бивалентными радикалами Х являются:
а) линейный C1-C10 алкилен;
с)
 ,
,
где n означает 0 или 1, и n1 означает 1;
e)
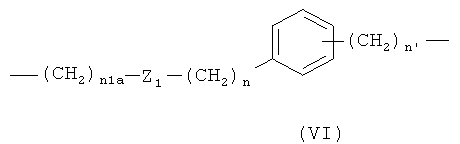 ,
,
где n1a означает целое число от 1 до 10, Z1 означает -С(O)O- или -ОС(O)-, n означает 0 или 1 и n1 означает 1;
при условии, что когда Х выбирают из бивалентных радикалов, упомянутых под с)-e), -ONO2 группа формулы (I) связана с -(СН2)n 1-группой;
f)
 ,
,
где Y1 означает -CH=СН-(CH2)n 2a-, где n2a означает 0, Z1a означает -ОС(O)-, n2 означает 1, R2 означает СН3, X1 означает -(СН)n 1a-, где n1a означает целое число от 1 до 10;
при условии, что в формуле (VII) -ONO2 группа формулы (I) связана с X1 группой;
g)
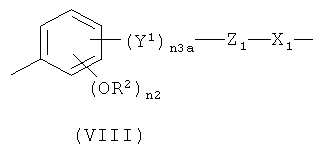 ,
,
где n3a означает 1, Y1 означает -CH=CH-(CH2)n 2a-, где n2a означает 0, Z1 означает -С(O)O-; n2 означает 1, R2 означает СН3, X1 означает -(СН)n 1a-, где n1a означает целое число от 1 до 10;
или в формуле (VIII) n3a означает 0, Z1 означает -ОС(O)- или -С(O)O-; n2 означает 1, R2 означает СН3, и X1 означает -(СН)n 1a-, где n1a означает целое число от 1 до 10;
при условии, что в формуле (VIII) -ONO2 группа формулы (I) связана с X1 группой;
h)
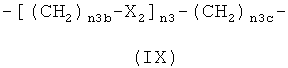 ,
,
где Х2 означает -O-;
n3 означает целое число от 1 до 4,
n3b означает 1 или 2;
n3c означает 2;
Одним из предпочтительных вариантов осуществления настоящего изобретения являются соединения формулы (I)
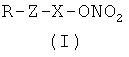 ,
,
где R является кортикостероидным остатком формулы (II), приведенной выше, где:
- R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III), где RA1 и RA2 означают -СН3, R3 означает атом фтора; или
- R1 означает -ОС(O)OmRi в положении α, где m означает 1 и Ri означает этил, R2 и R3 означают атомы водорода; или
- R1 означает -OC(O)OmRi в положении α, где m означает 0, Ri означает н-бутил, R2 означает -СН3 в положении β, R3 означает атом фтора;
Z означает -С(O)- или -С(O)O-;
Х имеет следующие значения:
а) линейный C1-С10 алкилен;
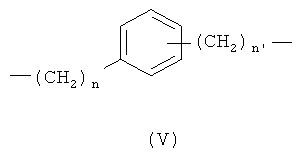
с)
 ,
,
где n означает 0 или 1, и n1 означает 1;
е)
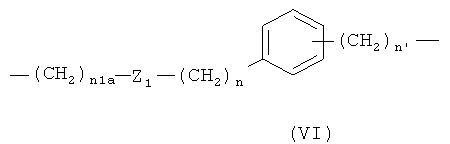 ,
,
где n1a означает целое число от 1 до 10, Z1 означает -С(O)O- или -ОС(O)-, n означает 0 или 1, и n1 означает 1;
при условии, что когда Х выбирают из бивалентных радикалов, упомянутых под с)-е), -ONO2 группа формулы (I) связана с -(CH2)n 1-группой;
f)
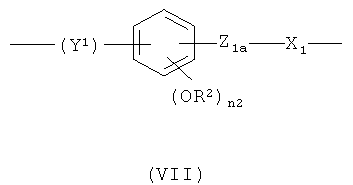 ,
,
где Y1 означает -СН=СН-(СН2)n 2a-, где n2a означает 0, Z1a означает -ОС(O)-; n2 означает 1, R2 означает СН3, X1 означает -(СН)n 1a-, где n1a означает целое число от 1 до 10;
при условии, что в формуле (VII) -ONO2 группа формулы (I) связана с X1 группой;
g)
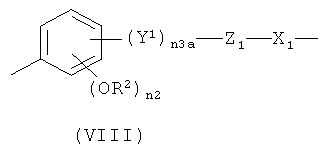 ,
,
где n3a означает 1, Y1 означает -CH=CH-(CH2)n 2a-, где n2a означает 0, Z1 означает -С(O)O-; n2 означает 1, R2 означает СН3, X1 означает -(CH)n 1a-, где n1a означает целое число от 1 до 10;
или в формуле (VIII) n3a означает 0, Z1 означает -ОС(O)- или -С(O)O-, n2 означает 1, R2 означает СН3, и X1 означает -(СН)n 1a-, где n1a означает целое число от 1 до 10;
при условии, что в формуле (VIII) -ONO2 группа формулы (I) связана с X1 группой;
h)
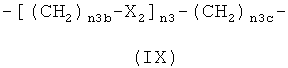 ,
,
где Х2 означает -O-;
n3 означает целое число от 1 до 6, предпочтительно от 1 до 4;
n3b означает 1 или 2;
n3c означает 2;
при условии, что когда в формуле (I) Z означает -С(O)- и в формуле (II) R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III), где RA1 и RA2 означают -СН3, R3 означает атом фтора, тогда Х не может быть линейным C1-С10 алкиленом;
Наиболее предпочтительные соединения формулы (I) настоящего изобретения означают:
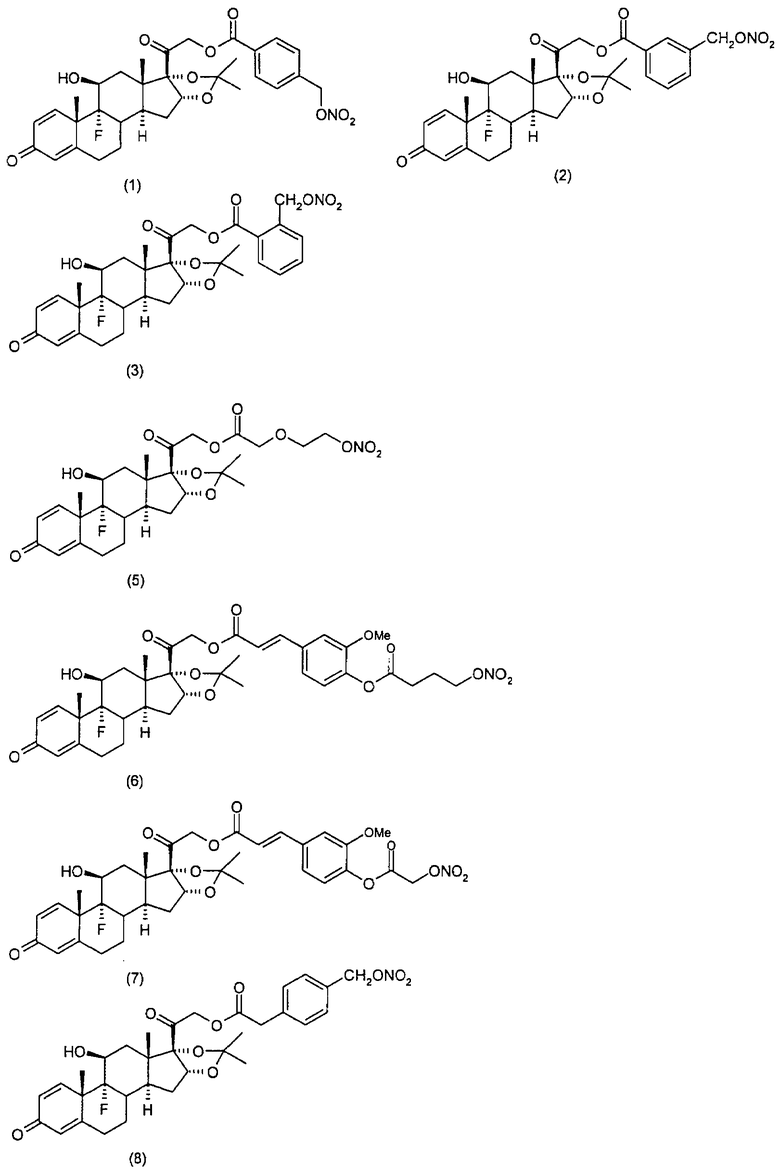
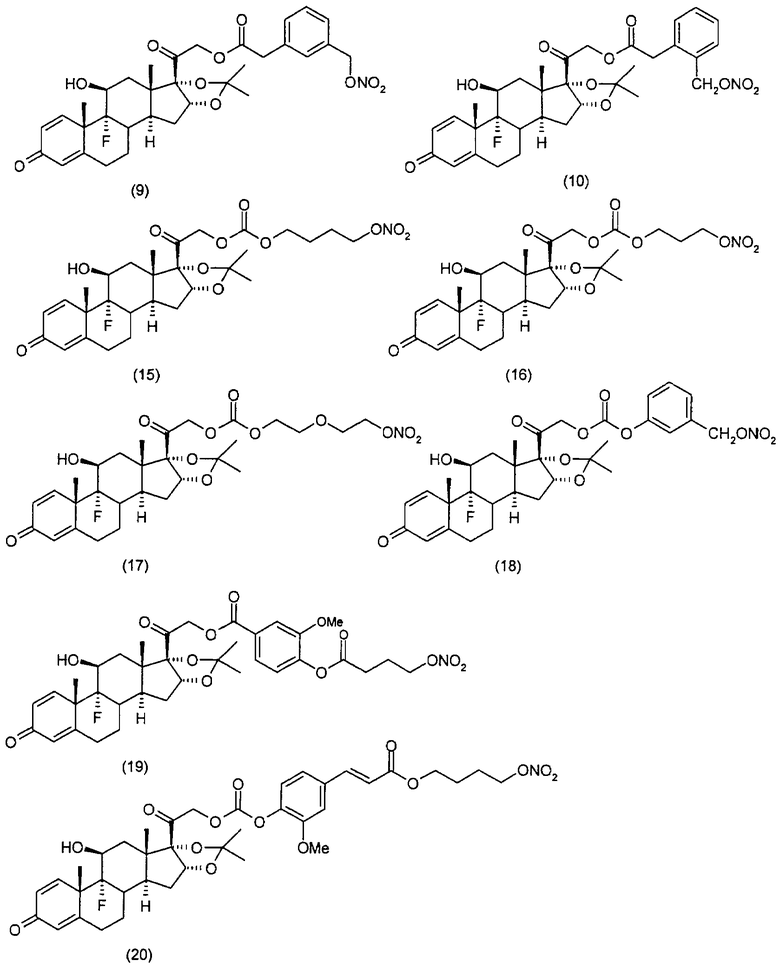
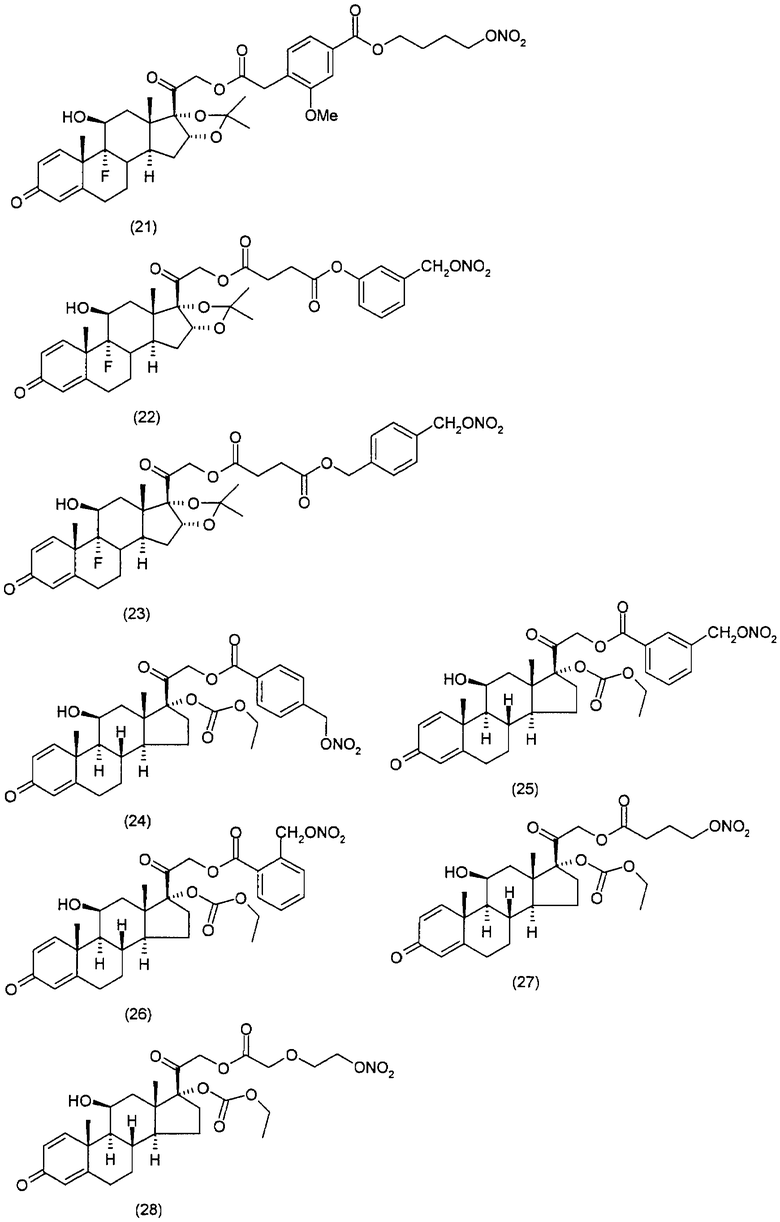
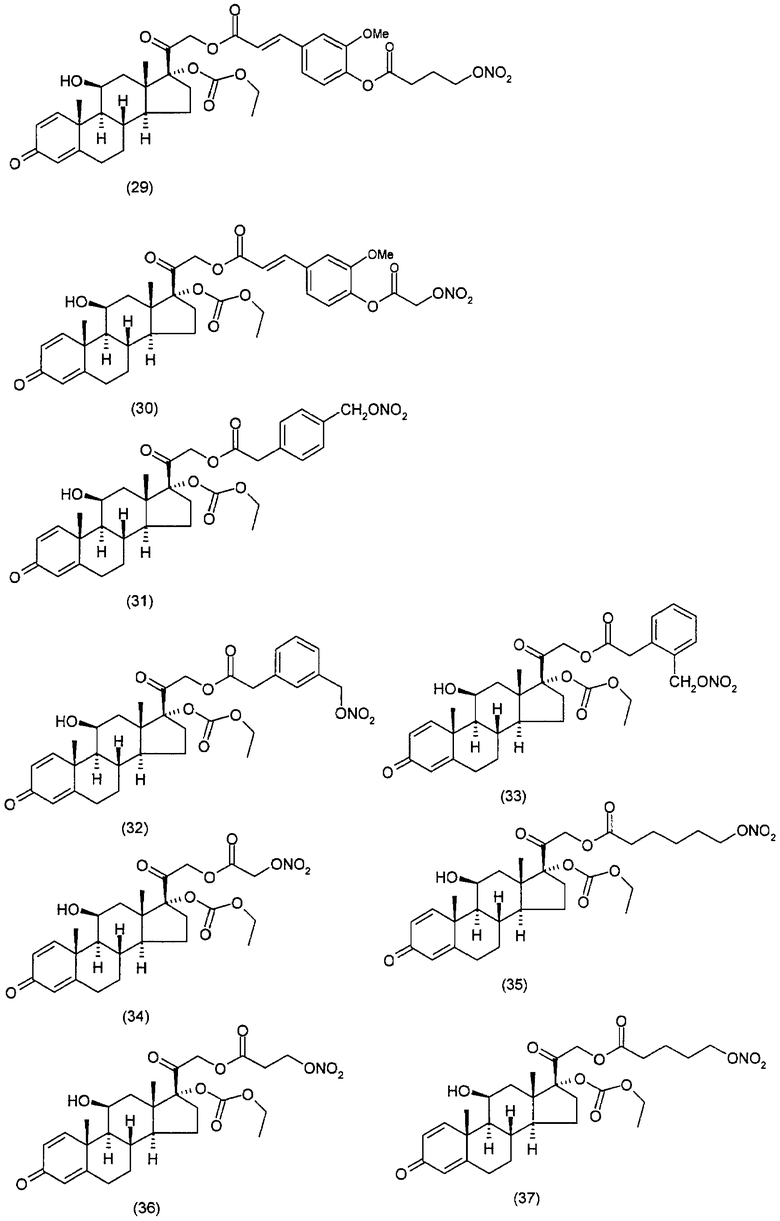
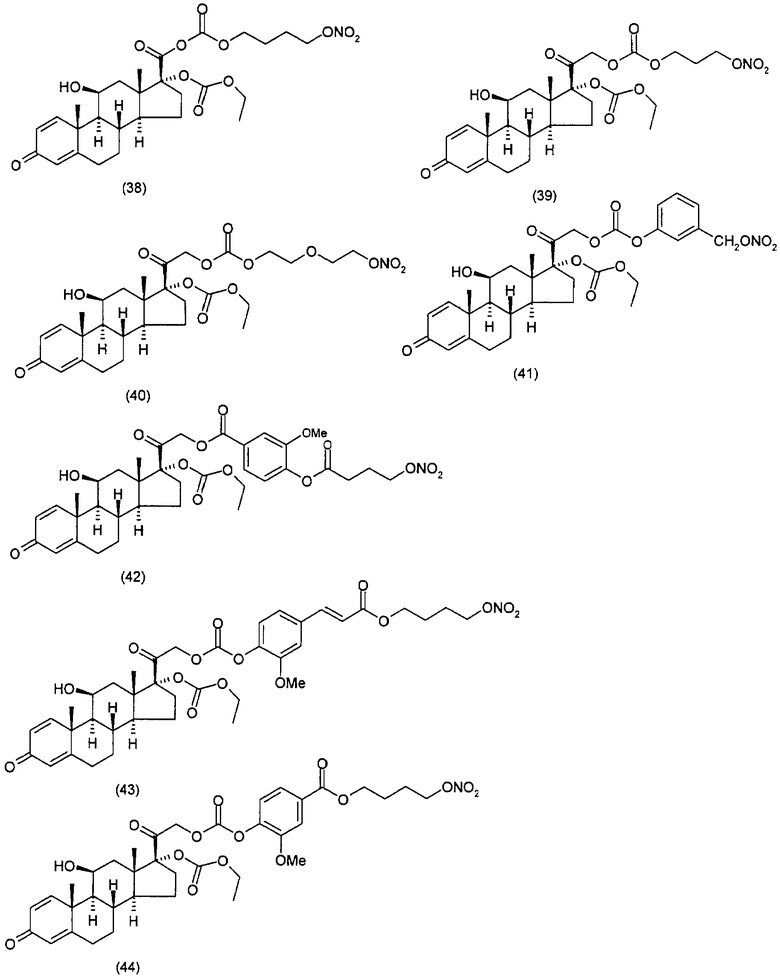
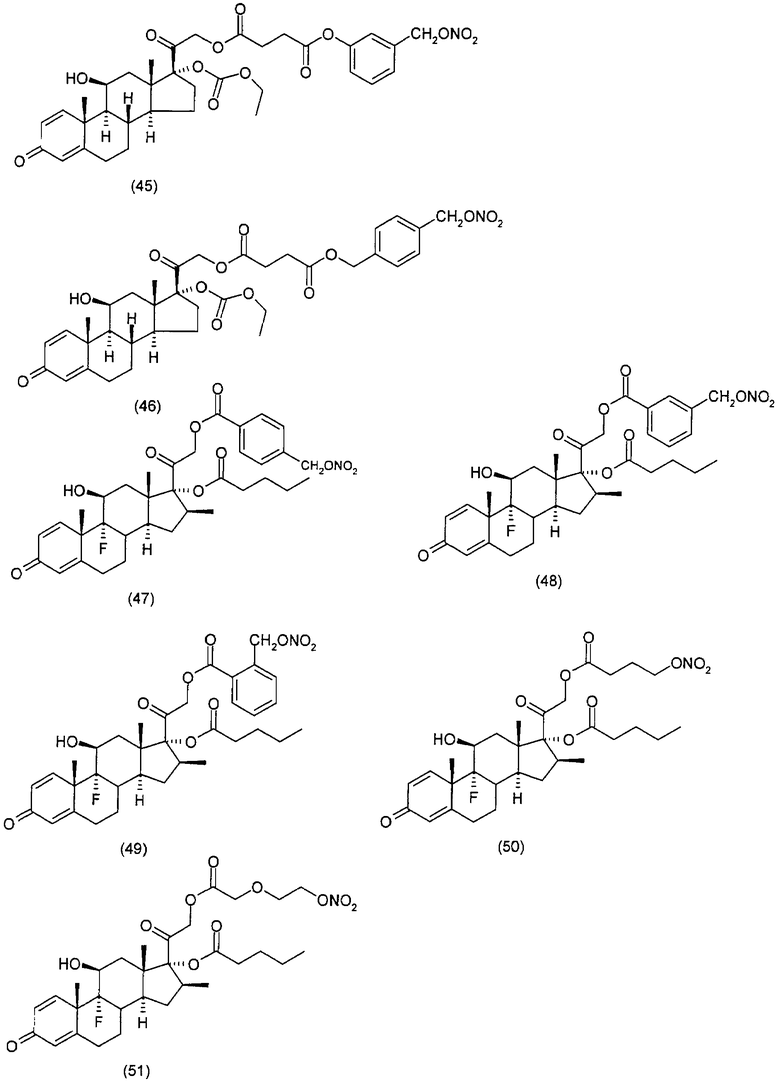
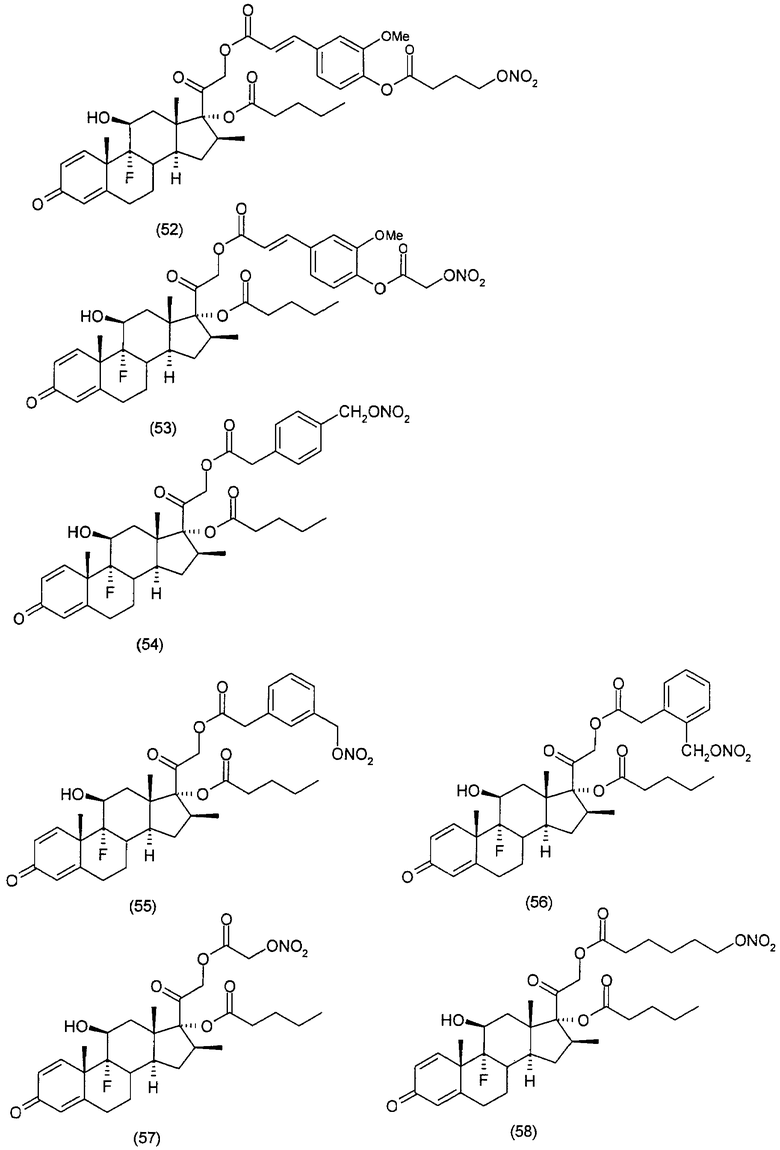
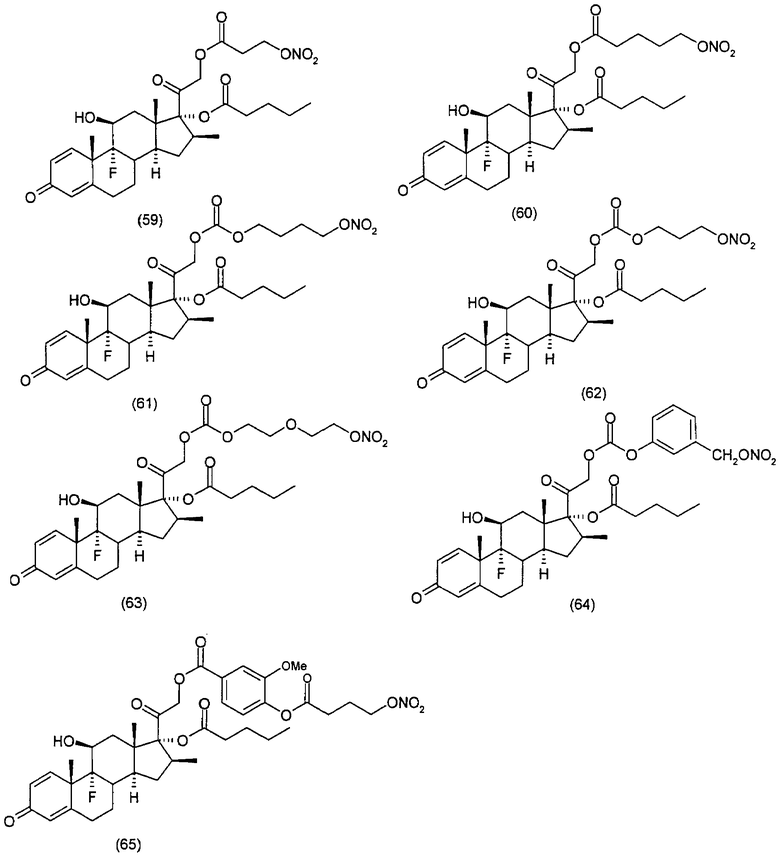
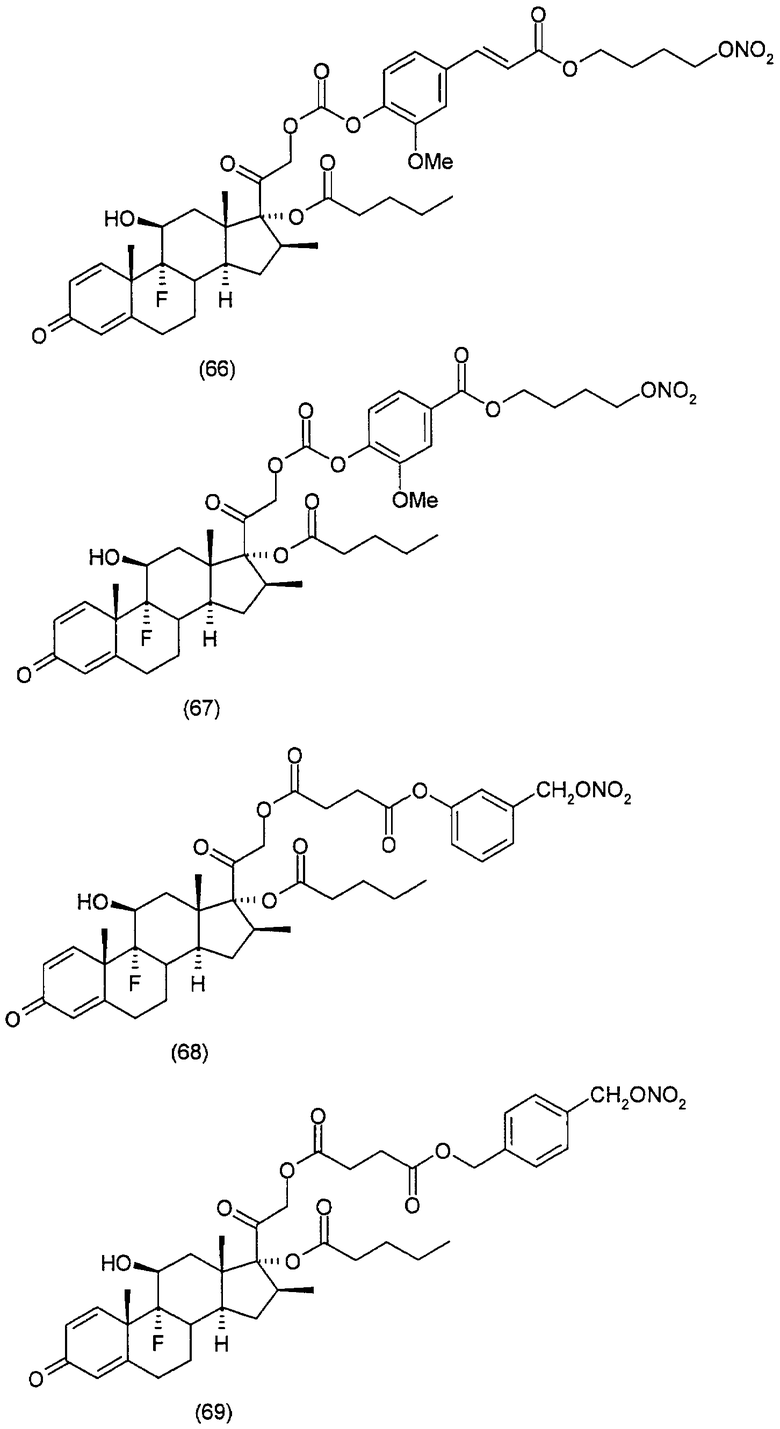
Другим вариантом осуществления настоящего изобретения является применение соединений формулы (I)
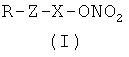
для лечения заболеваний или нарушений кожи или слизистой оболочки, где в формуле (I):
R означает кортикостероидный остаток формулы (II):
 ,
,
где R1 означает -OC(O)OmRi, где m означает 0 или 1, Ri означает разветвленный или линейный С1-С10 алкил, предпочтительно Ri означает разветвленный или линейный C1-С6 алкил, предпочтительными Ri группами являются: метил, этил, н-пропил, н-бутил;
R2 означает атом водорода или -СН3;
или R1 и R2, взятые вместе, являются группой формулы (III)
 ,
,
где RA1 и RA2 независимо выбраны из Н, C1-С10 линейной или разветвленной алкильной цепи, предпочтительно (C1-C5) алкила; более предпочтительно RA1 и RA2 означают -СН3, и группа формулы (III) означает изопропилидендиокси;
R1 и R2 могут быть связаны с атомами углерода в 16 или 17 стероидной структуры в положении α или β;
R3 означает атом водорода или атом фтора;
предпочтительно в формуле (II) R1, R2 и R3 имеют следующие значения:
- R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III), где RA1 и RA2 означают -СН3, R3 означает атом фтора; или
- R1 означает -OC(O)OmRi в положении α, где m означает 1, и Ri означает этил, R2 и R3 означают атомы водорода; или
- R1 означает -OC(O)OmRi в положении α, где m означает 0, Ri означает н-бутил, R2 означает -СН3 в положении β, R3 означает атом фтора;
Z означает группу, способную связывать X, выбранную из группы, состоящей из: -С(O)-, -С(O)O- или
 ,
,
где R' и R'' независимо выбраны из Н или линейного или разветвленного C1-C4 алкила; предпочтительно Z означает -С(O)- или -С(O)O-;
Х означает бивалентный радикал, имеющий следующие значения:
a) линейный или разветвленный C1-C20 алкилен, предпочтительно линейный или разветвленный C1-C10 алкилен, при необходимости замещенный одним или более заместителями, выбранными из группы, состоящей из: атомов галогена, гидрокси, -ONO2 или Т, где Т означает -ОС(O)(C1-С10алкил)-ONO2 или -O(С1-С10алкил)-ONO2; предпочтительно Х означает линейный C1-С10 алкилен;
b) C5-C7 циклоалкиленовая группа, при необходимости замещенная линейной или разветвленной C1-С10 алкильной группой, предпочтительно СН3;
c)
d)
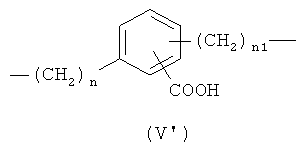 ,
,
где n означает целое число от 0 до 20, предпочтительно n означает целое число от 0 до 5; более предпочтительно n означает 0 или 1;
n1 означает целое число от 1 до 20, предпочтительно n1 означает целое число от 1 до 5; более предпочтительно n1 означает 1;
е)
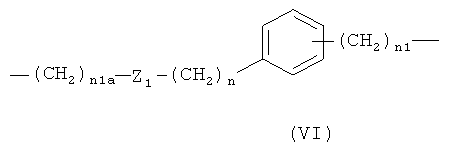 ,
,
где n1a означает целое число от 1 до 20, предпочтительно n1a означает целое число от 1 до 10;
Z1 означает -С(O)O- или -ОС(O)-; предпочтительно n1a означает -С(O)O-;
n является таким, как определено выше;
n1 является таким, как определено выше;
предпочтительно в формуле (VI) n1a означает целое число от 1 до 10;
Z1 означает -С(O)O-, n означает 0 или 1, и n1 означает 1;
при условии, что когда Х выбирают из бивалентных радикалов, упомянутых под с)-е), -ONO2 группа формулы (I) связана с -(СН2)n 1-группой;
f)
 ,
,
где Y1 означает -СН2-СН2-(СН2)n2a- или -СН=CH-(СН2)n2a-, где n2a означает целое число от 0 до 10; предпочтительно n2a означает 0 или означает целое число от 1 до 6;
Z1a означает -ОС(O)- или -С(O)O-;
n2 означает 0 или 1; предпочтительно n2 означает 1;
R2 означает Н или СН3; предпочтительно R2 означает СН3;
X1 означает -(CH)n1a-, где n1a является таким, как определено выше, или бивалентный радикал формулы (V), где n и n1 являются такими, как определено выше;
предпочтительно в формуле (VII) Y1 означает -СН-СН-(СН2)n2a-, где n2a означает 0, Z1a означает -ОС(O)-, n2 означает 1, R2 означает СН3, X1 означает -(CH)n1a-, где n1a означает целое число от 1 до 10;
при условии, что в формуле (VII) -ONO2 группа формулы (I) связана с X1 группой;
g)
 ,
,
где Y1 означает -CH2-CH2-(CH2)n2a- или -CH=CH-(CH2)n2a-, где n2 означает целое число от 0 до 10; предпочтительно n2a означает 0 или n2a означает целое число от 1 до 6;
n3a означает 0 или 1;
Z1 означает -С(O)O- или -ОС(O)-;
n2 означает 0 или 1; предпочтительно n2 означает 1;
R2 означает Н или СН3; предпочтительно R2 означает СН3;
X1 означает -(СН)n1a-, где n1a является таким, как указано выше, или бивалентный радикал формулы (V), где n и n1 являются такими, как определено выше;
предпочтительно в формуле (VIII) n3 означает 1, Y1 означает -СН=CH-(СН2)n 2a-, где
n2 означает 0, Z1 означает -С(O)O-, n2 означает 1, R2 означает СН3, X1 означает -(CH)n 1a-, где n1a означает целое число от 1 до 10; или в формуле (VIII) n3a означает 0, Z1 означает -ОС(O)- или -С(O)O-, n2 означает 1, R2 означает СН3 и X1 означает -(СН)n1a-, где n1a означает целое число от 1 до 10;
при условии, что в формуле (VIII) -ONO2 группа формулы (I) связана с X1 группой;
h)
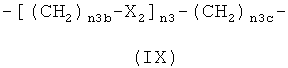 ,
,
где Х2 означает -О- или -S-;
n3 означает целое число от 1 до 6, предпочтительно от 1 до 4, и n3b означает целое число от 1 до 10, предпочтительно от 1 до 6, более предпочтительно n3b означает 1 или 2;
n3c означает целое число от 1 до 10, предпочтительно от 1 до 6, более предпочтительно n3c означает 2;
i)
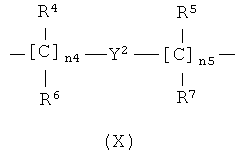 ,
,
где n4 означает целое число от 0 до 10;
n5 означает целое число от 1 до 10;
R4, R5, R6, R7 являются одинаковыми или различными и означают Н или линейный или разветвленный C1-C4 алкил, предпочтительно R4, R5, R6, R7 означают Н;
где -ONO2 группа формулы (I) связана с
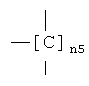
где n5 является таким, как определено выше;
Y2 является гетероциклическим насыщенным, ненасыщенным или ароматическим 5- или 6-членным кольцом, содержащим один или более гетероатомов, выбранных из азота, кислорода, серы,
и выбран из
 ,
,  ,
,  ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,  ,
, 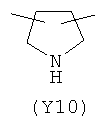 ,
,
 ,
,  ,
, 
Наиболее предпочтительные соединения формулы (I), указанной выше, которые могут быть использованы для лечения заболеваний или нарушений кожи или слизистой оболочки, представляют собой:
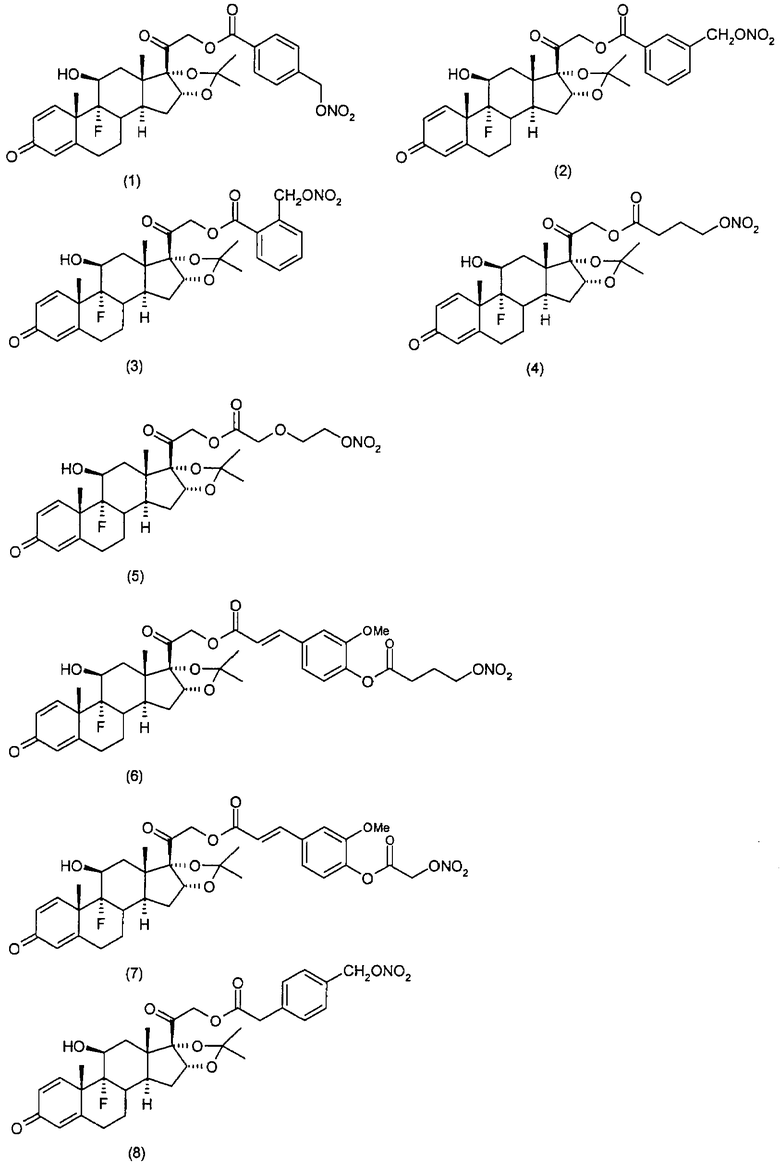
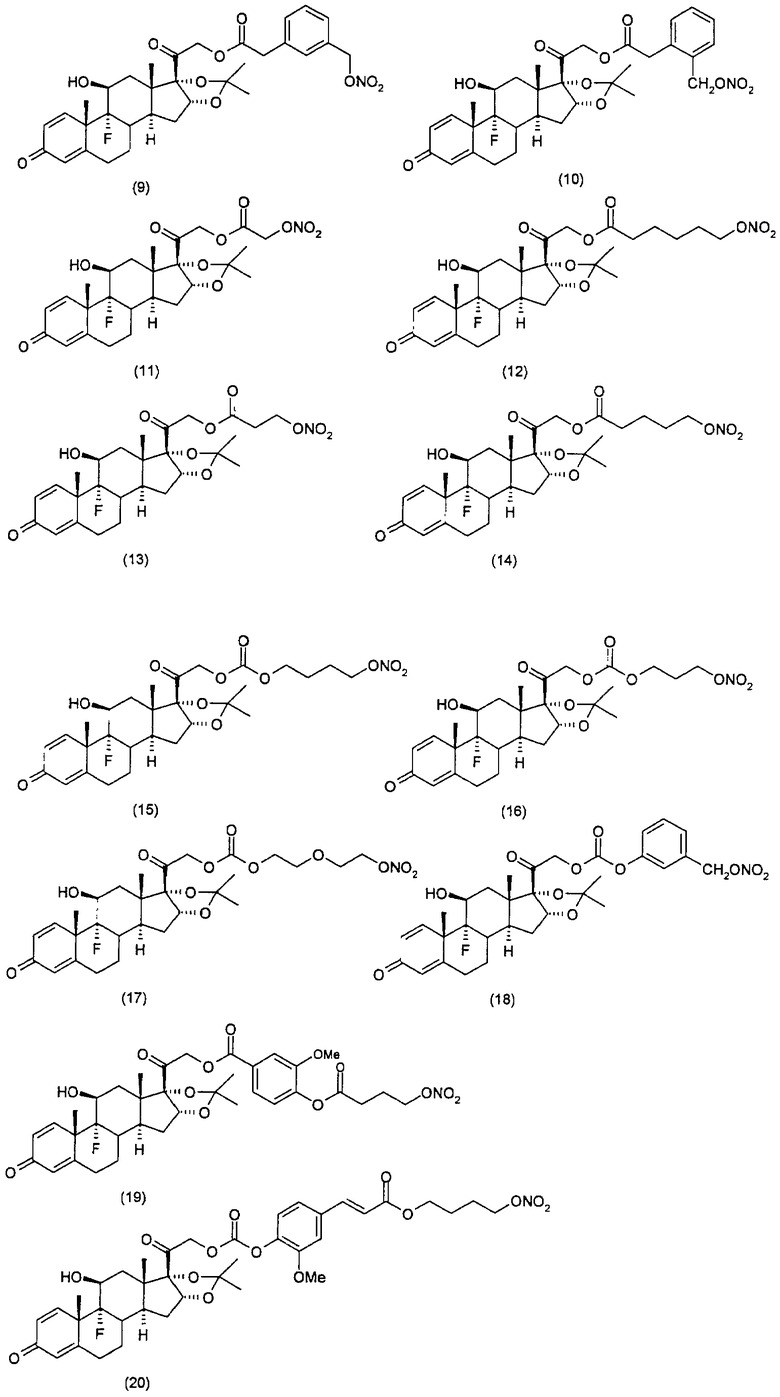
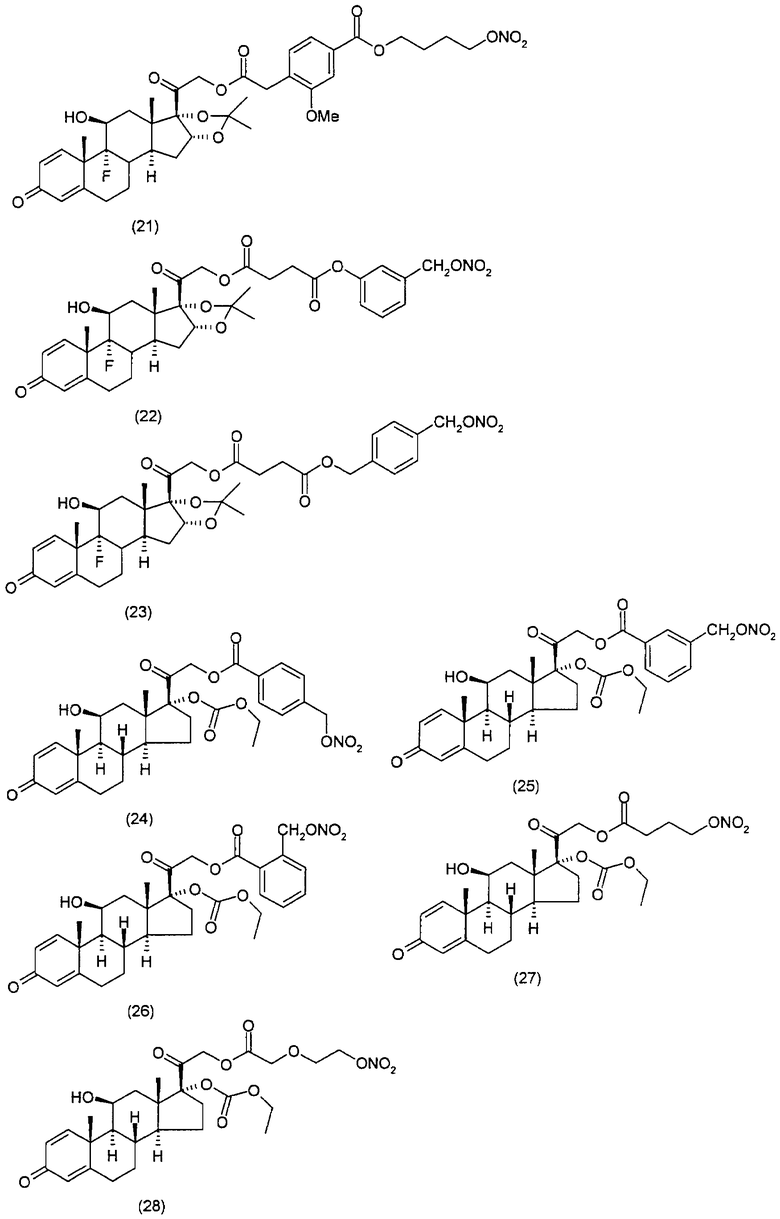
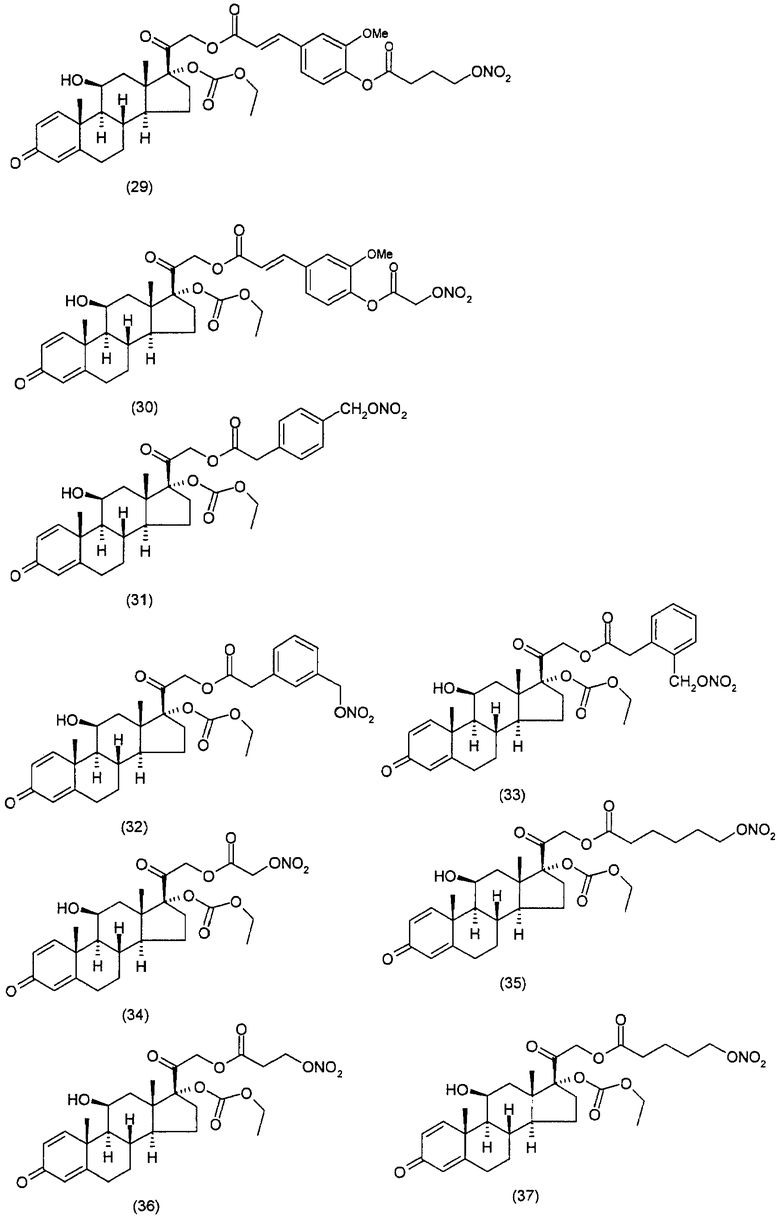
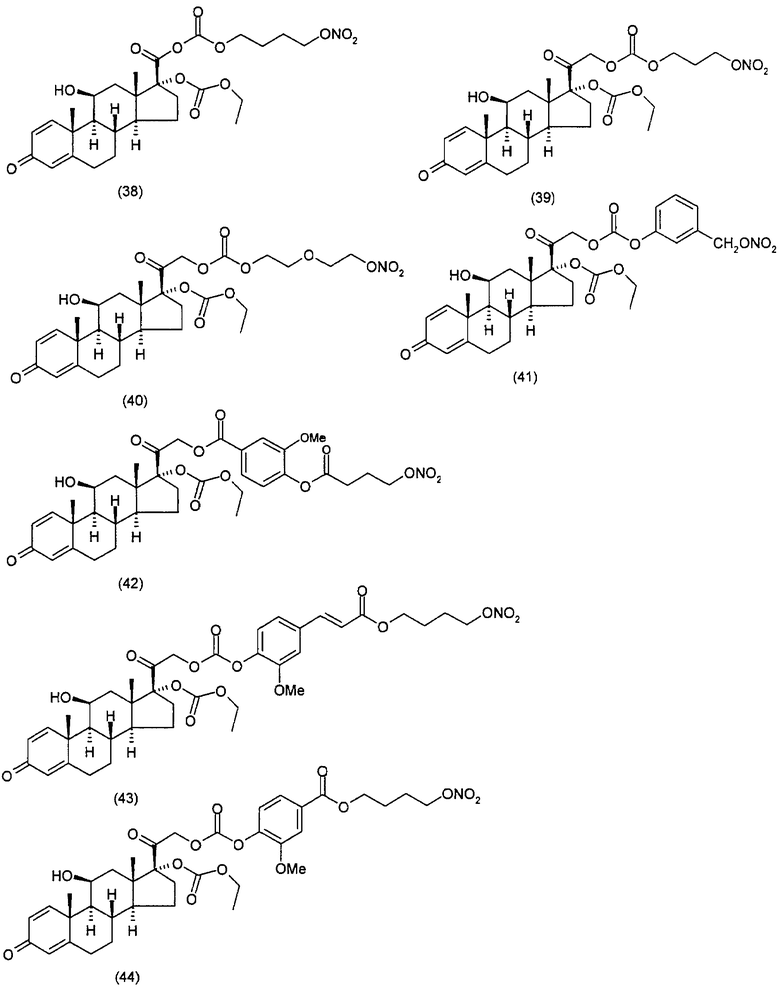
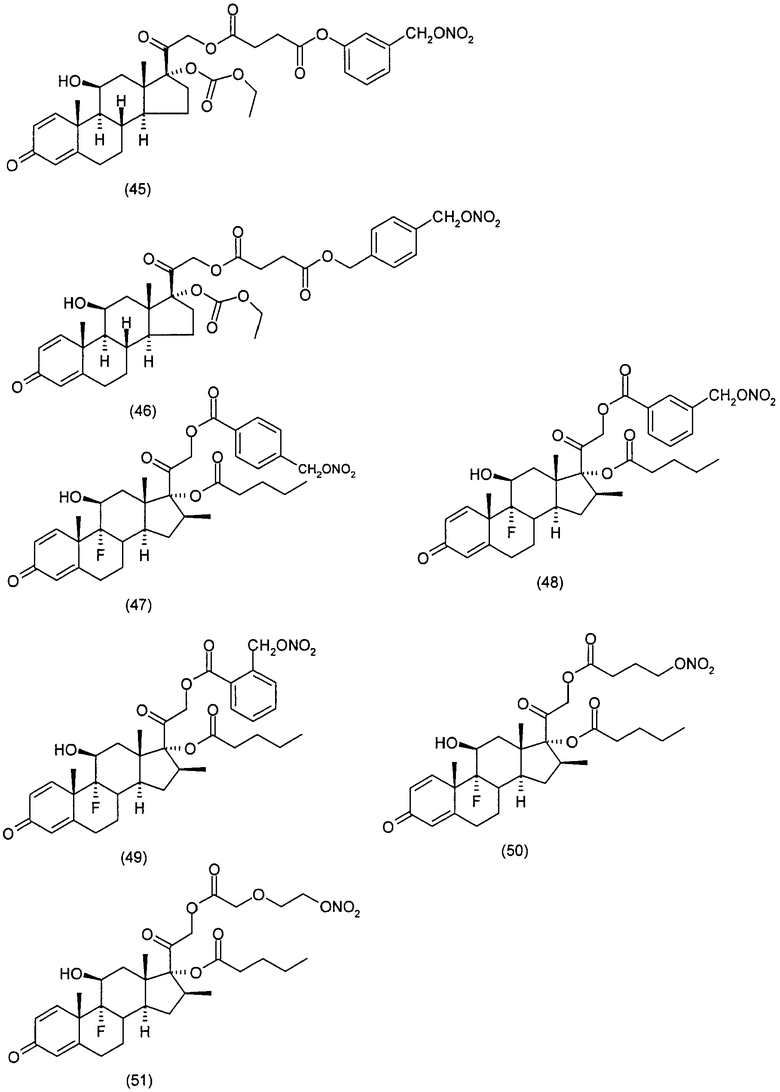
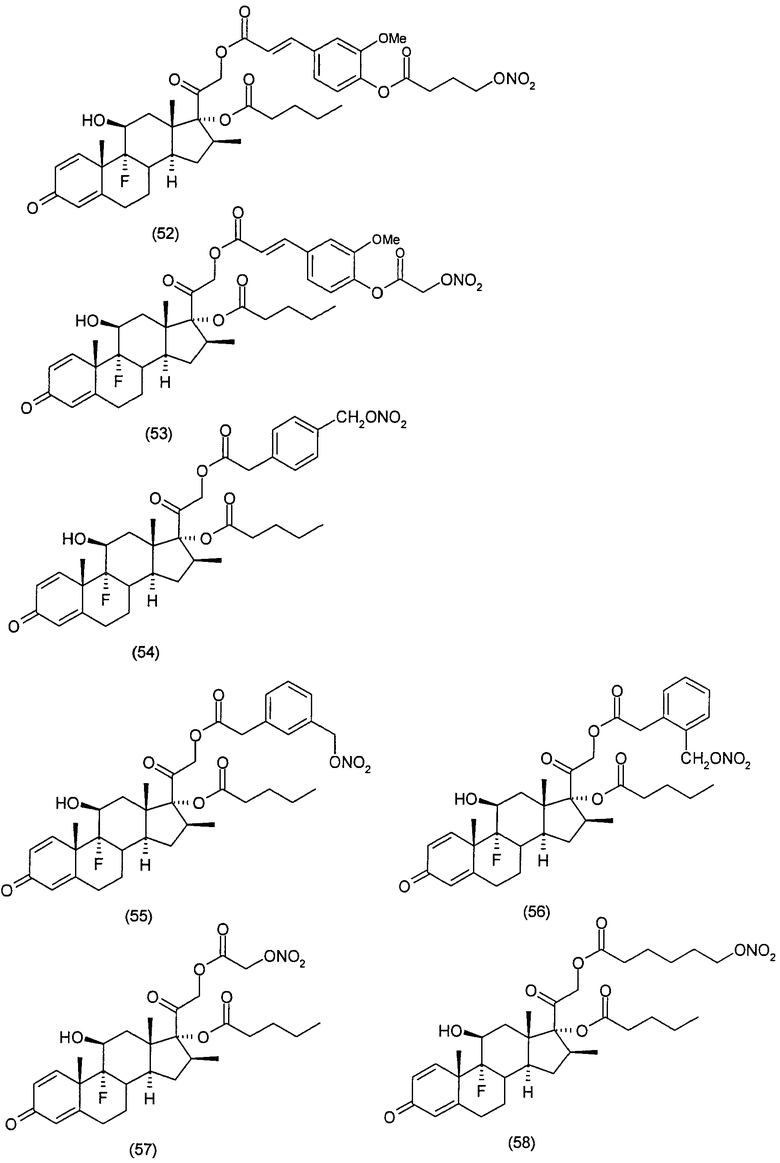
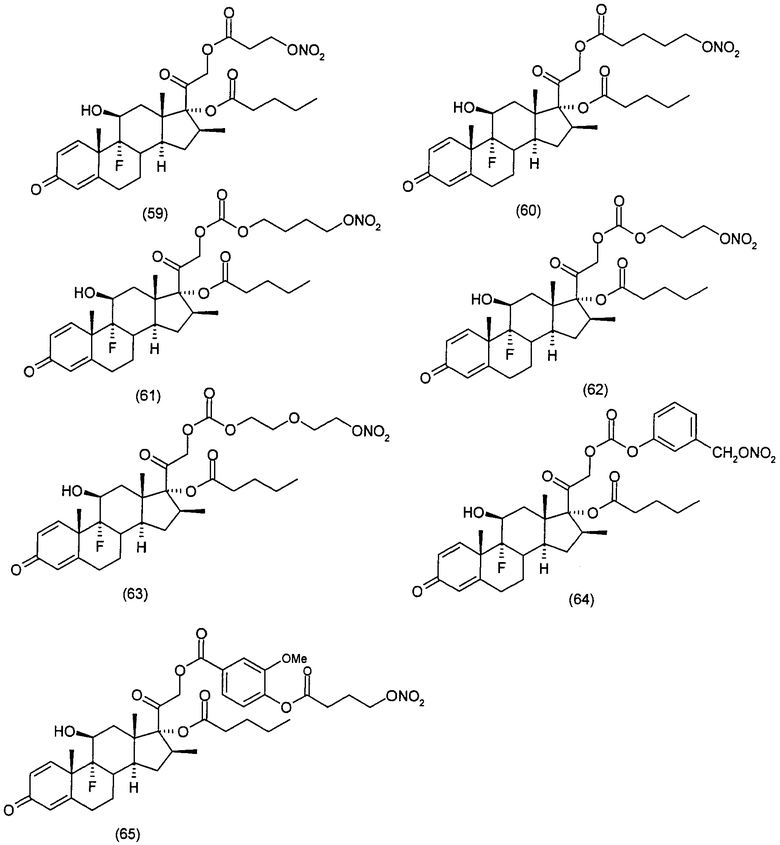
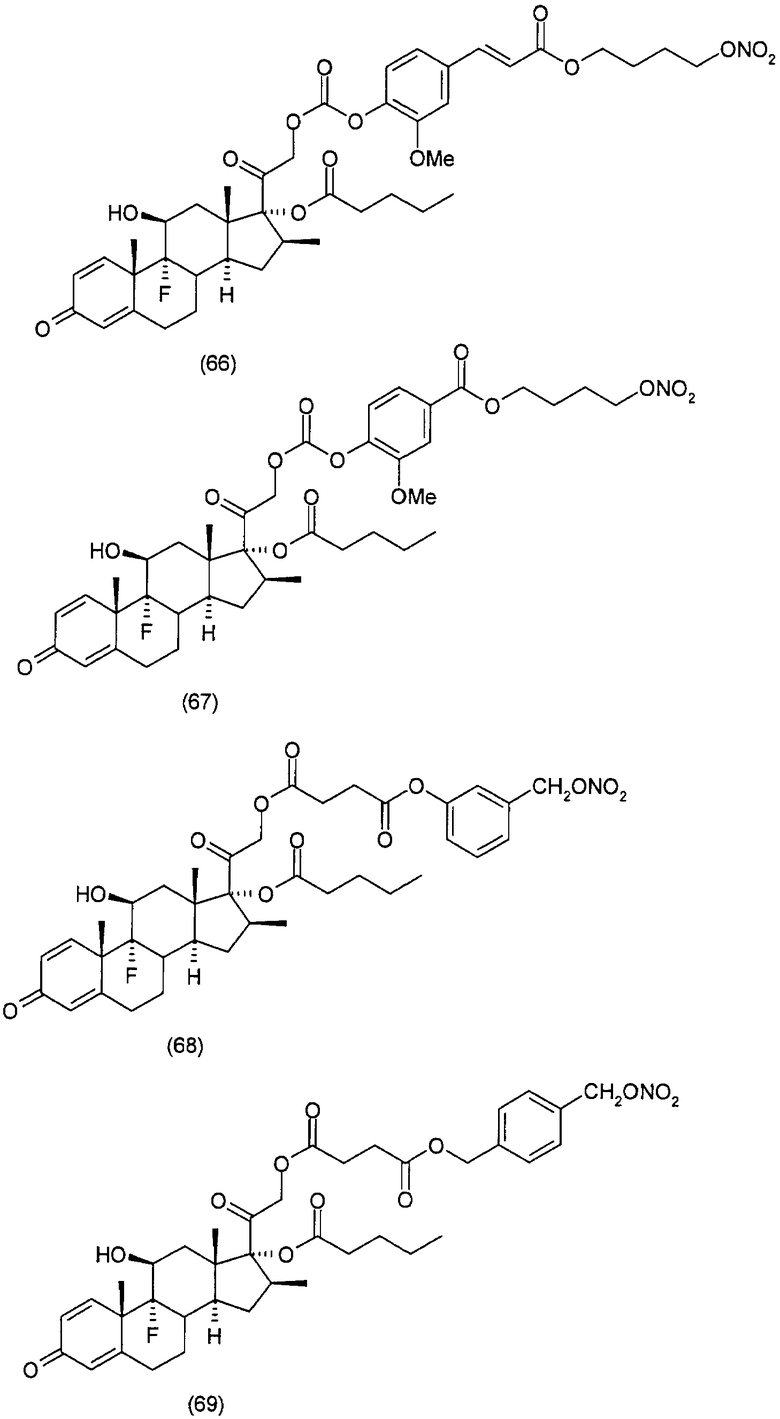
Соединения настоящего изобретения пригодны для лечения заболеваний или нарушений кожи или слизистой оболочки, включая, но не ограничиваясь этим, чувствительный к кортикостероидам дерматоз, атонический дерматит, контактный дерматит, себорейную экзему, воспаление, экзему, эритему, образование папул, шелушение, эрозию, выделение, образование струпьев, зуд, псориаз, буллезный эпидермолиз, эритему, гнойный гидраденит, бородавки, опрелость, окаймленную экзему, красный плоский лишай, себорейную экзему, которая поражает волосистую часть кожи головы и другие волосистые участки.
Соединения настоящего изобретения, в частности, пригодны для лечения чувствительного к кортикостероидам дерматоза, атопического дерматита, контактного дерматита, псориаза, себорейной экземы.
Термин «С1-С20 алкилен» при использовании здесь относится к разветвленной или линейной C1-C20 углеводородной цепи, предпочтительно имеющей от 1 до 10 углеродных атомов, такой как метилен, этилен, пропилен, изопропилен, н-бутилен, пентилен, н-гексилен и т.п.
Термин «C1-C20 алкил» при использовании здесь относится к разветвленным или линейным алкильным группам, содержащим от 1 до 10 углеродных атомов, включая метил, этил, н-пропил, изопропил, н-бутил, изобутил, т-бутил, пентил, гексил, октил и т.п.
Термин «гетероциклический» при использовании здесь относится к насыщенному, ненасыщенному или ароматическому 5- или 6-членному, содержащему один или более гетероатомов, выбранных из азота, кислорода, серы, такому как, например, пиридин, пиразин, пиримидин, пирролидин, морфолин, имидазол и т.п.
Это изобретение включает также фармацевтически приемлемые соли соединений формулы (I), их стереоизомеры и эпимеры.
Примеры фармацевтически приемлемых солей представляют собой или соли с неорганическими основаниями, такими как гидроксиды натрия, калия, кальция и алюминия, или соли с органическими основаниями, такими как лизин, аргинин, триэтиламин, дибензиламин, пиперидин и другие приемлемые органические амины.
Примерами органических кислот являются щавелевая кислота, винная кислота, малеиновая кислота, янтарная кислота, лимонная кислота. Примерами неорганических кислот являются азотная, соляная, серная, фосфорная кислоты. Предпочтительными являются соли с азотной кислотой.
Соединения изобретения, которые имеют один или более асимметрических атомов углерода, могут существовать как оптически чистые энантиомеры, чистые диастереомеры, смеси энантиомеров, смеси диастереомеров, энантиомерные рацемические смеси, рацематы или смеси рацематов. К объему настоящего изобретения также относятся все возможные изомеры, стереоизомеры и их смеси соединений формулы (I), включая смеси, обогащенные определенным изомером.
Заболевания или нарушения кожи или слизистой оболочки включают, но не ограничиваются этим, чувствительный к кортикостероидам дерматоз, атопический дерматит, контактный дерматит, себорейную экзему, воспаление, экзему, эритему, образование папул, шелушение, эрозию, выделение, образование струпьев, зуд, псориаз, буллезный эпидермолиз, эритему, гнойный гидраденит, бородавки, опрелость, окаймленную экзему, красный плоский лишай.
Также в объем настоящего изобретения входят фармацевтические составы, пригодные для местного введения, содержащие по меньшей мере соединение формулы (I) настоящего изобретения.
Предпочтительные фармацевтические дозированные формы включают составы в виде крема, лосьона и мази или композиции для местного распыления. Фармацевтические дозированные формы получают согласно процедурам, хорошо известным в данной области техники.
Количественное соотношение активного компонента формулы (I) в составе для местного применения согласно изобретению зависит от определенного типа получаемого состава, но, как правило, будет находиться в пределах около 0,001-12 мас.%, более предпочтительно 0,001-10 мас.%. В целом, однако, для большинства типов препаратов используемое количественное соотношение преимущественно будет в пределах от 0,001 до 1 мас.%, более предпочтительно 0,01-0,5% и особенно предпочтительно 0,025-0,1%.
Различные необязательные компоненты могут также присутствовать в составах для местного применения. Они представляют собой один или более различных растворителей, таких как различные короткоцепочечные спирты, включая, но не ограничиваясь этим, этиловый спирт, пропиленгликоль, триацетин, гексиленгликоль и их комбинации; подходящие окклюзионные агенты, которые могут присутствовать в составе для местного применения, включают, но не ограничиваются этим, вазелин, микрокристаллический воск, диметикон, пчелиный воск, минеральное масло, сквалан, вазелиновое масло, масло ши, карнаубский воск, SEPIGEL® (смесь изопарафин/полиакриламид/лаурет-7) и их комбинации; поверхностно-активное вещество, такое как, но не ограничиваясь этим, CETOMACROGOL® 1000, (Crodor, Inc.) глицерол-моностеарат, глицеролдистеарат, глицерилстеарат, полиоксиэтилен стеарат, смесь глицерилстеарата и ПЭГ-100 стеарата (как ARLACEL 165), полисорбат 40, полисорбат 60, полисорбат 80, СЕТЕТН-20®, сорбитанмонопальмитат, сорбитмоностеарат, сорбитмоноолеат и их комбинации. Другие различные необязательные компоненты могут также присутствовать в составе для местного применения. Они представляют собой носители (такие как вода или минеральное масло), кондиционеры для кожи (такие как ланолин, глицерин, холестерин, цетостеариловый спирт, диметикон, ПЭГ 100, ПЭГ 200, ПЭГ 300, ПЭГ 400 или изопропилмиристат), буферы (такие как цитрат натрия/лимонная кислота, двухосновный фосфат натрия/лимонная кислота или одноосновный фосфат натрия/ лимонная кислота) или консерванты (такие как имидомочевина, метилпарабен или пропилпарабен).
Экспериментальная часть
Процедура синтеза
Соединение общей формулы (I), как определено выше, где Z означает -СО-, и Х является таким, как определено выше, может быть получено
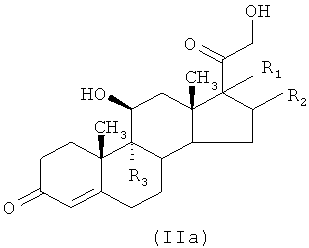
1а) реакцией соединения формулы (IIa), то есть кортикостероида-предшественника,
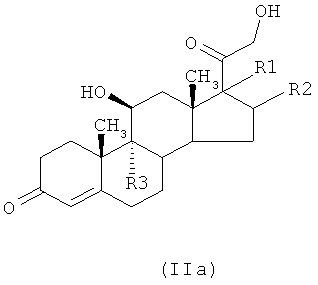
где R1, R2 и R3 являются такими, как определено выше, с соединением формулы (Ib)
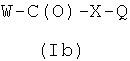 ,
,
где W означает -ОН, Cl или -OC(O)Ra, где Ra означает линейный или разветвленный C1-C5 алкил или Ra означает Ra1, выбранный из группы, состоящей из пентафторфенокси, 4-нитрофенокси или сукцимидинилокси;
Q означает -ONO2 или Z2, где Z2 выбирают из группы, состоящей из: атом хлора, атом брома, атом иода, мезиловая группа или тозиловая группа, в присутствии конденсирующего агента, и
1b) когда Q означает Z2, превращением соединения, полученного на стадии а) в нитропроизводное реакцией с источником нитрата.
На стадии 1а) реакция соединения формулы (IIa) с соединением формулы (1b), где W означает -ОН, может проводиться в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид (ДЦК), N'-(3-диметиламинопропил)-N-этилкарбодиимид гидрохлорид (EDAC), и катализатора, такого как N,N-диметиламинопиридин (ДМАП) или N,N'-карбонилдиимидазол (КДИ). Реакцию проводят в сухом инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от -20°С до 40°С. Реакцию завершают в интервал времени от 30 минут до 36 часов.
На стадии 1а) реакцию соединения формулы (IIa) с соединением формулы (Ib), где W означает -OC(O)Ra, где Ra является таким, как определено выше, можно проводить в присутствии катализатора, такого как N,N-диметиламинопиридин (ДМАП), или в присутствии ДМАП и кислоты Льюиса, такой как Sc(OTf)3 или Bi(OTf)3.
Реакцию проводят в инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от -20°С до 40°С. Реакцию завершают в интервал времени от 30 минут до 36 часов.
На стадии 1а) реакцию соединения формулы (IIa) с соединением формулы (Ib), где W означает Cl, Х является таким, как определено выше, и Q означает Z2, можно проводить в присутствии органического основания, такого как N,N-диметиламинопиридин (ДМАП), триэтиламин, пиридин. Реакцию проводят в инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от - 20°С до 40°С. Реакцию завершают в интервал времени от 30 минут до 36 часов.
На стадии 1b) источником нитрата может быть нитрат серебра, нитрат лития, нитрат натрия, нитрат калия, нитрат магния, нитрат кальция, нитрат железа, нитрат цинка или нитрат тетраалкиламмония (где алкил означает C1-С10алкил). Реакцию проводят в подходящем органическом растворителе, таком как ацетонитрил, тетрагидрофуран, метилэтилкетон, этилацетат, ДМФ, в темноте при температуре от комнатной температуры до температуры кипения растворителя. Предпочтительный источник нитрата представляет собой нитрат серебра.
Соединения формулы (IIa) доступны в продаже или могут быть синтезированы, как описано в ссылочных документах, представленных в The Merck Index, 13-e издание.
Соединение формулы (IIa), указанное выше, где R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III), где RA1 и RA2 являются -СН3, R3 означает атом фтора, известно под родовым наименованием триамцинолон ацетонид.
Соединение формулы (IIa), указанное выше, где R1 означает -OC(O)OmRi в положении α, где m означает 1 и R1 означает этил, R2 и R3 означают атомы водорода, известно под родовым наименованием преднизолон-17-этилкарбонат.
Соединение формулы (IIa), указанное выше, где R1 означает -OC(O)OmRi в положении α, где m означает 0 и R1 означает н-бутил, R2 и R3 означают атомы водорода, известно под родовым наименованием преднизолон-17-этилкарбонат.
Соединение формулы (IIa), указанное выше, где R1 означает -OC(O)OmRi в положении α, где m означает 0, и R1 означает н-бутил, R2 означает -СН3 в положении β, R3 означает атом фтора, известно под родовым наименованием бетаметазон-17-валерат.
Соединения формулы (Ib), где Q означает ОН, и Х и Z2 являются такими, как определено выше, доступны в продаже или могут быть синтезированы из соответствующей оксикислоты формулы НО-С(O)-Х-ОН методом, хорошо известным в данной области техники;
Соединения формулы (Ib), где Q означает ONO2, могут быть получены из соответствующих соединений, где Q означает Z2, превращением в нитропроизводное, как описано выше на стадии 1b).
Соединения формулы (Ib), где W=-OC(O)Ra и где Ra, Х и Q являются такими, как определено выше, могут быть получены из соответствующих кислот, где W=-ОН, реакцией с хлорформиатом, таким как изобутилхлорформиат, этилхлорформиат, в присутствии ненуклеофильного основания, такого как триэтиламин, в инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, полигалогенированный алифатический углеводород, при температуре от -20°С до 40°С. Реакция завершается в течение интервала времени 1-8 часов.
Соединения формулы (Ib), где W=Cl, могут быть получены из соответствующих кислот, где W=-ОН, реакцией с тионил - или оксалилхлоридом, галогенидами PIII или Pv в инертных растворителях, таких как толуол, хлороформ, ДМФ.
Соединение общей формулы (I), как определено выше, где Z означает -С(O)- и Х является таким, как определено выше, может быть синтезировано 2а) реакцией соединения формулы (IIa), указанной выше, с соединением формулы (Ic)
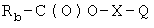
где Х и Q являются такими, как определено выше, Rb означает Cl, Br или Ra1, где Ra1 является таким, как определено выше;
2b) когда Q означает Z2, превращением соединения, полученного на стадии 2а), в нитропроизводное реакцией с источником нитрата, как описано выше.
На стадии 2а) реакцию, как правило, проводят в присутствии неорганического или органического основания в апротонном полярном/неполярном растворителе, таком как ДМФ, ТГФ или CH2Cl2 в температурном интервале между 0°-20°С; или в присутствии ДМАП и кислоты Льюиса, такой как Sc(OTf)3 или Bi(OTf)3 в растворителях, таких как ДМФ, CH2Cl2.
Соединение формулы (Ic), где Х и Q являются такими, как определено выше, и Rb означает Cl, Br, может быть синтезировано из соответствующего спирта формулы (Id) HO-X-Q способом, хорошо известным в данной области техники.
Соединения формулы (Ic), где Q означает Z2, доступны в продаже.
Соединения формулы (Ic), где Q означает ONO2, могут быть получены из соответствующих соединений, где Q означает Z1, превращением в нитропроизводные, как описано выше.
Соединение формулы (Ic) Rb-C(O)O-Y-Q, где Y и Q являются такими, как определено выше, Rb означает Ra1, может быть получено реакцией соединения формулы (Id) HO-X-Q с соединением формулы (Ic') Rb-C(O)O-Z2, где Z2 является таким, как определено выше. Реакцию, как правило, проводят в присутствии неорганического или органического основания в апротонном полярном/неполярном растворителе, таком как ДМФ, ТГФ или CH2Cl2, в температурном диапазоне между 0°-65°С или в двухфазной системе H2O/Et2O в температурном диапазоне между 20°-40°С; или в присутствии ДМАП и кислоты Льюиса, такой как Sc(OTf)3 или Bi(OTf)3, в растворителях, таких как ДМФ, CH2Cl2.
Соединения формулы (Ic'), где Rb означает Ra1, и Z2 является таким, как определено выше, доступны в продаже.
ПРИМЕРЫ
Пример 1
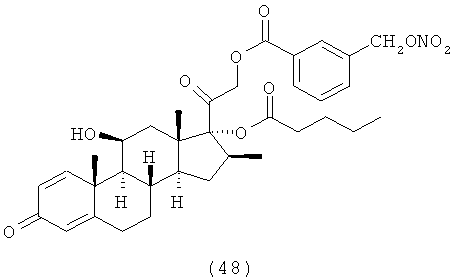
Синтез (11β,16α)-9-фтор-11-гидрокси-16,17-[1-метилэтилиденбис(окси)]-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-диона
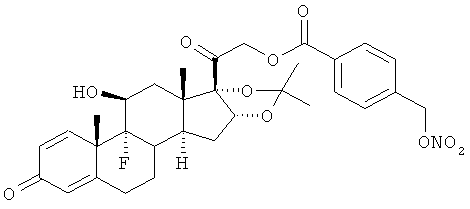
К раствору триамцинолона ацетонида (2,47 г, 5,7 ммоль) в дихлорметане (55 мл) добавляют 4-(нитрооксиметил)бензойную кислоту (1,38 г, 7,0 ммоль), ДМАП (0,07 г, 0,54 ммоль) и EDAC (1,39 г, 7,2 ммоль). Реакцию перемешивают при комнатной температуре в течение 24 ч. Раствор обрабатывают водой, органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией, элюент дихлорметан/этил ацетат 95/5. Продукт (1,2 г) получают в виде белого порошка.
1Н-ЯМР (ДМСО) δ: 8,05 (2Н, d); 7,64 (2H, d); 7,29 (1H, d); 6,23 (1H, dd); 6,01 (1H, s); 5,68 (2H, s); 5,52 (1H, d); 5,42 (1H, d); 5,01 (1H, d); 4,86 (1H, d); 4,2 (1H, bs); 2,7-2,25 (4H, m); 2,15-1,72 (4H, m); 1,65-1,45 (5H, m); 1,36 (3H, s); 1,21 (3H, s); 0,87 (3H, s).
Пример 2
Синтез (11β)-17-[(этоксикарбонил)окси]-11-гидрокси-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-диона
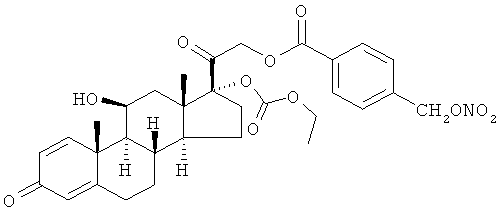
К раствору преднизолон 17-этилкарбоната (1,77 г, 4,1 ммоль) в дихлорметане (40 мл) добавляют 4-(нитрооксиметил)бензойную кислоту (1,0 г, 5,0 ммоль), ДМАП (0,05 г, 0,41 ммоль) и EDAC (1,0 г, 5,2 ммоль). Реакцию перемешивают при комнатной температуре в течение 24 ч. Раствор обрабатывают водой, органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией, элюент н-гексан/этил ацетат 6/4. Продукт (0,47 г) получают в виде белого порошка кристаллизацией с н-гексаном/этилацетатом. Темп.пл.=113-119°С.
1Н-ЯМР (ДМСО) δ: 8,07 (2H, d); 7,66 (2H, d); 7,32 (1H, dd); 6,18 (1H, dd); 5,93 (1H, s); 5,70 (2H, s); 5,15 (2H, m); 4,90 (1H, d); 3,33 (1H, m); 4,12 (2H, m); 2,80-2,76 (1H, m); 2,56-2,50 (1H, m); 2,32-2,28 (1H, m); 2,11-1,99 (1H, m); 1,90-1,78 (2H, m); 1,6-1,36 (5H, m); 1,25-1,15 (4H, m); 1,10-0,9 (5H, m).
Пример 3
Синтез (11β,16β)-9-фтор-11-гидрокси-16-метил-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]-17-(валерилокси)прегна-1,4-диен-3,20-диона
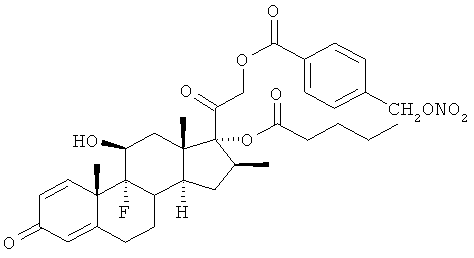
К раствору бетаметазон-17-валерата (2,54 г, 5,3 ммоль) в дихлорметане (50 мл) добавляют 4-(нитрооксиметил)бензойную кислоту (1,3 г, 6,5 ммоль), ДМАП (0,065 г, 0,53 ммоль) и EDAC (1,53 г, 8,0 ммоль). Реакцию перемешивают при комнатной температуре в течение 4 ч. Раствор обрабатывают водой, органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией, элюент н-гексан/этилацетат 65/35. Продукт (0,72 г) получают в виде белого порошка кристаллизацией с н-гексаном/этилацетатом. Темп.пл.=158-160°С.
1Н-ЯМР (ДМСО) δ: 8,03 (2Н, d); 7,63 (2Н, d); 7,29 (1H, d); 6,24 (1H, dd); 6,02 (1H, s); 5,68 (1H, d); 4,97 (1H, d); 4,71 (1H, d); 4,24 (1H, m); 2,7-2,2 (4H, m); 2,15-1,75 (6H, m); 1,58-1,05 (13H, m); 0,9 (3H, s); 0,85 (3H, t).
Пример 4
Синтез (11β)-17-[(этоксикарбонил)окси]-11-гидрокси-21-[1-оксо-[3-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-диона
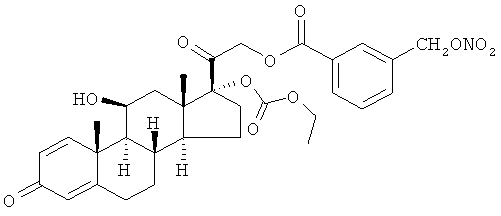
А) (11β)-17-[(этоксикарбонил)окси]-11-гидрокси-21-[1-оксо-[3-(хлорметил)бензоксил]]прегна-1,4-диен-3,20-дион
К раствору преднизолон 17-этилкарбоната (1,5 г, 4,5 ммоль) в дихлорметане (40 мл) добавляют 3-(хлорметил)бензойную кислоту (0,89 г, 4,45 ммоль), ДМАП (0,043 г, 0,35 ммоль) и EDAC (0,89 г, 4,45 ммоль). Реакцию перемешивают при комнатной температуре в течение 24 ч. Раствор обрабатывают насыщенным раствором бикарбоната натрия, водой, органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией, элюент н-гексан/этилацетат 1/1. Продукт (1,32 г) получают в виде белого порошка.
В) (11β)-17-[(этоксикарбонил)окси]-11-гидрокси-21-[1-оксо-[3-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион
Раствор соединения, полученного на стадии А), (1,3 г, 2,22 ммоль) и нитрата серебра (0,75 г, 4,44 ммоль) в ацетонитриле (20 мл) перемешивают при 60°С в темноте в течение 10 часов. Выпавший осадок (соли серебра) отфильтровывают и растворитель выпаривают под вакуумом. Остаток очищают флэш-хроматографией, элюент н-гексан/этилацетат 6/4. Продукт (1 г) получают в виде белого порошка.
1Н-ЯМР (ДМСО) δ: 8,11 (1Н, m); 8,04 (1H, m); 7,80 (1H, m); 7,62 (1H, m); 7,30 (1H, m); 6,15 (1H, m); 5,91 (1H, s); 5,67 (2H, s); 5,11 (2H, m); 4,88 (1H, bd); 4,31 (1H, bs); 4,11 (2H, m); 2,81-2,71 (1H, m); 2,6-2,49 (1H, m); 2,22-2,32 (1H, m); 2,15-1,95 (2H, m); 1,9-1,7 (4H, m); 1,6-1,3 (4H, m); 1,18 (3H, t); 1,1-0,9 (4H, m).
Пример 5
Синтез (11β,16β)-9-фтор-11-гидрокси-16-метил-21-[1-оксо-[3-(нитрооксиметил)бензоксил]]-17-(валерилокси)прегна-1,4-диен-3,20-диона
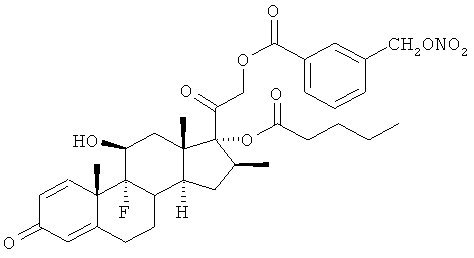
С) (11β,16β)-9-фтор-11-гидрокси-16-метил-21-[1-оксо-[3-(хлорметил)бензоксил]]-17-(валерилокси)прегна-1,4-диен-3,20-дион
К раствору бетаметазон-17-валерата (1,5 г, 3,1 ммоль) в дихлорметане (35 мл) добавляют 3-(хлорметил)бензойную кислоту (0,76 г, 4,5 ммоль), ДМАП (0,038 г, 0,31 ммоль) и EDAC (0,77 г, 4,0 ммоль). Реакцию перемешивают при комнатной температуре в течение 24 ч. Раствор обрабатывают насыщенным раствором бикарбоната натрия, водой, органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией, элюент н-гексан/этилацетат 8/2. Продукт (1,6 г) получают в виде белого порошка.
D) (11β,16β)-9-фтор-11-гидрокси-16-метил-21-[1-оксо-[3-(нитрооксиметил)бензоксил]]-17-(валерилокси)прегна-1,4-диен-3,20-дион
Раствор соединения С (1,68 г, 2,67 ммоль) и нитрата серебра (1,8 г, 11,2 ммоль) в ацетонитриле (25 мл) и тетрагидрофуране (2 мл) перемешивают при 60°С в темноте в течение 12 часов. Выпавший осадок (соли серебра) отфильтровывают и растворитель выпаривают под вакуумом. Остаток очищают флэш-хроматографией, элюент н-гексан/этилацетат 6/4. Продукт (1,1 г) получают в виде белого порошка.
1Н-ЯМР (ДМСО) δ: 8,11 (1Н, s); 8,03 (1H, d); 7,80 (1H, d); 7,62 (1H, t); 7,30 (1H, dd); 6,24 (1H, dd); 6,02 (1H, s); 5,67 (1H, s); 5,58 (1H, d); 4,99 (1H, d); 4,73 (1H, d); 4,29-4,20 (1H, m); 2,59-2,25 (8H, m); 2,19-2,01 (1H, m); 1,89-1,78 (4H, m); 1,56-1,07 (11H, m); 1,0-0,61 (6H, m).
Пример 6
Синтез (11β,16α)-9-фтор-11-гидрокси-16,17-[1-метилэтилиденбис(окси)]-21-[1-оксо-[3-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-диона
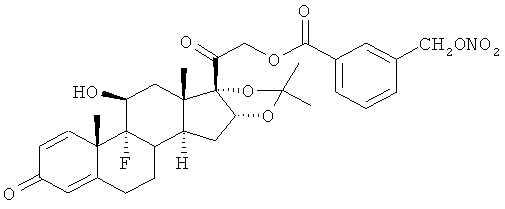
Е) (11β,16α)-9-фтор-11-гидрокси-16,17-[1-метилэтилиденбис(окси)]-21-[1-оксо-[3-(хлорметил)бензоксил]]прегна-1,4-диен-3,20-дион
К раствору триамцинолона ацетонида (1,5 г, 3,4 ммоль) в дихлорметане (35 мл) добавляют 3-(хлорметил)бензойную кислоту (0,83 г, 4,9 ммоль), ДМАП (0,042 г, 0,34 ммоль) и EDAC (0,84 г, 4,4 ммоль). Реакцию перемешивают при комнатной температуре в течение 24 ч. Раствор обрабатывают насыщенным раствором бикарбоната натрия, водой, органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Продукт (1,86 г) получают в виде белого порошка.
F) (11β,16α)-9-фтор-11-гидрокси-16,17-[1-метилэтилиденбис(окси)]-21-[1-оксо-[3-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион
Раствор соединения Е (1,8 г, 3,07 ммоль) и нитрата серебра (1,1 г, 6,5 ммоль) в ацетонитриле (25 мл) и тетрагидрофуране (10 мл) перемешивают при 60°С в темноте в течение 18 часов. Выпавший осадок (соли серебра) отфильтровывают и растворитель выпаривают под вакуумом. Остаток очищают флэш-хроматографией, элюент н-гексан/этилацетат 65/35. Продукт (1,3 г) получают в виде белого порошка.
1Н-ЯМР (ДМСО) δ: 8,12 (1Н, d); 8,03 (1H, d); 7,80 (1H, d); 7,63 (1H, t); 7,30 (1H, d); 6,23 (1H, dd); 6,01 (1H, s); 5,66 (2H, s); 5,46 (1H, bd); 5,45-5,37 (1H, m); 5,05-4,98 (1H, m); 4,86 (1H, bd); 4,22 (1H, bs); 2,72-2,29 (3H, m); 2,13-1,71 (4H, m); 1,62-1,49 (5H, m); 1,42-1,29 (4H, m); 1,2 (3H, s); 0,9 (3H, s).
Пример 7
Синтез (11β,16α)-9-фтор-11,21-дигидрокси-16,17-[1-метилэтилиденбис(окси)]прегна-1,4-диен-3,20-дион-21-[3-карбоки-1-оксопропокси)-3-(нитрооксиметил)бензол]
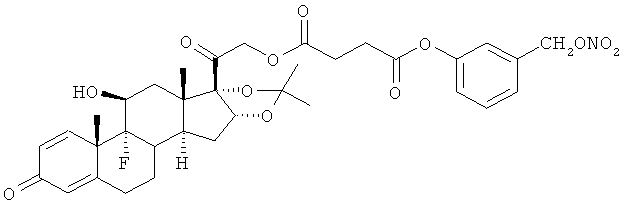
G) (11β,16α)-9-фтор-11,21-дигидрокси-16,17-[1-метилэтилиденбис(окси)]прегна-1,4-диен-3,20-дион 21-гемисукцинат
К раствору триамцинолона ацетонида (1,0 г, 2,3 ммоль) в трет-бутаноле (20 мл) добавляют янтарный ангидрид (0,72 г, 7,0 ммоль) и триэтиламин (0,98 г, 7,0 ммоль). Реакцию перемешивают при комнатной температуре в течение 3 ч. Раствор обрабатывают раствором 2,5% фосфорной кислоты и дихлорметаном, органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Продукт (1,33 г) получают в виде белого порошка.
Н) (11β,16α)-9-фтор-11,12-дигидрокси-16,17-[1-метилэтилиденбис(окси)]прегна-1,4-диен-3,20-дион-21-[3-карбокси-1-оксопропокси)-3-(нитрооксиметил)бензол]
К раствору соединения, полученного на стадии G (1,23 г, 2,3 ммоль), в дихлорметане (50 мл) добавляют 3-(нитрооксиметил)фенол (0,43 г, 2,53 ммоль), ДМАП (0,028 г, 0,23 ммоль) и EDAC (0,56 г, 2,9 ммоль). Реакцию перемешивают при комнатной температуре в течение 2 ч. Раствор обрабатывают водой, органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией, элюент н-гексан/этилацетат 7/3. Продукт (1,13 г) получают в виде белого порошка.
1Н-ЯМР (ДМСО) δ: 7,5-7,41 (1Н, m); 7,40-7,31 (1H, m); 7,30 (2H, m); 7,19-7,12 (1H, dd); 6,25-6,18 (1H, dd); 6,01 (1H, s); 5,54 (2H, s); 5,43 (1H, dd); 5,22-5,12 (1H, d); 4,85 (1H, d); 4,83-4,73 (1H, m); 4,20 (1H, bs); 2,92-2,79 (4H, m); 2,72-2,24 (4H, m); 2,15-1,72 (4H, m); 1,65-1,45 (5H, m); 1,36 (3H, s); 1,21 (3H, s); 0,87 (3H, s).
Пример 8
Синтез (11β)-17-[(этоксикарбонил)окси]-11,21-дигидроксипрегна-1,4-диен-3,20-дион-21-[3-карбокси-1-оксопропокси)-3-(нитрооксиметил)бензол]
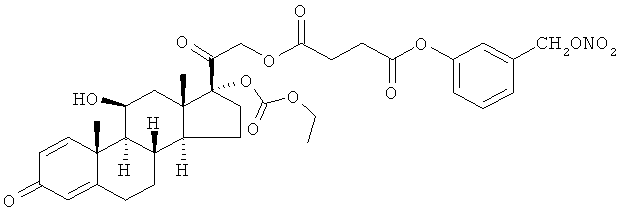
I) (11β)-17-[(этоксикарбонил)окси]-11,21-дигидроксипрегна-1,4-диен-3,20-дион 21-гемисукцинат
К раствору преднизолона 17-этилкарбоната (1,1 г, 2,54 ммоль) в трет-бутаноле (22 мл) добавляют янтарный ангидрид (0,77 г, 7,7 ммоль) и триэтиламин (1,1 мл, 7,75 ммоль). Реакцию перемешивают при комнатной температуре в течение 3 ч. Раствор обрабатывают раствором 2,5% фосфорной кислоты и дихлорметаном, органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Получают продукт (1,5 г).
L) (11β)-17-[(этоксикарбонил)окси]-11,21-дигидроксипрегна-1,4-диен-3,20-дион 21-[3-карбокси-1-оксопропокси)-3-(нитрооксиметил)бензол]
К раствору соединения, полученного на стадии I (1,35 г, 2,5 ммоль) в дихлорметане (50 мл) добавляют 3-(нитрооксиметил)фенол (0,473 г, 2,79 ммоль), ДМАП (0,031 г, 0,25 ммоль) и EDAC (0,62 г, 3,2 ммоль). Реакцию перемешивают при комнатной температуре в течение 4 ч. Раствор обрабатывают водой; органические слои сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией, элюент н-гексан/этилацетат 7/3. Продукт (0,7 г) получают в виде белого порошка.
1Н-ЯМР (ДМСО) δ: 7,47 (1Н, t); 7,36 (1H, d); 3,29 (1H, d); 7,24 (1H, m); 7,16 (1H, m); 6,15 (1H, m); 6,15 (1H, dd); 5,91 (1H, s); 5,57 (2H, s); 4,84 (2H, m); 4,81 (1H, d); 4,29 (1H, bs); 4,10 (2H, m); 2,86 (2H, m); 2,82 (2H, m); 2,74 (1H, m); 2,6-2,49 (1H, m); 2,28 (1H, m); 2,15-1,92 (2H, m); 1,90-1,61 (4H, m); 1,47 (1H, m); 1,35 (3H, s); 1,15 (3H, t); 1,1-0,9 (1H, m); 0,91 (3H, s).
ФАРМАКОЛОГИЧЕСКИЕ ПРИМЕРЫ
Пример 9
Определение in vivo ингибирования ТФА-вызванного отека уха после местного применения тестируемых соединений. Тестируемыми соединениями являлись следующие:
- (11β,16α)-9-фтор-11-гидрокси-16,17-[1-метилэтилиденбис(окси)]-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион, полученный, как описано в примере 1;
- триамцинолон ацетонид, который является контрольным соединением для соединения примера 1;
- (11β)-17-[(этоксикарбонил)окси]-11-гидрокси-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион, полученный, как описано в примере 2;
- предникарбат, который является контрольным соединением для соединения примера 2.
Исследования проводили согласно способам, описанным Carlson et al., Agents Actions 17:197-204, 1985, и Lucas et al., J Pharmacol Exp Ther 304:1172-1180, 2003.
Использовали группы из 5-9 самцов мышей Swiss 27±5 г. Воспалительный дерматит вызывали нанесением 2 мкг/ухо ТФА (тетрадеканоилфорболацетат), растворенного в абсолютном этаноле, на поверхность каждой дорсальной стороны обоих ушей (20 мкл/ухо).
За 15 мин до нанесения ТФА мыши получали местно 20 мкл раствора тестируемых соединений (0,39 нМ в этаноле) на участок, нанесенных непосредственно на кожу левого уха, и растворителя (100% этанол) на правое ухо. «Растворитель-Растворитель» обработанных мышей включали в качестве негативной контрольной группы. Соединения тестировали при эквимолекулярных дозах.
Животных умерщвляли через 3 или 5 ч после дозы ТФА. Затем немедленно удаляли равные части каждого уха и взвешивали. Процент изменения массы левого уха по сравнению с массой правого уха рассчитывали для каждого животного и измеряли процент ингибирования изменения массы обработанных животных по сравнению с изменением массы необработанных животных (негативный контроль). Результаты этого исследования представлены в таблице 1.
Пример 10
Воздействие тестируемых соединений на 12-O-тетрадеканоилфорбол ацетат (ТФА)-вызванное увеличение воспалительных маркеров (PGE2 (простагландин Е2) и TNF-α (фактор некроза опухоли α)) в ухе мыши.
Тестируемыми соединениями являются:
- (11β,16α)-9-фтор-11-гидрокси-16,17-[1-метилэтилиденбис(окси)]-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион, полученный, как описано в примере 1;
- триамцинолон ацетонид, который является контрольным соединением для соединения примера 1.
Десять самцов мышей Swiss использовали для группы обработки. 12-O-тетрадеканоилфорбол ацетат (2,0 мкг, ТФА), растворенный в 20 мкл абсолютного этанола, наносили в 10 мкл объемах как на внутренние, так и на внешние поверхности правого уха мышей. Часть правого уха мышей гомогенизировали в 500 мкл физиологического раствора и после центрифугирования на 1200 g в течение 15 мин при 4°С определяли уровни PGE2 и TNF-α радиоиммуноанализом (Hoult et al., Methods Enzymol 1994) или иммунофлуоресцентным анализом с временным разрешением (Реnnаnеn et al., Int J Immunopharmacol. 1995) соответственно. Тестируемые соединения, растворенные в растворителе, наносили местно за 15 мин перед применением ТФА. Результаты представлены в таблице 2.
** Р<0,01 относительно группы растворитель-ТФА
Результаты демонстрируют, что при низких дозах соединение примера 1 настоящего изобретения показывает уменьшение уровня PGE2 по сравнению с более высокой дозой соединения предшествующего уровня техники, и эти результаты показывают, что соединение настоящего изобретения более эффективно в уменьшении воспаления, чем соответствующее исходное соединение.
Результаты неожиданно показали, что соединение примера 1 настоящего изобретения ингибирует высвобождение TNF-α с более высокой эффективностью, чем соединение предшествующего уровня техники, как показано в таблице 2, следовательно, являясь более эффективным в уменьшении уровней воспаления.
Пример 11
Противовоспалительные свойства на модели контактного дерматита, вызванного бензалконием в мышах.
Исследуемыми соединениями являются следующие:
- (11β,16α)-9-фтор-11-гидрокси-16,17-[1-метилэтилиденбис(окси)]-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион, полученный, как описано в примере 1;
- триамцинолон ацетонид, который является контрольным соединением для соединения примера 1 (контрольное соединение);
- (11β)-17-[(этоксикарбонил)окси]-11-гидрокси-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион, полученный, как описано в примере 2.
Раздражительный контактный дерматит вызывали нанесением 5% бензалкония хлорида (100 мкл на участок, растворенный в оливковом масле:ацетоне, 1:5 об./об.) на дорсальную сторону двух ушей. Диаметр уха измеряли как параметр образования отека до и каждый час в течение 6 часов после нанесения бензалкония хлорида, используя электронный штангенциркуль. Последнее измерение проводят через 8 часов после индуцирован дерматита.
Тестируемые соединения наносят местно, растворяя в этаноле:стерильной воде (1:1) и применяя в конечном объеме 100 мкл, и через 5 минут может индуцироваться раздражительный контактный дерматит.
Значения отека уха (левые уши) для значений времени с 1 по 4 часа после стимулирования раздражения бензалконием хлоридом представлены в таблице 3. Соединение настоящего изобретения (соединение примера 1) демонстрирует дозозависимое воздействие на ингибирование отека уха с улучшенным профилем по сравнению с триамцинолона ацетонидом, в основном в более ранние периоды времени.
Пример 12
Противовоспалительные свойства на модели витальной микроскопии мышей
Тестируемыми соединениями являлись следующие:
- (11β,16α)-9-фтор-11-гидрокси-16,17-[1-метилэтилиденбис(окси)]-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион, полученный, как описано в примере 1;
- триамцинолона ацетонид, который является контрольным соединением для соединения примера 1;
- (11β)-17-[(этоксикарбонил)окси]-11-гидрокси-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион, полученный, как описано в примере 2;
- предникарбат, который является контрольным соединением для соединения примера 2.
Самцов мышей С57В16 подвергают анестезии инъекцией внутрибрюшинно смеси 10 мг/кг ксилазина (МТС Pharmaceuticals, Cambridge, Ontario, Canada) и 200 мг/кг кетамина гидрохлорида (Rogar/STB, London, Ontario, Canada). Витальную микроскопию проводили на полнослойном кожном лоскуте, толщина которого не позволяет визуализацию взаимодействия лейкоцитов/эндотелиальных клеток простой трансиллюминацией. Следовательно, после анестезии мыши будут получать инъекцию внутривенно флуоресцентного красителя, родамина 6G (Sigma, St. Louis, МО, USA, 0,3 мг/кг). При этой дозе родамин 6G метит лейкоциты и тромбоциты и, как было показано, не имеет влияния на кинетику лейкоцитов. Затем проводят срединный абдоминальный надрез от диафрагмы до тазовой области. Кожу тщательно отделяют от нижележащей ткани, но оставляют прикрепленной сбоку, так чтобы снабжение кровью кожного лоскута оставалось неповрежденным. Кожный лоскут растягивали на смотровом основании, чтобы сделать видимой дермальную микроциркуляторную часть, и закрепляли по краям, используя 4,0 нити для наложения швов. Открытые дермальные ткани обрызгивали физиологическим раствором, забуференным бикарбонатом, рН 7,4, чтобы избежать обезвоживания ткани. Микроциркуляцию наблюдали, используя инвертированный микроскоп (Nikon) с ×20 объективом, и родамин 6G делал возможным визуализацию и количественное определение «крутящихся» (rolling) и присоединенных (adherent) лейкоцитов посредством эпииллюминации при 510-560 нм с использованием 590 нм эмиссионного фильтра. Отдельные неразветвленные венулы (20-40 мкм в диаметре) выбирают для исследования. Изображения регистрируют в течение 5 мин после 15-минутного периода установления равновесия, и окончание этого 5-минутного интервала рассматривают как время 0. Адгезию лейкоцитов определяют при воспроизведении видеозаписи на 100 мкм длине сосуда (таблица 4). Лейкоцит рассматривается как присоединенный к эндотелию, если он остается неподвижным в течение 30 с или более. Поток лейкоцитов может быть определен как число лейкоцитов в минуту, перемещающихся со скоростью, меньшей, чем эритроциты, которые проходят контрольную точку в венуле.
Изменение в потоке «крутящихся» лейкоцитов оценивают как разницу между числом «крутящихся» лейкоцитов в каждый интервал времени и основным числом «крутящихся» лейкоцитов (таблица 5).
Тестируемые соединения наносят местно, растворяя в этаноле:стерильной воде (1:1) и применяя в конечном объеме 100 мкл, и через 5 минут может индуцироваться раздражительный контактный дерматит.
Результаты демонстрируют, что соединение настоящего изобретения показывает статистически значимые изменения в диаметре сосуда (Таблица 4), кроме того, оба тестируемых соединения уменьшают статистически «крутящиеся» лейкоциты (таблица 5), конечную точку первичного воспаления, в большей степени, чем соединения предшествующего уровня техники.
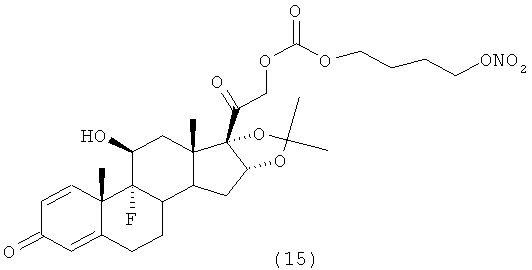
ПРИМЕР 13
Синтез (11β,16α)-9-фтор-11-гидрокси-16,17-(1-метилэтилиденбис(окси))-21-[1-оксо-[4-(нитрокси)бутилокси карбонил]]прегна-1,4-диен-3,20-диона
A) 4-хлорбутил перфторфенил карбонат
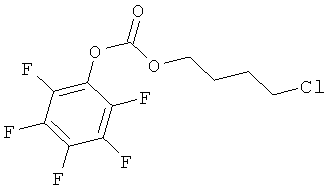
К раствору пентафторфенола (5 г, 27,16 ммоль) в дихлорметане (20 мл) добавляют триэтиламин (4,54 мл, 32,59 ммоль). Реакцию охлаждают до температуры 0°С и добавляют каплями раствор хлорбутилхлорформата (11,1 мл, 81,49 ммоль) в дихлорометане (20 мл). Смесь перемешивают при комнатной температуре в течение 6 часов. Реакцию разбавляют дихлорметаном (40 мл) и промывают 5% водным раствором NaH2PO4 (2×40 мл) и водой (3×50 мл). Органический слой сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией. (Biotage System, колонка 65i флэш, элюент: градиент н-гексан/этил ацетат 98/2, н-гексан/этил ацетет 75/25 в продолжение 5,3 л). Получают продукт (9,1 г).
B) 4-нитрооксибутил перфторфенил карбонат
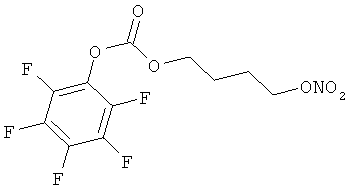
К раствору соединения А) (1,5 г, 4,7 ммоль) в ацетонитриле (20 мл) добавляют нитрат серебра (2 г, 11,77 ммоль). Реакцию нагревают до температуры 120°С в течение 45 минут при микроволновой иррадиации. Полученную смесь охлаждают, фильтруют и удаляют раствор при пониженном давлении. Остаток растворяют в этил ацетате (60 мл) и промывают водой (3×50 мл). Органический слой сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (Biotage System, колонка FLASH 40+М™ KP-Sil, элюент: градиент н-гексан/этил ацетат 9/1, н-гексан/этил ацетат 6/4 в продолжение 1000 мл). Получают продукт (1.06 г).
С) (11β,16а)-9-фтор-11-гидрокси-16,17-(1-метилэтилиденбис(окси))-21-[1-оксо-[4-(нитроокси)бутилоксикарбонил]]-прегна-1,4-диен-3,20-диона
К раствору триамцинолона ацетонида (0,754 г, 1,73 ммоль) в дихлорметане (8 мл) добавляют трифлат скандия (0,067 г, 0,145 ммоль) и DMAP (0,35 г, 2,89 ммоль). Реакцию охлаждают до температуры 0°С и добавляют раствор соединения В) (0,5 г, 1,44 ммоль) в дихлорметане (4 ммоль). Смесь перемешивают при комнатной температуре в течение 48 часов. Смесь разбавляют дихлорметаном (20 мл), промывают 5% NaH2PO4 (2×30 мл). Органический слой сушат сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (Biotage System, колонка FLASH 40+M™ KP-Sil, элюент: градиент н-гексан/этил ацетат 9/1 (200 мл), н-гексан/этил ацетат 2/8 в продолжение 2000 мл, н-гексан/этил ацетат 3/7 (600 мл)). Получают продукт (0, 463 г).
1H-NMR: (DMSO), δ: 7,27 (1H, d); 6,21 (1H, dd); 5,73 (1H, s); 5,46 (1H, d); 5,16 (H, d); 4,84 (1H, d); 4,73 (1H, d); 4,52 (2H, t); 4,25-4,10 (3H, m); 2,71-2,25 (4H, m); 2,21-1,65 (8Н, m); 1,6-1,42 (4H, m); 1,4-1,28 (4H, m); 1,12 (3H, s); 0,8 (3H, s).
Изобретение относится к новым нитрооксипроизводным стероидов, к способам их получения, их фармацевтическим составам для местного применения для лечения заболеваний или нарушений кожи или слизистой оболочки. Эти новые нитрооксипроизводные стероидов имеют улучшенную фармакологическую активность и улучшенную переносимость при местном применении. 6 н. и 16 з.п. ф-лы, 5 табл.
1. Соединение общей формулы (I)
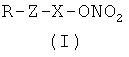
где R означает кортикостероидный остаток формулы (II)

где R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III)
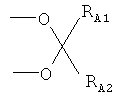 ,
,
где RA1 и RA2 означают -СН3;
R3 означает атом фтора; или
R1 означает -OC(O)OmRi в положении α, где m означает 1 и Ri означает этил, R2 и R3 означают атомы водорода; или
R1 означает -OC(O)OmRi в положении α, где m означает 0, Ri означает н-бутил, R2 означает -СН3 в положении β и R3 означает атом фтора;
Z означает группу, способную связывать X, выбранную из группы, состоящей из:
-С(O)-, С(O)O-;
Х означает бивалентный радикал, имеющий следующие значения:
a) линейный или разветвленный C1-C20 алкилен, при необходимости замещенный одним или более заместителями, выбранными из группы, состоящей из: атомов галогена, гидрокси;
b) C5-C7 циклоалкиленовая группа, при необходимости замещенная линейной или разветвленной C1-С10 алкильной группой;
c)
d)
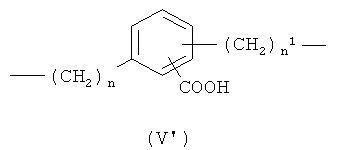
где n означает целое число от 0 до 20;
n1 означает целое число от 1 до 20;
е)
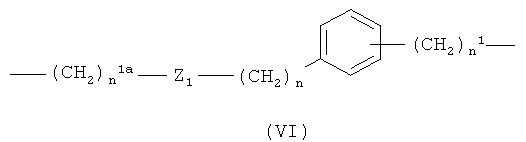
где n1a означает целое число от 1 до 20;
Z1 означает -С(O)O- или -ОС(O)-;
n является таким, как определено выше;
n1 является таким, как определено выше;
при условии, что, когда Х выбирают из бивалентных радикалов, упомянутых под с)-е), -ONO2 группа формулы (I) связана с -(CH2)n 1-группой;
при условии, что когда в формуле (I) Z означает -С(O)-, и в формуле (II) R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III), где RA1 и RA2 означают -СН3, R3 означает атом фтора, тогда Х не имеет следующее значение: а) линейный или разветвленный C1-С20 алкилен, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей из: атомов галогена, гидрокси.
2. Соединения формулы (I) по п.1, где
Z означает -С(O)- или -С(O)O-;
Х имеет следующие значения:
а) линейный или разветвленный C1-С10 алкилен, при необходимости замещенный одним или более заместителями, выбранными из группы, состоящей из: атомов галогена, гидрокси;
с)

d)
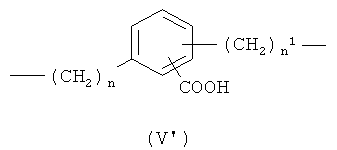
где n означает целое число от 0 до 5;
n1 означает целое число от 1 до 5;
e)
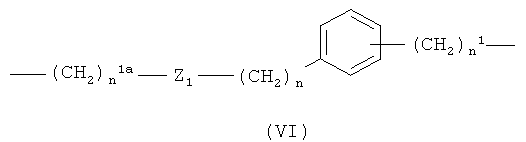
где n1a означает целое число от 1 до 10;
Z1 означает -С(O)O- или -ОС(O)-;
n является таким, как определено выше;
n1 является таким, как определено выше;
при условии, что, когда Х выбирают из бивалентных радикалов, упомянутых под с)-е), -ONO2 группа формулы (I) связана с -(CH2)n 1-группой;
при условии, что, когда в формуле (I) Z означает -С(O)-, и в формуле (II) R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III), где RA1 и RA2 означают -СН3, R3 означает атом фтора, тогда Х не имеет следующее значение:
а) линейный или разветвленный C1-С10 алкилен, при необходимости замещенный одним или более заместителями, выбранными из группы, состоящей из: атомов галогена, гидрокси.
3. Соединения формулы (I) по п.2, где
Х имеет следующие значения:
а) линейный или разветвленный C1-С10 алкилен;
с)

где n означает 0 или 1, и n1 означает 1;

где n1a означает целое число от 1 до 10;
Z1 означает -С(O)O- или -ОС(O)-;
n означает 0 или 1 и n1 означает 1;
при условии, что, когда Х выбирают из бивалентных радикалов, упомянутых под с)-е), -ONO2 группа формулы (I) связана с -(СН2)n 1-группой;
при условии, что, когда в формуле (I) Z означает -С(O)-, и в формуле (II) R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III), где RA1 и RA2 означают -СН3, R3 означает атом фтора, тогда Х не может быть линейным С1-С10 алкиленом.
4. Соединения формулы (I) по п.3, выбранные из следующей группы
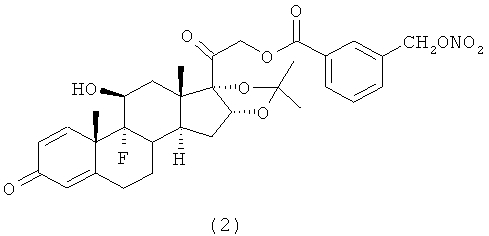
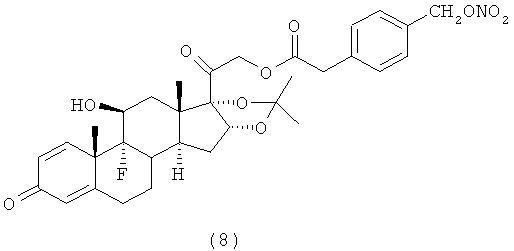
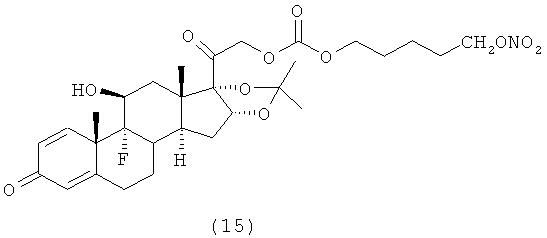
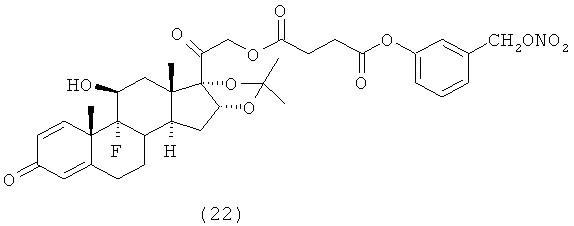
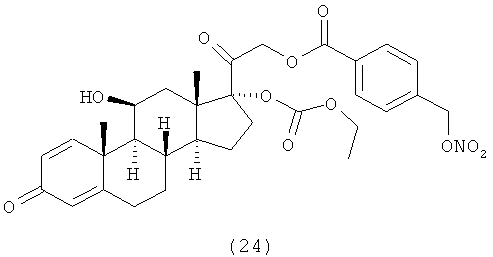
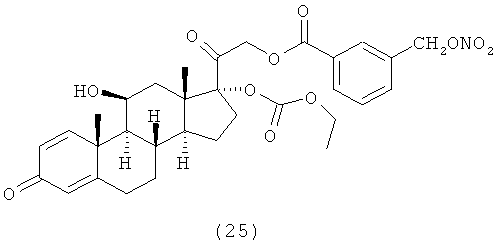
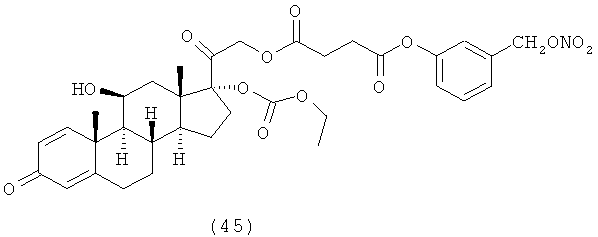
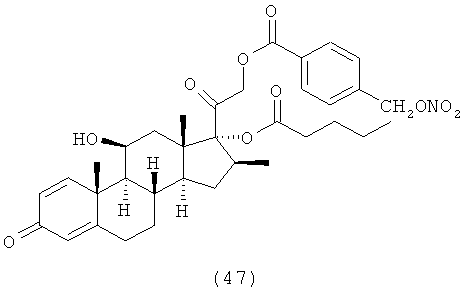
5. Соединение формулы (I) по п.1, которое представляет собой (11β,16α)-9-фтор-11-гидрокси-16,17-[1-метилэтилиденбис(окси)]-21-[1-оксо-[4-(нитрооксиметил)бензоксил]]прегна-1,4-диен-3,20-дион.
6. Применение соединений формулы (1) по п.1 для получения лекарственных средств для лечения чувствительного к кортикостероидам дерматоза, атонического дерматита, контактного дерматита, псориаза, себорейной экземы.
7. Применение соединения формулы (I) по п.5 для получения лекарственных средств для лечения атонического дерматита.
8. Применение соединения формулы (I) по п.5 для получения лекарственных средств для лечения контактного дерматита.
9. Применение соединения формулы (I) по п.5 для получения лекарственных средств для лечения псориаза.
10. Фармацевтический состав для лечения заболеваний кожи, содержащий, по меньшей мере, соединение формулы (I) по любому из пп.1-4 и фармацевтически приемлемые наполнители, где соотношение активного компонента составляет в пределах 0,001-12 вес.%, остальное составляют фармацевтически приемлемые наполнители.
11. Фармацевтические составы для лечения заболеваний кожи по п.10, выбранные из группы, содержащей составы в виде кремов, лосьонов, мазей или композиции для местного распыления.
12. Фармацевтический состав для лечения заболеваний кожи, содержащий соединение формулы (I) по п.5 и фармацевтически приемлемые наполнители, где соотношение активного компонента составляет в пределах 0,001-12 вес.%, остальное составляют фармацевтически приемлемые наполнители.
13. Фармацевтические составы для лечения заболеваний кожи по п.12, выбранные из группы, содержащей составы в виде кремов, лосьонов, мазей или композиции для местного распыления.
14. Способ получения соединения формулы (I) по п.1, где Z означает -СО-, предусматривающий:
1а) реакцию соединения формулы (IIa),
где R1 и R2 оба в положении α взяты вместе образуют группу формулы (III)
где RA1 и RA2 означают СН3, R3 означает атом фтора; или
R1 означает -OC(O)OmRi в положении α, где m означает 1 и Ri означает этил, R2 и R3 означают атомы водорода; или R1 означает -OC(O)OmRi в положении α, где m означает 0, Ri означает н-бутил, R2 означает -СН3 в положении β и
R3 означает атом фтора;
с соединением формулы (Ib)
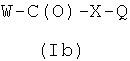 ,
,
где W означает -ОН;
Х является таким как описано в п.1;
Q означает -ONO2 или Z2, где Z2 выбирают из группы, состоящей из: атом хлора, атом брома, атом йода, мезиловая группа или тозиловая группа, в присутствии конденсирующего агента, и
1b) когда Q означает Z2, превращение соединения, полученного на стадии а), в нитропроизводное реакцией с источником нитрата.
15. Способ по п.14, где на стадии 1а) конденсирующий агент выбирают из группы, содержащей дициклогексилкарбодиимид, N'-(3-диметиламинопропил)-N-этилкарбодиимид гидрохлорид и катализатор, N,N-диметиламинопиридин или N,N'-карбонилдиимидазол.
16. Способ по пп.14 и 15, в котором стадию 1а) проводят в подходящем органическом растворителе, выбранном из N,N'-диметилформамида, тетрагидрофурана, толуола, диоксана или полигалогенированного алифатического углеводорода, при температуре от -20 до 40°С.
17. Способ по п.14, в котором на стадии 1b) источник нитрата выбирают из группы, содержащей: нитрат серебра, нитрат лития, нитрат натрия, нитрат калия, нитрат магния, нитрат кальция, нитрат железа, нитрат цинка или нитрат тетраалкиламмония.
18. Способ по пп.14-17, где стадию 1b) проводят в темноте в растворителе, выбранном из группы, содержащей: ацетонитрил, тетрагидрофуран, метилэтилкетон, этилацетат или N,N''-диметилформамид при температуре от комнатной температуры до температуры кипения растворителя.
19. Способ получения соединения формулы (I) по п.1, где Z означает -С(O)O-, предусматривающий:
2а) реакцию соединения формулы (IIa)

где R1 и R2 оба в положении α взяты вместе и образуют группу формулы (III)

где RA1 и RA2 означают -СН3;
R3 означает атом фтора; или
R1 означает -ОС(O)OmRi в положении α, где m означает 1, и Ri означает этил,
R2 и R3 означают атомы водорода; или
R1 означает -OC(O)OmRi в положении α, где m означает 0, Ri означает н-бутил,
R2 означает -СН3 в положении β и
R3 означает атом фтора; с соединением формулы (1с)
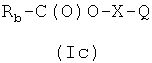
где Q означает -ONO2 или Z2, где Z2 выбирают из группы, состоящей из: атом хлора, атом брома, атом йода, мезиловая группа или тозиловая группа;
Х означает линейный C1-С10 алкилен;
Rb означает Ra1, выбранный из группы, состоящей из: пентафторфенокси, 4-нитрофенокси или сукцимидинилокси;
2b) когда Q означает Z2, превращение соединения, полученного на стадии 2а) в нит-ропроизводное реакцией с источником нитрата.
20. Способ по п.19, в котором стадию 2а) проводят в присутствии N,N-диметиламинопиридина и кислоты Льюиса, выбранной из Sc(OTf)3 или Bi(OTf)3, в растворителе, выбранном из N,N'-диметилформамида или полигалогенированного алифатического углеводорода.
21. Способ по п.19, в котором на стадии 2b) источник нитрата выбран из группы, содержащей: нитрат серебра, нитрат лития, нитрат натрия, нитрат калия, нитрат магния, нитрат кальция, нитрат железа, нитрат цинка или нитрат тетраалкиламмония.
22. Способ по пп.19-21, в котором стадию 2b) проводят в темноте в растворителе, выбранном из группы, содержащей: ацетонитрил, тетрагидрофуран, метилэтилкетон, этилацетат или N,N'-диметилформамид при температуре от комнатной температуры до температуры кипения растворителя.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| HAMMER S | |||
| Et al // Steroids, v 68, №4 (2003), p.329339 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
2011-04-10—Публикация
2006-08-04—Подача