Область техники, к которой относится изобретение
Изобретение относится к области молекулярной биологии, микробиологии, эпидемиологии и медицине и представляет собой способ идентификации мутаций в гене пенициллинсвязывающего белка 2 penA возбудителя гонореи Neisseria gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам (пенициллины, цефалоспорины) с использованием биологического микрочипа с иммобилизованными олигонуклеотидными зондами.
Уровень техники
Гонококковая инфекция, наряду с хламидиозом, трихомониазом и сифилисом, является одной из наиболее частых причин заболеваний, передающихся половым путем. Возбудитель инфекции - грамотрицательная аэробная бактерия Neisseria gonorrhoeae. Согласно данным Всемирной организации здравоохранения (ВОЗ), заболеваемость гонореей в мире в 2016 году составила 87 млн случаев (Report on global sexually transmitted infection surveillance, 2018. Geneva: World Health Organization; 2018). В России в 2016 году зарегистрировано более 21000 случаев заболевания (14,4 на 100000 населения) (Кубанова А.А., Кубанов А.А. и др. Вестник дерматол. венерол., 2017, т. 4, с. 12-27). Наиболее часто N. gonorrhoeae вызывает уретрит у мужчин и цервицит у женщин, осложнениями являются воспалительные заболевания органов малого таза у женщин, эпидидимиты и орхиты у мужчин, что может привести к развитию бесплодия. Особенностью возбудителя гонореи N. gonorrhoeae является его способность к быстрому формированию устойчивости ко всем лекарственным препаратам, используемым для лечения. В настоящее время для каждого из применяемых сейчас или ранее антимикробных препаратов (сульфонамиды, пенициллины, тетрациклины, спектиномицин, макролиды, фторхинолоны, цефалоспорины) обнаружены устойчивые изоляты (Unemo М., Shafer W.M. Clin. Microbiol. Rev., 2014, v. 27(3), p. 587-613, doi: 10.1128/CMR.00010-14; 
 Eur. J. Clin. Microbiol. Infect. Dis., 2017, v. 36 (7), p. 1065-1071, doi:10.1007/sl0096-017-2931-x).
Eur. J. Clin. Microbiol. Infect. Dis., 2017, v. 36 (7), p. 1065-1071, doi:10.1007/sl0096-017-2931-x).
Пенициллины, относящиеся к классу бета-лактамных антибиотиков, ранее широко использовались для лечения гонореи. В настоящее время пенициллины не применяются из-за широкого распространения штаммов N. gonorrhoeae, устойчивых к этим препаратам. Основным препаратом для лечения гонококковой инфекции в России и в мире сейчас является цефтриаксон, который, как и пенициллины, относится к бета-лактамным антибиотикам (класс цефалоспоринов III поколения). Гонококковая инфекция приобрела особую актуальность и опасность из-за формирования и широкого распространения мультирезистентных клонов, в том числе клонов, обладающих устойчивостью к цефалоспоринам III поколения, что может перевести гонорею в разряд неизлечимых заболеваний. Изоляты N. gonorrhoeae, демонстрирующие высокую устойчивость к цефалоспоринам, например Н041 и F89, обнаружены во многих странах мира (Unemo М, Nicholas R.A. Future Microbiol., 2012, v. 7, p. 1401-1422, doi: 10.2217/fmb.l2.117; Shimuta K., Watanabe Y. et al. BMC Infect. Dis., 2015, v. 15, 378, doi: 10.1186/sl2879-015-1110-x). ВОЗ включила N. gonorrhoeae в список из 12 патогенов, представляющих глобальную угрозу и требующих безотлагательной разработки новых лекарственных препаратов (Tacconelli Е., Carrara Е., et al. Lancet Infect. Dis., 2018, v. 18 (3), p. 318-327, doi: 10.1016/S 1473-3099(17)30753-3).
В России проводится постоянный мониторинг уровня устойчивости N. gonorrhoeae к антимикробным препаратам (Kubanova A., Kubanov A. et al. ВМС Infect. Dis., 2014, v. 14, p.342, doi: 10.1186/1471-2334-14-342; Kubanov A., Vorobyev D. et al. BMC Infect. Dis., 2016; v. 16, p. 389, doi: 10.1186/sl2879-016-1688-7; Kubanov A., Solomka V. et al. J. Clin. Microbiol., 2019, v. 57, e02024-18, doi: 10.1128/JCM.02024-18). К настоящему времени в РФ не обнаружено устойчивых к цефтриаксону штаммов, что может объясняться относительной изолированностью современной российской популяции N. gonorrhoeae от популяций стран Европы, Северной Америки и Юго-Восточной Азии, однако абсолютно необходимым является непрерывный контроль за распространением гонококковой инфекции и резистентностью изолятов N. gonorrhoeae к антимикробным препаратам, особенно к цефаспоринам III поколения. Выявление резистентных штаммов способствует предотвращению их распространения, а также необходимо для назначения адекватной антимикробной терапии заболевания.
Антимикробное действие бета-лактамных антибиотиков основано на подавлении образования пептидогликановых связей, что нарушает синтез клеточной стенки бактерий. Резистентность к этим препаратам N. gonorrhoeae объясняется мутациями в генах ponA, penA, porB и mtrR, а также наличием гена, кодирующего β-лактамазу - фермент, гидролизующий связь C-N в β-лактамном кольце антибиотика (Unemo М., Shafer W.M. Clin. Microbiol. Rev., 2014, v. 27(3), p. 587-613, doi: 10.1128/CMR.00010-14). Основным механизмом, приводящим к устойчивости к бета-лактамным препаратам, является изменение структуры пенициллинсвязывающего белка 2 (транспептидаза, РВР 2), кодируемого хромосомным геном penA, приводящее к снижению аффинности к бета-лактамам и уменьшению скорости ацилирования. Основная мутация в гене penA, связанная с резистентностью к пенициллинам (но не к цефалоспоринам) - инсерция кодона аспарагиновой кислоты Asp между 345 и 346 позициями (insAsp345); описаны также 4-8 сопутствующих замен на С-концевом участке белка. В результате мутаций чувствительность к пенициллину снижается в 6-8 раз (Brannigan J.A., Tirodimos LA. et al. Mol. Microbiol, 1990, v. 4, p.913-919, doi: 10.1111/jl365-2958.1990.tb00664.x; Dowson C.G., Jephcott A.E. et al. Mol. Microbiol., 1989, v. 3(1), p. 35-41, doi: 10.1111/j.1365-2958.1989.tb00101.x).
Как для пенициллинов, так и для цефаспоринов, основной мишенью действия является пенициллинсвязывающий белок 2. Однако показано, что изоляты, устойчивые к цефалоспоринам, часто не имеют инсерции insAsp345, приводящей к устойчивости к пенициллинам (Lindberg R., Fredlund Н. et al. Antimicrob. Agents Chemother., 2007, v. 51, p. 2117-2122, doi: 10.1128/AAC.01604-06; Ohnishi M., Golparian D. et al. Antimicrob. Agents Chemother., 2011, v. 55, p. 3538-3545, doi: 10.1128/AAC.00325-11). Устойчивость к цефалоспоринам в большинстве случаев ассоциирована с мозаичной структурой гена penA, который появился в результате рекомбинации с генами penA от комменсальных видов Neisseria, обычно обитающих в ротоглотке, таких как Neisseria perflava, Neisseria sicca, Neisseria polysaccharea, Neisseria cinerea, Neisseria flavescens (Ohnishi M., Ono E. et 1. Antimicrob. Agents Chemother., 2010, v. 54 (7), p. 3021-3023, doi: 10.1128/AAC.00245-10; Lindberg R., Fredlund H. Antimicrob. Agents Chemother., 2007, v. 51 (6), p. 2117-2122, doi: 10.1128/AAC.01604-06).
Мозаичный белок может содержать 60-70 аминокислотных замен по сравнению с пенициллинсвязывающим белком дикого типа (всего в белке 576 остатков). Имеются также белки, которые названы полумозаичными: их структуры кодируются генами penA, содержащими замены только в первой или только во второй половине гена. Большинство исследованных полумозаичных белков не содержат замен в аминокислотных остатках 1-214 (Demczuk W., Sidhu S. et al. J. Clin. Microbiol., 2017, v. 55(5), p. 1454-1468, doi: 10.1128/JCM.00100-17).
Мутации, приводящие к повышению устойчивости к цефалоспоринам включают замены Ala311Val, Ile312Met,, Val316Thr, Val316Pro, Thr483Ser, Ala501Pro, Ala501Val, Asn512Tyr, Gly545Ser (Unemo M., Jensen J.S. Nat. Rev. Urol., 2017, v. 14 (3), p. 139-152, doi: 10.1038/nrurol.2016.268; Osaka K., Takakura TJ. et al. Infect. Chemother., 2008, v. 14 (3), p.195-203, doi: 10.1007/sl0156-008-0610-7). Регрессионный анализ подтвердил влияние мутаций Ala311Val, Ala501Pro, Ala501Val, Ala501Thr, Asn512Tyr, Ala516Gly, Gly542Ser на повышение минимальной подавляющей концентрации (МПК) цефтриаксона и цефиксима у N. gonorrhoeae (Demczuk W., Martina I. Antimicrob. Agents Chemother., 2020, 64(3): e02005-19, doi:10.1128/AAC.02005-19).
Устойчивость N. gonorrhoeae к цефалоспоринам также ассоциирована с наличием немозаичных аллелей гена penA, несущих мутации, приводящих к заменам остатка 501 пенициллинсвязывающего белка 2 Ala510Val и Ala501Thr (Unemo М., Golparian D. et al. Antimicrob. Agents Chemother., 2012, v. 56, p. 1273-1280, doi: 10.1128/AAC.05760-11). Имеются данные о том, что замены Gly542Ser, Pro551Ser и Pro551Leu в немозаичных penA аллелях также вызывают повышения МПК цефтриаксона (Unemo М., Jensen J.S. Nat. Rev. Urol., 2017, v. 14 (3), p. 139-152, doi: 10.1038/nrurol.2016.268; Whiley D.M., Goire N. et al. J. Antimicrob. Chemother., 2010, v. 65 (8), p. 1615-161, doi: 10.1093/jac/dkql87).
В литературе предложена номенклатура генов penA в зависимости от аминокислотных последовательностей кодируемых ими белков, включая мутантные варианты. Согласно классической номенклатуре, аллели гена penA обозначаются римскими цифрами от I до XXXVIII (Zapun A., Morlot С. et al. Antibiotics, 2016, v. 5 (4), p. 35-49, doi: 10.3390/antibiotics5040035). Недавно разработанная в Канаде база данных NG-STAR (N gonorrhoeae Sequence Typing Antimicrobial Resistance, https://ngstar.canada.ca), собирающая информацию о штаммах N. gonorrhoeae, генах и детерминантах резистентности, использует классическую номенклатуру для генов penA и пополняет ее новыми последовательностями, для которых вводятся новые обозначения. В базе данных имеются сведения о типе генов penA (немозаичный, полумозаичный, мозаичный).
Методы секвенирования позволяют анализировать биологические образцы с одновременным определением последовательностей всех генов и анализом генетических детерминант резистентности. Секвенирование генов penA для определения типа гена и мутаций, приводящих к резистентности, описано во многих научных статьях (см., например, Gose S., Nguyen D. et al. BMC Infect. Dis., 2013, v. 13, p. 570, doi: 10.1186/1471-2334-13-570; Lee S.G., Lee H. J. et al. Antimicrob. Chemother., 2010, v. 65, p. 669-675, doi: 10.1093/jac/dkp505; Lee H, Unemo M. et al. J. Antimicrob. Chemother. 2015, v. 70, p. 2536-2542, doi: 10.1093/jac/dkvl46; Attram N., Agbodzi B. et al. PLoS One, 2019, v. 14 (10), e0223598., doi: 10.1371/journal.pone.0223598). Используется также полногеномное секвенирование для идентификации мутаций в генах N. gonorrhoeae, анализа и предсказания антибиотикорезистентности микроорганизма (Eyre D.W., Silva D.D. et al. J. Antimicrob. Chemother., 2017, v. 72, p. 1937-1947, doi:10.1093/jac/dkx067; Poncin Т., Merimeche M. et al. Euro Surveill., 2019, v. 24(36), 1900528, doi: 10.2807/1560-7917.ES.2019.24.36.1900528). Применение секвенирования ограничивается высокой стоимостью оборудования, которое доступно не для всех лабораторий. Кроме того, метод трудоемок и требует получения препарата высокоочищенной ДНК с использованием дорогостоящих реактивов.
Для определения мутаций в гене penA широкое распространение получили методы амплификации нуклеиновых кислот с различными способами детекции. Основные молекулярные тесты для обнаружения антибиотикорезистености N. gonorrhoeae, включая анализ мутаций в генах penA и обнаружения penA аллелей, описаны, например, в обзорной статье  , Low N. et al. (Expert Rev Mol Diagn., 2017, v. 17(9), p. 845-859, doi: 10.1080/14737159. 2017.1360137). В одной из первых работ по детекции мозаичных аллелей penA, опубликованной в 2008 г. (Ochiai S., Ishiko Н. et al. J. Clin..Microbiol., 2008, v. 46 (5), p. 1804-1810, doi: 10.1128/JCM.01800-07) был предложен метод на основе ПЦР в реальном времени, причем в качестве праймеров использовали фрагменты структур генов, кодирующих пенициллинсвязывающие белки бактерий N. cinerea и N perflava. Точность анализа была невысока - при анализе 70 изолятов, содержащих мозаичный типа гена, правильные результаты получены только для 47 изолятов. В последующей работе этот метод был дополнен зондом для специфической идентификации мозаичного penA аллеля penA XXXIV (Gose S., Nguyen D. et al. BMC Infect. Dis. 2013, v. 13, p. 570, doi: 10.1186/1471-2334-13-570), при этом специфичность анализа составила 57%.
, Low N. et al. (Expert Rev Mol Diagn., 2017, v. 17(9), p. 845-859, doi: 10.1080/14737159. 2017.1360137). В одной из первых работ по детекции мозаичных аллелей penA, опубликованной в 2008 г. (Ochiai S., Ishiko Н. et al. J. Clin..Microbiol., 2008, v. 46 (5), p. 1804-1810, doi: 10.1128/JCM.01800-07) был предложен метод на основе ПЦР в реальном времени, причем в качестве праймеров использовали фрагменты структур генов, кодирующих пенициллинсвязывающие белки бактерий N. cinerea и N perflava. Точность анализа была невысока - при анализе 70 изолятов, содержащих мозаичный типа гена, правильные результаты получены только для 47 изолятов. В последующей работе этот метод был дополнен зондом для специфической идентификации мозаичного penA аллеля penA XXXIV (Gose S., Nguyen D. et al. BMC Infect. Dis. 2013, v. 13, p. 570, doi: 10.1186/1471-2334-13-570), при этом специфичность анализа составила 57%.
В работе Unemo М., Golparian D. et al. (Antimicrob. Agents Chemother., 2012, v. 56(3), p. 1273-1280, doi: 10.1128/AAC.05760-11) методом ПЦР в реальном времени идентифицировали штамм N. gonorrhoeae F89, резистентный к цефтриаксону, несущий аллель penA XXXIV и замену Ala501Pro. В работе Whiley D.M., Mhango L. et al. (Emerg. Infect. Dis., 2018, v. 24 (8), p. 1573-1575, doi: 10.3201/eid2408. 180295) методом ПЦР в реальном времени детектировали ген penA мозаичного типа в штамме N. gonorrhoeae FC428.
Описана система детекции, основанная на петлевой изотермической амплификации (LAMP) для выявления мозаичного гена типа penA-60.001 (Shimuta K., Nakayama S.-I. et al. Antimicrob. Agents Chemother., 2019, v. 64(1), e01663-19, doi: 10.1128/AAC.01663-19). Этими же авторами предложена одновременная детекция мозаичных генов типов penA-59.001, penA-60.001 и penA-64.001 (Shimuta K., Igawa G. et al. J. Glob. Antimicrob. Resist., 2019, v. 19, p. 46-49, doi: 10.1016/j.jgar. 2019.02.011).
Для обнаружения мозаичных аллелей в штамме N. gonorrhoeae F89 описан метод ПЦР, использующий зонды с флуоресцентным переносом энергии и анализом кривых плавления (Goire N., Lahra М.М. et al. Euro Surveill., 2013, v. 18(14), 20444, doi: 10.2807/1560-7917.es2013.18.14.20444).
Также были опубликованы работы по одновременной детекции полиморфизмов в различных генах N. gonorrhoeae, включающих penA, porB, ponA, mtrR, ассоциированные с резистентностью к бета-лактамным антибиотикам, с использованием ПЦР, например, Peterson S.W., Martin I., et al. J. Clin. Microbiol. 2015, v. 53(7), p. 2042-2048, doi: 10.1128/JCM.00493-15.
Все вышеописанные методы с применением мультиплексной амплификации позволяют одновременно идентифицировать ограниченное число мутаций и/или типов генов penA. Чаще всего предложенные методы идентификации направлены на обнаружение типов гена penA в одном конкретном штамме N. gonorrhoeae. Кроме того, недостатком применения ПЦР-методов является риск ложноположительных результатов, возникающих при контаминации клинического материала и реактивов, и ложноотрицательных результатов при наличии в клинических образцах факторов, ингибирующих ПЦР, что влияет на чувствительность и специфичность анализа.
Для характеристики изолятов N. gonorrhoeae из Австралии, а именно, для идентификации 11 хромосомных детерминант антибиотикорезистентности, включающих наличие нескольких типов мозаичных penA генов и замен остатка 501 в немозаичных генах, использована технология MassARRAY iPLEX компании Agena Bioscience (Германия) для генотипирования с детекцией с помощью масс-спектрального анализа (Trembizki Е., Smith Н. et al. J. Antimicrob. Chemother., 2014, v. 69 (6), p. 1526-1532, doi: 10.1093/jac/dkt544). Метод требует наличия дорогостоящей аппаратуры и специально обученного персонала, при этом позволяет идентифицировать ограниченное число мутаций в гене penA.
Проведение многопараметрического анализа обеспечивает технология хМАР: анализ с использованием суспензии флуоресцентно-маркированных микросфер, на поверхности которой находятся специфические олигонуклеотидные зонды. Для детекции используется система лазеров, позволяющих проводить как качественную, так и количественную оценку наличия анализируемого соединения в образце. Описан анализ генетических маркеров резистентности N. gonorrhoeae к 6 антимикробным препаратам, включающих пенициллин, ципрофлоксацин, цефиксим, тетрациклин, азитромицин, спектиномицин (12 хромосомных локусов) с использованием данной технологии на микросферах MicroPlex-xTAG компании Luminex Corp. (США) (Balashov S., Mordechai E. et al. J. Mol. Diagn. 2013, v. 15 (1), p. 116-129, doi: 10.1016/j.jmoldx.2012.08.005. Недостатками данной технологии являются необходимость дорогостоящей аппаратуры для анализа, а также сложность получения микросфер. С использованием этого метода также было идентифицировано ограниченное число мутаций в гене penA.
Современные методы генетического многопараметрического анализа включают также методы на основе биологических микрочипов (ДНК-микроматриц): массивов олигонуклеотидных зондов, иммобилизованных в элементах микрочипа. ФГБУ «ГНЦДК» Минздрава России запатентован ДНК-чип для идентификации генетических детерминант антибиотикорезистентности возбудителей инфекций репродуктивного тракта человека Т. pallidum, N. gonorrhoeae, С. trachomatis, М. genitalium, М. hominis, G. vaginalis, U. parvum, U. urealiticum, A. vaginae, E. faecalis, T. vaginalis, E.coli, M. mulieris, S. anginosus, F. nucleatum, S. epidermidis, B. fragilis, к антимикробным препаратам, включающим антибиотики пенициллинового ряда, цефалоспорины, тетрациклины, фторхинолоны, макролиды, нитроимидазолы, спектиномицин (патент РФ №2685188, дата приоритета 25.11.2017, опубликовано 16.04.2019), а также олигонуклеотидный биочип для идентификации генетических детерминант резистентности N. gonorrhoeae к антимикробным препаратам, (патент РФ №2636457, дата приоритета 13.04.2016, опубликовано 23.11.2017). Оба ДНК-чипа позволяют идентифицировать только одну мутацию в гене penA: ins345Asp, приводящую к устойчивости к пенициллинам. Применение таких ДНК-микрочипов для анализа генетических детерминант резистентности N. gonorrhoeae описано в статьях Лейнсоо А.Т., Шаскольский Б.Л. и др. Бюллетень экспериментальной биологии и медицины, 2017, т. 164 (7), с. 63-72. doi: 10.1007/s10517-017-3925-5; Дементьева Е.И., Шаскольский Б.Л. и др. Инфекция и иммунитет, 2019, т. 9 (5-6), с. 750-762, doi: 10.15789/2220-7619-2019-5-6-750-762.
Из анализа уровня техники можно сделать вывод, что в настоящее время существует необходимость разработки способа идентификации мутаций в хромосомном гене пенициллинсвязывающего белка 2 penA N. gonorrhoeae, приводящих к резистентности в бета-лактамным антибиотикам, наиболее опасной из которой является резистентность к цефалоспоринам III поколения, который выгодно отличался бы от известных способов возможностью одновременной идентификации множества мутаций в гене penA, ассоциированных с резистентностью к бета-лактамным антибиотикам, включающим цефалоспорины, а также отличался простотой и быстротой проведения анализа.
Раскрытие сущности изобретения
В настоящем изобретении предложен способ идентификации мутаций в гене пенициллинсвязывающего белка 2 penA возбудителя гонореи N. gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам, включающим пенициллины и цефалоспорины, который выгодно отличается от известных из уровня техники способов возможностью одновременной идентификации мутаций в гене penA, приводящих к аминокислотным заменам Ala311Val, Ile312Met,Val316Thr, Val316Pro, Thr483Ser, Ala501Val, Ala501Pro, Ala501Thr, Asn512Tyr, Gly542Ser, Gly545Ser, Pro551Ser, Pro551Leu, ins345Asp, и позволяющий получить профили, соответствующие немозаичным аллелям гена penA, характерным для изолятов N. gonorrhoeae, чувствительных к бета-лактамным антибиотикам, либо профили, соответствующие немозаичным аллелям гена penA с мутацией insAsp345, характерным для изолятов N. gonorrhoeae, ассоциированным с устойчивостью только к пенициллинам, либо профили, соответствующие немозаичным, полумозаичным и мозаичным аллелям гена penA, ассоциированным с устойчивостью возбудителя гонореи N. gonorrhoeae к бета-лактамным антибиотикам, при этом получаемый профиль может включать мутации, приводящие к аминокислотным заменам Ala311Val, Ile312Met, Val316Thr, Val316Pro, Thr483Ser, Ala501Val, Ala501Pro, Ala501Thr, Asn512Tyr, Gly542Ser, Gly545Ser, Pro551Ser, Pro551Leu.
Способ идентификации мутаций в гене penA с на основе биочипа с иммобилизованными олигонуклеотидными зондами может быть использован для быстрого выявления штаммов возбудителя гонореи, обладающих наиболее опасными детерминантами резистентности, ассоциированными с устойчивостью к цефалоспоринам III поколения, что дает возможность назначения адекватной лекарственной терапии заболевания, а также для проведения эпидемиологического контроля за распространением N. gonorrhoeae. Способ не требует дорогостоящего оборудования и высококвалифицированного персонала.
Предлагаемый способ идентификации мутаций в гене penA N. gonorrhoeae основан на проведении мультиплексной ПЦР с получением одноцепочечных флуоресцентно-меченных фрагментов гена penA N. gonorrhoeae с последующей гибридизацией полученных фрагментов на биочипе, регистрацией гибридизационной картины (флуоресцентного изображения) и анализа флуоресцентных сигналов. Интерпретация результатов осуществляется в зависимости от того, в каком элементе биочипа зарегистрированы гибридизационные комплексы, образованные иммобилизованным олигонуклеотидным зондом и фрагментом гена penA.
Способ включает следующие стадии:
а) обеспечение биологического микрочипа, представляющего собой матрицу элементов, в каждом из которых иммобилизован олигонуклеотидный зонд, имеющий последовательность, выбранную из группы, включающей (а) соответствующие последовательности фрагментов гена penA, не содержащих мутаций, (б) соответствующие последовательности фрагментов мутантных вариантов гена penA и соответствующие последовательности фрагментов вариантов гена penA немозаичного, полумозаичного и мозаичного типа, приводящих к устойчивости N. gonorrhoeae к бета-лактамным антибиотикам;
б) мультиплексную амплификацию фрагментов гена penA при использовании геномной ДНК N. gonorrhoeae в качестве матрицы и набора праймеров, с получением преимущественно флуоресцентно-меченных фрагментов гена penA;
в) гибридизацию амплифицированных флуоресцентно-меченных продуктов, полученных на стадии (б), на биологическом микрочипе, полученном на стадии (а);
г) регистрацию и интерпретацию результатов гибридизации.
В одном из воплощений способ характеризуется тем, что биологический микрочип представляет собой подложку с гидрогелевыми элементами, полученными способом химической или фотоиндуцируемой сополимеризации и содержащими иммобилизованные олигонуклеотидные зонды, последовательности которых представлены SEQ ID NO: 1-64. Перечень последовательностей олигонуклеотидных зондов, используемых для изготовления биочипа, и их SEQ ID приведены в Таблице 1.
В другом воплощении способ характеризуется тем, что стадию мультиплексной амплификации фрагментов гена penA проводят, используя геномную ДНК N. gonorrhoeae, выделенную из материала клинического образца (соскобы со слизистой оболочки уретры и цервикального канала, отделяемое влагалища) или предварительно выращенной культуры микроорганизмов.
В следующем воплощении способ характеризуется тем, что при проведении стадии мультиплексной амплификации фрагментов гена penA используют набор специфичных праймеров, последовательности которых представлены SEQ ID: 65-78. Перечень последовательностей праймеров, используемых при мультиплексной амплификации фрагментов гена penA N. gonorrhoeae и их SEQ ID приведены в Таблице 2.
В еще одном из воплощений способ характеризуется тем, что на стадии регистрации и интерпретации результатов гибридизации выявляют мутации в гене penA N. gonorrhoeae с получением профилей, соответствующих немозаичным аллелям гена penA, характерным для чувствительных к бета-лактамным антибиотикам изолятов, либо профилей, соответствующих немозаичным аллелям гена penA с мутацией insAsp345, характерным для изолятов, устойчивых только к пенициллину, либо профилей, соответствующих немозаичным, полумозаичным и мозаичным аллелям гена penA, ассоциированным с устойчивостью к бета-лактамным антибиотикам (как пенициллинам, так и цефалоспоринам), при этом получаемый профиль может включать мутации, приводящие к аминокислотным заменам Ala311Val, Ile312Met, Val316Thr, Val316Pro, Thr483Ser, Ala501Val, Ala501Pro, Ala501Thr, Asn512Tyr, Gly542Ser, Gly545Ser, Pro551Ser, Pro551Leu.
Краткое описание фигур и таблиц
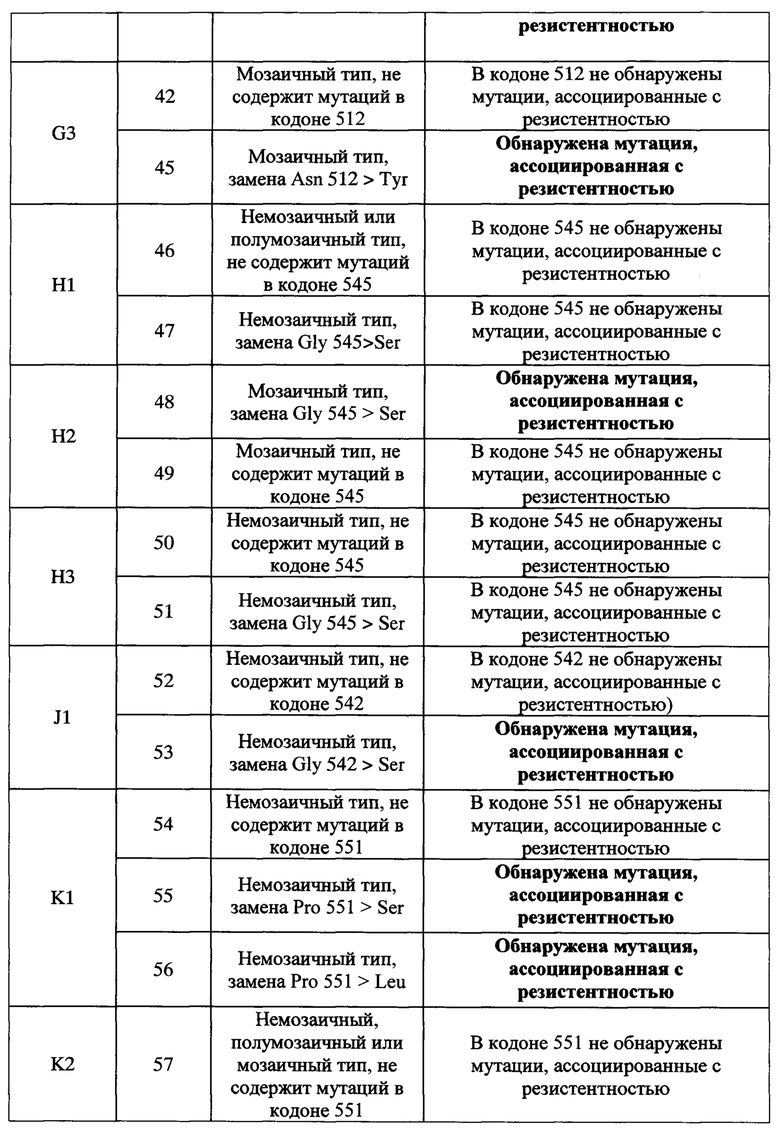
Фигура 1. Схема размещения элементов биочипа для идентификации мутаций в гене пенициллинсвязывающего белка 2 penA возбудителя гонореи Neisseria gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам.
Элементы биочипа представлены в виде кругов. Обозначение элемента - порядковый номер иммобилизованного олигонуклеотидного зонда, соответствующий SEQ ID, от 1 до 64, название аминокислотного остатка в гене penA, анализируемого на предмет соответствия дикому типу либо мутантному варианту. На схеме выделены группы зондов SEQ ID 1-3 (группа A), SEQ ID 4-10 (группа В), SEQ ID 11-14 (группа С), SEQ ID 15-21 (группа D), SEQ ID 22-27 (группа Е), SEQ ID 28-39 (группа F), SEQ ID 40-45 (группа G), SEQ ID 46-51 (группа Н), SEQ ID 52-53 (группа J), SEQ ID 54-62 (группа K), SEQ ID 63-64 (группа L), внутри которых на стадии регистрации и интерпретации результатов гибридизации выбирается максимальный флуоресцентный сигнал, и подгруппы зондов (A1, B1, В2…L1) для интерпретации результатов. М - элементы, содержащие флуоресцентный маркер для обработки сигналов элементов биочипа.
Фигура 2. Гибридизационная картина (флуоресцентное изображение) биочипа при анализе ДНК изолята N. gonorrhoeae, несущего ген penA немозаичного типа, не содержащего мутаций (ген penA дикого типа).
Фигура 3. Гибридизационная картина (флуоресцентное изображение) биочипа при анализе ДНК изолята N. gonorrhoeae с профилем, соответствующим немозаичному аллелю гена penA, несущего инсерцию ins345Asp, ассоциированную с устойчивостью N. gonorrhoeae к пенициллинам (но не к цефалоспоринам).
Фигура 4. Гибридизационная картина (флуоресцентное изображение) биочипа при анализе ДНК изолята N. gonorrhoeae с профилем, соответствующим мозаичному аллелю гена penA, несущего мутации Val 316 > Thr, Asn 512 > Tyr, Gly 545 > Ser, ассоциированные с устойчивостью N. gonorrhoeae к бета-лактамным антибиотикам.
Фигура 5. Гибридизационная картина (флуоресцентное изображение) биочипа при анализе ДНК изолята N. gonorrhoeae с профилем, соответствующим мозаичному аллелю гена penA, несущего мутации Ala 311 > Val, Val 316 > Thr, Ala 501 > Val, Asn 512 > Tyr, Pro 551 > Ser, ассоциированные с устойчивостью TV. gonorrhoeae к бета-лактамным антибиотикам.
Фигура 6. Гибридизационная картина (флуоресцентное изображение) биочипа при анализе ДНК изолята N. gonorrhoeae с профилем, соответствующим полумозаичному аллелю гена penA, несущего мутации Asn 512 > Tyr, insAsp345, ассоциированные с устойчивостью N. gonorrhoeae к бета-лактамным антибиотикам.
Таблица 1. Перечень олигонуклеотидньгх зондов, иммобилизованных в элементах биочипа, используемого в способе идентификации мутаций в гене пенициллинсвязывающего белка 2 penA возбудителя гонореи Neisseria gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам; группы и подгруппы зондов для анализа и интерпретации результатов гибридизации, соответствующие Фигуре 1.
Таблица 2. Перечень последовательностей праймеров, используемых на стадии мультиплексной амплификации фрагментов гена penA Neisseria gonorrhoeae.
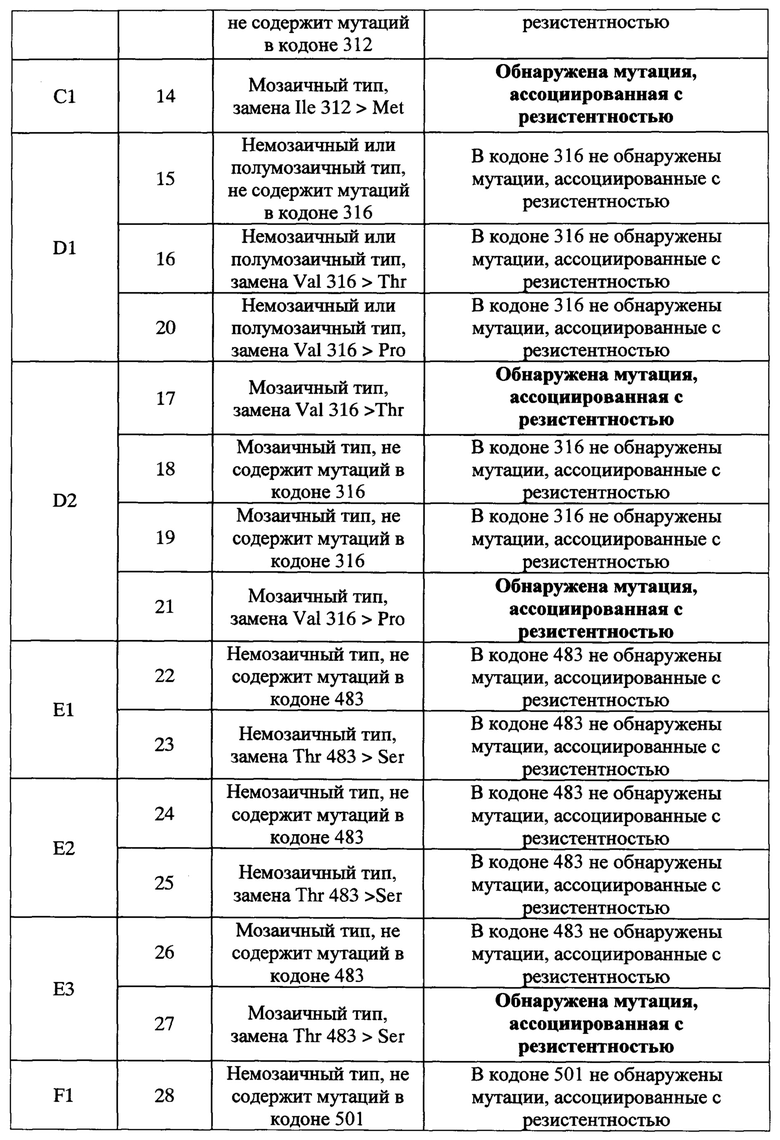
Таблица 3. Алгоритм интерпретации результатов гибридизации при осуществлении способа идентификации мутаций в гене 2 penA N. gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам с использованием биочипа, изображенного на Фигуре 1.
Осуществление изобретения
Целью изобретения являлось создание способа одновременной идентификации мутаций в гене пенициллинсвязывающего белка 2 penA N. gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам, включая пенициллины (бензилпенициллин, ампициллин и др.) и цефалоспорины (цефтриаксон, цефиксим, цефтибутен, цефотаксим, цефподоксим и др.), применяемые для терапии гонококковой инфекции. Установление генетических маркеров резистентности к бета-лактамным антибиотикам с использованием биочипа включает идентификацию мутаций в гене penA с получением профилей, соответствующих немозаичным аллелям гена penA, характерным для чувствительных к бета-лактамным антибиотикам изолятов, профилей, соответствующих немозаичным аллелям гена penA с мутацией insAsp345, характерным для изолятов, устойчивых только к пенициллину, либо профилей, соответствующих немозаичным, полумозаичным и мозаичным аллелям гена penA, ассоциированным с устойчивостью к бета-лактамным антибиотикам (как пенициллинам, так и цефалоспоринам), при этом получаемый профиль может включать мутации, приводящие к аминокислотным заменам Ala311Val, Ile312Met, Val316Thr, Val316Pro, Thr483Ser, Ala501Val, Ala501Pro, Ala501Thr, Asn512Tyr, Gly542Ser, Gly545Ser, Pro551Ser, Pro551Leu.
Одновременный анализ множества мутаций в гене penA достигается при использовании биологических микрочипов (биочипов). Биочип представляет собой матрицу (массив) элементов, в каждом из которых иммобилизован специфичный олигонуклеотидньгй зонд. Заявленный в данном изобретении способ заключается в обеспечении биочипа с соответствующими иммобилизованными олигонуклеотидными зондами, проведении мультиплексной амплификации с использованием праймеров, комплементарных фрагментам гена penA N. gonorrhoeae, с получением преимущественно одноцепочечных флуоресцентно-меченных фрагментов ДНК, гибридизацию флуоресцентно-меченных продуктов на биочипе, регистрацию флуоресцентных сигналов с получением гибридизационной картины и интерпретацию результатов гибридизации в зависимости от того, в каком элементе биочипа зарегистрированы гибридизационные комплексы, образованные иммобилизованным олигонуклеотидным зондом и фрагментом гена penA.
Биочип для осуществления заявляемого способа представляет собой матрицу элементов на подложке из стекла или пластика, которые могут быть сформированы разными способами. Растворы олигонуклеотидных зондов могут быть нанесены непосредственно на подложку с получением так называемого «планарного» биочипа, как описано в книге Matson R.S. Microarray Methods and Protocols. 2009. CRC Press. 216 pages, ISBN 9781420046656. Биочип также может представлять собой матрицу, состоящую из гидрогелевых элементов полусферической формы («трехмерный» биочип), содержащих ковалентно иммобилизованные олигонуклеотиды, изготовленный, например, методом сополимеризационной иммобилизации, разработанной и запатентованный Институтом молекулярной биологии им. В.А. Энгельгардта Российской академии наук (ИМБ РАН) (патент РФ 2216547, дата приоритета 16.10.2001, опубликовано 20.11.2003; патент ЕР 1437368; Грядунов с соавт. Acta Naturae. 2018. 10(4): 4-18, doi: 10.32607/20758251-2018-10-4-4-18). При изготовлении гидрогелевого биочипа формируют композиции, содержащие гелеобразующие мономеры и олигонуклеотидные зонды, подлежащие иммобилизации. Композиции наносят на подложки из стекла или пластика в виде массива микрокапель с помощью автоматического микродозатора (робота). Под действием УФ-излучения происходит полимеризация геля с одновременной ковалентной иммобилизацией зондов в элементах (микрокаплях). Изготовление биочипа на основе гидрогелей для идентификации мутаций в гене penA N. gonorrhoeae описано в Примере 1.
Выбор дискриминирующих олигонуклеотидных зондов проводят с учетом длины и сложности анализируемой последовательности, в частности, наличие повторов и протяженных гомополимерных последовательностей для обеспечения специфичности зондов в отношении анализируемой последовательности. Для каждой позиции, для которой анализируются мутации, подбирают набор специфичных олигонуклеотидов, способный выявлять известные варианты замен. С использованием программного обеспечения Oligo v. 6.3 (Molecular Biology Insights Inc., CILIA), рассчитывают температуры плавления олигонуклеотидов и, варьируя их длину, добиваются того, чтобы разброс температур плавления составлял не более 2-3°C. Избегают олигонуклеотидов, которые способны формировать вторичные структуры типа «шпильки» с высокими температурами плавления. Положение определяемых вариабельных нуклеотидов выбирают по возможности не далее 1-4 нуклеотида от середины соответствующего дискриминирующего олигонуклеотида. Структуры олигонуклеотидных зондов, иммобилизованных в элементах биочипа, используемого в способе идентификации мутаций в гене penA N. gonorrhoeae, приведены в Таблице 1.
Схема расположения элементов биочипа для идентификации мутаций в гене 2 penA представлена на Фигуре 1. Биочип содержит элементы с иммобилизованными олигонуклеотидными зондами, специфичными к исследуемым фрагментам гена penA, и элементы с иммобилизованным флуоресцентным маркером. Элементы с маркером используются для правильного позиционирования биочипа при регистрации флуоресцентного изображения и его обработки программным обеспечением биочип-анализатора (сканера) при получении результатов.
Мультиплексную амплификацию фрагментов penA N. gonorrhoeae для анализа с использованием биочипа проводят, используя геномную ДНК, выделенную из материала клинического образца (соскобы со слизистой оболочки уретры и цервикального канала, отделяемое влагалища) или выращенной культуры. Выделение ДНК проводят с использованием стандартных наборов для выделения нуклеиновых кислот, например, экспресс-наборы для выделения ДНК НПФ «Литех», Набор ДНК-сорб-АМ, ООО «ИнтерЛабСервис», Россия и др.
Мультиплексную ПЦР-амплификацию выполняют любым способом, позволяющим получить флуоресцентно-меченные фрагменты ДНК, соответствующие анализируемым последовательностям, например, с использованием процедур, описанных в статьях: Грядунов Д.А., Гетман И.А. и др. Молекулярная биология, 2011, т. 45 (6), с. 973-983, doi: 10.1134/S0026893311050062; Зименков Д.В., Кулагина Е.В. и др. Молекулярная биология, 2014, т. 48 (2), с. 251-264, doi: 10.7868/S0026898414020189; Zimenkov D.V., Kulagina E.V. et al. J. Antimicrob. Chemother., 2016, v. 71(6), p. 1520-1531, doi: 10.1093/jac/dkw015. Структуры праймеров, используемых на стадии мультиплексной амплификации фрагментов гена penA N. gonorrhoeae, приведены в Таблице 2.
На следующей стадии выполняют гибридизацию амплифицированных флуоресцентно-меченных продуктов-фрагментов гена penA на биологическом микрочипе. Гибридизацию проводят в растворе, содержащем буферный компонент для поддержания рН, соль для создания ионной силы и хаотропный (дестабилизирующий водородные связи) агент, при температуре, зависящей от температуры плавления иммобилизованных на микрочипе олигонуклеотидов, например, как описано в работе Mikhailovich V.M., Lapa S.A. et al. J. Clin. Microbiol., 2001. v. 131 (1), p. 94-98, doi: 10.1023/a:1017555318388.
По окончании процедуры гибридизации регистрируют флуоресцентные сигналы элементов биочипа, обусловленные формированием гибридизационных комплексов между иммобилизованными олигонуклеотидными зондами и флуоресцентно-меченными фрагментами гена penA. Интерпретацию результатов гибридизации выполняют посредством сравнения интенсивностей флуоресцентного сигнала элементов, в которых образовались совершенные и несовершенные гибридизационные комплексы. Сравнивают флуоресцентные сигналы в элементах, содержащих зонды, соответствующие аллелю penA дикого типа, и флуоресцентные сигналы в элементах, содержащих зонды, соответствующие аллелю с мутацией. Максимальный сигнал элемента свидетельствует о наличии или отсутствии мутации в данной аминокислотной позиции, а также о типе анализируемого аллеля гена penA: немозаичный, полумозаичный или мозаичный. Полученные результаты позволяют охарактеризовать мутационный профиль анализируемого изолята N. gonorrhoeae: тип гена penA, обнаруженные мутации, ассоциированные с устойчивостью N gonorrhoeae к бета-лактамным антибиотикам, включающие аминокислотные замены Ala311Val, Ile312Met, Val316Thr, Val316Pro, Thr483Ser, Ala501Val, Ala501Pro, Ala501Thr, Asn512Tyr, Gly542Ser, Gly545Ser, Pro551Ser, Pro551Leu (устойчивость как к пенициллинам, так и к цефалоспоринам), а также инсерцию insAsp345 (устойчивость только к пенициллинам).
С использованием схемы расположения дискриминирующих олигонуклеотидов на биочипе, приведенной на Фигуре 1, проводят сравнение сигналов внутри групп элементов SEQ ID 1-3 (группа A), SEQ ID 4-10 (группа В), SEQ ID 11-14 (группа С), SEQ ID 15-21 (группа D), SEQ ID 22-27 (группа E), SEQ ID 28-39 (группа F), SEQ ID 40-45 (группа G), SEQ ID 46-51 (группа H), SEQ ID 52-53 (группа J), SEQ ID 54-62 (группа K), SEQ ID 63-64 (группа L) (Таблица 2) и выбирают максимальный флуоресцентный сигнал внутри каждой группы. Далее определяют подгруппу, к которой принадлежит элемент с максимальным сигналом в группе (A1, B1, В2…L1) и по расположению элемента идентифицируют тип гена penA (немозаичного, полумозаичного, мозаичного), наличие или отсутствие мутации в соответствующем кодоне, ассоциированной с резистентностью к бета-лактамным антибиотикам. Алгоритм интерпретации результатов гибридизации приведен в Таблице 3.
Фигура 2 иллюстрирует гибридизационную картину, полученную при анализе изолята TV. gonorrhoeae с профилем, соответствующим немозаичному аллелю гена penA, не содержащего мутаций. Фигура 3 иллюстрирует гибридизационную картину, полученную при анализе изолята N. gonorrhoeae с профилем, соответствующим немозаичному аллелю гена penA, содержащего инсерцию ins345Asp, ассоциированную с устойчивостью TV. gonorrhoeae к пенициллинам (но не к цефалоспоринам).
Фигура 4 иллюстрирует гибридизационную картину, полученную при анализе изолята N. gonorrhoeae с профилем, соответствующим мозаичному аллелю гена penA, несущего мутации Val 316 > Thr, Asn 512 > Tyr, Gly 545 > Ser. Фигура 5 иллюстрирует гибридизационную картину, полученную при анализе изолята N. gonorrhoeae с профилем, соответствующим мозаичному аллелю гена penA, несущего мутации Ala 311 > Val, Val 316 > Thr, Ala 501 > Val, Asn 512 > Tyr, Pro 551 > Ser. Фигура 6 иллюстрирует гибридизационную картину, полученную при анализе изолята N. gonorrhoeae с профилем, соответствующим полумозаичному аллелю гена penA, несущего мутации Asn 512 > Tyr, insAsp345. Выявленные мутации ассоциированы с устойчивостью N. gonorrhoeae к бета-лактамным антибиотикам.
Описанный алгоритм интерпретации результатов гибридизации может быть реализован в программном обеспечении, позволяющем проводить автоматическую обработку результатов при регистрации флуоресцентного изображения биочипа, определения интенсивности флуоресцентного сигнала в каждом элементе, сравнения сигналов внутри групп и выдачи отчета о типе гена penA N. gonorrhoeae, наличия или отсутствия мутаций в гене penA, ассоциированных с устойчивостью к бета-лактамным антибиотикам.
Далее изобретение будет проиллюстрировано примерами, которые предназначены для обеспечения лучшего понимания сущности заявленного изобретения, но не должны рассматриваться как ограничивающие данное изобретение.
Пример 1. Изготовление гидрогелевого биочипа для идентификации мутаций в гене пенициллинсвязывающего белка 2 penA N. gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам.
Олигонуклеотидные зонды с последовательностями SEQ ID NO: 1-64 (Таблица 1) синтезировали на автоматического синтезаторе ABI-394 DNA/RNA synthesizer («Applied Biosystems», США) с использованием стандартного фосфорамидитного метода. Зонды содержали спейсер со свободной аминогруппой для ковалентной иммобилизации в гидрогеле, которая вводилась в процессе синтеза с использованием 5'-Amino-Modifier С6 («Glen Research)), США). Проводили очистку зондов обращенно-фазовой ВЭЖХ на хроматографе «Gilson», Франция.
Биочипы на основе гидрогеля изготавливали методом сополимеризационной иммобилизации по ранее разработанной методике, описанной в статье Rubina A.Y., Pan'kov S.V. et al. Anal. Biochem., 2004, v. 325, p. 92-106, doi: 10.1016/j.ab.2003.10.010.
Композиция для приготовления сополимеризационных микрочипов включала растворы 4,75% метакриламида, 0,25% N,N'-метиленбисакриламида, 50% глицерина, 5% N,N,N',N'-тетраметилэтилендиамина (TEMED), водные растворы олигонуклеотидов в концентрации 500-2000 пмоль/мкл, содержащих аминогруппу на 5'-конце, и 0,1 пмоль красителя Texas Red (Thermo Fischer Scientific, США). Композиции переносили в колодцы 384-луночного микротитровального планшета (Genetix, Великобритания), перемешивали и наносили на полимеризационные пластины в виде массива капель объемом ~0,1 нл с помощью роботизированного автоматического микродозатора, обеспечивающего перенос капель композиций последовательно и в строго определенном порядке в заданное место пластины с точностью 10 мкм. Полимеризацию гелевых элементов индуцировали УФ-облучением с длиной волны 350 нм и интенсивностью 0,06 мкВ/см2 в течение 40 минут при 20°C. По окончании полимеризации пластины промывали 0,1 М PBS-буфером, содержащим 0,1% Tween 20, при 65°C в течение 2 часов, затем деионизованной водой и высушивали. Разрезание полимеризационных пластин на индивидуальные подложки микрочипов выполняли с использованием лазера, фиксированного на двухкоординатном позиционере, после чего подложки вкладывали в пластиковые держатели формата предметного стекла и проводили технологический контроль качества. Диаметр гидрогелевых элементов составлял (100±5) мкм, а расстояние между элементами (200±10) мкм.
Схема размещения элементов изготовленного биочипа для идентификации мутаций в гене пенициллинсвязывающего белка 2 penA N. gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам, приведена на Фигуре 1. Биочип состоит из 67 элементов, 64 из которых содержат иммобилизованные олигонуклеотидные зонды с SEQ ID NO: 1-64, и три элемента с иммобилизованным флуоресцентным маркером - аналогом красителя Су5. Ячейки с маркером используются для правильного позиционирования биочипа при регистрации флуоресцентного изображения после проведения гибридизации и его обработки программным обеспечением анализатора биочипов (сканера) при автоматическом получении результатов. Биочип обеспечивает идентификацию мутаций в гене penA с получением профилей, соответствующих гену penA, характерных для чувствительных к бета-лактамным антибиотикам изолятов; профилей, соответствующих немозаичным аллелям гена penA с мутацией insAsp345, характерным для изолятов, устойчивых только к пенициллину; профилей, соответствующих немозаичным, полумозаичным и мозаичным аллелям гена penA, ассоциированным с устойчивостью к бета-лактамным антибиотикам (как пенициллинам, так и цефалоспоринам), при этом получаемый профиль может включать мутации, приводящие к аминокислотным заменам Ala311Val, Ile312Met, Val316Thr, Val316Pro, Thr483Ser, Ala501Val, Ala501Pro, Ala501Thr, Asn512Tyr, Gly542Ser, Gly545Ser, Pro551Ser, Pro551Leu.
Назначение каждого олигонуклеотидного зонда, присутствующего на биочипе, приведено в Таблице 1.
Пример 2. Процедура проведения идентификации мутаций в гене пенициллинсвязывающего белка 2 penA N. gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам идентификация с использованием биологического микрочипа.
Проведение анализа включало стадии мультиплексной амплификации фрагментов гена пенициллинсвязывающего белка 2 penA возбудителя гонореи 7V. gonorrhoeae с получением одноцепочечных флуоресцентно-меченных фрагментов ДНК, гибридизации полученных ПЦР-продуктов на биочипе, полученном, как описано в Примере 1, регистрации и интерпретации результатов гибридизации.
Для анализа использовали клинические образцы: соскобы со слизистой оболочки уретры и цервикального канала, отделяемое влагалища или выращенную культуру. Клинические образцы были предоставлены ФГБУ «ГНЦДК» Минздрава России. Выделение ДНК проводили с использованием экспресс-наборов для выделения ДНК НПФ «Литех» (Россия).
1. Проведение мультиплексной ПЦР.
Готовили реакционную смесь, внося в пробирку следующие реагенты (из расчета на 1 реакцию):
- 10 × ПЦР-буфер для HotStarTaq ДНК-полимеразы, Qiagen, Германия 3,0 мкл;
- дНТФ (водный раствор дезоксинуклеозидтрифосфатов, 2 мМ каждого) 3,0 мкл;
- флуоресцентный субстрат, 1 мМ 0,2 мкл;
- смесь праймеров для ПЦР, 1 пмоль/мкл для каждого праймера с прямым направлением и 50 пмоль/мкл для каждого праймера с обратным направлением, 3,0 мкл;
- HotStarTaq ДНК-полимераза, Qiagen, Германия 1,0 мкл.
- вода деионизованная 21,3 мкл;
Всего 31,5 мкл.
В качестве флуоресцентно-меченного субстрата использовали конъюгат дУТФ с флуоресцентным красителем - аналогом Су5, обладающим максимумом поглощения при 645 нм, максимумом флуоресценции при 670 нм (Kuznetsova V.E., Spitsyn М.А. et al. Mendeleev Communications, 2016, v. 26(2), p. 95-98). К ПЦР-смеси (31,5 мкл) добавляли 3 мкл раствора ДНК, выделенной из клинического образца. Флуоресцентный субстрат встраивался ДНК-полимеразой в растущую цепь ПЦР-продукта в ходе амплификации. Для отрицательного контрольного образца использовали 3 мкл деионизованной воды.
Проводили ПЦР на амплификаторе S1000 (Bio-Rad, США) с использованием следующей последовательности стадий: денатурация 5 мин при 95°C, 50 циклов по схеме 95°C - 30 с, 67°C - 30 с, 72°C - 30 с и 72°C - 5 мин. Полученные растворы использовали для проведения гибридизации на биочипах.
2. Гибридизация на биочипах
В пробирку помещали 10 мкл буфера для гибридизации (0,3 М HEPES, рН 7,5, 3,0 М гуанидинтиоцианата, 30 мМ ЭДТА) и 20 мкл реакционной смеси после проведения мультиплексной ПЦР. Смесь (30 мкл) вносили в гибридизационную камеру биочипа. Биочипы помещали в термостат и проводили гибридизацию при 37°C в течение 6-12 час. По окончании гибридизации биочипы трижды промывали дистиллированной водой и высушивали в потоке воздуха до полного исчезновения капель на поверхности подложки.
3. Регистрация результатов гибридизации
Для регистрации гибридизационных картин использовали Универсальный аппаратно-программный комплекс для анализа биологических микрочипов (УАПК) (ООО «БИОЧИП-ИМБ», Россия), оснащенный специализированным программным обеспечением ‘ImageWare®’ (ООО «БИОЧИП-ИМБ»).
Полученные после проведения анализа гибридизационные картины приведены на Фигурах 2-6.
Тип гена penA (мозаичный, полумозаичный, немозаичный), наличие/отсутствие мутаций в гене penA и соответствующий мутационный профиль анализируемого изолята N. gonorrhoeae устанавливали в соответствии с приведенным выше алгоритмом интерпретации результатов (Таблица 3). По результатам проведенной процедуры определяли наличие генетических детерминант резистентности в гене penA, ассоциированных с устойчивостью к бета-лактамным антибиотикам, включающим пенициллины и цефалоспорины.
Корректность идентификации генетических детерминант резистентности в гене penA с использованием предлагаемого способа проверяли методом секвенирования по Сэнгеру на автоматическом анализаторе 3500xL Applied Biosystems (США). Результаты, полученные с использованием способа, предлагаемого в данном изобретении, и полученные методом секвенирования, совпали для всех анализируемых образцов.
Способ с использованием биочипа, предлагаемый в данном изобретении, позволяет быстро и точно одновременно идентифицировать набор генетических детерминант, ассоциированных с резистентностью N. gonorrhoeae к бета-лактамным антибиотикам, в гене пенициллинсвязывающего белка 2 penA, включая устойчивость к цефалоспоринам III поколения - основным препаратам для лечения гонококковой инфекции в России и в мире. Метод не требует дорогостоящего оборудования и высококвалифицированного персонала. Способ может применяться в клинической лабораторной диагностике, медицине, включая дерматовенерологию, урологию, гинекологию, а также в эпидемиологии для мониторинга распространения N. gonorrhoeae и выявления наиболее опасных штаммов.
Таблица 1.
Таблица 2.
R = G или A; Y = T или C; W = А или Т; S = G или C.

| название | год | авторы | номер документа |
|---|---|---|---|
| ОЛИГОНУКЛЕОТИДНЫЙ БИОЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ РЕЗИСТЕНТНОСТИ Neisseria gonorrhoeae К АНТИМИКРОБНЫМ ПРЕПАРАТАМ, НАБОР ОЛИГОНУКЛЕОТИДОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ ИММОБИЛИЗАЦИИ НА БИОЧИПЕ | 2016 |
|
RU2636457C2 |
| ДНК-ЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ АНТИБИОТИКОРЕЗИСТЕНТНОСТИ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ, ПРИВОДЯЩИХ К НАРУШЕНИЮ РЕПРОДУКТИВНЫХ ФУНКЦИЙ ЧЕЛОВЕКА, НАБОР ОЛИГОНУКЛЕОТИДОВ ДЛЯ ИММОБИЛИЗАЦИИ НА ДНК-ЧИПЕ | 2016 |
|
RU2685188C2 |
| ПЛАЗМИДНЫЙ ВЕКТОР pESB ДЛЯ ОЦЕНКИ УСТОЙЧИВОСТИ NEISSERIA GONORRHOEAE К БЕТА-ЛАКТАМНЫМ АНТИБИОТИКАМ И СПОСОБ ЕГО КОНСТРУИРОВАНИЯ | 2021 |
|
RU2787047C1 |
| СПОСОБ ГЕНОТИПИРОВАНИЯ ИЗОЛЯТОВ NEISSERIA GONORRHOEAE НА БИОЛОГИЧЕСКОМ МИКРОЧИПЕ | 2023 |
|
RU2816767C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ ОДНОНУКЛЕОТИДНЫХ ПОЛИМОРФИЗМОВ В МНОГОКОПИЙНОМ ЛОКУСЕ ГЕНОМА МЕТОДОМ ПЕТЛЕВОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С ПОСЛЕДУЮЩЕЙ ГИБРИДИЗАЦИЕЙ НА БИОЛОГИЧЕСКОМ МИКРОЧИПЕ | 2022 |
|
RU2809184C1 |
| Способ анализа соматических мутаций в генах IDH1 и IDH2 с использованием LNA-блокирующей ПЦР и гибридизации с биологическим микрочипом | 2024 |
|
RU2839291C1 |
| Способ анализа соматических мутаций в генах BRAF, NRAS и KIT с использованием LNA-блокирующей мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2017 |
|
RU2674338C1 |
| Способ определения генетических детерминант резистентности возбудителя туберкулеза к бедаквилину и линезолиду | 2017 |
|
RU2677293C1 |
| СПОСОБ АНАЛИЗА СОМАТИЧЕСКИХ МУТАЦИЙ В ГЕНАХ EGFR, KRAS И BRAF С ИСПОЛЬЗОВАНИЕМ LNA-БЛОКИРУЮЩЕЙ МУЛЬТИПЛЕКСНОЙ ПЦР И ПОСЛЕДУЮЩЕЙ ГИБРИДИЗАЦИЕЙ С ОЛИГОНУКЛЕОТИДНЫМ БИОЛОГИЧЕСКИМ МИКРОЧИПОМ (БИОЧИПОМ) | 2014 |
|
RU2552483C1 |
| Способ анализа терминальных мутаций в генах BRCA1, BRCA2, ATM и PALB2 с использованием мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2020 |
|
RU2729360C1 |





Изобретение относится к биотехнологии и представляет собой способ идентификации мутаций в гене пенициллинсвязывающего белка 2 penA возбудителя гонореи Neisseria gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам (пенициллины, цефалоспорины). Способ включает обеспечение биологического микрочипа с иммобилизованными олигонуклеотидными зондами, мультиплексную амплификацию фрагментов гена penА, гибридизацию амплифицированных флуоресцентно-меченных продуктов на биочипе, регистрацию и интерпретацию результатов гибридизации. 4 з.п. ф-лы, 2 пр., 3 табл., 6 ил.
1. Способ идентификации мутаций в гене пенициллинсвязывающего белка 2 penA возбудителя гонореи Neisseria gonorrhoeae, приводящих к устойчивости к бета-лактамным антибиотикам, включающий:
а) обеспечение биологического микрочипа, представляющего собой матрицу элементов, в каждом из которых иммобилизован олигонуклеотидный зонд, имеющий последовательность, выбранную из группы, включающей (а) соответствующие последовательности фрагментов гена penA, не содержащих мутаций, (б) соответствующие последовательности фрагментов мутантных вариантов гена penA и (в) соответствующие последовательности фрагментов вариантов гена penA немозаичного, полумозаичного и мозаичного типа, приводящих к устойчивости N. gonorrhoeae к бета-лактамным антибиотикам;
б) мультиплексную амплификацию фрагментов гена penA при использовании геномной ДНК N. gonorrhoeae в качестве матрицы и набора праймеров, с получением преимущественно флуоресцентно-меченных фрагментов гена penA;
в) гибридизацию амплифицированных флуоресцентно-меченных продуктов, полученных на стадии (б), на биологическом микрочипе, полученном на стадии (а);
г) регистрацию и интерпретацию результатов гибридизации.
2. Способ по п. 1, характеризующийся тем, что биологический микрочип представляет собой подложку с гидрогелевыми элементами, полученными способом химической или фотоиндуцируемой сополимеризации и содержащими иммобилизованные олигонуклеотидные зонды, последовательности которых представлены SEQ ID NO: 1-64.
3. Способ по п. 1, в котором стадию мультиплексной амплификации фрагментов гена penA проводят, используя геномную ДНК N. gonorrhoeae, выделенную из материала клинического образца (соскобы со слизистой оболочки уретры и цервикального канала, отделяемое влагалища) или предварительно выращенной культуры микроорганизмов.
4. Способ по п. 1, в котором при проведении стадии мультиплексной амплификации фрагментов гена penA используют набор специфичных праймеров, последовательности которых представлены SEQ ID: 65-78.
5. Способ по п. 1, в котором на стадии регистрации и интерпретации результатов гибридизации выявляют мутации в гене penA с получением профилей, соответствующих немозаичным аллелям гена penA, характерным для чувствительных к бета-лактамным антибиотикам изолятов, профилей, соответствующих немозаичным аллелям гена penA с мутацией insAsp345, характерным для изолятов, устойчивых только к пенициллину, либо профилей, соответствующих немозаичным, полумозаичным и мозаичным аллелям гена penA, ассоциированным с устойчивостью к бета-лактамным антибиотикам (как пенициллинам, так и цефалоспоринам), при этом получаемый профиль может включать мутации, приводящие к аминокислотным заменам Ala311Val, Ile312Met, Val316Thr, Val316Pro, Thr483Ser, Ala501Val, Ala501Pro, Ala501Thr, Asn512Tyr, Gly542Ser, Gly545Ser, Pro551Ser, Pro551Leu.
| Ito M | |||
| et al., Emergence and spread of Neisseria gonorrhoeae clinical isolates harboring mosaic-like structure of penicillin-binding protein 2 in Central Japan, Antimicrobial Agents and Chemotherapy, 2005, Т | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ приготовления строительного изолирующего материала | 1923 |
|
SU137A1 |
| Lee S | |||
| G | |||
| et al | |||
| Various penA mutations together with mtrR, porB and ponA mutations in Neisseria gonorrhoeae | |||
Авторы
Даты
2021-01-22—Публикация
2020-06-30—Подача