Область изобретения
Данное изобретение относится к технологии производства первичных тугоплавких металлов, более конкретно к способу получения первичного металла тантала.
Предшествующий уровень техники изобретения
Некоторые тугоплавкие металлы, такие как тантал и ниобий, может быть сложно выделить в чистой (или первичной) форме, в частности, из-за термодинамической устойчивости их предшественников, таких как оксиды. Производство первичных тугоплавких металлов желательно, так как они применяются как исходные материалы, из которых могут быть изготовлены аноды конденсатора. Существующие методы получения первичных тугоплавких металлов обычно включают многостадийные процессы, в которых оксид тугоплавкого металла (например, пентаоксид тантала или пентаоксид ниобия) или другой предшественник (например, галогениды тантала) восстанавливаются в одну или две стадии, за которыми следуют дальнейшие стадии рафинирования и очистки. Такие многостадийные процессы обычно приводят к образованию ненужных потоков побочных продуктов.
Исходный материал, из которого металл тантал может быть получен, включает, например, гептафторотанталат калия (K2TaF7), галогениды тантала и пентаоксид тантала. Восстановление гептафторотанталата калия с натрием - это известный старый способ получения металла тантала. Гептафторотанталат калия и небольшую часть натрия запечатывают в металлическую трубку и нагревают до температуры воспламенения, что приводит к образованию твердой массы, которая включает металл тантал, гептафторотанталат калия, натрий и другие побочные продукты. Твердую смесь затем измельчают и выщелачивают разбавленной кислотой для того, чтобы выделить металл тантал, который обычно не совсем чистый.
Металл тантал может также быть получен с помощью следующего способа, в котором расплавленную структуру гептафторотанталата калия восстанавливают в присутствии соли разбавителя (например, хлорида натрия) путем введения расплавленного металла натрия в реактор в условиях постоянного перемешивания. Процесс восстановления расплавленного натрия приводит к образованию твердой массы, содержащей металл тантал, фторид натрия, фторид калия и другие побочные продукты. Твердую массу измельчают и выщелачивают разбавленным раствором кислоты для того, чтобы выделить металл тантал. Обычно, дополнительные стадии процесса, такие как агломерация, должны быть проведены с продуктом, металлом танталом, с целью улучшения физических свойств. Смотрите, например, патент США 2,950,185.
Электролитическое получение тантала включает электролиз расплавленной смеси гептафтортанталата калия, содержащей пентаоксид тантала (Та2О5), при температуре около 700°С в металлическом контейнере. Электролитическое восстановление приводит к формированию твердой массы, содержащей металл тантал, гептафторотанталат калия, оксиды тантала и другие побочные продукты. Твердую массу затем измельчают и выщелачивают разбавленной кислотой для того, чтобы выделить металл тантал, который обычно не совсем чистый. Такие электролитические способы получения металла тантала сейчас обычно не используются в промышленном масштабе.
Другие способы производства тугоплавких металлов, таких как металл тантал, включают восстановление пентаоксида тантала с металлическим кальцием в присутствии хлорида кальция, как описано, например, в патенте США 1,728,941; и восстановление пентаоксида тантала в присутствии силицида, такого как силицид магния, и гидрида, такого как гидрид кальция, как описано, например, в патенте США 2,516,863. Такие другие методы включают сложные стадии и приводят к формированию побочных продуктов, от которых тугоплавкий металл должен быть отделен.
Более современный способ получения тугоплавких металлов, таких как тантал, включает неполное восстановление оксида тугоплавкого металла (например, пентаоксида тантала или пентаоксида ниобия) путем контакта оксида тугоплавкого металла с газообразным восстанавливающим агентом, таким как газообразный магний. Неполностью восстановленный тугоплавкий металл затем выщелачивают, после чего восстанавливают и агломерируют. Смотрите, например, патент США 6,171,363 В1.
Другой современный способ производства тугоплавких металлов, таких как тантал и ниобий, включает сначала прохождение газообразного водорода через порошок оксида тугоплавкого металла (например, пентаоксида тантала), и, таким образом, образование промежуточного продукта - субоксида тугоплавкого металла. На второй стадии субоксид тугоплавкого металла восстанавливают путем контакта с восстанавливающим газообразным агентом (например, газообразный магнием). Почти полностью восстановленный тугоплавкий металл затем выщелачивают, после чего восстанавливают и агломерируют. Смотри, например, патент США 6,558,447 B1.
Последующие способы получения тугоплавких металлов включают введение галогенида тугоплавкого металла (например, пентахлорида тантала) или алкоксида тугоплавкого металла (например, алкоксида тантала) в плазму, образованную из газообразного водорода. Такие плазменные способы приводят к образованию нежелательных побочных продуктов, таких как коррозионные газообразные галогениды водорода (например, газообразный хлорид водорода), и газообразных алканолы. Плазменные способы на основе галогенида тугоплавкого металла подробно описываются, например, в патентах США 3,211,548, 3,748,106 и 6,689,187 B2. Плазменные способы на основе алкоксида тугоплавкого металла подробно описываются, например, в патенте США 5,711,783. Патент США 5,972,065 раскрывает очистку тантала с помощью плазменного дугового плавления. В способе согласно патенту США 5,972,065 порошок металла тантала помещают в сосуд и текущий поток плазмы, образованной из водорода или гелия, пропускают через порошок металла тантала.
Европейская патентная заявка ЕР 1 066 899 А2 раскрывает способ получения высокоочищенных сферических частиц металлов, таких как тантал и ниобий. Способ, раскрытый в европейской патентной заявке ЕР 1 066 899 А2, включает введение порошка тантала в плазму, образованную из газообразного водорода. Температура плазмы, как раскрыто в европейской патентной заявке ЕР 1 066 899 А2, составляет от 5000 К до 10000 К.
Было бы желательно разработать способы получения, по существу, чистых тугоплавких металлов, таких как первичные тугоплавкие металлы, которые не включают многочисленные стадии процесса и предпочтительно включают только одну стадию восстановления. Было бы также желательно, чтобы такие, вновь разработанные, способы получения тугоплавкого металла использовали промышленное сырье, которое легко доступно и сравнительно безопасно при переработке; и, по меньшей мере, сводили к минимуму образование нежелательных побочных продуктов, которые должны быть отделены и/или в других случая далее обработаны.
Краткое содержание сущности изобретения
Согласно настоящему изобретению обеспечивается способ получения первичного тугоплавкого металла, который может быть выполнен, по существу, в одну стадию и приводит к образованию побочного продукта, содержащего, по существу, воду, при этом данный способ включает:
(a) нагревание газа, содержащего химически активный газ, причем указанный химически активный газ содержит газообразный водород, и, таким образом, формирование нагретого газа, имеющего температурный интервал; и
(b) контактирование оксида тугоплавкого металла в виде частиц с указанным нагретым газом, где
(i) указанный температурный интервал указанного нагретого газа и
(ii) массовое отношение газообразного водорода указанного нагретого газа к указанному оксиду тугоплавкого металла в виде частиц
каждый выбираются таким образом, что
указанный нагретый газ содержит атомарный водород,
указанный оксид тугоплавкого металла является, по существу, термодинамически устойчивым, и
указанный оксид тугоплавкого металла восстанавливается с помощью атомарного водорода на стадии (b),
и таким образом образование указанного первичного тугоплавкого металла.
Согласно настоящему изобретению обеспечивается также способ получения первичного металла тантала, предусматривающий:
(a) нагревание газа, содержащего химически активный газ, причем указанный химически активный газ содержит газообразный водород, и, таким образом, формирование нагретого газа; и
(b) контактирование пентаоксида тантала в виде частиц с указанным нагретым газом при температуре от 1900 К (градусы Кельвин) до 2900 К, и, таким образом, восстановление указанного пентаоксида тантала в виде частиц и образование первичного металла тантала;
где газообразный водород указанного нагретого газа и указанный пентаоксид тантала в виде частиц, реагирующий с указанным нагретым газом, имеют массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц более чем 1,5:1.
В соответствии с данным изобретением также обеспечивается способ получения первичного металла ниобия, предусматривающий:
(a) нагревание газа, содержащего химически активный газ, причем указанный химически активный газ содержит газообразный водород, и, таким образом, образование нагретого газа; и
(b) контактирование оксида ниобия в виде частиц, выбранного из группы, состоящей из диоксида ниобия, пентаоксида ниобия и их комбинаций, с указанным нагретым газом при температуре от 2100 К до 2700 К и, таким образом, восстановление указанного оксида ниобия в виде частиц и образование первичного металла ниобия;
где газообразный водород указанного нагретого газа и указанный оксид ниобия в виде частиц, контактирующий с указанным нагретым газом, имеют массовое соотношение газообразного водорода и оксида ниобия в виде частиц, по меньшей мере, 9:1.
Признаки, характеризующие данное изобретение, подробно указываются в формуле изобретения, которая прилагается и составляет часть данного раскрытия. Эти и другие признаки изобретения, преимущества его применения и специфические объекты, полученные при его применении, будут более понятны из последующего детального описания и прилагающихся чертежей.
Если не указано иное, все цифры или выражения, такие как выражающие конструктивные размеры, композиционные количества, условия обработки и т.д., указанные в описании и формуле изобретения, понимаются как модифицированные во всех случаях посредством термина "около".
Краткое описание чертежей
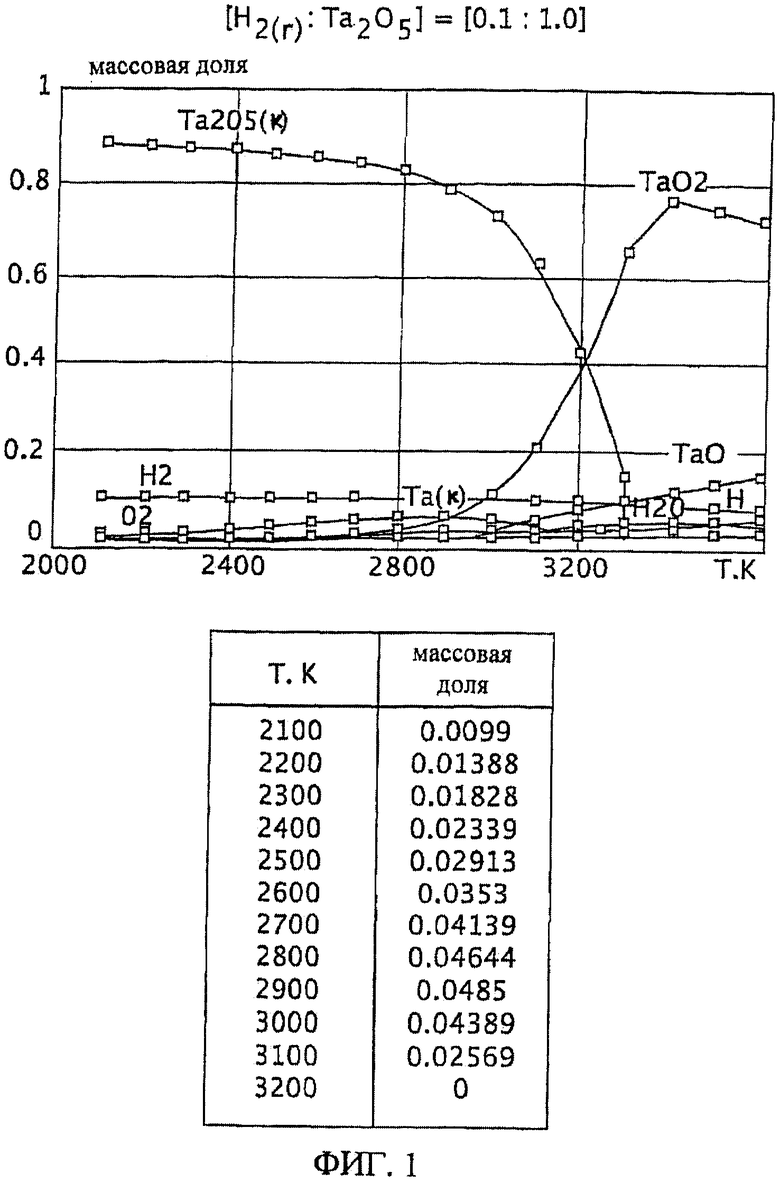
Фиг.1 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 0,1:1,0, Фиг.1 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
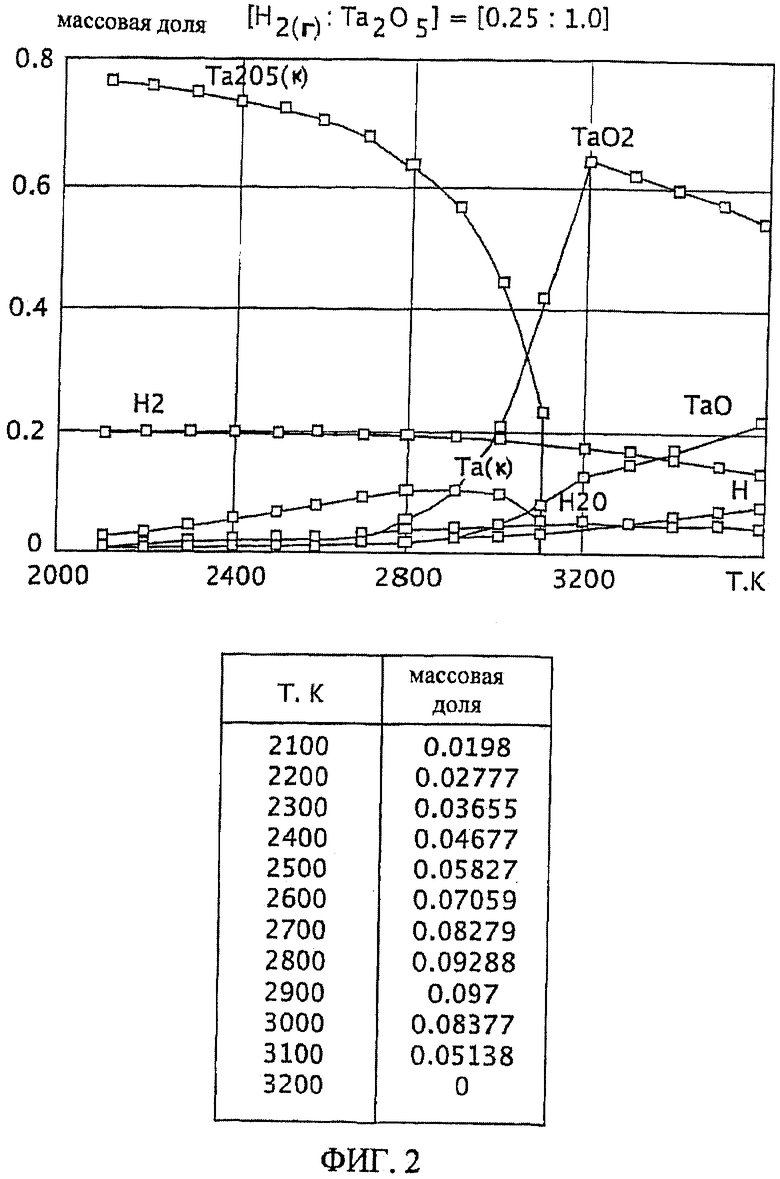
Фиг.2 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 0,25:1,0, Фиг.2 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
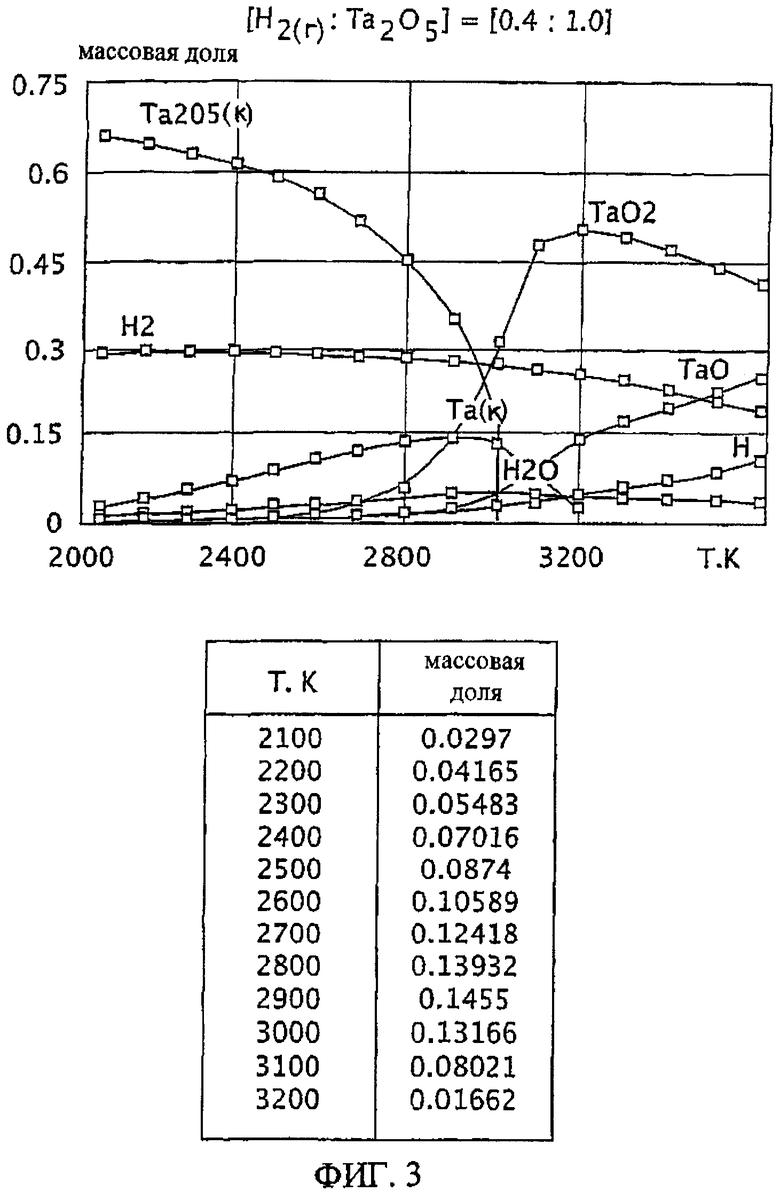
Фиг.3 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 0,4:1,0, Фиг.3 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
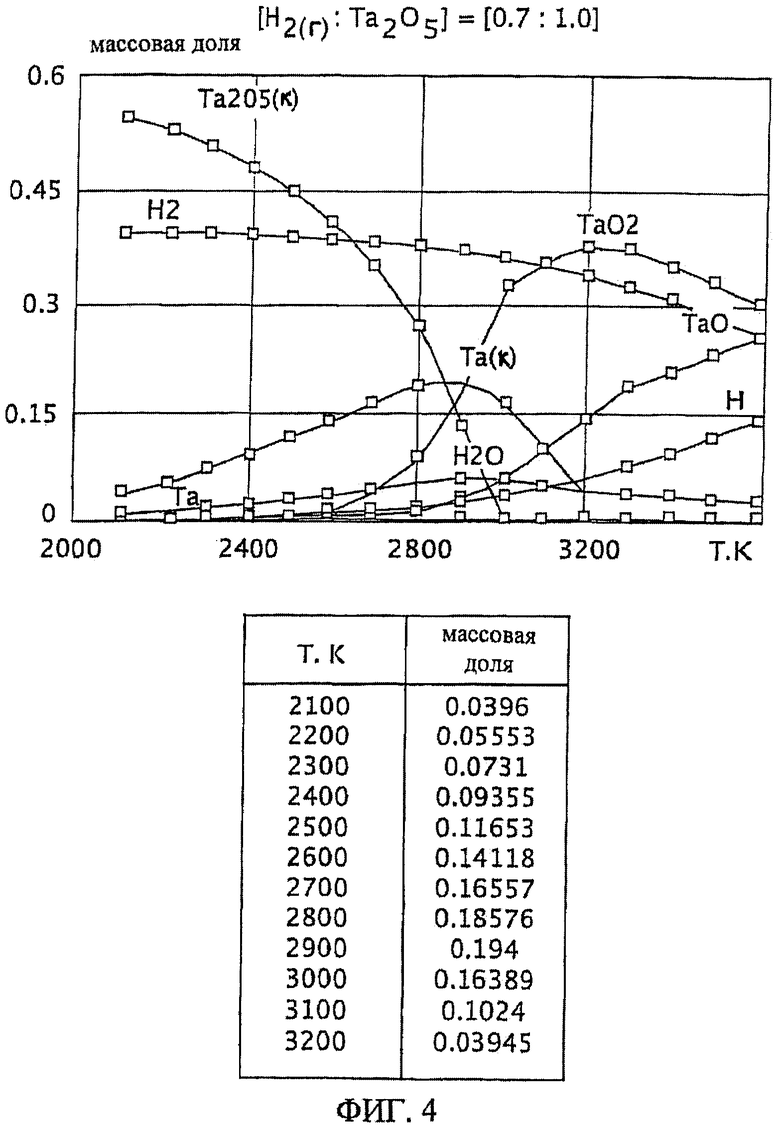
Фиг.4 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала к 0,7:1,0, Фиг.4 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
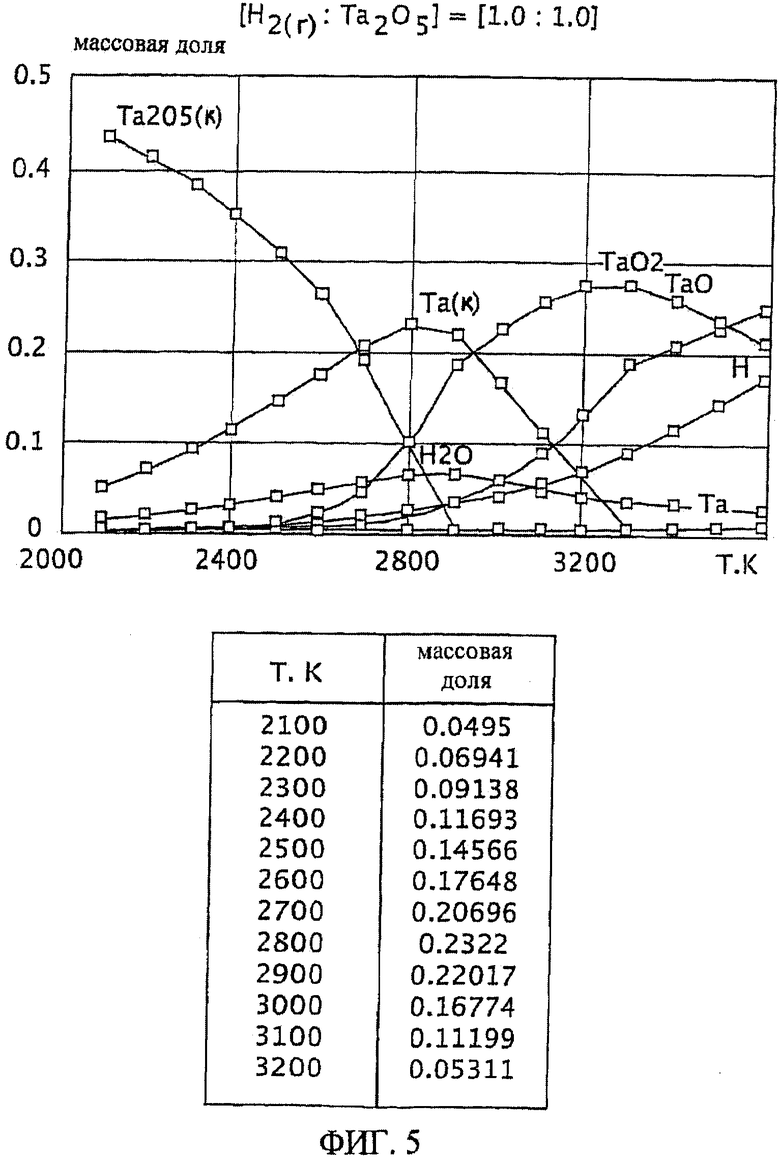
Фиг.5 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 1,0:1,0, Фиг.5 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
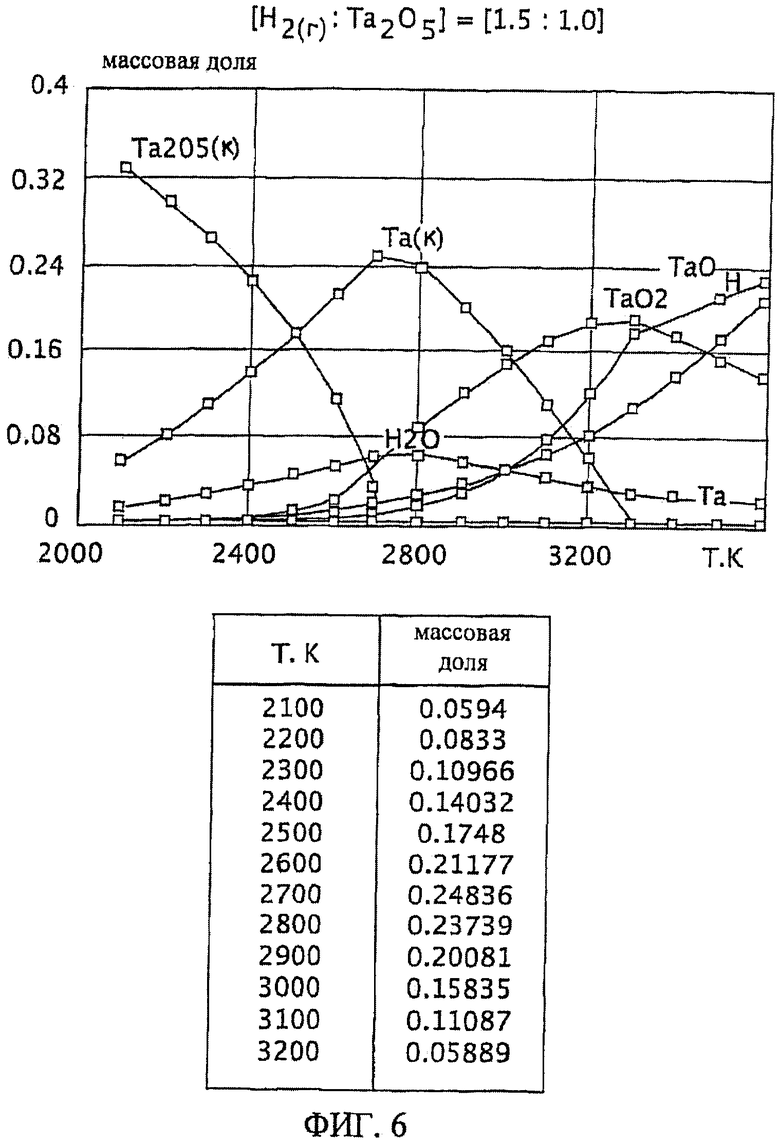
Фиг.6 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 1,5:1,0, Фиг.6 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
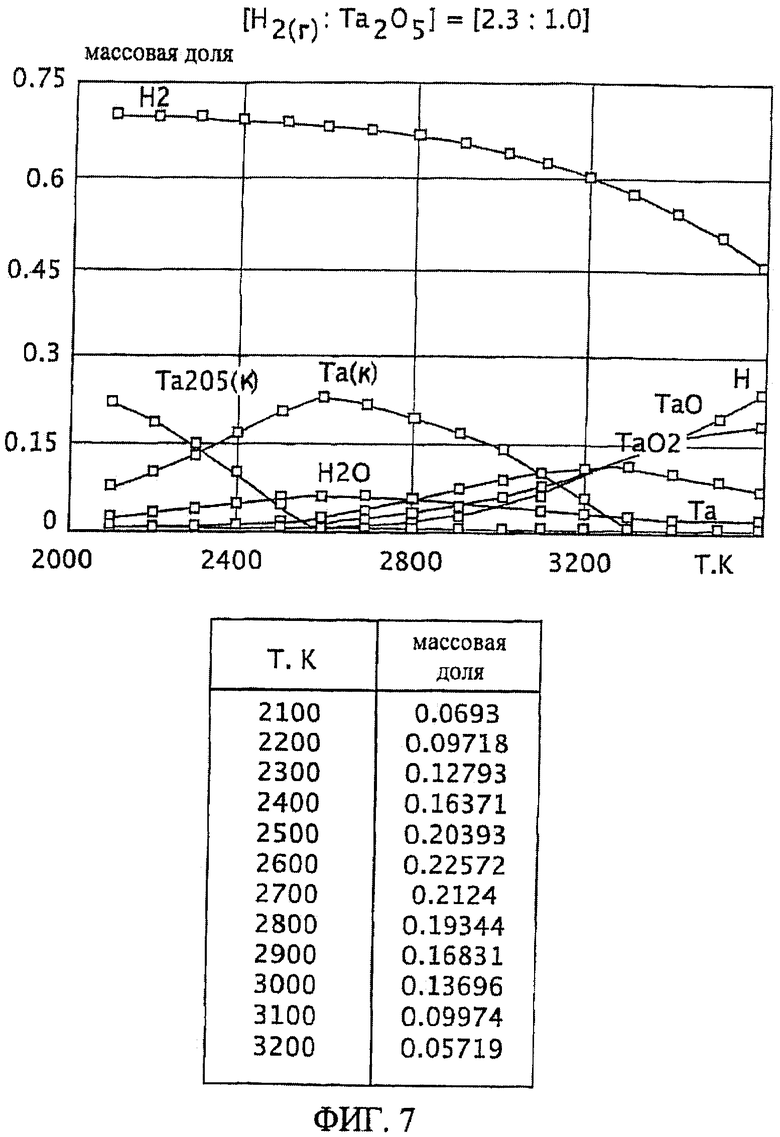
Фиг.7 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 2,3:1,0, Фиг.7 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
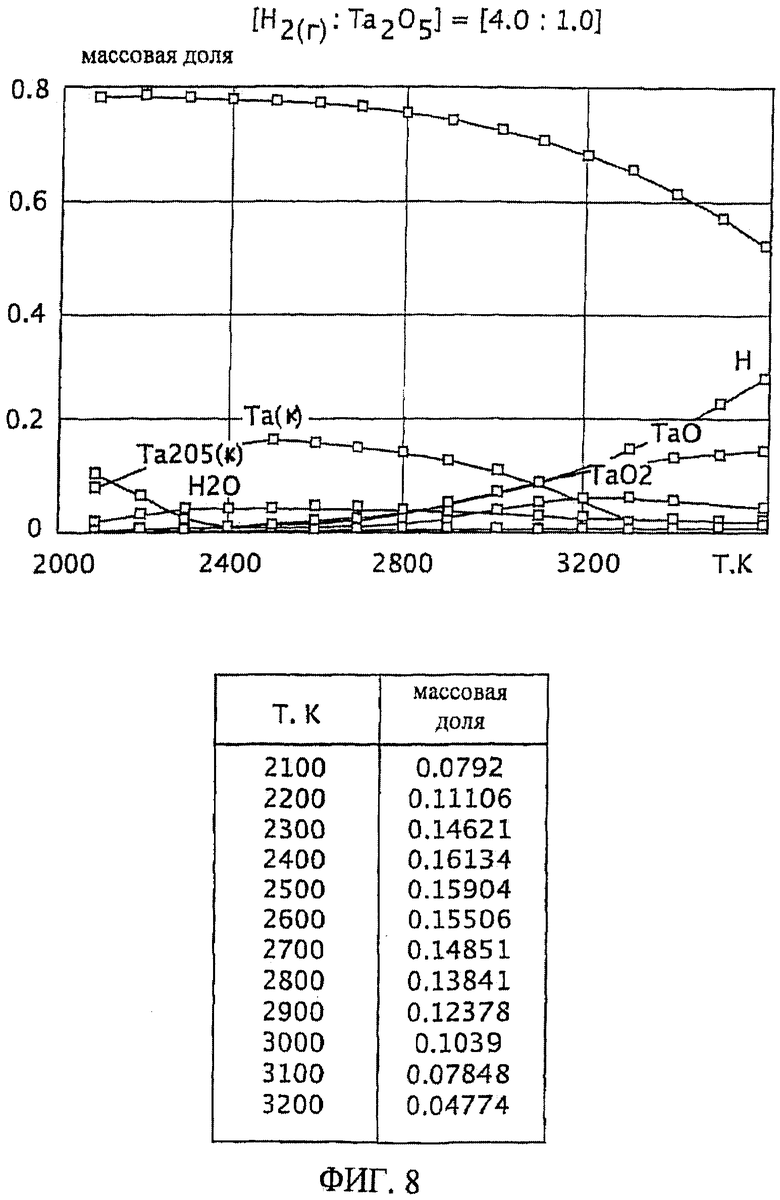
Фиг.8 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 4,0:1,0, Фиг.8 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
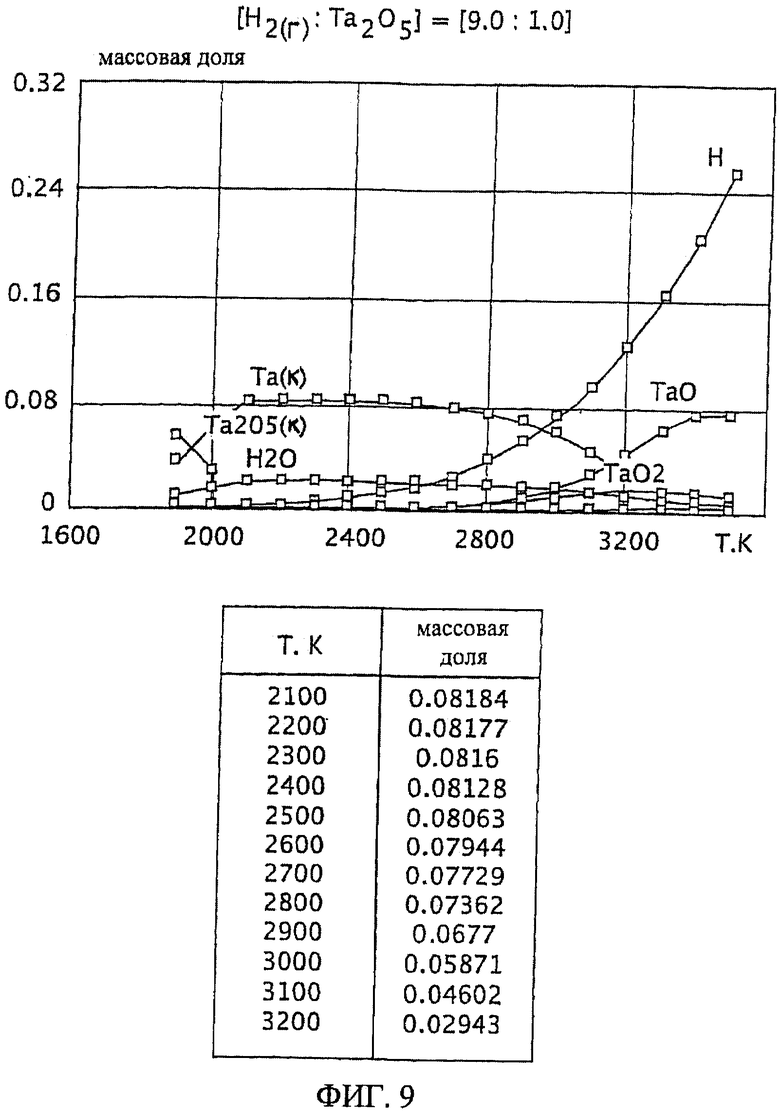
Фиг.9 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла тантала, при массовом соотношении газообразного водорода и пентаоксида тантала 9,0:1,0, Фиг.9 также включает таблицу массовой доли конденсированного первичного металла тантала (Та(к)) как функции от температуры, на основе которой строится часть графика;
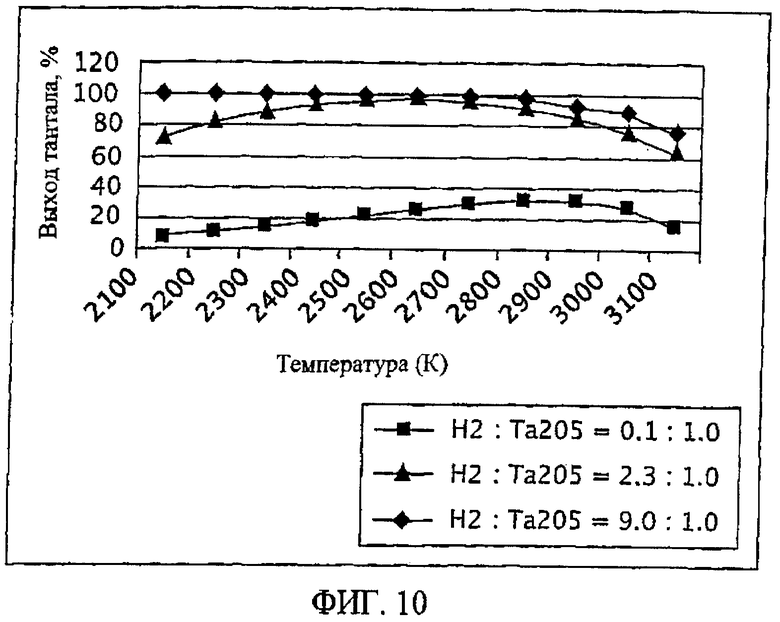
Фиг.10 является графическим изображением процентного выхода тантала как функции от температуры для трех отдельных массовых соотношений газообразного водорода к пентаоксиду тантала;
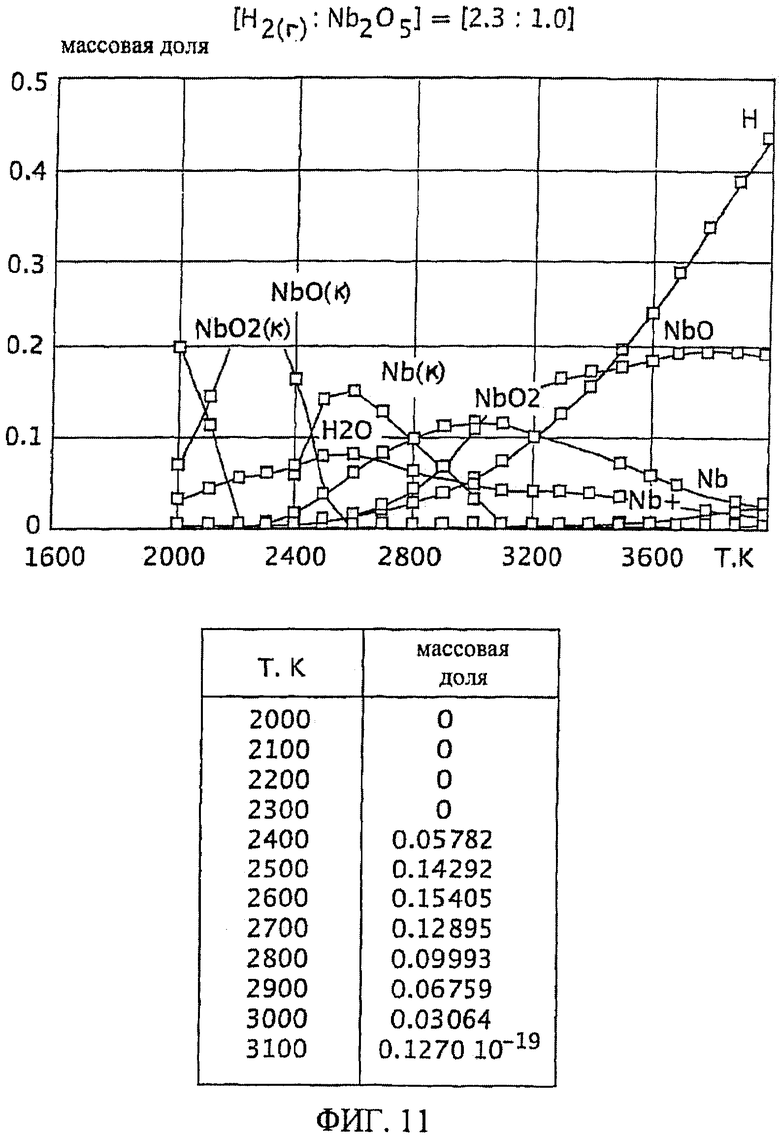
Фиг.11 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла ниобия, при массовом соотношении газообразного водорода и пентаоксида ниобия 2,3:1,0, Фиг.11 также включает таблицу массовой доли конденсированного первичного металла ниобия (Nb(к)) как функции от температуры, на основе которой строится часть графика;
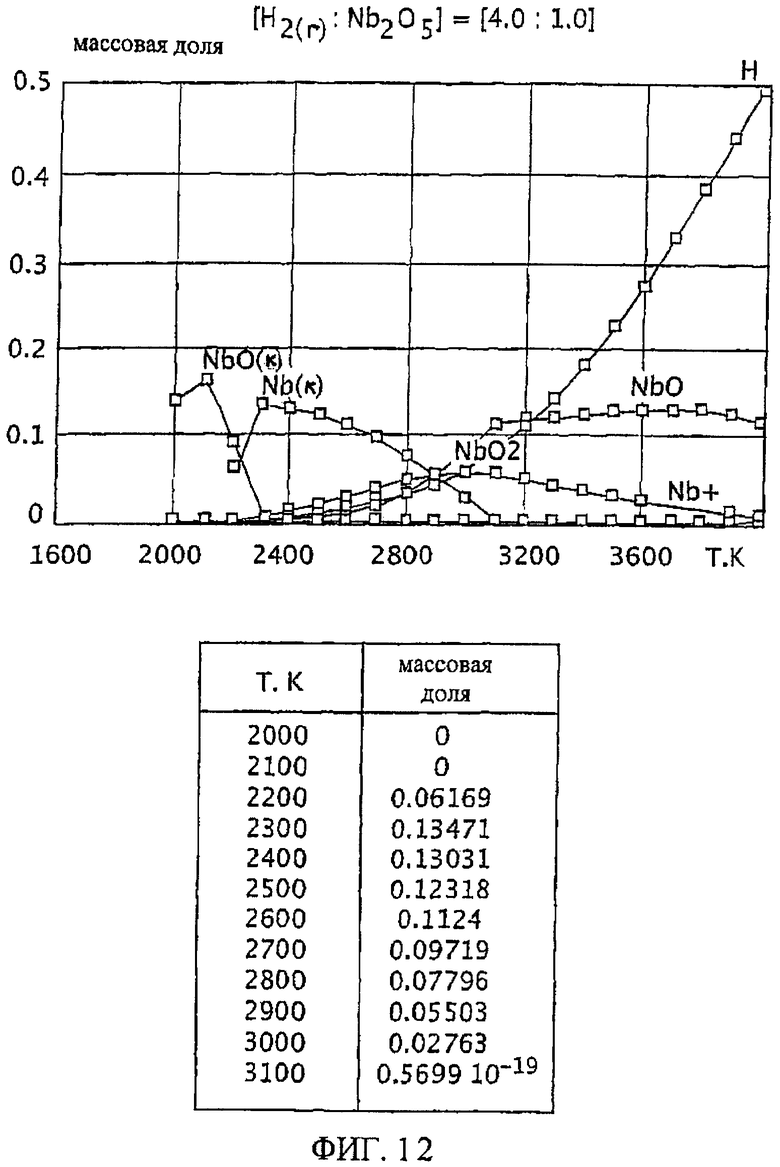
Фиг.12 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла ниобия, при массовом соотношении газообразного водорода и пентаоксида ниобия 4.0:1,0, Фиг. 12 также включает таблицу массовой доли конденсированного первичного металла ниобия (Nb(к)) как функции от температуры, на основе которой строится часть графика;
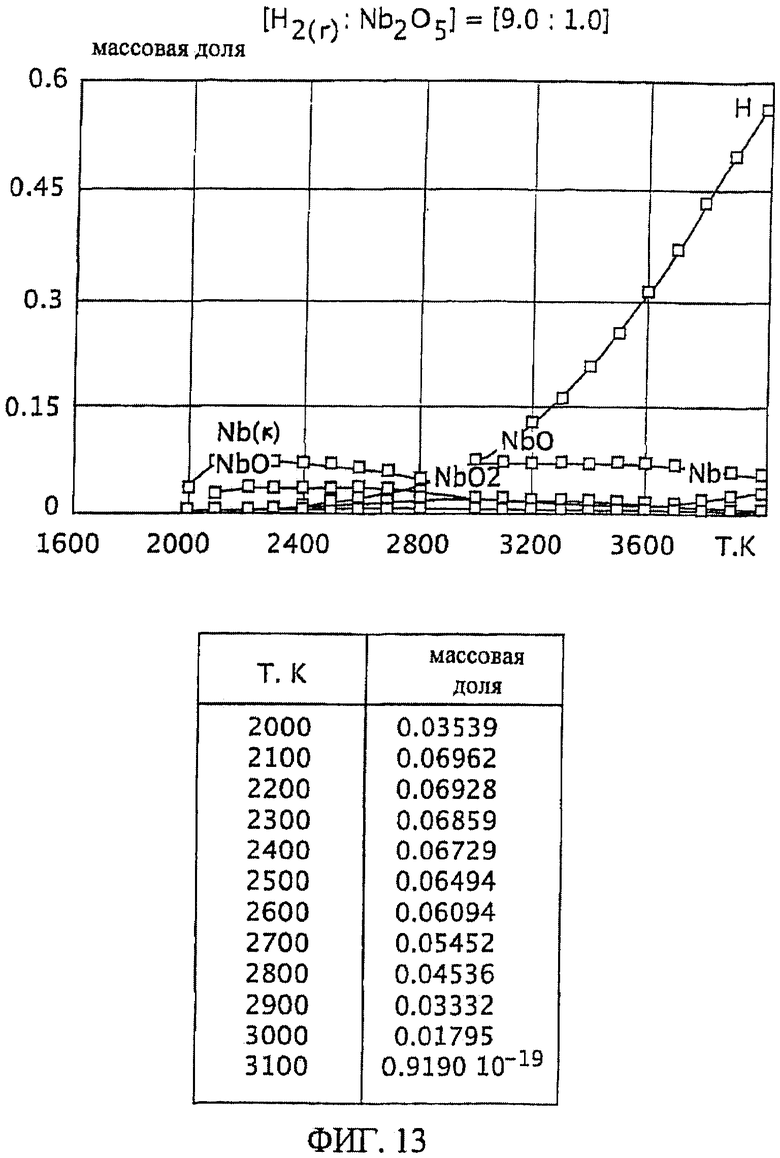
Фиг.13 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла ниобия, при массовом соотношении газообразного водорода и пентаоксида ниобия 9,0:1,0, Фиг.13 также включает таблицу массовой доли конденсированного первичного металла ниобия (Nb(к)) как функции от температуры, на основе которой строится часть графика; и
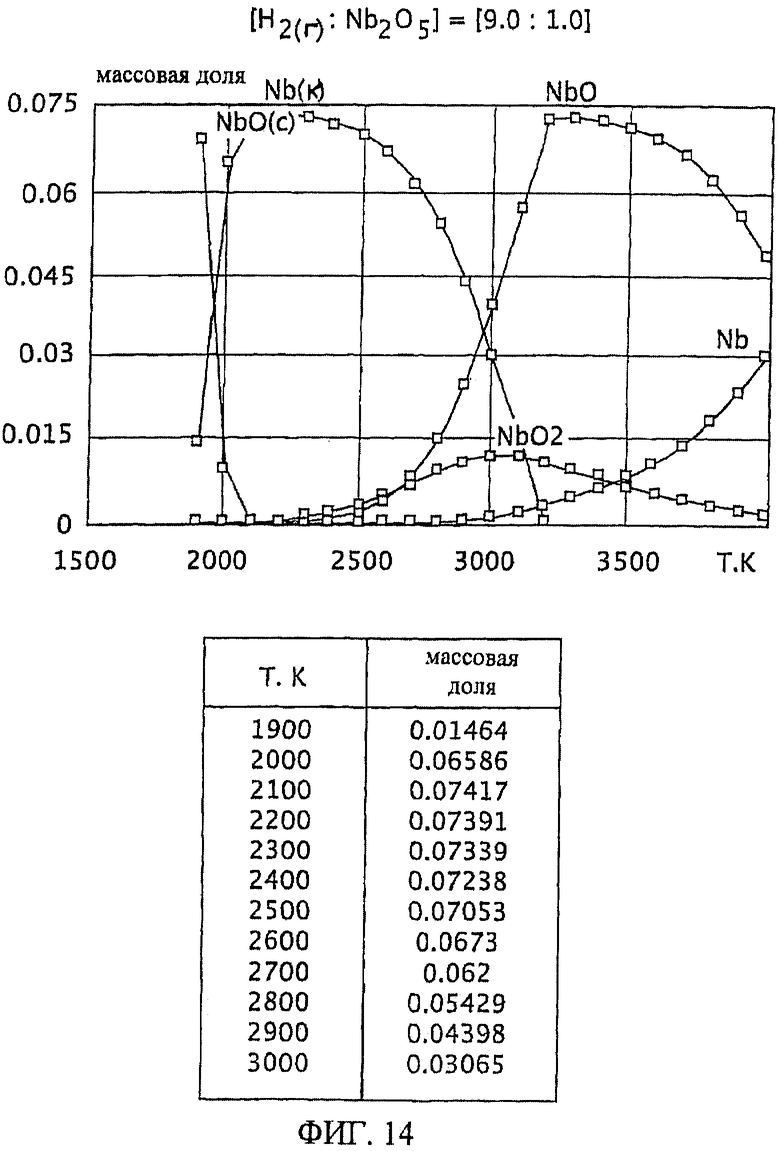
Фиг.14 является графическим изображением графика массовой доли как функции от температуры, для образования первичного металла ниобия, при массовом соотношении газообразного водорода и пентаоксида ниобия 9,0:1,0, Фиг.13 также включает таблицу массовой доли конденсированного первичного металла ниобия (Nb(к)) как функции от температуры, на основе которой строится часть графика;
На Фиг.1-14 аналогичные цифры и обозначения означают одни и те же элементы и признаки.
Подробное описание изобретения
Используемый здесь и в формуле изобретения термин «атомарный водород» означает газообразный одноатомный водород (то есть, Н(г) или Н), то есть не в ионной форме (например, газообразный катион водорода, Н+ (г) или Н+). Используемый здесь термин «газообразный водород» означает газообразный молекулярный (двухатомный) водород (то есть, H2(г) или Н2).
Газ, который нагревают и с которым контактирует загружаемый материал оксида тугоплавкого металла по способу настоящего изобретения, включает химически активный газ, который содержит газообразный водород. При необходимости, химически активный газ может дополнительно содержать другие химически активные компоненты, такие как алканы (например, метан, этан, пропан, бутан и их комбинации). Если химически активный газ содержит химически активные компоненты, отличные от водорода (например, метан), то эти другие химически активные компоненты обычно представлены в незначительном количестве (например, в количествах менее чем, или равных, 49 мас.%, основываясь на общей массе химически активного газа). Химически активный газ может включать: водород в количестве от 51 до 99 мас.%, от 60 до 85 мас.% или от 70 до 80 мас.%; и химически активный компонент, отличный от водорода (например, метан), в количестве от 1 до 49 мас.%, от 15 до 40 мас.% или от 20 до 30 мас.%, причем массовые проценты приведены по отношению к общей массе химически активного газа. Предпочтительно, чтобы химически активный газ содержал по существу 100 мас.% газообразного водорода.
Газ, который нагревают и с которым контактирует подаваемый материал оксида тугоплавкого металла, по способу настоящего изобретения может при необходимости дополнительно содержать инертный газ. Инертный газ может быть выбран, например, из одного или более инертных газов VIII группы периодической таблицы элементов. VIII группа элементов, из которой инертный газ может быть выбран, включает неон, аргон, криптон, ксенон и их комбинации. Предпочтительным инертным газом является аргон. Если инертный газ присутствует, то газ (подаваемый газ), который нагревают и с которым контактирует оксид тугоплавкого металла, обычно включает: от 20 до 50 мас.% химически активного газа, от 25 до 40 мас.% химически активного газа; и от 50 до 80 мас.% инертного газа, от 60 до 75 мас.% инертного газа, причем массовые проценты приведены по отношению к общей массе подаваемого газа. Инертный газ типично используется как носитель для химически активного газа. Когда способ данного изобретения проводится посредством плазмы, газ (подаваемый газ) обычно включает инертный газ, такой как аргон, как будет далее подробно рассмотрено здесь.
Способ данного изобретения включает выбор как температурного режима нагретого газа, так и массового соотношения газообразного водорода и загружаемого материала оксида тугоплавкого металла в виде частиц, с которым контактирует нагретый газ. Эти параметры выбирают так, что: нагретый газ содержит атомарный водород, загружаемый материал оксида тугоплавкого металла является, по существу, термодинамически устойчивым; и загружаемый материал оксида тугоплавкого металла восстанавливается с помощью атомарного водорода. Предпочтительно, чтобы загружаемый материал оксида тугоплавкого металла, по существу, полностью восстанавливался атомарным водородом во время контакта с нагретым газом.
Выбор температурного диапазона нагретого газа и массового соотношения газообразного водорода и оксида тугоплавкого металла в виде частиц не является очевидным действием, и не был известен ранее. С целью демонстрации образование первичного металла тантала путем восстановления пентаоксида тантала атомарным водородом будет рассмотрено ниже. Металл тантал имеет точку плавления приблизительно 3000°С. Исходя из этого, температуры нагретого газа, которые ниже и отчасти выше точки плавления тантала, представляют интерес с точки зрения минимизации затрат энергии, в зависимости от того, является ли образование расплавленного металла тантала желательным.
Образование первичного металла тантала путем восстановления пентаоксида тантала молекулярным водородом (то есть, Н2(г)), не является термодинамически благоприятным для температурного интервала от 1000°С до 3600°С. Следующее общее уравнение реакции (I) отображает восстановление пентаоксида тантала молекулярным водородом,
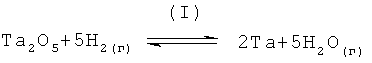
Общее уравнение реакции (I) было термодинамически проанализировано с помощью метода минимизации энергии Гиббса, использующего компьютерную программу, приобретенную коммерческим путем у Outokwnpu Research Oy, Финляндия, под именем HSC Chemistry 5.1.
В целях общей ссылки, если значения стандартной свободной энергии Гиббса (например, AG значения) отрицательны, то считают, что химическая реакция по уравнению (I) благоприятна, и, следовательно, равновесие смещено в правую сторону уравнения, и связанная с ним константа равновесие составляет более чем 1,0. Соответственно, если значения стандартной свободной энергии Гиббса положительны, реакция является менее благоприятной или неблагоприятной (в зависимости от величины положительного значения) и, следовательно, равновесие смещено в левую сторону уравнения, и связанная константа равновесия составляет менее чем 1,0. Нулевое значение стандартной свободной энергии Гиббса соответствует константе равновесия, равной 1,0.
Значения стандартной свободной энергии Гиббса рассчитывают, используя следующее общее уравнение.
ΔG=-(R)×(T)×Ln(K)
В вышеприведенном уравнении символ "R" означает газовую постоянную (универсальную газовую постоянную); "Т" означает температуру в градусах Кельвин; и "К" является константой равновесия.
Более подробно результаты компьютерного анализа методом минимизации энергии Гиббса для уравнения химической реакции (I) при использовании программного обеспечения HSC Chemistry 5.1 представлены в таблице 1.
Результаты, собранные в таблице 1, показывают, что восстановление пентаоксида тантала с помощью молекулярного водорода и образование первичного металла тантала, как представлено общим уравнением реакции (I), не является термодинамически благоприятным для температурного интервала от 1000°С до 3600°С. В частности необходимо отметить, что значения ΔG в таблице 1 являются положительными и большими величинами (свыше 100 ккал) для рассмотренного температурного интервала, то есть равновесие в уравнении химической реакции (I) смещено в левую сторону - сторону реагентов, противоположно правой стороне - стороне их продуктов. По существу, восстановление пентаоксида тантала
невозможно в температурном интервале от 1000°С до 3600°С.
Символы в таблице 1 и последующих таблицах означают: Т означает температуру; Н означает энтальпию; S означает энтропию; G означает стандартную свободную энергию Гиббса; и К означает константу равновесия, относящуюся к уравнению реакции.
Восстановление пентаоксида тантала атомарным водородом представлено следующим уравнением реакции (II),
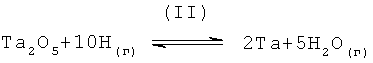
Результаты компьютерного анализа методом минимизации энергии Гиббса для уравнения реакции (II), использующего программное обеспечение HSC Chemistry 5.1, представлены в последующей таблице 2.
Результаты, представленные в таблице 2, показывают, что образование первичного металла тантала путем восстановления пентаоксида тантала атомарным водородом является термодинамически возможным при температурах меньше или равных около 3000°С и более благоприятным при температурах менее или равных 2800°С. Для температурного интервала от 1000°С до 2600°С значения ΔG в таблице 2 являются отрицательными, таким образом, указывая на смещение константы равновесия в уравнении реакции (II) в правую сторону (сторону продуктов) уравнения (то есть, в сторону образования первичного металла тантала). При температурах от 2800°С до 3000°С, несмотря на то, что значения стандартной свободной энергии Гиббса положительны, они являются настолько маленькими величинами, что тантал образуется. В общем, результаты таблицы 2, сами по себе, показывают, что восстановление пентаоксида тантала атомарным водородом является более благоприятным и должно проводиться при температуре менее или равной 2600°С.
Однако образование ионного водорода (который способен восстанавливать пентаоксид тантала) при температурном интервале от 1000°С до 3000°С является термодинамически невозможным. Кроме того, образование атомарного водорода, возможное при температурах выше или равных 2000°С, становится осуществимым только при температурах выше или равных 3000°С, как будет далее подробно рассмотрено.
Образование атомарного водорода представлено следующим общим уравнением реакции (III),
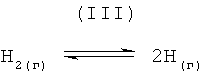
Общая реакция, представленная общим уравнением (III), подверглась компьютерному анализу методом минимизации энергии Гиббса, использующему программное обеспечение HSC Chemistry 5.1, результаты которого представлены в следующей таблице 3.
Из совокупности данных в таблице 3 можно увидеть, что стандартная свободная энергия Гиббса при образовании атомарного водорода является положительной для всего интервала температур от 1000°С до 3400°С, и становится отрицательной при температуре 3600°С. Константа равновесия (К) для общего уравнения (III) представлена следующим уравнением.
К=(РН(г))2/(РH2(г))
Символ "РН(г)" относится к парциальному давлению атомарного водорода, и символ "РН2(г)" относится к парциальному давлению молекулярного водорода. Предполагая объемный процент газообразного водорода равным 100% по объему и парциальное давление газообразного водорода равным 1 атм, можно провести оценку объемного процента атомарного водорода как квадратного корня из константы равновесия при конкретной температуре. Например, при температуре 2000°С процентный объем атомарного водорода составляет около 1%, тогда как объемный процент молекулярного водорода соответственно составляет около 99%. При температуре 2200°С процентный объем атомарного водорода составляет около 2%, тогда как объемный процент молекулярного водорода соответственно составляет около 98%.
При температуре 2400°С процентный объем атомарного водорода составляет около 10%, тогда как объемный процент молекулярного водорода соответственно составляет около 90%. По существу, образование атомарного водорода не является достаточно осуществимым при температуре менее 2000°С. При температуре от 2000°С до 2800°С образование атомарного водорода является осуществимым, но в нежелательно малом количестве. Результаты, собранные в таблице 3, показывают, что температуры, равные или превышающие 3000°С, требуются для благоприятного образования атомарного водорода. При непоказанных в таблице 3 температурах выше 4000°С равновесие в уравнении (III) по большей части смещается вправо (то есть, по существу, весь молекулярный водород превращается в атомарный водород).
Образование ионного водорода представлено следующим общим уравнением реакции (IV),
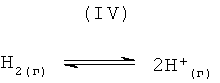
Компьютерный анализ методом минимизации энергии Гиббса для уравнения реакции (IV) был проведен при использовании программного обеспечения HSC Chemistry 5.1, и полученные из него результаты представлены в следующей таблице 4.
Результаты таблицы 4 ясно показывают, что образование ионного водорода при температурном интервале от 1000°C до 3600°С не является благоприятным с точки зрения термодинамики, так как значения стандартной свободной энергии Гиббса являются положительными и достаточно большими для всего этого температурного интервала. Хотя это не показано в таблице 4, но ионный водород не образуется в достаточном количестве при температуре ниже приблизительно 10000°С.
Термодинамический анализ уравнений реакции с (I) по (IV), как представлено в таблицах (1)-(4), дал расходящиеся показания, касательно температур, при которых пентаоксид тантала будет соответствующим образом восстанавливаться атомарным водородом с образованием металла тантала. В частности, термодинамический анализ уравнения реакции (II), как представлено в таблице (2), показывает, что восстановление пентаоксида тантала атомарным водородом является термодинамически возможным при температурах менее или равных 2600°С. Однако термодинамический анализ уравнения реакции (III), как представлено в таблице 3, показывает, что температуры более или равные 3000°С требуются для образования достаточных количеств атомарного водорода. По существу, если взять вместе уравнения (II) и (III) и термодинамические данные таблиц (2) и (3), то оказывается, что восстановление пентаоксида тантала стехиометрическим количеством атомарного водорода (то есть, при массовом отношении газообразного водорода к пентаоксиду тантала 0,02: 1,0) практически неосуществимо при температурах менее 3000°С.
Было обнаружено, что этот барьер, связанный с термодинамически неблагоприятным образованием атомарного водорода при температуре менее 3000°С, можно преодолеть путем тщательного выбора, как (i) температурного интервала, при котором газообразный водород (то есть, молекулярный газообразный водород) нагревается, так и (ii) массового соотношения газообразного водорода к оксиду тугоплавкого металла. С целью демонстрации выбор этих условий будет рассмотрен на примере восстановления пентаоксида тантала (Та2О5) с образованием первичного металла тантала (Та).
При последующем рассмотрении были исследованы температурные интервалы от приблизительно 1900 К до 3600 К или от приблизительно 2100 К до 3600 К. Следующие девять массовых (или весовых) отношений газообразного водорода к пентаоксиду тантала были исследованы для этого температурного интервала: 0,1:1,0; 0,25:1,0; 0,4:1,0; 0,7:1,0; 1:1,0; 1,5:1,0; 2,3:1,0; 4:1,0; и 9:1,0. Перечисленные массовые соотношения были проанализированы с помощью метода минимизации энергии Гиббса, используя компьютерную программу, которая была приобретена коммерческим путем у Б.Г.Трусова, Москва, Россия, под названием TERRA. С помощью анализа, использующего компьютерную программу TERRA, были получены графики равновесных массовых долей различных компонентов и продуктов реакции, связанных с реакционной системой, включающей пентаоксид тантала и газообразный водород в качестве реагентов, как функций от температуры. Кроме того, равновесные массовые доли следующих побочных продуктов также показаны на графиках: диоксида тантала (ТаO2(г)); и монооксида тантала (ТаO(г)), которые образуются в результате термического разложения пентаоксида тантала, как представлено на следующем уравнении реакции (V).
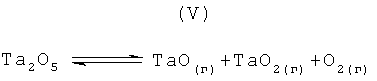
Графики зависимости массовой доли от температуры для восстановления пентаоксида тантала представлены на Фиг.1-9. На графиках Фиг. с 1-9 формулы Та2O5(к) и Та(к) относятся к связанным конденсированным образованиям. На Фиг.1-9 символ "Н" относится к газообразному атомарному водороду. На Фиг.1-9 все вещества без подстрочного индекса (к) являются газообразными веществами. Также на Фиг.1-9 включены таблицы равновесной массовой доли первичного металла тантала для температурного интервала от 2100 К до 3200 К при общем давлении 0,1 МПа.
При массовом (весовом) отношении газообразного водорода к пентаоксиду тантала 0,1:1,0 образование первичного металла тантала относительно низкое (имеющее значение максимальной массовой доли 0,049 при температуре 2900 К). Смотрите график и таблицу на Фиг.1. Кроме того, при температуре 2900 К количество образованного газообразного диоксида тантала (TaO2) является, по существу, нежелательно равнозначным максимальному количеству образованного первичного металла тантала при этой температуре. Как далее будет рассмотрено здесь, образование субоксидов загружаемого оксида тугоплавкого металла (например, газообразных ТаО и ТаО2 в случае пентаоксида тантала) является обычно нежелательным, особенно если субоксиды не восстанавливаются атомарным водородом.
Степень образования первичного металла тантала при массовом соотношении газообразного водорода и пентаоксида тантала 0,25:1,0 выше, чем при массовом соотношении 0,1:1,0 (например, имеется максимум массовой доли 0,097 при температуре 2900 К). Смотрите график и таблицу на Фиг.2. Однако при температуре 2900 К количество образованного газообразного диоксида тантала является, по существу, нежелательно равнозначным максимальному количеству образованного первичного металла тантала при этой температуре.
Массовые отношения газообразного водорода к пентаоксиду тантала 0,4:1,0; 0,7:1,0; 1,0:1,0; 1,5:1,0 приводят к более высокой степени образования первичного металла тантала, чем при массовом отношении 0,1:1,0. Смотрите Фиг.3-6. Однако, подобно наблюдаемой при массовом отношении 0,25:1, степень образования газообразной недокиси (например, газообразного ТаО и/или TaO2) является нежелательно высокой по отношению к степени образования первичного металла тантала при этих массовых отношения. Кроме того, при этих весовых отношениях максимум или пик количества первичного металла тантала образуется при относительно узких температурных интервалах (например, при температурном интервале в 100 К в случае массового соотношения 1,5:1,0, смотрите Фиг.6). Поддержание таких узких температурных интервалов, возможное при лабораторных условиях, может быть менее желательным на промышленном уровне.
Является желательным массовое соотношение газообразного водорода и оксида тугоплавкого металла, которое обеспечивает баланс между достаточной, воспроизводимой, и, по существу, постоянной степенью образования первичного тугоплавкого металла для широкого температурного интервала. Более того, желательно, чтобы образование газообразных субоксидов подаваемого материала тугоплавкого оксида металла (например, газообразных ТаО и ТаО2) было минимальным в этом температурном интервале, особенно если они не восстанавливаются атомарным водородом. Такой баланс реакционных условий особенно желателен при фабричном (или коммерческом) производственном уровне, например, с целью оптимизации модели оборудования и массовых балансов, связанных с ней.
Такой благоприятный баланс реакционных условий (то есть, достаточно высокое образование первичного металла тантала вместе с достаточно широким температурным интервалом и уменьшенной или минимальной степенью образования газообразного субоксида) обеспечивается с помощью массового соотношения газообразного водорода к пентаоксиду тантала, превышающего 1,5:1,0. При осуществлении данного изобретения желательно массовое соотношение, по меньшей, мере 2,3:1,0 и более желательно, по меньшей мере, 4,0:1,0. Смотрите Фиг.7 и 8. При массовом соотношении газообразного водорода и пентаоксида тантала 2,3:1,0 сочетание высокой степени образования пентаоксида тантала и пониженное образование газообразных субоксидов (газообразных ТаО и ТаО2) достигается при температурном интервале от около 2200 К до 2800 К (Фиг.7). Массовое соотношение газообразного водорода и пентаоксида тантала 4,0:1,0 обеспечивает более широкий температурный интервал, при котором образованию первичного металла тантала сопутствует пониженная степень образования газообразного субоксида, например при температурном интервале от около 2100 К до около 2900 К (Фиг.8).
Особенно желательный баланс между достаточной, воспроизводимой и, по существу, постоянной степенью образования первичного металла тантала для широкого температурного интервала обеспечивается массовым отношением газообразного водорода к пентаоксиду тантала, по меньшей мере, 9,0:1,0. См. Фиг.9. При массовом соотношении 9,0:1,0 достаточная и, по существу, постоянная степень образования первичного металла тантала (при значении равновесной массовой доли около 0,08) достигается при температурном интервале от приблизительно 1900 К до 2700 К. Кроме того, образование газообразных субоксидов (газообразных ТаО и ТаО2) при этом температурном интервале (от 1900 К до 2700 К) затем уменьшается и сводится к минимуму.
Восстановление пентаоксида тантала атомарным водородом может быть также оценено с точки зрения выхода тантала. Выход тантала рассчитывают по следующему уравнению.
% выход тантала=(Та(к)/Та(загруженный))×100
Термин "Та(к)" означает количество образованного конденсированного металла тантала, и термин "Та(загруженный)" означает количество тантала, введенного в реакцию, которое рассчитывают по массе пентаоксида тантала (Та2O5), введенного в реакцию. На Фиг.10 изображен процентный выход тантала как функция от температуры, для массовых соотношений газообразного водорода к пентаоксиду тантала: 9,0:1,0; 2,3:1,0 и 1,0:1,0. Ссылаясь на Фиг.10, при массовом соотношении газообразного водорода и пентаоксида тантала 9,0:1,0, по существу, 100 процентный выход тантала достигается при желательно широком температурном интервале от приблизительно 2150 К до 2750 К. Основываясь на увеличении как процентного выхода тантала, так и температурного интервала, при котором достигается такое увеличение выхода, с увеличением массовых отношений газообразного водорода к пентаоксиду тантала (как описывается на Фиг.10), ожидают, что массовые отношения газообразного водорода к пентаоксиду тантала, превышающие 9,0:1,0, будут, вероятно, приводить к, по существу, 100% выходам тантала даже при более широком температурном интервале (например, при температурном интервале от 2000°С до 3000°С).
Температурный интервал нагретого газа (который включает газообразный водород) и массовое отношение газообразного водорода к оксиду тугоплавкого металла каждый также выбираются так, чтобы загружаемый материал оксида тугоплавкого металла являлся, по существу, термодинамически устойчивым. В способе данного изобретения термодинамически устойчивый подаваемый материал оксида тугоплавкого металла сводит к минимуму образование из него субоксидов тугоплавкого металла, которые могут не восстанавливаться при контакте с атомарным водородом. Такая стабилизация таким образом лучше гарантирует, что достигается более полное восстановление подаваемого материала оксида тугоплавкого металла в методе настоящего изобретения.
Например, термическое разложение пентаоксида тантала приводит к образованию газообразных моно- и ди- оксидов, как представлено уравнением химической реакции (V), которое приведено далее.
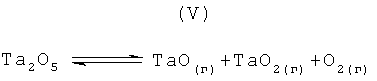
Уравнение равновесия химической реакции (V) представлено следующим уравнением (1),
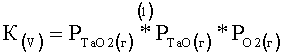
В уравнении (1) K(V) является константой равновесия для химической реакции (V), и каждый символ "Р" означает относительное парциальное давление.
Следующее уравнение химической реакции (VI) также важно для анализа термодинамической устойчивости загружаемого материала пентаоксида тантала.
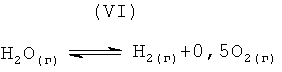
Уравнение равновесия для химической реакции (VI) представлено следующим уравнением (2),
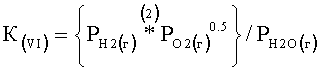
В уравнении 2 K(VI) является константой равновесия для уравнения химической реакции (VI), и каждый символ "Р" относится к относительному парциальному давлению.
Когда пентаоксид тантала нагревают в присутствии газообразного водорода (смотри уравнение (II) выше), парциальное давление кислорода должно удовлетворять как уравнению 1, так и уравнению 2. При данной температуре константы равновесия K(V) и K(VI) в уравнениях (1) и (2) остаются постоянными. Так как отношение {РН2(г)/РН2O(г)} в уравнении (2) уменьшается, парциальное давление кислорода О2(г) в уравнении (2) возрастает и соответственно парциальное давление кислорода O2(г) в уравнении (1) также возрастает. Так как парциальное давление O2(г) в уравнении (1) увеличивается, произведение парциальных давлений ТаO(г) и ТаO2(г) уменьшается. Соответственно, так как произведение парциальных давлений ТаO(г) и ТаO2(г) уменьшается, термодинамическая или термическая устойчивость Ta2O5 возрастает, и в частности улетучивание Ta2O5 сводится к минимуму.
Влияние массового соотношения газообразного водорода и пентаоксида тантала на термодинамическую устойчивость загружаемого материала пентаоксида тантала при определенной температуре может быть показано на Фиг.6 и 9. При массовом соотношении газообразного водорода и пентаоксида тантала 1,5:1,0 и температуре 2700 К, ссылаясь на Фиг.6, массовая доля ТаO2(г) составляет приблизительно 0,06. Однако, при массовом соотношении газообразного водорода и пентаоксида тантала 9,0:1,0 и температуре 2700 К, ссылаясь на Фиг.9, массовая доля ТаO2(г) незначительна (будучи менее чем 0,01). Так как массовое соотношение газообразного водорода и пентаоксида тантала возрастает, массовая доля ТаO2(г) уменьшается, и, соответственно, термодинамическая устойчивость пентаоксида тантала увеличивается.
В способе настоящего изобретения загружаемый материал оксида тугоплавкого металла, который восстанавливают, находится в форме измельченного оксида тугоплавкого металла. Частицы оксида тугоплавкого металла могут иметь формы, выбранные из, но не ограниченные этим, сферических форм, вытянутых сферических форм, неправильных форм (например, имеющие острые грани), пластинчатых или хлопьевидных форм, палочкообразных форм, шарообразных форм и их сочетаний. Средний размер частицы оксида тугоплавкого металла в виде частиц выбирают так, чтобы осуществлялось свободное течение оксида тугоплавкого металла в виде частиц. Оксид тугоплавкого металла в виде частиц обычно имеет средний размер частицы от 20 мкм до 1000 мкм, более характерно от 30 мкм до 800 мкм, и еще более характерно от 50 мкм до 300 мкм.
Полученный по способу данного изобретения первичный тугоплавкий металл может быть в форме, по существу, твердого и сплошного материала (например, в форме цилиндра). Предпочтительно, чтобы полученный по способу данного изобретения первичный тугоплавкий металл находился в форме первичного тугоплавкого металла в виде частиц и, более того, предпочтительно являлся свободнотекучим первичным тугоплавким металлом. Продукт первичного тугоплавкого металла в виде частиц обычно имеет средний размер частицы от 200 нм до 1000 мкм, более характерно от 1 мкм до 800 мкм, и также характерно от 10 мкм до 300 мкм.
В способе данного изобретения, по меньшей мере, некоторое количество оксида тугоплавкого металла в виде частиц восстанавливается с образованием первичного тугоплавкого металла путем контакта с нагретым газом. Предпочтительно, по меньшей мере, 50 мас.% оксида тугоплавкого металла в виде частиц в расчете на массу оксида тугоплавкого металла в виде частиц восстанавливается при контакте с нагретым газом. В особенно предпочтительном варианте осуществления данного изобретения, по меньшей мере, 90 мас.% (например, 98 или 100 мас.%) оксида тугоплавкого металла в виде частиц в расчете на массу оксида тугоплавкого металла в виде частиц восстанавливается при контакте с нагретым газом.
Газ или подаваемый газ (который включает газообразный водород) по способу настоящего изобретения нагревают так, чтобы нагретый газ включал атомарный водород, как обсуждалось здесь ранее. Предпочтительно, чтобы нагретый газ был, по существу, свободным от ионного водорода. Используемый здесь и в формуле изобретения термин "по существу свободный от ионного водорода" означает, что нагретый газ содержит массовую долю ионного водорода (Н+ (г)) менее чем 1×10-10 (как определено вычислениями согласно методу минимизации энергии Гиббса при использовании компьютерной программы TERRA).
Тугоплавкий металл в оксиде тугоплавкого металла может быть выбран из тантала (Та), ниобия (Nb), титана (Ti), циркония (Zr), гафния (Hf) и их комбинаций и сплавов. Предпочтительно выбирать оксид тугоплавкого металла из пентаоксида тантала, пентаоксида ниобия, диоксида ниобия и их комбинаций.
Нагретый газ и оксид тугоплавкого металла в виде частиц могут быть приведены в контакт друг с другом подходящим образом. Например, оксид тугоплавкого металла в виде частиц может быть введен в поток нагретого газа, или нагретый газ может быть пропущен через/над оксидом тугоплавкого металла в виде частиц.
В одном из вариантов осуществления изобретения оксид тугоплавкого металла в виде частиц помещают в контейнер (например, контейнер, сделанный из тугоплавкого металла, такого как тантал, ниобий или молибден) и нагретый газ пропускают через (и над) оксидом тугоплавкого металла в виде частиц внутри контейнера. Например, может быть использован цилиндрический контейнер, имеющий, по существу, открытый конец и конец, на котором сверху размещена тонкая металлическая решетка. Оксид тугоплавкого металла в виде частиц помещают в цилиндрический контейнер, и нагретый газ вводят непрерывно во внутрь контейнера через открытый конец, тогда как газообразные побочные продукты удаляются из контейнера через тонкую металлическую решетку. Образованный внутри контейнера первичный тугоплавкий металл может быть в твердой сплошной форме, или, что предпочтительно, в форме частиц. Продукт первичного тугоплавкого металла может быть затем удален из контейнера и далее переработан (например, размельчен, уплотнен или сформирован в виде проволоки, листа или фольги).
Контакт между оксидом тугоплавкого металла и нагретым газом, содержащим газообразный водород, может быть проведен в присутствии катализатора. Используемый здесь и в формуле изобретения термин "катализатор", по отношению к контакту между оксидом тугоплавкого металла и нагретым газом, означает материал, который увеличивает скорость образования атомарного водорода из газообразного водорода (то есть, молекулярного газообразного водорода). Не желая связываться какой-либо теорией, полагают, что катализатор увеличивает скорость образования атомарного водорода из газообразного водорода путем понижения энергии активации, связанной с таким образованием. Присутствие катализатора желательно для того, чтобы восстановление при температуре, требуемой для образования атомарного водорода и восстановления оксида тугоплавкого металла, могло бы быть также достигнуто (например, при температуре менее или равной 2000°С, 1500°С или 1000°С).
Катализатор - предпочтительно катализатор в виде частиц, содержащий металл, выбранный из, по меньшей мере, металла палладия, платины, иридия, рутения, родия, их комбинаций и их сплавов. Катализаторы в виде частиц предпочтительны благодаря большой площади поверхности, обеспеченной таким образом. Обычно катализатор в виде частиц имеет площадь поверхности от 5 до 25 м2/г катализатора, например 10 м2/г катализатора.
Катализатор, предпочтительно в форме частиц, может быть размещен в слое, через который пропускается нагретый газ, содержащий газообразный водород, таким образом создавая поток газа, содержащего атомарный водород, с которым затем контактирует оксид тугоплавкого металла. В одном из вариантов осуществления изобретения оксид тугоплавкого металла в виде частиц помещают на верхнюю поверхность сетки (например, сетки из тантала), имеющей множество отверстий. Катализатор в виде частиц поддерживают в контакте с нижней поверхностью сетки (например, посредством дополнительной сетки, имеющей множество отверстий, причем катализатор в виде частиц помещают между сеткой и дополнительным экраном). Нагретый газ, содержащий газообразный водород (например, нагретый с помощью электрической печи сопротивления), пропускается через катализатор в виде частиц, таким образом образуя атомарный водород, который пропускается через сетку и контактирует с оксидом тугоплавкого металла, находящимся на верхней поверхности сетки, таким образом восстанавливая оксид тугоплавкого металла и образуя первичный тугоплавкий металл. Такой процесс с помощью сеток обычно проводят как периодический процесс.
Катализаторы могут применяться в непрерывном процессе в соответствии с настоящим изобретением. Сетка (например, танталовая), содержащая множество отверстий, предусмотрена в форме непрерывной ленты. Лента имеет внутреннюю поверхность, которая определяет внутренний объем, в который вводится катализатор в виде частиц и в котором он содержится. Оксид тугоплавкого металла в виде частиц непрерывно подается на внешнюю поверхность верхней ленты, так как лента непрерывно движется (например, на валах). В то же самое время нагретый газ, содержащий газообразный водород, пропускается через нижнюю часть ленты и через катализатор в виде частиц, находящийся внутри внутреннего объема ленты, таким образом образуя атомарный водород. Атомарный водород далее пропускается через верхнюю часть ленты и контактирует с оксидом тугоплавкого металла в виде частиц, находящимся на внешней поверхности верхней ленты, таким образом образуя первичный тугоплавкий металл. Лента при необходимости может быть помещена в печь, в которую вводится газообразный водород.
В одном из вариантов осуществления настоящего изобретения нагретый газ является плазмой. Плазма образуется из подаваемого газа, содержащего инертный газ и химически активный газ. В частности, плазму получают путем ионизации инертного газа (например, ионизированный аргон), который распространяют по всему объему и смешивают с газообразным водородом. Используемый здесь и в патентной формуле термин "плазма" означает нагретый газ, который включает инертный газ, ионы инертного газа и химически активный газ (например, газообразный водород и атомарный водород) и при необходимости небольшое количество ионного водорода (например, массовая доля водорода в виде иона менее чем 1×10-10). Оксид тугоплавкого металла в виде частиц контактирует с плазмой и восстанавливается до образования первичного тугоплавкого металла.
Инертный газ и химически активный газ плазмы, и их относительные содержания, каждый, ранее описывались здесь относительно газа, который нагревают согласно способу настоящего изобретения. Например, инертный газ может быть выбран из, по меньшей мере, одного инертного газа VIII группы (например, неон, аргон, криптон, ксенон и их комбинации).
Химически активный газ плазмы содержит водород и при необходимости дополнительный химически активный газ, который отличается от водорода, такой как алкан (например, метан, этан, пропан, бутан и их комбинации). Относительные содержания водорода и дополнительного химически активного газа могут быть выбраны из тех количеств и интервалов, которые упоминались здесь ранее, относительно газа, который нагревают согласно способу настоящего изобретения.
Предпочтительно, чтобы химически активный газ плазмы содержал 100 мас.% водорода в расчете на общую массу химически активного газа.
Оксид тугоплавкого металла в виде частиц и плазма могут контактировать друг с другом путем пропускания плазмы через или над оксидом тугоплавкого металла в виде частиц. Например, оксид тугоплавкого металла в виде частиц может быть помещен в контейнер (например, цилиндрический контейнер), через который пропускается плазма, как было описано здесь ранее в отношении контактирования оксида тугоплавкого металла в виде частиц с нагретым газом.
Предпочтительно, чтобы оксид тугоплавкого металла в виде частиц и плазма могли контактировать друг с другом путем введения оксида тугоплавкого металла в виде частиц в плазму (иногда называют плазменной струёй или плазменным потоком). Плазменные аппараты, которые могут быть использованы в способе настоящего изобретения, включают те, которые известны специалистам в данной области техники. В одном из вариантов осуществления настоящего изобретения плазменный аппарат включает плазменную пушку, плазменный химический реактор и аппарат накопления продукта. Плазменный химический реактор (например, в форме вытянутого цилиндра) имеет первый конец и второй конец. Плазменная пушка крепится к первому концу плазменного химического реактора, а аппарат накопления продукта соединяется со вторым концом плазменного химического реактора. Плазменная пушка и аппарат накопления продукта, каждый, находятся в газообразном сообщении с плазменным химическим реактором. Плазменный аппарат предпочтительно располагать вертикально, с плазменной пушкой на верхнем конце и аппаратом накопления продукта на нижнем конце, что учитывает сочетание газового потока и силы тяжести для перемещения продукта первичного тугоплавкого металла вниз в аппарат накопления. Альтернативно, плазменный аппарат может быть размещен горизонтально.
Подаваемый газ (например, содержащий аргон и газообразный водород в объемном отношении аргона к водороду 3:1) подается в плазменную пушку и образуется плазма, которая распространяется, по меньшей мере, в части плазменного химического реактора. Оксид тугоплавкого металла в виде частиц подается в плазменный химический реактор и контактирует с плазмой внутри него. Оксид тугоплавкого металла в виде частиц может быть подан в реактор посредством инертного газа носителя, такого как аргон. При необходимости, дополнительный химически активный газ (например, водород) может быть отдельно подан в плазменный химический реактор.
Контакт оксида тугоплавкого металла в виде частиц с плазмой в плазменном химическом реакторе, в соответствии со способом настоящего изобретения, приводит к восстановлению оксида тугоплавкого металла в виде частиц с образованием первичного тугоплавкого металла. Предпочтительно, чтобы образованный в плазменном химическом реакторе первичный тугоплавкий металл находился в форме частиц.
Продукт первичного тугоплавкого металла проходит из плазменного химического реактора в аппарат накопления продукта. Аппарат накопления продукта может быть выбран из тех, которые известны специалисту в данной области техники. Например, аппарат накопления продукта может быть в форме вытянутого цилиндра, имеющего концевую коническую накопительную часть. Аппарат накопления продукта может включать отверстия для введения и прохода дополнительных газов (например, газов-носителей, таких как аргон) во внутрь и через него, для облегчения накопления продукта первичного тугоплавкого металла. Кроме того, если первичный тугоплавкий металл расплавляется в течение его образования в плазменном химическом реакторе, то введение дополнительных инертных газовых носителей в аппарат накопления продукта может также служить для затвердевания первичного тугоплавкого металла в форме частиц.
Аппарата накопления продукта может, при необходимости, включать аналитическое оборудование, такое как масс-спектрометр, для контроля (например, непрерывно) состава проходящих через него газов. В одном из вариантов осуществления данного изобретения результаты анализа газов в реальном масштабе времени, проходящих через аппарат накопления продукта, используются для непрерывной регулировки, например, состава и скоростей подачи подаваемого газа и оксида тугоплавкого металла в виде частиц, которые подаются в плазменный химический реактор. Продукт первичного тугоплавкого металла может затем быть удален из аппарата накопления продукта.
Способ по настоящему изобретению может быть проведен как периодический процесс или непрерывно. Прохождение нагретого газа или плазмы через контейнер, заполненный, по меньшей мере, частично оксидом тугоплавкого металла в виде частиц, типично осуществляется как периодический процесс. Введение оксида тугоплавкого металла в виде частиц в поток нагретого газа или плазмы (например, используя плазменный аппарат, как было ранее описано здесь) обычно проводят как непрерывный процесс.
Способ по настоящему изобретению может быть проведен в условиях пониженного давления, атмосферного давления или повышенной температуры. Например, пониженное давление может быть предусмотрено, по меньшей мере, в части аппарата накопления продукта или плазменного аппарата. Как правило, способ по настоящему изобретению проводят в условиях, по существу, атмосферного давления. В частности, контакт между нагретым газом (или плазмой) и оксидом тугоплавкого металла в виде частиц предпочтительно проводят в условиях атмосферного давления (например, атмосферного давления окружающей среды).
Проведение способа настоящего изобретения в условиях, по меньшей мере, атмосферного давления также служит для стабилизации оксида тугоплавкого металла в виде частиц (например, пентаоксида тантала). Ссылаясь на уравнение химической реакции (V) и уравнение (1), приведенные ранее, на основании принципа Ле Шателье, равновесие в реакции (V) смещается влево (в сторону пентаоксида тантала) при повышении общего давления.
В варианте осуществления данного изобретения способ включает получение первичного металла тантала из пентаоксида тантала в виде частиц. Образование первичного металла тантала уже обсуждалось здесь ранее со ссылкой на Фиг.1-9. Газ, который контактирует с пентаоксидом тантала в виде частиц, нагревают до температуры от 1900 К до 2900 К.
Газообразный водород нагретого газа и оксид тугоплавкого металла в виде частиц, с которым контактирует нагретый газ, имеют массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц более чем 1,5:1. Предпочтительно, чтобы массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц было больше или равно 4,0:1. При особенно предпочтительном варианте осуществления настоящего изобретения массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц больше или равно 9,0:1. Верхний предел массового соотношения газообразного водорода и пентаоксида тантала в виде частиц обычно меньше или равен 15:1, более характерно менее или равен 11:1, и еще более характерно менее или равен 10:1. Массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц может располагаться между любой комбинацией этих верхних и нижних значений, включающих описанные значения (если иного не установлено). Например, массовое соотношение газообразного водорода и пентаоксида тантала виде частиц может находиться в пределах от значения больше чем 1,5:1 до 15:1, предпочтительно от 2,3:1 до 10:1 и более предпочтительно от 4,0:1 до 10:1, и еще более предпочтительно от 9:1 до 15:1, или от 9:1 до 11:1, или от 9:1 до 10:1.
Если массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц больше или равно 9:1, то пентаоксид тантала в виде частиц предпочтительно контактирует с нагретым газом при температуре от 1900 К до 2700 К.
Первичный металл тантал может быть получен посредством контактирования пентаоксида тантала в виде частиц с плазмой, в соответствии со способом, описанным здесь ранее.
Пентаоксид тантала в виде частиц может быть выбран из доступных в продаже марок. Для улучшения чистоты продукта первичного металла тантала предпочтительно использовать пентаоксид тантала в виде частиц, по существу, чистый. В одном из вариантов осуществления настоящего изобретения пентаоксид тантала в виде частиц является, по существу, чистым. По существу, чистый пентаоксид тантала обычно содержит углерод, ниобий, кремний, вольфрам, алюминий и железо в общем количестве менее чем 50 чнм (частей на миллион). В особенно предпочтительном варианте осуществления настоящего изобретения, по существу, чистый пентаоксид тантала в виде частиц имеет содержание углерода менее чем 10 чнм.
В одном из вариантов осуществления настоящего изобретения первичный металл ниобий получают из пентаоксида ниобия (Nb2O5) и/или диоксида ниобия (NbO2). Массовые соотношения газообразного водорода и пентаоксида ниобия были исследованы при температуре от 2000 К до 3800 К посредством метода минимизации энергии Гиббса, используя компьютерную программу, доступную для приобретения у Б.Г. Трусова, Москва, Россия, под именем TERRA. Были исследованы следующие массовые отношения газообразного водорода к пентаоксиду ниобия: 2,3:1,0, 4,0:1,0 и 9,0:1,0. Смотрите Фиг.11, 12 и 13.
Фиг.11-13 также включают таблицы массовой доли полученного первичного металла ниобия как функции от температуры, на основании которых построена часть каждого графика. На Фиг.11-13 заключенный в скобки символ "(к)" обозначает конденсированные вещества (например, Nb(n) означает конденсированный ниобий).
Кроме того, на Фиг.11-13 все вещества, не имеющие нижнего индекса (к), являются газообразными.
В соответствии со способом настоящего изобретения предпочтительно восстанавливать, по существу, весь пентаоксид ниобия и/или диоксид ниобия с образованием первичного металла ниобия. Однако образование побочного продукта монооксида ниобия может также быть желательно, так как комбинации первичного металла ниобия и монооксида ниобия пригодны в промышленности.
При массовом соотношении газообразного водорода и пентаоксида ниобия 2,3:1,0 образование первичного металла ниобия достигает максимума при относительно узком температурном интервале (между 2600 К и 2700 К). Кроме того, монооксид ниобия образуется одновременно с первичным металлом ниобием. Смотрите Фиг.11.
При массовом соотношении газообразного водорода и пентаоксида ниобия 4,0:1,0 образование первичного металла ниобия достигает максимума при температуре
2300 К, после которой монотонно падает. Монооксид ниобия одновременно образуется как при низких, так и при высоких температурных интервалах, при которых образуется первичный металл ниобий в этих условиях. При массовом соотношении газообразного водорода и пентаоксида ниобия 4,0:1,0 образование первичного металла ниобия предпочтительно осуществлять при температурном интервале от
2300 К до 2600 К. Смотрите Фиг. 12.
Особенно желательный баланс достаточной, воспроизводимой и, по существу, постоянной степени образования первичного металла ниобия при широком температурном интервале достигается при массовом отношении газообразного водорода к пентаоксиду ниобия, по меньшей мере, 9,0:1,0. Смотрите Фиг.13. При массовом соотношении 9,0:1,0 достаточная и, по существу, постоянная степень образования первичного металла ниобия (имеющего значение равновесной массовой доли от около 0,06 до 0,07) достигается при температурном интервале от приблизительно 2100 К до 2700 К. Кроме того, образование субоксидов (NbO в частности) при этом температурном интервале (от 2100 К до 2700 К), по существу, уменьшается и сводится к минимуму.
В одном из вариантов осуществления настоящего изобретения газообразный водород нагретого газа и пентаоксид ниобия в виде частиц, с которым контактирует нагретый газ (с образованием первичного металла ниобия), имеют массовое соотношение газообразного водорода и пентаоксида ниобия в виде частиц более чем 2,3:1. Предпочтительно, чтобы массовое отношение газообразного водорода и пентаоксида ниобия в виде частиц было больше или равно 4,0:1. Более предпочтительно, чтобы массовое соотношение газообразного водорода и пентаоксида ниобия в виде частиц было больше или равно 9,0:1. Верхний предел массового соотношения газообразного водорода и пентаоксида ниобия в виде частиц обычно меньше или равен 15:1, более характерно меньше или равен 11:1, и еще более характерно меньше или равен 10:1. Массовое соотношение газообразного водорода и пентаоксида ниобия в виде частиц может располагаться между любой комбинацией этих верхних и нижних значений, включающих описанные значения (если иного не установлено). Например, массовое соотношение газообразного водорода и пентаоксида ниобия в виде частиц может находиться в пределах от значения более чем 2,3:1 до 15:1, предпочтительно от 4,0:1 до 11:1, и более предпочтительно от 9,0:1 до 15:1, или от 9,0:1 до 11:1, или от 9,0:1 до 10:1.
Образование первичного металла ниобия из диоксида ниобия (NbO2) было исследовано при температурах от 1900 К до 4000 К, посредством метода минимизации энергии Гиббса, используя компьютерную программу, доступную для приобретения у Б.Г.Трусов, Москва, Россия под названием TERRA. Исследовалось массовое отношение газообразного водорода к диоксиду ниобия 9,0:1,0. См. Фиг.14. Фиг.14 также включает таблицу массовой доли полученного первичного металла ниобия как функции от температуры, на основе которой строится часть графика. Как на Фиг.1-13, на Фиг.14 заключенный в скобки символ "(к)" обозначает конденсированные вещества (например, Nb(к) означает конденсированный ниобий), и вещества, которые не имеют нижний индекс (к), являются газообразными.
При массовом отношении газообразного водорода к диоксиду ниобия 9,0:1,0 образование первичного металла ниобия достигает максимума при температуре 2100 К, после которой оно сначала медленно, а затем быстро падает. Смотрите Фиг.14.
Особенно желательный баланс достаточной, воспроизводимой и, по существу, постоянной степени образования первичного металла ниобия при широком температурном интервале достигается при массовом соотношении газообразного водорода и диоксида ниобия, по меньшей мере, 9,0:1,0. Смотрите Фиг.14. При отношении масс 9,0:1,0 достаточная и, по существу, постоянная степень образования первичного металла тантала (имеющего значение равновесной массовой доли около 0,07) достигается при температурном интервале от 2100 К до 2500 К. Кроме того, образование субоксидов (NbO в частности) при этом температурном интервале (от 2100 К до 2500 К), по существу, уменьшается и сводится к минимуму.
В способе настоящего изобретения верхний предел массового соотношения газообразного водорода и диоксида ниобия в виде частиц обычно меньше или равен 15:1, более характерно меньше или равен 11:1, и еще более характерно меньше или равен 10:1. Массовое соотношение газообразного водорода и диоксида ниобия в виде частиц может находиться между любой комбинацией этих верхних значений и отношением 9:1, включающих в себя описанные значения. Например, массовое соотношение газообразного водорода и диоксида ниобия в виде частиц может находиться в пределах от значения, по меньшей мере, 9,0:1 до 15:1, предпочтительно от 9,0:1 до 11:1 и более предпочтительно от 9,0:1 до 10:1.
Пентаоксид ниобия и диоксид ниобия в виде частиц, каждый, могут быть выбраны независимо из имеющихся в продаже марок. Чтобы улучшить чистоту продукта первичного металла ниобия, предпочтительно использовать пентаоксид ниобия и/или диоксид ниобия виде частиц, которые являются, по существу, чистыми. В одном из вариантов осуществления настоящего изобретения оксид ниобия в виде частиц (то есть пентаоксид ниобия и/или диоксид ниобия) является, по существу, чистым. По существу, чистый пентаоксид ниобия и/или диоксид ниобия в виде частиц обычно содержат углерод, тантал, железо, кремний, вольфрам и алюминий в общем количестве менее чем 50 чнм. В особенно предпочтительном варианте осуществления данного изобретения, по существу, чистый оксид ниобия виде частиц имеет содержание углерода менее чем 10 чнм.
Первичный металл ниобий может быть получен в соответствии с данным изобретением, используя те способы, которые ранее обсуждались здесь относительно первичных тугоплавких металлов в общем и металла тантала в частности. Например, нагретый газ и пентаоксид ниобия и/или диоксид ниобия могут контактировать друг с другом при прохождении нагретого газа (необязательно в форме плазмы) через или над пентаоксидом ниобия виде частиц, в том время как он находится внутри контейнера (например, цилиндрического контейнера). Альтернативно, пентаоксид ниобия и/или диоксид ниобия в виде частиц могут быть введены в плазму, содержащую газообразный водород, таким образом образуя первичный металл тантал, как было ранее описано здесь.
Промышленные изделия, которые могут содержать первичные тугоплавкие металлы (например, тантал и/или ниобий), полученные в соответствии со способом настоящего изобретения, включают, но не ограничиваются, электронные конденсаторы, твердые электролиты, применяющиеся в компьютерах, твердые электролиты, применяющиеся в телекоммуникациях, электрооптические устройства и сверхпроводящие изделия. В частности, так называемые конденсаторы маленького размера (имеющие сочетание большой емкости на единицу объема и стабильных эксплутационных характеристик) могут быть изготовлены из первичных тугоплавких металлов, полученных по способу настоящего изобретения. Предпочтительно, чтобы первичные тугоплавкие металлы, полученные по способу настоящего изобретения, являлись первичными тугоплавкими металлами в виде частиц, и указанные промышленные изделия (например, электронные конденсаторы) изготавливались из первичных тугоплавких металлов в виде частиц.
Настоящее изобретение было описано по отношению к конкретным деталям частного варианта осуществления. Не подразумевается, что такие детали могут рассматриваться как ограничения объема прав на изобретение, за исключением того, насколько и до какой степени они включены в пункты приложенной формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОЛУЧЕНИЯ ТАНТАЛОВЫХ СПЛАВОВ И НИОБИЕВЫХ СПЛАВОВ | 2017 |
|
RU2697122C1 |
| УДАЛЕНИЕ МАГНИЯ ИЗ ПОРОШКОВ МЕТАЛЛОВ, ВОССТАНОВЛЕННЫХ МАГНИЕМ | 2005 |
|
RU2406593C2 |
| СПОСОБ НАНЕСЕНИЯ ПОКРЫТИЯ НА ПОВЕРХНОСТЬ СУБСТРАТА И ПРОДУКТ С ПОКРЫТИЕМ | 2007 |
|
RU2469126C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВЕЩЕСТВА, ВЫБРАННОГО ИЗ РЯДА ТУГОПЛАВКИХ МЕТАЛЛОВ ИЛИ РЯДА НЕМЕТАЛЛОВ: КРЕМНИЙ, БОР, ФОСФОР, МЫШЬЯК, СЕРА | 2005 |
|
RU2298588C2 |
| МЕТАЛЛОТЕРМИЧЕСКОЕ ВОССТАНОВЛЕНИЕ ОКИСЛОВ ТУГОПЛАВКИХ МЕТАЛЛОВ | 2001 |
|
RU2302928C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОДИСПЕРСНЫХ ПОРОШКОВ В ПЛАЗМЕ СВЧ-РАЗРЯДА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2010 |
|
RU2455061C2 |
| Способ изготовления структурно-градиентных порошковых материалов (варианты) | 2018 |
|
RU2693989C1 |
| Способ разделения анализируемого вещества | 1983 |
|
SU1124206A1 |
| МЕТАЛЛИЧЕСКИЕ ПОРОШКИ, ПОЛУЧЕННЫЕ ВОССТАНОВЛЕНИЕМ ОКСИДОВ ГАЗООБРАЗНЫМ МАГНИЕМ | 1999 |
|
RU2230629C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЧИСТОГО НИОБИЯ | 2012 |
|
RU2490347C1 |
Группа изобретений относится к способам получения первичного тугоплавкого металла. Способ включает нагрев химически активного газа, содержащего газообразный водород. Затем проводят контактирование оксида тугоплавкого металла с указанным нагретым газом в виде частиц пентаоксида тантала для восстановления пентаоксида тантала в виде частиц. При этом массовое соотношение газообразного атомарного водорода и пентаоксида тантала в виде частиц составляет более чем 1,5:1 при температуре от 1900 К до 2900 К с образованием первичного металла тантала. Другой вариант осуществления способа включает нагрев химически активного газа, содержащего газообразный водород. Затем проводят контактирование оксида тугоплавкого металла с указанным нагретым газом в виде частиц оксида ниобия, выбранного из группы, состоящей из диоксида ниобия, пентаоксида ниобия и их комбинации, с указанным нагретым газом для восстановления указанного оксида ниобия в виде частиц. При этом массовое соотношение газообразного водорода и оксида ниобия в виде частиц составляет по меньшей мере 9:1, при температуре от 2100 К до 2700 К с образованием первичного металла ниобия. Технический результат заключается в повышении эффективности получения первичного металла тантала или ниобия за счет проведения процесса в одну стадию. 2 н. 22 з.п. ф-лы, 14 ил., 4 табл.
1. Способ получения первичного тугоплавкого металла, включающий нагрев химически активного газа, содержащего газообразный водород, и контактирование оксида тугоплавкого металла в виде частиц пентаоксида тантала с указанным нагретым газом для восстановления пентаоксида тантала в виде частиц при массовом соотношении газообразного атомарного водорода и пентаоксида тантала в виде частиц, равном более чем 1,5:1, при температуре от 1900 до 2900К с образованием первичного металла тантала.
2. Способ по п.1, в котором массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц составляет по меньшей мере 2,3:1.
3. Способ по п.1, в котором массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц составляет по меньшей мере 4:1.
4. Способ по п.1, в котором массовое соотношение газообразного водорода и пентаоксида тантала в виде частиц составляет по меньшей мере 9:1 и пентаоксид тантала в виде частиц контактирует с нагретым газом при температуре от 1900 К до 2700 К.
5. Способ по п.1, в котором по меньшей мере 98 мас.% пентаоксида тантала в виде частиц восстанавливают с образованием первичного металла тантала.
6. Способ по п.1, в котором образованный первичный металл тантала получают в виде частиц.
7. Способ по п.1, в котором нагретый газ является плазмой, которая образуется из подаваемого газа, содержащего инертный газ и указанный химически активный газ, а пентаоксид тантала в виде частиц контактируют с указанной плазмой.
8. Способ по п.7, в котором инертный газ выбирают из группы, состоящей из инертных газов VIII группы периодической таблицы элементов Д.И.Менделеева и их комбинаций.
9. Способ по п.7, в котором пентаоксид тантала в виде частиц контактируют с указанной плазмой путем введения пентаоксида тантала в виде частиц в плазму.
10. Способ по п.1, в котором химически активный газ содержит в основном 100 мас.% газообразного водорода.
11. Способ по п.1, в котором указанный пентаоксид тантала является в основном чистым пентаоксидом тантала.
12. Способ по п.11, в котором пентаоксид тантала содержит менее чем 10 частей на миллион углерода.
13. Способ по п.1, в котором нагрев газа и контактирование пентаоксида тантала в виде частиц с нагретым газом проводят в основном при атмосферном давлении.
14. Способ получения первичного тугоплавкого металла, включающий нагрев химически активного газа, содержащего газообразный водород, контактирование оксида тугоплавкого металла в виде частиц оксида ниобия, выбранного из группы, состоящей из диоксида ниобия, пентаоксида ниобия и их комбинации, с указанным нагретым газом для восстановления указанного оксида ниобия в виде частиц при массовом соотношении газообразного водорода и оксида ниобия в виде частиц, равном по меньшей мере 9:1, при температуре от 2100 К до 2700 К с образованием первичного металла ниобия.
15. Способ по п.14, в котором по меньшей мере 90 мас.% оксида ниобия в виде частиц восстанавливают с образованием первичного металла ниобия.
16. Способ по п.14, в котором образованный первичный металл ниобий получают в виде частиц.
17. Способ по п.14, в котором нагретый газ является плазмой, которая образуется из подаваемого газа, содержащего инертный газ и химически активный газ, а оксид ниобия в виде частиц контактируют с указанной плазмой.
18. Способ по п.17, в котором инертный газ выбирают из группы, состоящей из инертных газов VIII группы периодической таблицы элементов Д.И.Менделеева и их комбинаций.
19. Способ по п.17, в котором оксид ниобия в виде частиц контактируют с указанной плазмой путем введения оксида ниобия в виде частиц в указанную плазму.
20. Способ по п.14, в котором химически активный газ содержит в основном 100 мас.% газообразного водорода.
21. Способ по п.14, в котором нагрев газа и контактирование оксида ниобия в виде частиц с нагретым газом проводят в основном при атмосферном давлении.
22. Способ по п.14, в котором оксид ниобия является в основном чистым пентаоксидом ниобия.
23. Способ по п.22, в котором пентаоксид ниобия имеет содержание углерода менее чем 10 частей на миллион.
24. Способ по п.14, в котором оксид ниобия в виде частиц является диоксидом ниобия в виде частиц, который контактирует с указанным нагретым газом при массовом соотношении газообразного водорода и диоксида ниобия в виде частиц, равном по меньшей мере 9:1, при температуре от 2100 К до 2500 К.
| СУРИС А.Л | |||
| Плазмохимические процессы и аппараты | |||
| - М.: Химия, 1989, с.268-274 | |||
| СПОСОБ ПОЛУЧЕНИЯ РЕДКИХ ТУГОПЛАВКИХ МЕТАЛЛОВ, КРЕМНИЯ И ИХ СОЕДИНЕНИЙ | 1999 |
|
RU2153016C1 |
| УСТАНОВКА ДЛЯ ПЛАЗМОХИМИЧЕСКОГО ВОССТАНОВЛЕНИЯ ОКСИДОВ МЕТАЛЛОВ | 2003 |
|
RU2238824C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКОВ ТУГОПЛАВКИХ МЕТАЛЛОВ | 2003 |
|
RU2243859C2 |
| US 5972065 A, 26.10.1999 | |||
| US 5711783 A, 27.01.1998 | |||
| HIEBLER H., PLAUL J.F | |||
| Hydrogen plasma smelting reduction-an option for steelmaking in the future | |||
| Metalurgija, vol.43, no.3, 2004, p.155-162. | |||
Авторы
Даты
2011-04-10—Публикация
2006-03-15—Подача