Область изобретения
Изобретение относится к новому способу, новым стадиям способа и новым промежуточным соединениям, применяемым в синтезе фармацевтически активных соединений, в частности ингибиторов ренина.
Предпосылки изобретения
Ренин поступает из почек в кровь, где он вызывает расщепление ангиотензиногена, в результате чего образуется декапептид ангиотензин I, который превращается затем в легких, почках и других органах в октапептид ангиотензин II. Октапептид повышает кровяное давление как непосредственно путем сужающего действия на сосуды, так и косвенно путем высвобождения из надпочечников содержащего ионы натрия гормона альдостерона, сопровождающегося увеличением объема внеклеточной жидкости, которое может быть связано с действием ангиотензина II. Ингибиторы ферментной активности ренина вызывают уменьшение образования ангиотензина I и, следовательно, продуцирование меньшего количества ангиотензина II. Уменьшение концентрации этого активного пептидного гормона является непосредственной причиной гипотензивного действия ингибиторов ренина.
С соединениями, такими как (по МНН) алискирен ((2S,4S,5S,7S)-5-амино-N-(2-карбамоил-2-метилпропил)-4-гидрокси-2-изопропил-7-[4-метокси-3-(3-метоксипропил)бензил]-8-метилнонамид), связана разработка антигипертензивных средств, которые взаимодействуют с ренин-ангиотензивной системой в начальной стадии биосинтеза ангиотензина II.
Поскольку соединение включает 4 хиральных атома углерода, совершенно необходимо решить проблему синтеза энантиомерно чистого соединения. Кроме того, приветствуются современные усовершенствованные пути для более удобного синтеза молекул такого типа.
Для решения этой проблемы настоящее изобретение предлагает новые синтетические пути и новые промежуточные соединения, дающие доступный и эффективный подход к этому классу соединений.
Краткое изложение сущности изобретения
В ходе исследования редуцированного деоксигенирования диастереомерной смеси вторичных бензиловых спиртов формулы I, приведенной ниже, была сделана попытка заменить эту группу на отличную от гидроксильной группы, в частности на отщепляемую группу, такую как галогруппа, например на хлор или йод, или сульфонатную группу органических сульфоновых кислот, например метансульфонатную (мезилат) или толуолсульфонатную (тозилат), чтобы облегчить восстановительный процесс. Однако ожидаемые соединения не были получены. Вместо ожидаемых соединений формулы II
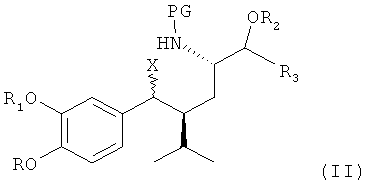
(которые затем согласно первоначальным планам могли были быть восстановлены в соответствующее соединение, где Х обозначает водород), где R, R1, R2, R3 и PG определены, как для соединения I, ниже, и Х обозначает иную, чем гидроксильная, группу, в частности отщепляемую группу, такую как галогруппа, например хлор или йод, или сульфонатная группа органических сульфоновых кислот, например метансульфонатная (мезилат) или толуолсульфонатная (тозилат), пирролидины формулы III, приведенные ниже, получены с высоким выходом в виде энантиомеров со стереохимией, указанной ниже. Эти неожиданные находки были затем использованы в общем новом пути синтеза алискирена и родственных соединений.
Детальное описание изобретения
В первом и очень существенном аспекте изобретение относится к способу получения соединения формулы III
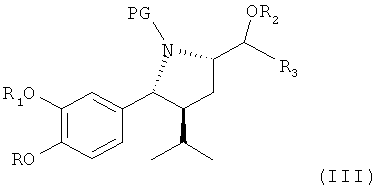
где
R обозначает водород, алкил или алкоксиалкил;
R1 обозначает водород, алкил или алкоксиалкил;
R2 обозначает водород или предпочтительно защитную группу для гидроксила;
R3 обозначает водород или незамещенный или замещенный алкил; и
PG обозначает защитную группу для аминогруппы, в частности удаляемую при гидролизе, например алкоксикарбонильную группу, такую как трет-бутоксикарбонильная группа или бензилоксикарбонильная группа;
или его соли;
заключающемуся в том, что соединение формулы I,
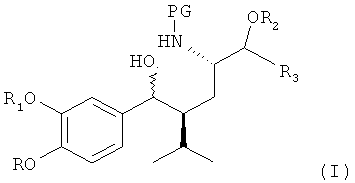
где R, R1, R2, R3 и PG определены, как для соединения формулы III, вводят в реакцию с реагентом, способным превратить (здесь, в частности, бензильную) гидроксигруппу (в частности, группу, связь которой обозначена волнистой линией на схеме в формуле I) в группу Х (которая предположительно присутствует в переходном соединении формулы II, как отмечено выше, в реакционной смеси перед циклизацией), где Х обозначает группу, отличную от гидроксигруппы или водорода, в частности уходящую группу.
Такие соединения формулы (I) используются в качестве исходных соединений. Так, доступен синтез с применением в качестве исходного соединения (S)-пироглутаминовой кислоты. В публикации WO 2006/024501 приведено получение кетоноаминопроизводных таких соединений, которые могут быть превращены в соответствующие аминоспирты посредством гидрирования или восстановления.
Реагентом, способным превратить гидроксигруппу в группу X, предпочтительно, является обычный реагент для замещения гидроксильной группы в бензиловом спирте на другую группу, в частности уходящую группу X, например реагент, где Х обозначает галогруппу, выбранный из группы, включающей (например, водные) галоидводородные кислоты, такие как хлористоводородная кислота, тионилгалогениды, такие как тионилхлорид, РХ*3, РОХ*3, РХ*5 или РОХ*5, где X* обозначает галоген (в частности, хлор или бром), комбинацию трифенилфосфин/галоген, такую как трифенилфосфин/йод, где Х обозначает фрагмент с органической сульфонилоксигруппой в качестве активного производного (образованной в условиях, сравнимых, как показано ниже, с активацией производного карбоновой кислоты формулы XVI, в процессе реакции, в частности в условиях получения ангидрида, например смешанного ангидрида с карбоновой кислотой, такой уксусная кислота, или симметричного ангидрида) или галоидангидрида органической сульфокислоты, такого как метансульфонилхлорид, трифторметансульфонилхлорид или тозилхлорид, в присутствии основания, например третичного азотистого основания, такого как триэтиламин или ему подобного. В случае тионилгалогенида, РХ*3, РОХ*3, РХ*5 или POX*5 реакцию проводят в растворителе типа толуола в присутствии третичного азотистого основания, такого как пиридин, например, при температуре в интервале от 0 до 50°С. В присутствии ангидрида или галоидангидрида органической сульфокислоты реакцию предпочтительно проводят в соответствующем растворителе типа толуола и/или диметиламинопиридина, и основания, например триэтиламина, в температурном интервале от 30 до 50°С. В присутствии трифенилфосфин/галогена реакцию предпочтительно проводят в соответствующем растворителе типа толуола и/или ацетонитрила, в присутствии азотистого основания (предпочтительно циклического незамещенного), такого как имидазол, при температуре в интервале от 0 до 50°С.
Альтернативно соединение (III) может быть получено из соединения (I) с использованием ионообменной смолы, предпочтительно кислой ионообменной смолы, такой как янтарная ионообменная смола, предпочтительно Amberlyst 15 (фирма Fluka) при удалении воды. Реакцию предпочтительно проводят в соответствующем растворителе типа толуола и/или ацетонитрила, при температурах в интервале от 30 до 50°С, например при комнатной температуре.
Другой важный вариант осуществления изобретения связан с соединением формулы III по определению выше или его солью.
Соединение формулы III может быть использовано, среди прочего, для синтеза фармацевтически активных субстанций, предпочтительно ингибиторов ренина, таких как алискирен, в частности, как описано далее.
В следующем предпочтительном варианте оуществления изобретения этот синтез включает в качестве следующей стадии или индивидуального синтеза (частичное) снятие защиты с соединения формулы III (которое в свободной форме или в виде соли также является предпочтительным вариантом по изобретению), где R2 обозначает защитную группу для гидроксигруппы, в частности группу, удаляемую в других условиях, чем требуется для удаления PG, более предпочтительно путем гидролиза, например трет-С4-С7-алкоксикарбонильную группу, такую как трет-бутоксикарбонильная группа, при этом R, R1, R3 и PG определены, как для соединения формулы I выше, в условиях удаления защитной группы R2 у соединения формулы IV,
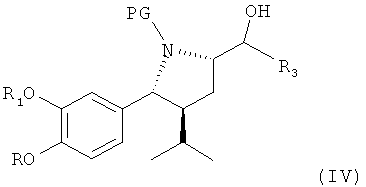
где R, R1, R3 и PG определены, как для формулы III выше, или его соли. Соединение формулы IV или его соль также являются предпочтительным вариантом по изобретению.
В случае защитной группы R2, удаляемой посредством гидролиза, например трет-С4-7-алкоксикарбонильной группы, такой как трет-бутоксикарбонильная группа, удаление предпочтительно проводят в присутствии кислоты или, более предпочтительно, в присутствии основания, такого как гидроксид металла, или предпочтительно гидроксида металла, более предпочтительно карбоната щелочноземельного металла, такого как карбонат калия, в присутствии растворителя, такого как спирт, например метанола или этанола, воды или их смеси, при температуре в интервале от 0°С до температуры кипения смеси, например от 30 до 60°С.
В качестве альтернативы реакционным стадиям, описанным выше, соединение (I) - также сырое (I) - может быть превращено посредством одностадийного синтеза в соединение (IV) в виде свободного основания (IVa), которое может быть очищено путем экстракции без выделения промежуточного соединения (III). Соединение (IVa) затем может быть кристаллизовано в виде соли, такой как малеат или оксалат. При этом предпочтительно провести его дальнейшую очистку. Соединение (IVa) легко превращается в соединение (IV). Введение защитной группы при азоте осуществляется просто, селективно и чисто.
В этой последовательности защитные группы R2 и PG предпочтительно удаляются путем гидролиза и более предпочтительно представляют собой, например, трет-С4-С7-алкоксикарбонильную группу, такую как трет-бутоксикарбонильная группа. Удаление предпочтительно проводят в присутствии основания или более предпочтительно в присутствии кислоты в условиях, известных из уровня техники, например, с использованием неорганической кислоты, предпочтительно в виде ее водного или спиртового раствора, такой как хлористоводородная кислота, трифторуксусная кислота, серная кислота, фосфорная кислота, метансульфоновая кислота и им подобные, в соответствующем растворителе, таком как спирт, например метанол или этанол, сложные эфиры, подобные этилацетату или изопропилацетату, или простые эфиры типа тетрагидрофурана или трибутилметилового эфира, вода или их смеси, при температуре в интервале от 0°С до температуры кипения реакционной смеси, например, от 50 до 100°С.
Если требуется кристаллизация соединения (IVa), она проводится с использованием обычных методов кристаллизации с применением нужной кислоты, такой как малеиновая кислота или щавелевая кислота, предпочтительно малеиновой кислоты.
Защита пирролидиновой аминогруппы осуществляется методами, известными из уровня техники, которые описаны, например, в примерах, приведенных далее, или в работах, процитированных в учебниках.
Предпочтительно к атому азота присоединяют Бок-группу, например ди-трет-дибутилкарбонат в стандартных условиях.
Соединение формулы IV может быть далее использовано во многих методах синтеза ингибиторов ренина, таких как алискирен.
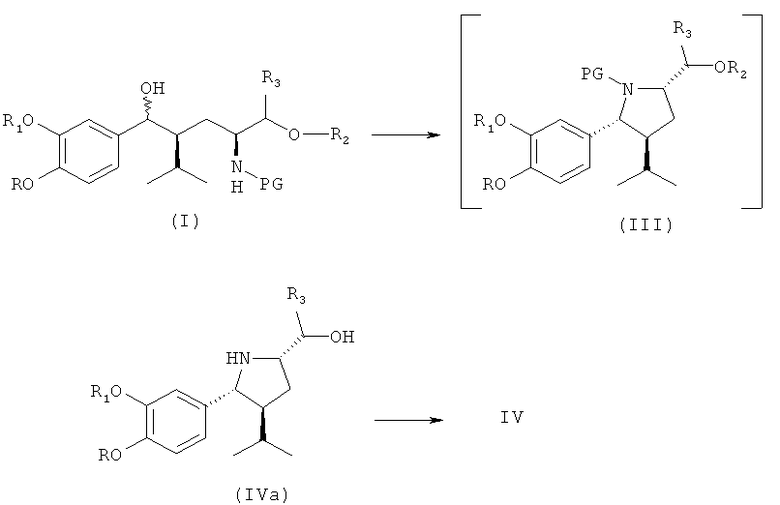
В первом варианте осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, включает окисление соединения формулы IV, в частности, синтезированного на предыдущих стадиях, до оксосоединения формулы V,
где R, R1, R3 и PG определены, как для формулы III выше, или его соли. Эта стадия способа сама по себе, а также соединение формулы V или его соль также являются вариантами по изобретению.
Реакция протекает в обычных условиях, которые применяются при окислении гидроксигруппы в оксигруппу с использованием стандартных окислительных реагентов (окислителей).
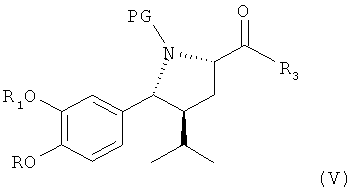
В (предпочтительном) случае, где R3 в соединении формулы IV обозначает водород, в этой реакции могут использоваться такие окислители, которые позволяют непосредственно получить из соединения формулы IV соответствующий альдегид формулы V или его соль, или сначала провести окисление до карбоксильного соединения формулы XVI
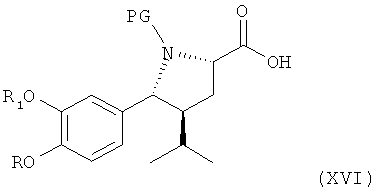
где R, R1 и PG определены выше, как для соединения формулы III, или его соли, которое может быть восстановлено с помощью восстанавливающих агентов до альдегида формулы V, где R3 обозначает водород, и где R, R1, R3 и PG по определению для формулы III выше, или его соли. Эти стадии способа, как таковые, а также соединение формулы XVI или его соль, и соединение формулы V или его соль также являются вариантами по изобретению. Реакция прямого получения альдегида формулы V может, например, быть проведена в присутствии окислителя, который позволяет провести окисление спирта в альдегид без излишнего образования кислоты формулы XVI, например, в условиях реакции Оппенауэра (используя, например, циклогексанон, коричный альдегид или анисовый альдегид в качестве окислителя в присутствии алкоголята алюминия, такого как трет-бутоксиалкоголят алюминия), предпочтительно с использованием хромовой кислоты, смеси дихромат/серная кислота, пиридиний-хлорхромата, пиридиний-дихромата, азотной кислоты, диоксида марганца или диоксида селена или посредством каталитической дегидрогенизации, или более предпочтительно, используя окислители, позволяющие проводить окисление в мягких условиях, такое как ТЕМРО-окисление (TEMPO = 2,2,6,6-тетраметилпиперидин-нитроксил), с использованием таких окислителей, как, например, хлорит натрия или гипохлорит кальция, предпочтительно в присутствии бромидов, например, бромида калия, в соответствующем растворителе типа метиленхлорида и/или воды, или с использованием диацетоксийодбензола в присутствии соответствующего растворителя, например метиленхлорида, при температурах в интервале от 0 до 50°С; в условиях реакции Шверна, например, с использованием диметилсульфоксида в присутствии оксалилхлорида при пониженных температурах в интервале от -90 до 0°С, предпочтительно в присутствии третичного азотистого основания, такого как триэтиламин или диизопропилэтиламин; в условиях реакции Кори-Кима, например, используя диметилсульфид в присутствии N-хлорсукцинимида; в условиях реакции Моффата-Пфитцнера, например, окисление диметилсульфоксидом в присутствии циклогексилкарбодиимида; окисление в условиях реакции Десса-Мартина в присутствии Десс-Мартин-перйодинана (1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1Н)-он) в соответствующем растворителе типа метиленхлорида, при температурах в интервале от 0 до 50°С; или с использованием SO3/пиридинового комплекса в диметилсульфоксиде в отсутствие или присутствии соответствующего растворителя, такого как метиленхлорид, например, при температурах в интервале от -30 до 30°С; или, с низким преимуществом, использование каталитической дегидрогенизации, например, в присутствии серебра, меди, оксида хрома или оксида цинка. При необходимости стехиометрия окислителей выбирается таким образом, чтобы избежать переокисления.
Окисление соединения формулы IV (а также альдегидного соединения формулы V, полученного, предпочтительно, по описанию выше) до соединения формулы XVI может, например, быть проведено с использованием реагента Джонса (CrO3 в водном растворе серная кислота/ацетон), с диоксидом марганца, с дихроматом пиридиния или, в частности, в условиях окисления по Пиннаку, например окислением с помощью хлорита натрия или гипохлорита кальция в присутствии слабой кислоты, предпочтительно дигидрофосфата щелочноземельного металла, например дигидрофосфата натрия, в соответствующем растворителе, например спирте, таком как трет-бутанол, 2-метил-2-бутанол, и/или в воде, при температуре в интервале от 0 до 50°С. Восстановление кислоты формулы XVI проводится далее с использованием восстанавливающего агента, позволяющего проводить селективное восстановление до альдегида формулы V, где R3 обозначает водород и где R, R1, R3 и PG определены, как для формулы III. Восстанавливающие агенты могут быть выбраны, например, из соответствующих комплексных гидридов, как таковых, и соединение формулы XVI может быть использовано с активированной карбоксильной группой, например, в виде хлорангидрида кислоты, активированного сложного эфира, ангидрида (например, смешанного) или путем активации в процессе реакции, например, с использованием соединения в активной форме или путем активации, как описано ниже при конденсации соединения формулы XVI с соединением формулы VI. Например, в случае хлорангидрида соединения формулы XVI восстановление до альдегида формулы V может быть проведено с помощью LiAlH (трет-бутокси)3 (литий-три(трет-бутокси)алюминий гидрид) в соответствующем растворителе, например 2-метоксиэтиловом эфире (диглим), или с помощью боргидрида натрия или его комплексов. Альтернативно восстановление может быть проведено путем гидрирования в присутствии катализаторов гидрирования, в условиях восстановительной реакции Розенмунда с использованием палладий/барий сульфата и водорода в соответствующем растворителе, таком как вода, спирт, например метанол или этанол, диоксан, этилацетат или смесь одного или более таких растворителей, обычно при температурах в интервале, например, от 0 до 80°С.
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы V при условии, что R3 в нем обозначает водород, в условиях реакции Гриньяра или ей подобных, с реагентом, полученным реакцией соединения формулы VI
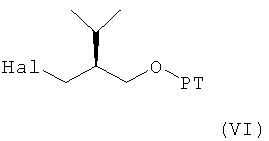
где Hal обозначает галоген, предпочтительно хлор, бром или йод, и РТ обозначает защитную группу для гидроксильной группы, с металлом, с получением соединения формулы VII
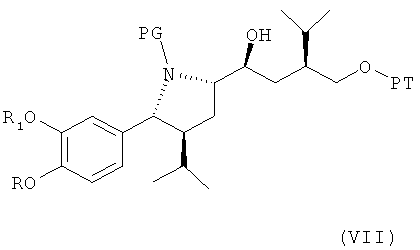
где R, R1 и PG определены, как для формулы III, и РТ обозначает защитную группу для гидроксильной группы, предпочтительно группу, которая может быть селективно удалена без удаления защитной группы PG, например 1-фенил-С1-С7-алкил, в частности бензил. Эта стадия способа, как таковая, а также соединение формулы VII или его соль также являются вариантами по изобретению. Диастереоселективность этой реакции очень высока, например, выше, чем 99:1, то есть другой возможный диастереомер практически не обнаружен. Это указывает на значительное преимущество использования пирролидиновой кольцевой системы для такой конверсии и, таким образом, для синтеза ингибиторов ренина, таких как алискирен.
Реакция предпочтительно проводится с металлом, взаимодействующим с соединением формулы VI, с образованием соответствующего металлорганического соединения, например с литием, натрием, железом, цинком, оловом, индием, марганцем, алюминием или медью, или с MnX, (алкил)3MnLi-, или -СеХ2, где Х обозначает галоген, такой как Cl, I или Br, более предпочтительно Br; или с реагентом, полученным с помощью комбинаций металлов, таких как Mg/Fe, или, кроме того, с кислотами Льюиса, такими как комплекс BF3 c диэтиловым эфиром, или с MgBr2, или подобными им, с получением реагентов типа Гриньяра для реакций, подобных реакции Гриньяра, или с магнием, дающим соответствующий реактив Гриньяра с магнием (Mg) в качестве металла для реакции Гриньяра, в соответствующем растворителе, например простом эфире, таком как циклический эфир, например тетрагидрофуран, алкиловом эфире, например диэтиловом эфире, трет-бутилметиловом эфире, углеводороде, таком как толуол, или галогенированном углеводороде, например, метиленхлориде, при температуре в интервале от 0 до 70°С. Реагенты Гриньяра или реагенты, подобные реагенту Гриньяра, или органолитиевые соединения являются предпочтительными, при этом реагенты Гриньяра или реагенты, подобные реагенту Гриньяра, особенно предпочтительны.
Соединение формулы (VI) может быть получено методами, хорошо известными из уровня техники, см., например, публикацию в Houben-Weyl, vol.13/2а, page 53-526, которая включена в данное описание посредством ссылок.
В следующем варианте названного первого варианта по изобретению способ синтеза ингибитора ренина, такого как алискирен, включает снятие защитной группы с соединения формулы VII аналогично удалению защитной группы для гидроксила РТ, например в случае защитной группы, которая может быть удалена посредством гидрирования, такой как 1-фенил-С4-7-алкил, в частности бензильной, путем каталитического гидрирования с получением соединения формулы VIII
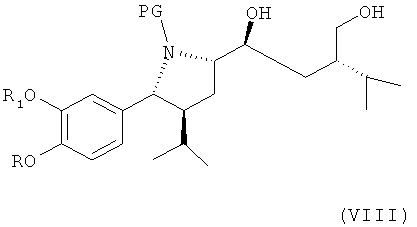
где R, R1 и PG определены, как для формулы III выше, или его соли. Эта стадия способа, как таковая, а также соединение формулы VIII или его соль, также являются вариантами по изобретению. Снятие защитной группы проводят в стандартных условиях, например, в случае удаления защитной группы посредством гидрирования с помощью водорода в присутствии катализатора, такого как благородный металл, например палладий, который может быть нанесен на носитель, такой как активированный уголь, в присутствии соответствующего растворителя типа спирта, например метанола или этанола, или неспиртового ратворителя, такого как (не ограничиваясь ими) толуол или этилацетат, при соответствующей температуре в интервале, например, от 0 до 50°С.
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в окислении соединения формулы VIII по первичной гидроксильной группе до альдегидного соединения формулы IX
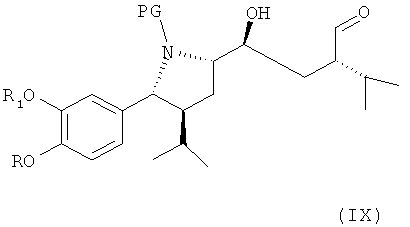
где R, R1 и PG определены, как для формулы III выше, или его соли, которое затем спонтанно циклизуется с образованием лактола формулы X,
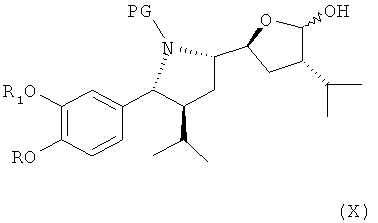
который либо в этой же реакционной смеси (in situ) или после выделения на отдельной стадии способа, которая, как таковая, также является вариантом по изобретению, окисляют затем до лактона формулы XI
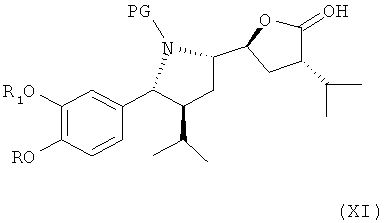
где в формуле Х и XI R, R1 и PG определены, как для соединения формулы III выше. Эта последовательность реакционных стадий от реакции соединения формулы VIII до соединения формулы XI, как таковая, а также соединение формулы IX или, особенно соединение формулы Х и/или формулы XI или их соли, также являются вариантами по изобретению. Окисление соединения формулы VIII, приводящее к лактолу формулы X, предпочтительно проводят в условиях, отмеченных в качестве предпочтительных при окислении соединения формулы IV до альдегида формулы V, например, с помощью комплекса SO3/пиридин в присутствии диметилсульфоксида в соответствующем растворителе, таком как метиленхлорид, предпочтительно в присутствии третичного азотистого основания, такого как триэтиламин, например, при температуре в интервале от 30 до 50°С. Последующее окисление до соединения формулы XI может быть проведено в тех же реакционных условиях с использованием избытка некоторых реагентов, отмеченных выше, или соединение может быть выделено и окислено отдельно с помощью других реагентов, например, упомянутых выше, более предпочтительно с использованием ТЕМРО/диацетоксийодбензола.
Альтернативно окисление может быть проведено также по первичной гидроксильной группе, не затрагивая вторичной гидроксильной группы, до соединения XI с помощью реагента ТПАР (тетра-N-пропиламмоний рутенат), например, согласно литературному источнику: S. Ley et al. Synthesis, 639 (1994). Этот метод особенно предпочтителен.
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы XI или его соли с амином формулы XII
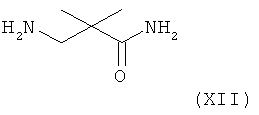
(где амидный азот при необходимости может быть защищен и защитная группа затем может быть удалена из соответствующего защищенного соединения формулы XIII), или его солью с получением соединения формулы XIII
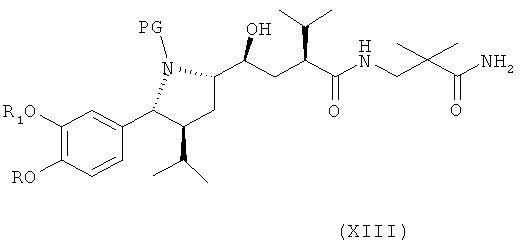
где R, R1 и PG определены, как для соединения формулы III выше, или его соли. Эта стадия способа, как таковая, а также соединение формулы XIII или его соль, также являются вариантами по изобретению.
Реакция предпочтительно проводится в стандартных условиях, применяемых для получения амида из лактона, например, в соответствующем растворителе или смеси растворителей, например в эфире, таком как трет-бутилметиловый эфир, предпочтительно в присутствии бифункционального катализатора со слабой кислой и слабой основной группой, например 2-гидроксипиридина или пролина, в присутствии соответствующего основания, например третичного азотистого основания, такого как триэтиламин, при соответствующей температуре в интервале, например, от 0°С до температуры кипения реакционной смеси, например в интервале от 0 до 85°С.
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в раскрытии цикла в соединении формулы XIII посредством восстановления или гидрогенолиза кольца с получением соединения формулы XIV
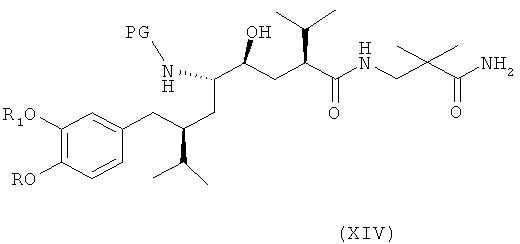
где R, R1 и PG определены, как для соединения формулы III выше, или его соли. Эта реакционная стадия, как таковая, также является вариантом по изобретению.
Раскрытие кольца с помощью восстановления предпочтительно проводится в условиях, использующих соответствующий металл в качестве восстановителя, например в условиях, сравнимых с уловиями проведения восстановления по Берчу с применением щелочных металлов и жидкого аммиака, например натрия или лития в жидком аммиаке (NH3) в присутствии, кроме того, соответствующего растворителя или смеси растворителей, таких как простой эфир, например тетрагидрофуран, и/или спирт, например этанол, при низких температурах, например при температуре в интервале от -90 до -20°С, в частности при температуре около -78°С. Возможны и альтернативные методы восстановления, например восстановление кальцием в трет-бутаноле, другие методы восстановления кальцием, литий-ди-трет-бутилбифенилидом, магнием в антрацене, или подобными методами, которые не требуют применения жидкого аммиака и низких температур (< -20°С).
Альтернативно раскрытие кольца может быть проведено посредством гидрирования. Такие методы хорошо известны из уровня техники и описаны, например, в Houben-Weyl, volume 11/1, Stickstoffverbindungen II, page 968-971 или D.Tourwé, et al., Tetrahedron, 54, 1753 (1998).
В следующем варианте названного первого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, включает снятие защиты с соединения формулы XIV с получением соответствующего соединения формулы XV,
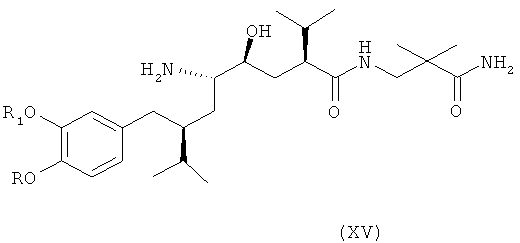
которое фармацевтически активно, в частности в качестве ингибитора ренина, где R и R1 определены, как для соединения формулы I, или его соли; и при необходимости превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или другую его соль. Например, если PG обозначает (что предпочтительно) C1-7-алкоксикарбонильную группу, такую как трет-бутоксикарбонил, удаление может быть проведено в стандартных условиях, например, в присутствии кислоты, такой как хлористоводородная кислота, в соответствующем растворителе, таком как диоксан, например при температурах в интервале от 0 до 50°С, например, при комнатной температуре.
Особенно важный аспект настоящего изобретения относится к способу получения соединения формулы XV или его соли, заключающемуся в первоначальном раскрытии кольца в соединении формулы XIII, описанном выше, посредством его селективного восстановления в соединение формулы XIV, описанное выше, или его соли, с последующим снятием защиты с соединения формулы XIV с получением соответствующего соединения формулы XV или его соли, и при необходимости превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или другую его соль.
В следующем втором варианте осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы XVI (которое может быть получено описанным выше методом или посредством первоначального окисления соединения формулы IV, где R3 обозначает водород, при этом в реакции могут использоваться такие окислители, которые приводят к соответствующему альдегиду формулы V или его соли, и последующего окисления альдегида формулы V до карбоновой кислоты формулы XVI или ее соли, например, посредством описанной выше реакции), описанного выше, или его соли (полученных предпочтительно, как описано выше, где синтез соединения формулы XVI описан первый раз), где R, R1 и PG определены, как для соединения формулы III, или его соли, с реагентом, способным активировать карбоксильную группу, в частности превращать ее в галоидангидрид, смешанный ангидрид, карбонилимидазолид или «Weinreb амид», и затем введение его в реакцию с металлоорганическим производным соединения формулы VI по описанию выше, в частности с производным цинка, лития или магния, с получением соединения формулы XVII,
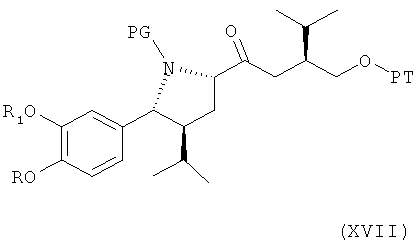
где R, R1 и PG определены, как для соединения формулы III выше, и РТ по определению, как для соединения формулы VI, или его соли. Эта стадия способа, как таковая, а также соединение формулы XVII или его соль также являются вариантами по изобретению.
Активацию карбоксильной группы в соединении формулы XVI, приводящую к ее реакционным производным, предпочтительно проводят в стандартных условиях реакции конденсации, где среди возможных реакционных производных кислоты формулы XVI реакционные сложные эфиры (например, гидроксибензотриазол (ГОБТ), пентафторфенил, 4-нитрофенил или N-гидроксисукцинимид эфир), имидазолид, «Weinreb амид», галоидангидриды (такие как хлор или бромангидрид) или реакционные ангидриды (такие как смешанные ангидриды низших алкановых кислот или симметричные ангидриды) являются предпочтительными. Реакционные производные карбоновой кислоты могут также образоваться в процессе реакции. Реакцию проводят посредством растворения соединений формулы XVI в соответствующем растворителе, например галогенированном углеводороде, таком как метиленхлорид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидон или смесь одного или более таких растворителей, и добавления соответствующего основания, например триэтиламина, диизопропилэтиламина (ДИЭА) или N-метилморфолина, если реакционное производное кислоты формулы II образуется в процессе реакции, добавления соответствующего конденсирующего агента, который способствует образованию предпочтительного реакционного производного карбоновой кислоты формулы XVI в процессе реакции, например дициклогексилкарбодиимид/1-гидробензотриазола (ДЦК/ГОБТ); хлорида бис-(2-оксо-3-оксазолидинил)фосфина (БОФ-С1); тетрафторбората O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N',N'-тетраметилурония (ТПТУ); тетрафторбората (O-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (ТБТУ); (бензотриазол-1-илокси)пирролидинофосфоний-гексафторфосфата (РуБОФ), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида/гидроксибензотриазола или/1-гидрокси-7-азабензотриазола (EDC/ГОБТ или EDC/ГОАТ) или одного ГОАТ, или с (1-хлор-2-метилпропенил)диметиламином. Реакционная смесь предпочтительно перемешивается при температурах в интервале приблизительно от -20 до 50°С, в частности в интервале от 0°С до 30°С, например при комнатной температуре. Реакция предпочтительно проводится в атмосфере инертного газа, например азота или аргона.
Последующую реакцию металлоорганического производного соединения формулы VI, в частности цинкового, литиевого или магниевого производного, или, кроме того, производного магния, алюминия или меди, затем предпочтительно проводят в обычных условиях, например, аналогично условиям реакции Гриньяра или подобным реакции Гриньяра, отмеченным выше для соединения формулы VI, с альдегидом формулы V.
В следующем варианте названного второго варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в восстановлении соединения формулы XVII в стереоселективных условиях и снятии защиты с полученного соединения путем удаления защитной для гидроксила группы РТ с получением соединения формулы VIII, как описано выше, или его соли.
Восстановление в стереоселективных условиях предпочтительно проводится в присутствии стереоселективного восстановителя, такого как LiAlH(O-трет-бутил)3, LiBH(втор-бутил)3 (Selectride®), калий селектрид или борогидрид/оксаазаборлидин («CBS-катализаторы» на основе новой работы Corey, Bakshi и Shibata, получаемые in situ из аминоспирта и борана), или посредством стереоселективного гидрирования, например, в присутствии таких катализаторов, как [Ru2Cl4((S- или R-)BINAP)]NEt3. Реакция протекает в стандартных условиях, например, в соответствующем растворителе, таком как тетрагидрофуран, метанол, этанол или смесь двух или более таких растворителей, например, при температуре в интервале от -80 до 50°С (см., например, Reger et al., Tetrahedron Letters, 2000,  , 10085).
, 10085).
Снятие защитной группы проводят в стандартных условиях, например, если РТ является группой, удаляемой гидрированием, такой как 1-фенил-С1-7-алкильная, например бензильная, ее удаляют с помощью каталитического гидрирования, например, в условиях, аналогичных описанным выше для снятия защиты с соединения формулы VII.
Соединение формулы VIII может быть далее введено в реакцию с соединением формулы X, или его солью, как описано выше, с получением после прохождения реакционных стадий, описанных выше, соединения формулы XV или его соли.
Альтернативно соединение формулы VIII по определению выше или его соль, предпочтительно получаемое согласно либо первому, либо второму варианту по изобретению, может быть далее введено в реакцию с соединением формулы XVIII
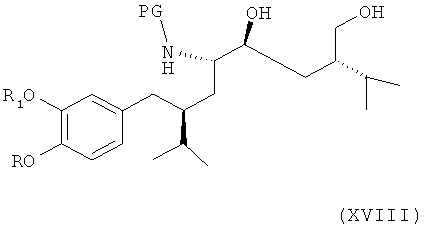
где R, R1 и PG определены, как для соединения формулы III, или его солью, с раскрытием пирролидинового кольца посредством восстановления или гидрогенолиза. Эта стадия способа, как таковая, а также соединение формулы XVIII, или его соль, также являются вариантами по изобретению. Раскрытие кольца посредством восстановления или гидрогенолиза предпочтительно проводят в условиях, упомянутых выше, для раскрытия кольца в соединении формулы XIV.
Альтернативно соединение формулы VII по определению выше, или его соль, предпочтительно получаемое согласно либо первому, либо второму варианту осуществления изобретения, может быть далее введено в реакцию с соединением формулы XVIII непосредственно, минуя стадию снятия защиты,

где R, R1 и PG определены, как для соединения формулы III, или его солью, с раскрытием пирролидинового кольца посредством восстановления или гидрогенолиза. Эта стадия способа, как таковая, а также соединение формулы XVIII или их соли, также являются вариантами по изобретению. Раскрытие кольца посредством восстановления или гидрогенолиза предпочтительно проводят в условиях, упомянутых выше, для раскрытия кольца в соединении формулы XIV. Этот метод особенно предпочтителен в случае, когда РТ является защитной группой, удаляемой в условиях восстановительного раскрытия кольца, в частности, если РТ является фенилС1-С7-алкилом, таким как бензил.
Соединение формулы XVIII может быть затем окислено в следующем варианте названного первого или второго вариантов осуществления изобретения в процессе синтеза ингибитора ренина, такого как алискирен (сравнимым с синтезом соединения формулы VIII через альдегид с раскрытием пирролидинового кольца, аналогично соединению формулы IX, предпочтительно в условиях, как описано для этой реакции), до лактола формулы XIX,
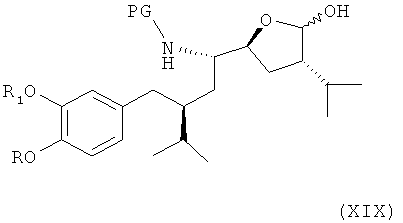
где R, R1 и PG определены, как для соединения формулы III, или его соли (где эта реакция, а также соединение формулы XIX или его соль, как таковые, также являются вариантами по настоящему изобретению), который либо в реакционной среде (in situ), либо после выделения окисляют до лактона формулы XX
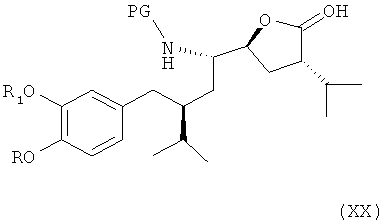
где R, R1 и PG определены, как для соединения формулы III, или его соли (где эта реакция, как таковая, также является вариантом осуществления настоящего изобретения). Реакция предпочтительно проводится в условиях, аналогично условиям, описанным выше для окисления соединения формулы Х до соединения формулы XI. Лактон формулы XX или его соль может быть также получен непосредственно из соединения формулы XVIII. В этом случае реакцию также предпочтительно проводят в условиях, аналогичных условиям, описанным выше для окисления соединения формулы Х до соединения формулы XI. Лактон формулы XX или его соль также являются новым предпочтительным вариантом осуществления изобретения.
Соединение формулы XX может быть затем в следующем варианте названного первого или второго варианта по изобретению способа синтеза ингибитора ренина, такого как алискирен, введено в реакцию с соединением формулы XII, описанным выше (в случае защищенной формы с последующим снятием защиты с азота амидной группы), предпочтительно в реакционных условиях, аналогичных условиям получения соединения формулы XIV, описанного выше, или его соли (где эта реакция, как таковая, также является вариантом осуществления настоящего изобретения). С соединения формулы XIV может быть снята защита описанным выше методом с получением конечного продукта формулы XV, описанного выше, или его соли.
В третьем варианте осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы VII или его соли, как описано выше (полученного согласно первому или второму вариантам по изобретению), протекающей с раскрытием кольца путем восстановления или гидрогенолиза, с получением соединения формулы XXI
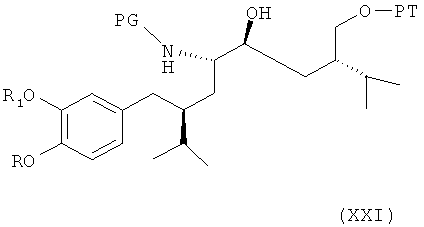
где R, R1 и PG определены, как для соединения формулы III, и РТ обозначает защитную группу для гидроксильной группы, или его соли (где эта стадия реакции, как таковая, а также соединение формулы XXI, или его соль, в частности, где PG обозначает бензилоксикарбонил, а РТ обозначает бензил, или где PG обозначает водород, а РТ обозначает бензил, также представляют собой варианты осуществления изобретения). Раскрытие кольца посредством восстановления или гидрогенолиза предпочтительно проводится в условиях, отмеченных выше для раскрытия кольца в соединении формулы XIV. Соединение формулы XXI, или его соль, может быть затем введено в реакцию аналогично соединению формулы VIII, как упомянуто выше, для удаления защитной группы с получением соединения формулы XVIII, описанного выше, или его соли, которое затем может быть далее превращено, например, через соединения XIX и XX и XIV, предпочтительно в аналогичных реакционных условиях, или в каждом случае через их соли, в соединение формулы XV по описанию выше, или его соль.
В четвертом варианте осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции раскрытия кольца путем восстановления или гидрогенолиза в соединении формулы Х или его соли, как описано выше, с получением соединения формулы XIX, как показано выше, или его соли, при этом реакция, как таковая, является вариантом осуществления изобретения. Раскрытие кольца посредством восстановления или гидрогенолиза предпочтительно проводится в условиях, отмеченных выше для реакции раскрытия кольца в соединении формулы XIV.
В следующем варианте названного четвертого варианта по изобретению способ синтеза ингибитора ренина, такого как алискирен, заключается в окислении соединения формулы XIX или его соли, с получением лактона соединения формулы XX или его соли, описанного выше (предпочтительно в условиях, аналогичных условиям, описанным для окисления соединения формулы Х в соединение формулы XI, как представлено выше), который в еще одном варианте названного четвертого варианта осуществления изобретения может быть введен в реакцию с соединением формулы XII или его солью, описанным выше, предпочтительно в условиях, аналогичных условиям, описанным для реакции соединения формулы XI с соединением формулы XII, с получением соединения формулы XIV, описанного выше, или его соли, которое может быть затем в следующем варианте названного четвертого варианта по изобретению превращено путем снятия защиты в соединение формулы XV или его соль, описанное выше, предпочтительно в условиях, аналогичных описанным выше для снятия защиты с соединения формулы XIV.
В пятом варианте осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции раскрытия кольца путем восстановления или гидрогенолиза в соединении формулы XI, по описанию выше, или его соли, с получением соединения формулы XX или его соли, как показано выше (где реакция, как таковая, является вариантом по изобретению). Раскрытие кольца посредством восстановления или гидрогенолиза предпочтительно проводится в условиях, отмеченных выше для реакции раскрытия кольца в соединении формулы XIV.
В следующем варианте названного пятого варианта по изобретению способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы XX или его соли с соединением формулы XII или его солью, как описано выше, предпочтительно в условиях, аналогичных условиям, описанным для реакции соединения формулы XI с соединением формулы XII, с получением соединения формулы XIV, как описано выше, или его соли, которое может быть затем в следующем варианте названного пятого варианта по изобретению превращено путем снятия защиты в соединение формулы XV или его соль, как описано выше, предпочтительно в реакционных условиях, аналогичных описанным выше для снятия защиты с соединения формулы XIV.
В шестом варианте осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы V, описанного выше, или его соли, где R3 обозначает водород, с соединением формулы XXII
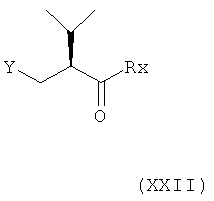
где Y обозначает Ph3P+ или (AlkO)2P(O), где Alk обозначает предпочтительно алкил, например С1-7-алкил (оба из которых могут быть получены in situ, соответственно), и Rx обозначает гидроксигруппу, защищенную гидроксигруппу, аминогруппу или NH-CH2C(CH3)2-CONH2, приводящей к соединению формулы XXIII
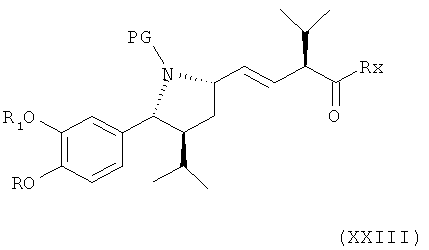
где R, R1 и PG определены, как для соединения формулы III, и Rx определен, как для соединения формулы XXII; или его соли. Эта стадия способа, как таковая, а также соединение формулы XXIII или его соль также представляют собой варианты по изобретению. Реакция при этом может быть проведена в присутствии соответствующего основания, например гидрида натрия, бутиллития, гексиллития, циклогексиллития или диизопропиламида лития, в соответствующих растворителях, таких как простые эфиры, например тетрагидрофуран, углеводороды, например толуол, или галогенированные углеводороды, например метиленхлорид, или смеси двух или более таких растворителей, например, при температурах в интервале от -78°С до 100°С.
В следующем варианте названного шестого варианта осуществления изобретения способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции раскрытия пирролидинового кольца путем восстановления или гидрогенолиза в соединении формулы XXIII или его соли с образованием азиридинового кольца в соединении формулы XXIII и получением соединения формулы XXIV
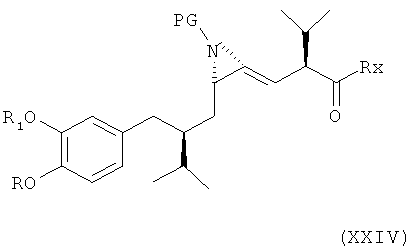
где R, R1 и PG определены, как для соединения формулы III, и Rx определен, как для соединения формулы XXII, или его соли. Эта стадия способа, как таковая, а также соединение формулы XXIV или его соль также представляют собой варианты по изобретению. Раскрытие кольца путем восстановления или гидрогенолиза предпочтительно проводится в условиях, описанных выше для раскрытия кольца в соединении формулы XIV.
В следующем варианте названного шестого варианта по изобретению способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы XXIV или его соли, с раскрытием кольца и образовании соединения формулы XX или его соли, если Rx в соединении формулы обозначает ОН (или если присутствует защищенная гидроксигруппа, то защитная группа сначала должна быть удалена, чтобы получить свободную ОН-группу). Реакция раскрытия кольца может, например, протекать в кислых или основных условиях, предпочтительно в присутствии подходящих растворителей, например спиртов, таких как этанол или метанол, простых эфиров, например тетрагидрофурана, углеводородов, например толуола, или галогенированных углеводородов, например метиленхлорида, при температурах в интервале от 0°С до температуры кипения соответствущей реакционной смеси. Соединение формулы XX, или его соль, может быть затем в следующем предпочтительном варианте шестого варианта по изобретению превращено в соединение формулы XIV, описанное выше, или его соль, посредством его реакции с соединением формулы XII, как описано выше, в соединение формулы XIV по определению выше, предпочтительно в реакционных условиях, аналогичных условиям, описанным выше, которое в следующем предпочтительном варианте шестого варианта по изобретению может быть затем путем снятия защиты превращено в соединение формулы XV или его соль, предпочтительно в условиях, аналогичных условиям, описанным выше для снятия защиты с соединения формулы XIV.
В еще одном следующем варианте названного шестого варианта по изобретению способ синтеза ингибитора ренина, такого как алискирен, заключается в реакции соединения формулы XXIV или его соли, где Rx обозначает NH-СН2С(СН3)2-CONH2, с раскрытием кольца (в условиях, предпочтительно аналогичных условиям, описанным в предыдущем параграфе) с образованием соединения формулы XIV или его соли. Это соединение может быть затем в следующем предпочтительном варианте этой версии шестого варианта по изобретению путем снятия защиты превращено в соединение формулы XV или его соль, предпочтительно в условиях, аналогичных условиям, описанным выше для снятия защиты с соединения формулы XIV.
Все эти различные пути синтеза показывают, что соединение формулы III представляет собой новое очень важное соединение, являющееся центральным промежуточным соединением в большом числе возможных синтетических путей, в частности, для синтеза ингибитора ренина, такого как алискирен. Вследствие этого соединение формулы III или его соль, а также его синтез составляют особо предпочтительные варианты осуществления изобретения.
Ниже перечислены все определения различных терминов, применяемых для описания новых промежуточных соединений и синтетических стадий по настоящему изобретению. Эти определения с заменой одного, более чем одного или всех общих выражений или символов, использумых в настоящем описании и приводящих к предпочтительным вариантами по изобретению, предпочтительно применимы к терминам, используемым во всем описании, если они не ограничены особо в отдельных примерах или фрагментах больших групп.
Термин «низший» или «C1-7-» определяет фрагмент, включающий вплоть до и максимально 7, в частности вплоть до и максимально 4, атома углерода, при этом названный фрагмент является разветвленным (один или более раз) или линейным и связан через концевой или неконцевой атом углерода. Низшим или С1-7-алкилом является, например, н-пентил, н-гексил или н-гептил, или предпочтительно С1-4-алкил, в частности метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил.
Гало или галоген предпочтительно обозначают общий термин, включающий фтор, хлор, бром или йод, наиболее предпочтительно фтор, хлор или бром; там, где упоминается галогруппа, это может означать, что присутствует один или более (например, вплоть до трех) атомов галогена, например в галоС1-7-алкиле, таком как трифторметил, 2,2-дифторэтил или 2,2,2-трифторэтил.
Алкил предпочтительно содержит до 20 атомов углерода и более и предпочтительно обозначает С1-С7-алкил. Алкил является линейным или разветвленным радикалом (один раз и, если необходимо и возможно, несколько раз). Особенно предпочтительным является метил.
Алкоксиалкил обозначает алкил (предпочтительно, по определению выше), который является замещенным при углероде, предпочтительно при концевом атоме углерода (в ω-положении), алкилоксигруппой (алкоксигруппой), где алкил определен выше, предпочтительно С1-7-алкоксигруппой. В качестве алкоксиалкила особенно предпочтительным является 3-метоксипропил.
Защитные группы могут присутствовать (см. также раздел "Общие условия проведения процесса"), чтобы защищать функциональные группы от нежелательных вторичных реакций, таких как ацилирование, этерификация, сложноэфирная этерификация, окисление, сольволиз и подобных им. Характерной чертой защитных групп является их способность к быстрому удалению без побочных вторичных реакций, обычно посредством сольволиза, восстановления, фотолиза, а также за счет ферментной активности, например в условиях, аналогичных физиологическим условиям, и отсутствие их в конечных продуктах. Специалистам известны или легко могут быть установлены защитные группы, являющиеся подходящими для реакций, отмеченных выше и далее. Если в одном промежуточном соединении, упомянутом в данном описании, присутствует одна или более защитных групп, они, предпочтительно, выбираются так, что, если одну из групп необходимо оставить, защитные группы должны быть выбраны селективно, например использованы две или более различные защитные группы, которые удаляются в разных условиях, например один класс защитных групп удаляется в мягких условиях проведения гидролиза, а другой - в жестких условиях, один класс посредством гидролиза в присутствии кислоты, а другой класс - посредством гидролиза в присутствии основания, или один класс удаляется путем восстановительного расщепления (например, с помощью каталитического гидрирования), а другой - с помощью гидролиза или подобного процесса.
В качестве группы, защищающей гидроксильную группу, может быть выбрана любая группа, которая является подходящей для обратимой защиты гидроксильных групп, например упомянутая в стандартных учебниках в разделе "Общие условия проведения процесса". Защитная группа для гидроксильной группы, как только что упомянуто в нескольких примерах, может быть выбрана из группы, включающей (в частности, состоящей из) силильную защитную группу, особенно такую, как диарил-низший алкил-силил, например дифенил-трет-бутилсилил, или более предпочтительно три-низший алкил-силил, например трет-бутилдиметилсилил или триметилсилил; ацильную группу, например низший алкалоил, такой как ацетил, бензоил; низший алкоксикарбонил, такой как трет-бутоксикарбонил (Бок), или фенил-низший алкоксикарбонил, такой как бензилоксикарбонил; тетрагидропиранил; незамещенный или замещенный 1-фенил-низший алкил, такой как бензил или п-метоксибензил, и метоксиметил. Бок-группа (селективно удаляемая гидролизом) и бензил (селективно удаляемый гидрированием) являются предпочтительными.
В качестве группы, защищающей аминогруппу, может быть выбрана любая группа, которая является подходящей для обратимой защиты аминогрупп, например упомянутая в стандартных учебниках в разделе "Общие условия проведения процесса". Защитная группа для аминогруппы, как только что упомянуто в нескольких примерах, может быть выбрана из группы, включающей (в частности, состоящей из) ацильную группу (в частности, остаток органической карбоновой кислоты, связанный через ее карбонильную группу, или остаток органической сульфокислоты, связанный через ее сульфонильную группу), арилметил, этерифицированную меркаптогруппу, 2-ацил-низший алк-1-енил, силил или N-низший алкил-пирролидинилиден. Предпочтительной защитной группой для аминогруппы является низший алкоксикарбонил, в частности трет-бутоксикарбонил (Бок), фенил-низший алкоксикарбонил, такой как бензилоксикарбонил, флюоренил-низший алкоксикарбонил, такой как флюоренилметоксикарбонил, 2-низший алканоил-низший алк-1-ен-2-ил и низший алкоксикарбонил-низший алк-1-ен-2-ил, при этом наиболее предпочтительны изобутирил, бензоил, феноксиацетил, 4-трет-бутилфеноксиацетил, N,N-диметилформамидинил, N-метилпирролидин-2-илиден или особенно трет-бутоксикарбонил.
Группа X, отличная от гидроксигруппы или водорода, является предпочтительно уходящей группой, например галогруппой, такой как хлор, бром или йод, или ацилоксифрагментом, полученным из органической сульфокислоты, таким как алкансульфонилоксигруппа, в частности C1-7-алкансульфонилоксигруппа, например метансульфонилоксигруппа, галоалкансульфонилоксигруппа, например галоC1-7-алкансульфонилоксигруппа, такая как трифторметансульфонилоксигруппа, или незамещенная или замещенная арилсульфонилоксигруппа, такая как толуолсульфонилоксигруппа (тозилоксигруппа).
Незамещенный или замещенный арил предпочтительно представляет собой моно- или полициклический фрагмент, в частности моноциклический, бициклический или трициклический арильный фрагмент с числом углеродных атомов от 6 до 22, в частности фенил (очень предпочтителен), нафтил (очень предпочтителен), инденил, флюоренил, аценафтиленил, фениленил или фенантрил, и является незамещенным или замещенным одним или более, в частности от одного до трех, фрагментами, предпочтительно независимо выбранными из группы, включающей С1-7-алкил, С1-7-алкенил, С1-7-алкинил, галоС1-7-алкил, такой как трифторметил, галогруппу, в частности фтор, хлор, бром или йод, гидроксигруппу, С1-7-алкоксигруппу, фенилоксигруппу, нафтилоксигруппу, фенил- или нафтилС1-7-алкоксигруппу, С1-7-алканоилоксигруппу, фенил- или нафтилС1-7-алканоилоксигруппу, аминогруппу, моно- или ди-(С1-7-алкил-, фенил-, нафтил-, фенил-С1-7-алкил-, нафтил-С1-7-алкил-, С1-7-алканоил- и/или фенил- или нафтилС1-7-алканоил)аминогруппу, карбоксильную группу, С1-7алкоксикарбонил, фенилоксикарбонил, нафтилоксикарбонил,
фенилС1-7-алкилоксикарбонил, нафтилС1-7-алкоксикарбонил, карбамоил, N-моно- или N,N-ди-(C1-7-алки, фени, нафти, фенил-С1-7-алки и/или нафтил-C1-7-алкил)аминокарбонил, цианогруппу, сульфогруппу, сульфамоил, N-моно- или N,N-ди-(С1-7-алкил-, фенил-, нафтил-, фенил-С1-7-алкил- и/или нафтил-C1-7-алкил)аминосульфонил и нитрогруппу.
Соли являются, прежде всего, фармацевтически приемлемыми солями соединений формулы XV или, в общем, солями любого из промежуточных соединений, упомянутых в данном тексте, где соли не исключаются по химическим причинам, легко понятным специалистам в данной области техники. Они могут быть получены при наличии в соединении солеобразующих групп, таких как основная или кислая группа, и существуют в диссоциированной форме, по крайней мере частично, например, в водных растворах при значении рН от 4 до 10, или могут быть выделены, в частности, в виде твердого вещества, особенно в кристаллической форме.
Такие соли образуются, например, в виде кислотно-аддитивных солей, предпочтительно с органическими или неорганическими кислотами, из соединений формулы XV или любого промежуточного соединения, упомянутого в данном описании, имеющих основной атом азота (например, в виде иминогруппы или аминогруппы), в особенности в виде фармацевтически приемлемых солей. Соответствующими неорганическими кислотами являются, например, галоидные кислоты, такие как хлористоводородная кислота, серная кислота или фосфорная кислота. Соответствующими органическими кислотами являются, например, карбоновые кислоты, фосфоновые кислоты, сульфоновые кислоты или сульфаминовые кислоты, например уксусная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, бензойная кислота, метан- или этансульфоновая кислота, этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 1,5-нафталиндисульфоновая кислота, N-циклогексилсульфаминовая кислота, N-метил-, N-этил- или N-пропилсульфаминовая кислота, или другие органические протоновые кислоты, такие как аскорбиновая кислота.
При наличии в соединении отрицательно заряженных радикалов, таких как карбоксигруппа или сульфогруппа, соли могут быть получены с основаниями, например, в виде металлических или аммонийных солей, например, таких как соли щелочных или щелочноземельных металлов, например, в виде натриевых, калиевых, магниевых или кальциевых солей, или в виде аммонойных солей с аммиаком или с соответствующими органическими аминами, такими как третичные моноамины, например триэтиламин, N-этилпиперидин или N,N'-диметилпиперазин.
Когда основная и кислотная группы присутствуют в одной и той же молекуле, соединение формулы XV или любое промежуточное соединение, упомянутое в данном описании, могут также образовать внутреннюю соль.
Для выделения или очистки соединений формулы XV или любого промежуточного соединения, упомянутого в данном описании, можно использовать фармацевтически неприемлемые соли, например пикраты или перхлораты. Для терапевтических целей используются только фармацевтически приемлемые соли или свободные соединения формулы XV (которые могут быть введены в фармацевтические препараты), и они поэтому предпочтительны, по крайней мере, в случае соединений формулы XV.
С точки зрения тесного родства между соединениями и промежуточными соединениями в свободной форме и в форме их солей, включая те соли, которые могут быть использованы в качестве промежуточных соединений, например, при очистке или идентификации соединений или их солей, любую ссылку на «соединения», «исходные соединения» и «промежуточные соединения» выше и далее, особенно на соединения формулы XV, следует понимать, как ссылку также на одну или более их солей или смесь соответствующего свободного соединения, промежуточного соединения или исходного соединения и одну или более их солей, каждые из которых предполагают включение также сольвата, метаболического предшествующего продукта, такого как эфир или амид соединения формулы XV, или соли одного или более из них, и считать эту ссылку, как соответствующую и целесообразную, если не указано иначе. Сюда относятся также различные кристаллические формы, которые могут быть получены.
При использовании множественной формы для соединений, исходных веществ, солей, фармацевтических препаратов, болезней, заболеваний и им подобных, имеется в виду, что это означает одно (предпочтительно), или более, отдельное соединение(ий), соль(ей), фармацевтический препарат(ов), болезнь(ей), заболевание(ий) или им подобных; там, где используется единичный или неопределенный артикль («a», «an»), это не предполагает исключения множественной формы, но только предпочтительно подразумевает «одно».
Исходные соединения, в частности, представляют собой соединения формулы I, VI, XII и/или XXI, отмеченные в настоящем описании, промежуточные соединения представляют собой, в частности соединения формулы III, IV, V, VII, VIII, IX, X, XI, XIII, XIV, XVI, XVII, XVIII, XIX, XX, XXI, XXIII и/или XXIV.
Изобретение относится также к способам синтеза исходных соединений (например, формулы I, VI, XII и/или XXI) и особенно к промежуточным соединениям формулы III, IV, V, VII, VIII, IX, X, XI, XIII, XIV, XVI, XVII, XVIII, XIX, XX, XXI, XXIII и XXIV, отмеченным выше, из их соответствующих предшественников, как отмечено выше, включая способы с одностадийным синтезом, приводящим к соединению формулы XV, более чем с одной или со всеми стадиями названного синтеза, и/или к фармацевтически активным субстанциям, в частности ингибиторам ренина, наиболее предпочтительно алискирену, включая способы с одностадийным синтезом, приводящим к соединению формулы XV, с более чем одной или всеми стадиями названного синтеза, и/или к фармацевтически активным субстанциям, и/или их применению в синтезе фармацевтически активных соединений, таких как ингибиторы ренина, в частности алискирен.
Общие условия процесса
В соответствии с профессиональными знаниями специалиста в данной области техники о возможных ограничениях в случае отдельных реакций возможные ограничения относятся в общем ко всем процессам, отмеченным ранее и далее, в то время как реакционные условия, в частности отмеченные выше и ниже, представляются предпочтительными.
В любых реакциях, отмеченных выше и далее, могут быть использованы защитные группы, где это уместно и необходимо, даже если это специально не отмечается, чтобы защитить функциональные группы, которые не предназначены для использования в данной реакции, и они могут быть введены или удалены на соответствующих и необходимых стадиях. Реакции, включающие использование защитных групп, поэтому входят как возможные реакции без специального упоминания о защите и/или снятии защиты в данное описание.
В объеме данного изобретения только легкоудаляемая группа, которая не является составной частью особо требуемого конечного продукта XV, обозначается, как "защитная группа", если в контексте не указано иначе. Защита функциональных групп такими защитными группами, сами защитные группы, и реакции, применяемые для их введения и удаления, описаны, например, в стандартных публикациях, таких как J.F.W.McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York 1973, in T.W.Greene and P.G.M.Wuts, "Protective Groups in Organic Synthesis", Third edition, Wiley, New York 1999, in "The Peptides"; Volume 3 (editors: E.Gross and J.Meienhofer), Academic Press, London and New York 1981, in "Methoden der organischen Chemie" (Methods of Organic Chemistry), Houben Weyl, 4th edition, Volume 15/1, Georg Thieme Verlag, Stuttgart 1974, in H.-D.Jakubke and H.Jeschkeit, "Aminosäuren, Peptide, Proteine" (Amino acids, Peptides, Proteins), Verlag Chemie, Weinheim, Deerfield Beach, and Basel 1982, and in Jochen Lehmann, "Chemie der Kohlenhydrate: Monosaccharide und Derivate" (Chemistry of Carbohydrates: Monosaccharides and Derivatives), Georg Thieme Verlag, Stuttgart 1974.
Характерной чертой защитных групп является способность к быстрому удалению без побочных вторичных реакций, обычно путем сольволиза, восстановления, фотолиза или, альтернативно, в физиологических условиях (например, при ферментативном расщеплении). Различные защитные группы могут быть выбраны так, чтобы они могли быть селективно удалены на различных стадиях, в то время как другие защитные группы сохранены. Соответствующие альтернативы могут быть легко выбраны специалистами в области техники в соответствии с приведенными выше стандартными ссылками или из описания, или приведенных здесь примеров.
Все вышеупомянутые стадии процесса могут быть проведены в стандартных реакционных условиях, предпочтительно специально отмеченных, в отсутствие или, обычно, в присутствии растворителей или разбавителей, предпочтительно растворителей или разбавителей, которые инертны по отношению к реагентам и растворяют их в отсутствие или присутствии катализаторов, конденсационных или нейтрализационных агентов, например ионообменных смол, таких как катионообменники, например, в форме H+, в зависимости от природы реакции и/или реагентов при пониженной, нормальной или повышенной температуре, например при температурах в интервале приблизительно от -100°С до около 190°С, предпочтительно от приблизительно -80°С до приблизительно 150°С, например в интервале от -80 до -60°С, при комнатной температуре, в интервале от -20 до 40°С или при температуре кипения растворителя, при атмосферном давлении или в запаянном сосуде под соответствующим давлением, и/или в инертной атмосфере, например в атмосфере аргона или азота.
Растворители, из которых могут быть выбраны растворители, пригодные для любой отдельной реакции, включают специально отмеченные растворители или, например, такие, как вода, сложные эфиры, такие как низший алкил-низший алконат, например этилацетат, простые эфиры, такие как алифатические эфиры, например диэтиловый эфир, или циклические эфиры, например тетрагидрофуран или диоксан, жидкие ароматические углеводороды, такие как бензол или толуол, спирты, такие как метанол, этанол или 1- или 2-пропанол, нитрилы, такие как ацетонитрил, галогенированные углеводороды, как например, метиленхлорид или хлороформ, амиды кислот, такие как диметилформамид или диметилацетамид, основания, такие как гетероциклические азотистые основания, например пиридин или N-метилпирролидин-2-он, ангидриды карбоновых кислот, такие как ангидриды низших алкановых кислот, например ангидрид уксусной кислоты, циклические, линейные или разветвленные углеводороды, такие как циклогексан, гексан или изопентан, или их смеси, например водные растворы, если не указано иначе в описании процессов. Такие смешанные растворители могут быть также использованы при проведении хроматографии или для разделения. При необходимости могут использоваться безводные или абсолютные растворители.
При необходимости реакционные смеси обрабатывают, в частности, чтобы выделить нужные соединениия или промежуточные соединения, применяя обычные методики, например, выбранные из группы, включающей, не лимитируя, экстракцию, нейтрализацию, кристаллизацию, хроматографию, выпаривание, высушивание, фильтрацию, центрифугирование и подобные им.
Изобретение относится также к таким формам осуществления процесса, при которых соединение, полученное в качестве промежуточного, на любой стадии процесса применяется в качестве исходного соединения для выполнения оставшихся стадий процесса, или в котором исходное соединение образуется в реакционных условиях, или используется в форме производного, например, в защищенной форме или в виде соли, или соединение, полученное способом по изобретению, образуется в реакционных условиях и получается далее in situ. В способе по настоящему изобретению предпочтительно используются такие исходные соединения, которые дают в результате соединения формулы XV, отмеченные, как предпочтительные. Специальные ссылки даются на реакционные условия, которые идентичны или аналогичны условиям, описанным в примерах. Изобретение относится также к новым исходным соединениям и промежуточным соединениям, представленным в данном описании, в частности, приводящим к соединениям, отмеченным в описании, как предпочтительные.
Изобретение, в частности, относится к любому способу, описанному ранее и далее, который приводит к алискирену или его фармацевтически приемлемой соли.
Следующие примеры служат иллюстрацией изобретения, не лимитируя его объема, и в то же время, с другой стороны, они представляют предпочтительные варианты реакционных стадий, промежуточных соединений и/или способа получения алискирена или его солей.
«Бок» в примерах обозначает трет-бутоксикарбонил.
Примеры
I. Синтез трет-бутилового эфира (1S, 3S, 5S)-5-трет-бутоксикарбонилоксиметил-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (3).
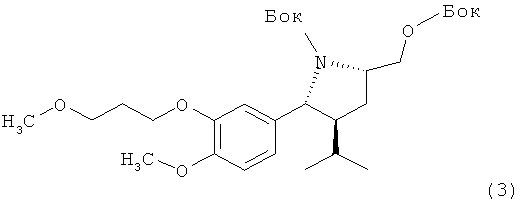
А. Вариант с примененем тионилхлорида.
Раствор 2,16 г 5-метилгексилового эфира, трет-бутилового эфира (2S, 4S)-2-трет-бутоксикарбониламино-4-[4-метокси-3-(4-метоксибутил)бензил]карбоновой кислоты (1) в 30 мл сухого толуола обрабатывают 1,07 г пиридина и добавляют по каплям 0,68 г тионилхлорида при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 3 ч и добавляют 0,22 г этанола и 30 мл воды. Двухфазовую систему экстрагируют, органический слой отделяют и промывают 20 мл 10%-ного водного раствора гидросульфата натрия, а затем 20 мл насыщенного водного раствора бикарбоната натрия. В конце органическую фазу дважды промывают 20 мл воды, а растворитель удаляют в вакууме, получая масло. Хроматография на силикагеле, элюирование смесью гептан/этилацетат дает 1,04 г соединения (3) в виде масла с отрицательным значением [а]d (измерен: - 39,1) при с=1, CHCl3.
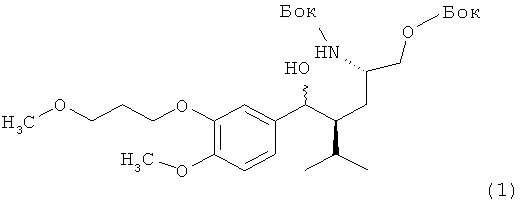
Б. Вариант с применением метансульфонилхлорида.
Раствор 1,98 г 5-метилгексилового эфира, трет-бутилового эфира (2S, 4S)-2-трет-бутоксикарбониламино-4-[4-метокси-3-(4-метоксибутил)бензил]карбоновой кислоты (1) в 20 мл сухого толуола обрабатывают 0,044 г диметиламинопиридина и 0,55 г триэтиламина и охлаждают до 0°С. По каплям добавляют метансульфонил (0,43 г), реакционную смесь нагревают до комнатной температуры и перемешивают в течение 30 ч. Смесь разбавляют 20 мл воды и органический слой отделяют, промывают 20 мл насыщенного водного раствора бикарбоната натрия, а затем органическую фазу дважды промывают 20 мл воды, растворитель удаляют в вакууме, получая продукт в виде масла. Хроматография на силикагеле, элюирование смесью гептан/этилацетат дает 1,64 г соединения (3) в виде масла с отрицательным значением [a]d (измерен: - 39,1) при с=1, CHCl3.
В. Вариант с применением трифенилфосфин/йода.
Раствор 1,48 г 5-метилгексилового эфира, трет-бутилового эфира (2S, 4S)-2-трет-бутоксикарбониламино-4-[4-метокси-3-(4-метоксибутил)бензил]карбоновой кислоты (1) в 15 мл смеси сухой толуол/ацетонитрил (в соотношении 85:15) обрабатывают 0,58 г имидазола при комнатной температуре, добавляют трифенилфосфин (1,14 г), а затем вносят по каплям раствор 1,11 г йода в 15 мл смеси толуол/ацетонитрил (в соотношении 85:15) в течение 15 мин. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч и гасят добавлением 20 мл 5%-ного водного раствора тиосульфата натрия. Органическую фазу отделяют и дважды промывают 20 мл рассола. Растворитель удаляют в вакууме, а образовавшееся масло хроматографируют на силикагеле, получая, например, 1,24 г соединения (3) в виде масла.
Г. Вариант с применением ионообменной смолы.
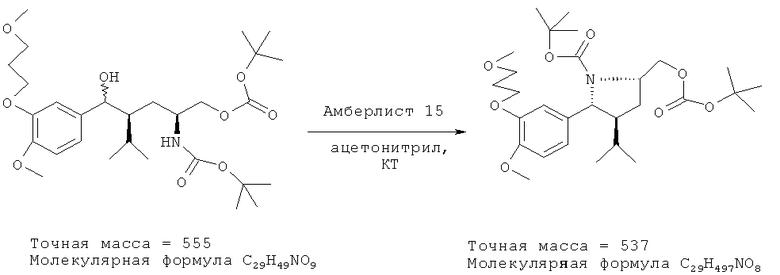
45,70 г 5-метилгексилового эфира, трет-бутилового эфира (2S, 4S)-2-трет-бутоксикарбониламино-4-[4-метокси-3-(4-метоксибутил)бензил]карбоновой кислоты (1) (ВЭЖХ: чистота 95,0% по площади, 78,1 ммоль) растворяют при комнатной температуре в 390 мл ацетонитрила. В раствор вносят 11,6 г (55,0 мэкв.) Амберлиста 15 (фирма Fluka 06423, 4,7 мэкв./г). Образовавшуюся смесь перемешивают при комнатной температуре в течение 5 ч. Следующее за этим фильтрование и выпаривание фильтрата при температуре 50°С и давлении 20 мбар приводит к остатку в виде прозрачного бесцветного масла. Чистота продукта составляет по данным ВЭЖХ 97,2% по площади.
Исходное соединение (1) может быть получено согласно следующему методу.
Получение соединения (1) восстановлением соответствующего арилкетона с помощью LiBH4
В трехгорлой колбе объемом 350 мл растворяют 34,5 г (62,3 ммоль) бис-Бок-арилкетона в 400 мл этанола и 3,5 мл воды. К этому раствору через капельную воронку добавляют раствор 40,7 г LiBH4 в 32 мл ТГФ в течение 15 мин при комнатной температуре. Остатки вещества в капельной воронке смывают 8 мл тетрагидрофурана и реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем вносят дополнительное количество 13,6 г LiBH4 в смеси 10 мл ТГФ и 1 мл воды. Реакционную смесь нагревают при температуре 40°С в течение 2 ч, а затем охлаждают до 0°С. Реакцию останавливают добавлением 125 мл уксусной кислоты, после чего реакционную смесь экстрагируют 500 мл воды и 500 мл ТБМЭ. Органическую фазу высушивают над сульфатом натрия и выпаривают в вакууме, получая очень вязкое масло, которое состоит из смеси эпимерных бензиловых спиртов (в соотношении 8:1).
II. Синтез трет-бутилового эфира (2R, 3S, 5S)-5-гидроксиметил-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (6):
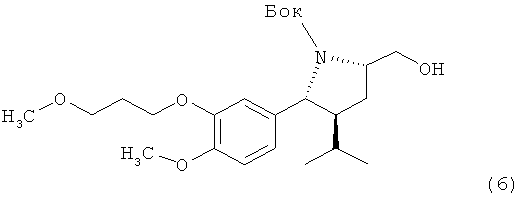
Раствор 2,52 г пирролидина (3) в 2,5 мл метанола обрабатывают 3,87 г карбоната калия, суспензию нагревают до температуры 45°С и перемешивают при этой температуре в течение 4 ч. Реакционную смесь разбавляют затем 60 мл трет-бутилметилового эфира и 20 мл воды и экстрагируют трет-бутилметиловым эфиром. Органический слой отделяют, а водный раствор промывают 40 мл трет-бутилметилового эфира. Объединенные органические фазы дважды промывают 20 мл воды и растворитель удаляют в вакууме, получая спирт (6) в виде масла. Отрицательное значение [а]d найдено при с=1, CHCl3.
1Н-ЯМР (d6-ДМСО/D2O, 300 К) 6,90-6,80 (3Н), 4,03-3,90 (3Н), 3,80 (1Н), 3,75 (3Н), 3,55-3,45 (3H), 3,23 (3H), 3,05 (1Н), 2,00-1,80 (3H), 1,65 (1Н), 1,40 (9Н), 1,20 (1Н), 0,74 (6Н).
Альтернативный путь синтеза трет-бутилового эфира (2R, 3S, 5S)-5-гидроксиметил-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (6):
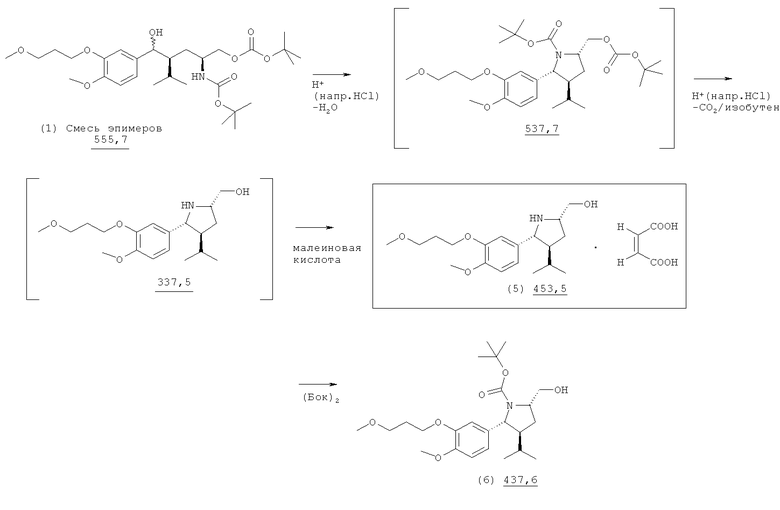
Синтез {(2S, 4S, 5R)-4-Изопропил-5-[4-метокси-3-(3-метоксипропокси)фенил]-пирролидин-2-ил}метанол(Z)-бут-2-ендионовой кислоты 1/соль (6).
К раствору 5,56 г 5-метилгексилового эфира, трет-бутилового эфира (2S, 4S)-2-трет-бутоксикарбониламино-4-[4-метокси-3-(4-метоксибутил)бензил]карбоновой кислоты (1) в 28 мл абсолютного этанола добавляют 2,5 мл 37%-ного водного раствора хлористоводородной кислоты (или эквивалентное количество 2-молярного раствора хлористоводородной кислоты в этаноле) при температуре от 0 до 5°С. После перемешивания в течение 1 ч при температуре 0-5°С реакционную смесь постепенно нагревают при температуре 78-80°С в течение 1 ч. Перемешивание при нагревании с обратным холодильником продолжают в течение 2-4 ч до завершения реакции. Реакционную смесь охлаждают до комнатной температуры и добавляют 18 мл воды. Органический растворитель (этанол) удаляют в вакууме, а оставшийся водный концентрат экстрагируют 12 мл изопропилацетата. Водный слой отделяют и после добавления 30 мл изопропилацетата медленно вносят приблизительно 3,2 мл 30%-ного водного раствора гидроксида натрия при температуре от 0 до 5°С при энергичном перемешивании до тех пор, пока величина рН не достигнет 11-12. Органический слой отделяют и концентрируют до остаточного объема приблизительно 25 мл (удаление воды посредством азеотропной перегонки).
Раствор 1,16 г малеиновой кислоты в 12 мл изопропанола добавляют к концентрату промежуточного соединения (5) в форме свободного основания в изопропилацетате при температуре 40°С. Кристаллизацию малеата соединения (5) инициируют внесением затравки при температуре 40°С и завершают при охлаждении суспензии до температуры от 0 до 5°С. Кристаллы малеат 1/1 соль соединения (5) отделяют фильтрованием, промывают 16 мл смеси изопропилацетат/изопропанол в соотношении 3:1 (по объему) и высушивают в вакууме.
1Н-ЯМР (d6-ДМСО, 300 К): 7,2 (1Н), 6,9-7,1 (2Н), 6,0 (2Н), 5,3 (1Н), 4,1-4,2 (1H), 3,9-4,1 (2Н), 3,8 (1Н), 3,6-3,7 (3H), 3,4-3,5 (2Н), 3,3 (3H), 2,4-2,5 (1Н), 1,9-2,0 (3H), 1,8-1,9 (1Н), 1,6-1,7 (1Н), 0,8-0,9 (3H), 0,7-0,8 (3H).
Синтез трет-бутилового эфира (2R, 3S, 5S)-5-гидроксиметил-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (6).
2,27 г малеат 1/1 соль соединения (5) растворяют в смеси 10 мл метиленхлорида с 8 мл воды и при энергичном перемешивании добавляют 8 мл 2-молярного водного раствора гидроксида натрия при температуре от 0 до 5°С. Затем в течение 10 мин добавляют 1,14 г ди-трет-бутилдикарбоната в 10 мл метиленхлорида. После перемешивания в течение 15 мин при температуре от 0 до 5°С реакционную смесь медленно нагревают до комнатной температуры и перемешивают приблизительно в течение 0,5 ч.
Органическую фазу отделяют, промывают водой, высушивают над сульфатом натрия или посредством азеотропной перегонки и затем выпаривают в вакууме. Оставшееся сырое соединение (6) - или концентрат продукта в метиленхлориде - может быть непосредственно использовано в синтезе соединения (7) согласно патентному примеру, приведенному ниже.
III. Синтез трет-бутилового эфира (2R, 3S, 5S)-5-формил-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (7)
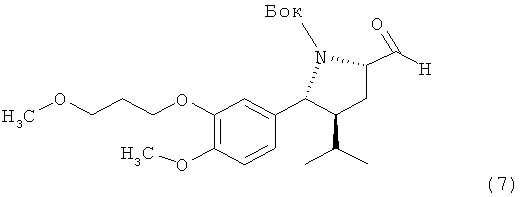
Использование SO3/пиридинового комплекса.
Раствор 4,7 г спирта(6) в 58 мл метиленхлорида обрабатывают 33 мл диметилсульфоксида и добавляют 5,67 г триэтиламина. Смесь охлаждают до 0°С и по каплям добавляют раствор 6,84 г SO3/пиридинового комплекса, растворенного в 46 мл диметилсульфоксида, в течение 20 мин. Реакционную смесь перемешивают затем при 0°С в течение 2 ч и гасят, добавляя 105 мл воды и 105 мл гептана. Органический слой отделяют и промывают 25 мл 10%-ного водного раствора гидросульфата натрия. Органическую фазу затем промывают 110 мл воды, а затем 25 мл насыщенного водного раствора гидрокарбоната натрия. В конце органическую фазу промывают водой до тех пор, пока величина рН водного раствора не достигнет 7. Растворитель затем удаляют, получая соединение (7) в виде масла. Отрицательное значение [а]d найдено при с=1, CHCl3.
1Н-ЯМР (d6-ДМСО, 300 К) 9,75 (1Н), 6,90-6,80 (3H), 4,63-4,30 (3H), 4,00 (2Н), 3,75 (3H), 3,50 (3H), 3,23 (3H), 2,10-1,90 (4Н), 1,85 (1Н), 1,60 (1Н), 1,05 (9Н), 0,85 (6Н).
Альтернативно к раствору 1,1 г спирта (6) в 10 мл дихлорметана добавляют 0,4 г пиридина, 1,1 г диизопропилэтиламина и 2,0 г диметилсульфоксида. Смесь охлаждают до температуры -5°С и четырьмя порциями с интервалами в два часа добавляют 0,6 г триоксид сера/пиридинового комплекса. Реакцию останавливают добавлением 2,5 мл воды и подкисляют внесением 1 мл 37%-ной хлористоводородной кислоты. Фазы разделяют, органическую фазу промывают 2,5 мл воды, высушивают над сульфатом натрия и удаляют растворитель в вакууме, получая 0,88 г альдегида (7) в виде масла.
Использование ТЕМПО (2,2,6,6-тетраметилпиперидиннитроксила).
Смесь 0,96 г спирта (6), 0,044 г гидрокарбоната натрия, 0,026 г бромида калия и 0,051 г ТЕМПО в 3 мл дихлорметана и 1,2 мл воды охлаждают до температуры 5°С. К смеси по каплям добавляют 0,13 г 10-13%-ного водного раствора гипохлорита натрия, смесь перемешивают в течение 5 ч в температурном интервале от 5°С до 20°С, а затем добавляют 0,57 г сульфата натрия. Фазы затем разделяют и органическую фазу дважды промывают 5 мл воды. Выпаривание растворителя в вакууме приводит к 0,50 г альдегида (7) в виде масла.
IV. Синтез трет-бутилового эфира (2R, 3S, 5S)-4-изопропил-5-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1,2-дикарбоновой кислоты (15):
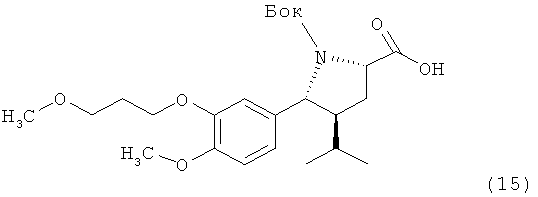
Раствор 1,7 г альдегида (7) в 15 мл трет-бутанола обрабатывают 3 мл 2-метил-2-бутена. По каплям прибавляют раствор 0,43 г хлорита натрия и 1,73 г дигидрофосфата натрия в 15 мл воды. Двухфазную смесь перемешивают в течение 90 мин при комнатной температуре и добавляют 15 мл толуола и 15 мл воды. Органический слой отделяют и промывают 20 мл воды. Растворитель удаляют в вакууме, получая кислоту (15) в виде прозрачного масла, которое медленно кристаллизуется.
1Н-ЯМР (d6-ДМСО, 354 К) 12,25 (1Н), 7,35 (1Н), 6,90 (1Н), 6,81 (1Н), 4,38 (1Н), 4,25 (1Н), 4,00 (2Н), 3,75 (3H), 3,45 (2Н), 3,23 (3H), 2,15-1,85 (4Н), 1,65 (1Н), 1,25 (9Н), 0,85 (6Н).
V. Синтез трет-бутилового эфира (2R, 3S, 5S)-5-((1S, 3S)-3-бензилоксиметил-1-гидрокси-4-метил-пентил)-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (8):
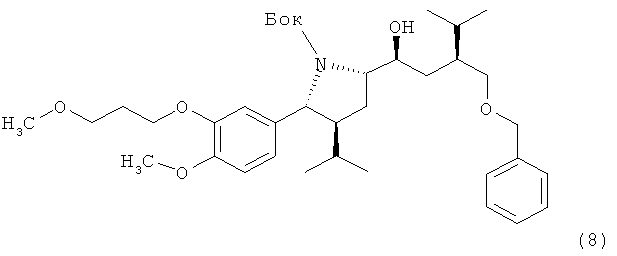
Раствор 1,98 г альдегида (7) в 15 мл тетрагидрофурана охлаждают до 10°С и обрабатывают реактивом Гриньяра, полученным реакцией 1,23 г ((S)-2-бромметил-3-метилбутоксиметил)бензола и 0,12 г магния в диэтиловом эфире, содержащем 0,043 г 1,2-дибромэтана, при температуре 45°С. Реакционную смесь перемешивают в течение 90 мин при комнатной температуре, затем добавляют 20 мл 25%-ного водного раствора хлористого аммония, а затем добавляют 20 мл трет-бутилметилового эфира. Органическую фазу отделяют, дважды промывают 20 мл воды, а затем концентрируют в вакууме, получая сырой спирт (8) в виде масла. Очистка на силикагеле дает 0,97 г чистого соединения (8). Отрицательное значение [а]d найдено при с=1, CHCl3.
М++Н=628, M++H+Na=650.
Альтернативно раствор 27 г альдегида (7) в 30 мл тетрагидрофурана добавляют при комнатной температуре к реактиву Гриняра, полученному при нагревании с обратным холодильником 20 г ((S)-2-хлорметил-3-метилбутоксиметил)бензола с 3,2 г магния в 120 мл тетрагидрофурана, содержащего 1,3 г 1,2-дибромэтана, в течение 4 ч. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре, а затем добавляют 100 мл 2-нормального водного раствора серной кислоты. Смесь перемешивают до растворения избытка магния, затем фазы разделяют и органическую фазу промывают 50 мл 12%-ного водного раствора хлорида натрия. Органическую фазу концентрируют в вакууме, получая 42,6 г сырого спирта (8) в виде масла.
VI. Синтез трет-бутилового эфира (2R, 3S, 5S)-5-((1S, 3S)-1-гидроксиметил-3-гидроксиметил-4-метилпентил)-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (9):
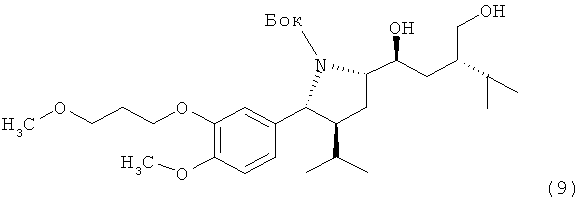
Раствор 0,48 г соединения (8) в 1,5 мл метанола обрабатывают 0,1 г 10%-ного палладия на активированном угле. Суспензию перемешивают в атмосфере водорода до окончания поглощения водорода. Суспензию фильтруют, и твердое вещество промывают метанолом двумя порциями по 5 мл. Удаление растворителя в вакууме дает спирт (9) в виде масла. Отрицательное значение [a]d (например, -34,1, -34,6) найдено при с=1, CHCl3.
VIa. Синтез трет-бутилового эфира ((1S, 2S, 4S)-2-гидрокси-4-гидроксиметил-1-{(S)-2-[4-метокси-3-(3-метоксипропокси)бензил]-3-метилбутил}-5-метилгексил)карбаминовой кислоты (9а):
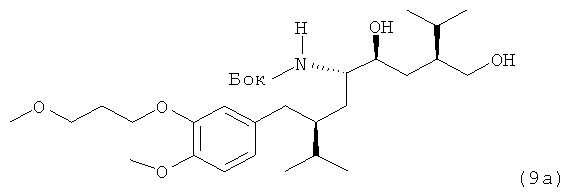
а) Раствор 1 г пирролидина (8) в 17 мл ТГФ охлаждают до температуры -78°С, после чего конденсируют в реакционную колбу 17 мл аммиака. К смеси добавляют 0,44 г натрия и образовавшуюся темно-окрашенную массу перемешивают в течение ночи при температуре -78°С, а затем к ней добавляют 2,6 г хлористого аммония. Смесь оставляют самопроизвольно нагреваться до комнатной температуры (аммиак выпаривают, а непрореагировавший натрий растворяют), после чего прибавляют 40 мл толуола и 1,9 г уксусной кислоты. Через 10 мин добавляют 25 мл воды и фазы разделяют. Водную фазу снова экстрагируют 25 мл толуола, затем объединенные органические фазы четыре раза промывают раствором вода-рассол (в соотношении 1:1), а затем высушивают над сульфатом натрия и выпаривают в вакууме. Очистка сырого масляного продукта (0,86 г) на силикагеле, элюирование смесью этилацетат/гептан приводит к 0,71 г чистого соединения (9а).
1Н-ЯМР (CDCl3, 300 К): 6,8 (2Н), 6,7 (1Н), 4,7 (1Н), 4,1 (2Н), 3,8 (3H), 3,5-3,7 (5Н), 3,4-3,5 (1Н), 3,4 (3H), 2,7-2,8 (1Н), 2,4-2,5 (3H), 2,0-2,2 (2Н), 1,5-1,8 (8Н), 1,4 (9Н), 0,8-0,9 (12Н).
б) Раствор 1,0 г пирролидина (8) в 2,5 мл тетрагидрофурана вносят в смесь 0,37 г натрия в 5 мл аммиака и 2,5 мл тетрагидрофурана при температуре -50°С. Смесь перемешивают в течение 3 ч, а затем добавляют 2,56 г хлористого аммония и оставляют смесь самопроизвольно нагреваться до комнатной температуры. К смеси прибавляют затем 40 мл толуола, 1,9 г уксусной кислоты и 25 мл воды. Фазы разделяют и водную фазу вновь экстрагируют 25 мл толуола. Объединенные органические фазы затем промывают (четыре раза по 120 мл) смесью вода-рассол (в соотношении 1:1), высушивают над сульфатом натрия и растворитель удаляют в вакууме, получая 0,76 г продукта (9а) в виде масла.
VII. Синтез трет-бутилового эфира (2R, 3S, 5S)-5-((2S, 4S)-5-гидрокси-4-изопропилтетрагидрофуран-2-ил)-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (10):
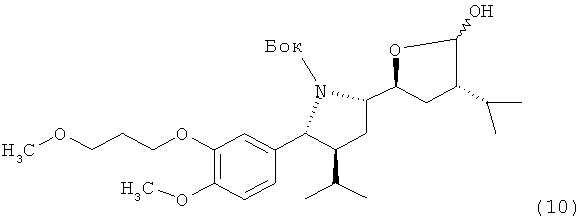
Вариант с применением комплекса SO3/пиридин.
Раствор 0,20 г спирта (9) в 5 мл метиленхлорида обрабатывают 3 мл диметилсульфоксида и 0,2 г триэтиламина при 0°С, а затем добавляют по каплям раствор 0,24 г SO3/пиридинового комплекса в 4 мл диметилсульфоксида в течение 15 мин при температуре 0°С. Реакционную смесь перемешивают в течение 40 мин при температуре 0°С, а затем нагревают до комнатной температуры и дополнительно перемешивают в течение 2 ч. После этого добавляют воду (10 мл) и гептан (15 мл) и образовавшуюся смесь экстрагируют. Органическую фазу промывают 15 мл 10%-ного водного раствора гидросульфата натрия, а затем водой (15 мл) и 10%-ным водным раствором бикарбоната натрия. Органическую фазу удаляют в вакууме, получая 0,18 г лактола (10) M++=536.
VIII. Синтез трет-бутилового эфира (2R, 3S, 5S)-3-изопропил-5-((2S, 4S)-4-изопропил-5-оксотетрагидрофуран-2-ил)-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (II):
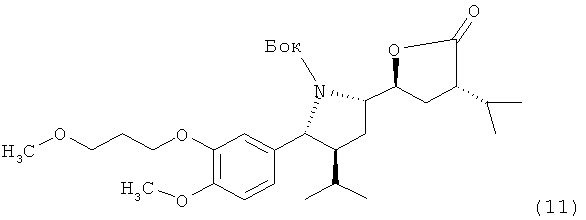
Раствор 0,16 г спирта (9) в 3 мл метиленхлорида обрабатывают 0,005 г TEMPO, затем порциями добавляют 0,20 г диацетоксийодбензола. Смесь перемешивают в течение 5 ч при комнатной температуре, после чего обнаруживают только лактол (10). Затем добавляют следующую порцию 0,20 г диацетоксийодбензола и реакционную смесь перемешивают в течение дополнительных 24 ч при комнатной температуре. После добавления водного раствора тиосульфата натрия (5 мл 10%-ный раствор) и воды (5 мл) фазы разделяют. Органическую фазу промывают 10 мл воды, а растворитель удаляют в вакууме, получая масло. Хроматография на силикагеле дает 0,12 г соединения (11), [α]D=+28,3°C (1%, CHCl3), т.пл. 70-71,5°С.
1Н-ЯМР (CDCl3, 300 К): 6,6-6,8 (3H), 4,3-4,4 (2Н), 4,0-4,1 (2Н), 3,7-3,8 (4Н), 3,5-3,6 (2Н), 3,3 (3H), 2,5-2,6 (2Н), 2,3-2,4 (1Н), 2,0-2,2 (5H), 1,4-1,7 (4Н), 1,4 (9Н), 1,0 (3H), 0,9 (3H), 0,8 (6Н).
Альтернативно, 76 мг лактола (10) растворяют в 2 мл ацетонитрила и добавляют 80 мг молекулярного сита. К образовавшейся суспензии добавляют раствор 21 мг N-оксида N-метилморфолина и 2,5 мг тетра-N-пропиламмоний перрутената в 1 мл ацетонитрила. После перемешивания в течение 2 ч при комнатной температуре реакция завершается. Растворитель выпаривают в вакууме, остаток растворяют в этилацетате и фильтруют через короткий слой силикагеля. Фильтрат выпаривают в вакууме, получая 77 мг соединения (11).
Альтернативно к раствору 0,68 г спирта (9а) в 18 мл ацетонитрила, содержащему 0,7 г измельченного молекулярного сита (4Å), прибавляют 0,59 г N-оксида N-метилморфолина и 44 мг тетрапропиламмоний перрутената, а затем смесь перемешивают в течение ночи. После удаления растворителя в вакууме, остаток переносят в этилацетат, фильтруют через силикагель, промывают этилацетатом и растворитель снова удаляют в вакууме. Очистка сырого масляного продукта (0,72 г) на силикагеле, элюирование смесью этилацетат/гептан, дает 0,57 г чистого лактона (11).
IX. Синтез трет-бутилового эфира (2R, 3S, 5S)-5-[(1S, 3S)-3-(2-карбамоил-2-метилпропилкарбамоил)-1-гидрокси-4-метилпентил]-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты (12):
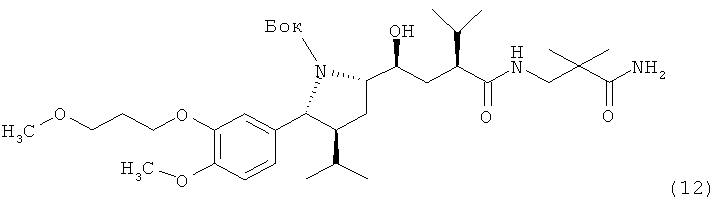
Раствор 0,08 г лактона (11), 0,052 г 3-амино-2,2-диметилпропионамида и 0,014 г 2-гидроксипиридина в 0,3 мл трет-бутилметилового эфира, содержащего 0,02 г триэтиламина, перемешивают в течение 18 ч при температуре 83°С. Реакционную смесь охлаждают затем до комнатной температуры, разбавляют 2 мл толуола и промывают 2 мл 10%-ного водного раствора гидросульфата натрия. Органическую фазу отделяют, промывают водой, растворитель удаляют в вакууме, получая масло. Это масло суспендируют в 5 мл гексана при перемешивании. Твердое вещество удаляют посредством фильтрования, а гексан удаляют в вакууме, получая 0,06 г амида (12) в виде пены.
М+-Н=648.
X. Синтез трет-бутилового эфира ((1S, 2S, 4S)-4-(2-карбамоил-2-метилпропилкарбамоил)-2-гидрокси-1-{(S)-2-[4-метокси-3-(3-метоксипропокси)бензил]-3-метилбутил}-5-метилгексил)карбаминовой кислоты (13):
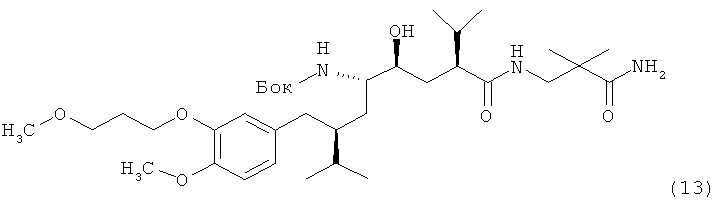
Раствор 0,037 г амида (12) растворяют в 1 мл тетрагидрофурана и охлаждают до температуры -78°С. Добавляют жидкий аммиак, а затем 0,0042 г металлического лития. Раствор, имеющий темно-голубую окраску, перемешивают в течение 2 ч при температуре -78°С, а затем добавляют 0,35 г этанола, смесь перемешивают в течение 30 мин при температуре -78°С, добавляют хлорид аммония (0,15 г), после чего смесь нагревают до комнатной температуры. Органическую фазу разделяют между водой и этилацетатом, отделяют ее и растворитель удаляют в вакууме. Остаток перемешивают с гептаном и отфильтровывают. Продукт (13) после удаления гептана идентифицируют с аутентичным образцом. М++Н=652.
XI. (2S, 4S, 5S, 7S)-5-Амино-N-(2-карбамоил-2-метилпропил)-4-гидрокси-2-изопропил-7-[4-метокси-3-(3-метоксипропокси)бензил]-8-метилнонанамид)
Продукт (13) растворяют в смеси 4-молярного раствора хлористоводородной кислоты в диоксане. Раствор перемешивают в течение 24 ч при комнатной температуре и нейтрализуют твердым гидрокарбонатом натрия. Суспензию отфильтровывают, растворитель удаляют в вакууме, получая продукт в виде пены (для характеристики см., например, ЕР 0678503, пример 137).
Из свободного соединения или полученной хлористоводородной соли может быть получена гемифумаратовая соль названного в заголовке соединения, например, как описано в US 6730798, пример J1 (включая смешивание с фумаровой кислотой, растворение в этаноле, фильтрование, выпаривание полученного раствора, повторное растворение остатка в ацетонитриле, затравка с помощью небольшого количества хемифумаратовой соли названного в заголовке соединения и выделение осажденного вещества), включенного посредством ссылок, особенно относительно реакции образования этой соли, в настоящее описание.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИНТЕЗ ИНГИБИТОРОВ РЕНИНА С ИСПОЛЬЗОВАНИЕМ РЕАКЦИИ ЦИКЛОПРИСОЕДИНЕНИЯ | 2006 |
|
RU2423348C2 |
| РАСКРЫТИЕ ЦИКЛОВ ЛАКТОНОВ И ЛАКТАМОВ | 2010 |
|
RU2550691C2 |
| 3,5-ЗАМЕЩЕННЫЕ ПИПЕРИДИНЫ, КАК ИНГИБИТОРЫ РЕНИНА | 2006 |
|
RU2415840C2 |
| НОВЫЕ N-СУЛЬФАМОИЛПИПЕРИДИНАМИДЫ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ОЖИРЕНИЯ И РОДСТВЕННЫХ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ | 2006 |
|
RU2442773C2 |
| ПРОИЗВОДНЫЕ АЛКИЛАМИНОТИАЗОЛА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2005 |
|
RU2401262C2 |
| АЛЬТЕРНАТИВНЫЕ СПОСОБЫ СИНТЕЗА ИНГИБИТОРОВ РЕНИНА И ИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2005 |
|
RU2411230C2 |
| ЦИКЛИЧЕСКИЕ И ГЕТЕРОЦИКЛИЧЕСКИЕ N-ЗАМЕЩЕННЫЕ α-ИМИНОГИДРОКСАМОВЫЕ И КАРБОНОВЫЕ КИСЛОТЫ | 1996 |
|
RU2164914C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5-ГИДРОКСИ-БЕНЗО[B]ТИОФЕН-3-КАРБОНОВОЙ КИСЛОТЫ (ВАРИАНТЫ) И ПРОИЗВОДНЫЕ БЕНЗО[B]ТИОФЕНОВОЙ КИСЛОТЫ | 1999 |
|
RU2186065C1 |
| ГИДРОКСИЭТИЛАМИНОСУЛЬФОНАМИДЫ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ РЕТРОВИРУСНЫХ ПРОТЕАЗ, СПОСОБ ЛЕЧЕНИЯ РЕТРОВИРУСНЫХ ИНФЕКЦИЙ, СПОСОБ ЛЕЧЕНИЯ СПИДА | 1993 |
|
RU2173680C2 |
| ПРОИЗВОДНЫЕ МОЧЕВИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ БЕЛКА, СВЯЗЫВАЮЩЕГО ЖИРНЫЕ КИСЛОТЫ | 2014 |
|
RU2642454C2 |
Настоящее изобретение относится к новому способу, новым стадиям способа и новым промежуточным соединениям для синтеза фармацевтически активных соединениий, в частности ингибиторов ренина, таких как алискирен. Изобретение, в частности, относится к способу получения соединения формулы III,
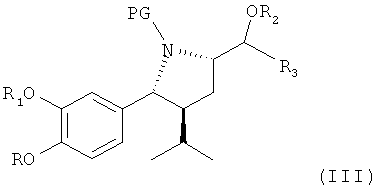 ,
,
где R, R1, R2, R3 и PG определены в описании, или его соли, заключающемуся в реакции соединения формулы I
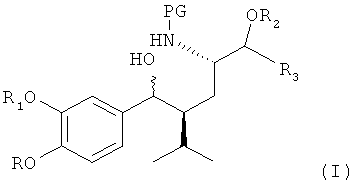 ,
,
с реагентом, выбранным, например, из группы, включающей галоидоводородную кислоту, тионилгалогенид, РХ*3, РОХ*3, РХ*5, РОХ*5, где X* обозначает галоген, комбинацию трифенилфосфина и галогена и активное производное органической сульфоновой кислоты. 52 н. и 11 з.п. ф-лы.
1. Способ получения соединения формулы III
 ,
,
где
R обозначает водород, алкил или алкоксиалкил;
R1 обозначает водород, алкил или алкоксиалкил;
R2 обозначает водород или предпочтительно защитную группу для гидроксила;
R3 обозначает водород или незамещенный или замещенный алкил; и
PG обозначает защитную группу для аминогруппы, в частности группу, удаляемую гидролизом, например, низшую алкоксикарбонильную группу, такую, как трет-бутоксикарбонил или бензилоксикарбонил;
или его соли;
заключающийся в том, что соединение формулы I
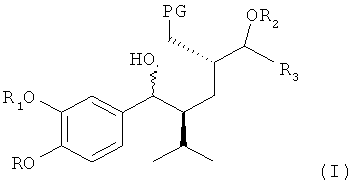 ,
,
где R, R1, R2, R3 и PG являются такими, как определено для соединения формулы III, вводят в реакцию с реагентом, способным превратить гидроксигруппу в формуле I в X, где Х обозначает группу, отличную от гидроксигруппы или водорода, в частности уходящую группу, в частности, с реагентом, выбранным из группы, включающей галоидоводородную кислоту, тионилгалогенид, РХ*3, РОХ*3, РХ*5, РОХ*5, где X* обозначает галоген, комбинацию трифенилфосфина и галогена и активное производное органической сульфоновой кислоты.
2. Способ по п.1, где в соединениях формулы III и соединениях формулы I
R1 обозначает С1-7алкокси-С1-7алкил, в частности 3-метоксипропил;
R обозначает С1-7алкоксигруппу, в частности метоксигруппу; и
R3 обозначает водород, при этом оставшиеся фрагменты определены в п.1 или 2.
3. Соединение формулы III по п.1, где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности, 3-метоксипропил;
R2 обозначает водород или предпочтительно защитную группу для гидроксила;
R3 обозначает водород или незамещенный или замещенный алкил; и
PG обозначает защитную группу для аминогруппы, в частности, защитную группу, удаляемую посредством гидролиза, например, низший алкоксикарбонил, такой, как третбутоксикарбонил;
или его соль.
4. Соединение формулы III по п.3, а именно, третбутиловый эфир (IS,3S,5S)-5-трет-бутоксикарбонилоксиметил-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты или его соль.
5. Способ получения соединения формулы IV
 ,
,
где R, R1, R3 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в удалении защитной группы R2 у гидроксила в соединении формулы III или его соли.
6. Соединение формулы IV
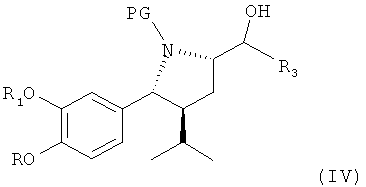 ,
,
где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности, 3-метоксипропил;
R3 обозначает водород или незамещенный или замещенный алкил; и
PG обозначает защитную группу для аминогруппы, в частности защитную группу, удаляемую посредством гидролиза, например, низший алкоксикарбонил такой, как третбутоксикарбонил;
или его соль.
7. Соединение формулы IV по п.5, а именно, третбутиловый эфир (2R,3S,5S)-5-гидроксиметил-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты или его соль.
8. Способ получения соединения формулы IVa
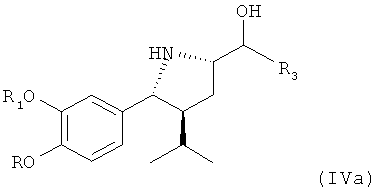 ,
,
где
R обозначает водород, алкил или алкоксиалкил;
R1 обозначает водород, алкил или алкоксиалкил;
R3 обозначает водород или незамещенный или замещенный алкил; и PG обозначает защитную группу для аминогруппы, в частности защитную группу, удаляемую посредством гидролиза, например, низший алкоксикарбонил такой, как третбутоксикарбонил или бензилоксикарбонил;
или его соли;
заключающийся в удалении защитных групп R2 и PG в соединении формулы I, определенном в п.1, или его соли и образовании пирролидинового кольца.
9. Способ получения соединения формулы IV
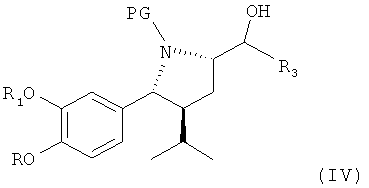 ,
,
где R обозначает водород, алкил или алкоксиалкил;
R1 обозначает водород, алкил или алкоксиалкил;
R3 обозначает водород или незамещенный или замещенный алкил; и PG обозначает защитную группу для аминогруппы, в частности защитную группу, удаляемую посредством гидролиза, например, низший алкоксикарбонил такой, как третбутоксикарбонил или бензилоксикарбонил;
или его соли,
заключающийся в защите атома азота пирролидина с помощью защитной группы PG в соединении формулы (IVa) или его соли

где R, R1 и R3 являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4.
10. Способ получения оксосоединения PG О формулы V
 ,
,
где R, R1, R3 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в окислении соединения формулы IV или его соли, по одному из пп.5-7 или 9;
где в случае, когда R3 в соединении формулы IV обозначает водород, окисление проводят непосредственно до оксосоединения формулы V, или сначала окисляют до кислоты формулы XVI
 ,
,
где R, R1 и PG являются такими, как определено выше для соединения формулы V или его соли, которое затем восстанавливают до соответствующего альдегида формулы V, где R3 обозначает водород, а другие фрагменты определены выше.
11. Соединение формулы XVI, показанной в п.10, где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности 3-метоксипропил; и
PG обозначает защитную группу для аминогруппы, в частности, защитную группу, удаляемую посредством гидролиза, например, низший алкоксикарбонил, такой, как третбутоксикарбонил;
или его соль.
12. Соединение формулы XVI по п.11, а именно, 1-третбутиловый эфир (2R,3S,5S)-4-изопропил-5-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1,2-дикарбоновой кислоты или его соль.
13. Соединение формулы V по п.10, где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности 3-метоксипропил;
R3 обозначает водород или незамещенный или замещенный алкил; и PG обозначает защитную группу для аминогруппы, в частности защитную группу, удаляемую посредством гидролиза, например, низший алкоксикарбонил, такой, как третбутоксикарбонил;
или его соль.
14. Соединение формулы V по п.13, а именно, третбутиловый эфир (2R,3S,5S)-5-формил-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты или его соль.
15. Способ получения соединения формулы VII
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, и РТ обозначает защитную группу для гидроксила, заключающийся в том, что соединение формулы V по п.10, где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности, 3-метоксипропил;
R3 обозначает водород; и
PG обозначает защитную группу для аминогруппы, в частности защитную группу, удаляемую путем гидролиза, например, низший алкоксикарбонил, такой, как третбутоксикарбонил; или его соль в условиях реакции Гриньяра или условиях, подобных реакции Гриньяра, вводят в реакцию с реагентом, полученным реакцией соединения формулы VI
 ,
,
где Hal обозначает галогруппу, предпочтительно хлор, бром или йод, и РТ обозначает защитную группу для гидроксильной группы, с металлом.
16. Соединение формулы VII по п.15, где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности, 3-метоксипропил;
R3 обозначает водород; и
PG обозначает защитную группу для аминогруппы, в частности защитную группу, удаляемую путем гидролиза, например, низший алкоксикарбонил, такой, как третбутоксикарбонил;
или его соль.
17. Соединение формулы VII по п.16, а именно, третбутиловый эфир (2R,3S,5S)-5-((1S,3S)-3-бензилоксиметил-1-гидрокси-4-метилпентил)-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты или его соль.
18. Способ получения соединения формулы VIII
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в снятии защиты в соединении формулы VII по одному из пп.15-17 путем удаления защитной группы РТ для гидроксильной группы.
19. Соединение формулы VIII по п.18 или его соль, где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности, 3-метоксипропил; и
PG обозначает защитную группу для аминогруппы, или его соль.
20. Соединение формулы VIII по п.19, а именно, третбутиловый эфир (2R,3S,5S)-5-((1S,3S)-1-гидроксиметил-3-гидроксиметил-4-метилпентил)-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты или его соль.
21. Способ получения лактола формулы Х
 ,
,
где R1, R и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в том, что соединение формулы VIII или его соль по одному из пп.18-20 окисляют по первичной гидроксильной группе до альдегида формулы IX
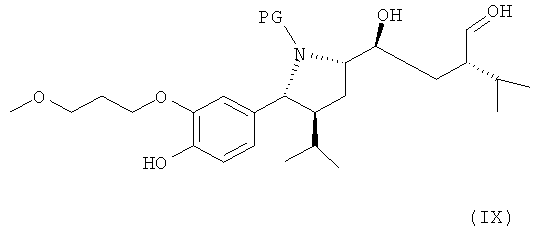 ,
,
где R, R1 и PG определены выше для формулы X, или его соли, которое затем самопроизвольно циклизуется с образованием лактола формулы Х или его соли.
22. Лактол формулы X, указанной в п.21, или его фармацевтически приемлемая соль, где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности, 3-метоксипропил; и
PG обозначает защитную группу для аминогруппы, или его соль.
23. Лактол формулы Х по п.22, а именно, третбутиловый эфир (2R,3S,5S)-5-((2S,4S)-5-гидрокси-4-изопропилтетрагидрофуран-2-ил)-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты или его соль.
24. Альдегид соединения формулы IX по п.21 или его фармацевтически приемлемая соль, где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности 3-метоксипропил; и PG обозначает защитную группу для аминогруппы, или его соль.
25. Альдегид соединения формулы IX по п.24, а именно, третбутиловый эфир (2R,3S,5S)-5-((1S,3S)-3-формил-1-гидрокси-4-метилпентил)-2-[4-гидрокси-3-(3-метоксипропокси)фенил]-3-изопропилпирролидин-1-карбоновой кислоты или его соль.
26. Способ получения лактона формулы XI
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, заключающийся в окислении согласно п.21 соединения формулы Х по одному из пп.21 или 23 в соединение формулы XI, или его соль.
27. Соединение формулы XI, указанной в п.26, где R обозначает водород, алкил или алкоксиалкил, предпочтительно С1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности, 3-метоксипропил; и PG обозначает защитную группу для аминогруппы, или его соль.
28. Соединение формулы XI по п.27, а именно, третбутиловый эфир (2R,3S,5S)-3-изопропил-5-((2S,4S)-4-изопропил-5-оксотетрагидрофуран-2-ил)-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты или его соль.
29. Способ получения соединения формулы XIII
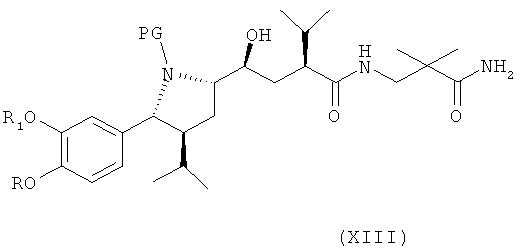 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, заключающийся в том, что соединения формулы XI по одному из пп.26-28 или его соль, вводят в реакцию с амином формулы XII
 ,
,
где атом азота амидогруппы, при необходимости, может быть также защищен, и защитную группу затем удаляют из соответствующего защищенного соединения формулы XIII), или его соли.
30. Соединение формулы XIII, указанной в п.29, где R обозначает водород, алкил или алкоксиалкил, предпочтительно С1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности, 3-метоксипропил; и PG обозначает защитную группу для аминогруппы, или его соль.
31. Соединение формулы XIII по п.30, а именно, третбутиловый эфир (2R,3S,5S)-5-[(1S,3S)-3-(2-карбамоил-2-метилпропилкарбамоил)-1-гидрокси-4-метилпентил]-3-изопропил-2-[4-метокси-3-(3-метоксипропокси)фенил]пирролидин-1-карбоновой кислоты или его соль.
32. Способ получения соединения формулы XIV
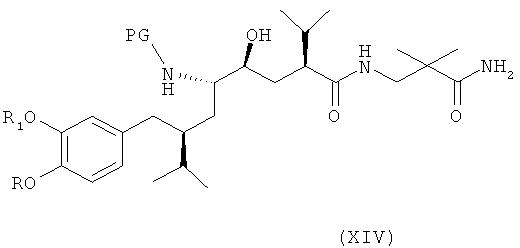 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в раскрытии кольца в соединении формулы XIII по одному из пп.29-31 посредством реакции восстановления или гидрогенолиза с получением соединения формулы XIV или его соли; и, при необходимости, превращения полученного свободного соединения формулы XIV в соль или полученной соли в свободное соединение формулы XIV или его другую соль.
33. Способ получения соединения ОН формулы XV
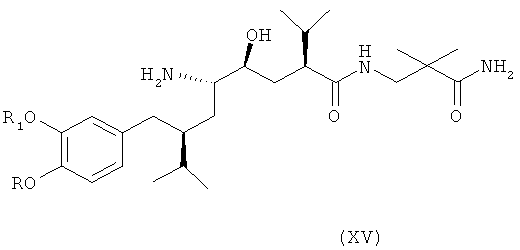 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в раскрытии кольца в соединении формулы XIII по одному из пп.29-31 посредством реакции восстановления или гидрогенолиза с получением соединения формулы XIV или его соли и удалении защитной группы PG; и, при необходимости, превращении полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
34. Способ получения соединения формулы XV, показанной в п.33, где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3, заключающийся в осуществлении одной или более, например всех, стадий:
(i) получение соединения формулы III по одному из пп.1-3 или его соли, получение соединения формулы IV по п.5 или его соли, или
(ii) получение соединения формулы IVa по п.8 или его соли, получение соединения формулы IV по п.9 или его соли, получение соединения формулы V по п.10, или его соли, при условии, что в исходных веществах и промежуточных соединениях формул III и IV R3 обозначает водород, получение соединения формулы VII по п.15 или его соли, получение соединения формулы VIII по п.18 или его соли, получение лактола формулы IX по п.21 или его соли, получение лактона формулы Х по п.26 или его соли, получение соединения формулы XIII по п.29 или его соли, получение соединения формулы XIV по п.32 или его соли и снятие с него защиты по п.33 с получением соединения формулы XV или его соли, и, при необходимости, превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
35. Способ по п.34, где соединением формулы XV является (2S,4S,5S,7S)-5-амино-N-(2-карбамоил-2-метилпропил)-4-гидрокси-2-изопропил-7-[4-метокси-3-(3-метоксипропокси)бензил]-8-метилнонанамид или его фармацевтически приемлемая соль, заключающийся в применении исходных веществ и промежуточных соединений с соответствующими заместителями.
36. Способ получения соединения формулы XVI
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в том, что соединение формулы IV
 ,
,
где
R обозначает водород, алкил или алкоксиалкил, предпочтительно C1-7алкоксигруппу, в частности метоксигруппу;
R1 обозначает водород, алкил или алкоксиалкил, С1-7алкокси-С1-7алкил, в частности, 3-метоксипропил;
R3 обозначает водород; и
PG обозначает защитную группу для аминогруппы, в частности защитную группу, удаляемую путем гидролиза, например, низший алкоксикарбонил такой, как третбутоксикарбонил; или его соль вводят в реакцию с окислителем с получением соединения формулы XVI или его соли.
37. Способ получения соединения формулы XVII
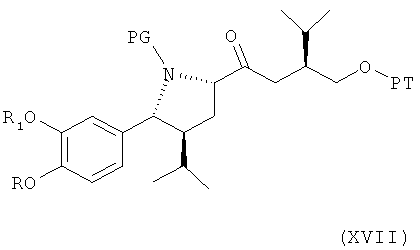 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в том, что соединение формулы XVI
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль сначала вводят в реакцию с реагентом, способным активизировать карбоксильную группу, а затем с металлоорганическим производным формулы VI
 ,
,
где Hal обозначает галогруппу, предпочтительно хлор, бром или йод, и РТ обозначает защитную группу для гидроксила.
38. Соединение формулы XVII
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, и РТ обозначает защитную группу для гидроксила, или его соль.
39. Способ получения соединения формулы VIII
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в том, что соединение формулы XVII по п.38 или его соль восстанавливают в стереоселективных условиях и (частично) снимают защиту в полученном соединении путем удаления защищающей гидроксил группы РТ.
40. Способ получения соединения формулы XV
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в осуществлении одной или более, например всех, стадий:
(i) получение соединения формулы III по одному из пп.1-3 или его соли, получение соединения формулы IV по п.5 или его соли, или
(ii) получение соединения формулы IVa по п.8 или его соли, получение соединения формулы IV по п.9 или его соли, получение соединения формулы XVI по п.36 или его соли, при условии, что в исходных веществах и промежуточных соединениях формул III и IV R3 обозначает водород, получение соединения формулы XVII по п.37 или его соли, получение соединения формулы VIII по п.39 или его соли, получение лактола формулы Х по п.21 или его соли, получение лактона формулы Х по п.26 или его соли, получение соединения формулы XIII по п.29 или его соли, получение соединения формулы XIV по п.32 или его соли и снятие с него защиты по п.33 с получением соединения формулы XV или его соли, и, при необходимости, превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
41. Способ получения соединения формулы XVIII
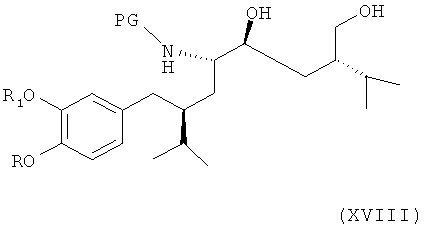 ,
,
где R, R1 и PG являются такими, как определено для соединений формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в том, что в соединении формулы VIII
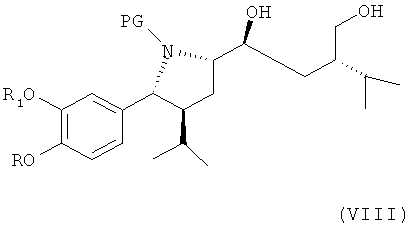 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли осуществляют раскрытие пирролидинового кольца посредством реакции восстановления или гидрогенолиза.
42. Соединение формулы XVIII
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль.
43. Способ получения соединения формулы XIX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в том, что соединение формулы XVIII
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль окисляют в лактол формулы XIX или его соль.
44. Лактол формулы XIX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль.
45. Способ получения лактона формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в том, что лактол формулы XIX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль окисляют до соединения формулы XX или его соли.
46. Способ получения соединения формулы XV
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в осуществлении одной или более, например всех, стадий:
(i) получение соединения формулы III по одному из пп.1-3 или его соли, получение соединения формулы IV по п.5 или его соли, или
(ii) получение соединения формулы IVa по п.8 или его соли, получение соединения формулы IV по п.9 или его соли, и затем
а) получение соединения формулы V или его соли по п.10, получение соединения формулы VII или его соли по п.15, и получение соединения формулы VIII или его соли,
б) получение соединения формулы XVI по п.36 или его соли при условии, что в исходных веществах и промежуточных соединениях формул III и IV R3 обозначает водород, получение соединения формулы XVII по п.37 или его соли, и получение соединения формулы VIII по п.39,
с последующим получением из соединения формулы VIII или его соли, полученного согласно варианту а) или варианту б), соединения формулы XVIII или его соли по п.41, получение соединения формулы XIX или его соли по п.43, получение соединения формулы XX или его соли по п.45, получение соединения формулы XIV
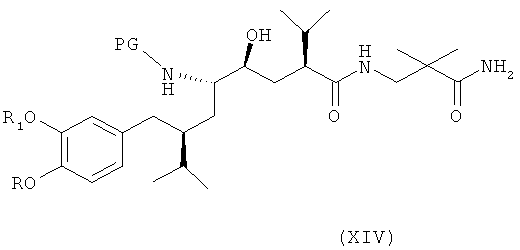 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, при котором соединение формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль вводят в реакцию с соединением формулы XII
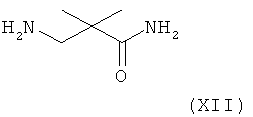 ,
,
или его солью и
снятие с него защиты согласно п.33 с получением соединения формулы XV или его соли и, при необходимости, превращение соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
47. Способ получения соединения формулы XXI
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, и РТ обозначает защитную группу для гидроксильной группы, или его соли, заключающийся в раскрытия кольца с помощью реакции восстановления или гидрогенолиза в соединении формулы VII
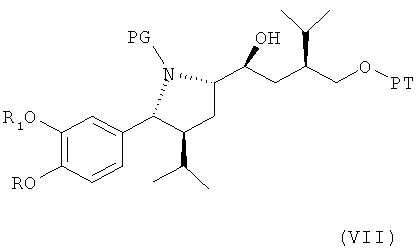 ,
,
где R, R1 и PG являются такими, как определено выше для соединения формулы XXI и РТ обозначает защитную группу для гидроксильной группы.
48. Соединение формулы XXI
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы I в одном из пп.1-3 или в п.4, и РТ обозначает защитную группу для гидроксильной группы, или его соль, или предпочтительно, где PG обозначает бензилоксикарбонил и РТ обозначает бензил, или где PG обозначает водород и РТ обозначает бензил, и R и R1 являются такими, как определено для соединения формулы I в одном из пп.1-3 или в п.4, или его соль, соответственно.
49. Способ получения соединения формулы XV
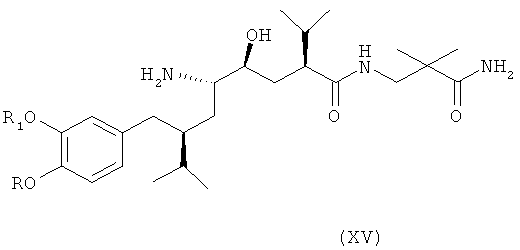 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в осуществлении одной или более, например, всех стадий:
(i) получение соединения формулы III по одному из пп.1-3 или его соли, получение соединения формулы IV по п.5 или его соли, или
(ii) получение соединения формулы IVa по п.8 или его соли, получение соединения формулы IV по п.9 или его соли, получение соединения формулы V или его соли по п.10, получение соединения формулы VII по п.15 или его соли, получение соединения формулы XXI или его соли по п.48, получение соединения формулы XVIII или его соли путем удаления защитной для гидроксила группы РТ, получение соединения формулы XIX или его соли по п.43, получение соединения формулы XX или его соли по п.45, получение соединения формулы XIV
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, при котором соединение формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль вводят в реакцию с соединением формулы XII
 ,
,
или его солью,
и снятие с него защиты по п.33 с получением соединения формулы XV или его соли и, при необходимости, превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
50. Способ получения соединения формулы XIX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в раскрытии кольца с помощью реакции восстановления или гидрогенолиза в соединении формулы Х или его соли
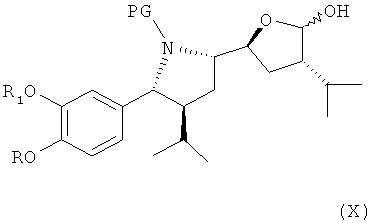 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4.
51. Способ получения соединения формулы XV
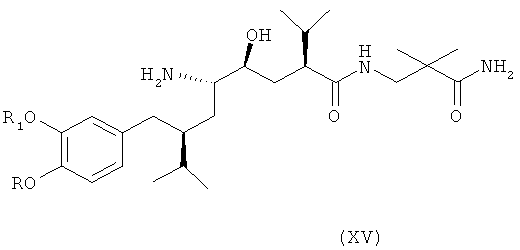 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в осуществлении одной или более, например, всех стадий:
(i) получение соединения формулы III по одному из пп.1-3 или его соли, получение соединения формулы IV по п.5 или его соли, или
(ii) получение соединения формулы IVa по п.8 или его соли, получение соединения формулы IV по п.9 или его соли, получение соединения формулы V или его соли по п.10, получение соединения формулы VII или его соли по п.15, получение соединения формулы VIII или его соли по п.18, получение соединения формулы Х или его соли по п.21, получение соединения формулы XIX или его соли по п.50, получение соединения формулы XX или его соли по п.45, получение соединения формулы XIV
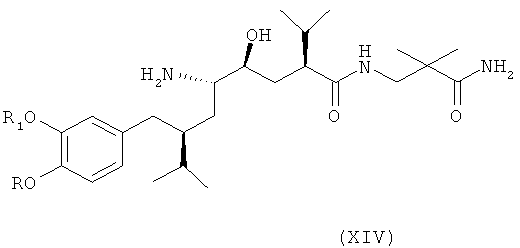 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, при котором соединение формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль вводят в реакцию с соединением формулы XII
 ,
,
или его солью,
и снятие с него защиты по п.33 с получением соединения формулы XV или его соли, и, при необходимости, превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
52. Способ получения соединения формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в раскрытии кольца посредством реакции восстановления или гидрогенолиза в соединении формулы XI или его соли
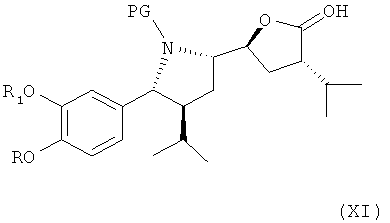 ,
,
где в формулах XX и XI R, R1 и PG обозначены по определению для соединения формулы III по одному из пп.1-3 или по п.4.
53. Способ получения соединения формулы XV
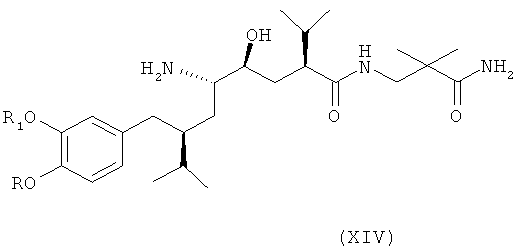 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в осуществлении одной или более, например, всех стадий:
(i) получение соединения формулы III по одному из пп.1-3 или его соли, получение соединения формулы IV по п.5 или его соли, или
(ii) получение соединения формулы IVa по п.8 или его соли, получение соединения формулы IV по п.9 или его соли, получение соединения формулы V или его соли по п.10, получение соединения формулы VII или его соли по п.15, получение соединения формулы VIII или его соли по п.18, получение соединения формулы Х или его соли по п.21, получение соединения формулы XI или его соли по п.26, получение соединения формулы XX или его соли по п.52, получение соединения формулы XIV
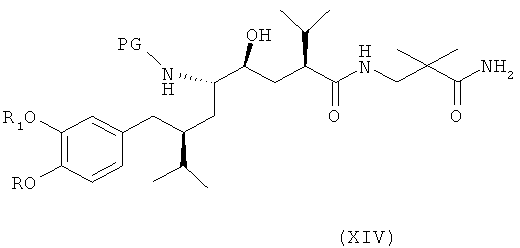 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, при котором соединение формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль вводят в реакцию с соединением формулы XII
 ,
,
или его солью,
и снятие с него защиты согласно п.33 с получением соединения формулы XV или его соли, и, при необходимости, превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
54. Способ получения соединения формулы XXIII
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, и Rx обозначает гидроксигруппу, защищенную гидроксигруппу, аминогруппу или NH-CH2C(CH3)2-CONH2, и его соли, заключающийся в том, что соединение формулы V или его соль
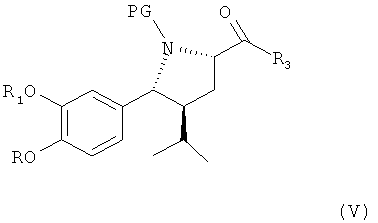 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из вышеуказанных пунктов, и R3 обозначает водород, вводят в реакцию с соединением формулы XXII
 ,
,
где Y обозначает Ph3P+ или (AlkO)2P(O), где Alk обозначает алкил, например, C1-7алкил, и Rx обозначает гидроксигруппу, защищенную гидроксигруппу, аминогруппу или NH-CH2C(CH3)2-CONH2.
55. Соединение формулы XXIII
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, и Rx обозначает гидроксигруппу, защищенную гидроксигруппу, аминогруппу или NH-CH2C(CH3)2-CONH2, или его соль.
56. Способ получения соединения формулы XXIV
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, и Rx обозначает гидроксигруппу, защищенную гидроксигруппу, аминогруппу или NH-СН2С(СН3)2-CONH2, или его соли, заключающийся в расщеплении кольца посредством реакции восстановления или гидрогенолиза в соединении формулы XXIII по п.55 или его соли.
57. Соединение формулы XXIV
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, и Rx обозначает гидроксигруппу, защищенную гидроксигруппу, аминогруппу или NH-CH2C(CH3)2-CONH2, или его соль.
58. Способ получения соединения формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в расщеплении кольца в соединении формулы XXIV
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, и Rx обозначает гидроксигруппу, защищенную гидроксигруппу, аминогруппу или NH-CH2C(CH3)2-CONH2.
59. Способ получения соединения формулы XV
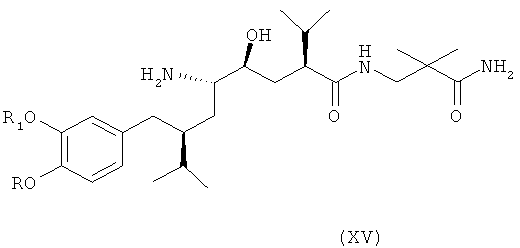 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в осуществлении одной или более, например, всех стадий:
(i) получение соединения формулы III по одному из пп.1-3 или его соли, получение соединения формулы IV по п.5 или его соли, или
(ii) получение соединения формулы IVa по п.8 или его соли, получение соединения формулы IV по п.9 или его соли, получение соединения формулы V или его соли по п.10, получение соединения формулы XXIII или его соли по п.54, получение соединения формулы XXIV или его соли по п.56, получение соединения формулы XX или его соли по п.58, получение соединения формулы XIV
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, при котором соединение формулы XX
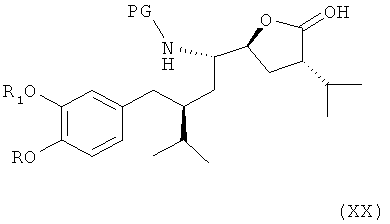 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль вводят в реакцию с соединением формулы XII
 ,
,
или его солью,
и снятие с него защиты согласно п.33 с получением соединения формулы XV или его соли, и, при необходимости, превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
60. Способ получения соединения формулы XVIII
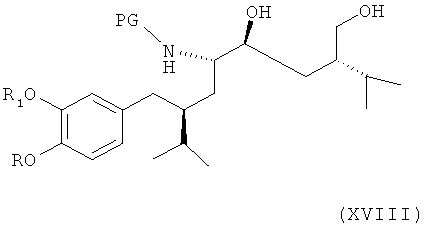 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в расщеплении пирролидинового кольца посредством реакции восстановления или гидрогенолиза в соединении формулы VII или его соли
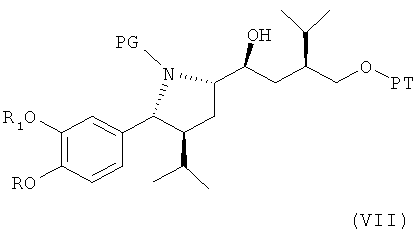 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, и РТ обозначает защитную группу для гидроксильной группы.
61. Способ получения соединения формулы XV
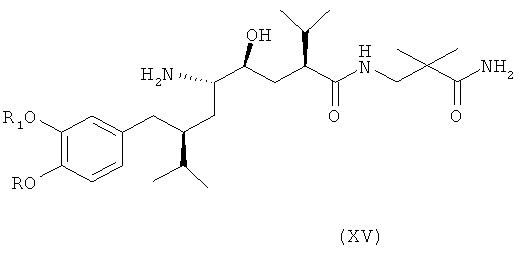 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в осуществлении одной или более, например, всех стадий:
(i) получение соединения формулы III по одному из пп.1-3 или его соли, получение соединения формулы IV по п.5 или его соли, или
(ii) получение соединения формулы IVa по п.8 или его соли, получение соединения формулы IV по п.9 или его соли, получение соединения формулы V или его соли по п.10, получение соединения формулы VII или его соли по п.15, получение соединения формулы XVIII или его соли по п.60, получение соединения формулы XIX или его соли по п.43, получение соединения формулы XX или его соли по п.45, получение соединения формулы XIV
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, при котором соединение формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль вводят в реакцию с соединением формулы XII
 ,
,
или его солью,
и снятие с него защиты согласно п.33 с получением соединения формулы XV или его соли, и, при необходимости, превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
62. Способ получения лактона формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в окислении соединения формулы XVIII
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, в лактон формулы XX или его соль.
63. Способ получения соединения формулы XV
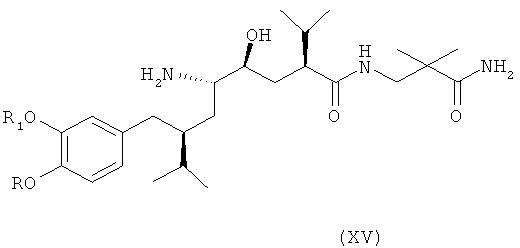 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, заключающийся в осуществлении одной или более, например, всех стадий:
(i) получение соединения формулы III по одному из пп.1-3 или его соли, получение соединения формулы IV по п.5 или его соли, или (ii) получение соединения формулы IVa по п.8 или его соли, получение соединения формулы IV по п.9 или его соли, получение соединения формулы V или его соли по п.10, получение соединения формулы VII или его соли по п.15, получение соединения формулы XVIII или его соли по п.60, получение соединения формулы XX или его соли по п.62, получение соединения формулы XIV
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соли, при котором соединение формулы XX
 ,
,
где R, R1 и PG являются такими, как определено для соединения формулы III в одном из пп.1-3 или в п.4, или его соль вводят в реакцию с соединением формулы XII
 ,
,
или его солью,
и снятие с него защиты согласно п.33 с получением соединения формулы XV или его соли, и, при необходимости, превращение полученного свободного соединения формулы XV в соль или полученной соли в свободное соединение формулы XV или его другую соль.
| ЕР 1215201 А2 (SPEEDEL PHARMA AG) 19.06.2002 | |||
| Устройство для генерации звука | 1977 |
|
SU678503A1 |
| DONDONI A | |||
| et al | |||
| Облицовка комнатных печей | 1918 |
|
SU100A1 |
| Tetrahedron Letters, vol.42, no.29, 4819-4823, 16.07.2001 | |||
| НИТРАТ АСЕ-ИНГИБИТОРА | 1998 |
|
RU2194037C2 |
Авторы
Даты
2011-05-20—Публикация
2006-06-06—Подача