Изобретение относится к соединениям общей формулы
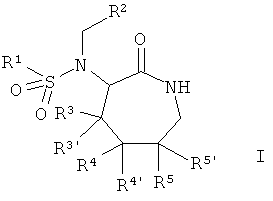
где
R1 представляет собой низший алкил, замещенный галогеном, либо представляет собой арил или гетероарил, незамещенный или замещенный галогеном;
R2 представляет собой гетероциклоалкил, арил или гетероарил, которые являются незамещенными или замещенными одним или более чем одним заместителем, выбранным из группы, состоящей из галогена, низшего алкилокси, низшего алкила, замещенного галогеном, O-низшего алкила, замещенного галогеном, либо замещены группой C(O)-NR''2, (CR2)m-C(O)-R', гетероарилом или S(O)2-низшим алкилом;
R3/R3', R4/R4' и R5/R5' представляют собой независимо друг от друга атом водорода или фтора, где по меньшей мере один из R4/R4' или R5/R5' всегда представляет собой фтор;
R' представляет собой арил или гидрокси;
R'' представляет собой атом водорода, циклоалкил или представляет собой гетероциклоалкил;
R представляет собой атом водорода или низший алкил;
m равно 0, 1, 2 или 3;
и к их фармацевтически приемлемым солям присоединения кислоты, оптически чистым энантиомерам, рацематам или дистереомерным смесям.
Как используют здесь, термин "низший алкил" означает насыщенную прямоцепочечную или разветвленную группу, содержащую от 1 до 7 атомов углерода, например: метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
Термин "низший алкокси" означает группу, где алкильный остаток является таким, как определено выше, и который присоединен через атом кислорода.
Термин "галоген" означает хлор, йод, фтор и бром.
Термин "арил" означает одновалентный циклический ароматический углеводородный радикал, состоящий из одного кольца или из большего числа конденсированных колец, в которых по меньшей мере одно кольцо является ароматическим по природе, например фенил или нафтил. Предпочтительной арильной группой является фенил.
Термин "гетероарил" означает одновалентный ароматический карбоциклический радикал, содержащий по меньшей мере один гетероатом, выбранный из группы, состоящей из N, О или S, например: пиридил, пиразинил, пиримидинил, пиридазинил, триазинил, тиазолил, тиенил, фурил, пирролил, имидазолил, пиразолил, изотиазолил, тетразолил, [1,2,4]триазолил, [1,2,4]оксадиазолил, оксазолил или изоксазолил. Предпочтительными гетероарильными группами являются пиридил, тиенил, триазинил, фурил или тиазолил.
Термин "гетероциклоалкил" означает неароматический углеводородный радикал, содержащий по меньшей мере один гетероатом, выбранный из группы, состоящей из N, О или S, например: оксетанил, тетрагидрофуранил, тетрагидропиранил, азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил или тиоморфолинил. Предпочтительными гетероциклоалкильными группами являются морфолинил, пиперидинил или пирролидинил.
Термин "циклоалкил" означает насыщенное карбоциклическое кольцо, содержащее 3-7 атомов углерода.
Термин "фармацевтически приемлемые соли присоединения кислоты" охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, пара-толуолсульфоновая кислота и тому подобное.
Обнаружено, что соединения общей формулы I являются ингибиторами γ-секретазы, и соответствующие соединения могут быть полезны при лечении болезни Альцгеймера или распространенных видов рака, включая, но не ограничиваясь ими, карциномы шейки матки и карциномы молочной железы, а также злокачественные опухоли кроветворной системы.
Болезнь Альцгеймера (БА) является наиболее распространенным случаем деменции в пожилом возрасте. Патологически БА характеризуется отложением в головном мозге амилоида во внеклеточных бляшках и внутриклеточных нейрофибриллярных клубках. Амилоидные бляшки главным образом состоят из амилоидных пептидов (А-бета пептидов), которые образуются из β-амилоидного белка-предшественника (АРР) путем серии стадий протеолитического расщепления. Идентифицировано несколько форм АРР, из которых наиболее распространенными являются белки длиной 695, 751 и 770 аминокислот. Они все имеют происхождение от одного гена посредством дифференциального сплайсинга. А-бета пептиды имеют происхождение от одного и того же домена АРР, но отличаются по своим N- и С-концам, основные виды которых имеют длину 40 и 42 аминокислоты.
А-бета пептиды продуцируются из АРР посредством последовательного действия двух протеолитических ферментов, называемых β- и γ-секретазой. Сначала β-секретаза расщепляет во внеклеточном домене АРР непосредственно снаружи от трансмембранного домена (ТМ) с образованием С-концевого фрагмента АРР, содержащего ТМ и цитоплазматический домен (CTFβ). CTFβ является субстратом для γ-секретазы, которая расщепляет при нескольких соседних положениях внутри ТМ с образованием Аβ пептидов и цитоплазматического фрагмента. Большинство А-бета пептидов имеют длину 40 аминокислот (Аβ40), минорные виды несут две дополнительные аминокислоты на своем С-конце. Предполагают, что последние амилоидные пептиды в большей степени патогенны.
β-Секретаза представляет собой типичную аспартилпротеазу. γ-Секретаза представляет собой протеолитическую активность, состоящую из нескольких белков, и ее точный состав не полностью понятен. Однако пресенилины являются существенными компонентами этой активности и могут представлять собой новую группу нетипичных аспартилпротеаз, которые расщепляют внутри ТМ их субстратов, и которые сами по себе являются политопическими мембранными белками. Другими существенными компонентами γ-секретазы могут быть пресенилин, никастрин и продукты генов aph1 и pen-2. Доказанными субстратами для γ-секретазы являются АРР и белки семейства рецепторов Notch, однако γ-секретаза обладает свободной субстратной специфичностью и может расщеплять дополнительные мембранные белки, не родственные АРР и Notch. Было продемонстрировано генетическими методами, то есть удалением либо генов пресенилина 1 и 2, либо гена никастрина, что γ-секретаза абсолютно необходима для передачи сигнала Notch. Это было впоследствии подтверждено обработкой специфичными ингибиторами γ-секретазы.
Рецепторы Notch не только являются существенными в эмбриональном развитии, но также играют критическую роль в нескольких тканях взрослого организма, которые продолжают претерпевать пролиферацию и дифференциацию, например кроветворных клетках и эпителии кишечника и кожи. Передача сигнала рецепторами Notch происходит посредством упорядоченной последовательности событий: связывание с лигандом группы Delta или Jagged, расщепление внеклеточного домена протеазой ADAM (TACE) и последующее расщепление γ-секретазой внутри трансмембранного домена Notch. Последнее расщепление приводит в результате к высвобождению цитоплазматического домена, который затем перемещается в ядро, где действует с другими белками в качестве регулятора специфичной группы генов.
Роль Notch в онкогенезе человека наиболее четко установлена для острого Т-клеточного лимфобластного лейкоза (Т-ОЛЛ). В некоторых редких случаях Т-ОЛЛ показана хромосомная транслокация (7:9), которая приводит к конститутивной активации Notch1. Недавно сообщили, что примерно в 50% всех случаев Т-ОЛЛ существует точечная мутация в рецепторе Notch1, которая также вызывает гиперактивацию. Было показано, что рост некоторых клеточных линий, полученных от таких лейкозов, был чувствителен к обработке ингибиторами γ-секретазы, что подтверждает ее существенную роль для передачи сигнала Notch1.
Более обширная роль Notch в онкогенезе обсуждается в нескольких недавних статьях, в которых описано, что его передача сигнала необходима для поддержания неопластического фенотипа в ras-трансформированных клетках. Нарушение регуляции биохимического пути передачи сигнала ras обнаружено при ряде распространенных видов рака, включая карциномы шейки матки и карциномы молочной железы.
Активность γ-секретазы абсолютно необходима для продуцирования А-бета пептидов. Это показано как генетическими методами, то есть удалением генов пресенилина, так и с помощью низкомолекулярных ингибиторных соединений. Поскольку согласно амилоидной гипотезе БА продуцирование и отложение А-бета является конечной причиной заболевания, считают, что избирательные и эффективные ингибиторы γ-секретазы полезны для предупреждения и лечения БА.
Таким образом, соединения по данному изобретению должны быть полезны при лечении БА или распространенных видов рака посредством блокирования активности γ-секретазы и уменьшения или предотвращения образования различных амилоидогенных А-бета пептидов и, кроме того, посредством блокирования биохимических путем передачи сигнала Notch они могут препятствовать патогенезу рака.
В различных документах описаны современные знания по ингибированию γ-секретазы, например, в приведенных ниже публикациях:
The EMBO Journal (2204), 23, 483-488,
Biochemistry (2004), 43 (30), 9774-9789,
Nature Reviews/Neuroscience, Vol.3, April 2002/281,
Biochemical Society Transactions (2002), Vol.30, part 4,
Current Topics in Medicinal Chemistry, 2002, 2, 371-383,
Current Medicinal Chemistry, 2002, Vol.9, No. 11, 1087-1106,
Drug Development Research, 56, 211-227, 2002,
Drug Discovery Today, Vol.6, No. 9, May 2001, 459-462,
FEBS Letters, 483, (2000), 6-10,
Science, Vol.297, 353-356, July 2002,
Journ. of Medicinal Chemistry, Vol.44, No. 13, 2001, 2039-2060,
Nature Cell Biology 2, 461-462, 2000,
Nature 398, 518-522, 1999,
Nature Cell Biology 3, 1129-1132, 2001,
PNAS98, 7487-7491, 2001,
Cancer Cell 1, 75-87, 2002,
Science 306, 269-271, 2004,
Mol Cell Biol 23, 655-664, 2003,
Nature Medicine 8, 979-986, 2002 и
Oncogene 22, 6598-6608, 2003.
Объектами настоящего изобретения являются соединения формулы I как таковые, применение соединений формулы I и их фармацевтически приемлемых солей для изготовления лекарств для лечения заболеваний, связанных с ингибированием γ-секретазы, их изготовление, лекарства на основе соединения в соответствии с изобретением и их изготовление, а также применение соединений формулы I при борьбе с болезнью Альцгеймера или с распространенными раками, включая, но не ограничиваясь ими, карциномы шейки матки и карциномы молочной железы, либо при их предупреждении.
Следующим объектом изобретения являются все формы оптически чистых энантиомеров, рацематы или диастереомерные смеси для соединений формулы I.
Наиболее предпочтительными соединениями формулы I являются соединения, где R4/R4' оба представляют собой фтор и R1 представляет собой фенил, замещенный галогеном.
Предпочтительными соединениями из этой группы, кроме того, являются соединения, где R2 представляет собой фенил, замещенный галогеном и/или C(O)-N(R'')2, например приведенные ниже соединения:
4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-N-циклопропилбензамид или
4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фтор-N-пирролидин-1-илбензамид.
Следующими предпочтительными соединениями из этой группы являются соединения, где R2 представляет собой фенил, замещенный галогеном и низшим алкокси, например соединение
4-хлор-N-(2,3-дифтор-4-метоксибензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид.
Предпочтительными соединениями из этой группы являются соединения, где R2 представляет собой фенил, замещенный галогеном и гетероарилом, например приведенное ниже соединение
4-хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-[2-фтор-4-(2Н-[1,2,4]триазол-3-ил)-бензил]-бензолсульфонамид.
Предпочтительными соединениями из этой группы, кроме того, являются соединения, где R2 представляет собой фенил, замещенный (CR2)mC(O)-R', например приведенные ниже соединения
3-(4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-пропионовая кислота или
3-(4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-3-метилмасляная кислота.
Предпочтительными соединениями, кроме того, являются соединения, где R1 представляет собой гетероарил, замещенный галогеном, либо R1 представляет собой низший алкил, замещенный галогеном.
Настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области техники, например, с помощью описанных ниже процессов, которые включают
а) взаимодействие соединения формулы

с соединением формулы

с получением соединения формулы

где R1, R2, R3/R3', R4/R4' и R5/R5' имеют такое значение, как описано выше, либо
б) взаимодействие соединения формулы

с соединением формулы

в присутствии основания или с соединением формулы

в присутствии Ph3P и DIAD
с получением соединения формулы

где R1, R2, R3/R3', R4/R4' и R5/R5' имеют такое значение, как описано выше, и если желательно, преобразование полученных соединений в фармацевтически приемлемые соли присоединения кислоты.
Подробные процессы для получения соединений формулы I описаны на схемах 1 и 2 и в Примерах 1-18. Исходные вещества формул VII, VIII, IX, Х и XI являются известными соединениями или могут быть получены способами, хорошо известными в данной области техники.
Использованы приведенные ниже сокращения:
DIAD - диэтилазодикарбоксилат
DMAP - 4-диметиламинопиридин
EDC - 1-этил-3-(3-диметиламинопропил)карбодиимид
TATU - 1,1,3,3-тетраметил-2-(1Н-1,2,3-триазоло[5,4-b]пиридин-1-ил)урония тетрафторборат
TPTU - O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N',N'-тетраметилурония тетрафторборат
DMB - 2,4-диметоксибензил
DAST - диэтиламиносеры трифторид
ДМФ - N,N-диметилформамид
Деоксофтор - [бис(2-метоксиэтил)амино]серы трифторид
Схема 1

где R1, R2, R3/R3', R4/R4' и R5/R5' имеют такое значение, как описано выше, и Ph3P представляет собой трифенилфосфин.
Аминоазепан-2-он формулы VII обрабатывают альдегидом и подходящим восстанавливающим реагентом, таким как триацетоксиборгидрид натрия или цианоборгидрид натрия, с получением аминного соединения формулы II. Раствор этого амина в дихлорметане можно подвергать взаимодействию с одним эквивалентом ароматического сульфонилхлорида в присутствии основания, такого как основание Хюнига или триэтиламин, и каталитического количества DMAP с получением после колоночной хроматографии чистого соединения формулы I. Альтернативно соединение формулы VII можно подвергать взаимодействию сначала с сульфонилхлоридом, приводящему в результате к сульфонамидным соединениям формулы IV, которые поддаются дальнейшему преобразованию с использованием, например, протокола Мицунобу, посредством которого спирт R2CH2OH, трифенилфосфин и диизопропил- или диэтилазодикарбоксилат подвергают взаимодействию при низкой температуре в инертной атмосфере в сухом растворителе, таком как тетрагидрофуран. Реакционной смеси дают нагреться, а затем перемешивают при комнатной температуре в течение нескольких часов с получением после колоночной хроматографии соединений формулы I. Промежуточные соединения формулы IV можно также использовать в реакции, где галогенид R2CH2hal подвергают взаимодействию в присутствии избытка карбоната калия, каталитического количества йодида калия в сухом растворителе ДМФ и при повышенной температуре. Затем реакционную смесь фильтруют, подкисляют и очищают, используя колоночную хроматографию, с получением соединений формулы I.
3-Аминоазепан-2-оны, замещенные атомом фтора в кольце, формулы VII могут быть получены различными способами, описанными в литературе, и конкретно одним из подходов, изображенным на схеме 2.

Амин формулы Х (который может быть получен путем взаимодействия замещенного бензальдегида с аллиламинами в восстанавливающих условиях) можно подвергать сочетанию с производным аминокислоты формулы XI, используя стандартные реагенты пептидного сочетания, такие как EDC или TATU, с получением при высоких выходах бис-аллиловых производных формулы XII. Метатезис замыкания цикла соединений формулы XII может быть достигнут с использованием катализаторов на основе рутения, таких как описаны Grubbs. Катализатор Grubbs 2-го поколения был более эффективен для получения соединений формулы XIII. Полученные в результате алкены формулы XIII могут быть окислены до 5,6-оксо-региоизомеров формулы XIV посредством палладиевых комплексов в окружающей среде, насыщенной кислородом. Региоизомерную смесь кетонов формулы XIV нелегко разделить с помощью хроматографии. Эта смесь может быть далее преобразована в парные дифторированные соединения формулы XV, используя коммерческие соединения, такие как DAST или деоксофтор. Соединения формулы XV могут быть адекватно разделены с помощью хроматографии на силикагеле. В результате удаления защитной группы в условиях ацидолиза получают 3-аминоазепан-2-оны, замещенные атомом фтора в кольце, формулы VII.
Подробное описание можно найти в Примерах А-К и 1-18.
Если соединения формулы I являются основными, они могут быть преобразованы в соответствующие соли присоединения кислоты.
Это преобразование осуществляют путем обработки по меньшей мере стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное, и органические кислоты, такие как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота и тому подобное. Типично свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и тому подобное, и добавляют кислоту в подобном растворителе. Температуру поддерживают между 0°С и 50°С. Полученная в результате соль спонтанно выпадает в осадок или может быть выведена из раствора менее полярным растворителем.
Соли присоединения кислоты соединений формулы I могут быть преобразованы в соответствующие свободные основания путем обработки по меньшей мере стехиометрическим количеством соответствующего основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
Соединения формулы I и их фармацевтически применимые соли присоединения кислоты обладают ценными фармакологическими свойствами. Конкретно, обнаружено, что соединения по настоящему изобретению могут ингибировать γ-секретазу.
Соединения были исследованы в соответствии с тестом, приведенным здесь ниже.
Описание анализа на γ-секретазу
Активность тестируемых соединений можно оценить в анализах, которые измеряют протеолитическое расщепление соответствующих субстратов активностью γ-секретазы. Эти анализы могут представлять собой клеточные анализы, где, например, субстрат γ-секретазы гибридизуют в его цитоплазматическом домене с фактором транскрипции. Клетки трансфицируют этим гибридным геном и геном-репортером, например, люциферазы светляка, экспрессия которого усиливается этим фактором транскрипции. Расщепление гибридного субстрата γ-секретазой должно приводить к экспрессии гена-репортера, мониторинг которой можно осуществлять в соответствующих анализах. Активность γ-секретазы можно также определить в бесклеточных анализах in vitro, где, например, клеточный лизат, содержащий γ-секретазный комплекс, инкубируют с подходящим субстратом, представляющим собой производное АРР, который расщепляется до А-бета пептидов. Количество продуцируемых пептидов можно определить с помощью специфичных анализов ЭЛАЙЗА. Клеточные линии нейронного происхождения секретируют А-бета пептиды, которые можно измерить специфичным анализом ЭЛАЙЗА. Обработка соединениями, которые ингибируют γ-секретазу, приводит к снижению секретируемых А-бета пептидов, обеспечивая, таким образом, измерение ингибирования.
В анализе активности γ-секретазы in vitro используют мембранную фракцию НЕК293 в качестве источника γ-секретазы и рекомбинантный субстрат АРР. Последний состоит из 100 С-концевых аминокислот человеческого АРР, которые гибридизуют с 6хгистидиновым "хвостом" для очистки, который экспрессируют в E.coli в регулируемом экспрессионном векторе, например pEt15. Этот рекомбинантный белок соответствует укороченному фрагменту АРР, который образуется в результате расщепления γ-секретазой внеклеточного домена, и который составляет субстрат γ-секретазы. Принцип этого анализа описан в Li Y. М. et al., PNAS 97 (11), 6138-6143 (2000). Клетки Hek293 механически разрушают, и микросомную фракцию выделяют с помощью дифференциального центрифугирования. Мембраны солюбилизируют в детергенте (0,25% CHAPSO) и инкубируют с АРР субстратом. А-бета пептиды, которые продуцируются в результате расщепления этого субстрата γ-секретазой, обнаруживают с помощью специфичных анализов ЭЛАЙЗА, как описано (Brockhaus M et al., Neuroreport 9 (7), 1481-1486 (1998)).
Предпочтительные соединения показывают IC50<10 нМ. В приведенном ниже перечне описаны некоторые данные по ингибированию γ-секретазы:


Соединения формулы I и фармацевтически приемлемые соли соединений формулы I можно применять в качестве лекарств, например, в форме фармацевтических препаратов. Эти фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток, покрытых оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Введение можно, однако, также осуществлять ректально, например, в форме суппозиториев, парентерально, например, в форме инъекционных растворов.
Соединения формулы I можно обрабатывать с фармацевтически инертными, неорганическими или органическими носителями для изготовления фармацевтических препаратов. Лактоза, кукурузный крахмал или его производные, тальк, стеариновые кислоты или их соли и тому подобное можно использовать, например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой, драже и твердых желатиновых капсул. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и тому подобное. В зависимости от природы активного вещества, однако, обычно не требуется никаких носителей в случае мягких желатиновых капсул. Подходящими носителями для изготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и тому подобное. Подходящими носителями для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полутвердые или жидкие полиолы и тому подобное.
Фармацевтические препараты могут, кроме того, содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для варьирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать еще другие терапевтически ценные вещества.
Лекарства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом настоящего изобретения, как и способ их изготовления, который включает приведение одного или более чем одного соединения формулы I и/или его фармацевтически приемлемых солей присоединения кислоты и, если желательно, одного или более чем одного другого терапевтически ценного вещества в форму галенова препарата для введения вместе с одним или более чем одним терапевтически инертным носителем.
В соответствии с изобретением соединения формулы I, а также их фармацевтически приемлемые соли полезны при борьбе с заболеваниями, при которых полезно ингибирование γ-секретазы, такими как болезнь Альцгеймера, или при их предупреждении.
Дозировка может варьировать в широких пределах, и ее, конечно, нужно регулировать по индивидуальным потребностям в каждом конкретном случае. В случае перорального введения дозировка для взрослых может варьировать от примерно 0,01 мг до примерно 1000 мг в сутки соединения общей формулы I или соответствующее количество его фармацевтически приемлемой соли. Суточную дозировку можно вводить в виде однократной дозы или в дробных дозах, и, кроме того, верхний предел может быть также превышен, когда это считают показанным.

Методика изготовления
1. Смешивают п.п.1, 2 и 3 в подходящем смесителе в течение 30 минут.
2. Добавляют п.п.4 и 5 и смешивают в течение 3 минут.
3. Заполняют в подходящую капсулу.
Пример А
4-Хлорметил-N-циклопропилбензамид

4-Хлорметилбензоилхлорид (2,82 г, 15 ммоль) и циклопропиламин (1,26 мл, 18 ммоль) подвергали взаимодействию в CH2Cl2 (30 мл) и в присутствии основания Хюнига (3,1 мл, 18 ммоль) в течение 1 ч. Образовался осадок, который повторно солюбилизировали добавлением этилацетата. Реакционную смесь промывали раствором 5% KHSO4/10% K2SO4, насыщенным раствором NaCl, и высушивали (Na2SO4). Органическую фазу фильтровали и концентрировали при пониженном давлении с получением полутвердого вещества, которое растирали в гексанах: твердое вещество 3,1 г (95%); 1Н ЯМР (CDCl3) δ 0.60-0.64 (m, 2H), 0.85-0,90 (m, 2H), 2.89-2.92 (m, 1Н), 4.60 (s, 2H), 6.20 (br, 1H), 7.44 (d, 2H), 7.71-7.74 (m, 2H); MS: m/e=210.2 (MH+)
Пример В
(6-Метоксипиридин-3-ил)-метанол
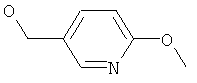
К алюмогидриду лития (0,68 г, 18 ммоль), суспендированному в сухом ТГФ (10 мл), добавляли по каплям раствор метил-6-метоксиникотината (1 г, 6 ммоль) в сухом ТГФ (5 мл). Реакционную смесь перемешивали в течение 2 ч при кт, затем охлаждали (ледяная баня) и гасили водой (2 мл) с последующим добавлением 1 н. NaOH (6 мл) и воды (2 мл). Охлаждающую баню удаляли, и смесь перемешивали в течение 30 мин при кт, фильтровали и концентрировали при пониженном давлении. Остаток разбавляли водой и экстрагировали этилацетатом (3х). Объединенные органические экстракты промывали водой, рассолом, высушивали (MgSO4), фильтровали и концентрировали при пониженном давлении с получением сырого масла, которое очищали на силикагеле (этилацетат/н-гептан 1:1): бесцветное масло 0,45 г (51%); 1H ЯМР (COCl3) δ 1.69 (t, 1H), 3.94 (s, 3Н), 4.62 (d, 2H), 6.75 (d, 1H), 7.62 (dd, 1H), 8.13 (d, 1H); MS: m/e=139,0 (M+)
Пример С
1-Бромметил-4-дифторметилбензол

К раствору 4-бромметилбензальдегида (1,0 г, 5,2 ммоль) в CH2Cl2 (60 мл) добавляли [бис(2-метоксиэтил)амино]серы трифторид (50% раствор в толуоле, 14 мл), и светло-желтую реакционную смесь перемешивали в течение 4 часов при 40°С в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении, и масляный остаток добавляли по каплям к охлажденному во льду раствору NaHCO3 (наполовину насыщенному, 50 мл). Полученную в результате смесь экстрагировали этилацетатом (3х), и объединенные органические экстракты промывали водным NaHCO3, рассолом, высушивали (MgSO4·2H2O), фильтровали и концентрировали при пониженном давлении с получением желтого масла: 1,03 г, 85%; MS: m/e=220,0 (M), 141,0 (M-Br); 1H ЯМР (400 МГц, CDCl3) δ млн-1 4.50 (s, 2H), 6.64 (t, JHF=51 Гц, 1Н), 7.49 (s, 4H).
Пример D
{(R)-1-[Аллил-(2,4-диметоксибензил)-карбамоил]-бут-3-енил}-карбаминовой кислоты трет-бутиловый эфир

(R)-N-Вос-аллилглицин (2,3 г, 9,9 ммоль) растворяли в диметилформамиде (20 мл) и активировали реагентом сочетания TATU (3,5 г, 10,9 ммоль) и основанием Хюнига (3,8 мл, 21,9 ммоль) в течение 2 мин. Аллил-(2,4-диметоксибензил)-амин (2,1 г, 9,9 ммоль), растворенный в диметилформамиде (20 мл), добавляли к охлажденной (баня лед-вода) реакционной смеси, и перемешивание продолжали в течение ночи. Растворитель выпаривали, и остаток растворяли в этилацетате, промывали насыщенным раствором NaHCO3, 1 М раствором KHSO4, рассолом, высушивали (MgSO4·2H2O), фильтровали и концентрировали при пониженном давлении и очищали на силикагеле (этилацетат/н-гептан 1:4): бесцветная смола 2,6 г (62%); MS: m/e=405,5 (MH+).
Пример Е
[(R)-1-(2,4-Диметоксибензил)-2-оксо-2,3,4,7-тетрагидро-1H-азепин-3-ил]-карбаминовой кислоты трет-бутиловый эфир

(R)-1-[Аллил-(2,4-диметоксибензил)-карбамоил]-бут-3-енил}-карбаминовой кислоты трет-бутиловый эфир (2,6 г, 6,4 ммоль) растворяли в CH2Cl2 (200 мл), добавляли катализатор [1,3-бис-(2,4,6-триметилфенил)-2-имидазолидинилиден]дихлор(фенилметилен)-(трициклогексилфосфин)рутений] Grubbs II (0,55 г, 0,64 ммоль), и реакционную смесь кипятили с обратным холодильником в течение 1,5 часов. Реакционную смесь концентрировали при пониженном давлении, растворяли в этилацетате и промывали раствором NaHCO3, 1 М раствором KHSO4, рассолом, высушивали (MgSO4·2H2O), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (этилацетат/н-гептан 1:4->1:2): темно-коричневое твердое вещество 1,93 г (80%); MS: m/e=377,4 (MH+), 277,3 (M-Boc).
Пример F
Смесь [(R)-1-(2,4-диметоксибензил)-2,6-диоксоазепан-3-ил]-карбаминовой кислоты трет-бутилового эфира; компаунд с [(R)-1-(2,4-диметоксибензил)-2,5-диоксоазепан-3-ил]-карбаминовой кислоты трет-бутиловым эфиром


[(R)-1-(2,4-Диметоксибензил)-2-оксо-2,3,4,7-тетрагидро-1H-азепин-3-ил]-карбаминовой кислоты трет-бутиловый эфир (5,4 г, 14,3 ммоль) растворяли в ДМФ/воде (10:1 об/об), а затем добавляли Pd(ll)Cl2 (1 г, 5,7 ммоль) и Cu(l)Cl (7,2 г, 72,4 ммоль). Реакционную смесь вакуумировали и насыщали О2, а затем нагревали при 50°С в течение 48 ч. Во время реакции использовали дополнительные добавления Pd(ll)Cl2 (3×0,4 эквивалента). Реакционную смесь разбавляли водой (400 мл) и фильтровали через целлит. Фильтрат экстрагировали этилацетатом (5х), и объединенные органические экстракты промывали раствором NaHCO3, 1 М раствором KHSO4, рассолом, высушивали (MgSO4·2H2O), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (этилацетат/н-гептан 1:2->1:1) с получением смеси [(R)-1-(2,4-диметоксибензил)-2,6-диоксоазепан-3-ил]-карбаминовой кислоты трет-бутилового эфира и [(R)-1-(2,4-диметоксибензил)-2,5-диоксоазепан-3-ил]-карбаминовой кислоты трет-бутилового эфира в соотношении 1:2: белое твердое вещество 3,8 г (67%); MS: m/e=392,9 (MH+).
Пример G
[(R)-1-(2,4-Диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-карбаминовой кислоты трет-бутиловый эфир

[Бис(2-метоксиэтил)амино]серы трифторид (3,5 г, 15,8 ммоль) растворяли в сухом толуоле (30 мл) и охлаждали (ледяная баня) в атмосфере аргона. Добавляли по каплям этилэфират трифторида бора (0,16 г, 1,13 ммоль), и смесь перемешивали в течение 30 мин при 5°С. Затем добавляли смесь 1:2 [(R)-1-(2,4-диметоксибензил)-2,6-диоксоазепан-3-ил]-карбаминовой кислоты трет-бутилового эфира и [(R)-1-(2,4-диметоксибензил)-2,5-диоксоазепан-3-ил]-карбаминовой кислоты трет-бутилового эфира (4,44 г, 11,3 ммоль), растворенную в толуоле (15 мл), охлаждающую баню удаляли, и реакционную смесь медленно нагревали до 50°С, а затем перемешивали в течение 5 ч при этой повышенной температуре. Реакционную смесь наливали на охлажденный во льду, наполовину насыщенный раствор NaHCO3 и экстрагировали этилацетатом (3х). Объединенные органические экстракты промывали водой, рассолом, высушивали (MgSO4·2H2O), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (этилацетат/н-гептан 1:4->1:3) с получением [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-карбаминовой кислоты трет-бутилового эфира: пена 1,32 г (25%); Rf 0,4 (гексан/этилацетат, 1:1 об/об); MS: m/e=415,1 (MH+), при 437,1 (MNa+)
1Н ЯМР (400 МГц, CDCl3) δ млн-1 1.45 (s, 9H), 1.54-1.69 (m, 1H), 1.75-1.98 (m, 1H), 2.00-2.16 (m, 1H), 2.49-2.65 (m, 1H), 3.34-3.44 (m, 1H), 3.47-3.60 (m, 1H), 3.80 (s, 3H), 3.81 (s, 3H), 4.49 (d, J=14.2 Гц, 1H), 4.52-4.56 (m, 1H), 4.69 (d, J=14.5 Гц, 1H), 5.97 (d, J=5.4 Гц, 1H), 6.42-6.48 (m, 2H), 7.19 (d, J=8.9 Гц, 1Н).
Пример H
[(R)-1-(2,4-Диметоксибензил)-6,6-дифтор-2-оксоазепан-3-ил]-карбаминовой кислоты трет-бутиловый эфир

Соединение выделили при выходе 6,5% в виде побочного продукта при синтезе другого региоизомера [(R)-1-(2,4-диметоксибензил)-6,6-дифтор-2-оксоазепан-3-ил]-карбаминовой кислоты трет-бутилового эфира.
Rf 0,45 (гексан/этилацетат, 1:1 об/об); MS: m/e=415.3 (MH+), при 432,2 (MNH4 +).
1Н ЯМР (400 МГц, CDCl3) δ млн-1 1.41 (s, 9H), 1.54-1.56 (m, 1H), 2.1-2.3 (m, 3Н), 3.6-3.8 (m, 2H), 3.80 (s, 3Н), 3.82 (s, 3Н), 4.21 (d, J=14 Гц, 1Н), 4.38 (dd, J=6/8 Гц 1H), 5.0 (d, J=14 Гц, 1H), 6.05 (b, 1H), 6.45-6.48 (m, 2H), 7.3 (d, J=8 Гц, 1Н).
Пример I
4-Хлор-N-[(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-бензолсульфонамид

(R)-1-(2,4-Диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-карбаминовой кислоты трет-бутиловый эфир (0,77 г, 1,86 ммоль) растворяли в 4 M HCl/1,4-диоксане (20 мл) и давали идти реакции в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и один раз концентрировали из ацетонитрила. К полученной в результате соли гидрохлорид добавляли CH2Cl2 (30 мл) с последующим добавлением по каплям основания Хюнига (1 мл, 5,6 ммоль). Добавляли раствор 4-хлорбензолсульфонилхлорида (0,59 г, 2,8 ммоль) в CH2Cl2 (4 мл), и реакционную смесь (рН 8) перемешивали еще в течение 1,5 ч. Реакционную смесь разбавляли CH2Cl2 и промывали раствором NaHCO3, 1 M раствором KHSO4, рассолом, высушивали (MgSO4·2H2O), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (этилацетат/н-гептан 1:2): белые кристаллы 0,74 г (78%);
MS: m/e=487,1 (MH-);
1H ЯМР (400 МГц, CDCl3) δ млн-1 1.46-1.65 (m, 1H), 1.87-2.11 (m, 2H), 2.51-2.62 (m, 1H), 3.27-3.32 (m, 2H), 3.77 (s, 3Н), 3.81 (s, 3Н), 3.96-4.04 (m, 1H), 4.38 (d, J=14.2 Гц, 1H), 4.62 (d, J=14.5 Гц, 1H), 6.33 (d, J=5.6 Гц, 1H), 6.41-6.46 (m, 2H), 6.91-6.95 (m, 1H), 7.45-7.50 (m, 2H), 7.78-7.83 (m, 2H).
Пример J
4-Хлор-N-[(R)-1-(2,4-диметоксибензил)-6,6-дифтор-2-оксоазепан-3-ил]-бензолсульфонамид
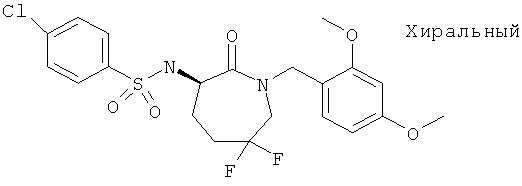
Соединение, указанное в заголовке, MS: m/e=487,2 (MH+), получили аналогично примеру I, начиная с [(R)-1-(2,4-диметоксибензил)-6,6-дифтор-2-оксоазепан-3-ил]-карбаминовой кислоты трет-бутилового эфира.
Пример К
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид
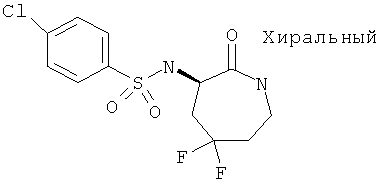
Смесь, содержащую 40% трифторуксусную кислоту, 1% трифторметансульфоновую кислоту в CH2Cl2 (20 мл), добавляли к 4-хлор-N-[(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-бензолсульфонамиду (0,5 г, 1,0 ммоль). Через 30 мин реакционную смесь концентрировали, и остаток растворяли в этилацетате и промывали водой, раствором NaHCO3, 1 М раствором KHSO4, рассолом, высушивали (MgSO4·2H2O), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (CH2Cl2/МеОН 95:5 об/об): белое твердое вещество 0,74 г (78%); MS: m/e=337,1 (MH-).
Пример 1
4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-N-циклопропилбензамид
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид (0,05 г, 0,15 ммоль), 4-хлорметил-N-циклопропилбензамид (0,05 г, 0,22 ммоль), К2СО3 (0,20 г, 1,5 ммоль), KI (0,005 г, 0,03 ммоль) добавляли к сухому ДМФ (2,5 мл), и полученную в результате реакционную смесь перемешивали в течение 3,5 ч при 65°С в атмосфере аргона. Растворитель удаляли при пониженном давлении, и остаток растворяли в этилацетате и промывали 5% KHSO4/10% K2SO4 (2х), водой, рассолом, высушивали (MgSO4), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (этилацетат/н-гептан 3:2 об/об), и очищенный продукт лиофилизировали: белый лиофилизат 60 мг; MS: m/e=512,3 (МН+), 534,2 (MNH4 +)
1Н ЯМР (400 МГц, CDCl3) δ млн-1 0.57-0.69 (m, 2H), 0.79-0.94 (m, 2H), 1.78-1.95 (m, 1H), 1.98-2.14 (m, 1H), 2.19-2.32 (m, 2H), 2.88-2.94 (m, J=7.1, 7.1, 7.0, 3.8 Гц, 1H), 3.16-3.25 (m, J=13.2, 7.9, 5.2, 2.5, 2.5 Гц, 1H), 3.37-3.47 (m, 1H), 4.52 (d, J=17.2 Гц, 1H), 4.77-4.95 (m, 2H), 5.78 (dd, J=7.7, 5.2 Гц, 1H), 6.11-6.24 (m, 1H), 7.40-7.46 (m, 3H), 7.65-7.74 (m, 3H).
Пример 2
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-(4-изоксазол-5-илбензил)-бензолсульфонамид
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид алкилировали, используя 5-(4-бромметилфенил)-изоксазол, аналогично Примеру 1 с получением 4-хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-(4-изоксазол-5-илбензил)-бензолсульфонамида: MS: m/e=496,0 (МН+), 513,2 (MNH4 +).
Пример 3
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-(6-метоксипиридин-3-илметил)бензолсульфонамид
а) 4-Хлор-N-[(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-N-(6-метоксипиридин-3-илметил)-бензолсульфонамид
4-Хлор-N-[(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-бензолсульфонамид (0,04 г, 0,07 ммоль), (6-метоксипиридин-3-ил)-метанол (0,014 г, 0,10 ммоль), трифенилфосфин (0,04 г, 0,13 ммоль) растворяли в сухом ТГФ (3 мл) при 0-5°С (баня лед-вода) в атмосфере аргона с последующим добавлением по каплям диизопропилазодикарбоксилата (28 мг, 0,13 ммоль) в сухом ТГФ (0,5 мл). Реакционную смесь перемешивали еще в течение 1 ч при кт, а затем концентрировали при пониженном давлении. Сырое желтое масло очищали на силикагеле (этилацетат/н-гептан 1:2): бесцветная смола 23 мг (52%); MS: m/e=610,3 (МН+).
б) 4-Хлор-N-((R)-5,5-диФтор-2-оксоазепан-3-ил)-N-(6-метоксипиридин-3-илметил)бензолсульфонамид
Смесь, содержащую трифторуксусную кислоту/трифторметансульфоновую кислоту (10:1 об/об, 4 мл), добавляли к 4-хлор-N-[1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-N-(6-метоксипиридин-3-илметил)-бензолсульфонамиду (21 мг, 0,03 ммоль). Через 1 ч реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в этилацетате и промывали 5% KHSO4/10% K2SO4 (2x), водой, рассолом, высушивали (MgSO4), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (этилацетат/н-гептан 3:2 об/об), и очищенный продукт лиофилизировали: белый лиофилизат 15,3 мг; MS: m/e=460,1 (MH+).
Пример 4
4-Хлор-N-(2,3-дифтор-4-метоксибензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид алкилировали, используя 1-бромметил-2,3-дифтор-4-метоксибензол, аналогично Примеру 1 с получением 4-хлор-N-(2,3-дифтор-4-метоксибензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид: MS: m/e=495,1 (MH+), 512,1 (MNH4 +).
Пример 5
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-(2-фтор-4-метоксибензил)-бензолсульфонамид
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид подвергали взаимодействию с (2-фтор-4-метоксифенил)-метанолом аналогично Примеру 3а с получением 4-хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-(2-фтор-4-метоксибензил)-бензолсульфонамид: MS: m/e=477,1 (MH+), 494,3 (MNH4 +).
Пример 6
4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фторбензойная кислота
а) 4-{[(4-Хлор-бензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фторбензойной кислоты метиловый эфир
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид алкилировали, используя 4-бромметил-3-фторбензойной кислоты метиловый эфир, аналогично Примеру 1 с получением 4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фторбензойной кислоты метилового эфира: MS: m/e=504,9 (MH+), 522,1 (MNH4 +).
б) 4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фторбензойная кислота
4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фторбензойной кислоты метиловый эфир (130 мг, 0,26 ммоль) растворяли в ТГФ/МеОН (5 мл) и обрабатывали 1 н. NaOH (1,2 мл) в течение 1,5 ч. Реакционную смесь концентрировали при пониженном давлении, разбавляли, используя воду, и экстрагировали диэтиловым эфиром. Водную фазу подкисляли, используя смесь 5% KHSO4/10% K2SO4, и экстрагировали этилацетатом (3х). Объединенные органические фракции промывали рассолом, высушивали (Na2SO4), фильтровали, концентрировали при пониженном давлении (103 мг). Сырой продукт (50 мг) очищали, используя препаративную хроматографию ОФ (C18) (с обращенной фазой): лиофилизат 22 мг; MS: m/e=489,0 (MH-).
Пример 7
4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фтор-N-пирролидин-1-илбензамид
4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фторбензойную кислоту (50 мг, 0,10 ммоль) растворяли в ДМФ (1 мл) и активировали реагентом сочетания TPTU (33 мг, 0,11 ммоль) и основанием Хюнига (0,03 мл, 0,26 ммоль) в течение 2 мин. Добавляли 1-аминопирролидина гидрохлорид (0,013 г, 0,22 ммоль) и дополнительное количество основания Хюнига (0,03 мл, 0,26 ммоль). После 1 ч реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в этилацетате и промывали 5% KHSO4/10% K2SO4 (2х), водой, рассолом, высушивали (MgSO4), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (этилацетат->этилацетат/5% МеОН), и очищенный продукт лиофилизировали: белый лиофилизат 32 мг; MS: m/e=559,3 (MH+), 581,2 (MNa+).
Пример 8
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-(4-метансульфонилбензил)-бензолсульфонамид
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид алкилировали, используя 4-метилсульфонилбензилбромид, аналогично Примеру 1 с получением 4-хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-(4-метансульфонилбензил)-бензолсульфонамида: MS: m/e=507,2 (МН+), 524,1 (MNH4 +).
Пример 9
4-Хлор-N-(4-дифторметоксибензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид алкилировали, используя 4-(дифторметокси)бензилбромид, аналогично Примеру 1 с получением 4-хлор-N-(4-дифторметоксибензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид: MS: m/e=495,1 (MH+), 512,1 (MNH4 +).
Пример 10
4-Хлор-N-(4-дифторметилбензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид алкилировали, используя 1-бромметил-4-дифторметилбензол, аналогично Примеру 1 с получением 4-хлор-N-(4-дифторметилбензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамида: MS: m/e=479,1 (MH+), 496,0 (MNH4 +).
Пример 11
N-(1-Бензоилпиперидин-4-илметил)-4-хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид
а) 4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-пиперидин-1-карбоновой кислоты трет-бутиловый эфир
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид алкилировали, используя 4-(толуол-4-сульфонилоксиметил)-пиперидин-1 -карбоновой кислоты трет-бутиловый эфир, аналогично Примеру 1 с получением 4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-пиперидин-1-карбоновой кислоты трет-бутилового эфира: MS: m/e=536,3 (МН+), 553,2 (MNH4 +).
б) 4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-пиперидин-4-илметилбензолсульфонамид
4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-пиперидин-1-карбоновой кислоты трет-бутиловый эфир (0,105 г, 0,2 ммоль) растворяли в смеси трифторуксусной кислоты и дихлорметана (1:1) и перемешивали в течение ночи. После экстракции водным раствором бикарбоната натрия органический слой высушивали (MgSO4) и выпаривали с получением 80 мг (94%) 4-хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-пиперидин-4-илметилбензолсульфонамид; MS: m/e=436,2 (MH+).
в) N-(1-Бензоилпиперидин-4-илметил)-4-хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-пиперидин-4-илметилбензолсульфонамид (0,04 г, 0,09 ммоль) и триэтиламин (19 мг, 0,18 ммоль) растворяли в дихлорметане (1,5 мл). Затем добавляли бензоилхлорид (0,018 г, 0,13 ммоль), и смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь распределяли между водным раствором бикарбоната натрия и этилацетатом. Органический слой высушивали (MgSO4) и концентрировали при пониженном давлении. Остаток очищали на силикагеле (гептан/этилацетат 1:1) с получением 29 мг (58%) соединения, указанного в заголовке; MS: m/e=540,3 (МН+), 557,1 (MNH4 +).
Пример 12
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-[2-фтор-4-(2Н-[1,2,4]триазол-3-ил)-бензил]-бензолсульфонамид
а) 4-Хлор-N-(4-циано-2-фторбензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид алкилировали, используя 4-бромметил-3-фторбензонитрил, аналогично Примеру 1 с получением 4-хлор-N-(4-циано-2-фторбензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамида: MS: m/e=472,2 (MH+).
б) 4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фторбензимидокислоты этилового эфира гидрохлорид
4-Хлор-N-(4-циано-2-фторбензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид (0,23 г, 0,49 ммоль) суспендировали в сухом этаноле (10 мл) и охлаждали до 0°С. Сухой газ HCl осторожно барботировали в течение 30 мин в эту суспензию. Эту светло-красную реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Полученный в результате прозрачный желтый раствор концентрировали при пониженном давлении, и сырой продукт использовали непосредственно в следующей стадии: 0,28 г; MS: m/e=516,2 (МН-).
в) 4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-N-[2-фтор-4-(2Н-[1,2,4]триазол-3-ил)-бензил]-бензолсульфонамид
Сырую соль гидрохлорид (0,27 г, примерно 0,49 ммоль) и формилгидразин (чистота 90%, 36 мг, 0,54 ммоль) растворяли в пиридине (7,3 мл) и перемешивали в течение 3 ч в атмосфере аргона. Реакционную смесь концентрировали при пониженном давлении и добавляли ксилолы (12,1 мл), и реакционную смесь нагревали при 145°С в течение 30 мин. Реакционную смесь концентрировали при пониженном давлении, и сырое желтое твердое вещество очищали на силикагеле (CH2Cl2/МеОН 95:5), и очищенный продукт лиофилизировали: белый лиофилизат 75 мг; MS: m/e=514,2 (MH+), 531,0 (MNH4 +).
Пример 13
4-{[(4-Хлорбензолсульфонил)-((R)-6,6-дифтор-2-оксоазепан-3-ил)-амино]-метил}-N-циклопропилбензамид
4-Хлор-N-[(R)-1-(2,4-диметоксибензил)-6,6-дифтор-2-оксоазепан-3-ил]-бензолсульфонамид подвергали удалению защитной группы диметоксибензил аналогично Примеру К, а затем алкилировали, используя хлорметил-N-циклопропилбензамид, аналогично протоколу в Примере 1 с получением 4-{[(4-хлорбензолсульфонил)-((R)-6,6-дифтор-2-оксоазепан-3-ил)-амино]-метил}-N-циклопропилбензамида. MS: m/e=512,1 (MH+);
1Н ЯМР (400 МГц, CDCl3) δ млн-1 0.56-0.68 (m, 2H), 0.81-0.91 (m, 2H), 1.72-1.87 (m, 2H), 1.95-2.14 (m, 1H), 2.17-2.27 (m, 1H), 2.91 (qd, J=7.1, 3.8 Гц, 1Н), 3.31-3.50 (m, 1H), 3.54-3.67 (m, 1H), 4.51-4.62 (m, 1H), 4.82-4.94 (m, 2H), 5.51-5.62 (m, 1H), 6.16 (s, 1H), 7.41-7.52 (m, 3H), 7.65-7.72 (m, 3H).
Пример 14
3-(4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-пропионовая кислота
a) 3-(4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-пропионовой кислоты метиловый эфир
4-Хлор-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид алкилировали, используя 3-(4-бромметилфенил)-пропионовой кислоты метиловый эфир, аналогично Примеру 1 с получением 3-(4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-пропионовой кислоты метилового эфира: MS: m/e=515,1 (МН+), 532,1 (MNH4 +).
б) 3-(4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-пропионовая кислота
3-(4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-пропионовой кислоты метиловый эфир (65 мг, 0,13 ммоль) растворяли в метаноле (0,5 мл) и обрабатывали 2 н. LiOH в воде (0,25 мл, 0,5 ммоль) в течение ночи при 40°С. Реакционную смесь распределяли между 4 н. HCl и этилацетатом. Органический слой высушивали (MgSO4) и концентрировали при пониженном давлении. Сырой продукт (50 мг) очищали, используя колоночную хроматографию (дихлорметан/метанол 90:10), с получением 45 мг (71%); MS: m/e=499,0 (MH-).
Пример 15
3-(4-{[(4-Хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-3-метилмасляная кислота
Это соединение получили аналогично Примеру 14, используя 3-(4-бромметилфенил)- 3-метилмасляной кислоты метиловый эфир на стадии 14а), с получением 3-(4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-3-метилмасляной кислоты: MS: m/e=527,1 (МН-).
Пример 16
3,3,3-Трифторпропан-1-сульфокислоты ((R)-5,5-дифтор-2-оксоазепан-3-ил)-(6-метоксипиридин-3-илметил)-амид
а) 3,3,3-Трифторпропан-1-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-амид
[(R)-1-(2,4-Диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-карбаминовой кислоты трет-бутиловый эфир (0,85 г, 1,85 ммоль) растворяли в 38 мл дихлорметана. 4 М HCl/1,4-диоксан (20 мл) добавляли по каплям, и смеси давали прореагировать в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и концентрировали один раз из ацетонитрила. К 291 мг полученной в результате соли гидрохлорид добавляли CH2Cl2 (20 мл) с последующим добавлением по каплям основания Хюнига (0,36 мл, 2,1 ммоль). Добавляли раствор 3,3,3-трифторпропан-1-сульфонилхлорида (0,19 г, 0,9 ммоль) в CH2Cl2 (5 мл), и реакционную смесь (рН 8) перемешивали еще в течение 1,5 ч. Реакционную смесь очищали на силикагеле (гептан-этилацетат, 95:5-0:100): белое твердое вещество 0,30 г (77%); MS: m/e=473,1 (M-H-).
б) 3,3,3-Трифторпропан-1-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил)-(6-метоксипиридин-3-илметил)-амид
3,3,3-Трифторпропан-1-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-амид (0,15 г, 0,31 ммоль), (6-метоксипиридин-3-ил)-метанол (0,06 г, 0,38 ммоль), трифенилфосфин (0,17 г, 0,62 ммоль) растворяли в сухом ТГФ (15 мл) при 0-5°С (баня лед-вода) в атмосфере аргона с последующим добавлением по каплям диизопропилазодикарбоксилата (0,12 мл, 0,62 ммоль) в сухом ТГФ (1,5 мл). Реакционную смесь перемешивали еще в течение 1 ч при кт, а затем концентрировали при пониженном давлении. Сырое масло очищали на силикагеле (сначала: гептан-этилацетат, 97:3-0:100; затем: дихлорметан-метанол, 98:2-90:10): белое твердое вещество 214 мг (81%); MS: m/e=654,2 (М+СН3СОО-).
в) 3,3,3-Трифторпропан-1-сульфокислоты ((R)-5,5-дифтор-2-оксоазепан-3-ил)-(6-метоксипиридин-3-илметил)-амид
Смесь, содержащую трифторуксусную кислоту/трифторметансульфоновую кислоту (5:2 об/об, 0,76 мл), добавляли к 3,3,3-трифторпропан-1-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-(6-метоксипиридин-3-илметил)-амиду (0,2 г, 0,24 ммоль) в дихлорметане (10 мл). Через 2 ч реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в этилацетате и промывали водой, насыщенным водным бикарбонатом натрия и рассолом, высушивали (Na2SO4), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (гептан-этилацетат, 9:1-0:1): белое твердое вещество 72 мг (69%); MS: m/e=446,2 (MH+).
Пример 17
5-Хлортиофен-2-сульфокислоты ((R)-5,5-дифтор-2-оксоазепан-3-ил)-(6-метоксипиридин-3-илметил)-амид
а) 5-Хлортиофен-2-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-амид
[(R)-1-(2,4-Диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-карбаминовой кислоты трет-бутиловый эфир (0,85 г, 1,85 ммоль) растворяли в 38 мл дихлорметана. 4 М HCl/1,4-диоксан (20 мл) добавляли по каплям, и смеси давали прореагировать в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и концентрировали один раз из ацетонитрила. К 291 мг полученной в результате соли гидрохлорид добавляли CH2Cl2 (20 мл) с последующим добавлением по каплям основания Хюнига (0,36 мл, 2,1 ммоль). Добавляли раствор 5-хлортиофен-2-сульфонилхлорида (0,21 г, 0,9 ммоль) в CH2Cl2 (5 мл), и реакционную смесь (рН 8) перемешивали еще в течение 1,5 ч. Реакционную смесь очищали на силикагеле (гептан-этилацетат, 95:5-0:100): белое твердое вещество 0,40 г (97%); MS: m/e=493,1 (M-H-).
б) 5-Хлортиофен-2-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил1-(6-метоксипиридин-3-илметил)-амид
5-Хлортиофен-2-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-амид (0,20 г, 0,40 ммоль), (6-метоксипиридин-3-ил)-метанол (0,07 г, 0,48 ммоль), трифенилфосфин (0,22 г, 0,80 ммоль) растворяли в сухом ТГФ (15 мл) при 0-5°С (баня лед-вода) в атмосфере аргона с последующим добавлением по каплям диизопропилазодикарбоксилата (0,16 мл, 0,80 ммоль) в сухом ТГФ (1,5 мл). Реакционную смесь перемешивали еще в течение 1 ч при кт, а затем концентрировали при пониженном давлении. Сырое масло очищали на силикагеле (сначала: гептан-этилацетат, 97:3-0:100; затем: дихлорметан-метанол, 98:2-90:10): белое твердое вещество 0,19 г (53%); MS: m/e=674,2 (М+СН3СОО-).
в) 5-Хлортиофен-2-сульфокислоты ((R)-5,5-дифтор-2-оксоазепан-3-ил)-(6-метоксипиридин-3-илметил)-амид
Смесь, содержащую трифторуксусную кислоту/трифторметансульфоновую кислоту (5:2 об/об, 0.62 мл), добавляли к 5-хлортиофен-2-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-(6-метоксипиридин-3-илметил)-амиду (0,17 г, 0,19 ммоль) в дихлорметане (10 мл). Через 2 ч реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в этилацетате и промывали водой, насыщенным водным бикарбонатом натрия и рассолом, высушивали (Na2SO4), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (гептан-этилацетат, 9:1-0:1): белое твердое вещество 69 мг (77%); MS: m/e=466,1 (MH+).
Пример 18
5-Хлорпиридин-2-сульфокислоты (4-дифторметоксибензил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амид
а) 5-Хлорпиридин-2-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5.5-дифтор-2-оксоазепан-3-ил]-амид
[(R)-1-(2,4-Диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-карбаминовой кислоты трет-бутиловый эфир (0,46 г, 1,0 ммоль) растворяли в 20 мл дихлорметана. 4 М HCl/1,4-диоксан (20 мл) добавляли по каплям, и смеси давали прореагировать в течение 1 ч. Реакционную смесь концентрировали при пониженном давлении и концентрировали один раз из ацетонитрила. К полученной в результате соли гидрохлорид добавляли CH2Cl2 (15 мл) с последующим добавлением по каплям основания Хюнига (0,44 мл, 2,5 ммоль). Добавляли раствор 5-хлорпиридин-2-сульфонилхлорида (0,33 г, 1,1 ммоль) в CH2Cl2 (5 мл), и реакционную смесь (рН 8) перемешивали еще в течение 1,5 ч. Реакционную смесь очищали на силикагеле (гептан-этилацетат, 95:5-0:100): белое твердое вещество 0,37 г (76%); MS: m/e=490,2 (MH+).
б) 5-Хлорпиридин-2-сульфокислоты ((R)-5,5-дифтор-2-оксоазепан-3-ил)-амид
Смесь, содержащую трифторуксусную кислоту/трифторметансульфоновую кислоту (5:2 об/об, 2,44 мл), добавляли к 5-Хлорпиридин-2-сульфокислоты [(R)-1-(2,4-диметоксибензил)-5,5-дифтор-2-оксоазепан-3-ил]-амиду (0,37 г, 0,76 ммоль) в дихлорметане (20 мл). Через 2 ч реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в этилацетате и промывали водой, насыщенным водным бикарбонатом натрия и рассолом, высушивали (Na2SO4), фильтровали, концентрировали при пониженном давлении и очищали на силикагеле (гептан-этилацетат, 1:1-0:1): белое твердое вещество 0,22 г (84%); MS: m/e=340,0 (MH+).
в) 5-Хлорпиридин-2-сульфокислоты (4-дифторметоксибензил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амид
5-Хлорпиридин-2-сульфокислоты ((R)-5,5-дифтор-2-оксоазепан-3-ил)-амид (0,21 г, 0,61 ммоль), 4-(дифторметокси)бензилбромид (0,23 г, 0,91 ммоль), К2СО3 (0,85 г, 6,08 ммоль), KI (0,02 г, 0,12 ммоль) добавляли к сухому ДМФ (10 мл), и полученную в результате реакционную смесь перемешивали в течение 1,5 ч при 65°С и в течение дополнительных 3 ч при комнатной температуре в атмосфере аргона. Растворитель удаляли при пониженном давлении, и остаток очищали на силикагеле (сначала: этилацетат/н-гептан 1:2 об/об; затем: дихлорметан/МеОН, 100:0-95:5): коричневатое масло, 0,23 г; MS: m/e=496,1 (MH+).
| название | год | авторы | номер документа |
|---|---|---|---|
| N-ЗАМЕЩЕННЫЕ БЕНЗОЛСУЛЬФОНАМИДЫ | 2004 |
|
RU2364587C2 |
| ЦИКЛОАЛКАНОВОЕ ПРОИЗВОДНОЕ | 2013 |
|
RU2635354C2 |
| СОЕДИНЕНИЯ БЕНЗОЛСУЛЬФОНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2017 |
|
RU2769827C2 |
| БЛОКАТОР НАТРИЕВЫХ КАНАЛОВ | 2016 |
|
RU2705578C1 |
| МОДУЛЯТОРЫ НАТРИЕВОГО КАНАЛА ДЛЯ ЛЕЧЕНИЯ БОЛИ | 2014 |
|
RU2669367C2 |
| ПРОИЗВОДНЫЕ ПИРИДООКСАЗИНОНА В КАЧЕСТВЕ ИНГИБИТОРОВ TNAP | 2016 |
|
RU2715704C2 |
| НЕПЕПТИДНЫЕ АНТАГОНИСТЫ GnRH | 2003 |
|
RU2329251C2 |
| СОЕДИНЕННЫЕ МОСТИКОВОЙ СВЯЗЬЮ N-ЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДО-ИНГИБИТОРЫ ГАММА-СЕКРЕТАЗЫ | 2006 |
|
RU2422443C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
| ПРОИЗВОДНЫЕ АЛЬФА-(N-СУЛЬФОНАМИДО)АЦЕТАМИДА КАК ИНГИБИТОРЫ БЕТА-АМИЛОИДА | 2002 |
|
RU2300518C2 |
Изобретение относится к соединениям общей формулы (I)

где R3/R3', R4/R4' и R5/R5', где по меньшей мере один из R4/R4' или R5/R5' всегда представляет собой атом фтора, а значения остальных радикалов раскрыты в описании. Обнаружено, что соединения общей формулы I являются ингибиторами γ-секретазы, и могут быть полезны при лечении болезни Альцгеймера или распространенных раков, включая, но не ограничиваясь ими, карциномы шейки матки и карциномы молочной железы и злокачественные опухоли кроветворной системы.
3 н. и 12 з.п. ф-лы, 3 табл.
1. Соединения общей формулы

где R1 представляет собой С1-7алкил, замещенный галогеном, либо представляет собой арил или гетероарил, незамещенный или замещенный галогеном, где арил здесь и далее означает одновалентный циклический ароматический углеводородный радикал, состоящий из одного кольца или из большего числа конденсированных колец, в которых по меньшей мере одно кольцо является ароматическим по природе, а гетероарил здесь и далее означает одновалентный ароматический карбоциклический радикал, содержащий по меньшей мере один гетероатом, выбранный из N, О или S;
R2 представляет собой гетероциклоалкил, где гетероциклоалкил здесь и далее означает неароматический углеводородный радикал, содержащий по меньшей мере один гетероатом, выбранный из N, О или S, арил или гетероарил, которые являются незамещенными или замещенными одним или более чем одним заместителем, выбранным из группы, состоящей из галогена, С1-7алкилокси, С1-7алкила, замещенного галогеном, O-(С1-7)алкила, замещенного галогеном, либо замещены группой C(O)-NR''2, (CR2)m-C(O)-R', гетероарилом или S(O)2-(C1-7)алкилом;
R3/R3', R4/R4' и R5/R5' представляют собой независимо друг от друга атом водорода или фтора, где по меньшей мере один из R4/R4' или R5/R5' всегда представляет собой атом фтора;
R' представляет собой арил или гидрокси;
R'' представляет собой атом водорода, С3-7циклоалкил или представляет собой гетероциклоалкил;
R представляет собой атом водорода или С1-7алкил;
m равно 0, 1, 2 или 3;
и их фармацевтически приемлемые соли присоединения кислоты, оптически чистые энантиомеры, рацематы или диастереомерные смеси.
2. Соединения по п.1 формулы I, где R4/R4' оба представляют собой фтор и R1 представляет собой фенил, замещенный галогеном.
3. Соединения по п.2 формулы I, где R2 представляет собой фенил, замещенный галогеном и/или C(O)-N(R'')2.
4. Соединения по п.3 формулы I, которые представляют собой 4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-N-циклопропилбензамид или
4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-3-фтор-N-пирролидин-1-илбензамид.
5. Соединения по п.2 формулы I, где R2 представляет собой фенил, замещенный галогеном и С1-7алкокси.
6. Соединения по п.5 формулы I, которые представляют собой 4-хлор-N-(2,3-дифтор-4-метоксибензил)-N-((R)-5,5-дифтор-2-оксоазепан-3-ил)-бензолсульфонамид.
7. Соединения по п.2 формулы I, где R2 представляет собой фенил, замещенный галогеном и гетероарилом.
8. Соединения по п.7 формулы I, где соединение представляет собой 4-хлор-N-((Р)-5,5-дифтор-2-оксоазепан-3-ил)-N-[2-фтор-4-(2Н-[1,2,4]триазол-3-ил)-бензил]-бензолсульфонамид.
9. Соединения по п.2 формулы I, где R2 представляет собой фенил, замещенный (CR2)mC(O)-R'.
10. Соединения по п.9 формулы I, которые представляют собой
3-(4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-пропионовую кислоту или
3-(4-{[(4-хлорбензолсульфонил)-((R)-5,5-дифтор-2-оксоазепан-3-ил)-амино]-метил}-фенил)-3-метилмасляную кислоту.
11. Соединения по п.1 формулы I, где R1 представляет собой гетероарил, замещенный галогеном.
12. Соединения по п.1 формулы I, где R1 представляет собой С1-7алкил, замещенный галогеном.
13. Лекарство, обладающее способностью ингибировать γ-секретазу, содержащее одно или более чем одно соединение по п.1 и фармацевтически приемлемые эксципиенты.
14. Лекарство по п.13 для лечения болезни Альцгеймера или распространенных видов рака.
15. Применение соединения по п.1 для изготовления лекарств для лечения болезни Альцгеймера или распространенных видов рака.
| WO 2005042489 А 12.05.2005 | |||
| WO 2004084898 A 07.10.2004 | |||
| EA 200000373 A3 25.12.2000. |
Авторы
Даты
2011-05-27—Публикация
2006-08-02—Подача