Настоящее изобретение относится к группе соединений, которые действуют как антагонисты рецептора GnRH. Эти соединения полезны в лечении эндометриоза и гормон-зависимых видов рака и в регуляции овуляции в протоколах оплодотворения in vitro.
Предшествующий уровень техники
Гонадотропин-высвобождающий гормон (GnRH, также известный как рилизинг-фактор лютеинизирующего гормона, LHRH) представляет собой декапептидный гормон, продуцирующийся в гипоталамусе. После высвобождения он транспортируется в гипофиз, где вызывает секрецию фолликулостимулирующего гормона (FSH) и лютеинизирующего гормона (LH). Эти два гормона затем воздействуют на яичники (у женщин) или яички (у мужчин). Они регулируют фолликулогенез и овуляцию у женщин и высвобождение стероидных гормонов как у мужчин, так и у женщин.
Широко известно, что избыточная секреция стероидных гормонов может быть вредна для здоровья. Например, некоторые новообразования (такие как рак молочной железы или предстательной железы) и эндометриоз вызваны высокими уровнями стероидов. Поэтому агенты, которые модулируют систему гипоталамус-гипофиз-половые железы, представляют терапевтический интерес. Первые клинически использованные соединения представляли собой супер-агонисты GnRH. Они являются аналогами GnRH, которые сохраняют все биологические действия нативного гормона, но их вводят таким образом, чтобы вызвать хроническую активацию рецепторов GnRH. В течение нескольких дней эта хроническая активация вызывает отрицательную негативную регуляцию рецептор-опосредованной передачи сигнала и падение уровней FSH и LH. Недостаток этих агентов состоит в том, что в течение первых нескольких дней они вызывают сверхпродукцию FSH и LH, которая может привести к аллергической реакции ("flare" reaction). Поэтому внимание было сосредоточено на разработке антагонистов GnRH. Модификация пептидной последовательности привела к открытию ряда пептидных антагонистов, которые в настоящее время проходят клинические испытания. Однако, поскольку эти соединения все же являются пептидами, их следует вводить парентерально (обычно путем подкожной или внутримышечной инъекции). Эти соединения являются также относительно дорогостоящими для производства и очистки. Таким образом, существует потребность в терапевтически эффективных непептидных антагонистах GnRH и, особенно, в соединениях, которые можно вводить перорально и которые являются недорогими.
Краткое описание изобретения
Здесь описан ряд арилсульфонамидов, которые являются мощными и избирательными антагонистами рецептора GnRH. Соответственно, в первом аспекте настоящего изобретения предложены соединения, которые представляют собой производные общей формулы 1, и их фармацевтически приемлемые соли.
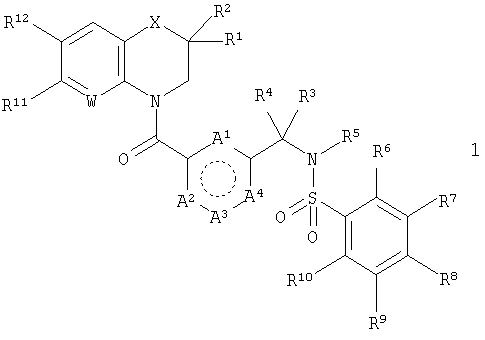
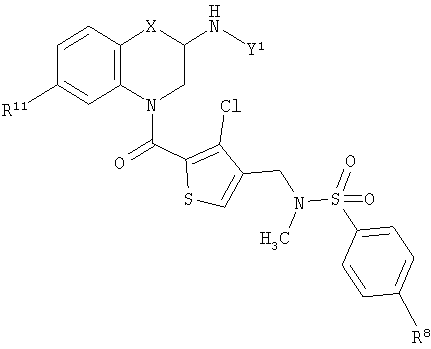
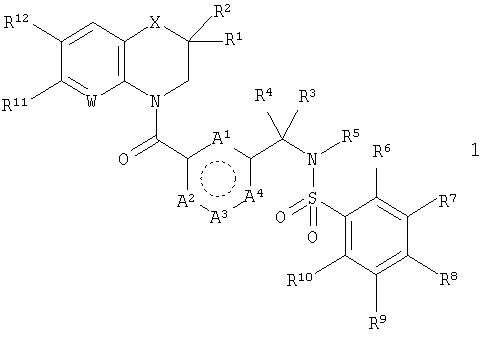
В этой общей структуре каждый А1-А3 может быть выбран из А5 и А6, где А5 может представлять собой либо =CR13-, либо =N-, и А6 может представлять собой -NR14-, -О- или -S-. А4 может представлять собой либо ковалентную связь, либо А5. Если А4 представляет собой ковалентную связь, так что кольцо, включающее в себя А1-А4, представляет собой пятичленное кольцо, то один из А1-А3 должен представлять собой А6, а два других должны представлять собой А5. Если А4 представляет собой А5, так что указанное кольцо представляет собой шестичленное кольцо, то все А1-А3 должны представлять собой А5. Группа R1 может быть выбрана из Н (атома водорода), NHY1 и COY2. В любом из этих случаев группа R2 представляет собой Н. Альтернативно и R1, и R2 могут представлять собой метильные группы или вместе могут представлять собой =O, чтобы образовать карбонильную группу. Каждая из групп R3, R4 и R5 независимо выбрана из Н, групп, представляющих собой низший алкил и низший алкенил. Каждая из групп R6, R7, R8, R9, R10, R11 и R12 независимо выбрана из Н, групп, представляющих собой низший алкил, низший алкенил, NH2, галогена (F, Cl и Br), O-алкил, O-низший алкил, O-низший алкенил, CH2NMe2 и CF3. Группа R13 выбрана из Н, F, Cl, Br, NO2, NH2, ОН, Me, Et, OMe, NMe2 и CF3. Группа R14 выбрана из Н, метила и этила. W выбран из =СН- и =N-. X выбран из СН2, О, S, SO2, NH, групп, представляющих собой N - низший алкил и N - низший алкенил. Группа Y1 выбрана из СО - низший алкил, СО - низший алкенил, СО(СН2)bY3, CO(CH2)bCOY3 и CO(CH2)bNHCOY3, где b означает 1-3. Группа Y2 выбрана из OR15, NR16R17 и NH(CH2)cCOY3, где с означает 1-3. Группа Y3 выбрана из алкила, низшего алкенила, OR15 и NR16R17. Группа R15 выбрана из Н, низшего алкила, низшего алкенила и (CH2)aR18, где а означает 0-4. Каждая из групп R16 и R17 независимо выбрана из Н, низшего алкила и (CH2)aR18 или вместе они представляют собой -(CH2)2-Z-(CH2)2-. Группа R18 представляет собой ОН, фенильную группу или ароматический гетероцикл, выбранный из пиридила, пиримидинила, пиразинила, фурила, тиенила, пирролила, имидазолила, пиразолила, оксазолила, изоксазолила, тиазолила, изотиазолила, триазолила, оксадиазолила и тиадиазолила, каждый из которых возможно может иметь заместитель, представляющий собой группу низший алкил или алкенил. Z выбран из О, СН2, S, SO2, NH, N - низший алкил и N - низший алкенил.
В других аспектах настоящего изобретения предложены фармацевтическая композиция, в которой одним из активных агентов является соединение общей формулы 1, применение соединения общей формулы 1 для приготовления такой фармацевтической композиции и способы лечения некоторых медицинских состояний.
Подробное описание изобретения
В первом аспекте настоящего изобретения предложены соединения, которые представляют собой производные общей формулы 1

Кольцо, включающее в себя А1-А4, представляет собой пяти- или шестичленную карбоциклическую или гетероциклическую группу. Окружность из точек внутри этой группы предназначена для того, чтобы показать, что кольцо содержит соответствующее для ароматического кольца определенного размера количество двойных и одинарных связей, а именно две двойные связи и три одинарные связи для пятичленного кольца и три двойные связи и три одинарные связи для шестичленного кольца. При определенных условиях, зависящих от природы А4, каждый из А1-А3 может быть выбран из А5 и А6, где А5 может представлять собой либо =CR13-, либо =N-, и А6 может представлять собой -NR14-, -О- или -S-. А4 может представлять собой либо ковалентную связь, либо А5. Если А4 представляет собой ковалентную связь, так что кольцо, включающее в себя А1-А4, представляет собой пятичленное кольцо, то один из А1-А3 должен представлять собой А6, а два других должны представлять собой А5. Если А4 представляет собой А5, так что указанное кольцо представляет собой шестичленное кольцо, то все А1-А3 должны представлять собой А5. Эти ограничения учитывают, что кольцо имеет одну из следующих четырех частичных структур:

Для частичных структур 2-4 две группы, представленные А5, не зависят друг от друга, так что обе могут представлять собой =N- или =CR13-, или одна может представлять собой =N-, а другая =CR13-. Аналогично в частичной структуре 5 четыре группы, представленные А5, являются независимыми, так что все группы могут представлять собой =N-, все группы могут представлять собой =CR13-, или от одной до трех групп могут представлять собой =N-, a остальные =CR13-. Кроме того, если =CR13- появляется в соединении более одного раза, то значение R13 при каждом появлении не зависит от других. Во всех случаях 1,3-связь между карбонильным и аминометильным заместителями сохраняется.
Группа R1 может быть выбрана из Н (атома водорода), NHY1 и COY2. В любом из этих случаев группа R2 представляет собой Н. Альтернативно и R1, и R2 могут представлять собой метил или вместе могут представлять собой =O, чтобы образовать карбонильную группу.
Каждая из групп R3, R4 и R5 независимо выбрана из Н, групп, представляющих собой низший алкил и низший алкенил.
Каждая из групп R6, R7, R8, R9, R10, R11 и R12 независимо выбрана из Н, групп, представляющих собой низший алкил и низший алкенил, NH2, галогенов (F, Cl и Br), O-алкил, CH2NMe2 и CF3.
Группа R13 выбрана из Н, F, Cl, Br, NO2, NH2, ОН, Me, Et, OMe, NMe2 и CF3.
Группа R14 выбрана из Н, метила и этила.
W выбран из =СН- и =N-.
Х выбран из CH2, О, S, SO2, NH, N - низший алкил и N - низший алкенил.
Группа Y1 выбрана из СО - низший алкил, СО - низший алкенил, CO(CH2)bY3, CO(CH2)bCOY3 и CO(CH2)bNHCOY3, где b означает 1-3.
Группа Y2 выбрана из OR15, NR16R17 и NH(CH2)cCOY3, где с означает 1-3.
Группа Y3 выбрана из низшего алкила, низшего алкенила, OR15 и NR16R17.
Группа R15 выбрана из Н, низшего алкила, низшего алкенила и (CH2)aR18, где а означает 0-4.
Каждая из групп R16 и R17 независимо выбрана из Н, низшего алкила, низшего алкенила и (CH2)aR18, или вместе они представляют собой -(CH2)2-Z-(СН2)2-.
Группа R18 представляет собой ОН, фенильную группу или ароматический гетероцикл, выбранный из пиридила, пиримидинила, пиразинила, фурила, тиенила, пирролила, имидазолила, пиразолила, оксазолила, изоксазолила, тиазолила, изотиазолила, триазолила, оксадиазолила и тиадиазолила, каждый из которых возможно может иметь заместитель, представляющий собой группу низший алкил или низший алкенил.
Z выбран из О, СН2, S, SO2, NH, групп, представляющих собой N - низший алкил и N - низший алкенил.
В контексте настоящего описания группы, представляющие собой низший алкил, включают в себя линейные, разветвленные и циклические алкильные группы, содержащие до шести атомов углерода, включая метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, трет-амил, неопентил, циклопропил, циклогексил, циклопропилметил и тому подобное, но не ограничиваясь этим. Группы, представляющие собой низший алкенил, включают в себя мононенасыщенные линейные, разветвленные и циклические алкенильные группы, содержащие до шести атомов углерода, включая аллил, бут-2-енил, циклопент-3-енил и тому подобное, но не ограничиваясь этим. Алкенильные группы, где двойная связь находится в точке присоединения, такие как винил и 1-пропенил, не рассматриваются в качестве групп, представляющих собой низший алкенил, в контексте настоящего описания.
Некоторые соединения общей формулы 1 способны образовывать соли с кислотами или основаниями. Например, соединения общей формулы 1, которые имеют кислотную функциональную группу, могут образовывать натриевые, калиевые, кальциевые, магниевые или тетраалкиламмониевые соли после обработки соответствующим гидроксидом, карбонатом или бикарбонатом, или триалкиламмониевые соли после взаимодействия с соответствующим амином. Альтернативно соединения общей формулы 1, которые имеют основную группу, могут образовывать соли присоединения с неорганическими и органическими кислотами, такими как соляная кислота, серная кислота, фосфорная кислота, уксусная кислота, трифторуксусная кислота, бензойная кислота, памовая кислота, лимонная кислота, фумаровая кислота, метансульфоновая кислота и тому подобное. В той степени, в какой эти соли являются фармацевтически приемлемыми, они включены в объем настоящего изобретения.
Соединения общей формулы 1 могут содержать один или более чем один стереогенный ("асимметрический") центр. Такие соединения проявляют оптическую изомерию и поэтому могут существовать в виде энантиомеров или диастереомеров. Такие изомеры, в чистом виде или в виде смесей, включая рацемические смеси, но не ограничиваясь ими, также включены в объем настоящего изобретения.
В предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где и R3 и R4 представляют собой Н.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где R5 представляет собой группу, представляющую собой низший алкил или низший алкенил и более предпочтительно метильную группу.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где все А1, А2, А3 и А4 представляют собой А5. Более предпочтительно все они представляют собой =CR13- или три из них представляют собой =CR13- и один представляет собой =N-. Еще более предпочтительно А1, А3 и А4 представляют собой =СН- и А2 представляет собой =CR13-. Наиболее предпочтительно А1, А3 и А4 представляют собой =СН- и А2 представляет собой =CF- или =CCl-. В альтернативном, более предпочтительном воплощении один из А1, А2, А3 и А4 представляет собой =N-, а другие представляют собой =СН-. Наиболее предпочтительно А1 представляет собой =N-, а А2, А3 и А4 представляют собой =СН-.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где А4 представляет собой ковалентную связь. Более предпочтительно А1 и один из А2 и А3 представляют собой А5, а другой представляет собой А6. Наиболее предпочтительно А1 представляет собой А5, один из А2 и А3 представляет собой =СН-, а другой представляет собой -S-.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где по меньшей мере три из R6-R10 представляют собой Н. Более предпочтительно четыре из R6-R10 представляют собой Н и один представляет собой галоген или трифторметил. Наиболее предпочтительно R6, R7, R9 и R10 представляют собой Н и R8 представляет собой галоген или трифторметил.
В другом предпочтительном воплощении настоящего изобретения предложено соединение общей формулы 1, где R1 представляет собой COY2 и R2 представляет собой Н. Более предпочтительно Y2 представляет собой NR16R17 или NHCH2COY3. Наиболее предпочтительно Y2 представляет собой NH-CH2-R18 или NHCH2CONHCH3, где R18 представляет собой пиридил или 3-метил-1,2,4-оксадиазол-5-ил.
Соединения общей формулы 1 могут быть получены двумя способами, как описано в следующей схеме.
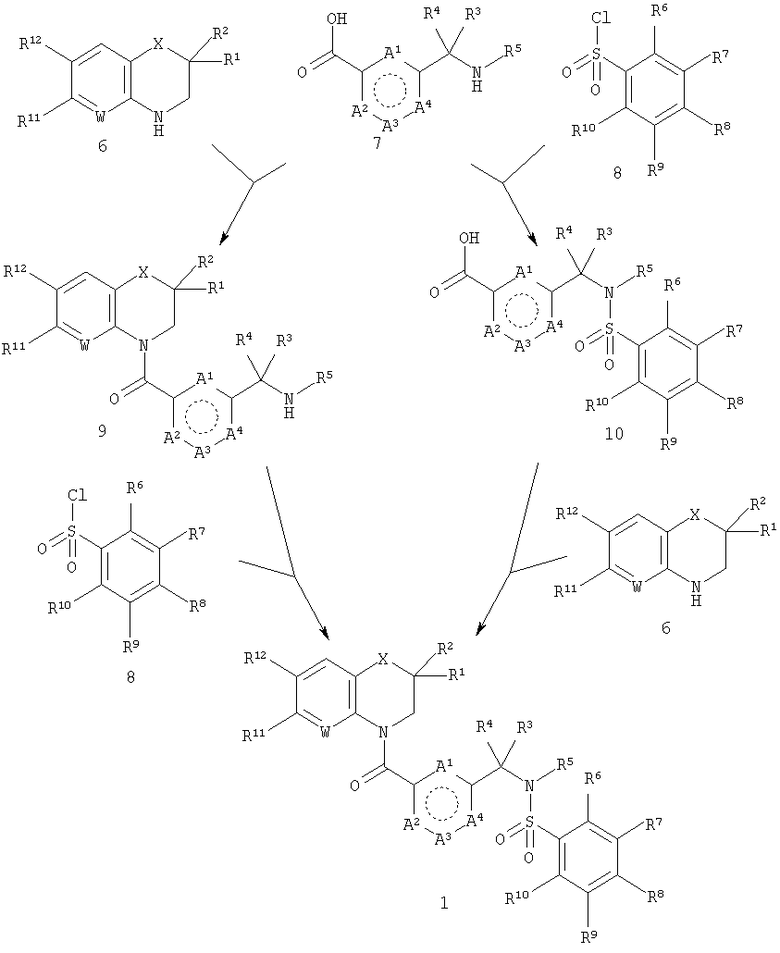
Требуются три исходных соединения, соответствующих общим формулам 6, 7 и 8. Либо 6 и 7 объединяют с получением промежуточного соединения общей формулы 9, либо 7 и 8 объединяют с получением промежуточного соединения общей формулы 10. Затем либо 8 и 9, либо 6 и 10 объединяют с получением продукта общей формулы 1. На определенных стадиях синтеза обычно необходимо использовать подходящие защитные группы, чтобы избежать побочных реакций. Использование таких защитных групп хорошо известно в данной области техники. Например, см. Greene, TW; "Protective Groups in Organic Synthesis", Wiley, New York, 1999. В частности, аминогруппа исходного вещества 7, вероятно, будет несовместима с условиями, необходимыми для осуществления взаимодействия 6 с 7, и, следовательно, должна быть защищена. Подходящие защитные группы представляют собой, например, трет-бутилоксикарбонильную (Boc) и бензилоксикарбонильную (Z) группы. Для группы карбоновой кислоты соединения 7 также может потребоваться защита. Если это так, то она может быть защищена в виде сложного эфира, такого как метиловый, этиловый, трет-бутиловый или бензиловый эфир.
Из схемы видно, что две стратегии синтеза требуют одинаковых химических превращений и отличаются только порядком, в котором они выполняются. Эти два превращения представляют собой
1) образование амида из карбоновой кислоты и циклического амина (6+7→9; 6+10→1) и
2) образование сульфонамида из сульфонилхлорида и амина (7+8→10; 8+9→1).
Образование амида представляет собой хорошо известную реакцию. Карбоновую кислоту и амин смешивают в подходящем растворителе, который обычно представляет собой апротонный растворитель, такой как дихлорметан или диметилформамид, и добавляют агент конденсации. В настоящее время большинство таких агентов доступно. Подходящие агенты включают в себя карбодиимиды, такие как дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIC) и N-(диметиламинопропил)-N'-(этил)карбодиимид (водорастворимый карбодиимид, WSC·HCl), производные фосфора, такие как гексафтор-фосфат (бензотриазол-1-илокси)трис(диметиламино)фосфония (ВОР), гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония (товарный знак РуВОР) и бис-(2-оксо-3-оксазолидинил)фосфинхлорид (BOP-CI), и производные мочевины, такие как гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU). Третичный амин также может быть включен в реакционную смесь. Примеры таких третичных аминов включают в себя триэтиламин, диизопропилэтиламин и 4-диметиламинопиридин. Взаимодействие обычно осуществляют при комнатной температуре или при более низкой температуре, такой как 0°С или -20°С. В тех случаях, когда реакция протекает медленно, смесь также можно нагревать до температуры, не превышающей точку кипения растворителя.
Образование сульфонамида также представляет собой хорошо известную реакцию. Обычно сульфонилхлорид и амин смешивают в апротонном растворителе, таком как дихлорметан или диметилформамид, в присутствии третичного амина (например, триэтиламина, диизопропилэтиламина и 4-диметиламинопиридина). Добавлять агент конденсации не нужно. Реакцию обычно проводят приблизительно при комнатной температуре.
Исходные соединения (6, 7 и 8) получают согласно опубликованным способам или путем модификации этих способов. В некоторых случаях может быть необходимо или желательно выполнять заключительные модификации молекулы после того, как эти три компонента будут объединены. Такие дополнения и модификации будут очевидны для специалиста в данной области техники.
Соединения общей формулы 1 являются мощными и специфическими антагонистами рецептора GnRH. Поэтому они полезны в лечении состояний, где GnRH вовлечен в патофизиологию. Например, эти соединения могут быть использованы для лечения некоторых гормон-зависимых видов рака, таких как рак молочной железы или предстательной железы. Они также могут быть использованы для лечения нераковых состояний, таких как доброкачественная гиперплазия предстательной железы и эндометриоз. Благодаря их способности блокировать высвобождение LH и FSH эти соединения могут быть использованы для регуляции фертильности. Они могут быть использованы в качестве контрацептивных агентов либо для мужчин, либо для женщин. Они также могут быть использованы при осуществлении программ искусственного оплодотворения, где необходимо регулировать уровни циркулирующих гормонов с целью оптимизации возможности получения зрелых яйцеклеток. Они также могут быть использованы для контроля криминального антиобщественного поведения.
Поэтому во втором аспекте настоящего изобретения предложено применение соединения общей формулы 1 в качестве терапевтического агента в медицине или ветеринарии. При использовании по этому назначению соединение будут приготавливать и вводить так же, как уже известно в данной области техники и как более подробно будет описано ниже.
В предпочтительном воплощении это соединение используют для лечения гормон-зависимого рака, доброкачественной гиперплазии предстательной железы или эндометриоза, в качестве контрацептивного агента, в качестве вспомогательного средства при осуществлении программы искусственного оплодотворения или в качестве агента, модифицирующего поведение. В другом предпочтительном воплощении это соединение используют в медицине.
В третьем аспекте настоящего изобретения предложена фармацевтическая композиция, отличающаяся тем, что в качестве активного агента она включает в себя по меньшей мере одно соединение общей формулы 1. Композиция может быть твердой, такой как таблетка, капсула, порошок, суппозиторий или тому подобное, или жидкой, такой как раствор, суспензия, эмульсия или крем. Композиция может включать в себя такие эксципиенты, которые обычно известны в данной области техники, включая наполнители, связывающие агенты, разбавители, диспергирующие агенты, смазывающие агенты, растворители, консерванты и корригенты.
В предпочтительном воплощении композиция представляет собой таблетку или капсулу, подходящую для перорального введения.
В другом предпочтительном воплощении композиция предназначена для лечения гормон-зависимого рака, доброкачественной гиперплазии предстательной железы или эндометриоза, в качестве контрацептивного агента, в качестве вспомогательного средства при осуществлении программы искусственного оплодотворения или в качестве агента, модифицирующего поведение.
В четвертом аспекте настоящего изобретения предложено применение соединения общей формулы 1 в качестве компонента фармацевтической композиции.
В пятом аспекте настоящего изобретения предложен новый способ лечения в медицине или ветеринарии, отличающийся тем, что субъекту вводят терапевтически эффективное количество соединения общей формулы 1, для того чтобы достичь желаемого результата.
Соединение, приготовленное в виде подходящей фармацевтической композиции, может быть введено любым подходящим путем, включая пероральное, трансбуккальное, назальное, легочное, ректальное, вагинальное, трансдермальное, внутримышечное, подкожное и внутривенное введение. Вводимое количество и частота, с которой повторяют введение, будут определены лечащим врачом (или ветеринаром) с учетом состояния и истории болезни субъекта и желаемого терапевтического результата. Обычная доза для человека будет находиться в диапазоне от 0,1 до 500 мг. Дозу можно вводить один раз в день или до четырех раз в день. Курс лечения может включать в себя однократное введение или повторное введение в течение периода от нескольких дней или недель до нескольких лет, если состояние, подлежащее лечению, является хроническим.
В предпочтительном воплощении субъект представляет собой мужчину или женщину.
В другом предпочтительном воплощении состояние, подлежащее лечению, представляет собой гормон-зависимый рак. Более предпочтительно оно представляет собой рак предстательной железы или рак молочной железы.
В другом предпочтительном воплощении, состояние, подлежащее лечению, представляет собой эндометриоз.
В другом предпочтительном воплощении состояние, подлежащее лечению, представляет собой доброкачественную гиперплазию предстательной железы.
В другом предпочтительном воплощении состояние, подлежащее лечению, представляет собой бесплодие. В частности, лечение является частью программы искусственного оплодотворения.
В другом предпочтительном воплощении целью лечения является обеспечение контрацепции.
В другом предпочтительном воплощении субъект представляет собой "лицо, совершившее половое преступление", то есть субъект, совершивший сексуальные нападения на других людей.
Настоящее изобретение, описанное выше, далее описано с помощью следующих примеров, которые предназначены для иллюстрации изобретения, а не для ограничения каким-либо образом объема изобретения.
Примеры
Хроматография означает флэш-хроматографию на силикагеле, если не указано иначе.
А. Синтез промежуточных соединений.
Бензоморфолин
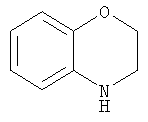
2H-1,4-Бензоксазин-3(4Н)-он (4,5 г, 30 ммоль) добавляли порциями к перемешиваемой суспензии алюмогидрида лития (4,7 г, 120 ммоль) в тетрагидрофуране (ТГФ) (100 мл) и кипятили с обратным холодильником в течение 3 ч. Смесь охлаждали на бане лед/вода и при перемешивании добавляли раствор аммиака (8 мл) и воду (40 мл). Смесь фильтровали через целит и концентрировали. Хроматография (50% EtOAc/50% 60-80 петролейного эфира) дала бензоморфолин (3,7 г, 91%) в виде светло-коричневого масла.
Пиридо[3,2-b]морфолин
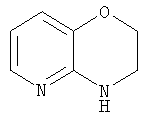
2H-Пиридо[3,2-b]-1,4-оксазин-3(4H)-он (1,9 г, 12,6 ммоль) добавляли к суспензии алюмогидрида лития (2,0 г, 53 ммоль) в сухом ТГФ (100 мл) при охлаждении на бане лед/вода. Смесь нагревали до 60°С и перемешивали в течение 4 ч. Смесь снова охлаждали на бане лед/вода и медленно добавляли воду (20 мл), затем этилацетат (200 мл). Смесь фильтровали и разделяли. Органическую фазу промывали водой и рассолом, сушили и концентрировали с получением пиридо[3,2-b]морфолина (1,5 г, 89%) в виде белого твердого вещества.
Этилбензоморфолин-2-карбоксилат
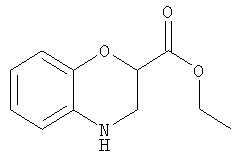
Этил-2,3-дибромпропионат (24 г, 92 ммоль) добавляли по каплям к кипящему при температуре дефлегмации раствору о-аминофенола (10 г, 92 ммоль) и карбоната калия (15 г, 110 ммоль) в ацетоне (100 мл). Через 18 ч смесь охлаждали и концентрировали. Добавляли этилацетат и воду и смесь разделяли. Органическую фазу промывали рассолом, фильтровали и концентрировали. Хроматография (30% EtOAc/70% 60-80 петролейного эфира) дала этилбензоморфолин-2-карбоксилат (4,5 г, 24%) в виде красного масла.
Бензоморфолин-2-карбоновая кислота
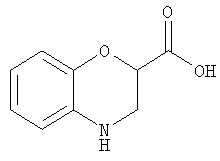
Раствор гидроксида лития (290 мл, 7,0 ммоль) в воде (10 мл) добавляли к раствору этилбензоморфолин-2-карбоксилата (750 мг, 3,6 ммоль) в диоксане (15 мл). Смесь перемешивали в течение 18 ч и концентрировали с получением бензоморфолин-2-карбоновой кислоты в виде литиевой соли, которую использовали без дополнительной очистки.
1,2,3,4-Тетрагидрохиноксалин-2-он

а) Гидрохлорид метилового эфира глицина (2,2 г, 18 ммоль), диизопропилэтиламин (2,9 г, 29 ммоль), 18-краун-6 (370 мг, 1,4 ммоль) и фторид калия (1,6 г, 28 ммоль) добавляли к раствору 1-фтор-2-нитробензола (2 г, 14 ммоль) в ацетонитриле (150 мл). Смесь нагревали при 80°С в течение 48 ч и охлаждали. Добавляли 0,3 н. гидросульфат калия и этилацетат и смесь разделяли. Органическую фазу промывали водой и рассолом, фильтровали через бумагу для разделения фаз и концентрировали. Хроматография (15% EtOAc/85% 60-80 петролейного эфира) дала метиловый эфир N-(2-нитрофенил)глицина в виде желтого твердого вещества (2,5 г, 85%).
б) Раствор метилового эфира N-(2-нитрофенил)глицина (740 мг, 3,6 ммоль) в этилацетате (50 мл) и метаноле (25 мл) гидрировали при атмосферном давлении над каталитическим количеством 10%-ного палладия на углероде. Через 1 ч смесь фильтровали и концентрировали с получением 1,2,3,4-тетрагидрохиноксалин-2-она в виде желтого твердого вещества (530 мг, 99%).
3-Ацетамидо-1,2,3,4-тетрагидрохинолин
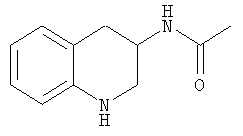
а) Ацетилхлорид (410 мг, 5,2 ммоль) и триэтиламин (620 мг, 6,2 ммоль) добавляли к раствору 3-аминохинолина (710 мг, 4,9 ммоль) в дихлорметане (50 мл) и смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли хлороформ (100 мл), смесь подкисляли 1 н. соляной кислотой (50 мл) и фазы разделяли. Водную фазу подщелачивали 1 н. раствором гидроксида натрия и экстрагировали смесью хлороформ/изопропанол (IPA) (85:15, 175 мл). Органический экстракт промывали водой, рассолом, сушили и концентрировали с получением 3-ацетамидохинолина (780 мг, 84%) в виде желтого твердого вещества.
б) Боран-пиридиновый комплекс (320 мг, 3,5 ммоль) добавляли к раствору 3-ацетамидохинолина (320 мг, 1,7 ммоль) в уксусной кислоте (20 мл) и смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли хлороформ (150 мл) и смесь промывали 2 н. раствором гидроксида натрия, водой и рассолом. Органическую фазу сушили и концентрировали.
Хроматография (80% EtOAc/20% 60-80 петролейного эфира) дала 3-ацетамидо-1,2,3,4-тетрагидрохинолин (180 мг, 55%) в виде бледно-желтого твердого вещества.
N-(2-Гидроксиэтил)бензоморфолин-2-карбоксамид
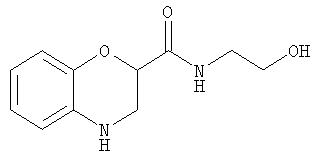
НОВТ (1-гидроксибензотриазол) (3,1 г, 20 ммоль) добавляли к раствору бензоморфолин-2-карбоксилата лития (2,6 г, 15 ммоль) в дихлорметане (75 мл) и диметилформамиде (ДМФ) (7,0 мл) и охлаждали на бане лед/вода. Добавляли WSC·HCl (3,2 г, 17 ммоль), смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч. Смесь снова охлаждали на бане лед/вода и добавляли этаноламин (1,0 г, 17 ммоль) и триэтиламин (2,8 мл, 2,0 г, 20 ммоль).
Перемешивание продолжали при комнатной температуре в течение 3 дней. Смесь концентрировали и растворяли в этилацетате и 0,3 н. растворе гидросульфата калия. Фазы разделяли. Органическую фазу промывали насыщенным раствором гидрокарбоната натрия и водную фазу снова экстрагировали этилацетатом и хлороформом. Объединенные органические фазы сушили и концентрировали. Хроматография (6% метанола/94% хлороформа) дала N-(2-гидроксиэтил)бензоморфолин-2-карбоксамид (1,1 г, 33%) в виде коричневой смолы.
N-(3-Метил-1,2,4-оксадиазол-5-илметил)бензоморфолин-2-карбоксамид
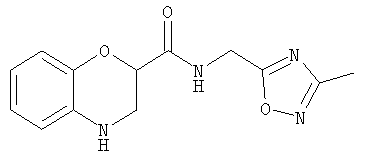
НОВТ (1,0 г, 6,5 ммоль) и WSC·HCl (1,1 г, 5,8 ммоль) добавляли к раствору бензоморфолин-2-карбоксилата лития (900 мг, 5,0 ммоль) в дихлорметане (25 мл) и ДМФ (4,0 мл) при охлаждении на бане лед/вода. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 45 мин. Добавляли триэтиламин (0,73 мл, 530 мг, 5,2 ммоль) и раствор 3-метил-1,2,4-оксадиазол-5-илметиламина (590 мг, 5,2 ммоль, полученного согласно Н.Biere et al., Liebigs Ann. Chem. 1749 (1986)) в дихлорметане (5,0 мл) и смесь перемешивали в течение 18 ч. Смесь концентрировали, растворяли в этилацетате и промывали 0,3 н. гидросульфатом калия, насыщенным гидрокарбонатом натрия и рассолом. Органическую фазу сушили и концентрировали. Хроматография (80% этилацетата/20% 60-80 петролейного эфира) дала N-(3-метил-1,2,4-оксадиазол-5-илметил)бензоморфолин-2-карбоксамид (900 мг, 65%) в виде коричневой смолы.
трет-Бутил-N-(3-хлор-2-(метилоксикарбонил)тиофен-4-метил)-N-метилкарбамат
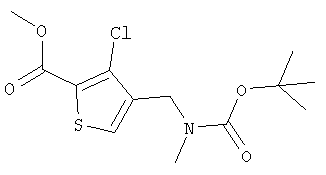
а) Раствор метил-3-хлор-4-метилтиофенкарбоксилата (10 г, 53 ммоль), N-бромсукцинимида (9,4 г, 53 ммоль) и азо-бис-(изобутиронитрила) (860 мг, 5,3 ммоль) в тетрахлориде углерода (300 мл) кипятили с обратным холодильником в течение 18 ч. Смесь фильтровали и концентрировали. Хроматография (10% EtOAc/90% гексанов) дала метил-4-бромметил-3-хлортиофен-2-карбоксилат (5,5 г, 39%) в виде белого твердого вещества.
б) Раствор метил-4-бромметил-3-хлортиофен-2-карбоксилата (7,6 г, 28 ммоль) в смеси насыщенный аммиак/этанол (200 мл) перемешивали при комнатной температуре в течение 18 ч. Смесь концентрировали в вакууме, растирали в диэтиловом эфире и растворяли в диоксане (200 мл). Добавляли гидроксид натрия (3,4 г, 85 ммоль), ди-трет-бутилдикарбонат (9,2 г, 42 ммоль) и воду (200 мл) и смесь перемешивали в течение 18 ч. Добавляли избыток гидроксида натрия и смесь нагревали при 70°С в течение 3 ч. Смесь промывали диэтиловым эфиром и подкисляли твердым гидросульфатом калия. Смесь экстрагировали этилацетатом и дихлорметаном, сушили и концентрировали с получением трет-бутил-N-(3-хлор-2-карбокситиофен-4-метил)карбамата (6,0 г, 73%) в виде коричневого масла.
в) Гидрид натрия (60%-ная дисперсия, 820 мг, 21 ммоль) добавляли к раствору трет-бутил-N-(3-хлор-2-карбокситиофен-4-метил)карбамата (2,0 г, 6,8 ммоль) в ДМФ (30 мл) при охлаждении на бане лед/вода. Смесь оставляли нагреваться до комнатной температуры в течение 1 ч. Добавляли йодметан (4,0 мл) и смесь перемешивали в течение 18 ч. Добавляли воду и смесь подкисляли разбавленным раствором гидросульфата калия и экстрагировали EtOAc. Органическую фазу промывали водой и рассолом, сушили и концентрировали. Хроматография (20% EtOAc/80% гексанов) дала трет-бутил-N-(3-хлор-2-(метилоксикарбонил)тиофен-4-метил)-N-метилкарбамат (1,52 г, 70%) в виде коричневого масла.
Этил-2-(метиламинометил)тиазол-4-карбоксилат
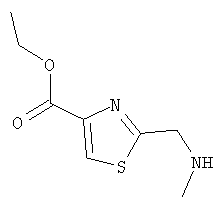
а) Раствор этил-2-метилтиазол-4-карбоксилата (5,0 г, 29 ммоль), N-бромсукцинимида (6,2 г, 35 ммоль) и азо-бис-(изобутиронитрила) (480 мг, 2,9 ммоль) в тетрахлориде углерода (150 мл) кипятили с обратным холодильником в течение 18 ч. Смесь фильтровали и концентрировали. Хроматография (20% EtOAc/80% гексанов и 30% EtOAc/70% гексанов) дала этил-2-бромметилтиазол-4-карбоксилат (3,25 г, 44%).
б) Раствор этил-2-бромметилтиазол-4-карбоксилата (4,25 г, 17 ммоль) в ТГФ (50 мл) по каплям добавляли к раствору метиламина в ТГФ (2 М, 30 мл, 60 ммоль) при охлаждении до -10°С. Смесь оставляли нагреваться до комнатной температуры и перемешивали еще в течение 30 мин. Смесь разбавляли EtOAc и промывали 0,3 н. раствором гидросульфата калия и рассолом. Органическую фазу сушили и концентрировали с получением этил-2-(метиламинометил)тиазол-4-карбоксилата (3,06 г, 70%) в виде оранжевого масла, которое использовали без дополнительной очистки.
трет-Бутил-N-метил-N-(3-(метилоксикарбонил)бензил)карбамат
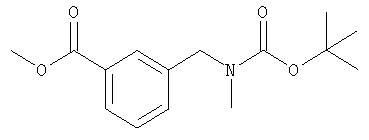
а) Смесь 3-цианобензойной кислоты (5,0 г, 34 ммоль), 10%-ного палладия на углероде (1 г) и концентрированной соляной кислоты (3 мл) в метаноле (150 мл) перемешивали в токе газообразного водорода при атмосферном давлении в течение 6 ч. Смесь фильтровали через Celite®, концентрировали и подвергали азеотропной перегонке с толуолом. Остаток растворяли в 1 М растворе гидрокарбоната калия (105 мл) и диоксане (50 мл) и охлаждали на бане лед/вода. Добавляли раствор ди-трет-бутилдикарбоната (7,9 г, 36 ммоль) в диоксане (25 мл) и смесь оставляли нагреваться до комнатной температуры. После перемешивания в течение 3 дней диоксан удаляли в вакууме. Водный остаток промывали 60-80 петролейным эфиром, подкисляли 1 н. соляной кислотой и экстрагировали этилацетатом. Органическую фазу промывали рассолом, сушили и концентрировали с получением трет-бутил-N-(3-карбоксибензил)карбамата (8,2 г, 86%) в виде белого твердого вещества.
б) Гидрид натрия (60%-ная дисперсия, 700 мг, 18 ммоль) добавляли к раствору трет-бутил-N-(3-карбоксибензил)карбамата (2,0 г, 8,0 ммоль) в ДМФ (40 мл) при охлаждении на бане лед/вода. Через 15 мин смесь оставляли нагреваться до комнатной температуры в течение 15 мин. Смесь снова охлаждали на бане лед/вода и добавляли йодметан (3,7 мл, 8,4 г, 60 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли воду и смесь концентрировали в вакууме. Добавляли этилацетат и 0,3 н. гидросульфат калия, смесь разделяли. Органическую фазу промывали рассолом, сушили и концентрировали. Хроматография (20% EtOAc, 80% 60-80 петролейного эфира) дала трет-бутил-N-метил-N-(3-(метилоксикарбонил)бензил)карбамат (1,6 г, 69%) в виде бесцветного масла.
трет-Бутил-N-(3-карбоксибензил)-N-метилкарбамат
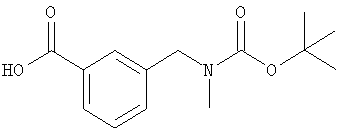
Моногидрат гидроксида лития (420 мг, 10 ммоль) и воду (15 мл) добавляли к раствору трет-бутил-N-метил-N-(3-(метилоксикарбонил)бензил)карбамата (1,6 г, 5,6 ммоль) в диоксане (20 мл) и смесь перемешивали в течение 2 ч. Диоксан удаляли в вакууме и остаток растворяли в 0,3 н. гидросульфате калия. Смесь экстрагировали этилацетатом, органическую фазу промывали водой и рассолом, сушили и концентрировали с получением трет-бутил-N-(3-карбоксибензил)-N-метилкарбамата (1,4 г, 95%).
трет-Бутил-(1-(4-карбокситиазол-2-ил)этил)карбамат
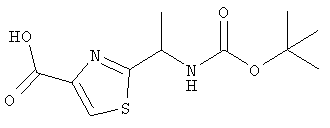
а) Гидрокарбонат калия (1,58 г, 15,7 ммоль) и этилбромпируват (2,1 мл, 16,9 ммоль) добавляли к раствору (R,S)-2-(трет-бутилоксикарбониламино)тиопропионамида (800 мг, 3,9 ммоль) в 1,2-диметоксиэтане (10 мл) при -10°С. Смесь перемешивали и оставляли нагреваться до 0°С в течение 2 ч и до комнатной температуры в течение 1,5 ч. Смесь фильтровали и твердое вещество промывали диэтиловым эфиром. Фильтрат концентрировали, растворяли в 1,2-диметоксиэтане (10 мл) и охлаждали до -30°С. К этому раствору добавляли трифторуксусный ангидрид (1,8 мл, 12,8 ммоль) и 2,6-лутидин (3,2 мл, 27,2 ммоль). Через 50 мин раствор концентрировали и распределяли между хлороформом и водой. Органический слой сушили и концентрировали с получением трет-бутил-(1-(4-(этилоксикарбонил)тиазол-2-ил)этил)карбамата (1,4 г) в виде сырого вещества, которое использовали непосредственно на следующей стадии.
б) Моногидрат гидроксида лития (165 мг, 3,9 ммоль) добавляли к раствору трет-бутил-(1-(4-(этилоксикарбонил)тиазол-2-ил)этил)карбамата (1,4 г сырого вещества) в ТГФ (25 мл) и воде (20 мл) и перемешивали при комнатной температуре в течение 18 ч. Добавляли дополнительное количество моногидрата гидроксида лития (165 мг) и перемешивание продолжали в течение 4 ч. ТГФ удаляли в вакууме, водный остаток подкисляли 1 н. соляной кислотой и дважды экстрагировали хлороформом. Объединенные органические слои промывали рассолом, сушили и концентрировали. Хроматография (хлороформ, метанол, уксусная кислота, 50:2:1) и перекристаллизация (EtOAc/гексаны) дала трет-бутил-(1-(4-карбокситиазол-2-ил)этил)карбамат (686 мг, 64% за две стадии).
Б. Синтез соединений по изобретению.
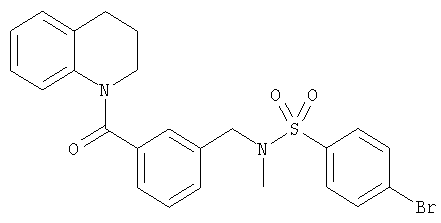
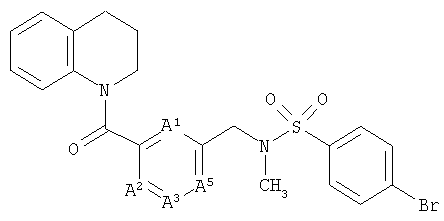
ПРИМЕР 1
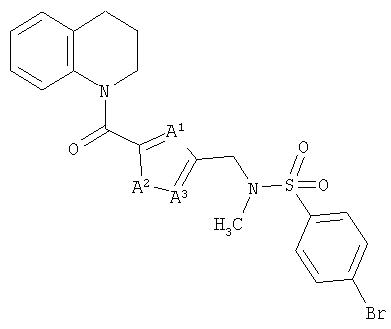
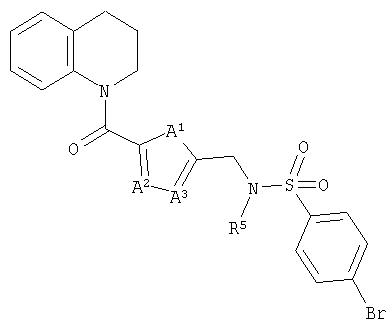
4-Бром-N-метил-N-(3-(1,2,3,4-тетрагидрохинолин-1-карбонил)бензил)бензолсульфонамид
а) 1,2,3,4-Тетрагидрохинолин (4,2 г, 31 ммоль) добавляли по каплям к раствору 3-цианобензоилхлорида (5,2 г, 31 ммоль) и триэтиламина (3,1 г, 31 ммоль) в дихлорметане (125 мл) при охлаждении на бане лед/вода. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. Эту смесь промывали 0,3 М раствором гидросульфата калия, насыщенным раствором гидрокарбоната натрия и рассолом. Органическую фазу фильтровали через бумагу для разделения фаз и концентрировали с получением 1-(3-цианобензоил)-1,2,3,4-тетрагидрохинолина (7,1 г, 86%).
б) Раствор 1-(3-цианобензоил)-1,2,3,4-тетрагидрохинолина (7,1 г, 27 ммоль) и соляной кислоты (2,2 мл) в метаноле (100 мл) гидрировали при атмосферном давлении в течение 8 ч над каталитическим количеством 10%-ного палладия на углероде. Смесь фильтровали через Celite® и концентрировали с получением гидрохлорида 1-(3-аминометилбензоил)-1,2,3,4-тетрагидрохинолина (8,1 г, 99%) в виде белого твердого вещества.
в) Ди-трет-бутилдикарбонат (7,1 г, 32 ммоль) добавляли к раствору гидрохлорида 1-(3-аминометилбензоил)-1,2,3,4-тетрагидрохинолина (8,1 г, 27 ммоль) и триэтиламина (7,5 мл, 54 ммоль) в дихлорметане (200 мл) и перемешивали в течение 18 ч. Смесь промывали 0,3 М раствором гидросульфата калия, водой, раствором гидрокарбоната натрия и рассолом. Органическую фазу сушили над сульфатом натрия, фильтровали через бумагу для разделения фаз и концентрировали. Хроматография (силикагель, 30% EtOAc, 70% 40-60 петролейного эфира) дала трет-бутил-N-(3-(1,2,3,4-тетрагидрохинолин-1-карбонил)бензил)карбамат (8,0 г, 84%) в виде белого твердого вещества.
г) Гидрид натрия (0,91 г, 60%-ная дисперсия в масле, 23 ммоль) добавляли к раствору трет-бутил-N-(3-(1,2,3,4-тетрагидрохинолин-1-карбонил)бензил)карбамата (8,0 г, 22 ммоль) в ДМФ в токе азота при охлаждении на бане лед/вода. Оставляли нагреваться до комнатной температуры в течение 45 мин. Смесь охлаждали на бане лед/вода и по каплям добавляли йодметан (9,8 г, 68 ммоль). Оставляли нагреваться до комнатной температуры и перемешивали в течение 5 ч. Добавляли 0,3 н. гидросульфат калия и смесь экстрагировали EtOAc. Органическую фазу промывали водой, сушили над сульфатом натрия и упаривали. Хроматография (30% EtOAc, 70% 60-80 петролейного эфира) дала трет-бутил-N-метил-N-(3-(1,2,3,4-тетрагидрохинолин-1-карбонил)бензил)карбамат (7,7 г, 93%) в виде желтой смолы.
д) Раствор трет-бутил-N-метил-N-(3-(1,2,3,4-тетрагидрохинолин-1-карбонил)бензил)карбамата (7,7 г, 20 ммоль) в растворе 4 н. хлороводорода в диоксане (20 мл) перемешивали в течение 30 мин. Смесь концентрировали и подвергали азеотропной перегонке с толуолом и дихлорметаном с получением гидрохлорида 1-(3-метиламинометилбензоил)-1,2,3,4-тетрагидрохинолина в виде стеклообразного вещества (6,3 г, 99%).
е) 1-(3-Метиламинометилбензоил)-1,2,3,4-тетрагидрохинолин в виде свободного основания выделяли путем водной обработки HCl-соли насыщенным раствором гидрокарбоната натрия, экстракции дихлорметаном и концентрирования в вакууме. 4-Бромбензолсульфонилхлорид (41 мг, 0,16 ммоль) добавляли к раствору свободного основания (42 мг, 0,15 ммоль) и триэтиламина (30 мкл, 0,20 ммоль) в дихлорметане (10 мл) и перемешивали в течение 3 ч. Смесь упаривали и подвергали хроматографии (35% EtOAc/65% 60-80 петролейного эфира) с получением 4-бром-N-метил-N-(3-(1,2,3,4-тетрагидрохинолин-1-карбонил)бензил)бензолсульфонамида в виде белого твердого вещества (40 мг, 53%).
1H-ЯМР (CDCl3): 1.88-2.08 (2Н, m), 2.35 (3Н, s), 2.65-2.75 (2Н, m), 3.70-3.90 (2Н, m), 3.95 (2Н, s), 6.55-6.62 (1Н, m), 6.75 (1Н, t, J=8 Гц), 6.90 (1H, t, J=8 Гц), 7.05-7.15 (2Н, m), 7.20-7.35 (3Н, m), 7.50-7.65 (4Н, m).
Масс-спектрометрия с ионизацией электрораспылением (МСИЭР), m/z=499.4, 501.4 (50:50, MH+).
Микроанализ. Найдено: С 57.79%; Н 4.69%; N 5.76%. Рассчитано для С24Н23BrN2O3S: С 57.72%; Н 4.64%; N 5.61%.
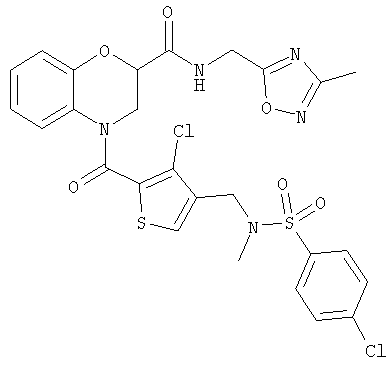
ПРИМЕР 2
4-(3-Хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбонил)-N-(3-метил-1,2,4-оксадиазол-5-илметил)бензоморфолин-2-карбоксамид
а) 4-Хлорбензолсульфонилхлорид (10 г, 47 ммоль) добавляли к раствору гидрохлорида метиламина (3,5 г, 52 ммоль) и триэтиламина (16,5 мл, 12,0 г, 119 ммоль) в дихлорметане (100 мл) при охлаждении на бане лед/вода. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. Смесь концентрировали, и хроматография (30% EtOAc/70% гексанов) дала 4-хлор-N-метилбензолсульфонамид (7,9 г, 81%) в виде бесцветного масла.
б) Гидрид натрия (60%-ная дисперсия, 150 мг, 3,8 ммоль) добавляли к раствору 4-хлор-N-метилбензолсульфонамида (640 мг, 3,1 ммоль) в ДМФ (12 мл) при охлаждении на бане лед/вода. После перемешивания в течение 15 мин смесь оставляли нагреваться до комнатной температуры и перемешивали еще в течение 30 мин. Добавляли метил-4-бромметил-3-хлортиофен-2-карбоксилат (1,08 г, 4,0 ммоль) и смесь перемешивали в течение 18 ч. Добавляли 0,3 н. раствор гидросульфата калия и смесь упаривали. Смесь экстрагировали этилацетатом и органический экстракт промывали рассолом, сушили и концентрировали. Хроматография (25% EtOAc/75% 60-80 петролейного эфира) дала метил-3-хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбоксилат (1,25 г, 79%) в виде белого твердого вещества.
в) Гидроксид лития (210 мг, 5,0 ммоль) и воду (10 мл) добавляли к раствору метил-3-хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбоксилата (990 мг, 2,5 ммоль) в диоксане (20 мл) и смесь перемешивали в течение 18 ч. Смесь упаривали и добавляли 0,3 н. гидросульфат калия. Смесь экстрагировали этилацетатом, органические экстракты промывали водой и рассолом, сушили и концентрировали с получением 3-хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбоновой кислоты (800 мг, 84%) в виде белого твердого вещества.
г) Раствор 3-хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбоновой кислоты (57 мг, 0,15 ммоль) в тионилхлориде (2 мл) и дихлорметане (5 мл) кипятили с обратным холодильником в течение 1 ч. Смесь охлаждали и концентрировали в вакууме. Остаток добавляли к раствору N-{3-метил-1,2,4-оксадиазол-5-илметил)бензоморфолин-2-карбоксамида (40 мг, 0,15 ммоль) и триэтиламина (42 мкл, 0,30 ммоль) в дихлорметане (10 мл) и перемешивали при комнатной температуре в течение 3 дней. Смесь концентрировали, и хроматография (30% EtOAc/70% гексанов и 100% EtOAc) дала 4-(3-хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбонил)-N-(3-метил-1,2,4-оксадиазол-5-илметил)бензоморфолин-2-карбоксамида в виде бесцветного масла (31 мг, 33%).
1H-ЯМР (CDCl3): 2.37 (3Н, s), 2.65 (3Н, s), 4.01 (1Н, dd, J=6.9 Гц, 13.3 Гц), 4.09 (2Н, s), 4.38 (1H, dd, J=3.0 Гц, 13.3 Гц), 4.72 (1H, dd, J=5.4 Гц.17.3 Гц), 4.82 (1H, dd, J=6.2 Гц, 17.3 Гц), 4.91 (1H, dd, J=3.0 Гц, 6.9 Гц), 6.81-6.92 (1H, m), 7.03-7.14 (3Н, m), 7.28 (1H, s), 7.51 (1H, s) 7.52 (2Н, d, J=8.4 Гц), 7.74 (2Н, d, J=8.4 Гц).
Масс-спектрометрия с химической ионизацией при атмосферном давлении (ХИАД МС), m/z=635.9 (МН+).
ПРИМЕР 3
4-(3-Хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)-тиофен-2-карбонил)-N-(2-гидроксиэтил)бензоморфолин-2-карбоксамид
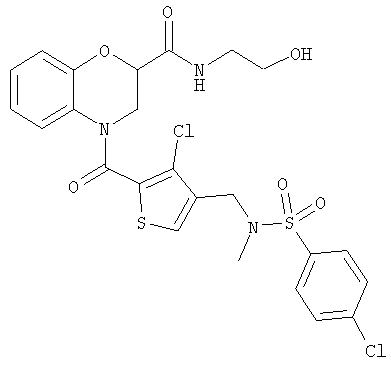
а) трет-Бутилдиметилсилилхлорид (135 мг, 0,9 ммоль) добавляли к раствору N-(2-гидроксиэтил)бензоморфолин-2-карбоксамида (185 мг, 0,83 ммоль) и имидазола (61 мг, 0,90 ммоль) в ДМФ (3 мл) при охлаждении на бане лед/вода. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. Смесь концентрировали, растворяли в этилацетате, промывали 0,3 н. гидросульфатом калия и рассолом, фильтровали через бумагу для разделения фаз и концентрировали. Хроматография (70% EtOAc/30% 60-80 петролейного эфира) дала N-(2-(трет-бутилдиметилсилилоксиэтил)бензоморфолин-2-карбоксамид (230 мг, 82%) в виде коричневой смолы.
б) 3-Хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбоновую кислоту (69 мг, 0,18 ммоль) растворяли в тионилхлориде (5 мл) и нагревали до температуры дефлегмации в течение 90 мин. Смесь охлаждали, концентрировали и растворяли в дихлорметане (5 мл). Этот раствор добавляли к раствору N-(2-(трет-бутилдиметилсилилоксиэтил)бензоморфолин-2-карбоксамида (61 мг, 0,18 ммоль) и триэтиламина (84 мкл, 0,6 ммоль) в дихлорметане (5 мл). Смесь перемешивали в течение 1 ч и концентрировали. Хроматография (40% EtOAc/60% 60-80 петролейного эфира) дала N-(2-трет-бутилдиметилсилилоксиэтил)-4-(3-хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбонил)бензоморфолин-2-карбоксамид (65 мг, 52%) в виде белого твердого вещества.
в) Раствор фторида тетрабутиламмония в ТГФ (1,0 М, 1,0 мл, 1,0 ммоль) добавляли к раствору N-(2-трет-бутилдиметилсилилоксиэтил)-4-(3-хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбонил)бензоморфолин-2-карбоксамида (65 мг, 0,093 ммоль) в ТГФ (4,0 мл) и перемешивали в течение 1 ч. Смесь концентрировали, растворяли в этилацетате, промывали 1 н. соляной кислотой и рассолом, фильтровали и концентрировали. Хроматография (95% 60-80 петролейного эфира/5% EtOAc) дала 4-(3-хлор-4-(N-(4-хлорбензолсульфонил)-N-метиламинометил)тиофен-2-карбонил)-N-(2-гидроксиэтил)бензоморфолин-2-карбоксамид в виде белого твердого вещества (25 мг, 46%).
1Н-ЯМР (CDCl3): 2.67 (3Н, s), 3.36-3.46 (2Н, m), 3.64-3.70 (2Н, m), 4.09-4.16 (4Н, m), 4.85 (1Н, t, J=4.2 Гц), 6.85-6.90 (2Н, m), 7.01-7.10 (2Н, m), 7.25-7.29 (1Н, m), 7.51 (1Н, s), 7.53 (2Н, d, J=8.4 Гц), 7.74 (2Н, d, J=8.4 Гц).
ХИАД МС m/z=584 (MH+).
ПРИМЕР 4
4-(3-Хлор-4-(N-(4-хлор-3-нитробензолсульфонил)-N-метиламинометил)тиофен-2-карбонил)бензоморфолин
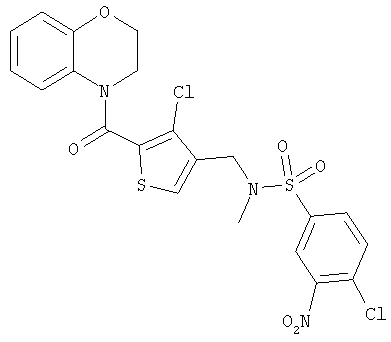
а) 1 н. гидроксид лития (водн.) (7,0 мл, 7,0 ммоль) добавляли к раствору трет-бутил-N-(3-хлор-2-(метилоксикарбонил)тиофен-4-метил)-N-метилкарбамата (1,52 г, 4,75 ммоль) в диоксане (20 мл) и смесь перемешивали при комнатной температуре в течение 18 ч. Смесь разбавляли этилацетатом, подкисляли 1 н. гидросульфатом калия (водн.) и разделяли. Органическую фазу промывали водой и рассолом, сушили и концентрировали с получением трет-бутил-N-(2-карбокси-3-хлортиофен-4-метил)-N-метилкарбамата в виде бесцветного масла (1,38 г, 95%).
б) Бензоморфолин (405 мг, 3,0 ммоль) и триэтиламин (0,49 мл, 356 мг, 3,5 ммоль) добавляли к раствору трет-бутил-N-(3-хлор-2-карбокситиофен-4-метил)-N-метилкарбамата (0,73 г, 2,5 ммоль) в дихлорметане (10 мл) и смесь охлаждали на бане лед/вода. Добавляли Pybrop® (1,4 г, 3,0 ммоль) и смесь перемешивали в течение 10 мин. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 дней. Смесь промывали водой, сушили над сульфатом натрия и концентрировали. Хроматография (25% EtOAc/75% 60-80 петролейного эфира) дала смесь продукта и непрореагировавшего бензоморфолина. Эту смесь растворяли в этилацетате, дважды промывали 1 н. соляной кислотой, один раз рассолом, сушили над сульфатом натрия и концентрировали с получением трет-бутил-N-(2-(бензоморфолин-4-карбонил)-3-хлортиофен-4-метил)-N-метилкарбамата (0,70 г, 66%) в виде светло-коричневой смолы.
в) Раствор 4 н. хлороводорода в диоксане (5 мл) добавляли к раствору трет-бутил-N-(2-(бензоморфолин-4-карбонил)-3-хлортиофен-4-метил)-N-метилкарбамата (0,70 г, 1,7 ммоль) в диоксане (10 мл) при охлаждении до 12°С. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. Смесь концентрировали в вакууме и подвергали азеотропной перегонке с толуолом и 60-80 петролейным эфиром с получением гидрохлорида 4-(3-хлор-4-(метиламинометил)тиофен-2-карбонил)бензоморфолина (0,58 г, 95%) в виде белого твердого вещества.
г) 4-Хлор-3-нитробензолсульфонилхлорид (0,46 г, 1,8 ммоль) добавляли к раствору гидрохлорида 4-(3-хлор-4-(метиламинометил)тиофен-2-карбонил)бензоморфолина (0,54 г, 1,49 ммоль) и триэтиламина (0,50 мл, 0,36 г, 3,6 ммоль) в дихлорметане (20 мл) при охлаждении на бане лед/вода. Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 3 дней. Смесь концентрировали и подвергали хроматографии с получением 4-(3-хлор-4-(N-(4-хлор-3-нитробензолсульфонил)-N-метиламинометил)тиофен-2-карбонил)бензоморфолина (0,61 г, 76%) в виде белого кристаллического твердого вещества.
1Н-ЯМР (d6 ДМСО): 2.61 (3Н, s), 3.86-3.98 (2Н, m), 4.17 (2Н, s), 4.30-4.40 (2Н, m), 6.75 (1Н, dt, J=1.5, 8.4 Гц), 6.91 (1Н, dd, J=1.5, 8.4 Гц), 7.05 (1Н, dt, J=1.5, 8.4 Гц), 7.20 (1Н, d, J=8.4 Гц), 7.85 (1Н, s), 8.04 (1Н, d, J=8.4 Гц), 8.10 (1Н, dt, J=2.0, 8.4 Гц), 8.50 (1Н, d, J=2.0 Гц).
МСИЭР m/z=541.6 (MH+).
ПРИМЕР 5
4-(4-(N-(3-Амино-4-хлорбензолсульфонил)-N-метиламинометил)-3-хлортиофен-2-карбонил)бензоморфолин
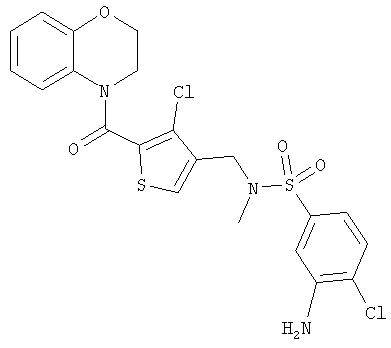
Смесь 4-(3-хлор-4-(N-(4-хлор-3-нитробензолсульфонил)-N-метиламинометил)тиофен-2-карбонил)бензоморфолина (200 мг, 0,37 ммоль) и цинковой пыли (400 мг) в ледяной уксусной кислоте (10 мл) нагревали при 100°С в течение 5 ч. Смесь охлаждали на бане лед/вода и разбавляли водой. Медленно добавляли гранулы гидроксида натрия (5 г) для получения рН 14. Смесь экстрагировали дихлорметаном, сушили над сульфатом натрия и концентрировали. Флэш-хроматография (35% EtOAc/65% 60-80 петролейного эфира) дала смесь продукта и непрореагировавшего исходного вещества. Препаративная высокоэффективная жидкостная хроматография (ВЭЖХ) этой смеси дала 4-(4-(N-(3-амино-4-хлорбензолсульфонил)-N-метиламинометил)-3-хлортиофен-2-карбонил)бензоморфолин (102 мг, 54%) в виде белого твердого вещества.
1Н-ЯМР (d6 ДМСО): 2.51 (3Н, s), 3.92 (2Н, t, J=4.3 Гц), 4.03 (2Н, s), 4.34 (2Н, J=4.3 Гц), 6.76 (1Н, t, J=6.9 Гц), 6.88-6.96 (2Н, m), 7.05 (1Н, t, J=6.9 Гц), 7.18-7.30 (2Н, m), 7.45 (1Н, d, J=8.4 Гц), 7.86 (1Н, s).
ХИАД MC m/z=512 (MH+).
ПРИМЕР 6
1-(2-(N-(4-Бромбензолсульфонил)-N-метиламинометил)тиазол-4-карбонил)-1,2,3,4-тетрагидрохинолин
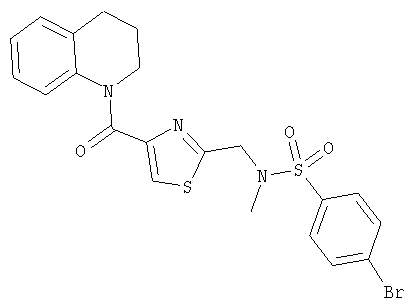
а) 4-Бромбензолсульфонилхлорид (2,1 г, 8,2 ммоль) добавляли к раствору этил-2-(метиламинометил)тиазол-4-карбоксилата (1,5 г, 7,5 ммоль) и триэтиламина (2,1 мл, 1,5 г, 15 ммоль) в дихлорметане (30 мл) и смесь перемешивали в течение 18 ч. Смесь разбавляли этилацетатом и промывали 1 н. гидросульфатом калия, водой и рассолом, сушили и концентрировали. Хроматография (35% EtOAc/65% гексанов) дала этил-2-(N-(4-бромбензолсульфонил)-N-метиламинометил)тиазол-4-карбоксилат (2,1 г, 67%) в виде белого твердого вещества.
б) Этил-2-(N-(4-бромбензолсульфонил)-N-метиламинометил)тиазол-4-карбоксилат (2,1 г, 5,2 ммоль) добавляли к смеси 1 н. раствора гидроксида лития (10 мл, 10 ммоль) и диоксана (20 мл) и нагревали до 50°С до тех пор, пока не получали раствор. Смесь перемешивали при комнатной температуре еще в течение 3 дней. Смесь упаривали, растворяли в EtOAc и подкисляли 1 н. раствором гидросульфата калия. Фазы разделяли и органическую фазу промывали водой и рассолом, сушили и концентрировали с получением 2-(N-(4-бромбензолсульфонил)-N-метиламинометил)тиазол-4-карбоновой кислоты (1,86 г, 95%) в виде белого твердого вещества.
в) Тионилхлорид (2,0 мл) добавляли к раствору 2-(N-(4-бромбензолсульфонил)-N-метиламинометил)тиазол-4-карбоновой кислоты (460 мг, 1,2 ммоль) в дихлорметане (20 мл) и раствор кипятили с обратным холодильником в течение 2 ч. Смесь охлаждали до комнатной температуры, концентрировали в вакууме и подвергали азеотропной перегонке с толуолом с получением белого твердого вещества. Это вещество растворяли в дихлорметане (20 мл) и добавляли к нему триэтиламин (0,34 мл, 250 мг, 2,4 ммоль) и 1,2,3,4-тетрагидрохинолин (0,18 мл, 190 мг, 1,4 ммоль). После перемешивания в течение 1 ч смесь концентрировали в вакууме. Хроматография (50% EtOAc/50% гексанов) дала 1-(2-(N-(4-бромбензолсульфонил)-N-метиламинометил)тиазол-4-карбонил)-1,2,3,4-тетрагидрохинолин (580 мг, 97%) в виде белого твердого вещества.
1Н-ЯМР (CDCl3): 1.98 (2Н, квинтет, J=6.6 Гц), 2.60 (3Н, s), 2.75 (2Н, t, J=6.6 Гц), 3.87 (2Н, t, J=6.6 Гц), 4.36 (2Н, s), 6.62-6.78 (1Н, m), 6.85-6.90 (1Н, m) 6.95 (1H, dt, J=1.3, 7.3 Гц), 7.08 (1 H, d, J=7.3 Гц), 7.59-7.64 (4Н, m), 7.65 (1H, s).
МСИЭР m/z=506.1, 508.1 (50:50, MH+).
ПРИМЕР 7
4-Бром-N-метил-N-(3-(пиридо[3,2-b]морфолин-1-карбонил)бензил)бензолсульфонамид

a) WSC·HCl (470 мг, 2,5 ммоль) и 4-(диметиламино)пиридин (290 мг, 2,4 ммоль) добавляли к раствору трет-бутил-N-(3-карбоксибензил)-N-метилкарбамата (520 мг, 2,0 ммоль) и пиридо[3,2-b]морфолина (290 мг, 2,1 ммоль) в дихлорметане (25 мл). Смесь кипятили с обратным холодильником в течение 18 ч. Смесь концентрировали в вакууме, растворяли в этилацетате, промывали водой и рассолом, сушили и концентрировали. Хроматография (40% EtOAc/60% 60-80 петролейного эфира) дала трет-бутил-N-метил-N-(3-(пиридо[3,2-b]морфолин-1-карбонил)бензил)карбамат (700 мг, 94%) в виде бесцветного масла.
б) Раствор трет-бутил-N-метил-N-(3-(пиридо[3,2-b]морфолин-1-карбонил)бензил)карбамата (610 мг, 1,6 ммоль) в смеси 4 н. хлороводород/диоксан (30 мл) перемешивали в течение 1 ч. Смесь концентрировали в вакууме с получением дигидрохлорида 1-(3-(метиламинометил)бензоил)пиридо[3,2-b]морфолина (512 мг, 100%) в виде белого твердого вещества.
в) 4-Бромбензолсульфонилхлорид (31 мг, 0,12 ммоль) добавляли к раствору дигидрохлорида 1-(3-(метиламинометил)бензоил)пиридо[3,2-b]морфолина (35 мг, 0,11 ммоль) в дихлорметане (20 мл). рН доводили до 9 триэтиламином и смесь перемешивали в течение 18 ч. Смесь концентрировали в вакууме, растворяли в этилацетате, промывали водой и рассолом, сушили и концентрировали. Хроматография (80% хлороформа/20% циклогексана) дала 4-бром-N-метил-N-(3-(пиридо[3,2-b]морфолин-1-карбонил)бензил)бензолсульфонамид (42 мг, 77%) в виде твердого вещества белого цвета с желтоватым оттенком.
1Н-ЯМР (CDCl3): 2.49 (3Н, s), 4.09 (2Н, s), 4.13 (2Н, t, J=4.6 Гц), 4.46 (2Н, t, J=4.8 Гц), 6.87-6.91 (1Н, m), 7.19-7.51 (5Н, m), 7.52 (1Н, d, J=1.6 Гц), 7.63-7.71 (4Н, m).
МСИЭР m/z=502, 504 (50:50, MH+).
ПРИМЕР 8
4-Бром-N-метил-N-(3-(1,2,3,4-тетрагидрохиноксалин-3-он-1-карбонил)бензил)бензолсульфонамид

а) WSC·HCl (640 мг, 3,4 ммоль) и 4-(диметиламино)пиридин (330 мг, 2,7 ммоль) добавляли к раствору трет-бутил-N-(3-карбоксибензил)-N-метилкарбамата (700 мг, 2,6 ммоль) и 1,2,3,4-тетрагидрохиноксалин-2-она (440 мг, 2,9 ммоль) в дихлорметане (20 мл). Смесь перемешивали в течение 18 ч, концентрировали в вакууме и растворяли в этилацетате. Этот раствор промывали раствором 0,3 н. гидросульфата калия и насыщенным раствором гидрокарбоната натрия, сушили и концентрировали. Хроматография (50% EtOAc/50% 60-80 петролейного эфира) дала трет-бутил-N-(3-(1,2,3,4-тетрагидрохиноксалин-3-он-1-карбонил)бензил)-N-метилкарбамат (280 мг, 27%) в виде оранжевого масла.
б) Раствор трет-бутил-N-(3-(1,2,3,4-тетрагидрохиноксалин-3-он-1-карбонил)бензил)-N-метилкарбамата (280 мг, 0,71 ммоль) в смеси 4 н. хлороводород/диоксан (30 мл) перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали в вакууме, растворяли в хлороформе, промывали насыщенным раствором гидрокарбоната натрия и рассолом, сушили и концентрировали. Хроматография (10% метанола/90% хлороформа) дала 1-(3-(метиламинометил)бензоил-1,2,3,4-тетрагидрохиноксалин-3-он (98 мг, 49%) в виде оранжевого твердого вещества.
в) 4-Бромбензолсульфонилхлорид (29 мг, 0,11 ммоль) добавляли к раствору 1-(3-(метиламинометил)бензоил-1,2,3,4-тетрагидрохиноксалин-3-она (30 мг, 0,10 ммоль) в дихлорметане (10 мл). рН доводили до 9 триэтиламином и смесь перемешивали в течение 18 ч. Смесь концентрировали в вакууме, растворяли в этилацетате, промывали водой и рассолом, сушили и концентрировали. Хроматография (50% EtOAc/50% 60-80 петролейного эфира) дала 4-бром-N-метил-N-(3-(1,2,3,4-тетрагидрохиноксалин-3-он-1-карбонил)бензил)бензолсульфонамид (34 мг, 60%) в виде белого твердого вещества.
1Н-ЯМР (CDCl3): 2.46 (3Н, s), 4.06 (2Н, s), 4.59 (2Н, s), 6.66 (1Н, s), 6.76 (1Н, t, J=7.6 Гц), 6.97 (1Н, d, J=6.6 Гц), 7.06-7.12 (1Н, m), 7.21 (1Н, s), 7.31-7.43 (3Н, m), 7.63-7.71 (4Н, m), 8.97 (1Н, s).
МСИЭР m/z=514, 516 (50:50, MH+).
ПРИМЕР 9
3-Ацетамидо-1-(2-(N-(4-бромбензолсульфонил)-N-метиламинометил)тиазол-4-карбонил)-1,2,3,4-тетрагидрохинолин
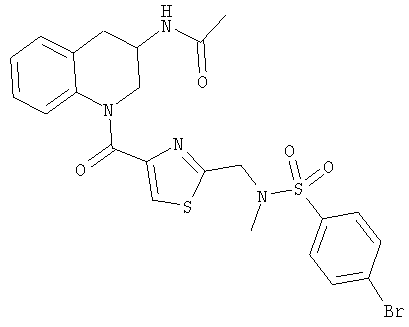
Тионилхлорид (5,0 мл) добавляли к раствору 2-(N-(4-бромбензолсульфонил)-N-метиламинометил)тиазол-4-карбоновой кислоты (250 мг, 0,64 ммоль) в дихлорметане (20 мл) и раствор кипятили с обратным холодильником в течение 2 ч. Смесь охлаждали и концентрировали в вакууме с получением хлорангидрида в виде белого твердого вещества. Этот хлорангидрид (130 мг, 0,32 ммоль) растворяли в дихлорметане (10 мл) и к нему добавляли 3-ацетамидо-1,2,3,4-тетрагидрохинолин (61 мг, 0,32 ммоль) и триэтиламин (0,089 мл, 65 мг, 0,64 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч и концентрировали в вакууме. Хроматография (EtOAc) дала 3-ацетамидо-1-(2-(N-(4-бромбензолсульфонил)-N-метиламинометил)тиазол-4-карбонил)-1,2,3,4-тетрагидрохинолин (96 мг, 53%) в виде белого твердого вещества.
1Н-ЯМР (CDCl3): 1.85 (3Н, s), 2.61 (3Н, s), 2.78 (1Н, dd, J=3.6 Гц, 16.8 Гц), 3.21 (1Н, dd, J=5.9 Гц, 16.8 ГЦ), 3.69 (1Н, dd, J=3.0 Гц, 12.9 Гц), 4.30-4.35 (3Н, m), 4.55-4.60 (1Н, m), 6.02 (1Н, d, J=7.6 Гц), 6.97-7.15 (3Н, m), 7.15-7.20 (1Н, m), 7.66 и 7.69 (каждый 2Н, каждый d, J=3.6 Гц), 7.88 (1Н, s).
МСИЭР m/z=563.0, 565.0 (50:50. МН+).
ПРИМЕР 10
1-(2-(1-(4-Бромбензолсульфониламино)этил)тиазол-4-карбонил)-1,2,3,4-тетрагидрохинолин
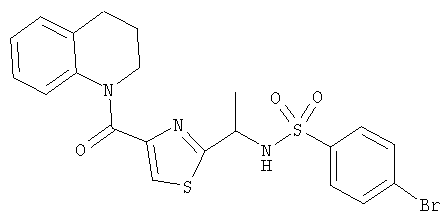
а) HBTU (306 мг, 0,81 ммоль) добавляли к раствору трет-бутил-(1-(4-карбокситиазол-2-ил)этил)карбамата (200 мг, 0,73 ммоль) в ДМФ (5 мл) при комнатной температуре. Добавляли диизопропилэтиламин (0,26 мл, 190 мг, 1,5 ммоль) и 1,2,3,4-тетрагидрохинолин (0,11 мл, 117 мг, 0,88 ммоль) и смесь перемешивали в течение 18 ч. Смесь распределяли между этилацетатом и 1 н. соляной кислотой и разделяли. Органический слой промывали водой и рассолом, сушили и концентрировали. Хроматография (45% EtOAc/55% гексанов) дала трет-бутил-(1-(4-(1,2,3,4-тетрагидрохинолин-1-карбонил)тиазол-2-ил)этил)карбамат (180 мг, 63%).
б) Раствор трет-бутил-(1-(4-(1,2,3,4-тетрагидрохинолин-1-карбонил)тиазол-2-ил)этил)карбамата (180 мг, 0,47 ммоль) в смеси 4 н. хлороводород/диоксан (10 мл) перемешивали на бане лед/вода и оставляли нагреваться до комнатной температуры. Смесь концентрировали и дважды подвергали азеотропной перегонке с толуолом, дважды с тетрахлорметаном и один раз с дихлорметаном с получением гидрохлорида 1-(2-(1-аминоэтил)тиазол-4-карбонил)-1,2,3,4-тетрагидрохинолина. Предполагалось, что выход является количественным, и это вещество использовали непосредственно, растворяя его в дихлорметане (5 мл) и триэтиламине (0,16 мл, 118 мг, 1,2 ммоль). Полученный раствор охлаждали на бане лед/вода и добавляли к нему 4-бромбензолсульфонилхлорид (119 мг, 0,47 ммоль). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. Упаривание и хроматография (50% EtOAc/50% гексанов) дали 1-(2-(1-(4-бромбензолсульфониламино)этил)тиазол-4-карбонил)-1,2,3,4-тетрагидрохинолин в виде белого твердого вещества (144 мг, 61%).
1Н-ЯМР (CDCl3): 1.38 (3Н, d, J=6.9 Гц), 2.05 (2Н, dt, J=3.3 Гц, 6.6 Гц), 2.79-2.84 (2Н, m), 3.80-4.01 (2Н, m), 4.56 (1Н, квинтет, J=6.9 Гц), 5.29 (1Н, d, J=7.6 Гц), 6.63-6.79 (1Н, br m), 6.94 (1Н, t, J=7.6 Гц), 7.07 (1Н, dt, J=1.3 Гц, 7.6 Гц), 7.18 (1Н, d, J=7.6 Гц), 7.58 (2Н, d, J=8.9 Гц), 7.59 (1Н, s), 7.64 (2Н, d, J=8.9 Гц).
МСИЭР m/z=506.0, 507.9 (50:50, MH+).
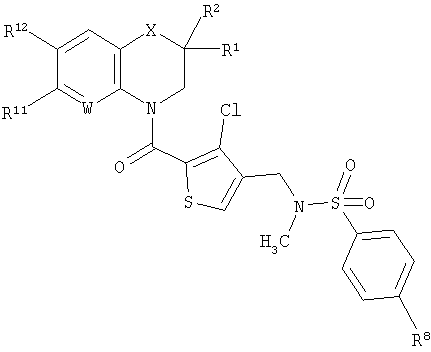
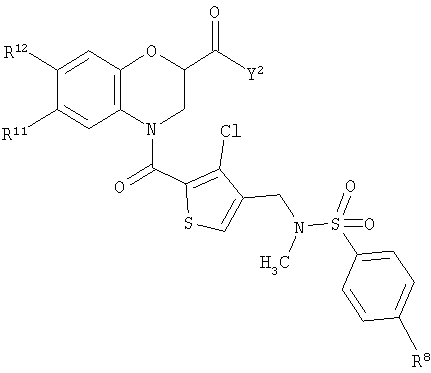
ПРИМЕРЫ 11-70
Соединения, приведенные в таблице, получали, используя аналогичные способы.
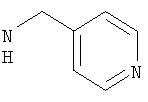
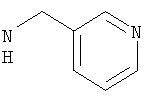

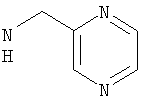
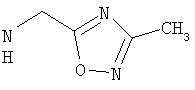

Соединения, описанные выше, вытесняют лиганд с радиоактивной меткой из GnRH-рецепторсодержащих мембранных препаратов при концентрациях ниже 5 мкМ.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТАГОНИСТЫ РЕЦЕПТОРА ВАЗОПРЕССИНА V | 2005 |
|
RU2370497C2 |
| ДИГИДРОНАФТИРИДИНЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ, ПОДХОДЯЩИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2804468C2 |
| Бензотиофены и родственные соединения в качестве агонистов STING | 2019 |
|
RU2806274C2 |
| ЗАМЕЩЕННЫЕ ДИАЛКИЛ (ОКСИДО)-Λ-СУЛЬФАНИЛИДЕН НИКОТИНАМИД ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2014 |
|
RU2711749C2 |
| МУЛЬТИЗАМЕЩЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ТРОМБИНА | 2011 |
|
RU2639876C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛО[3, 4-b]ПИРИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ), ПРИМЕНЕНИЕ (ВАРИАНТЫ), КОМПОЗИЦИЯ (ВАРИАНТЫ) | 2003 |
|
RU2357967C2 |
| ИНГИБИТОРЫ ФУРИНА | 2019 |
|
RU2799824C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИЗОХИНОЛИНА, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ СИНАПТИЧЕСКОГО ЗАХВАТА ДОПАМИНА И СПОСОБ ЛЕЧЕНИЯ | 2000 |
|
RU2293728C2 |
| СУЛЬФОНАМИДНЫЕ ПЕРИ-ЗАМЕЩЕННЫЕ БИЦИКЛЫ ДЛЯ ЛЕЧЕНИЯ ОККЛЮЗИОННОГО ПОРАЖЕНИЯ АРТЕРИЙ | 2005 |
|
RU2403240C2 |
| ИМИДАЗОПИРАЗИНЫ | 2012 |
|
RU2600327C2 |
Изобретение относится к непептидным антагонистам GnRH, имеющим общую формулу 1
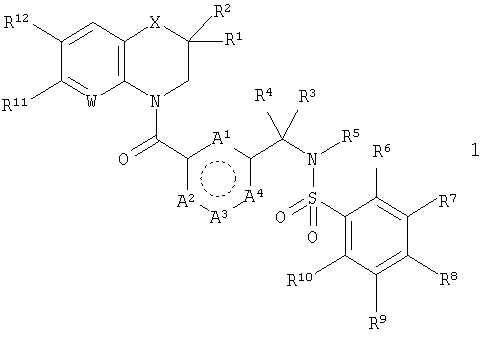
где каждый А1, А2 и А3 независимо выбран из А5 и А6; и А4 представляет собой либо ковалентную связь, либо А5, при условии, что если А4 представляет собой ковалентную связь, то один из А1-А3 представляет собой А6, а два других представляют собой А5, и что если А4 представляет собой А5, то все A1-A3 представляют собой А5; А5 выбран из C-R13 и N; А6 выбран из N-R14, S и О; R1 выбран из Н, NHY1 и COY2, и R2 представляет собой Н; или и R1, и R2 представляют собой метил или вместе представляют собой =O; каждый R3, R4 и R5 независимо представляет собой Н или низший алкил; каждый R6, R7, R8, R9, R10, R11 и R12 независимо выбран из Н, NH2, F, Cl, Br, O-алкил и CH2NMe2; R13 выбран из Н, F, Cl, Br, NO2, NH2, ОН, Me, Et, OMe и NMe2; R14 выбран из Н, метила и этила; W выбран из СН и N; Х выбран из СН2, О и NH; Y1 выбран из СО-низший алкил, CO(CH2)bY3, СО(СН2)bCOY3 и CO(CH2)bNHCOY3; Y2 выбран из OR15, NR16R17 и NH(CH2)cCOY3; Y3 выбран из алкила, OR15 и NR16R17; R15 представляет собой Н; каждый R16 и R17 независимо выбран из Н, низшего алкила и (CH2)aR18 или вместе они представляют собой -(CH2)2-Z-(СН2)2-; R18 выбран из ОН, пиридила, пиразинила и оксадиазолила; Z представляет собой NH; а означает 0-4; b и с означают 1-3. Также изобретение относится к применению соединений формулы 1 в качестве терапевтического агента и фармацевтической композиции, проявляющей активность антагониста рецептора GnRH. Также в данном изобретении описывается способ получения соединений формулы 1. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 5 н. и 22 з.п. ф-лы, 1 табл.
где каждый А1, А2 и А3 независимо выбран из А5 и А6 и
А4 представляет собой либо ковалентную связь, либо А5 при условии, что
если А4 представляет собой ковалентную связь, то один из А1-А3 представляет собой А6, а два других представляют собой А5, и что
если А4 представляет собой А5, то все А1-А3 представляют собой А5;
А5 выбран из C-R13 и N;
А6 выбран из N-R14, S и О;
R1 выбран из Н, NHY1 и COY2, и R2 представляет собой Н; или и R1, и R2 представляют собой метил или вместе представляют собой =O;
каждый R3, R4 и R5 независимо представляет собой Н или низший алкил;
каждый R6, R7, R8, R9, R10, R11 и R12 независимо выбран из Н, NH2, F, Cl, Br, O-алкил и CH2NMe2;
R13 выбран из Н, F, Cl, Br, NO2, NH2, ОН, Me, Et, OMe и NMe2;
R14 выбран из Н, метила и этила;
W выбран из СН и N;
Х выбран из СН2, О и NH;
Y' выбран из СО-низший алкил, СО(СН2)bY3, CO(CH2)bCOY3 и CO(CH2)bNHCOY3;
Y2 выбран из OR15, NR16R17 и NH(CH2)cCOY3;
Y3 выбран из алкила, OR15 и NR16R17;
R15 представляет собой Н;
каждый R16 и R17 независимо выбран из Н, низшего алкила и (СН2)аR18 или вместе они представляют собой -(CH2)2-Z-(CH2)2-;
R18 выбран из ОН, пиридила, пиразинила и оксадиазолила;
Z представляет собой NH;
а означает 0-4 и
b и с означают 1-3.
(3-метил-[1,2,4]оксадиазол-5-илметил)-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(2-гидрокси-этил)-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
4-хлор-N-[4-хлор-5-(2,3-дигидро-бензо[1,4]оксазин-4-карбонил)-тиофен-3-илметил]-N-метил-3-нитро-бензолсульфонамида,
3-амино-4-хлор-N-[4-хлор-5-(2,3-дигидро-бензо[1,4]оксазин-4-карбонил)-тиофен-3-илметил]-N-метил-бензолсульфонамида,
4-бром-N-[4-(3,4-дигидро-2Н-хинолин-1-карбонил)-тиазол-2-илметил]-N-метил-бензолсульфонамида,
N-[1-(2-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-тиазол-4-карбонил)-1,2,3,4-тетрагидро-хинолин-3-ил]-ацетамида,
4-бром-N-[4-хлор-5-(3,4-дигидро-2Н-хинолин-1-карбонил)-тиофен-3-илметил]-N-метил-бензолсульфонамида,
4-бром-N-[4-хлор-5-(2,3-дигидро-пиридо[3,2-b][1,4]оксазин-4-карбонил)-тиофен-3-илметил]-N-метил-бензолсульфонамида,
4-хлор-N-[4-хлор-5-(7-фтор-2,3-дигидро-бензо[1,4]оксазин-4-карбонил)-тиофен-3-илметил]-N-метил-бензолсульфонамида,
4-хлор-N-[4-хлор-5-(3,3-диметил-3,4-дигидро-2Н-хиноксалин-1-карбонил)-тиофен-3-илметил]-N-метил-бензолсульфонамида,
4-бром-N-[4-хлор-5-(3-оксо-3,4-дигидро-2Н-хиноксалин-1-карбонил)-тиофен-3-илметил]-N-метил-бензолсульфонамида,
метиламида 4-(4-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-3-хлор-тиофен-2-карбонил)-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(2-гидрокси-этил)-амида 4-(5-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-4-хлор-тиофен-3-карбонил)-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(2-гидрокси-этил)-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-6-метокси-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(2-гидрокси-этил)-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-7-фтор-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
метилового эфира {[4-(5-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-4-хлор-тиофен-3-карбонил)-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбонил]-амино}-уксусной кислоты,
метилкарбамоилметил-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
метилкарбамоилметил-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-6-метокси-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(пиридин-4-илметил)-амида 4-(5-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-4-хлор-тиофен-3-карбонил)-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(пиридин-3-илметил)-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(пиридин-3-илметил)-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-6-метокси-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(пиразин-2-илметил)-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-6-метокси-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(3-метил-[1,2,4]оксадиазол-5-илметил)-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-6-метокси-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
N-[1-(4-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-3-хлор-тиофен-2-карбонил)-1,2,3,4-тетрагидро-хинолин-3-ил]-ацетамида,
3-амино-N-[1-(4-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-3-хлор-тиофен-2-карбонил)-1,2,3,4-тетрагидро-хинолин-3-ил]-пропионамида,
(2-амино-этил)-амида 4-(4-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-3-хлор-тиофен-2-карбонил)-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
(2-амино-этил)-амида 4-(3-хлор-4-{[(4-хлор-бензолсульфонил)-метил-амино]-метил}-тиофен-2-карбонил)-6-метокси-3,4-дигидро-2Н-бензо[1,4]оксазин-2-карбоновой кислоты,
3-ацетиламино-N-[1-(4-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-3-хлор-тиофен-2-карбонил)-1,2,3,4-тетрагидро-хинолин-3-ил]-пропионамида,
4-ацетиламино-N-[1-(4-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-3-хлор-тиофен-2-карбонил)-1,2,3,4-тетрагидро-хинолин-3-ил]-бутирамида,
N-[1-(4-{[(4-бром-бензолсульфонил)-метил-амино]-метил}-3-хлор-тиофен-2-карбонил)-1,2,3,4-тетрагидро-хинолин-3-ил]-4-(3-этил-уреидо)-бутирамида,
4-бром-N-[5-(3,4-дигидро-2Н-хинолин-1-карбонил)-тиофен-3-илметил]-N-метил-бензолсульфонамида,
4-бром-N-[5-(3,4-дигидро-2Н-хинолин-1-карбонил)-фуран-2-ил]-N-метил-бензолсульфонамида,
4-бром-N-[6-(3,4-дигидро-2Н-хинолин-1-карбонил)-пиридин-2-илметил]-N-метил-бензолсульфонамида,
4-бром-N-[4-хлор-3-(3,4-дигидро-2Н-хинолин-1-карбонил)-бензил]-N-метил-бензолсульфонамида,
4-бром-N-[3-(3,4-дигидро-2Н-хинолин-1-карбонил)-4-фтор-бензил]-N-метил-бензолсульфонамида,
4-бром-N-[3-(3,4-дигидро-2Н-хинолин-1-карбонил)-4-нитро-бензил]-N-метил-бензолсульфонамида,
4-бром-N-[4-бром-3-(3,4-дигидро-2Н-хинолин-1-карбонил)-бензил]-N-метил-бензолсульфонамида
или их фармацевтически приемлемых солей.

где
каждый А1, А2 и А3 независимо выбран из А5 и А6 и
А4 представляет собой либо ковалентную связь, либо А5 при условии, что
если А4 представляет собой ковалентную связь, то один из А1-А3 представляет собой А6, а два других представляют собой А5, и что
если А4 представляет собой А5, то все А1-А3 представляют собой А5;
А5 выбран из C-R13 и N;
А6 выбран из N-R14, S и О;
R1 выбран из Н, NHY1 и COY2 и R2 представляет собой Н или и R1, и R2 представляют собой метил или вместе представляют собой =O;
каждый R3, R4 и R5 независимо представляет собой Н или низший алкил;
каждый R6, R7, R8, R9, R10, R11 и R12 независимо выбран из Н, NH2, F, Cl, Br, O-алкил и CH2NMe2;
R13 выбран из Н, F, Cl, Br, NO2, NH2, ОН, Me, Et, OMe и NMe2;
R14 выбран из Н, метила и этила;
W выбран из СН и N;
Х выбран из СН2, О и NH;
Y1 выбран из СО-низший алкил, СО(СН2)bY3, CO(CH2)bCOY3 и CO(CH2)bNHCOY3;
Y2 выбран из OR15, NR16R17 и NH(CH2)cCOY3;
Y3 выбран из алкила, OR15 и NR16R17;
R15 представляет собой Н;
каждый R16 и R17 независимо выбран из Н, низшего алкила и (СН2)аR18 или вместе они представляют собой -(CH2)2-Z-(CH2)2-;
R18 выбран из ОН, пиридила, пиразинила и оксадиазолила;
Z представляет собой NH;
а означает 0-4 и
b и с означают 1-3,
который включает в себя стадии:
а) взаимодействия соединения формулы 7
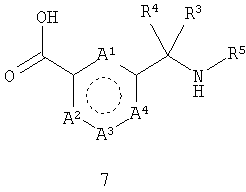
где А1-А4 и R3-R5 такие, как определено выше,
с соединением формулы 6
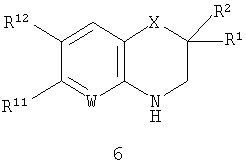
где R1, R2, R11 и R12, W и Х такие, как определено выше,
с получением соединения формулы 9
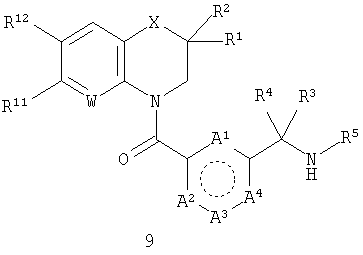
где A1-A4, R1-R5, R11, R12, W и X такие, как определено выше; и
б) взаимодействия полученного соединения формулы 9 с соединением формулы 8
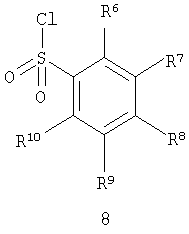
где R6-R10 такие, как определено выше.

где каждый А1, А2 и А3 независимо выбран из А5 и А6 и
А4 представляет собой либо ковалентную связь либо А5 при условии, что
если А4 представляет собой ковалентную связь, то один из А1-А3 представляет собой А6, а два других представляют собой А5, и что
если А4 представляет собой А5, то все А1-А3 представляют собой А5;
А5 выбран из C-R13 и N;
А6 выбран из N-R14, S и О;
К1 выбран из Н, NHY1 и COY2 и R2 представляет собой Н или и R', и R2 представляют собой метил или вместе представляют собой =O;
каждый R3, R4 и R5 независимо представляет собой Н или низший алкил;
каждый R6, R7, R8, R9, R10, R11 и R12 независимо выбран из Н, NH2, F, Cl, Br, O-алкил и CH2NMe2;
R13 выбран из Н, F, Cl, Br, NO2, NH2, ОН, Me, Et, OMe и NMe2;
R14 выбран из Н, метила и этила;
W выбран из СН и N;
Х выбран из СН2, О и NH;
Y1 выбран из СО-низший алкил, СО(СН2)bY3, СО(СН2)bCOY3 и CO(CH2)bNHCOY3;
Y2 выбран из OR15, NR16R17 и NH(CH2)cCOY3;
Y3 выбран из алкила, OR15 и NR16R17;
R15 представляет собой Н;
каждый R16 и R17 независимо выбран из Н, низшего алкила и (CH2)aR18 или вместе они представляют собой -(CH2)2-Z-(CH2)2-;
R18 выбран из ОН, пиридила, пиразинила и оксадиазолила;
Z представляет собой NH;
а означает 0-4 и
b и с означают 1-3,
который включает в себя стадии:
а) взаимодействия соединения формулы 7

где А1-А4 и R3-R5 такие, как определено выше,
с соединением формулы 8

где R6-R10 такие, как определено выше,
с получением соединения формулы 10
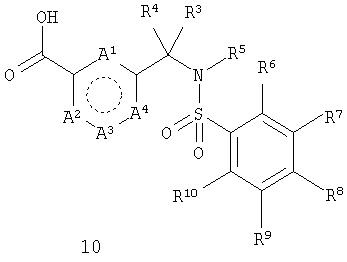
где А1-А4 и R3-R10 такие, как определено выше; и
б) взаимодействия полученного соединения формулы 10 с соединением формулы 6

где R1, R2, R11 и R12, W и Х такие, как определено выше.
| УСТРОЙСТВО ДЛЯ ПРИВЕДЕНИЯ ВО ВРАЩЕНИЕ МАШИН-ОРУДИЙ | 1937 |
|
SU53178A1 |
| Монобензоильное производное димера дигидрохинолина,проявляющее ингибирующие свойства в отношении меди и медных сплавов в среде,содержащей @ -ионы | 1982 |
|
SU1082785A1 |
Авторы
Даты
2008-07-20—Публикация
2003-03-12—Подача