ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новому применению аденилциклазного токсина Bordetella в приготовлении векторов для нацеливания in vivo представляющей интерес молекулы конкретно на экспрессирующие CD11b клетки. Данное изобретение относится также к иммуногенной композиции, которая примирует иммунные реакции, к фармацевтическим композициям и новому вектору для доставки молекул к экспрессирующим CD11b клеткам.
Bordetella pertussis, этиологический агент коклюша, секретирует несколько токсинов, в том числе хорошо известный токсин коклюша (РТ) и аденилатциклазный токсин (CyaA), или также аденилциклазу. CyaA является в мышиной респираторной модели критическим фактором вирулентности B. pertussis, который является необходимым для ранних стадий колонизации легких. Действительно, генетическая делеция этого токсина разительно уменьшает патологические эффекты инфекции B. pertussis, снижая число бактерий, извлекаемых из легких, и почти устраняя рекрутинг воспалительных клеток и повреждение легких, наблюдаемое после инфекции [Weiss et al., 1984; Weiss et al., 1989; Gross et al., 1992; Khelef et al., 1992; Khelef et al., 1994; Gueirard et al., 1998]. Кроме того, CyaA является защитным антигеном против инфекции B. pertussis в мышиной респираторной модели [Guiso et al., 1989; Guiso et al., 1991].
Первоначально обнаруженная Hewlett et al. в культуральных супернатантах B. pertussis [Hewlett et al., 1976] аденилциклаза, как было позднее обнаружено, активируется эукариотическим кальмодулином [Wolff et al., 1980]. Этот поразительный признак быстро нашел логическое обоснование, когда было показано Confer и Eaton, что аденилциклаза может проникать в эукариотические клетки, где при активации кальмодулином она может запускать процесс значительного увеличения цАМФ в этих клетках-мишенях [Confer et al., 1982].
Аденилциклаза кодируется геном cyaA, и его экспрессия, подобно экспрессии других генов вирулентности B. pertussis, координированно регулируется сигналами окружающей среды. Ген cyaA является частью оперона, который содержит также гены cyaB, D и Е, которые необходимы для секреции CyaA [Ladant et al., 1999].
Токсин CyaA является бифункциональным белком из 1706 остатков, который состоит из N-концевого каталитического домена из 400 аминокислот и С-концевой части из 1306 остатков, которая является ответственной за связывание этого токсина с мембраной клетки-мишени и последующую доставку этой каталитической части молекулы в цитозоль клетки [Sakamoto et al., 1992] [Ladant et al., 1999]. Эта часть проявляет также слабую гемолитическую активность вследствие ее способности образовывать катионселективные каналы в биологических мембранах [Benz et al., 1994] [Gray et al., 1998]. Этот район является гомологичным гемолизину Escherichia coli и другим членам семейства RTX (Repeat in ToXin) бактериальных токсинов. В частности, он содержит ряд богатых глицином и аспартатом нанопептидных повторов, которые участвуют в связывании кальция [Rose et al., 1995] [Coote et al., 1992].
Полипептид CyaA синтезируется в виде неактивного протоксина, который превращается в активный токсин в результате посттрансляционного пальмитоилирования двух внутренних лизинов (лизинов 856 и 963). Эта модификация требует продукта вспомогательного гена, cyaC, который локализован вблизи cyaA на хромосоме B. pertussis.
Было показано, что CyaA связывается с различными типами клеток и инвазирует различные типы клеток, в том числе клетки, не имеющие мембранного транспорта, такие как эритроциты млекопитающих [Rogel et al., 1992]. Это предполагает, что каталитический домен CyaA транслоцируется (перемещается) прямо через плазматическую мембрану клеток-мишеней. Интернализация каталитического домена в цитозоль клетки является кальций- и температурозависимым процессом и зависит от потенциала плазматической мембраны [Rogel et al., 1992] [Karimova et al., 1998] [Otero et al., 1995]. Однако молекулярные механизмы, посредством которых этот токсин транспортирует свой N-концевой каталитический домен через мембрану, в настоящее время являются в значительной степени неизвестными. Кроме того, не был известен специфический рецептор для связывания CyaA.
Физиологические последствия клеточной интоксикации посредством CyaA были охарактеризованы in vitro в фагоцитах. Confer и Eaton первые показали, что CyaA, экстрагированный из B. pertussis, увеличивает уровень внутриклеточного цАМФ в нейтрофилах или макрофагах, приводя к ингибированию хемотаксиса и бактерицидных функций, таких как генерирование супероксида и фагоцитарных свойств [Confer et al., 1982]. Эти активности были подтверждены позднее с очищенными токсинами или с бактериальными мутантами с генетической делецией CyaA [Pearson et al., 1987; Friedman et al., 1987] [Njamkepo et al., 2000]. В противоположность этому и вопреки значительным изменениям в их содержании цАМФ жизнеспособность клеточных линий не гематопоэтического происхождения, по-видимому, не подвергается влиянию интоксикации CyaA [Bassinet et al., 2000]. Кроме того, авторы данного изобретения показали ранее, что CyaA B. pertussis может запускать апоптоз макрофагов in vitro [Khelef et al., 1993; Khelef et al., 1995] и in vivo [Gueirard et al., 1998]. В этих моделях генетическая делеция CyaA устраняла апоптоз макрофагов, но не гибель нейтрофилов, что предполагает, что CyaA i) является ответственным за апоптоз макрофагов, ii) может быть ответственным за апоптоз нейтрофилов, но что за это может быть также ответственен и другой фактор.
Наряду с этим, исследования in vivo, выполненные на мышиной модели инфекции В. bronchiseptica (гомологе B. pertussis животных, CyaA которого является близкородственным), показали, что главной мишенью токсичности CyaA В. bronchiseptica является GM-CSF-зависимая и циклофосфамидчувствительная популяция, которая контролирует ранние стадии инфекции [Harvill et al., 1999]. Эти критерии идентифицировали нейтрофилы и, возможно, другие клетки, в том числе макрофаги или дендритные клетки, но не были описаны данные или высказаны предположения, что клеточный рецептор CD11b участвует в нацеливании посредством CyaA. Эти популяции клеток-мишеней для CyaA являются фактором, который лимитирует ранние фазы инфекции и способствует развитию адаптивной иммунной реакции, которая регулирует последние фазы инфекции [Harvill et al., 1999].
В противоположность другим токсинам, CyaA в течение продолжительного времени считался независимым от какого-либо рецептора связывания. В основе этого лежали наблюдения, что i) CyaA может вызывать интоксикацию большого разнообразия модельных клеточных линий различного происхождения [Ladant et al., 1999], ii) CyaA связывается с клетками Jurkat и овечьими эритроцитами, не обнаруживая насыщения [Gray et al., 1999]. Однако некоторая специфичность была обнаружена в отношении клеток, инфицируемых CyaA. Действительно, исследования in vivo показали, что во время мышиной респираторной инфекции видами Bordetella CyaA специфически разрушал лейкоциты (особенно макрофаги) без разительного повреждения эпителиальных клеток [Gueirard et al., 1998; Harvill et al., 1999].
В патентной заявке WO 93/21324 было предложено использование аденилциклазы Bordetella для индукции CD4+ Т-клеточной или CD8+ Т-клеточной реакции; однако поскольку не был идентифицирован специфический рецептор для аденилциклазы Bordetella, было неизвестно, связано ли представление этого антигена с поглощением неспецифической антигенпредставляющей клеткой с последующим примированием перекрестнореагирующим антигеном и представлением дендритными клетками, или этот антиген был нацелен на специфические антигенпредставляющие клетки (рАРС).
В соответствии с их поверхностным фенотипом, дендритные клетки (высокая экспрессия МНС I и II, костимуляторных молекул и молекул адгезии) представляют наиболее активные АРС во многих анализах in vitro для примирования "необученных" Т-клеток [Bell et al., 1999; Viola et al., 1999]. Другие АРС, такие, например, как покоящиеся "необученные" В-клетки, могли бы даже быть толерогенными (вызывающими толерантность), так как инъецирование покоящихся В-клеток самцов самкам-хозяевам приводит к специфической толеризации специфических для самцов CD8+ Т-клеток [Fuchs et al., 1992]. In vitro "необученные" В-клетки могли бы способствовать делеции "необученных" CD8+ Т-клеток через Fas-зависимый механизм [Bennet et al., 1998].
Кроме того, представление Ag (антигена) дендритными клетками коррелирует in vivo с индукцией Т-клеточных реакций. Это было установлено для МНС II-рестрицированного представления антигена (Ag). Инъекция Ag без адъюванта внутривенным путем (iv) обычно не индуцирует примирование Т-клеток [Kyburz et al., 1993; Aichele et al., 1994; Aichele et al., 1995] и приводит к представлению Ag неспецифическими В-клетками [Guery et al., 1997] [Zhong et al., 1997; Reis e Sousa et al., 1999] и в конечном счете дендритными клетками [Crowley et al., 1990] [Zhong et al., 1997; Reis e Sousa et al., 1999]. В противоположность этому, стратегии локальной иммунизации, например, подкожной (sc) иммунизации, обычно в присутствии адъюванта, вызывают индукцию примирования Т-клеток и нацеленное представление Ag Лангергансовой клеткой, мигрирующей из кожи в ЛУ (лимфатический узел), дренируя сайт иммунизации. В этом случае В-клетки и макрофаги не участвуют [Guery et al., 1996]. Подобные результаты были получены после подкожной (sc) или интрадермальной (id) ДНК-иммунизации для MHCII- и MHCI-пептидных комплексов: дендритные клетки могут быть непосредственно трансфицированы в локальном участке инъекции и затем могут мигрировать в афферентные ЛУ через афферентную лимфатическую систему [Condon et al., 1996; Casares et al., 1997; Porgador et al., 1998]. Эта миграция известна как ключевое событие иммунитета, так как механическое разрушение афферентной лимфатической системы аннулирует Т-клеточную реакцию на повышающие чувствительность кожи агенты или кожные трансплантаты [Zinkernagel et al., 1997].
Таким образом, нацеливание на дендритные клетки является существенным для стимуляции CD4+ и CD8+ Т-клеток. Поскольку большинство реакций в виде антител являются зависимыми от помощи CD4+ Т-клеток, нацеливание антигена на дендритные клетки является главной задачей в вакцинации.
Интерес авторов заявки лежал в исследовании представления аденилциклазы видов Bordetella Т-клеткой, и они идентифицировали специфическую рецепторную молекулу, присутствующую на специфических клетках, которая взаимодействует с CyaA и открывает новые возможности для применения CyaA в качестве белкового вектора для представляющих интерес молекул.
Генетически детоксицированные бактериальные токсины являются кандидатами в качестве вакцинных векторов, в частности для Т-эпитопа, вследствие их способности вторгаться в эукариотические клетки (Ladant et al., 1999). Однако было показано, что небольшое число белковых векторов примирует реакции ЦТЛ (цитотоксических Т-лимфоцитов) in vivo (Ballard et al., 1996; Cabonette et al., 1999). Кроме того, несмотря на многочисленные многообещающие исследования in vitro, не описан вектор, нацеленный исключительно на рАРС, в частности на дендритные клетки и более предпочтительно - на миелоидные дендритные клетки.
Авторы изобретения дополнительно показали, что другие клетки, в частности нейтрофилы, могли бы быть мишенями для векторов согласно изобретению.
Данное изобретение обеспечивает средства, которые могут, по меньшей мере частично, удовлетворить эти потребности, и предлагает новые векторы, которые могли бы конкретно нацеливать молекулы на определенные популяции рАРС, например, для обеспечения возможности стимуляции иммунной реакции.
Кроме того, молекула, нацеленная на эти рАРС и специфические лейкоциты, могла бы обеспечить получение новых векторов, применимых для доставки биологически активной молекулы к проксимальному окружению этих клеток. Например, эти молекулы могли бы модулировать функциональные свойства клеток-мишеней или клеток, участвующих в иммунной реакции или в воспалительной реакции.
В самом деле, авторы изобретения обнаружили, что аденилциклазный токсин Bordetella pertussis специфически связывается с клеточным рецептором, названным (CD11b/CD18) αМ/β2-рецептором, и что это взаимодействие является необходимым для внутриклеточной доставки аденилциклазного домена в цитозоль клеток и затем для смерти клеток. Интегрин αМ/β2 (CD11b/CD18) является димером семейства β2-интегринов, причем экспрессия этих интегринов ограничивается лейкоцитами. Характер распределения экспрессии CD11b/CD18 αМ/β2 у мыши и человека ограничивается его экспрессией в нейтрофилах/гранулоцитах, макрофагах, дендритных клетках, NK-клетках и субпопуляциях В- и Т- CD8+ лимфоцитов (Jeyaseelan et al., 2000; Arnaout et al., 1990).
Таким образом, этот рецептор представлял бы идеальную мишень для новых векторов, сконструированных, в частности, для Т-эпитоп-иммунизации.
В данном изобретении авторы показали, что аденилциклаза Bordetella может быть использована для нацеливания молекулы in vivo конкретно на экспрессирующие CD11b клетки.
В частности, в данном изобретении авторы заявки показали, что пептидный антиген, содержащийся в аденилциклазном токсине Bordetella pertussis, может быть эффективно нацелен конкретно на поверхность дендритных клеток, может транслоцироваться в цитозоль указанных дендритных клеток и примировать ЦТЛ-реакцию.
В конкретном варианте указанную реакцию получают без помощи адъюванта и CD4+ Т-клеток (Т-клеток-хелперов).
Было также показано, что генетически модифицированная аденилциклаза может быть химически связана с представляющим интерес пептидом для нацеливания указанного пептида на экспрессирующие CD11b клетки, в частности в цитозоль дендритных клеток.
Таким образом, данное изобретение обеспечивает новую эффективную иммуногенную композицию, а также новый вектор доставки лекарственного средства в экспрессирующие CD11b клетки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к применению аденилциклазы Bordetella в получении белкового вектора для нацеливания представляющей интерес молекулы конкретно в экспрессирующие CD11b клетки.
Данное изобретение относится также к применению аденилциклазы Bordetella, где указанную аденилциклазу рекомбинируют с антигеном и, в частности, модифицируют путем инсерции представляющего интерес пептида или модифицируют путем инсерции представляющей интерес молекулы для получения композиции для нацеливания указанных пептида или молекулы на экспрессирующие CD11b клетки.
Термин "специфически" означает в контексте данного изобретения, что аденилциклаза при использовании в качестве вектора для представляющей интерес молекулы преимущественно направляется к экспрессирующим CD11b клеткам, предоставляя тем самым средство для нацеливания представляющей интерес молекулы на поверхности указанных клеток или в указанных клетках селективным образом относительно других клеток.
В одном варианте данного изобретения представляющая интерес молекула направляется, в частности, к экспрессирующим CD11b клеткам.
В применении здесь термин "экспрессирующие CD11b клетки" относится к клеткам, которые экспрессируют CD11b/CD18 αМ/β2-рецептор на их поверхности. В частности, этими клетками являются гранулоциты/нейтрофилы, макрофаги, NK-клетки, субпопуляции CD8+ Т-клеток и В-клеток и миелоидные дендритные клетки.
Поскольку экспрессирующие CD11b клетки и более конкретно миелоидные дендритные клетки, нейтрофилы и макрофаги участвуют в существенных функциях иммунной и природной защитной системы, в частности в воспалительных и специфических иммунных реакциях, данное изобретение относится к приготовлению белкового вектора или композиции, способных нацеливать представляющую интерес молекулу или представляющий интерес пептид на эти экспрессирующие CD11b клетки, в частности на миелоидные дендритные клетки, нейтрофилы или макрофаги.
В частности, в одном варианте нацеливание указанных молекулы или пептида является эффективным in vivo.
Тем самым данное изобретение обеспечивает средства для конструирования композиций, пригодных для введения животному-хозяину или человеку-хозяину, требующих нацеливания на определенные лейкоциты и, в частности, миелоидные дендритные клетки, нейтрофилы и макрофаги.
Аденилциклаза Bordetella является кальмодулинзависимой аденилциклазой, секретируемой в видах Bordetella, или ее фрагментом, причем указанный фрагмент сохраняет функциональные свойства этой аденилциклазы, главного фактора вирулентности, обязательного для начальных фаз бактериальной колонизации в легком. Эта аденилциклаза синтезируется и секретируется в форме полипептида из 1706 аминокислот. Кальмодулинзависимая каталитическая активность локализована в первых 400 аминокислотах. Для того чтобы он стал активным, указанный аденилциклазный токсин становится инвазивным и гемолитическим при посттрансдукционной модификации посредством коэкспрессии продукта гена cyaC.
Следующие специфические признаки аденилциклазного токсина Bordetella указывают на то, что этот токсин может быть использован в приготовлении белкового вектора для нацеливания in vivo представляющей интерес молекулы на экспрессирующие CD11b клетки:
а) эта аденилциклаза связывается специфически с экспрессирующими CD11b клетками,
b) N-каталитический домен транслоцируется в цитозоль этих экспрессирующих CD11b клеток,
с) С-концевой домен связывается с мембраной экспрессирующих CD11b клеток и может интернализироваться по пути эндоцитоза,
d) эпитоп, химически связанный с генетически модифицированной аденилциклазой, может индуцировать in vivo специфические ЦТЛ-реакции.
Выражение "аденилциклаза" в данном изобретении включает в себя природную или модифицированную аденилциклазу, в том числе генетически или химически модифицированную аденилциклазу, обеспечивающую полученный продукт, способный нацеливать предсталяющую интерес молекулу конкретно на экспрессирующие CD11b клетки.
Таким образом, данное изобретение относится к применению аденилциклазы Bordetella, определенной выше, и более конкретно к применению модифицированной или рекомбинантной аденилциклазы для нацеливания представляющей интерес молекулы специфически в экспрессирующие CD11b клетки.
Более конкретно, рекомбинантные аденилциклазы включают в себя аденилциклазы, которые были генетически модифицированы для обеспечения либо аденилциклаз с пептидной последовательностью или остатками цистеина, встроенными в каталитическом домене, либо укороченных аденилциклаз, не имеющих всего их каталитического домена или его части.
Вследствие специфического взаимодействия между аденилциклазным токсином Bordetella и CD11b/CD18 αМ/β2-рецептором представляющая интерес молекула специфически нацеливается по меньшей мере на поверхность экспрессирующих CD11b клеток. В конкретном варианте данного изобретения аденилциклазный токсин Bordetella используют в получении белкового вектора для доставки представляющей интерес молекулы либо в цитозоль экспрессирующих CD11b клеток, на поверхность экспрессирующих CD11b клеток или в путь эндоцитоза экспрессирующих CD11b клеток.
Экспрессирующие векторы для получения рекомбинантной аденилциклазы Bordetella описаны в патентной заявке WO 93/21324 (Institut Pasteur). Новые экспрессирующие векторы для получения генетически модифицированной аденилциклазы Bordetella, пригодные для химического связывания представляющего интерес пептида, также описаны в экспериментальной части далее. Более конкретно, могут быть сконструированы экспрессирующие векторы, направляющие экспрессию как гена cyaA, так и гена cyaC (Sebo et al., 1991). Параллельно может быть сконструирована вторая плазмида, несущая гены, необходимые для секреции цитотоксической аденилциклазы в E. coli, такие как hlyB и hlyD, как описано, например, у Meckman et al., 1985. В частности, может быть использована экспрессионная плазмида рСАСТ3, описанная в WO 93/21324. С использованием этой плазмиды аденилциклаза может быть экспрессирована в E. coli и, возможно, секретирована этой бактерией в больших количествах. Ее можно также легко очистить, например, с использованием аффинной хроматографии на смоле СаМ Affi-Gel или других опубликованных процедур, например с использованием ДЭАЭ-сефарозы и фенил-сефарозы (Guermonprez et al., 2000).
В одном варианте данного изобретения аденилциклаза является рекомбинантной генетически модифицированной аденилциклазой. В частности, мутации, такие как точковые мутации, делеции или инсерции могут быть получены с использованием обычных способов сайт-направленного или случайного мутагенеза, при условии, что домены, необходимые для связывания с экспрессирующими CD11b клетками и, необязательно, для транслокации в цитозоль, все еще являются функциональными. Анализы для оценки специфического связывания рекомбинантных токсинов и их фрагментов с экспрессирующими CD11b клетками и необязательно последующей транслокации каталитичесого домена описаны в следующей ниже экспериментальной части.
В другом варианте данного изобретения рекомбинантная аденилциклаза вида Bordetella является фрагментом природного, модифицированного или рекомбинантного аденилциклазного токсина вида Bordetella, где указанный фрагмент способен связывать CD11b-рецептор. В частности, в данном изобретении было обнаружено, что фрагмент, включающий в себя остатки 373-1706 (CyaA 373-1706), содержит структуры, существенно необходимые для взаимодействия с CD11b/CD18-рецептором. Таким образом, предпочтительным фрагментом аденилциклазного токсина вида Bordetella является аденилциклазный токсин Bordetella, в котором отсутствует весь N-концевой каталитический домен или часть, и более конкретно аденилциклаза Bordetella pertussis, в которой отсутствуют - полностью или частично - остатки 1-373.
Специфическое связывание CD11b может оцениваться in vitro с использованием моноклональных анти-CD11b-антител, как иллюстрируется в примерах.
Для применения в получении белкового вектора или получении композиции эта аденилциклаза предпочтительно является нетоксичной. Нетоксичные мутанты аденилциклазного токсина хорошо описаны в данной области (Betsou et al., 1993; Betsou et al., 1995).
В предпочтительном варианте данного изобретения аденилциклаза выделена из Bordetella pertussis.
В конкретных вариантах представляющая интерес молекула выбрана из группы, содержащей пептиды, гликопептиды, липопептиды, полисахариды, олигосахариды, нуклеиновые кислоты, липиды и химикалии.
В конкретных вариантах представляющей интерес молекулой является гетерологичный антиген. В применении здесь термин "гетерологичный" относится к антигену, иному, чем аденилциклаза, которая используется в самом векторе.
В предпочтительном варианте данного изобретения производство белкового вектора предусматривает стадию встраивания гетерологичной молекулы и, в частности, пептида, в каталитический домен аденилциклазы в пермиссивном сайте.
В применении здесь термин "пермиссивный сайт" относится к сайту, где гетерологичная молекула и, в частности, пептид могут быть встроены без существенного влияния на желаемые функциональные свойства аденилциклазного токсина, т.е. без влияния на домены, необходимые для специфического связывания с CD11b/CD18-рецептором и предпочтительно без влияния на процесс транслокации каталитического домена. В предпочтительном варианте дополнительно сохраняется способность токсина CyaA стимулировать синтез цАМФ в клетках-мишенях.
Способы выбора пермиссивных сайтов представлены, например, в WO 93/21324 и в Ladant et al., 1992. В частности, методология с использованием двойного отбора (устойчивости к антибиотику и калориметрического теста на чашках с использованием α-комплементации) позволяет легко идентифицировать олигонуклеотидные инсерции (сохраняющие рамку считывания) в части гена, кодирующего N-концевой каталитический домен этого токсина. Функциональные последствия действия этих мутаций на каталитическую активность этого токсина могут быть легко проанализированы как генетически (функциональной комплементацией cya- штамма E. coli), так и биохимически (характеристикой стабильности модифицированных аденилциклаз, их ферментативной активности, их взаимодействия с саМ и т.д.). Эта методология позволяет проводить скрининг большого числа мутаций для идентификации сайтов, которые являются потенциально выгодными для встраивания антигенных детерминант.
В конкретных вариантах данного изобретения пермиссивный сайт выбран из группы, состоящей из остатков 137-138, остатков 224-225, остатков 228-229, остатков 235-236, остатков 317-318 и остатков 335-336 аденилциклазы Bordetella pertussis.
Однако в данном изобретении могут быть использованы другие пермиссивные сайты, которые могут быть идентифицированы, например, с использованием указанной выше методологии, в частности сайты между остатками 400 и 1700.
Производство белкового вектора может также предусматривать стадию слияния представляющей интерес молекулы, например гетерологичного пептида, на N-концевом участке аденилциклазы Bordetella, в которой полностью или частично отсутствует ее N-концевой каталитический домен, и более предпочтительно аденилциклазы Bordetella pertussis, в которой отсутствуют остатки 1-373.
В предпочтительном варианте данного изобретения аденилциклаза в соответствии с одним из приведенных выше определений используется в производстве белкового вектора или в получении композиции, специфически сконструированных для примирования CD8+ цитотоксической Т-клеточной реакции (ЦТЛ-реакции), причем указанная реакция осуществляет нацеливание аденилциклазы, модифицированной (в частности, рекомбинированной или конъюгированной) представляющей интерес молекулой, на экспрессирующие CD11b клетки с последующей транслокацией представляющей интерес молекулы в цитозоль указанных экспрессирующих CD11b клеток и, в частности, миелоидных дендритных клеток. В этом контексте представляющая интерес молекула является или она содержит предпочтительно эпитоп или антиген.
В применении здесь термин "эпитоп" относится к гетерологичной молекуле и, в частности, гетерологичному пептиду, который может индуцировать иммунную реакцию.
В конкретных вариантах антиген выбран из группы, состоящей из внутриклеточного антигена бактериальной клетки, антигена опухолевой клетки, вирусного антигена, грибного антигена или антигена клетки-паразита.
В предпочтительном варианте данного изобретения природную, модифицированную или рекомбинантную аденилциклазу, в соответствии с приведенными выше определениями, используют в производстве белкового вектора или в получении композиции, специфическии предназначенных для примирования CD4+ клеточной реакции, причем указанная реакция осуществляет нацеливание аденилциклазы, модифицированной (в частности, рекомбинированной или конъюгированной) представляющей интерес молекулой, на экспрессирующие CD11b клетки, в частности миелоидные дендритные клетки. В этом контексте представляющая интерес молекула является или она содержит предпочтительно эпитоп или антиген.
Представляющей интерес молекулой может быть, в частности, антиген, выбранный из группы, состоящей из антигена полиовируса, антигена вируса ВИЧ, антигена вируса гриппа, эпитопа вируса хориоменингита, опухолевого антигена.
Кроме того, функциональные свойства экспрессирующих CD11b клеток определяют новое применение аденилциклазного токсина Bordetella в приготовлении белкового вектора для нацеливания лекарственного средства на эти специфическиие клетки. В этом контексте, в одном конкретном варианте данного изобретения, так называемой представляющей интерес молекулой является лекарственное средство. Указаннное лекарственное средство может быть химически или генетически связано с аденилциклазой. Способы связывания лекарственного средства с полипептидом являются хорошо известными в данной области и предусматривают, например, дисульфидное связывание с использованием активированного N-пиридилсульфонилом сульфгидрила.
Предпочтительно представляющей интерес молекулой является противовоспалительное лекарственное средство, которое при связывании с аденилциклазным токсином специфически нацеливается на поверхность клеток, участвующих в воспалительной реакции, таких как нейтрофилы.
В частности, в экспериментальной части впервые показано, что можно прививать молекулы к CyaA химическим связыванием или генетическим встраиванием для нацеливания in vivo на CD11B+ антигенпредставляющие клетки и, в частности, в цитозоль CD11b+ антигенпредставляющих клеток. В самом деле, было обнаружено, что при связывании молекулы, соответствующей конкретному CD8+ Т-клеточному эпитопу, с каталитическим доменом детоксицированного CyaA, либо при помощи дисульфидной связи, либо путем генетической инсерции, эта сконструированная молекула может индуцировать in vivo специфическую ЦТЛ-реакцию, показывая таким образом, что указанный CD8+ Т-клеточный эпитоп транслоцируется в цитозоль экспрессирующих CD11b клеток.
Более конкретно, представление антигена для селективного примирования CD8+ цитотоксических клеток выполняется в основном миелоидными дендритными клетками.
Таким образом, в конкретном варианте рекомбинантная аденилциклаза, используемая для получения белкового вектора, является генетически модифицированной аденилциклазой, содержащей одну или несколько молекул, химически связанных посредством дисульфидной связи с генетически встроенными остатками цистеина, локализованными в каталитическом домене указанной аденилциклазы.
Фактически, множественные молекулы могут быть связаны химически с аденилциклазой посредством дисульфидной связи с различными остатками цистеина, локализованными в различных пермиссивных сайтах в каталитическом домене.
Автор изобретения также показал, что ЦТЛ, специфические в отношении приготовленного в виде вектора антигена, могут быть примированы in vivo после единственной внутривенной инъекции рекомбинантного токсина, в частности, без необходимости обеспечения гетерологичного адъюванта. Эти результаты, показанные в экспериментальной части, и, в частности, специфическое нацеливание этого эпитопа на миелоидные дендритные клетки обеспечивают новые стратегии иммунизации, которые не требуют использования адъюванта и помощи CD4+ Т-клеток.
Таким образом, данное изобретение относится также к применению аденилциклазного токсина Bordetella, рекомбинированного с молекулой и, в частности, представляющим интерес пептидом, для получения композиции, приготовленной для внутривенного введения и обеспечивающей CD8+ Т-клеточную реакцию in vivo, причем указанная композиция не содержит гетерологичного адъюванта. Данное изобретение относится также к самой этой композиции.
Данное изобретение относится, в частности, также к новой иммуногенной композиции, приготовленной для введения, в частности внутривенного введения, животному-хозяину или человеку-хозяину, отличающейся тем, что она содержит рекомбинантную аденилциклазу Bordetella, которая содержит антиген, встроенный в ее каталитический домен.
Далее, данное изобретение относится к фармацевтической композиции для введения человеку или животному, составленной для нацеливания представляющей интерес молекулы специфически на экспрессирующие CD11b клетки, отличающейся тем, что указанная представляющая интерес молекула связана с аденилциклазой вида Bordetella.
В одном предпочтительном варианте представляющая интерес молекула выбрана из группы, состоящей из пептидов, гликопептидов, липопептидов, полисахаридов, олигосахаридов, нуклеиновых кислот, липидов и химикалиев.
В другом предпочтительном варианте представляющей интерес молекулой является антиген.
В другом конкретном варианте фармацевтическая или иммуногенная композиция содержит конструкцию нуклеиновой кислоты, кодирующую рекомбинантную аденилциклазу вида Bordetella, содержащую рекомбинантную аденилциклазу вида Bordetella, связанную с представляющей интерес молекулой.
В конкретных вариантах аденилциклазой является токсин из Bordetella pertussis.
В других конкретных вариантах этот аденилциклазный токсин является генетически модифицированным токсином. В одном предпочтительном варианте аденилциклаза является нетоксичной аденилциклазой, в частности детоксицированной аденилциклазой.
В одном предпочтительном варианте генетически модифицированная аденилциклаза способна транслоцировать представляющую интерес молекулу специфически в цитозоль экспрессирующих CD11b клеток.
В частности, указанной генетически модифицированной аденилциклазой является аденилциклаза Bordetella, в которой полностью или частично отсутствует ее каталитический N-концевой домен, и более конкретно аденилциклаза Bordetella pertussis, в которой отсутствуют остатки 1-373.
Предпочтительно генетически модифицированная аденилциклаза содержит один или несколько остатков цистеина, встроенных в каталитическом домене в пермиссивные сайты. Такая генетически модифицированная аденилциклаза может быть связана с представляющими интерес одной или несколькими молекулами посредством дисульфидных связей во встроенном остатке (встроенных остатках) цистеина.
В предпочтительном варианте эту молекулу и, в частности, антиген встраивают в пермиссивные сайты, выбранные из группы, состоящей из остатков 137-138, остатков 224-225, остатков 228-229, остатков 235-236 и остатков 317-318 и остатков 335-336 аденилциклазы Bordetella pertussis, или эта молекула слита с N-концевой частью аденилциклазы Bordetella, в которой полностью или частично отсутствует N-концевой каталитический домен, и более конкретно с N-концевой частью аденилциклазы Bordetella pertussis, в которой отсутствуют остатки 1-373.
В конкретном варианте этой молекулой является антиген, который является внутриклеточным антигеном бактериальной клетки, антигеном опухолевой клетки, вирусным антигеном, грибным антигеном или антигеном клетки-паразита.
В предпочтительных вариантах представляющей интерес молекулой является антиген, выбранный из группы, состоящей из антигена полиовируса, антигена вируса ВИЧ, антигена вируса гриппа, эпитопа вируса хориоменингита, опухолевого антигена.
В другом варианте генетически модифицированный токсин способен доставлять представляющую интерес молекулу специфически к поверхности экспрессирующих CD11b клеток или в путь эндоцитоза.
Авторы изобретения показали, что in vivo внутривенное введение иммуногенной композиции животному-хозяину или человеку-хозяину, как определено в данном изобретении, без адъюванта (адъювантов) является достаточным для эффективной стимуляции иммунной реакции у указанного животного-хозяина или человека-хозяина.
В частности, иммуногенные композиции данного изобретения способны индуцировать или стимулировать in vivo или in vitro иммунную клеточную реакцию с участием специфических дендритных клеток.
В результате этого в конкретном варианте эта иммуногенная или фармацевтическая композиция является выгодно лишенной примирующих адъювантов, обычно используемых в данной области, таких как гидроксид алюминия.
В одном конкретном варианте представляющей интерес молекулой является лекарственное средство, предпочтительно противовоспалительное лекарственное средство.
Кроме того, данное изобретение относится также к применению определенной выше иммуногенной композиции для получения вакцины или иммунотерапевтической композиции для введения животному-хозяину или человеку-хозяину.
В применении здесь термин "иммунотерапевтическая композиция" относится к композиции, которая приводит к иммунологической реакции и которая связана с терапевтическими способами лечения, такими как лечение против рака, вирусных инфекций, паразитарных инфекций или бактериальных инфекций.
Далее, данное изобретение относится к способу иммунизации хозяина, животного или человека, где указанный способ предусматривает стадии:
а) обеспечения иммуногенной композиции, как описано выше;
b) введения указанной иммуногенной композиции, предпочтительно внутривенным путем, указанному хозяину для стимуляции иммунной реакции.
Наконец, данное изобретение относится к белковому вектору для доставки представляющей интерес молекулы конкретно к экспрессирующим CD11b клеткам, отличающемуся тем, что указанный вектор содержит аденилциклазу вида Bordetella и более предпочтительно рекомбинантную или модифицированную аденилциклазу вида Bordetella, связанную с указанной представляющей интерес молекулой.
Этот белковый вектор способен нацеливать представляющую интерес молекулу на экспрессирующие CD11b клетки через конкретно связывание аденилциклазы Bordetella с CD11b/CD18 αМ/β2-рецептором, который присутствует на поверхности специфических клеток. В одном конкретном варианте этот вектор способен также доставлять представляющую интерес молекулу специфически в цитозоль экспрессирующих CD11b клеток.
В конкретных вариантах этот белковый вектор способен нацеливать представляющую интерес молекулу на дендритные клетки, в частности миелоидные дендритные клетки или нейтрофилы.
Представляющая интерес молекула является химически или генетически связанной с аденилциклазой, более предпочтительно рекомбинантным аденилциклазным токсином. Способы связывания молекулы с полипептидом хорошо известны в данной области. В качестве примера, авторы данного изобретения показали, что производное биотина, биотин HDPD, может быть селективно связано на уникальном остатке цистеина, генетически встроенном в каталитический домен. Синтетические пептиды были связаны подобным образом с цистеинсодержащим аденилциклазным токсином или с генетически модифицированной аденилциклазой, лишенной природного остатка цистеина, но содержащей уникальный генетически встроенный остаток цистеина.
В другом конкретном варианте представляющей интерес молекулой, связанной с аденилциклазой, является эпитоп, химически связанный с генетически модифицированной аденилциклазой, лишенной природного остатка цистеина, но содержащей генетически встроенный остаток (остатки) цистеина в пермиссивный сайт в ее каталитическом домене.
В конкретном варианте белковый вектор содержит генетически модифицированную аденилциклазу. В одном предпочтительном варианте эта аденилциклаза является рекомбинантной нетоксичной аденилциклазой из Bordetella pertussis.
Более конкретно, данное изобретение относится к белковому вектору, который состоит из рекомбинантной аденилциклазы Bordetella, в которой полностью или частично отсутствует N-концевой каталитический домен, и, более предпочтительно аденилциклазы Bordetella pertussis, в которой отсутствуют остатки 1-373.
Другим предпочтительным белковым вектором согласно изобретению является генетически модифицированная аденилциклаза Bordetella, лишенная природного остатка (остатков) цистеина, но содержащая генетически встроенный остаток (остатки) цистеина в пермиссивном сайте в каталитическом домене.
Предпочтительно в одном конкретном варианте данного изобретения лекарственным средством, которое должно доставляться, является противовоспалительное средство, которое при связывании с аденилциклазным токсином нацеливается на поверхность или в цитозоль клеток, участвующих в воспалительной реакции, таких как нейтрофилы.
Следующие далее примеры будут иллюстрировать данное изобретение без ограничения объема заявленного изобретения. Более конкретно, в части А показаны экспериментальные данные, которые выявляют специфическое связывание аденилциклазного токсина с CD11b/CD18-рецептором и, в частности, специфическое связывание аденилциклазного токсина с экспрессирующими CD11b клетками in vitro. В части В экспериментальные результаты показывают возможность нацеливания генетически связанной молекулы, более конкретно антигена, in vitro и in vivo специфически в цитозоль экспрессирующих CD11b клеток и, в частности, на миелоидные дендритные клетки. Кроме того, эти результаты показывают, что это нацеливание опосредуется CD11b-рецептором и что наблюдается ЦТЛ-примирование после системной иммунизации в отсутствие адъюванта. В части С показано, что специфическое связывание эпитопных пептидов посредством дисульфидной связи на CyaA-фрагментах может проводиться для обеспечения новых белковых векторов. В части D показано, что только С-концевая часть CyaA является необходимой и достаточной для взаимодействия с CD11b-рецепторами.
Наконец, эти результаты показывают, что, в противоположность другим ЦТЛ-реакциям, таким как реакции, индуцированные против перекрестнореагирующего антигена, помощь CD4+ Т-клеток не является обязательной для примирования ЦТЛ-реакций.
ПОДПИСИ К ЧЕРТЕЖАМ
Фигура 1: Насыщаемое связывание CyaA коррелирует с экспрессией CD11b.
а: Связывание CyaA на поверхности макрофагов (J774A.1), В-клеток (LB27.4) и Т-клеток (EL4) выполняли при 37°С в течение 20 минут. Связанный с поверхностью CyaA детектировали с биотинилированным поликлональным анти-CyaA-антителом, выявляемым с использованием стрептавидина-РЕ и детектируемым проточной цитометрией на живых клетках, как описано в разделе Материалы и способы. Связывание выражено в виде ΔMFI = (средняя величина интенсивности флуоресценции клеток, инкубированных с CyaA) - (средняя величина интенсивности флуоресценции клеток без CyaA).
b, c, d, e: Поверхностная экспрессия β2-интегринов на клетках J774A.1, LB27.4 и EL4. Экспрессию CD11а (b), CD11b (с), CD11с (d) и CD18 (е) определяли проточной цитометрией с использованием специфических mAb, связанных с РЕ. Экспрессия интегрина выражена в виде ΔMFI = (средняя величина интенсивности флуоресценции клеток, окрашенных специфическими mAb) - (средняя величина интенсивности флуоресценции клеток, окрашенных изотипическими контрольными mAb).
Фигура 2: Связывание CyaA с мышиными клеточными линиями блокируется анти-CD11b-mAb.
Клетки преинкубировали при 4°С в течение 15 минут в присутствии или в отсутствие 20 мкг/мл специфических mAb и затем инкубировали при 4°С в течение 20 минут с 5 мкг/мл CyaA и с 10 мкг/мл специфических mAb, если они присутствуют во время преинкубации. Поверхностно-связанный CyaA детектировали биотинилированными поликлональными анти-CyaA-антителами, выявляли стептавидином-РЕ и детектировали проточной цитометрией на живых клетках, как описано в разделе Материалы и способы.
a, b: Действие mAb М1/70 против CD11b на связывание различных доз CyaA. Дендритные клетки FSDC (а) или макрофаги J774A.1 (b) преинкубировали только со средой  или с mAb М1/70 против CD11b
или с mAb М1/70 против CD11b  и затем инкубировали с CyaA в присутствии или в отсутствие mAb М1/70 против CD11b. Bmax определяли подставлением экспериментальных точек, полученных из экспериментов без mAb, в ΔMFI = Bmax*[CyaA]/(Kd + [CyaA]). Связывание CyaA показано графиком в виде % Bmax против концентрации CyaA.
и затем инкубировали с CyaA в присутствии или в отсутствие mAb М1/70 против CD11b. Bmax определяли подставлением экспериментальных точек, полученных из экспериментов без mAb, в ΔMFI = Bmax*[CyaA]/(Kd + [CyaA]). Связывание CyaA показано графиком в виде % Bmax против концентрации CyaA.
c, d: Действие специфических mAb на фиксированной дозе связывания CyaA. Клетки FSDC (c) или J774A.1 (d) преинкубировали в присутствии или в отсутствие специфических mAb (анти-CD11а, 2D7, анти-CD11b, М1/70 и 5С6, анти-CD11с, НL3, анти-CD18, С17/16, контрольного А95-1) и инкубировали с CyaA при фиксированной концентрации 5 мкг/мл. Величины ΔMFI, полученные для связывания CyaA на клетках, обработанных специфическими mAb, нормализовали в виде величин ΔMFI, полученных для связывания CyaA без mAb.
Фигура 3: Связывание CyaA с нейтрофилами человека блокируется анти-CD11b- и анти-CD18-mAb.
a, b, c: Гистограммы флуоресценции свежеочищенных нейтрофилов преинкубировали только со средой (а), анти-CD11b-mAb 44 (b) или контрольным мышиным mAb того же самого изотипа (с) и затем инкубировали с биотинилированным CyaA (серые) или без него (белые) и выявляли с использованием стрептавидина-РЕ. Числа клеток строили на графике против log РЕ-флуоресценции.
d: Действие специфических mAb на связывание CyaA с нейтрофилами (анти-CD11b, 44, М1/70, анти-CD18, TS/18, контрольного мышиного IgG2а, контрольного крысиного IgG2b, А95-1). Свежеочищенные нейтрофилы преинкубировали в присутствии и в отсутствие специфических mAb и инкубировали с CyaA. Величины ΔMFI, полученные для связывания CyaA на клетках, обработанных специфическими mAb, нормализовали в виде % величин ΔMFI, полученных для связывания CyaA без mAb.
Фигура 4: Увеличение внутриклеточного цАМФ и гибель клеток (некроз), опосредованные CyaA, специфически блокируются анти-CD11b-mAb в клетках J774A.1.
а: Действие специфических mAb на накопление внутриклеточного цАМФ. Клетки J774A.1 преинкубировали при 4°С в течение 1 часа в присутствии и в отсутствие 10 мкг/мл специфических mAb (анти-CD11b, М1/70, анти-CD18, С17/16) и затем инкубировали при 37°С в течение 20 минут с 5 мкг/мл CyaA и с 10 мкг/мл mAb, если они присутствуют во время преинкубации. Внутриклеточные содержания цАМФ определяли, как описано в разделе Материалы и способы.
b: Действие специфических mAb на опосредованную CyaA гибель клеток. Клетки J774A.1 преинкубировали при 4°С в течение 1 часа в присутствии и в отсутствие 10 мкг/мл специфических mAb (анти-CD11а, 2D7, анти-CD11b, М1/70, анти-CD11с, HL3, анти-CD18, С17/16, контроля, 2.4G2). Затем их инкубировали при 37°С в течение 2 часов с 0,5 мкг/мл CyaA и с 10 мкг/мл mAb, если они присутствуют во время преинкубации. Лизис клеток определяли по высвобождению LDH с использованием Cytotox 96™-анализа.
Фигура 5: Клетки СНО связывают CyaA и становятся чувствительными к CyaA при трансфекции CD11b, но не CD11с.
а, b: Связывание CyaA на поверхности трансфектантов СНО. Клетки СНО, трансфицированные человеческим CD11b/CD18  человеческим CD11с/CD18
человеческим CD11с/CD18  или ложнотрансфицированные
или ложнотрансфицированные  инкубировали с различными дозами CyaA в течение 20 минут при 37°С (а) или 4°С (b). Поверхностно-связанный CyaA детектировали биотинилированным поликлональным анти-CyaA-антителом, выявляли с использованием стрептавидина-РЕ и детектировали проточной цитометрией на живых клетках, как описано в разделе Материалы и способы. Связывание выражено в виде ΔMFI = (средняя величина интенсивности флуоресценции клеток, инкубированных с CyaA) - (средняя величина интенсивности флуоресценции клеток без CyaA).
инкубировали с различными дозами CyaA в течение 20 минут при 37°С (а) или 4°С (b). Поверхностно-связанный CyaA детектировали биотинилированным поликлональным анти-CyaA-антителом, выявляли с использованием стрептавидина-РЕ и детектировали проточной цитометрией на живых клетках, как описано в разделе Материалы и способы. Связывание выражено в виде ΔMFI = (средняя величина интенсивности флуоресценции клеток, инкубированных с CyaA) - (средняя величина интенсивности флуоресценции клеток без CyaA).
с: Внутриклеточное накопление цАМФ в трансфектантах СНО. Клетки СНО, трансфицированные CD11b/CD18 человека  CD11с/CD18
CD11с/CD18  человека или ложнотрансфицированные
человека или ложнотрансфицированные  инкубировали в присутствии или в отсутствие CyaA в течение 20 минут при 37°С. Внутриклеточное содержание цАМФ определяли, как описано в разделе Материалы и способы.
инкубировали в присутствии или в отсутствие CyaA в течение 20 минут при 37°С. Внутриклеточное содержание цАМФ определяли, как описано в разделе Материалы и способы.
d: Лизис клеток в трансфектантах СНО. Клетки СНО, трансфицированные CD11b/CD18 человека, CD11с/CD18 человека или ложнотрансфицированные, инкубировали в присутствии или в отсутствие 5 мкг/мл CyaA в течение 4 часов при 37°С. Лизис клеток определяли по высвобождению LDH с использованием Cytotox 96™-анализа.
Фигура 6: Внутривенная иммунизация с использованием CyaAOVA примирует анти-OVA-ЦТЛ-реакции в В-клетках, CD4 и CD40 - независимым образом.
Мышей С57ВL/6 WT (дикого типа) +/+ (а), CD4-/- (b), CD40-/- (с) или IgM-/- (d) внутривенно иммунизировали 50 мкг CyaAOVA, генетически детоксицированной формы CyaA, несущей Н-2Кb-рестрицированный эпитоп SIINFEKL из OVA  , или CyaAЕ5, контрольный детоксицированный токсин без эпитопа OVA
, или CyaAЕ5, контрольный детоксицированный токсин без эпитопа OVA  Спустя семь дней животных умерщвляли и спленоциты повторно стимулировали in vitro в течение 5 дней 10 мкг/мл синтетического пептида pOVA в присутствии облученных спленоцитов С57BL/6. ЦТЛ-активность оценивали в 4-часовом анализе высвобождения хрома51 против клеток Н-2Кb+ EL4, предварительно кратковременно обработанных
Спустя семь дней животных умерщвляли и спленоциты повторно стимулировали in vitro в течение 5 дней 10 мкг/мл синтетического пептида pOVA в присутствии облученных спленоцитов С57BL/6. ЦТЛ-активность оценивали в 4-часовом анализе высвобождения хрома51 против клеток Н-2Кb+ EL4, предварительно кратковременно обработанных  или не обработанных
или не обработанных  pOVA при 10 мкг/мл.
pOVA при 10 мкг/мл.
Фигура 7: Идентификация антигенпредставляющих клеток селезенки, участвующих в представлении CyaAOVA in vitro или in situ, после внутривенной иммунизации.
Фракция низкой плотности спленоцитов представляет CyaAOVA специфической анти-OVA CD8+ Т-клеточной гибридоме (а, b): анализ in vitro (а): Фракции низкой  и высокой плотности (HDF,
и высокой плотности (HDF,  или нефракционированные общие спленоциты из необработанных мышей
или нефракционированные общие спленоциты из необработанных мышей  культивировали с клетками B3Z, CD8+ Т-клеточной гибридомой, специфической в отношении пептида pOVA в контексте Н-2Кb. После 18 часов сокультивирования в присутствии рекомбинантного детоксицированного CyaA, несущего пептид OVA
культивировали с клетками B3Z, CD8+ Т-клеточной гибридомой, специфической в отношении пептида pOVA в контексте Н-2Кb. После 18 часов сокультивирования в присутствии рекомбинантного детоксицированного CyaA, несущего пептид OVA  или контрольного пептида
или контрольного пептида  в различных концентрациях, IL-2, высвобождаемый в супернатанты, измеряли в тесте CTLL-пролиферации. Результаты выражены в Δимп/мин и представлены в виде графиков против концентрации CyaA во время анализа Δимп/мин = [имп/мин + CyaA] - [имп/мин - CyaA]).
в различных концентрациях, IL-2, высвобождаемый в супернатанты, измеряли в тесте CTLL-пролиферации. Результаты выражены в Δимп/мин и представлены в виде графиков против концентрации CyaA во время анализа Δимп/мин = [имп/мин + CyaA] - [имп/мин - CyaA]).
Анализ ex vivo (b): Клетки селезенок получали из мыши, предварительно иммунизированной внутривенно (iv) (6-12 ч) 50 мкг  или CyaALCMV
или CyaALCMV  , и фракционировали на LDF и HDF (фракции низкой плотности и высокой плотности). Различные количества клеток, извлеченных из TSC
, и фракционировали на LDF и HDF (фракции низкой плотности и высокой плотности). Различные количества клеток, извлеченных из TSC  LDF
LDF  или HDF
или HDF  или нефракционированных спленоцитов
или нефракционированных спленоцитов  непосредственно помещали в культуру с B3Z без добавления рекомбинантного CyaA. Высвобождение IL-2 оценивали после 18 часов культивирования, как описано выше. Результаты, выраженные в имп/мин, строили в виде графиков против числа антигенпредставляющих клеток (АРС), присутствующих в каждой лунке.
непосредственно помещали в культуру с B3Z без добавления рекомбинантного CyaA. Высвобождение IL-2 оценивали после 18 часов культивирования, как описано выше. Результаты, выраженные в имп/мин, строили в виде графиков против числа антигенпредставляющих клеток (АРС), присутствующих в каждой лунке.
Дендритные клетки (CD11с+) являются более эффективными АРС для CyaAOVA, чем CD11bвыс+ CD11с- клетки или В-клетки (CD45R+) (с, d):
Анализ in vitro (с): CD11с+ , полученные клеточным сортингом из фракции LDF, CD11bвыс+ CD11с-
, полученные клеточным сортингом из фракции LDF, CD11bвыс+ CD11с- и (CD45R+)
и (CD45R+)  клетки, полученные клеточным сортингом из TSC, помещали в культуру с B3Z и выдерживали в течение 18 часов в присутствии различных концентраций CyaAOVA. IL-2 оценивали, как описано выше.
клетки, полученные клеточным сортингом из TSC, помещали в культуру с B3Z и выдерживали в течение 18 часов в присутствии различных концентраций CyaAOVA. IL-2 оценивали, как описано выше.
Анализ ex vivo (d): Клетки, полученные клеточным сортингом с использованием проточной цитометрии из мышей С57BL/6, предварительно (6-12 часов) иммунизированные 50 мкг CyaAOVA, использовали в качестве антигенпредставляющих клеток (АРС). Полученные сортингом клетки CD11с+ CD11bвыс+ CD11с-
CD11bвыс+ CD11с- и (CD45R+)
и (CD45R+)  из спленоцитов низкой плотности сразу же помещали в культуру с клетками B3Z и выдерживали в течение 18 часов при различных числах клеток на лунку, без добавления CyaAOVA. IL-2 оценивали, как описано выше.
из спленоцитов низкой плотности сразу же помещали в культуру с клетками B3Z и выдерживали в течение 18 часов при различных числах клеток на лунку, без добавления CyaAOVA. IL-2 оценивали, как описано выше.
Субпопуляция CD8α- миелоидных дендритных клеток является более эффективными антигенпредставляющими клетками (АРС) для CyaA, чем субпопуляция CD8α+ лимфоидных дендритных клеток (е, f):
Клетки CD11с+ низкой плотности из необработанных мышей (е) или мышей, предварительно (6-12 часов) иммунизированных внутривенно (iv) 50 мкг CyaAOVA (f), фракционировали на миелоидные дендритные клетки  и лимфоидные дендритные клетки
и лимфоидные дендритные клетки  проточной цитометрией и использовали в качестве антигенпредставляющих клеток (АРС) в in vitro (е) и ex vivo (f) анализах для стимуляции B3Z. IL-2 оценивали, как описано выше.
проточной цитометрией и использовали в качестве антигенпредставляющих клеток (АРС) в in vitro (е) и ex vivo (f) анализах для стимуляции B3Z. IL-2 оценивали, как описано выше.
Генетическое истощение В-клеток не нарушает представление CyaAOVA спленоцитами (g, h):
TSC  LDF
LDF  или HDF
или HDF  из мышей С57ВL/6 WT
из мышей С57ВL/6 WT  или с недостаточностью В-клеток
или с недостаточностью В-клеток  использовали в качестве антигенпредставляющих клеток (АРС) в анализе in vitro
использовали в качестве антигенпредставляющих клеток (АРС) в анализе in vitro  или анализе ex vivo
или анализе ex vivo  для стимуляции B3Z, как в а). Мыши были либо неиммунизированными (g), либо предварительно (1,5 ч) иммунизированными внутривенно (iv) 50 мкг CyaAOVA (h). IL-2 оценивали, как описано выше.
для стимуляции B3Z, как в а). Мыши были либо неиммунизированными (g), либо предварительно (1,5 ч) иммунизированными внутривенно (iv) 50 мкг CyaAOVA (h). IL-2 оценивали, как описано выше.
Фигура 8: Представление CyaAOVA дендритными клетками требует ТАР-транспортеров in vitro и in vivo после внутривенной иммунизации.
Анализ in vitro (а): полученные клеточным сортингом клетки TSC  или CD11с+
или CD11с+ из контрольных мышей С57ВL/6 ТАР+/+
из контрольных мышей С57ВL/6 ТАР+/+  или ТАР-/-
или ТАР-/-  культивировали с клетками B3Z в присутствии или в отсутствие различных доз CyaAOVA. IL-2 оценивали, как описано на фигуре 6а. Результаты выражены в имп/мин и построены в виде графиков в зависимости от концентрации антигена.
культивировали с клетками B3Z в присутствии или в отсутствие различных доз CyaAOVA. IL-2 оценивали, как описано на фигуре 6а. Результаты выражены в имп/мин и построены в виде графиков в зависимости от концентрации антигена.
Анализ ex vivo (b): полученные клеточным сортингом клетки TSC  или CD11с+
или CD11с+ из контрольных мышей С57ВL6 ТАР+/+
из контрольных мышей С57ВL6 ТАР+/+  или ТАР-/-
или ТАР-/-  предварительно иммунизированные внутривенно (iv) 50 мкг CyaAOVA, культивировали с B3Z в течение 18 часов. IL-2 оценивали, как описано на фигуре 6а. Результаты выражены в имп/мин и построены в виде графиков в зависимости от числа сокультивируемых клеток.
предварительно иммунизированные внутривенно (iv) 50 мкг CyaAOVA, культивировали с B3Z в течение 18 часов. IL-2 оценивали, как описано на фигуре 6а. Результаты выражены в имп/мин и построены в виде графиков в зависимости от числа сокультивируемых клеток.
Фигура 9: Роль интегрина αМ β2 (CD11b) в связывании CyaAOVA с клетками.
Связывание CyaAOVA-биотина с TSC блокируется анти-CD11b (а): Суспензии TSC инкубировали при 4°С с 10 мкг/мл mAb М1/70 анти-CD11b или контрольным mAb того же изотипа или вообще без антител. Затем CyaAOVA-биотин в концентрации 2 мкг/мл (левые панели) или различных концентрациях (правые панели) добавляли к этим клеткам и выдерживали в течение 30 минут при 4оС. После промывания CyaAOVA-биотин выявляли с использованием стрептавидина-РЕ в течение 30 минут (Strep-РЕ). Затем, после промывания, клетки ресуспендировали в ЗФР, содержащем пропидийиодид. Размер (FSC) живых клеток, дискриминированных исключением пропидийиодида, наносили на график против Strep-PE-флуоресценции. Процент лейкоцитов, положительных в отношении CyaAOVA-биотина, наносили на график против концентрации CyaAOVA-биотина во время окрашивания.
Связывание CyaAOVA-биотина с клетками низкой плотности коррелирует с экспрессией CD11b (b): клетки низкой плотности LDF трижды окрашивали на CD11b, CD8α и CyaAOVA-биотин (или среду) или в отдельных экспериментах с CD11с, CD8α и CD11b (или контрольным mAb). После промывания клетки окрашивали в течение 30 минут Strep-PE для выявления CyaAOVA-биотина, анти-CD11с-FITC и анти-CD8α-АРС. Дискриминации выполняли на лимфоидных DC (CD11с+ CD8α+), миелоидных DC (CD11с+ CD8α-), CD8+ Т-клетках (CD11с- CD8α+) и других клетках (CD11с- CD8α-). Для каждой дискриминации CyaAOVA-биотин-окрашивание или CD11b-окрашивание строили в виде графика против числа клеток в отдельных гистограммах. Левые гистограммы: суспензии низкой плотности (LDF) инкубировали с 0 (серые гистограммы), 2,5 (узкие, белые гистограммы) или 10 мкг/мл (широкие, белые гистограммы) CyaAOVA-биотина в течение 30 минут при комнатной температуре. Правые гистограммы: изотипический контроль-РЕ (серая гистограмма), CD11b-РЕ (тонкие, белые гистограммы).
Фигура 10: Роль интегрина αМ β2 (CD11b) в представлении CyaAOVA посредством МНС I.
Анализ представления антигена in vitro TSC (a, b): Такие же эксперименты, что и в а, b, выполняли с TSC из неиммунизированных мышей С57ВL/6 в качестве АРС. Стимуляцию B3Z оценивали по высвобождению IL-2 в супернатантах сокультур, измеренному в анализе CTLL-пролиферации. Результаты наносили на график в виде имп/мин против концентрации CyaAOVA или pOVA.
Анализ представления антигена ex vivo TSC или фракциями CD11b+ или CD11b- (c, d): Мышей С57ВL/6 внутривенно иммунизировали 50 мкг CyaAOVA (с) или 10 мкг pOVA (d). Клетки CD11b+ или CD11b-
или CD11b- сортировали методом проточной цитометрии из TSC
сортировали методом проточной цитометрии из TSC  и помещали в культуру различное количество клеток на лунку с B3Z. После 18 часов сокультивирования стимуляцию B3Z оценивали по высвобождению IL-2. Результаты, выраженные в имп/мин, наносили на график против чисел АРС из иммунизированных животных в каждой лунке.
и помещали в культуру различное количество клеток на лунку с B3Z. После 18 часов сокультивирования стимуляцию B3Z оценивали по высвобождению IL-2. Результаты, выраженные в имп/мин, наносили на график против чисел АРС из иммунизированных животных в каждой лунке.
Фигура 11: Суммирование методологии для химического связывания эпитопов с рекомбинантным CyaA через дисульфидную связь.
Фигура 12: Диаграмма вектора для химического связывания ЦТЛ-эпитопов.
Фигура 13: График, показывающий высвобождение IL-2 клетками B3Z, измеренное в анализе пролиферации CTLL.
3 х 105 клеток селезенки из мышей С57ВI/6 сокультивировали в течение 18 часов с 105 клетками B3Z в присутствии различных концентраций циклаз. Высвобождение IL-2 клетками B3Z измеряли в анализе пролиферации CTLL.
Фигура 14: График, показывающий цитотоксическую активность, измеренную на 51Cr-меченных клетках-мишенях EL4, кратковременно обработанных (А) или необработанных (В) 50 мкМ пептидом OVA.
Мышей С57ВL/6 внутривенно иммунизировали 50 мкг различных CyaA. Спустя 7 дней клетки селезенки стимулировали пептидом OVA. Цитотоксическую активность измеряли на 51Cr-меченных клетках-мишенях.
Фигура 14 показывает способность in vivo белковых векторов согласно изобретению индуцировать OVA-специфические ЦТЛ-реакции.
Фигура 15: Ингибирование связывания CyaA с CD11b CyaA-Е5 и CyaA-фрагментами
Клетки СНО, трансфицированные CD11b/CD18, преинкубировали на льду в течение 1 часа с различными концентрациями CyaA-Е5 (черные треугольники), CyaA 1-383 (черные квадраты) или CyaA 373-1706 (черные ромбы) и затем инкубировали на льду в течение 30 минут с 5 мкг/мл биотинилированного CyaA-Е5. Поверхностно-связанную циклазу обнаруживали с использованием стрептавидина-РЕ и анализировали методом проточной цитометрии на живых клетках. Результаты выражали в виде средней интенсивности флуоресценции (А), процента положительных клеток (В) и процента ингибирования (С).
Фигура 16: Схематическое представление экспрессирующего вектора pTRAC-373-1706.
Большие стрелки представляют собой открытые рамки считывания β-лактамазы (bla), термочувствительного репрессора cl857 фага лямбда (λcl857), гена cyaC и укороченного гена 'cyaA (стрелки указыают направление трансляции соответствующих генов). Указаны также сайт инициации репликации ColE1 (Ori), промотор Pr (λPr) и некоторые имеющие отношение к вектору сайты рестрикции. Межгенная область между cyaC и укороченными генами 'cyaA детализована в нижней части. Она показывает новое удлинение С-конца cyaC (по ходу транскрипции (справа) от Arg182 CyaC дикого типа), стоп-кодон (подчеркнутый), инициирующий Met и первые кодоны CyaA373-1706 (слева от Ser373 CyaA дикого типа).
ПРИМЕРЫ
А. Аденилатциклазный токсин Bordetella взаимодействует специфически с интегрином αМβ2 (CD11b/CD18)
А.1. Материалы и способы
А.1.1. Рекомбинантные токсины и антитела
Протокол для получения CyaA был уже описан в другом месте [Karimova, et al., 1998]. Токсины CyaA получали в штамме E. coli BLR, несущем экспрессионную плазмиду, рСАСТ3, которая несет структурный ген cyaA для CyaA под контролем промотора lacUV5 и вспомогательный ген cyaC, требуемый для активации протоксина. После солюбилизации в 8 М мочевине, HEPES-Na 20 мМ, рН 7,5, CyaA очищали до гомогенности более 95% (как оценено анализом в ДСН-геле, не показано) последовательной хроматографией на ДЭАЭ-сефарозе и фенил-сефарозе. Рекомбинантный детоксицированный токсин CyaA, CAСTE5-Cys-OVA, несущий уникальный цистеин, инсерцированный в генетически инактивированный каталитический домен, конструировали путем встраивания подходящего двухцепочечного олигонуклеотида между сайтами BsiwI и KpnI рСАСТ-Ova-E5 [Guermonprez et al., 2000]. В полученном белке CAСTE5Cys-Ova аминокислотная последовательность ASCGSIINFEKLGT встроена между остатками 224 и 225 CyaA. Этот рекомбинантный токсин экспрессировали и очищали, как описано ранее. Очищенный белок метили на его уникальном цистеине высокоспецифическим сульфгидрильным реагентом N-(6-биотинамидо)гексил))-3'-(2'-пиридилтио)пропионамидом (Биотин-HPDP, Pierce), в соответствии с инструкциями изготовителя. Биотинилированный CyaA повторно очищали на ДЭАЭ-сефарозе для удаления непрореагировавшего реагента Биотин-HPDP. Концентрации токсина определяли спектрофотометрически по поглощению при 280 нм с использованием коэффициента молекулярной экстинкции 142 М-1 х см-1 (исследования связывания) или с использованием системы анализа белка Biorad (исследования накопления цАМФ и гибели клеток).
Очищенные mAb, специфические для мышиного CD11а (2D7, крысиный IgG2а, κ), мышиного и человеческого CD11b (М1/70, крысиный IgG2b, κ), мышиного CD11с (HL3, хомячка 1, λ), мышиного CD18 (С71/16, крысиные IgG2а, κ), контрольные (А95-1 или анти-CD16/32, 2,4G2, крысиный IgG2b, κ), получали из Pharmingen (San Diego, USA). Супернатанты от гибридом анти-CD11b человека (44, мышиный IgG2а, κ) и анти-CD18 человека (TS/18, мышиный IgG, κ) были любезно подарены, и их использовали при разведении 1/2 в экспериментах с блокированием. Супернатанты от анти-CD11b мыши (5С6, крысиный IgG2b, κ) были любезно представлены G. Milon (Pasteur Institute, Paris) и их использовали при конечном разведении 1/2 в анализах ингибирования связывания. Поликлональные антитела анти-CyaA получали у кролика, иммунизированного подкожно очищенным CyaA. Сыворотки преципитировали из иммунной сыворотки сульфатом аммония (33%). После центрифугрования осажденные белки ресуспендировали в 20 мМ HEPES-Na, 150 мМ NaCl, рН 7,5 (буфер С) и интенсивно диализовали против того же самого буфера. Затем антитела биотинилировали инкубированием с Биотин-амидокапроатным эфиром N-гидроксисукцинимида (Sigma, растворенным в диметилсульфоксиде) в течение 130 минут при комнатной температуре. Затем добавляли 100 мМ этаноламин, рН 9,0, и после 30 минут дополнительного инкубирования смесь интенсивно диализовали при 4°С против буфера С. Биотинилированные антитела хранили при -20оС.
А.1.2. Клетки и культуральные среды
Клетки ЕL4, J774A.1, LB27.4, THP-1 получали из Американской Коллекции Типовых Культур (АТСС) и культивировали в RPMI 1640, дополненной 10% фетальной телячьей сывороткой, 100 Е/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ L-глутамином, в присутствии или в отсутствие 5 х 10-5 М 2-меркаптоэтанола (полная среда). Клетки FSDC [Girolomoni et al., 1995] культивировали в полной среде. Клетки СНО, трансфицированные CD11b/CD18 или CD11с/CD18 человека или трансфицированные только вектором (пустым), получали от D. Golenbock (Boston, USA) и культивировали в присутствии неомицина, как описано ранее [Ingalis et al., 1998]. Нейтрофилы человека очищали, как описано ранее [Rieu et al., 1992].
А.1.3. Анализы связывания CyaA
Все анализы связывания выполняли в DMEM с 4,5 мг/мл глюкозы (Life Technologies) без сыворотки в 96-луночных культуральных планшетах (Costar). 2 х 105 клеток на лунку инкубировали в течение 20 минут (при 4°С или 37°С в зависимости от экспериментов) в конечном объеме 200 мкл. В некоторых экспериментах клетки преинкубировали в течение 20 минут при 4°С в присутствии блокирующих mAb в конечном объеме 100 мкл. Раствор токсина добавляли в эти клетки при непрерывном присутствии mAb в общем объеме 200 мкл при 4°С. Затем планшеты центрифугировали при 1500 об/мин в течение 5 минут, и супернатанты удаляли. Клетки инкубировали при 4°С в течение 25 минут с биотинилированными поликлональными антителами против CyaA (1/400 в DMEM, 50 мкг на лунку) в присутствии контрольной (неиммуной или преиммунной) кроличьей сыворотки в качестве агента насыщения (1/50).
После центрифугирования и удаления супернатанта клетки окрашивали конъюгатом стрептавидин-фикоэритрин (РЕ) (Pharmingen) при разведении 1/300 (50 мкл на лунку). После промывания клетки анализировали методом проточной цитометрии на приборе FACStar (Becton Dickinson, Mountain View, USA) в присутствии 5 мкг/мл пропидийиодида. Дискриминации проводили для исключения агрегатов клеток и мертвых клеток посредством исключения пропидийиодидом. Экспериментальные точки подставляли в гиперболическую модель ΔMFI=Bmax*[CyaA]/(Kd + [CuaA], где Bmax = % максимального связывания, с использованием программного обеспечения PRISM.
А.1.4. Анализ цАМФ
Накопление цАМФ измеряли конкурентным иммуноанализом антигена [Karimova et al., 1998], в котором инкубационная среда состоит из DMEM без сыворотки, но содержащей 4,5 мг/мл глюкозы и 20 Е/мл гексокиназы. Гексокиназу, которая катализирует АТФ-зависимое фосфорилирование глюкозы, добавляли для истощения внеклеточной среды от любых следов АТФ, предотвращая посредством этого внеклеточный синтез цАМФ. Таким образом, измеренное количество цАМФ является репрезентативным количеством накопления строго внутриклеточного цАМФ. 5 х 105 клеток преинкубировали в 96-луночных планшетах при 100 мкл на лунку в присутствии или в отсутствие 10 мкг/мл специфических mAb при 4°С в течение 1 часа и затем инкубировали при 37°С в течение 20 минут с 0,05, 0,5 или 5 г/мл CyaA и с 10 мкг/мл специфических mAb, когда они присутствовали во время преинкубации. Для действия "доза - ответ" CyaA клетки непосредственно инкубировали с токсином в течение 20 минут при 37°С. После интоксикации клетки центрифугировали при 2500 об/мин в течение 5 минут. Пробы лизировали 100 мкл 0,1 н. HCl, кипятили в течение 5 минут при 120°С и нейтрализовали 100 мкл 0,125 М Трис, 0,2 М NaCl. Микротитрационные планшеты покрывали конъюгатами цАМФ-БСА, разведенными при 1/4000 в 0,1 М Na2CO3 рН 9,5. Их промывали дважды в ЗФР-Твин 0,1%, насыщали в течение 1 часа в 2% ЗФР-БСА и промывали пять раз ЗФР-Твин 0,1%. Пробы и стандарт цАМФ (Sigma) сразу же добавляли в планшеты, покрытые конъюгатами цАМФ-БСА, и серийно разводили смесью 1/1 0,1 н. HCl и 0,125 М Трис/0,2 М NaCl. Добавляли кроличье антитело против цАМФ при разведении 1/2500 в ЗФР-БСА 2% и инкубировали при 37°С в течение 3 часов. Планшеты промывали пять раз смесью ЗФР-Твин 0,1%. Антикроличьи антитела, связанные с пероксидазой хрена (Amersham), добавляли при разведении 1/2500 в ЗФР-БСА 2%, инкубировали при 37°С в течение 1 часа и выявляли с использованием классической пероксидазной реакции. Экспериментальные точки стандартной кривой подставляли в сигмоидную модель с использованием программного обеспечения PRISM.
А.1.5. Анализ токсичности
Гибель клеток (некроз) оценивали, как описано ранее [Khelef et al., 1993; Khelef et al., 1995]. Вкратце, 105 клеток инкубировали в течение 24 часов в 96-луночном планшете в полной среде и промывали один раз бессывороточной средой. Все инкубирования клеток выполняли далее в бессывороточной среде. Эффекты "доза - ответ" оценивали путем прямого добавления различных концентраций CyaA к клеткам СНО при 37°С в течение 4 часов. Для ингибирования цитотоксичности клетки преинкубировали при 4°С в течение 1 часа в присутствии или в отсутствие 10 мкг/мл специфических mAb и затем инкубировали при 37°С с 0,5 мкг/мл CyaA в течение 2 часов для клеток J774A.1 или с 5 мкг/мл в течение 4 часов для клеток СНО и с 10 мкг/мл специфических mAb, когда они присутствовали при преинкубации. Лизис клеток оценивали с использованием Cytotox 96™-анализа (Promega), который позволяет опрелять количество лактатдегидрогеназы (LDH), высвобождаемой в среду умирающими клетками.
А.2. Результаты
А.2.1. Насыщаемое связывание CyaA коррелирует с присутствием CD11b на поверхности клеток-мишеней
Для характеристики клеточной специфичности CyaA в отношении популяции лейкоцитов авторы выбрали три репрезентативные мышиные клеточные линии, экспрессирующие различную комбинацию интегринов β2: J774A.1, опухолевые макрофаги; EL4, Т-клеточная тимома и LB27.4, В-клеточная лимфома. После 20 минут инкубации с CyaA при 37°С связвание CyaA с клеточной поверхностью этих клеток подвергали мониторингу проточной цитометрией с использованием биотинилированных анти-CyaA-антител и стрептавидина-РЕ (фикоэритрина). При этих условиях авторы наблюдали эффективное, зависимое от дозы и насыщаемое связывание CyaA на клеточной линии J774A.1. Аффинность CyaA в отношении клеток J774A.1 была высокой, так как средние Kd были 9,2 ± 4,5 нМ и 3,2 ± 1,9 нМ соответственно. Наблюдали низкое связывание CyaA с клетками EL4 и LB27.4, но оно не было насыщаемым при испытанных концентрациях.
Для определения того, коррелирует ли связывание CyaA с клеточной линией J774A.1 с экспрессией одного из членов семейства интегринов β2, авторы выполняли фенотипический анализ этих клеток с использованием проточной цитометрии с применением моноклональных антител (mAb), специфичных в отношении трех цепей α хорошо охарактеризованных интегринов β2 (CD11а, CD11b и CD11с) и в отношении общей β-цепи (CD18) (фигура 1b, c, d, e). Клетки J774A.1 экспрессировали в основном CD11b и CD18, но были также положительными в отношении CD11а. Клетки EL4 и LB27.4 экспрессировали в основном CD11а и CD18. Взятые в целом, эти результаты показывают, что эффективное и насыщаемое связывание CyaA с J774A.1 коррелировало с присутствием интегрина CD11b/CD18.
А.2.2. Насыщаемое связывание CyaA специфически блокируется анти-CD11b-mAb
Затем авторы исследовали, может ли CD11b/CD18 непосредственно участвовать в связывании CyaA с клетками, экспрессирующими этот интегрин. Авторы выполняли количественный анализ ингибирования, полученного с анти-CD11b-mAb М1/70, посредством расчета процента величин средней флуоресценции в отсутствие mAb при фиксированных или варьирующихся концентрациях CyaA (фигура 2). Ингибирование связывания CyaA, полученное с анти-CD11b-mAb М1/70, было почти полным при большинстве испытанных концентраций CyaA (фигура 2а, b). Это ингибирование было специфическим, так как анти-CD11а-, анти-CD11с-, анти-CD18-mAb или контрольные mAb не ингибировали связывание CyaA. Второе анти-CD11b-mAb (клон 5с6) также ингибировало связывание CyaA (фигура 2с, d). Сходные результаты получали с FSDC, линией незрелых дендритных клеток, экспрессирующих CD11b (фигура 2а, с), и макрофагальной клеточной линией J774A.1 (фигура 2b, d).
Для испытания того, может ли CyaA подобным образом взаимодействовать с CD11b человека, исследования связывания CyaA проводили на нейтрофилах человека, высокая экспрессия CD11b которых является хорошо установленной. Поскольку получали высокую фоновую флуоресценцию после инкубирования миелоидных клеток человека с антителами против CD11b кролика (данные не показаны), авторы разработали другой анализ связывания. Детоксицированную форму CyaA специфически биотинилировали на уникальных остатках цистеина, генетически введенных в их каталитическй домен. С применением этой системы авторы смогли детектировать связывание CyaA с нейтрофилами (фигура 3). Преинкубация нейтрофилов с mAb 44 или М1/70 против CD11b привела к, соответственно, полному или частичному ингибированию связывания CyaA (фигура 3а и b). В противоположность С71/16, mAb против мышиного CD18, которое не блокировало связывание CyaA с мышиными клетками, преинкубация с mAb TS/18 против CD18 человека приводила к полному ингибированию связывания CyaA с нейтрофилами человека (фигура 3b). Сходные результаты получали с клеточной линией ТНР-1 моноцитов человека (данные не приведены).
Таким образом, связывание CyaA с поверхностью трех миелоидных клеточных линий как мышиного, так и человеческого происхождения (J774A.1, FSDC, THP-1), а также свежеочищенных нейтрофилов человека опосредуется, по-видимому, в основном интегрином CD11b/CD18.
А.2.3. Опосредованные CyaA увеличение цАМФ и токсичность специфически ингибируются анти-CD11b-mAb
Для оценки физиологического значения CD11b/CD18-зависимого связывания CyaA авторы исследовали действие блокирующих mAb на цитотоксичность CyaA. Сначала авторы измерили количество цАМФ, продуцируемого в клетках J774A.1, подвергнутых действию CyaA, в присутствии различных mAb. Как показано на фигуре 4а, увеличение внутриклеточного содержания цАМФ, индуцированное CyaA, полностью снималось при преинкубации с анти-CD11b-mAb М1/70. mAb С17/16 против мышиного CD18, которые не блокировали клеточное связывание CyaA (фигура 2), не влияли на внутриклеточное содержание цАМФ обработанных CyaA клеток. Таким образом, эти результаты в сильной степени предполагают, что увеличение внутриклеточного цАМФ, индуцируемое CyaA, зависит от взаимодействия этого токсина с CD11b. Для дополнительного анализа необходимости этой молекулы для токсичности CyaA, авторы оценивали действие mAb, специфических в отношении различных цепей семейства интегринов β2, на CyaA-опосредованную гибель клеток. Фигура 4b показывает, что анти-CD11b-mAb J774A.1 разительно уменьшало гибель клеток, индуцируемую CyaA (80% ингибирование). Не наблюдали действия на гибель клеток, индуцированную CyaA, когда J774A.1 преинкубировали с mAb, которые не блокируют связывание токсина с клетками (анти-CD11а, анти-CD11с или анти-CD18 или контрольные mAb).
Взятые в целом, эти результаты показывают, что связывание CyaA посредством CD11b является строго необходимым для опосредованной CyaA токсичности в клетках J774A.1.
А.2.4. Трансфекция клеток СНО CD11b/CD18 придает им чувствительность к CyaA
Для подтверждения роли CD11b в связывании CyaA авторы использовали клетки СНО, трансфицированные интегринами человека CD11b/CD18 или CD11с/CD18, или ложнотрансфицированные (только вектором) клетки. Как показано на фигуре 5а, CyaA мог связываться, при 37°С, с этими клеточными линиями. Однако связывание CyaA было эффективным и насыщаемым в клетках СНО, экспрессирующих CD11b/CD18, но не в клетках с CD11с/CD18 или ложнотрансфицированных клетках. Аффинность CyaA в отношении CD11b/CD18-трансфицированных клеток была в диапазоне нМ (Kd = 0,7 ± 0,09 нМ). При 4°С эффективность связывания CyaA уменьшалась в сравнении со связыванием при 37°С (фигура 5b). При этой температуре различия между CD11b/CD18-трансфицированными клетками и двумя другими клеточными линиями были более ярко выраженными.
Поскольку авторы обнаружили, что CD11b был необходимым для опосредованной CyaA токсичности в клетках J774A.1, авторы затем определяли, является ли экспрессия CD11b достаточной для придания CyaA-чувствительного фенотипа трансфицированным клеткам СНО. В соответствии с более ранними сообщениями [Gordon et al., 1988], CyaA индуцировал значительное количество внутриклеточного цАМФ в клетках СНО, трансфицированных CD11с/CD18, или в контрольных ложнотрансфицированных клетках, но только при высоких концентрациях токсина (5 мкг/мл, фигура 5с). В противоположность этому, CyaA увеличивал внутриклеточный уровень цАМФ в трансфицированных CD11b/CD18 клетках СНО даже при самой низкой из исследованных концентраций (0,05 мкг/мл). Кроме того, продуцирование цАМФ в ответ на 5 мкг/мл CyaA было в 4-5 раз увеличенным в CD11b/CD18-трансфицированных клетках в сравнении с CD11с/CD18 трансфицированными или ложнотрансфицированными клетками.
Авторы оценивали также роль CD11b/CD18 в CyaA-опосредованной гибели клеток. Как показано на фигуре 5d, более 50% клеток СНО, трансфицированных CD11b/CD18, были убиты после 4 часов инкубации с 5 мкг/мл CyaA, тогда как не было влияния на CD11с/CD18-трансфицированные или ложнотрансфицированные клетки при этой обработке.
Таким образом, в целом эти результаты ясно доказали, что экспрессия интегрина CD11b/CD18 человека является достаточной для создания высокоаффинного рецептора для CyaA в клетках СНО.
А.3. Обсуждение: рецептор для CyaA
В противоположность другим токсинам, токсин CyaA считался в течение продолжительного времени независимым от связывания с каким-либо рецептором. Это мнение основывается на наблюдениях, что i) CyaA может вызывать интоксикацию большого разнообразия модельных клеточных линий различного происхождения [Ladant et al., 1999], ii) CyaA связывается с клетками Jurkat и овечьими эритроцитами ненасыщающим образом [Gray et al., 1999]. Фактически с помощью этих наблюдений установили, что неспецифическая адсорбция CyaA на липидных мембранах приводит к некоторой транслокации каталитического домена в цитозоль. Однако не исключается существование специфического рецептора. Авторы показали в этом исследовании на миелоидных клеточных линиях, что связывание и токсические свойства CyaA зависят от его взаимодействия с интегрином CD11b/CD18. Эффективное и насыщаемое связывание коррелирует с экспрессией CD11b и полностью и специфически блокируется анти-CD11b-mAb. Кроме того, экспрессия CD11b/CD18 в клетках СНО разительно увеличивает связывание CyaA, приводя к увеличенной чувствительности к интоксикации этим токсином. Исследования авторов являются первым доказательством, подтверждающим взаимодействие CyaA с молекулой клеточной поверхности, специфически экспрессируемой на лейкоцитах. Почти полная блокада связывания CyaA анти-CD11b-mAb предполагает, что CD11b является основным рецептором для CyaA в испытанных клеточных линиях. Отсутствие эффективного связывания с CD11с/CD18-трансфектантами или CD11а/CD18-экспрессирующими клетками, такими как EL4 или LB27.4, предполагает, что CD11b является единственным интегрином β2-семейства, участвующим в связывании CyaA с клетками-мишенями.
В соответствии с предыдущими исследованиями авторы наблюдали детектируемое связывание CyaA со многими испытанными клеточными линиями. Кроме того, CyaA в высоких концентрациях запускал небольшое, но детектируемое увеличение цАМФ в ложнотрансфицированных клетках СНО, которое не было связано с гибелью клеток. Таким образом, при высоких концентрациях CyaA может связываться и транслоцироваться в большом разнообразии клеточных линий, но эффективное и насыщаемое связывание, транслокация и убивание клеток является отличительным признаком экспрессирующих CD11b клеток.
Связывание CyaA с членом семейства β2-интегринов напоминает поведение других RTX-токсинов, которые, как было недавно обнаружено, взаимодействуют с этими молекулами [Lally et al., 1997; Li et al., 1999; Ambagala et al., 1999; Jeyaseelan et al., 2000]. HlyA E.coli, который имеет строгую гомологию с CyaA, образует катионные поры в плазматической мембране. HlyA проявляет специфичность в отношении лейкоцитов, но только при низкой концентрации [Welch et al., 1991]. Было показано, что эта относительная специфичность опосредована его взаимодействием с интегрином CD11с/CD18 [Lally et al., 1997]. Подобным образом, лейкотоксин A. actinomycetemcomitans и P. haemolytica (LtxA и LktA, сответственно), которые являются менее разнородными RTX-токсинами, специфическими для лейкоцитов человека и коровы, соответственно, также взаимодействуют с CD11а/CD18 [Lally et al., 1997; Li et al., 1999; Ambagala et al., 1999; Jeyasseelan et al., 2000]. Несмотря на строгую гомологию с HlyA, CyaA узнает другой интегрин β2 (CD11b/CD18), клеточное распределение которого является другим. Действительно, CD11b экспрессируется в основном на макрофагах, нейтрофилах и дендритных клетках, но не на большинстве Т- и В-клеток, тогда как CD11а экспрессируется на всех лейкоцитах, в том числе Т- и В-лимфоцитах.
Это специфическое нацеливание CyaA на экспрессирующие CD11b клетки используется в данном изобретении для специфического нацеливания на эту конкретную субпопуляцию клеток. Детоксицированные мутанты CyaA, сохраняющие инвазивность, могли бы использоваться для доставки фармакологически активных молекул к CD11b-положительным клеткам без заметного влияния на другие типы клеток.
В. Нацеленная доставка антигена в цитозоль миелоидных клеток и селективное ЦТЛ-примирование
В.1. Материалы и методы
В.1.1. Рекомбинантные аденилциклазные токсины и пептид
Синтетический пептид pOVA (SIINFEKL) получали из NEOSYSTEM и его разбавляли в ЗФР до концентрации 1 мг/мл.
В.1.2. Иммунизация и анализ для детектирования цитотоксических Т-клеток
Самок мышей С57ВL/6 (H-2b) из Iffa Credo (L'arbresle, France) использовали в возрасте между 6 и 8 неделями. ТАР1-/- (Van Kaer et al., 1992), CD4-/- (Killeen et al., 1993), CD40-/- (Kawabe et al., 1994) и недостаточные по В-клеткам μМТ (Kitamura et al., 1991), выведенные на фенотипе С57BL/6, происходили из предприятия CDTA (CNRS, Orleans, France) и их разводили в специальных сооружениях в Institut Pasteur. Животных внутривенно иммунизировали антигеном в ЗФР. Спустя семь дней после инъекции животных умерщвляли и селезенки извлекали. Суспензии отдельных клеток спленоцитов (2,5 х 207 клеток) повторно стимулировали в 10 мл СМ (см. ниже) облученными клетками селезенки (2,5 х 107 клеток) в течение 5 дней в присутствии 1 мкг/мл pOVA. Анализ цитотоксичности выполняли точно так, как описано ранее (Fayolle et al., 1999).
В.1.3. Клеточные линии
Клетки B3Z (Karttunen et al., 1992), CD8+ Т-клеточные гибридомы, специфические для пептида OVA 257-264 (SIINFEKL) в контексте Н-2Кb, были любезно представлены доктором N. Shastri (University of California, Berkeley, USA).
В.1.4. Анализы представления антигена
Все анализы представления антигена выполняли сокультивированием антигенпредставляющих клеток (АРС) с клетками B3Z в 96-луночных культуральных планшетах (конечный объем 0,2 мл) в RPMI 1640, дополненной 10% фетальной телячьей сывороткой, 100 Е/мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ L-глутамином и 5 х 10-5 М 2-меркаптоэтанолом (полной среде, СМ). Стимуляцию клеток B3Z (105 клеток на лунку) подвергали мониторингу по высвобождению IL-2 в супернатантах 18-24-часовых культур в присутствии АРС. IL-2 измеряли в CTLL-анализе, как описано ранее (Guermonprez et al., 1999). В некоторых экспериментах (см. подписи к фигурам) стимуляцию B3Z оценивали с использованием NF-AT lacZ-репортерного анализа. LacZ-активность в клеточных лизатах оценивали с субстратом CPRG, как описано ранее (Karttunen et al., 1992). Выполняли два анализа представления антигена: i) Анализ in vitro: АРС, происходящие из неиммунизированных мышей, сокультивировали (105 клеток на лунку) с клетками B3Z в присутствии Ag в различных концентрациях. В некоторых экспериментах АРС преинкубировали или не преинкубировали с mAb при 10 мкг/мл в течение 40 минут при 4°С, затем к клеткам добавляли антиген в конечном объеме 100 мкл при непрерывном присутствии mAb. После 4-часовой обработки АРС промывали дважды и помещали в сокультуру с клетками B3Z. Очищенные используемые mAb были mAb против CD11b (М1/70, крысиный IgG2b, κ) или контрольные mAb того же изотипа, происходящие из (Pharmingen) (San Diego, USA), ii) Анализ ex vivo: АРС происходили из мышей, предварительно иммунизированных внутривенно различными Ag, и их помещали в культуру с клетками B3Z в конечном объеме 0,2 мл при различных числах АРС на лунку.
В.1.5. Антигенпредставляющие клетки и сортинг
Тотальные клетки селезенки (TSC), фракции низкой плотности (LDF) и высокой плотности (HDF) получали в соответствии с протоколом Steinman, модифицированным Vremec et al., 1992). Вкратце, селезенки подвергали действию коллагеназы в течение 40 минут при 37°С и затем лацерировали дважды и получали при непрерывном присутствии 5 мМ ЭДТА. Клетки центрифугировали на плотном растворе БСА. Супернатант и осадок клеток собирали раздельно, и эти фракции были названы фракцией низкой плотности и фракцией высокой плотности, соответственно. Окрашивание CD11с выполняли при 4°С в ЗФР, дополненном 5% фетальной телячьей сывороткой и 2 мМ ЭДТА (ЗФР-FACS), с mAb HL3 хомячка, связанными с фикоэритрином (РЕ), флуоресцеинизотиоцианатом (FITC) или биотинилированными и затем выявляемыми с использованием стрептавидина-РЕ. Окрашивание CD8α выполняли с mAb 53-6.7, связанными с РЕ. Окрашивание CD11b выполняли с mAb М1/70, связанными с РЕ или FITC. Окрашивание CD54R выполняли с mAb В220, связанными с РЕ или биотинилированными и выявляемыми с использованием стрептавидина-РЕ. Все mAb получали из Pharmingen. После двух промывок клетки сортировали с использованием FACStar (Becton Dickinson, Mountain View, USA). Клетки асептически извлекали в СМ. Чистоту подвергнутых сортингу клеток проверяли на аликвоте разделенных сортингом клеток, анализируемой на приборе FACScan (Becton Dickinson, Mountain View, USA). Чистота подвергнутых сортингу клеток обычно была 80 и 98%. В других экспериментах (упомянутых в подписях к фигурам) CD11с+ клетки сортировали непосредственно из продуктов расщепления коллагеназой селезенки с использованием CD11с-микрогранул и магнитной технологии клеточного сортинга в соответствии с протоколом поставщика (MACs, MiltenyiBiotec, Bergish Gladbach, Germany). С использованием этого способа чистота отсортированных клеток была в диапазоне около 80%.
В.2. Результаты
В.2.1. CD4- и CD40-независимое примирование ЦТЛ после системной иммунизации с использованием CyaAOVA в отсутствие адъюванта
Эпитоп SIINFEKL куриного овальбумина, H-2Kb-рестрицированного, использовали в качестве экспериментального модельного эпитопа. Его генетически инсерцировали в каталитический домен детоксицированного, все еще инвазивного мутантного CyaA. Мышей С57BL/6 (H-2Kb) иммунизировали iv один раз 50 мкг рекомбинантного токсина или контрольным солевым раствором. Спустя семь дней после иммунизации активность ЦТЛ в отношении pOVA детектировали в спленоцитах CyaAOVA-иммунизированных мышей С57ВL/6, но не в мышах, инъецированных солевым раствором или контрольным CyaA (фигура 6а). Сходные результаты получали с CD4- или CD40-недостаточными мышами, что указывает на то, что, в противоположность многим другим ЦТЛ-реакциям (таким как реакции, индуцированные против перекрестнореагирующего Ag (Bennet et al., 1997; 1998; Schoenberger et al., 1998, Ridge et al., 1998), помощь CD4+ Т-клеток не была обязательной для примирования ЦТЛ-реакций при помощи CyaAOVA (фигура 6b, с). Кроме того, В-клетки не требовались, так как ЦТЛ-реакции получали также в недостаточных по В-клеткам мышах (IgM-/-, фигура 6d). Примесные LPS, возможно, действующие в качестве адъювантов, не участвуют в стимуляции ЦТЛ-реакций CyaAOVA, так как C57BL10ScSn и LPS-гипореактивные мыши C57BL10ScCr проявляли сходную OVA-специфическую ЦТЛ-реакцию после инъекции CyaAOVA (не показано).
В.2.2. Нацеливание in vitro и in vivo CyaAOVA-представления на экспрессирующие CD11b клетки
Для лучшего понимания иммуногенности CyaAOVA авторы намеревались определить АРС, участвующие в его представлении CD8+ Т-клеткам. С использованием секреции IL-2 в качестве показателя для стимуляции, авторы показывают, что B3Z, Н-2Кb-рестрицированная, анти-OVA CD8+ Т-клеточная гибридома, стимулируется in vitro общей массой спленоцитов в присутствии CyaAOVA, но не CyaALCMV (фигура 7а). Авторы намеревались анализировать АРС-способность трех хорошо определенных АРС спленоцитов: DC (CD11с+), В-клеток (CD45R+) и макрофагов/гранулоцитов (CD11bвыс+CD11с-). Вследствие низкого процента CD11с+ в общих спленоцитах (<1%) авторы выполняли фракционирование по плотности и сортировали CD11с+ из DC-обогащенной (4-10%) популяции низкой плотности проточной цитометрией. Фракция высокой плотности содержала только следовые количества CD11с+ клеток. В противоположность этому, распределение CD45R+ и CD11bвыс+CD11с- (состоящие из гранулоцитов/макрофагов)-клетки в обеих фракциях обеспечивали возможность сортинга на общей популяции на эти маркеры. Как показано на фигуре 7с, CyaAOVA презентировался наиболее эффективно посредством DC, менее эффективно CD11bвыс+CD11с- и В-клетками. Это коррелирует с почти исключительным распределением антигенпредставляющей способности во фракции спленоцитов низкой плотности (фигура 7а). В резком противоречии как фракция низкой плотности, так и фракция высокой плотности способны стимулировать B3Z в ответ на pOVA (не показано).
Для обнаружения Кb-OVA-комплексов, образованных in vivo после иммунизации, АРС, полученные у мышей, иммунизированных iv за 8-15 часов перед иммунизацией CyaAOVA, сокультивировали с клетками B3Z in vitro без добавления Ag (анализ ex vivo). Как и в анализе in vitro, АРС, ответственные за представление CyaAOVA, присутствовали исключительно в DC-обогащенной фракции низкой плотности спленоцитов (фигура 7b). Специфичность этого анализа проверяли с АРС из CyaALCMV-иммунизированных мышей, которые не стимулировали B3Z (фигура 7b). Для дополнительной характеристики АРС низкой плотности, участвующих в представлении CyaAOVA, авторы выполняли клеточные сортинги: результаты, приведенные на фигуре 7d, показывают, что фракция DC(CD11с+) была более эффективной АРС. Макрофаги/гранулоциты (CD11bвыс+CD11с-) и В-клетки (CD45R+), полученные сортингом из той же самой фракции, были неэффективными для стимуляции B3Z.
Для дополнительной характеристики АРС, участвующих в представлении CyaAOVA, авторы выполняли субфракционирование CD11с+ DC низкой плотности селезенки на CD11с+CD8α+ миелоидную субпопуляцию и CD11с+CD8α+ лимфоидную субпопуляцию. Анализы in vitro и ex vivo (фигуры 7е и f соответственно) показали, что антигенпредставляющая способность в отношении CyaAOVA сохранялась миелоидной субпопуляцией, которая также экспрессировала CD11b+, в противоположность лимфоидной субпопуляции, экспрессирующей низкие уровни этого интегрина (Pulendran et al., 1997; Vremec et al., 1997). Неспособность CD11с+CD8α+ лимфоидной субпопуляции представлять CyaA была специфической для CyaAOVA, так как CD11с+CD8α+ и CD11с+CD8α- презентировали одинаково хорошо синтетический пептид pOVA клеткам B3Z.
Анализы in vitro и ex vivo, выполненные со спленоцитами из контроля (С57BL/6) или недостаточных по В-клеткам мышей (IgM-/-), подтвердили слабый вклад В-клеток в представление CyaAOVA in vitro и in vivo (фигура 7g и h). В соответствии с этими результатами ЦТЛ-реакции, индуцируемые CyaAOVA, не подвергались значимому влиянию в недостаточных по В-клеткам мышах в сравнении с контрольными мышами (фигура 5d).
В.2.3. MHCI-рестрицированное представление CyaAOVA дендритными клетками зависит от цитозольной доставки рекомбинантного токсина как in vitro, так и in vivo
Для определения того, зависит ли представление CyaAOVA от цитозольной доставки эпитопа OVA или от внеклеточной нагрузки, авторы выполняли анализы представления Ag общими спленоцитами или дендритными клетками CD11с+ DC из ТАР-/- или контрольных ТАР+/+ спленоцитов, очищенных из неиммунизированных животных (in vitro, фигура 8а) или из животных, иммунизированных iv CyaAOVA (ex vivo, фигура 8b). Результаты показывают, что представление CyaAOVA дендритными клетками полностью зависит от ТАР, либо in vitro, либо in vivo. Поскольку представление pOVA является ТАР-зависимым явлением, авторы проверяли функциональность ТАР-/- DC, полученных при сортинге из CyaAOVA-иммунизированных мышей, стимуляцией B3Z этими клетками, загруженными in vitro пептидом pOVA (не показано). Эти результаты показывают, что представление in vivo CyaAOVA зависит от его цитозольной доставки.
В.2.4. Взаимодействие CyaA с CD11b является необходимым для клеточного связывания и доставки встроенного антигена в цитозольный путь для представления антигена посредством МНС I
Авторы показали в части А, что насыщаемое и эффективное связывание CyaA WT с CD11b+ клетками может быть специфически блокировано анти-CD11b-mAb. Кроме того, CD11b-трансфекция специфически придавала насыщаемое связывание и чувствительность к CyaA WT CD11b- клеткам, в противном случае устойчивым к CyaA WT. Блокада клеточного связывания анти-CD11b-mAb ингибировала последующую внутриклеточную доставку каталитического домена аденилциклазы, увеличение цАМФ и гибель клеток, индуцированные CyaA WT. Поскольку эти результаты были получены на клеточных линиях, остается определить, связывается ли CyaA со спленоцитами. Авторы изобретения создали проточный цитометрический анализ для детектирования фиксации биотинилированной детоксицированной формы CyaA, несущей пептид OVA (CyaAOVAбиотин), с суспензиями общих спленоцитов с использованием стрептавидина, сопряженного с фикоэритрином. С использованием этого анализа авторы изобретения наблюдали, что CyaAOVA связывается с субпопуляцией лейкоцитов в суспензии общих спленоцитов (5-7%). Преинкубация с анти-CD11b-mAb М1/70, но не с контрольными mAb элиминировала это связывание (фигура 9а). Кроме того, имеется корреляция между экспрессией CD11b и связыванием CyaAOVA с клетками низкой плотности: CyaAOVA связывается эффективно с CD11с+CD8α+, которые экспрессируют высокие уровни CD11b, менее эффективно с CD11с+CD8α+, которые экспрессируют низкие уровни CD11b, и очень слабо с CD11с-CD8α+ Т-клетками, которые не экспрессируют CD11b (фигура 9b). Примечательно, что CyaAOVA связывается эффективно с низким процентом CD11с-CD8α- клеток в корреляции с присутствием CD11bвыс+ в этой CD11с- популяции. Таким образом, связывание CyaAOVA-биотина опосредовано CD11b (как и в отношении CyaA WT), и прогнозирует способность конкретного клеточного типа представлять CyaAOVA.
Авторы изобретения показали in vitro, что анти-CD11b-mAb М1/70 блокирует представление CyaAOVA TSC-клетками клеткам B3Z (фигура 10а). Эта блокада является специфической, так как i) контрольный mAb или mAb, специфические в отношении других членов семейства β2-интегринов (анти-CD11а, анти-CD11с), имели слабое действие или не имели действия (фигура 10а и неприведенные данные), ii) на представление pOVA не влияло анти-CD11b-mAb или ни одно из этих mAb (фигура 10b и неприведенные данные). Это подтверждает, что CD11b является главным рецептором CyaAOVA, по меньшей мере в селезенке, и что взаимодействие CyaAOVA-CD11b является обязательным для представления инсерцированного эпитопа.
Наконец, для определения роли экспрессирующих CD11b клеток в представлении CyaAOVA авторы выполняли эксперименты с сортингом клеток на целых клетках-спленоцитах мышей, иммунизированных CyaAOVA или pOVA. Тотальные клетки-спленоциты сортировали на фракции CD11b+ и CD11b-. В то время как эти две субпопуляции стимулировали B3Z после pOVA-иммунизации iv (фигура 10d), только субпопуляция CD11b+ стимулировала B3Z после iv CyaAOVA-иммунизации.
Взятые вместе, эти результаты ясно доказывают, что представление пептида OVA из CyaAOVA зависит от клеточного связывания и, следовательно, от взаимодействия с CD11b.
В.3. Дискуссия
В данном исследовании с использованием детоксицированной аденилциклазы Bordetella pertussis в качестве вектора доставки эпитопа авторы установили стратегию иммунизации, которая примирует ЦТЛ-реакции после единственной инъекции, что позволяет обойти необходимость применения адъюванта. Авторы идентифицировали механизмы, которые способствуют высокой эффективности детоксицированного CyaA в качестве вектора:
В.3.1. CyaA нацеливается на миелоидные дендритные клетки через его взаимодействие с интегрином CD11b
Анализ представления антигена специфической CD8+ Т-клеточной гибридоме с использованием загруженных in vitro или in vivo АРС (анализ in vitro или ex vivo, соответственно) показал, что наиболее эффективными АРС для CyaAOVA являются дендритные клетки (DC) CD11b+ CD11bвыс+. Действительно, вся антигенпредставляющая способность в отношении CyaAOVA принадлежала фракции спленоцитов низкой плотности, которая удерживает DC. Клеточный сортинг определенных типов клеток выявил, что CD11b+ CD11bвыс+ DC-клетки являются гораздо более эффективными, чем CD11b-CD11bвыс+ клетки, для представления CyaAOVA. Небольшой вклад, наблюдаемый для В-клеток (CD45R+), был подтвержден эффективной презентацией CyaAOVA (in vitro и ex vivo) и ЦТЛ-реакциями в не имеющих В-клеток мышах.
В.3.2. CyaA доставляет Ag в цитозольный путь для представления посредством МНС класса I in vivo
Здесь авторы показывают зависимость представления CyaAOVA тотальным спленоцитам in vitro. Удивительно, но авторам удалось также показать, что представление CyaAOVA in vivo происходит также согласно ТАР-зависимому пути. Это приводит к выводу, что представление CyaAOVA in vivo происходила эффективно из цитозольной доставки, а не из возможной внеклеточной деградации.
В.3.3. Примирование ЦТЛ устраняет необходимость помощи CD4+ Т-клеток и является независимой от передачи сигнала CD40
Созревание от стадии незрелости в направлении зрелой стадии характеризуется i) уменьшением способности захвата Ag, ii) увеличением способности примирования Т-клеток, iii) миграцией из сайтов сбора Ag (маргинальной, краевой) зоны в селезенке) в направлении зоны Т-клеток (периартериолярные слои в селезенке), где они максимизируют возможность встречи с Ag-специфическими Т-клетками (de Smedt et al., 1996). Кроме Ag-представления дендритными клетками (DC), фаза созревания, как теперь предполагается, является необходимым условием для примирования Т-клеток. Исследования in vitro выдвинули на первый план роль CD4+ Т-клеток в передаче сигнала созревания дендритных клеток, особенно через взаимодействие CD40L-CD40 (Bell et al., 1999). В случае примирования CD8+ Т-клеток после примирования перекрестнореагирующим клеточным Ag, CD4+ Т-клетки освобождаются от выполнения их помощи CD8+ Т-клеткам в CD40-зависимом механизме (Schuurhuis et al., 2000; Bennet et al., 1998; Schoenberger et al., 1998; Ridge et al., 1998). Поскольку CyaAOVA примирует ЦТЛ в CD4- и CD40-независимом пути, хотелось бы предположить, что детоксицированный CyaA мог бы быть наделен внутренней адъювантностью.
В.3.4. Заключение
В данном изобретении представлена, насколько известно авторам, первая характеристика белкового вакцинного вектора, который подходит как для нацеливания на специфические АРС, для цитозольной доставки находящегося в векторе Ag, так и для не требующего адъюванта примирования ЦТЛ. Кроме того, авторы изобретения выяснили механизм клеточного нацеливания путем демонстрации того, что представление антигена (Ag) зависит от взаимодействия между CyaA и CD11b, его рецептора. Таким образом, клеточная специфичность CyaA является благоприятным образом адаптированной к цели доставки Ag. Наконец, клеточная специфичность CyaA или других бактериальных токсинов может служить для цитозольной доставки большого диапазона фармацевтически используемых молекул, действие которых должно быть нацелено на ограниченный набор клеток.
С. Применение аденилциклазы для доставки химически связанных антигенов к дендритным клеткам in vivo
С.1. Способы связывания представляющих интерес молекул с произведенными из CyaA векторами
Здесь описана общая методология для создания рекомбинантных CyaA-токсинов прививкой представляющих интерес молекул к CyaA посредством дисульфидных связей.
В качестве иллюстрации, синтетический пептид длиной 12 аминокислот, соответствующий CD8+ Т-клеточному эпитопу, из овальбумина, сшивали химически посредством дисульфидной связи с остатком цистеина, генетически введенным в каталитическией домен CyaA в положении 235 (CyaA дикого типа не имеет остатков цистеина). Ожидаемыми преимуществами этой новой архитектуры являются:
(i) многосторонность: единственный белок-носитель CyaA может быть легко связан с любыми желаемыми синтетическими пептидами;
(ii) иммуногенность: при доставке в цитозоль АРС эпитопы, химически связанные с CyaA, должны быть высвобождены из этого вектора (вследствие восстанавливающих внутриклеточных условий) и введены непосредственно в путь представления посредством МНС класса I, что устраняет необходимость потенциально ограничивающей стадии протеолитического процессинга протеосомой.
Общая процедура связывания синтетических пептидов с CyaA дисульфидными связями представлена на фигуре 11.
В первой стадии получают рекомбинантный токсин CyaA, который содержит единственный остаток цистеина, генетически инсерцированный в каталитический домен CyaA (CyaA дикого типа не имеет остатка цистеина).
Рекомбинантный токсин CyaA, АСТМ235, был охарактеризован ранее (Heveker and Ladant, 1997). В частности, АСТМ235 несет дипептид Cys-Ser, встроенный между аминокислотой 235 и 236, и является полностью токсичным. Этот токсин экспрессировали и очищали до гомогенности, как описано выше в А.1.1.
Во второй стадии конструировали синтетический пептид, соответствующий CD8+ Т-клеточному эпитопу из овальбумина; кроме того, во время химического синтеза к последовательности SIINFEKL (однобуквенный код для аминокислот), которая является точной последовательностью эпитопа, добавляли остаток цистеина с активированной нитропиридинсульфонилтиольной группой (Cys-NPys) на N-конце этого пептида. Активированный Npys-цистеин отделяли от последовательности SIINFEKL гибким мотивом GGA для облегчения дополнительного протеолитического процессинга этого пептида в АРС. Этот пептид (Cys-Npys-OVA, молекулярная масса: 1405 Да) был синтезирован Neosystem (Strasbourg, France).
В третьей стадии пептид Cys-Npys-OVA связывали с АСТМ235 с использованием следующей процедуры.
Десять мг очищенного АСТМ235 в 8 М мочевине, 20 мМ HEPES-Na, рН 7,5, восстанавливали инкубированием в течение 12 часов в присутствии 10 мМ дитиотреитола (ДТТ). Эффективность восстановления проверяли электрофоретическим анализом на ДСН-ПААГ при невосстанавливающих условиях: по существу весь белок АСТМ235 мигрировал в виде единственной полосы 200 кДа, соответствующей мономерной частице, без проявления каких-либо димерных частиц (молекулярной массы около 400 кДа). Затем этот восстановленный белок наносили на колонку ДЭАЭ-сефарозы (Amersham Pharmacia Biotech) (5 мл упакованной смолы), уравновешенную в 8 М мочевине, 20 мМ HEPES-Na, рН 7,5. Белок АСТМ235 полностью удерживался на ДЭАЭ-сефарозной смоле, которую затем интенсивно промывали 8 М мочевиной, 20 мМ HEPES-Na, рН 7,5, 0,1 М NaCl (> 100 мл) для удаления любых следов ДТТ (отсутствие остаточного ДТТ проверяли с использованием классической реакции Эллмана с 5,5'-дитио-бис-(2-нитробензойной кислотой), DTNB). Затем восстановленный белок АСТМ235 элюировали из ДЭАЭ-сефарозной смолы в 7 мл 8 М мочевине, 20 мМ HEPES-Na, рН 7,5, 0,5 М NaCl. Затем три мг (около 2 мкмоль) пептида Cys-Npys-OVA добавляли к восстановленному белку АСТМ235 (8 мг, около 45 нмоль), и эту смесь инкубировали в течение 16 часов при комнатной температуре. Затем добавляли 25 мл 20 мМ HEPES-Na, рН 7,5 и 8 мл 5 М NaCl, и затем эту разбавленную смесь наносили на фенил-сефарозную колонку (Amersham Pharmacia Biotech) (10 мл упакованной смолы), уравновешенную в 20 мМ HEPES-Na, рН 7,5, 1 М NaCl. Фенил-сефарозную смолу промывали 50 мл 20 мМ HEPES-Na, рН 7,5, 1 М NaCl и затем 50 мл 20 мМ HEPES-Na, рН 7,5. Затем дериватизованный белок АСТМ235 элюировали в 8 М мочевине, 20 мМ HEPES-Na, рН 7,5. Концентрацию токсина определяли спектрофотометрически из поглощения при 280 нм с использованием коэффициента молекулярной экстинкции 142000 М-1.см-1.
Пептид Cys-Npys-OVA связывали с использованием той же самой процедуры со вторым рекомбинантным токсином CyaA, CyaAЕ5-LCMVgp, который является детоксицированным вариантом (т.е. не имеющим ферментативной активности в результате инсерции 2 аминокислот LQ между остатками 188 и 189). Этот токсин также содержит полипептидную последовательность из 15 аминокислот (PASAKAVYNFATCGT), встроенную между остатками 224 и 225 CyaA, которая содержит единственный остаток Cys. Плазмида, кодирующая этот рекомбинантный токсин, является производным pCACT-ova-E5 (Guermonprez et al., 2000), модифицированным инсерцией между сайтами рестрикции StuI и KpnI подходящего синтетического двухцепочечного олигонуклеотида, кодирующего последовательность PASAKAVYNFATCGT. Белок CyaAЕ5-LCMVgp экспрессировали и очищали, как описано ранее в А.1.1.
Пептиды, показанные в таблице 1, также связывали подобным образом с другим детоксицированным рекомбинантным токсином CyaA, CyaAЕ5-CysOVA, который содержит ту же самую инсерцию LQ-дипептида в каталитическом сайте и последовательность из 14 аминокислот, инсерцированную между остатками 224 и 225 CyaA. Этот инсерт содержит остаток Cys, смежный с эпитопом OVA, как показано на фигуре 12. Плазмида, кодирующая этот рекомбинантный токсин, является производным рСАСТ-ova-E5, модифицированным инсерцией между сайтами рестрикции BsiWI и KpnI подходящего синтетического двухцепочечного олигонуклеотида, кодирующего последовательность ASCGSIINFEKLGT. Белок CyaAЕ5-CysOVA экспрессировали и очищали, как описано ранее в А.1.1.
CyaAЕ5-CysOVA может рассматриваться как общий детоксицированный вектор для химического связывания ЦТЛ-эпитопов дисульфидными мостиками. Присутствие эпитопа OVA в CyaAЕ5-CysOVA обеспечивает возможность легкого анализа in vitro на функциональность в доставке эпитопа измерением представления эпитопа OVA в специфическую Т-клеточную гибридому, как описано ранее в В.1.4.
Пептиды NPys ЦТЛ, связанные с CyaAЕ5-CysOVA
Альтернативно, тиольные группы рекомбинантных токсинов CyaA могут быть активированы 2,2'-дитиодипиридином (Sigma) и дериватизованы пептидами, содержащими восстановленный цистеин (процедура восстановления Cys в синтетических пептидах обеспечена изготовителем). Это было бы особенно удобным, если желаемый пептид содержит внутренний остаток цистеина.
С.2. Анализ иммуногенности in vitro и in vivo эпитопа OVA, химически связанного с CyaA
Доставку эпитопа OVA к молекулам МНС класса I посредством CyaA после химического (CyaA-gp-S-S-OVA E5) или генетического связывания (CyaA-OVA E5) сначала анализировали, исследуя представление этих молекул CD8+ Т-клеточной гибридоме анти-OVA B3Z спленоцитами. 3 х 105 клеток селезенки из мышей С57BL/6 сокультивировали в течение 18 часов с 105 клеток B3Z в присутствии различных концентраций рекомбинантого CyaA. Высвобождение IL-2 клетками B3Z измеряли в анализе CTLL-пролиферации.
Как показано на фигуре 13, высокую секрецию IL-2 наблюдали, когда клетки B3Z стимулировали либо CyaA-gp-S-S-OVA E5, либо CyaA-OVA E5, что демонстрировало, следовательно, что эпитоп OVA, химически связанный с CyaA, доставлялся так же эффективно в цитозольный путь антигенпредставляющих клеток, как после генетического связывания. Не наблюдали продуцирования IL-2, когда клетки B3Z стимулировали молекулами CyaA, не имеющими эпитопа OVA, что указывало на специфичность продуцирования IL-2.
Затем во второй стадии анализировали способность этих молекул in vivo индуцировать OVA-специфические ЦТЛ-реакции. Мышей С57BL/6 (2 мыши на группу) иммунизировали iv-инъекцией 50 мкг различных CyaA. Спустя семь дней 25 х 106 клеток селезенки каждой мыши повторно стимулировали 0,1 мкг пептида OVA в присутствии 25 х 106 облученных сингенных клеток селезенки в течение пяти дней.
Цитотоксическую активность этих эффекторных клеток измеряли на 51Cr-меченных клетках-мишенях EL4, обработанных кратковременно (или не обработанных) 50 мкМ пептидом OVA.
Как показано на фигуре 14, высокие ЦТЛ-реакции индуцировались в мышах, иммунизированных либо CyaA-gp-S-S-OVA E5, либо CyaA-OVA E5, что демонстрировало, следовательно, сравнимую эффективность химического или генетического связывания эпитопа OVA. Не наблюдали ЦТЛ-реакции у мышей, иммунизированных контрольными молекулами CyaA, не имеющими эпитопа OVA, или при использовании не имеющих оболочки клеток ЕL4, в качестве клеток-мишеней, что указывает, следовательно, на специфичность наблюдаемых ЦТЛ-реакций.
Таким образом, эти результаты ясно демонстрируют, что CD8+ Т-клеточный эпитоп, химически связанный с произведенными из CyaA белковыми векторами, очень эффективно доставляется в цитозольный путь для представления посредством МНС класса I и индуцирует сильную ЦТЛ-реакцию in vivo.
D. Идентификация произведенного из CyaA фрагмента, который связывается с CD11b/CD18 и может быть использован в качестве эффективных векторов доставки молекул
В качестве попытки картирования района, который участвует во взаимодействии между CyaA и CD11b/CD18-рецептором, конструировали различные субфрагменты CyaA, и испытывали их на их способность конкурировать с биотинилированным токсином CyaA за связывание с CD11b/CD18 на поверхности трансфицированных клеток СНО с использованием способов, описанных выше в параграфе А.
D.1. Экспрессия CyaA373-1706
Белок CyaA373-1706 получали в E. coli с использованием нового экспрессионного вектора pTRAC-373-1706 (фигура 16). Он является производным плазмиды pDL1312 (Ladant 1995), сконструированным путем замены гена нейрокальцина плазмиды pDL1312 геном cyaC (который кодирует CyaC, участвующий в превращении proCyaA в активный токсин посттрансляционным пальмитоилированием Lys 860 и 983 CyaA) и 3'-частью гена cyaA, которая кодирует С-концевой домен - кодоны 373-1706 - CyaA (см. фигуру 16). Как ген cyaC, так и ген 'cyaA помещают в одну и ту же транскрипционную единицу под контроль промотора Pr фага λ. 3'-конец гена cyaC модифицируют введением перед его кодоном сайт связывания рибосом для усиления инициации трансляции расположенного справа гена 'cyaA (фигура 16). Полученная модификация полипептида CyaC (последние 3 аминокислоты Gly-Thr-Ala на С-конце CyaC были заменены последовательностью Asn-Arg-Glu-Glu) не влияла на его способность ацилировать CyaA. 5'-конец гена cyaA (кодирующий каталитический домен этого токсина (слева от сайта BstBI гена cyaA) делетировали и заменяли подходящим синтетическим двухцепочечным олигонуклеотидом, кодирующим последовательность MGCGN (фигура 16).
pTRAC-373-1706 кодирует также термочувствительный репрессор λ CI857, который сильно репрессирует транскрипцию гена при промоторе Pr λ при температурах ниже 32°С, сайт инициации репликации colE1 и ген бета-лактамазы, который придает устойчивость к ампициллину.
Экспрессию этого белка CyaA373-1706 проводили в штамме E. coli BLR. Клетки, трансформированные плазмидой pTRAC-373-1706, выращивали при 30°С в LB-среде, содержащей 150 мг/л ампициллина, до средней log-фазы, и затем индуцировали синтез CyaC и укороченного CyaA увеличением температуры выращивания до 42°С. Бактерии собирали после 3-4 часов дополнительного роста при 42°С. Затем белок CyaA373-1706 очищали, как описано для CyaA дикого типа (Guermonprez et al., 2000). CyaA373-1706 не имеет активности синтеза цАМФ, он проявляет гемолитическую активность на эритроцитах овцы и содержит также уникальные остатки цистеина в его N-концевой последовательности MGCGN.
D.2. Ингибирование связывания CyaA-Е5 с CD11b CyaA-Е5 и CyaA-фрагментами: 1-383 (каталитическим доменом) и 373-1706 (гидрофобным и повторяющимся доменами)
Как показано на фигуре 15, сильное ингибирование связывания биотинилированного CyaA-Е5 получали после инкубирования трансфицированных клеток СНО с CyaA-Е5. Подобное ингибирование получали после инкубирования этих клеток с фрагментом CyaA-373-1706, тогда как фрагмент CyaA 1-383 не оказывал значимого влияния на связывание биотинилированного CyaA-Е5.
Таким образом, эти результаты ясно показывают, что фрагмент CyaA, который включает в себя остатки 373-1706, CyaA373-1706, содержит структуры, обязательно требующиеся для взаимодействия CyaA с рецептором CD11b/CD18.
Е. Выводы
Поскольку молекулы МНС класса I обычно являются пептидами, происходящими из эндогенно синтезируемых белков, эпитопы должны доставляться в цитозоль антигенпредставляющих клеток для индукции ЦТЛ-реакций. Ранее было установлено, что ЦТЛ-примирующая активность рекомбинантного белка АСТ основывается по меньшей мере частично на его способности доставлять эпитопы CD8+ Т-клеток в цитозоль антигенпредставляющих клеток (АРС). В одном подходе эпитопы генетически (генной инженерией) встраивали в каталитический домен CyaA, так как известно, что для токсина дикого типа, эта часть полипептида достигает цитозоля клеток-мишеней, где она проявляет токсическое действие (т.е. синтез цАМФ). После вхождения в эти клетки каталитический домен CyaA, несущий этот эпитоп в виде инсерта, должен быть протеолитически процессирован для высвобождения зрелого эпитопа CD8+ Т-клеток, который затем будет транслоцирован в эндоплазматический ретикулум для связи его с молекулами МНС класса I.
Этот протеолитический процессинг, проводимый протеосомой, может быть лимитирующей стадией в многочисленных случаях (Pamer and Cresswell, 1998; Cascio et al., 2001), приводя к значительному уменьшению общего выхода зрелого эпитопа. Альтернативный подход, описанный здесь, который состоит в связывании этих эпитопов с каталитическим доменом CyaA посредством дисульфидной связи, предоставляет существенное преимущество, заключающееся в том, что с этой конструкцией, зрелые эпитопы (требующие только N-концевого подравнивания) будут количественно высвобождаться из CyaA внутри цитозоля АРС. Кроме того, будет легко при помощи генной инженерии ввести несколько остатков цистеина в каталитический домен (например, в предварительно картированные пермиссивные сайты, WO 93/21324 (Institut Pasteur)) рекомбинантного детоксицированного токсина CyaA таким образом, что множественные пептиды могут быть связаны на одной и той же молекуле CyaA. Это должно увеличивать общую доставку эпитопа и иммуногенность рекомбинантного белка.
Делеционное картирование позволило идентифицировать С-концевую часть CyaA (аминокислоты 373-1706) в качестве района, который участвует во взаимодействии этого токсина с его рецептором CD11b/CD18. Укороченный белок CyaA373-1706 может быть, следовательно, использован в качестве белкового модуля для нацеливания CD11b+ клеток in vivo. В частности, полипептиды или белки, соответствующие представляющим интерес антигенам, могут быть генетически (генная инженерия) слиты с CyaA373-1706 для доставки в дендритные клетки для индукции специфических иммунных реакций. Подобное связывание может выполняться на рекомбинантном белке CyaA373-1706, который также содержит уникальный цистеин в его N-концевой части.
БИБЛИОГРАФИЯ
















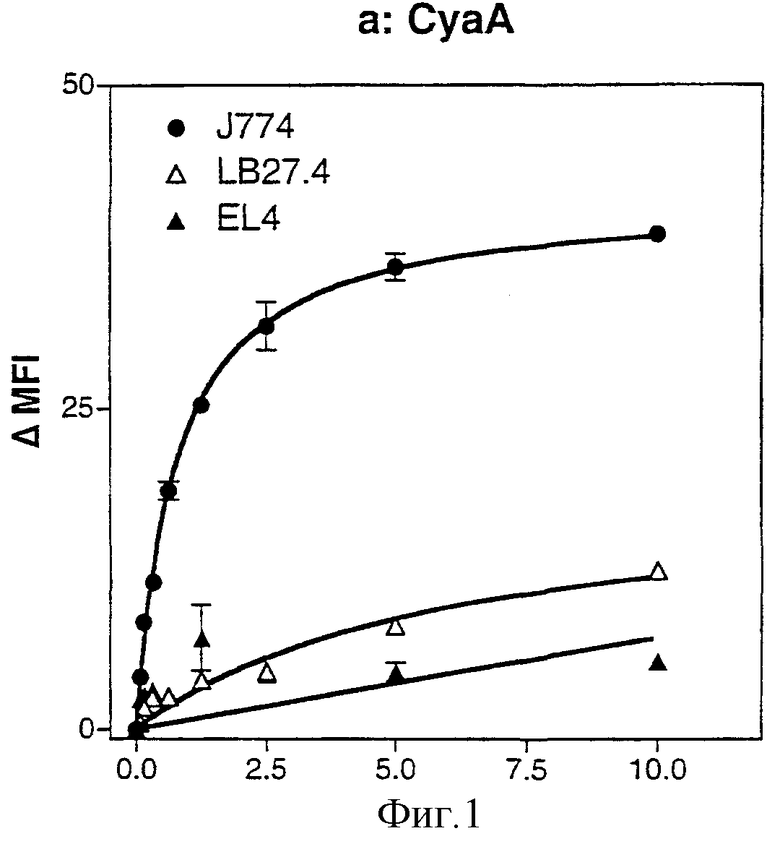
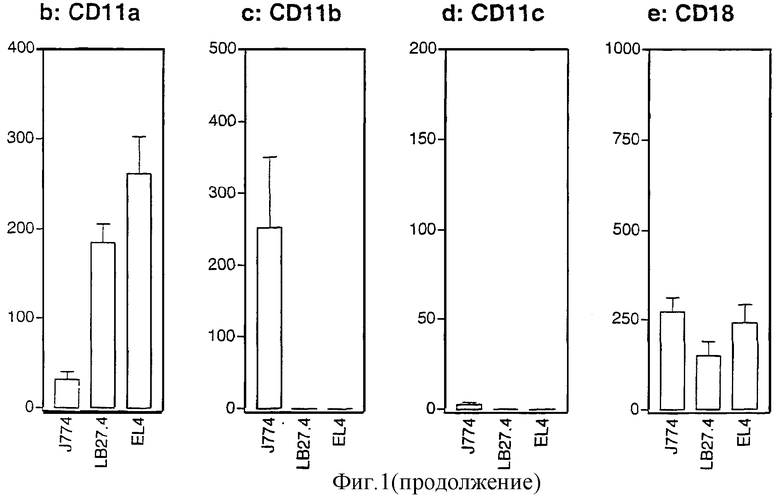
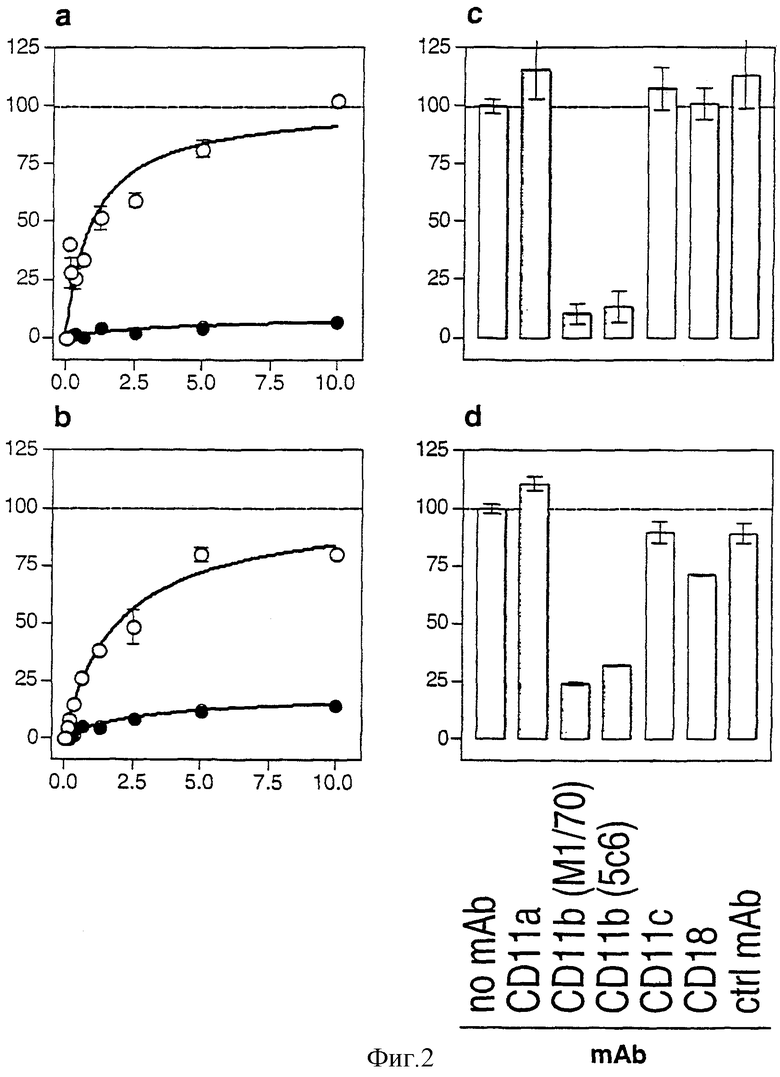
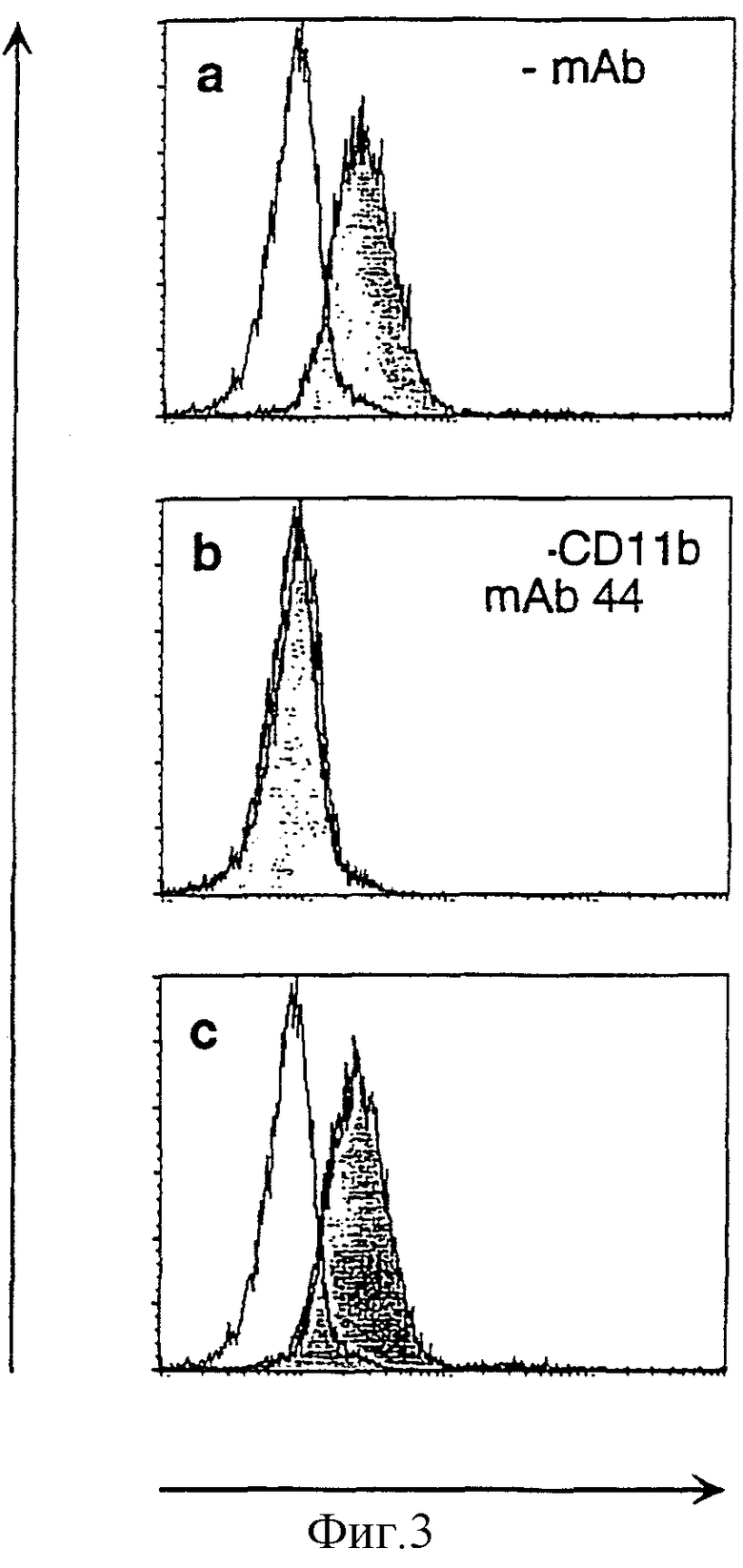
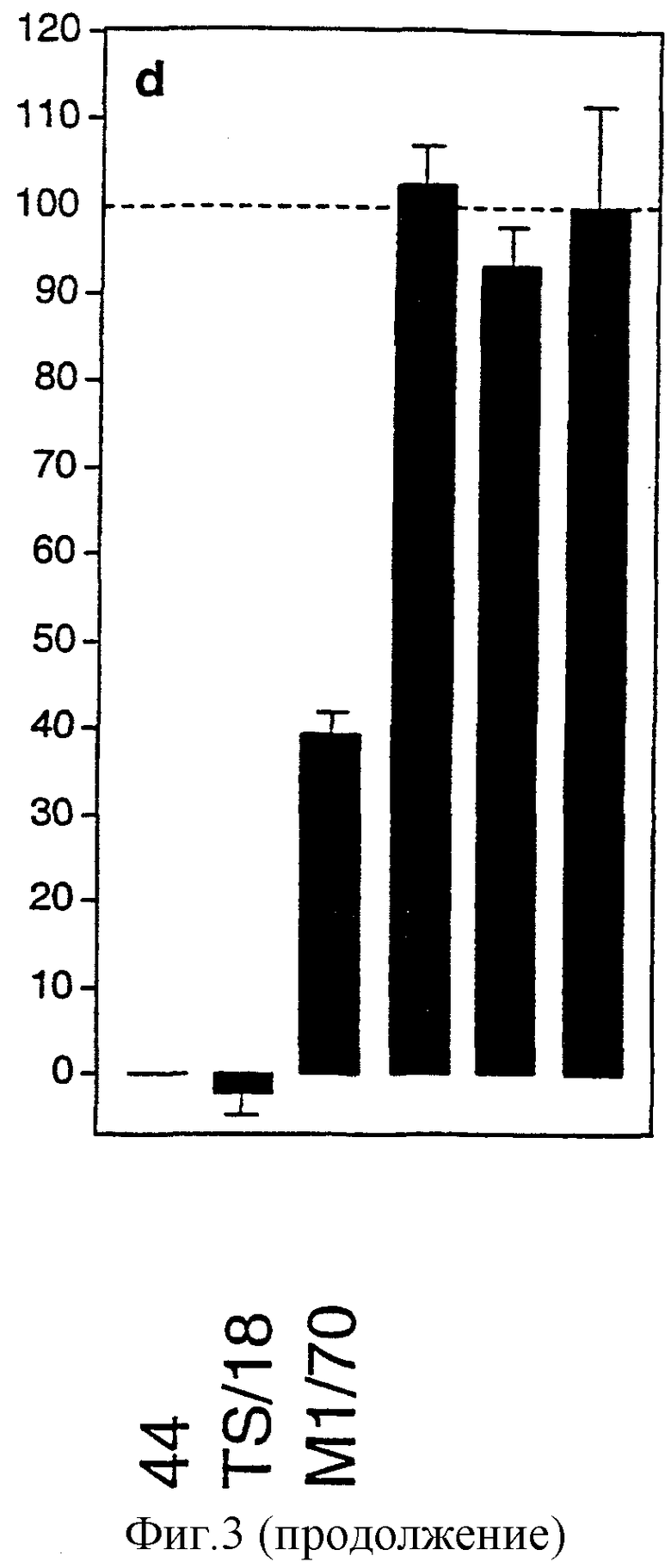
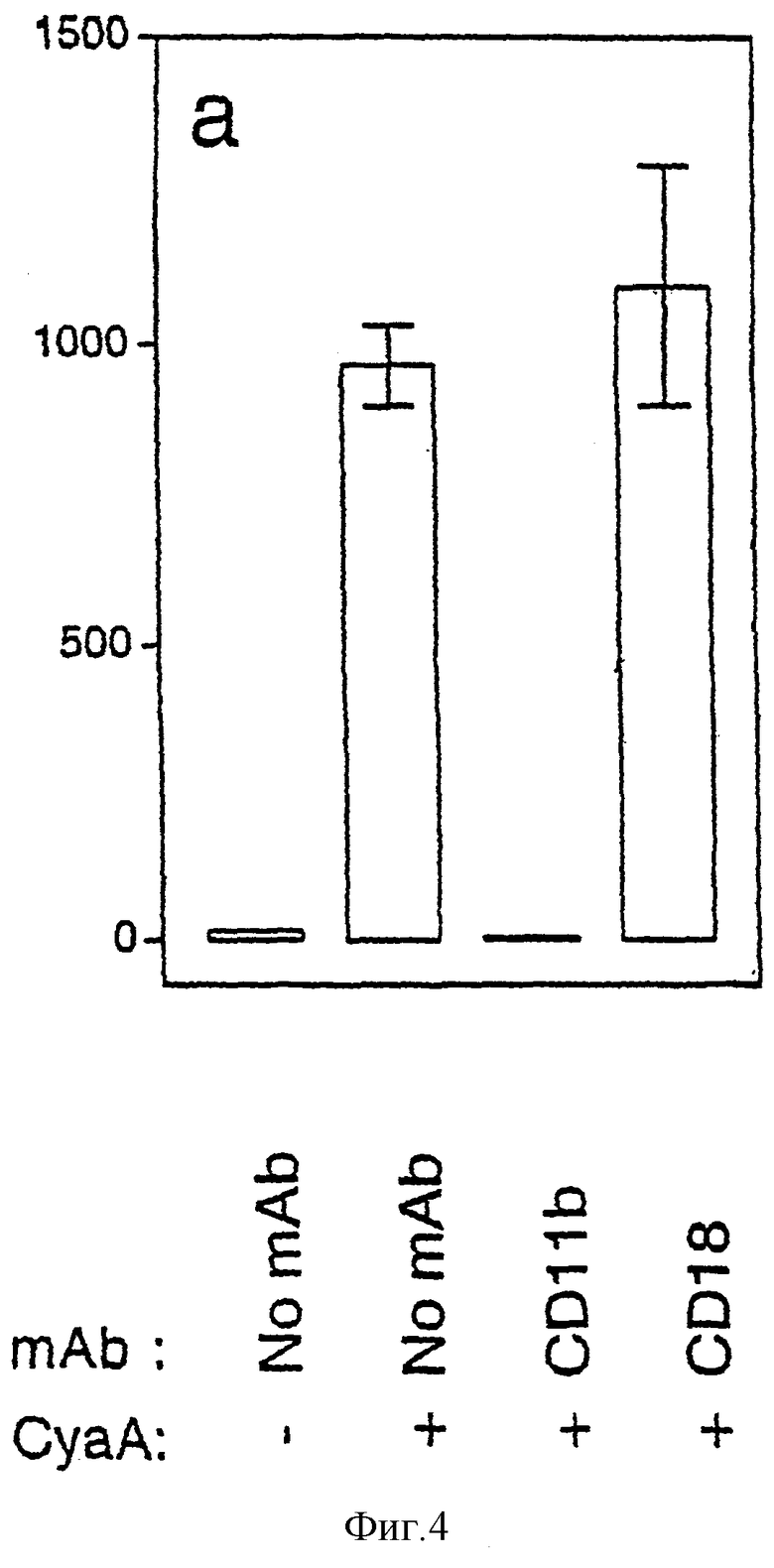
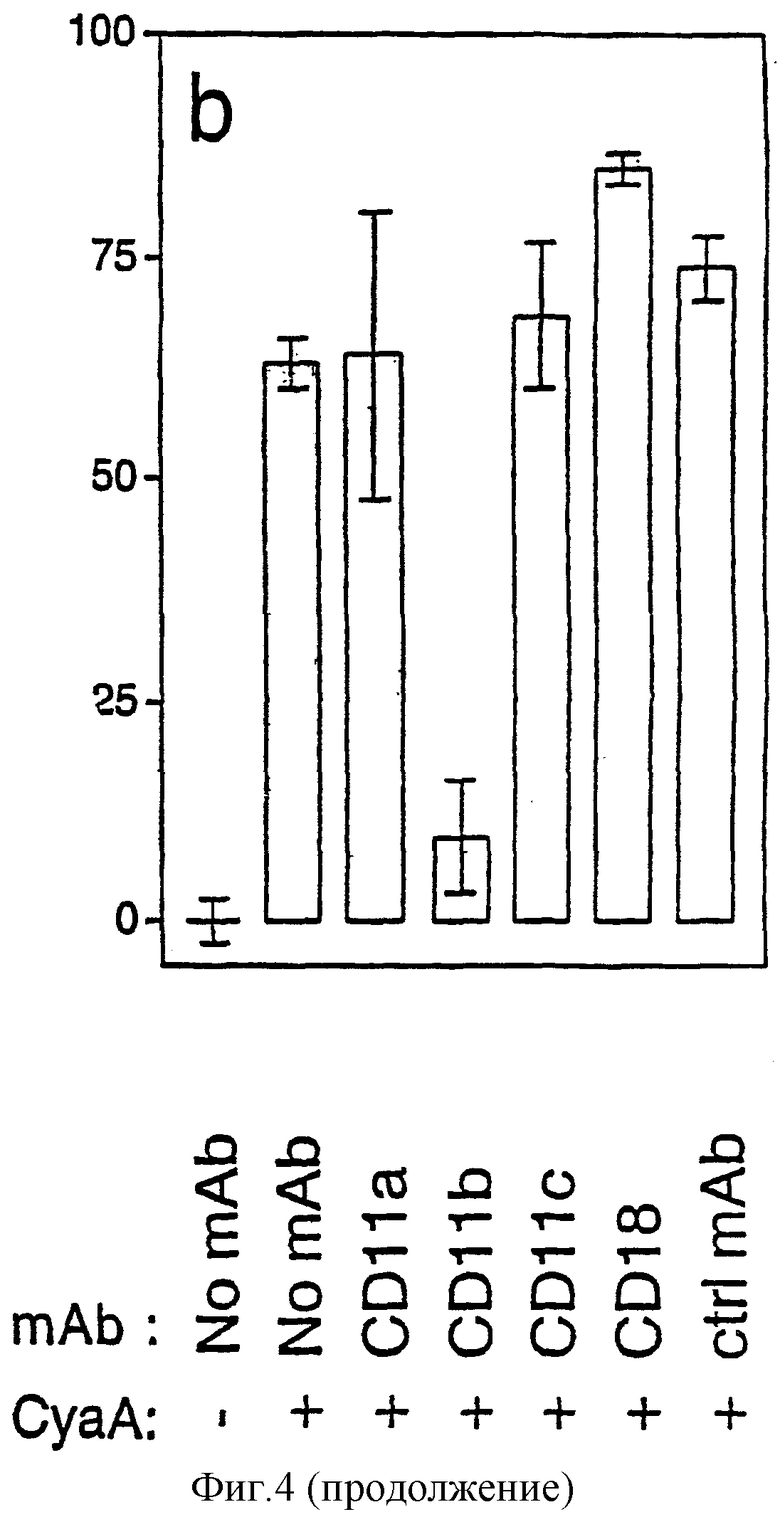
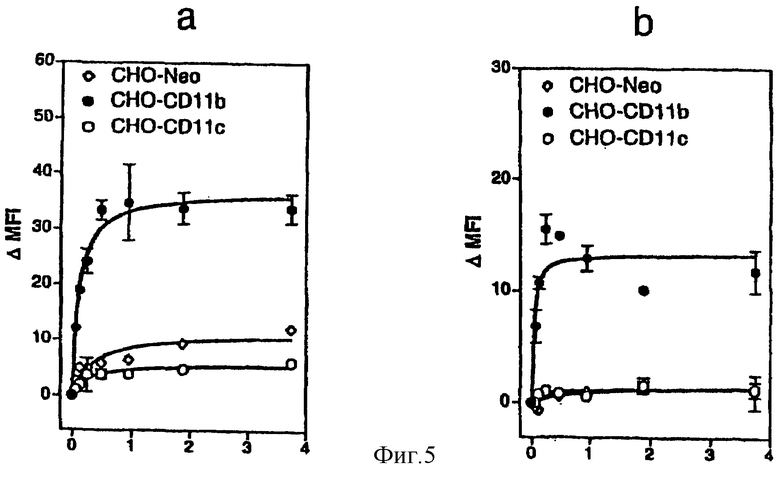
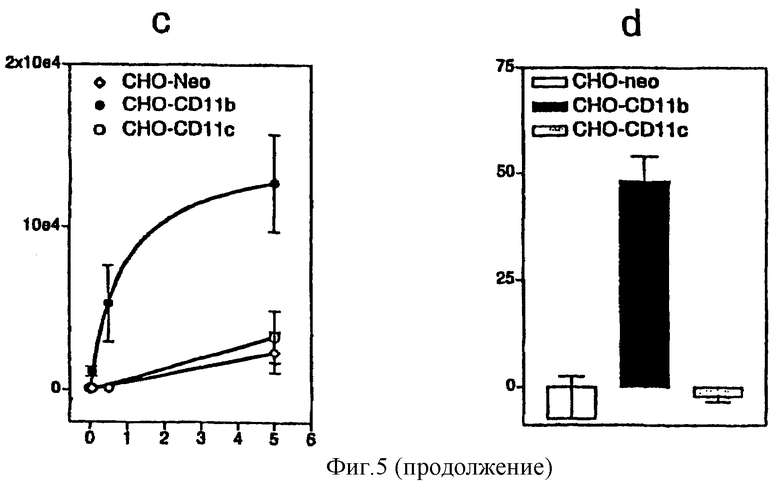


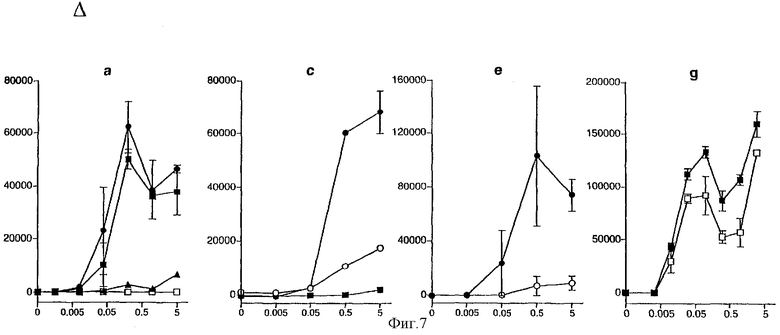
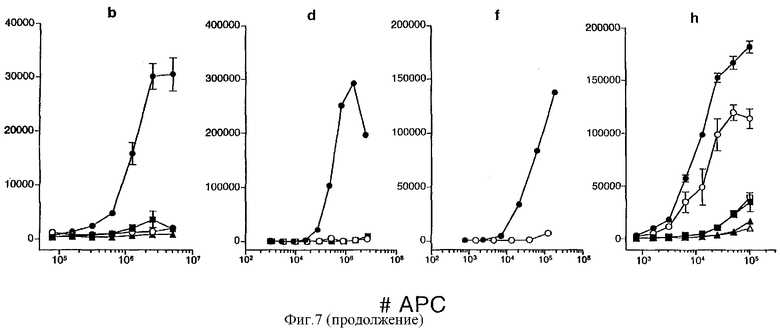
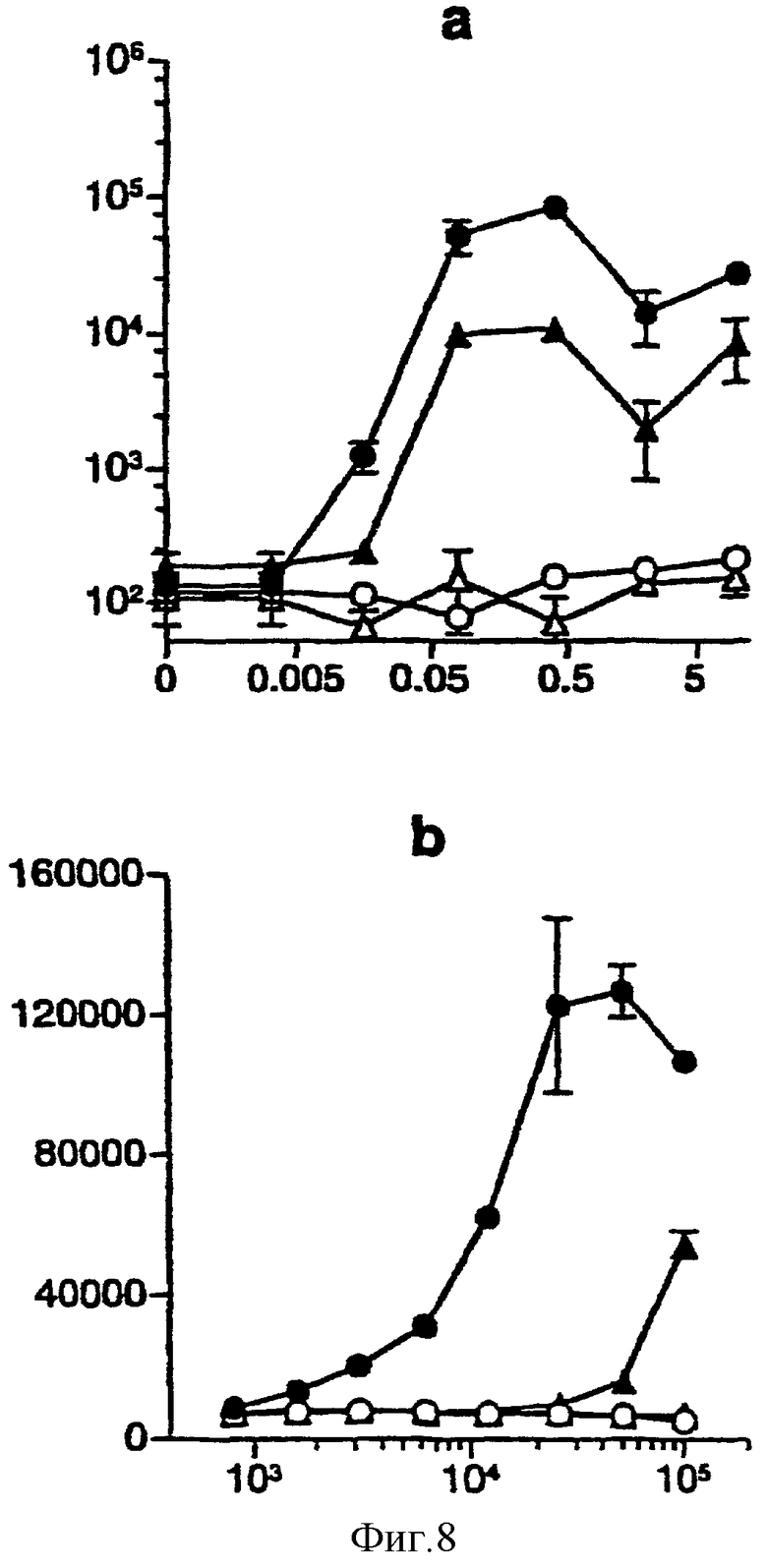
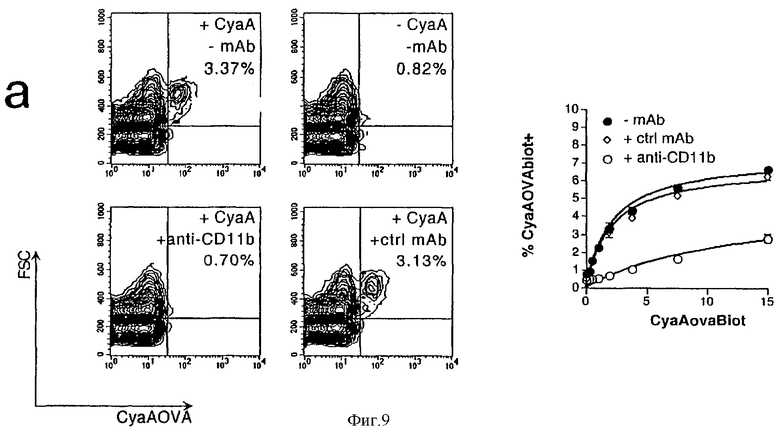
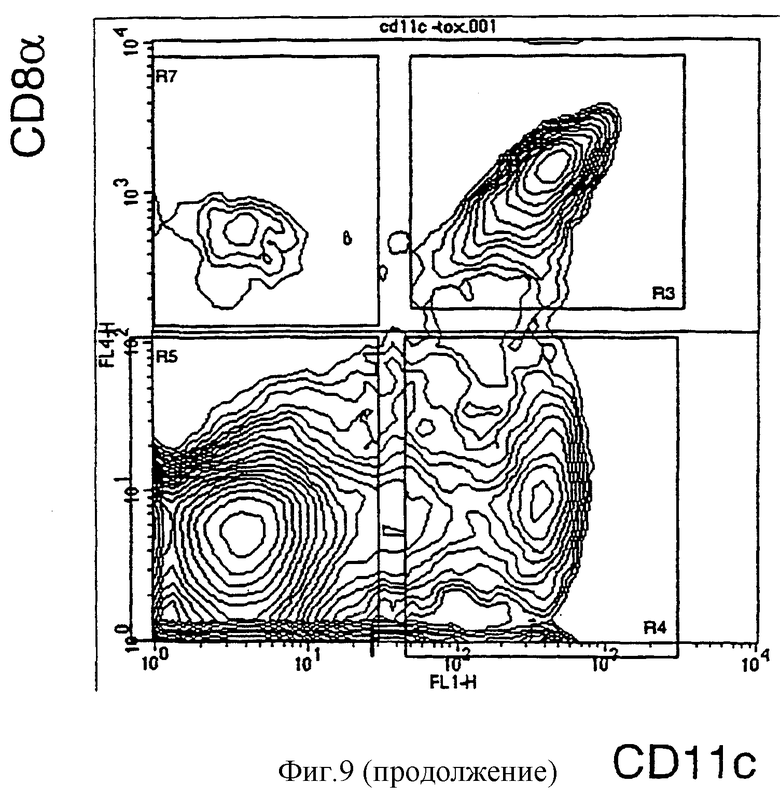
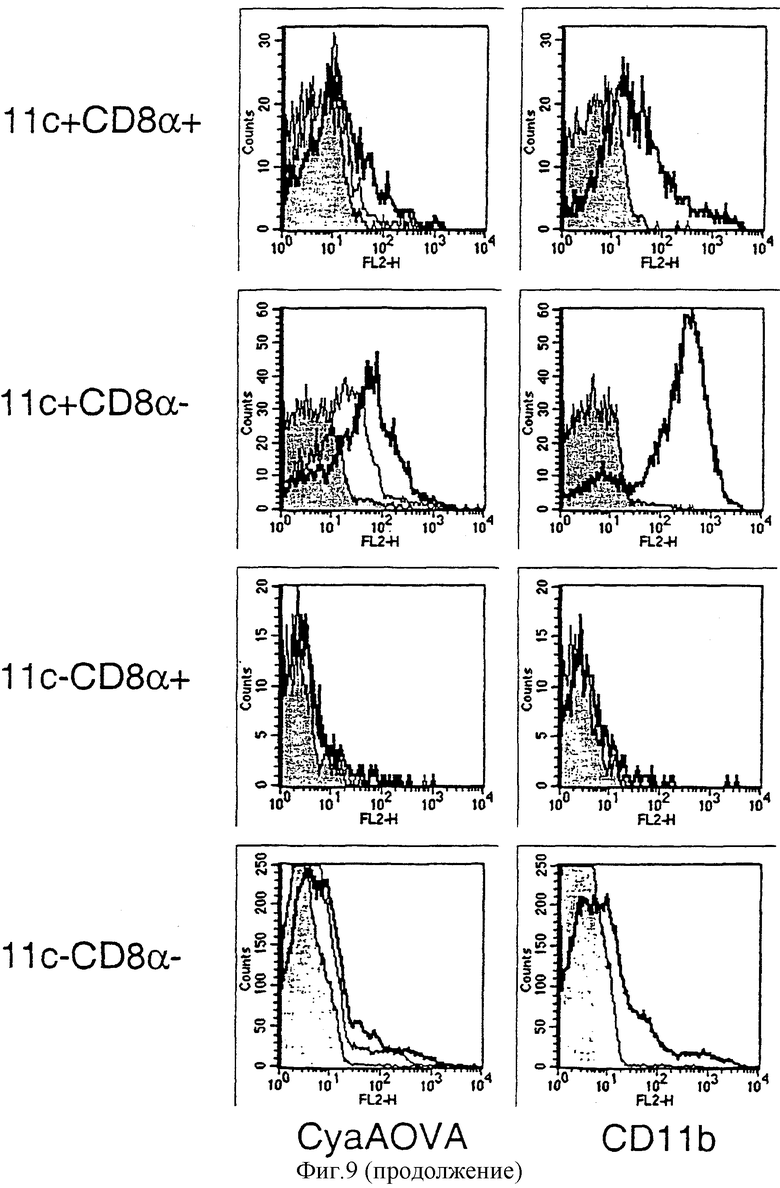

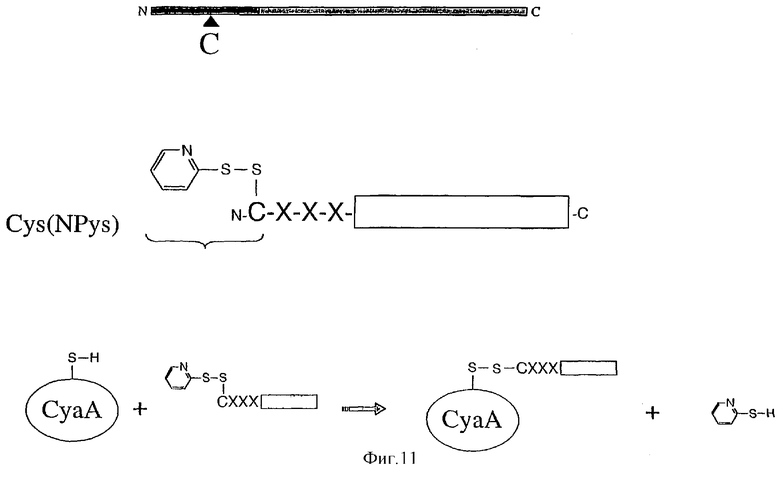
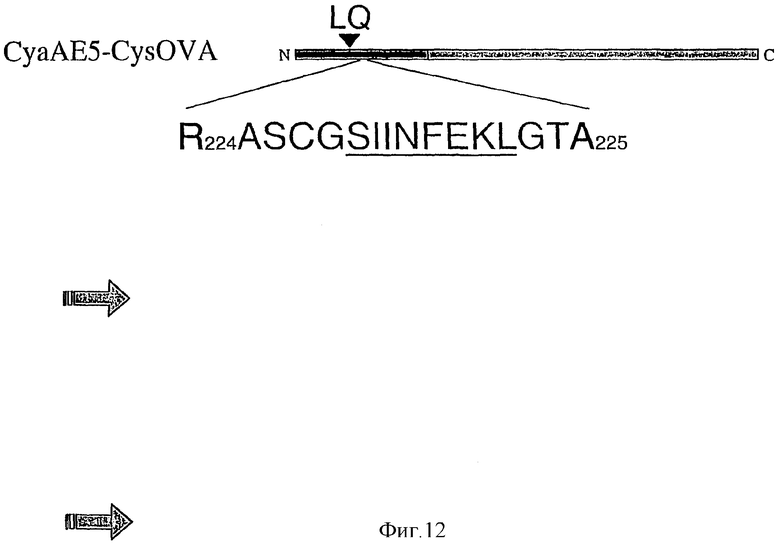
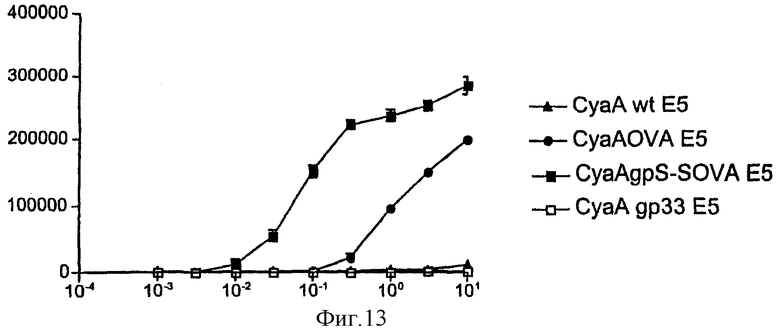
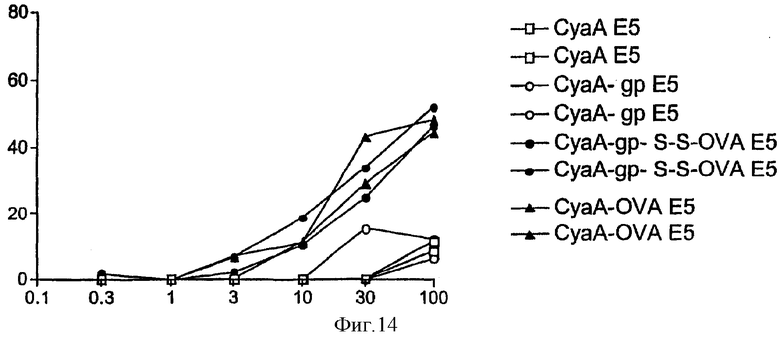
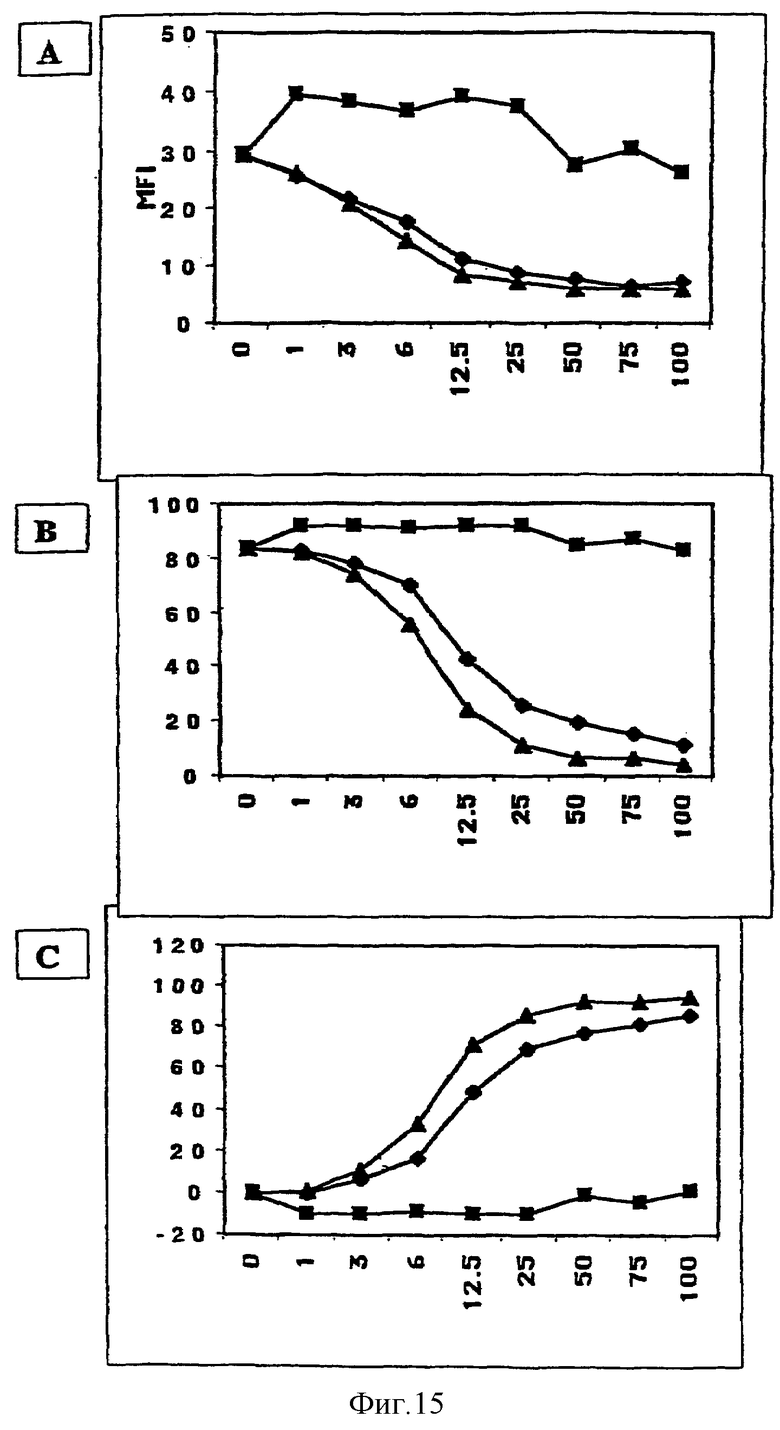
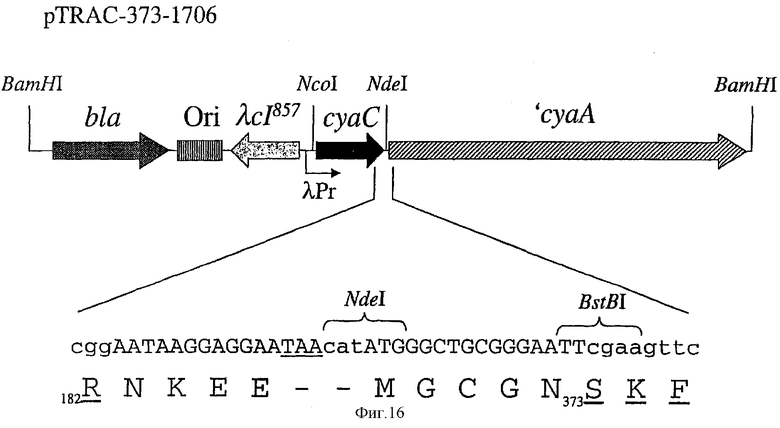
Изобретение касается применения аденилциклазного токсина бактерий рода Bordetella в производстве белковых векторов для нацеливания in vivo представляющей интерес молекулы конкретно на экспрессирующие CD11b клетки. Представляющая интерес молекула выбирается из группы, включающей пептиды, гликопептиды, липопептиды, полисахариды, олигосахариды, нуклеиновые кислоты, липиды и химикалии, обладает антигенными свойствами и нацеливается и транслоцируется в цитозоль экспрессирующих CD11b клеток. Изобретение касается также применения иммуногенной композиции на основе аденилциклазы бактерий рода Bordetella в качестве вакцины и для получения иммунотерапевтической композиции. Описан белковый вектор, содержащий аденилциклазу бактерий рода Bordetella для нацеливания представляющей интерес молекулы на экспрессирующие CD11b клетки, в частности непосредственно в цитозоль указанных клеток. Изобретение обеспечивает средства, которые могут конкретно нацеливать in vivo молекулы на определенные популяции рАРС для обеспечения возможности стимуляции иммунной системы. 7 н. и 49 з.п. ф-лы, 60 ил., 1 табл.
| WO 9321324 А, 28.10.1993 | |||
| LADANT D | |||
| et al., Bordetella pertussis adenylate cyclase: a toxin with multiple talents, Trends in Microbiology, 7, no | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ очистки белкового токсина бактерий ВоRDетеLLа реRтUSSIS | 1987 |
|
SU1600633A3 |
Авторы
Даты
2007-12-10—Публикация
2001-09-14—Подача