Применение материалов, обладающих ионной проводимостью, в области электрохимии, как, например, топливные элементы, диализный мешок, электролизеры и электрохимические методы разделения, ограничено из-за их гидролитических и термоокислительных областей устойчивости, которые часто находятся в области ниже 100°С. Однако в ряде применений, как, например, в случае топливных элементов, предпочтительно достигать более высоких рабочих температур (ок. 100-200°С). С одной стороны, требуется пониженное охлаждение топливного элемента, с другой стороны, при повышенных температурах повышается электрическая мощность ячейки как следствие ускоренных электродных реакций и уменьшенного отравления электродов (например, посредством CO из реформера).
Повышенные температуры, в особенности в среде, содержащей влагу и кислород, требуют химически, термически, термоокислительно и гидролитически стойких материалов.
В настоящее время, например, в области технологии топливных элементов, в основном используют перфторированные сульфированные полимеры (например, Nafion®), которые в целом обладают высокой химической, термической и термоокислительной устойчивостью, однако их дорого и затратно получать и утилизировать. Не требующей больших затрат альтернативой перфторированным полимерам являются мембранные материалы на основе сульфированных поли(ариленов), как, например, поли(ариленэфиркетоны), поли(ариленэфирсульфоны) и поли(арилентиоэфирсульфоны), которые в настоящее время испытывают для топливных элементов. (Общие сведения из уровня техники топливных элементов и мембранных материалов для них, а также для синтеза вышеназванных и других поли(ариленов) приведены в обзоре литературы.
Общим в структуре поли(ариленэфиркетонов), поли(ариленэфирсульфонов) и поли(арилентиоэфирсульфонов) является то, что к сульфированным ароматическим кольцам присоединена по меньшей мере одна электронодонорная мостичная группа (например, простая эфирная группа -O- или тиогруппа -S-). Так как гидролитическая устойчивость сульфокислотных групп в ароматическом кольце из-за электронодонорных заместителей (например, простой эфирной группы -O- или тиогруппы -S-) ухудшается, эти полимеры склонны к реакциям деструкции сульфокислотных групп при повышенных температурах. Кроме этого, в особенности эфирные мостики не достаточно устойчивы по отношению к кислородной атаке (например, пероксидные радикалы, тест Фентона (Fentons-Test)).
Поэтому задачей данного изобретения является создание новых гидролитически и термоокислительно устойчивых полимеров, которые в особенности предпочтительно могут использоваться в области технологий мембранных и топливных элементов и могут быть получены без особых затрат. Связанной с этим задачей является разработка нового способа получения таких полимеров.
Эти задачи согласно изобретению решаются путем получения сульфированных поли(ариленов) по пункту 1 формулы изобретения и способа получения этих поли(ариленов) по пунктам 22 и 24 формулы изобретения. Специальные и предпочтительные формы выполнения изобретения являются объектами зависимых пунктов.
Описание изобретения
Данное изобретение касается новых сульфированных поли(ариленов), характеризующихся структурным звеном -X-Ar(SO3M)n-Y-, где ароматическое кольцо, с которым связана сульфокислотная группа, замещено исключительно электроноакцепторными мостичными группами (сильно деактивирующими группами, например, сульфонной группой -SO2- или кетонной группой -CO-) X и Y, а также, в случае необходимости, другими не электронодонорными заместителями, а также их синтеза и применения.
По сравнению с ароматическими соединениями, замещенными электронодонорными группами (активирующими группами, например, сульфидной группой -S- или простой эфирной группой -O-) или электронодонорными и электроноакцепторными группами, гидролитическая устойчивость сульфокислоты в ароматическом соединении, замещенном электроноакцепторными группами, которое не имеет электронодонорных заместителей, должна быть значительно выше. Это следует из теоретических соображений о механизме гидролиза сульфированных ароматических соединений, или обратных реакций, электрофильного ароматического сульфирования. Эти реакции в общем обратимы, причем стадией, определяющей скорость, является образование σ-комплекса как промежуточной стадии электрофильного ароматического замещения. При повышенной температуре и высокой активности воды сульфокислотные группы относительно легко вновь отщепляются от ароматического соединения (инверсия сульфирования), что ограничивает пригодность сульфированных поли(ариленов) низкими температурами. Все заместители, которые дестабилизируют промежуточную стадию электрофильного ароматического замещения (σ-комплекс) как, например, деактивирующие электроноакцепторные заместители в орто- или параположении к сульфокислоте, затрудняют обратную реакцию (гидролиз) и тем самым стабилизируют сульфокислотную группу в ароматическом соединении. Однако, таким образом электрофильное сульфирование ароматических соединений, замещенных электроноакцепторами без дополнительных электронодонорных заместителей, также чрезвычайно затруднено или практически невозможно.
Решение этой проблемы достигается согласно изобретению с помощью способа, причем сначала получают сульфированный полимер, у которого ароматическое кольцо, замещенное одной сульфокислотной группой, имеет еще, по меньшей мере, один электронодонорный заместитель. Сначала присоединением химически превращают электронодонорный заместитель в электроноакцепторный заместитель. Это превращение может происходить, например, посредством окисления сульфидной группы -S- (электронодонор) до сульфоновой группы -SO2- (электроноакцептор).
Электроноакцепторными группами, которые здесь используют, являются оттягивающие электроны группы, которые как заместители понижают электронную плотность на ароматическом кольце (обозначаются также как деактивирующие группы). Оттягивающие электроны группы обладают -M и/или -I-эффектом.
Резонансный эффект (M-эффект, мезомерный эффект) в общем действует только когда группа связана непосредственно с ненасыщенной (например, ароматической) системой. Он действует через п-электроны, в противоположность эффекту поля (I-эффект, индуктивный эффект), который действует на систему через пространство, через молекулы растворителя или предпочтительно через σ-связи системы.
-M-эффект (отрицательный резонансный эффект): группа обладает -M-эффектом, если электронная плотность у этой группы больше, чем ожидаемая, и электронная плотность у ненасыщенной системы меньше, чем ожидаемая. Некоторыми, не ограничивающими примерами для мостичных групп с -M-эффектом являются -SO2-, -SO2O-, -CO-, -COO-, -CONH-, -CONR- и -POR-. Такие группы являются предпочтительными согласно изобретению.
Электронодонорными группами, которые здесь используют, соответственно являются группы, которые как заместители повышают электронную плотность на ароматическом кольце (обозначаются также как активирующие группы). Электронодонорные группы обладают +M и/или +I-эффектом. Примерами для таких мостичных групп являются простая эфирная группа -O- и сульфидная группа (тиоэфир) -S-.
Сульфированные поли(арилены) согласно изобретению содержат один или несколько структурных звеньев формулы -[X-Ar(SO3M)n-Y-]-, причем X и Y, одинаковые или отличающиеся друг от друга, соответственно обозначают электроноакцепторную группу, Ar представляет собой ароматическую или гетероароматическую циклическую систему предпочтительно с 5-18 атомами в кольце, M обозначает одновалентный катион, и n обозначает целое число от 1 до 4, и причем X, Y, Ar, M и n, независимо друг от друга, в различных структурных звеньях могут быть одинаковыми или разными.
Мостичные группы X и Y могут находиться в ароматическом кольце в пара-, мета- и ортоположении, причем параположение как правило предпочтительно. Пригодными, не ограничивающими примерами для электроноакцепторных мостичных групп X и Y являются -SO2-, -SO-, -SO2O-, -CO-, -COO-, -CONH-, -CONR- и -POR-, причем -SO2- и -CO- являются предпочтительными, и -SO2- является наиболее предпочтительной.
Специальными, не ограничивающими примерами для пригодных ароматических или гетероароматических циклических систем являются фенилен, нафтилен, антрацен, фенантрен, бифенилен, фуран, тиофен, пиррол, тиазол, триазол, пиридин, имидазол и бензимидазол.
Ароматические или гетероароматические кольца могут быть замещены одной - четырьмя сульфокислотными группировками -SO3M, т.е. в вышеприведенной формуле n=1-4, причем для Ar=фенилен n предпочтительно равно 1 или 2. Противоион M сульфонатной группы является или протоном, т.е. имеет место сульфокислота, или обычным одновалентным катионом. Типичными примерами таких катионов являются ионы металлов как Li+, Na+, K+, а также NR4 +, PR4 +, причем R обозначает органический остаток, предпочтительно алкил.
Ароматические или гетероароматические кольца кроме сульфокислотных групп и мостичных заместителей X и Y могут содержать еще другие не электронодонорные заместители. Некоторыми специальными, не ограничивающими примерами таких заместителей являются галогены, например, F, Cl, Br, или незамещенные или замещенные алкильные группы, например, -CH3 или -CF3.
В одной предпочтительной форме выполнения Ar обозначает фенилен, и сульфированный поли(арилен) содержит один или несколько следующих структурных звеньев I, II или III
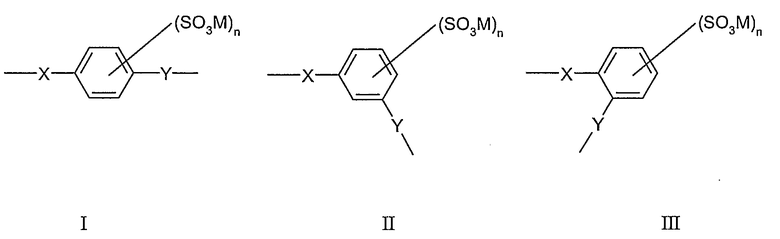
где X и Y определены, как указано выше, являются одинаковыми или разными.
В типичной форме выполнения структурное звено или звенья общей формулы -X-Ar(SO3M)n-Y- образован(ы) повторяющимися звеньями формул -[-Ar1(SO3M)n-X-]- или -[-Ar2(SO3M)n-Y-]-, причем X и Y, одинаковые или отличающиеся друг от друга, соответственно обозначают электроноакцепторные группы, Ar1 и Ar2, одинаковые или отличающиеся друг от друга, представляют собой выше определенную ароматическую или гетероароматическую циклическую систему Ar предпочтительно с 5-18 атомами в кольце, M обозначает одновалентный катион, как определено выше, и n обозначает целое число от 1 до 4, и причем X, Y, Ar1, Ar2, M и n, независимо друг от друга, в различных структурных звеньях могут быть одинаковыми или разными, и причем сульфированные ароматические или гетероароматические циклические системы Ar1(SO3M)n или Ar2(SO3M)n не замещены электронодонорными группами. Звенья -[-Ar1(SO3M)n-X-]- или -[-Ar2(SO3M)n-Y-]- могут быть одинаковыми или различаться типом ароматического кольца и/или степенью замещения и/или положениями заместителей.
В специальной форме выполнения данного изобретения сульфированный поли(арилен) содержит только повторяющиеся звенья формул -[-Ar1(SO3M)n-X-]- или -[-Ar2(SO3M)n-Y-]-. В особенном случае сульфированный поли(арилен) содержит только одно или несколько вышеуказанных структурных звеньев I, II или III.
Особенно предпочтительно сульфированные поли(арилены) обозначают сульфированные поли(ариленсульфоны), в особенности поли(сульфокислота-фениленсульфоны) и их сополимеры. Другими не ограничивающими примерами сульфированных поли(ариленов) согласно изобретению являются поли(сульфокислота-фениленэфиркетоны), поли(сульфокислота-фениленсульфонкетоны) и их сополимеры.
Однако данное изобретение включает также такие сополимерные поли(арилены), которые кроме звеньев, образующих структурное звено или звенья общей формулы -X-Ar(SO3M)n-Y-, содержат одно или несколько звеньев формулы -[Ar3-Z-]-, причем Z может быть электронодонорной или электроноакцепторной группой, или ни одной из них, Ar3 представляет собой ароматическую или гетероароматическую циклическую систему предпочтительно с 5-18 атомами в кольце без SO3M-заместителей, и группы Ar3 и Z в различных звеньях -[Ar3-Z-]- могут быть одинаковыми или разными, с оговоркой, что группа Z только тогда может быть связана с сульфированной ароматической или гетероароматической циклической системой формулы Ar(SO3M)n, если Z не является электронодонором.
Некоторыми пригодными, не ограничивающими примерами мостичных групп Z являются -SO2-, -SO-, -SO2O-, -CO-, -COO-, -CONH-, -CONR- и -POR-, -S-, -O- и алкилен. Другие пригодные группы для специалиста в области полимерной химии являются очевидными.
Специальными, не ограничивающими примерами для пригодных ароматических или гетероароматических циклических систем Ar3 являются фенилен, нафтилен, антрацен, фенантрен, бифенилен, фуран, тиофен, пиррол, тиазол, триазол, пиридин, имидазол, бензимидазол и т.д. Эти циклические системы помимо мостичных заместителей при желании могут содержать и другие заместители.
Также объектами данного изобретения являются сополимеры, которые кроме повторяющихся звеньев сульфированного поли(арилена), как описано выше, содержат еще (предпочтительно повторяющиеся) звенья, по меньшей мере, одного другого мономера или макромономера.
В качестве другого мономера или макромономера в принципе пригодно каждое соединение, которое способно сополимеризоваться с арильными мономерами, используемыми согласно изобретению. Обычно при этом речь идет о α,ω-дигидрокси-соединении или о α,ω-дигалогензамещенном соединении. Предпочтительно α,ω-дигидрокси-соединение характеризуется формулой HO-W-OH, и α,ω-дигалогензамещенное соединение - формулой Hal-W-Hal, причем W выбрано из группы, состоящей из -(CH2)n-, -(CF2)n-, -(CF2CH2)n-, -(CH2-CH2-O)n-CH2-CH2-, -(CH(CH)3-CH2-O)n-CH(CH3)-CH2-, -(CF2-CF2-O)n-CF2-CF2-, полиариленэфирсульфонов, полиариленэфиркетонов, полисилоксанов (например, -(SiR2-O)n-). Hal в дигалогензамещенном соединении обозначает галогенный остаток, например, F, Cl, Br и I.
Чистые сульфированные поли(арилены) согласно изобретению или сополимеры могут быть также смешаны с одним или несколькими обычными полимерами известным образом, чтобы получить полимерную смесь, которая соединяет в себе благоприятные свойства своих отдельных компонентов. Например, согласно изобретению могут быть смешаны полимеры на основе сульфированного поли(арилена) с «пластифицирующими компонентами», чтобы придать полученной в результате полимерной смеси большую гибкость и/или пластичность. Пригодные полимеры известны специалисту и могут быть, например, выбраны из группы: PBI (полибензимидазол), PTFE (политетрафторэтилен), PVDF (поливинилиденфторид), PSU (полисульфоны), PES (полиэфирсульфоны), PEK (полиэфиркетоны), PPO (полифениленоксиды), PPS (полифениленсульфиды), PA (полиимиды), PC (поликарбонаты), PMMA (полиметилметакрилаты), полифосфазены.
В специальной форме выполнения согласно изобретению чистые сульфированные поли(арилены) или сополимеры, или полимерные смеси могут быть заделаны в инертную пористую матрицу, например, органическую (пористый PE (ПЭ), PP (ПП), PVDF (ПВДФ), PTFE (ПТФЭ) и др.) или неорганическую матрицу (пористый нитрид бора, диоксид кремния и др.).
В следующей форме выполнения согласно изобретению чистые сульфированные поли(арилены) или сополимеры, или полимерные смеси могут быть усилены волокнистыми материалами, например, стекловолокном, керамическими волокнами, текстильными волокнами, углеволокном, микропористым полипропиленом или политетрафторэтиленом и т.д.
Кроме этого согласно изобретению чистые сульфированные поли(арилены) или сополимеры, или вышеназванные полимерные смеси могут быть комбинированы с активными или неактивными наполнителями, включая, однако не ограничиваясь этим, частицы TiO2, ZrO2 или SiO2, фосфат и фосфонат циркония, вольфрамовую или молибденовую кислоту и т.д., чтобы образовать соответствующий композитный материал. Также возможна комбинация с другими традиционными добавками без другого.
Сульфированные поли(арилены) согласно изобретению имеют молекулярный вес в области от 2000 до 2000000, обычно в области от 2000 до 1000000, наиболее часто в области от 10000 до 1000000, предпочтительнее в области от 2000 до 200000, еще предпочтительнее в области от 10000 до 100000.
Синтез сульфированных поли(ариленов) согласно изобретению осуществляют путем многостадийной реакции, причем сначала получают сульфированный полимер, имеющий еще, по меньшей мере, один электронодонорный заместитель в сульфированном ароматическом кольце, который затем переводят в электроноакцепторный заместитель.
В специальной форме выполнения на первой стадии уже существующий, электронодонорно замещенный полиарилен, полученный традиционным способом или коммерчески доступный, сульфируют самим по себе известным способом, например, превращением с SO3 и/или H2SO4 (смотри пример 11).
Однако чаще получение сульфированного полимера включает поликонденсацию уже сульфированных мономеров. Таким образом состав и свойства получаемого в результате сульфированного полимера могут устанавливаться по желанию.
В целом такой способ получения включает стадии:
а) получение сульфированного арильного мономера F1-AS-F2, причем AS обозначает арильную систему из одного или нескольких ароматических колец, причем, по меньшей мере, одно ароматическое кольцо замещено сульфокислотной группой, и арильная система которого характеризуется функциональными группами F1 и F2, которые могут быть одинаковыми или разными и могут вступать в реакцию конденсации, или несколько таких различных арильных мономеров;
b) поликонденсация сульфированного арильного мономера или сульфированных арильных мономеров из стадии a) с образованием сульфированного поли(арилена), который содержит, по меньшей мере, один электронодонорный заместитель в сульфированном ароматическом кольце;
с) перевод, по меньшей мере, одного электронодонорного заместителя в электроноакцепторный заместитель с образованием сульфированного поли(арилена), который характеризуется только электроноакцепторными заместителями в сульфированном ароматическом кольце.
При одном варианте этого способа в поликонденсации, кроме одного или нескольких сульфированных арильных мономеров F1-AS-F2, как определено выше, участвуют еще один или несколько арильных мономеров F1-ANS-F2, причем ANS обозначает арильную систему из одного или нескольких ароматических колец, которые не замещены сульфокислотной группой, и арильная система которого характеризуется функциональными группами F1 и F2, как определено выше, которые могут быть одинаковыми или разными. При этом образуется частично сульфированный поли(арилен), характеризующийся по меньшей мере одним электронодонорным заместителем в сульфированном ароматическом кольце, и у которого по меньшей мере один электронодонорный заместитель затем переводят в электроноакцепторный заместитель, причем образуется частично сульфированный поли(арилен), характеризующийся исключительно электроноакцепторными заместителями в сульфированном ароматическом кольце.
Специальная форма выполнения включает получение сульфированного поли(ариленсульфона) следующими стадиями:
a) получение сульфированного арильного мономера F1-AS-F2, характеризующегося функциональными группами F1 и F2, которые могут быть одинаковыми или разными и могут вступать в реакцию конденсации с сульфидными группировками, или нескольких таких различных арильных мономеров, как определено выше;
b) поликонденсация сульфированного арильного мономера или сульфированных арильных мономеров из стадии a) с арилдисульфидом или сульфидом щелочного металла с образованием сульфированного поли(ариленсульфидсульфона);
c) окисление сульфированного поли(ариленсульфидсульфона) со стадии b) до сульфированного поли(ариленсульфона).
Предпочтительно функциональные группы F1 и F2 арильного мономера, одинаковые или разные, опять выбраны из группы, включающей фтор, хлор, бром или иод.
В форме выполнения способа согласно изобретению сульфированные арильные мономеры характеризуются структурной формулой F1-Ar1-SO2-Ar2-F2, т.е. AS = Ar1-SO2-Ar2-, причем Ar1 и Ar2 могут быть одинаковыми или разными и соответственно представляют собой ароматичекую или гетероароматическую циклическую систему с 5-18 атомами в кольце, с оговоркой, что у, по меньшей мере, одного используемого арильного мономера Ar1 и/или Ar2 замещен (или замещены), по меньшей мере, одной группой SO3M, причем M определен, как описано выше.
На следующей схеме реакции I показаны принципиальные стадии способа согласно изобретению на конкретном, не ограничивающем примере получения гомополимера поли(сульфокислота-1,4-фениленсульфона) (детальное описание в примерах 1 и 2).
Схема реакции I
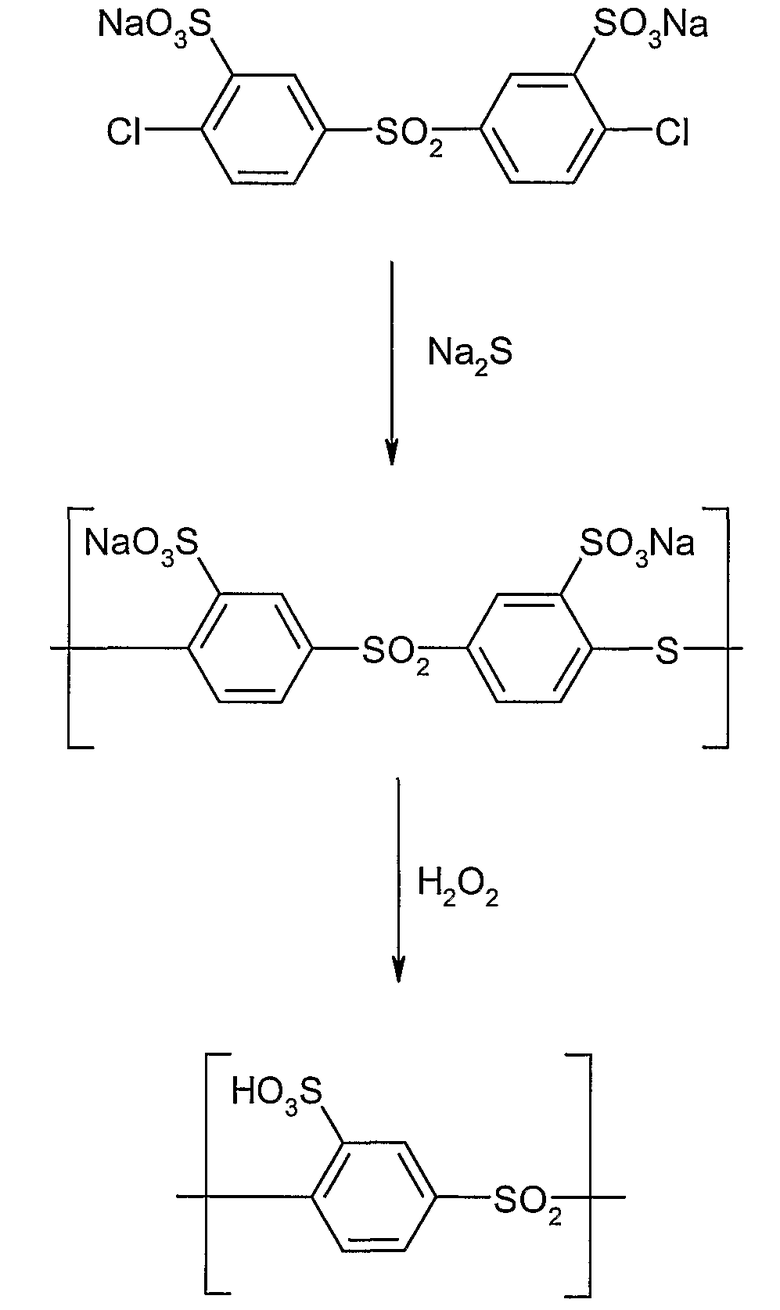
Как уже указывалось выше, в этом способе может быть использован только один арильный мономер, так что образуется гомополимер поли(ариленсульфон), или могут быть получены два или более различных арильных сомономера и подвергнуты сополиконденсации и последующему окислению. Вследствие этого специальная форма выполнения способа предполагает, что, по меньшей мере, у одного арильного сомономера остатки Ar1 и/или Ar2 замещены группой SO3M, причем M определен, как описано выше, и, по меньшей мере, у одного другого арильного мономера остатки Ar1 и/или Ar2 не замещены группой SO3M.
Предпочтительно функциональные группы F1 и F2 арильного мономера, одинаковые или разные, опять выбраны из группы, включающей фтор, хлор, бром или иод.
На следующей схеме реакции II показаны принципиальные стадии получения сополимера сульфированного поли(ариленсульфона) при использовании исходных мономеров: динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфона и 4,4'-дифтордифенилсульфона (пример 3). С помощью запланированного соотношения обоих исходных мономеров может регулироваться состав конечного полимера. В указанной схеме реакции II и в схемах примеров 3-10 продукт реакции поликонденсации для обзорности представлен в качестве блок-сополимера обоих различных исходных мономеров. Однако данное изобретение включает равным образом или даже предпочтительнее также соответствующие статистические сополимеры, которые могут быть получены способом, описанным в примере 3. Другие статистические или блок-сополимеры достаточно легко могут быть получены аналогичным образом (смотри примеры 4-10).
Предпочтительными растворителями для реакций полимеризации или сополимеризации являются апротонные, полярные, высококипящие растворители, как 1-метил-2-пирролидон (NMP) (НМП), диметилсульфоксид (DMSO)(ДМСО), диметилформамид (DMF) (ДМФ), диметилацетамид (DMAc) (ДМАц), сульфолан, дифенилсульфон, 1,3-диметил-2-имидазолидинон.
Типичным образом температура реакции составляет 100-250°С, предпочтительно 140-200°С.
Реакция с сульфидами щелочных металлов (например, сульфидом натрия), как правило, происходит в присутствии добавок карбоксилатов щелочных металлов (например, ацетата натрия, ацетата лития), карбонатов щелочных металлов (например, карбоната лития), сульфонатов щелочных металлов, бората лития, хлорида лития.
Сульфид щелочного металла (например, сульфид натрия) также может быть использован в качестве гидрата (например, Na2S·9H2O).
Схема реакции II
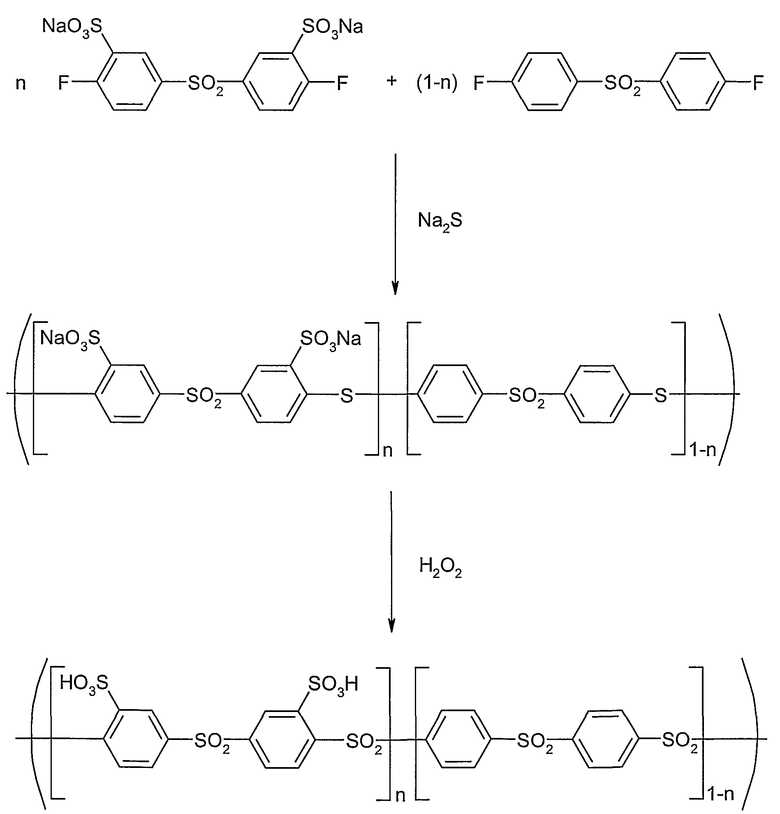
Такого рода сополимеры различного состава также характеризуются различной ионообменной емкостью. Вышеописанный способ дает возможность посредством пригодного проведения реакции при использовании определенных исходных мономеров и определенных соотношений мономеров целенаправленно получать сополимеры с регулируемой разнообразной ионообменной емкостью (ИОЕ) (IES = ion exchange capacity [мэкв/г], (ЕВ = эквивалентный вес; EW = equivalent weight [г/экв]).
Для образцов сополимеров, получаемых согласно или аналогично вышеуказанной схеме, в соответствующих примерах приведены расчетные формулы. Для других сополимеров согласно изобретению соответствующие формулы без труда могут быть определены эмпирически.
При использовании новых мембранных материалов в каждом случае можно ожидать значительно более высокой гидролитической, а также термоокислительной устойчивости.
Характеристика сульфированных поли(ариленсульфонов) согласно изобретению может осуществляться различными способами, например, посредством элементного анализа, ЯМР, растворимости, ГПХ, MALDI-TOF (хромато-масс-спектрометрия с лазерным детектором), ДСК, рентгена, ИОЕ с помощью титрования, плотности, ИК, набухания в воде и метаноле, водно-абсорбционной изотермии, исследований водной диффузии и электроосмоса, измерений проводимости в особенности при повышенных температурах при увлажнении, исследований водопоглощения и гидролитической устойчивости (ТГА при 1 атм водяного пара) и термоокислительной устойчивости (ТГА в атмосфере кислорода, например 80% N2 и 20% O2). Некоторые результаты последних исследований приведены на фиг. 1-4. Следующие результаты исследований, при которых подробно изучали свойства полимеров согласно изобретению и с которыми сравнивали известные из литературы сульфированные поли(ариленэфирсульфоны) и сульфированные поли(ариленсульфидсульфоны), приведены на фиг. 5-11.
Краткое описание фигур
Фиг.1 изображает протонную проводимость свыше 100°С поли(сульфокислота-1,4-фениленсульфон)а по сравнению с Nafion 117, измеренную в атмосфере водяного пара (p(H2O)=105 Па).
Фиг.2А изображает водопоглощение Nafion 117 в атмосфере водяного пара (p(H2O)=105 Па).
Фиг.2B изображает водопоглощение поли(сульфокислота-1,4-фениленсульфон)а в атмосфере водяного пара (p(H2O)=105 Па).
Фиг.3А изображает водопоглощение сульфированного поли(1,4-фениленсульфон-1,4-фениленсульфид-1,3-фениленсульфид)а в атмосфере водяного пара (p(H2O)=105 Па).
Фиг.3B изображает водопоглощение сульфированного поли(1,4-фениленсульфон-1,4-фениленсульфид)а в атмосфере водяного пара (p(H2O)=105 Па).
Фиг.4 показывает более высокую термоокислительную устойчивость сульфированного поли(ариленсульфона) (S-PS 220) в сравнении с соответствующим сульфированным поли(ариленсульфидсульфоном) посредством термогравиметрических измерений в кислородсодержащей атмосфере (20% O2 и 80% N2).
Фиг.5A показывает более высокую термоокислительную устойчивость сульфированного поли(ариленсульфона) (sPS-430, n=0,8, пример 4) в сравнении с сульфированным поли(ариленсульфидсульфоном) (sPSS-312, n=1,0, пример 4) посредством термогравиметрических измерений в кислородсодержащей атмосфере (20% O2 и 80% N2, скорость нагрева 2 К/мин). Также представлена чисто термическая устойчивость sPS-430 а атмосфере азота.
Фиг.5B показывает, что в кислородсодержащей атмосфере у сульфированного поли(ариленсульфидсульфона) спонтанное превращение (окисление) сульфидных групп -S- до сульфогрупп -SO2- при образовании сульфированного поли(ариленсульфона) не имеет места.
Фиг.6A показывает температурную зависимость водопоглощения и десорбции воды Nafion® 117 в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час).
Фиг.6B показывает температурную зависимость водопоглощения и десорбции воды сульфированного поли(ариленсульфона) (sPS-220, n=1,0, пример 2) в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час). Обратимое изменение веса вследствие десорбции воды и водопоглощения во время фаз нагревания и охлаждения доказывает высокую гидролитическую устойчивость сульфокислотных групп.
Фиг.6C показывает температурную зависимость водопоглощения и десорбции воды сульфированного поли(ариленсульфона) (sPS-360, n=1,0, пример 4) в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час). Обратимое изменение веса вследствие десорбции воды и водопоглощения во время фаз нагревания и охлаждения доказывает высокую гидролитическую устойчивость сульфокислотных групп.
Фиг.6D показывает температурную зависимость водопоглощения и десорбции воды сульфированного поли(ариленсульфона) (sPS-430, n=0,8, пример 4) в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час). Обратимое изменение веса вследствие десорбции воды и водопоглощения во время фаз нагревания и охлаждения доказывает высокую гидролитическую устойчивость сульфокислотных групп.
Фиг.6E показывает температурную зависимость водопоглощения и десорбции воды сульфированного поли(ариленсульфона) (sPS-336, n=1,0, пример 6) в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час). Обратимое изменение веса вследствие десорбции воды и водопоглощения во время фаз нагревания и охлаждения доказывает высокую гидролитическую устойчивость сульфокислотных групп.
Фиг.6F показывает температурную зависимость водопоглощения и десорбции воды сульфированного поли(ариленэфир-эфир-кетона) (sPEEK-500, ИОЕ (IEC)=2,0 ммоль/г) в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час). Необратимое изменение веса доказывает гидролитическое разложение сульфокислоты в ароматическом соединении.
Фиг.6G показывает температурную зависимость водопоглощения и десорбции воды сульфированного поли(ариленсульфидсульфона) (sPSS-204, n=1,0, пример 2) в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час). Необратимое изменение веса доказывает гидролитическое разложение сульфокислоты в ароматическом соединении.
Фиг.6H показывает температурную зависимость водопоглощения и десорбции воды сульфированного поли(ариленсульфидсульфона) (sPSS-312, n=1,0, пример 4) в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час). Необратимое изменение веса доказывает гидролитическое разложение сульфокислоты в ароматическом соединении.
Фиг.6I показывает температурную зависимость водопоглощения и десорбции воды сульфированного поли(ариленсульфидсульфона) (sPSS-258, n=1,0, пример 5) в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час). Необратимое изменение веса доказывает гидролитическое разложение сульфокислоты в ароматическом соединении.
Фиг.6J показывает температурную зависимость водопоглощения и десорбции воды сульфированного поли(ариленсульфидсульфона) (sPSS-304, n=1,0, пример 6) в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час). Необратимое изменение веса доказывает гидролитическое разложение сульфокислоты в ароматическом соединении.
Фиг.7 показывает 13С-ЯМР-спектр образца сульфированного поли(ариленсульфидсульфона) (sPSS-304, n=1,0, пример 6) перед и после ТГА в атмосфере водяного пара (p(H2O)=105 Па). Спектры доказывают количественное отщепление сульфокислотных групп от ароматического соединения.
Фиг.8 показывает температурную зависимость водопоглощения в жидкой воде сульфированного поли(ариленсульфона) (sPS-430, n=0,8, пример 4) по сравнению с Nafion® 117, сульфированного поли(ариленэфир-эфир-кетона) (sPEEK, ИОЕ=1,35 ммоль/г) и известного из литературы сульфированного поли(ариленсульфидсульфона) (sPSS-661, n=0,4, ИОЕ=1,51 ммоль/г).
Фиг.9 показывает зависимость от температуры и набухания протонной проводимости сульфированного поли(ариленсульфона) (sPS-430, n=0,8, пример 4), измеренную с помощью импеданс-спектроскопии.
Фиг.10 показывает температурную зависимость протонной проводимости двух сульфированных поли(ариленсульфонов) (sPS-220, n=1,0, пример 2 и sPS-430, n=0,8, пример 4) по сравнению с Nafion® 117 и сульфированным поли(ариленэфир-эфир-кетоном) sPEEK, измеренную в атмосфере водяного пара (p(H2O)=105 Па) с помощью импеданс-спектроскопии.
Фиг.11 показывает зависимость от температуры и мольной доли набухания сульфированного поли(ариленсульфона) (sPS-430, n=0,8, пример 4) в смеси вода/метанол по сравнению с Nafion® 117.
В исследованиях характеристик, результаты которых представлены на фиг. 1-4, определяли проводимость в атмосфере водяного пара (p(H2O)=105 Па) с помощью импеданс-спектроскопии, водопоглощение полимеров в атмосфере водяного пара (p(H2O)=105 Па) посредством ТГА (термогравиметрического анализа) и термоокислительную устойчивость посредством ТГА в кислородсодержащей атмосфере.
Путем циклических измерений между Т=105 и 180°С в атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час) можно оценить гидролитическую устойчивость сульфокислотных групп в ароматическом соединении. Обратимое изменение веса вследствие десорбции и поглощения воды во время фаз нагревания и охлаждения указывает на высокую устойчивость сульфокислотных групп в исследованной области температур, в то время как необратимое изменение веса указывает на гидролитическое разложение ароматической сульфокислоты. Так как при гидролизе в качестве продукта реакции образуется серная кислота, и она является более гигроскопичной, чем соответствующая сульфокислота, во время разложения наблюдают возрастание водопоглощения. Сульфированные поли(ариленсульфоны) (фиг.2А) и Nafion (фиг.2B) в этих условиях являются стабильными, в то время как соответствующие сульфированные поли(ариленсульфидсульфоны) характеризуются реакциями разложения (фиг. 3А и 3B).
Чтобы показать отчетливое различие между сульфированными поли(ариленсульфонами) sPS, описанными в этом изобретении, от известных из литературы сульфированных поли(ариленэфирсульфонов) и сульфированных поли(ариленсульфидсульфонов) sPSS [реф.: 1-6], получали несколько этих указанных полимеров, подробно исследовали их свойства и сравнивали со свойствами полимеров согласно изобретению.
Структурное звено сульфированного поли(ариленсульфона) sPS согласно изобретению:
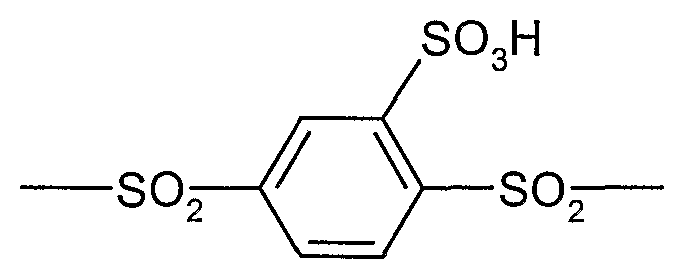
Структурное звено сульфированного поли(ариленэфирсульфона) или поли(ариленсульфидсульфона) sPSS:

Другим общеупотребительным обозначением для поли(ариленсульфидсульфона) является поли(арилентиоэфирсульфон).
Кроме различного молекулярного строения между сульфированными поли(ариленэфирсульфонами) или сульфированными поли(ариленсульфидсульфонами) и чистыми сульфированными поли(ариленсульфонами) наблюдают отчетливые различия в термической, термоокислительной и гидролитической устойчивости, а также в растворимости, набухаемости и проводимости этих полимеров, причем возможно явное разграничение.
Для термического или термоокислительного сравнения устойчивости сульфированных поли(ариленсульфонов) и сравнительных полимеров был проведен термогравиметрический анализ (ТГА при 2 К/мин) в атмосфере азота или кислородсодержащей атмосфере (20% O2 и 80% N2 или чистая атмосфера O2). Эти измерения показали отчетливо более высокую область стабильности для сульфированных поли(ариленсульфонов) sPS по сравнению с сульфированными поли(ариленсульфидсульфонами) sPSS. Как представлено на изображении фиг.5А, реакция разложения (вероятно, отщепление сульфокислотной группы от ароматического кольца) у сульфированных поли(ариленсульфидсульфонов) sPSS начинается уже ниже 250°С, в то время как эта реакция у сульфированных поли(ариленсульфонов) sPS со сравнимой обменной емкостью начинается только выше 300°С. На фиг.5А приведены примеры ТГА сульфированного поли(ариленсульфона) sPS-430 (пример 4, n=0,8) и сульфированного поли(ариленсульфидсульфона) sPSS-312, (пример 4, n=0,8) в кислородсодержащей атмосфере. Чисто термическая устойчивость sPS-430 (пример 4, n=0,8) в атмосфере азота сравнима с термоокислительной устойчивостью или незначительно выше, как и представлено на фиг.5А.
В особенности сравнение измерений в инертной атмосфере (азот) и в кислородсодержащей атмосфере сульфированного поли(ариленсульфидсульфона) sPSS (смотри фиг.5B) показывает, что превращение (окисление) сульфидной группы до сульфоновой группы -SO2- с образованием чисто сульфированного поли(ариленсульфона) в кислородсодержащей атмосфере не имеет места. Как в инертной атмосфере, так и в кислородсодержащей атмосфере наблюдается разложение сульфированного поли(ариленсульфидсульфона) при равной температуре, т.е. не наблюдается стабилизирующего эффекта в кислородсодержащей атмосфере по сравнению с инертной атмосферой. Таким образом, этого также не следует ожидать в топливных элементах.
Еще более очевидно проявляется различие между сульфированными поли(ариленсульфонами) и известными из литературы сульфированными поли(ариленсульфидсульфонами) [1-6] в отношении гидролитической устойчивости сульфокислотных групп у ароматического соединения. Путем цикличных измерений в интервале температур между Т=110°С и 180°С в полной атмосфере водяного пара (p(H2O)=105 Па, скорость нагрева и охлаждения 12°С/час) смогли доказать гидролитическую устойчивость сульфокислотных групп у ароматического соединения. Обратимые изменения веса вследствие десорбции воды и абсорбции во время фаз нагрева и охлаждения доказывают высокую гидролитическую устойчивость сульфокислотных групп в исследованной области температур, в то время как необратимое изменение веса указывает на гидролитическое разложение ароматической сульфокислоты. Так как при гидролизе в качестве продукта реакции образуется серная кислота, и она является более гигроскопичной, чем соответствующая сульфокислота в ароматическом соединении, во время разложения сначала частично наблюдают возрастание водопоглощения, затем при дальнейшем разложении это может привести к снижению веса. Только PFSA-полимеры как Nafion® 117 (фиг.6А) и сульфированные поли(ариленсульфоны) sPS (фиг. 6B, 6C, 6D, 6E) стабильны в этих условиях, тогда как соответствующие известные из литературы сульфированные поли(ариленэфир-эфир-кетоны) sPEEK (фиг.6F) и сульфированные поли(ариленсульфидсульфоны sPSS (фиг. 6G, 6H, 6I, 6J) [1-6] отчетливо характеризуются реакциями разложения. С помощью исследований 13С-ЯМР-спектров даже смогли показать, что имеет место количественное отщепление сульфокислотных групп сульфированного поли(ариленсульфидсульфона) при этих условиях реакции (смотри фиг.7).
Следующее существенное отличие наблюдается в растворимости в воде сульфированных полимеров. Обычно имеется прямая связь между растворимостью в воде или набухаемостью (=водопоглощение) и обменной емкостью сульфированного полимера. В целом растворимость в воде или набухание сульфированного полимера возрастает с увеличивающейся обменной емкостью (=ионообменной емкостью, ИОЕ (IES)). Однако высокая обменная емкость в общем приводит также к высокой ионной проводимости. Поэтому цель состоит в том, чтобы получить полимер с возможно более высокой обменной емкостью, но одновременно нерастворимый в воде или не сильно набухаемый полимер. Сравнение сульфированных поли(ариленов) показало, что растворимость в воде сульфированного поли(ариленсульфона) по сравнению с сульфированным поли(ариленсульфидсульфоном), сульфированным поли(ариленэфирсульфоном), сульфированным поли(ариленэфиркетоном) и сульфированным поли(ариленсульфидом) при сопоставимой обменной емкости отчетливо снижена. Так, сульфированные поли(ариленэфиркетоны) или поли(ариленсульфидсульфоны) при ИОЕ более 1,8-2,0 ммоль/г почти полностью растворимы в воде (смотри полимеры sPSS-312 (n=1,0) sPSS-370 (n=0,8) в примере 4), или также при более низкой ИОЕ в области 1,3-1,7 ммоль/г очень сильно набухают при температуре около 50-70°С (смотри фиг.8). Таким образом, эти полимеры с высокой ИОЕ или при высокой температуре не пригодны для использования в топливных элементах или для других подобных применений. Напротив, аналогичные полисульфоны даже с ИОЕ 2,5 ммоль/г и выше являются нерастворимыми в воде. Кроме того, даже при температуре выше 120°С при средней ионообменной емкости (<2,5 ммоль/г ) и высоком молекулярном весе они показывают почти постоянную набухаемость в воде (смотри фиг.8), приблизительно сравнимую с Nafion® 117, что делает их интересными для использования в широкой температурной области, вплоть до температур выше 100°С. Важное преимущество сульфированного поли(ариленсульфона) состоит, таким образом, в его потенциально высокой ионообменной емкости и взаимосвязанной с этим высокой протонной проводимости при одновременной нерастворимости в воде и малом набухании в воде. Высокую протонную проводимость в жидкой воде (σ=130 мС/см при 25°С) смогли измерить у полимера sPS-430 (пример 4, n=0,8) посредством импеданс-спектроскопии, на фиг.9 также показана зависимость от температуры и набухания протонной проводимости sPS-430 (пример 4, n=0,8). Проводимость при Т>100°С в атмосфере водяного пара также характеризуется сопоставимыми, вплоть до лучших, результатами по сравнению с Nafion® 117 в качестве сравнительного полимера (смотри фиг.10), а также является отчетливо лучшей проводимостью, чем у соответствующего сульфированного поли(ариленэфир-эфир-кетона) sPEEK.
Следующее отличие наблюдается в набухании и растворимости сульфированных поли(ариленсульфонов) в водно-метанольных смесях. Мембраны из PFSA (=perfluoro sulfonic acid; перфторсульфокислота), как, например, Nafion®, или сульфированный поли(ариленсульфидсульфон) в растворе метанола набухают очень сильно, причем сульфированные поли(ариленсульфидсульфоны) при повышенной обменной емкости даже растворяются в метаноле (смотри sPSS-312 (n=1,0) и sPSS-370 (n=0,8) в примере 4). Напротив, сульфированные поли(ариленсульфоны) в смесях метанол/вода даже при высокой концентрации метанола, а также высокой температуре характеризуются значительно меньшим набуханием (показано на sPS-430, пример 4, n=0,8, смотри фиг.11), что также делает эти полимеры очень интересными для непосредственно метанольных топливных элементов (DMFC). Также протекание метанола через мембрану по отношению к мембране из Nafion® 117 снижено примерно на половину (при равной толщине), измерено посредством диффузионной камеры при 60°С (полуячейка: 1М раствор метанола - вода).
Помимо этого можно ожидать еще другие интересные свойства, например, такие как высокая избирательная проницаемость ионов, что открывает использование этих полимеров в различных электромембранных процессах. Так, сульфированные поли(ариленсульфоны) могут быть использованы в электродиализе, диализе Доннана и в электролизе. Далее, высокая химическая и гидролитическая устойчивость позволяют использование в электролизе в воде. Благодаря возможности изготавливать мембраны с очень высокой обменной емкостью и, вследствие этого, плотностью заряда, можно ожидать еще другие интересные области применения. Так, мембраны из гидролитически стабильных поли(ариленсульфонов) пригодны для увлажнения и осушки газов. Это свойство точно так же важно для смачивания анодных и катодных газов, как и для простых применений, как для кондиционирования воздуха в помещениях, особенно в низкоэнергетических домах. Далее, катионобменные мембраны еще пригодны для электромагнитной защиты, в особенности в области ГГц (GHz) специально для WLAN-применений (в широкополостных локальных компьютерных сетях). Кроме этого, возможность использования находят прозрачные пленки из высокозарядных сульфированных поли(ариленсульфонов) в электростатических покрытиях экранов, особенно LCD (жидкокристаллических)-дисплеев, например, в портативных компьютерах.
Также оказалось, что синтез сульфированных поли(ариленсульфонов) через уже сульфированные мономеры с последующим окислением предпочтительнее также описанного в этом изобретении окисления уже сульфированных поли(ариленсульфидов). Последний метод приводит к материалам, которые характеризуются значительно худшими пленкообразующими свойствами (смотри пример 11).
Подобные результаты наблюдают при окислении поли(п-фениленсульфидов) H2O2 в концентрированной серной кислоте, как описано в патенте J. Studinka, R. Gabler, Polyarylene sulphonates from sulphonated polyarylene sulphide by two-stage oxidation in acid medium DE 1938806A1 (1970) [7], причем образуется материал, который нерастворим во всех известных растворителях, а также является неплавким и поэтому также не может перерабатываться термически. Также если предполагают сульфирование ароматического соединения путем использования концентрированной серной кислоты при окислении, теряются всякие пленкообразующие свойства. Кроме того, достижение повышенной обменной емкости (>0,1 ммоль/г) посредством этого метода исключено. Поэтому получение сульфированных поли(ариленсульфонов) путем полимеризации уже сульфированных мономеров с последующим окислением более предпочтительно по сравнению с сульфированием уже образованного поли(ариленсульфида) с последующим или одновременным окислением.
Следующие примеры позволяют более подробно объяснить изобретение, не ограничивая его при этом.
ПРИМЕР 1
Получение бифункционального сульфированного арильного мономера
а) Динатрий-3,3'-дисульфонат-4,4'-дихлордифенилсульфон (DSDCS)
В колбе, снабженной холодильником, нагревали 4,4'-дихлордифенилсульфон (30 г, 0,104 моль, Aldrich) и олеум (60 мл, 60% SO3 в H2SO4, Aldrich) до 110°С и перемешивали 12 час. После охлаждения до комнатной температуры выливали реакционную смесь в 1000 мл ледяной воды. Затем добавляли хлорид натрия (350 г), чтобы осадить продукт. Белый осадок получали путем фильтрования и вновь растворяли в 800 мл воды. После нейтрализации раствора NaOH продукт снова высаживали хлоридом натрия (200 г), отфильтровывали и очищали посредством перекристаллизации из смеси вода/изопропанол (2:8). В заключение белый продукт при 50°С в течение 24 часов сушили в вакууме (2·10-3 мбар). Выход составил 30,5 г (59%) динатрий-3,3'-дисульфонат-4,4'-дихлордифенилсульфонмоногидрата. Содержание воды зависело от условий сушки и было определено посредством 1H-ЯМР и элементного анализа.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,24 (д, 2H, CH, J=2,4 Гц), 7,77 (дд, 2H, CH, J=2,4, 8,3 Гц), 7,58 (д, 2H, CH, J=8,3 Гц), 3,24 (с, 2H, H2O),
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 141,6 (с), 138,3 (с), 138,0 (с), 133,5 (с), 131,6 (с), 128,3 (с).
b) Динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфон (DSDFS)
Это соединение было получено аналогично динатрий-3,3'-дисульфонат-4,4'-дихлордифенилсульфону (DSDCS) в виде моногидрата до тригидрата (в зависимости от условий сушки).
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,06 (дд, 2H, CH, JHH=2,5 Гц, JHF=6,4 Гц), 7,87 (ддд, 2H, CH, JHH=2,6, 8,7 Гц, JEF=4,3 Гц), 7,32 (дд, 2H, CH, JHH=8,8 Гц, JHF=9,2 Гц), 3,23 (c, 2H, H2O);
13C ЯМР (75,5 MГц, ДМСО-d6): δ = 162,1 (д, JCF=259,2 Гц), 137,4 (д, JCF=18,9 Гц), 136,7 (д, JCF=2,0 Гц), 131,5 (д, JCF=10,0 Гц), 128,9 (д, JCF=4,6 Гц), 119,0 (д, JCF=24,6 Гц).
Вместо натриевой соли сульфированного мономера получали также соответствующую калиевую соль и использовали для полимеризации.
ПРИМЕР 2
Получение поли(сульфокислота-1,4-фениленсульфона)
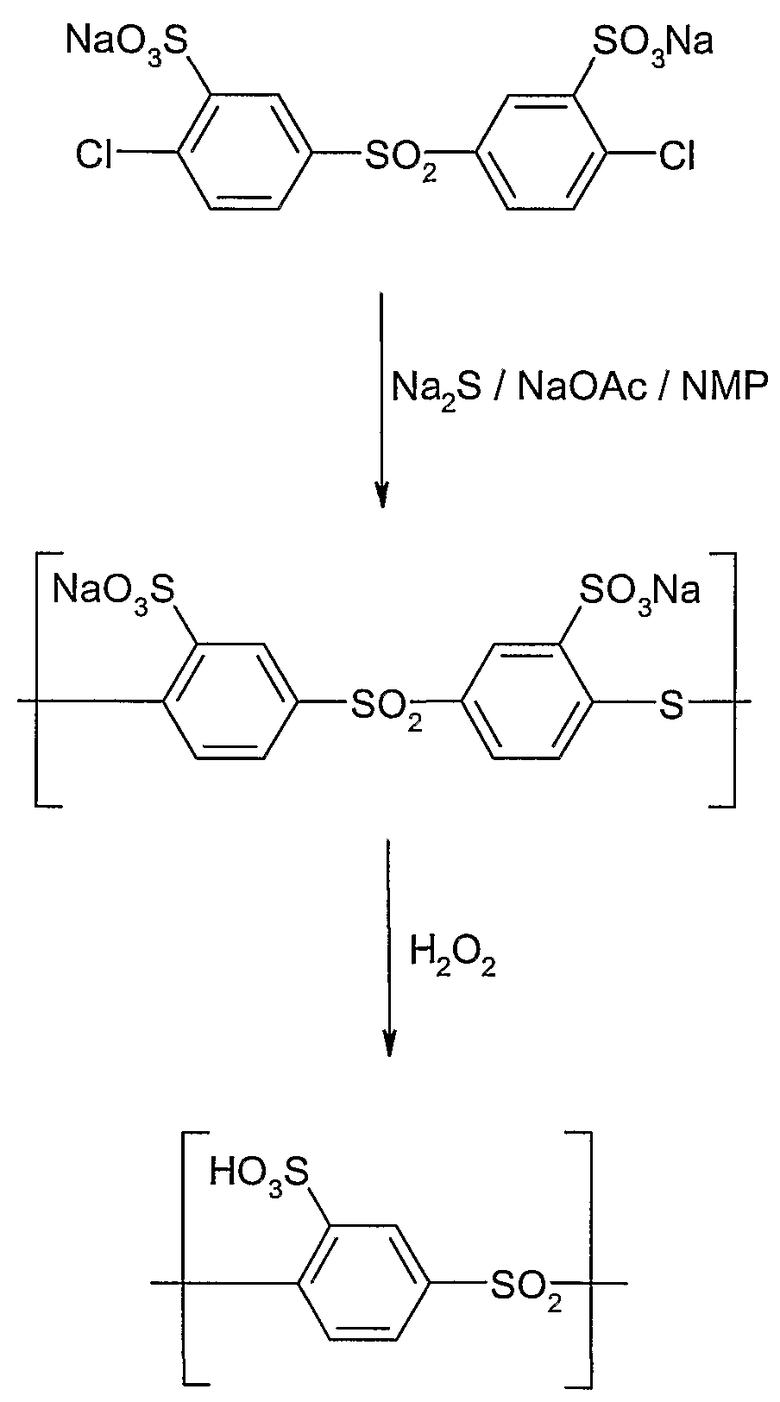
I. Полимеризация
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфид):
Полимеризацию проводили в нагреваемой и заполненной аргоном круглодонной колбе объемом 100 мл, которая была оборудована вводом для аргона, магнитной мешалкой и ловушкой Дина-Старка (Dean-Stark-Falle), снабженной охладителем. В колбу добавляли 3,8591 г (7,578 ммоль) динатрий-3,3'-дисульфонат-4,4'-дихлордифенилсульфонмоногидрата (М=509,25 г/моль), 0,5914 г (7,578 ммоль) сульфида натрия (Na2S) и 0,6216 г (7,578 ммоль) сухого ацетата натрия. Эту смесь сушили в течение 2 час при 100°С в вакууме (2·10-3 мбар). Затем добавляли в атмосфере аргона 20 мл сухого 1-метил-2-пирролидона (NMP) и 35 мл сухого толуола, и реакционную смесь нагревали в масляной бане 4 часа до 145°С, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 18 час при 190°С. После охлаждения до комнатной температуры суспензию черного цвета медленно прикапывали в изопропанол (800 мл), чтобы осадить полимер. Серый осадок отфильтровывали и промывали изопропанолом. Затем продукт вновь растворяли в 50 мл воды (раствор черного цвета), опять высаживали в изопропанол (800 мл), отфильтровывали и промывали изопропанолом, и сушили в вакууме (2·10-3 мбар). Для отделения всех побочных продуктов полимер очищали с помощью 24-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после отделения растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили темно-коричневое твердое вещество (4,346 г, М=452,39 г/моль Na+-форма=9,62 ммоль, М=596,51 г/моль Na+-форма и 4H2O/SO3H=7,286 ммоль, М=408,43 H+-формы). Часть натриевой соли (ок. 0,2 г) подвергали превращению посредством ионообменника (Dowex® Marathon® C) в H+-форму.
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте;
нерастворим в метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне, этилацетате, трифторуксусной кислоте.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,20 (д, 2H, CH, JНН=1,7 Гц), 7,70 (дд, 2H, CH, JНН=1,9, 8,0 Гц), 7,18 (д, 2H, CH, JНН=8,3 Гц), 3,24 (c, 20H, H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 148,6 (с), 141,6 (с), 139,0 (с), 135,0 (с), 129,1 (с), 127,1 (с).
Молекулярный вес: Mn=1672, Mw=2767, D=1,6551 (приставка 41, ГПХ)
Mn=46832, Mw=81145, D=1,7327 (приставка 19, ГПХ)
II. Окисление:
Сульфированный поли(1,4-фениленсульфон): 4,34 г (9,62 ммоль) поли(натрийсульфонатфенилен-тио-сульфона) растворяли в 50 мл концентрированной серной кислоты с образованием темно-коричневого раствора. Медленно добавляли пероксид водорода (4,5 мл 36% H2O2 в воде, ок. 45 ммоль H2O2). Затем реакционную смесь 2 дня перемешивали при комнатной температуре. После разбавления смеси 200 мл воды отделяли серную кислоту посредством диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 3000). Воду удаляли посредством ротационного испарителя, и продукт сушили при 50°С в вакууме (2·10-3 мбар). Выход составил 2,3 г (5,22 ммоль, М=440,42 г/моль) полимера, окрашенного в бледно-коричневый цвет.
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в водном растворе 1М NaCl, метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне, этилацетате, трифторуксусной кислоте.
1H-ЯМР (300 МГц, ДМСО-d6): δ = 8,32 (с, 2H, CH), 8,19 (д, 2H, CH, JHH=8,2 Гц), 7,99 (д, 2H, CH, JHH=8,4 Гц), между 6 и 4 м.д (ушир.с, SO3H Ч n H2O, в зависимости от содержания воды).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 147,7 (с), 1440 (с), 143,3 (с), 133,1 (с), 128,9 (с), 128,5 (с).
ПРИМЕР 3
Синтез поли(сульфокислота-фениленсульфона) с варьируемой обменной емкостью: сульфированный поли(1,4-фениленсульфон) с n=0,7 и 0,8
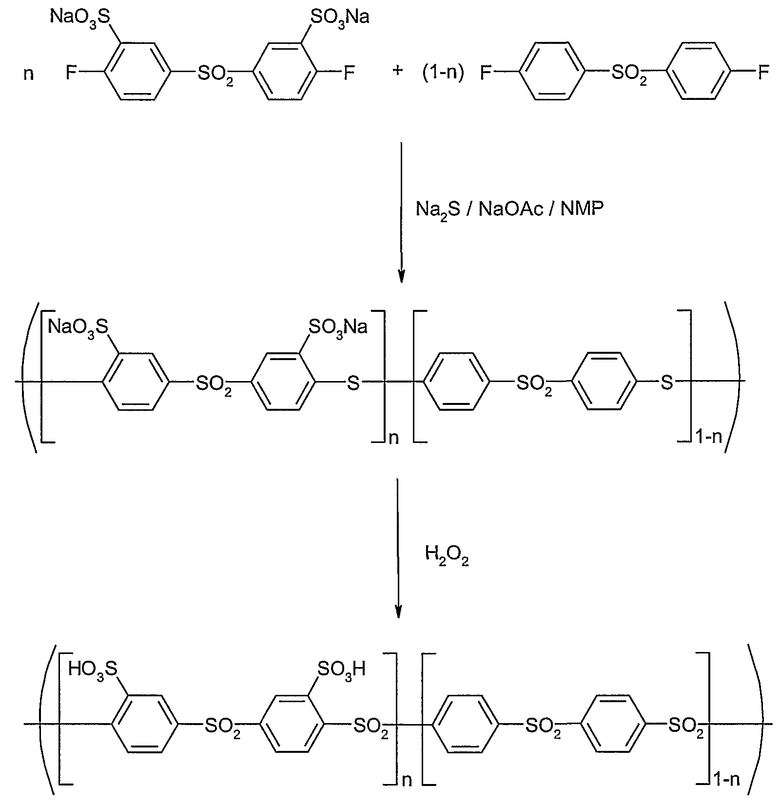
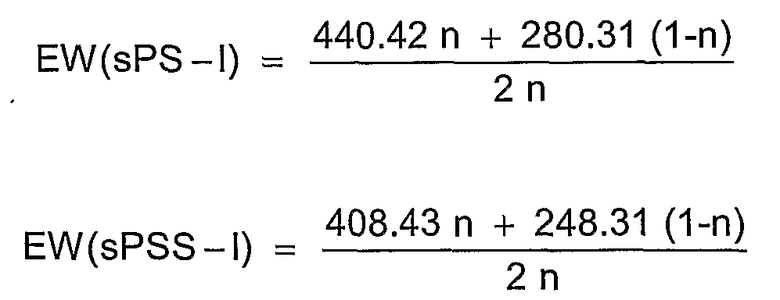
I. Полимеризация (n=0,7):
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфид):
Полимеризацию проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 100 мл, которая была оборудована вводом для аргона, магнитной мешалкой и ловушкой Дина-Старка, снабженной охладителем. В колбу добавляли 3,233 г (8,026 ммоль, М=476,34 г/моль) динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфонмоногидрата, 0,9299 г (3,657 ммоль, М=254,25 г/моль) 4,4'-дифтордифенилсульфона, 0,8948 г (11,466 ммоль) сульфида натрия (Na2S) и 0,958 г (11,466 ммоль) сухого ацетата натрия. Эту смесь сушили в течение 2 час при 70°С в вакууме (1·10-3 мбар). Затем добавляли в атмосфере аргона 20 мл сухого 1-метил-2-пирролидона (НMP) и 40 мл сухого толуола, и реакционную смесь нагревали в масляной бане 2 часа до 140°С, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 19 час при 180°С. После охлаждения до комнатной температуры суспензию темно-фиолетового цвета медленно прикапывали в изопропанол (600 мл), чтобы высадить полимер. Серый осадок отфильтровывали и промывали изопропанолом. Затем продукт вновь растворяли в 50 мл воды (темно-коричневый раствор), опять высаживали в изопропанол (800 мл), отфильтровывали и промывали изопропанолом и сушили в вакууме (2·10-3 мбар). Для отделения всех побочных продуктов полимер очищали с помощью 24-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 3000), причем после отделения растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили темно-коричневое твердое вещество (3,80 г, М=391,17 г/моль Na+-форма=9,71 ммоль).
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте.
Нерастворим в метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,21 (д, 2H, CH, JHH=1,6 Гц), 7,83 (ушир.д, 1,6H, CH, JHH=6,7 Гц), 7,70 (д, 2H, CH, JHH=8,4 Гц), 7,45 (д, 1,6H, CH, Jm=6,7 Гц), 7,17 (д, 2H, CH, JHН=8,4 Гц ), 3,25 (ушир.с, 6H, H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 148,6 (с), 141,6 (с), 141,3 (с), 140,5 (с), 139,0 (с), 135,0 (с), 132,1 (с), 129,4 (с), 129,0 (с), 127,1 (с).
Молекулярный вес: Mn=19612, Mw=27043 г/моль, D=1,3789 (ГПХ) для Na+-формы
II. Окисление (n=0,7):
Сульфированный поли(1,4-фениленсульфон): 2,188 г (ок. 5,59 ммоль) поли(натрийсульфонатфенилен-тио-сульфона) из вышеприведенной реакции растворяли в 50 мл концентрированной серной кислоты с образованием коричневого раствора. Медленно добавляли пероксид водорода (4,0 мл 36% H2O2 в воде, ок. 40 ммоль H2O2). Затем реакционную смесь 2 дня перемешивали при комнатной температуре. После разбавления смеси 250 мл воды отделяли серную кислоту посредством диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 3000). Воду удаляли посредством ротационного испарителя, и продукт сушили при 50°С в вакууме (2·10-3 мбар). Выход составил 1,93 г (М=392,39 г/моль H+-форма=4,92 ммоль) полимера, окрашенного в слабо желтоватый цвет.
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО, диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ) (THF), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,29 (ушир.с и ушир.д, вместе 4H, CH), 8,08 (м, 0,6H, CH), 7,97 (д, 2H, CH, JHH=8,4 Гц), 7,85 (м, 0,6H, CH), 6,35 (уширс, 12H, SO3H Ч n H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 147,9 (с), 144,1 (с), 143,2 (с), 133,5 (с), 130,2 (слабый с), 129,8 (слабый с), 128,7 (с), 128,0 (с).
Молекулярный вес: Mn=33362, Mw=61256 г/моль, D=1,8361 (ГПХ) для H+-формы
I. Полимеризация (n=0,8):
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфид) :
Полимеризацию проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 100 мл, которая была оборудована вводом для аргона, магнитной мешалкой и ловушкой Дина-Старка, снабженной охладителем. В колбу добавляли 3,6073 г (7,040 ммоль) динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфонтригидрата, 0,4475 г (1,760 ммоль) 4,4'-дифтордифенилсульфона, 0,6868 г (8,801 ммоль) сульфида натрия (Na2S) и 0,7938 г (9,680 ммоль) сухого ацетата натрия. Эту смесь сушили в течение 2 час при 70°С в вакууме (2·10-3 мбар). Затем добавляли в атмосфере аргона 18 мл сухого 1-метил-2-пирролидона (НМП) и 40 мл сухого толуола, и реакционную смесь нагревали в масляной бане 12 час до 145°С, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 24 час при 175°С. После охлаждения до комнатной температуры суспензию черного цвета медленно прикапывали в изопропанол (600 мл), чтобы высадить полимер. Серый осадок отфильтровывали и промывали изопропанолом. Затем продукт вновь растворяли в 50 мл воды (черный раствор), опять высаживали в изопропанол (800 мл), отфильтровывали и промывали изопропанолом, и сушили в вакууме (2·10-3 мбар). Для отделения всех побочных продуктов полимер очищали при использовании 12-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после отделения растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили темно-коричневое твердое вещество (2,69 г, М=411,57 г/моль Na+-форма=6,54 ммоль).
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте.
Нерастворим в метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,23 (c, 2H, CH), 7,83 (c, 1H, CH), 7,71 (д, 2H, CH), 7,45 (c, 1H, CH), 7,17 (д, 2H, CH), 3,33 (ушир.c, H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 148,6 (с), 141,6 (с), 141,0 (с), 140,4 (с), 139,0 (с), 135,0 (с), 132,1 (с), 129,4 (с), 129,1 (с), 127,1 (с).
II. Окисление (n=0,8):
Сульфированный поли(1,4-фениленсульфон): 2,26 г (ок. 5,49 ммоль) поли(натрийсульфонатфенилен-тио-сульфона) из вышеприведенной реакции суспендировали в 30 мл ледяной уксусной кислоты, затем добавляли 10 мл концентрированной серной кислоты. Медленно добавляли пероксид водорода (2,5 мл 36% H2O2 в воде, ок. 25 ммоль H2O2). Затем реакционную смесь 24 часа перемешивали при температуре 55°С. После разбавления смеси 200 мл ледяной уксусной кислоты отфильтровывали бледный, слабо-желтоватый осадок. Продукт очищали посредством диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000) и при 50°С сушили в вакууме (2·10-3 мбар). Выход составил 1,80 г (М=408,40 г/моль Na+-форма=4,41 ммоль) полимера, окрашенного в слабо-желтоватый цвет.
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,31 (ушир.c, 2H, CH), 8,19 (ушир.c, 2H, CH), 8,08 (ушир.c, 0,4H, CH), 7,98 (ушир.c, 2H, CH), 7,88 (c, 0,4H, CH), 5,16 (ушир.c, SO3H Ч n H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 147,7 (с), 144,0 (с), 143,3 (с), 133,1 (с), 130,2 (слабый с), 129,8 (слабый с), 128,8 (с), 128,4 (с).
По аналогии с реакциями, описанными в примере 3, были получены другие сополимеры с различной ионообменной емкостью при использовании различных соотношений исходных мономеров: динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфона и 4,4'-дифтордифенилсульфона, или динатрий-3,3'-дисульфонат-4,4'-дихлордифенилсульфона и 4,4'-дихлордифенилсульфона. Условия реакции были аналогичными.
ПРИМЕР 4
Синтез поли(сульфокислота-ариленсульфона) с варьируемой обменной емкостью: сульфированный поли(1,4-фениленсульфон) с n=1,0 и 0,8
Дитиоловый компонент: 4,4'-тиобисбензолтиол (бис-(4-меркаптофенил)сульфид)
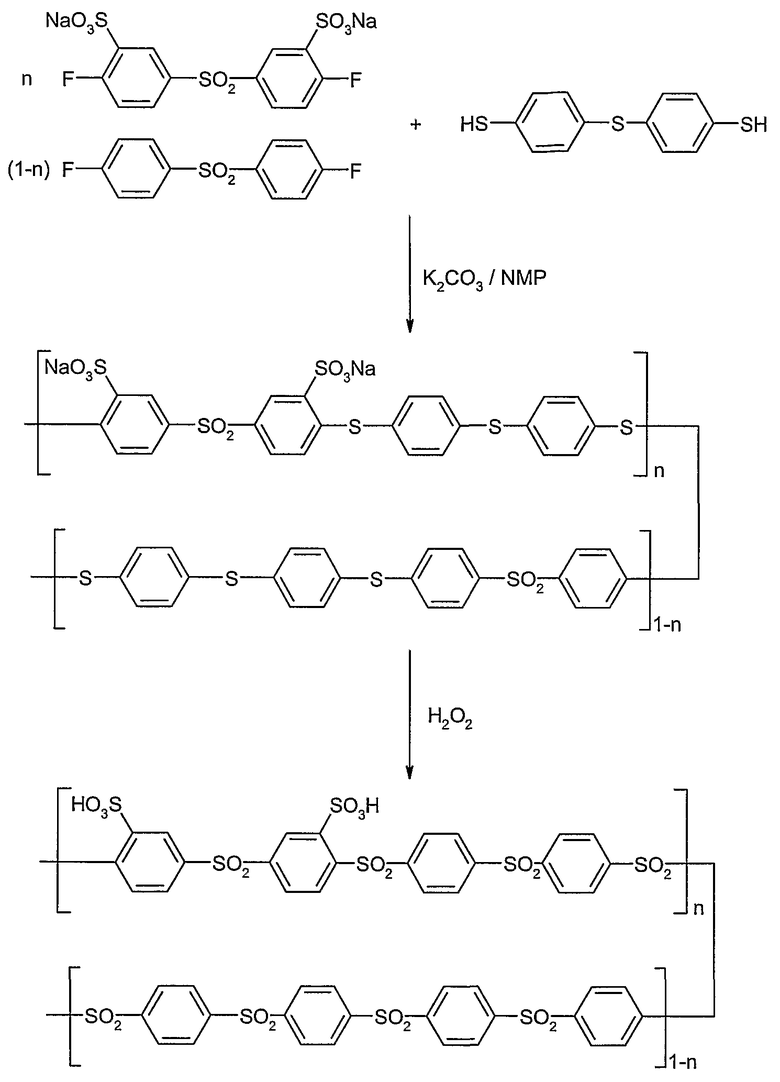
1. Приготовление
I. Полимеризация:
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфид-1,4-фениленсульфид-1,4-фениленсульфид):
Полимеризацию проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 100 мл, которая была оборудована вводом для аргона, магнитной мешалкой и ловушкой Дина-Старка, снабженной охладителем. В колбу добавляли 3,276 г (6,394 ммоль) динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфонтригидрата, 1,601 г (6,394 ммоль) 4,4'-тиобисбензолтиола и 1,060 г (7,673 ммоль) сухого карбоната калия. Эту смесь сушили в течение 2 час при 70°С в вакууме (2·10-3 мбар). Затем добавляли в атмосфере аргона 18 мл сухого 1-метил-2-пирролидона (НМП) и 40 мл сухого толуола, и реакционную смесь нагревали в масляной бане до 145°С 4 часа, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 15 час при 185°С. После охлаждения до комнатной температуры суспензию черного цвета медленно прикапывали в изопропанол (600 мл), чтобы высадить полимер. Серый осадок отфильтровывали и промывали изопропанолом. Затем продукт вновь растворяли в 100 мл воды (коричневый раствор), опять высаживали в изопропанол (600 мл), отфильтровывали и промывали изопропанолом и сушили в вакууме (2·10-3 мбар). Для отделения всех побочных продуктов полимер очищали с использованием 24-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после отделения растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили темно-коричневое твердое вещество (4,056 г, М=668,70 г/моль Na+-форма=6,07 ммоль).
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте.
Нерастворим в метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,09 (с, 2H, CH), 7,57 (д, 2H, CH, JHH=8,3 Гц), 7,44 (д, 4H, CH, JHH=7,9 Гц), 7,37 (д, 4H, CH, JHH=7,9 Гц), 6,80 (д, 2H, CH, JHН=8,3 Гц).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 144,7 (с), 144,1 (с), 136,5 (с), 136,2 (с), 135,9 (с), 132,0 (с), 130,8 (с), 127,6 (с), 126,0 (с).
Молекулярный вес: Mn=8378, Mw=34670 г/моль, D=4,1383 (ГПХ) для Na+-формы
II. Окисление:
Сульфированный поли(1,4-фениленсульфон): 3,22 г (4,82 ммоль, М=668,70 г/моль) мелко растолченного твердого вещества из вышеприведенной реакции суспендировали в 50 мл ледяной уксусной кислоты и 10 мл концентрированной серной кислоты. Темно-коричневую реакционную смесь нагревали до 55°С, затем медленно прикапывали 8 мл 36% раствора пероксида водорода (ок. 80 ммоль H2O2). Эту смесь 5 час перемешивали при 55°С, причем твердое вещество медленно обесцвечивалось. Затем смесь быстро нагревали до 110°С, чтобы удалить избыточный пероксид. Затем смесь разбавляли 150 мл ледяной уксусной кислоты. Бледно-желтое до бесцветного твердое вещество отфильтровывали и многократно промывали ледяной уксусной кислотой. Для отделения всех побочных продуктов полимер очищали с использованием 48-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после удаления растворителя и сушки при 50°С в вакууме (2·10-3 мбар) получили твердое вещество бледно-желтого цвета (2,83 г, М=720,74 г/моль = 3,93 ммоль).
Растворимость:
Растворим в диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в воде (только набухание), метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,44 (ушир., 4H, CH), 8,16 (ушир., 2H, CH), 7,94 (ушир., 4H, CH), 7,89 (ушир., 4H, CH), 5,01 (ушир., 9H, H2O).
13C-ЯМР (75,5 MГц, ДМСО-d5): δ = 150,0 (с), 146,9 (с), 144,7 (с), 144,1 (с), 141,2 (с), 134,2 (с), 129,9 (с), 128,6 (с).
2. Приготовление
I. Полимеризация (n=1,0):
sPSS-312 (n=1,0) Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфид-1,4-фениленсульфид-1,4-фениленсульфид):
Полимеризацию проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 1000 мл, которая была оборудована вводом для аргона, механической мешалкой и ловушкой Дина-Старка, снабженной охладителем. В колбу добавляли 30,170 г (0,0685 моль) динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфона, 16,482 г (0,0658 моль), 4,4'-тиобисбензолтиола и 19,1 г (0,138 моль) сухого карбоната калия. Затем добавляли 200 мл сухого 1-метил-2-пирролидона (НМП) и 80 мл сухого толуола, и реакционную смесь в слабом токе аргона перемешивали 30 минут при комнатной температуре. Затем реакционную смесь нагревали в масляной бане до 150°С 3 часа, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 36 час при 185°С, причем через 24 часа добавляли следующие 100 мл НМП. После охлаждения до комнатной температуры суспензию темно-фиолетового цвета медленно прикапывали в изопропанол (1200 мл), чтобы высадить полимер. Фиолетовый осадок отфильтровывали и промывали изопропанолом. Затем продукт вновь растворяли в 600 мл воды (темно-фиолетовый раствор), опять высаживали в изопропанол (1200 мл), потом отфильтровывали серый осадок и промывали изопропанолом. Для отделения всех побочных продуктов полимер очищали с использованием 36-часового диализа (диализный мешок от Sigma-Aldrich с исключенным молекулярным весом = 12000-14000), причем после удаления растворителя и сушки при 60°С в вакууме (2·10-3 мбар) в результате получили темно-фиолетовое твердое вещество (38,46 г, М=700,94 г/моль K+-форма, 83,4%). Часть полимера (7,93 г) посредством ионообменника (Dowex® Marathon® C) перевели в H+-форму. В результате получили светло-коричневый полимер (6,96 г, 98,5%), который сушили при 60°С в вакууме в течение 12 час. Согласно 1H-ЯМР-спектру полимер все еще содержал 3,7 H2O/SO3H, тем самым измеренная ионообменная емкость (ИОЕ) после вычета 3,7 H2O/SO3H (ИОЕ)=3,116 ммоль/г) примерно соответствовала теоретически ожидаемой ИОЕ 3,201 ммоль/г.
Растворимость:
Растворим в воде, метаноле (H+-форма), диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте.
Нерастворим в метаноле (Na+/K+-форма), этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,09 (с, 2H, CH), 7,57 (д, 2H, CH, JHH=8,3 Гц), 7,44 (д, 4H, CH, JHH=7,9 Гц), 7,37 (д, 4H, CH, JHH=7,9 Гц), 6,80 (д, 2H, CH, JНН=8,3 Гц).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 144,7 (с), 144,1 (с), 136,5 (с), 136,2 (с), 135,9 (с), 132,0 (с), 130,8 (с), 127,6 (с), 126,0 (с).
Молекулярный вес: Mn=21229 г/моль, Mw=52025 г/моль, D=2,45 (ГПХ в ДМФ/60°C/добавка соли/относительно полистирольного стандарта) для Na+/K+-формы
II. Окисление (n=1,0):
sPS-360 (n=1,0) Сульфированный поли(1,4-фениленсульфон): 20,0 г (28,5 ммоль, М=700,92 г/моль для калиевой формы) мелко растолченного фиолетового твердого вещества из вышеприведенной реакции (sPSS-312, n=1,0) суспендировали в 400 мл ледяной уксусной кислоты и 15 мл концентрированной серной кислоты. К темно-коричневой реакционной смеси медленно прикапывали 26 мл раствора пероксида водорода (30%, ок. 0,26 моль H2O2). Эту смесь 36 час перемешивали при комнатной температуре, причем твердое вещество медленно обесцвечивалось. Затем смесь разбавляли 200 мл ледяной уксусной кислоты. Бледно-желтый до бесцветного осадок отфильтровывали и многократно промывали ледяной уксусной кислотой. Для отделения всех побочных продуктов полимер очищали с использованием 48-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 12000-14000), причем после удаления растворителя и сушки при 60°С в вакууме получили твердое вещество бледно-желтого цвета (18,25 г, М=720,74 г/моль = 88,9%). Смогли получить прозрачные пленки из растворов в ДМАц, ДМСО и НМП (20 вес.%).
Растворимость:
Растворим в диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц);
Не растворим в воде (только набухание), метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
Проводимость при 25°С: 128 мСм/см (в жидкой воде)
Е-модуль при 30°С: 600 МПа (ДМА(DMA, Dynamic mechanical analysis, динамический механический анализ) с 1 Гц, измерено в воздухе, заранее подвергали набуханию в воде)
Относительная вязкость: 2,972 при 25°С, С=1 г/дл в ДМСО
Характеристическая вязкость: 1,089 дл/г при 25°С, С=1 г/дл в ДМСО
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,44 (ушир., 4H, CH), 8,16 (ушир., 2H, CH), 7,94 (ушир., 4H, CH), 7,89 (ушир., 4H, CH), 5,01 (ушир., 9H, H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 150,0 (с), 146,9 (с), 144,7 (с), 144,1 (с), 141,2 (с), 134,2 (с), 129,9 (с), 128,6 (с).
3. Приготовление
I. Полимеризация (n=0,8):
sPSS-370 (n=0,8) Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфид-1,4-фениленсульфид-1,4-фениленсульфид):
Полимеризацию проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 1000 мл, которая была оборудована вводом для аргона, механической мешалкой и ловушкой Дина-Старка, снабженной охладителем. В колбу добавляли 30,090 г (65,65 ммоль) динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфона, 4,173 г (16,40 ммоль) 4,4'-дифтордифенилсульфона, 20,548 г (82,06 ммоль) 4,4'-тиобисбензолтиола и 17,0 г (0,123 моль) сухого карбоната калия. Затем добавляли 200 мл сухого 1-метил-2-пирролидона (НMП) и 80 мл сухого толуола, и реакционную смесь в токе аргона перемешивали 30 минут при комнатной температуре. Затем реакционную смесь нагревали в масляной бане до 150°С 3 часа, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 36 час при 185°С, причем через 24 часа добавляли следующие 100 мл НМП. После охлаждения до комнатной температуры суспензию темно-фиолетового цвета медленно прикапывали в изопропанол (1200 мл), чтобы высадить полимер. Фиолетовый осадок отфильтровывали и промывали изопропанолом. Затем продукт растворяли в 600 мл воды (темно-фиолетовый раствор), опять высаживали в изопропанол (1200 мл), потом отфильтровывали серый осадок и промывали изопропанолом. Для отделения всех побочных продуктов полимер очищали с использованием 36-часового диализа (диализный мешок от Sigma-Aldrich с исключенным молекулярным весом = 12000-14000), причем после удаления растворителя и сушки при 60°С в вакууме в результате получили темно-фиолетовое твердое вещество (33,07 г, М=653,66 г/моль K+-форма, 61,7%). Часть полимера (7,47 г) посредством ионообменника (Dowex® Marathon® C) перевели в H+-форму. В результате получили светло-коричневое твердое вещество (6,50 г, 96,0%), которое сушили при 60°С в вакууме в течение 12 час.
Растворимость:
Растворим в воде, метаноле (H+-форма), диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте.
Нерастворим в метаноле (Na+/K+-форма), этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,09, 7,70, 7,57, 7,44, 7,37, 7,20, 6,80.
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 144,7 (с), 144,4 (слабый с), 144,2 (с), 138,5 (слабый с), 136,5 (s), 136,2 (с), 135,9 (с), 135,6 (слабый с), 132,0 (s), 130,8 (с), 130,2 (слабый с), 128,4 (с), 127,6 (с), 126,0 (с).
Молекулярный вес: Mn=169680 г/моль, Mw=315424 г/моль, D=1,86 (ГПХ в ДМФ/60°С/добавка соли/относительно полистирольного стандарта) для Na+/K+-формы
II. Окисление (n=0,8):
sPS-430 (n=0,8) Сульфированный поли(1,4-фениленсульфон): 20,0 г (28,5 ммоль, М=700,92 г/моль для калиевой формы) мелко растолченного фиолетового твердого вещества из вышеприведенной реакции (sPSS-3370, n=0,8) суспендировали в 400 мл ледяной уксусной кислоты и 15 мл концентрированной серной кислоты. К темно-коричневой реакционной смеси медленно прикапывали 26 мл раствора пероксида водорода (30%, ок. 0,26 моль H2O2). Эту смесь 36 час перемешивали при комнатной температуре, причем твердое вещество медленно обесцвечивалось. Затем смесь разбавляли 200 мл ледяной уксусной кислоты. Бледно-желтый до бесцветного осадок отфильтровывали и многократно промывали ледяной уксусной кислотой. Для отделения всех побочный продуктов полимер очищали с использованием 48-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 12000-14000), причем после удаления растворителя и сушки при 60°С в вакууме получили твердое вещество бледно-желтого цвета (18,25 г, М=720,74 г/моль = 88,9%). Смогли получить прозрачные пленки из растворов в ДМСО, ДМАц, и НМП (20 вес.%).
Растворимость:
Растворим (после нагревания) в диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в воде (только набухание), метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
Проводимость при 25°С: 130 мСм/см (в жидкой воде)
Е-модуль при 60°С: 600 МПа (ДМА с 1 Гц, измерено в воздухе, заранее подвергали набуханию в воде)
1Н-ЯМР (300 MГц, ДМСО-d6): δ = 8,48 (д), 8,44 (с), 8,16 (д), 8,10 (с), 7,94 (д), 7,89 (д), 5,0 (H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 150,1 (с), 146,9 (с), 145,1 (слабый с), 144,7 (с), 144,1 (с), 143,6 (слабый с), 141,2 (с), 134,2 (с), 130,2 (с), 129,9 (с), 128,6 (с).
Молекулярный вес: Mn=44151, Mw=679752 г/моль, D=15,4 (ГПХ в ДМФ/60°С/добавка соли/относительно полистирольного стандарта) для H+-формы (малая растворимость в ДМФ).
ПРИМЕР 5
Синтез поли(сульфокислота-фениленсульфона) с варьируемой обменной емкостью: сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфон-1,3-фениленсульфон) с n= 1,0 и 0,8
Дитиоловый компонент: бензол-1,3-дитиол
I. Полимеризация (n=1,0):
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфид-1,3-фениленсульфид):
Полимеризацию проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 100 мл, которая была оборудована вводом для аргона, магнитной мешалкой и ловушкой Дина-Старка, снабженной охладителем. В колбу добавляли 4,8537 г (9,531 ммоль, М=509,25 г/моль) динатрий-3,3'-дисульфонат-4,4'-дихлордифенилсульфон-могогидрата, 1,3557 г (9,531 ммоль) бензол-1,3-дитиола и 1,449 г (10,5 ммоль) сухого карбоната калия. Эту смесь сушили в течение 2 час при 70°С в вакууме (2·10-3 мбар). Затем добавляли в атмосфере аргона 15 мл сухого 1-метил-2-пирролидона (НМП) и 25 мл сухого толуола, и реакционную смесь нагревали в масляной бане до 150°С 4 часа, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 20 час при 190°С. После охлаждения до комнатной температуры суспензию, окрашенную в слабо-желтоватый цвет, медленно вливали в изопропанол (500 мл), чтобы высадить полимер. Осадок, окрашенный в слабо-розовый цвет, отфильтровывали и промывали изопропанолом. Затем продукт вновь растворяли в 50 мл воды, опять высаживали в изопропанол (800 мл), отфильтровывали, промывали изопропанолом, и сушили в вакууме (2·10-3 мбар). Для отделения всех побочных продуктов полимер очищали с использованием 24-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после отделения растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили окрашенное в розовый цвет твердое вещество (5,10 г, М=560,54 г/моль Na+-форма=9,10 ммоль). Часть натриевой соли (ок. 1,0 г) посредством ионообменника (Dowex® Marathon® C) подвергли превращению до H+-формы.
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте.
Нерастворим в водном растворе 1М NaCl, метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне, этилацетате, трифторуксусной кислоте.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,08 (д, 2H, CH, JHH=1,7 Гц), 7,61 (с, 1H, CH), 7,56 (дд, 2H, CH, JНН=1,7, 7,2 Гц), 7,48 (с, 3H, CH), 6,85 (д, 2H, CH, JHH=7,2 Гц), 4,96 (с, H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 145,4 (с), 144,5 (с), 141,3 (с), 137,3 (с), 136,7 (с), 134,2 (с), 132,7 (с), 128,6 (с), 128,5 (с), 126,8 (с).
II. Окисление (n=1,0):
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфон-1,3-фениленсульфон): 3,08 г (5,49 ммоль, М=560,54 г/моль) твердого вещества из вышеприведенной реакции растворяли в 50 мл концентрированной серной кислоты. К слабо-зеленоватому раствору медленно прикапывали 5 мл 36% раствора пероксида водорода (ок. 50 ммоль H2O2), причем наблюдалось посветление до бледно-желтого. Эту смесь перемешивали 1 день при комнатной температуре. После разбавления смеси 200 мл воды отделяли серную кислоту путем диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 3000). Воду удаляли с помощью ротационного испарителя, и продукт сушили при 50°С в вакууме (2·10-3 мбар). Выход твердого вещества бледно-желтого цвета составил 2,40 г (4,13 ммоль, М=580,58 г/моль).
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в водном растворе 1М NaCl, метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне, этилацетате, трифторуксусной кислоте.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,45 и 8,44 (два с, вместе 4H, CH), 8,16 (д, 2H, CH, JHH=7,2 Гц), 7,88 (д, 2H, CH, JHH=7,2 Гц), 7,46 (т, 1H, CH, JHН=6,5 Гц), 3,87 (с, H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 149,6 (с), 144,4 (с), 142,4 (с), 141,9 (с), 134,2 (с), 133,4 (с), 130,1 (с), 129,9 (с), 129,8 (с), 128,4 (с).
II. Полимеризация (n=0,8):
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфид-1,3-фениленсульфид):
Полимеризацию проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 100 мл, которая была оборудована вводом для аргона, магнитной мешалкой и ловушкой Дина-Старка, снабженной охладителем. В колбу добавляли 4,4466 г (9,335 ммоль) динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфон-моногидрата, 0,5933 г (2,334 ммоль) 4,4'-дифтордифенилсульфона, 1,6596 г (11,668 ммоль) бензол-1,3-дитиола и 3,255 г (23,336 ммоль) сухого карбоната калия. Эту смесь сушили в течение 2 час при 90°С в вакууме (2·10-3 мбар). Затем добавляли в атмосфере аргона 20 мл сухого 1-метил-2-пирролидона (НМП) и 35 мл сухого толуола, и реакционную смесь нагревали в масляной бане до 145°С 4 часа, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 24 час при 180°С. После охлаждения до комнатной температуры темно-фиолетовый раствор медленно вливали в изопропанол (800 мл), чтобы высадить полимер. Осадок, окрашенный в розовый цвет, отфильтровывали и промывали изопропанолом. Затем продукт вновь растворяли в 50 мл воды (фиолетовый раствор), опять высаживали в изопропанол (800 мл), отфильтровывали, промывали изопропанолом, и сушили в вакууме (2·10-3 мбар). Для отделения всех побочных продуктов полимер очищали с использованием 24-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 3000), причем после отделения растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили окрашенное в фиолетовый цвет твердое вещество (3,66 г, М=519,73 г/моль Na+-форма=7,04 ммоль).
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте.
Нерастворим в метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, метиленхлориде, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,10, 7,73, 7,62, 7,59, 7,51, 7,24, 6,78.
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 145,4, 145,1, 144,8, 144,6, 144,1, 141,3, 140,0, 139,1, 138,6, 137,3, 136,9, 136,7, 136,6, 135,3, 134,2, 133,3, 132,7, 128,9, 128,6, 128,5, 127,5, 126,7, 126,5.
II. Окисление (n=0,8):
Сульфированный поли(1,4-фенилен-сульфон-1,4-фенилен-сульфон-1,3-фенилен-сульфон): 3,066 г (5,90 ммоль, М=519,73 г/моль) твердого вещества из вышеприведенной реакции суспендировали в 50 мл концентрированной серной кислоты. К этой суспензии зеленого цвета медленно прикапывали 6 мл 36% раствора пероксида водорода (ок. 60 ммоль H2O2), причем наблюдалось посветление до бледно-желтой окраски. Эту смесь перемешивали 1 день при комнатной температуре. После разбавления смеси 200 мл воды отделяли серную кислоту путем диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 3000). Воду удаляли с помощью ротационного испарителя, и продукт сушили при 50°С в вакууме (2·10-3 мбар). Выход твердого вещества бледно-желтого цвета составил 2,21 г (4,0 ммоль, М=548,56 г/моль).
Растворимость:
Практически нерастворим во всех растворителях, в воде (набухание)
1H-ЯМР (300 МГц, ДМСО-d6): δ = 8,45 (ушир., CH), 8,08 (ушир., CH), 7,84 (ушир., CH), 6,19 (ушир., CH), 5,66 (ушир., CH), 4,04 (H2O).
13С-ЯМР: неизвестен из-за очень малой растворимости
Молекулярный вес: неизвестен из-за очень малой растворимости
ПРИМЕР 6
Синтез поли(сульфокислота-фениленсульфона) с варьируемой обменной емкостью: сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфон-1,3-фениленоксид) с n=1,0
Дитиоловый компонент: 4,4'-оксобисбензолтиол (бис-(4-меркаптофенил)оксид)
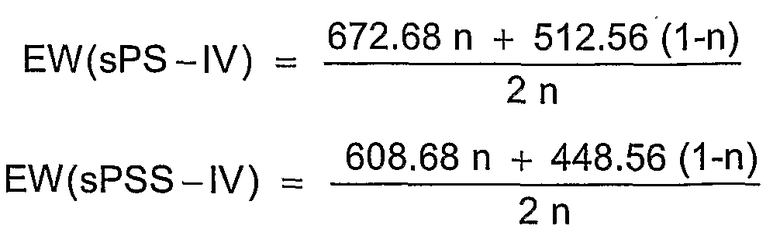
I. Полимеризация:
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфид-1,4-фениленоксид-1,4-фениленсульфид):
Полимеризацию проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 100 мл, которая была оборудована вводом для аргона, магнитной мешалкой и ловушкой Дина-Старка, снабженной охладителем. В колбу загружали 2,2566 г (4,404 ммоль) динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфонтригидрата, 1,0320 г (4,404 ммоль) 4,4'-оксобисбензолтиола и 0,852 г (6,16 ммоль) сухого карбоната калия. Эту смесь сушили в течение 2 час при 70°С в вакууме (2·10-3 мбар). Затем добавляли в атмосфере аргона 18 мл сухого 1-метил-2-пирролидона (НМП) и 40 мл сухого толуола, и реакционную смесь нагревали в масляной бане до 145°С 4 часа, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 15 час при 185°С. После охлаждения до комнатной температуры суспензию черного цвета медленно прикапывали в изопропанол (600 мл), чтобы высадить полимер. Коричневый осадок отфильтровывали и промывали изопропанолом. Затем продукт вновь растворяли в 100 мл воды, опять высаживали в изопропанол (600 мл), отфильтровывали, промывали изопропанолом, и сушили в вакууме (2·10-3 мбар). Для отделения всех побочных продуктов полимер очищали с использованием 12-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после отделения растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили твердое вещество темно-коричневого цвета (2,89 г, М=652,64 г/моль Na+-форма=4,43 ммоль). Часть натриевой соли (исходная смесь 38) (ок. 1,0 г) посредством ионообменника (Dowex® Marathon® C) подвергли превращению до H+-формы.
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте.
Нерастворим в водном растворе 1М NaCl, метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне, этилацетате, трифторуксусной кислоте.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,08 (с, 2H, CH), 7,56 (д, 2H, CH, JHH=8,4 Гц), 7,47 (д, 4H, CH, JHH=8,2 Гц), 7,13 (д, 4H, CH, JHH=8,2 Гц), 6,74 (д, 2H, CH, JHH=8,4 Гц).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 158,1 (с), 145,9 (с), 144,5 (с), 138,5 (с), 136,9 (с), 128,3 (с), 127,7 (с), 126,6 (с), 125,9 (с), 121,3 (с).
Молекулярный вес: Mn=2217, Mw=3402 г/моль, D=1,5346 (ГПХ) для Na+-формы
II. Окисление:
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфон-1,4-фениленоксид): 1,55 г (2,37 ммоль, М=652,64 г/моль) мелко раздробленного твердого вещества из вышеприведенной реакции суспендировали в 50 мл ледяной уксусной кислоты и 5 мл концентрированной серной кислоты. Темно-коричневую реакционную смесь нагревали до 55°С, причем медленно прикапывали 4 мл 36% раствора пероксида водорода (ок. 40 ммоль H2O2). Эту смесь перемешивали 5 час при 55°С, причем твердое вещество медленно светлело. Затем смесь быстро нагревали до 110°С, чтобы удалить избыточный пероксид. Затем смесь разбавляли 150 мл ледяной уксусной кислоты. Бледно-желтое твердое вещество отфильтровывали и многократно промывали ледяной уксусной кислотой. Для отделения всех побочных продуктов полимер очищали с использованием 48-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после удаления растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили твердое вещество светло-коричневого цвета (1,45 г, М=672,68 г/моль, 2,16 ммоль).
Растворимость:
Растворим в воде, диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц), концентрированной серной кислоте;
нерастворим в метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМГ (300 MГц, ДМСО-d6): δ = 8,47 (с, 2H, CH), 8,44 (д, 2H, CH, JHH=7,7 Гц), 8,11 (д, 2H, CH, JHН=7,7 Гц), 7,84 (д, 4H, CH, JHH=7,9 Гц), 7,17 (с, 5H, H2O), 7,04 (д, 2H, CH, JHH=7,9 Гц).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 159,9 (с), 149,5 (с), 144,1 (с), 143,4 (с), 136,9 (с), 133,9 (с), 132,2 (с), 129,8 (с), 129,7 (с), 119,3 (с).,
ПРИМЕР 7
Синтез поли(сульфокислота-фениленсульфона) с варьируемой обменной емкостью: сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфон-1,4-фениленсульфон-1,4-фениленоксид-1,4-фениленсульфон-1,4-фениленоксид-1,4-фениленсульфон-1,4-фениленсульфон) с n=0,7
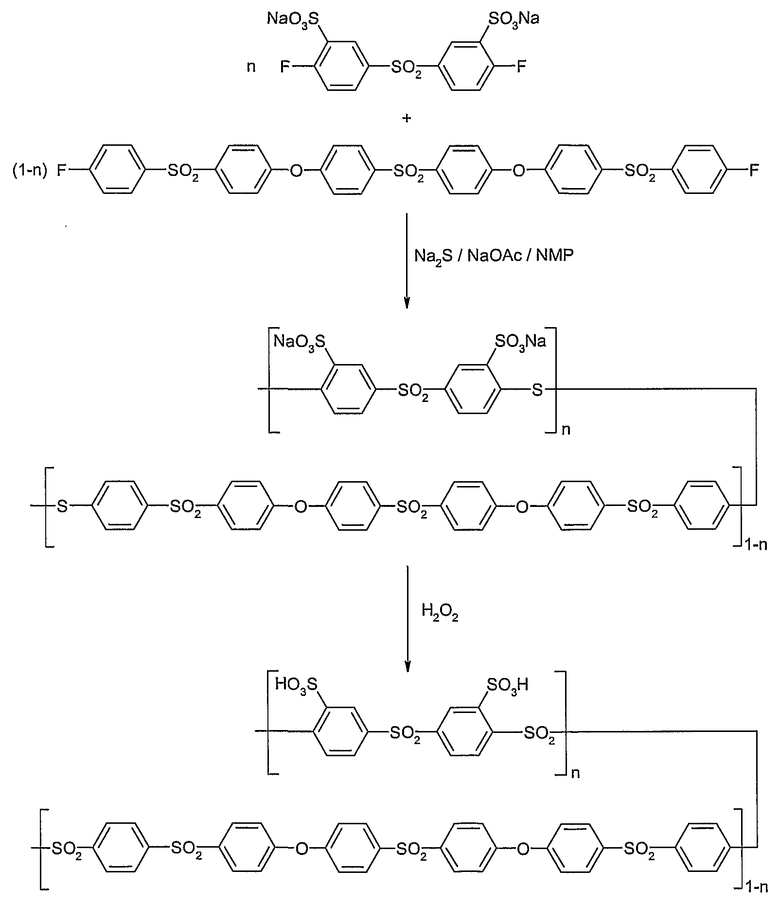
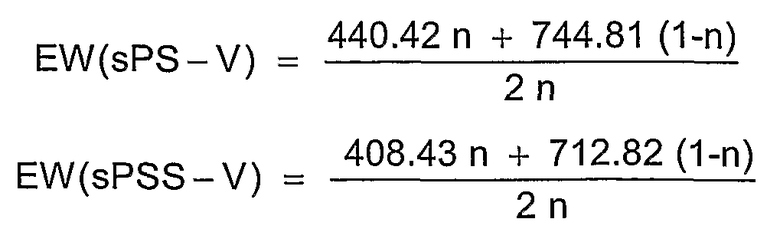
I. Полимеризация:
Поли(1,4-фениленсульфон-1,4-фениленсульфид-1,4-фениленсульфон-1,4-фениленоксид-1,4-фениленсульфон-1,4-фениленоксид-1,4-фениленсульфон-1,4-фениленсульфид):
Полимеризацию проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 100 мл, которая была оборудована вводом для аргона, магнитной мешалкой и ловушкой Дина-Старка, снабженной охладителем. В колбу загружали 3,7680 г (7,35 ммоль) динатрий-3,3'-дисульфонат-4,4'-дифтордифенилсульфонтригидрата, 2,2650 г (3,15 ммоль) бис-(4-фторфенилсульфофенилоксофенил)сульфона, 0,8199 г (10,50 ммоль) сульфида натрия (Na2S) и 0,861 г (10,50 ммоль) сухого ацетата натрия. Эту смесь сушили в течение 2 час при 70°С в вакууме (2·10-3 мбар). Затем добавляли в атмосфере аргона 18 мл сухого 1-метил-2-пирролидона (НМП) и 40 мл сухого толуола, и реакционную смесь нагревали в масляной бане до 150°С 4 часа, чтобы удалить любую возможную воду (водоотделитель). Затем толуол удаляли (отгоняли) в вакууме ловушкой Дина-Старка, и реакцию продолжали 15 час при 190°С. После охлаждения до комнатной температуры суспензию темно-зеленого цвета медленно прикапывали в изопропанол (600 мл), чтобы высадить полимер. Темно-зеленый осадок отфильтровывали и промывали изопропанолом. Затем продукт суспендировали в 200 мл воды, и для отделения всех побочных продуктов очищали с использованием 24-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после удаления растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили твердое вещество темно-коричневого цвета (2,44 г, М=530,52 г/моль Na+-форма=4,60 ммоль).
Растворимость:
Растворим в диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в воде (набухание), метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,21 (с, CH), 7,89, 7,86, 7,72, 7,69, 7,44, 7,17 (без идентификации сигнала), 3,25 (с, H2O),
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 160,1 (c), 148,7 (c), 141,7 (c), 141,1 (c), 140,9 (c), 139,0 (c), 137,3 (c), 136,8 (c), 135,0 (c), 132,1 (c), 130,9 (c), 129,3 (c), 128,9 (c), 127,0 (c), 120,6 (c), 117,0 (c),
II. Окисление:
Сульфированный поли(1,4-фениленсульфон-1,4-фениленсульфон-1,4-фениленсульфон-1,4-фениленоксид-1,4-фениленсульфон-1,4-фениленоксид-1,4-фениленсульфон-1,4-фениленсульфон):
1,56 г (2,94 ммоль) мелко раздробленного твердого вещества из вышеприведенной реакции суспендировали в 30 мл ледяной уксусной кислоты и 2,7 мл концентрированной серной кислоты. Темно-коричневую реакционную смесь нагревали до 55°С, причем медленно прикапывали 1,5 мл 36% раствора пероксида водорода (ок. 15 ммоль H2O2). Эту смесь перемешивали 3 час при 55°С, причем реакционная смесь медленно светлела. Затем смесь быстро нагревали до 110°С, чтобы удалить избыточный пероксид. Затем смесь разбавляли 150 мл ледяной уксусной кислоты. Бледно-коричневато окрашенное твердое вещество отфильтровывали и многократно промывали ледяной уксусной кислотой. Для отделения всех побочных продуктов полимер очищали с использованием 48-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после отделения растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили твердое вещество бледно-коричневатого цвета (0,977 г, 1,84 ммоль М=531,74 г/моль).
Растворимость:
Растворим в диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в воде (набухание), метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 MГц, ДМСО-d6): δ = 8,33, 8,16, 8,09, 7,99, 7,87 (сильный сигнал), 7,64, 7,49, 7,39, 7,15 (сильный сигнал) (все сигналы без идентификации), 4,48 (с, H2O).
13C-ЯМР (75,5 MГц, ДМСО-d6): δ = 160,8 (c), 160,1 (с, сильный сигнал), 159,8 (c), 148,6 (c), 147,7 (c), 146,8 (c), 144,7 (c), 143,8 (c), 143,4 (c), 142,5 (c), 142,1 (c), 137,3 (с, сильный сигнал), 135,4 (c), 132,9 (c), 131,5 (c), 130,9 (с, сильный сигнал), 130,1 (c), 129,6 (c), 129,0 (c), 128,6 (c), 128,1 (c), 127,7 (c), 120,9 (c), 120,6 (с, сильный сигнал), 116,9 (c).
ПРИМЕР 8
Синтез поли(сульфокислота-фениленсульфонкетона) с варьируемой обменной емкостью: сульфированный поли(1,4-фениленкетон-1,4-фениленсульфон)
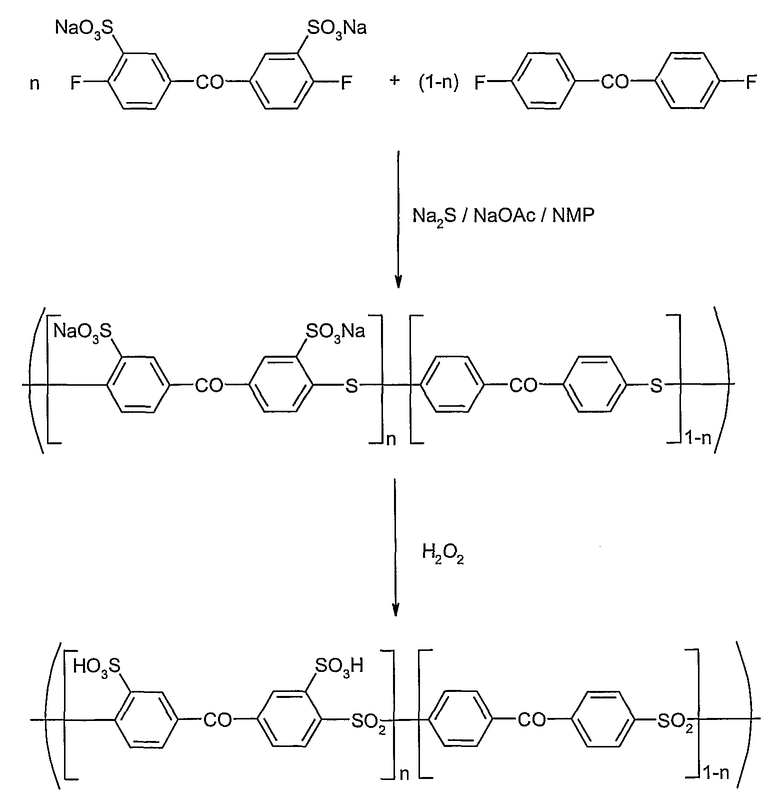
ПРИМЕР 9
Синтез блоксополимера, состоящего из поли(сульфокислота-фениленсульфона) и α,ω-дигидрокси-компонента HO-W-OH
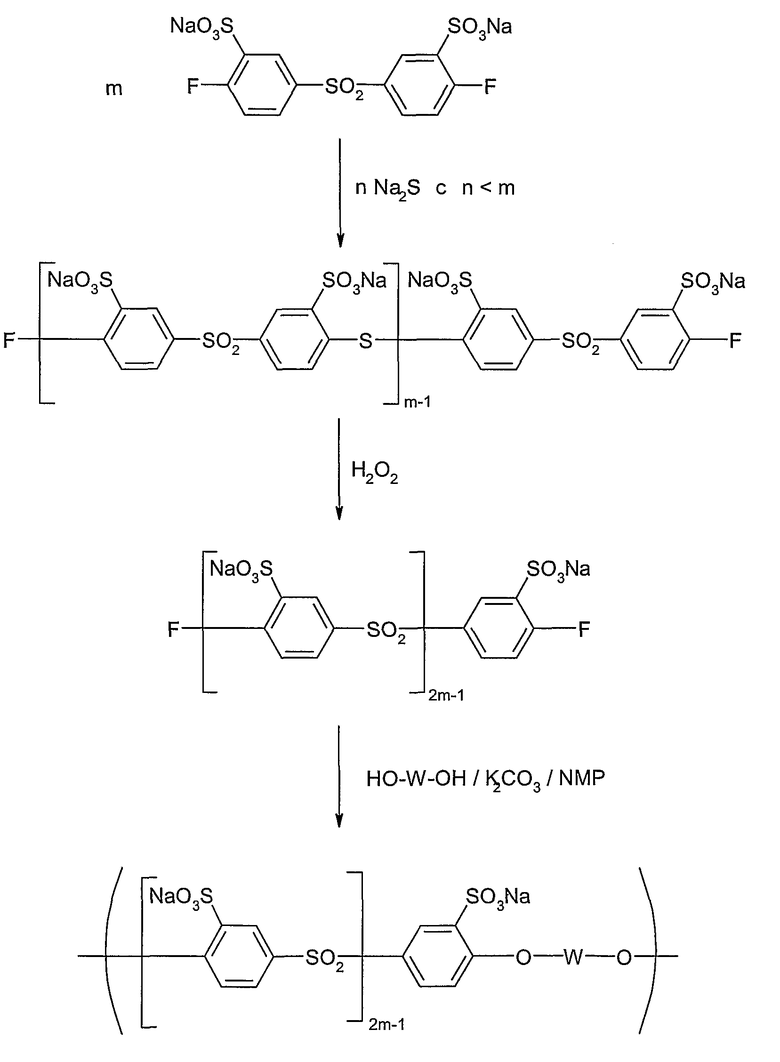
При превращении с сульфидами щелочных металлов реакционный раствор содержит добавку, как карбоксилаты щелочных металлов (например, ацетат натрия, ацетат лития), карбонаты щелочных металлов (например, карбонат лития), сульфонаты щелочных металлов, борат лития, хлорид лития.
Предпочтительными растворителями для превращения с HO-W-OH являются апротонные, полярные, высококипящие растворители, как, например, 1-метил-2-пирролидон (НМП), диметилсульфоксид (ДМСО), диметилформамид (ДМФ), диметилацетамид (ДМАц), сульфолан, дифенилсульфон, 1,3-диметил-1,2-имидазолидинон.
Температура реакции обычно составляла 100-250°С, предпочтительно 140-200°С.
Типичное время реакции составляло 5-24 часа, предпочтительно 12-18 часов.
ПРИМЕР 10
Синтез блоксополимера, состоящего из поли(сульфокислота-фениленсульфона) и α,ω-дигалогензамещенного компонента Hal-W-Hal
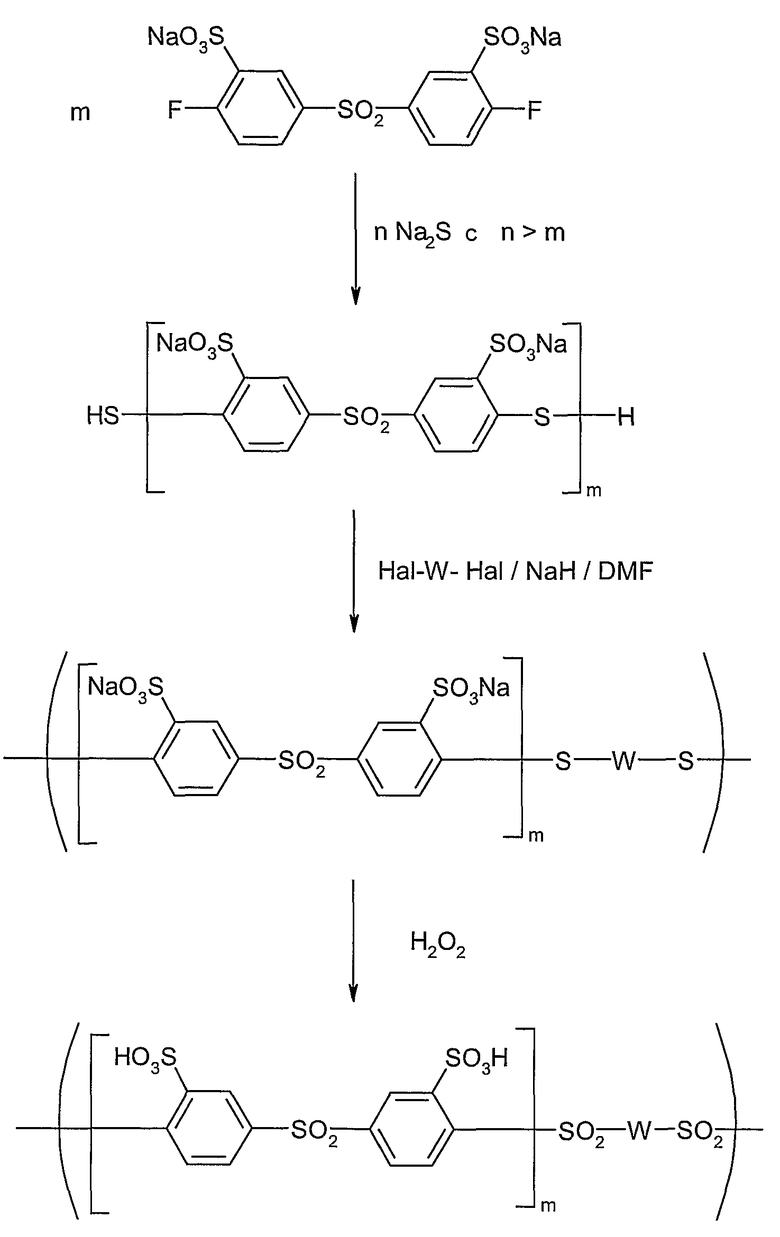
Предпочтительная температура реакции с гидридом натрия (NaH) в ДМФ составляла 0-30°С.
Типичное время реакции составляло 1-24 часа.
ПРИМЕР 11
Синтез поли(сульфокислота-1,4-фениленсульфона)
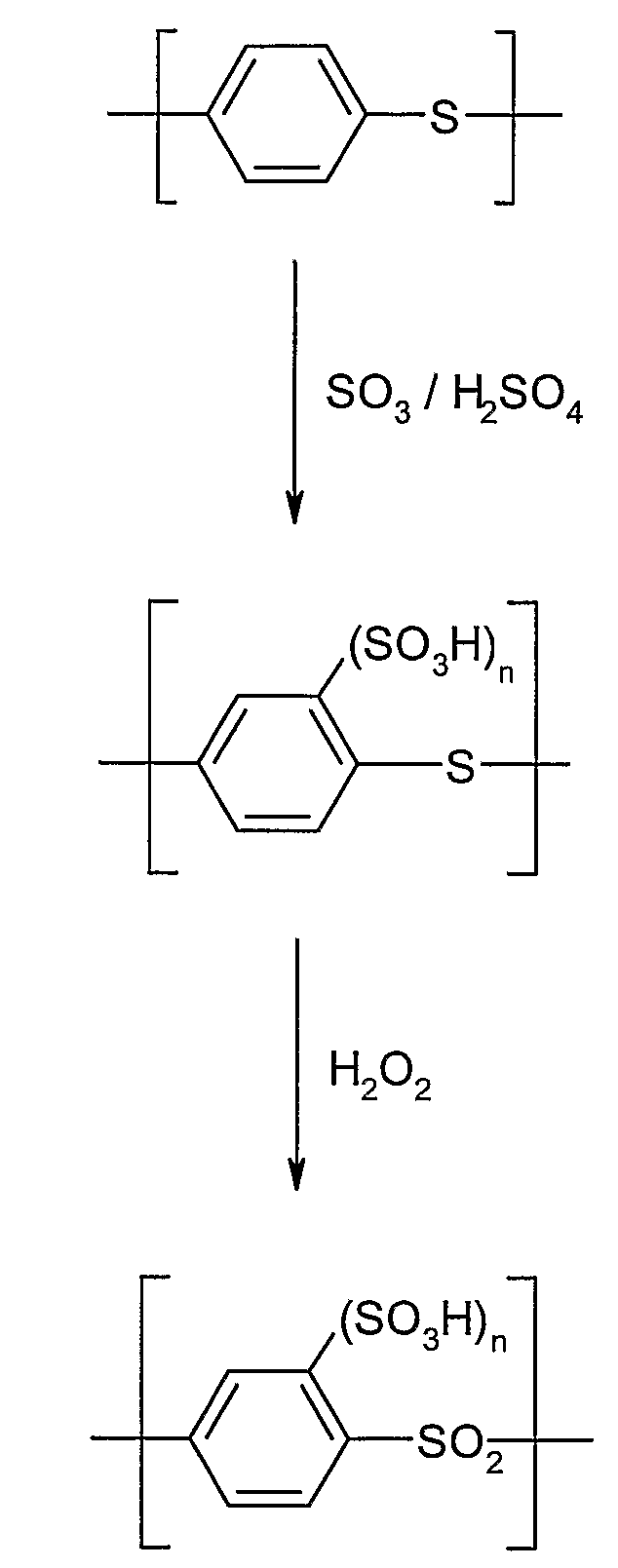
I. Сульфированный поли(1,4-фениленсульфид):
Сульфированный поли(1,4-фениленсульфид): Сульфирование проводили в обогреваемой и заполненной аргоном круглодонной колбе объемом 100 мл, которая была оборудована вводом для аргона и магнитной мешалкой. В колбе суспендировали 4,04 г (37,4 ммоль) поли(1,4-фениленсульфида) (Aldrich, Mn=15000, M=108,15 г/моль) в 50 мл концентрированной серной кислоты. К этой суспензии медленно прикапывали при сильном перемешивании 10 мл 60%-ного раствора SO3 в серной кислоте (олеум, ок. 150 ммоль SO3), при этом образовывался темно-зеленый раствор. Его перемешивали при комнатной температуре в течение 12 час. Затем раствор медленно вливали в 400 мл ледяной уксусной кислоты (охлаждение в ледяной бане до 0°С), причем полимер выпадал в виде твердого вещества, окрашенного в зеленоватый цвет. Его отфильтровывали и сушили в вакууме (2·10-3 мбар) в течение 2 час Получили твердое вещество, окрашенное в бледно-зеленоватый цвет.
Растворимость:
Растворим в диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в воде (набухание), метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
Плотность: 1,720 г/см3 для H+-формы
1H-ЯМР (300 МГц, ДМСО-d6): δ = 7,8-7,4 (ушир.м), 7,19 (ушир.м), 3,72 (с, H2O).
II. Окисление сульфированного поли(1,4-фениленсульфида):
Сульфированный поли(1,4-фениленсульфон): 5,0 г (2,6 ммоль, М=188,21 моль/г) мелко раздробленного твердого вещества из вышеприведенной реакции суспендировали в 100 мл ледяной уксусной кислоты и 10 мл концентрированной серной кислоты. Темно-коричневую реакционную смесь нагревали до 55°С, затем медленно прикапывали 10 мл 36% раствора пероксида водорода (ок. 100 ммоль H2O2). Эту смесь перемешивали 12 час при 55°С. Затем бледно-желтую смесь быстро нагревали до 110°С, чтобы удалить избыточный пероксид. Затем смесь разбавляли 300 мл ледяной уксусной кислоты, и твердое вещество отфильтровывали. Его суспендировали в 100 мл воды. Для отделения всех побочных продуктов (серной кислоты, уксусной кислоты) суспензию очищали с использованием 72-часового диализа (диализный мешок от Sigma-Aldrich, исключенный молекулярный вес = 8000), причем после удаления растворителя и сушки при 50°С в вакууме (2·10-3 мбар) в результате получили твердое вещество бледно-желтого цвета (4,5 г, М=220,21 г/моль).
Растворимость:
Растворим в диметилсульфоксиде (ДМСО), диметилформамиде (ДМФ), 1-метил-2-пирролидоне (НМП), N,N'-диметилацетамиде (ДМАц).
Нерастворим в воде (набухание), метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
1H-ЯМР (300 МГц, ДМСО-d6): δ = 8,1 (ушир.м), 5,18 (с, H2O).
13C-ЯМР (75,5 МГц, ДМСО-d6): δ = 145,7 (с), 145,2 (с), 139,8 (с), 134,6 (с), 130,2 (с), 128,7 (с).
III. Окисление сульфированного поли(1,4-фениленсульфида)с ИОЕ=1,6 ммоль/г:
Сульфированный поли(1,4-фениленсульфон): 5,00 г (0,04 моль, М=124,2 моль/г, ИОЕ=1,6 ммоль/г) мелко раздробленного сульфированного поли(1,4-фениленсульфида) из другой исходной смеси суспендировали в 300 мл ледяной уксусной кислоты и 15 мл концентрированной серной кислоты. Затем медленно прикапывали 12 мл 30% раствора пероксида водорода (ок. 0,12 моль H2O2). Эту смесь перемешивали 36 час при комнатной температуре. Затем белый осадок отфильтровывали, и промывали 200 мл воды. Его сушили при 60°С в вакууме в течение 12 час Получили белое твердое вещество (5,73 г, 91,1%), которое было практически нерастворимо во всех используемых растворителях. Пленкообразование из горячего НМП было невозможно.
Растворимость:
Незначительно растворим в горячем 1-метил-2-пирролидоне (НМП).
Нерастворим в воде, ДМСО, метаноле, этаноле, изопропаноле, толуоле, тетрагидрофуране (ТГФ), хлороформе, ацетоне.
По аналогии с реакциями, описанными в примере 11, были получены другие полимеры с различной ионообменной емкостью (степенью сульфирования) при использовании различных соотношений исходного полимера поли(1,4-фениленсульфида) и олеума (SO3). Условия реакции были аналогичными.
Обзор литературы
В целом, представление об уровне техники в области топливных элементов дано в части 3 Handbook of Fuel Cells - Fundamentals, Technology and Applications, Vol 3 (Eds. W. Vielstich, A. Lamm, H.A. Gasteiger), John WILEY & Sons, 2003. Описание мембранных материалов для топливных элементов приводится в обзоре Q Li, R. He, J.O. Jensen, N.J.Bjerrum Chem Mater. 2003, 15, 4896 и M.A. Hickner, H.Ghassemi, Y.S. Kim, J.E. McGrath Chem. Rev. 2004, 104, 4587; представление о связи между структурой, морфологией и процессами переноса в мембранах для топливных элементов дано в обзоре K.D. Kreuer, S.J. Paddison, E. Spohr, M. Schuster Chem. Rev. 2004, 104, 4637.
Полимеры со структурным звеном -SO2-Ar(SO3H)n-SO2- (Ar = ароматический остаток, n=1-4) в CA (Chemical Abstracts) не описаны. Напротив, имеются многочисленные публикации и описания к патентам со структурным звеном -SO2-Ar(SO3H)-O- (поли(ариленэфирсульфоны)), как, например, в публикации F. Wang, M. Hickner, Y.S. Kim, T.A.Zawodzinski, J.E. McGrath J. Membr. Sci. 2002, 197, 231), у которых ароматический остаток, который имеет сульфокислотную группу, окружен как сульфоновой группой -SO2-, так и простой эфирной группой -O-. Описаны также полимеры, содержащие вместо простой эфирной группы тиоэфирную группу (сульфидную группу) -S-: поли(арилентиоэфирсульфоны) или поли(ариленсульфидсульфоны) со структурным звеном -SO2-Ar(SO3H)-S-, например, в публикации T.D. Dang, Z. Bai, M.J. Dalton, E. Fossum Polymer Preprints 2004, 45, 22; Z. Bai, L.D. Williams, M.F. Durstock, T.D. Dang, Polymer Preprints 2004, 45, 60; K.B. Wiles, V.A. Bhau, F. Wang, M. Hickner, J.E. McGrath Polymer Preprints 2003, 44, 1089; F. Wang, J. Mecham, W. Harrison, J.E. McGrath Polymer Preprints 2000, 41, 1401; K.B. Wiles, V.A. Bhau, F. Wang, J.E. McGrath Polymer Preprints 2002, 43, 993; K.B. Wiles, C.M. de Diego, J.E. McGrath Polymer Preprints 2004, 45, 724.
Синтез этих полимеров осуществляют путем поликонденсации сульфированного дихлордифенилсульфона или дифтордифенилсульфона с тиобисбензолтиолом. Первое упоминание сульфированного мономера дихлордифенилсульфона или дифтордифенилсульфона имеет место в патенте L.M. Robeson, M. Matzner US Patent 4380598 (1983), или в публикации M. Udea, H. Toyota, T. Ochi, J. Sugiyama, K. Yonetake, T. Masuko, T. Teramoto J. Polym. Sci., Polym. Chem. 1993, 31, 853. Далее было описано большое число полимеризаций, исходя из сульфированных мономеров этого вида, например, в публикациях F. Wang, M. Hickner, Q. Ji, W. Harrison, J. Mecham, T.A.Zawodzinski, J.E. McGrath Macromol. Symp. 2001, 175, 387 и F. Wang, M. Hickner, Y.S. Kim, T.A.Zawodzinski, J.E. McGrath J. Membr. Sci. 2002, 197, 231, и W. Harrison, F. Wang, J.B. Mecham, V. Bhau, M. Hill, Y.S. Kim, J.E. McGrath J. Polym. Sci., Polym. Chem. 2003, 41, 2264; F. Wang, J. Li, T. Chen, J. Xu Polymer 1999, 40, 795; F. Wang, T. Chen, J. Xu Macromol. Chem. Phys. 1998, 199, 1421.
Наряду с этим, объектами некоторых патентов являются несульфированные полимеры со структурным звеном -SO2-Ar-SO2- (Ar = ароматический остаток, несульфированный), например, J. Studinka, R. Gabler, Polyarylene sulphonates from sulphonated polyarylene sulphide by two-stage oxidation in acid medium DE Patent 1938806A1 (1970), а также US Patenten 6020442 (2000), 6013761 (2000), 5496916 (1996), 5496917 (1996), и некоторых публикаций, как, например, D.R. Robello, A. Ulman, E. Urankar Macromol. 1993, 26, 6718 и H.M. Colquhoun, P. Aldred, F.H. Kohnke, P.L. Herbertson, I. Baxter, D.J. Williams Macromol. 2002, 35, 1685.
Механизм сульфирования ароматических соединений описан в публикации J.O. Morley, D.W. Roberts J. Org. Chem. 1997, 62, 7358-7363.
Специальные ссылки
[1] T.D. Dang, Z. Bai, M.J. Dalton, E. Fossum Polymer Preprints 2004, 45, 22.
[2] Z. Bai, L.D. Williams, M.F. Durstock, T.D. Dang, Polymer Preprints 2004, 45, 60.
[3] K.B. Wiles, V.A. Bhau, F. Wang, M.A. Hickner, J.E. McGrath Polymer Preprints 2003, 44, 1089.
[4] F. Wang, J. Mecham, W. Harrison, J.E. McGrath Polymer Preprints 2000, 41, 1401.
[5] K.B. Wiles, V.A. Bhau, F. Wang, J.E. McGrath Polymer Preprints 2002, 43, 993.
[6] K.B. Wiles, C.M. de Diego, J.E. McGrath Polymer Preprints 2004, 45, 724.
[7] J. Studinka, R. Gabler (Uitikon-Waldegg, CH) Polyarylene Sulphonates from Sulphonated Polyarylene Sulphide by Two-Stage Oxidation in Acid Medium DE 1938806A1 (1970).
[8] D. Fleischer, H. Strutz, J. Kulpe, A. Schleicher (Ticona GmbH, Germany), Oxidized Polyarylene Sulphides US 6020442 (2000).
[9] D. Zierer, H. Scheckenbach (Ticona GmbH, Germany), Oxidation of Polyarylene Sulphides US 6013761 (2000).
[10] D. Fleischer, H. Strutz, J. Kulpe, A. Schleicher (Hoechst Aktiengesellschaft, Germany), Process for Oxidizing Polyarylene Compounds Containing Thioether Groups US 5496916 (1996).
[11] D. Fleischer, H. Strutz, J. Kulpe, A. Schleicher (Hoechst Aktiengesellschaft, Germany), Two-Stage Oxidation of Polyarylene Sulphides US 5496917 (1996).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРИМИДИНЫ И ИХ ВАРИАНТЫ, И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2760733C2 |
| ПИРАЗОЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ FSHR И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2663898C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ КАРБОНУКЛЕОЗИДА, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕ ПРОТИВОРАКОВЫХ АГЕНТОВ | 2017 |
|
RU2712944C1 |
| СУЛЬФОНАМИДНЫЕ ПЕРИ-ЗАМЕЩЕННЫЕ БИЦИКЛЫ ДЛЯ ЛЕЧЕНИЯ ОККЛЮЗИОННОГО ПОРАЖЕНИЯ АРТЕРИЙ | 2005 |
|
RU2403240C2 |
| 6, 6-БИЦИКЛИЧЕСКИЕ КОЛЬЦЕВЫЕ ЗАМЕЩЕННЫЕ ГЕТЕРОБИЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗ | 2005 |
|
RU2379308C2 |
| СИНТЕЗ КАРБАМОИЛПИРИДОНОВЫХ ИНГИБИТОРОВ ИНТЕГРАЗЫ ВИЧ И ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2527451C2 |
| СОЕДИНЕНИЯ | 2019 |
|
RU2838187C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСОВ РУТЕНИЯ (0) С ОЛЕФИНОМ | 2010 |
|
RU2559322C2 |
| АМИНОПРОИЗВОДНЫЕ ОКСО- ИЛИ ГИДРОКСИЗАМЕЩЕННЫХ ГИДРАЗИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ РЕТРОВИРУСНОЙ ПРОТЕАЗЫ | 1993 |
|
RU2126794C1 |
| Производные 5,8-диметокси-6,7-метилендиокси кумарина, обладающие антирадикальной активностью | 2023 |
|
RU2814111C1 |
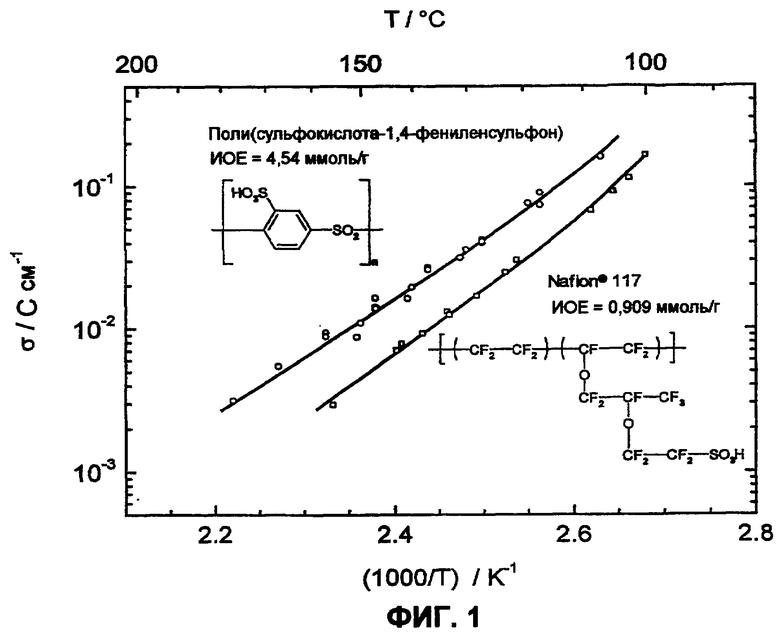
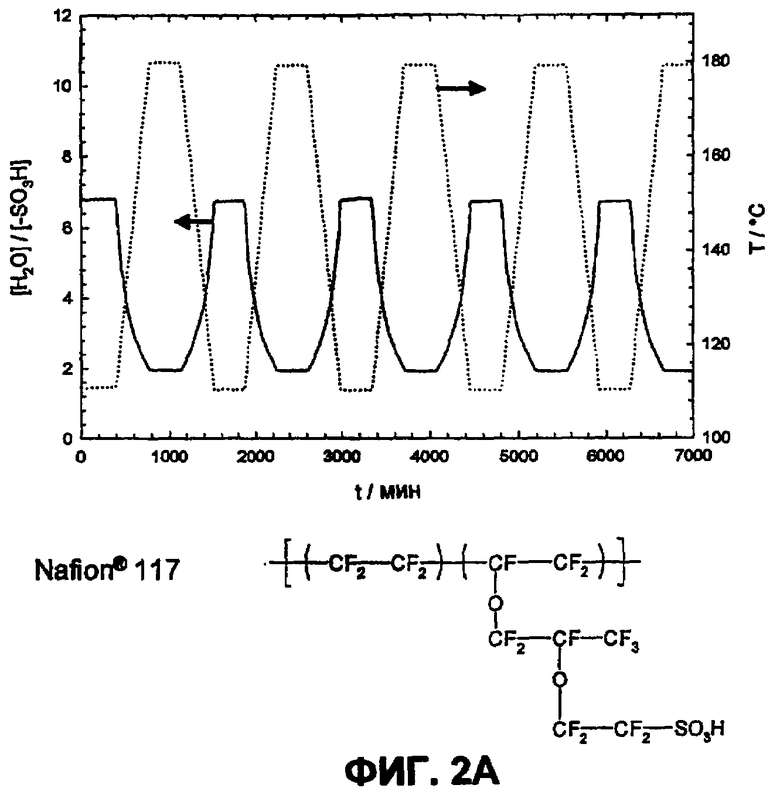
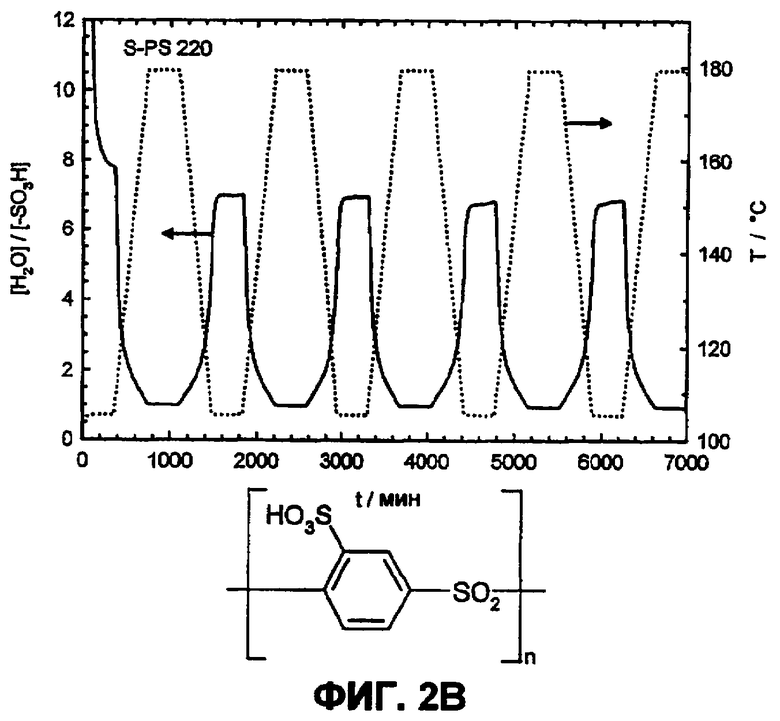
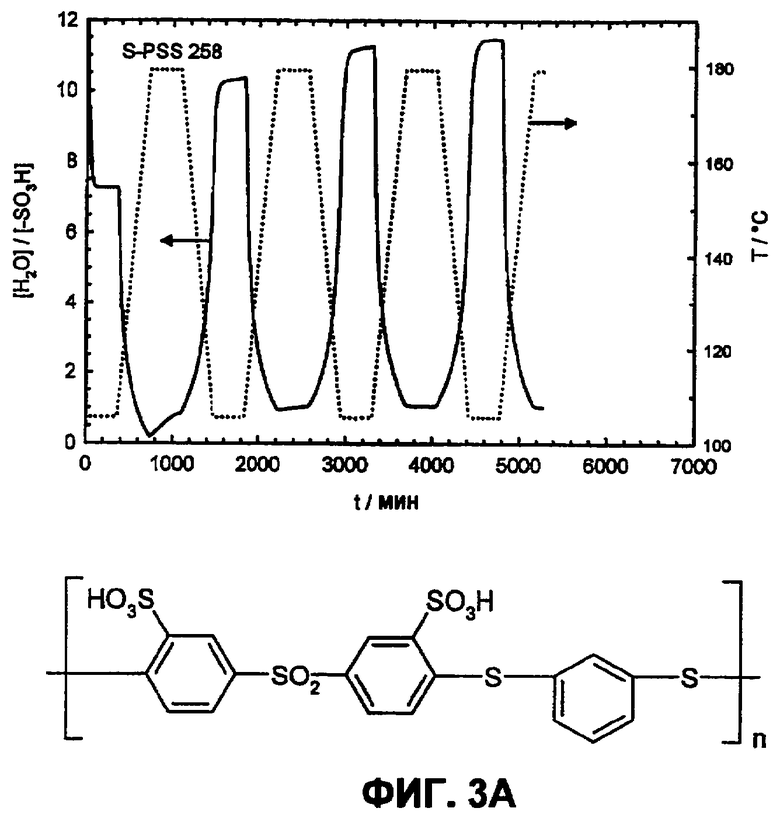
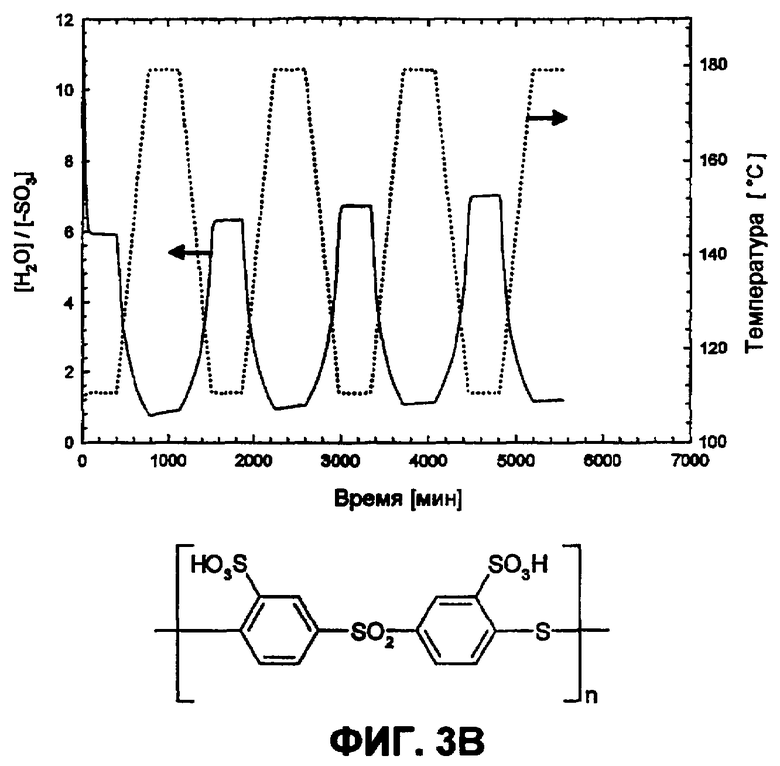
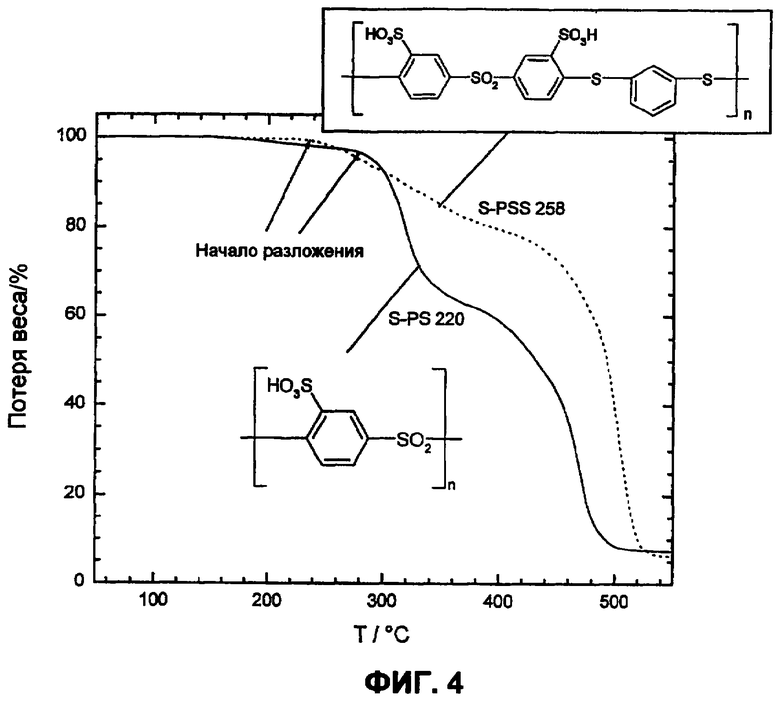
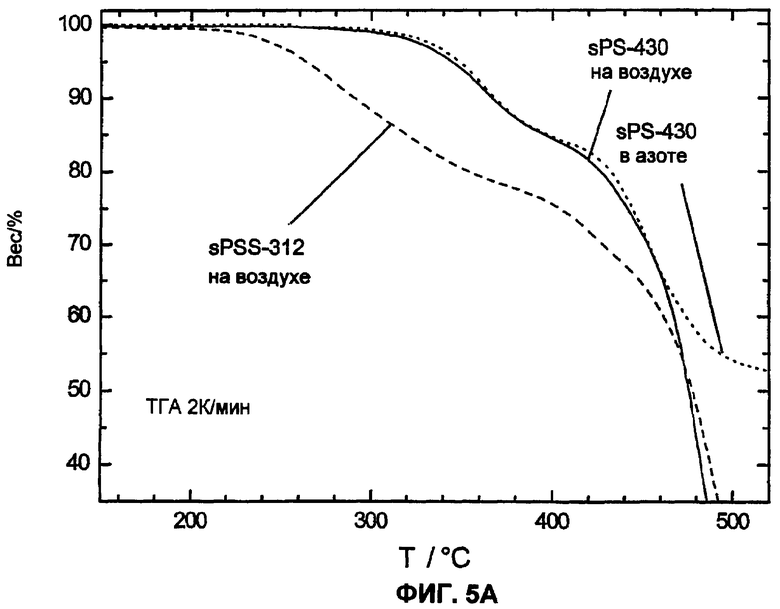
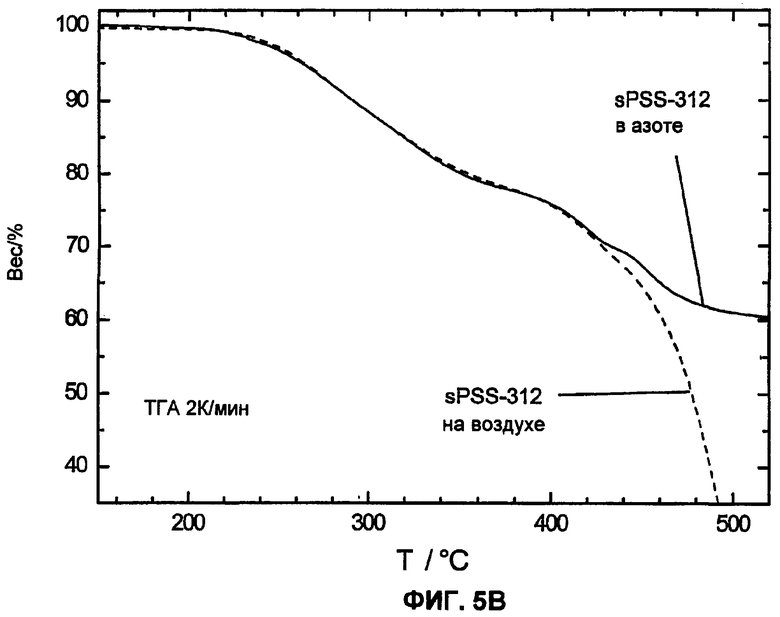
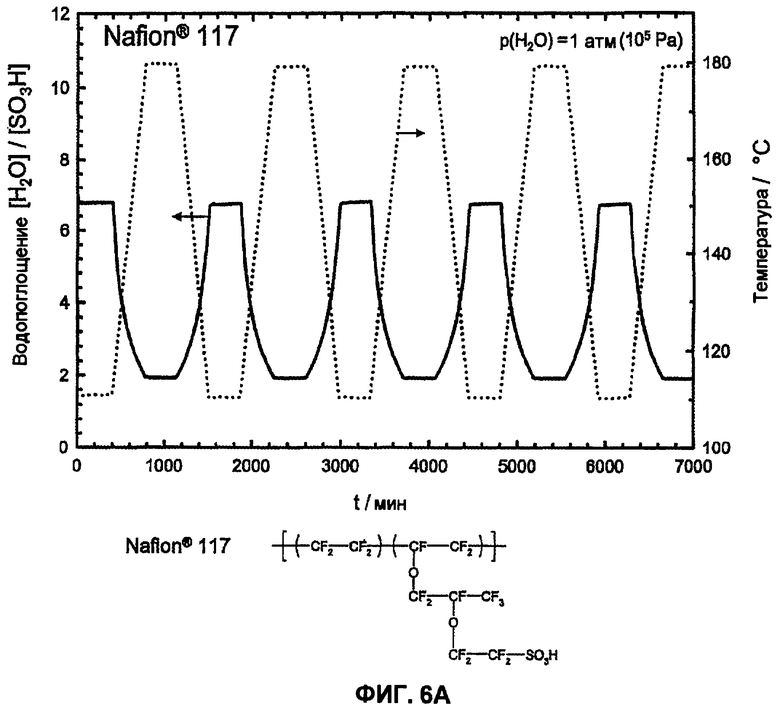
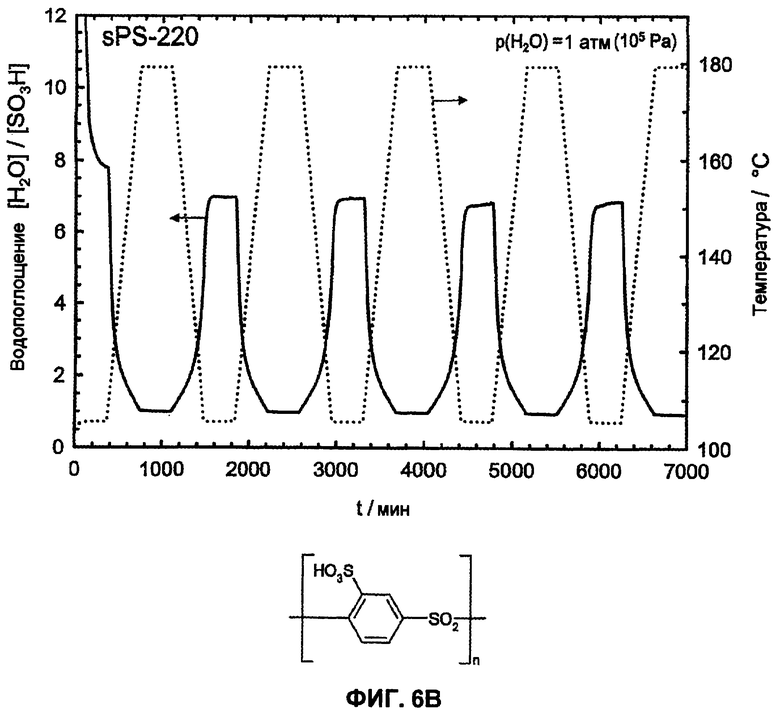
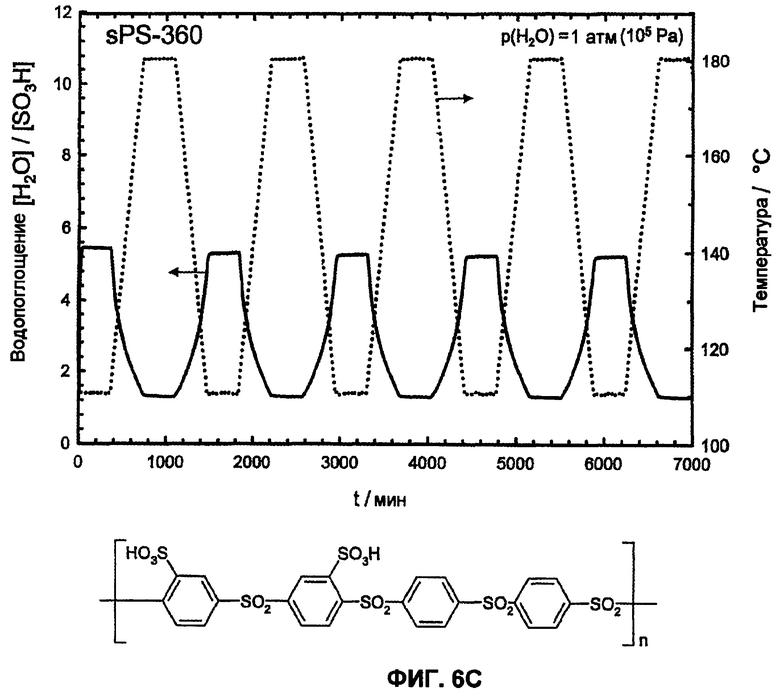
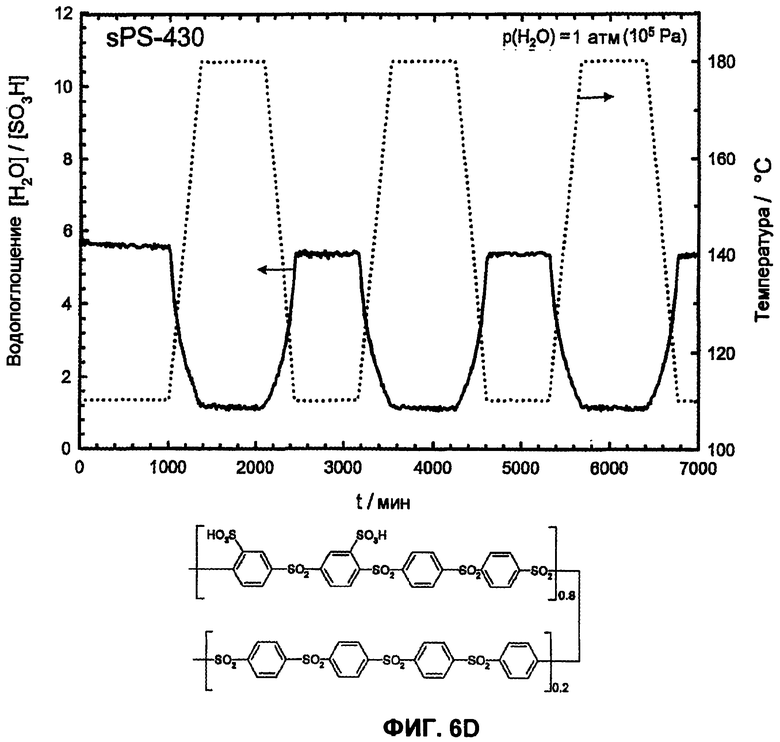
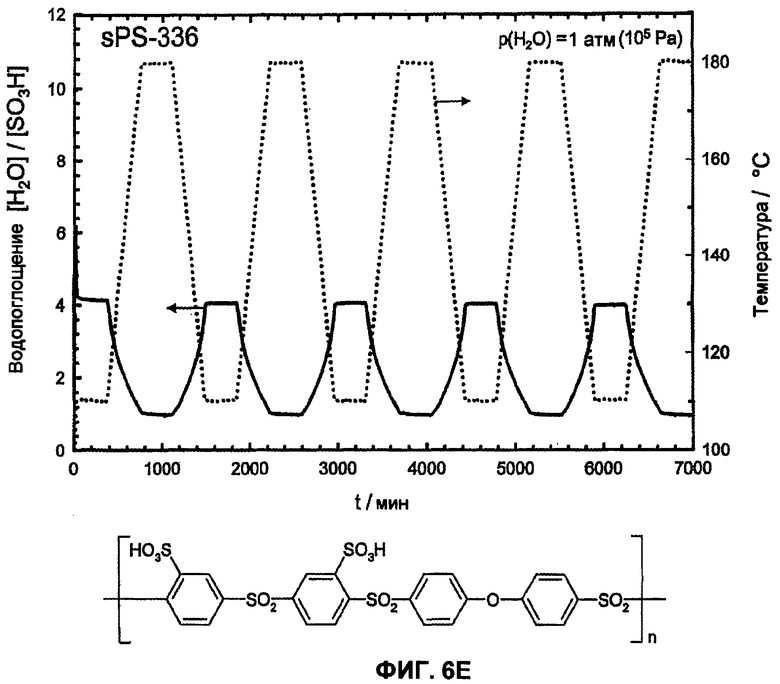
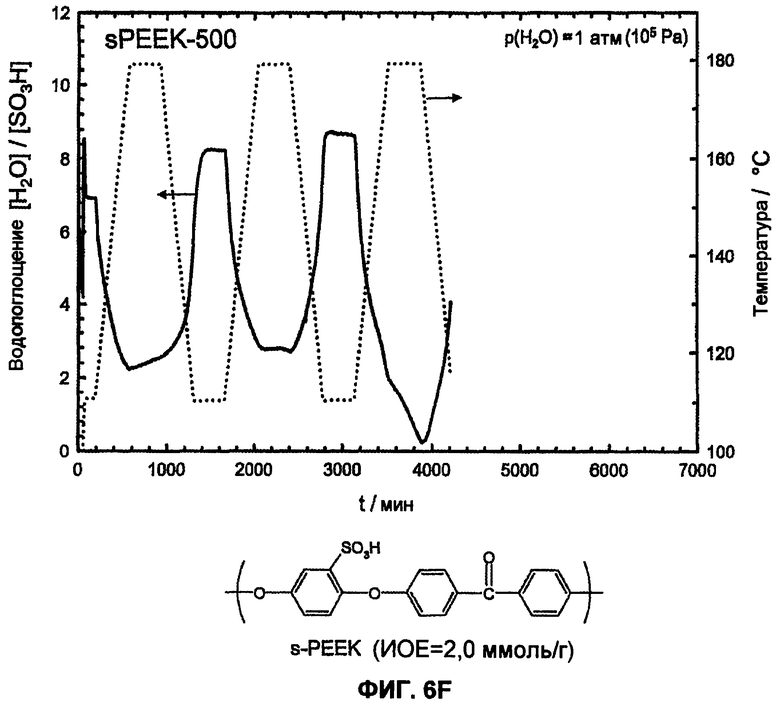
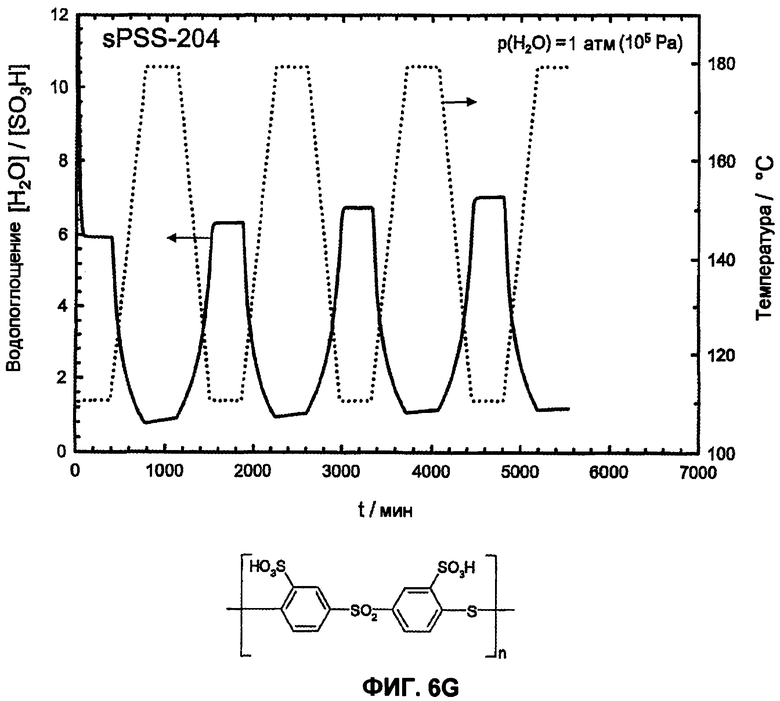
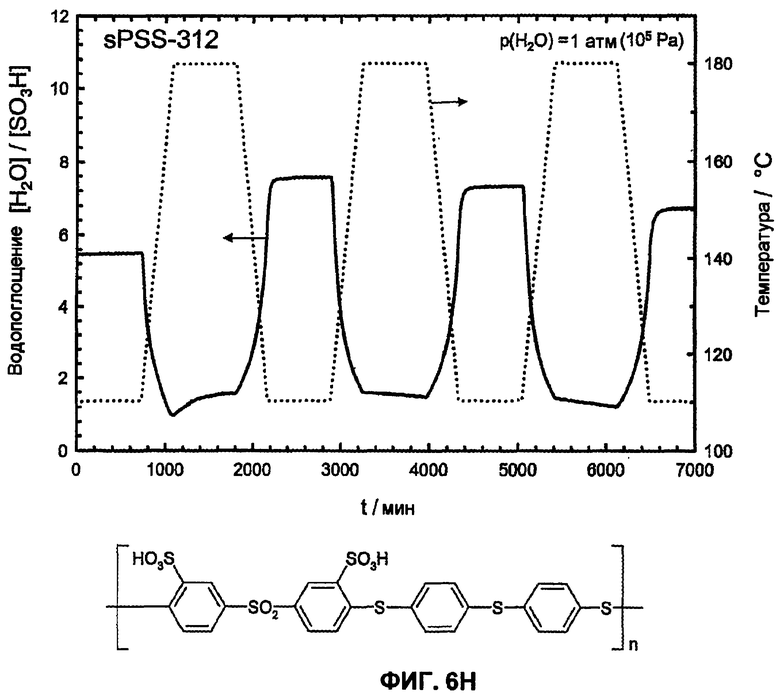
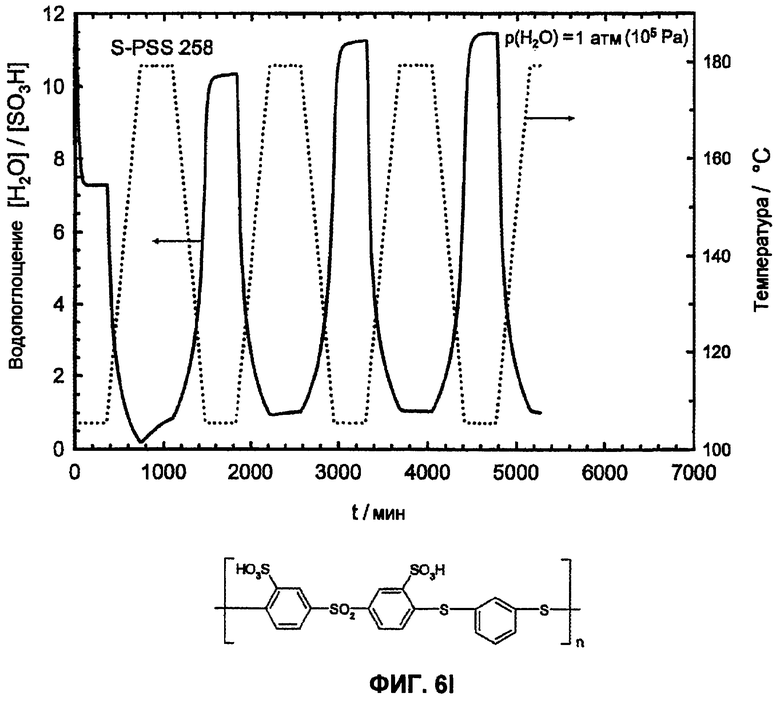
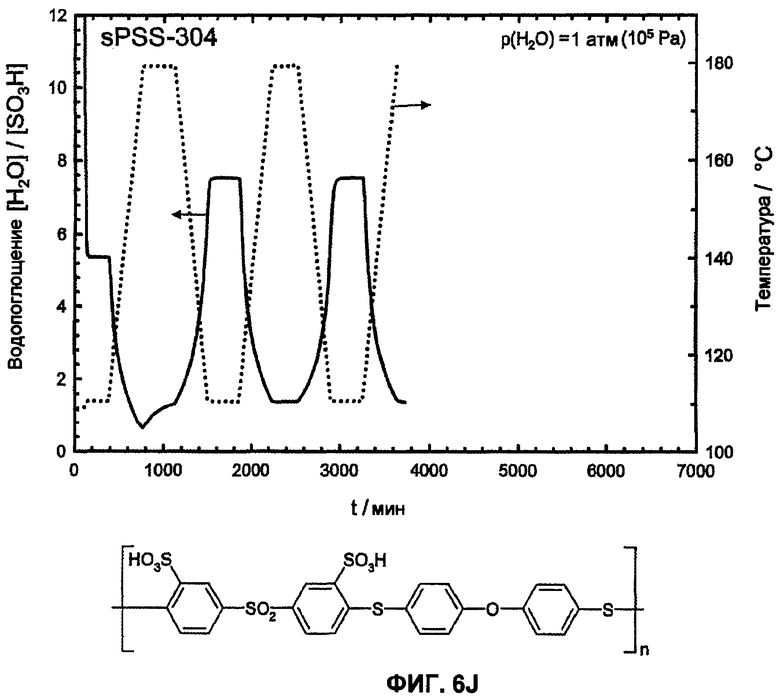
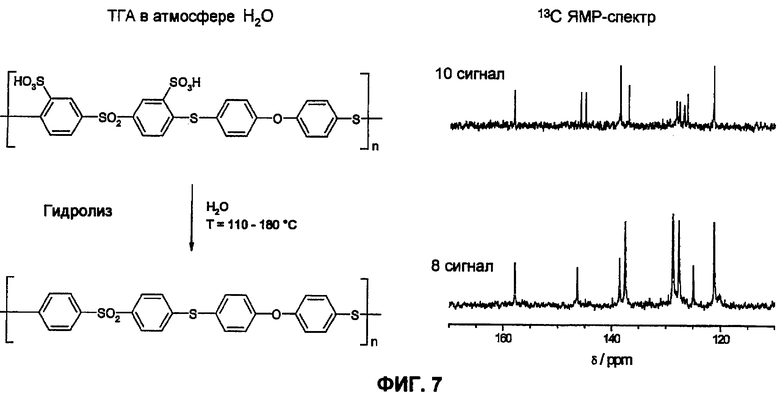
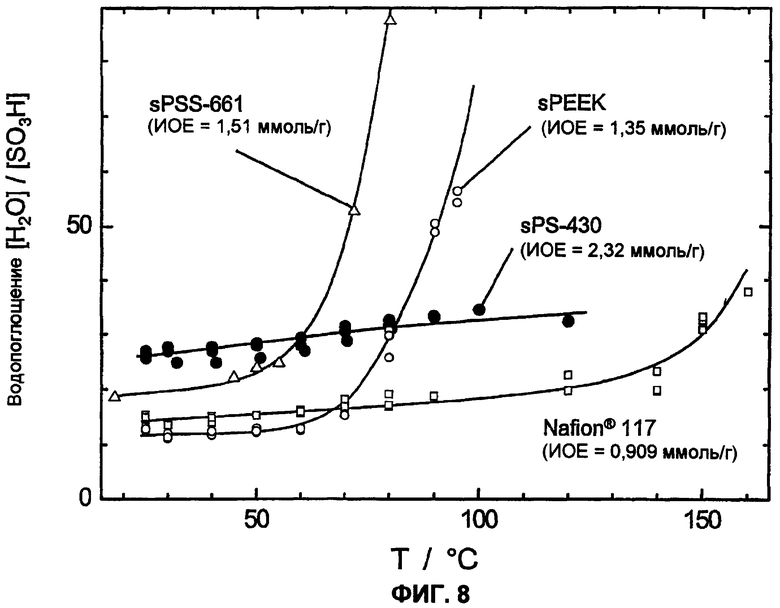
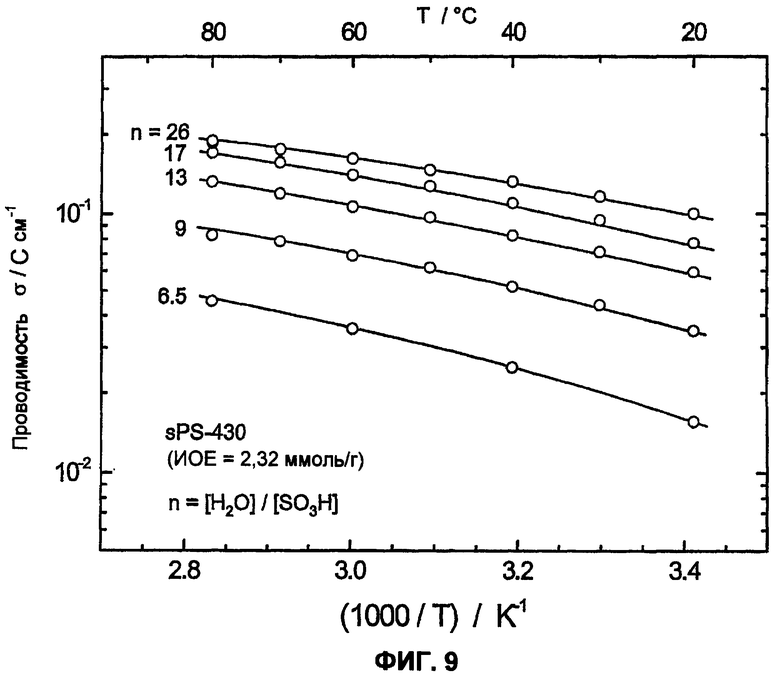
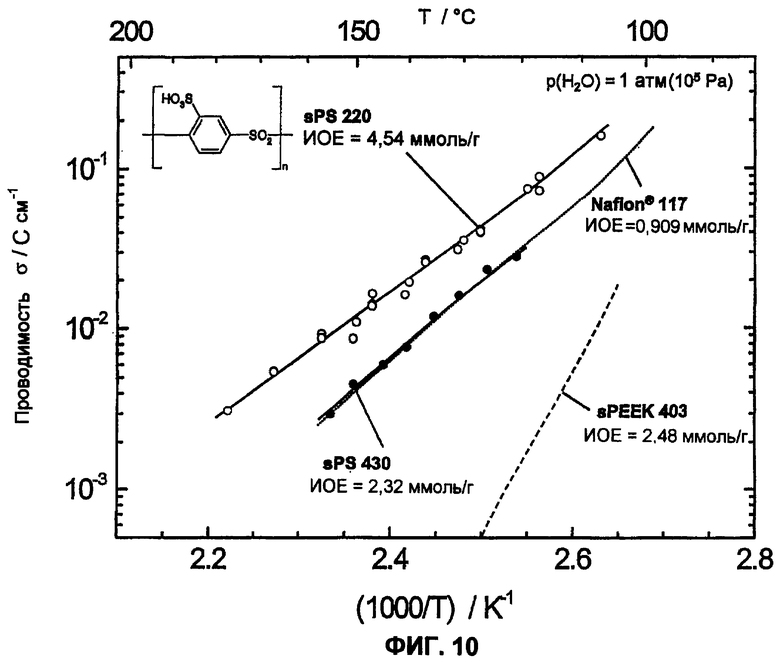
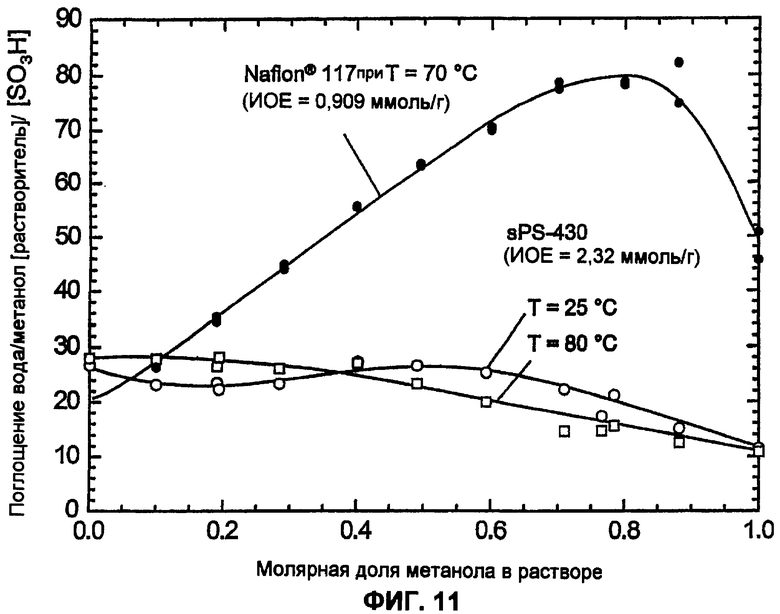
Настоящее изобретение относится к сульфированным поли(ариленам), их получению и использованию в мембранах, топливных элементах, электродиализе, увлажнении и осушении газов или для защиты от электромагнитного излучения. Предложенные сульфированные поли(арилены) содержат один или несколько структурных звеньев общей формулы -Х-Аr(SO3М)n-Y-, где Х и У выбраны из -SO2-, -SO-, -SO2O-, -СО-, -СОО-, -CONH-, -CONR- и -POR-, Аr выбран из фенилена, нафтилена, антрацена, фенантрена, бифенилена, фурана, тиофена, пиррола, тиазола, триазола, пиридина, имидазола и бензимидазола, которые помимо сульфокислотной группы и заместителей Х и У могут иметь заместители, которые не являются электронодонорными группами, М выбран из Li+, Na+, K+, NR4 +, PR4 + и Н+, n - целое число от 1 до 4, R означает алкил, который содержит исключительно повторяющиеся звенья формул -[Аr1(SO3М)n-Х-]- и -[Аr2(SO3М)n-Y-]-, где Ar1 и Ar2 означают ароматическую или гетероароматическую циклическую систему с 5-18 атомами в кольце, как определено выше для Аr, М и n такие, как определено выше. Технический результат - получение новых сульфированных поли(ариленов) и продуктов на их основе. 14 н. и 10 з.п. ф-лы, 23 ил.
1. Сульфированный поли(арилен), который содержит один или несколько структурных звеньев общей формулы -Х-Аr(SO3М)n-Y-, где Х и Y одинаковые или отличающиеся друг от друга, каждый означает электроноакцепторную группу, которая выбрана из группы, состоящей из -SO2-, -SO-, -SO2O-, -CO-, -СОО-, -CONH-,
-CONR- и -POR-, Аr означает ароматическую или гетероароматическую циклическую систему с 5-18 атомами в кольце, выбранную из группы, состоящей из фенилена, нафтилена, антрацена, фенантрена, бифенилена, фурана, тиофена, пиррола, тиазола, триазола, пиридина, имидазола и бензимидазола, причем ароматическая или гетероароматическая циклическая система помимо сульфокислотной группы и заместителей Х и Y может иметь еще заместители, которые не являются электронодонорными группами, М означает одновалентный катион, выбранный из группы Li+, Na+, К+, NR4 +, PR4 + и Н+ и n означает целое число от 1 до 4, причем X, Y, Аr, М и n независимо друг от друга в разных структурных элементах могут быть одинаковыми или разными, R означает алкил, отличающийся тем, что он содержит исключительно повторяющиеся звенья формул -[Ar1(SO3M)n-Х-]- и -[Ar2(SO3М)n-Y-]-, где Х и Y одинаковые или отличающиеся друг от друга каждый означает электроноакцепторную группу, какая определена выше, Аr1 и Аr2 одинаковые или отличающиеся друг от друга означают ароматическую или гетероароматическую циклическую систему с 5-18 атомами в кольце, как определено выше, М и n такие, как определено выше, и X, Y, Ar1, Ar2, M и n независимо друг от друга в разных структурных элементах могут быть одинаковыми или разными.
2. Сульфированный поли(арилен) по п.1, отличающийся тем, что n равно 1.
3. Сульфированный поли(арилен) по п.1, отличающийся тем, что Х и Y каждый означает -SO2.
4. Сульфированный поли(арилен) по п.1, отличающийся тем, что он содержит один или несколько следующих структурных элементов I, II или III
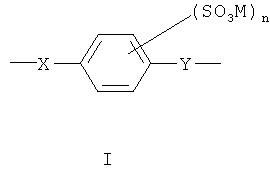
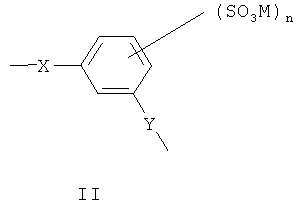
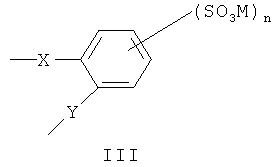
где X, Y, М и n определены, как в п.1.
5. Сульфированный поли(арилен), который содержит один или несколько структурных звеньев общей формулы -Х-Аr(SO3М)n-Y-, где X, Y, Аr, М и n определены, как указано в п.1, отличающийся тем, что помимо упомянутых звеньев, которые образуют структурный элемент или элементы общей формулы -Х-Аr(SO3М)n-Y-, он содержит одно или несколько звеньев формулы -[-Аr3-Z-]-, в которой Z может быть электронодонорной или электроноакцепторной группой или ни одной из них, и выбран из группы, состоящей из -SO2-, -SO-, -SO2O-, -CO-, -СОО-,
-CONH-, -CONR-, -POR-, -S-, или -O-, Аr3 означает ароматическую или гетероароматическую циклическую систему с 5-18 атомами в кольце без заместителей SO3М, причем Аr3 для каждого звена формулы -[-Аr3-Z-]-независимо выбран из группы, состоящей из фенилена, нафтилена, антрацена, фенантрена, бифенилена, фурана, тиофена, пиррола, тиазола, триазола, пиридина, имидазола и бензимидазола, и причем группы Аr3 и Z в разных звеньях -[-Аr3-Z-]- могут быть одинаковыми или разными, при условии, что группа Z может быть связана с сульфированной ароматической или гетероароматической циклической системой формулы Аr(SO3М)n, только если Z не является электронодонором.
6. Сульфированный поли(арилен) по п.5, отличающийся тем, что он имеет молекулярный вес в диапазоне от 2000 до 2000000.
7. Сульфированный поли(арилен) по п.6, отличающийся тем, что он имеет молекулярный вес в диапазоне от 10000 до 1000000.
8. Сульфированный поли(арилен) по пп.1-7, введенный в пористую матрицу.
9. Сульфированный поли(арилен) по пп.1-7 в комбинации с волокнистыми материалами, наполнителями или другими добавками.
10. Способ получения блок-сополимера, который помимо повторяющихся звеньев сульфированного поли(арилена) по одному из пп.1-7 содержит еще одно или несколько звеньев по меньшей мере одного другого мономера или макромономера, причем сульфированный поли(арилен) по одному из пп.1-7 может реагировать с по меньшей мере одним другим мономером или макромономером, и по меньшей мере один другой мономер или макромономер является α,ω-дигидрокси-соединением или α,ω-дигалогензамещенным соединением, где α,ω-дигидрокси-соединение имеет формулу HO-W-OH соответственно, α,ω-дигалогензамещенное соединение имеет формулу Hal-W-Hal, где W выбрано из группы, состоящей из: -(CH2)n-, (CF2)n-, -(CF2CH2)n-, -(СН2-СН2-O)n-СН2-СН2-, -(СН(СН3)-СН2-O)n-СН(СН3)-СН2-, -(CF2-CF2-O)n-CF2-CF2-, полиариленэфирсульфонов, полиариленэфиркетонов и полисилоксанов, и Hal означает галогенный остаток.
11. Блок-сополимер, получаемый способом по п.10, который в качестве повторяющегося звена содержит сульфированный поли(арилен) по п.7 с молекулярным весом в диапазоне от 10000 до 1000000.
12. Блок-сополимер по п.11 в комбинации с волокнистыми материалами, наполнителями или другими добавками.
13. Полимерная смесь, содержащая сульфированный поли(арилен) по одному из пп.1-7 или блок-сополимер по п.11 и по меньшей мере один другой полимер, причем по меньшей мере один другой полимер выбран из группы полимеров, состоящей из PBI (полибензимидазол), PTFE (политетрафторэтилен), PVDF (поливинилиденфторид), PSU (полисульфоны), PES (простые полиэфирсульфоны), РЕК (полиэфиркетоны), РРО (полифениленоксид), PPS (полифениленсульфид), PI (полиимиды), PC (поликарбонаты), РММА (полиметилметакрилаты), и полифосфазенов.
14. Полимерная смесь по п.13, введенная в пористую матрицу.
15. Полимерная смесь по п.13 в комбинации с волокнистыми материалами, наполнителями или другими добавками.
16. Способ получения сульфированного поли(арилена) по одному из пп.1-4, включающий
a) получение сульфированного арильного мономера F1-AS-F2, где AS означает арильную систему из одного или нескольких ароматических колец, выбранную из фенилена, нафтилена, антрацена, фенантрена, бифенилена, фурана, тиофена, пиррола, тиазола, триазола, пиридина, имидазола и бензимидазола, причем по меньшей мере одно ароматическое кольцо замещено сульфокислотной группой, причем арильная система содержит функциональные группы F1 и F2, выбранные из группы, состоящей из фтора, хлора, брома или йода, которые могут быть одинаковыми или отличающимися друг от друга, и может вступать в реакцию конденсации, или несколько других таких арильных мономеров;
b) поликонденсацию сульфированного арильного мономера или мономеров со стадии а) с образованием сульфированного поли(арилена), который содержит по меньшей мере один электронодонорный заместитель в сульфированном ароматическом кольце;
с) перевод по меньшей мере одного электронодонорного заместителя, выбранного из -S-, или -O-, в электроноакцепторный заместитель, выбранный из группы, состоящей из -SO2-, -SO-, -SO2O-, -СО-, -СОО-, -CONH-, -CONR- и -POR-, с образованием сульфированного поли(арилена), который содержит исключительно электроноакцепторные заместители в сульфированном ароматическом кольце.
17. Способ получения сульфированного поли(арилена), отличающийся тем, что в поликонденсации помимо одного или нескольких сульфированных арильных мономеров F1-AS-F2, какие определены в п.16, могут участвовать один или несколько арильных мономеров F1-ANS-F2, причем ANS означает арильную систему с одним или несколькими ароматическими кольцами, которые не замещены сульфокислотной группой, выбранную из фенилена, нафтилена, антрацена, фенантрена, бифенилена, фурана, тиофена, пиррола, тиазола, триазола, пиридина, имидазола и бензимидазола, причем эта арильная система содержит функциональные группы F1 и F2, какие определены в п.16, которые могут быть одинаковыми или отличающимися друг от друга, причем образуется частично сульфированный поли(арилен), который содержит по меньшей мере один электронодонорный заместитель, выбранный из -S-, или -O-, в сульфированном ароматическом кольце, и этот по меньшей мере один электронодонорный заместитель переводят в электроноакцепторный заместитель, выбранный из группы, состоящей из -SO2-, -SO-, -SO2O-, -СО-, -СОО-, -CONH-, CONR- и -POR, причем образуется частично сульфированный поли(арилен), который содержит исключительно электроноакцепторные заместители в сульфированном ароматическом кольце.
18. Способ получения сульфированного поли(ариленсульфона), включающий:
а) получение сульфированного арильного мономера, который имеет структурную формулу F1-Ara-SO2-Arb-F2, где Аrа или Аrb могут быть одинаковыми или разными, и каждый представляет собой ароматическую или гетероароматическую циклическую систему с 5-18 атомами в кольце, какая определена в п.1, при условии, что в по меньшей мере одном используемом арильном мономере Аrа и/или Аrb замещены по меньшей мере одной группой SО3М, где М определено выше, и функциональные группы F1 и F2 выбраны из группы, состоящей из фтора, хлора, брома или йода, которые могут быть одинаковыми или отличающимися друг от друга и которые могут реагировать в реакции конденсации с одной или несколькими сульфидными группами, или нескольких других таких арильных мономеров;
b) поликонденсацию сульфированного арильного мономера или арильных мономеров со стадии а) с арилдисульфидом или сульфидом щелочного металла с образованием сульфированного поли(ариленсульфидсульфона);
c) окисление сульфированного поли(ариленсульфидсульфона) со стадии b) до сульфированного поли(ариленсульфона).
19. Способ по п.18, отличающийся тем, что в поликонденсации помимо одного или нескольких сульфированных арильных мономеров, какие определены в п.18, участвуют один или несколько арильных мономеров F1-ANS-F2, где ANS означает арильную систему из одного или нескольких ароматических колец, которые не замещены группой сульфоновой кислоты, выбранную из фенилена, нафтилена, антрацена, фенантрена, бифенилена, фурана, тиофена, пиррола, тиазола, триазола, пиридина, имидазола и бензимидазола, причем арильная система содержит функциональные группы F1 и F2, какие определены в п.18, которые могут быть одинаковыми или отличающимися друг от друга,
причем образуется частично сульфированный поли(ариленсульфидсульфон), который содержит по меньшей мере один электронодонорный заместитель в сульфированном ароматическом кольце, и окисление частично сульфированного поли(ариленсульфидсульфона) в частично сульфированный поли(ариленсульфон), который содержит исключительно электроноакцепторные заместители в сульфированном ароматическом кольце.
20. Способ по п.18, отличающийся тем, что по меньшей мере у одного арильного мономера остатки Аra и/или Аrb замещены по меньшей мере одной группой SO3М, где М такое, как определено выше, а у по меньшей мере одного другого арильного мономера остатки Аrа и/или Аrb не замещены группой SO3М.
21. Применение сульфированного поли(арилена) по одному из пп.1-7 в качестве мембранного материала, в частности, как ионообменной мембраны, в топливных элементах, в частности в прямых метанольных топливных элементах (DMFC), или для электродиализа, диализа Доннана, электролиза, для увлажнения и осушения газов или для защиты от электромагнитного излучения.
22. Применение блок-сополимера по п.11 в качестве мембранного материала, в частности, как ионообменной мембраны, в топливных элементах, в частности DMFC-топливных элементах, или для электродиализа, диализа Доннана, электролиза, для увлажнения и осушения газов или для защиты от электромагнитного излучения.
23. Применение полимерной смеси по п.13 в качестве мембранного материала, в частности, в качестве ионообменной мембраны, в топливных элементах, в частности, DMFC-топливных элементах, или для электродиализа, диализа Доннана, электролиза, для увлажнения и осушения газов или для защиты от электромагнитного излучения.
24. Применение сульфированного поли(арилена) по п.8 или 9, или блок-сополимера по п.12, или полимерной смеси по п.14 или 15 в качестве мембранного материала, в топливных элементах, в частности DMFC-топливных элементах, или для электродиализа, диализа Доннана, электролиза, для увлажнения и осушения газов или для защиты от электромагнитного излучения.
| Электрогидравлический усилитель | 1987 |
|
SU1479714A1 |
| DANG T.D | |||
| ET ALL, Papers presented at the meeting - American chemical society | |||
| Division of polymer chemistry, vol | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| DE 1938806 A1, 12.02.1970 | |||
| Способ получения полиариленэфиро-СульфОНА | 1978 |
|
SU806697A1 |
Авторы
Даты
2011-07-10—Публикация
2006-03-07—Подача