Настоящее изобретение относится к новым соединениям и способам их получения. Указанные соединения являются антагонистами рецептора двойного действия (DARA) в отношении рецепторов ЕТА и АТ1. Изобретение также относится к комбинациям указанных новых соединений с ранее известными средствами. Изобретение также относится к применению указанных соединений и комбинаций для получения лекарственного средства для лечения артериальной гипертензии различных видов, уменьшения повреждения органов различного вида, лечения или профилактики диабетической нефропатии и лечения опосредуемых эндотелином и ангиотензином нарушений.
Артериальная гипертензия представляет собой все более распространяющееся состояние, имеющее большие медицинские и экономические последствия как для человека, так и для общества. Несмотря на наличие на рынке множества классов гипотензивных средств, более 40% пациентов, страдающих гипертензией, имеют кровяное давление, не поддающееся должному контролю, несмотря на лечение. Учитывая многофакторную природу сердечно-сосудистых заболеваний, включая артериальную гипертензию, одновременное нацеливание более чем на один физиологический механизм представляется вероятной стратегией для достижения лучших эффектов.
С открытием того факта, что ангиотензин (Ang-II) и его рецептор AT1 являются мишенью для лечения артериальной гипертензии и сердечной недостаточности, возрос интерес к биологическому действию других вазоактивных пептидов. Сердечно-сосудистый гомеостаз включает перекрестный обмен между ренин-ангиотензивной и эндотелиновой системами, причем каждая система усиливает ответ другой. Таким образом, Ang-II стимулирует синтез мРНК препроэндотелина и высвобождение ЕТ-1. ЕТ-1 опосредует часть Ang-II-индуцированной избыточной пролиферации клеток, характерной для повреждения концевых органов. Предварительное лечение с помощью антагониста рецептора ЕТА снижает повышение кровяного давления, вызванное инфузией Ang-II.
Взаимодействие ренин-ангиотензивной и эндотелиновой систем, двух основных вазоактивных систем делает поэтому комбинированную мишень особенно привлекательной. Смешанный антагонист эндотелина-ангиотензина не только усиливает гипотензивный эффект блокады АТ1, но также снижает серьезность повреждения концевых органов, как показано на нескольких крысиных моделях артериальной гипертензии. Так, субэффективная доза антагониста рецептора АТ1 лозартана приводила к нормализации кровяного давления при использовании в комбинации с антагонистом ЕТА, и данная комбинация также уменьшала гипертрофию сердечной мышцы и увеличивала выживаемость по сравнению с лечением только лозартаном (Bohlender J. et a1, Hypertension 2000:35:992-7).
Причин для того, чтобы предпочесть использование антагониста рецептора двойного действия, а не фиксированной комбинации, несколько. Во-первых, с регулирующей точки зрения, каждое соединение в фиксированной комбинации должно быть задокументировано в монотерапии. После этого фиксированная комбинация должна быть задокументирована клинически в факториальном исследовании и в дополнительных исследованиях. Также с этими двумя препаратами в комбинации должны быть проведены токсикологические исследования. Напротив, антагонист рецептора двойного действия может быть задокументирован обычным для нового соединения способом.
Во-вторых, включение антагониста ЕТА в фиксированную комбинацию не представляется целесообразным, так как большинство антагонистов ЕТА оказывают токсикологическое действие. Во избежание неблагоприятных эффектов, свойственных блокаде ЕТА, новый антагонист рецептора двойного действия должен иметь более высокое сродство к АТ1, чем к ЕТА. Однако сродство к ЕТА не должно быть нулевым. Таким образом, новый антагонист рецептора двойного действия обладает активностью как в отношении рецепторов ЕТА, так и в отношении АТ1. Кроме того, во избежание блокады положительных действий, осуществляемых через рецептор ETB (сосудорасширение, натрийурез и клиренс ЕТ-1) и через рецепторы AT2 (сосудорасширение и анти-пролиферативные эффекты), новые соединения должны предпочтительно выборочно иметь мишенью только рецепторы ЕТА и АТ1.
Ранее было известно применение антагонистов эндотелина и антагонистов ангиотензина II, которые не являются двойными антагонистами АТ1 и ЕТА, для лечения артериальной гипертензии. Например, в WO98/49162 на имя Texas Biotechnology Corp. раскрыты гетероароматические сульфамиды в качестве антагонистов эндотелина. Аналогично, в ЕР 513979 А1 на имя Merck and Co., Inc. раскрыты антагонисты ангиотензина II, включающие замещенный тиофен или фуран.
Bristol-Myers Squibbs описаны несколько серий двойных рецепторов (Jae et al., Pyrrolidine-3-carboxylic acids as Endothelin antagonist. 5. Highly selective, potent and orally active ETA antagonist. J. Med. Chem. 2001, 44: 3978-3984; Tellew et al., Discovery of 4'-[(Imidazol-1-ил)methyl]biphenyl-2-sulphonamids as dual endothelin/angiotensin II receptor antagonists. Bio. & Med. Chem. Lett, 2003, 13: 1093-1096, US2002143024, WOOO/001389 and WO01/044239).
Однако соединения согласно настоящему изобретению не были ранее раскрыты. Кроме того, показано, что селективность соединений согласно настоящему изобретению обладает неожиданной селективностью для АТ1 по сравнению с ЕТА, т.e. отношение между сродством к АТ1 и ЕТА.
Одним объектом настоящего изобретения является соединение формулы
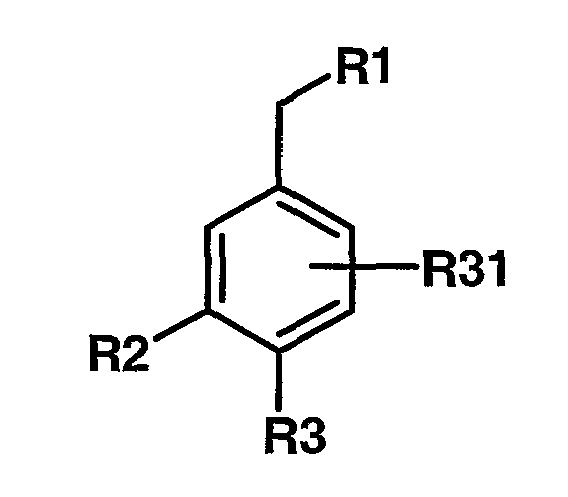
где R3 имеет любую из формул
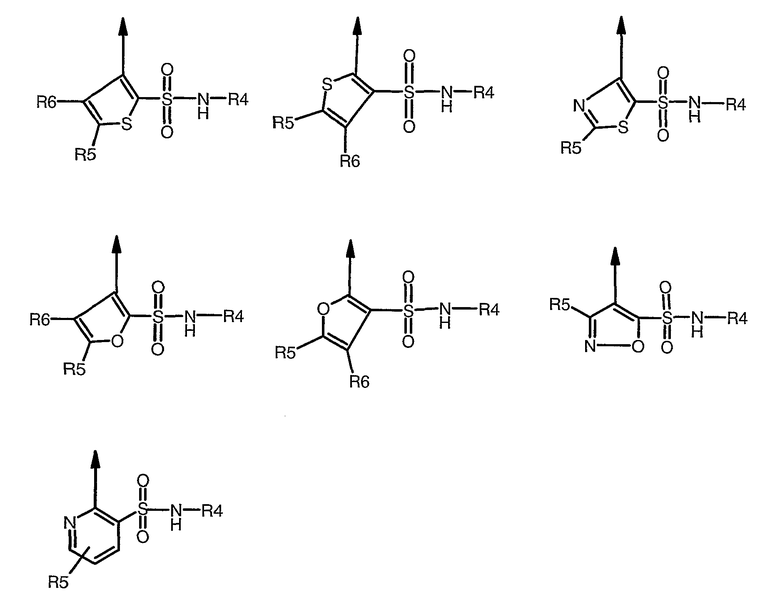

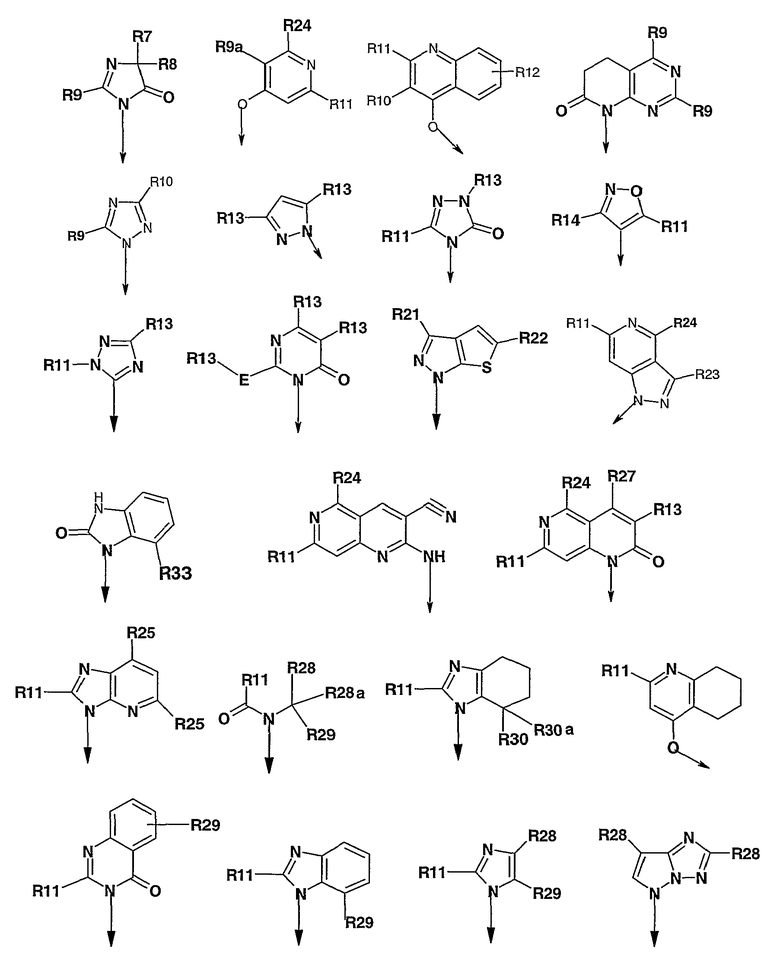
где R1 выбран из
где
R2, каждый независимо, означает водород, галоген, C1-C8алкил, галоген-C1-C8алкил, C3-C8циклоалкил, C2-C8алкенил, C2-C8алкинил, C1-C8алкокси-C1-C8алкил, C1-C8алкокси, арилокси, C1-C8алкокси-C1-C8алкокси, циано, гидроксил, гидрокси-C1-C8алкил, нитро, -(CH2)WNR18R19, где w равен 0, 1, 2 или 3, и R18 и R19 независимо означают водород, C1-C8алкил, арил, арил-C1-C8алкил, гетероарил, гетероарил-C1-C8алкил или могут вместе образовывать пяти- или шестичленную насыщенную или ненасыщенную кольцевую структуру, необязательно содержащую один-два гетероатома, выбранных из кислорода, серы или азота, и могут быть необязательно замещены C1-C8алкилом, гидроксилом или оксогруппой;
R4 означает пяти- или шестичленную моно- или бициклическую кольцевую систему, имеющую от одного до трех гетероатомов, выбранных из O, N и S, такую как пиридил, пиримидил, пиразинил, пиридазинил, триазинил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, оксадиазолил, имидазолил, триазолил, тетразолил и пиридотиазолил, каждый из которых может быть необязательно замещен одним или несколькими из следующих заместителей: водородом, галогеном, циано, C1-C8алкилом, C1-C8алкокси, трифторметилом и -COR32;
R5 и R6 независимо означают водород, галоген, C1-C8алкил, -COOR13, -СО-NR18R19, циано и -NR18R19, или R5 и R6 могут вместе образовывать пяти- или шестичленное циклоалкильное, арильное кольцо или гетероарильную кольцевую структуру, имеющую один-два гетероатома, выбранных из O, N и S, которая может быть дополнительно замещена C1-C8алкилом, C1-C8алкокси или гидрокси; где R18 и R19 независимо выбраны из водорода, C1-C8алкила, арил-C1-C8алкила, гетероарил-C1-C8алкила, (C3-C8циклоалкил)-C1-C8алкила, или могут вместе образовывать пяти- или шестичленную насыщенную кольцевую структуру, необязательно содержащую один-два гетероатома, выбранных из O, N и S;
R7 и R8, каждый независимо, означает C1-C8алкил, гидрокси-C1-C8алкил, C3-C8циклоалкил, гидроксизамещенный C3-C8циклоалкил, C1-C8алкокси-C1-C8алкил, гидроксизамещенный C1-C8алкокси-C1-C8алкил, или R7 и R8 вместе образуют циклобутильное, циклопентильное, циклогексильное, тетрагидрофуранильное или тетрагидропиранильное кольцо, которое может быть необязательно замещено одной или несколькими гидроксильными группами;
R9 независимо означает C1-C8алкил, гидрокси-C1-C8алкил, гидроксизамещенный галоген-C1-C8алкил, C3-C8циклоалкил, (C3-C8циклоалкил)-C1-C8алкил, арил-C1-C8алкил, C1-C8алкокси, гидроксизамещенный C1-C8алкокси, C1-C8алкокси-C1-C8алкил, гидроксизамещенный C1-C8алкокси-C1-C8алкил, C1-C8алкилкарбонил, арилкарбонил, карбокси, C1-C8алкоксикарбонил и гетероарил-C1-C8алкил;
R9a независимо означает C1-C8алкил, C1-C8алкокси-C1-C8алкил, C1-C8алкилкарбонил, арилкарбонил, гетероарилкарбонил, карбокси, C1-C8алкокси и -COOR13;
R10 означает водород, C1-C8алкил, (C3-C8циклоалкил)-C1-C8алкил или арил-C1-C8алкил;
R11 независимо означает C1-C8-алкил, C1-C8алкокси, арил-C1-C8алкил, гетероарил-C1-C8алкил и (C3-C8циклоалкил)-C1-C8алкил;
R12 означает водород, галоген, C1-C8алкил, -COOR17, C1-C8алкил-C1-C8тиоалкил, C1-C8алкокси или C1-C8алкокси-C1-C8алкил, нитро, NHR24;
R13 независимо означает водород, C1-C8алкил, арил и гетероарил;
R14 независимо означает водород, C1-C8алкил, арил, NHCOR13 и NR18R19, где R18, R19 независимо выбраны из водорода, C1-C8алкила, арил-C1-C8алкила или могут вместе необязательно образовывать пяти- или шестичленную насыщенную кольцевую структуру, необязательно содержащую один-два гетероатома, выбранных из O, N и S;
E означает простую связь, -(CH2)- или -S-;
R17 означает водород, C1-C4алкил, необязательно замещенный арилом;
R21 означает
(a) C1-C8алкил, галоген-C1-C8алкил, арил-C1-C8алкил или гетероарил-C1-C8алкил,
(b) -(CH2)NR18R19, где R18 и R19 независимо означают водород, C1-C8алкил, арил, гетероарил или могут вместе образовывать пяти- или шестичленную насыщенную или ненасыщенную кольцевую структуру, необязательно содержащую один-два гетероатома, выбранных из O, N и S,
(c) арил или
(d) гетероарил;
R22 означает
(a) -CO2R13, -CO2-C1-C8алкил, -СО-NR18R19 или
(b) -(CH2)NR18R19, где R18 и R19 независимо означают водород, C1-C8алкил, арил, гетероарил или могут вместе образовывать пяти- или шестичленную насыщенную или ненасыщенную кольцевую структуру, необязательно содержащую один-два гетероатома, выбранных из O, N и S;
R23 означает
(a) водород, C1-C8алкил, арил, C1-C8алкокси, галоген, гетероарил, гетероарил-C1-C8алкил, C3-C6циклоалкил, (C3-C8циклоалкил)-C1-C8алкил, -CH2COOR13, -CH2CONHR13 или трифторметил, где любой арильный и гетероарильный остатки необязательно замещены водородом, галогеном, C1-C8алкилом, C1-C8алкокси, циано, трифторметилом, нитро, амино, -NHSO2-R13, -SO2NHR13, -COOR13, - CONHR13, или
(b) -(CH2)NR18R19, где R18 и R19 независимо означают водород, C1-C8алкил, арил, гетероарил или могут вместе образовывать пяти- или шестичленную насыщенную или ненасыщенную кольцевую структуру, необязательно содержащую один-два гетероатома, выбранных из кислорода, серы и азота, арил и гетероарил, необязательно замещенный водородом, галогеном, C1-C8алкилом, C1-C8алкокси, циано, трифторметилом, нитро, амино, -NHSO2-R14, -SO2NHR24, COOH, -COOR17 или -CONHR14;
R24 означает
C1-C8алкил, C1-C8алкокси, арил, гетероарил, арил-C1-C8алкил, гетероарил-C1-C8алкил, (C3-C8циклоциклоалкил)-C1-C8алкил и трифторметил, где любой арильный и гетероарильный остатки необязательно моно- или дизамещены галогеном, C1-C8алкилом, C1-C8алкокси, циано, трифторметилом, нитро, амино, -NHSO2-R13, -SO2NHR13, COOR13, -CONHR13, -(CH2)NR18R19, где R18 и R19 независимо означают водород, C1-C8алкил или могут вместе образовывать пяти- или шестичленную насыщенную или ненасыщенную кольцевую структуру, необязательно содержащую один-два гетероатома, выбранных из O, N и S;
R25 независимо означает C1-C6алкил, (C3-C6циклоалкил)-C1-C8алкил;
R27 означает Н, арил, гетероарил, C1-C8алкил, C1-C8алкокси, O-арил, O-гетероарил, S-арил, S-гетероарил или NR18R19, где R18 и R19 независимо выбраны из Н, C1-C8алкила, гетероарил-C1-C8алкила, (C3-C8циклоалкил)-C1-C8алкила или могут вместе образовывать пяти- или шестичленную насыщенную кольцевую структуру, необязательно содержащую один-два гетероатома, выбранных из O, N и S, которая может быть дополнительно замещена C1-C8алкилом, где арильный и гетероарильный остатки необязательно моно- или дизамещены галогеном, C1-C8алкилом, C1-C8алкокси, трифторметилом;
R28 и R28a, каждый независимо, означает водород, галоген, C1-C8алкил, гидрокси-C1-C8алкил, C3-C8циклоалкил, (C3-C8циклоалкил)-C1-C8алкил, арил, гетероарил, арил-C1-C8алкил, C1-C8алкил-C1-C8тиоалкил, C1-C8алкокси, C1-C8алкокси-C1-C8алкил или R28 и R28a вместе с атомом углерода, к которому они присоединены, образуют C3-C8циклоалкильное кольцо;
R29 означает
(a) -(CH2)w-COOR17,
(b) -(CH2)w-(C=O)NR18R19, где R18 и R19 независимо выбраны из Н, C1-C8алкила, арила, гетероарила, или R18 и R19 могут вместе образовывать пяти- или шестичленную насыщенную кольцевую структуру, содержащую один или два гетероатома, выбранных из O, N и S, где арильный или гетероарильный остатки могут быть моно- или дизамещены галогеном, C1-C8алкилом, C1-C8алкокси и трифторметилом или
(c) -(CH2)W-CH2-OH, где w равен 0,1 или 2;
R30 и R30a, каждый независимо, означает водород, C1-C8алкокси или вместе образуют карбонил;
R31, каждый независимо, означает водород, галоген, C1-C8алкил, C1-C8алкокси-C1-C8алкил, циано, гидрокси, гидрокси-C1-C8алкил, C2-C8алкинил и галоген-C1-C8алкил;
R32 означает C1-C6алкил, C3-C6циклоалкил, арил и гетероарил; и
R33 означает C1-C8алкоксикарбонил;
включая его фармацевтически приемлемые соли, гидраты, сольваты, атропоизомеры, энантиомеры, диастереомеры, таутомеры, полиморфы и пролекарства.
В другом варианте осуществления настоящее изобретение относится к соединению, как определено выше, однако включая только его фармацевтически приемлемые соли.
В другом варианте осуществления настоящее изобретение относится к соединению, как определено выше, где R3 имеет любую из формул
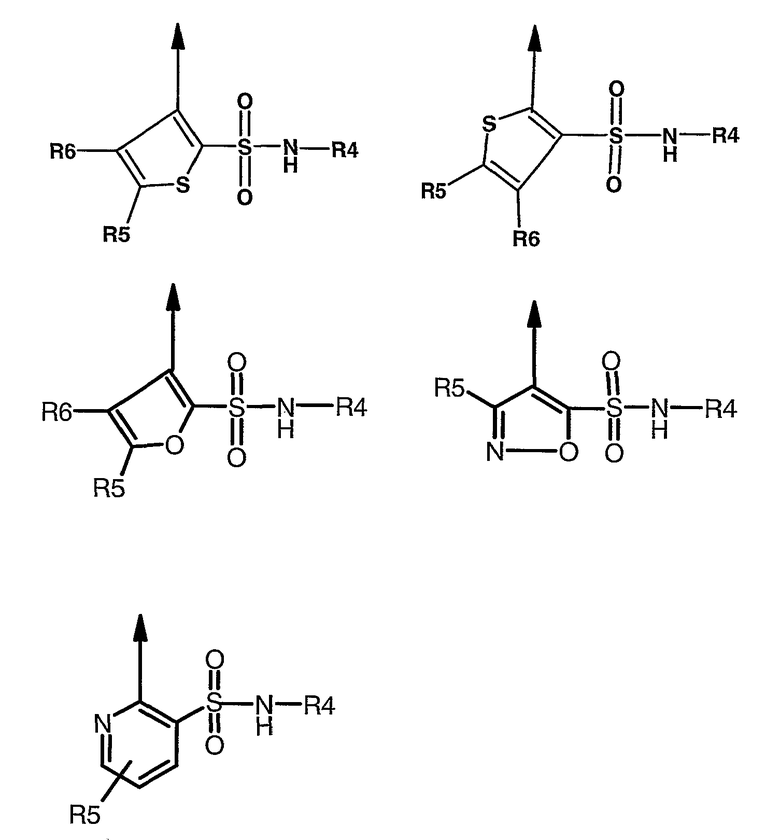
где R1 выбран из
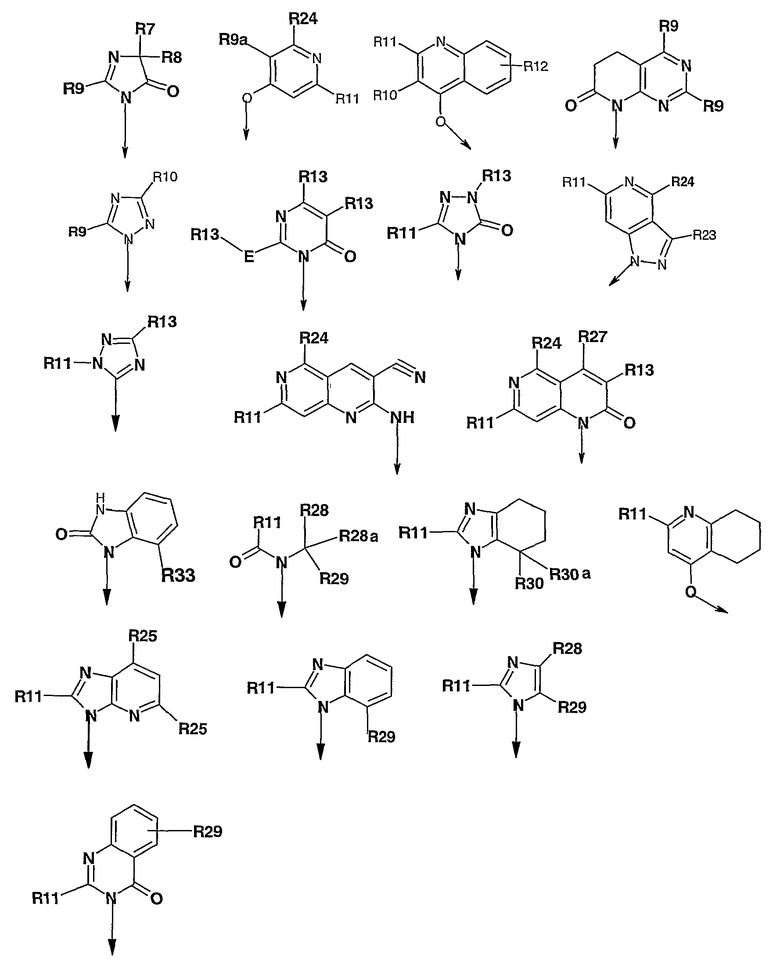
где
R2, каждый независимо, означает водород, галоген, C1-C8алкил, C1-C8алкокси-C1-C8алкил, C1-C8алкокси, C1-C8алкокси-C1-C8алкокси, гидроксил, гидрокси-C1-C8алкил, -(CH2)WNR18R19, где w равен 1, и R18 и R19 образуют пяти- или шестичленную насыщенную или ненасыщенную кольцевую структуру, необязательно содержащую от одного до двух гетероатомов, выбранных из кислорода, серы или азота, и может быть необязательно замещен C1-C8алкилом или оксогруппой;
R4 означает пяти- или шестичленную моно- или бициклическую кольцевую систему, имеющую один-три гетероатома, выбранных из O, N и S, такую как пиридил, пиримидил, пиразинил, пиридазинил, изоксазолил, тиазолил, тиадиазолил, тетразолил и пиридотиазолил, каждый из которых может быть необязательно замещен одним или несколькими из следующих заместителей: водородом, галогеном, C1-C8алкилом, C1-C8алкокси,
R5 и R6 независимо означают водород, C1-C8алкил, или
R5 и R6 могут вместе образовывать пяти- или шестичленное циклоалкильное или арильное кольцо, которое может быть дополнительно замещено C1-C8алкилом;
R7 и R8 вместе образуют циклобутил, циклопентил или циклогексил;
R9 означает C1-C8алкил;
R9a независимо означает C1-C8алкил, C1-C8алкокси-C1-C8алкил, C1-C8алкилкарбонил, арилкарбонил, гетероарилкарбонил, карбокси и -COOR13;
R10 означает водород, C1-C8алкил или (C3-C8циклоалкил)-C1-C8алкил;
R11 независимо означает C1-C8-алкил, C1-C8алкокси, арил-C1-C8алкил, гетероарил-C1-C8алкил и (C3-C8циклоалкил)-C1-C8алкил;
R12 означает водород, C1-C8алкокси или -COOR17;
R13 означает водород, C1-C8алкил, арил или гетероарил;
E означает простую связь;
R17 означает водород;
R23 означает водород, C1-C8алкил, арил, C1-C8алкокси, галоген, гетероарил, гетероарил-C1-C8алкил, C3-C6циклоалкил или трифторметил, где любой арильный и гетероарильный остатки необязательно замещены водородом, галогеном, C1-C8алкилом, C1-C8алкокси, трифторметилом;
R24 означает C1-C8алкил, арил, гетероарил, арил-C1-C8алкил, гетероарил-C1-C8алкил, (C3-C8циклоалкил)-C1-C8алкил и трифторметил, где любой арильный и гетероарильный остатки необязательно моно- или дизамещены галогеном, C1-C8алкилом, C1-C8алкокси или трифторметилом;
R25 означает C1-C6алкил, и
R27 означает Н, арил, гетероарил, C1-C8алкил, C1-C8алкокси, O-арил, О-гетероарил, S-арил или NR18R19, где R18 и R19 образуют пяти- или шестичленную насыщенную кольцевую структуру, необязательно содержащую один-два гетероатома, выбранных из O, N и S, которая может быть дополнительно замещена C1-C8алкилом;
R28 и R28a, каждый независимо, означает водород, галоген или C1-C8алкил;
R29 означает -COOH;
R30 и R30a вместе образуют карбонил;
R31 означает галоген и
R33 означает C1-C8алкоксикарбонил.
Конкретные примеры соединений приведены в примерах 1-104.
Другим объектом настоящего изобретения является способ получения соединения, как определено выше, включающий по меньшей мере одну из следующих стадий:
a) взаимодействие тиофена с сульфурилгалогенидом с получением тиенилсульфурилгалогенида,
b) взаимодействие тиенилсульфурилгалогенида с первичным амином с получением сульфонамида,
c) N-защиту сульфонамида с получением N-защищенного сульфонамида,
d) литиирование галогенированного тиофена с получением литиированного тиофена,
e) сочетание литиированного тиофена с галогензамещенным сложным алкиловым эфиром ароматической карбоновой кислоты или ароматическим альдегидом с получением арилтиенилового сложного эфира или альдегида,
f) восстановление арилтиенилового сложного эфира или альдегида с получением арилтиенилового спирта,
g) преобразование гидроксильной группы арилтиенилового спирта в арилтиенильное производное, имеющее уходящую группу,
h) взаимодействие арилтиенильного производного, имеющего уходящую группу, с нуклеофилом, и
i) удаление защитной группы N-защищенного сульфонамида.
Другим объектом настоящего изобретения является комбинация, включающая соединение, как определено выше, и по меньшей мере один из бета-блокаторов, антагонистов кальция, диуретиков, ингибиторов АСЕ, ингибиторов ренина, антагонистов ангиотензина II, ингибиторов вазопептидаз, антагонистов рецептора минералокортикоидов, гипотензивных средств и антидиабетических средств.
Другим объектом настоящего изобретения является комбинация, включающая соединение, как определено выше, и по меньшей мере один из бета-блокаторов, антагонистов кальция, диуретиков, ингибиторов АСЕ, ингибиторов ренина, антагонистов ангиотензина II, ингибиторов вазопептидаз, антагонистов рецептора минералокортикоидов, гипотензивных средств, антидиабетических средств, фибринолитических средств, антитромботических средств и липидпонижающих средств.
Другим объектом является фармацевтическая композиция, содержащая соединение, как определено выше, в смеси с фармацевтическим адъювантом, разбавителем или носителем.
В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей комбинацию, как определено выше, в смеси с фармацевтическим адъювантом, разбавителем или носителем.
Другим объектом настоящего изобретения является применение соединения, как определено выше, для получения лекарственного средства для лечения артериальной гипертензии различных видов, уменьшения повреждения органа различных видов, лечения или профилактики кардиомиопатии различного происхождения, диабетической васкулопатии и ее осложнений, лечения нарушений, опосредуемых эндотелином и ангиотензином, включающих, но не ограничивающихся ими, сосудистые воспалительные состояния, включая атеросклероз, и лечения рака предстательной железы.
Другим объектом настоящего изобретения является применение комбинации, как определено выше, для получения лекарственного средства для лечения артериальной гипертензии различных видов, уменьшения повреждения органа различных видов, лечения или профилактики кардиомиопатии различного происхождения, диабетической васкулопатии и ее осложнений, лечения нарушений, опосредуемых эндотелином и ангиотензином, включающих, но не ограничивающихся ими, сосудистые воспалительные состояния, включая атеросклероз, и лечения рака предстательной железы.
Другим объектом настоящего изобретения является применение антагониста рецептора двойного действия рецепторов АТ1 и ЕТА, имеющих более высокое сродство к АТ1, чем к ЕТА, для получения лекарственного средства для лечения артериальной гипертензии различных видов, уменьшения повреждения органа различных видов, лечения или профилактики кардиомиопатии различного происхождения, диабетической васкулопатии и ее осложнений, лечения нарушений, опосредуемых эндотелином и ангиотензином, включающих, но не ограничивающихся ими, сосудистые воспалительные состояния, включая атеросклероз, и лечения рака предстательной железы.
Другим объектом настоящего изобретения является способ лечения артериальной гипертензии различных видов, уменьшения повреждения органа различных видов, лечения или профилактики кардиомиопатии различного происхождения, диабетической васкулопатии и ее осложнений, лечения нарушений, опосредуемых эндотелином и ангиотензином, включающих, но не ограничивающихся ими, сосудистые воспалительные состояния, включая атеросклероз, и лечения рака предстательной железы, путем введения млекопитающему соединения, как определено выше.
Другим объектом настоящего изобретения является способ лечения артериальной гипертензии различных видов, уменьшения повреждения органа различных видов, лечения или профилактики кардиомиопатии различного происхождения, диабетической васкулопатии и ее осложнений, лечения нарушений, опосредуемых эндотелином и ангиотензином, включающих, но не ограничивающихся ими, сосудистые воспалительные состояния, включая атеросклероз, и лечения рака предстательной железы путем введения млекопитающему комбинации, как определено выше.
Другим объектом настоящего изобретения является способ лечения артериальной гипертензии различных видов, уменьшения повреждения органа различных видов, лечения или профилактики кардиомиопатии различного происхождения, диабетической васкулопатии и ее осложнений, лечения нарушений, опосредуемых эндотелином и ангиотензином, включающих, но не ограничивающихся ими, сосудистые воспалительные состояния, включая атеросклероз, и лечения рака предстательной железы, путем введения млекопитающему антагониста рецептора двойного действия рецепторов АТ1 и ЕТА, имеющих более высокое сродство к АТ1, чем к ЕТА.
Определения
Как использовано в данном описании, термин "C1-C8алкил" означает прямую или разветвленную алкильную группу, содержащую от 1 до 8 атомов углерода. Примеры указанного C1-C8алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, а также пентил, гексил, гептил и октил с прямой или разветвленной цепью. Для частей группы "C1-C8алкил" рассматриваются такие подгруппы, как C1-C7алкил, C1-C6алкил, C2-C8алкил, C2-C7алкил, C2-C6алкил, C3-C5алкил, C4-C6алкил, C5-C7алкил и т.д.
Как использовано в данном описании, термин "C1-C8алкокси" означает прямую или разветвленную алкоксигруппу, содержащую от 1 до 8 атомов углерода. Примеры указанного C1-C8алкокси включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, а также пентокси, гексокси, гептокси и октокси с прямой или разветвленной цепью. Для частей группы "C1-C8алкокси" рассматриваются такие подгруппы, как C1-C7алкокси, C1-C6алкокси, C2-C8алкокси, C2-C7алкокси, C2-C6алкокси, C3-C5алкокси, C4-C6алкокси, C5-C7алкокси и т.д.
Как использовано в данном описании, термин "C2-C8алкенил" означает прямую или разветвленную алкенильную группу, содержащую от 2 до 8 атомов углерода. Примеры указанного C2-C8алкенила включают винил, 1-пропенил, 2-пропенил, н-бутенил, изобутенил, втор-бутенил, а также пентенил, гексенил, гептенил и октенил с прямой или разветвленной цепью. Для частей группы "C2-C8алкенил" рассматриваются такие подгруппы, как C2-C7алкенил, C2-C6алкенил, C3-C8алкенил, C3-C7алкенил, C3-C6алкенил, C3-C5алкенил, C4-C6алкенил, C5-C7алкенил и т.д.
Как использовано в данном описании, термин "C2-C8алкинил" означает прямую или разветвленную алкенильную группу, содержащую от 2 до 8 атомов углерода. Примеры указанного C2-C8алкинила включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, а также пентинил, гексинил, гептинил и октинил с прямой или разветвленной цепью. Для частей группы "C2-C8алкинил" рассматриваются такие подгруппы, как C2-C7алкинил, C2-C6алкинил, C2-C8алкинил, C3-C7алкинил, C3-C6алкинил, C3-C5алкинил, C4-C6алкинил, C5-C7алкинил и т.д.
Как использовано в данном описании, термин "C3-C8циклоалкил" означает циклическую алкильную группу, содержащую от 3 до 8 атомов углерода. Примеры указанного C3-C8циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Для частей группы "C3-C8циклоалкил" рассматриваются такие подгруппы, как C3-C7циклоалкил, C3-C6циклоалкил, C3-C5циклоалкил, C4-C6циклоалкил, C5-C7циклоалкил и т.д.
Как использовано в данном описании, термин "C3-C8циклоалкокси" означает циклическую алкильную группу, содержащую от 3 до 8 атомов углерода, связанную с экзоциклическим атомом кислорода. Примеры указанного C3-C8циклоалкокси включают циклопропокси, циклобутокси, циклопентокси, циклогексокси, циклогептокси и циклооктокси. Для частей группы "C3-C8циклоалкокси" рассматриваются такие подгруппы, как C3-C7циклоалкокси, C3-C6циклоалкокси, C3-C5циклоалкокси, C4-C6циклоалкокси, C5-C7циклоалкокси и т.д.
Как использовано в данном описании, термин "C3-C8циклоалкенил" означает циклическую алкенильную группу, содержащую от 3 до 8 атомов углерода. Примеры указанного C3-C8циклоалкенила включают 1-циклопропенил, 2-циклопропенил, 1-циклобутенил, 1-циклопентенил, 1-циклогексенил, 1-циклогептенил и 1-циклооктенил. Для частей группы "C3-C8циклоалкенил" рассматриваются такие подгруппы, как C3-C7циклоалкенил, C3-C6циклоалкенил, C3-C5циклоалкенил, C4-C6циклоалкенил, C5-C7циклоалкенил и т.д.
Как использовано в данном описании, термин "арил" означает моно- или бициклические ароматические кольцевые системы, такие как фенил, нафтил, необязательно, монозамещенный или дизамещенный группами, выбранными из водорода, галогена, C1-C8алкила, C1-C8алкокси, циано и трифторметила.
Как использовано в данном описании, термин "гетероарил" означает пяти- или шестичленные моно- или бициклические кольцевые системы, содержащие один-три гетероатома, выбранных из O, N и S. Примерами гетероарила являются фурил, тиенил, пирролил, пиридил, пиримидил, пиразинил, пиридазинил, триазинил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, имидазолил, триазолил, тетразолил и пиридотиазолил.
Как использовано в данном описании, термин "гетероцикл" означает пяти- или шестичленные моно- или бициклические кольцевые насыщенные или частично насыщенные системы, содержащие один-три гетероатома, выбранных из O, N и S. Примерами гетероарила являются тетрагидрофурил, пирролидинил, пиперидинил, пиперазинил, тетрагидротиенил и имидазолидинил.
Как использовано в данном описании, термин "галоген" означает фтор, хлор, бром или йод. Термин "пергалоген" означает группу, к которой присоединено максимально возможное число атомов галогена.
Как использовано в данном описании, когда две или более групп используются в соединении друг с другом, это означает, что каждая группа замещена непосредственно предыдущей группой. Например, C1-C8алкоксикарбонил означает карбонильную группу, замещенную C1-C8алкоксигруппой. Аналогично, гетероарил-C1-C8алкил означает C1-C8алкильную группу, замещенную гетероарильной группой.
Как использовано в данном описании, термин "предупреждение" или "профилактика" имеет свое обычное значение и таким образом означает предотвращение или облегчение серьезных последствий заболевания или побочного эффекта за счет раннего обнаружения.
Как использовано в данном описании, термин "млекопитающее" означает человека или животное, такое как обезьяны, приматы, собаки, кошки, лошади, коровы и т.д.
Как использовано в данном описании, отдельные энантиомеры, рацемические смеси и неравные смеси двух энантиомеров входят в объем изобретения, если такие изомеры существуют. Следует понимать, что все возможные диастереомерные формы (чистые энантиомеры, рацемические смеси и неравные смеси двух энантиомеров), таутомеры и атропоизомеры входят в объем изобретения.
Как использовано в данном описании, термин "атропоизомеры" относится к оптическим изомерам, которые могут быть разделены только потому, что вращение относительно простых связей предотвращено или значительно замедлено, как это часто встречается в случаях пространственно ограниченного вращения в биарильных системах.
Как использовано в данном описании, термин "полиморфы" относится к соединениям, имеющим такую же химическую формулу, тот же самый тип соли и имеющим такую же форму гидрата/сольвата, но имеющим разные кристаллографические свойства.
Как использовано в данном описании, термин "гидраты" относится к соединению, к молекуле которого присоединено некоторое число молекул воды.
Как использовано в данном описании, термин "сольваты" относится к соединению, к молекуле которого присоединено некоторое число молекул растворителя.
Настоящее изобретение также охватывает пролекарства соединений по изобретению, т.е. вторичные соединения, которые превращаются в первичные соединения in vivo.
In vivo расщепляющиеся сложные эфиры представляют собой только один тип пролекарств родительской молекулы. Гидролизуемый (или расщепляющийся) in vivo сложный эфир соединения согласно настоящему изобретению, которое содержит карбоксильную группу, например фармацевтически приемлемый сложный эфир, который гидролизуется в организме человека или животных с образованием родительской кислоты. Подходящие фармацевтически приемлемые сложные эфиры для карбокси включают C1-C8алкоксиметиловые сложные эфиры, например метоксиметиловый, C1-C8алканолоксиметиловый сложный эфир, например пивалоилоксиметил; сложные фталидиловые эфиры; C3-C8циклоалкоксикарбонилокси-C1-C8алкиловые сложные эфиры, например 1-циклогексилкарбонилоксиэтил; 1,3-диоксолен-2-онилметиловые сложные эфиры, например 5-метил-1,3-диоксолен-2-онилметил; и C1-C8алкоксикарбонилоксиэтиловые сложные эфиры, например 1-метоксикарбонилоксиметил; и могут быть образованы по любой карбоксильной группе в соединениях согласно настоящему изобретению.
Как использовано в данном описании, термин "фармацевтически приемлемые соли" включает аддитивные соли кислот и аддитивные соли оснований. Такие соли могут быть образованы обычными средствами, например реакцией свободной кислоты или свободного основания соединения по изобретению с одним или несколькими эквивалентами подходящей кислоты или основания, необязательно в растворителе или в среде, в которой соль является нерастворимой, с последующим удалением указанного растворителя или указанной среды с использованием стандартных методик (например, в вакууме или сушкой сублимацией). Соли также могут быть получены обменом противоиона соединения по изобретению в виде соли с другим противоионом с использованием подходящей ионообменной смолы.
Подходящие кислоты являются нетоксичными и включают, например, но не ограничиваются ими, хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, серную кислоту, азотную кислоту, уксусную кислоту, лимонную кислоту, аскорбиновую кислоту, молочную кислоту, яблочную кислоту и винную кислоту. Подходящие основания являются нетоксичными и включают, например, но не ограничиваются ими, гидроксид натрия, гидроксид калия, аммиак, метиламин, диметиламин, триметиламин и триэтиламин.
В контексте настоящего описания термин "лечение" также включает "профилактику", если нет конкретного указания обратного. Термин "лечение" в рамках контекста настоящего изобретения также охватывает введение эффективного количества соединения согласно настоящему изобретению для того, чтобы смягчить или уже имеющееся болезненное состояние, острое или хроническое, или рецидивирующее состояние. Это определение также охватывает профилактическую терапию для профилактики рецидивирующего состояния и постоянную терапию для хронических нарушений.
Соединения согласно настоящему изобретению могут вводиться в виде обычной фармацевтической композиции любым путем, включая пероральный, внутримышечный, подкожный, местный, внутриносовой, внутрибрюшинный, внутриторакальное, внутривенное, эпидуральное, внутриоболочковое, интрацеребровентрикулярное и путем инъекции в сустав.
В одном варианте осуществления настоящего изобретения путь введения может быть пероральным, внутривенным или внутримышечным.
Доза будет зависеть от пути введения, серьезности заболевания, возраста и массы тела пациента и других факторов, которые обычно рассматривает лечащий врач, определяя индивидуальный режим и уровень доз, наиболее подходящий для конкретного пациента.
Для получения фармацевтических композиций соединений согласно настоящему изобретению инертные фармацевтически приемлемые носители могут быть твердыми или жидкими. Твердые формы включают порошки, таблетки, диспергируемые гранулы, капсулы, облатки и суппозитории.
Твердым носителем может быть одно или несколько веществ, которые могут также действовать как растворители, ароматизирующие вещества, солюбилизаторы, лубриканты, суспендирующие агенты, связующие или дезинтеграторы таблеток; он может также представлять собой инкапсулирующий материал.
В порошках носитель представляет собой тонко измельченное твердое вещество, которое находится в смеси с тонко измельченным соединением согласно настоящему изобретению или активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми связующими свойствами в подходящих пропорциях и спрессован в желаемую форму и размер.
Для получения композиции суппозитория легкоплавкий воск, такой как смесь глицеридов жирной кислоты и масла какао, расплавляют и в нем диспергируют активный ингредиент, например, путем перемешивания. Расплавленную гомогенную смесь затем льют в формы подходящего размера и дают охладиться и затвердеть.
Подходящими носителями являются карбонат магния, стеарат магния, тальк, лактоза, сахар, пектин, декстрин, крахмал, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, легкоплавкий воск, масло какао и т.п.
Термин «композиция» также включает состав активного компонента с инкапсулирующим материалом в качестве носителя, обеспечивающим капсулу, в которой активный компонент (с другими носителями или без них) окружен носителем, который находится таким образом в комбинации с ним. Аналогичным образом включены облатки.
Таблетки, порошки, облатки и капсулы могут использоваться в виде твердых дозированных форм, подходящих для перорального введения.
Жидкие композиции включают растворы, суспензии и эмульсии. Например, растворы активных соединений в стерильной воде или пропиленгликоле могут быть жидкими препаратами, подходящими для парентерального введения. Жидкие композиции также могут быть составлены в растворе в водном растворе полиэтиленгликоля.
Водные растворы для перорального введения могут быть получены путем растворения активного компонента в воде и добавления подходящих красителей, ароматизирующих веществ, стабилизаторов и загустителей, если желательно. Водные растворы для перорального использования могут быть получены путем диспергирования тонко измельченного активного компонента в воде вместе с вязкими материалами, такими как природные или синтетические камеди, смолы, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, и другими суспендирующими агентами, известными в области фармацевтических составов.
В зависимости от способа введения фармацевтическая композиция согласно одному варианту осуществления настоящего изобретения включает от 0,05 до 99 масс.% (процент по массе), согласно альтернативному варианту осуществления от 0,10 до 50 масс.% соединения согласно настоящему изобретению, все массовые концентрации в процентах даны в расчете на общую массу композиции.
Терапевтически эффективное количество для практики настоящего изобретения может быть определено при помощи известных критериев, включая возраст, массу тела и реакцию индивидуального пациента, и может интерпретироваться в рамках контекста заболевания, которое подвергают лечению или профилактику которого осуществляют, специалистом в данной области.
Вышеуказанный объект, относящийся к фармацевтической композиции, содержащей соединение согласно настоящему изобретению, аналогично относится к фармацевтической композиции, включающей комбинацию согласно настоящему изобретению.
В следующем описании приведены схемы реакции, чтобы раскрыть синтезы соединений согласно настоящему изобретению.
Схема I
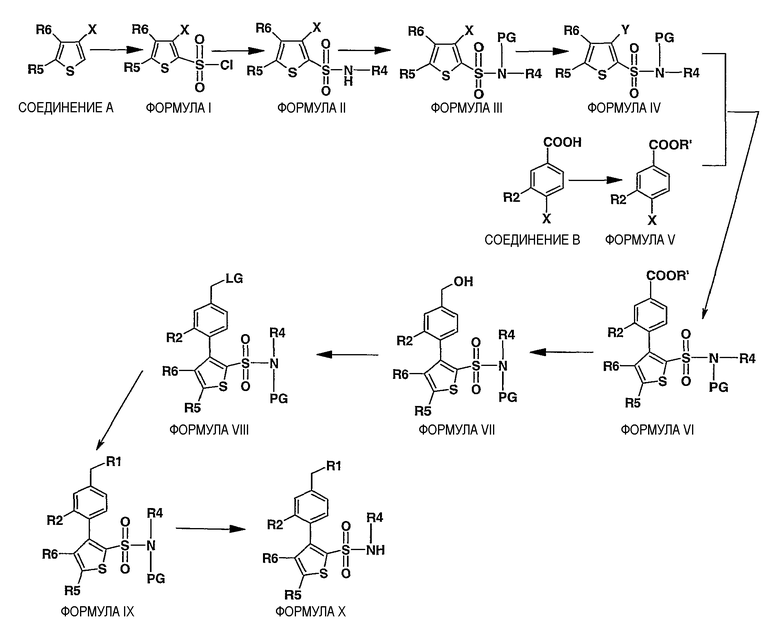
Описание схемы I:
Соединения формулы X, где R1, R2, R4, R5 и R6 имеют значения, определенные выше, могут быть получены удалением защитной группы от соединения формулы IX, где PG означает подходящую защитную группу азота. Примеры условий для удаления защитной группы и защитных групп азота могут быть найдены в T.W. Greene and P.G.M. Wuts, Protecting Groups in Organic Synthesis, John Wiley and Sons, Inc, New York, 1991, pp. 309-405. Предпочтительными защитными группами азота являются метоксиметильная (МОМ), метоксиэтоксиметильная (МЕМ) и 2-(триметилсилил)этоксиметильная (SEM) группы и, не ограничиваясь ими, например, C1-C6алкоксикарбонильная группа (такая, как метоксикарбонил, этоксикарбонил или изобутоксикарбонил), бензилоксикарбонил (в котором бензольное кольцо может быть необязательно замещено). Защитная группа PG может быть удалена из соединения формулы IX обработкой одним или несколькими агентами для удаления защитной группы. Следует понимать, что агент или агенты для удаления защитной группы будут зависеть от конкретной защитной группы. Подходящие агенты для удаления защитной группы и методы их использования известны в данной области. Например, алкоксикарбонильная группа может быть удалена в основных условиях, например, гидроксидом натрия или алкоголятом (например, метилатом натрия) в подходящем растворителе, таком как метанол; 2-метоксиэтоксиметильная группа может быть удалена с использованием кислых условий, например хлористоводородной кислотой в подходящем растворителе, таком как этанол; и триC1-C4алкилсилилэтоксиметильная группа может быть удалена, используя тетрабутиламмонийфторид в тетрагидрофуране, используя трифторуксусную кислоту или используя смесь хлористоводородной кислоты в подходящем растворителе, таком как этанол.
Соединения формулы IX могут быть получены из соединения формулы VIII замещением удаляемой группы (LG) конъюгатом основания соединения R1-Н, где R1 имеет значение, определенное выше, с использованием основания в инертном растворителе. Примеры основания включают карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия и гидрид калия или алкиллитий. Предпочтительным основанием является гидрид натрия. Пример инертного растворителя включает простые эфиры (тетрагидрофуран, 1,4-диоксан, диэтиловый эфир) или N,N-диметилформамид. Предпочтительным растворителем является N,N-диметилформамид. Примеры температур реакции составляют приблизительно от 0°C до 120°C, предпочтительно приблизительно от 20°C до 110°C.
Соединения формулы VIII (где LG означает уходящую группу типа, но, не ограничиваясь ими, -OSO2CH3, -OSO2PhCH3, -OSO2Ph, -OSO2CF3) могут быть получены взаимодействием соединения формулы VII, например, но, не ограничиваясь ими, с ClSO2CH3, ClSO2PhCH3, ClSO2Ph или (CF3SO2)2O, в присутствии основания в инертном растворителе. Пример инертного растворителя включает простые эфиры (тетрагидрофуран, 1,4-диоксан, диэтиловый эфир) или N,N-диметилформамид.
Соединения формулы VII могут быть получены восстановлением соединения формулы VI в инертном растворителе с использованием гидрида щелочного металла, такого как алюмогидрид лития.
Соединения формулы VI могут быть получены в результате катализируемого палладием сочетания соединения формулы V с соединением формулы IV в присутствии подходящего основания в инертном растворителе. Примеры катализаторов на основе палладия включают тетракис(трифенилфосфин)палладий(0), хлорид палладия(II). Предпочтительным катализатором на основе палладия является тетракис(трифенилфосфин)палладий(0). Примеры основания включают третичные амины, такие как, но, не ограничиваясь ими, триэтиламин, или водный раствор карбоната калия, натрия или цезия. Примеры растворителей включают тетрагидрофуран, 1,4-диоксан, ацетонитрил, толуол, бензол или спирты с прямой цепью, 1,2-диметоксиэтан или их комбинации. Предпочтительным растворителем является смесь толуола и этанола. Примером температуры реакции является температура приблизительно от 25°C до 125°C, предпочтительно приблизительно от 65°C до 110°C.
Соединения формулы V, где R' означает низший алкил, такой как метил, этил, изобутил и бензил, и X подразумевают галоген (хлор, бром, йод) могут быть получены из соединения B средствами, известными специалисту в данной области.
Соединения B являются коммерчески доступными или могут быть получены средствами, известными специалисту в данной области.
Соединения формулы IV, где Y означает подходящий борсодержащий заместитель, могут быть получены литиированием соединений формулы III, где X означает водород или галоген (хлор, бром, йод), и взаимодействием полученного гетероариллития с подходящим боратным производным. Подходящие боратные соединения являются коммерчески доступными или могут быть получены средствами, известными специалисту в данной области.
Соединения формулы III могут быть получены путем защиты азота в соединении формулы II. Примеры защитных групп азота и способов защиты азота аналогичны группам и способам защиты аминов, как описано в T.W. Greene and P.G.M. Wuts, Protecting Groups in Organic Synthesis, John Wiley and Sons, Inc. New York, 1991.
Соединения формулы II могут быть получены взаимодействием соединения формулы I с соединением R4-NH2.
Соединения формулы I являются коммерчески доступными или могут быть получены средствами, известными специалисту, через соединение A.
Соединения A являются коммерчески доступными или могут быть получены средствами, известными специалисту в данной области.
Схема II
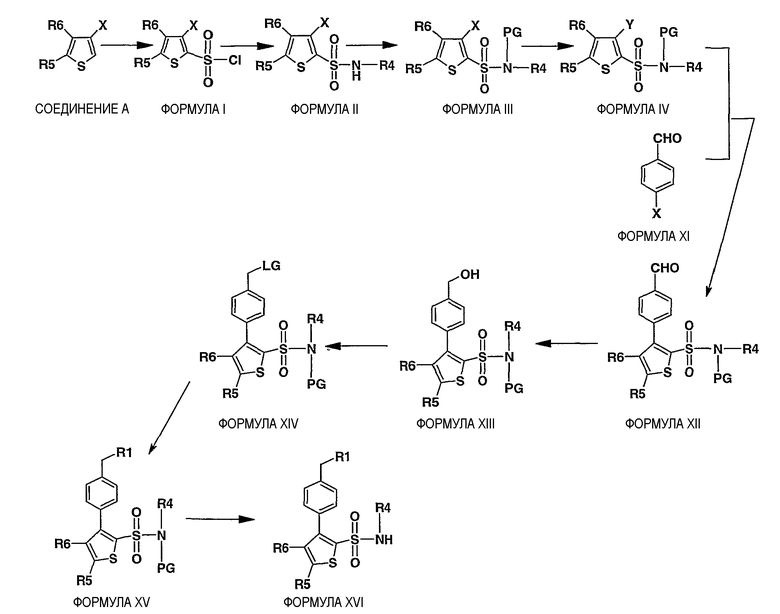
Описание схемы II:
Соединения формулы XVI, где R1, R4, R5 и R6 имеют значения, определенные выше, могут быть получены удалением защитной группы из соединения формулы XV, где PG означает подходящую защитную группу азота. Защитная группа PG может быть удалена от соединения формулы XV обработкой одним или несколькими агентами для удаления защитной группы. Следует понимать, что агент или агенты для удаления защитной группы будут зависеть от конкретной защитной группы. Подходящие агенты для удаления защитной группы и методы для использования известны в данной области.
Соединения формулы XV могут быть получены из соединения формулы XIV через замещение удаляемой группы (LG) конъюгатом основания с соединением R1-Н, где R1 имеет значения, определенные выше, с использованием основания в инертном растворителе. Примеры оснований включают карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия и гидрид калия или алкиллитий. Предпочтительным основанием является гидрид натрия. Пример инертного растворителя включает простые эфиры (тетрагидрофуран, 1,4-диоксан, диэтиловый эфир) или N,N-диметилформамид. Предпочтительным растворителем является N,N-диметилформамид. Примером температуры реакции является температура приблизительно от 0°C до 120°C, предпочтительно приблизительно от 20°C до 110°C.
Соединение формулы XIV (где LG означает уходящую группу типа, но, не ограничиваясь ими, -OSO2CH3, -OSO2PhCH3, -OSO2Ph, -OSO2CF3) могут быть получены взаимодействием соединения формулы XIII, например, но, не ограничиваясь ими, с ClSO2CH3, ClSO2PhCH3, ClSO2Ph или (CF3SO2)2O в присутствии основания в инертном растворителе. Пример инертного растворителя включает простые эфиры (тетрагидрофуран, 1,4-диоксан, диэтиловый эфир) или N,N-диметилформамид.
Соединение формулы XIII может быть получено восстановлением соединения формулы XII в инертном растворителе при использовании восстановителей, таких как алюмогидрид лития, боргидрид натрия и цианоборгидрид натрия.
Соединения формулы XII могут быть получены в результате катализируемого палладием сочетания соединения формулы XI с соединением формулы IV в присутствии подходящего основания в инертном растворителе. Примеры катализаторов на основе палладия включают тетракис(трифенилфосфин)палладий(0), хлорид палладия(II). Предпочтительным катализатором на основе палладия является тетракис(трифенилфосфин)палладий(0). Примеры основания включают третичные амины, такие как, но, не ограничиваясь ими, триэтиламин, или водный раствор карбоната калия, натрия или цезия. Примеры растворителей включают тетрагидрофуран, 1,4-диоксан, ацетонитрил, толуол, бензол или спирты с прямой цепью, 1,2-диметоксиэтан или их комбинации. Предпочтительным растворителем является смесь толуола и этанола. Примером температуры реакции является температура приблизительно от 25°C до 125°C, предпочтительно приблизительно от 65°C до 110°C.
Соединения формулы XI являются коммерчески доступными или могут быть получены средствами, известными специалисту в данной области.
Соединения формулы IV могут быть получены, как описано на схеме I.
Схема III
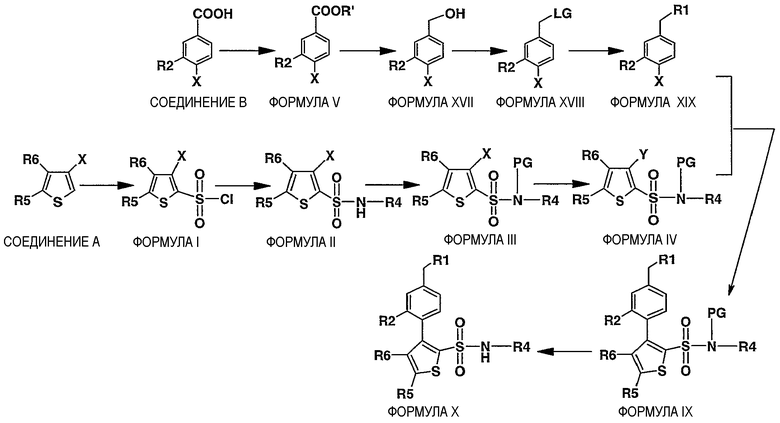
Описание схемы III
Соединения формулы X, где R1, R2, R4, R5 и R6 имеют значения, определенные выше, могут быть получены удалением защитной группы из соединения формулы IX, как описано на схеме I.
Соединения формулы IX могут быть получены в результате катализируемого палладием сочетания соединения формулы XIX с соединением формулы IV в присутствии подходящего основания в инертном растворителе. Примеры катализаторов на основе палладия включают тетракис(трифенилфосфин)палладий(0), хлорид палладия(II). Предпочтительным катализатором на основе палладия является тетракис(трифенилфосфин)палладий(0). Примеры основания включают третичные амины, такие как, но, не ограничиваясь ими, триэтиламин, или водный раствор карбоната калия, натрия или цезия. Примеры растворителей включают тетрагидрофуран, 1,4-диоксан, ацетонитрил, толуол, бензол или спирты с прямой цепью, 1,2-диметоксиэтан или их комбинации. Предпочтительным растворителем является смесь толуола и этанола. Примером температуры реакции является температура приблизительно от 25°C до 125°C, предпочтительно приблизительно от 65°C до 110°C.
Соединения формулы IV могут быть получены, как описано на схеме I.
Соединения формулы XIX могут быть получены через замещение удаляемой группы (LG) соединения формулы XVIII конъюгатом основания с соединением R1-Н, где R1 имеет значения, определенные выше, с использованием основания в инертном растворителе. Примеры оснований включают карбонат натрия, карбонат калия, карбонат цезия, гидрид натрия и гидрид калия или алкиллитий. Предпочтительным основанием является гидрид натрия. пример инертного растворителя включает простые эфиры (тетрагидрофуран, 1,4-диоксан, диэтиловый эфир) или N,N-диметилформамид. Предпочтительным растворителем является N,N-диметилформамид. Примером температуры реакции является температура приблизительно от 0°C до 120°C, предпочтительно приблизительно от 20°C до 110°C.
Соединения формулы XVIII (где LG означает уходящую группу типа, но, не ограничиваясь ими, -OSO2CH3, -OSO2PhCH3, -OSO2Ph, -OSO2CF3) могут быть получены взаимодействием соединения формулы XVII, например, но, не ограничиваясь ими, с ClSO2CH3, ClSO2PhCH3, ClSO2Ph или (CF3SO2)2O, в присутствии основания в инертном растворителе. Пример инертного растворителя включает простые эфиры (тетрагидрофуран, 1,4-диоксан, диэтиловый эфир) или N,N-диметилформамид.
Соединения формулы XVII могут быть получены восстановлением соединения формулы V в инертном растворителе при использовании восстановителей, таких как алюмогидрид лития, боргидрид натрия и цианоборгидрид натрия.
Соединения формулы V могут быть получены, как описано на схеме I.
За счет изменения структуры замещения соединения формулы I альтернативный изомер, то есть соединение формулы B, также может использоваться в качестве исходного соединения на схеме I, II или III, приводя к изомерной форме соединений формулы X и формулы XVI.
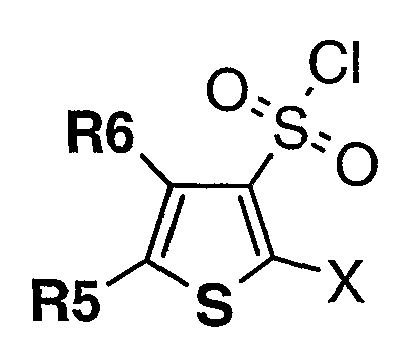
Формула В
Гетероциклические кольца, как приведено в данном описании, получение которых не было явным образом раскрыто, могут быть получены аналогично гетероциклическим кольцам, получение которых было явным образом раскрыто.
В последующем описании настоящее изобретение освещается следующими неограничивающими примерами.
Когда они используются, выражения "содержит" и "содержащий" означают "включает" и "включающий", но не ограничиваются ими. Таким образом могут присутствовать другие ингредиенты, носители и добавки.
ПРИМЕРЫ
Аббревиатуры
АСЕ - ангиотензин-превращающий фермент
Ang-II - ангиотензин
АТ1 - рецептор 1 ангиотензина II
AT2 - рецептор 2 ангиотензина II
ЕТА - рецептор эндотелина А
ETB - рецептор эндотелина B
LAH - литийалюминийгидрид
кт или КТ - комнатная температура
т - триплет
с - синглет
д - дублет
кв. - квартет
квин. - квинтет
м - мультиплет
ушир. - уширенный
ушир.с - уширенный синглет
дм - дублет мультиплетов
ушир.т - уширенный триплет
дд - дублет дублетов
Общие экспериментальные методики
Масс-спектры регистрировали на системе Thermo Finnigan LC-MS (LCQ classic). Измерения 1Н ЯМР регистрировали на Bruker Avance DPX 400 МГц. Химические сдвиги даются в м.д. с TMS в качестве внутреннего стандарта.
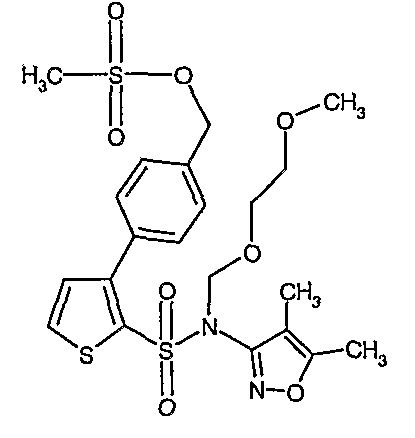
Пример 1
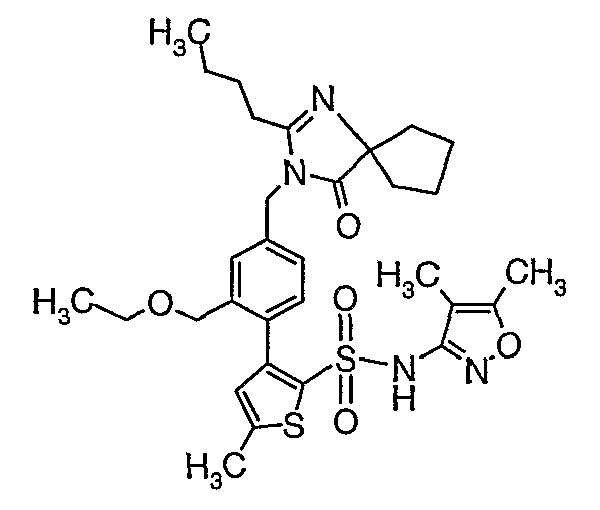
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(2-бутил-4-оксо-1,3-диазаспиро[4,4]нон-1-ен-3-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез этилового эфира 4-бром-3-метилбензойной кислоты
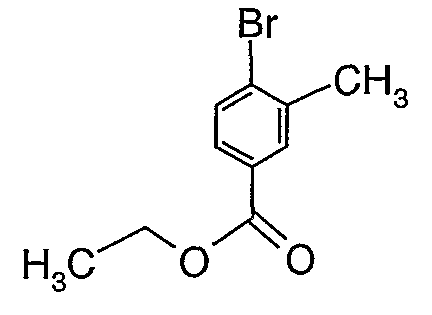
К охлажденному раствору (0°C) 4-бром-3-метилбензойной кислоты (25 г, 0,116 моль) в этаноле (100 мл) добавляли при перемешивании концентрированную серную кислоту (8 мл). После завершения добавления реакционную смесь нагревали с обратным холодильником в течение 6 часов. Реакционную смесь охлаждали и затем концентрировали в вакууме. К остатку добавляли (50 мл) холодной воды с последующей экстракцией простым диэтиловым эфиром (100 мл×2). Органический слой промывали насыщенным раствором бикарбоната натрия, затем водой и насыщенным раствором соли. Наконец, эфирный слой сушили над сульфатом натрия и упаривали в вакууме, получая 26 г этилового эфира 4-бром-3-метилбензойной кислоты.
Стадия 02: Синтез 4-бром-3-(бромметил)этилбензоата
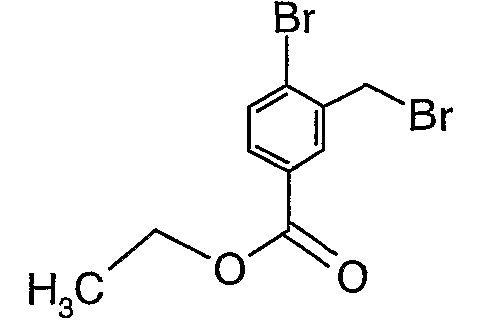
К раствору этилового эфира 4-бром-3-метилбензойной кислоты (25 г, 0,102 моль) в тетрахлорметане (100 мл) при комнатной температуре добавляли N-бромсукцинимид (20,13 г, 0,113 моль) и (1,24 г, 0,005 моль) пероксида бензоила. Затем реакционную смесь нагревали с обратным холодильником в течение 10 часов. Реакционную смесь охлаждали и фильтровали. Фильтрат концентрировали в вакууме. Остаток, полученный таким образом, очищали, растирая с гексаном (100 мл). Твердое вещество, полученное таким образом, отфильтровывали и сушили при отсасывании, получая 12 г 4-бром-3-(бромметил)этилбензоата.
Стадия 03: Синтез этилового эфира 4-бром-3-этоксиметилбензойной кислоты
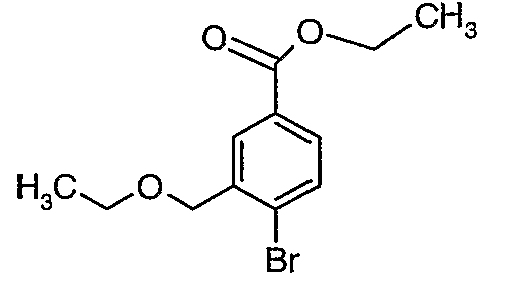
К охлажденному раствору (0°C) 4-бром-3-(бромметил)этилбензоата (12 г, 0,037 моль) в этаноле (25 мл) добавляли этоксид натрия (5,0 г, 0,074 моль) и (4 мл) N,N-диметилформамида. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре. Затем реакционную смесь концентрировали в вакууме и остаток разбавляли этилацетатом (100 мл). Этилацетатный слой промывали водой и насыщенным раствором соли и, наконец, органический слой сушили над сульфатом натрия. Органический слой упаривали в вакууме, получая 10,0 г этилового эфира 4-бром-3-этоксиметилбензойной кислоты.
Стадия 04: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
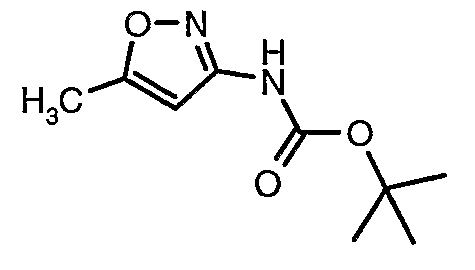
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем полученную смесь охлаждали до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 05: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
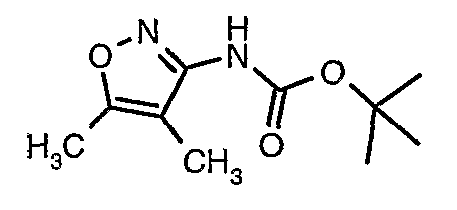
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 06: Синтез 4,5-диметилизоксазол-3-иламина
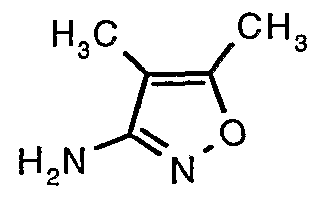
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями к трифторуксусной кислоте (22 мл, 0,3108 моль) при 0°C. После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
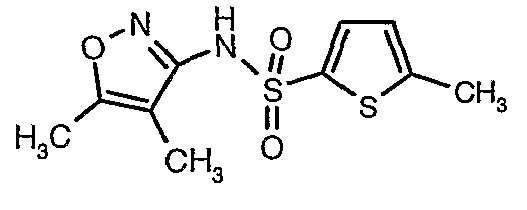
Раствор 5-метилтиофен-2-сульфонилхлорида (10,5 г, 0,053 моль) в (15 мл) метиленхлорида добавляли к раствору 3-амино-4,5-диметилизоксазола (4 г, 0,035 моль) и диметиламинопиридина (500 мг) в пиридине (20 мл) при 0°C. После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 4,0 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 08: Синтез(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
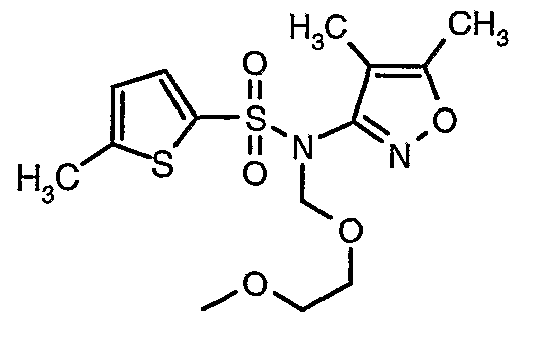
При 0°C при перемешивании гидрид натрия (0,800 г, 0,166 моль, 60%-ная дисперсия в минеральном масле) добавляли к N,N-диметилформамиду (30 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (4 г, 0,0146 моль). После завершения добавления температуру реакционной смеси медленно поднимали и перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C, затем к реакционной смеси добавляли по каплям метоксиэтоксиметилхлорид (2,7 г, 0,021 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, к полученной смеси (90 мл) добавляли этилацетат и перемешивали реакционную смесь в течение 20 мин, с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 3,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 09: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамид
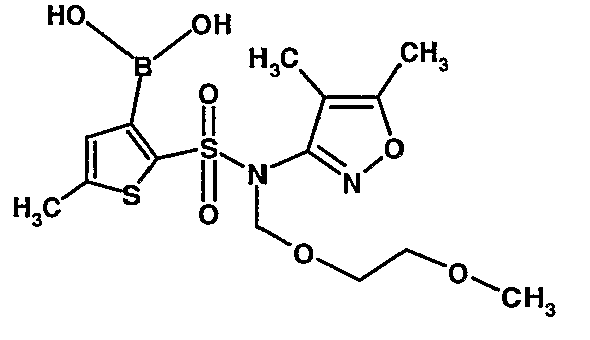
В сухой атмосфере азота раствор (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты (3,7 г, 0,010 моль) в тетрагидрофуране (30 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (11 мл, 0,025 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно доводили до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (3 мл, 0,015 моль). После завершения добавления температуру медленно повышали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Этилацетатный слой сушили над сульфатом натрия и концентрировали в вакууме, получая 3,4 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 10: Синтез этилового эфира 4-{2[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
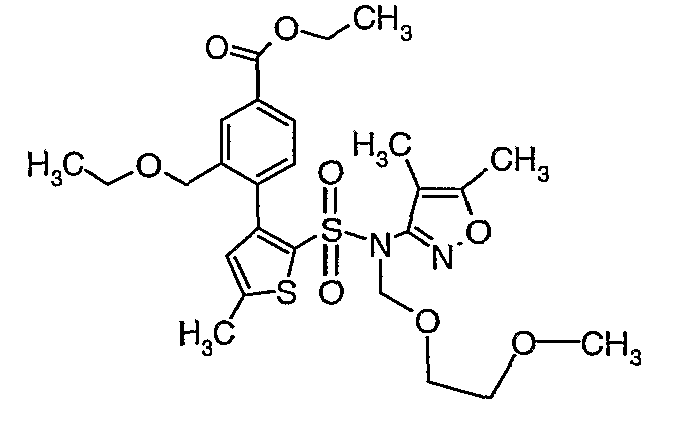
К перемешиваемому раствору 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,2 г, 0,0128 моль) и этилового эфира 4-бром-3-этоксиметилбензойной кислоты (3,7 г, 0,0128 моль) в толуоле (50 мл) и этаноле (25 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (4,0 г в 19 мл воды). Реакционную смесь перемешивали в атмосфере азота в течение 15 минут и затем в реакционную смесь добавляли тетракистрифенилфосфинпалладий(0) (0,745 г, 0,64 ммоль). Реакционную смесь нагревали до 85°C в течение 6 часов. Реакционную смесь концентрировали и к остатку добавляли этилацетат (25 мл), затем охлажденную воду экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали полностью в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 0,300 г этилового эфира 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в виде маслянистой массы.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
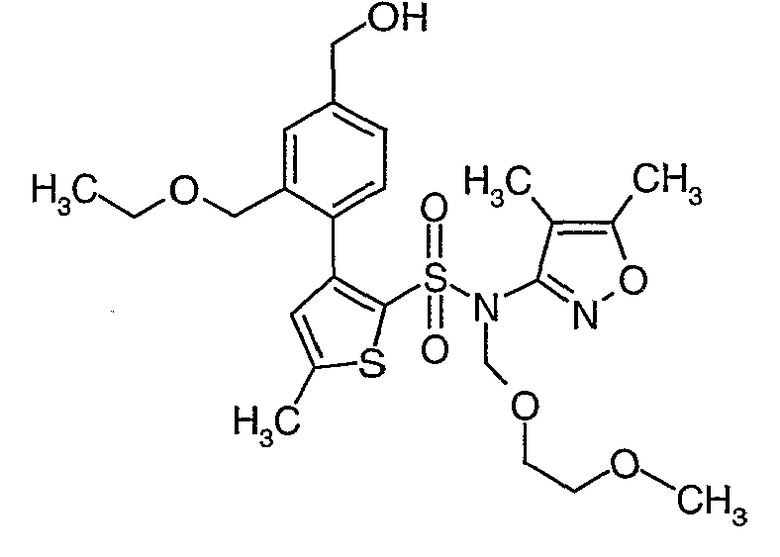
Алюмогидрид лития (0,100 г) добавляли при 0°C к перемешиваемому раствору тетрагидрофурана (10 мл) в токе сухого азота с последующим дополнением этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты (0,300 г) в (15 мл) тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 часа, затем температуру повышали до комнатной температуры и смесь перемешивали в течение 4 часов. Избыток алюмогидрида лития разрушали добавлением раствора гидроксида натрия (1 г, растворенный в 100 мл воды) при 0°C с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали полностью в вакууме, получая 0,240 г (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 12: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты
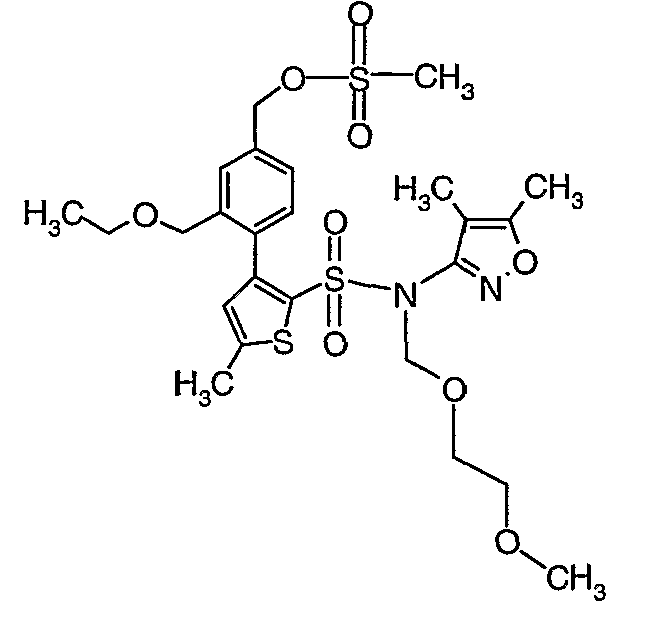
N-этилдиизопропиламин (0,2 мл, 0,0011 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (0,240 г, 0,00045 моль) в 10 мл дихлорметана. Реакционную смесь охлаждали до 0°C, затем в реакционную смесь медленно добавляли метансульфонилхлорид (0,043 мл, 0,00055 моль). Реакционную смесь выдерживали при комнатной температуре в течение 3 часов и затем помещали в ледяную воду с последующей экстракцией метиленхлоридом (25 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 0,220 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(2-бутил-4-оксо-1,3-диазаспиро[4,4]нон-1-ен-3-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
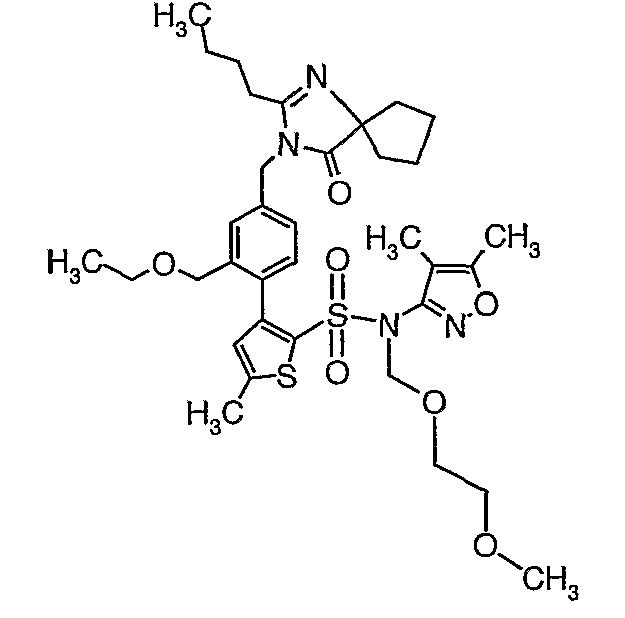
К перемешиваемому раствору 2-бутил-1,3-диазаспиро[4,4]нон-1-ен-4-она (0,080 г, 0,41 ммоль) в диметилформамиде (2 мл) при -15°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,025 г, 0,54 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (0,220 г, 0,36 ммоль) в 2 мл диметилформамида и перемешивали при комнатной температуре в течение 24 часов. Смесь затем разбавляли этилацетатом (20 мл), затем 5 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 0,230 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(2-бутил-4-оксо-1,3-диазаспиро[4,4]нон-1-ен-3-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
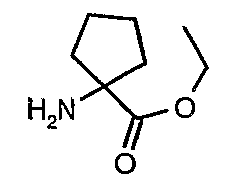
Стадия 14: Синтез этилового эфира 1-аминоциклопентанкарбоновой кислоты
К перемешиваемому раствору 1-аминоциклопентанкарбоновой кислоты (25 г, 0,193 моль) в этаноле (250 мл) при 0°C добавляли 15 мл концентрированной серной кислоты. Реакционную смесь нагревали с обратным холодильником в течение 24 часов, затем охлаждали и упаривали в вакууме. Остаток нейтрализовали добавлением твердого бикарбоната натрия с последующим добавлением 50 мл холодной воды. Смесь экстрагировали дихлорметаном (200 мл×4). Органический слой промывали водой, насыщенным раствором соли, сушили над сульфатом натрия и упаривали, получая 27 г этилового эфира 1-аминоциклопентанкарбоновой кислоты.
Стадия 15: Синтез 2-бутил-1,3-диазаспиро[4,4]нон-1-ен-4-она
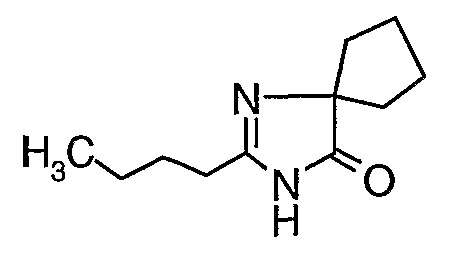
К перемешиваемому раствору этилового эфира 1-аминоциклопентанкарбоновой кислоты (7 г, 0,0445 моль) в 30 мл толуола добавляли этиловый эфир пентанимидной кислоты (7 г, 0,054 моль), затем каталитическое количество уксусной кислоты (1-2 мл) и реакционную смесь нагревали с обратным холодильником в течение 48 часов. Реакционную смесь охлаждали и концентрировали в вакууме, остаток растворяли в этилацетате (50 мл) и затем промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и упаривали, получая 5 г 2-бутил-1,3-диазаспиро[4,4]нон-1-ен-4-она в виде светло-желтого масла.
Стадия 16: (4,5-диметилизоксазол-3-ил)амид 3-[4-(2-бутил-4-оксо-1,3-диазаспиро[4,4]нон-1-ен-3-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
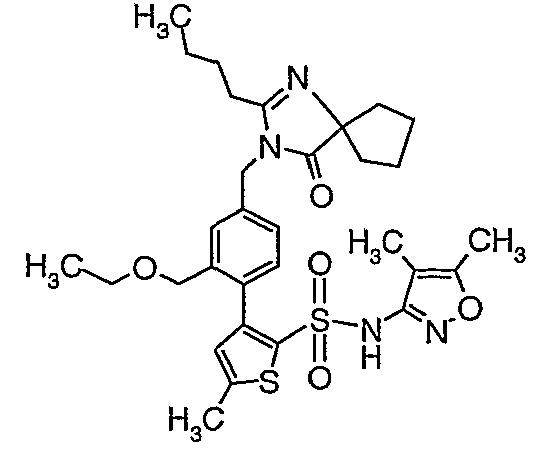
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[4-(2-бутил-4-оксо-1,3-диазаспиро[4,4]нон-1-ен-3-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (0,230 г, 0,32 ммоль) при комнатной температуре добавляли 95%-ный этанол (5 мл) и 6 н. водный раствор хлористоводородной кислоты (4 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 часов. Реакционную смесь концентрировали в вакууме, и рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия. Реакционный раствор затем подкисляли до рН 5 уксусной кислотой и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали флэш-хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 50 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(2-бутил-4-оксо-1,3-диазаспиро[4,4]нон-1-ен-3-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C31H40N4O5S2
Молекулярная масса: 612,80
1H ЯМР (ДМСО-d6): 0,83 (т, J=7,2 Гц, 3H), 1,06 (т, J=7,2 Гц, 3H), 1,28-1,33 (м, 2H), 1,51-1,54 (м, 2H), 1,56 (с, 3H), 1,66-1,71 (м, 2H), 1,84-1,87 (м, 6H), 2,20 (с, 3H), 2,32-2,38 (м, 2H), 2,48 (с, 3H), 3,23-3,27 (м, 2H), 4,07-4,11 (м, 2H), 4,72-4,74 (м, 2H), 6,74 (с, 1Н), 6,97-7,03 (м, 2H), 7,17-7,19 (м, 1H), 10,75 (с, 1Н).
Масс-спектр: (m+1) 613.
Пример 2
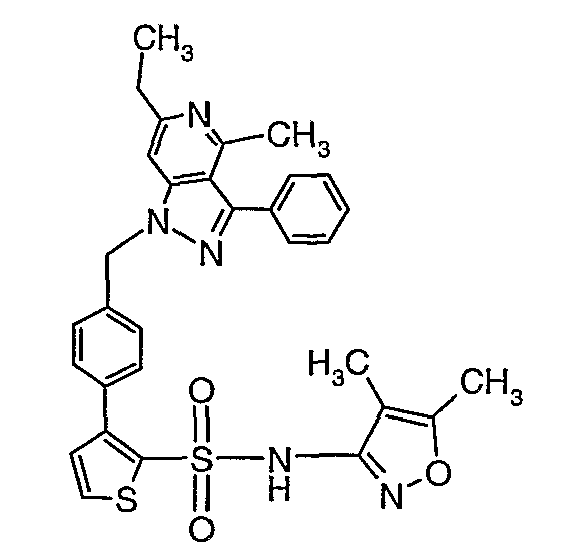
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез 1-фенилбутан-1,3-диона
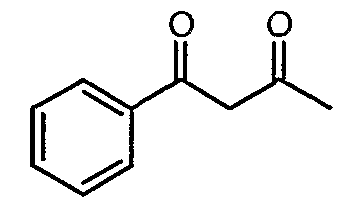
Этоксид натрия (13,5 г, 0,198 моль) добавляли к перемешиваемому раствору сухого этилацетата (80 мл, 0,72 моль) при -5°C. К реакционной смеси добавляли метилфенилкетон (20 г, 0,185 моль) при -5°C и затем температуру реакционной смеси выдерживали при 0°C в течение 12 ч. Реакционную смесь затем подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенный органический слой промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и упаривали, получая 21 г желтого твердого вещества, представляющего собой 1-фенилбутан-1,3-дион.
Стадия 02: Синтез 3-амино-1-фенилбут-2-ен-1-она

Смесь 1-фенилбутан-1,3-диона (20 г, 0,123 моль) и ацетат аммония (38 г, 0,49 моль) в сухом метаноле (200 мл) перемешивали и нагревали с обратным холодильником в течение 24 ч. Реакционную смесь концентрировали в вакууме и к остатку добавляли охлажденную воду с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и упаривали, получая 19 г желтого твердого вещества, представляющего собой 3-амино-1-фенилбут-2-ен-1-он.
Стадия 03: Синтез 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона
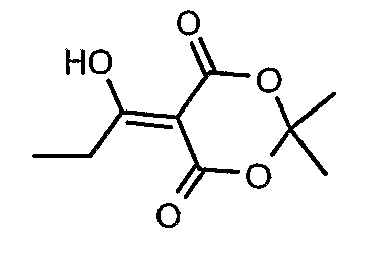
Пропионилхлорид (7 мл, 0,0763 моль) добавляли к раствору кислоты Мелдрама (10 г, 0,069 моль) в пиридине (12 мл, 0,138 моль) и метиленхлориде (50 мл) при 0°C в течение 30 мин, температуре реакционной смеси давали подняться до температуры окружающей среды и перемешивали в течение 1 ч. Реакционную смесь затем подкисляли, используя 1 н. хлористоводородную кислоту, и экстрагировали метиленхлоридом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 10 г 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона в виде твердого кристаллического вещества.
Стадия 04: Синтез 3-бензоил-6-этил-2-метил-1Н-пиридин-4-она
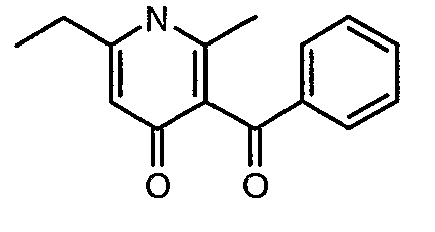
Смесь 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона (17,39 г, 0,087 моль) и 3-амино-1-фенилбут-2-ен-1-она (10 г, 0,062 моль) перемешивали и нагревали при 120°C в течение 2 ч. Затем реакционную смесь очищали хроматографией на колонке с силикагелем, элюируя желаемую фракцию 10%-ным метанолом и этилацетатом, получая 5,8 г 3-бензоил-6-этил-2-метил-1Н-пиридин-4-она в виде желтого твердого вещества.
Стадия 05: Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)фенилметанона
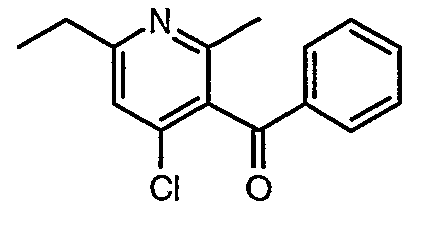
3-Бензоил-6-этил-2-метил-1Н-пиридин-4-он (2,7 г, 0,011 моль) добавляли к оксихлориду фосфора (8 мл) при 0°C. Затем реакционную смесь перемешивали, нагревали до 50°C и температуру реакционной смеси поддерживали в течение 8 часов. Проводили обработку, выпаривая оксихлорид фосфора в вакууме, и остаток, полученный таким образом, подщелачивали до рН 8 насыщенным раствором бикарбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия и концентрировали, получая 2,6 г (4-хлор-6-этил-2-метилпиридин-3-ил)фенилметанона в виде желтого масла.
Стадия 06: Синтез 6-этил-4-метил-3-фенил-1Н-пиразоло[4,3-c]пиридина
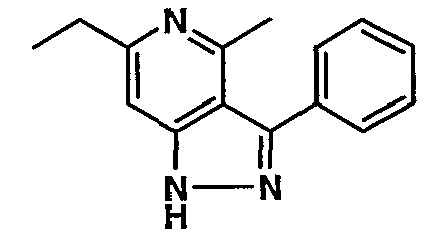
(4-хлор-6-этил-2-метилпиридин-3-ил)фенилметанон (2,5 г, 0,0096 моль) растворяли в этаноле (10 мл) и к реакционной смеси добавляли гидразингидрат (2,3 мл, 0,048 моль). Реакционную смесь перемешивали и нагревали с обратным холодильником в течение 4 часов. Затем реакционную смесь упаривали в вакууме. К остаточной массе добавляли воду со льдом, твердое вещество, полученное таким образом, отфильтровывали и сушили при отсасывании, получая 1,8 г 6-этил-4-метил-3-фенил-1Н-пиразоло[4,3-c]пиридина.
Стадия 07: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
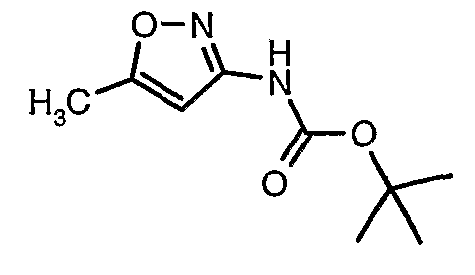
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси (245 г, 1,12 моль) за 1 час добавляли ди-трет-бутилбикарбонат. После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в 500 мл этилацетата. Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая 130 г трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 08: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
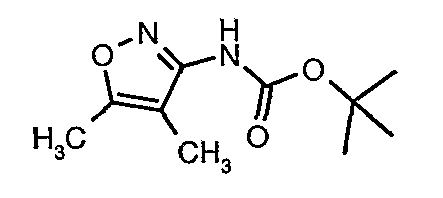
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 09: Синтез 4,5-диметилизоксазол-3-иламина
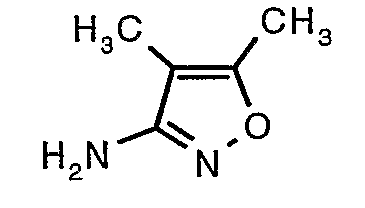
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями к трифторуксусной кислоте (22 мл, 0,3108 моль) при 0°C. После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 10: Синтез 3-бромтиофен-2-сульфонилхлорида
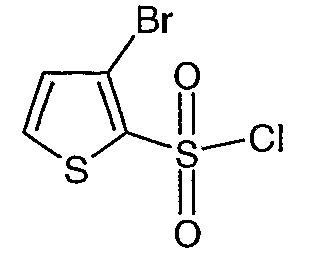
3-Бромтиофен (10 г, 0,0617 моль) помещали в метиленхлорид (60 мл) и охлаждали реакционную смесь до -78°C. Затем к реакционной смеси при -78°C добавляли по каплям хлорсульфоновую кислоту (25 мл, 0,396 моль). Температуру реакционной смеси медленно поднимали до 0°C и выдерживали в течение 1 часа. Реакционную смесь медленно вливали в ледяную воду с последующей экстракцией метиленхлоридом (100 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над безводным сульфатом натрия и упаривали в вакууме, получая твердое вещество коричневого цвета. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 5,4 г 3-бромтиофен-2-сульфонилхлорида.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты
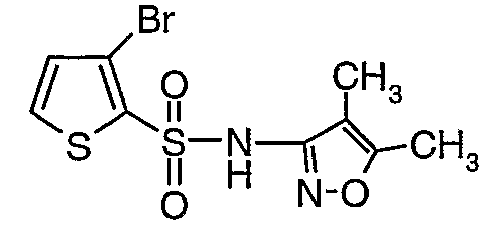
К раствору 3-амино-4,5-диметилизоксазола (2 г, 0,0178 моль) (25 мл) в пиридине и диметиламинопиридине (0,230 г, 0,0019 моль) при 0°C добавляли 3-бромтиофен-2-сульфонилхлорид (5,0 г, 0,01912). Затем температуру реакционной смеси медленно повышали до комнатной температуры (28°C) и затем реакционную смесь перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток подкисляли, используя 1 н. хлористоводородную кислоту, до рН 1 с последующей экстракцией дихлорметаном (50 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 3,5 г (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты
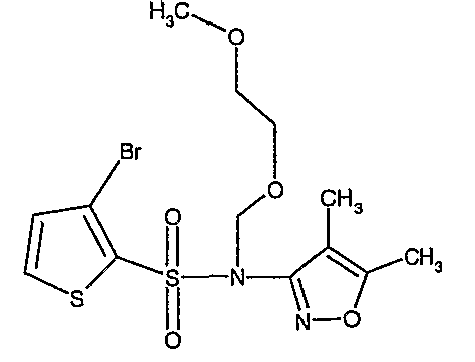
В токе сухого азота гидрид натрия (0,600 г, 0,0125 моль, 60% в минеральном масле) добавляли порциями к раствору (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты (3,5 г, 0,0103 моль) в N,N-диметилформамиде (30 мл) при -15°C. После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем реакционную смесь повторно охлаждали до 0°C. К реакционной смеси за 30 минут добавляли по каплям 2-метоксиэтоксиметилхлорид (1,55 г, 0,0124 моль), поддерживая температуру реакционной смеси 0°C. Реакционную смесь перемешивали при 0°C в течение 30 мин и затем при комнатной температуре в течение 4 ч. Затем реакционную смесь разбавляли этилацетатом (100 мл) с последующим добавлением (30 мл) ледяной воды. Органический слой отделяли, промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 2,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты в виде желтого масла.
Стадия 13: Синтез(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты
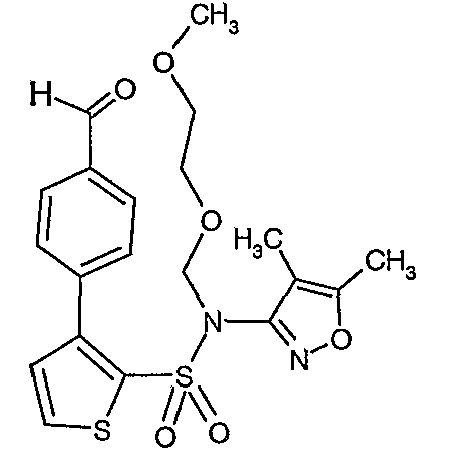
К перемешиваемому раствору 2,7 г (0,0063 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты и 1,04 г (0,006 моль) 4-формилбороновой кислоты в толуоле (15 мл) и этаноле (12 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (2 г в 16 мл воды). Реакционную смесь перемешивали в течение 15 минут, затем в реакционную смесь добавляли тетракистрифенилфосфинпалладий(0). Реакционную смесь нагревали до 85°C в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат (50 мл) с последующим упариванием в вакууме. К остаточной массе добавляли этилацетат (100 мл), затем охлажденную воду и смесь экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 1,1 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты
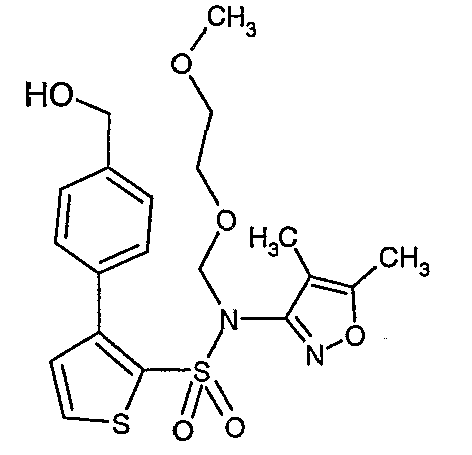
Литийалюминийгидрид (0,100 г, 0,0029 моль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана с последующим добавлением (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты (1,1 г, 0,0024 моль) в 15 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, затем температуру поднимали до комнатной температуры (28°C) и перемешивали в течение 4 ч. Реакционную смесь обрабатывали добавлением раствора гидроксида натрия (1 г, растворенный в 100 мл воды) в реакционную смесь при 0°C с последующей экстракцией этилацетатом (50 мл×2). Объединенные органические слои промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 1,0 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты
К охлажденному до 0°C раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты (1,0 г, 0,0022 моль) в 60 мл дихлорметана добавляли N-этилдиизопропиламин (0,6 мл, 0,0033 моль) с последующим медленным добавлением к реакционной смеси раствора метансульфонилхлорида (0,2 мл, 0,0033 моль) в 10 мл дихлорметана. Реакционную смесь затем нагревали и перемешивали при комнатной температуре в течение 3 ч. Осуществляли обработку добавлением в реакционную смесь ледяной воды с последующей экстракцией метиленхлоридом (25 мл×2). Объединенный органический экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 0,700 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты в виде вязкой жидкости.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
К перемешиваемому раствору 6-этил-4-метил-3-фенил-1Н-пиразоло[4,3-c]пиридина (0,344 г, 0,00145 моль) в диметилформамиде (5 мл) при 0°C в токе сухого газообразного азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,100 г, 0,00174 моль). После добавления температуру реакционной смеси повышали до комнатной температуры и выдерживали в течение 30 мин. Реакционную смесь затем повторно охлаждали до 0°C и добавляли по каплям раствор (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты (0,700 г, 0,00145 моль) в диметилформамиде (5 мл) и смесь перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл воды при 0°C, экстрагировали этилацетатом (50 мл×2) и объединенный органический экстракт промывали водой и насыщенным раствором соли. Затем органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 1,0 г (4,5-диметилизоксазол-3-ил(2-метоксиэтоксиметил)амида 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты в виде смолы.
Стадия 17: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
К 1,0 г (1,48 ммоль) 4,5-диметилизоксазол-3-ил(2-метоксиэтоксиметил)амида 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты при комнатной температуре добавляли 95%-ный этанол (10 мл) и 5 мл 6 н. водного раствора хлористоводородной кислоты. Реакционную смесь затем нагревали с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали и концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой и рН раствора доводили до рН 5 с использованием раствора бикарбоната натрия. Раствор экстрагировали этилацетатом (50 мл×2), объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 200 мг аморфной желтоватой пены.
Молекулярная формула: C31H29N5O3S2
Молекулярная масса: 583,72.
1H ЯМР (ДМСО-d6): 1,29 (т, J=7,2 Гц, 3H), 1,44 (с, 3H), 2,08 (с, 3H), 2,47 (с, 3H), 2,80-2,86 (м, 2H), 5,72 (с, 2H), 7,11-7,13 (м, 1Н), 7,28-7,31 (м, 2H), 7,40-7,43 (м, 2H), 7,51-7,56 (м, 4H), 7,65-7,68 (м, 2H), 7,90-7,92 (м, 1Н), 10,80 (ушир.с, 1Н).
Масс-спектр: (m-1) 582
Пример 3

(4,5-Диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-4-фенилсульфанил-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез 3-аминометилпентаноата
Смесь метилпропионилацетата (50 г, 0,3842 моль) и ацетата аммония (148 г, 1,921 моль) в сухом метаноле (500 мл) перемешивали и нагревали с обратным холодильником в течение 2 дней. Реакционную смесь охлаждали и концентрировали в вакууме. Остаток, полученный таким образом, подщелачивали до рН 8 и экстрагировали этилацетатом. Этилацетатный слой промывали водой, насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 50 г 3-аминометилпентаноата в виде светло-желтой жидкости.
Стадия 02: Синтез метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты
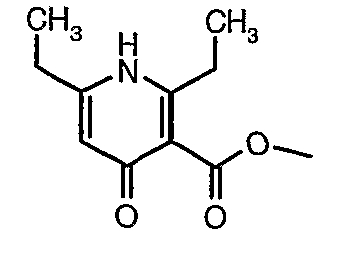
К смеси 3-аминометилпентаноата (50 г, 0,387 моль) и метилпропионилацетата (50 г, 0,384 моль) в o-ксилоле (200 мл) добавляли 40A молекулярные сита (50 г). Затем реакционную смесь перемешивали и нагревали с обратным холодильником с помощью аппарата Дина-Старка в течение 5 дней. Реакционную смесь охлаждали до комнатной температуры и молекулярные сита отфильтровывали. Фильтрат концентрировали и неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь 50% дихлорметан:метанол в качестве элюента, получая 20 г желаемого продукта в виде белого твердого вещества
Стадия 03: Синтез метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты
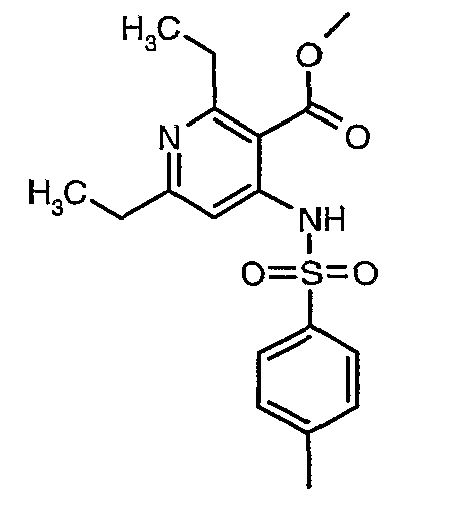
В токе сухого газообразного азота тозилизоцианат (39 г, 0,197 моль) добавляли к перемешиваемой суспензии 2,6-диэтил-4-оксо-1,4-дигидропиридин-3-метилкарбоксилата (25 г, 0,119 моль) в ацетонитриле (250 мл). После падения начальной экзотермы смесь нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и суспендированный твердый продукт отделяли фильтрованием, получая 20 г метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты.
Стадия 04: Синтез метилового эфира 4-амино-2,6-диэтилникотиновой кислоты
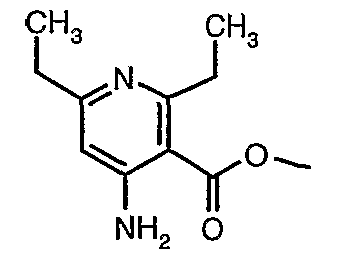
Метиловый эфир 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты (40 г, 0,110 моль) при 0°C добавляли к концентрированной серной кислоте (57 мл, 1,10 моль) и затем реакционную смесь перемешивали при 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и выливали на лед. pH полученного раствора доводили до рН 8 твердым карбонатом натрия и экстрагировали дихлорметаном (200 мл×2). Объединенные органические слои промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 19 г 4-амино-2,6-диэтилпиридин-3-метилкарбоксилата в виде белого твердого вещества
Стадия 05: Синтез этилового эфира 5,7-диэтил-4-гидрокси-2-оксо-1,2-дигидро[1, 6]нафтиридин-3-карбоновой кислоты
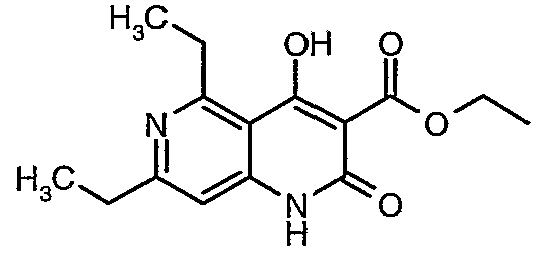
Диэтилмалонат (15 мл, 0,093 моль) и 4-амино-2,6-диэтилпиридин-3-метилкарбоксилат (19,0 г, 0,09 моль) добавляли к раствору этоксида натрия (7 г, 0,10 моль) в этаноле (60 мл) и реакционную смесь нагревали при 150°C и давлении 100 psi в течение 20 часов в автоклаве. Реакционной смеси давали охладиться, летучие вещества удаляли выпариванием и полученное полутвердое вещество растирали с простым эфиром, получая твердое вещество белого цвета, которое отделяли фильтрованием и растворяли в воде. Полученный раствор затем подкисляли 1 н. хлористоводородной кислотой, получая твердое вещество белого цвета, которое отфильтровывали и сушили при отсасывании, получая 11 г 5,7-диэтил-4-гидрокси-2-оксо-1,2-дигидро-1,6-нафтиридин-3-этилкарбоксилата в виде белого твердого вещества.
Стадия 06: Синтез 5,7-диэтил-4-гидрокси-1Н-[1,6]нафтиридин-2-она
5,7-диэтил-4-гидрокси-2-оксо-1,2-дигидро-1,6-нафтиридин-3-этилкарбоксилат (11 г) растворяли в смеси воды (11 мл), 1,4-диоксана (22 мл) и концентрированной хлористоводородной кислоты (11 мл), и реакционную смесь нагревали с обратным холодильником в течение 3 часов. Реакционную смесь затем охлаждали и суспендированное твердое вещество отфильтровывали, промывали этанолом и простым эфиром и сушили при отсасывании, получая 4,3 г 5,7-диэтил-4-гидрокси-1,6-нафтиридин-2(1Н)-она в виде белого твердого вещества.
Стадия 07: Синтез 4-хлор-5,7-диэтил-1,6-нафтиридин-2(1Н)-она

4,3 г (0,019 моль) 5,7-диэтил-4-гидрокси-1,6-нафтиридин-2(1Н)-она растворяли в 22 мл оксихлорида фосфора и реакционную смесь нагревали с обратным холодильником в течение 24 часов. Реакционную смесь концентрировали, остаток растворяли в концентрированной хлористоводородной кислоте (16 мл) и 22 мл воды и нагревали с обратным холодильником в течение 4 часов. Реакционную смесь разбавляли водой и подщелачивали твердым бикарбонатом натрия. Полученное твердое вещество отделяли фильтрованием, промывали водой и сушили при отсасывании, получая 3,0 г 4-хлор-5,7-диэтил-1,6-нафтиридин-2(1Н)-она в виде твердого вещества оранжевого цвета.
Стадия 08: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем полученную смесь охлаждали до 0°C. К реакционной смеси за 1 час добавляли ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая 130 г трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 09: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты

В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 10: Синтез 4,5-диметилизоксазол-3-иламина
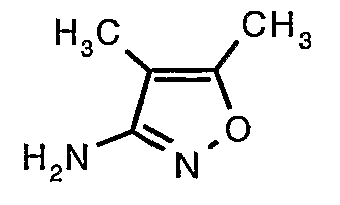
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями при 0°C к трифторуксусной кислоте (22 мл 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 11: Синтез 3-бромтиофен-2-сульфонилхлорида

3-Бромтиофен (10 г, 0,0617 моль) растворяли в метиленхлориде (60 мл) и реакционную смесь охлаждали до -78°C. Затем при -78°C добавляли по каплям хлорсульфоновую кислоту (25 мл, 0,396 моль). Температуру реакционной смеси медленно поднимали до 0°C и выдерживали в течение 1 часа. Реакционную смесь медленно вливали в холодную воду с последующей экстракцией метиленхлоридом (100 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над безводным сульфатом натрия, упаривали в вакууме, получая твердое вещество коричневого цвета. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 5,4 г 3-бромтиофен-2-сульфонилхлорида.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты
К раствору 3-амино-4,5-диметилизоксазола (2 г, 0,0178 моль) в 25 мл пиридина и диметиламинопиридине (0,230 г, 0,0019 моль) при 0°C добавляли 3-бромтиофен-2-сульфонилхлорид (5,0 г, 0,01912). Затем температуру реакционной смеси медленно повышали до комнатной температуры (28°C) и затем реакционную смесь перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток подкисляли, используя 1 н. хлористоводородную кислоту, до рН 1 с последующей экстракцией дихлорметаном (50 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 3,5 г (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты
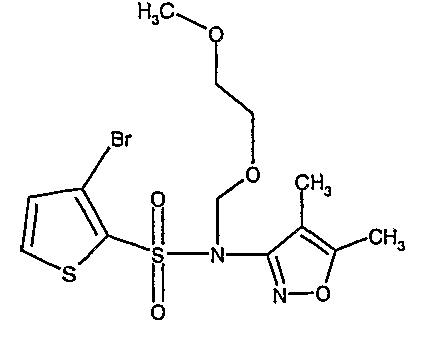
В токе сухого азота гидрид натрия (0,600 г, 0,0125 моль, 60% в минеральном масле) добавляли порциями к раствору (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты (3,5 г, 0,0103 моль) в N,N-диметилформамиде (30 мл). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем реакционную смесь повторно охлаждали до 0°C. К реакционной смеси за 30 минут добавляли по каплям 2-метоксиэтоксиметилхлорид (1,55 г, 0,0124 моль), поддерживая температуру реакционной смеси 0°C. Реакционную смесь перемешивали при 0°C в течение 30 мин и затем при комнатной температуре в течение 4 ч. Затем реакционную смесь разбавляли этилацетатом (100 мл) с последующим добавлением (30 мл) ледяной воды. Органический слой отделяли, промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 2,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты в виде желтого масла.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты
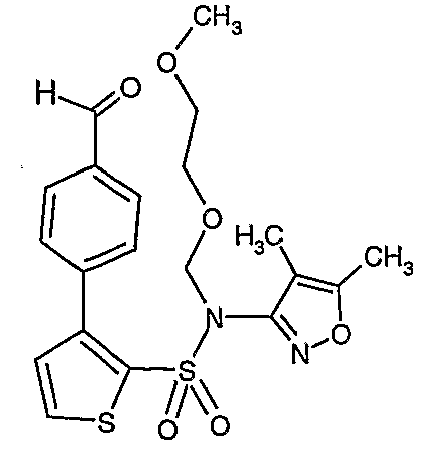
К перемешиваемому раствору 2,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида (0,0063 моль) 3-бромтиофен-2-сульфоновой кислоты и 1,04 г (0,006 моль) 4-формилбороновой кислоты в толуоле (15 мл) и этаноле (12 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (2 г в 16 мл воды). Реакционную смесь перемешивали в течение 15 минут и затем добавляли тетракистрифенилфосфинпалладий(0). Реакционную смесь затем нагревали при 85°C в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и затем добавляли этилацетат (50 мл). Реакционную смесь концентрировали в вакууме и к остаточной массе добавляли этилацетат (100 мл), затем охлажденную воду с последующей экстракцией этилацетатом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 1,1 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты
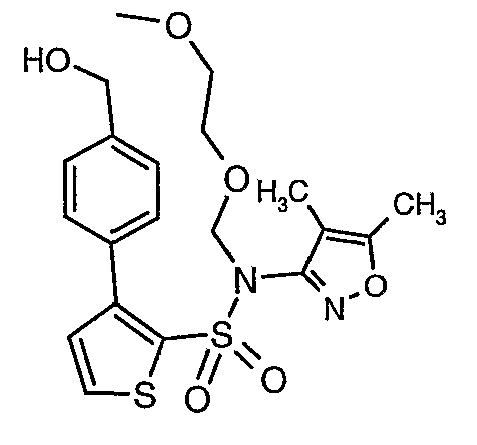
Литийалюминийгидрид (0,100 г, 0,0029 моль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана (15 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты (1,1 г, 0,0024 моль) в 15 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, температуру затем повышали до комнатной температуры (28°C) и перемешивали в течение 4 ч. Реакционную смесь обрабатывали добавлением в реакционную смесь при 0°C раствора гидроксида натрия (1 г, растворенного в 100 мл воды) с последующей экстракцией этилацетатом (50 мл×2). Объединенные органические слои промывали водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 1,0 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты
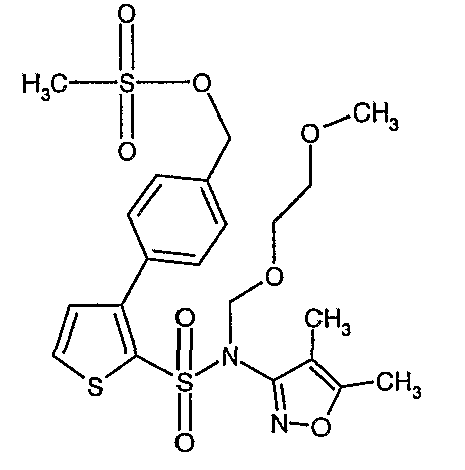
К охлажденному до 0°C раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты (1,0 г, 0,0022 моль) в 60 мл дихлорметана добавляли N-этилдиизопропиламин (0,6 мл, 0,0033 моль) с последующим медленным добавлением к реакционной смеси раствора метансульфонилхлорида (0,2 мл, 0,0033 моль) в 10 мл дихлорметана. Реакционную смесь затем нагревали и перемешивали при комнатной температуре в течение 3 ч. Осуществляли обработку добавлением в реакционную смесь ледяной воды с последующей экстракцией метиленхлоридом (25 мл×2). Объединенный органический экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 0,700 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты в виде вязкой жидкости.
Стадия 17: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хлор-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
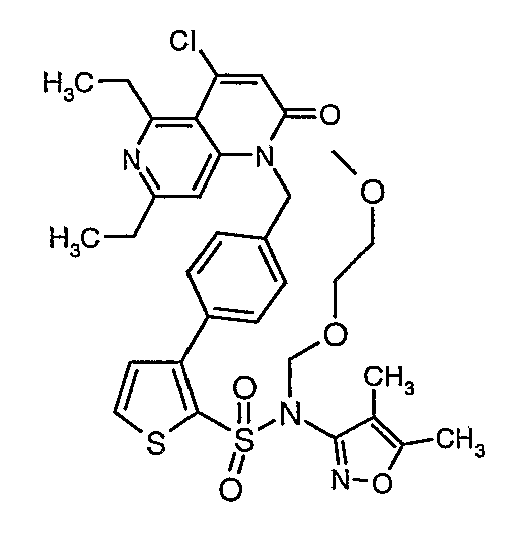
4-хлор-5,7-диэтил-1,6-нафтиридин-2-(1Н)-он (1 г, 4,22 ммоль) добавляли при 0°C в атмосфере азота к суспензии гидрида натрия (0,242 г, 5,04 ммоль, 50%) в 10 мл N,N-диметилформамида и смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь повторно охлаждали до 0°C и добавляли по каплям раствор (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты (2,4 г, 4,65 ммоль) в 10 мл N,N-диметилформамида. Реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь разбавляли 40 мл этилацетата, затем 10 мл холодной воды, органическую фазу отделяли и водный слой снова экстрагировали 20 мл этилацетата. Объединенный органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 300 мг (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хлор-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты.
Стадия 18: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-4-фенилсульфанил-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
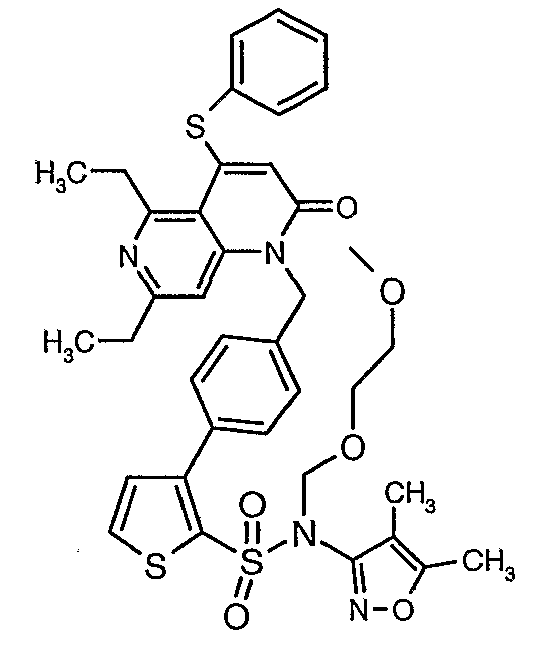
Гидрид натрия (25 мг, 0,83 ммоль 50%) добавляли к раствору тиофенола (0,04 мл, 0,44 ммоль) в 2 мл ДМФА и смесь перемешивали до прекращения кипения. Затем добавляли порциями твердую массу (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хлор-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (300 мг, 0,44 ммоль, spot-2). Реакционную смесь перемешивали и нагревали при 50°C в течение 2 часов, затем вливали в воду и перемешивали в течение 30 мин. Затем смесь подкисляли разбавленной хлористоводородной кислотой до рН 1 и экстрагировали этилацетатом. Этилацетатный слой промывали водой и насыщенным раствором соли. Затем органический слой сушили над сульфатом натрия и концентрировали, получая 300 мг (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-4-фенилсульфанил-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты в виде вязкой массы.
Стадия 19: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-4-фенилсульфанил-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты

(4,5-Диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-[4-(5,7-диэтил-2-оксо-4-фенилсульфанил-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (0,3 г, 0,40 ммоль) помещали в этанол (5 мл), добавляли 6 н. хлористоводородную кислоту (5 мл) и реакционную смесь нагревали с обратным холодильником в течение 2 ч при 100°C. Реакционную смесь концентрировали в вакууме, остаток, полученный таким образом, разбавляли водой, затем рН раствора доводили до pH 5 с помощью насыщенного раствора бикарбоната натрия и экстрагировали этилацетатом (25 мл×2). Этилацетатный слой промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 70 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-4-фенилсульфанил-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты в виде белого твердого вещества.
Молекулярная формула: C34H32N4O4S3
Молекулярная масса: 656,84.
1H ЯМР (ДМСО-d6): 1,19 (т, J=7,2 Гц, 3H), 1,42 (т, J=7,2 Гц, 3H), 1,46 (с, 3H), 2,11 (с, 3H), 2,76-2,78 (м, 2H), 3,47-3,52 (м, 2H), 5,48 (с, 2H), 5,80 (с, 1Н), 7,11 (д, J=4,8 Гц, 1Н), 7,21 (д, J=8,4 Гц, 2H), 7,37 (д, J=8 Гц, 2H), 7,65-7,75 (м, 6H), 7,94 (д, Гц J=5,2, 1Н), 10,83 (с, 1Н).
Масс-спектр: (m+1) 657.
Пример 4
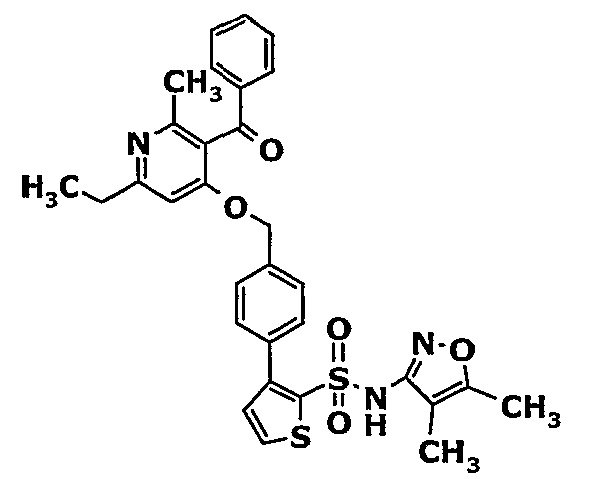
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(3-бензоил-6-этил-2-метилпиридин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез 1-фенилбутан-1,3-диона
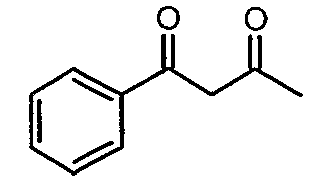
Этоксид натрия (13,5 г, 0,198 моль) при -5°C добавляли к перемешиваемому раствору сухого этилацетата (80 мл, 0,72 моль). К реакционной смеси при -5°C добавляли метилфенилкетон (20 г, 0,185 моль) и затем температуру реакционной смеси поддерживали при 0°C в течение 12 ч. Реакционную смесь затем подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенный органический слой промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и упаривали, получая 21 г желтого твердого вещества, представляющего собой 1-фенилбутан-1,3-дион.
Стадия 02: Синтез 3-амино-1-фенилбут-2-ен-1-она
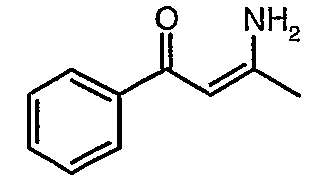
Смесь 1-фенилбутан-1,3-дион (20 г, 0,123 моль) и ацетат аммония (38 г, 0,49 моль) в сухом метаноле (200 мл) перемешивали и нагревали с обратным холодильником в течение 24 ч. Реакционную смесь концентрировали в вакууме и к остатку добавляли охлажденную воду с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и упаривали, получая 19 г желтого твердого вещества, представляющего собой 3-амино-1-фенилбут-2-ен-1-он.
Стадия 03: Синтез 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона
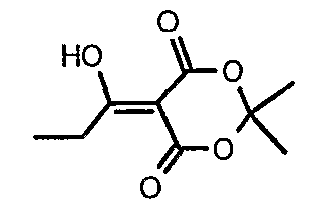
Пропионилхлорид (7 мл, 0,0763 моль) при 0°C за 30 минут добавляли к раствору кислоты Мелдрама (10 г, 0,069 моль) в пиридине (12 мл, 0,138 моль) и метиленхлориде (50 мл), температуре реакционной смеси давали подняться до температуры окружающей среды и затем перемешивали в течение 1 ч. Реакционную смесь затем подкисляли, используя 1н. хлористоводородную кислоту, и экстрагировали метиленхлоридом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 10 г 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона в виде твердого кристаллического вещества.
Стадия 04: Синтез 3-бензоил-6-этил-2-метил-1Н-пиридин-4-она
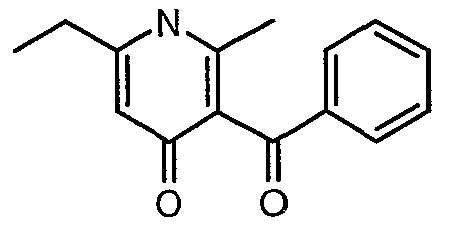
Смесь 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона (17,39 г, 0,087 моль) и 3-амино-1-фенилбут-2-ен-1-она (10 г, 0,062 моль) перемешивали и нагревали при 120°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и неочищенное соединение очищали на колонке с силикагелем, используя смесь 10% метанол:этилацетат в качестве элюента, получая 5,8 г 3-бензоил-6-этил-2-метил-1Н-пиридин-4-она в виде желтого твердого вещества.
Стадия 05: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
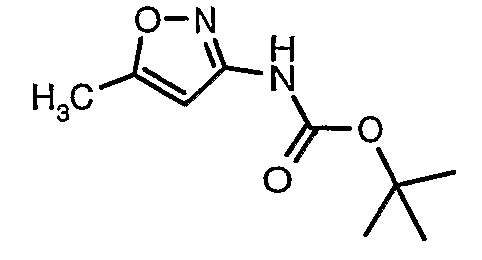
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 06: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты

В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 07: Синтез 4,5-диметилизоксазол-3-иламина
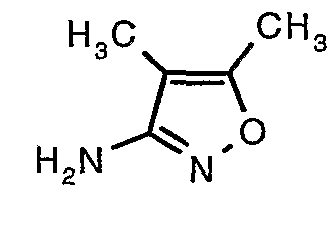
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) при 0°C добавляли порциями к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 08: Синтез 3-бромтиофен-2-сульфонилхлорида
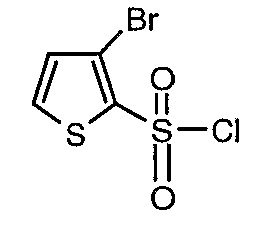
3-Бромтиофен (10 г, 0,0617 моль) помещали в метиленхлорид (60 мл) и охлаждали полученный раствор до -78°C. Затем к реакционной смеси при -78°C добавляли по каплям хлорсульфоновую кислоту (25 мл, 0,396 моль). Температуру реакционной смеси медленно поднимали до 0°C и выдерживали в течение 1 часа. Смесь затем медленно вливали в ледяную воду с последующей экстракцией метиленхлоридом (100 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над безводным сульфатом натрия и упаривали в вакууме, получая твердое вещество коричневого цвета. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 5,4 г 3-бромтиофен-2-сульфонилхлорида.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты
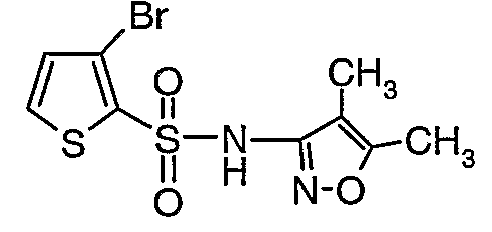
К раствору 3-амино-4,5-диметилизоксазола (2 г, 0,0178 моль) в 25 мл пиридина и диметиламинопиридине (0,230 г, 0,0019 моль) при 0°C добавляли 3-бромтиофен-2-сульфонилхлорид (5,0 г, 0,01912). Затем температуру реакционной смеси медленно повышали до комнатной температуры (28°C) и затем реакционную смесь перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток подкисляли, используя 1 н. хлористоводородную кислоту, до рН 1 с последующей экстракцией дихлорметаном (50 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 3,5 г (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты
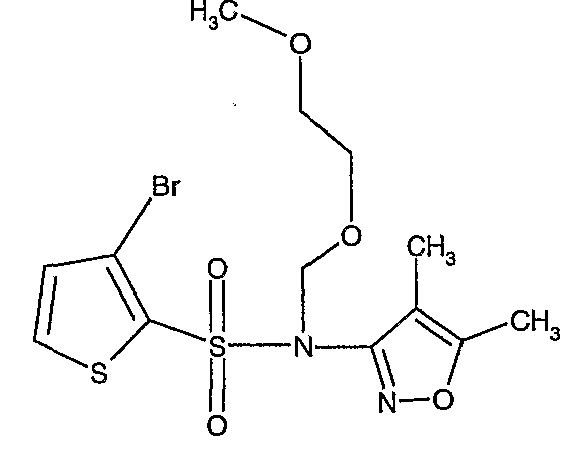
В токе сухого азота гидрид натрия (0,600 г, 0,0125 моль, 60% в минеральном масле) при -15°C добавляли порциями к раствору (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты (3,5 г, 0,0103 моль) в N,N-диметилформамиде (30 мл). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем реакционную смесь повторно охлаждали до 0°C. К реакционной смеси за 30 минут добавляли по каплям 2-метоксиэтоксиметилхлорид (1,55 г, 0,0124 моль), поддерживая температуру реакционной смеси 0°C. Реакционную смесь перемешивали при 0°C в течение 30 мин и затем при комнатной температуре в течение 4 ч. Затем реакционную смесь разбавляли этилацетатом (100 мл) с последующим добавлением (30 мл) ледяной воды. Органический слой отделяли, промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 2,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты в виде желтого масла.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты
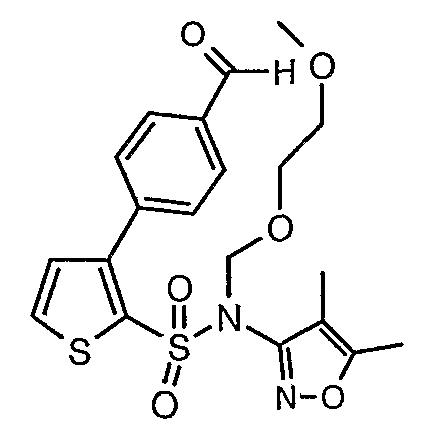
К перемешиваемому раствору (2,7 г, 0,0063 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты и 4-формилбороновой кислоты (1,04 г, 0,006 моль) в толуоле (15 мл) и этаноле (12 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (2 г в 16 мл воды). Реакционную смесь затем перемешивали в течение 15 минут, затем в реакционную смесь добавляли тетракистрифенилфосфинпалладий(0) (0,40 г, 0,00034 моль). Смесь нагревали при 85°C в течение 6 ч и затем охлаждали до комнатной температуры, затем добавляли этилацетат (50 мл). Реакционную смесь концентрировали в вакууме и к остаточной массе добавляли этилацетат (100 мл), затем охлажденную воду с последующей экстракцией этилацетатом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 1,1 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты
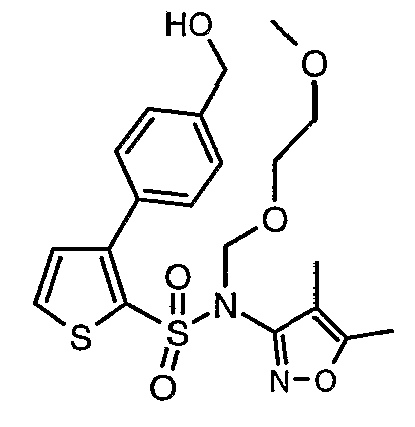
Литийалюминийгидрид (0,100 г, 0,0029 моль) добавляли в токе азота при 0°C и при перемешивании к тетрагидрофурану (25 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты (1,1 г, 0,0024 моль) в 15 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, температуру повышали до комнатной температуры (28°C) и смесь перемешивали в течение 4 ч. Реакционную смесь обрабатывали добавлением при 0°C раствора гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (50 мл×2). Объединенные органические слои промывали водой и насыщенным раствором соли, затем органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 1,0 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты
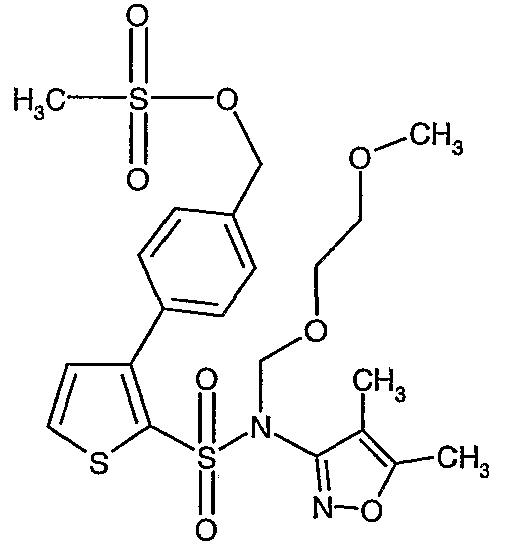
Охлажденному до 0°C раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты (1,0 г, 0,0022 моль) в 60 мл дихлорметана добавляли N-этилдиизопропиламин (0,6 мл, 0,0033 моль) с последующим медленным добавлением к реакционной смеси раствора метансульфонилхлорида (0,2 мл, 0,0033 моль) в 10 мл дихлорметана. Реакционную смесь затем нагревали и перемешивали при комнатной температуре в течение 3 ч. Осуществляли обработку добавлением в реакционную смесь ледяной воды с последующей экстракцией метиленхлоридом (25 мл×2). Объединенный органический экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 0,700 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты в виде вязкой жидкости.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(3-бензоил-6-этил-2-метилпиридин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты
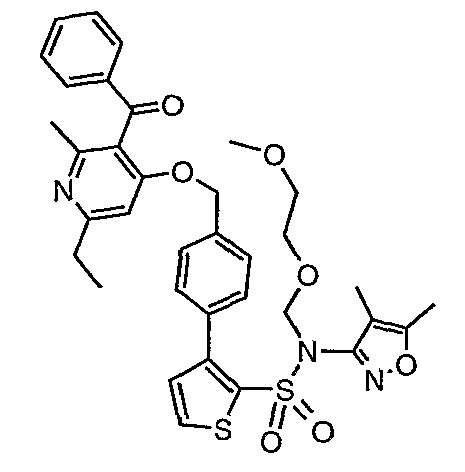
К перемешиваемому раствору 3-бензоил-6-этил-2-метил-1Н-пиридин-4-она (0,294 г, 0,0012 моль) в N,N-диметилформамиде (5 мл) при 0°C в токе сухого газообразного азота газового добавляли порциями гидрид натрия (60% в минеральном масле) (0,070 г, 0,0014 моль). После добавления температуру реакционной смеси повышали до комнатной температуры и выдерживали в течение 30 мин. Смесь повторно охлаждали до 0°C, добавляли по каплям раствор (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты (0,6 г, 0,0011 моль) в 5 мл диметилформамида и смесь перемешивали при комнатной температуре в течение 24 ч. Смесь затем охлаждали и разбавляли этилацетатом (40 мл) с последующим добавлением воды (10 мл) при 0°C, затем экстрагировали этилацетатом (50 мл×2), объединенный органический экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме, получая 0,5 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(3-бензоил-6-этил-2-метилпиридин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты в виде смолы.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(3-бензоил-6-этил-2-метилпиридин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты
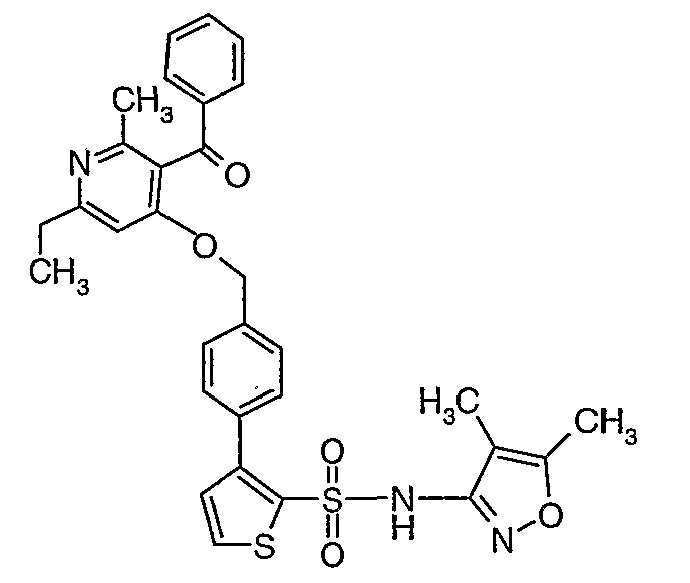
К 0,5 г (0,73 ммоль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-[4-(3-бензоил-6-этил-2-метилпиридин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты при комнатной температуре добавляли 95%-ный этанол (5 мл) и 5 мл 6 н. водного раствора хлористоводородной кислоты. Реакционную смесь нагревали с обратным холодильником в течение 3 ч и затем концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой и рН раствора доводили до величины рН 5 с помощью раствора бикарбоната натрия. Затем смесь экстрагировали этилацетатом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали, используя флэш-хроматографию на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 70 мг аморфной желтоватой пены, представляющей собой (4,5-диметилизоксазол-3-ил)амид 3-[4-(3-бензоил-6-этил-2-метилпиридин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты.
Молекулярная формула: C31H29N3O5S2
Молекулярная масса: 587,71.
1H ЯМР (ДМСО-d6): 1,26 (т, J=7,2 Гц, 3H), 1,48 (с, 3H), 2,12 (с, 3H), 2,22 (с, 3H), 2,74-2,81 (м, 2H), 5,19 (с, 2H), 6,98-7,01 (м, 1Н), 7,11-7,13 (м, 3H), 7,27-7,29 (м, 2H), 7,55-7,57 (м, 2H), 7,69-7,77 (м, 3H), 7,94 (м, 1Н), 10,85 (с, 1Н).
Масс-спектр: (m+1) 588.
Пример 5
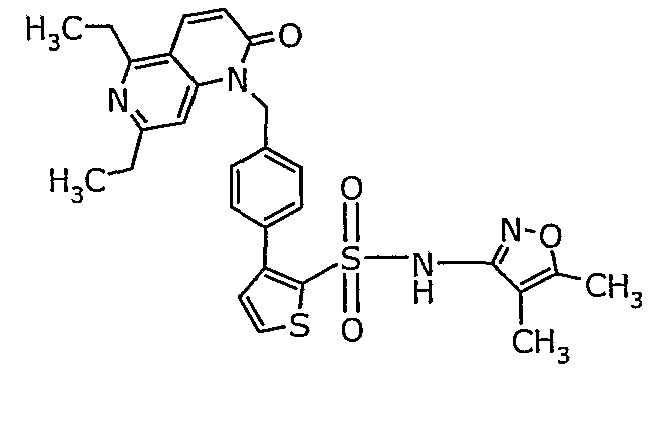
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
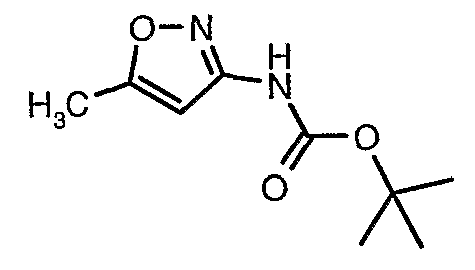
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 02: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты

В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 03: Синтез 4,5-диметилизоксазол-3-иламина
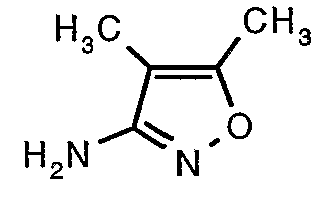
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) при 0°C добавляли порциями к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 04: Синтез 3-бромтиофен-2-сульфонилхлорида
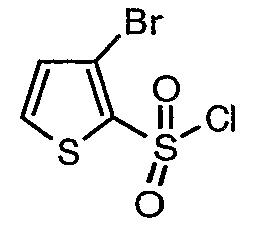
3-Бромтиофен (10 г, 0,0617 моль) растворяли в метиленхлориде (60 мл) и раствор охлаждали до -78°C. Затем к реакционной смеси при -78°C добавляли по каплям хлорсульфоновую кислоту (25 мл, 0,396 моль). Температуру реакционной смеси медленно повышали до 0°C и выдерживали в течение 1 часа. Реакционную смесь медленно вливали в ледяную воду с последующей экстракцией метиленхлоридом (100 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли и затем сушили над безводным сульфатом натрия, упаривали в вакууме, получая твердое вещество коричневого цвета. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 5,4 г 3-бромтиофен-2-сульфонилхлорида.
Стадия 05: Синтез (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты
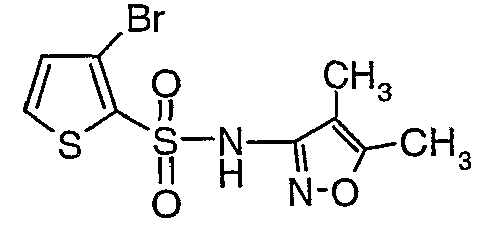
К раствору 3-амино-4,5-диметилизоксазола (2 г, 0,0178 моль) в 25 мл пиридина и диметиламинопиридине (0,230 г, 0,0019 моль) при 0°C добавляли 3-бромтиофен-2-сульфонилхлорид (5,0 г, 0,01912). Затем температуру реакционной смеси медленно повышали до комнатной температуры (28°C) и затем реакционную смесь перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток подкисляли, используя 1 н. хлористоводородную кислоту, до рН 1 с последующей экстракцией дихлорметаном (50 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 3,5 г (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-бромтиофен-2-сульфоновой кислоты
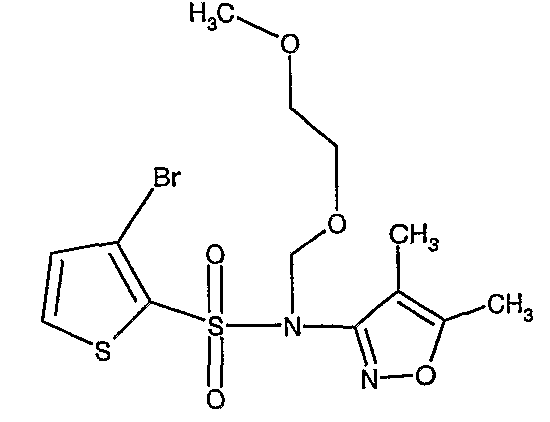
В токе сухого азота гидрид натрия (0,600 г, 0,0125 моль, 60% в минеральном масле) при -15°C добавляли порциями к раствору (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты (3,5 г, 0,0103 моль) в N,N-диметилформамиде (30 мл). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем реакционную смесь повторно охлаждали до 0°C. К реакционной смеси за 30 минут добавляли по каплям 2-метоксиэтоксиметилхлорид (1,55 г, 0,0124 моль), поддерживая температуру реакционной смеси 0°C. Реакционную смесь перемешивали при 0°C в течение 30 мин и затем при комнатной температуре в течение 4 ч. Затем реакционную смесь разбавляли этилацетатом (100 мл) с последующим добавлением (30 мл) ледяной воды. Органический слой отделяли, промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 2,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты в виде желтого масла.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-(4-формилфенил)тиофен-2-сульфоновой кислоты
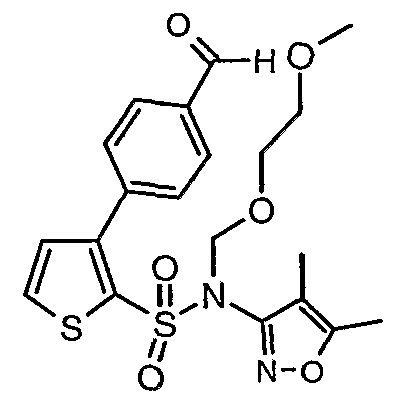
К перемешиваемому раствору 2,1 г (0,0063 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты и 4-формилбороновой кислоты 1,04 г (0,006 моль) в толуоле (15 мл) и этаноле (12 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (2 г в 16 мл воды). Реакционную смесь перемешивали в течение 15 минут и затем добавляли тетракистрифенилфосфинпалладий(0) (0,40 г, 0,00034 моль). Реакционную смесь нагревали при 85°C в течение 6 ч, затем охлаждали до комнатной температуры и добавляли этилацетат (50 мл). Реакционную смесь затем концентрировали в вакууме. К остаточному материалу добавляли этилацетат (100 мл), затем охлажденную воду с последующей экстракцией этилацетатом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем с использованием 1:2 гексан/этилацетат в качестве элюента, получая 1,1 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 08: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты
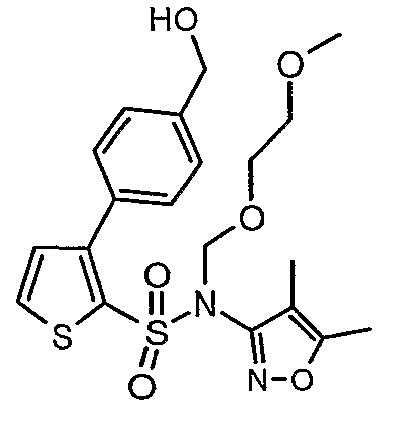
Литийалюминийгидрид (0,100 г, 0,0029 моль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана с последующим добавлением (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты (1,1 г, 0,0024 моль) в тетрагидрофуране (15 мл). Реакционную смесь перемешивали при 0°C в течение 1 ч, затем температуру повышали до комнатной температуры (28°C) и перемешивали в течение 4 ч. Реакционную смесь обрабатывали добавлением раствора гидроксида натрия (1 г, растворенный в 100 мл воды) при 0°C с последующей экстракцией этилацетатом (50 мл×2). Объединенные органические слои промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме, получая 1,0 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты

К охлажденному до 0°C раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты (1,0 г, 0,0022 моль) в 60 мл дихлорметана добавляли N-этилдиизопропиламин (0,6 мл, 0,0033 моль) с последующим медленным добавлением к реакционной смеси раствора метансульфонилхлорида (0,2 мл, 0,0033 моль) в 10 мл дихлорметана. Реакционную смесь затем нагревали и перемешивали при комнатной температуре в течение 3 ч. Осуществляли обработку добавлением в реакционную смесь ледяной воды с последующей экстракцией метиленхлоридом (25 мл×2). Объединенный органический экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 0,700 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты в виде вязкой жидкости.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]-1-илметил)фенил]тиофен-2-сульфоновой кислоты
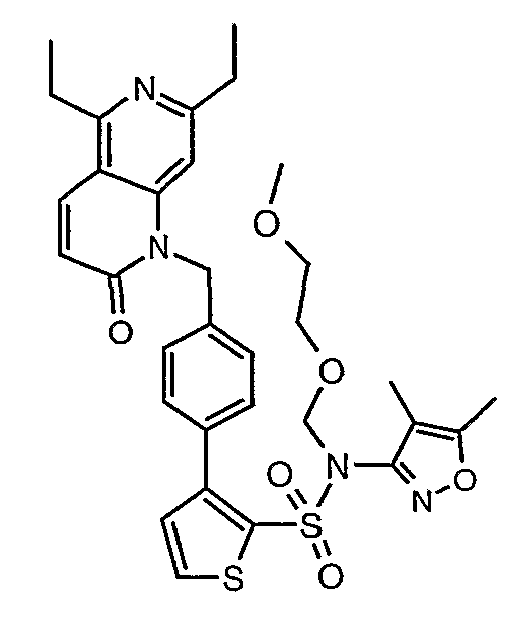
К перемешиваемому раствору 5,7-диэтил-1Н-[1,6]нафтиридин-2-она (0,4 г, 0,0020 моль) в N,N-диметилформамиде (5 мл) при 0°C в токе сухого газообразного азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,115 г, 0,0025 моль). После добавления температуру реакционной смеси повышали до комнатной температуры и выдерживали в течение 30 мин. Реакционную смесь повторно охлаждали до 0°C и добавляли по каплям раствор (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты (1,0 г, 0,0020 моль) в N,N-диметилформамиде (5 мл) и смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь затем разбавляли этилацетатом (40 мл), затем водой (10 мл) при 0°C и затем экстрагировали этилацетатом (50 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме, получая неочищенное соединение. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 460 мг (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтаридин-1-ил)фенил]тиофен-2-сульфоновой кислоты в виде смолы.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
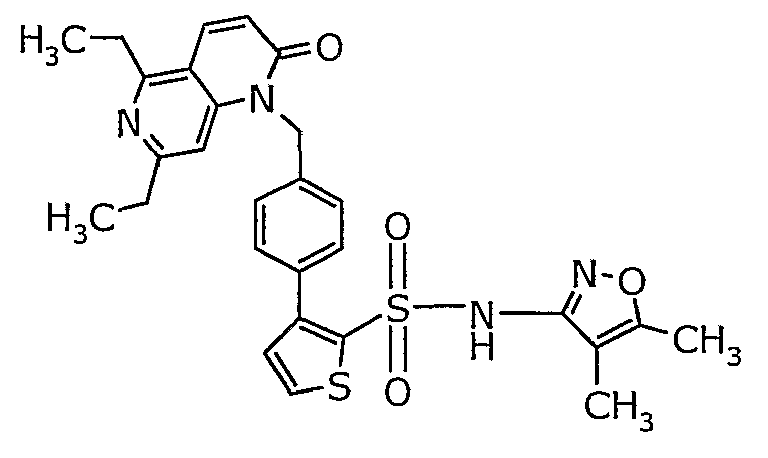
К 0,460 г (0,75 ммоль) (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-ил)фенил]тиофен-2-сульфоновой кислоты при комнатной температуре добавляли 95%-ный этанол (5 мл) и 5 мл 6 н. водного раствора хлористоводородной кислоты. Реакционную смесь нагревали с обратным холодильником в течение 3 ч и затем концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой, рН раствора доводили до величины рН 5 с использованием раствора бикарбоната натрия и смесь экстрагировали этилацетатом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали, используя флэш-хроматографию на колонке с силикагелем, используя смесь l:l гексан/этилацетат в качестве элюента, получая 200 мг желтоватой пены, представляющей собой (4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты.
Молекулярная формула: C28H28N4O4S2
Молекулярная масса: 548,67.
1H ЯМР (ДМСО-d6): 1,17 (т, J=7,2 Гц, 3H), 1,25 (т, J=7,2 Гц, 3H), 1,45 (с, 3H), 2,10 (с, 3H), 2,70-2,76 (м, 2H), 3,04-3,11 (м. 2H), 5,53 (с, 2H), 6,72 (д, J=IO Гц, 1Н), 7,12 (д, J=5,2 Гц, 1Н), 7,16 (с, 1Н), 7,23 (д, Гц J=8 2H), 7,39 (д, Гц J=8, 2H), 7,94 (д, J=4,8 Гц, 1Н), 8,24 (д, Гц J=10, 1Н), 10,83 (с, 1Н). Масс-спектр: (m-1) 547.
Пример 6
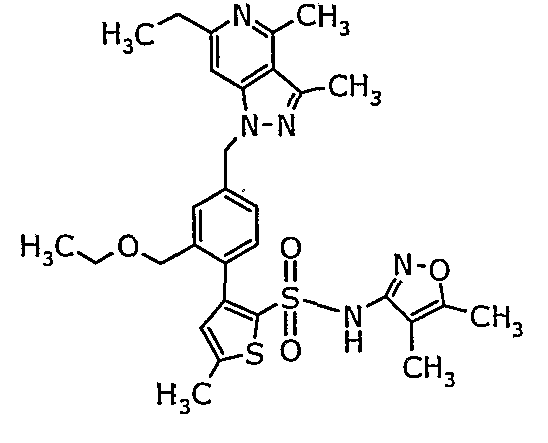
(4,5-Диметилизоксазол-3-ил)амид 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона
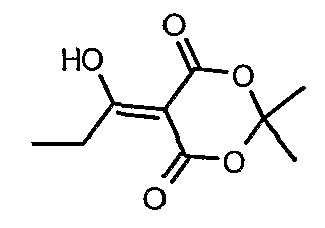
Пропионилхлорид (35 мл, 0,381 моль) добавляли за 30 минут к раствору кислоты Мелдрама (50 г, 0,345 моль) в пиридине (60 мл, 0,690 моль) и метиленхлориде (200 мл) при 0°C, температуре реакционной смеси давали подняться до температуры окружающей среды и перемешивали в течение 1 ч. Смесь затем подкисляли, используя 1 н. хлористоводородную кислоту, и экстрагировали метиленхлоридом (200 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме, получая 50 г 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона в виде твердого кристаллического вещества.
Стадия 02: Синтез 3-ацетил-6-этил-2-метил-1Н-пиридин-4-она
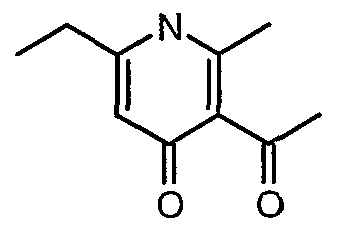
Смесь 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона (37,8 г, 0,189 моль) и 4-аминопент-3-ен-2-она (12,5 г, 0,126 моль) нагревали с обратным холодильником при 120°C в течение 2 ч. Реакционную смесь охлаждали и неочищенное соединение очищали на колонке с силикагелем, используя смесь 10% метанол:этилацетат в качестве элюента, получая 6 г 3-ацетил-6-этил-2-метил-1Н-пиридин-4-она в виде желтого твердого вещества.
Стадия 03: Синтез 1-(4-хлор-6-этил-2-метилпиридин-3-ил)этанона
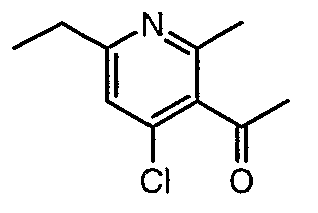
3-Ацетил-6-этил-2-метил-1Н-пиридин-4-он (5 г, 0,027 моль) при 0°C добавляли к 10 мл оксихлорида фосфора. Реакционную смесь нагревали и перемешивали при 50°C и выдерживали при этой температуре в течение 8 часов. Реакционную смесь упаривали в вакууме и остаток, полученный таким образом, подщелачивали до рН 8 насыщенным раствором бикарбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали, получая 3,2 г 1-(4-хлор-6-этил-2-метилпиридин-3-ил)этанона в виде желтой масляной жидкости.
Стадия 04: Синтез 6-этил-3,4-диметил-1Н-пиразоло[4,3-с]пиридина
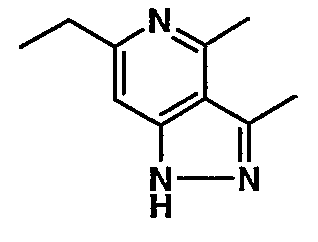
1-(4-хлор-6-этил-2-метилпиридин-3-ил)этанон (1,7 г, 0,0086 моль) растворяли в этаноле (20 мл) и к раствору добавляли гидразингидрат (2,15 мл, 0,038 моль). Реакционную смесь медленно нагревали с обратным холодильником и выдерживали при кипении с обратным холодильником в течение 4 часов. Реакционную смесь упаривали в вакууме и остаток помещали на лед. Твердое вещество, полученное таким образом, отфильтровывали и сушили при отсасывании, получая 1 г 6-этил-3,4-диметил-1Н-пиразоло[4,3-c]пиридина.
Стадия 05: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
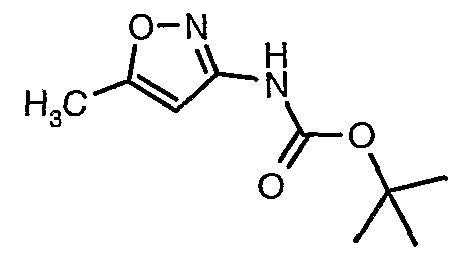
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 06: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
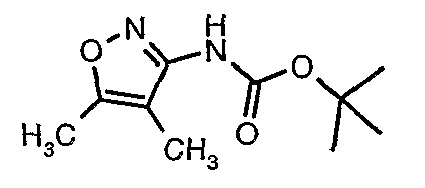
В сухой атмосфере азота (5-метилизоксазол-3-ил)карбаминовой кислоты трет-бутиловый эфир (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 07: Синтез 4,5-диметилизоксазол-3-иламина
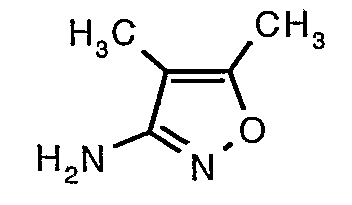
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) при 0°C добавляли порциями к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 08: Синтез 5-метилтиофен-2-сульфонилхлорида
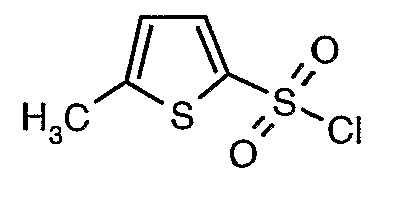
2-метилтиофен (50 г, 0,51 моль) в хлороформе при температуре от -5°C до 0°C добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе (100 мл). Реакционную смесь выдерживали при 0°C в течение 3 ч и неочищенный материал реакции медленно помещали в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
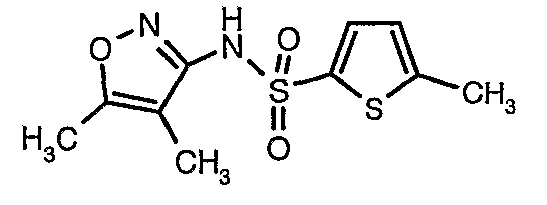
Раствор 5-метилтиофен-2-сульфонилхлорида (10,5 г, 0,053 моль) в 15 мл метиленхлорида при 0°C добавляли к раствору 3-амино-4,5-диметилизоксазола (4 г, 0,035 моль) и диметиламинопиридина (500 мг) в пиридине (20 мл). После завершения добавления температуру реакционной смеси медленно повышали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 4,0 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
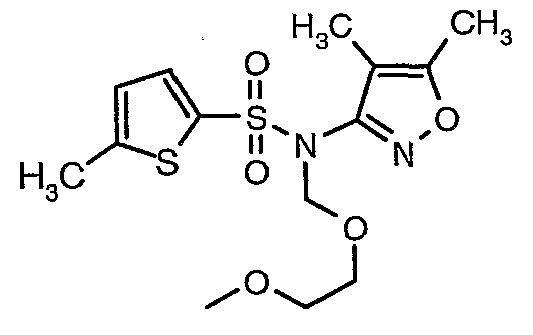
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60%-ная дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C с последующим добавлением по каплям к реакционной смеси метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, добавляли (90 мл) этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси 25 мл воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 11: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамид
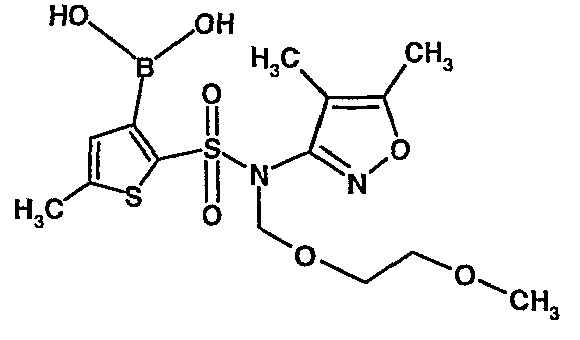
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. Медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно повышали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 12: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
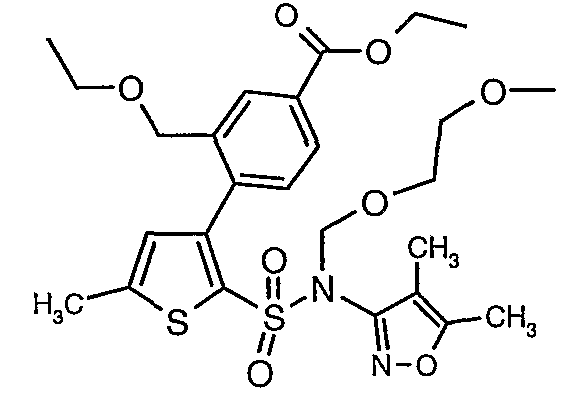
К перемешиваемому раствору 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (15 г, 0,037 моль) и этилового эфира 4-бром-3-этоксиметилбензойной кислоты (11 г, 0,038 моль) в толуоле (120 мл) и этаноле (60 мл) в атмосфере азота добавляли водный раствор 2M карбоната натрия (4,0 г в 19 мл воды). Реакционную смесь перемешивали в атмосфере азота в течение 15 минут и затем добавляли тетракистрифенилфосфинпалладий(0) (2,15 г, 0,0018 моль). Смесь нагревали до 85°C в течение 6 часов. Реакционную смесь концентрировали, к остатку добавляли этилацетат (25 мл), затем охлажденную воду и экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали полностью в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 8 г этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в виде маслянистой массы.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
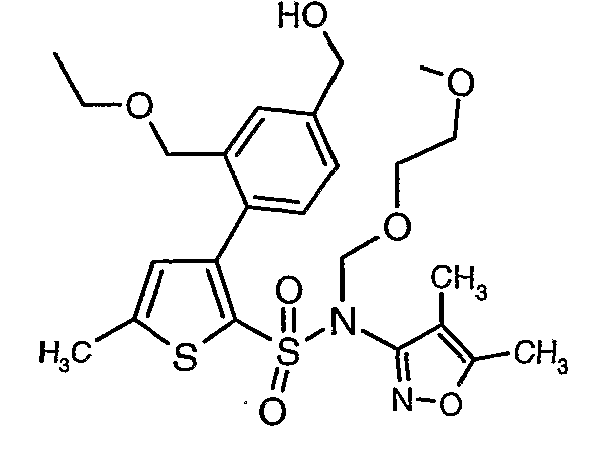
Алюмогидрид лития (1,4 г, 0,037 моль) при 0°C в токе азота добавляли к перемешиваемому раствору тетрагидрофурана с последующим добавлением этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилфенил)уксусной кислоты (8 г, 0,014 моль) в 35 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 часа, затем температуру повышали до комнатной температуры и смесь перемешивали в течение 4 часов. Избыток алюмогидрида лития разрушали добавлением при 0°C раствора гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали полностью в вакууме, получая 4,7 г (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 14: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты
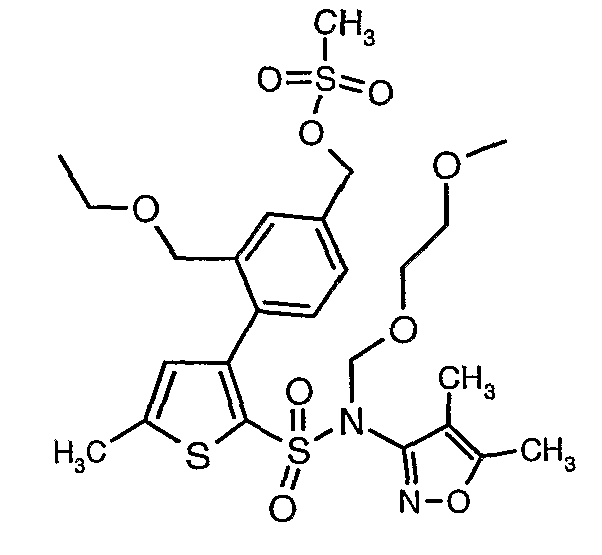
N-этилдиизопропиламин (2,13 мл, 0,012 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (3,2 г, 0,0060 моль) в 10 мл дихлорметана. Реакционную смесь охлаждали до 0°C, затем в реакционную смесь медленно добавляли метансульфонилхлорид (0,6 мл, 0,0073 моль). Смесь выдерживали при комнатной температуре в течение 3 часов и затем помещали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 3,3 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
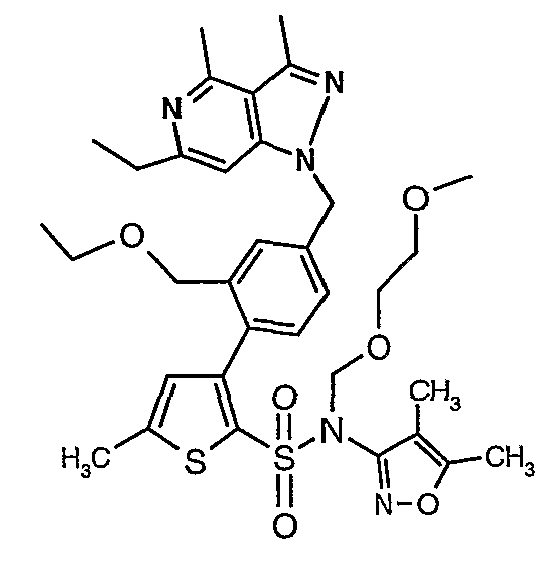
К перемешиваемому раствору 6-этил-3,4-диметилпиразоло[4,3-c]пиридина (0,380 г, 0,0021 моль) в N,N-диметилформамиде (5 мл) при -15°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,125 г, 0,0026 моль). После завершения добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь затем повторно охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (1,25 г, 0,002 ммоль) в 5 мл N,N-диметилформамида, затем перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой отделяли, затем промывали водой и насыщенным раствором соли, наконец, сушили над сульфатом натрия и упаривали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 1,0 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты

К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (1,0 г, 1,46 ммоль) при комнатной температуре добавляли 95%-ный этанол (7 мл) и 6 н. водный раствор хлористоводородной кислоты (7 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч и затем концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой и рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия. Полученный раствор затем подкисляли до pH 5 уксусной кислотой и экстрагировали этилацетатом (25 мл×2). Объединенные органические слои промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 200 мг (4,5-диметилизоксазол-3-ил)амида 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C30H35N5O4S2
Молекулярная масса: 593,76.
1H ЯМР (ДМСО-d6): 1,02 (т, J=6,8 Гц, 3H), 1,26 (т, J=6,8 Гц, 3H), 1,49 (с, 3H), 2,14 (с, 3H), 2,46 (с, 3H), 2,63 (с, 3H), 2,76 (м, 5H), 3,24-3,28 (м, 2H), 4,05 (с, 2H), 5,55 (с, 2H), 6,68 (с, 1Н), 6,92 (д, 1=1,6 Гц, 1Н), 6,99 (д, J=7,6 Гц, 1Н), 7,28 (с, 1Н), 7,38 (с, 1Н), 10,85 (с, 1Н).
Масс-спектр: (m+1) 594.
Пример 7
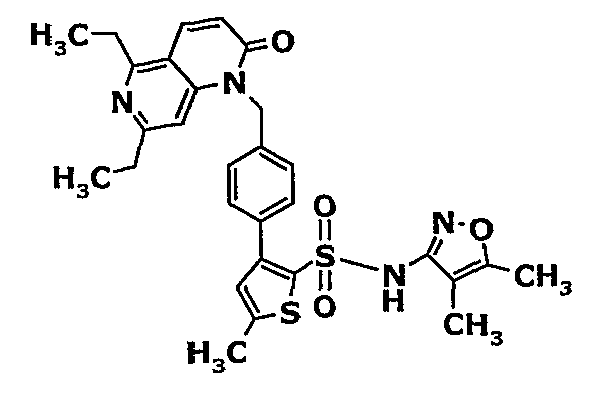
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
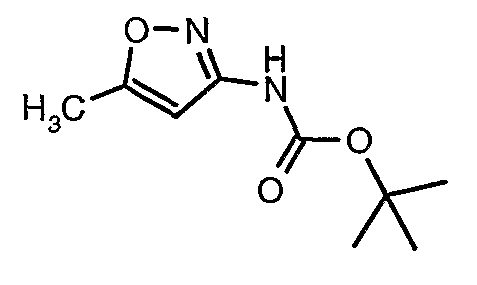
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая 130 г трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 02: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
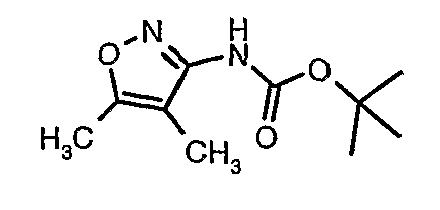
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 ч. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 03: Синтез 4,5-диметилизоксазол-3-иламина
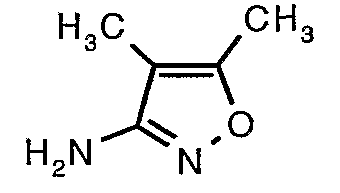
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) при 0°C добавляли порциями к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 04: Синтез 5-метилтиофен-2-сульфонилхлорида
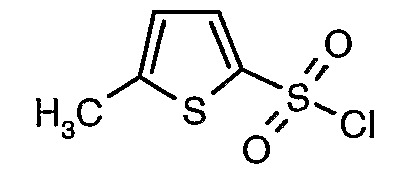
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Температуру реакционной смеси выдерживали при 0°C в течение 3 ч. Неочищенную реакционную массу медленно вводили в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 05: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
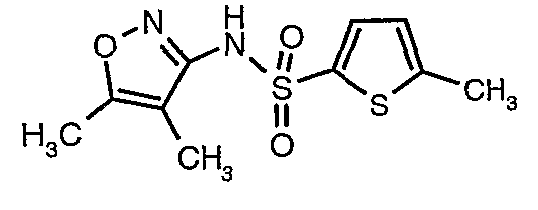
Раствор 5-метилтиофен-2-сульфонилхлорида (10,5 г, 0,053 моль) в (15 мл) метиленхлорида добавляли при 0°C к раствору 3-амино-4,5-диметилизоксазола (4 г, 0,035 моль) и диметиламинопиридина (500 мг) в пиридине (20 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 4,0 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
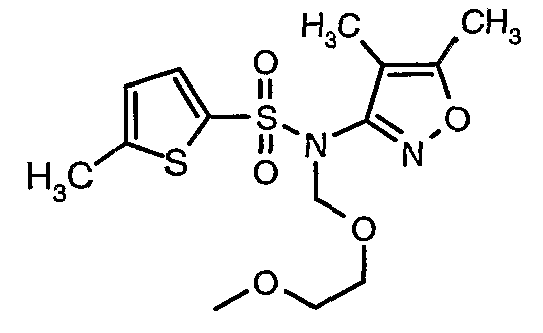
При 0°C при перемешивании гидрид натрия (0,800 г, 0,166 моль, 60%-ная дисперсия в минеральном масле) добавляли к N,N-диметилформамиду (30 мл) с последующим добавлением 5-метилтиофен-2-сульфоновой кислоты (4,5-диметилизоксазол-3-ил)амид (4 г, 0,0146 моль). После завершения добавления температуру реакционной смеси медленно поднимали и перемешивали при температуре окружающей среды в течение 30 минут, затем реакционную смесь повторно охлаждали до 0°C с последующим добавлением к реакционной смеси по каплям метоксиэтоксиметилхлорида (2,7 г, 0,021 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, добавляли (90 мл) этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 3,7 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 07: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
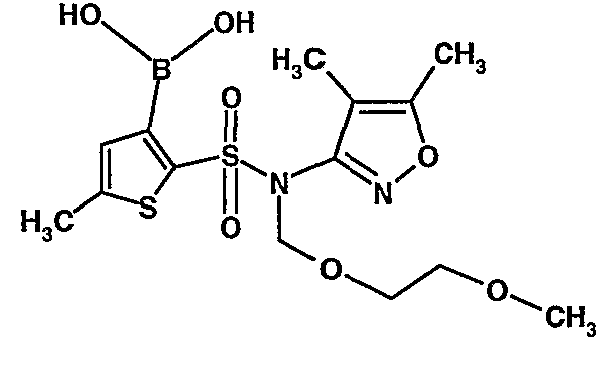
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно повышали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смеси перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 08: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)-5-метилтиофен-2-сульфоновой кислоты
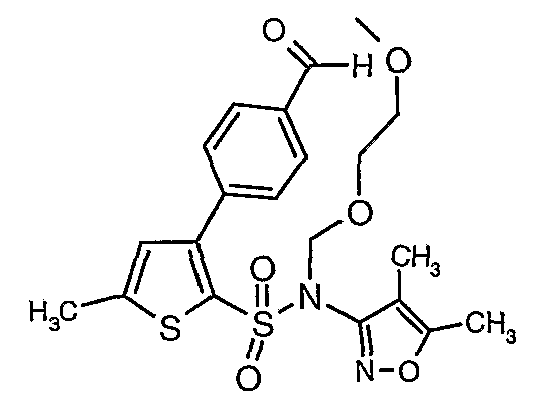
К перемешиваемому раствору 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (3,4 г, 0,008 моль) и 4-бромбензальдегида (1,5 г, 0,0081 моль) в толуоле (20 мл) и этаноле (10 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (2,36 г в 11 мл воды). Реакционную смесь перемешивали в атмосфере азота в течение 15 минут, затем добавляли тетракистрифенилфосфинпалладий(0) (0,430 г, 0,00037 моль) и реакционную смесь нагревали при 85°C в течение 6 ч. Смесь охлаждали и добавляли этилацетат (25 мл) с последующим перемешиванием при комнатной температуре в течение 10 мин. Реакционную смесь концентрировали и остаток, полученный таким образом, растворяли в этилацетате (100 мл) с последующей промывкой водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 1,8 г 3-(4-формилфенил)-5-метилтиофен-2-(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида в виде маслянистой массы.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
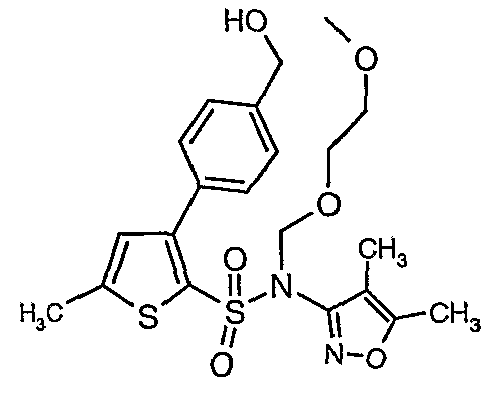
Алюмогидрид лития (0,300 г, 0,0088 моль) добавляли к тетрагидрофурану при 0°C в сухой атмосфере азота с последующим добавлением (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты (1,8 г, 0,0039 моль) в 15 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, затем температуру повышали до комнатной температуры и перемешивали в течение 4 ч. Избыток алюмогидрида лития разрушали добавлением раствора гидроксида натрия (1 г, растворенный в 100 мл воды) при 0°C с последующей экстракцией этилацетатом (50 мл×2). Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 1,5 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты в виде масляной жидкости.
Стадия 10: Синтез 3-(4-метансульфонилметилфенил)-5-метилтиофен-2-(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида
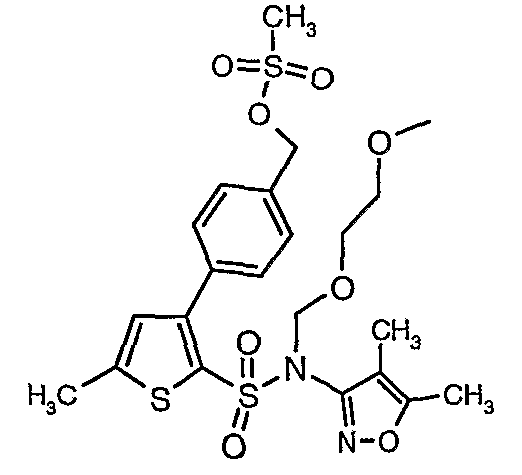
К раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (1,5 г, 0,0032 моль) в 20 мл дихлорметана добавляли N-этилдиизопропиламин (1,2 мл, 0,0034 моль). Реакционную смесь охлаждали до 0°C и затем в реакционную смесь медленно добавляли метансульфонилхлорид (0,3 мл, 0,0038 моль). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 3 ч. Затем смесь вливали в ледяную воду с последующей экстракцией метиленхлоридом (25 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 0,800 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)-5-метилтиофен-2-сульфоновой кислоты в виде вязкой жидкости.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты

К перемешиваемому раствору 5,7-диэтил-1Н-[1,6]нафтиридин-2-она (0,467 г, 2,3 ммоль) в N,N-диметилформамиде (3 мл) при -15°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,170 г, 3,5 ммоль). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 30 мин. Затем реакционную смесь повторно охлаждали до 0°C и добавляли по каплям раствор (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)-5-метилтиофен-2-сульфоновой кислоты (1,2 г, 2,2 ммоль) в 10 мл N,N-диметилформамида, реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Затем реакционную смесь разбавляли этилацетатом (40 мл) и водой (20 мл). Органический слой отделяли, промывали водой и насыщенным раствором соли и, наконец, сушили над сульфатом натрия и упаривали в вакууме. Неочищенное соединение очищали на колонке с силикагелем с использованием смеси 1:4 гексан/этилацетат в качестве элюента, получая 0,500 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты в виде масляной жидкости.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
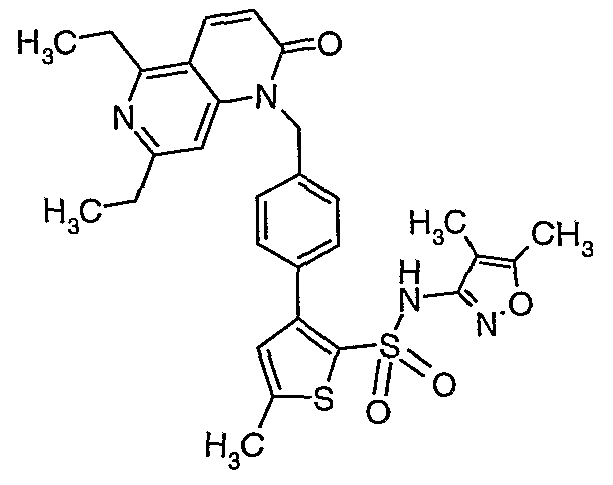
К раствору 95%-ого этанола (6 мл) и 6 н. водного раствора хлористоводородной кислоты (6 мл) при комнатной температуре добавляли (0,500 г, 0,76 ммоль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты. Реакционную смесь затем нагревали с обратным холодильником в течение 3 ч и концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой, рН раствора доводили до рН 5 с помощью раствора бикарбоната натрия и экстрагировали этилацетатом (30 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали, получая 400 мг неочищенного продукта, который очищали на колонке с силикагелем с использованием смеси 1:4 гексан/этилацетат в качестве элюента, получая 340 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты в виде белого твердого вещества.
Молекулярная формула: C29H30N4O4S2
Молекулярная масса: 562,70.
1H ЯМР (ДМСО-d6): 1,18 (т, J=7,2 Гц, 3H), 1,26 (т, J=7,2 Гц, 3H), 1,46 (с, 3H), 2,11 (с, 3H), 2,47 (с, 3H), 2,76-2,80 (м, 2H), 3,12-3,17 (м, 2H), 5,54 (с, 2H), 6,79-6,81 (м, 1Н), 6,86 (с, 1Н), 7,20-7,26 (м, 3H), 7,36 (д, J=8,4 Гц, 2H), 8,28-8,31 (м, 1Н), 10,74 (с, 1Н).
Масс-спектр: (m-1) 561.
Пример 8
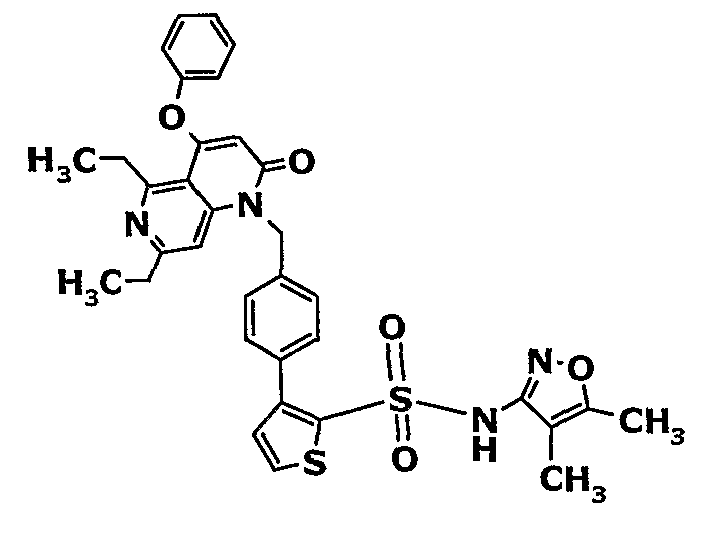
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-4-фенокси-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез 3-аминометилпентаноата
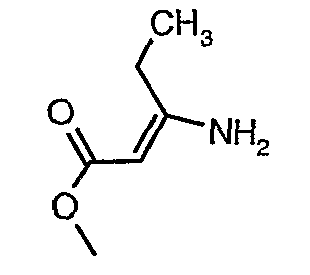
Смесь метилпропионилацетата (50 г, 0,3842 моль) и ацетата аммония (148 г, 1,921 моль) в сухом метаноле (500 мл) перемешивали и нагревали с обратным холодильником в течение 2 дней. Реакционную смесь охлаждали и концентрировали в вакууме. Остаток, полученный таким образом, подщелачивали до рН 8 и экстрагировали этилацетатом. Этилацетатный слой промывали водой, насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 50 г 3-аминометилпентаноата в виде светло-желтой жидкости.
Стадия 02: Синтез метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты
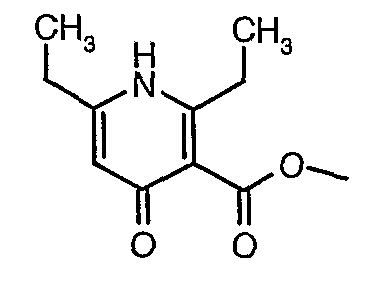
К смеси 3-аминометилпентаноата (50 г, 0,387 моль) и метилпропионилацетата (50 г, 0,384 моль) в o-ксилоле (200 мл) добавляли (50 г) 40A молекулярные сита. Реакционную смесь перемешивали и нагревали с обратным холодильником с помощью аппарата Дин Старка в течение 5 дней. Смесь охлаждали до комнатной температуры и молекулярные сита отфильтровывали от реакционной смеси. Фильтрат концентрировали и неочищенное соединение очищали на колонке с силикагелем, используя смесь 50% дихлорметан:метанол в качестве элюента, получая 20 г желаемого продукта в виде белого твердого вещества.
Стадия 03: Синтез метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты

В токе сухого газообразного азота тозилизоцианат (39 г, 0,197 моль) добавляли к перемешиваемой суспензии 2,6-диэтил-4-оксо-1,4-дигидропиридин-3-метилкарбоксилата (25 г, 0,119 моль) в ацетонитриле (250 мл). После падения начальной экзотермы смесь нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и суспендированный твердый продукт отделяли фильтрованием, получая 20 г метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты.
Стадия 04: Синтез метилового эфира 4-амино-2,6-диэтилникотиновой кислоты
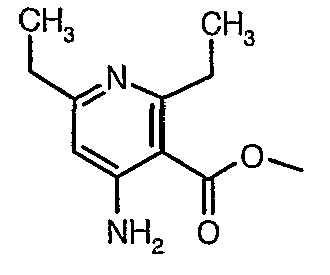
Метиловый эфир 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты (40 г, 0,110 моль) добавляли при 0°C к концентрированной серной кислоте (57 мл, 1,10 моль) и затем реакционную смесь перемешивали при 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и выливали на лед. pH полученного раствора доводили до pH 8 добавлением твердого карбоната натрия и раствор затем экстрагировали дихлорметаном (200 мл×2). Объединенные органические слои промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали, получая 19 г 4-амино-2,6-диэтилпиридин-3-метилкарбоксилата в виде белого твердого вещества.
Стадия 05: Синтез этилового эфира 5,7-диэтил-4-гидрокси-2-оксо-1,2-дигидро[1,6]нафтиридин-3-карбоновой кислоты
Диэтилмалонат (15 мл, 0,093 моль) и 4-амино-2,6-диэтилпиридин-3-метилкарбоксилат (19,0 г, 0,09 моль) добавляли к раствору этоксида натрия (7 г, 0,10 моль) в этаноле (60 мл) и реакционную смесь нагревали при 150°C и давлении 100 psi в течение 20 часов в автоклаве. Смеси давали охладиться, летучие вещества удаляли выпариванием и полученное полутвердое вещество растирали с простым эфиром, получая твердое вещество белого цвета, которое отделяли фильтрованием. Твердое вещество растворяли в воде и раствор затем подкисляли 1,5 н. хлористоводородной кислотой, получая твердое вещество белого цвета, которое отфильтровывали и сушили при отсасывании, получая 11 г 5,7-диэтил-4-гидрокси-2-оксо-1,2-дигидро-1,6-нафтиридин-3-этилкарбоксилата в виде белого твердого вещества.
Стадия 06: Синтез 5,7-диэтил-4-гидрокси-1Н-[1,6]нафтиридин-2-она

5,7-диэтил-4-гидрокси-2-оксо-1,2-дигидро-1,6-нафтиридин-3-этилкарбоксилат (11 г) растворяли в смеси воды (11 мл), 1,4-диоксана (22 мл) и концентрированной хлористоводородной кислоты (11 мл) и реакционную смесь нагревали с обратным холодильником в течение 3 часов. Реакционную смесь затем охлаждали и суспендированное твердое вещество отфильтровывали, промывали этанолом и простым эфиром и сушили при отсасывании, получая 4,3 г 5,7-диэтил-4-гидрокси-1,6-нафтиридин-2(1Н)-она в виде не совсем белого твердого вещества.
Стадия 07: Синтез 4-хлор-5,7-диэтил-1,6-нафтиридин-2(1Н)-она
4,3 г (0,019 моль) 5,7-диэтил-4-гидрокси-1,6-нафтиридин-2(1Н)-она растворяли в 22 мл оксихлорида фосфора, и реакционную смесь нагревали с обратным холодильником в течение 24 часов. Реакционную смесь концентрировали, остаток растворяли в концентрированной хлористоводородной кислоте (16 мл) и 22 мл воды и нагревали с обратным холодильником в течение 4 часов. Смесь разбавляли водой и подщелачивали твердым бикарбонатом натрия, полученное твердое вещество отделяли фильтрованием, промывали водой и сушили при отсасывании, получая 3,0 г 4-хлор-5,7-диэтил-1,6-нафтиридин-2 (1Н)-она в виде твердого вещества оранжевого цвета.
Стадия 08: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
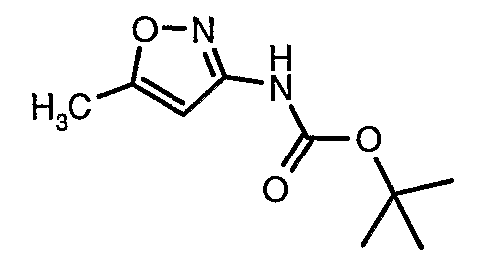
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилубикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 09: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
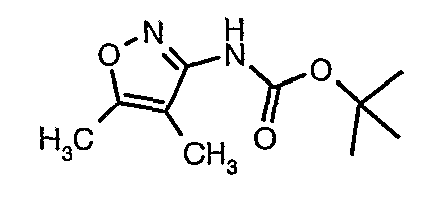
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 10: Синтез 4,5-диметилизоксазол-3-иламина
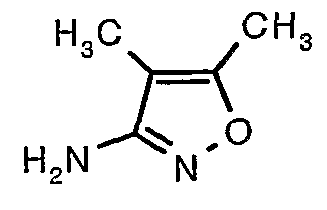
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) при 0°C добавляли порциями к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 11: Синтез 3-бромтиофен-2-сульфонилхлорида
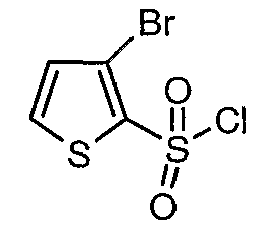
3-Бромтиофен (10 г, 0,0617 моль) растворяли в метиленхлориде (60 мл) и реакционную смесь охлаждали до -78°C. Затем добавляли по каплям при -78°C хлорсульфоновую кислоту (25 мл, 0,396 моль). Температуру реакционной смеси медленно поднимали до 0°C и выдерживали в течение 1 часа. Реакционную смесь медленно вливали в ледяную воду с последующей экстракцией метиленхлоридом (100 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над безводным сульфатом натрия, упаривали в вакууме, получая твердое вещество коричневого цвета. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 5,4 г 3-бромтиофен-2-сульфонилхлорида.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты
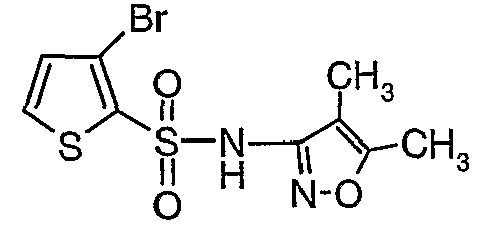
К раствору 3-амино-4,5-диметилизоксазола (2 г, 0,0178 моль) в 25 мл пиридина и диметиламинопиридине (0,230 г, 0,0019 моль) при 0°C добавляли 3-бромтиофен-2-сульфонилхлорид (5,0 г, 0,01912). Затем температуру реакционной смеси медленно поднимали до комнатной температуры (28°C) и затем реакционную смесь перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток подкисляли, используя 1 н. хлористоводородную кислоту, до рН 1 с последующей экстракцией дихлорметаном (50 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 3,5 г (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты
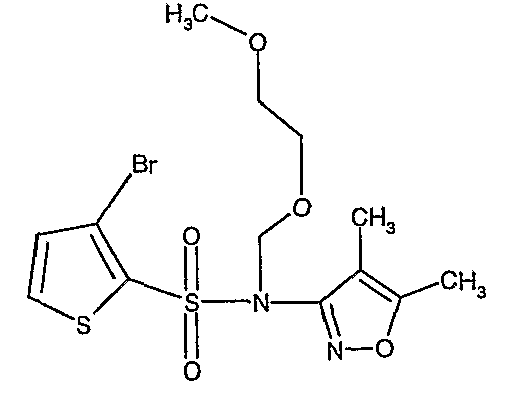
В токе сухого азота гидрид натрия (0,600 г, 0,0125 моль, 60% в минеральном масле) при -15°C добавляли порциями к раствору (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты (3,5 г, 0,0103 моль) в N,N-диметилформамиде (30 мл). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем реакционную смесь повторно охлаждали до 0°C. К реакционной смеси добавляли за 30 минут по каплям 2-метоксиэтоксиметилхлорид (1,55 г, 0,0124 моль), поддерживая температуру реакционной смеси 0°C. Реакционную смесь перемешивали при 0°C в течение 30 мин и затем при комнатной температуре в течение 4 ч. Затем реакционную смесь разбавляли этилацетатом (100 мл) с последующим добавлением (30 мл) ледяной воды. Органический слой отделяли, промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 2,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты в виде желтого масла.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты
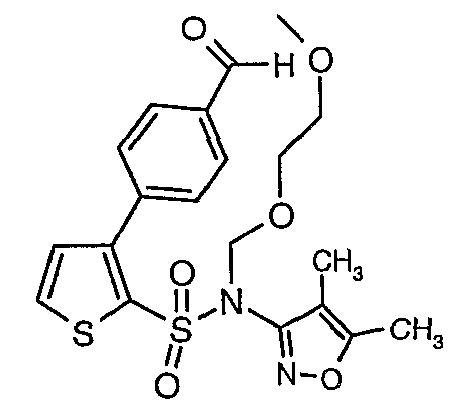
К перемешиваемому раствору 2,7 г (0,0063 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты и 4-формилбороновой кислоты 1,04 г (0,006 моль) в толуоле (15 мл) и этаноле (12 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (2 г в 16 мл воды). Реакционную смесь перемешивали в течение 15 минут, затем добавляли тетракистрифенилфосфинпалладий(0) (0,40 г, 0,00034 моль). Реакционную смесь нагревали при 85°C в течение 6 ч, затем охлаждали до комнатной температуры и добавляли этилацетат (50 мл). Смесь концентрировали в вакууме и к остаточной массе добавляли этилацетат (100 мл), затем охлажденную воду с последующей экстракцией этилацетатом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 1,1 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты
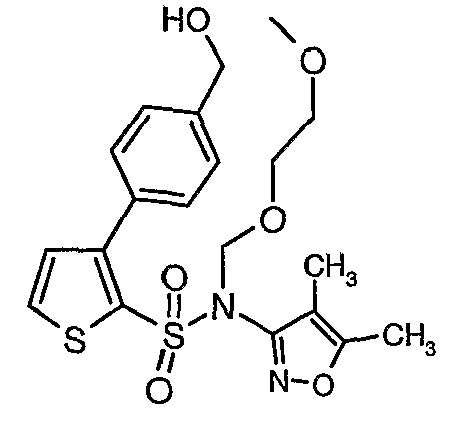
Литийалюминийгидрид (0,100 г, 0,0029 моль) при 0°C добавляли в токе азота к перемешиваемому раствору тетрагидрофурана (15 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты (1,1 г, 0,0024 моль) в 15 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, температуру повышали до комнатной температуры (28°C) и перемешивали в течение 4 ч. Реакционную смесь обрабатывали добавлением при 0°C раствора гидроксида натрия (1 г, растворенного в 100 мл воды) с последующей экстракцией этилацетатом (50 мл×2). Объединенные органические слои промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме, получая 1,0 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты в виде масла.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты
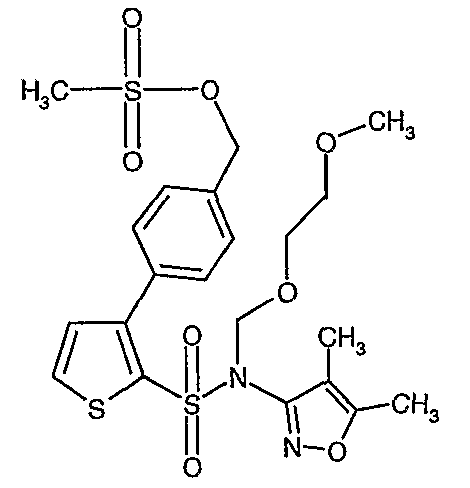
К охлажденному до 0°C раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты (1,0 г, 0,0022 моль) в 60 мл дихлорметана добавляли N-этилдиизопропиламин (0,6 мл, 0,0033 моль) с последующим медленным добавлением к реакционной смеси раствора метансульфонилхлорида (0,2 мл, 0,0033 моль) в 10 мл дихлорметана. Реакционную смесь затем нагревали и перемешивали при комнатной температуре в течение 3 ч. Осуществляли обработку добавлением в реакционную смесь ледяной воды с последующей экстракцией метиленхлоридом (25 мл×2). Объединенный органический экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 0,700 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты в виде вязкой жидкости.
Стадия 17: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хлор-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
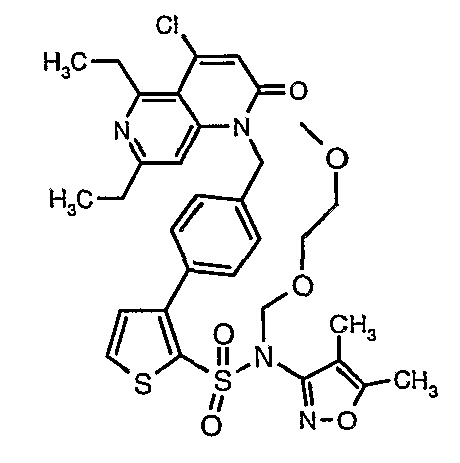
4-хлор-5,7-диэтил-1,6-нафтиридин-2-(1Н)-он (0,16 г, 0,6 ммоль) при 0°C в атмосфере азота добавляли к суспензии гидрида натрия (0,053 г, 1,0 ммоль, 50%) в (5 мл) N,N-диметилформамида и смесь перемешивали в течение 30 минут при комнатной температуре. Реакционную смесь повторно охлаждали до 0°C и добавляли по каплям раствор (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты (0,367 г, 0,7 ммоль) в 5 мл N,N-диметилформамида. Реакционную смесь перемешивали при комнатной температуре в течение 20 часов и затем разбавляли 40 мл этилацетата, затем 10 мл холодной воды. Органическую фазу отделяли и водный слой снова экстрагировали 20 мл этилацетата. Объединенный органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали, получая 0,350 г неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хлор-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты в виде коричневого масла.
Стадия 18: (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-[4-(5,7-диэтил-2-оксо-4-фенокси-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
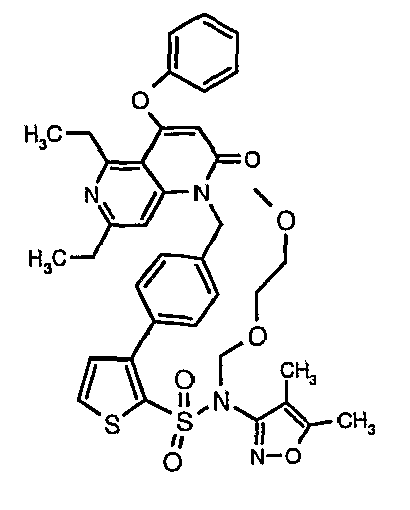
К раствору фенола (56 мг, 0,59 ммоль) в 3 мл N,N-диметилформамида при 0°C добавляли порциями гидрид натрия (31 мг, 0,64 ммоль, 50%) и реакционную смесь перемешивали до прекращения кипения. Затем по каплям добавляли раствор (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хлор-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (350 мг, 0,50 ммоль) в 3 мл N,N-диметилформамид. После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали при комнатной температуре в течение 14 ч. Реакционную смесь разбавляли этилацетатом, перемешивали в течение 10 минут, затем подкисляли разбавленной хлористоводородной кислотой до рН 5 и экстрагировали этилацетатом. Органический слой отделяли и промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме, получая 300 мг неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-4-фенокси-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты в виде вязкой массы.
Стадия 19: (4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-4-фенокси-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
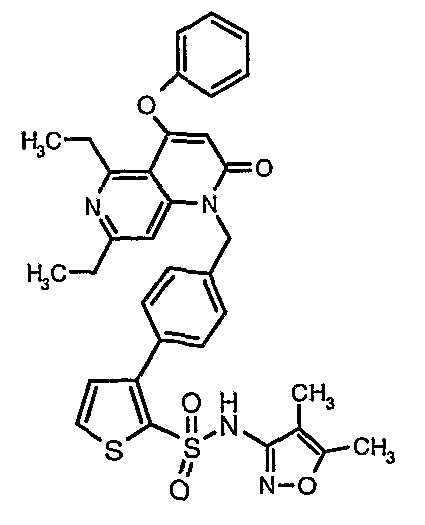
0,30 г (0,41 ммоль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-4-фенилсульфанил-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты растворяли в (5 мл) этанола, затем добавляли 5 мл 6 н. хлористоводородной кислоты и смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, разбавляли водой, рН полученного раствора доводили до рН 5 с помощью насыщенного раствора бикарбоната натрия и смесь затем экстрагировали этилацетатом (25 мл×2). Этилацетатный слой промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 20 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-4-фенокси-2H-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты в виде белого твердого вещества.
Молекулярная формула: C34H32N4O5S2
Молекулярная масса: 640,77.
1H ЯМР (ДМСО-d6): 1,19 (т, J=7,2 Гц, 3H), 1,30 (т, J=7,2 Гц, 3H), 1,47 (с, 3H), 2,12 (с, 3H), 2,70-2,76 (м, 2H), 3,12-3,17 (м, 2H), 5,50 (с, 2H), 7,14-7,97 (м, 13Н), 10,83 (с, 1Н).
Масс-спектр: (m+1) 641.
Пример 9
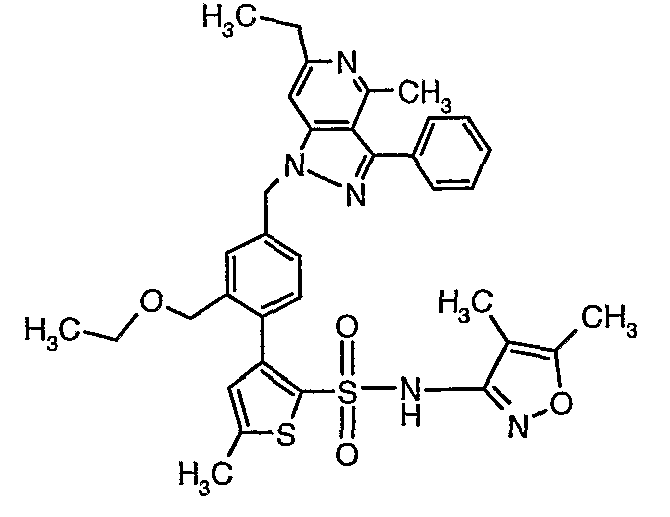
(4,5-Диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-[2-этоксиметил-4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 1-фенилбутан-1,3-диона
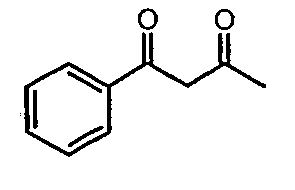
Этоксид натрия (13,5 г, 0,198 моль) добавляли при -5°C к перемешиваемому раствору сухого этилацетата (80 мл, 0,72 моль). К реакционной смеси добавляли при -5°C метилфенилкетон (20 г, 0,185 моль) и затем температуру реакционной смеси поддерживали при 0°C в течение 12 ч. Реакционную смесь затем подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенный органический слой промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и упаривали, получая 21 г желтого твердого вещества, представляющего собой 1-фенилбутан-1,3-дион.
Стадия 02: Синтез 3-амино-1-фенилбут-2-ен-1-она
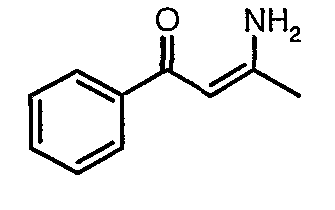
Смесь 1-фенилбутан-1,3-диона (20 г, 0,123 моль) и ацетата аммония (38 г, 0,49 моль) в сухом метаноле (200 мл) перемешивали и нагревали с обратным холодильником в течение 24 ч. Реакционную смесь концентрировали в вакууме и к остатку добавляли охлажденную воду с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Затем органический слой сушили над сульфатом натрия и упаривали, получая 19 г желтого твердого вещества, представляющего собой 3-амино-1-фенилбут-2-ен-1-он.
Стадия 03: Синтез 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона
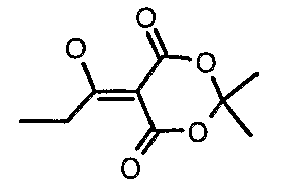
Пропионилхлорид (7 мл, 0,0763 моль) добавляли за 30 минут к раствору кислоты Мелдрама (10 г, 0,069 моль) в пиридине (12 мл, 0,138 моль) и метиленхлориде (50 мл) при 0°C, температуре реакционной смеси давали повыситься до температуры окружающей среды и перемешивали в течение 1 ч. Реакционную смесь затем подкисляли, используя 1 н. хлористоводородную кислоту, и экстрагировали метиленхлоридом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 10 г 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона в виде твердого кристаллического вещества.
Стадия 04: Синтез 3-бензоил-6-этил-2-метил-1Н-пиридин-4-она
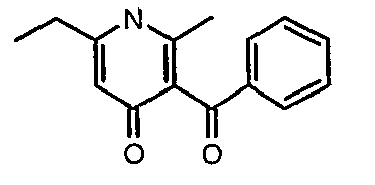
Смесь 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона (17,39 г, 0,087 моль) и 3-амино-1-фенилбут-2-ен-1-она (10 г, 0,062 моль) перемешивали и нагревали при 120°C в течение 2 ч. Реакционную смесь очищали хроматографией на колонке с силикагелем, элюируя желаемую фракцию 10%-ным метанолом и этилацетатом, получая 5,8 г 3-бензоил-6-этил-2-метил-1Н-пиридин-4-она в виде желтого твердого вещества.
Стадия 05: Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)фенилметанона
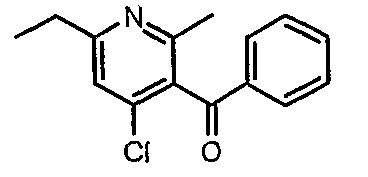
3-Бензоил-6-этил-2-метил-1Н-пиридин-4-он (2,7 г, 0,011 моль) добавляли при 0°C к оксихлориду фосфора (8 мл). Реакционную смесь перемешивали, нагревали до 50°C и затем температуру поддерживали в течение 8 часов. Осуществляли обработку, выпаривая оксихлорид фосфора в вакууме, и остаток, полученный таким образом, подщелачивали до рН 8 насыщенным раствором бикарбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия и концентрировали, получая 2,6 г (4-хлор-6-этил-2-метилпиридин-3-ил)фенилметанона в виде желтого масла.
Стадия 06: Синтез 6-этил-4-метил-3-фенил-1Н-пиразоло[4,3-c]пиридина
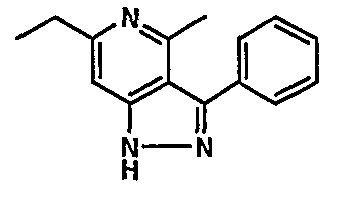
(4-хлор-6-этил-2-метилпиридин-3-ил)фенилметанон (2,5 г 0,0096 моль) растворяли в этаноле (10 мл) и к реакционной смеси добавляли гидразингидрат (2,3 мл, 0,048 моль). Смесь перемешивали и нагревали с обратным холодильником в течение 4 часов. Затем реакционную смесь упаривали в вакууме. К остатку добавляли воду со льдом и твердое вещество, полученное таким образом, отфильтровывали и сушили при отсасывании, получая 1,8 г 6-этил-4-метил-3-фенил-1Н-пиразоло[4,3-c]пиридина.
Стадия 07: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
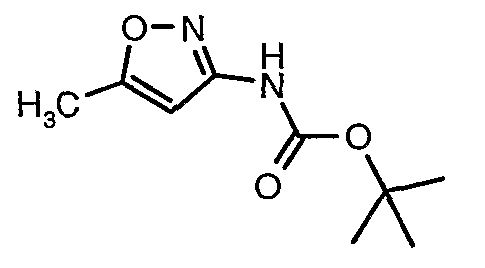
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл) и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 08: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
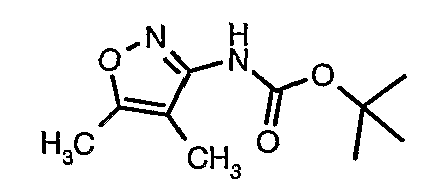
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 09: Синтез 4,5-диметилизоксазол-3-иламина
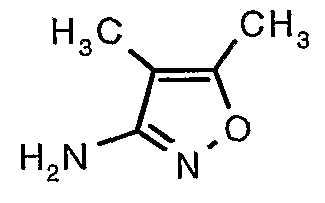
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями при 0°C к трифторуксусной кислоте (22 мл 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 10: Синтез 5-метилтиофен-2-сульфонилхлорида
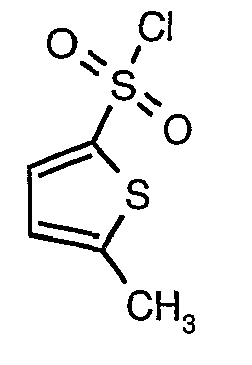
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Температуру реакции поддерживали при 0°C в течение 3 ч. Неочищенную реакционную массу медленно загружали в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
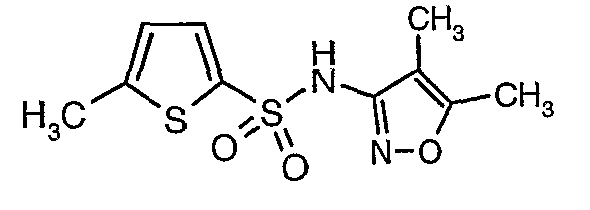
Раствор 5-метилтиофен-2-сульфонилхлорид (16,0 г, 0,081 моль) в 25 мл метиленхлорида добавляли при 0°C к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
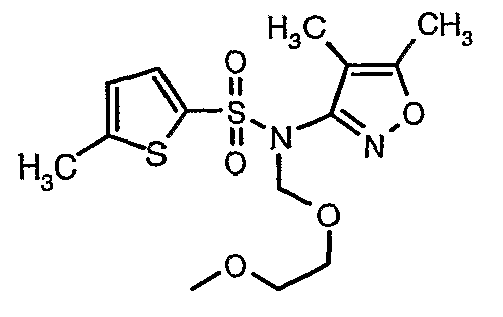
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл), с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и перемешивали смесь при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C с последующим добавлением по каплям к реакционной смеси метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, добавляли 90 мл этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 13: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
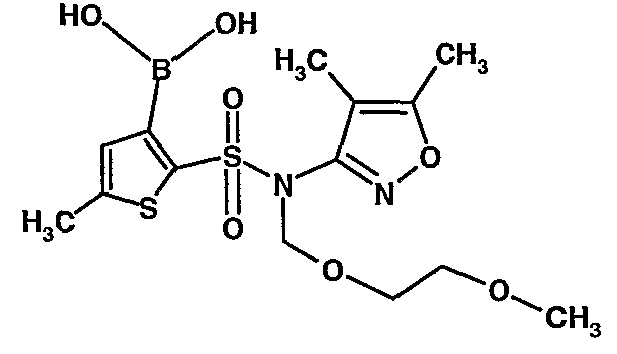
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно поднимали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 14: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
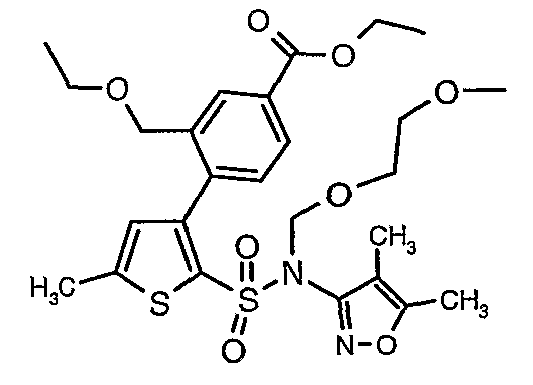
К перемешиваемому раствору 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (15 г, 0,037 моль) и этилового эфира 4-бром-3-этоксиметилбензойной кислоты (11 г, 0,038 моль) в толуоле (120 мл) и этаноле (60 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (4,0 г в 19 мл воды). Реакционную смесь перемешивали в атмосфере азота в течение 15 минут и затем добавляли тетракистрифенилфосфинпалладий(0) (2,15 г, 0,0018 моль). Реакционную смесь нагревали при 85°C в течение 6 часов, затем концентрировали и к остатку добавляли этилацетат (25 мл), затем охлажденную воду, с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали полностью в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 8 г этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в виде маслянистой массы.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
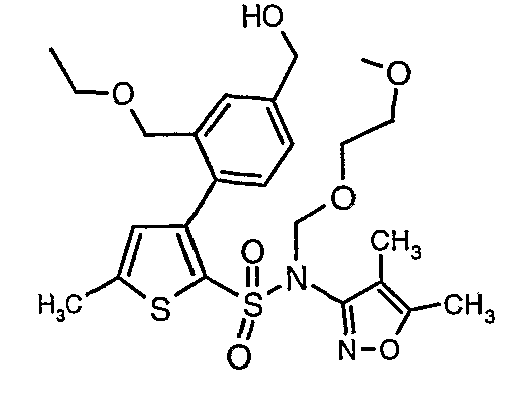
Алюмогидрид лития (1,4 г, 0,037 моль) добавляли при 0°C к перемешиваемому раствору тетрагидрофурана (25 мл) в токе азота с последующим добавлением этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилфенил)уксусной кислоты (8 г, 0,014 моль) в 35 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 часа, затем температуру повышали до комнатной температуры и смесь перемешивали в течение 4 часов. Избыток алюмогидрида лития разрушали добавлением при 0°C раствора гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали полностью в вакууме, получая 4,7 г (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 16: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты
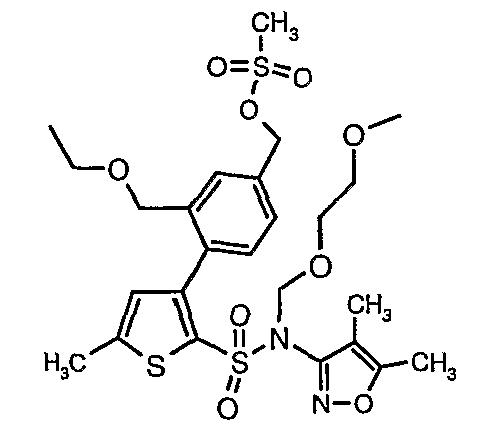
N-этилдиизопропиламин (2,13 мл, 0,012 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (3,2 г, 0,0060 моль) в 10 мл дихлорметана. Реакционную смесь охлаждали до 0°C, затем в реакционную смесь медленно добавляли метансульфонилхлорид (0,6 мл, 0,0073 моль). Смесь выдерживали при комнатной температуре в течение 3 часов и затем помещали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 3,3 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты.
Стадия 17: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
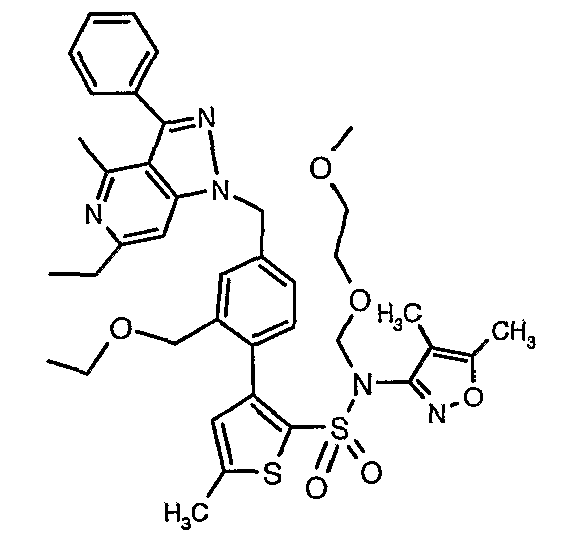
К перемешиваемому раствору 6-этил-4-метил-3-фенил-1H-пиразоло[4,3-c]пиридина (0,454 г, 0,0019 моль) в N,N-диметилформамиде (6 мл) при -15°C в токе сухого азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,110 г, 0,0023 моль). После завершения добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь повторно охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (1,1 г, 0,0018 ммоль) в 6 мл N,N-диметилформамида. После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и затем перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл) с последующим добавлением (10 мл) холодной воды. Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 1:4 гексан/этилацетат в качестве элюента, получая 0,90 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 18: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
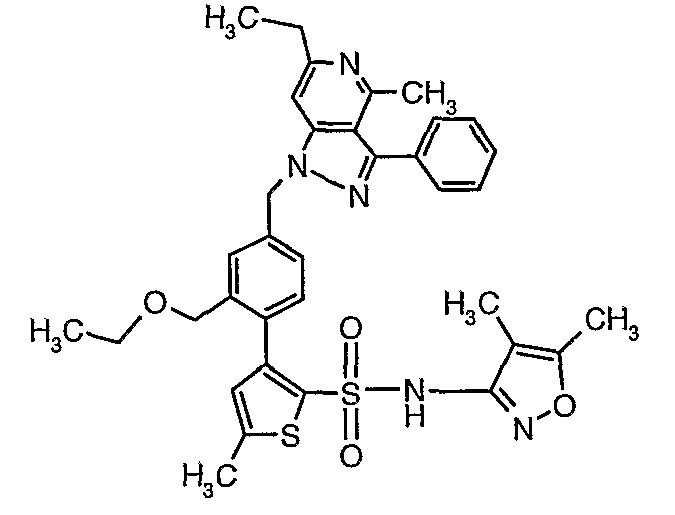
95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (10 мл) добавляли при комнатной температуре при перемешивании к 0,90 г (1,20 ммоль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты. Реакционную смесь нагревали с обратным холодильником в течение 3 ч и затем концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой и рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия. Реакционный раствор затем подкисляли до рН 5 уксусной кислотой и затем экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли и, наконец, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 1:2 гексан/этилацетат в качестве элюента, получая 100 мг 3-[2-этоксиметил-4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида.
Молекулярная формула: C35H37N5O4S2
Молекулярная масса: 655,83.
1H ЯМР (ДМСО-d6): 1,01 (т, J=6,8 Гц, 3H), 1,29 (т, J=7,6 Гц, 3H), 1,47 (с, 3H), 2,11 (с, 3H), 2,47 (с, 3H), 2,63 (с, 3H), 2,79-2,86 (м, 2H), 3,23-3,29 (м, 2H), 4,06 (с, 2H), 5,71 (с, 2H), 6,70 (с, 1Н), 6,94-6,97 (м, 1Н), 7,11-7,13 (м, 1Н), 7,37 (с, 1Н), 7,50-7,56 (м, 4H), 7,64-7,67 (м, 2H), 10,71 (с, 1Н).
Масс-спектр: (m+1) 656.
Пример 10
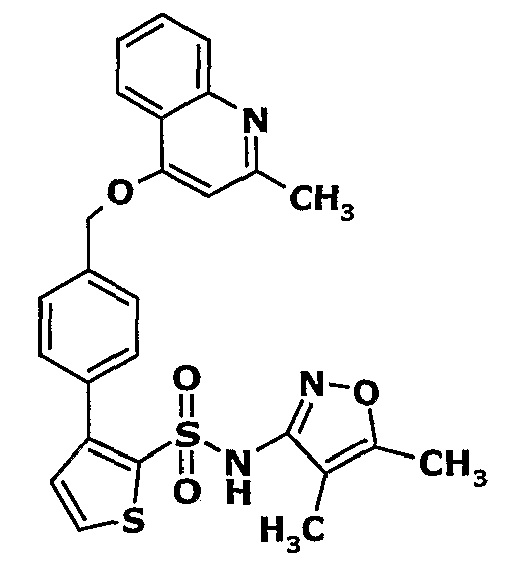
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(2-метилхинолин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
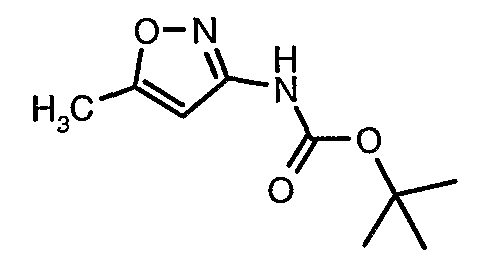
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая 130 г трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 02: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
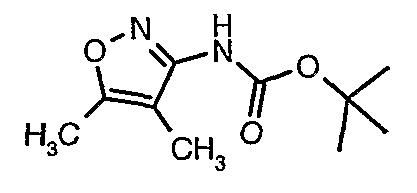
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 03: Синтез 4,5-диметилизоксазол-3-иламина
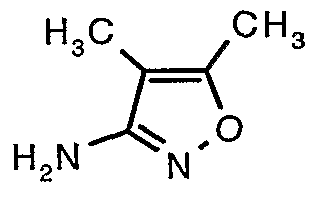
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) при 0°C добавляли порциями к трифторуксусной кислоте (22 мл 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 04: Синтез 3-бромтиофен-2-сульфонилхлорида
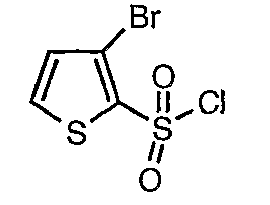
3-Бромтиофен (10 г, 0,0617 моль) растворяли в метиленхлориде (60 мл) и реакционную смесь охлаждали до -78°C. Затем к реакционной смеси при -78°C добавляли по каплям хлорсульфоновую кислоту (25 мл, 0,396 моль). Затем температуру медленно поднимали до 0°C и выдерживали при этой температуре в течение 1 часа. Реакционную смесь медленно вливали в холодную воду с последующей экстракцией метиленхлоридом (100 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над безводным сульфатом натрия, упаривали в вакууме, получая твердое вещество коричневого цвета. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 5,4 г 3-бромтиофен-2-сульфонилхлорида.
Стадия 05: Синтез (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты
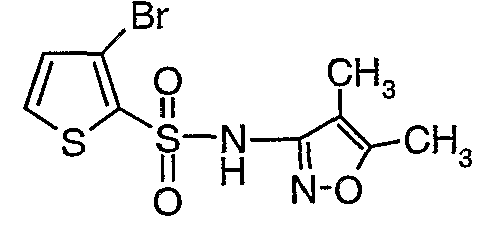
К раствору 3-амино-4,5-диметилизоксазола (2 г, 0,0178 моль) в (25 мл) в пиридине и диметиламинопиридине (0,230 г, 0,0019 моль) при 0°C добавляли 3-бромтиофен-2-сульфонилхлорид (5,0 г, 0,01912). Затем температуру реакционной смеси медленно повышали до комнатной температуры (28°C) и затем реакционную смесь перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток подкисляли, используя 1 н. хлористоводородную кислоту, до рН 1 с последующей экстракцией дихлорметаном (50 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 3,5 г (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)-(2-этоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты
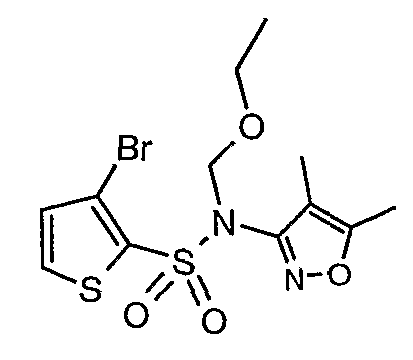
К раствору (4,5-диметилизоксазол-3-ил)амида 3-бромтиофен-2-сульфоновой кислоты (18,6 г, 0,055 моль) в N,N-диметилформамиде (60 мл) при -15°C добавляли порциями гидрид натрия (60% в минеральном масле) (3,17 г, 0,066 моль). После перемешивания при комнатной температуре в течение 30 мин реакционную смесь охлаждали до 0°C с использованием бани лед-соль. К реакционной смеси по каплям за 30 минут добавляли хлорметоксиэтан (7,82 г, 0,082 моль), поддерживая температуру реакционной смеси 0°C. Реакционную смесь перемешивали на бане лед-соль в течение 30 мин и затем при комнатной температуре в течение 4 ч. Реакционную смесь затем разбавляли этилацетатом (100 мл), затем 30 мл ледяной холодной воды, органический слой отделяли, промывали водой и насыщенным раствором соли и, наконец, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 8,2 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты в виде желтого масла.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты
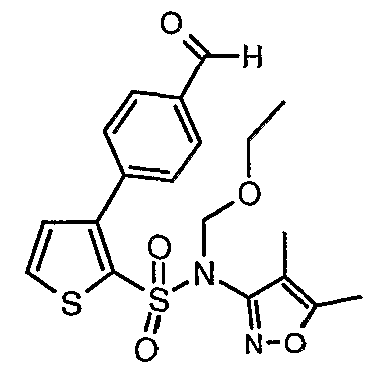
К перемешиваемому раствору (7,8 г, 0,0195 моль) (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-бромтиофен-2-сульфоновой кислоты и 4-формилбороновой кислоты (2,96 г, 0,0198 моль) в толуоле (60 мл) и этаноле (30 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (6,27 г в 30 мл воды) и перемешивание смеси продолжали в течение 15 минут. Затем к реакционной смеси добавляли тетракистрифенилфосфинпалладий(0) (1,14 г, 0,99 ммоль), затем нагревали при 85°C в течение 6 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли 50 мл этилацетата. Реакционную смесь концентрировали в вакууме и к остатку, полученному таким образом, добавляли этилацетат (100 мл), затем охлажденную воду. Слои разделяли и водный слой затем экстрагировали этилацетатом (100 мл). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 10,2 г (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты в виде маслянистой массы.
Стадия 08: Синтез (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты
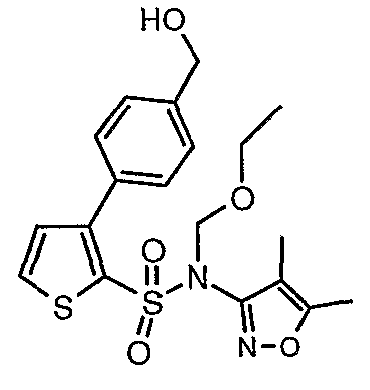
В токе сухого азота алюмогидрид лития (1,4 г, 0,036 моль) добавляли при 0°C к перемешиваемому раствору тетрагидрофурана (20 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты (10,0 г, 0,024 моль) в 50 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, затем температуру повышали до комнатной температуры и перемешивание продолжали в течение 4 ч. Реакционную смесь затем охлаждали до 0°C и добавляли раствор 50 мл гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (50 мл×2). Органический слой отделяли и промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме, получая 6,0 г (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты в виде масляной жидкости.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты
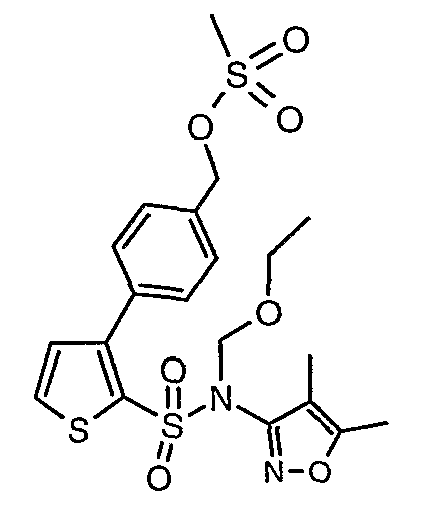
N-этилдиизопропиламин (3,7 мл, 0,02 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты (6,0 г, 0,0142 моль) в 60 мл дихлорметана. Реакционную смесь охлаждали до 0°C и затем медленно добавляли раствор метансульфонилхлорида (1,32 мл, 0,0161 моль) в 10 мл дихлорметана. После добавления температуру реакционной смеси поддерживали при комнатной температуре в течение 3 часов. Затем добавляли ледяную воду с последующей экстракцией метиленхлоридом (25 мл×2). Объединенный органический экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 6,0 г (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты в виде вязкой жидкости.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-[4-(2-метилхинолин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты
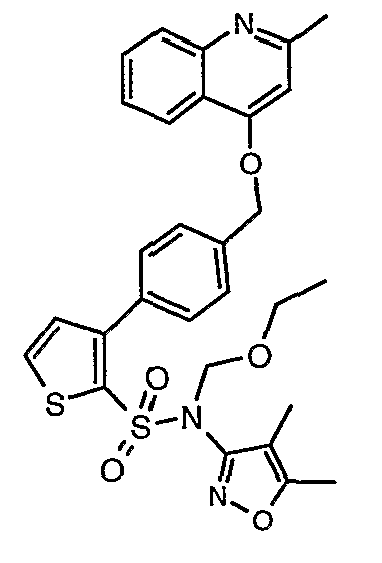
К перемешиваемому раствору 2-метил-1Н-хинолин-4-она (0,16 г, 1,0 ммоль) в N,N-диметилформамиде (5 мл) при 0°C в токе сухого газообразного азота добавляли порциями гидрид натрия (60% в минеральном масле) (72,0 мг, 1,5 ммоль). После завершения добавления температуру реакционной смеси повышали до комнатной температуры и выдерживали в течение 30 мин. Реакционную смесь повторно охлаждали до 0°C и добавляли по каплям раствор (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-(4-метансульфонилметилфенил)тиофен-2-сульфоновой кислоты (0,5 г, 1,0 ммоль) в 5 мл N,N-диметилформамида. Реакционную смесь перемешивали при комнатной температуре в течение 24 ч и затем охлаждали до 0°C, затем добавляли этилацетат (40 мл), затем 10 мл воды. Органические слои разделяли, водный слой экстрагировали этилацетатом (50 мл×2) и объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая неочищенное соединение. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 1:1 гексан/этилацетат в качестве элюента, получая 510 мг (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-[4-(2-метилхинолин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты в виде вязкой жидкости.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(2-метилхинолин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты

К 0,51 г (0,90 ммоль) (4,5-диметилизоксазол-3-ил)этоксиметиламида 3-[4-(2-метилхинолин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты при комнатной температуре добавляли этанол (6 мл) и 6 мл 6 н. водного раствора хлористоводородной кислоты. Реакционную смесь нагревали с обратным холодильником в течение 3 ч, затем концентрировали в вакууме и полученный остаток разбавляли водой. pH полученного раствора доводили до pH 5 с использованием раствора бикарбоната натрия и экстрагировали этилацетатом (50 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 1:1 гексан/этилацетат в качестве элюента, получая 90 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(2-метилхинолин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты в виде желтоватого твердого вещества.
Молекулярная формула: C26H23N3O4S2
Молекулярная масса: 505,61.
1H ЯМР (ДМСО-d6): 1,54 (с, 3H), 2,12 (с, 3H), 2,63 (с, 3H), 5,41 (с, 2H), 7,12-7,18 (м, 2H), 7,48-7,53 (м, 1Н), 7,55-7,58 (м, 2H), 7,59-7,61 (м, 2H), 7,68-7,73 (м, 1Н), 7,85-7,88 (м, 2H), 8,13-8,16 (м, 1Н), 10,93 (с, 1Н).
Масс-спектр: (m-1) 504.
Пример 11
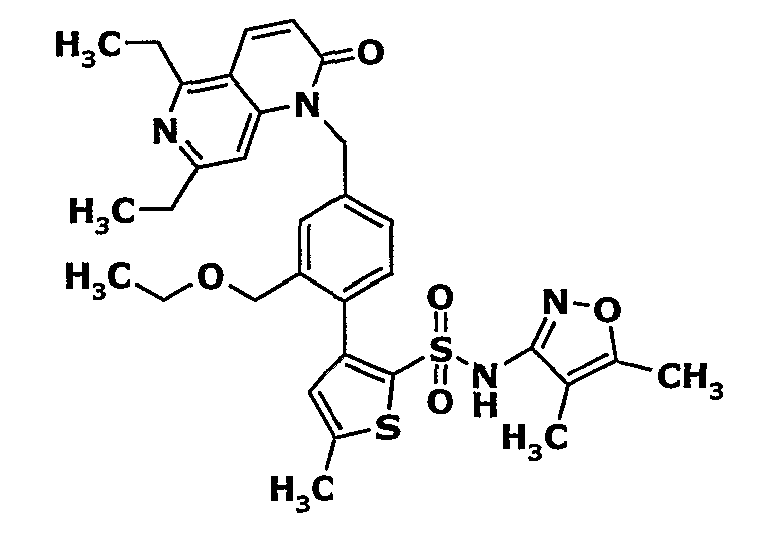
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
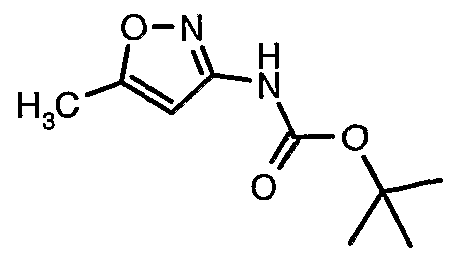
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 02: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
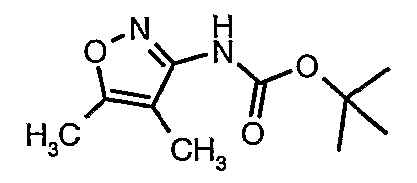
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 03: Синтез 4,5-диметилизоксазол-3-иламина

Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями при 0°C к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 04: Синтез 5-метилтиофен-2-сульфонилхлорида
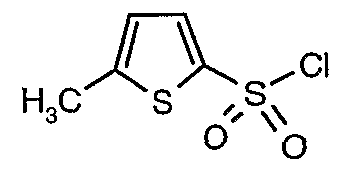
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе (100 мл) добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Реакционную смесь выдерживали при 0°C в течение 3 ч. Неочищенную реакционную массу медленно загружали в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия, упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 05: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
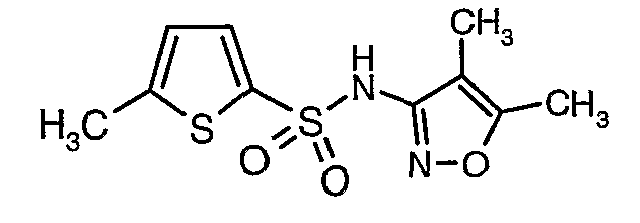
Раствор 5-метилтиофен-2-сульфонилхлорида (16,0 г, 0,081 моль) в 25 мл метиленхлорида при 0°C добавляли к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
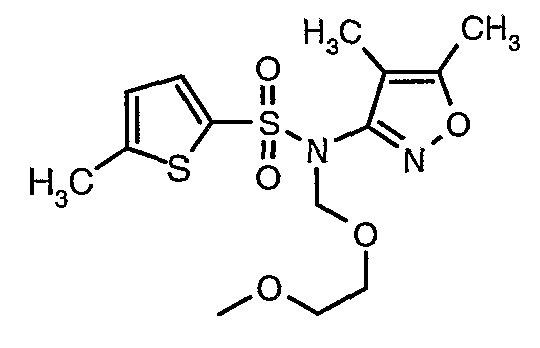
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и смесь перемешивали при температуре окружающей среды в течение 30 минут, затем реакционную смесь повторно охлаждали до 0°C с последующим добавлением по каплям к реакционной смеси метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, добавляли 90 мл этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 07: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
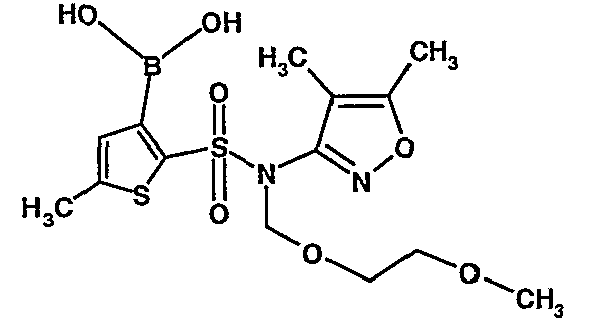
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно поднимали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 08: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
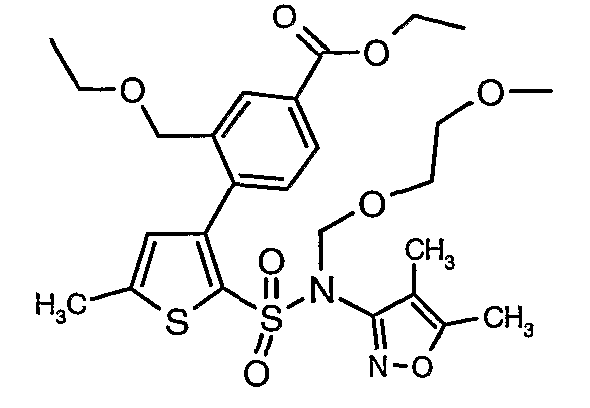
К перемешиваемому раствору этилового эфира 4-бром-3-этоксиметилбензойной кислоты (4 г, 0,0139 моль) в диметоксиэтане (50 мл) в токе сухого азота добавляли бис(трифенилфосфин)палладий(II)хлорид (1 г, 0,00142 моль), затем 2M водный раствор карбоната натрия (4,3 г в 20 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут и затем нагревали до 60°C. К полученному раствору добавляли по каплям за 45 мин раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,5 г, 0,0136 моль в 25 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 60 минут такую же процедуру повторяли с последующим добавлением за 45 мин 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,5 г, 0,0136 моль в 25 мл диметоксиэтана), и, наконец, реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат (100 мл) с последующим добавлением воды. Органические слои разделяли и водный слой далее экстрагировали этилацетатом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 7 г этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
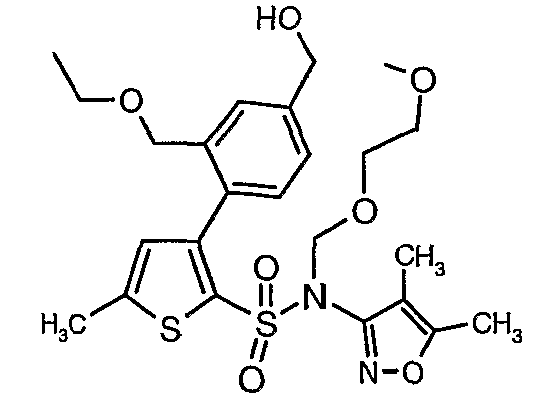
Алюмогидрид лития (1,4 г, 0,037 моль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана (20 мл) с последующим добавлением этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилфенил)уксусной кислоты (8 г, 0,014 моль) в 35 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 часа, затем температуру повышали до комнатной температуры и смесь перемешивали в течение 4 ч. Избыток алюмогидрида лития разрушали добавлением при 0°C раствора гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 4,5 г (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 10: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты
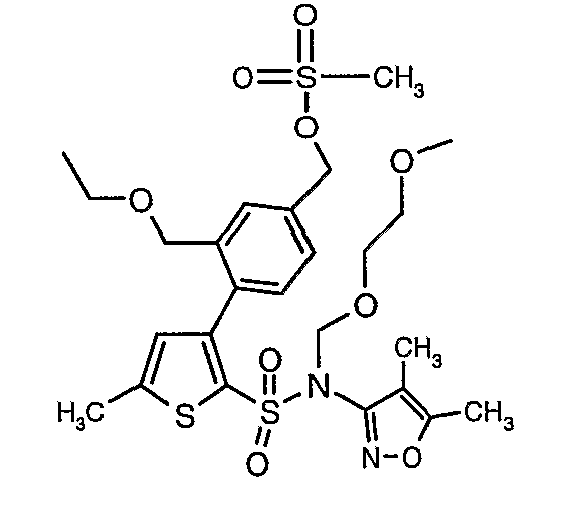
N-этилдиизопропиламин (3,35 мл, 0,0193 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (6,7 г, 0,0127 моль) в 50 мл дихлорметана. Реакционную смесь охлаждали до 0°C, затем в реакционную смесь медленно добавляли метансульфонилхлорид (1,8 г, 0,0157 моль). Смесь выдерживали при комнатной температуре в течение 3 часов и затем помещали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 7,2 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты в виде коричневого масла.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
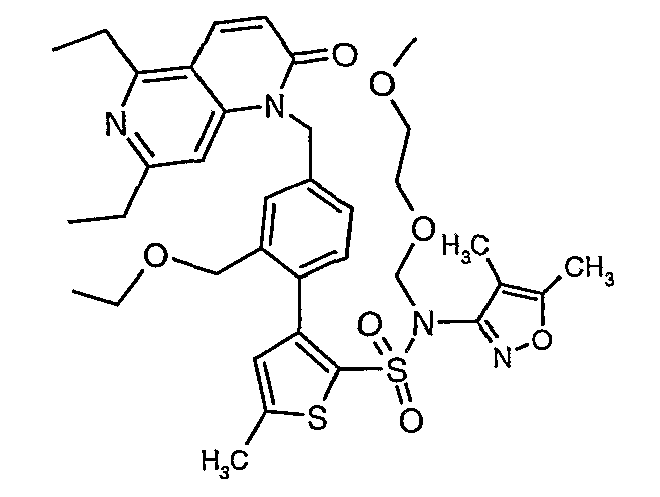
К перемешиваемому раствору 5,7-диэтил-1Н-[1,6]нафтиридин-2-она (0,7 г, 0,00346 моль) в N,N-диметилформамиде (6 мл) при -15°C в токе сухого азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,166 г, 0,00346 моль). После завершения добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Затем реакционную смесь повторно охлаждали до 0°C и добавляли по каплям при 0°C раствор метансульфоновой кислоты 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира (1,9 г, 0,00315 ммоль) в 6 мл N,N-диметилформамида. Температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 24 ч. Реакционную смесь затем разбавляли этилацетатом (40 мл) с последующим добавлением 10 мл холодной воды. Органический слой отделяли и промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 1:1 гексан/этилацетат в качестве элюента, получая 1,2 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
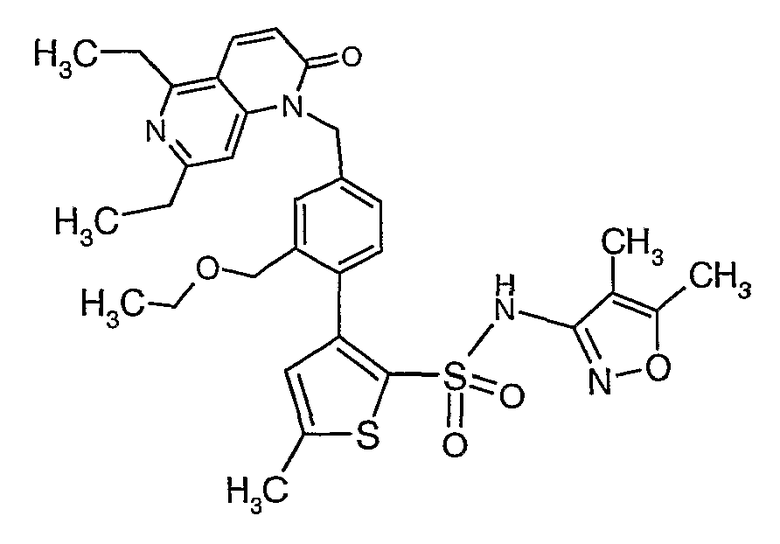
К 1,2 г (1,69 ммоль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты при комнатной температуре при перемешивании добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали при 90°C в течение 3 ч и затем концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой и рН раствора доводили до рН 8 с использованием насыщенного раствора бикарбоната натрия. Полученный раствор затем экстрагировали этилацетатом (35 мл×2) и объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 700 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C32H36N4O5S2
Молекулярная масса: 620,78.
1H ЯМР (ДМСО-d6): 0,98 (т, J=6,8 Гц, 3H), 1,19 (т, J=6,8 Гц, 3H), 1,24 (т, J=7,6 Гц, 3H), 1,47 (с, 3H), 2,11 (с, 3H), 2,47 (с, 3H), 2,69-2,75 (м, 2H), 3,04-3,10 (м, 2H), 3,19-3,25 (м, 2H), 4,05 (с, 2H), 5,52 (с, 2H), 6,70-6,75 (м, 2H), 6,89-6,92 (м, 1Н), 7,03-7,06 (м, 1Н), 7,16 (с, 1Н), 7,32 (с, 1Н), 8,23-8,26 (м, 1Н), 10,65 (с, 1Н).
Масс-спектр: (m-1) 619.
Пример 12

(4,5-Диметилизоксазол-3-ил)амид 3-[4-(3-ацетил-2,6-диметилпиридин-4-илоксиметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
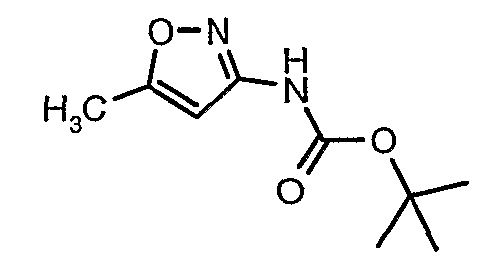
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 02: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
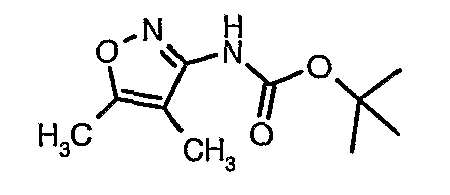
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 03: Синтез 4,5-диметилизоксазол-3-иламина
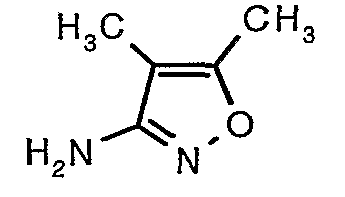
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) при 0°C добавляли порциями к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 04: Синтез 5-метилтиофен-2-сульфонилхлорида
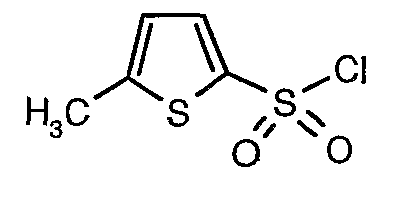
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Реакционную смесь выдерживали при 0°C в течение 3 ч и неочищенную реакционную массу медленно вводили в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия, упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 05: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
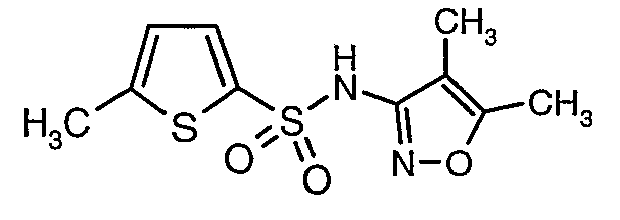
Раствор 5-метилтиофен-2-сульфонилхлорида (16,0 г, 0,081 моль) в (25 мл) метиленхлорида при 0°C добавляли к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 06: Синтез (4,5 диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
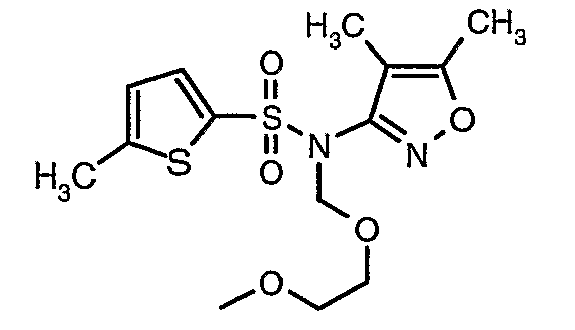
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) при 0°C добавляли к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и смесь перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C с последующим добавлением к реакционной смеси по каплям метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, добавляли (90 мл) этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 07: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
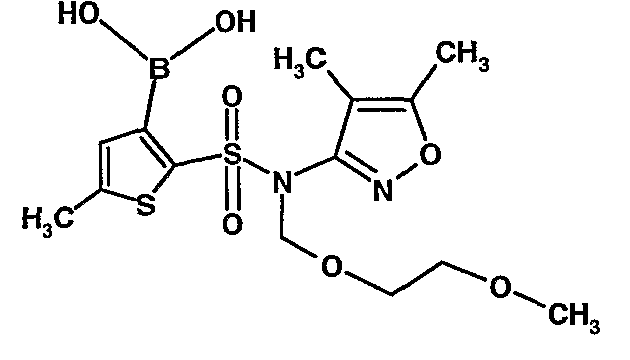
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно поднимали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. После этого реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 08: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
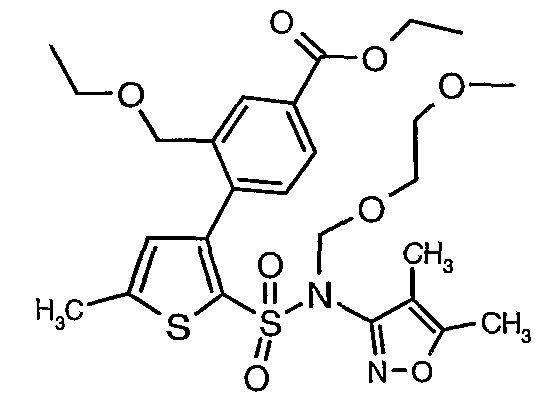
К перемешиваемому раствору этилового эфира 4-бром-3-этоксиметилбензойной кислоты (4 г, 0,0139 моль) в диметоксиэтане (50 мл) в токе сухого азота добавляли бис(трифенилфосфин)палладий(II)хлорид (1 г, 0,00142 моль), затем 2M водный раствор карбоната натрия (4,3 г в 20 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 1 мин и затем нагревали при 60°C. К полученной смеси за 45 минут добавляли раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,5 г, 0,0136 моль в 25 мл диметоксиэтана) и реакционную смесь затем нагревали с обратным холодильником в течение 60 мин. Через 60 минут такую же процедуру повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,5 г, 0,0136 моль в 25 мл диметоксиэтана). Наконец, реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат (100 мл) с последующим добавлением воды. Затем органические слои разделяли и водный слой далее экстрагировали этилацетатом (50 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 7 г этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
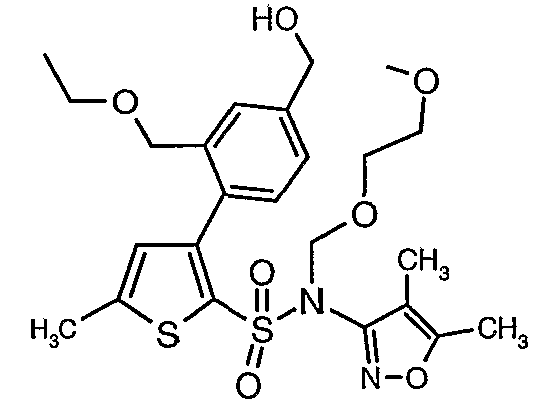
Алюмогидрид лития (1,4 г, 0,037 моль) при 0°C в токе азота добавляли к перемешиваемому раствору тетрагидрофурана (20 мл) с последующим добавлением этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилфенил)уксусной кислоты. (8 г, 0,014 моль) в 35 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 часа, затем температуру повышали до комнатной температуры и смесь перемешивали в течение 4 часов. Избыток алюмогидрида лития разрушали добавлением при 0°C раствора гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 4,5 г (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 10: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты
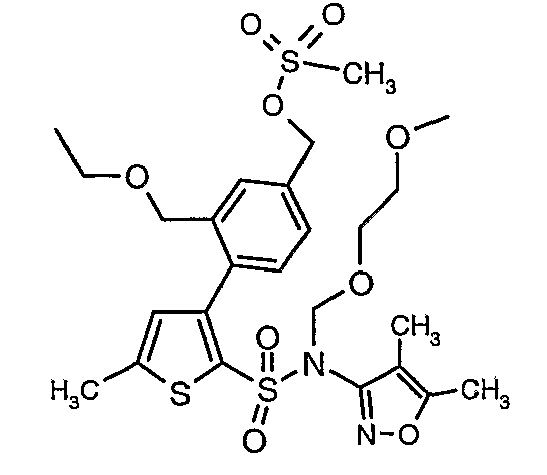
N-этилдиизопропиламин (3,35 мл, 0,0193 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (6,7 г, 0,0127 моль) в 50 мл дихлорметана. Реакционную смесь охлаждали до 0°C, затем медленно добавляли метансульфонилхлорид (1,8 г, 0,0157 моль). Реакционную смесь выдерживали при комнатной температуре в течение 3 часов и затем помещали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 7,2 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты в виде коричневого масла.
Стадия 11: Синтез 3-ацетил-2,6-диметил-1Н-пиридин-4-она
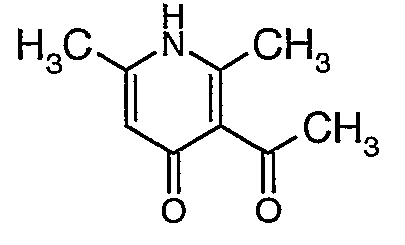
Смесь 12 г (0,12 моль) 4-амино-3-пентен-2-она и 25 г (0,176 моль) 2,2,6-триметил-1,3-диоксен-4-она перемешивали и нагревали до 120°C в течение 3 ч на масляной бане. Реакционную смесь охлаждали до комнатной температуры, выделенное твердое вещество отфильтровывали в вакууме, промывали простым эфиром и сушили при отсасывании, получая 5 г кристаллического белого твердого вещества, представляющего собой 3-ацетил-2,6-диметил-1Н-пиридин-4-он.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(3-ацетил-2,6-диметилпиридин-4-илоксиметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
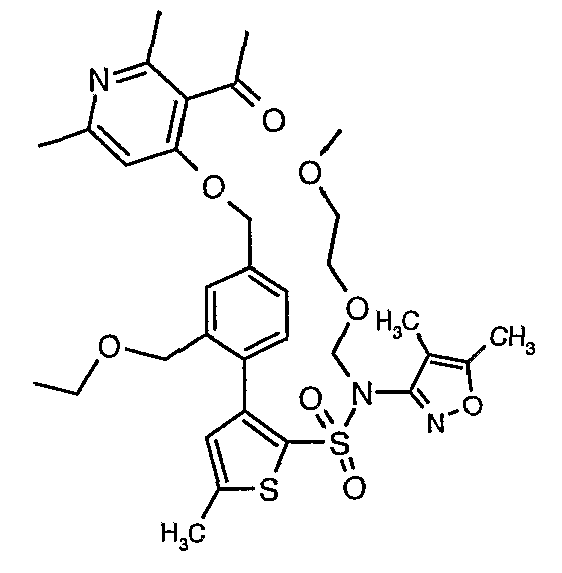
К перемешиваемому раствору 3-ацетил-2,6-диметил-1Н-пиридин-4-она (0,451 г, 0,0027 моль) в N,N-диметилформамиде (6 мл) при -15°C в токе сухого азота добавляли по каплям гидрид натрия (60% в минеральном масле) (0,132 г, 0,00275 моль). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и выдерживали в течение 30 мин. Реакционную смесь повторно охлаждали до 0°C и добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (1,5 г, 0,00248 моль) в 9 мл N,N-диметилформамида. После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь затем разбавляли этилацетатом (40 мл), затем (10 мл) холодной воды. Органический слой отделяли и затем промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 1:1 гексан/этилацетат в качестве элюента, получая 800 мг (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(3-ацетил-2,6-диметилпиридин-4-илоксиметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(3-ацетил-2,6-диметилпиридин-4-илоксиметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
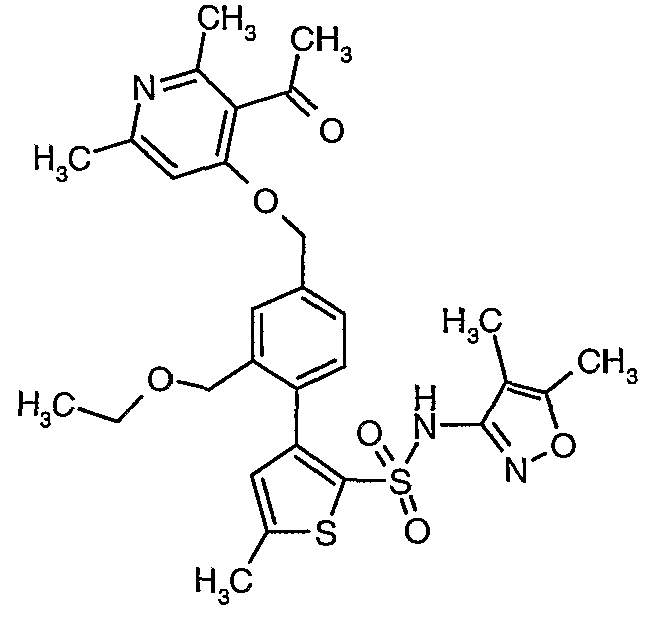
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[4-(3-ацетил-2,6-диметилпиридин-4-илоксиметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (0,80 г, 1,19 ммоль) при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали при 90°C в течение 3 ч, затем концентрировали в вакууме и остаток, полученный таким образом, разбавляли водой. рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия. Полученный раствор экстрагировали этилацетатом (25 мл×2), и объединенные органические экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 200 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(3-ацетил-2,6-диметилпиридин-4-илоксиметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C29H33N3O6S2
Молекулярная масса: 583,72.
1H ЯМР (ДМСО-d6): 1,07 (т, J=7,2 Гц, 3H), 1,56 (с, 3H), 2,19 (с, 3H), 2,28 (с, 3H), 2,42 (с, 3H), 2,48 (с, 6H), 3,28-3,32 (м, 2H), 4,11 (с, 2H), 5,27 (с, 2H), 6,76 (с, 1Н), 7,02-7,07 (м, 2H), 7,27-7,30 (м, 1Н), 7,50 (с, 1Н), 10,70 (с, 1Н).
Масс-спектр: (m-1) 582.
Пример 13
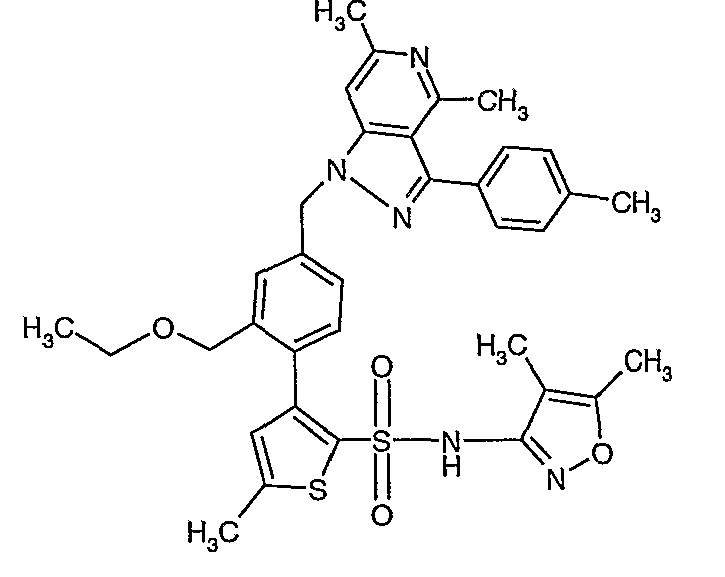
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(4,6-диметил-3-паратолилпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 1-п-толилбутан-1,3-диона

К 50 мл N,N-диметилформамида, охлажденного до 0°C, добавляли гидрид натрия (60% в минеральном масле) (7,49 г, 0,31 моль) с последующим добавлением раствора 4-метилацетофенона (38 г, 0,284 моль) в сухом этилацетате (56 мл, 0,56 моль). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь затем подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 41 г желтого твердого вещества, представляющего собой 1-п-толилбутан-1,3-дион.
Стадия 02: Синтез 3-амино-1-п-толилбут-2-ен-1-она
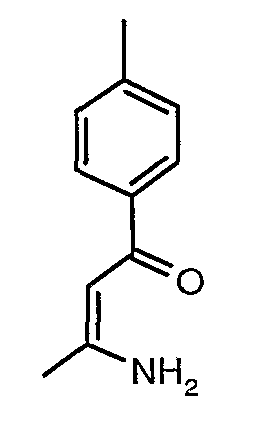
Смесь 1-п-толилбутан-1,3-диона (41 г, 0,23 моль) и ацетата аммония (71,8 г, 0,93 моль) в сухом метаноле (200 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь затем концентрировали полностью в вакууме и к остатку добавляли охлажденную воду и подщелачивали до рН 8, используя насыщенный раствор бикарбоната натрия, с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 25 г 3-амино-1-п-толилбут-2-ен-1-она.
Стадия 03: Синтез 4-бром-3-(бромметил)этилбензоата
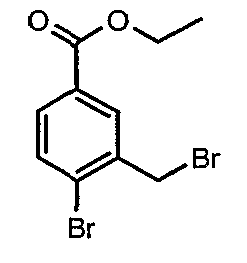
К раствору этилового эфира 4-бром-3-метилбензойной кислоты (28 г, 0,11 моль) в 100 мл тетрахлорметана добавляли 22,65 г (0,12 моль) N-бромсукцинимида и бензоилпероксид (1,4 г, 0,005 моль, 75% в воде) и смесь нагревали с обратным холодильником в течение 10 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали и остаток, полученный таким образом, очищали, растирая с гексаном (100 мл), получая твердый продукт, который отфильтровывали и сушили при отсасывании, получая 17,5 г 4-бром-3-(бромметил)этилбензоата.
Стадия 04: Синтез этилового эфира 4-бром-3-этоксиметилбензойной кислоты
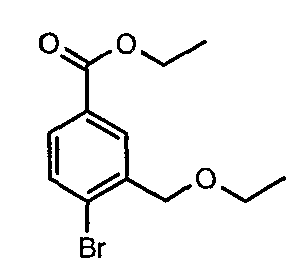
К охлажденному раствору 4-бром-3-(бромметил)этилбензоата (17,5 г, 0,054 моль) в этаноле (30 мл) добавляли этоксид натрия (7 г, 0,074 моль) и 12 мл N,N-диметилформамида. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре и затем концентрировали в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (100 мл). Этилацетатный слой промывали водой и насыщенным раствором соли и, наконец, сушили над сульфатом натрия и упаривали в вакууме, получая 12,5 г этилового эфира 4-бром-3-этоксиметилбензойной кислоты.
Стадия 05: Синтез 6-диметил-3-(4-метилбензоила)-1Н-пиридин-4-она
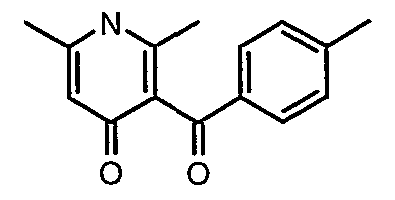
Смесь 2,2,6-триметил[1,3]диоксин-4-она (24,36 г, 0,17 моль) и 3-амино-1-п-толилбут-2-ен-1-она (15 г, 0,086 моль) нагревали с обратным холодильником при 120°C в течение 6 ч. Реакционную смесь непосредственно очищали хроматографией на колонке с силикагелем, используя смесь 10% метанол:этилацетат в качестве элюента, получая 3,2 г 6-диметил-3-(4-метилбензоил)-1H-пиридин-4-она.
Стадия 06: Синтез (4-хлор-2,6-диметилпиридин-3-ил)паратолилметанона
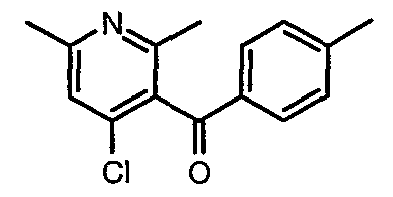
К 20 мл охлажденного (0°C) оксихлорида фосфора добавляли (3,2 г, 0,013 моль) 6-диметил-3-(4-метилбензоил)-1Н-пиридин-4-она. Реакционную смесь перемешивали и нагревали при 100°C в течение 8 часов. Затем реакционную смесь упаривали в вакууме, и остаток, полученный таким образом, подщелачивали до рН 8 насыщенным раствором карбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме, получая 3,2 г (4-хлор-2,6-диметилпиридин-3-ил)-п-толилметанона.
Стадия 07: Синтез 4,6-диметил-3-п-толил-1Н-пиразоло[4,3-c]пиридина
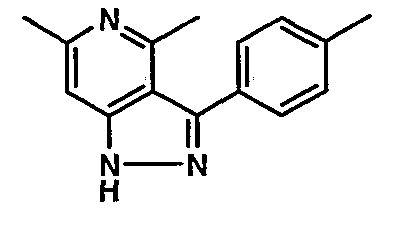
К (4-хлор-2,6-диметилпиридин-3-ил)паратолилметанону (3,2 г, 0,01 моль) в этаноле (10 мл) добавляли гидразингидрат (5,8 мл, 0,185 моль) с последующим добавлением двух капель уксусной кислоты. После завершения добавления температуру реакционной смеси медленно поднимали до температуры кипения и выдерживали в течение 6 часов. Реакционную смесь охлаждали до комнатной температуры и затем упаривали в вакууме. Неочищенную массу помещали на лед, твердое вещество, полученное таким образом, отфильтровывали и сушили при отсасывании, получая 1,6 г 4,6-диметил-3-п-толил-1Н-пиразоло[4,3-c]пиридина.
Стадия 08: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
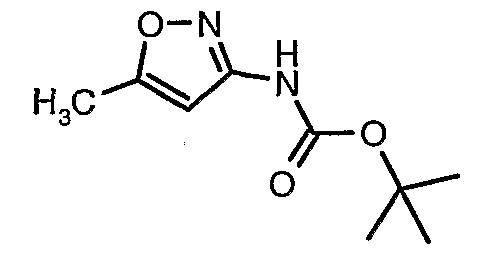
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 09: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
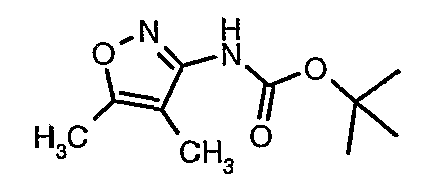
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 10: Синтез 4,5-диметилизоксазол-3-иламина
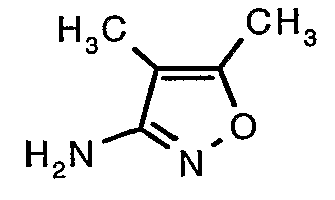
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) при 0°C добавляли порциями к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 11: Синтез 5-метилтиофен-2-сульфонилхлорида
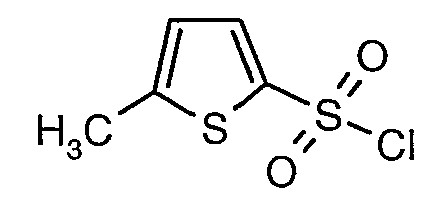
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Реакционную смесь затем выдерживали при 0°C в течение 3 ч. Неочищенную реакционную массу медленно загружали в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия, упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
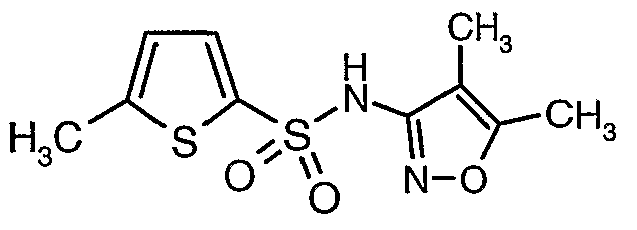
Раствор 5-метилтиофен-2-сульфонилхлорида (16,0 г, 0,081 моль) в (25 мл) метиленхлорида добавляли при 0°C к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
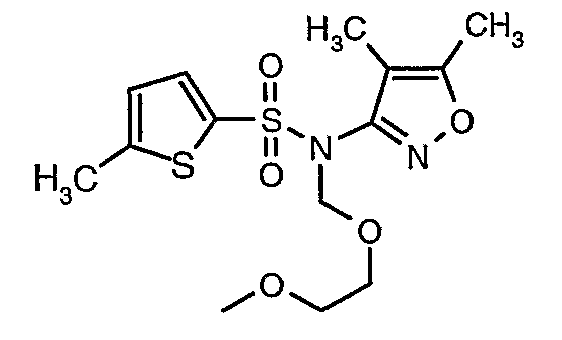
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и смесь перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C с последующим добавлением по каплям к реакционной смеси метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, добавляли 90 мл этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 14: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
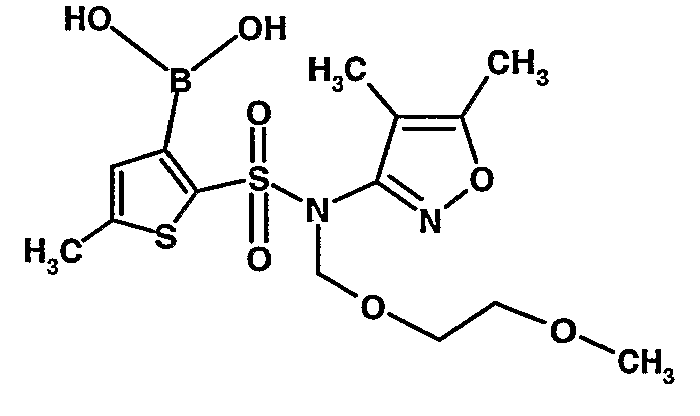
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно поднимали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 15: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
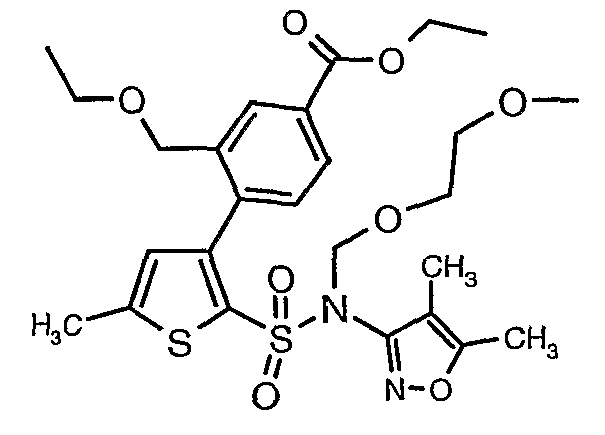
К перемешиваемому раствору этилового эфира 4-бром-3-этоксиметилбензойной кислоты (4 г, 0,0139 моль) в диметоксиэтане (50 мл) в токе сухого азота добавляли бис(трифенилфосфин)палладий(II)хлорид (1 г, 0,00142 моль) с последующим добавлением 2M водного раствора карбоната натрия (4,3 г в 20 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут и затем нагревали при 60°C. К полученному раствору за 45 минут добавляли по каплям 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамид (5,5 г, 0,0136 моль в 25 мл диметоксиэтана), и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 60 минут такую же процедуру повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,5 г, 0,0136 моль в 25 мл диметоксиэтана). Реакционную смесь затем нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Смесь охлаждали до комнатной температуры и добавляли этилацетат (100 мл) с последующим добавлением воды. Затем органические слои разделяли и водный слой экстрагировали этилацетатом (50 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 7 г этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
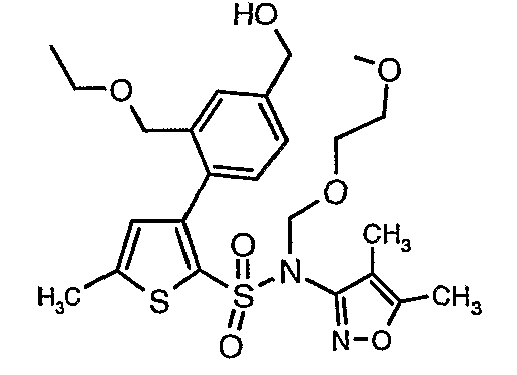
Алюмогидрид лития (1,4 г, 0,037 моль) при 0°C в токе азота добавляли к перемешиваемому раствору тетрагидрофурана (80 мл) с последующим добавлением этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты (8 г, 0,014 моль) в 35 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 часа, затем температуру повышали до комнатной температуры и смесь перемешивали в течение 4 часов. Избыток алюмогидрида лития разрушали добавлением при 0°C раствора гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 4,7 г (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 17: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил)-3-этоксиметилбензилового эфира метансульфоновой кислоты
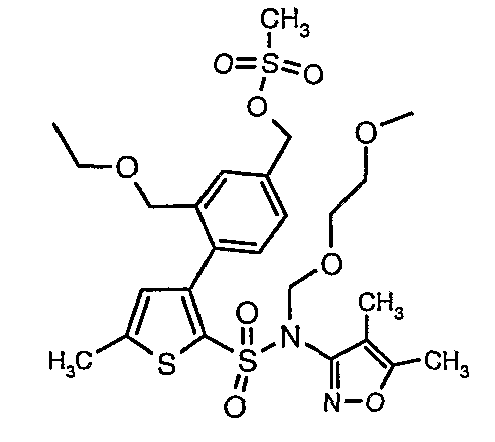
N-этилдиизопропиламин (2,13 мл, 0,012 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (3,2 г, 0,0060 моль) в 30 мл дихлорметана. Реакционную смесь охлаждали до 0°C, затем в реакционную смесь медленно добавляли метансульфонилхлорид (0,6 мл, 0,0073 моль). Реакционную смесь выдерживали при комнатной температуре в течение 3 часов и затем помещали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 3,3 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты в виде коричневого масла.
Стадия 18: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4,6-диметил-3-п-толилпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
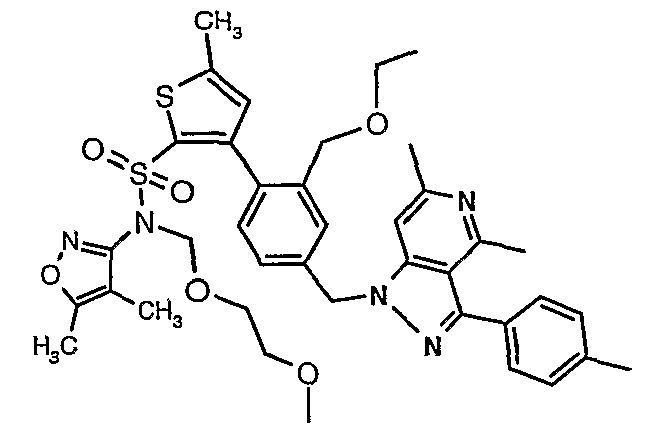
К перемешиваемому раствору 4,6-диметил-3-п-толил-1Н-пиразоло[4,3-c]пиридина (0,78 г, 3,3 ммоль) в N,N-диметилформамиде (15 мл) при -15°C в токе сухого азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,24 г, 5 ммоль). После завершения добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь повторно охлаждали до 0°C и добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (2 г, 3,3 ммоль) в 10 мл N,N-диметилформамида и смесь затем перемешивали при комнатной температуре в течение 24 ч. Смесь затем охлаждали до 0°C и разбавляли этилацетатом (40 мл), затем (10 мл) холодной воды. Органический слой отделяли, водный слой экстрагировали этилацетатом (50 мл×2) и объединенный органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 2,2 г неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметиламида 3-[4-(4,6-диметил-3-п-толилпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 19: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(4,6-диметил-3-п-толилпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
К 2,2 г (2,95 ммоль) неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметиламида 3-[4-(4,6-диметил-3-п-толилпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты добавляли при комнатной температуре 95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь перемешивали, нагревали в течение 3 ч и затем реакционную смесь концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой, рН раствора доводили до рН 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 300 мг 3-[4-(4,6-диметил-3-п-толилпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-(4,5-диметилизоксазол-3-ил)амида.
Молекулярная формула: C35H37N5O4S2
Молекулярная масса: 655,84.
1H ЯМР (ДМСО-d6): 1,01 (т, J=7,2 Гц, 3H), 1,47 (с, 3H), 2,11 (с, 3H), 2,40 (с, 3H), 2,47 (с, 3H), 2,48 (с, 3H), 2,53 (с, 3H), 3,24-3,27 (м, 2H), 4,05 (с, 2H), 5,68 (с, 2H), 6,70 (с, 1Н), 6,93-6,95 (м, 1Н), 7,08-7,10 (м, 1Н), 7,32-7,34 (м, 3H), 7,51-7,54 (м, 3H), 10,75 (с, 1Н).
Масс-спектр: (m+1) 656,2.
Пример 14
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез l-тиофен-2-илбутан-1,3-диона
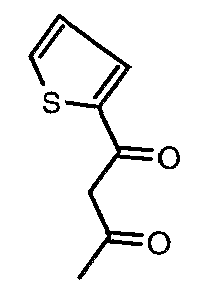
Гидрид натрия (60% в минеральном масле) (4,18 г, 0,17 моль) добавляли при 0°C и в токе сухого азота к 40 мл N,N-диметилформамида. К полученной смеси добавляли раствор 2-ацетилтиофена (20 г, 0,16 моль) в сухом этилацетате (31 мл, 0,32 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь затем подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и упаривали, получая 27 г l-тиофен-2-илбутан-1,3-диона.
Стадия 02: Синтез 3-амино-1-тиофен-2-илбут-2-ен-1-она
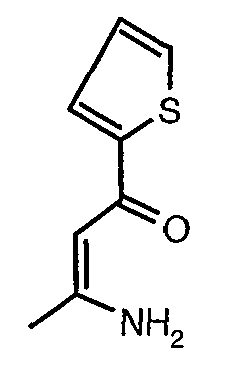
Смесь 1-тиофен-2-илбутан-1,3-диона (26,5 г, 0,16 моль) и ацетата аммония (48,6 г, 0,63 моль) в сухом метаноле (260 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали полностью в вакууме и к остатку добавляли охлажденную воду. Реакционную смесь подщелачивали до рН 8 с использованием насыщенного раствора бикарбоната натрия с последующей экстракцией этилацетатом (100 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали, получая 16,8 г 3-амино-1-тиофен-2-илбут-2-ен-1-она.
Стадия 03: Синтез 4-бром-3-(бромметил)этилбензоата
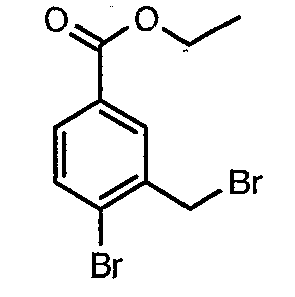
К раствору этилового эфира 4-бром-3-метилбензойной кислоты (28 г, 0,11 моль) в 100 мл тетрахлорметана добавляли 22,65 г (0,12 моль) N-бромсукцинимида и бензоилпероксид (1,4 г, 0,005 моль, 75% в воде) и смесь нагревали с обратным холодильником в течение 10 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали. Остаток, полученный таким образом, очищали, растирая с гексаном (100 мл), получая твердый продукт, который отфильтровывали и сушили при отсасывании, получая 17,5 г 4-бром-3-(бромметил)этилбензоата.
Стадия 04: Синтез этилового эфира 4-бром-3-этоксиметилбензойной кислоты
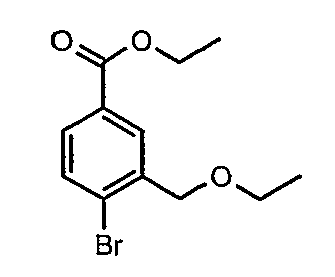
К охлажденному (0°C) раствору 4-бром-3-(бромметил)этилбензоата (17,5 г, 0,054 моль) в этаноле (30 мл) добавляли этоксид натрия (7 г, 0,074 моль) и 12 мл N,N-диметилформамида. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре и затем концентрировали в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (100 мл). Этилацетатный слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 12,5 г этилового эфира 4-бром-3-этоксиметилбензойной кислоты.
Стадия 05: Синтез 2,6-диметил-3-(тиофен-2-карбонил)-1Н-пиридин-4-она
Смесь 2,2,6-триметил[1,3]диоксин-4-она (28,6 г, 0,20 моль) и 3-амино-1-тиофен-2-илбут-2-ен-1-она (16,8 г, 0,10 моль) нагревали с обратным холодильником при 120°C в течение 6 ч. Остаток непосредственно очищали хроматографией на колонке с силикагелем, используя смесь 10% метанол:этилацетат в качестве элюента, получая 4,6 г 2,6-диметил-3-(тиофен-2-карбонил)-1Н-пиридин-4-она.
Стадия 06: Синтез (4-хлор-2,6-диметилпиридин-3-ил)тиофен-2-илметанона
2,6-диметил-3-(тиофен-2-карбонил)-1Н-пиридин-4-он (4,6 г, 0,01 моль) при 0°C добавляли к 30 мл оксихлорида фосфора. Смесь перемешивали и нагревали при 100°C в течение 8 часов. Затем реакционную смесь упаривали в вакууме и остаток, полученный таким образом, подщелачивали до рН 8 насыщенным раствором карбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме, получая 4,35 г (4-хлор-2,6-диметилпиридин-3-ил)тиофен-2-илметанона.
Стадия 07: Синтез 4,6-диметил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина

(4-Хлор-2,6-диметилпиридин-3-ил)тиофен-2-илметанон (4,35 г, 0,02 моль) помещали в этанол (20 мл). К полученной смеси добавляли гидразингидрат (6 мл, 0,185 моль), затем две капли уксусной кислоты. Температуру медленно повышали, смесь нагревали с обратным холодильником и выдерживали в течение 6 часов. Реакционную смесь упаривали в вакууме. Неочищенную массу помещали на лед, твердое вещество, полученное таким образом, отфильтровывали и сушили при отсасывании, получая 4,48 г 4,6-диметил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина.
Стадия 08: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
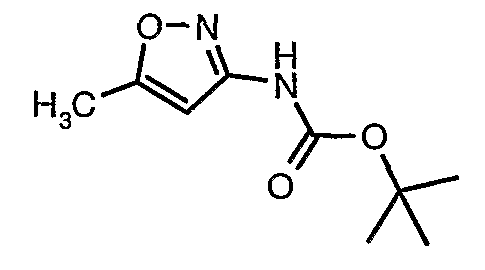
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая 130 г трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 09: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
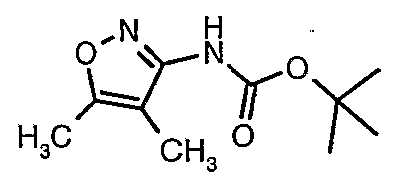
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 10: Синтез 4,5-диметилизоксазол-3-иламина
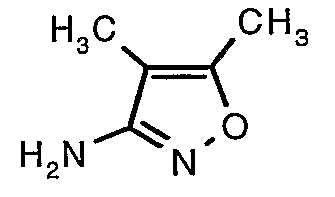
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями при 0°C к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 11: Синтез 5-метилтиофен-2-сульфонилхлорида
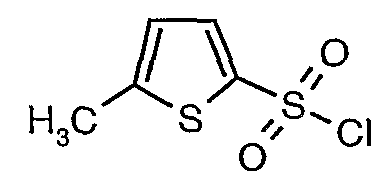
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе (100 мл) добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Реакционную смесь выдерживали при 0°C в течение 3 ч. Неочищенную реакционную массу медленно загружали в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия, упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
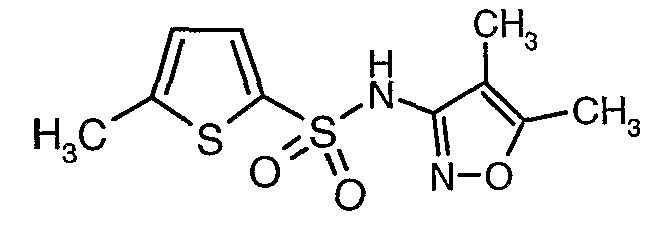
Раствор 5-метилтиофен-2-сульфонилхлорида (16,0 г, 0,081 моль) в 25 мл метиленхлорида добавляли при 0°C к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
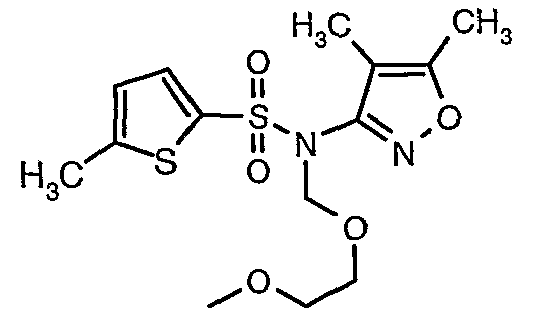
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и смесь перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C с последующим добавлением к реакционной смеси по каплям метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, добавляли (90 мл) этилацетат и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 14: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
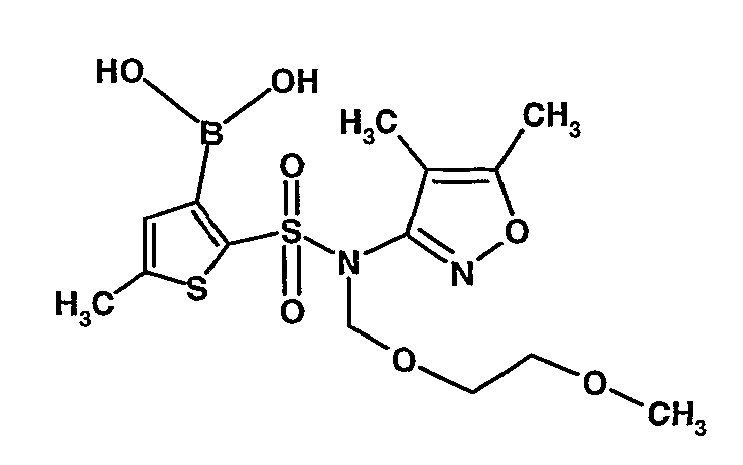
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (70 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно поднимали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 15: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
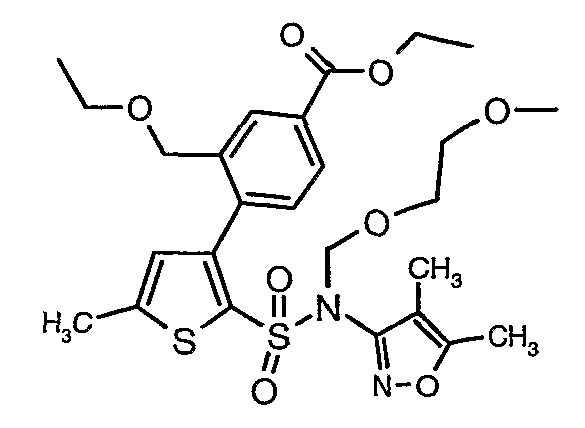
К перемешиваемому раствору этилового эфира 4-бром-3-этоксиметилбензойной кислоты (4 г, 0,0139 моль) в диметоксиэтане (50 мл) в токе сухого азота добавляли бис(трифенилфосфин)палладий(II)хлорид (l г, 0,00142 моль) с последующим добавлением 2M водного раствора карбоната натрия (4,3 г в 20 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. Добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,5 г, 0,0136 моль в 25 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 60 минут такую же процедуру повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,5 г, 0,0136 моль в 25 мл диметоксиэтана). Реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Смесь затем охлаждали до комнатной температуры и добавляли этилацетат (100 мл) с последующим добавлением воды. Органические слои разделяли и водный слой экстрагировали этилацетатом (50 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 7 г этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
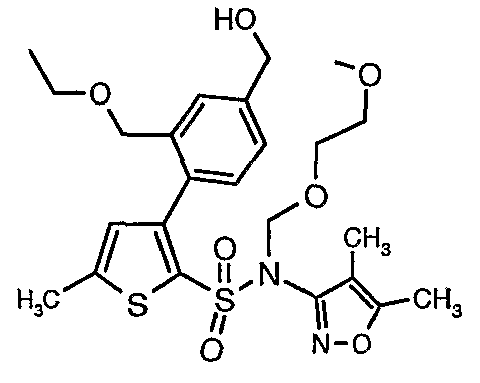
Алюмогидрид лития (1,4 г, 0,037 моль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана (70 мл) с последующим добавлением 8 г (0,014 моль) этилового эфира 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в 35 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 часа, затем температуру повышали до комнатной температуры и смесь перемешивали в течение 4 часов. Избыток алюмогидрида лития разрушали добавлением при 0°C раствора гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 4,7 г (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 17: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты
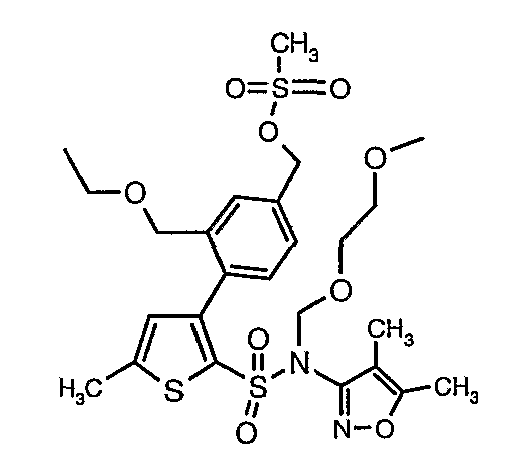
N-этилдиизопропиламин (2,13 мл, 0,012 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (3,2 г, 0,0060 моль) в 30 мл дихлорметана. Реакционную смесь охлаждали до 0°C, затем медленно добавляли метансульфонилхлорид (0,6 мл, 0,0073 моль). Реакционную смесь выдерживали при комнатной температуре в течение 3 часов и затем помещали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 3,3 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты в виде коричневого масла.
Стадия 18: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
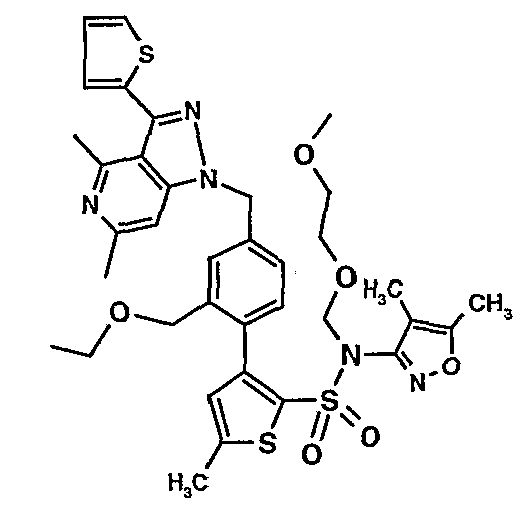
К перемешиваемому раствору 4,6-диметил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина (0,76 г, 3,3 ммоль) в N,N-диметилформамиде (15 мл) при -15°C в токе сухого азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,24 г, 5 ммоль). После завершения добавления реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 30 мин. Затем реакционную смесь повторно охлаждали до 0°C и добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (2 г, 3,3 ммоль) в 10 мл N,N-диметилформамида и смесь перемешивали при комнатной температуре в течение 24 часов. Смесь затем разбавляли этилацетатом (40 мл) с последующим добавлением 10 мл холодной воды. Органический слой отделяли, промывали водой и насыщенным раствором соли и, наконец, сушили над сульфатом натрия и упаривали в вакууме, получая 2,1 г неочищенного 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида в виде вязкой маслянистой массы.
Стадия 19: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
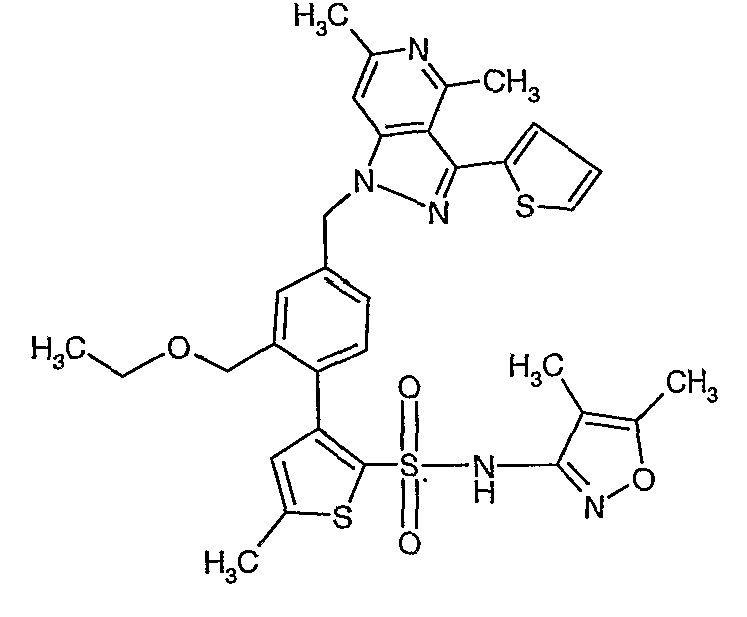
К 2,1 г (2,8 ммоль) неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь перемешивали и нагревали в течение 3 ч. Затем реакционную смесь концентрировали в вакууме, остаток, полученный таким образом, разбавляли водой, рН раствора доводили до рН 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (30 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 320 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C32H33N5O4S3
Молекулярная масса: 647,84.
1H ЯМР (ДМСО-d6): 1,01 (т, J=7,2 Гц, 3H), 1,47 (с, 3H), 2,12 (с, 3H), 2,47 (с, 3H), 2,53 (с, 3H), 2,66 (с, 3H), 3,22-3,27 (м, 2H), 4,05 (с, 2H), 5,69 (с, 2H), 6,70-6,71 (м, 1Н), 6,93-6,95 (м, 1Н), 7,06-7,09 (м, 1Н), 7,23-7,25 (м, 1Н), 7,34 (с, 1Н), 7,52-7,53 (м, 2H), 7,71-7,73 (м, 1Н), 10,76 (с, 1Н).
Масс-спектр: (m+1) 648,1.
Пример 15
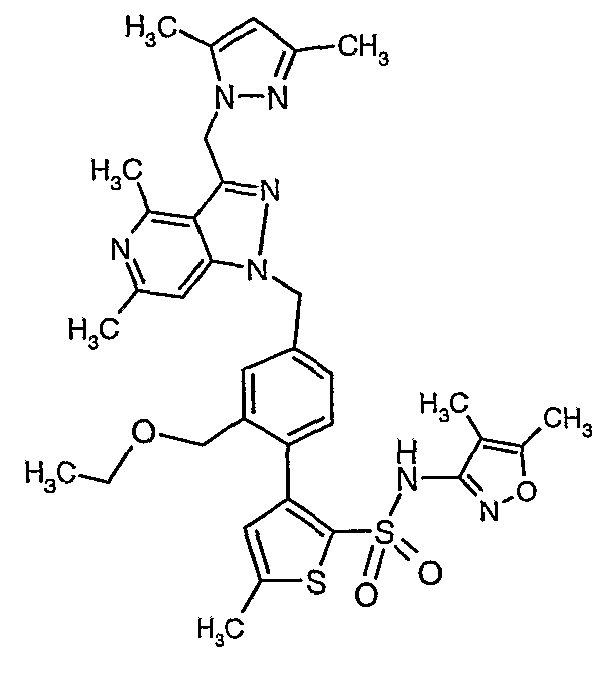
(4,5-Диметилизоксазол-3-ил)амид 3-{4-[3-(3,5-диметилпиразол-1-илметил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-этоксиметилфенил}-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 1-(3,5-диметилпиразол-1-ил)пентан-2,4-диона
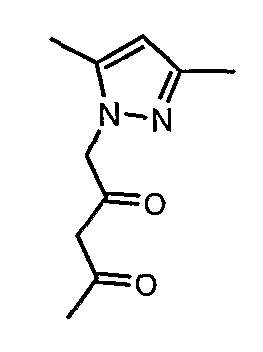
Гидрид натрия (60% в минеральном масле) (8,6 г, 0,179 моль) при 0°C добавляли в токе сухого азота к N,N-диметилформамиду (100 мл). К полученной смеси добавляли раствор этилового эфира (3,5-диметилпиразол-1-ил)уксусной кислоты (30 г, 0,164 моль) в сухом ацетоне (11,4 мл, 0,196 моль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, затем подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали, получая 26 г 1-(3,5-диметилпиразол-1-ил)пентан-2,4-диона
Стадия 02: Синтез 4-амино-1-(3,5-диметилпиразол-1-ил)пент-3-ен-2-она
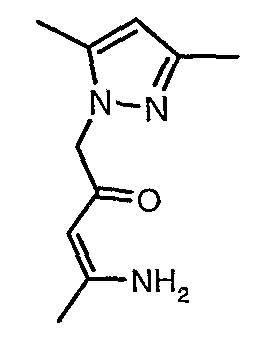
Смесь 1-(3,5-диметилпиразол-1-ил)пентан-2,4-диона (26 г, 0,134 моль) и ацетата аммония (52 г, 0,675 моль) в сухом метаноле (200 мл) перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь концентрировали полностью в вакууме и к остатку добавляли охлажденную воду. Реакционную смесь подщелачивали до рН 8, используя насыщенный раствор бикарбоната натрия, с последующей экстракцией этилацетатом (100 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали, получая 20 г 4-амино-1-(3,5-диметилпиразол-1-ил)пент-3-ен-2-она.
Стадия 03: Синтез 4-бром-3-(бромметил)этилбензоата
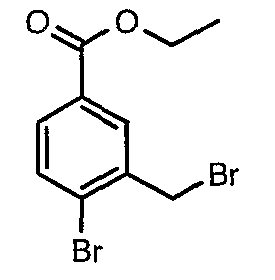
К раствору этилового эфира 4-бром-3-метилбензойной кислоты (28 г, 0,11 моль) в 100 мл тетрахлорметана добавляли 22,65 г (0,12 моль) N-бромсукцинимида и бензоилпероксид (1,4 г, 0,005 моль, 75% в воде) и смесь нагревали с обратным холодильником в течение 10 часов. Смесь затем охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали. Остаток, полученный таким образом, очищали, растирая с гексаном (100 мл), получая твердый продукт, который отфильтровывали и сушили при отсасывании, получая 17,5 г 4-бром-3-(бромметил)этилбензоата.
Стадия 04: Синтез этилового эфира 4-бром-3-этоксиметилбензойной кислоты
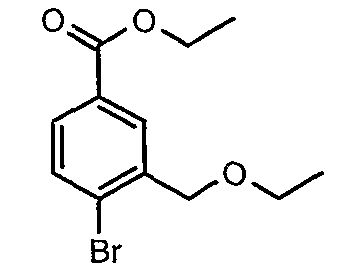
К охлажденному (0°C) раствору 4-бром-3-(бромметил)этилбензоата (17,5 г, 0,054 моль) в этаноле (30 мл) добавляли этоксид натрия (7 г, 0,074 моль) и (12 мл) N,N-диметилформамида. Реакционную смесь перемешивали в течение 4 часов при комнатной температуре и затем концентрировали в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (100 мл). Этилацетатный слой промывали водой и насыщенным раствором соли и, наконец, сушили над сульфатом натрия и упаривали в вакууме, получая 12,5 г этилового эфира 4-бром-3-этоксиметилбензойной кислоты.
Стадия 05: Синтез 3-[2-(3,5-диметилпиразол-1-ил)ацетил]-2,6-диметил-1Н-пиридин-4-она
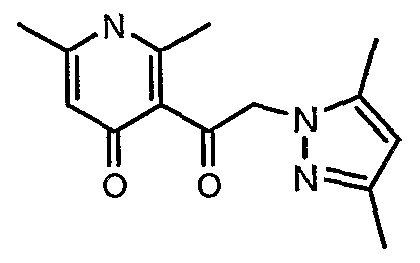
Смесь 2,2,6-триметил[1,3]диоксин-4-она (30 г, 0,21 моль) и 4-амино-1-(3,5-диметилпиразол-1-ил)пент-3-ен-2-она (20 г, 0,10 моль) нагревали с обратным холодильником при 120°C в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и непосредственно очищали на колонке с силикагелем, используя смесь 10% метанол:этилацетат в качестве элюента, получая 6 г 3-[2-(3,5-диметилпиразол-1-ил)ацетил]-2,6-диметил-1Н-пиридин-4-она.
Стадия 06: Синтез 1-(4-хлор-2,6-диметилпиридин-3-ил)-2-(3,5-диметилпиразол-1-ил)этанона
3-[2-(3,5-диметилпиразол-1-ил)ацетил]-2,6-диметил-1Н-пиридин-4-он (6 г, 0,023 моль) добавляли при 0°C к 30 мл оксихлорида фосфора. Реакционную смесь перемешивали при 30°C в течение 8 часов. Реакционную смесь упаривали в вакууме и остаток подщелачивали до рН 8 насыщенным раствором карбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия и концентрировали, получая 1,8 г 1-(4-хлор-2,6-диметилпиридин-3-ил)-2-(3,5-диметилпиразол-1-ил)этанона.
Стадия 07: Синтез 3-(3,5-диметилпиразол-1-илметил)-4,6-диметил-1Н-пиразоло[4,3-c]пиридина
1-(4-хлор-2,6-диметилпиридин-3-ил)-2-(3,5-диметилпиразол-1-ил)этанон (1,8 г, 0,0065 моль) растворяли в этаноле (10 мл). К смеси добавляли гидразингидрат (3,12 мл, 0,0624 моль) с последующим добавлением двух капель уксусной кислоты. Температуру медленно поднимали, нагревали с обратным холодильником и затем выдерживали при кипении в течение 6 часов. Реакционную смесь охлаждали до комнатной температуры и затем упаривали в вакууме. Неочищенную массу помещали на лед, полученное твердое вещество отфильтровывали и сушили при отсасывании, получая 0,5 г 3-(3,5-диметилпиразол-1-илметил)-4,6-диметил-1Н-пиразоло[4,3-c]пиридина.
Стадия 08: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
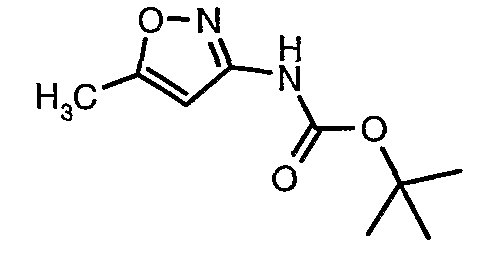
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 09: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
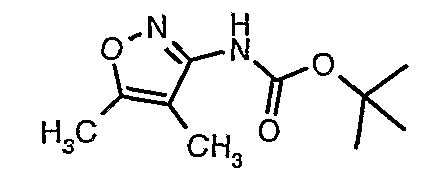
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 10: Синтез 4,5-диметилизоксазол-3-иламина
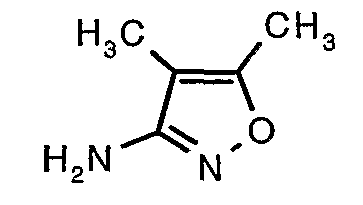
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями при 0°C к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 11: Синтез 5-метилтиофен-2-сульфонилхлорида
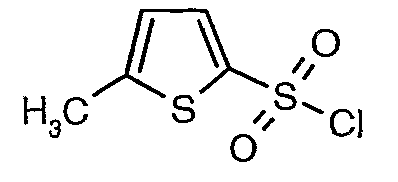
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Реакционную смесь затем выдерживали при 0°C в течение 3 ч. Неочищенную реакционную массу медленно загружали в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия и упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
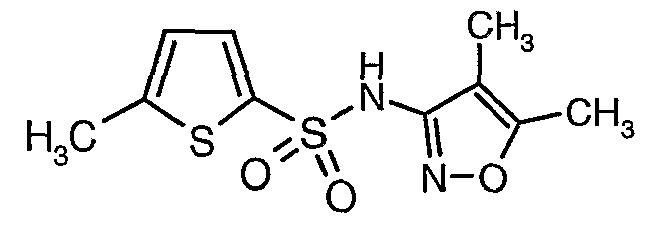
Раствор 5-метилтиофен-2-сульфонилхлорида (16,0 г, 0,081 моль) в 25 мл метиленхлорида добавляли при 0°C к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
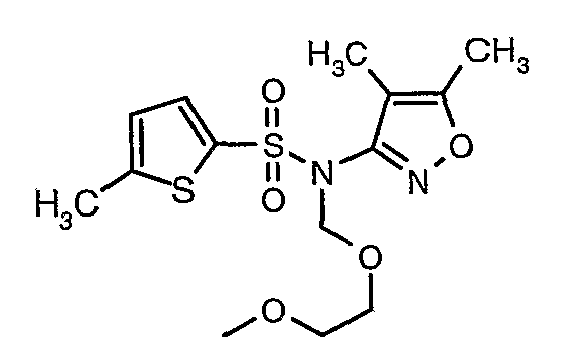
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C, с последующим добавлением по каплям к реакционной смеси метоксэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C и добавляли (90 мл) этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 14: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
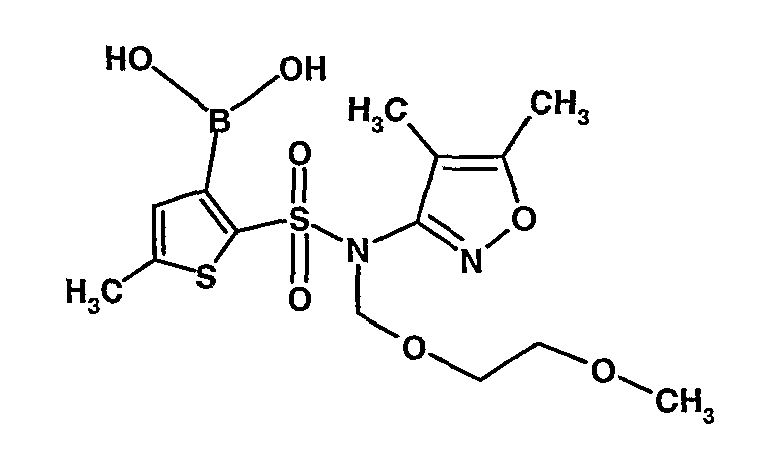
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно поднимали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 15: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
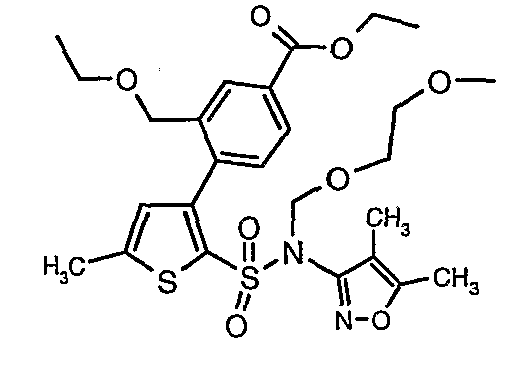
К перемешиваемому раствору этилового эфира 4-бром-3-этоксиметилбензойной кислоты (4 г, 0,0139 моль) в диметоксиэтане (50 мл) в токе сухого азота добавляли бис(трифенилфосфин)палладий(II)хлорид (1 г, 0,00142 моль) с последующим добавлением 2M водного раствора карбоната натрия (4,3 г в 20 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. К полученной смеси за 45 минут добавляли раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,5 г, 0,0136 моль в 25 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 60 минут такую же процедуру повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5,5 г, 0,0136 моль в 25 мл диметоксиэтана). Реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч, затем охлаждали до комнатной температуры и добавляли этилацетат (100 мл) с последующим добавлением воды. Затем органические слои разделяли, водный слой экстрагировали этилацетатом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли, и, наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 7 г этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
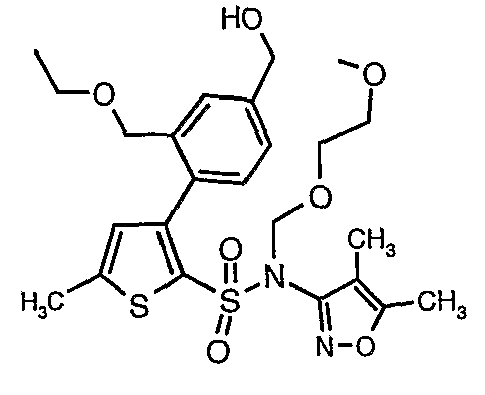
Алюмогидрид лития (1,4 г, 0,037 моль) добавляли при 0°C в токе азота при перемешивании к тетрагидрофурану (20 мл) с последующим добавлением этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилфенил)уксусной кислоты (8 г, 0,014 моль) в 35 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 часа, затем температуру повышали до комнатной температуры и смесь перемешивали в течение 4 часов. Избыток алюмогидрида лития разрушали добавлением при 0°C раствора гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 4,7 г (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 17: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил-5-метилтиофен-3-ил)-3-этоксиметилбензилового эфира метансульфоновой кислоты
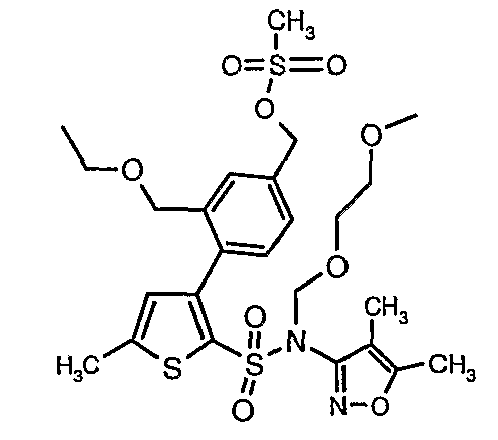
N-этилдиизопропиламин (2,13 мл, 0,012 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (3,2 г, 0,0060 моль) в 30 мл дихлорметана. Реакционную смесь охлаждали до 0°C, затем медленно добавляли метансульфонилхлорид (0,6 мл, 0,0073 моль). Реакционную смесь выдерживали при комнатной температуре в течение 3 часов и затем помещали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли, органический слой сушили над сульфатом натрия и концентрировали, получая 3,3 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты в виде коричневого масла.
Стадия 18: Синтез 3-{4-[3-(3,5-диметилпиразол-1-илметил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-этоксиметилфенил}-5-метилтиофен-2-(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида
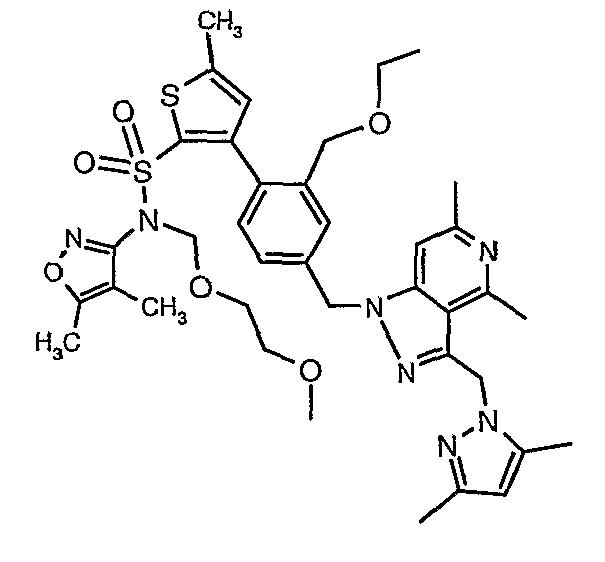
К перемешиваемому раствору 3-(3,5-диметилпиразол-1-илметил)-4,6-диметил-1Н-пиразоло[4,3-c]пиридина (0,45 г, 0,0017 моль) в N,N-диметилформамиде (10 мл) при
-15°C в токе сухого азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,127 г, 0,0026 моль). После завершения добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь повторно охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (1 г, 0,0016 моль) в 10 мл N,N-диметилформамида и перемешивали при комнатной температуре в течение 24 часов. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой отделяли, промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 1,5 г неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-{4-[3-(3,5-диметилпиразол-1-илметил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-этоксиметилфенил}-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 19: Синтез 3-{4-3-[(3,5-диметилпиразол-1-илметил)-4,6-диметилпиразоло[4,3-с]пиридин-1-илметил]-2-этоксиметилфенил}-5-метилтиофен-2-(4,5-диметилизоксазол-3-ил)амида
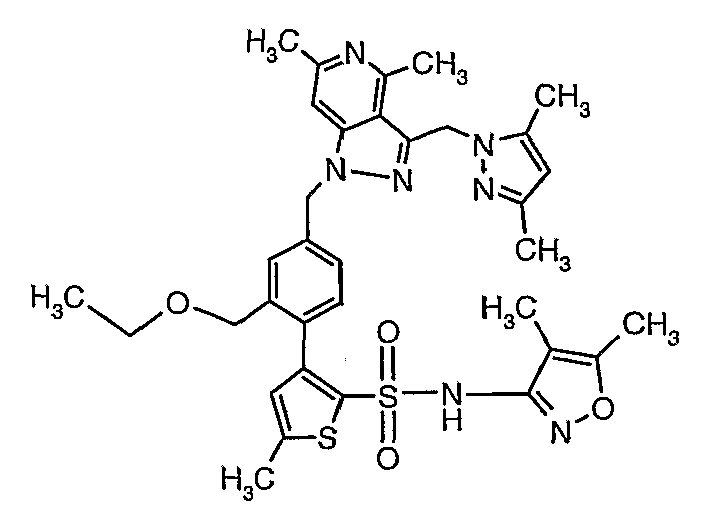
К (1,5 г, 1,96 ммоль) неочищенного 3-{4-[3-(3,5-диметилпиразол-1-илметил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-этоксиметилфенил}-5-метилтиофен-2-(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида при комнатной температуре добавляли 95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (6 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Затем реакционную смесь концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (30 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 300 мг (4,5-диметилизоксазол-3-ил)амида 3-{4-[3-(3,5-диметилпиразол-1-илметил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-этоксиметилфенил}-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C34H39N7O4S2
Молекулярная масса: 673,86.
1H ЯМР (ДМСО-d6): 1,02 (т, J=7,2 Гц, 3H), 1,51 (с, 3H), 2,02 (с, 3H), 2,13 (с, 3H), 2,29 (с, 3H), 2,47 (с, 3H), 2,48 (с, 3H), 2,76 (с, 3H), 3,22-3,27 (м, 2H), 4,04 (с, 2H), 5,59 (с, 2H), 5,60 (с, 2H), 5,82 (с, 1Н), 6,69 (с, 1Н), 6,91-6,93 (м, 1Н), 7,00-7,02 (м, 1Н), 7,29 (с, 1Н), 7,43 (с, 1Н), 10,70 (с, 1Н).
Масс-спектр: (m-1) 674,2.
Пример 16

(4,5-Диметоксиизоксазол-3-ил)амид 3-[2-метоксиметил-4-(4,5,7-триметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез N-(3-ацетил-2,6-диметилпиридин-4-ил)-4-метилбензолсульфонамида

Тозилизоцианат (52 г, 0,26 моль) добавляли к перемешиваемой суспензии 3-ацетил-2,6-диметил-1Н-пиридин-4-она (20 г, 0,12 моль) в ацетонитриле (200 мл). После падения начальной экзотермы смесь нагревали с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, и суспендированное твердое вещество отделяли фильтрованием, получая 30 г N-(3-ацетил-2,6-диметилпиридин-4-ил)-4-метилбензолсульфонамида.
Стадия 02: Синтез 1-(4-амино-2,6-диметилпиридин-3-илэтанона
N-(3-ацетил-2,6-диметилпиридин-4-ил)-4-метилбензолсульфонамид (30 г, 0,10 моль) добавляли при 0°C к концентрированной серной кислоте (30 мл) и затем реакционную смесь перемешивали при 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и вливали в измельченный лед. Величину рН смеси доводили до pH 8 добавлением твердого карбоната натрия и экстрагировали дихлорметаном (100 мл×3), объединенные органические фазы промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали, получая 9 г 1-(4-амино-2,6-диметилпиридин-3-илэтанона в виде твердого вещества с низкой температурой плавления.
Стадия 03: Синтез 4,5,7-триметил-1Н-[1,6]нафтиридин-2-она
1-(4-Амино-2,6-диметилпиридин-3-илэтанон (9 г, 0,054 моль) и (карбэтоксиметилен)трифенилфосфоран (21 г, 0,06 моль) добавляли к ксилолу (100 мл), смесь перемешивали и нагревали с обратным холодильником в течение 6 часов. Реакционную смесь упаривали в вакууме и к полученному таким образом остатку добавляли этоксид натрия (2,1 г) и 20 мл этанола. Смесь перемешивали, нагревали с обратным холодильником в течение 6 ч, затем упаривали в вакууме и остаток разбавляли водой с последующим добавлением при перемешивании концентрированной хлористоводородной кислоты. Полученную смесь затем экстрагировали простым эфиром. Эфирный экстракт отбрасывали. Водную фазу подщелачивали твердым карбонатом калия и экстрагировали этилацетатом, органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали, получая 0,662 г 4,5,7-триметил-1Н-[1,6]нафтиридин-2-она.
Стадия 04: Синтез 4-бром-3-(бромметил)этилбензоата
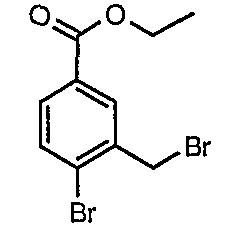
К раствору этилового эфира 4-бром-3-метилбензойной кислоты (28 г, 0,11 моль) в 100 мл тетрахлорметана добавляли (22,65 г, 0,12 моль) N-бромсукцинимида и бензоилпероксида (1,4 г, 0,005 моль, 75% в воде) и смесь нагревали с обратным холодильником в течение 10 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали и остаток, полученный таким образом, очищали, растирая с гексаном (100 мл), получая твердый продукт, который отфильтровывали и сушили при отсасывании, получая 17,5 г 4-бром-3-(бромметил)этилбензоата.
Стадия 05: Синтез этилового эфира 4-бром-3-метоксиметилбензойной кислоты
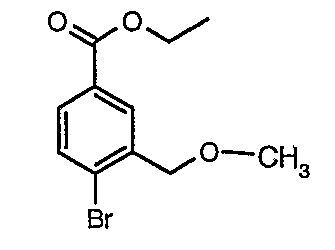
К охлажденному (0°C) раствору 40 мл метанола и 3 г (0,05 моль) метоксида натрия при 0°C добавляли раствор (13 г, 0,04 моль) этилового эфира 4-бром-3-бромметилбензойной кислоты в 12 мл N,N-диметилформамида. Реакционную смесь перемешивали при комнатной температуре (28-30°C) в течение 2 ч и затем упаривали в вакууме. Полученный остаток подкисляли до рН 1 разбавленной хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г этилового эфира 4-бром-3-метоксиметилбензойной кислоты.
Стадия 06: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
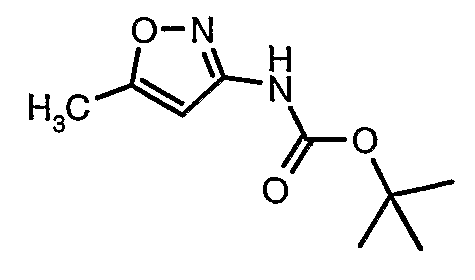
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая (130 г) трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 07: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
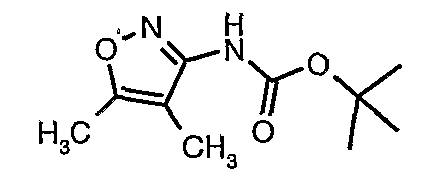
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 08: Синтез 4,5-диметилизоксазол-3-иламина
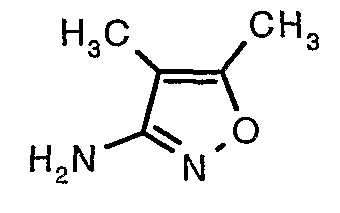
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями при 0°C к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 09: Синтез 5-метилтиофен-2-сульфонилхлорида
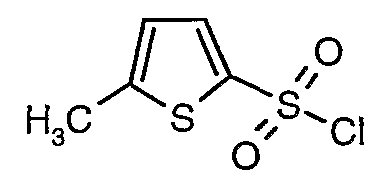
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Затем реакционную смесь выдерживали при 0°C в течение 3 ч. Неочищенную реакционную массу затем медленно загружали в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия, упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
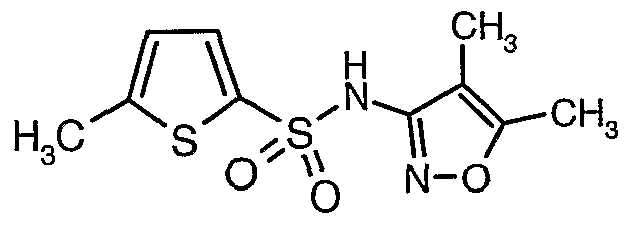
Раствор 5-метилтиофен-2-сульфонилхлорида (16,0 г, 0,081 моль) в 25 мл метиленхлорида добавляли при 0°C к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
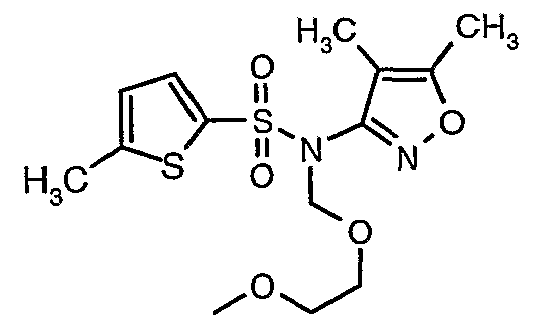
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C с последующим добавлением по каплям к реакционной смеси метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, добавляли (90 мл) этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 12: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
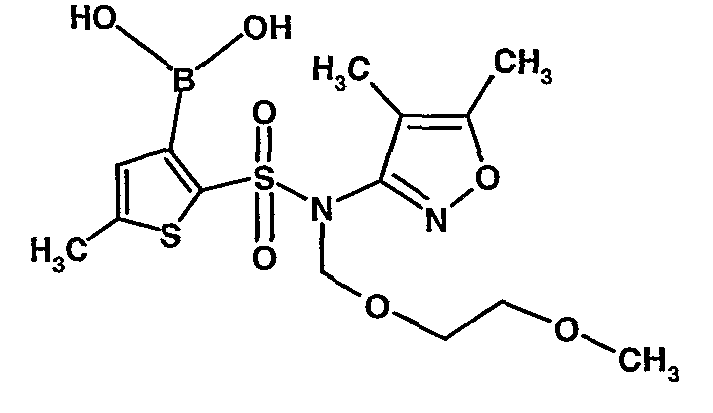
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно поднимали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 13: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензойной кислоты
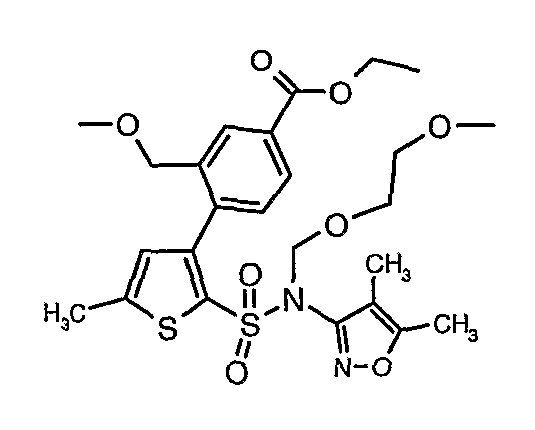
К перемешиваемому раствору этилового эфира 4-бром-3-метоксиметилбензойной кислоты (4 г, 0,014 моль) в диметоксиэтане (50 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (1 г, 0,0014 моль) с последующим добавлением 2M водного раствора карбоната натрия (4,3 г в 20 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. К реакционной смеси за 45 минут добавляли по каплям раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (3,1 г, 0,0076 моль в 25 мл диметоксиэтана), и реакционную смесь затем нагревали с обратным холодильником в течение 60 мин. Через 1 ч такую же процедуру повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (3,1 г, 0,0076 моль в 25 мл диметоксиэтана). После завершения добавления реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и затем разбавляли этилацетатом (100 мл) и водой. Органический слой отделяли и водный слой экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 5,5 г этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
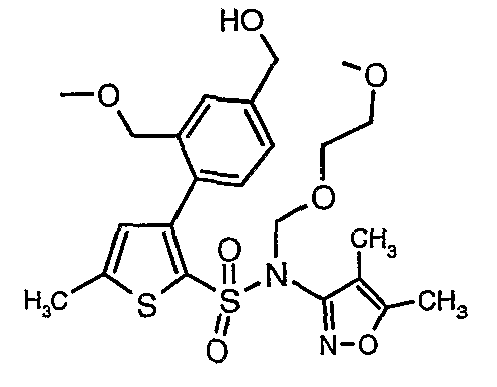
Алюмогидрид лития (0,7 г, 0,018 моль) добавляли к перемешиваемому раствору тетрагидрофурана (15 мл) при 0°C в токе сухого азота с последующим добавлением раствора этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензойной кислоты (5,5 г, 0,009 моль) в 30 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, затем температуру повышали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь затем охлаждали до 0°C и добавляли по каплям раствор 50 мл гидроксида натрия (1 г, растворенный в 100 мл воды), поддерживая температуру при 0°C. Осуществляли последующую экстракцию этилацетатом (25 мл×2). Органический слой отделяли и промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 2,7 г (4,5-диметилизоксазол-3-ил)-2-метоксиметил)амида 3-(2-этоксиметил-4-метилфенилгидрокси)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 15: Синтез 4-(2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты
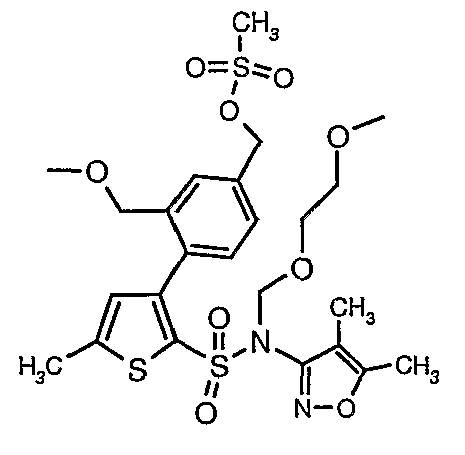
N-этилдиизопропиламин (2 мл, 0,011 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-2-метоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (2,6 г, 0,0051 моль) в 30 мл дихлорметана. Реакционную смесь охлаждали до 0°C и затем в реакционную смесь медленно добавляли метансульфонилхлорид (0,5 мл, 0,0061 моль). После завершения добавления реакционную смесь выдерживали при комнатной температуре в течение 3 ч и затем загружали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенный органический экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали, получая 2,7 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты.
Стадия 16: Синтез (4,5-диметоксиизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-метоксиметил-4-(4,5,7-триметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
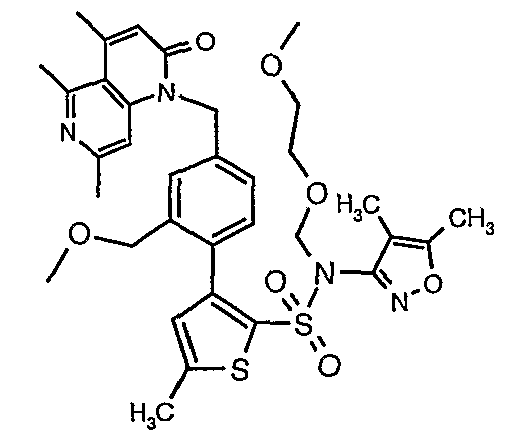
К перемешиваемому раствору 4,5,7-триметил-1Н-[1,6]нафтиридин-2-она (0,065 г, 0,0034 моль) в N,N-диметилформамиде (10 мл) при -15°C в токе сухого азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,25 г, 0,0052 моль). После завершения добавления реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 30 мин. Реакционную смесь повторно охлаждали до 0°C и добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты (2,1 г, 0,0035 ммоль) в 10 мл диметилформамида. Реакционную смесь перемешивали при комнатной температуре в течение 24 ч и затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой отделяли, промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенное соединение, которое очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 1 г (4,5-диметоксиизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-метоксиметил-4-(4,5,7-триметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 17: Синтез (4,5-диметоксиизоксазол-3-ил)амида 3-[2-метоксиметил-4-(4,5,7-триметил-2-оксо-2H-[1,6]нафтиридин-1-илметилфенил]-5-метилтиофен-2-сульфоновой кислоты
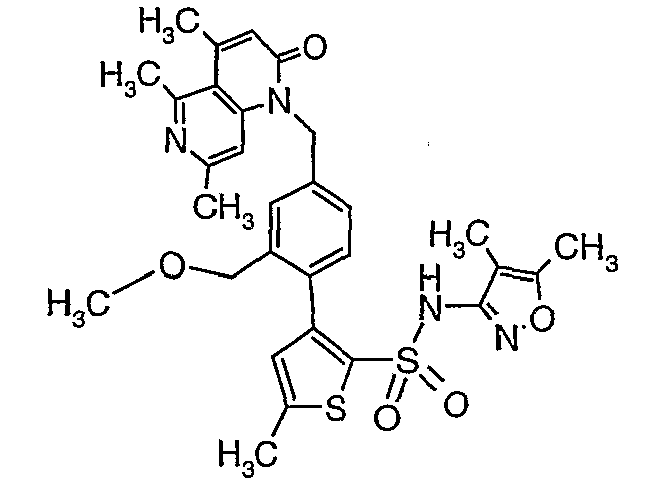
К (1,0 г, 1,46 ммоль) (4,5-диметоксиизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-метоксиметил-4-(4,5,7-триметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты при комнатной температуре добавляли 95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч, затем концентрировали в вакууме, и остаток, полученный таким образом, разбавляли водой. рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×3). Объединенные органические экстракты промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 100 мг (4,5-диметоксиизоксазол-3-ил)амида 3-[2-метоксиметил-4-(4,5,7-триметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C30H32N4O5S2
Молекулярная масса: 592,74.
1H ЯМР (ДМСО-d6): 1,46 (с, 3H), 2,11 (с, 3H), 2,40 (с, 3H), 2,46 (с, 3H), 2,69 (с, 3H), 2,89 (с, 3H), 3,11 (с, 3H), 4,01 (с, 2H), 5,49 (с, 2H), 6,61 (с, 1Н), 6,68 (с, 1Н), 6,95 (с, 2H), 7,16 (с, 1Н), 7,29 (с, 1Н), 10,66 (с, 1Н).
Масс-спектр: (m+1) 593,1.
Пример 17
(4,5-диметилизоксазол-3-ил)амид 3-[4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона
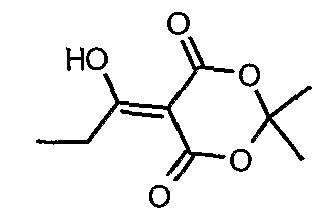
Пропионилхлорид (35 мл, 0,381 моль) добавляли при 0°C за 30 минут к раствору кислоты Мелдрама (50 г, 0,345 моль) в пиридине (60 мл, 0,690 моль) и метиленхлориде (200 мл), температуре реакционной смеси давали повыситься до температуры окружающей среды и перемешивали в течение 1 ч. Реакционную смесь затем подкисляли, используя 1 н. хлористоводородную кислоту, и экстрагировали метиленхлоридом (200 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 50 г 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона в виде твердого кристаллического вещества.
Стадия 02: Синтез 3-ацетил-6-этил-2-метил-1Н-пиридин-4-она
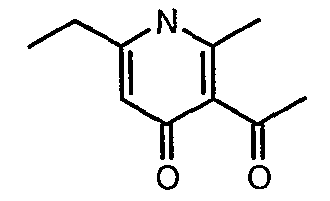
Смесь 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона (37,8 г, 0,189 моль) и 4-аминопент-3-ен-2-она (12,5 г, 0,126 моль) нагревали с обратным холодильником при 120°C в течение 2 ч. Реакционную смесь охлаждали и неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь 10% метанол:этилацетат в качестве элюента, получая 6 г 3-ацетил-6-этил-2-метил-1Н-пиридин-4-она в виде желтого твердого вещества.
Стадия 03: Синтез 1-(4-хлор-6-этил-2-метилпиридин-3-ил)этанона
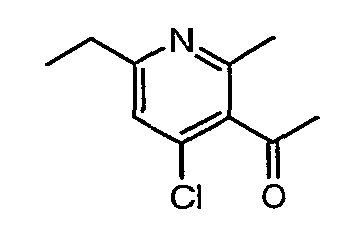
3-Ацетил-6-этил-2-метил-1Н-пиридин-4-он (5 г, 0,027 моль) при 0°C добавляли к 10 мл оксихлорида фосфора. Реакционную смесь нагревали при перемешивании до 50°C и выдерживали при этой температуре в течение 8 часов. Реакционную смесь затем упаривали в вакууме, и остаток, полученный таким образом, подщелачивали до рН 8 насыщенным раствором бикарбоната натрия, с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные органические экстракты промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали, получая 3,2 г 1-(4-хлор-6-этил-2-метилпиридин-3-ил)этанона в виде желтой масляной жидкости.
Стадия 04: Синтез 6-этил-3,4-диметил-1Н-пиразоло[4,3-c]пиридина
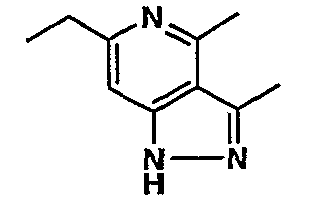
1-(4-хлор-6-этил-2-метилпиридин-3-ил)этанон (1,7 г, 0,0086 моль) растворяли в этаноле (20 мл) и добавляли гидразингидрат (2,15 мл, 0,038 моль). Реакционную смесь медленно нагревали с обратным холодильником и выдерживали при кипении в течение 4 часов. Реакционную смесь затем упаривали в вакууме и остаток, представляющий собой неочищенное соединение, разгружали на лед. Твердое вещество, полученное таким образом, отфильтровывали и сушили при отсасывании, получая 1 г 6-этил-3,4-диметил-1Н-пиразоло[4,3-c]пиридина.
Стадия 05: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
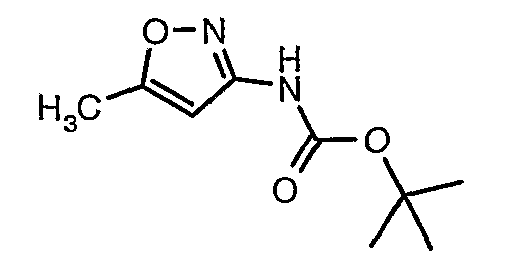
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая 130 г трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 06: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
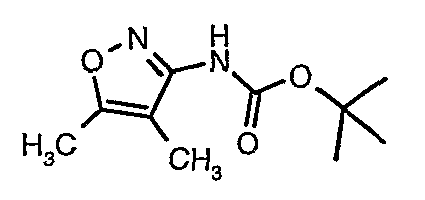
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 07: Синтез 4,5-диметилизоксазол-3-иламина
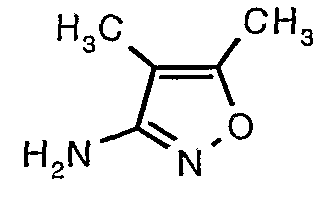
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями при 0°C к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 08: Синтез 5-метилтиофен-2-сульфонилхлорида
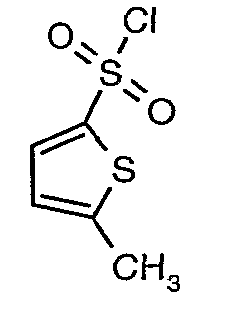
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Реакционную смесь выдерживали при 0°C в течение 3 ч и неочищенную реакционную массу затем медленно выгружали в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия, упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
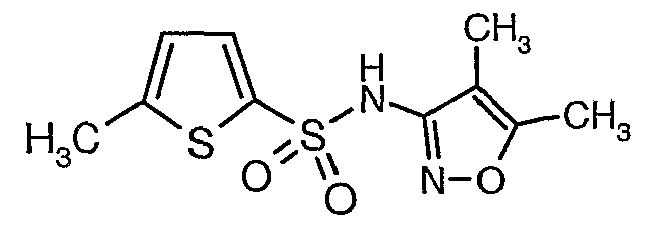
Раствор 5-метилтиофен-2-сульфонилхлорида (16,0 г, 0,081 моль) в 25 мл метиленхлорида добавляли при 0°C к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
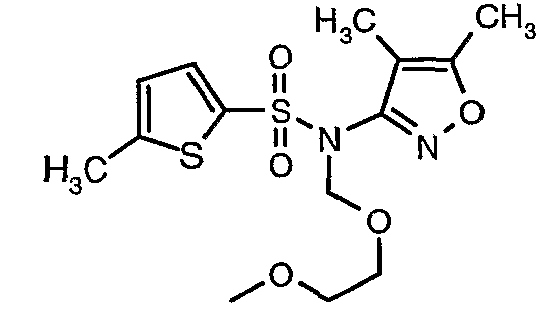
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C с последующим добавлением к реакционной смеси по каплям метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C и добавляли (90 мл) этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 11: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
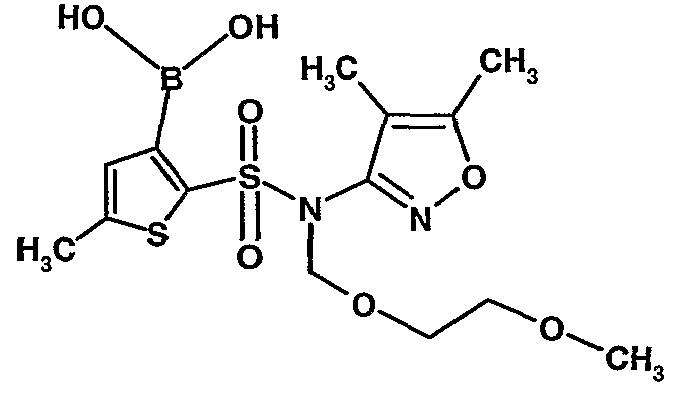
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно повышали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 12: Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты
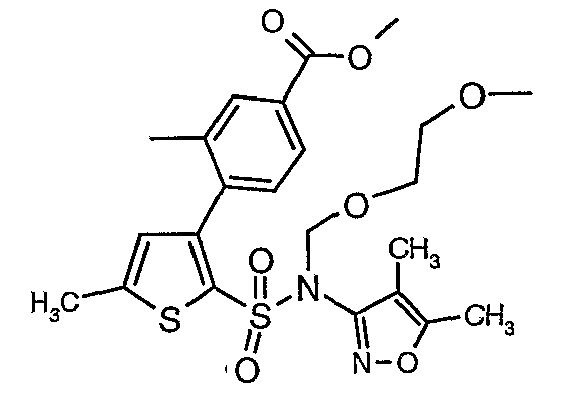
К перемешиваемому раствору метилового эфира 4-бром-3-метилбензойной кислоты (4,72 г, 0,0247 моль) в диметоксиэтане (50 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (1,45 г, 0,002 моль) с последующим добавлением 2M водного раствора карбоната натрия (6,5 г в 30 мл воды), реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. В полученную смесь добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5 г, 0,012 моль в 25 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч такую же процедуру повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5 г, 0,012 моль в 25 мл диметоксиэтана). Реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Смесь охлаждали и разбавляли этилацетатом (100 мл) и водой, органический слой отделяли и водный слой экстрагировали этилацетатом (50 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 9,7 г метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты
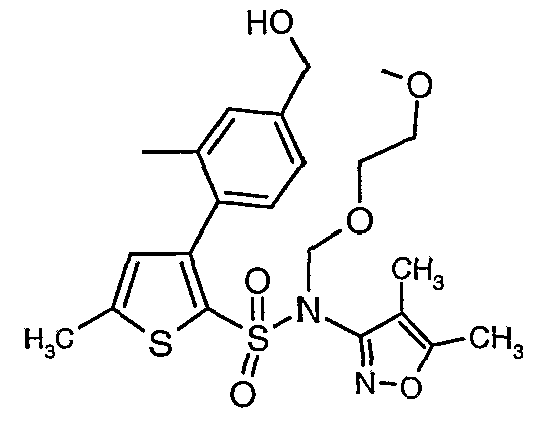
Алюмогидрид лития (1 г, 0,026 моль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана (15 мл) с последующим добавлением метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты (9,7 г, 0,019 моль) в 75 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, затем температуру повышали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь охлаждали до 0°C и добавляли по каплям раствор гидроксида натрия (50 мл) (1 г, растворенный в 100 мл воды), поддерживая температуру при 0°C, смесь экстрагировали этилацетатом (25 мл×2) и органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь 1:3 гексан/этилацетат в качестве элюента, получая 5,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 14: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты
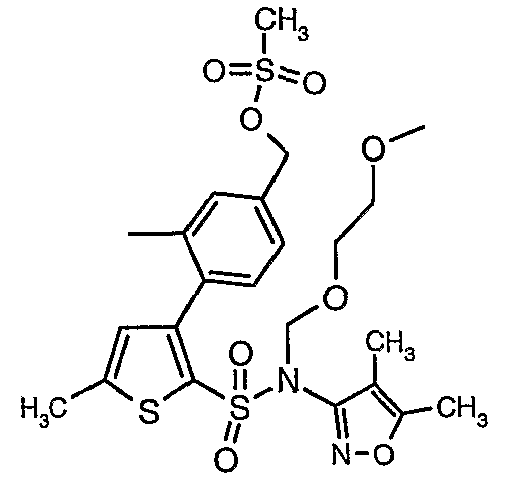
N-этилдиизопропиламин (3 мл, 0,017 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты (5,7 г, 0,012 моль) в 40 мл дихлорметана. Реакционную смесь охлаждали до 0°C и затем медленно добавляли метансульфонилхлорид (1,16 мл, 0,014 моль). После завершения добавления реакционную смесь выдерживали при комнатной температуре в течение 3 ч. Реакционную смесь затем помещали в смесь льда и холодной воды с последующей экстракцией метиленхлоридом (50 мл×2). Объединенный экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 6 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(6-этил-3,4-диметилпиразоло[4,3-с]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
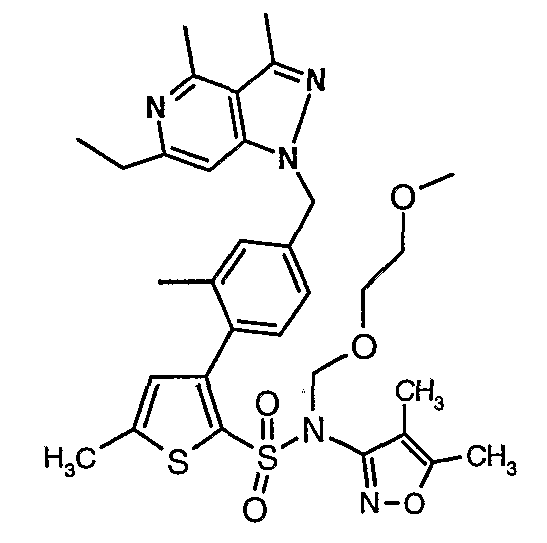
К перемешиваемому раствору 6-этил-3,4-диметил-1Н-пиразоло[4,3-c]пиридина (0,59 г, 3,5 ммоль) в N,N-диметилформамиде (5 мл) при -15°C в токе сухого азота добавляли порциями гидрид натрия (60% в минеральном масле) (0,26 г, 5,4 ммоль). После завершения добавления реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 30 мин. Реакционную смесь затем охлаждали до 0°C и добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты (2 г, 3,5 ммоль) в 5 мл N,N-диметилформамида. Смесь затем перемешивали при комнатной температуре в течение 24 ч и затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой отделяли и промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 2 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(6-этил-3,4-диметилпиразоло[4,3-с]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
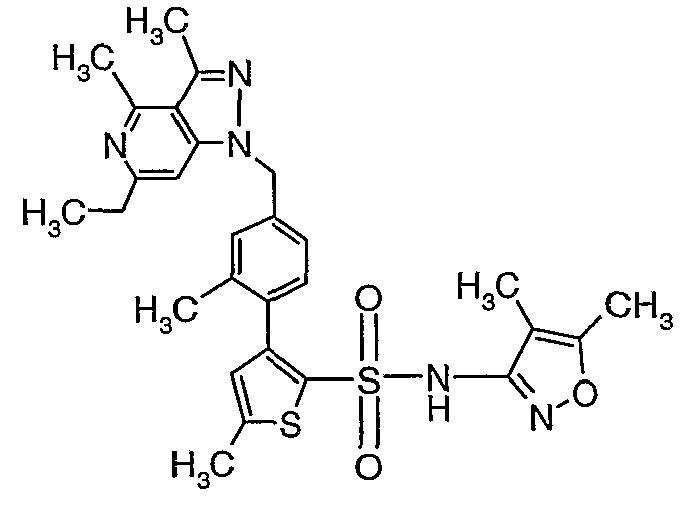
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (2 г, 3,13 ммоль) при комнатной температуре добавляли 95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь затем концентрировали в вакууме и остаток, полученный таким образом, разбавляли водой, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия. После этого рН раствора доводили до pH 5 уксусной кислотой и затем смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 300 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(6-этил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C28H31N5O3S2
Молекулярная масса: 549,72.
1H ЯМР (ДМСО-d6): 1,26 (т, J=7,2 Гц, 3H), 1,49 (с, 3H), 1,93 (с, 3H), 2,14 (с, 3H), 2,47 (с, 3H), 2,63 (с, 3H), 2,75-2,81 (м, 5H), 5,49 (с, 2H), 6,68 (с, 1Н), 6,89 (с, 2H), 7,10 (с, 1Н), 7,37 (с, 1Н), 10,80 (с, 1Н).
Масс-спектр: (m+1) 550,2.
Пример 18
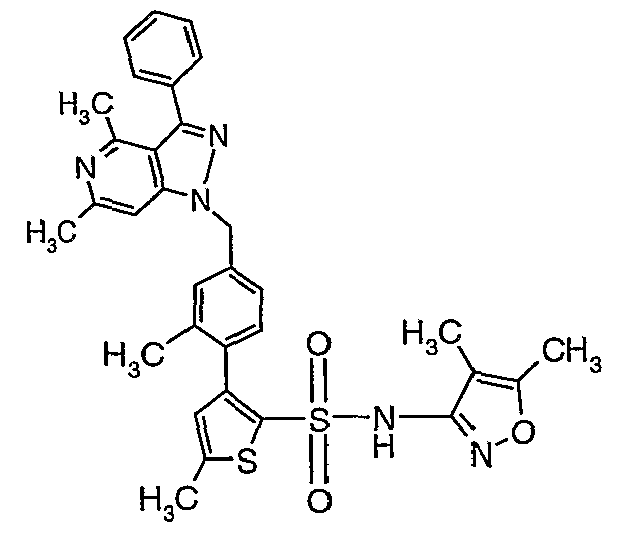
(4,5-диметилизоксазол-3-ил)амид 3-(4,6-диметил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 3-бензоил-2,6-диметил-1Н-пиридин-4-она
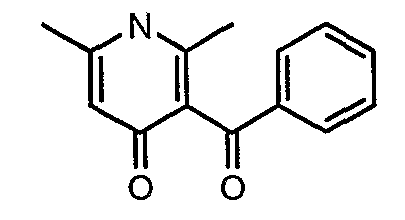
Смесь 2,2,6-триметил[1,3]диоксин-4-она (15 мл, 0,10 моль) и 3-амино-1-фенилбут-2-ен-1-она (5,8 г, 0,036 моль) нагревали с обратным холодильником при 120°C в течение 6 ч. Реакционную смесь очищали хроматографией на колонке с силикагелем, элюируя желаемый продукт 10%-ным метанолом и этилацетатом, получая 2 г 3-бензоил-2,6-диметил-1Н-пиридин-4-она.
Стадия 02: Синтез (4-хлор-2,6-диметилпиридин-3-ил)фенилметанона
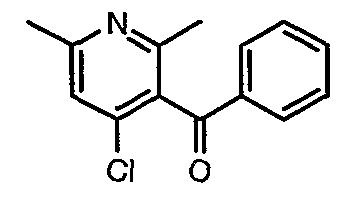
3-Бензоил-2,6-диметил-1Н-пиридин-4-он (2 г, 0,008 моль) при 0°C добавляли к 15 мл оксихлорида фосфора. Смесь нагревали при перемешивании до 100°C и выдерживали в этих условиях в течение 8 часов. Осуществляли обработку, упаривая оксихлорид фосфора в вакууме. Полученный остаток подщелачивали до рН 8 насыщенным раствором карбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали, получая 2 г (4-хлор-2,6-диметилпиридин-3-ил)фенилметанона.
Стадия 03: Синтез 4,6-диметил-3-фенил-1Н-пиразоло[4,3-с]пиридина
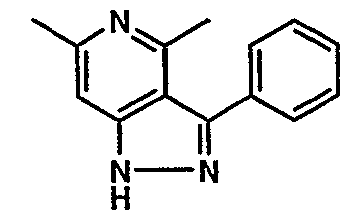
(4-хлор-2,6-диметилпиридин-3-ил)фенилметанон (2 г, 0,008 моль) помещали в этанол (15 мл), затем добавляли гидразингидрат (3 мл, 0,06 моль) и две капли уксусной кислоты. Температуру реакционной смеси медленно поднимали, нагревая с обратным холодильником, причем нагревание продолжали в течение 6 часов. Реакционную смесь полностью упаривали в вакууме. Неочищенную массу разгружали на лед, полученное твердое вещество отфильтровывали и сушили при отсасывании, получая 1,61 г 4,6-диметил-3-фенил-1Н-пиразоло[4,3-c]пиридина.
Стадия 04: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
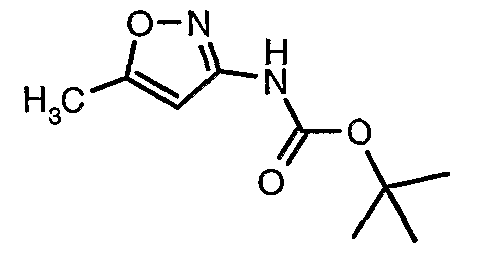
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая 130 г трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 05: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
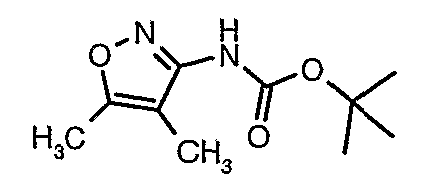
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 06: Синтез 4,5-диметилизоксазол-3-иламина
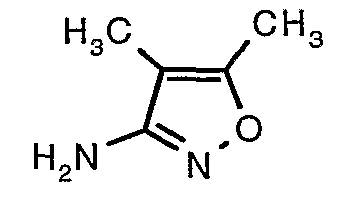
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями при 0°C к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 07: Синтез 5-метилтиофен-2-сульфонилхлорида
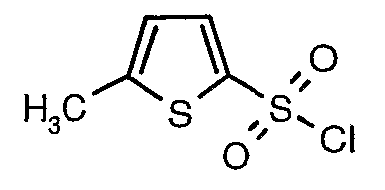
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Реакционную смесь выдерживали при 0°C в течение 3 ч. Неочищенную реакционную массу медленно выгружали в ледяную холодную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия и упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 08: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
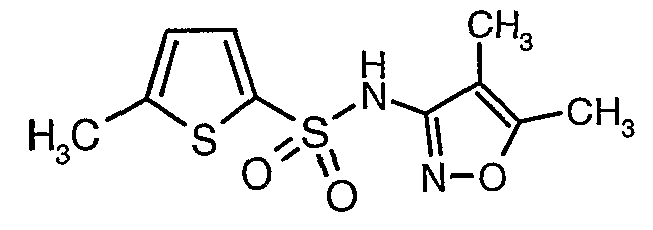
Раствор 5-метилтиофен-2-сульфонилхлорида (16,0 г, 0,081 моль) в 25 мл метиленхлорида добавляли при 0°C к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
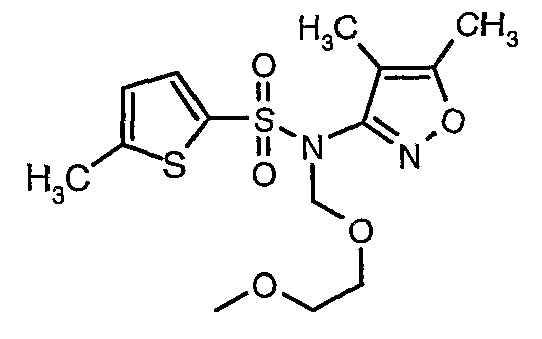
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C с последующим добавлением по каплям к реакционной смеси метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C и добавляли 90 мл этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси 25 мл воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 10: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
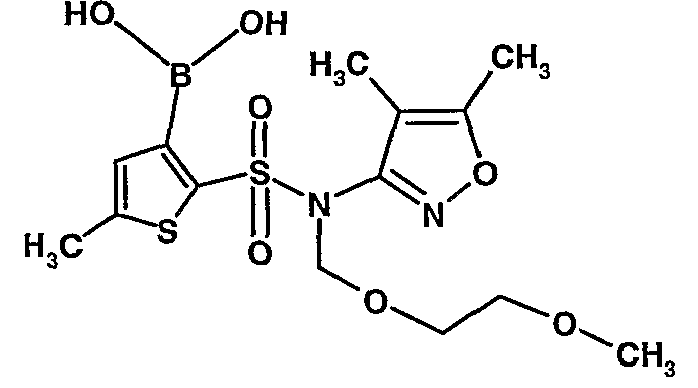
В сухой атмосфере азота раствор (14 г, 0:038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно поднимали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 11: Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты
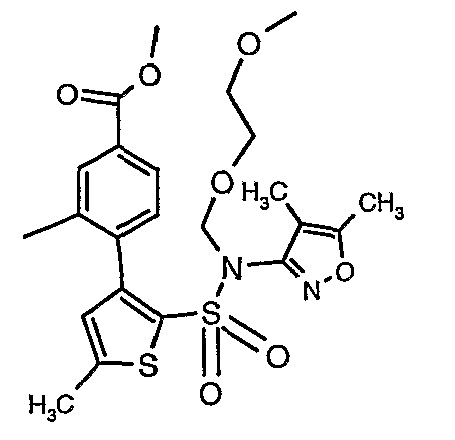
К перемешиваемому раствору метилового эфира 4-бром-3-метилбензойной кислоты (4,72 г, 0,0247 моль) в диметоксиэтане (50 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (1,45 г, 0,002 моль) с последующим добавлением 2M водного раствора карбоната натрия (6,5 г в 30 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. К полученной смеси добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5 г, 0,012 моль в 25 мл диметоксиэтана) и затем реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч такую же процедуру повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5 г, 0,012 моль в 25 мл диметоксиэтана). Реакционную смесь нагревали с обратным холодильником в течение 4 ч и затем перемешивали при комнатной температуре в течение 12 ч. Смесь охлаждали и разбавляли этилацетатом (100 мл) и водой, органические слои разделяли и водный слой экстрагировали этилацетатом (50 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 9,7 г метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты

Алюмогидрид лития (1 г, 0,026 моль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана (15 мл) с последующим добавлением метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты (9,7 г, 0,019 моль) в 75 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, затем температуру повышали до комнатной температуры и смесь перемешивали в течение 4 ч. Реакционную смесь охлаждали до 0°C и добавляли по каплям раствор гидроксида натрия (50 мл) (1 г, растворенный в 100 мл воды), поддерживая температуру при 0°C, с последующей экстракцией этилацетатом (25 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 1:3 гексан/этилацетат в качестве элюента, получая 5,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 13: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты
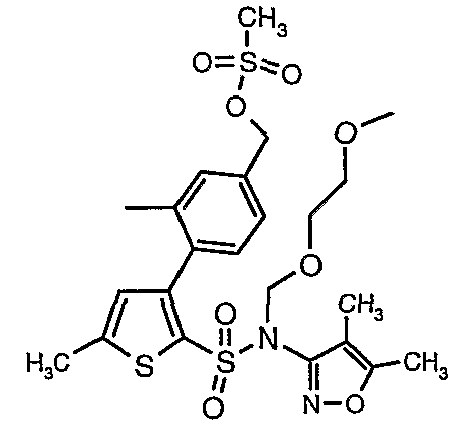
N-этилдиизопропиламин (3 мл, 0,017 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты (5,7 г, 0,012 моль) в 40 мл дихлорметана. Реакционную смесь охлаждали до 0°C и затем в реакционную смесь медленно добавляли метансульфонилхлорид (1,16 мл, 0,014 моль). После завершения добавления реакционную смесь выдерживали при комнатной температуре в течение 3 ч. Реакционную смесь выгружали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенный экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 6 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4,6-диметил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
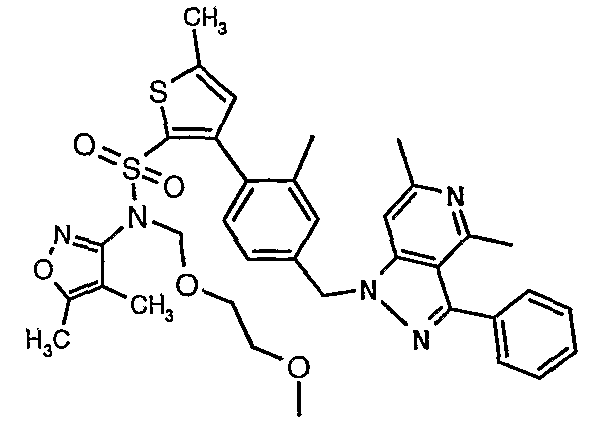
К перемешиваемому раствору 4,6-диметил-3-фенил-1Н-пиразоло[4,3-c]пиридина (749 мг, 3,5 ммоль) в диметилформамиде (15 мл) при -15°C в атмосфере азота добавляли гидрид натрия (60% в минеральном масле) (0,24 г, 5 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь снова охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты (2 г, 3,5 ммоль) в 10 мл N,N-диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой отделяли и промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 2,2 г неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4,6-диметил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)амида 3-(4,6-диметил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
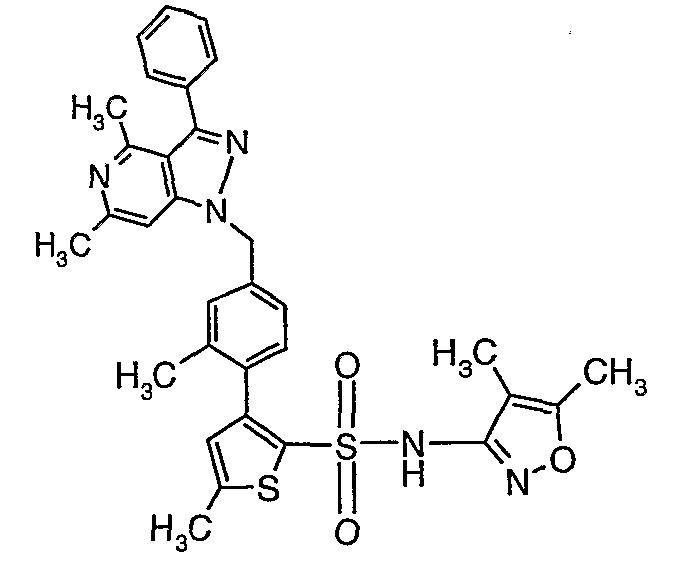
К (2,2 г, 2,95 ммоль) неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4,6-диметил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь перемешивали и нагревали в течение 3 ч, затем концентрировали в вакууме. Остаток, полученный таким образом, разбавляли водой и затем рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия. Смесь затем экстрагировали этилацетатом (25 мл×3) и объединенный органический экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 1:1 гексан/этилацетат в качестве элюента, получая 300 мг (4,5-диметилизоксазол-3-ил)амида 3-(4,6-диметил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C32H31N5O3S2
Молекулярная масса: 597,76.
1H ЯМР (ДМСО-d6): 1,46 (с, 3H), 1,93 (с, 3H), 2,11 (с, 3H), 2,47 (с, 3H), 2,48 (с, 3H), 2,55 (с, 3H), 5,63 (с, 2H), 6,69 (с, 1Н), 6,89-6,91 (м, 1Н), 6,98-7,00 (м, 1Н), 7,18 (с, 1Н), 7,50-7,68 (м, 6H), 10,75 (с, 1Н).
Масс-спектр: (m+1) 598,2.
Пример 19
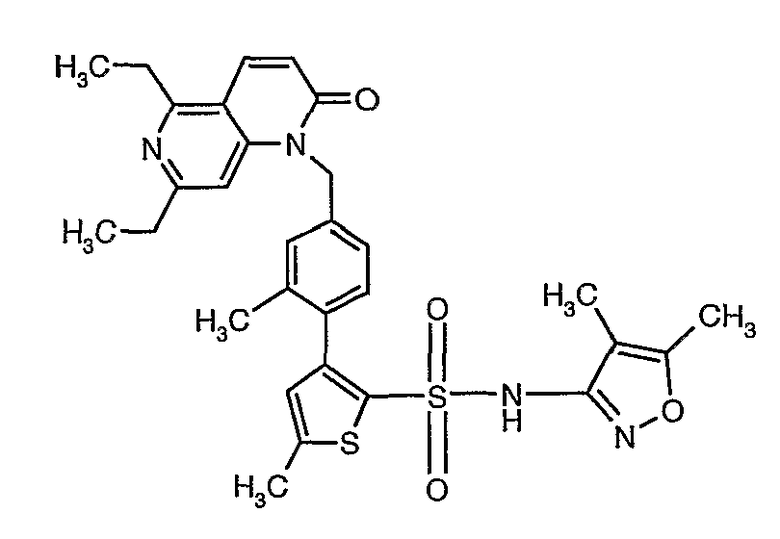
(4,5-Диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
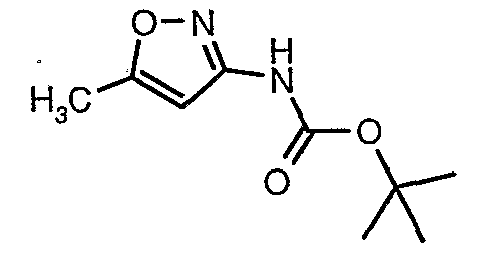
5-метилизоксазол-3-иламин (100 г, 1,019 моль) растворяли в пиридине (200 мл, 2,545 моль) и затем охлаждали полученную смесь до 0°C. К реакционной смеси добавляли за 1 час ди-трет-бутилбикарбонат (245 г, 1,12 моль). После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Затем реакционную смесь концентрировали при 60-70°C в вакууме. Остаток, полученный таким образом, растворяли в этилацетате (500 мл). Этилацетатный слой промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный продукт. Неочищенный продукт растворяли в горячем толуоле (200 мл), и после выдерживания в течение 2 часов при комнатной температуре кристаллизовалось твердое вещество, которое отфильтровывали, промывали холодным толуолом (50 мл) и сушили при отсасывании, получая 130 г трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты.
Стадия 02: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
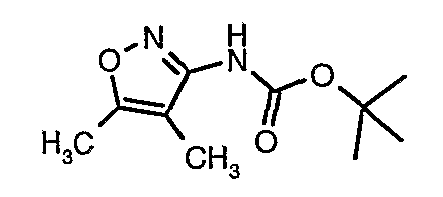
В сухой атмосфере азота трет-бутиловый эфир (5-метилизоксазол-3-ил)карбаминовой кислоты (20 г, 0,10 моль) растворяли в гексане (150 мл) и добавляли N,N,N',N'-тетраметилэтилендиамин (35 мл, 0,221 моль). Реакционную смесь затем охлаждали до -78°C. К реакционной смеси за 30 минут добавляли н-бутиллитий (106 мл, 0,250 моль, 15%-ный раствор в гексане), поддерживая температуру реакционной смеси при -78°C. Реакционную смесь перемешивали в течение 1 часа и добавляли метилйодид (12 мл, 0,15 моль). После завершения добавления реакционную смесь перемешивали при -10°C в течение 4 часов. Затем реакционную смесь гасили насыщенным раствором хлорида аммония (60 мл). Твердое вещество, полученное таким образом, отфильтровывали, промывали холодным гексаном (50 мл) и сушили при отсасывании, получая 22 г трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты.
Стадия 03: Синтез 4,5-диметилизоксазол-3-иламина
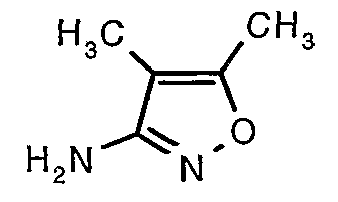
Трет-бутиловый эфир (4,5-диметилизоксазол-3-ил)карбаминовой кислоты (22 г, 0,1036 моль) добавляли порциями при 0°C к трифторуксусной кислоте (22 мл, 0,3108 моль). После завершения добавления реакционную смесь нагревали до 60°C и перемешивали в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и подщелачивали насыщенным раствором бикарбоната натрия. Продукт экстрагировали метиленхлоридом (100 мл×2). Органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме, получая 9 г 4,5-диметилизоксазол-3-иламина в виде желтого твердого вещества.
Стадия 04: Синтез 5-метилтиофен-2-сульфонилхлорида
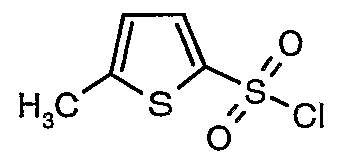
Раствор 2-метилтиофена (50 г, 0,51 моль) в хлороформе добавляли к раствору хлорсульфоновой кислоты (105 мл, 1,53 моль) в хлороформе при температуре от -5°C до 0°C. Затем реакционную смесь выдерживали при 0°C в течение 3 ч. Неочищенную реакционную массу медленно выгружали в ледяную воду с последующей экстракцией хлороформом (100 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над безводным сульфатом натрия и упаривали в вакууме, получая 16 г 5-метилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 05: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
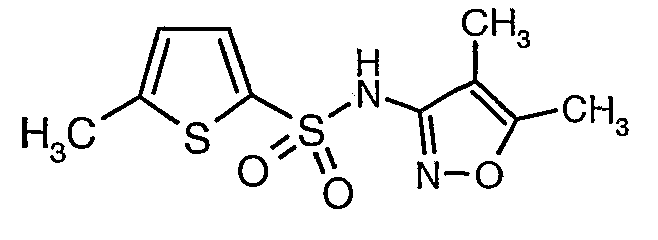
Раствор 5-метилтиофен-2-сульфонилхлорида (16,0 г, 0,081 моль) в 25 мл метиленхлорида при 0°C добавляли к раствору 3-амино-4,5-диметилизоксазола (6,2 г, 0,055 моль) и диметиламинопиридина (500 мг) в пиридине (40 мл). После завершения добавления температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Реакционную смесь затем концентрировали в вакууме, остаток, полученный таким образом, подкисляли, используя 1 н. хлористоводородную кислоту, с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали, получая 18 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
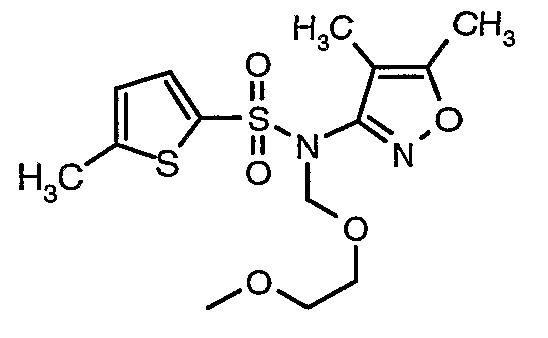
В токе сухого азота и при перемешивании гидрид натрия (3,4 г, 0,07 моль, 60% дисперсия в минеральном масле) добавляли при 0°C к N,N-диметилформамиду (40 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты (16,5 г, 0,060 моль). После завершения добавления температуру реакционной смеси медленно поднимали и смесь перемешивали при температуре окружающей среды в течение 30 минут, затем повторно охлаждали реакционную смесь до 0°C с последующим добавлением по каплям к реакционной смеси метоксиэтоксиметилхлорида (8,03 г, 0,064 моль). После завершения добавления температуру реакционной смеси медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Затем реакционную смесь охлаждали до 0°C, добавляли (90 мл) этилацетата и перемешивали реакционную смесь в течение 20 мин с последующим добавлением к реакционной смеси (25 мл) воды со льдом. Органический слой отделяли, водный слой снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Органический слой концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 18,2 г (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 07: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
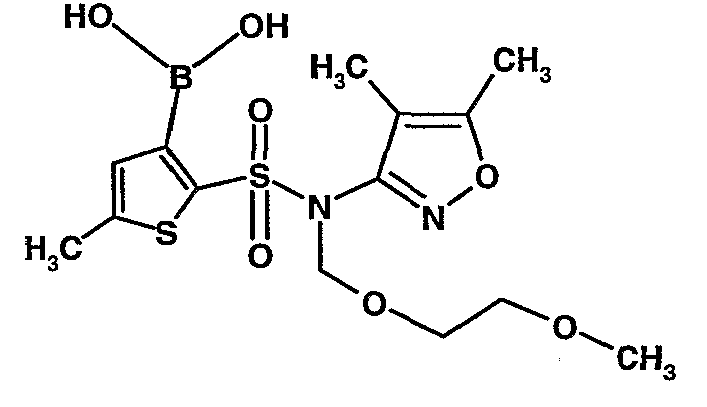
В сухой атмосфере азота раствор (14 г, 0,038 моль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в тетрагидрофуране (80 мл) охлаждали до -78°C. К полученному раствору медленно добавляли н-бутиллитий (60 мл, 0,097 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 часа, затем температуру реакционной смеси медленно поднимали до 0°C и затем реакционную смесь перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C и затем добавляли триизопропилборат (15 мл, 0,062 моль). После завершения добавления температуру медленно поднимали до 0°C и реакционную смесь перемешивали в течение 1 часа. Затем реакционную смесь охлаждали до -10°C и к реакционной смеси медленно добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 15 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 08: Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты
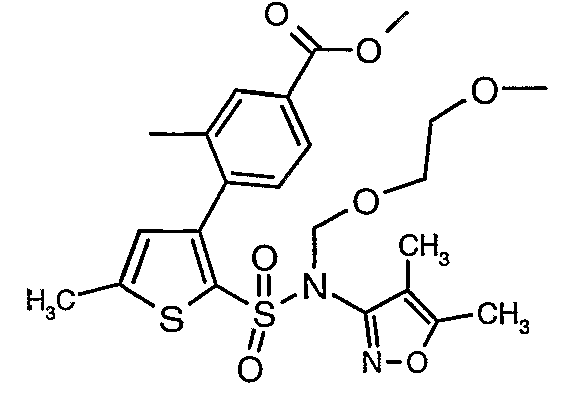
К перемешиваемому раствору сложного метилового эфира 4-бром-3-метилбензойной кислоты (4,72 г, 0,0247 моль) в диметоксиэтане (50 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (1,45 г, 0,002 моль) с последующим добавлением 2M водного раствора карбоната натрия (6,5 г в 30 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. К полученной смеси добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5 г, 0,012 моль в 25 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч такую же процедуру повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (5 г, 0,012 моль в 25 мл диметоксиэтана). Реакционную смесь нагревали с обратным холодильником в течение 4 ч, перемешивали при комнатной температуре в течение 12 ч, затем охлаждали и разбавляли этилацетатом (100 мл) и водой. Органические слои разделяли, водный слой экстрагировали этилацетатом (50 мл×2) и объединенные экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 4:1 гексан/этилацетат в качестве элюента, получая 9,7 г метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты
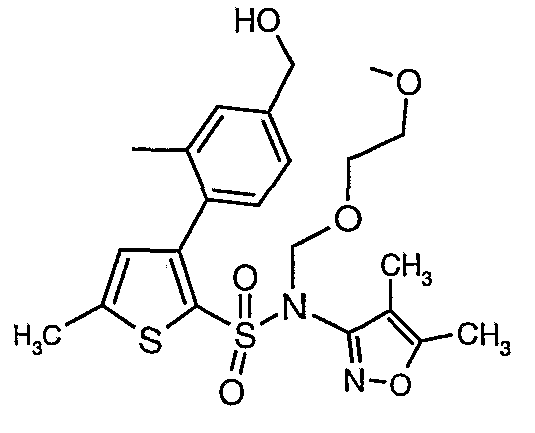
Алюмогидрид лития (1 г, 0,026 моль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана (15 мл) с последующим добавлением метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты (9,7 г, 0,019 моль) в 75 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 1 ч, затем температуру повышали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь охлаждали до 0°C и добавляли по каплям раствор гидроксида натрия (50 мл) (1 г, растворенный в 100 мл воды), поддерживая температуру 0°C. Осуществляли последующую экстракцию этилацетатом (25 мл×2) и органический слой промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь 1:3 гексан/этилацетат в качестве элюента, получая 5,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 10: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты
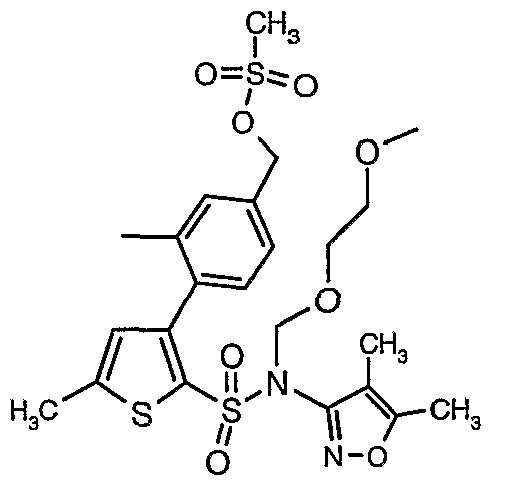
N-этилдиизопропиламин (3 мл, 0,017 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты (5,7 г, 0,012 моль) в 40 мл дихлорметана. Реакционную смесь охлаждали до 0°C и затем в реакционную смесь медленно добавляли метансульфонилхлорид (1,16 мл, 0,014 моль). После завершения добавления реакционную смесь выдерживали при комнатной температуре в течение 3 ч. Реакционную смесь затем выгружали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенный экстракт промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 6 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
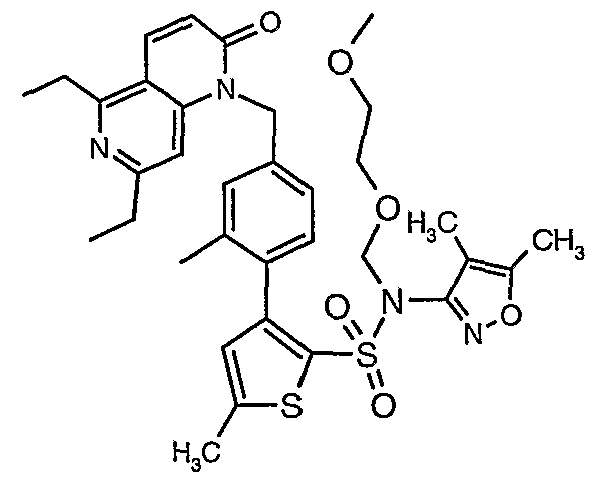
К перемешиваемому раствору 5,7-диэтил-1Н-[1,6]нафтиридин-2-она (0,74 г, 3,5 моль) в диметилформамиде (10 мл) при -15°C в токе сухого азота добавляли порциями гидрид натрия (60% в минеральном масле) (260 мг, 5,4 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь затем повторно охлаждали до 0°C и добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты (2 г, 3,5 ммоль) в (10 мл) N,N-диметилформамида и смесь затем перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой отделяли и промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и упаривали в вакууме. Неочищенное соединение очищали на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 1,6 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
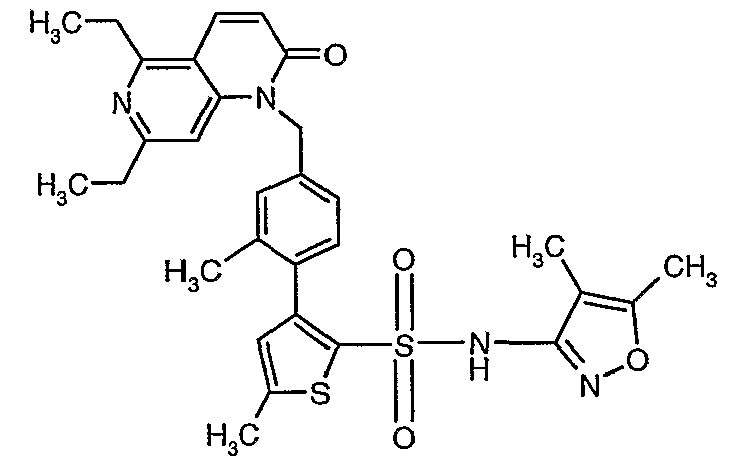
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (1,6 г, 2,40 ммоль) при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч, затем концентрировали в вакууме и остаток, полученный таким образом, разбавляли водой. рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия. Затем смесь экстрагировали этилацетатом (25 мл×2) и объединенные органические экстракты промывали водой и насыщенным раствором соли. Наконец, органический слой сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя смесь 1:1 гексан/этилацетат в качестве элюента, получая 200 мг (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C30H32N4O4S2
Молекулярная масса: 576,74.
1H ЯМР (ДМСО-d6): 1,20 (т, J=7,6 Гц, 3H), 1,25 (т, J=7,6 Гц, 3H), 1,46 (с, 3H), 1,92 (с, 3H), 2,10 (с, 3H), 2,47 (с, 3H), 2,70-2,76 (м, 2H), 3,04-3,10 (м, 2H), 5,46 (с, 2H), 6,70-6,74 (м, 2H), 6,85-6,87 (м, 1Н), 6,91-6,92 (м, 1Н), 7,14-7,16 (м, 2H), 8,22-8,25 (м, 1Н), 10,62 (с, 1Н).
Масс-спектр: (m+1) 577,2.
Пример 20
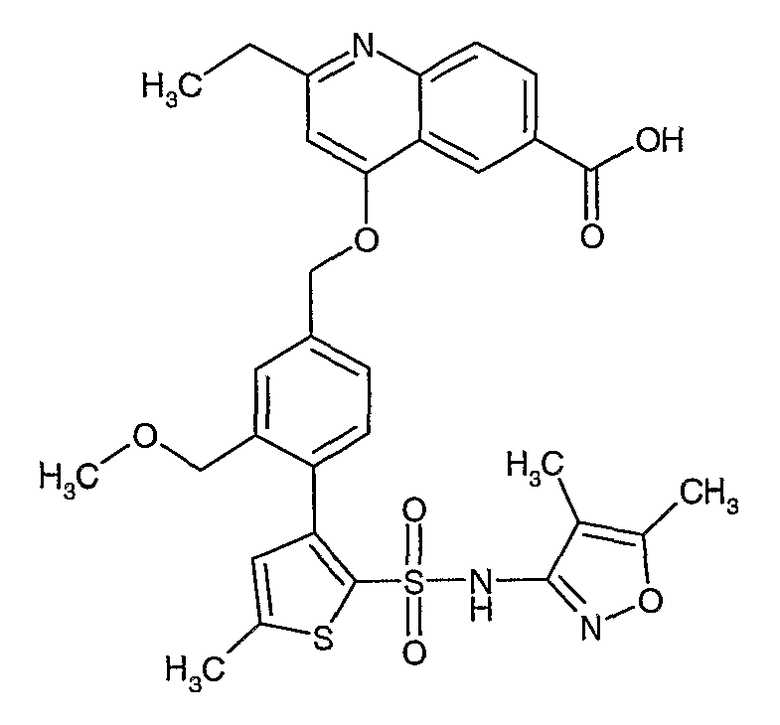
4-{4-[2-(4,5-Диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]-3-метоксиметилбензилокси}-2-этилхинолин-6-карбоновая кислота
Стадия 01: Синтез этилового эфира 4-[1-метоксикарбонилметилпропилиденамино]бензойной кислоты
Этиловый эфир п-аминобензойной кислоты (25 г, 0,15 моль) добавляли к перемешиваемому раствору метилпропионилацетата (24 г, 0,18 моль) в толуоле (200 мл) с последующим добавлением уксусной кислоты (0,1 мл). После этого реакционную смесь нагревали с обратным холодильником в течение 24 часов с непрерывным удалением воды с помощью аппарата Дина-Старка. Затем реакционную смесь охлаждали до комнатной температуры и упаривали в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 3,0 г этилового эфира 4-[1-метоксикарбонилметилпропилиденамино]бензойной кислоты в виде масла.
Стадия 02: Синтез этилового эфира 2-этил-4-оксо-1,4-дигидрохинолин-6-карбоновой кислоты
Этиловый эфир 4-[1-метоксикарбонилметилпропилиденамино]бензойной кислоты (3,0 г, 0,012 моль) добавляли к дифениловому эфиру (15 мл) и реакционную смесь перемешивали и нагревали при 250°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли (250 мл) гексан и охлаждали до 15°C. Кристаллизованный продукт отфильтровывали в вакууме, промывали (100 мл) гексана и сушили при отсасывании, получая 450 мг этилового эфира 2-этил-4-оксо-1,4-дигидрохинолин-6-карбоновой кислоты в виде твердого кристаллического вещества.
Стадия 03: Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты
Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты осуществляли согласно стадии 02 примера 01.
Стадия 04: Синтез этилового эфира 4-бром-3-метоксиметилбензойной кислоты
Синтез этилового эфира 4-бром-3-метоксиметилбензойной кислоты осуществляли согласно стадии 05 примера 16.
Стадия 05: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 04 примера 01.
Стадия 06: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 05 примера 01.
Стадия 07: Синтез 4,5-диметилизоксазол-3-иламина
Синтез 4,5-диметилизоксазол-3-иламина осуществляли согласно стадии 06 примера 01.
Стадия 08: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 10: Синтез 5-метилтиофен-2-сульфоновой кислоты (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 11: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 12: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензойной кислоты
К перемешиваемому раствору этилового эфира 4-бром-3-метоксиметилбензойной кислоты (2,25 г, 8,2 ммоль) в диметоксиэтане (25 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (522 мг, 0,7 ммоль) с последующим добавлением 2M водного раствора карбоната натрия (2,62 г в 13 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. Добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (1,5 г, 3,7 ммоль в 25 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч то же самое повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (1,5 г, 3,7 ммоль в 25 мл диметоксиэтана), реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли 100 мл этилацетата и водой, слои разделяли, водный слой экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, получая 2,8 г этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 12 примера 01.
Стадия 14: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты
Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты осуществляли согласно стадии 13 примера 01.
Стадия 15: Синтез этилового эфира 4-(4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил)-3-метоксиметилбензилокси)-2-этилхинолин-6-карбоновой кислоты
К перемешиваемому раствору этилового эфира 2-этил-4-оксо-1,4-дигидрохинолин-6-карбоновой кислоты (450 мг, 1,8 ммоль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (130 мг, 2,7 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты (1 г, 1,8 ммоль) в (10 мл) N,N-диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (30 мл), затем 10 мл холодной воды, органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 1 г неочищенного этилового эфира 4-(4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилокси)-2-этилхинолин-6-карбоновой кислоты в виде вязкой маслянистой массы.
Стадия 16: Синтез этилового эфира 4-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]-3-метоксиметилбензилокси)-2-этилхинолин-6-карбоновой кислоты
К 1,0 г этилового эфира 4-(4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилокси)-2-этилхинолин-6-карбоновой кислоты при комнатной температуре добавляли 95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 200 мг этилового эфира 4-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]-3-метоксиметилбензилокси}-2-этилхинолин-6-карбоновой кислоты.
Стадия 17: Синтез 4-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]-3-метоксиметилбензилокси)-2-этилхинолин-6-карбоновой кислоты
К этиловому эфиру 4-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]-3-метоксиметилбензилокси}-2-этилхинолин-6-карбоновой кислоты (200 мг, 0,3 ммоль) добавляли раствор гидроксида натрия (50 мг в 2 мл воды) с последующим добавлением (5 мл) метанола. Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Затем реакционную смесь упаривали в вакууме, к остатку добавляли воду и экстрагировали диэтиловым эфиром. Водный слой отделяли, охлаждали до 5°C и подкисляли до рН 2 разбавленной хлористоводородной кислотой и экстрагировали этилацетатом (50 мл×2). Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме, получая твердое вещество коричневого цвета, которое растирали с гексаном, фильтровали в вакууме, промывали гексаном и сушили при отсасывании, получая 45 мг 4-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]-3-метоксиметилбензилокси}-2-этилхинолин-6-карбоновой кислоты в виде коричневого твердого вещества.
Молекулярная формула: C31H31N3O7S2
Молекулярная масса: 621,73.
1H ЯМР (ДМСО-d6): 1,25 (т, J=7,6 Гц, 3H), 1,36 (с, 3H), 2,15 (с, 3H), 2,47 (с, 3H), 2,91-2,97 (кв., J=7,6 Гц, 2H), 3,18 (с, 3H), 4,12 (с, 2H), 5,44 (с, 2H), 6,94 (с, 1Н), 7,21 (с, 2H), 7,41 (с, 1Н), 7,53 (с, 1Н), 7,94-7,96 (д, J=8,8 Гц, 1Н), 8,15-8,18 (дд, J=8,8 Гц, 1Н), 8,76 (с, 1Н), 10,71 (ушир., 1Н), 13,05 (ушир., 1Н).
Масс-спектр: (m+1) 622,1.
Пример 21
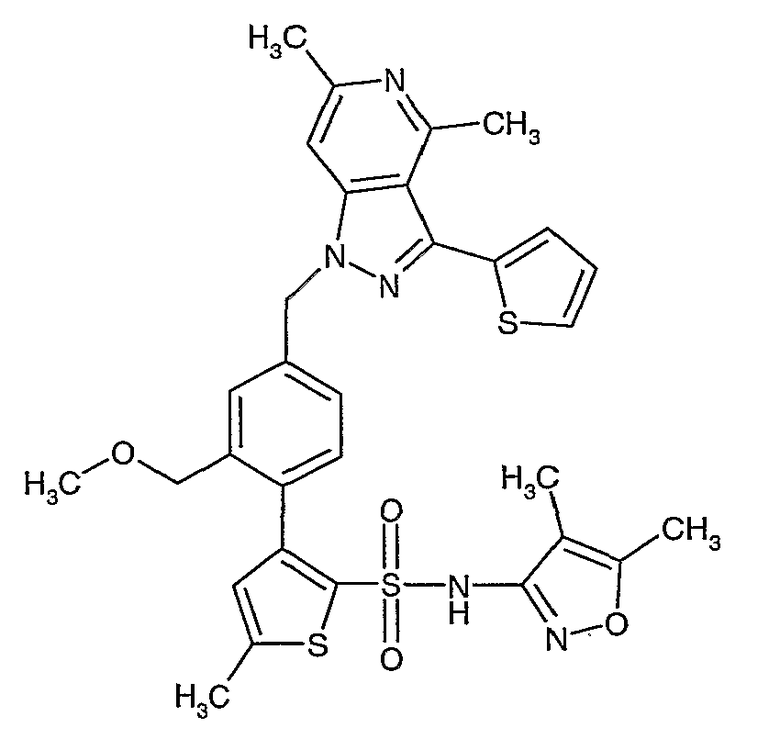
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез l-тиофен-2-илбутан-1,3-диона
В 40 мл N,N-диметилформамида при 0°C добавляли гидрид натрия (60% в минеральном масле) (4,18 г, 0,17 моль). Затем раствор, полученный растворением 2-ацетилтиофена (20 г, 0,16 моль) в сухом этилацетате (31 мл, 0,32 моль), добавляли к реакционной смеси. Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали, получая 27 г 1-тиофен-2-илбутан-1,3-диона.
Стадия 02: Синтез 3-амино-1-тиофен-2-илбут-2-ен-1-она
Смесь 1-тиофен-2-илбутан-1,3-диона (26,5 г, 0,16 моль) и ацетата аммония (48,6 г, 0,63 моль) в сухом метаноле (260 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали полностью в вакууме и к остатку добавляли охлажденную воду. Реакционную смесь подщелачивали до рН 8, используя насыщенный раствор бикарбоната натрия, с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали, получая 16,8 г 3-амино-1-тиофен-2-илбут-2-ен-1-она.
Стадия 03: Синтез 2,6-диметил-3-(тиофен-2-карбонил)-1Н-пиридин-4-она
Смесь 2,2,6-триметил[1,3]диоксин-4-она (28,6 г, 0,20 моль) и 3-амино-1-тиофен-2-илбут-2-ен-1-она (16,8 г, 0,10 моль) нагревали с обратным холодильником при 120°C в течение 6 ч. Реакционную смесь очищали хроматографией на колонке с силикагелем, элюируя желаемый продукт 10%-ным метанолом и этилацетатом, получая 4,6 г 2,6-диметил(тиофен-2-карбонил)-1H-пиридин-4-она.
Стадия 04: Синтез (4-хлор-2,6-диметилпиридин-3-ил)тиофен-2-илметанона
2,6-Диметил-3-(тиофен-2-карбонил)-1Н-пиридин-4-он (4,6 г, 0,01 моль) добавляли к 30 мл оксихлорида фосфора при 0°C. Перемешивали и нагревали реакционную смесь при 100°C и выдерживали в течение 8 часов. Осуществляли обработку, выпаривая оксихлорид фосфора в вакууме, и остаток подщелачивали до рН 8 насыщенным раствором карбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над безводным сульфатом натрия и концентрировали, получая 4,35 г (4-хлор-2,6-диметилпиридин-3-ил)тиофен-2-илметанона.
Стадия 05: Синтез 4,6-диметил-3-тиофен-2-ил-1Н-пиразоло[4,3-с]пиридина
(4-Хлор-2,6-диметилпиридин-3-ил)тиофен-2-илметанона (4,35 г, 0,02 моль) помещали в этанол (20 мл) и к реакционной смеси добавляли гидразингидрат (6 мл, 0,185 моль) и две капли уксусной кислоты. Медленно поднимали температуру и нагревали с обратным холодильником, поддерживая кипение в течение 6 часов. Реакционную смесь полностью упаривали в вакууме. Неочищенную массу разгружали на лед, полученное твердое вещество отфильтровывали и сушили при отсасывании, получая 4,48 г 4,6-диметил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина.
Стадия 06: Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты
Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты осуществляли согласно стадии 02 примера 01.
Стадия 07: Синтез этилового эфира 4-бром-3-метоксиметилбензойной кислоты
Синтез этилового эфира 4-бром-3-метоксиметилбензойной кислоты осуществляли согласно стадии 05 примера 16.
Стадия 08: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 04 примера 01.
Стадия 09: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 05 примера 01.
Стадия 10: Синтез 4,5-диметилизоксазол-3-иламина
Синтез 4,5-диметилизоксазол-3-иламина осуществляли согласно стадии 06 примера 01.
Стадия 11: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 14: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 15: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил)-3-метоксиметилбензойной кислоты
Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил)-3-метоксиметилбензойной кислоты осуществляли согласно стадии 13 примера 16.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 14 примера 16.
Стадия 17: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил)-3-метоксиметилбензилового эфира метансульфоновой кислоты
4-{2-[(4,5-Диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензиловый эфир метансульфоновой кислоты получали согласно стадии 15 примера 16.
Стадия 18: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 4,6-диметил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина (433 мг, 1,9 ммоль) в N,N-диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (140 мг, 3 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты (1 г, 1,8 ммоль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды, органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 2 г неочищенного соединения, которое очищали хроматографией на колонке на силикагеле, получая 1 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 19: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
К 1,0 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты при комнатной температуре добавляли 95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 100 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C31H31N5O4S3
Молекулярная масса: 633,80.
1H ЯМР (ДМСО-d6): 1,46 (с, 3H), 2,12 (с, 3H), 2,47 (с, 3H), 2,49 (с, 3H), 2,66 (с, 3H), 3,14 (с, 3H), 4,04 (м, 2H), 5,68 (с, 2H), 6,69-7,73 (м, 8H), 10,66 (ушир., 1Н).
Масс-спектр: (m+1) 634,3.
Пример 22
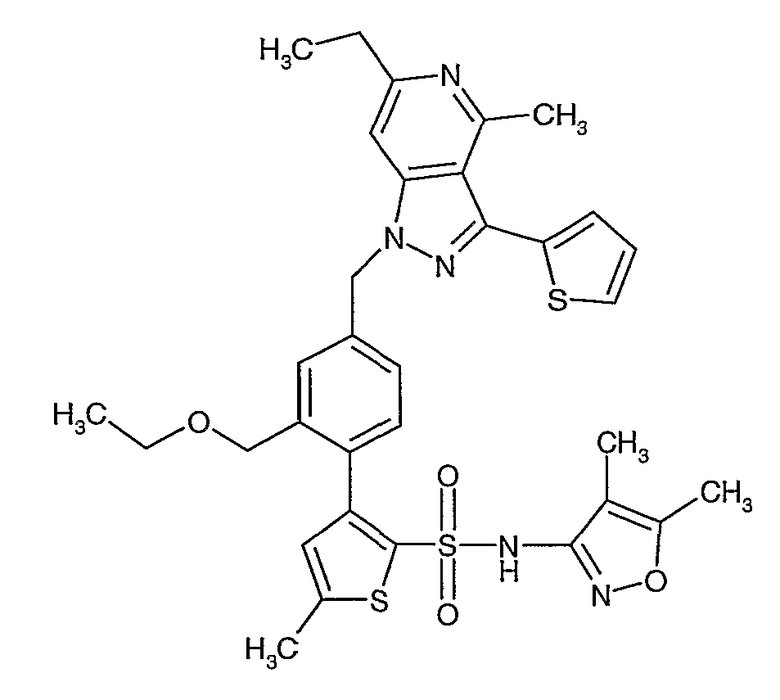
(4,5-Диметилизоксазол-3-ил)амид 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 1-тиофен-2-илбутан-1,3-диона
В 40 мл N,N-диметилформамида при 0°C добавляли гидрид натрия (60% в минеральном масле) (4,18 г, 0,17 моль). Затем к реакционной смеси добавляли раствор, полученный растворением 2-ацетилтиофена (20 г, 0,16 моль) в сухом этилацетате (31 мл, 0,32 моль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали, получая 27 г 1-тиофен-2-илбутан-1,3-диона.
Стадия 02: Синтез 3-амино-1-тиофен-2-илбут-2-ен-1-она
Смесь 1-тиофен-2-илбутан-1,3-диона (26,5 г, 0,16 моль) и ацетата аммония (48,6 г, 0,63 моль) в сухом метаноле (260 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали полностью в вакууме и к остатку добавляли охлажденную воду. Реакционную смесь подщелачивали до pH 8, используя насыщенный раствор бикарбоната натрия, с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали, получая 16,8 г 3-амино-1-тиофен-2-илбут-2-ен-1-она.
Стадия 03: Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты
Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты осуществляли согласно стадии 02 примера 01.
Стадия 04: Синтез этилового эфира 4-бром-3-этоксиметилбензойной кислоты
Синтез этилового эфира 4-бром-3-этоксиметилбензойной кислоты осуществляли согласно стадии 03 примера 01.
Стадия 05: Синтез 6-этил-2-метил-3-(тиофен-2-карбонил)-1Н-пиридин-4-она
Смесь 2,2-диметил-5-пропионил[1,3]диоксан-4,6-диона (15,8 г, 0,08 моль) и 3-амино-1-тиофен-2-илбут-2-ен-1-она (11 г, 0,066 моль) нагревали с обратным холодильником при 120°C в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и затем растирали с простым эфиром, продукт отфильтровывали в вакууме, промывали простым эфиром и сушили при отсасывании, получая 6 г 6-этил-2-метил-3-(тиофен-2-карбонил)-1Н-пиридин-4-она.
Стадия 06: Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)тиофен-2-илметанона
6-Этил-2-метил-3-(тиофен-2-карбонил)-1Н-пиридин-4-он (6 г, 0,024 моль) добавляли при 0°C к 30 мл оксихлорида фосфора. Перемешивали и нагревали реакционную смесь до 100°C и выдерживали в течение 8 часов. Осуществляли обработку, выпаривая оксихлорид фосфора в вакууме, и остаток подщелачивали до рН 8 насыщенным раствором карбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над безводным сульфатом натрия и концентрировали, получая 3 г (4-хлор-6-этил-2-метилпиридин-3-ил)тиофен-2-илметанона в виде коричневого масла.
Стадия 07: Синтез 6-этил-4-метил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина
(4-Хлор-6-этил-2-метилпиридин-3-ил)тиофен-2-илметанон (3 г, 0,011 моль) помещали в этанол (20 мл) и к реакционной смеси добавляли гидразингидрат (9 мл, 0,185 моль) и две капли уксусной кислоты. Медленно поднимали температуру и нагревали с обратным холодильником, поддерживая кипение в течение 6 ч. Реакционную смесь полностью упаривали в вакууме. Неочищенную массу помещали на лед, полученное твердое вещество отфильтровывали и сушили при отсасывании, получая 1,7 г 6-этил-4-метил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина.
Стадия 08: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 04 примера 01.
Стадия 09: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 05 примера 01.
Стадия 10: Синтез 4,5-диметилизоксазол-3-иламина
Синтез 4,5-диметилизоксазол-3-иламина осуществляли согласно стадии 06 примера 01.
Стадия 11: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 13: Синтез (4,5 диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 14: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 15: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты осуществляли согласно стадии 15 примера 15.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 16 примера 15.
Стадия 17: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты
Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты осуществляли согласно стадии 17 примера 15.
Стадия 18: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 6-этил-4-метил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина (448 мг, 1,8 ммоль) в N,N-диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (132 мг, 2,5 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (1 г, 1,8 ммоль) в (8 мл) диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 2 г неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 19: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
К 2 г неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь перемешивали и нагревали в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (30 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 200 мг (4,5-диметилизоксазол-3-ил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C33H35N5O4S3
Молекулярная масса: 661,87.
1H ЯМР (ДМСО-d6): 1,10 (т, J=6,8 Гц, 3H), 1,242-1,31 (м, 6H), 1,47 (с, 3H), 2,12 (с, 3H), 2,47 (с, 3H), 2,67 (с, 3H), 2,80-2,85 (кв., J=7,6 Гц, 2H), 3,23-3,28 (кв., J=6,8 Гц, 2H), 4,06 (с, 2H), 5,71 (с, 2H), 6,69 (с, 1Н), 6,94-6,96 (д, J=7,6 Гц, 1Н), 7,08-7,10 (д, J=7,6 Гц, 1H), 7,23-7,25 (м, 1Н), 7,35 (с, 1Н), 7,45 (с, 2H,), 7,71-7,73 (д, J=5,2 Гц, 1Н), 10,63 (ушир., 1Н).
Масс-спектр: (m+1) 662,3.
Пример 23
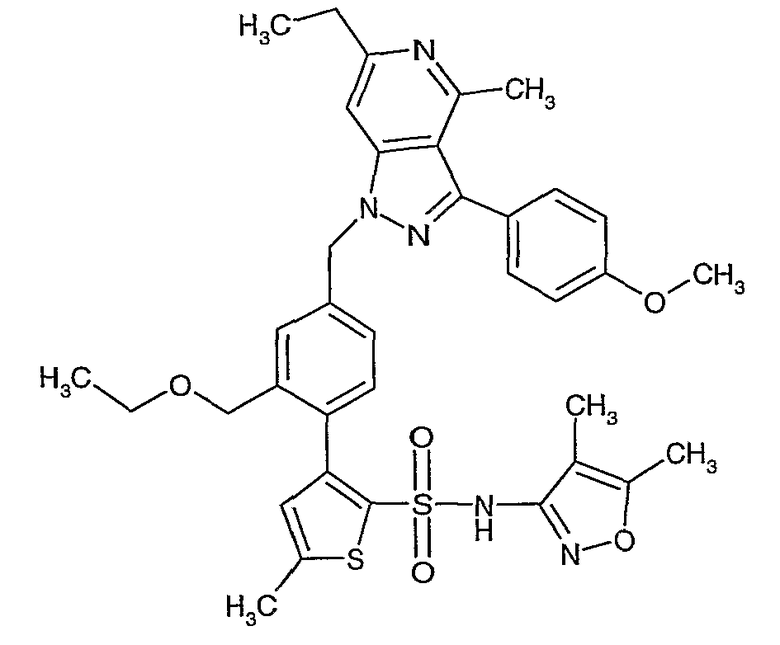
(4,5-Диметилизоксазол-3-ил)амид 3-{2-этоксиметил-4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 1-(4-метоксифенил)бутан-1,3-диона
В 30 мл при 0°C N,N-диметилформамида добавляли гидрид натрия (60% в минеральном масле) (8,8 г, 0,219. моль) с последующим добавлением раствора сухого этилацетата (15,5 г, 0,175 моль) и 1-(4-метоксифенил)этанона (22 г, 0,145 моль). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Реакционную смесь подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали, получая 22 г 1-(4-метоксифенил)бутан-1,3-диона.
Стадия 02: Синтез 3-амино-1-(4-метоксифенил)бут-2-ен-1-она
Смесь 1-(4-метоксифенил)бутан-1,3-диона (22 г, 0,114 моль) и ацетата аммония (26,3 г, 0,342 моль) в сухом метаноле (150 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали полностью в вакууме и к остатку добавляли охлажденную воду. Реакционную смесь подщелачивали до pH 8, используя насыщенный раствор бикарбоната натрия, с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали, получая 20 г 3-амино-1-(4-метоксифенил)бут-2-ен-1-она.
Стадия 03: Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты
Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты осуществляли согласно стадии 02 примера 01.
Стадия 04: Синтез этилового эфира 4-бром-3-этоксиметилбензойной кислоты
Синтез этилового эфира 4-бром-3-этоксиметилбензойной кислоты осуществляли согласно стадии 03 примера 01.
Стадия 05: Синтез 6-этил-3-(4-метоксибензоил)-2-метил-1H-пиридин-4-она
Смесь 2,2,6-триметил-5-пропионил[1,3]диоксин-4-она (15 г, 0,075. моль) и 3-амино-1-(4-метоксифенил)бут-2-ен-1-она (12 г, 0,062. моль) нагревали с обратным холодильником при 120°C в течение 6 ч. Реакционную смесь очищали, растирая неочищенную реакционную смесь с простым эфиром, отделенное таким образом твердое вещество отфильтровывали в вакууме, промывали простым эфиром и сушили при отсасывании, получая 2,4 г 6-этил-3-(4-метоксибензоил)-2-метил-1Н-пиридин-4-она.
Стадия 06: Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)-(4-метоксифенил)метанона
6-Этил-3-(4-метоксибензоил)-2-метил-1Н-пиридин-4-он (2,4 г) добавляли при 0°C к оксихлориду фосфора (15 мл). Перемешивали и нагревали реакционную смесь до 100°C и выдерживали в течение 8 часов. Осуществляли обработку, выпаривая оксихлорид фосфора в вакууме, и остаток подщелачивали до рН 8 насыщенным раствором карбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над безводным сульфатом натрия и концентрировали, получая 2,44 г (4-хлор-6-этил-2-метилпиридин-3-ил)-(4-метоксифенил)метанона.
Стадия 07: Синтез 6-этил-3-(4-метоксифенил)-4-метил-1Н-пиразоло[4,3-с]пиридина
(4-Хлор-6-этил-2-метилпиридин-3-ил)-(4-метоксифенил)метанон (2,44 г, 0,0084 моль) помещали в этанол (20 мл) и к реакционной смеси добавляли гидразингидрат (3 мл) и две капли уксусной кислоты. Медленно поднимали температуру и нагревали с обратным холодильником, поддерживая кипение в течение 6 часов. Реакционную смесь полностью упаривали в вакууме. Неочищенную массу помещали на лед, полученное твердое вещество отфильтровывали и сушили при отсасывании, получая 1,7 г 6-этил-3-(4-метоксифенил)-4-метил-1Н-пиразоло[4,3-c]пиридина.
Стадия 08: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 04 примера 01.
Стадия 08: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 05 примера 01.
Стадия 09: Синтез 4,5-диметилизоксазол-3-иламина
Синтез 4,5-диметилизоксазол-3-иламина осуществляли согласно стадии 06 примера 01.
Стадия 10: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 13: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 14: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты осуществляли согласно стадии 15 примера 15.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 16 примера 15.
Стадия 16: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты
Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты осуществляли согласно стадии 17 примера 15.
Стадия 17: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-{2-этоксиметил-4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 6-этил-3-(4-метоксифенил)-4-метил-1Н-пиразоло[4,3-c]пиридина (492 мг, 1,8 ммоль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (132 мг, 2,5 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (1 г, 1,8 ммоль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 2 г неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-{2-этоксиметил-4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 18: Синтез (4,5-диметилизоксазол-3-ил)амида 3-{2-этоксиметил-4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты
К 2 г неочищенного (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-{2-этоксиметил-4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты при комнатной температуре добавляли этанол (13 мл) и 6 н. водный раствор хлористоводородной кислоты (10 мл). Реакционную смесь перемешивали и нагревали в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (30 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 70 мг (4,5-диметилизоксазол-3-ил)амида 3-{2-этоксиметил-4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C36H39N5O5S2
Молекулярная масса: 685,87.
1H ЯМР (ДМСО-d6): 1,02 (т, J=7,2 Гц, 3H), 1,27 (т, J=7,2 Гц, 3H), 1,48 (с, 3H), 2,12 (с, 3H), 2,45 (с, 3H), 2,48 (с, 3H), 2,79-2,85 (кв., J=7,6 Гц, 2H), 3,23-3,29 (кв., J=6,8 Гц, 2H), 3,84 (с, 3H), 4,07 (с, 2H), 5,70 (с, 2H), 6,70-7,59 (м, 10Н), 10,75 (ушир., 1Н).
Масс-спектр: (m+1) 686,3.
Пример 24
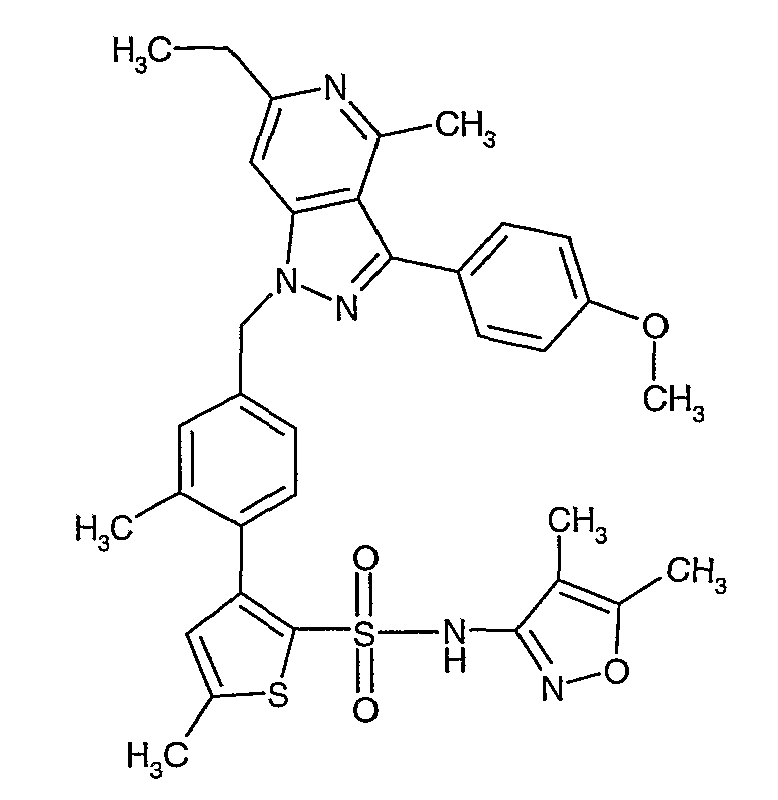
(4,5-Диметилизоксазол-3-ил)амид 3-{4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 1-(4-метоксифенил)бутан-1,3-диона
Синтез 1-(4-метоксифенил)бутан-1,3-диона осуществляли согласно стадии 01 примера 23.
СТАДИЯ 02: Синтез 3-амино-1-(4-метоксифенил)бут-2-ен-1-она
Синтез 3-амино-1-(4-метоксифенил)бут-2-ен-1-она осуществляли согласно стадии 02 примера 23.
Стадия 03: Синтез 6-этил-3-(4-метоксибензоил)-2-метил-1H-пиридин-4-она
Синтез 6-этил-3-(4-метоксибензоил)-2-метил-1Н-пиридин-4-она осуществляли согласно стадии 05 примера 23.
Стадия 04: Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)-(4-метоксифенил)метанона
Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)-(4-метоксифенил)метанона осуществляли согласно стадии 06 примера 23.
Стадия 05: Синтез 6-этил-3-(4-метоксифенил)-4-метил-1Н-пиразоло[4,3-c]пиридина
Синтез 6-этил-3-(4-метоксифенил)-4-метил-1Н-пиразоло[4,3-c]пиридина осуществляли согласно стадии 07 примера 23.
Стадия 06: Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (5-метилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 04 примера 01.
Стадия 07: Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты
Синтез трет-бутилового эфира (4,5-диметилизоксазол-3-ил)карбаминовой кислоты осуществляли согласно стадии 05 примера 01.
Стадия 08: Синтез 4,5-диметилизоксазол-3-иламина
Синтез 4,5-диметилизоксазол-3-иламина осуществляли согласно стадии 06 примера 01.
Стадия 09: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 11: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 12: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 13: Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты
Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты осуществляли согласно стадии 08 примера 19.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 19.
Стадия 15: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты
Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты осуществляли согласно стадии 10 примера 19.
Стадия 16: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-{4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 6-этил-3-(4-метоксифенил)-4-метил-1Н-пиразоло[4,3-c]пиридина (642 мг, 2,4 ммоль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (173 мг, 3,6 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты (1,2 г, 2,4 ммоль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 2 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-{4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 17: Синтез (4,5-диметилизоксазол-3-ил)амида 3-{4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-с]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-{4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты (2 г) при комнатной температуре добавляли 95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме и рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия. Реакционный раствор затем подкисляли до pH 5 уксусной кислотой и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 170 мг (4,5-диметилизоксазол-3-ил)амида 3-{4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C34H35N5O4S2
Молекулярная масса: 641,8.
1H ЯМР (ДМСО-d6): 1,29 (м, 3H), 1,46 (с, 3H), 1,94 (с, 3H), 2,11 (с, 3H), 2,47 (с, 3H), 2,79-2,85 (м, 2H), 3,85 (с, 4H), 5,62 (с, 2H), 6,68-7,59 (м, 11Н), 10,68 (ушир., 1Н).
Масс-спектр: (m+1) 642,3.
Пример 25
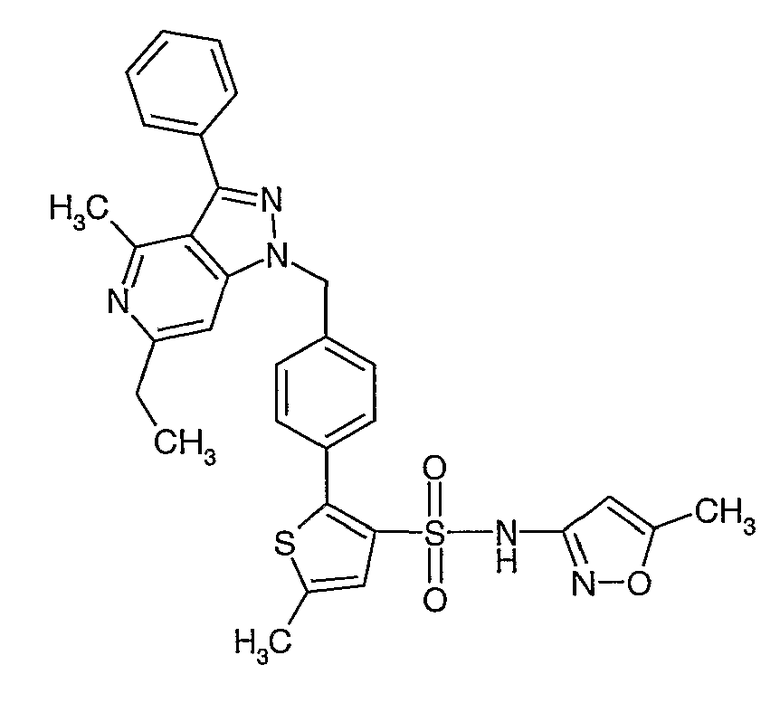
(5-Метилизоксазол-3-ил)амид 2-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-3-сульфоновой кислоты
Стадия 01: Синтез 1-фенилбутан-1,3-диона
Синтез 1-фенилбутан-1,3-диона осуществляли согласно стадии 01 примера 9.
Стадия 02: Синтез 3-амино-1-фенилбут-2-ен-1-она
Синтез 3-амино-1-фенилбут-2-ен-1-она осуществляли согласно стадии 02 примера 9.
Стадия 03: Синтез 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона
Синтез 5-(1-гидроксипропилидин)-2,2-диметил-1,3-диоксан-4,6-диона осуществляли согласно стадии 03 примера 9.
Стадия 04: Синтез 3-бензоил-6-этил-2-метил-1Н-пиридин-4-она
Синтез 3-бензоил-6-этил-2-метил-1Н-пиридин-4-она осуществляли согласно стадии 04 примера 9.
Стадия 05: Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)фенилметанона
Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)фенилметанона осуществляли согласно стадии 05 примера 9.
Стадия 06: Синтез 6-этил-4-метил-3-фенил-1Н-пиразоло[4,3-c]пиридина
Синтез 6-этил-4-метил-3-фенил-1Н-пиразоло[4,3-c]пиридина осуществляли согласно стадии 06 примера 9.
Стадия 07: Синтез 2-бром-5-метилтиофен-3-сульфонилхлорида
2-Бром-5-метилтиофен (5 г, 0,0282 моль) добавляли при 15°C к смеси хлорсульфоновой кислоты (4,7 мл, 0,0705 моль) и пентахлорида фосфора (г, моль). Выдерживали реакционную смесь при 15°C в течение 10 мин. Неочищенную реакционную массу медленно выгружали в ледяную воду с последующей экстракцией простым диизопропиловым эфиром (100 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли. Сушили органический слой над безводным сульфатом натрия и упаривали в вакууме, получая 6,3 г 2-бром-5-метилтиофен-3-сульфонилхлорида в виде коричневой жидкости.
Стадия 08: Синтез (5-метилизоксазол-3-ил)амида 2-бром-5-метилтиофен-3-сульфоновой кислоты
2-Бром-5-метилтиофен-3-сульфонилхлорид (6,3 г, 0,0229 моль) в метиленхлориде (50 мл) добавляли при 0°C к раствору 3-амино-5-метилизоксазола (3,37 г, 0,0344 моль) в пиридине (50 мл) и диметиламинопиридине (280 мг). Температуру медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Концентрировали реакционную смесь полностью в вакууме, подкисляли реакционную смесь с использованием 1 н. хлористоводородной кислоты с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали, получая 6 г (5-метилизоксазол-3-ил)амида 2-бром-5-метилтиофен-3-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 09: Синтез этоксиметил(5-метилизоксазол-3-ил)амида 2-бром-5-метилтиофен-3-сульфоновой кислоты
Гидрид натрия (0,64 г, 0,0267 моль) добавляли при 0°C к перемешиваемому раствору диметилформамида (15 мл) с последующим добавлением (5-метилизоксазол-3-ил)амида 2-бром-5-метилтиофен-3-сульфоновой кислоты (6,0 г, 0,0178 моль). Медленно поднимали температуру и выдерживали при температуре окружающей среды в течение 30 минут, затем охлаждали до 0°C с последующим добавлением при 0°C этоксиметилхлорида (2,02 г, 0,0214 моль). После завершения добавления температуру медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. Добавляли к реакционной смеси 90 мл этилацетата, затем 25 мл воды со льдом. Органический слой отделяли, водный снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, получая 4,45 г этоксиметил(5-метилизоксазол-3-ил)амида 2-бром-5-метилтиофен-3-сульфоновой кислоты в виде желтоватого масла.
Стадия 10: Синтез этоксиметил(5-метилизоксазол-3-ил)амида 2-(4-формилфенил)-5-метилтиофен-3-сульфоновой кислоты
К перемешиваемому раствору этоксиметил(5-метилизоксазол-3-ил)амида 2-бром-5-метилтиофен-3-сульфоновой кислоты (3 г, 0,00076 моль) и 4-формилфенилбороновой кислоты (1,026 г, 0,00684 моль) в толуоле (60 мл) и этаноле (50 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (2,417 г в 11,4 мл воды). Перемешивали реакционную смесь в атмосфере азота в течение 15 минут, затем добавляли в реакционную смесь тетракистрифенилфосфинпалладий(0) (0,791 г, 0,00068 моль). Реакционную смесь нагревали при 85°C в течение 6 ч. Реакционную смесь концентрировали в вакууме. К остатку добавляли этилацетат (25 мл), затем охлажденную воду и экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали полностью в вакууме. Неочищенное соединение очищали хроматографией на колонке на силикагеле, получая 2,3 г этоксиметил(5-метилизоксазол-3-ил)амида 2-(4-формилфенил)-5-метилтиофен-3-сульфоновой кислоты в виде маслянистой массы.
Стадия 11: Синтез этоксиметил(5-метилизоксазол-3-ил)амида 2-(4-гидроксиметилфенил)-5-метилтиофен-3-сульфоновой кислоты
К перемешиваемому раствору этоксиметил(5-метилизоксазол-3-ил)амида 2-(4-формилфенил)-5-метилтиофен-3-сульфоновой кислоты (2,3 г, 0,0055 моль) в 35 мл тетрагидрофурана при 0°C в токе азота добавляли боргидрид натрия (0,249 г, 0,0066 моль) с последующим добавлением 2 капель воды. Перемешивали реакционную смесь при температуре окружающей среды в течение 1 ч. Реакционную смесь упаривали в вакууме, к остатку добавляли 1 н. раствор хлористоводородной кислоты с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали полностью в вакууме. Неочищенный продукт очищали хроматографией на колонке с силикагелем, используя смесь этилацетат:гексан в качестве элюента, получая 740 мг этоксиметил(5-метилизоксазол-3-ил)амида 2-(4-гидроксиметилфенил)-5-метилтиофен-3-сульфоновой кислоты.
Стадия 12: Синтез 4-{3-[этоксиметил(5-метилизоксазол-3-ил)сульфамоил]-5-метилтиофен-2-ил)бензилового эфира метансульфоновой кислоты
N-этилдиизопропиламин (0,6 мл, 0,00344 моль) добавляли к раствору этоксиметил(5-метилизоксазол-3-ил)амида 2-(4-гидроксиметилфенил)-5-метилтиофен-3-сульфоновой кислоты (740 мг, 0,00175 моль) в 15 мл дихлорметана. Охлаждали реакционную смесь до 0°C, в реакционную смесь добавляли медленно метансульфонилхлорид (0,2 мл, 0,00251 моль). Реакционную смесь выдерживали при комнатной температуре в течение 3 ч. Реакционную смесь выгружали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Сушили органический слой над сульфатом натрия и концентрировали, получая 1,24 г 4-{3-[этоксиметил(5-метилизоксазол-3-ил)сульфамоил]-5-метилтиофен-2-ил)бензилового эфира метансульфоновой кислоты.
Стадия 13: Синтез этоксиметил(5-метилизоксазол-3-ил)амида 2-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-3-сульфоновой кислоты
К перемешиваемому раствору 6-этил-4-метил-3-фенил-1H-пиразоло[4,3-c]пиридина (452 мг, 0,00191 моль) в диметилформамиде (6 мл) при -0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (69 мг, 0,00287 моль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{3-[этоксиметил(5-метилизоксазол-3-ил)сульфамоил]-5-метилтиофен-2-ил}бензилового эфира метансульфоновой кислоты (1,24 г, 0,00248 моль) в 6 мл диметилформамида и перемешивали при комнатной температуре в течение 5 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 1,35 г этоксиметил(5-метилизоксазол-3-ил)амида 2-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-3-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 14: Синтез (5-метилизоксазол-3-ил)амида 2-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-3-сульфоновой кислоты
К этоксиметил(5-метилизоксазол-3-ил)амиду 2-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-3-сульфоновой кислоты (1,35 г) при комнатной температуре добавляли 95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (6 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме и рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия с последующей экстракцией этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан/этилацетат в качестве элюента, получая 182 мг (5-метилизоксазол-3-ил)амида 2-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-3-сульфоновой кислоты.
Молекулярная формула: C31H29N5O3S2
Молекулярная масса: 583,72.
1H ЯМР (ДМСО-d6): 1,28 (т, J=7,6 Гц, 3H), 2,29 (с, 3H), 2,48 (с, 3H), 2,61 (с, 3H), 2,74-2,84 (кв., J=7,2 Гц, 2H), 5,69 (с, 2H), 7,31-7,65 (м, 12Н), 11,55 (ушир., 1Н).
Масс-спектр: (m+1) 584,3.
Пример 26
3-{4-[2-(3,4-Диметилизоксазол-5-илсульфамоил)-5-метилтиофен-3-ил]бензил}-2-этокси-3H-бензимидазол-4-карбоновая кислота
Стадия 01: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 02: Синтез (3,4-диметилизоксазол-5-ил)амида 5-метилтиофен-2-сульфоновой кислоты
5-метилтиофен-2-сульфонилхлорид (10,5 г, 0,053 моль) в метиленхлориде (50 мл) добавляли при 0°C к раствору 3,4-диметилизоксазол-5-иламина (5 г, 0,044 моль) в пиридине (20 мл) и диметиламинопиридине (500 мг). Температуру медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Концентрировали реакционную смесь полностью в вакууме, реакционную смесь подкисляли с использованием 1 н. хлористоводородной кислоты с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали, получая 10 г смеси (3,4-диметилизоксазол-5-ил)амида 5-метилтиофен-2-сульфоновой кислоты и в виде коричневого твердого вещества.
Стадия 03: Синтез (3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Гидрид натрия (0,726 г, 0,0182 моль) добавляли при 0°C к перемешиваемому раствору диметилформамида (30 мл) с последующим добавлением (3,4-диметилизоксазол-5-ил)амида 5-метилтиофен-2-сульфоновой кислоты (3,3 г, 0,012 моль). Температуру медленно поднимали и выдерживали при температуре окружающей среды в течение 30 минут, затем охлаждали до 0°C с последующим добавлением при 0°C (2-хлорметоксиэтил)триметилсилана (2,6 г, 0,014 моль). После завершения добавления температуру реакции медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. К реакционной смеси добавляли 90 мл этилацетата, затем 25 мл воды со льдом. Органический слой отделяли, водный снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 4,6 г (3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 04: Синтез 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида
(3,4-Диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амид 5-метилтиофен-2-сульфоновой кислоты (4,6 г, 0,016 моль) растворяли в 35 мл тетрагидрофурана и реакционную смесь охлаждали до -78°C. В атмосфере азота в реакционную смесь при использовании шприца медленно добавляли н-бутиллитий (18 мл, 0,028 моль, 15%-ный раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 ч, медленно поднимали температуру до 0°C и перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C, затем добавляли триметилборат (2 мл, 0,017 моль). После завершения добавления медленно поднимали температуру до 0°C и перемешивали в течение 1 ч. Реакционную смесь охлаждали до -10°C и добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме, получая 6,1 г 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 05: Синтез ангидрида 3-нитрофталевой кислоты
Перемешивали (50 г, 0,236 моль) 3-нитрофталевой кислоты в (50 мл, 0,53 моль) уксусного ангидрида. Реакционную смесь нагревали при 100-120°C в течение 20 мин с получением чистого раствора, реакционную смесь охлаждали до комнатной температуры, получая твердое кристаллическое вещество, полученный таким образом кристаллический продукт суспендировали в гексане и фильтровали в вакууме, промывали гексаном, получая 50 г ангидрида 3-нитрофталевой кислоты.
Стадия 06: Синтез 3-нитрофталамовой кислоты
К охлажденному раствору водного аммиака (30-35%, 200 мл) добавляли порциями за 15 минут ангидрид 3-нитрофталевой кислоты (45 г, 0,23 моль) и перемешивали реакционную смесь в течение 30 мин. Реакционную смесь подкисляли до рН 2 с внешним охлаждением разбавленной хлористоводородной кислотой. Через 20 мин отделяли твердое вещество, которое отфильтровывали в вакууме и промывали гексаном. Продукт сушили в вакууме, получая 50 г 3-нитрофталамовой кислоты.
Стадия 07: Синтез 2-амино-3-нитробензойной кислоты
К перемешиваемому холодному раствору гидроксида калия (113 г, 2,01 моль) в воде (550 мл) при 5-10°C медленно добавляли бром (11,5 мл, 0,22 моль). Реакционную смесь перемешивали при этой температуре в течение 15 минут. 3-Нитрофталамовую кислоту (45 г, 0,21 моль) добавляли одной порцией. Реакционную смесь нагревали и перемешивали при 60-70°C в течение 4 часов. Реакционную смесь подкисляли с внешним охлаждением разбавленной хлористоводородной кислотой до рН 2. Твердый продукт отфильтровывали в вакууме, сушили горячим воздухом в сушильном шкафу при 60-70°C, получая 40 г 2-амино-3-нитробензойной кислоты.
Стадия 08: Синтез метилового эфира 2-амино-3-нитробензойной кислоты
К перемешиваемому холодному раствору 2-амино-3-нитробензойной кислоты (20 г, 0,11 моль) в метаноле (300 мл) добавляли при 0-5°C серную кислоту (48 мл). Реакционную смесь нагревали с обратным холодильником в течение 12 часов, охлаждали до комнатной температуры и метанол упаривали в вакууме. Реакционную смесь подщелачивали насыщенным раствором (pH~7-8) бикарбоната натрия. Экстрагировали этилацетатом (500 мл×2), сушили над сульфатом натрия и упаривали в вакууме, получая 11,0 г метилового эфира 2-амино-3-нитробензойной кислоты в виде твердого кристаллического вещества желтого цвета.
Стадия 09: Синтез метилового эфира 3-нитро-2-(2,2,2-трифторацетиламино)бензойной кислоты
К перемешиваемому холодному раствору метилового эфира 2-амино-3-нитробензойной кислоты (9,0 г, моль) в пиридине (90 мл) добавляли по каплям в течение 30 минут при 0-5°C ангидрид трифторуксусной кислоты (9,0 мл, 0,06 моль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили ледяной водой (100 мл) при перемешивании. Доводили рН до 7-8 насыщенным раствором бикарбоната натрия. Полученное твердое вещество отфильтровывали в вакууме и промывали гексаном. Полученное твердое вещество растворяли в этилацетате, сушили над сульфатом натрия и упаривали в вакууме, получая 7,5 г метилового эфира 3-нитро-2-(2,2,2-трифторацетиламино)бензойной кислоты в виде твердого вещества.
Стадия 10: Синтез метилового эфира 2-[(4-бромбензил)-(2,2,2-трифторацетил)амино]-3-нитробензойной кислоты
К перемешиваемому раствору метилового эфира 3-нитро-2-(2,2,2-трифторацетиламино)бензойной кислоты (7,0 г, 0,024 моль) в ацетоне (50 мл) добавляли безводный карбонат калия (6,6 г, 0,048 моль). 4-Бромбензилбромид (8,9 г, 0,035 моль) в ацетоне (20 мл) добавляли по каплям при комнатной температуре в течение 10 минут. Реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь упаривали в вакууме. Неочищенный продукт помещали в этилацетат (200 мл) и промывали водой (100 мл×2). Органический слой сушили над сульфатом натрия и упаривали в вакууме с получением масла. Масло охлаждали до 0-5°C для его отверждения. Твердое вещество перемешивали в гексане (70 мл), отфильтровывали и сушили при отсасывании в вакууме в течение 30 минут, получая 6,4 г метилового эфира 2-[(4-бромбензил)-(2,2,2-трифторацетил)амино]-3-нитробензойной кислоты.
Стадия 11: Синтез метилового эфира 2-(4-бромбензиламино)-3-нитробензойной кислоты
К перемешиваемому холодному раствору метилового эфира 2-[(4-бромбензил)-(2,2,2-трифторацетил)амино]-3-нитробензойной кислоты (6,4 г, 0,01 моль) в тетрагидрофуране (70 мл) добавляли раствор гидроксида натрия (5 г в 20 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 7 часов. Тетрагидрофуран выпаривали и реакционную смесь подкисляли с внешним охлаждением разбавленным водным раствором хлористоводородной кислоты до рН 2. Экстрагировали этилацетатом (200 мл×2), сушили над сульфатом натрия и упаривали в вакууме, получая 3,6 г метилового эфира 2-(4-бромбензиламино)-3-нитробензойной кислоты в виде коричневого твердого вещества.
Стадия 12: Синтез метилового эфира 3-амино-2-(4-бромбензиламино)бензойной кислоты
К перемешиваемому раствору метилового эфира 2-(4-бромбензиламино)-3-нитробензойной кислоты (2,6 г, 0,006 моль) в этилацетате (65 мл) добавляли дигидрат хлорида олова (II) (6,5 г, 0,028 моль) и реакционную смесь нагревали при 70°C в течение 1 часа. Реакционную смесь охлаждали, гасили насыщенным водным раствором карбоната натрия. Органический слой отделяли и водный слой экстрагировали этилацетатом (100 мл×2). Объединенный органический слой сушили над сульфатом натрия и упаривали, получая 2,0 г метилового эфира 3-амино-2-(4-бромбензиламино)бензойной кислоты в виде коричневого масла.
Стадия 13: Синтез метилового эфира 3-(4-бромбензил)-2-этокси-3H-бензимидазол-4-карбоновой кислоты
К перемешиваемому раствору метилового эфира 3-амино-2-(4-бромбензиламино)бензойной кислоты (0,9 г, 0,003 моль) в уксусной кислоте (0,3 мл, 0,005 моль) добавляли тетраэтилортокарбонат (0,7 г, 0,003 моль) и реакционную смесь нагревали при 70-80°C в течение 1 часа. Охлаждали до комнатной температуры и в реакционную смесь добавляли насыщенный раствор бикарбоната натрия. Реакционную смесь экстрагировали этилацетатом (50 мл×2). Органический слой сушили над сульфатом натрия и упаривали в вакууме с получением 1 г метилового эфира 3-(4-бромбензил)-2-этокси-3H-бензимидазол-4-карбоновой кислоты в виде твердого вещества зеленоватого цвета.
Стадия 14: Синтез метилового эфира 3-(4-{2-[(3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}бензил)-2-этокси-3H-бензимидазол-4-карбоновой кислоты
В токе сухого азота к 2,4 г (0,0062 моль) метилового эфира 3-(4-бромбензил)-2-этокси-3H-бензимидазол-4-карбоновой кислоты добавляли раствор карбоната натрия, полученного растворением (1,1 г) в 8 мл воды. Затем добавляли при перемешивании (320 мг, 0,00055 моль) бис(трифенилфосфин)палладий(II)хлорид с последующим добавлением 10 мл диметоксиэтана. К реакционной смеси добавляли по каплям за 30 минут раствор 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида (3,15 г, 0,0068 моль) в 15 мл диметоксиэтана. Реакционную смесь перемешивали и нагревали с обратным холодильником в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли 50 мл этилацетата с последующим упариванием в вакууме. Полученный остаток растворяли в 100 мл этилацетата и промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и упаривали в вакууме, получая 2 г неочищенного продукта в виде коричневого масла, которое очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат в качестве элюента, получая 2,5 г метилового эфира 3-(4-{2-[(3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}бензил)-2-этокси-3H-бензимидазол-4-карбоновой кислоты.
Стадия 15: Синтез метилового эфира 3-{4-[2-(3,4-диметилизоксазол-5-илсульфамоил)-5-метилтиофен-3-ил]бензил}-2-этокси-3H-бензимидазол-4-карбоновой кислоты
0,5 г (0,00069 ммоль) метилового эфира 3-(4-{2-[(3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}бензил)-2-этокси-3H-бензимидазол-4-карбоновой кислоты растворяли в 15 мл тетрагидрофурана с последующим добавлением раствора тетрабутиламмонийфторида (2 мл, 1 молярный раствор в тетрагидрофуране). Реакционную смесь нагревали при 90°C в течение 3 ч. Затем реакционную смесь охлаждали до комнатной температуры, добавляли разбавленную хлористоводородную кислоту и экстрагировали этилацетатом (50 мл×2), этилацетатный слой промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и упаривали в вакууме, получая 0,5 г коричневой маслянистой массы, представляющей собой метиловый эфир 3-{4-[2-(3,4-диметилизоксазол-5-илсульфамоил)-5-метилтиофен-3-ил]бензил}-2-этокси-3H-бензимидазол-4-карбоновой кислоты.
Стадия 16: Синтез 3-{4-[2-(3,4-диметилизоксазол-5-илсульфамоил)-5-метилтиофен-3-ил]бензил}-2-этокси-3H-бензимидазол-4-карбоновой кислоты
К метиловому эфиру 3-{4-[2-(3,4-диметилизоксазол-5-илсульфамоил)-5-метилтиофен-3-ил]бензил}-2-этокси-3H-бензимидазол-4-карбоновой кислоты (0,5 г, 0,0010 моль) добавляли раствор гидроксида лития (0,15 г в 2,5 мл воды) с последующим добавлением метанола (2,5 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 6 ч. Затем реакционную смесь упаривали в вакууме, к остатку, полученному таким образом, добавляли воду и полученную смесь экстрагировали диэтиловым эфиром. Водный слой отделяли, охлаждали до 5°C, подкисляли до рН 2 разбавленной хлористоводородной кислотой и экстрагировали этилацетатом (50 мл×2). Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме, получая твердое вещество коричневого цвета, которое растирали с гексаном, фильтровали в вакууме, промывали гексаном и сушили при отсасывании, получая 108 мг 3-{4-[2-(3,4-диметилизоксазол-5-илсульфамоил)-5-метилтиофен-3-ил]бензил}-2-этокси-3H-бензимидазол-4-карбоновой кислоты.
Молекулярная формула: C27H26N4O6S2
Молекулярная масса: 566,65.
1H ЯМР (ДМСО-d6): 1,42 (т, J=7,2 Гц, 3H), 1,46 (с, 3H), 1,94 (с, 3H), 2,47 (с, 3H), 4,58-4,64 (кв., J=7,2 Гц, 2H), 5,68 (с, 2H), 6,68 (с, 1Н), 6,94-6,96 (д, J=8 Гц, 2H), 7,19 (т, J=8 Гц, 1Н), 7,28 (ушир., 2H), 7,55-7,70 (м, 2H), 11,07 (ушир., 1Н), 13,18 (ушир., 1Н).
Масс-спектр: (m+1) 567,1.
Пример 27
(3,4-Диметилизоксазол-5-ил)амид 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 1-тиофен-2-илбутан-1,3-диона
Синтез 1-тиофен-2-илбутан-1,3-диона осуществляли согласно стадии 01 примера 22.
Стадия 02: Синтез 3-амино-1-тиофен-2-илбут-2-ен-1-она
Синтез 3-амино-1-тиофен-2-илбут-2-ен-1-она осуществляли согласно стадии 01 примера 22
Стадия 03: Синтез 6-этил-2-метил-3-(тиофен-2-карбонил)-1Н-пиридин-4-она
Синтез 6-этил-2-метил-3-(тиофен-2-карбонил)-1Н-пиридин-4-она осуществляли согласно стадии 05 примера 22.
Стадия 04: Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)тиофен-2-илметанона
Синтез (4-хлор-6-этил-2-метилпиридин-3-ил)тиофен-2-илметанона осуществляли согласно стадии 06 примера 22.
Стадия 05: Синтез 6-этил-4-метил-3-тиофен-2-ил-1Н-пиразоло[4,3-с]пиридина
Синтез 6-этил-4-метил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина осуществляли согласно стадии 07 примера 22.
Стадия 06: Синтез метилового эфира 4-бром-3-бромметилбензойной кислоты
28 г (0,11 моль) этилового эфира 4-бром-3-метилбензойной кислоты растворяли в 120 мл тетрахлорметана, к полученному добавляли 22,65 г (0,12 моль) N-бромсукцинимида с последующим добавлением 1,4 г (0,005 моль) бензоилпероксида (75% в воде). Реакционную смесь перемешивали и нагревали с обратным холодильником в течение 2-3 ч. Реакционную смесь охлаждали до 0°C с получением твердого кристаллического вещества, которое отфильтровывали в вакууме и промывали 30 мл тетрахлорметана. Полученный таким образом фильтрат упаривали в вакууме. Остаток разбавляли 300 мл гексана и охлаждали до 0°C с получением твердого кристаллического вещества, которое отфильтровывали в вакууме, промывали гексаном, получая 17,5 г этилового эфира 4-бром-3-бромметилбензойной кислоты.
Стадия 07: Синтез метилового эфира 4-бром-3-этоксиметилбензойной кислоты
К охлажденному раствору 30 мл этанола и 7 г (0,10 моль) этоксида натрия при 0°C добавляли раствор 17,5 г (0,054 моль) в 12 мл N,N-диметилформамида. Реакционную смесь перемешивали при комнатной температуре (28-30°C) в течение 2 ч и затем упаривали в вакууме. Полученный остаток подкисляли до рН 1 разбавленной хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали в вакууме, получая 12,5 г этилового эфира 4-бром-3-этоксиметилбензойной кислоты.
Стадия 08: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 09: Синтез (3,4-диметилизоксазол-5-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (3,4-диметилизоксазол-5-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 02 примера 74.
Стадия 10: Синтез (3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 03 примера 74.
Стадия 11: Синтез 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида осуществляли согласно стадии 04 примера 74.
Стадия 12: Синтез метилового эфира 4-{2-[(3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты
К перемешиваемому раствору метилового эфира 4-бром-3-этоксиметилбензойной кислоты (3 г, 0,01 l моль) в диметоксиэтане (50 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (695 мг, 0,00099 моль) с последующим добавлением 2M водного раствора карбоната натрия (3,15 г в 15 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. Добавляли за 45 минут по каплям раствор 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида (2 г, 0,005 моль в 25 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 час снова добавляли за 45 минут 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамид (2 г, 0,005 моль в 25 мл диметоксиэтана), реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли этилацетатом (100 мл) и водой, слои разделяли, водный слой экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке на силикагеле, получая 2,6 г метилового эфира 4-{2-[(3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 13: Синтез (3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
Литийалюминийгидрид (350 мг, 0,92 ммоль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана с последующим добавлением метилового эфира 4-{2-[(3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензойной кислоты (2,6 г, 4,7 ммоль) в тетрагидрофуране. Перемешивали реакционную смесь при 0°C в течение 1 ч, температуру реакционной смеси поднимали до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь охлаждали до 0°C и добавляли по каплям раствор 30 мл гидроксида натрия (1 г, растворенный в 100 мл воды), поддерживая температуру 0°C, с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали полностью в вакууме, получая 2,2 г (3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 14: Синтез 4-{2-[(3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты
N-этилдиизопропиламин (2,13 мл, 0,012 моль) добавляли к раствору (3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты (2,2 г, 4,1 моль) в 30 мл дихлорметана. Охлаждали реакционную смесь до 0°C, в реакционную смесь добавляли медленно метансульфонилхлорид (0,45 мл, 5 ммоль). Выдерживали реакционную смесь при комнатной температуре в течение 3 ч. Реакционную смесь выгружали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Сушили органический слой над сульфатом натрия и концентрировали, получая 2,2 г 4-{2-[(3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты.
Стадия 15: Синтез (3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 6-этил-4-метил-3-тиофен-2-ил-1Н-пиразоло[4,3-c]пиридина (0,447 г, 1,8 ммоль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (132 мг, 3,3 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-{2-[(3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-этоксиметилбензилового эфира метансульфоновой кислоты (1 г, 1,8 ммоль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 0,6 г неочищенного (3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 16: Синтез (3,4-диметилизоксазол-5-ил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты
К 600 мг неочищенного (3,4-диметилизоксазол-5-ил)-(2-метоксиэтоксиметил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты добавляли при комнатной температуре этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь перемешивали и нагревали при 120°C в течение 6 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до рН 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (30 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 80 мг (3,4-диметилизоксазол-5-ил)амида 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-c]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C27H26N4O6S2
Молекулярная масса: 661,87.
1H ЯМР (ДМСО-d6): 1,00-1,05 (м, 3H), 1,30-1,32 (м, 3H), 1,42 (с, 3H), 2,00 (с, 3H), 2,46 (с, 3H), 2,82-2,88 (кв., J=7,6 Гц, 2H), 3,25-3,28 (кв., J=7,6 Гц, 2H), 4,03 (с, 2H), 5,72 (с, 2H), 6,66-7,74 (м, 8H).
Масс-спектр: (m+1) 662,2.
Пример 28
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-пропилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона)
В токе сухого азота к перемешиваемому раствору пропионитрила (200 г, 3,6 моль) в толуоле (1000 мл) добавляли н-бутилацетат (538 г, 6,46 моль) с последующим добавлением к реакционной смеси метоксида натрия (197 г, 3,64 моль). После завершения добавления реакционную смесь нагревали и перемешивали при 90°C в течение 24 часов. Затем реакционную смесь охлаждали до комнатной температуры (25°C). Отделенное твердое вещество отфильтровывали, промывали гексаном и сушили в вакууме при 60°-65°C, получая 198 г натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона).
Стадия 02: Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила
К перемешиваемому раствору натриевой соли цианобутанона (70 г, 0,588 моль) в толуоле (780 мл) медленно добавляли при 0-5°C серную кислоту (52 г 0,5349 моль) и затем добавляли этиленгликоль (72,93 г, 1,172 моль). Реакционную смесь нагревали с обратным холодильником в течение 8,0 часов с помощью аппарата Дина-Старка. Реакционную смесь охлаждали до 0°C с последующим добавлением 2М раствора NaOH, слой толуола отделяли и промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и упаривали в вакууме, получая 59 г 2-(2-метил[1,3]диоксолан-2-ил)пропионитрила в виде желтоватой жидкости.
Стадия 03: Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима
К перемешиваемому раствору 4М гидроксида натрия (310 мл) в метаноле (267 мл) медленно добавляли при 10°C гидрохлорид гидроксиламина (75 г, 3,0 моль), после завершения добавления к реакционной смеси при комнатной температуре добавляли 2-(β-этилендиоксиацето)пропионамидоксим (65 г, 0,460 моль). Реакционную смесь затем нагревали с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры, затем метанол отгоняли в вакууме, остаток, полученный таким образом, экстрагировали этилацетатом (100 мл×3). Этилацетатный слой промывали насыщенным раствором соли, сушили над сульфатом натрия и упариванием слоя этилацетата при пониженном давлении получали 34 г 2-(β-этилендиоксиацето)пропионамидоксима в виде масла.
Стадия 04: Синтез 3-амино-4,5-диметилизоксазола
К перемешиваемому раствору 2-(β-этилендиоксиацето)пропионамидоксима (105 г, 0,60 моль) в н-пропаноле (1050 мл) добавляли медленно при 10-20°C серную кислоту (96 г, 0,979 моль). Реакционную смесь нагревали с обратным холодильником в течение 4 часов. н-Пропанол отгоняли в вакууме, к остатку добавляли этилацетат (600 мл) и нейтрализовали водным раствором бикарбоната натрия. Затем органический слой отделяли, промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и упаривали при пониженном давлении, получая 40 г неочищенного 3-амино-4,5-диметилизоксазола, который повторно кристаллизовали из смеси толуол/гексан, получая 32 г чистого 3-амино-4,5-диметилизоксазола.
Стадия 05: Синтез 5-пропилтиофен-2-сульфонилхлорида
2-пропилтиофен (5,0 г, 0,0396 моль) добавляли к суспензии хлорсульфоновой кислоты (6,6 мл, 0,099 моль) и пентахлорида фосфора (8,25 г, 0,0396 моль) при температуре от 10°C до 15°C. Выдерживали реакционную смесь при 15°C в течение 10 мин. Неочищенную реакционную массу медленно выгружали в ледяную воду с последующей экстракцией простым диизопропиловым эфиром (50 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия, упаривали в вакууме, получая 7,0 г 5-пропилтиофен-2-сульфонилхлорида в виде коричневой жидкости.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)амида 5-пропилтиофен-2-сульфоновой кислоты
5-Пропилтиофен-2-сульфонилхлорид (7,0 г, 0,0312 моль) в метиленхлориде (25 мл) добавляли при 0°C к раствору 3-амино-4,5-диметилизоксазола (3,18 г, 0,0284 моль) в пиридине (5,8 мл) и диметиламинопиридине (0,347 г). Температуру реакционной смеси медленно поднимали до комнатной температуры и перемешивали в течение 6 часов. Концентрировали реакционную смесь полностью в вакууме, реакционную смесь подкисляли с использованием 1 н. хлористоводородной кислоты с последующей экстракцией метиленхлоридом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали, получая 8,1 г (4,5-диметилизоксазол-3-ил)амида 5-пропилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-пропилтиофен-2-сульфоновой кислоты
Карбонат калия (6,14 г, 0,044 моль) добавляли при 0°C к перемешиваемому раствору диметилформамида (30 мл) с последующим добавлением (4,5-диметилизоксазол-3-ил)амида 5-пропилтиофен-2-сульфоновой кислоты (5,38 г, 0,0178 моль). Температуру медленно поднимали и выдерживали при температуре окружающей среды в течение 30 минут, затем охлаждали до 0°C с последующим добавлением при 0°C метоксиэтоксиметилхлорида (2,67 г, 0,0214 моль). После завершения добавления температуру медленно поднимали до температуры окружающей среды и перемешивали в течение 3 ч. К реакционной смеси добавляли 90 мл этилацетата, затем 25 мл воды со льдом. Органический слой отделяли, водный снова экстрагировали этилацетатом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, получая 4,2 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-пропилтиофен-2-сульфоновой кислоты в виде желтоватого масла.
Стадия 08: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-пропилтиофенсульфонамида
(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 5-пропилтиофен-2-сульфоновой кислоты (4,2 г, 0,011 моль) растворяли в тетрагидрофуране (20 мл), реакционную смесь охлаждали до -78°C в атмосфере азота. В реакционную смесь при использовании шприца медленно добавляли н-бутиллитий (17 мл, 0,0275 моль, 1,6М раствор в н-гексане). После завершения добавления реакционную смесь перемешивали при -78°C в течение 1 ч, медленно поднимали температуру до 0°C и перемешивали в течение 30 мин. Реакционную смесь снова охлаждали до -78°C, затем добавляли триизопропилборат (3 мл, 0,0132 моль). После завершения добавления медленно поднимали температуру до 0°C и перемешивали в течение 1 ч. Реакционную смесь охлаждали до -10°C и добавляли насыщенный раствор хлорида аммония с последующей экстракцией этилацетатом (50 мл×2). Объединенный экстракт промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме, получая 4,5 г 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-пропилтиофенсульфонамида в виде густой маслянистой массы.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтокси)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 1-(4-бром-3-метилбензил)-5,7-диэтил-1Н-[1,6]нафтиридин-2-она (1,0 г, 0,0026 моль) в диметоксиэтане (20 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (0,183 г, 0,00026 моль) с последующим добавлением 2M водного раствора карбоната натрия (0,827 г в 3,9 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. Добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-пропилтиофенсульфонамида (0,5616 г, 0,0013 моль в 10 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч то же самое повторяли с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-пропилтиофенсульфонамида (0,5616 г, 0,0013 моль в 10 мл диметоксиэтана), реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли этилацетатом (50 мл) и водой, слои разделяли, водный слой экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме, получая 1,2 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде светло-желтой маслянистой массы.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-пропилтиофен-2-сульфоновой кислоты
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[4-(5,7-диметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (1,2 г) при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (4 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя смесь гексан:этилацетат, получая 190 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-пропилтиофен-2-сульфоновой кислоты.
Стадия 11: Синтез 3-аминометилпентаноата
Смесь метилпропионилацетата (50 г, 0,3842 моль) и ацетата аммония (148 г, 1,921 моль) в сухом метаноле (500 мл) перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь концентрировали. Остаток подщелачивали до рН 8 и экстрагировали этилацетатом. Этилацетатный слой промывали водой, насыщенным раствором соли, сушили над сульфатом натрия и концентрировали, получая 50 г 3-аминометилпентаноата в виде светло-желтой жидкости.
Стадия 12: Синтез метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты
Смесь 3-аминометилпентаноата (50 г, 0,387 моль) и метилпропионилацетата (50 г, 0,384 моль) в 200 мл o-ксилола и 50 г 40 Е молекулярных сит нагревали с обратным холодильником в аппарате Дина-Старка в течение 5 дней. Молекулярные сита отфильтровывали, фильтрат концентрировали и очищали на колонке с силикагелем, элюируя смесью 50% дихлорметан:метанол, с получением 20 г метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты в виде белого твердого вещества.
Стадия 13: Синтез метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты
Тозилизоцианат (39 г, 0,197 моль) добавляли к перемешиваемой суспензии 2,6-диэтил-4-оксо-1,4-дигидропиридин-3-метилкарбоксилата (25 г, 0,119 моль) в ацетонитриле (250 мл). После падения начальной экзотермы смесь нагревали с обратным холодильником в течение 2 часов. Смесь охлаждали до комнатной температуры и суспендированное твердое вещество отделяли фильтрованием, получая 20 г метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты.
Стадия 14: Синтез метилового эфира 4-амино-2,6-диэтилникотиновой кислоты
Метил 2,6-диэтил-4-(4-тозиламино)пиридин-3-метилкарбоксилат (40 г, 0,110 моль) добавляли при 0°C к концентрированной серной кислоте (57 мл, 1,10 моль) и затем реакционную смесь перемешивали при 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и выливали на измельченный лед. Смесь доводили до рН 8 твердым карбонатом натрия и экстрагированную DCM объединенную органическую фазу промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали, получая 19 г метила 4-амино-2,6-диэтилпиридин-3-метилкарбоксилата в виде белого твердого вещества.
Стадия 15: Синтез (4-амино-2,6-диэтилпиридин-3-ил)метанола
Раствор 4-амино-2,6-диэтилпиридин-3-метилкарбоксилата (20 г, 0,0962 моль) в тетрагидрофуране (150 мл) добавляли по каплям за 30 минут к перемешиваемой суспензии алюмогидрида лития (7,3 г, 0,1923 моль) в тетрагидрофуране (150 мл), реакционную смесь затем перемешивали и нагревали с обратным холодильником в течение 5 ч. Реакционную смесь охлаждали на бане со льдом, добавляли осторожно 2M водный раствор гидроксида натрия (50 мл), затем воду (20 мл), полученную смесь перемешивали в течение 1 ч, затем добавляли тетрагидрофуран (150 мл). Нерастворимые вещества удаляли фильтрованием и промывали этилацетатом. Объединенные органические слои сушили над сульфатом натрия, концентрировали в вакууме, получая 12,1 г (4-амино-2,6-диэтилпиридин-3-ил)метанола.
Стадия 16: Синтез 4-амино-2,6-диэтилпиридин-3-карбальдегида
Смесь (4-амино-2,6-диэтилпиридин-3-ил)метанола (12,0 г, 0,0667 моль) и диоксида марганца (17,39 г, 0,2 моль) в толуоле (150 мл) перемешивали и нагревали с обратным холодильником в течение 10 часов. Горячую реакционную смесь фильтровали и твердое вещество промывали этилацетатом (150 мл). Объединенный фильтрат концентрировали упариванием в вакууме, получая 11,7 г 4-амино-2,6-диэтилпиридин-3-карбальдегида в виде желтого твердого вещества.
Стадия 17: Синтез 5,7-диэтил-1Н-[1,6]нафтиридин-2-она
Смесь 4-амино-2,6-диэтилпиридин-3-карбальдегида (11,7 г, 0,657 моль) и (карэтоксиметилен)трифенилфосфорана (27,44 г, 0,07884 моль) в толуоле (150 мл) перемешивали и нагревали с обратным холодильником в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли выпариванием. К остатку добавляли раствор метоксида натрия (12,42 г, 0,23 моль) в метаноле (150 мл) и полученный раствор нагревали с обратным холодильником в течение 4 часов. Метанол удаляли выпариванием и добавляли воду (100 мл). Смесь подкисляли до рН 2 добавлением концентрированной хлористоводородной кислоты. Смесь затем экстрагировали этилацетатом (100 мл×2). Органический экстракт отбрасывали. Водную фазу затем подщелачивали добавлением карбоната натрия. Затем экстрагировали дихлорметаном (200 мл×3). Органический слой промывали водой, насыщенным раствором соли, сушили над сульфатом натрия и концентрировали, получая 5,5 г 5,7-диэтил-1H-[1,6]нафтиридин-2-она в виде белого твердого вещества.
Стадия 18: Синтез 1-(4-бром-3-метилбензил)-5,7-диэтил-1H-[1,6]нафтиридин-2-она
К перемешиваемому раствору карбоната калия (6,16 г, 0,04455 моль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли 5,7-диэтил-1Н-[1,6]нафтиридин-2-он (3,0 г, 0,01485 моль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Затем реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-бром-3-метилбензилового эфира метансульфоновой кислоты (5,39 г, 0,01931 моль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 8 часов. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 4,0 г 1-(4-бром-3-метилбензил)-5,7-диэтил-1Н-[1,6]нафтиридин-2-она в виде коричневого твердого вещества.
Молекулярная формула: C32H36N4O4S2
Молекулярная масса: 604.
1H ЯМР (ДМСО-d6): 0,91 (т, J=7,2 Гц, 3H), 1,18-1,27 (м, 6H), 1,45 (с, 3H), 1,61-1,66 (кв., J=7,6 Гц, 2H), 1,92 (с, 3H), 2,11 (с, 3H), 2,70-2,80 (м, 4H), 3,04-3,10 (кв., J=7,2 Гц, 2H), 5,46 (с, 2H), 6,71-7,16 (м, 6H), 8,22-8,25 (д, J=9,36 гц, 1Н), 10,59 (с, 1Н).
Масс-спектр: (m-1) 603,2.
Пример 29

(4,5-Диметилизоксазол-3-ил)амид 3-[4-(5,7-диметил-2-оксо-3-фенил-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона)
Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона) осуществляли согласно стадии 01 примера 28.
Стадия 02: Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила
Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила осуществляли согласно стадии 02 примера 28.
Стадия 03: Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима
Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима осуществляли согласно стадии 03 примера 28.
Стадия 04: Синтез 3-амино-4,5-диметилизоксазола
Синтез 3-амино-4,5-диметилизоксазола осуществляли согласно стадии 04 примера 28.
Стадия 05: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 08: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 09: Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил]-3-метилбензойной кислоты
Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты осуществляли согласно стадии 08 примера 19.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 19.
Стадия 11: Синтез 4-12-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил)-3-метилбензилового эфира метансульфоновой кислоты
Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты осуществляли согласно стадии 10 примера 19.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диметил-2-оксо-3-фенил-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 5,7-диметил-3-фенил-1H-[1,6]нафтиридин-2-она (0,5 г, 0,002 моль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (150 мг, 0,0031 моль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты (1 г, 0,002 моль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 24 часов. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 1,3 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диметил-2-оксо-3-фенил-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диметил-2-оксо-3-фенил-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[4-(5,7-диметил-2-оксо-3-фенил-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (1,3 г) при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (6 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 200 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диметил-2-оксо-3-фенил-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде белого твердого вещества.
Стадия 14: Синтез этилового эфира 2,6-диметил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты
Смесь этилового эфира 3-аминометилбут-2-еновой кислоты (24,0 г, 0,184 моль) и метилового эфира 3-оксомасляной кислоты (22,0 г, 0,17 моль) в 200 мл o-ксилола и 50 г 3Е молекулярных сит нагревали с обратным холодильником в аппарате Дина-Старка в течение 2 дней. Молекулярное сито отфильтровывали и фильтрат концентрировали, получая полутвердое вещество, которое суспендировали в 25 мл этилацетата и фильтровали, получая 9,0 г этилового эфира 2,6-диметил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты в виде белого твердого вещества.
Стадия 15: Синтез этилового эфира 2,6-диметил-4-(толуол-4-сульфониламино)никотиновой кислоты
Тозилизоцианат (36,0 г, 0,18 моль) добавляли к перемешиваемой суспензии этилового эфира 2,6-диметил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты (20,0 г, 0,10 моль) в ацетонитриле (200 мл), после падения начальной экзотермы смесь нагревали с обратным холодильником в течение 2 часов. Смесь охлаждали до комнатной температуры и суспендированное твердое вещество отделяли фильтрованием, получая 37,0 г этилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты.
Стадия 16: Синтез этилового эфира 4-амино-2,6-диметилникотиновой кислоты
Этиловый эфир 2,6-диметил-4-(толуол-4-сульфониламино)никотиновой кислоты (37,0 г, 0,10 моль) добавляли при 0°C к концентрированной серной кислоте (57 мл, 1,15 моль) и затем реакционную смесь перемешивали при 50°C в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и выливали на измельченный лед. Смесь доводили до рН 8 твердым карбонатом натрия и экстрагировали дихлорметаном (100 мл×2), объединенную органическую фазу промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали, получая 20,6 г этилового эфира 4-амино-2,6-диметилникотиновой кислоты.
Стадия 17: Синтез (4-амино-2,6-диметилпиридин-3-ил)метанола
К перемешиваемому холодному раствору этилового эфира 4-амино-2,6-диметилникотиновой кислоты (18,0 г, 0,0928 моль) в тетрагидрофуране (130 мл) добавляли порциями при 0°C алюмогидрид лития (7,044 г, 0,1856 моль). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин, затем нагревали с обратным холодильником в течение 6 часов. Реакционную смесь охлаждали до 0°C и добавляли порциями водный раствор гидроксида натрия (10 г в 100 мл воды). Органический слой декантировали и водный слой экстрагировали тетрагидрофураном (500 мл×2). Объединенный органический слой упаривали, получая 12,0 г (4-амино-2,6-диметилпиридин-3-ил)метанола в виде твердого кристаллического вещества.
Стадия 18: Синтез 4-амино-2,6-диметилпиридин-3-карбальдегида
К раствору (4-амино-2,6-диметилпиридин-3-ил)метанола (5,0 г, 0,0329 моль) в толуоле (80 мл) добавляли диоксид марганца (8,58 г, 0,0987 моль). Реакционную смесь нагревали с обратным холодильником в течение 6 часов. Реакционную смесь охлаждали до комнатной температуры, фильтровали через слой hyflow и остаток промывали толуолом. Органический фильтрат упаривали, получая 5,29 г 4-амино-2,6-диметилпиридин-3-карбальдегида в виде белого твердого вещества.
Стадия 19: Синтез 5,7-диметил-3-фенил[1,6]нафтиридин-2-иламина
Смесь 4-амино-2,6-диметилпиридин-3-карбальдегида (3 г, 0,02 моль), метоксида натрия (2,14 г, 0,04 моль) и фенилацетонитрила (2,34 г, 0,02 моль) нагревали при 60°C в течение 2 ч. Летучие вещества удаляли упариванием и остаток распределяли между этилацетатом и водой. Органическую фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме, получая 4,3 г 5,7-диметил-3-фенил[1,6]нафтиридин-2-иламина.
Стадия 20: Синтез 5,7-диметил-3-фенил-1Н-[1,6]нафтиридин-2-она
Раствор нитрита натрия (6,0 г) в воде (20 мл) добавляли по каплям за 45 минут к раствору 5,7-диметил-3-фенил[1,6]нафтиридин-2-иламина (4,3 г, 0,02 моль), 30 мл воды и 11 н. хлористоводородной кислоты (10 мл). Реакционную смесь перемешивали в течение еще 1 ч, затем суспендированное твердое вещество белого цвета отделяли фильтрованием и сушили в вакууме, получая 4,35 г 5,7-диметил-3-фенил-1Н-[1,6]нафтиридин-2-она.
Молекулярная формула: C34H32N4O4S2
Молекулярная масса: 624.
1H ЯМР (ДМСО-d6): 1,49 (с, 3H), 1,93 (с, 3H), 2,12 (с, 3H), 2,47 (с, 3H), 2,48 (с, 3H), 2,78 (с, 3H), 5,54 (с, 2H), 6,71 (с, 1Н), 6,88-6,94 (м, 2H), 7,15 (с, 1Н), 7,21 (с, 1Н), 7,40-7,49 (м, 3H), 7,79-7,81 (м, 2H), 8,24 (с, 1Н), 10,62 (ушир., 1Н).
Масс-спектр: (m+1) 623,2.
Пример 30

(3,4-диметилизоксазол-5-ил)амид 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 02: Синтез (3,4-диметилизоксазол-5-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (3,4-диметилизоксазол-5-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 02 примера 26.
Стадия 03: Синтез (3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 03 примера 26.
Стадия 04: Синтез 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида осуществляли согласно стадии 04 примера 26.
Стадия 05: Синтез 3-аминометилпентаноата
Синтез 3-аминометилпентаноата осуществляли согласно стадии 11 примера 28.
Стадия 06: Синтез метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты
Синтез метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты осуществляли согласно стадии 12 примера 28.
Стадия 07: Синтез метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты
Синтез метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты осуществляли согласно стадии 13 примера 28.
Стадия 08: Синтез метилового эфира 4-амино-2,6-диэтилникотиновой кислоты
Синтез метилового эфира 4-амино-2,6-диэтилникотиновой кислоты осуществляли согласно стадии 14 примера 28.
Стадия 09: Синтез (4-амино-2,6-диэтилпиридин-3-ил)метанола
Синтез (4-амино-2,6-диэтилпиридин-3-ил)метанола осуществляли согласно стадии 14 примера 28.
Стадия 10: Синтез 4-амино-2,6-диэтилпиридин-3-карбальдегида
Синтез 4-амино-2,6-диэтилпиридин-3-карбальдегида осуществляли согласно стадии 15 примера 28.
Стадия 11: Синтез 5,7-диэтил-1Н-[1,6]нафтиридин-2-она
Синтез 5,7-диэтил-1Н-[1,6]нафтиридин-2-она осуществляли согласно стадии 16 примера 28.
Стадия 12: Синтез 1-(4-бром-3-метилбензил)-5,7-диэтил-1Н-[1,6]нафтиридин-2-она
При 0°C в атмосфере азота добавляли 5,7-диэтил-1Н-[1,6]нафтиридин-2-он (3,0 г, 0,01485 моль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Затем реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-бром-3-метилбензилового эфира метансульфоновой кислоты (5,39 г, 0,01931 моль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 8 часов. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 4,0 г 1-(4-бром-3-метилбензил)-5,7-диэтил-1Н-[1,6]нафтиридин-2-она в виде коричневого твердого вещества.
Стадия 13: Синтез (3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 1-(4-бром-3-метилбензил)-5,7-диэтил-1Н-[1,6]нафтиридин-2-она (1,0 г, 0,0026 моль) в диметоксиэтане (20 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (0,183 г, 0,00026 моль) с последующим добавлением 2M водного раствора карбоната натрия (0,827 г в 3,9 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 минут и затем нагревали при 60°C. Добавляли по каплям за 45 минут раствор 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида (0,58 г, 0,0013 моль в 10 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч такую же процедуру повторяли с последующим добавлением за 45 минут 3-борон-N-(3,4-диметил-3-изоксазолил)-N-[(2-триметилсиланилэтоксиметил)]-5-метилтиофенсульфонамида (0,58 г, 0,0013 моль в 10 мл диметоксиэтана), реакционную смесь нагревали с обратным холодильником в течение 4 часов и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли этилацетатом (50 мл) и водой, слои разделяли, водный слой экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме, получая 1,9 г (3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде светло-желтой маслянистой массы.
Стадия 14: Синтез (3,4-диметилизоксазол-5-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
1,9 г (0,00269 моль) (3,4-диметилизоксазол-5-ил)-(2-триметилсиланилэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты растворяли в 10 мл тетрагидрофурана с последующим добавлением раствора тетрабутиламмонийфторида (8,1 мл, 1 молярный раствор в тетрагидрофуране). Реакционную смесь нагревали при 55°C в течение 3 ч. После этого реакционную смесь охлаждали до комнатной температуры, добавляли разбавленную хлористоводородную кислоту и экстрагировали этилацетатом (50 мл×2), этилацетатный слой промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и упаривали в вакууме, получая масляную массу коричневого цвета (1,0 г). Неочищенное соединение очищали хроматографией на колонке с силикагелем, получая 122 мг (3,4-диметилизоксазол-5-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Молекулярная формула: C30H32N4O4S2
Молекулярная масса: 576.
1H ЯМР (ДМСО-d6): 1,20 (т, J=7,2 Гц, 3H), 1,25 (т, J=7,2 Гц, 3H), 1,42 (с, 3H), 1,93 (с, 3H), 1,98 (с, 3H), 2,45 (с, 3H), 2,70-2,74 (кв., J=7,6 Гц, 2H), 3,04-3,10 (кв., J=7,6 Гц, 2H), 5,46 (с, 2H), 6,70-7,35 (м, 6H), 8,22-8,25 (д, J=8,8 Гц, 1Н), 11,07 (ушир., 1Н).
Масс-спектр: (m-1) 575,2.
Пример 31
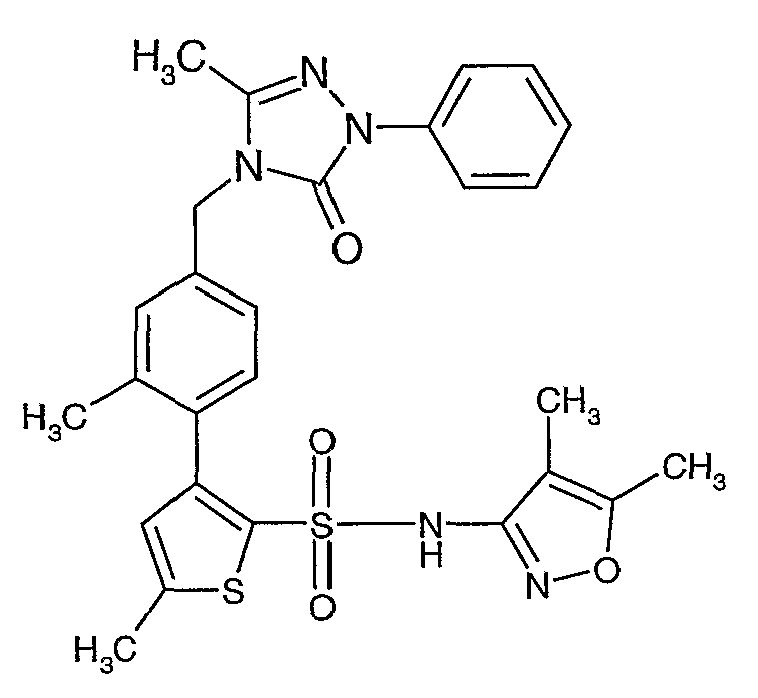
(4,5-диметилизоксазол-3-ил)амид 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона)
Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона) осуществляли согласно стадии 01 примера 28.
Стадия 02: Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила
Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила осуществляли согласно стадии 02 примера 28.
Стадия 03: Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима
Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима осуществляли согласно стадии 03 примера 28.
Стадия 04: Синтез 3-амино-4,5-диметилизоксазола
Синтез 3-амино-4,5-диметилизоксазола осуществляли согласно стадии 04 примера 28.
Стадия 05: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 08: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты
К перемешиваемому раствору 4-(4-бром-3-метилбензил)-5-метил-2-фенил-2,4-дигидро[1,2,4]триазол-3-она (2 г, 0,00558 моль) в диметоксиэтане (10 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (0,39 г, 0,000558 моль) с последующим добавлением 2M водного раствора карбоната натрия (1,77 г в 8,3 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. Добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (1,125 г, 0,00558 моль в 5 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч повторяли такую же процедуру с последующим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (1,125 г, 0,00558 моль в 5 мл диметоксиэтана), реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли этилацетатом (50 мл) и водой, слои разделяли, водный слой экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке на силикагеле, получая 3,5 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты (2 г) при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 400 мг (4,5-диметилизоксазол-3-ил)амида 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты в виде белого твердого вещества.
Стадия 11: Синтез гидрохлорида этилового эфира имида уксусной кислоты
В охлажденный до 0°C раствор ацетонитрила (50 г, 1,21 моль) и этанола (55,66 г, 1,21 моль) в течение 2 часов вводили сухую газообразную HCl (44,5 г). После завершения введения реакционную смесь перемешивали при 0°C в течение 6 ч и затем сохраняли при комнатной температуре в течение 6 часов. Реакционную смесь упаривали в вакууме, получая 30 г кристаллического белого твердого вещества, представляющего собой гидрохлорид этилового эфира имида уксусной кислоты. Его далее использовали как таковой.
Стадия 12: Синтез этилового эфира [1-этоксиэтилиден]карбаминовой кислоты
К охлажденному до 0°C раствору гидрохлорида этилового эфира имида уксусной кислоты в дихлорметане (30 г, 0,248 моль) в токе азота добавляли диизопропилэтиламин (80 г, 0,642 моль) и реакционную смесь перемешивали при 0°C в течение 30 мин. Затем к реакционной смеси за 45 минут добавляли по каплям этилхлорформиат (26,3 г, 0,2492 моль). Затем реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали в вакууме и фильтрат концентрировали в вакууме, получая 50 г этилового эфира [1-этоксиэтилиден]карбаминовой кислоты в виде масла.
Стадия 13: Синтез 5-метил-2-фенил-2,4-дигидро[1,2,4]триазол-3-она
К 20 г (0,125 моль) этилового эфира [1-этоксиэтилиден]карбаминовой кислоты добавляли толуол (на 100 мл). К реакционной смеси добавляли 12,4 г (0,114 моль) фенилгидразина и реакционную смесь нагревали с обратным холодильником в течение 2 ч при 45°C, затем реакционную смесь охлаждали до комнатной температуры и затем добавляли 12,7 г (0,125 моль) триэтиламина, затем реакционную смесь нагревали с обратным холодильником в течение 6 часов. Реакционную смесь упаривали в вакууме и неочищенный продукт повторно кристаллизовали из простого диэтилового эфира, получая твердое кристаллическое вещество, которое отфильтровывали в вакууме и сушили при отсасывании, получая 9,5 г 5-метил-2-фенил-2,4-дигидро[1,2,4]триазол-3-она.
Стадия 14: Синтез 4-(4-бром-3-метилбензил)-5-метил-2-фенил-2,4-дигидро[1,2,4]триазол-3-она
К перемешиваемому раствору 5-метил-2-фенил-2,4-дигидро[1,2,4]триазол-3-она (1,85 г, 0,01 моль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (617 мг, 0,0017 моль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Затем реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-бром-3-метилбензилового эфира метансульфоновой кислоты (2,86 г, 0,010 моль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 3,4 г 4-(4-бром-3-метилбензил)-5-метил-2-фенил-2,4-дигидро[1,2,4]триазол-3-она в виде коричневого твердого вещества.
Молекулярная формула: C27H27N5O4S2
Молекулярная масса: 549.
1H ЯМР (ДМСО-d6): 1,55 (с, 3H), 1,96 (с, 3H), 2,18 (с, 3H), 2,27 (с, 3H), 4,90 (с, 2H), 6,74 (с, 1Н), 6,95-6,97 (д, J=7,6 Гц, 1Н), 7,04-7,06 (д, J=7,6 Гц, 1Н), 7,17 (с, 1Н), 7,23 (т, J=7,6 Гц, 1Н), 7,47 (т, J=7,6 Гц, 2H), 7,92-7,94 (д, J=7,6 гц, 2H), 10,58 (ушир., 1Н).
Масс-спектр: (m-1) 548,1.
Пример 32
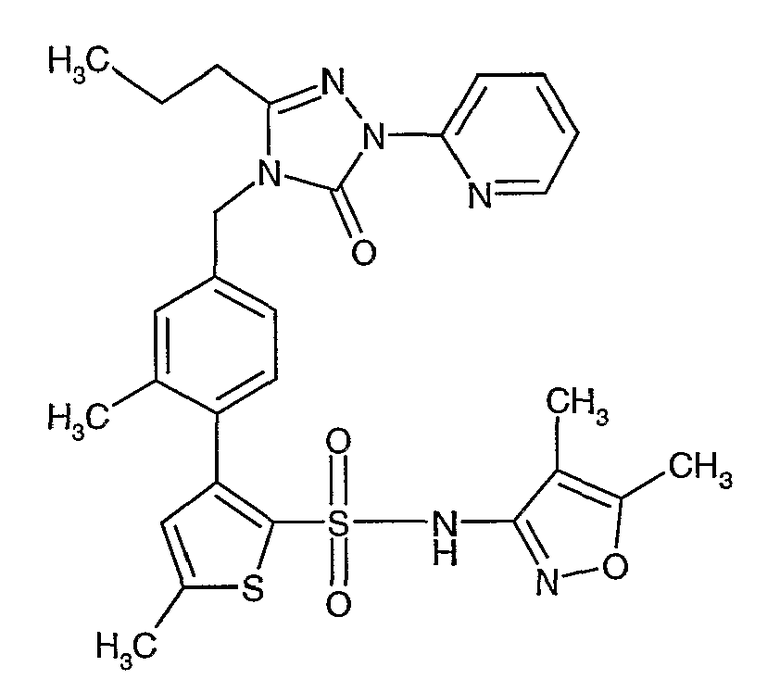
(4,5-Диметилизоксазол-3-ил)амид 5-метил-3-[2-метил-4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона)
Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона) осуществляли согласно стадии 01 примера 28.
Стадия 02: Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила
Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила осуществляли согласно стадии 02 примера 28.
Стадия 03: Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима
Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима осуществляли согласно стадии 03 примера 28.
Стадия 04: Синтез 3-амино-4,5-диметилизоксазола
Синтез 3-амино-4,5-диметилизоксазола осуществляли согласно стадии 04 примера 28.
Стадия 05: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 08: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты
К перемешиваемому раствору 4-(4-бром-3-метилбензил)-5-пропил-2-пиридин-2-ил-2,4-дигидро[1,2,4]триазол-3-она (0,5 г, 0,001 моль) в диметоксиэтане (5 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (0,09 г, 0,00012 моль) с последующим добавлением 2M водного раствора карбоната натрия (0,4 г в 2,16 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. Добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (0,26 г, 0,0001 моль в мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч повторяли такую же процедуру с дальнейшим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (0,26 г, 0,0001 моль в мл диметоксиэтана), реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли этилацетатом (20 мл) и водой, слои разделяли, водный слой экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, получая 0,78 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты в виде коричневого масла.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метил-3-[2-метил-4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты (0,78 г) при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 40 мг (4,5-диметилизоксазол-3-ил)амида 5-метил-3-[2-метил-4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты в виде белого твердого вещества.
Стадия 11: Синтез гидрохлорида сложного этилового эфира имида масляной кислоты
В охлажденный до 0°C раствор бутиронитрила (50 г, 0,726 моль) и этанола (33,33 г, 0,724 моль) вводили сухую газообразную HCl (до увеличения массы реакционной смеси до 26 г) (26,44 г, 0,724 моль), после завершения добавления реакционную смесь перемешивали при 0°C в течение 6 ч и затем сохраняли при комнатной температуре в течение 6 ч. Реакционную смесь упаривали в вакууме, получая 35 г кристаллического белого твердого вещества, представляющего собой гидрохлорид сложного этилового эфира имида масляной кислоты. Его далее использовали как таковой.
Стадия 12: Синтез этилового эфира [1-этоксибутилиден]карбаминовой кислоты
К охлажденному до 0°C раствору гидрохлорида сложного этилового эфира имида масляной кислоты (25 г, 0,18 моль) в дихлорметане (125 мл) в токе азота добавляли диизопропилэтиламин (55 г, 0,58 моль) и реакционную смесь перемешивали при 0°C в течение 30 мин. Затем к реакционной смеси за 45 минут добавляли по каплям этилхлорформиат (17 г, 0,156 моль). Затем реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь фильтровали в вакууме и фильтрат концентрировали в вакууме, получая 24 г этилового эфира [1-этоксибутилиден]карбаминовой кислоты в виде масла.
Стадия 13: Синтез 5-пропил-2-пиридин-2-ил-2,4-дигидро[1,2,4]триазол-3-она
К 10 г (0,5 моль) этилового эфира [1-этоксибутилиден]карбаминовой кислоты добавляли толуол (на 20 мл). К реакционной смеси добавляли 5,3 г (0,048 моль) пиридин-2-илгидразина и нагревали реакционную смесь при 45°C в течение 30 мин, затем реакционную смесь охлаждали до комнатной температуры, затем добавляли 5,4 г (0,053 моль) триэтиламина и затем реакционную смесь нагревали с обратным холодильником в течение 6 ч. Реакционную смесь упаривали в вакууме и неочищенный продукт повторно кристаллизовали из простого диэтилового эфира, получая твердое кристаллическое вещество, которое отфильтровывали в вакууме и сушили при отсасывании, получая 2,2 г 5-пропил-2-пиридин-2-ил-2,4-дигидро[1,2,4]триазол-3-она.
Стадия 14: Синтез 4-(4-бром-3-метилбензил)-5-метил-2-фенил-2,4-дигидро[1,2,4]триазол-3-она
К перемешиваемому раствору 5-пропил-2-пиридин-2-ил-2,4-дигидро[1,2,4]триазол-3-она (1 г, 0,004 моль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (294 мг, 0,0073 моль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Затем реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-бром-3-метилбензилового эфира метансульфоновой кислоты (1,64 г, 0,0058 моль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (20 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 2 г 4-(4-бром-3-метилбензил)-5-метил-2-фенил-2,4-дигидро[1,2,4]триазол-3-она в виде коричневого твердого вещества.
Молекулярная формула: C28H30N6O4S2
Молекулярная масса: 578.
1H ЯМР (ДМСО-d6): 0,94 (т, J=7,6 Гц, 3H), 1,29 (с, 3H), 1,64-1,69 (кв., 2H), 1,96 (с, 3H), 2,18 (с, 3H), 2,55 (т, J=7,6 Гц, 3H), 4,91 (с, 2H), 6,74 (с, 1Н), 6,95-7,16 (м, 4H), 7,92-7,99 (м, 2H), 8,49-8,50 (д, 2H), 10,62 (с, 1Н).
Масс-спектр: (m-1) 577,2.
Пример 33
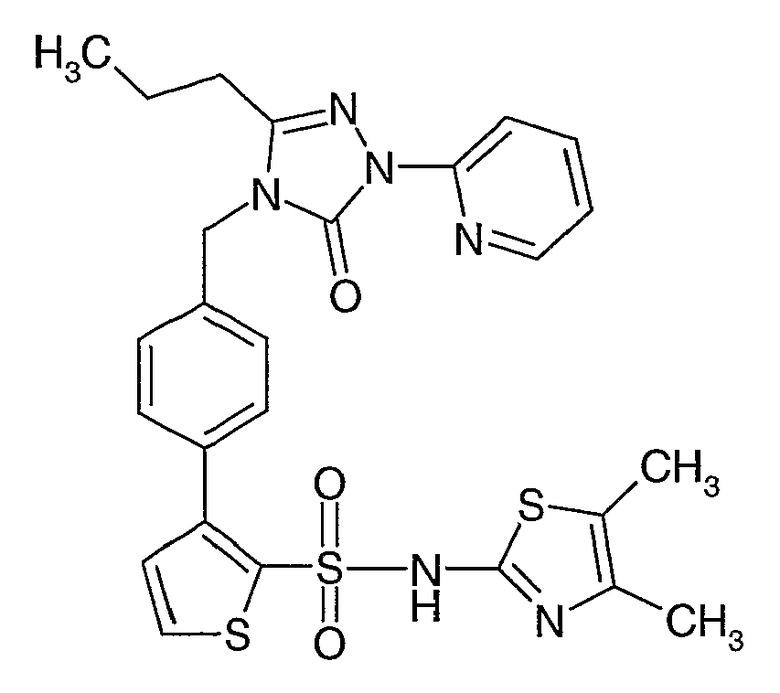
(4,5-диметилтиазол-2-ил)амид 3-[4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез 3-бромтиофен-2-сульфонилхлорида
Синтез 3-бромтиофен-2-сульфонилхлорида осуществляли согласно стадии 10 примера 02.
Стадия 02: Синтез (4,5-диметилтиазол-2-ил)амида 3-бромтиофен-2-сульфоновой кислоты
3-Бромтиофен-2-сульфонилхлорид (20 г, 0,076 моль) добавляли к раствору 4,5-диметилтиазол-2-иламина (15 г, 0,071 моль) в 40 мл раствора гидроксида натрия (6 г, 0,15 моль) при комнатной температуре и перемешивали в течение 6 часов. Концентрировали реакционную смесь полностью в вакууме, реакционную смесь подкисляли с использованием 1 н. хлористоводородной кислоты с последующей экстракцией дихлорметаном (50 мл×3). Объединенный экстракт промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали, получая смесь продуктов, которую растворяли в метанольном растворе гидроксида натрия и реакционную смесь перемешивали и нагревали при 50°C в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и упаривали в вакууме. Остаток, полученный таким образом, подкисляли разбавленной хлористоводородной кислотой до рН 2 с последующей экстракцией метиленхлоридом (100 мл×3). Объединенный экстракт промывали водой, насыщенным раствором соли и сушили над безводным сульфатом натрия, упаривали в вакууме, получая 9 г коричневого твердого вещества, представляющего собой (4,5-диметилтиазол-2-ил)амид 3-бромтиофен-2-сульфоновой кислоты.
Стадия 03: Синтез (4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты
К раствору (4,5-диметилтиазол-2-ил)амида 3-бромтиофен-2-сульфоновой кислоты (8 г, 0,022 моль) в 40 мл ацетона и 10 мл диметилформамида при 0°C добавляли карбонат калия (5 г, 0,036 моль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь охлаждали до 0°C, используя баню лед-соль. 2-Метоксиэтоксиметилхлорид (5 г, 0,040 моль) добавляли по каплям за 30 минут при 0°C. Реакционную смесь перемешивали на бане лед-соль в течение 30 мин и затем при комнатной температуре в течение 4 ч. Смесь разбавляли этилацетатом (100 мл), затем 30 мл ледяной воды и органический слой отделяли, промывали водой и насыщенным раствором соли, наконец, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 3 г (4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты в виде желтого масла.
Стадия 05: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты
К перемешиваемому раствору (3 г, 6,8 ммоль) (4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)амида 3-бромтиофен-2-сульфоновой кислоты и 1,2 г (8 ммоль) 4-формилбороновой кислоты в диметоксиэтане (30 мл) в атмосфере азота добавляли 2M водный раствор карбоната натрия (2,16 г в 10 мл воды). Перемешивали реакционную смесь в течение 15 минут, затем к реакционной смеси добавляли бис(трифенилфосфин)палладий(II)хлорид (400 мг, 0,68 ммоль). Реакционную смесь нагревали при 85°C в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли 50 мл этилацетата. Концентрировали реакционную смесь в вакууме, к остатку добавляли этилацетат (100 мл), затем охлажденную воду с дальнейшей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали полностью в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, получая 2,5 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты в виде маслянистой массы.
Стадия 06: Синтез (4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты
Боргидрид натрия (400 мг, 10 ммоль) добавляли при 0°C в токе азота к перемешиваемому раствору тетрагидрофурана с последующим добавлением (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты (2,5 г, 5,3 ммоль) в 15 мл тетрагидрофурана. Перемешивали реакционную смесь при 0°C в течение 1 ч, поднимали температуру реакционной смеси до комнатной температуры и перемешивали в течение 4 ч. Проводили обработку добавлением при 0°C раствора гидроксида натрия (1 г, растворенный в 100 мл воды) с последующей экстракцией этилацетатом (50 мл×2). Сушили органический слой над сульфатом натрия и концентрировали полностью в вакууме, получая 2,3 г (4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты в виде масляной жидкости.
Стадия 07: Синтез 4-{2-[(4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)сульфамоил]тиофен-3-ил}бензилового эфира метансульфоновой кислоты
N-этилдиизопропиламин (2 мл, 10,8 ммоль) добавляли к раствору (4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты (2,3 г, 4,9 ммоль) в 15 мл дихлорметана. Охлаждали реакционную смесь до 0°C, затем в реакционную смесь медленно добавляли раствор метансульфонилхлорида (0,5 мл, 6,1 ммоль) в 10 мл дихлорметана. Реакционную смесь выдерживали при комнатной температуре в течение 3 ч. Осуществляли обработку добавлением в реакционную смесь ледяной воды с последующей экстракцией метиленхлоридом (25 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Сушили органический слой над сульфатом натрия и концентрировали в вакууме, получая 1,8 г 4-{2-[(4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)сульфамоил]тиофен-3-ил}бензилового эфира метансульфоновой кислоты в виде вязкой жидкости.
Стадия 08: Синтез (4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты
К перемешиваемому раствору 5-пропил-2-пиридин-2-ил-2,4-дигидро[1,2,4]триазол-3-она (700 мг, 3,4 ммоль) в диметилформамиде (5 мл) при 0°C в токе сухого газообразного азота добавляли порциями гидрид натрия (60% в минеральном масле) (252 мг, 5,2 ммоль). После добавления температуру повышали до комнатной температуры и выдерживали в течение 30 мин. Снова охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)сульфамоил]тиофен-3-ил}бензилового эфира метансульфоновой кислоты (1,8 г, 3,5 ммоль) в 5 мл диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл воды при 0°C и экстрагировали этилацетатом (50 мл×2) Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили органический слой над сульфатом натрия и концентрировали в вакууме, получая 2 г (4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты в виде смолы.
Стадия 09: Синтез (4,5-диметилтиазол-2-ил)амида 3-[4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты
К 2 г (4,5-диметилтиазол-2-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты при комнатной температуре добавляли 95%-ный этанол (15 мл) и 10 мл 6 н. водный раствор хлористоводородной кислоты. Реакционную смесь нагревали с обратным холодильником в течение 6 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 5 с использованием раствора бикарбоната натрия и смесь экстрагировали этилацетатом (50 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле, используя смесь гексан:этилацетат, получая 180 мг желтоватого твердого вещества, представляющего собой (4,5-диметилтиазол-2-ил)амид 3-[4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты.
Молекулярная формула: C26H26N6O3S3
Молекулярная масса: 566.
1H ЯМР (ДМСО-d6): 0,93 (3, 3H), 1,64 (м, 2H), 2,07 (с, 3H), 2,12 (с, 3H), 2,55 (т, J=3,2 Гц, 2H), 4,96 (с, 2H), 7,20-8,50 (м, 10-ый), 12,46 (ушир., 1Н).
Масс-спектр: (m-1) 565,12.
Пример 34
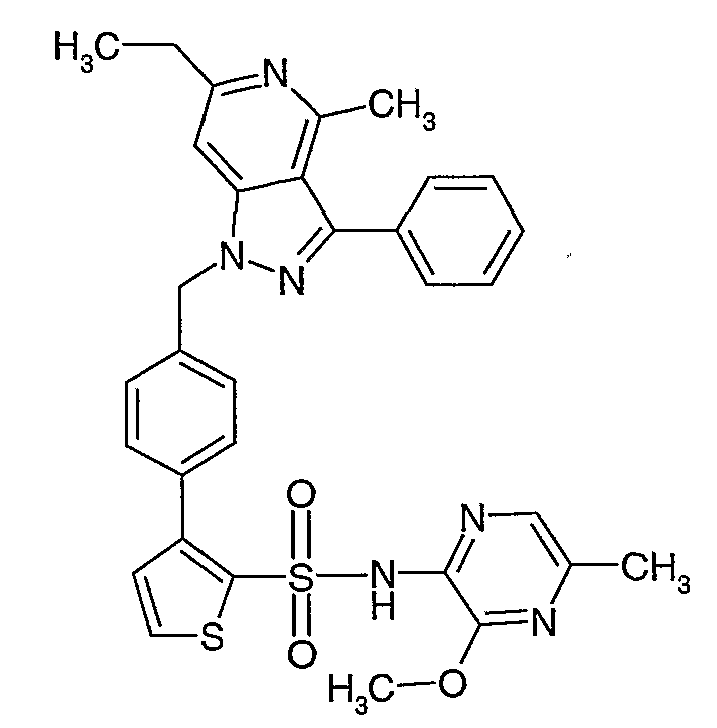
Изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амид 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
Стадия 01: Синтез 3-бромтиофен-2-сульфонилхлорида
Синтез 3-бромтиофен-2-сульфонилхлорида осуществляли согласно стадии 10 примера 02.
Стадия 02: Синтез (3-метокси-5-метилпиразин-2-ил)амида 3-бромтиофен-2-сульфоновой кислоты
К перемешиваемому холодному раствору 3-метокси-5-метилпиразин-2-иламина (2,5 г, 0,018 моль) в пиридине (30 мл) добавляли диметиламинопиридин (0,3 г, 0,002 моль), затем 3-бромтиофен-2-сульфонилхлорид (6,5 г, 0,025 моль). Реакционную смесь нагревали и перемешивали при 60°C в течение 24 часов. Пиридин упаривали в вакууме. Неочищенный продукт помещали в этилацетат и промывали насыщенным раствором бикарбоната натрия. Этилацетатный слой сушили над сульфатом натрия и концентрировали в вакууме, получая 4,4 г (3-метокси-5-метилпиразин-2-ил)амида 3-бромтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 03: Синтез изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-бромтиофен-2-сульфоновой кислоты
К перемешиваемому холодному раствору (3-метокси-5-метилпиразин-2-ил)амида 3-бромтиофен-2-сульфоновой кислоты (5,5 г, 0,015 моль) в диметилформамиде (30 мл) при 0°C добавляли порциями гидрид натрия (60% в минеральном масле, 0,870 г, 0,018 моль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. При 0°C добавляли изобутилхлорформиат (2,4 г, 0,017 моль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли этилацетат (150 мл) и воду (50 мл). Органический слой промывали водой (50 мл×3). Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 5 г изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-бромтиофен-2-сульфоновой кислоты в виде коричневатого масла.
Стадия 04: Синтез изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты
К 4-формилбороновой кислоте (1,61 г, 0,011 моль) в 20 мл этанола добавляли изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амид 3-бромтиофен-2-сульфоновой кислоты (5 г, 0,01 l моль) в толуоле (20 мл) с последующим добавлением 2M раствора карбоната натрия (3,4 г в 6 мл воды 0,032 моль) и перемешивали в течение 15 минут. Добавляли тетракистрифенилфосфинпалладий(0) (0,53 г, 0,00045 моль) и реакционную смесь нагревали и перемешивали при 110°C-120°C в течение 6 часов. К реакционной смеси добавляли этилацетат (50 мл), реакционную смесь концентрировали в вакууме. Добавляли воду (100 мл) и экстрагировали этилацетатом (100 мл). Органический слой сушили над сульфатом натрия и концентрировали в вакууме, получая 6 г изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты.
Стадия 05: Синтез изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты
К перемешиваемому раствору изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-(4-формилфенил)тиофен-2-сульфоновой кислоты (5 г, 0,011 моль) в тетрагидрофуране (30 мл) добавляли при 0°C боргидрид натрия (0,6 г, 0,017 моль) и перемешивали при комнатной температуре в течение 60 минут. Реакционную смесь охлаждали до 0°C и к реакционной смеси добавляли разбавленный раствор гидроксида натрия (0,5 г в 50 мл). Реакционную смесь затем экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме, получая 3,9 г изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты в виде коричневого масла.
Стадия 06: Синтез 4-{2-[изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)сульфамоил]тиофен-3-ил}бензилового эфира метансульфоновой кислоты
К перемешиваемому раствору изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-(4-гидроксиметилфенил)тиофен-2-сульфоновой кислоты (1,5 г, 3 ммоль) в дихлорметане (20 мл) при 0°C добавляли триэтиламин (1,0 мл, 6 ммоль) и перемешивали в течение 5 мин, затем при 0°C метансульфонилхлорид (0,3 мл, 3,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь гасили водой (15 мл). Органический слой отделяли и сушили над сульфатом натрия, концентрировали в вакууме, получая 1,5 г 4-{2-[изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)сульфамоил]тиофен-3-ил}бензилового эфира метансульфоновой кислоты.
Стадия 07: Синтез изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-с]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
К перемешиваемому раствору 6-этил-4-метил-3-фенил-1Н-пиразоло[4,3-c]пиридина (0,640 г, 2,7 ммоль) в диметилформамиде (5 мл) при 0°C в атмосфере азота добавляли гидрид натрия (50%, 0,2 г, 4 ммоль) и перемешивали в течение 30 минут при комнатной температуре. Затем реакционную смесь охлаждали до 0°C и добавляли 4-{2-[изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)сульфамоил]тиофен-3-ил}бензиловый эфир метансульфоновой кислоты (1,5 г, 2,7 ммоль) в диметилформамиде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционные смеси разбавляли этилацетатом (20 мл) и 10 мл воды. Органический слой отделяли и промывали водой (10 мл×3), насыщенным раствором соли, сушили над сульфатом натрия и концентрировали в вакууме, получая 1 г неочищенного изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты в виде вязкой жидкости.
Стадия 08: Синтез (3-метокси-5-метилпиразин-2-ил)амида 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-с]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты
К изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амиду 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (1 г) добавляли метанол (10 мл) и гидроксид натрия (500 мг в 5 мл воды). Реакционную смесь нагревали и перемешивали при 50°C в течение 1 часа. Метанол упаривали и нейтрализовали разбавленной хлористоводородной кислотой (рН~6,5). Экстрагировали дихлорметаном (50 мл), сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке с силикагелем, используя этилацетат и гексан, получая 50 мг изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амида 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты.
Молекулярная формула: C32H30N6O3S2
Молекулярная масса: 610.
1H ЯМР (ДМСО-d6): 1,24-1,31 (т, J=7,6 Гц 3H), 2,24 (с, 3H), 2,47 (с, 3H), 2,80-2,85 (кв., J 7,2 Гц, 2H), 3,72 (с, 3H), 5,71 (с, 2H), 7,08-7,09 (д, J=5,2 Гц 1H), 7,26-7,28 (д, J=8 Гц, 2H), 7,44-7,46 (д, J=8,4 Гц, 2H), 7,48-7,55 (м, 5H), 7,65-7,68 (дд, J=8 Гц, 2H), 7,86-7,87 (д, J=5,2, 1Н).
Масс-спектр: (m+1) 611,27.
Пример 35
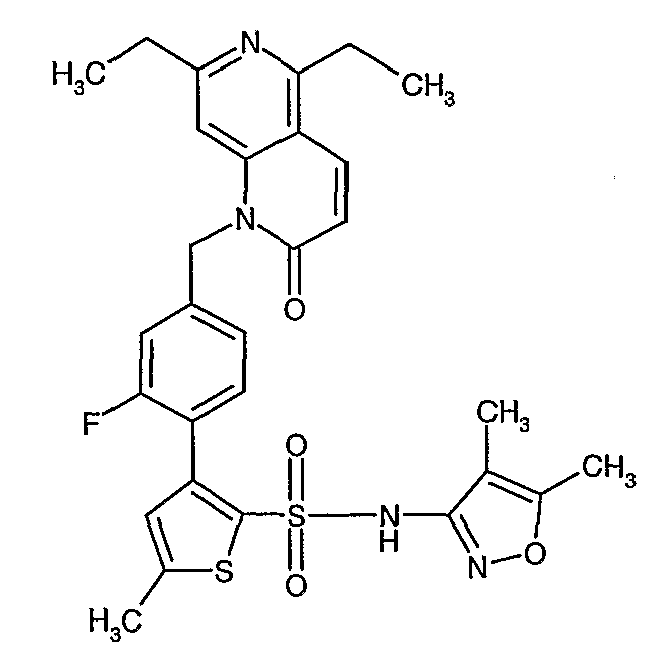
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-фторфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона)
Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона) осуществляли согласно стадии 01 примера 28.
Стадия 02: Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила
Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила осуществляли согласно стадии 02 примера 28.
Стадия 03: Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима
Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима осуществляли согласно стадии 03 примера 28.
Стадия 04: Синтез 3-амино-4,5-диметилизоксазола
Синтез 3-амино-4,5-диметилизоксазола осуществляли согласно стадии 04 примера 28.
Стадия 05: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 08: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-фторфенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 1-(4-бром-3-фторбензил)-5,7-диэтил-1Н-[1,6]нафтиридин-2-она (2 г, 5,1 ммоль) в диметоксиэтане (20 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (370 мг, 0,51 ммоль) с последующим добавлением 2M водного раствора карбоната натрия (1,7 г в 8 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. Добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (1 г, 2,5 ммоль в 15 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч повторяли такую же процедуру с дальнейшим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (1 г, 2,5 ммоль в 15 мл диметоксиэтана), реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли этилацетатом (100 мл) и водой, слои разделяли, водный слой экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке на силикагеле, получая 2 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-фторфенил]-5-метилтиофен-2-сульфоновой кислоты в виде светло-желтой маслянистой массы.
Стадия 010: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-фторфенил]-5-метилтиофен-2-сульфоновой кислоты
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-фторфенил]-5-метилтиофен-2-сульфоновой кислоты (2 г) при комнатной температуре добавляли этанол (15 мл) и 6 н. водный раствор хлористоводородной кислоты (10 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 200 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-фторфенил]-5-метилтиофен-2-сульфоновой кислоты в виде желтого твердого вещества.
Стадия 11: Синтез 3-аминометилпентаноата
Синтез 3-аминометилпентаноата осуществляли согласно стадии 11 примера 28.
Стадия 12: Синтез метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты
Синтез метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты осуществляли согласно стадии 12 примера 28.
Стадия 13: Синтез метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты
Синтез метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты осуществляли согласно стадии 13 примера 28.
Стадия 14: Синтез метилового эфира 4-амино-2,6-диэтилникотиновой кислоты
Синтез метилового эфира 4-амино-2,6-диэтилникотиновой кислоты осуществляли согласно стадии 14 примера 28.
Стадия 15: Синтез (4-амино-2,6-диэтилпиридин-3-ил)метанола
Синтез (4-амино-2,6-диэтилпиридин-3-ил)метанола осуществляли согласно стадии 14 примера 28.
Стадия 16: Синтез 4-амино-2,6-диэтилпиридин-3-карбальдегида
Синтез 4-амино-2,6-диэтилпиридин-3-карбальдегида осуществляли согласно стадии 15 примера 28.
Стадия 17: Синтез 5,7-диэтил-1Н-[1,6]нафтиридин-2-она
Синтез 5,7-диэтил-1Н-[1,6]нафтиридин-2-она осуществляли согласно стадии 16 примера 28.
Стадия 18: Синтез 1-бром-4-бромметил-2-фторбензола.
К раствору 1-бром-2-фтор-4-метилбензола (5 г, 0,026 моль) в тетрахлорметане (40 мл) добавляли N-бромсукцинимид (5,6 г, 0,037 моль) с последующим добавлением 400 мг азоизобутиронитрила (AIBN), затем реакционную смесь нагревали с обратным холодильником в течение 6 ч. Реакционную смесь охлаждали до 0°C и фильтровали в вакууме; фильтрат упаривали в вакууме, получая 6 г 1-бром-4-бромметил-2-фторбензола в виде желтого масла. Его далее использовали как таковой.
Стадия 19: Синтез 1-(4-бром-3-фторбензил)-5,7-диэтил-1Н-[1,6]-нафтиридин-2-она
К перемешиваемому раствору 5,7-диэтил-1Н-[1,6]нафтиридин-2-она (1 г, 0,005 моль) в диметилформамиде (10 мл) при температуре окружающей среды в атмосфере азота добавляли карбонат калия (1 мг, 0,0072 моль) с последующим добавлением 1-бром-4-бромметил-2-фторбензола (1,4 г, 0,0052 моль) в 10 мл диметилформамида. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Смесь затем фильтровали и остаток промывали этилацетатом, объединенную органическую фазу промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 2 г 1-(4-бром-3-фторбензил)-5,7-диэтил-1Н-[1,6]-нафтиридин-2-она в виде масла желтого цвета.
Молекулярная формула: C32H30N6O3S2
Молекулярная масса: 580.
1H ЯМР (ДМСО-d6): 1,20 (т, J=7,6 Гц, 3H), 1,25 (т, J=7,6 Гц, 3H), 1,49 (с, 3H), 2,10 (с, 3H), 2,48 (с, 3H), 2,67-2,75 (кв., J=7,2 Гц, 2H), 3,05-3,10 (кв., J=7,2 Гц, 2H), 5,51 (с, 2H), 6,72-6,74 (д, J=10 Гц, 1Н), 6,81 (с, 1Н), 6,95-6,97 (д, J=7,6 Гц, 1Н), 7,13-7,16 (м, 3H), 8,24-8,26 (д, J=10 гц, 1Н), 10,72 (ушир., 1Н).
Масс-спектр: (m-1) 579,13.
Пример 36
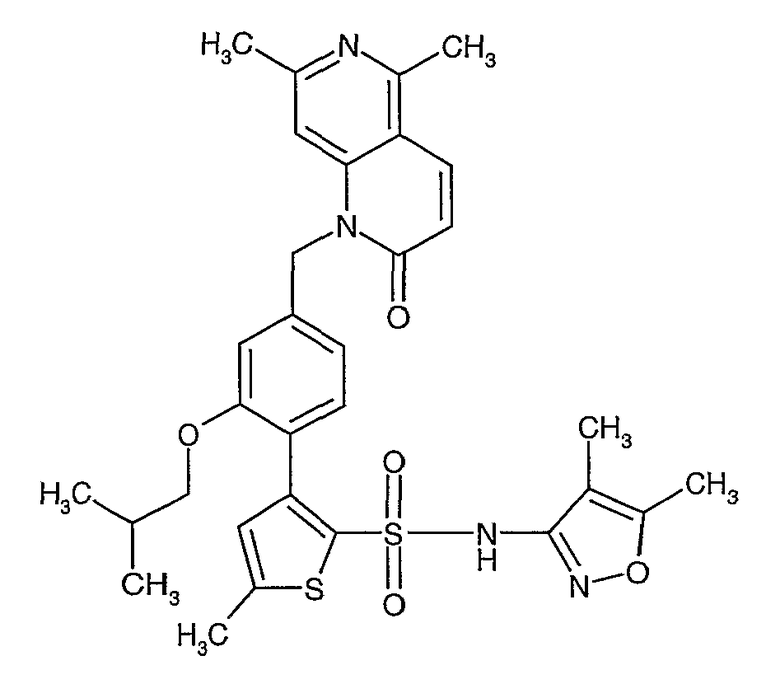
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(5,7-диметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-изобутоксифенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона)
Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона) осуществляли согласно стадии 01 примера 28.
Стадия 02: Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила
Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила осуществляли согласно стадии 02 примера 28.
Стадия 03: Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима
Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима осуществляли согласно стадии 03 примера 28.
Стадия 04: Синтез 3-амино-4,5-диметилизоксазола
Синтез 3-амино-4,5-диметилизоксазола осуществляли согласно стадии 04 примера 28.
Стадия 05: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 08: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 09: Синтез метилового эфира 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-изобутоксибензойной кислоты
К перемешиваемому раствору метилового эфира 4-бром-3-изобутоксибензойной кислоты (1,0 г, 0,00348 моль) в диметоксиэтане (15 мл) в атмосфере азота добавляли бис(трифенилфосфин)палладий(II)хлорид (0,243 г, 3,4 ммоль) с последующим добавлением 2M водного раствора карбоната натрия (0,811 г в 3,8 мл воды). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и затем нагревали при 60°C. Добавляли по каплям за 45 минут раствор 3-борон-N-(4,5-Диметил-3~изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (700 мг, 0,003465 моль в 15 мл диметоксиэтана) и реакционную смесь нагревали с обратным холодильником в течение 60 мин. Через 1 ч повторяли такую же процедуру с дальнейшим добавлением за 45 минут 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида (700 мг, 0,003465 моль в 15 мл диметоксиэтана), реакционную смесь нагревали с обратным холодильником в течение 4 ч и перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли этилацетатом (100 мл) и водой, слои разделяли, водный слой экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и концентрировали в вакууме. Неочищенное соединение очищали хроматографией на колонке на силикагеле, получая 1,8 г метилового эфира 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-изобутоксибензойной кислоты в виде светло-желтой маслянистой массы.
Стадия 10: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-изобутоксифенил)-5-метилтиофен-2-сульфоновой кислоты
Алюмогидрид лития (0,15 г, 0,0039 моль) при 0°C в токе азота добавляли к перемешиваемому раствору тетрагидрофурана (15 мл) с последующим добавлением метилового эфира 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-изобутоксибензойной кислоты (1,5 г, 0,0026 моль) в 20 мл тетрагидрофурана. Реакционную смесь перемешивали при 0°C в течение 15 минут. Поднимали температуру реакционной смеси до комнатной температуры и перемешивали в течение 4 ч. Реакционную смесь охлаждали до 0°C и добавляли по каплям раствор 50 мл гидроксида натрия (1 г, растворенный в 100 мл воды), поддерживая температуру 0°C, с последующей экстракцией этилацетатом (25 мл×2). Органический слой сушили над сульфатом натрия и концентрировали полностью в вакууме, получая 1,4 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-изобутоксифенил)-5-метилтиофен-2-сульфоновой кислоты.
Стадия 11: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-изобутоксибензилового эфира метансульфоновой кислоты
N-этилдиизопропиламин (0,67 г, 0,005204 моль) добавляли к раствору (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-изобутоксифенил)-5-метилтиофен-2-сульфоновой кислоты (1,4 г, 0,0026 моль) в 10 мл дихлорметана. Охлаждали реакционную смесь до 0°C, в реакционную смесь медленно добавляли метансульфонилхлорид (0,351 г, 0,003122 моль). Реакционную смесь выдерживали при комнатной температуре в течение 3 ч. Реакционную смесь выгружали в ледяную воду с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали разбавленной хлористоводородной кислотой, затем водой и насыщенным раствором соли. Сушили органический слой над сульфатом натрия и концентрировали, получая 1,5 г 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-изобутоксибензилового эфира метансульфоновой кислоты.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-изобутоксифенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 5,7-диметил-1Н-[1,6]нафтиридин-2-она (0,0423 г, 0,002435 моль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (146 мг, 0,00365 моль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-изобутоксибензилового эфира метансульфоновой кислоты (1,5 г, 0,002435 моль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая неочищенный материал, который очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 0,7 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(5,7-диметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-изобутоксифенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-изобутоксифенил]-5-метилтиофен-2-сульфоновой кислоты
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[4-(5,7-диметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-изобутоксифенил]-5-метилтиофен-2-сульфоновой кислоты (0,7 г) при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 120 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(5,7-диметил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-изобутоксифенил]-5-метилтиофен-2-сульфоновой кислоты в виде белого твердого вещества.
Стадия 14: Синтез этилового эфира 2,6-диметил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты
Синтез этилового эфира 2,6-диметил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты осуществляли согласно стадии 14 примера 29.
Стадия 15: Синтез этилового эфира 2,6-диметил-4-(толуол-4-сульфониламино)никотиновой кислоты
Синтез этилового эфира 2,6-диметил-4-(толуол-4-сульфониламино)никотиновой кислоты осуществляли согласно стадии 15 примера 29.
Стадия 16: Синтез этилового эфира 4-амино-2,6-диметилникотиновой кислоты
Синтез этилового эфира 4-амино-2,6-диметилникотиновой кислоты осуществляли согласно стадии 16 примера 29.
Стадия 17: Синтез (4-амино-2,6-диметилпиридин-3-ил)метанола
Синтез (4-амино-2,6-диметилпиридин-3-ил)метанола осуществляли согласно стадии 17 примера 29.
Стадия 18: Синтез 4-амино-2,6-диметилпиридин-3-карбальдегида
Синтез 4-амино-2,6-диметилпиридин-3-карбальдегида осуществляли согласно стадии 18 примера 29.
Стадия 19: Синтез 5,7-диметил-1Н-[1,6]нафтиридин-2-она
Смесь 4-амино-2,6-диметилпиридин-3-карбальдегида (6,1 г, 0,041 моль) и (карэтоксиметилен)трифенилфосфорана (35,38 г, 0,101 моль) в ксилоле (150 мл) перемешивали и нагревали с обратным холодильником в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли выпариванием. К остатку добавляли раствор метоксида натрия (7,75 г, 0,144 моль) в метаноле (150 мл) и полученный раствор нагревали с обратным холодильником в течение 4 ч. Метанол удаляли упариванием и добавляли воду (200 мл). Смесь подкисляли до рН 1-2 добавлением через воронку хлористоводородной кислоты. Смесь затем экстрагировали этилацетатом (мл) и экстракт отбрасывали. Водную фазу затем подщелачивали добавлением карбоната натрия. Затем осуществляли экстракцию дихлорметаном (200 мл×3). Органический слой промывали водой, насыщенным раствором соли, сушили над сульфатом натрия и концентрировали, получая 1,6 г 5,7-диметил-1Н-[1,6]нафтиридин-2-она в виде белого твердого вещества.
Стадия 20: Синтез 4-бром-3-гидроксибензойой кислоты
4,7 г бромида меди растворяли в 5 мл 48%-ной бромистоводородной кислоты и нагревали с обратным холодильником в течение 30 минут. Затем в другой колбе 6 мл 48%-ной бромистоводородной кислоты охлаждали до 0°C. К 5 г (0,032679 моль) 4-амино-3-гидроксибензойной кислоты добавляли при перемешивании (2,61 г, 0,03782 моль) раствора нитрита натрия (растворенного в 20 мл воды). Перемешивали реакционную смесь в течение 30 мин при 0°C, затем полученный раствор добавляли по каплям за 30 минут к активированному раствору бромида натрия. После завершения добавления реакционную смесь нагревали с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и затем фильтровали через слой hyflow, фильтрат экстрагировали этилацетатом (50 мл×3). Органический слой промывали водой, насыщенным раствором соли, сушили над сульфатом натрия и концентрировали, получая 1 г 4-бром-3-гидроксибензойной кислоты.
Стадия 21: Синтез метилового эфира 4-бром-3-гидроксибензойной кислоты
4-Бром-3-гидроксибензойную кислоту (1 г, 0,004 моль) растворяли в 20 мл метанола, полученный раствор охлаждали до 0°C и затем добавляли 0,2 мл концентрированной серной кислоты. После завершения добавления реакционную смесь нагревали с обратным холодильником в течение 6 ч, затем метанол упаривали в вакууме. К остатку добавляли воду и экстрагировали простым диэтиловым эфиром. Органический слой промывали раствором бикарбоната натрия, затем водой и насыщенным раствором соли, наконец, органический слой сушили над сульфатом натрия и концентрировали, получая 1,3 г метилового эфира 4-бром-3-гидроксибензойный кислоты.
Стадия 22: Синтез метилового эфира 4-бром-3-изобутоксибензойной кислоты
Метиловый эфир 4-бром-3-гидроксибензойный кислоты (1,3 г, 0,005 моль) растворяли в 10 мл диметилформамида с последующим добавлением карбоната калия (1,7 г, 0,01 моль). Затем к реакционной смеси (1 г, 0,007 моль) добавляли изобутилбромид и реакционную смесь нагревали и перемешивали при 90°C в течение 10 ч. Реакционную смесь охлаждали до комнатной температуры и реакционную смесь фильтровали в вакууме, к фильтрату добавляли воду и экстрагировали этилацетатом (20 мл×3). Органический слой промывали водой, насыщенным раствором соли, сушили над сульфатом натрия и концентрировали, получая 1 г метилового эфира 4-бром-3-изобутоксибензойной кислоты в виде масла.
Молекулярная формула: C31H34N4O5S2
Молекулярная масса: 606.
1H ЯМР (ДМСО-d6): 0,812-0,82 (д, J=6,78 Гц, 6H), 1,47 (с, 3H), 1,79-1,82 (м, 1Н), 2,10 (с, 3H), 2,44 (с, 3H), 2,46 (с, 3H), 2,70 (с, 3H), 3,59-3,61 (д, J=6,4 Гц, 2H), 5,46 (с, 2H), 6,53-6,55 (д, J=8 Гц, 1Н), 6,71-6,74 (м, 2H), 7,00-7,04 (м, 2H), 7,22 (с, 2H), 8,19-8,21 (д, 1Н), 10,55 (ушир., 1Н).
Масс-спектр: (m-1) 605,1.
Пример 37
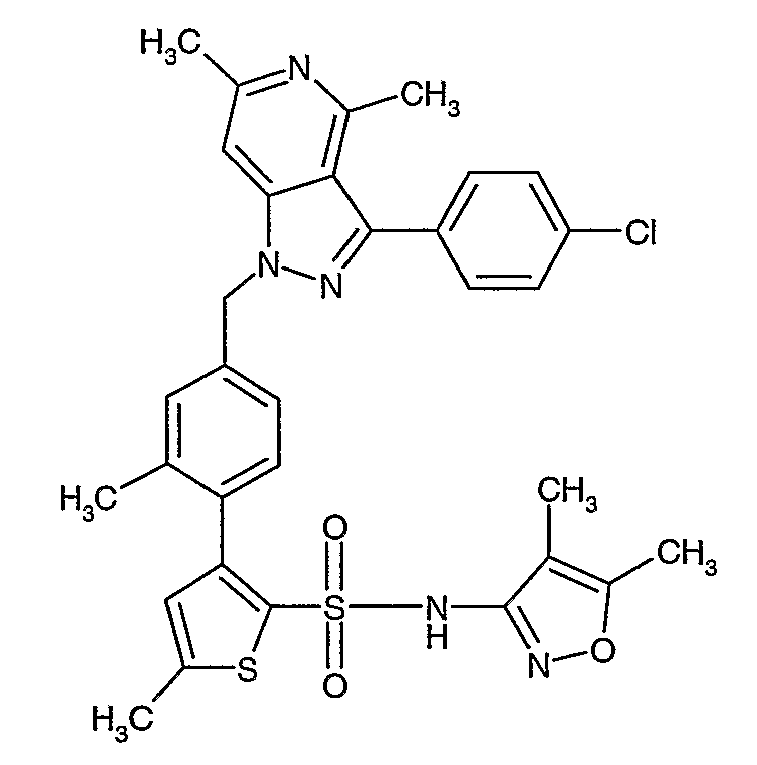
(4,5-Диметилизоксазол-3-ил)амид 3-{4-[3-(4-хлорфенил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона)
Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона) осуществляли согласно стадии 01 примера 28.
Стадия 02: Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила
Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила осуществляли согласно стадии 02 примера 28.
Стадия 03: Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима
Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима осуществляли согласно стадии 03 примера 28.
Стадия 04: Синтез 3-амино-4,5-диметилизоксазола
Синтез 3-амино-4,5-диметилизоксазола осуществляли согласно стадии 04 примера 28.
Стадия 05: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 06: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амид 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 07: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 08: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 13: Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты
Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты осуществляли согласно стадии 08 примера 19.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 19.
Стадия 15: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты
Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты осуществляли согласно стадии 10 примера 19.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-{4-[3-(4-хлорфенил)-4,6-диметилпиразоло[4,3-с]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 3-(4-хлорфенил)-4,6-диметил-1Н-пиразоло[4,3-c]пиридина (516 мг, 0,002 моль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (150 мг, 0,0031 моль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты (1,0 г, 0,002 моль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 24 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 1,6 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-{4-[3-(4-хлорфенил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)амида 3-{4-[3-(4-хлорфенил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-{4-[3-(4-хлорфенил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты (1,6 г) при комнатной температуре добавляли этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 200 мг (4,5-диметилизоксазол-3-ил)амида 3-{4-[3-(4-хлорфенил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты в виде белого твердого вещества.
Стадия 14: Синтез 1-(4-хлорфенил)бутан-1,3-диона
В 50 мл N,N-диметилформамида при 0°C добавляли гидрид натрия (60% в минеральном масле) (3,88 г, 0,097 моль) с последующим добавлением раствора сухого этилацетата (6,8 г, 0,07727 моль) и 4-хлорметилфенилкетона (10,0 г, 0,065 моль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь подкисляли 1 н. хлористоводородной кислотой и экстрагировали этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали, получая 13,0 г желтого твердого вещества, представляющего собой 1-(4-хлорфенил)бутан-1,3-дион.
Стадия 15: Синтез 3-амино-1-(4-хлорфенил)бут-2-ен-1-она
Смесь 1-(4-хлорфенил)бутан-1,3-диона (27,0 г, 0,136 моль) и ацетата аммония (31,6 г, 0,41 моль) в сухом метаноле (200 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали полностью в вакууме и к остатку добавляли охлажденную воду. Реакционную смесь подщелачивали до pH 8, используя насыщенный раствор бикарбоната натрия, с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали, получая 32,0 г 3-амино-1-(4-хлорфенил)бут-2-ен-1-она.
Стадия 16: Синтез 3-(4-хлорбензоил)-2,6-диметил-1Н-пиридин-4-она
Смесь 2,2,6-триметил[1,3]диоксин-4-она (11,56 г, 0,081 моль) и 3-амино-1-(4-хлорфенил)бут-2-ен-1-она (10,0 г, 0,059 моль) нагревали с обратным холодильником при 120°C в течение 6 ч. Реакционную смесь очищали хроматографией на колонке с силикагелем, элюируя желаемый продукт 10%-ным метанолом и этилацетатом, получая 3,1 г 3-(4-хлорбензоил)-2,6-диметил-1Н-пиридин-4-она.
Стадия 17: Синтез (4-хлор-2,6-диметилпиридин-3-ил)-(4-хлорфенил)метанона
3-(4-хлорбензоил)-2,6-диметил-1Н-пиридин-4-он (3,1 г, 0,012 моль) добавляли при 0°C к 20 мл оксихлорида фосфора. Перемешивали и нагревали реакционную смесь при 100°C и выдерживали в течение 8 часов. Осуществляли обработку, выпаривая оксихлорид фосфора в вакууме, и остаток подщелачивали до рН 8 насыщенным раствором карбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над безводным сульфатом натрия и концентрировали, получая 3,2 г (4-хлор-2,6-диметилпиридин-3-ил)-(4-хлорфенил)метанона.
Стадия 18: Синтез 3-(4-хлорфенил)-4,6-диметил-1Н-пиразоло[4,3-c]пиридина
(4-Хлор-2,6-диметилпиридин-3-ил)-(4-хлорфенил)метанон (3,4 г, 0,012 моль) помещали в этанол (10 мл), и к реакционной смеси добавляли гидразингидрат (5,8 мл, 0,185 моль) и две капли уксусной кислоты. Температуру медленно поднимали и смесь нагревали с обратным холодильником, поддерживая кипение в течение 6 часов. Реакционную смесь полностью упаривали в вакууме. Неочищенную массу помещали на лед, полученное твердое вещество отфильтровывали и сушили при отсасывании, получая 700 мг 3-(4-хлорфенил)-4,6-диметил-1Н-пиразоло[4,3-c]пиридина.
Молекулярная формула: C32H30ClN5O3S2
Молекулярная масса: 631,5.
1H ЯМР (ДМСО-d6): 1,45 (с, 3H), 1,93 (с, 3H), 2,11 (с, 3H), 2,47 (с, 3H), 2,49 (с, 3H), 2,54 (с, 3H), 5,63 (с, 2H), 6,68 (с, 1Н), 6,90-6,99 (м, 2H), 7,17 (с, 1Н), 7,51 (с, 1Н), 7,58-7,60 (д, J=8,4 Гц, 2H), 7,68-7,70 (д, J=8,4 Гц, 2H), 10,64 (ушир., 1Н).
Масс-спектр: (m-1) 630,1.
Пример 38
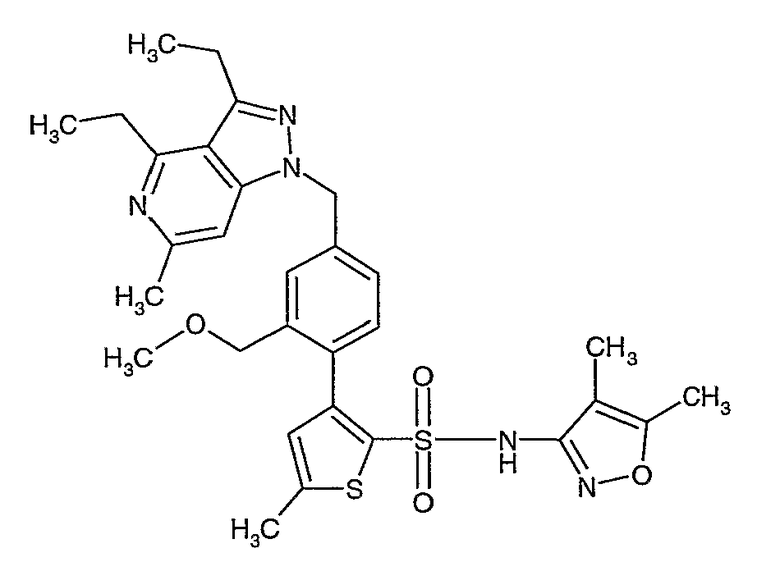
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(3,4-диэтил-6-метилпиразоло[4,3-c]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона)
Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона) осуществляли согласно стадии 01 примера 28.
Стадия 02: Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила
Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила осуществляли согласно стадии 02 примера 28.
Стадия 03: Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима
Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима осуществляли согласно стадии 03 примера 28.
Стадия 04: Синтез 3-амино-4,5-диметилизоксазола
Синтез 3-амино-4,5-диметилизоксазола осуществляли согласно стадии 04 примера 28.
Стадия 05: Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты
Синтез этилового эфира 4-бром-3-бромметилбензойной кислоты осуществляли согласно стадии 02 примера 01.
Стадия 06: Синтез этилового эфира 4-бром-3-метоксиметилбензойной кислоты
Синтез этилового эфира 4-бром-3-метоксиметилбензойной кислоты осуществляли согласно стадии 04 примера 20.
Стадия 07: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 08: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 10: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 11: Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензойной кислоты
Синтез этилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензойной кислоты осуществляли согласно стадии 15 примера 21.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-2-метоксиметил)амида 3-(2-этоксиметил-4-гидроксиметилфенил)-5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 16 примера 21.
Стадия 13: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты
Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты осуществляли согласно стадии 16 примера 21.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(3,4-диэтил-6-метилпиразоло[4,3-c]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 3,4-диэтил-6-метил-1Н-пиразоло[4,3-c]пиридина (536 мг, 2,8 ммоль) в диметилформамиде (10 мл) при 0°C в атмосфере азота добавляли порциями гидрид натрия (60% в минеральном масле) (204 мг, 4,2 ммоль). После добавления реакционную смесь нагревали до температуры окружающей среды и выдерживали в течение 30 мин. Реакционную смесь охлаждали до 0°C, к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метоксиметилбензилового эфира метансульфоновой кислоты (1,5 г, 2,8 ммоль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 16 ч. Смесь затем разбавляли этилацетатом (40 мл), затем 10 мл холодной воды. Органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 1,5 г неочищенного соединения. Неочищенное соединение очищали хроматографией на колонке на силикагеле, получая 1,0 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(3,4-диэтил-6-метилпиразоло[4,3-c]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 15: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(3,4-диэтил-6-метилпиразоло[4,3-с]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты
К 1,5 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(3,4-диэтил-6-метилпиразоло[4,3-c]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты при комнатной температуре добавляли 95%-ный этанол (10 мл) и 6 н. водный раствор хлористоводородной кислоты (8 мл). Реакционную смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали дихлорметаном (25 мл×3). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле, используя смесь гексан:этилацетат, получая 90 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(3,4-диэтил-6-метилпиразоло[4,3-c]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты.
Стадия 16: Синтез 5-аминогепт-4-ен-3-она
Смесь гептан-3,5-диона (8 г, 0,062 моль) и ацетата аммония (14,43 г, 0,187 моль) в сухом метаноле (50 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали полностью в вакууме и к остатку добавляли охлажденную воду. Реакционную смесь подщелачивали до pH 8, используя насыщенный раствор бикарбоната натрия, с последующей экстракцией этилацетатом (100 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над сульфатом натрия и упаривали, получая 6 г 5-аминогепт-4-ен-3-она.
Стадия 17: Синтез 2-этил-6-метил-3-пропионил-1Н-пиридин-4-она
Смесь 2,2,6-триметил[1,3]диоксин-4-она (13,4 г, 0,094 моль) и 5-аминогепт-4-ен-3-она (6 г, 0,047 моль) нагревали с обратным холодильником при 120°C в течение 6 ч. Реакционную смесь очищали хроматографией на колонке с силикагелем, элюируя желаемый продукт 10%-ным метанолом и этилацетатом, получая 3,9 г 2-этил-6-метил-3-пропионил-1Н-пиридин-4-она.
Стадия 18: Синтез 1-(4-хлор-2-этил-6-метилпиридин-3-ил)пропан-1-она
2-Этил-6-метил-3-пропионил-1Н-пиридин-4-он (3,9 г) добавляли при 0°C к 20 мл оксихлорида фосфора. Перемешивали и нагревали реакционную смесь при 100°C и выдерживали в течение 6 часов. Осуществляли обработку, упаривая оксихлорид фосфора в вакууме, и остаток подщелачивали до рН 8 насыщенным раствором карбоната натрия с последующей экстракцией метиленхлоридом (50 мл×2). Объединенные экстракты промывали водой и насыщенным раствором соли. Сушили над безводным сульфатом натрия и концентрировали, получая 2,95 г 1-(4-хлор-2-этил-6-метилпиридин-3-ил)пропан-1-она.
Стадия 19: Синтез 3,4-диэтил-6-метил-1Н-пиразоло[4,3-c]пиридина
1-(4-хлор-2-этил-6-метилпиридин-3-ил)пропан-1-он (2,95 г) помещали в этанол (20 мл) и к реакционной смеси добавляли гидразингидрат (6 мл) и две капли уксусной кислоты. Температуру медленно поднимали и нагревали смесь с обратным холодильником, поддерживая кипение в течение 6 часов. Реакционную смесь полностью упаривали в вакууме. Неочищенную массу выливали на лед, полученное твердое вещество отфильтровывали и сушили при отсасывании, получая 1,68 г 3,4-диэтил-6-метил-1Н-пиразоло[4,3-c]пиридина.
Молекулярная формула: C30H35N5O4S2
Молекулярная масса: 593.
1H ЯМР (ДМСО-d6): 1,29-1,36 (м, 6H), 1,49 (с, 3H), 2,14 (с, 3H), 2,48 (с, 3H), 2,54 (с, 3H), 3,07-3,13 (м, 5H), 4,03 (с, 2H), 5,59 (с, 2H), 6,70 (с, 1Н), 6,92-7,01 (м, 2H), 7,34 (с, 1Н), 7,48 (с, 1Н), 10,75 (ушир., 1Н).
Масс-спектр: (m-1) 592,2.
Пример 39
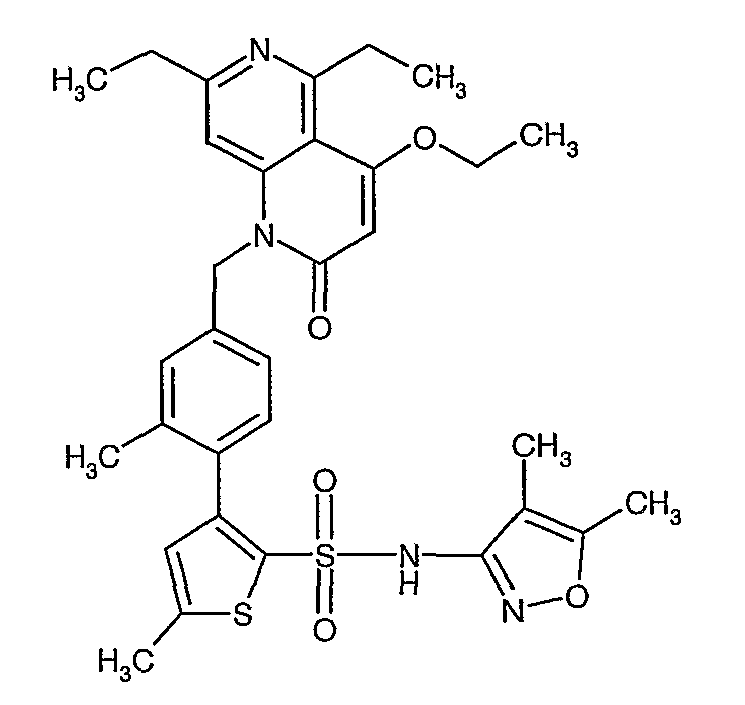
(4,5-Диметилизоксазол-3-ил)амид 3-[4-(4-этокси-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
Стадия 01: Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона)
Синтез натриевой соли 3-гидрокси-2-метилбут-2-еннитрила (натриевая соль 3-циано-2-бутанона) осуществляли согласно стадии 01 примера 28.
Стадия 02: Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила
Синтез 2,2-(2-метил[1,3]диоксолан-2-ил)пропионитрила осуществляли согласно стадии 02 примера 28.
Стадия 03: Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима
Синтез N-гидрокси-2-(2-метил[1,3]диоксолан-2-ил)пропионамидина или 2-(β-этилендиоксиацето)пропионамидоксима осуществляли согласно стадии 03 примера 28.
Стадия 04: Синтез 3-амино-4,5-диметилизоксазола
Синтез 3-амино-4,5-диметилизоксазола осуществляли согласно стадии 04 примера 28.
Стадия 07: Синтез 5-метилтиофен-2-сульфонилхлорида
Синтез 5-метилтиофен-2-сульфонилхлорида осуществляли согласно стадии 07 примера 01.
Стадия 08: Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 08 примера 01.
Стадия 09: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 01.
Стадия 10: Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида
Синтез 3-борон-N-(4,5-диметил-3-изоксазолил)-N-[(2-метоксиэтокси)метил]-5-метилтиофенсульфонамида осуществляли согласно стадии 10 примера 01.
Стадия 13: Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты
Синтез метилового эфира (4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензойной кислоты осуществляли согласно стадии 08 примера 19.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты
Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-(4-гидроксиметил-2-метилфенил)-5-метилтиофен-2-сульфоновой кислоты осуществляли согласно стадии 09 примера 19.
Стадия 15: Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил)-3-метилбензилового эфира метансульфоновой кислоты
Синтез 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты осуществляли согласно стадии 10 примера 19.
Стадия 12: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хлор-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору 4-хлор-5,7-диэтил-1H-[1,6]нафтиридин-2-она (0,5 г, 2,2 ммоль) в диметилформамиде (10 мл) при температуре окружающей среды в атмосфере азота добавляли карбонат калия (437 мг, 3,2 ммоль) и к реакционной смеси добавляли по каплям раствор 4-{2-[(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)сульфамоил]-5-метилтиофен-3-ил}-3-метилбензилового эфира метансульфоновой кислоты (1,17 г, 2 ммоль) в 10 мл диметилформамида и перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь затем фильтровали и остаток промывали этилацетатом (40 мл), объединенный органический слой промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и упаривали в вакууме, получая 1,2 г неочищенных веществ, которые очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 0,8 г (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хлор-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде вязкой маслянистой массы.
Стадия 13: Синтез (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-этокси-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
К перемешиваемому раствору (800 мг, 1,15 ммоль) (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хлор-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в 8 мл этанола при комнатной температуре добавляли этоксид натрия (120 мг, 1,7 ммоль). После завершения добавления реакционную смесь перемешивали и нагревали при 40°C в течение 1 часа. Затем реакционную смесь охлаждали до комнатной температуры и упаривали в вакууме. К остатку добавляли воду и доводили рН до 2 с помощью водного раствора хлористоводородной кислоты с последующей экстракцией этилацетатом (50 мл×2). Органический слой промывали водой и насыщенным раствором соли, наконец, сушили над сульфатом натрия и упаривали в вакууме, получая 700 мг (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амида 3-[4-(4-хтокси-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде масла.
Стадия 14: Синтез (4,5-диметилизоксазол-3-ил)амида 3-[4-(4-этокси-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты
К (4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амиду 3-[4-(4-этокси-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (0,3 г) при комнатной температуре добавляли этанол (5 мл) и 6 н. водный раствор хлористоводородной кислоты (3 мл). Реакционную смесь нагревали с обратным холодильником в течение 2 ч. Реакционную смесь концентрировали в вакууме, рН раствора доводили до pH 8 с использованием насыщенного раствора бикарбоната натрия и смесь экстрагировали этилацетатом (25 мл×2). Объединенный органический экстракт промывали водой и насыщенным раствором соли, затем сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на колонке с силикагелем, используя смесь гексан:этилацетат, получая 80 мг (4,5-диметилизоксазол-3-ил)амида 3-[4-(4-этокси-5,7-диэтил-2-оксо-2H-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты в виде коричневого твердого вещества.
Стадия 11: Синтез 3-аминометилпентаноата
Синтез 3-аминометилпентаноата осуществляли согласно стадии 11 примера 28.
Стадия 12: Синтез метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты
Синтез метилового эфира 2,6-диэтил-4-оксо-1,4-гидропиридин-3-карбоновой кислоты осуществляли согласно стадии 12 примера 28.
Стадия 13: Синтез метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты
Синтез метилового эфира 2,6-диэтил-4-(толуол-4-сульфониламино)никотиновой кислоты осуществляли согласно стадии 13 примера 28.
Стадия 14: Синтез метилового эфира 4-амино-2,6-диэтилникотиновой кислоты
Синтез метилового эфира 4-амино-2,6-диэтилникотиновой кислоты осуществляли согласно стадии 14 примера 28.
Стадия 19: Синтез этилового эфира 5,7-диэтил-4-гидрокси-2-оксо-1,2-дигидро[1,6]нафтиридин-3-карбоновой кислоты
Диэтилмалонат (15 мл, 0,093 моль) и метил-4-амино-2,6-диэтилпиридин-3-карбоксилат (19,0 г, 0,09 моль) добавляли к раствору этоксида натрия (7 г, 0,10 моль) в этаноле (60 мл), и реакционную смесь нагревали при 150°C и давлении 100 psi в течение 20 часов в автоклаве. Реакционной смеси давали охладиться, летучие вещества удаляли выпариванием и полученное полутвердое вещество растирали с простым эфиром, получая твердое вещество белого цвета, которое отделяли фильтрованием и растворяли в воде. Полученный раствор затем подкисляли 1 н. хлористоводородной кислотой, получая твердое вещество белого цвета, которое отфильтровывали и сушили при отсасывании, получая 11 г 5,7-диэтил-4-гидрокси-2-оксо-1,2-дигидро-1,6-нафтиридин-3-этилкарбоксилата в виде белого твердого вещества.
Стадия 20: Синтез 5,7-диэтил-4-гидрокси-1H-[1,6]нафтиридин-2-она
5,7-диэтил-4-гидрокси-2-оксо-1,2-дигидро-1,6-нафтиридин-3-этилкарбоксилат (11 г) растворяли в смеси воды (11 мл), 1,4-диоксана (22 мл) и концентрированной хлористоводородной кислоты (11 мл) и реакционную смесь нагревали с обратным холодильником в течение 3 часов. Реакционную смесь затем охлаждали, суспендированное твердое вещество отфильтровывали, промывали этанолом и простым эфиром и сушили при отсасывании, получая 4,3 г 5,7-диэтил-4-гидрокси-1,6-нафтиридин-2(1Н)-она в виде белого твердого вещества.
Стадия 21: Синтез 4-хлор-5,7-диэтил-1,6-нафтиридин-2(1Н)-она
4,3 г (0,019 моль) 5,7-диэтил-4-гидрокси-1,6-нафтиридин-2(1Н)-она растворяли в 22 мл оксихлорида фосфора и реакционную смесь нагревали с обратным холодильником в течение 24 часов. Реакционную смесь концентрировали, остаток растворяли в концентрированной хлористоводородной кислоте (16 мл) и 22 мл воды и нагревали с обратным холодильником в течение 4 часов. Реакционную смесь разбавляли водой и подщелачивали твердым бикарбонатом натрия. Полученное твердое вещество отделяли фильтрованием, промывали водой и сушили при отсасывании, получая 3,0 г 4-хлор-5,7-диэтил-1,6-нафтиридин-2(1Н)-она в виде твердого вещества оранжевого цвета.
Молекулярная формула: C32H36N4O5S2
Молекулярная масса: 620.
1H ЯМР (ДМСО-d6): 1,16-1,27 (м, 6H), 1,47-1,50 (м, 6H), 1,92 (с, 3H), 2,12 (с, 3H), 2,48 (с, 3H), 2,67-2,72 (кв., J=7,2 Гц, 2H), 3,20-3,26 (кв., J=7,2 Гц, 2H), 4,21-4,26 (кв., J=6,8 Гц, 2H), 5,46 (с, 2H), 6,10 (с, 1Н), 6,70 (с, 1Н), 6,84-6,91 (м, 2H), 7,11-7,16 (м, 2H), 10,26 (с, 1H).
Масс-спектр: (m-1) 619,2
Следующие соединения также могут быть получены с использованием методики, указанной на реакционной схеме I, II и III, как показано выше:
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диметил-2-оксо-2H-1,6-нафтиридин-1-илметил)фенил]-5-метил-фуран-2-сульфоновой кислоты (соединение 40),
(4-этил-5-метилизоксазол-3-ил)амид 5-метил-3-[4-(7-оксо-2-пропил-4,5,6,7-тетрагидробензимидазол-1-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 41),
3-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]бензил}-4-оксо-2-пропил-3,4-дигидрохиназолин-5-карбоновая кислота (соединение 42),
(4,5-диметилизоксазол-3-ил)амид 5-метил-3-[4-(3,4,5,7-тетраметил-2-оксо-2H-1,6-нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 43),
(4,5-диметилизоксазол-3-ил)амид 2[4-(4,5-диэтил-3,7-диметил-2-оксо-2H-1,6-нафтиридин-1-илметил)фенил]пиридин-3-сульфоновой кислоты (соединение 44),
2-бутил-5-хлор-3-{4-[5-(4,5-диметилизоксазол-3-илсульфамоил)-3-метилизоксазол-4-ил]бензил}-3H-имидазол-4-карбоновая кислота (соединение 45),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(2-метил-5,6,7,8-тетрагидрохинолин-4-илоксиметил)фенил]бензо[b]тиофен-2-сульфоновой кислоты (соединение 46),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)фенил]бензо[b]тиофен-2-сульфоновой кислоты (соединение 47),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диметил-2-оксо-2H-1,6-нафтиридин-1-илметил)фенил]-4,5,6,7-тетрагидробензо[b]тиофен-2-сульфоновой кислоты (соединение 48),
(4,5-диметилизоксазол-3-ил)амид 3-[2-хлор-4-(5,7-диметил-2-оксо-2H-1,6-нафтиридин-1-илметил)фенил]бензофуран-2-сульфоновой кислоты (соединение 49),
(4,5-диметилизоксазол-3-ил)амид 3-[2-хлор-4-(3,5-дипропил-1,2,4-триазол-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 50),
(5-метил-4-пропилизоксазол-3-ил)амид 3-{2-хлор-4-[5,7-диэтил-3-(5-метилтиофен-2-ил)-2-оксо-2Н-1,6-нафтиридин-1-илметилтиофен-2-сульфоновой кислоты (соединение 51),
(4,5-диметилизоксазол-3-ил)амид 4-[4-(2-этил-5,7-диметилимидазо[4,5-b]пиридин-3-илметил)фенил]-3-метилизоксазол-5-сульфоновой кислоты (соединение 52),
(4,5-диметилизоксазол-3-ил)амид 3-[2-хлор-4-(3-изобутил-6-метокси-2-метилхинолин-4-илоксиметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 53),
(4-бутил-5-метилизоксазол-3-ил)амид 3-[2-хлор-4-(4-оксо-2-пропил-1,3-диазаспиро[4,5]дец-1-ен-3-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 54),
(4,5-диметилизоксазол-3-ил)амид 3-[2-хлор-4-(5-фенил-2-пропил-2H-1,2,4-триазол-3-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 55),
(4,5-диметилизоксазол-3-ил)амид 4-метил-2-[4-(7-оксо-2-пропил-4,5,6,7-тетрагидробензимидазол-1-илметил)фенил]пиридин-3-сульфоновой кислоты (соединение 56),
(5-метокси-тиазоло[5,4-b]пиридин-2-ил)амид 3-[4-(5,7-диметил-2-оксо-2H-1,6-нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 57),
(2,4-диметоксипиримидин-5-ил)амид 2-[4-(5,7-диметил-2-оксо-2H-1,6-нафтиридин-1-илметил)фенил]пиридин-3-сульфоновой кислоты (соединение 58),
(2,4-диметоксипиримидин-5-ил)амид 3-{4-[4,6-диметил-3-(5-метилтиофен-2-ил)пиразоло[4,3-c]пиридин-1-илметил]фенил}тиофен-2-сульфоновой кислоты (соединение 59),
изоксазол-3-иламид 3-{4-[4,6-диметил-3-(5-метилтиофен-2-ил)пиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 60),
(5-этил-1,3,4-тиадиазол-2-ил)амид 3-[4-(6-метокси-2,3-диметилхинолин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты (соединение 61),
(1Н-тетразол-5-ил)амид 3-{4-[3-(3-хлорфенил)-5,7-диэтил-2-оксо-2H-1,6-нафтиридин-1-илметил]фенил}тиофен-2-сульфоновой кислоты (соединение 62),
(4,5-диметилизоксазол-3-ил)амид 3-{4-[4,6-диметил-3-(3-трифторметилфенил)пиразоло[4,3-c]пиридин-1-илметил]-2-гидроксифенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 63),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(4,6-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-(2-гидроксиэтил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 64),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(3-хлор-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-метоксифенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 65),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(3-1,3-бензодиоксол-5-ил-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-(2-метоксиэтокси)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 66),
(4,5-диметилизоксазол-3-ил)амид 3-[4-[4,6-диметил-3-(5-метилтиофен-2-ил)пиразоло[4,3-c]пиридин-1-илметил]-2-(2-оксопирролидин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 67),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(4,6-диметил-3-фенилпиразоло[4,3-c]пиридин-1-илметил)-2-(3,5-диметилпиразол-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 68),
(4,5-диметилизоксазол-3-ил)амид 3-{4-[3-(3-изобутоксифенил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-метоксифенил}-4,5-диметилтиофен-2-сульфоновой кислоты (соединение 69),
(4,5-диметилизоксазол-3-ил)амид 3-{4-[3-(3-хлорфенил)-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил]-2-этоксифенил}-5-этилтиофен-2-сульфоновой кислоты (соединение 70),
(4-хлор-5-метилизоксазол-3-ил)амид 3-{4-[4-(4-метоксифенил)-5,7-диметил-2-оксо-2H-1,6-нафтиридин-1-илметил]-2-пропоксифенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 71),
(4,5-диметилизоксазол-3-ил)амид 3-{4-[5,7-диметил-4-(4-метилпиперазин-1-ил)-2-оксо-2H-1,6-нафтиридин-1-илметил]-2-метоксифенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 72),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(3-метокси-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-(2-метоксиэтокси)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 73),
этиловый эфир 4-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]бензилокси}-6-метил-2-пропилникотиновой кислоты (соединение 74),
4-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]бензилокси}-6-метил-2-пропилникотиновая кислота (соединение 75),
метиловый эфир 3-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]бензил}-2-оксо-2,3-дигидро-1Н-бензимидазол-4-карбоновой кислоты (соединение 76),
(4,5-диметилизоксазол-3-ил)амид 3-[2-этоксиметил-4-(6-оксо-4-фенил-2-пропил-6H-пиримидин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 77),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(2,4-диметил-7-оксо-6,7-дигидро-5H-пиридо[2,3-d]пиримидин-8-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 78),
(4,5-диметилизоксазол-3-ил)амид 3-[2-этоксиметил-4-(4-этил-6-оксо-2-пропил-6h-пиримидин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 79),
(4,5-диметилизоксазол-3-ил)амид 3-{4-[(3-циано-5,7-диметил-1,6-нафтиридин-2-иламино)метил]фенил}тиофен-2-сульфоновой кислоты (соединение 80),
(4,5-диметилизоксазол-3-ил)амид 3-{4-[4,6-диметил-3-(5-метилтиофен-2-ил)пиразоло[4,3-c]пиридин-1-илметил]-2-этоксиметилфенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 81),
(4-изобутил-5-метилизоксазол-3-ил)амид 3-{2-хлор-4-[5,7-диэтил-3-(5-метилтиофен-2-ил)-2-оксо-2H-1,6-нафтиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 82),
этиловый эфир 4-{4-[2-(5-этил-4-метилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]бензилокси}-6-метил-2-пропилникотиновой кислоты (соединение 83),
(4,5-диметилизоксазол-3-ил)амид 3-{2,6-дихлор-4-[4,6-диметил-3-(5-метилтиофен-2-ил)пиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 84),
(4-этил-5-метилизоксазол-3-ил)амид 3-{2-хлор-4-[3-метил-6-тиофен-2-илметил-4-(3-трифторметилфенил)пиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 85),
(5-этил-4-метилизоксазол-3-ил)амид 3-[4-(6-циклопропилметил-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-пропилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 86),
(4,5-диметилизоксазол-3-ил)амид 3-(4-{6-[2-(3-хлорфенил)-этил]-3,4-диметилпиразоло[4,3-c]пиридин-1-илметил}-2 гидроксифенил)-5-метилтиофен-2-сульфоновой кислоты (соединение 87),
(4,5-диметилизоксазол-3-ил)амид 3-{2-(2-гидроксиэтил)-4-[3-метил-6-(4-метилбензил)-4-(5-метилтиофен-2-ил)пиразоло[4,3-c]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 88),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(4-циклопропилметил-6-изобутилпиразоло[4,3-c]пиридин-1-илметил)-2-метоксифенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 89),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(3-циклопропил-4,6-диметилпиразоло[4,3-c]пиридин-1-илметил)-2-фторфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 90),
(4,5-диметилизоксазол-3-ил)амид 3-[4-[4-(3-хлорфенил)-6-метил-3-трифторметилпиразоло[4,3-c]пиридин-1-илметил]-2-(2-метоксиэтокси)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 91),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(3-хлор-6-метил-4-пропилпиразоло[4,3-c]пиридин-1-илметил)-2-метилфенил]-4,5-диметилтиофен-2-сульфоновой кислоты (соединение 92),
(5-этил-4-метилизоксазол-3-ил)амид 3-{4-[3-(4-бутоксифенил)-6-метил-4-трифторметилпиразоло[4,3-c]пиридин-1-илметил]-2-хлор-фенил}-5-этилтиофен-2-сульфоновой кислоты (соединение 93),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(7-изобутил-2-оксо-5-фенил-2H-1,6-нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 94),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(7-бензил-2-оксо-5-пропил-2H-1,6-нафтиридин-1-илметил)-2-хлорфенил]-5-этилтиофен-2-сульфоновой кислоты (соединение 95),
(4,5-диметилизоксазол-3-ил)амид 3-{2,6-дихлор-4-[7-циклопропилметил-5-(5-метилтиофен-2-ил)-2-оксо-2H-1,6-нафтиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 96),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(4,5-диметил-2-оксо-7-тиофен-2-илметил-2H-1,6-нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 97),
(4,5-диметилизоксазол-3-ил)амид 3-[2-хлор-4-(7-этил-2-оксо-5-тиофен-2-илметил-2H-1,6-нафтиридин-4-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 98),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5-циклопропилметил-7-этил-2-оксо-2H-1,6-нафтиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 99),
(4,5-диметилизоксазол-3-ил)амид 3-[2-хлор-4-(7-циклопропилметил-2-оксо-4-o-толил-5-трифторметил-2H-1,6-нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 100),
(4,5-диметилизоксазол-3-ил)амид 3-{2-циклопропилметокси-4-[5,7-диметил-2-оксо-4-(пиридин-4-илокси)-2H-1,6-нафтиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 101),
(4,5-диметилизоксазол-3-ил)амид 3-[2-хлор-4-(5,7-диметил-2-оксо-3-пиридин-2-ил-2H-1,6-нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 102),
(4,5-диметилизоксазол-3-ил)амид 3-[2-хлор-4-(5,7-диэтил-4-метил-2-оксо-3-фенил-2H-1,6-нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 103),
(S)-2-({4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]-3-этоксиметилбензил}пентаноиламино)-3-метилмасляная кислота (соединение 104).
Модель скрининга для определения потенциала in vivo
Животные:
Самцов крыс SD (300-350 г) анестезировали смесью кетамин/ксилазин (или кетамин/диазепам). После трахеальной интубации крыс вентилировали комнатным воздухом в объеме 10 мл/кг массы тела и при частоте дыхания 70 вдохов/минута. Животных согревали посредством гомеотермической общей системы. Левую яремную вену канюлировали для внутривенного введения лекарственного средства, а правую бедренную артерию - для измерения системного кровяного давления и частоты сердечных сокращений. После стабилизации кровяного давления (приблизительно 15 минут) вводили атропин (0,4 мг/кг в/в) и мекамиламин (3 мг/кг в/в) для ингибирования автономных нервных рефлексов.
Эффективность в отношении рецепторов АТ1 у анестезированных крыс
Кровяное давление повышали приблизительно до 45 мм рт.ст. постоянной инфузией человеческого Ang-II (50 нг/кг/минута) в течение 2,5-3 часов. Чтобы заблокировать все рецепторы ЕТА, до начала инфузии Ang-II вводили селективный антагонист ЕТА (ZD1611, 1,5 мг/кг). Когда кровяное давление было стабилизировано, исследуемое соединение вводили инфузией в течение 30 минут при трех возрастающих скоростях введения лекарственного средства. Пробы крови отбирали в начале и в конце каждой скорости введения лекарственного средства для определения плазменной концентрации лекарственного средства. Аналогично, пробы крови отбирали с промежутками в течение 2 часов после окончания инфузии лекарственного средства. Число животных на каждое соединение составляло 6-8. Кровяное давление регистрировали в течение всего эксперимента. PK/PD-моделирование затем использовали для исследования фармакодинамики (то есть потенциала и эффективности in vivo), используя несвязанную плазменную концентрацию и данные в отношении эффекта (кровяное давление).
Потенциал в отношении рецепторов ЕТА у анестезированных крыс
Кровяное давление повышали постоянной инфузией человеческого big ЕТ-1 (0,05 нг/кг/минута) в течение 2,5-3 часов. Чтобы заблокировать все рецепторы АТ1, до начала инфузии big ЕТ-1 вводили Losartan. Когда кровяное давление было стабилизировано, исследуемое соединение вводили инфузией в течение 30 минут при трех возрастающих скоростях введения лекарственного средства. Пробы крови отбирали в ходе начала и конца каждой скорости введения лекарственного средства для определения плазменной концентрации. Аналогично, пробы крови отбирали с промежутками в течение 2 часов после окончания инфузии лекарственного средства. Число животных на каждое соединение составляло 6-8. Кровяное давление регистрировали в течение всего эксперимента. PK/PD-моделирование затем использовали для исследования фармакодинамики (то есть потенциала и эффективности in vivo), используя несвязанную плазменную концентрацию и данные в отношении эффекта (кровяное давление).
Фигура 1: Процент ингибирования вызванного ангиотензином II (Ang-II) и большим эндотелином 1 (bET 1) повышения кровяного давления у крыс SD соединением примера 15.
Модель скрининга для определения потенциала in vitro
Функциональный тест на АТ1
Клетки CHO, стабильно суперэкспрессирующие полноразмерный рецептор АТ1 человека, культивировали в DMEM (Gibco) с 10% FCS (Hyclone) и селекцию поддерживали, используя 0,5 мг/мл G418 (Gibco). Клетки при 70%-ном слиянии обрабатывали трипсином, повторно суспендировали в среде и подсчитывали. 20000 клеток/лунка высеивали в черные 384-луночные полистирольные планшеты с прозрачными основаниями и оставляли на 16 часов для прилипания. К клеткам добавляли краситель Flou-4 (TEFLABS, США) в HBSS (Gibco) в течение 1 часа, затем промывали в HBSS и к клеткам добавляли 0,6 мкл разбавленных соединений в диметилсульфоксиде в 30 мкл HBSS в жидкой системе обработки Multimek (Beckman, США). Клетки затем помещали во флуорометрический спектрофотометр для считывания планшетов (FLIPR, Molecular Devices, США) и добавляли 20 мкл пептида ангиотензин-II в качестве агониста (при EC80) в HBSS.
Выход Са наблюдали в течение 2 минут, и максимальную высоту пика измеряли в различных концентрациях соединения и выстраивали согласно уравнению
y=А+((B-A)/1+((C/x)^D))),
и высчитывали IC50, где
A означает плато основания кривой, то есть значение конечного минимума y,
B означает вершину плато кривой, то есть значение конечного максимума y,
C означает значение x в середине кривой. Оно представляет собой значение log EC50, когда А+B=100,
D означает угловой коэффициент, x означает изначально известные значения x, y означает изначально известные значения y.
Функциональный тест на ЕТА
Клетки CHO, стабильно суперэкспрессирующие полноразмерный рецептор ЕТА человека, культивировали в DMEM (Gibco) с 10% FCS (Hyclone) и селекцию поддерживали, используя 0,5 мг/мл G418 (Gibco). Клетки при 70%-ном слиянии обрабатывали трипсином, повторно суспендировали в среде и подсчитывали. 20000 клеток/лунка высеивали в черные 384-луночные полистирольные планшеты с прозрачными основаниями и оставляли на 16 часов для прилипания. К клеткам добавляли краситель Flou-4 (TEFLABS, США) в HBSS (Gibco) в течение 1 часа, затем промывали в HBSS и к клеткам добавляли 0,6 мкл разбавленных соединений в диметилсульфоксиде в 30 мкл HBSS в жидкой системе обработки Multimek (Beckman, США). Клетки затем помещали во флуорометрический спектрофотометр для считывания планшетов (FLIPR, Molecular Devices, США) и добавляли 20 мкл пептида эндотелин-1 в качестве агониста в HBSS (при EC80).
Выход Са наблюдали в течение 2 минут, и максимальную высоту пика измеряли в различных концентрациях соединения и выстраивали согласно уравнению
y=А+((B-A)/1+((C/x)^D))),
и высчитывали IC50, где
A означает плато основания кривой, то есть значение конечного минимума y,
B означает вершину плато кривой, то есть значение конечного максимума y,
C означает значение x в середине кривой. Оно представляет собой значение log EC50, когда А + B = 100,
D означает угловой коэффициент, x означает изначально известные значения x, y означает изначально известные значения y.
В целом потенциал соединений согласно настоящему изобретению составляет от 1 нМ до 10 мкМ для АТ1 и от 10 нМ до 50 мкМ для ЕТА: Примеры индивидуальных значений IC50 являются следующими:
Приведенные значения показывают, что баланс селективности между АТ1 vs. ЕТА является хорошим для соединений согласно настоящему изобретению, что является неожиданным относительно предшествующего уровня техники.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ С МЕДИЦИНСКИМИ ЭФФЕКТАМИ, ОБУСЛОВЛЕННЫМИ ВЗАИМОДЕЙСТВИЕМ С РЕЦЕПТОРОМ ГЛЮКОКОРТИКОИДОВ | 2006 |
|
RU2430086C2 |
| ПРОИЗВОДНЫЕ БЕНЗОТИАЗОЛА | 2001 |
|
RU2251419C2 |
| Пирроло[2,3-B]пиридиновые производные в качестве ингибиторов протеинкиназ | 2012 |
|
RU2629999C2 |
| НОВЫЕ ЛИГАНДЫ ЭСТРОГЕНОВЫХ РЕЦЕПТОРОВ | 2009 |
|
RU2492164C2 |
| ПИРРОЛО[2,3-b]ПИРИДИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2006 |
|
RU2565071C2 |
| СУЛЬФОНАМИДНЫЕ ПЕРИ-ЗАМЕЩЕННЫЕ БИЦИКЛЫ ДЛЯ ЛЕЧЕНИЯ ОККЛЮЗИОННОГО ПОРАЖЕНИЯ АРТЕРИЙ | 2005 |
|
RU2403240C2 |
| СОЕДИНЕНИЕ, АНТАГОНИСТ ЭНДОТЕЛИНОВОГО РЕЦЕПТОРА A И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2022 |
|
RU2831561C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-([1,3]ДИОКСОЛАН-4-ИЛМЕТИЛ)-1Н-ПИРАЗОЛ-3-ИЛАМИНА | 2013 |
|
RU2621725C2 |
| АГОНИСТЫ GLP-1 РЕЦЕПТОРА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2765721C1 |
| МОДУЛЯТОРЫ КИНАЗЫ, АССОЦИИРОВАННОЙ С РЕЦЕПТОРОМ ИНТЕРЛЕЙКИНА-1 | 2007 |
|
RU2459821C2 |
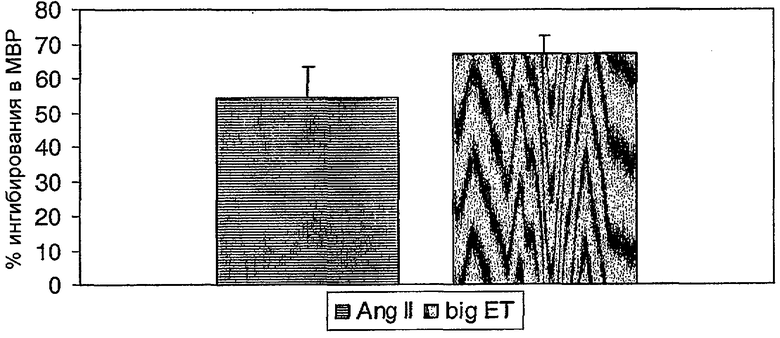
Настоящее изобретение относится к соединениям формулы
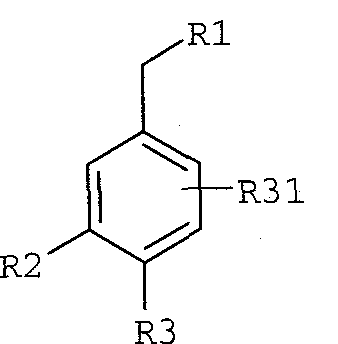
где R3 имеет любую из формул

где R1 выбран из
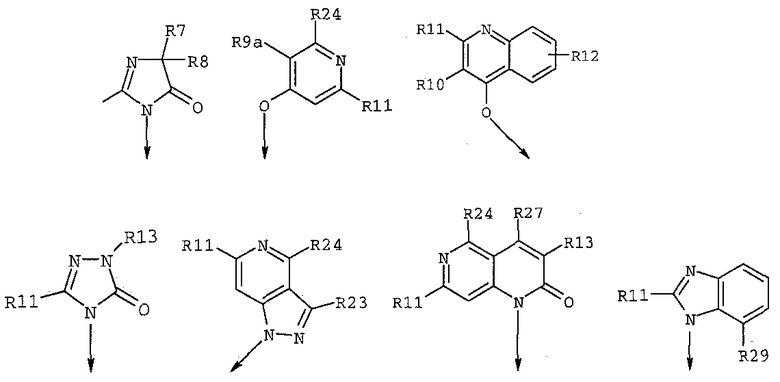
где R2, каждый независимо, означает водород, галоген, C1-C8алкил, С1-С8алкокси-С1-С8алкил, C1-С8алкокси; R4 означает пяти- или шестичленную моноциклическую кольцевую систему, имеющую два гетероатома, выбранных из О, N и S, такую как пиразинил, изоксазолил или тиазолил, каждый из которых может быть необязательно замещен одним или несколькими из следующих заместителей: С1-С8алкилом или С1-С8алкокси; R5 и R6 независимо означают водород или С1-С8алкил; R7 и R8 вместе образуют циклопентильное кольцо; R9 независимо означает С1-С8алкил; R9a независимо означает С1-С8алкилкарбонил или фенилкарбонил; R10 означает водород; R11 независимо означает С1-С8-алкил или С1-С8алкокси; R12 означает водород или -COOR17; R13 независимо означает водород, фенил и 6-членный гетероарил, содержащий один гетероатом, выбранный из N; R17 означает водород; R23 означает (а) С1-С8алкил, фенил, 5-членный гетероарил, содержащий 1-2 гетероатомов, выбранных из S, N, где любой фенильный и гетероарильный остатки необязательно замещены галогеном, С1-С8алкилом или С1-С8алкокси; R24 означает С1-С8алкил; R27 означает Н, C1-C8алкил, C1-C8алкокси, O-фенил, S-фенил; R29 означает -(CH2)w-COOR17, где w=0; R31 означает водород; и их фармацевтически приемлемым солям. Изобретение также относится к способу получения соединений изобретения, к фармацевтической композиции, обладающей свойствами антагонистов рецепторов двойного действия в отношении рецепторов AT1 и ЕТА, содержащей в качестве активного компонента соединение изобретения, к применению соединения для получения лекарственного средства, к способам лечения артериальной гипертензии. 7 н. и 1 з.п. ф-лы, 1 ил.
1. Соединение формулы
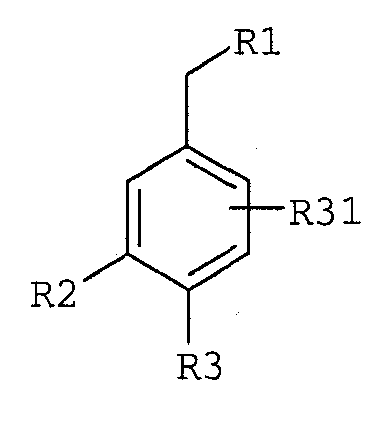
где R3 имеет любую из формул
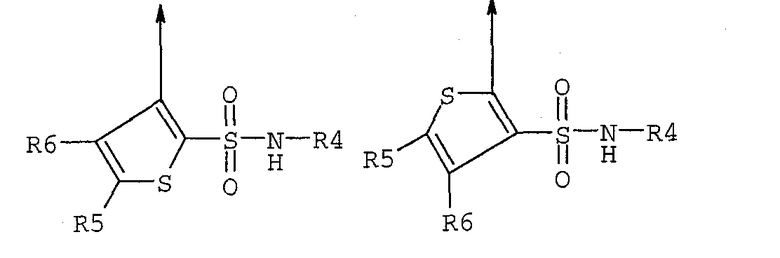
где R1 выбран из
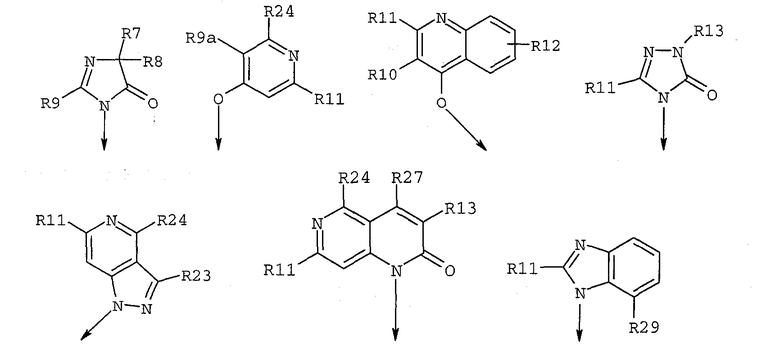
где
R2, каждый независимо, означает водород, галоген, С1-С8алкил, С1-С8алкокси-С1-С8алкил, C1-C8алкокси;
R4 означает пяти- или шестичленную моноциклическую кольцевую систему, имеющую два гетероатома, выбранных из О, N и S, такую как пиразинил, изоксазолил или тиазолил, каждый из которых может быть необязательно замещен одним или несколькими из следующих заместителей: С1-С8алкилом или С1-С8алкокси;
R5 и R6 независимо означают водород или С1-С8алкил;
R7 и R8 вместе образуют циклопентильное кольцо;
R9 независимо означает С1-С8алкил;
R9a независимо означает С1-С8алкилкарбонил или фенилкарбонил;
R10 означает водород;
R11 независимо означает C1-C8-алкил или С1-С8алкокси;
R12 означает водород или -COOR17;
R13 независимо означает водород, фенил и 6-членный гетероарил, содержащий один гетероатом, выбранный из N;
R17 означает водород;
R23 означает
(а) С1-С8алкил, фенил, 5-членный гетероарил, содержащий 1-2 гетероатомов, выбранных из S, N, где любой фенильный и гетероарильный остатки необязательно замещены галогеном, C1-С8алкилом или С1-С8алкокси;
R24 означает С1-С8алкил;
R27 означает Н, С1-С8алкил, С1-С8алкокси, O-фенил, S-фенил;
R29 означает -(CH2)w-COOR17; где w=0;
R31 означает водород;
включая его фармацевтически приемлемые соли.
2. Соединение по п.1, которое выбрано из группы соединений, включающей
(4,5-диметилизоксазол-3-ил)амид 3-[4-(2-бутил-4-оксо-13-диазаспиро[4.4]нон-1-ен-3-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 1),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-с]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 2),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-4-фенилсульфанил-2Н-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 3),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(3-бензоил-6-этил-2-метилпиридин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты (соединение 4),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 5),
(4,5-диметилизоксазол-3-ил)амид 3-[2-этоксиметил-4-(6-этил-3,4-диметилпиразоло[4,3-с]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 6),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 7),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-4-фенокси-2Н-[1,6]нафтиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 8),
(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-[2-этоксиметил-4-(6-этил-4-метил-3-фенилпиразоло[4,3-с]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 9),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(2-метилхинолин-4-илоксиметил)фенил]тиофен-2-сульфоновой кислоты (соединение 10),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 11),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(3-ацетил-2,6-диметилпиридин-4-илоксиметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 12),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(4,6-диметил-3-паратолилпиразоло[4,3-с]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 13),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)-2-этоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 14),
(4,5-диметилизоксазол-3-ил)амид 3-{4-[3-(3,5-диметилпиразол-1-илметил)-4,6-диметилпиразоло[4,3-с]пиридин-1-илметил]-2-этоксиметилфенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 15),
(4,5-диметоксиизоксазол-3-ил)амид 3-[2-метоксиметил-4-(4,5,7-триметил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 16),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(6-этил-3,4-диметилпиразоло[4,3-с]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 17),
(4,5-диметилизоксазол-3-ил)амид 3-(4,6-диметил-3-фенилпиразоло[4,3-с]пиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 18),
(4,5-диметилизоксазол-3-ил)-(2-метоксиэтоксиметил)амид 3-[4-(5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 19),
4-{4-[2-(4,5-диметилизоксазол-3-илсульфамоил)-5-метилтиофен-3-ил]-3-метоксиметилбензилокси}-2-этилхинолин-6-карбоновую кислоту (соединение 20),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(4,6-диметил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 21),
(4,5-диметилизоксазол-3-ил)амид 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 22),
(4,5-диметилизоксазол-3-ил)амид 3-{2-этоксиметил-4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-с]пиридин-1-илметил]фенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 23),
(4,5-диметилизоксазол-3-ил)амид 3-{4-[6-этил-3-(4-метоксифенил)-4-метилпиразоло[4,3-с]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 24),
(5-метилизоксазол-3-ил)амид 2-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-с]пиридин-1-илметил)фенил]-5-метилтиофен-3-сульфоновой кислоты (соединение 25),
3-{4-[2-(3,4-диметилизоксазол-5-илсульфамоил)-5-метилтиофен-3-ил]бензил}-2-этокси-3Н-бензимидазол-4-карбоновую кислоту (соединение 26),
(3,4-диметилизоксазол-5-ил)амид 3-[2-этоксиметил-4-(6-этил-4-метил-3-тиофен-2-илпиразоло[4,3-с]пиридин-1-илметил)фенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 27),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-пропилтиофен-2-сульфоновой кислоты (соединение 28),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диметил-2-оксо-3-фенил-2Н-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 29),
(3,4-диметилизоксазол-5-ил)амид 3-[4-(5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 30),
(4,5-диметилизоксазол-3-ил)амид 5-метил-3-[2-метил-4-(3-метил-5-оксо-1-фенил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 31),
(4,5-диметилизоксазол-3-ил)амид 5-метил-3-[2-метил-4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 32),
(4,5-диметилтиазол-2-ил)амид 3-[4-(5-оксо-3-пропил-1-пиридин-2-ил-1,5-дигидро[1,2,4]триазол-4-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 33),
изобутоксикарбамоил(3-метокси-5-метилпиразин-2-ил)амид 3-[4-(6-этил-4-метил-3-фенилпиразоло[4,3-с]пиридин-1-илметил)фенил]тиофен-2-сульфоновой кислоты (соединение 34),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)-2-фторфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 35),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(5,7-диметил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)-2-изобутоксифенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 36),
(4,5-диметилизоксазол-3-ил)амид 3-{4-[3-(4-хлорфенил)-4,6-диметилпиразоло[4,3-с]пиридин-1-илметил]-2-метилфенил}-5-метилтиофен-2-сульфоновой кислоты (соединение 37),
(4,5-диметилизоксазол-3-ил)амид 3-(4-(3,4-диэтил-6-метилпиразоло[4,3-с]пиридин-1-илметил)-2-метоксиметилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 38),
(4,5-диметилизоксазол-3-ил)амид 3-[4-(4-этокси-5,7-диэтил-2-оксо-2Н-[1,6]нафтиридин-1-илметил)-2-метилфенил]-5-метилтиофен-2-сульфоновой кислоты (соединение 39).
3. Способ получения соединения по п.1, включающий, по меньшей мере, одну из следующих стадий:
a) взаимодействие тиофена с сульфурилгалогенидом с получением тиенилсульфурилгалогенида,
b) взаимодействие тиенилсульфурилгалогенида с первичным амином с получением сульфонамида,
c) N-защиту сульфонамида с получением N-защищенного сульфонамида,
d) литиирование галогенированного или негалогенированного N-защищенного сульфонамидтиофена, последующее взаимодействие с соответствующим боратным производным с получением N-защищенного сульфонамида борной кислоты,
e) N-защищенный сульфонамид борной кислоты далее взаимодействует с галогензамещенным сложным алкиловым эфиром ароматической карбоновой кислоты или ароматическим альдегидом с получением арилтиенилового сложного эфира или альдегида,
f) восстановление арилтиенилового сложного эфира или альдегида с получением арилтиенилового спирта,
g) преобразование гидроксигруппы арилтиенилового спирта в арилтиенильное производное, имеющее уходящую группу,
h) взаимодействие арилтиенильного производного, имеющего уходящую группу, с нуклеофилом, и
i) удаление защитной группы от N-защищенного сульфонамида.
4. Фармацевтическая композиция, обладающая свойствами антагонистов рецепторов двойного действия в отношении рецепторов AT1 и ЕТА, содержащая в качестве активного компонента соединение по п.1, в смеси с фармацевтическим адъювантом, разбавителем или носителем.
5. Применение соединения по п.1 для получения лекарственного средства, обладающего свойствами антагонистов рецепторов двойного действия в отношении рецепторов AT1 и ЕТА.
6. Применение соединения по п.1, обладающего свойствами антагониста рецептора двойного действия рецепторов AT1 и ЕТА, для получения лекарственного средства для лечения артериальной гипертензии.
7. Способ лечения артериальной гипертензии путем введения млекопитающему эффективного количества соединения по п.1.
8. Способ лечения артериальной гипертензии путем введения млекопитающему эффективного количества антагониста рецептора двойного действия рецепторов AT1 и ЕТА, имеющего более высокое сродство к AT1, чем к ЕТА, представляющего собой соединение по п.1.
| Mark C | |||
| KOWALA et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| The journal of pharmacology and experimental therapeutics | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Natesan Murugesan et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2011-08-10—Публикация
2007-03-01—Подача