Штамм Bradyrhizobium japonicum 206 ВКПМ В-9505 предназначен для предпосевной инокуляции семян или предпосевного внесения в почву с целью обеспечения азотфиксирующего симбиоза растений сои и клубеньковых бактерий через образование клубеньков. Штамм выращивают либо традиционным жидкофазным методом, или методом твердофазной ферментации на высокодисперсных влагоемких ненабухающих минеральных носителях, содержащих растворы источников углерода, азота, минеральных солей и ростостимулирующих добавок.
Используется в виде водных суспензий с добавками пленкообразующих веществ для предпосевной инокуляции семян сои, или в виде водных суспензий, или же нейтральных сыпучих смесей для внесения в почву весной перед посевом сои в равномерно распределяемой дозе около 500·109 КОЕ/га.
Штамм вирулентен ко всем испытанным сортам сои, районированных в центрально-черноземных областях России и соседних с ним регионах. Обеспечивает повышение урожайности, масличности и содержания белка в соевом зерне. Относительные прибавки этих показателей за счет применения штамма лежат в пределах 15-40% в зависимости от условий применения.
Описание изобретения.
Изобретение относится к областям биотехнологии и сельскохозяйственной микробиологии и представляет собой новый штамм клубеньковых бактерий, специфичный для районированных сортов сои, обеспечивающий эффективный симбиоз растений сои с данным штаммом клубеньковых бактерий.
Симбиоз бобовых растений и клубеньковых бактерий известен с конца 19-го века [1 - стр.293, 2 - стр.454, 4 - стр.395-398]. Заключается он в том, что клубеньковые бактерии рода Rhizobium и Bradyrhizobium способны инфицировать молодые корни бобовых растений. Внедряясь в клетку корня, они стимулируют ее разрастание и размножаются в ней, питаясь углеводами, поступающими в клетку. При этом образуется надорганизменная симбиотическая система, в которой растение и клетки бактерий вместе синтезируют новое вещество, получившее название леггемоглобин, который накапливается в образовавшихся в месте инфицирования корневых клубеньках и выполняет тройную функцию: поставляет аэробным бактериям кислород и молекулярный азот, защищает азотфиксирующий аппарат бактерий (фермент нитрагиназу) от отравляющего действия кислорода и, таким образом, обеспечивает эффективную фиксацию и биотрансформацию молекулярного азота в формы, доступные для усваивания его как микроорганизмами, так и растением. При этом большая часть (до 90%) фиксированного атмосферного азота усваивается растением, а остальные - микроорганизмами. Бобовые растения способны усваивать азот и из почвы, но при наличии симбиоза с клубеньковыми бактериями урожай семян бобовых существенно выше на 10-40% чем на исходной, даже хорошо удобренной почве. Кроме того, растения и их семена, выросшие в симбиозе с клубеньковыми бактериями, содержат больше белка, что является важным показателем их качества. Особенно это важно для массовых зернобобовых культур, в частности для сои.
Со времен обнаружения и изучения симбиоза стало развиваться направление искусственной инокуляции бобовых растений клубеньковыми бактериями, выращиваемых в лабораторных и промышленных условиях [3 - стр.3-9]. При этом оказалось, что искусственная инокуляция обеспечивает повышение урожайности и качества бобовой продукции не только на почвах, не содержащих природных вирулентных культур клубеньковых бактерий, но также и на почвах, где такие бактерии имеются, и существует естественный симбиоз [1 - стр.294-298]. Это объясняется тем, что клубеньковые бактерии рода Rhizobium и Bradyrhizobium способны размножаться либо в корневых клубеньках бобовых растений, либо в искусственных условиях. В почве они способны только сохраниться некоторое время в подходящих локальных нишах. То есть, одним из факторов хозяйственной эффективности симбиоза является концентрация вирулентных видов клубеньковых бактерий в почве. Кроме этого в искусственных условиях могут быть селекционированы более вирулентные штаммы с повышенной азотфиксирующей активностью. Установлено, что для эффективного симбиоза требуется внесение в почву во время посева около 500 миллиардов вирулентных клеток клубеньковых бактерий на 1 га площади посева [3 - стр.7].
Установлено, что по вирулентности (способность инфицировать корни бобовых растений с образованием клубеньков), существует видовая специфичность бактерий родов Rhizobium и Bradyrhizobium, т.е. определенные виды бактерий рода Rhizobium образуют симбиоз с отдельными видами или с группой видов бобовых растений. В частности, для сои существует один симбионтный типовой вид Bradyrhizobium japonicum [4 - стр.396, 3 - стр.5]. Кроме этого, для сои существует сортовая специфичность штаммов Bradyrhizobium japonicum, т.е. существуют штаммы Bradyrhizobium japonicum, вирулентные только по отношению к определенным группам сортов сои. Довольно частым явлением бывает необходимость селекции новых штаммов Bradizhizobium japonicum к новым или районируемым сортам сои в связи с распространением выращивания этой культуры в новые для нее регионы. В частности, это имеет место для центрально-черноземной и центральной России, Белоруссии, Приволжских регионов, т.е. с распространением посевов сои с юга в более северные и северо-восточные регионы.
В настоящее время в мире выделено, отселекционировано и поддерживается в искусственных условиях множество штаммов клубеньковых бактерий для сои (роды: Rhizobium и Bradyrhizobium, вид - Bradyrhizobium japonicum); 3 - стр.7, Каталоги ВКМ и ВКПМ].
Некоторые из них опробованы на сортах сои центрально-черноземного региона, в частности в Белгородской области. Часть из них проявили вирулентность к местным и районированным сортам. Это явление и стало основой для селекции высокоэффективного штамма клубеньковых бактерий для сортов сои, районированных в Белгородской области, центральночерноземных областях, а так же целью настоящего изобретения.
Основой для селекции стала выделенная культура из найденных клубеньков на участке длительного культивирования сои опытного стационара Белгородской государственной сельхозакадемии (БГСХА) на сое «Белгородская-48» селекции БГСХА. Выделенная чистая культура была размножена на искусственной среде и снова использована для инокуляции сои «Белгородская-48», «Белгородская-6». В результате этой операции была отмечена достаточно высокая вирулентность на сорте «Белгородская-48» и некоторая небольшая вирулентность на сое «Белгородская-6». Клубеньковые бактерии, выделенные из клубеньков сои «Белгородская-6» были использованы для инокуляции сои «Белгородская-48», «Белгородская-6», «Ланцетная», «Глазастая», «Ясельда», «Армавирская» и др. При этом высокая вирулентность и эффективность наблюдалась на сортах «Белгородская-48» и «Белгородская-6», а на остальных сортах низкие и средние показатели. Выделение, размножение и последующая повторная инокуляция семян сои выделенными культурами повышали вирулентность и эффективность симбиоза штамма с материнским сортом «Белгородская-48» и другими сортами. Последующие этапы селекции сводились к отбору культуры клубеньковых бактерий из наиболее эффективных симбиозов исследованного ряда сортов сои и распространялись на другие сорта сои. Ускорению работ по этапам обеспечила модифицированная методика [3 - стр.437]. Модификация методики состояла в том, что в пробирки с агаризованной прозрачной средой помещали не просто семена сои, а их проростки, а инокуляцию проростков производили с помощью микропипетки разбавленной суспензией чистой культуры штамма после внедрения корешка приростка в агаризованную среду. Использовали следующий состав среды: MgSO4 - 0,1%, K2HPO4 - 0,1%, Са3(PO4)2 - 0,002%, FeSO4 - следы, агар - 1%. Прозрачная агаризованная среда позволяла оценить время появления клубеньков, их число и размеры в определенный период времени. Отобранные варианты сравнивали в опытах выращивания сои на почве в фитотроне в лабораторных условиях. Далее эффективность симбиозов оценивали в полевых условиях на полях первого посева сои и на полях длительного выращивания сои, где в почве уже обнаружено постоянное присутствие Bradyrhizobium japonicum.
Вирулентность штаммов оценивали по числу образовавшихся клубеньков в среднем на одно растение, а эффективность по среднему весу одного клубенька, приросту урожайности и содержанию белка в соевом зерне.
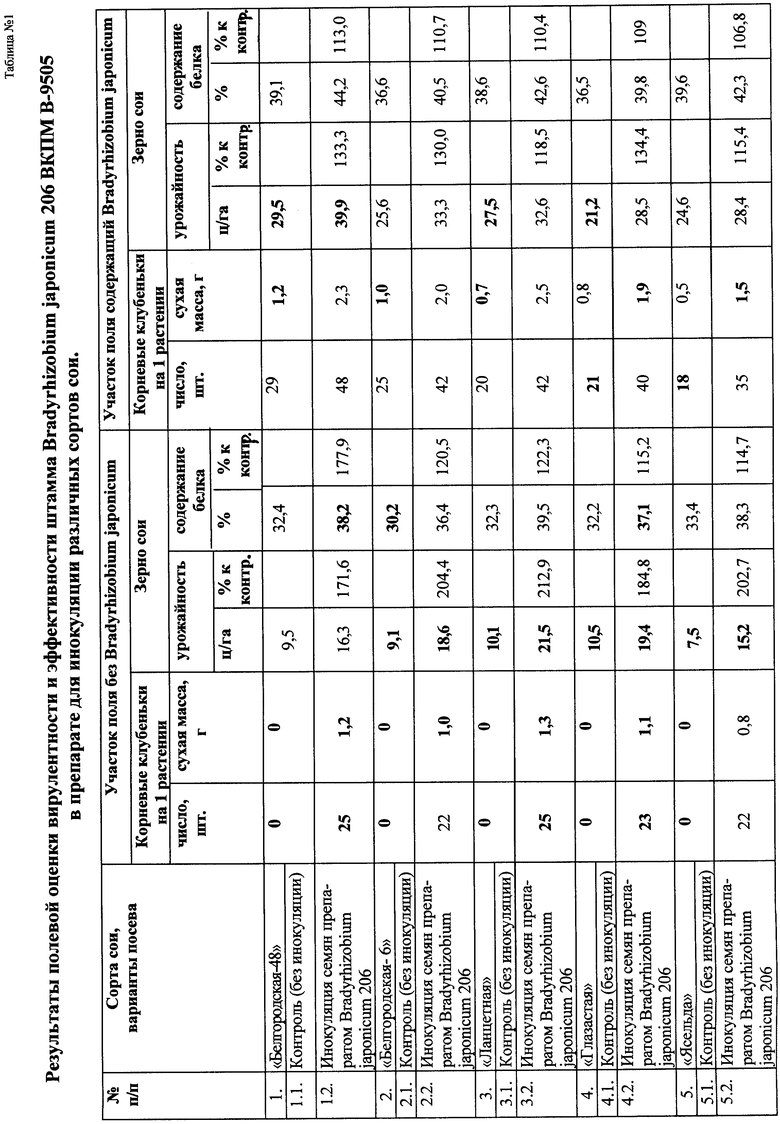
В качестве иллюстрации свойств выделенного и отселекционированного штамма приводим таблицу результатов полевых испытаний препарата на его основе в 2006 году (таблица 1).
О генетической устойчивости штамма свидетельствует неизменность показателей вирулентности и эффективности симбиоза с базовым сортом сои «Белгородская-48» при многочисленных пересевах культуры на маннитно-дрожжевых (DSM) и гороховых агаризованных средах как при посевах через жидкую суспензию, так и при непосредственных пересевах петлей.
Идентификацию штамма провели как по результатам вышеописанных операций (характерные свойства), так и по микроскопическим, биохимическим и физиологическим признакам в соответствии с определителем бактерий Берджи (Москва, «Мир», 1977 г., с.80-81).
Штамм оказался медленнорастущим и назван Bradyrhizobium japonicum 206. Этот штамм задепонирован в ВКПМ как Bradyrhizobium japonicum 206 ВКПМ В-9505.
Культурально-морфологические признаки.
Штамм Bradyrhizobium japonicum 206 - палочковидные прямые, изогнутые клетки. Грамотрицательные, спор не образуют.
Температура - (26-30)°С, рН=6-7.
Колонии округлые, полупрозрачные, беловатые, более или менее гранулированной консистенции, диаметром не более 0,5 мм через 5-7 суток инкубации на агаризованной среде с дрожжевым экстрактом, маннитолом и почвенным экстрактом. Рост на среде сопровождается образованием внеклеточной слизи полисахаридной природы.
Характерная особенность этих организмов - способность проникать в корневые волоски сои (сем. Glycine) сортов Белгородская-6, Белгородская-48, Ланцетная, Глазастая.
Физиологические признаки.
Штамм является аэробом, растет в температурном интервале 15-35°С, температурный оптимум 26-28°С при рН=6-7. Оптимум рН=7,0-7,2 (начало выращивания). Растет на богатых питательных средах на основе углеводов, экстрактов и автолизатов дрожжей.
Биохимические признаки.
Штамм является хемоорганотрофом.
В жидких средах усваивает Д-маннит, глюкозу, а также смеси этих углеводов с сахарозой, целлюлозу и крахмал не усваивает. Источники азота - соли аммиака, нитраты, аминокислоты. На МПА не растет. При росте на средах с углеводами выделяет слизь полисахаридной природы. При росте на жидкой среде ДSМ вызывает ее подщелачивание до рН=8, начиная со второго полупериода роста.
Характерное свойство (признак) - способность внедряться в корневые волоски сои (ряд сортов районированных в ЦЧР и близких по климатическим условиям регионах).
В зависимости от используемых составов жидких сред и условий культивирования в течение 96 часов получают культуральную жидкость (КЖ) с титром 108-1010 КОЕ/см3.
При выращивании на сыпучем твердофазном носителе (порошковая стерильная фракция влагоемкого нейтрального неорганического материала, наполненная жидкой питательной средой до влажности 70-75% и засеянная культурой) с исходным засевом 106-107 КОЕ/г после выдержки в термостате при температуре 28-30°С без перемешивания и дополнительной аэрации в течение семи суток получают готовый продукт с титром не ниже 8·109 КОЕ/г.
Среда хранения.
Тверная среда хранения ДSМ, содержащая Д-маннит, дрожжевой экстракт, почвенный экстракт засевается культурой и культивируется при температуре (26-28)°С в течение 5-7 суток, затем хранить в холодильнике.
Периодичность пересева - 1 раз в 3 месяца.
Изобретение поясняется следующими примерами.
Пример 1. Получение посевного материала и выращивание культуры на ДSМ-агаре.
Из пробирки хранения петлей в стерильных условиях культуру высевают штрихом на поверхность скошенного Д8М (или фасолевого) агара посевной пробирки и выращивают в термостате при температуре (26-28)°С в аэробных условиях в течение 5-7 суток. Выросший слой культуры смывают с поверхности питательной средой (состав: меласса, глюкоза, аммоний сернокислый, калий фосфорнокислый, магний сернокислый, марганец сернокислый, аммоний молибденовокислый) и сливают в посевную колбу. Объем смыва в посевной колбе доводят питательной средой до 100 мл и перемешивают на качалке при 190-220 об/мин. Получают 100 мл посевного материала с титром около 108 КОЕ/мл. Таким образом нарабатывают посевной материал в необходимом объеме для использования как для жидкофазного глубинного культивирования аэрацией, так и для твердофазного культивирования в воздухопроницаемых пакетах.
Пример 2. Жидкофазное культивирование в колбах.
В качалочные колбы (объемом 750 мл) помещают по 90 мл жидкой питательной среды, стерилизуют при 120-125°С в автоклаве, охлаждают и засевают под пламенем горелки 10 мл посевного материала, полученного в примере 1. Колбы устанавливают на качалке с частотой колебания 190-220 об/мин в термостируемой комнате при температуре 28-30°С и перемешивают непрерывно в течение 96 часов.
Получают культуральную жидкость с титром около 109 КОЕ/мл.
Пример 3. Жидкофазное культивирование в ферментере.
В ферментере «Биор-250» (объем емкости 200 л), снабженным мешалкой и воздушным аэратором барботажного типа, готовят 150 л питательной среды, проводят стерилизацию глухим паром (через стенку рубашки) при температуре 120-125°С, затем среду охлаждают и засевают 5 литрами посевного материала полученного в примере 1 или 2. Выращивание культуры проводят при температуре 28-30°С, барбатировании воздуха 0,5-1 объема на 1 объем среды при работающей мешалке с частотой 60 об/мин в течение 96 часов.
В конце процесса получают 150 л культуральной жидкости (КЖ) с титром около 109 КОЕ/мл.
Пример 4. Твердофазное выращивание.
200 г нейтрального влагоемкого, не набухающего минерального порошка загружают в пакет емкостью 2 л, герметично запаивают и стерилизуют в автоклаве при температуре 132°С в течение 60 минут. Затем в стерильных условиях в пакет со стерилизованным порошком вводят засеянную культурой жидкую среду, прокол заклеивают кусочком скотча или другого аналогичного материала. Путем вращения и разминания содержимого пакета производят его гомогенизацию, помещают пакет в воздушный термостат при температуре 28-30°С и выращивают культуру, периодически вентилируя воздушное пространство термостата в течение семи суток. Получают готовый препарат клубеньковых бактерий с титром не менее 8·109 КОЕ/г. Гектарная доза этого препарата при внесении в почву путем предпосевной обработки семян 80 г, что составляет 640 млрд. живых клеток на 1 га.
Пример 5. Оценка вирулентности штамма в лабораторных условиях.
Готовят среду, содержащую: MgSO4 - 0,1%, K2HPO4 - 0,1%, Са3(PO4)2 - 0,002%, FeSO4 - следы, агар - 1% и в горячем виде разливают ее в стеклянные пробирки по 15 мл. Через некоторое время при охлаждении в пробирках образуется агаровый гель.
Отбирают по 10 семен сои сортов:«Белгородская-48», «Белгородская-6», «Ланцетная», «Глазастая», «Ясельда». Семена тщательно моют водой, погружают на 3-4 секунды в этиловый спирт, затем на 10 минут в 0,1% раствор сулемы, снова тщательно омывают дистиллированной водой и помещают на салфетку, увлажненную дистиллированной водой в чашку Петри. Чашки Петри с семенами устанавливают в термостате с температурой 30°С, проращивают в течение 1,5-2 суток (до появления корешка размером 0,5-0,8 см).
Семена с проростками помещают на поверхность агарового геля в пробирки, вдавливая корешки вглубь геля и оставляя семена на поверхности, закрывают пробирки ватно-марлевыми пробками и в таком виде выдерживают при температуре 25-27°С трое суток до формирования корневой системы в прозрачном геле и стеблей с зачатками листьев над поверхностью. Затем на основе посевных материалов (пример 1,2) или культуральной жидкости (пример 3), или препарата (пример 4), готовят водную суспензию клеток клубеньковых бактерий с титром 10 КОЕ/мл и с помощью микропипетки вносят по 0,1 мл этих суспензий на корни растений в пробирках так, чтобы этот объем суспензии был впитан в образовавшиеся вокруг корня микротрещины в агаровом геле.
В контрольные пробирки таким же образом вносят дистиллированную воду. Пробирки устанавливают в фитотрон с освещением при температуре 25-27°С на подращивание растений. Через 7-9 суток с помощью лупы можно наблюдать образование клубеньков, которые на 21-е сутки после инокуляции хорошо видны невооруженным глазом и можно легко подсчитать их количество и оценить размеры с помощью, например, катетометра.
В контрольных пробирках клубеньки не образуются, а в пробирках с введением суспензии штамма в корневых системах вышеназванных сортов сои через 7 суток обнаруживали по 7-10 зачатков клубеньков, а через 20 суток - число корневых клубеньков обнаруживали от 15 до 20 штук с размерами 1-2 мм. В связи с неестественными условиями роста сои в последующее время число и размеры клубеньков существенно не увеличивалось.
Пример 6. Оценка вирулентности в фитотроне на сосудах с почвой.
В опыте использована почва (чернозем обыкновенный), не содержащая клубеньковых бактерий, вирулентных к сое, что установлено контрольными опытами с чистыми семенами сои.
2 кг почвы помещали в керамические сосуды, увлажняли до влажности 30% и засевали в них семена сои разных сортов, подготовленные и стерилизованные как в примере 5. В контрольных посевах семена сои не инокулировали, а обрабатывали дистиллированной водой в количестве 1% к весу семян. В опытных вариантах семена сои обрабатывали водными суспензиями штамма культуры Bradyrhizobium japonicum, содержащими 6·108 активных клеток в 1 мл. При этом использованы жидкие и сыпучие формы препарата, полученные как в примерах 1-4. Семена (4 семени на сосуд) высевали в сосуды с почвой на глубину 2 см и ставили в фитотрон на выращивание при температуре 20-25°С с интенсивным равномерным освещением в течение 12 часов и в течение остальных 12 часов в сутках - в темноте. После всходов в сосуде оставляли только одно лучшее по виду растение и продолжали его выращивание. Выращивание заканчивали через 7 суток после формирования первого тройчатого листа для каждого сорта сои. Почву с растением осторожно извлекали из сосудов, устанавливали на поддон и осторожно смывали почву струей воды. Проводили осмотр корневой системы, образовавшиеся корневые клубеньки собирали, считали и взвешивали. В селекционных опытах для последующих работ отбирали клубеньки из вариантов с наибольшим числом и массой этих образований.
Для отобранного штамма, таким образом, оценивали вирулентность и эффективность симбиоза штамма с различными сортами сои (эти работы продолжаются с целью оценки ограничений сортовой и регионально-климатической применимости штамма и возможности дальнейшей его селекции).
Пример 7. Оценка вирулентности и эффективности симбиоза препаратов на основе штамма в полевых условиях.
В полевых условиях (деляночные и производственные опыты) оценку вирулентности и эффективности штамма проводили в условиях, близких к сельскохозяйственным технологиям выращивания сои. Деляночные опыты проводили на полевом опытном стационаре БГСХА на участках с почвой с присутствием клубеньковых бактерий и на отдаленных участках, где посев сои производили впервые, а также на дачных делянках, где так же отсутствовали вирулентные к сое клубеньковые бактерии. Семена сои в опытах инокулировали рабочими растворами жидких и сыпучих препаратов в дозах, обеспечивающих содержание 500·109 живых клеток штамма в гектарной норме высева семян. Для исключения набухаемости семян и однородности обработки рабочий раствор составлялся таким образом, чтобы его объем (вес), содержащий гектарную дозу препарата, составлял около 1% от веса семян (вода для рабочих растворов не должна содержать дезинфицирующих веществ). Например, при гектарной норме высева семян 100 кг используется 1 л рабочего раствора, содержащего 200 мл жидкого или 80 г сыпучего препарата, содержащего культуру Bradyrhizobium japonicum 206 и 100 мл прилипателя (органоминеральный комплекс). Рабочий раствор подается малой струей или порциями на постоянно перемешиваемые семена во вращаемом наклоном сосуде, например вращающаяся бетономешалка, производится тщательное ворошение (пересыпание) наполовину наполненного семенами мешка с полиэтиленовым вкладышем или с использованием специальных устройств с дозатором, распылителем раствора и перемешиванием семян.
Инокуляцию и хранение обработанных семян проводят в местах, защищенных от прямых солнечных лучей и иного активного облучения, губительно действующего на микроорганизмы. Без дополнительной защиты от высыхания хранение обработанных семян допустимо в течение не более одних суток. Высев семян проводят одним из принятых способов (сплошной узкорядной, широкорядной или периодично-рядовой сев). В контрольных вариантах семена обрабатывали водой. В течение вегетационного периода вели фенологические наблюдения за посевами, контроль образования клубеньков, а после созревания - оценивали урожайность и качество (содержание белка) в соевых зернах. Результаты части проведенных опытов приведены в таблице 1.
Использованная литература.
1. Мишустин Е.Н. Микроорганизмы и продуктивность земледелия. М.: Наука, 1972 г.
2. Практикум по микробиологии под редакцией А.И.Нетрусова. М.: ACADEMA, 2005 г.
3. Методы культивирования азотфиксирующих бактерий, способы получения и применения препаратов на их основе (методические рекомендации). Составитель А.В.Хотянович. ВАСХНИЛ, ВНИИСХМ, Лен., 1991 г.
4. Шлегель Г. Общая микробиология (перевод с немецкого). М.: Мир, 1987 г.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ КЛУБЕНЬКОВЫХ БАКТЕРИЙ Bradyrhizobium japonicum ВКМ В-2455D ДЛЯ ИЗГОТОВЛЕНИЯ БАКТЕРИАЛЬНОГО УДОБРЕНИЯ ПОД СОЮ | 2009 |
|
RU2415925C1 |
| ШТАММ BRADYRHIZOBIUM DIAZOEFFICIENS CCM GS-4 (ВКПМ В-12660) - РИЗОБИАЛЬНЫЙ КОМПОНЕНТ МИКРОБНОГО БИОПРЕПАРАТА ДЛЯ ПРЕДПОСЕВНОЙ ОБРАБОТКИ СОИ | 2017 |
|
RU2654580C1 |
| Штамм Bradyrhizobium ottawaense, высокоэффективный микросимбионт сои, и микробный препарат на его основе для повышения продуктивности растений | 2022 |
|
RU2786571C1 |
| ШТАММ КЛУБЕНЬКОВЫХ БАКТЕРИЙ Bradyrhizobium japonicum 859 ДЛЯ ПОЛУЧЕНИЯ УДОБРЕНИЯ ПОД СОЮ | 2012 |
|
RU2487932C1 |
| ШТАММ КЛУБЕНЬКОВЫХ БАКТЕРИЙ Bradyrhizobium japonicum ВКМ В-2456D ДЛЯ ИЗГОТОВЛЕНИЯ БАКТЕРИАЛЬНОГО УДОБРЕНИЯ ПОД СОЮ | 2009 |
|
RU2413762C2 |
| Штамм клубеньковых бактерий ВRаDYRнIZовIUм Sp. (АSтRаGаLUS) для производства бактериального удобрения под астрагал | 1989 |
|
SU1699990A1 |
| ШТАММ КЛУБЕНЬКОВЫХ БАКТЕРИЙ Bradyrhizobium japonicum ДЛЯ ИЗГОТОВЛЕНИЯ БАКТЕРИАЛЬНОГО УДОБРЕНИЯ ПОД СОЮ | 2014 |
|
RU2568067C1 |
| Штамм бактерий ВRаDYRнIZовIUм Sp.(НеDYSаRUм) для получения бактериального удобрения под копеечник альпийский | 1989 |
|
SU1719387A1 |
| Штамм бактерий RнIZовIUм меLILотI для производства удобрения под пажитник | 1991 |
|
SU1806124A3 |
| Штамм клубеньковых бактерий ВRаDYRнIZовIUм Sp. (GLYcYRRIZa) для производства бактериального удобрения под солодку голую | 1988 |
|
SU1698242A1 |
Изобретение относится к биотехнилогии, в частности к штамму клубеньковых бактерий Bradyrhizobium japonicum 206 ВКПМ В-9505, вирулентному к районированным сортам сои. Штамм Bradyrhizobium japonicum 206 выделен из клубеньков сои Белгородская-48, районированной в Белгородской области, и отселекционирован методом перекрестного инокулирования с целью достижения вирулентности к другим различным сортам сои, культивируемым в Белгородской области и в других областях Центрально-Европейской части России. Штамм Bradyrhizobium japonicum 206 депонирован в ВКПМ под номером ВКПМ В- 9505 и обладает вирулентностью к сортам сои, культивируемым в России, в Украине и в Белоруссии. Полученный штамм предназначен для предпосевной инокуляции растений путем обработки семян или непосредственным введением в почву препаратов на основе штамма. Изобретение позволяет повысить урожайность и качество соевого зерна (масличность, содержание белка), выращиваемого на почвах, как не содержащих, так и содержащих вирулентные виды клубеньковых бактерий, интродуцируемых каким-либо образом ранее. 1 табл.
Штамм клубеньковых бактерий Bradyrhizobium japonicum 206 ВКПМ В-9505, вирулентный к районированным сортам сои.
| Штамм бактерий ВRаDYRнIZовIUм JароNIсUм для получения удобрения под сою | 1990 |
|
SU1824385A1 |
| БИОПРЕПАРАТ ДЛЯ ПОВЫШЕНИЯ УРОЖАЙНОСТИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР И УЛУЧШЕНИЯ КАЧЕСТВА ПРОДУКЦИИ | 2006 |
|
RU2322061C2 |
| ПРИБОР ДЛЯ ЮСТИРОВКИ ПОЛОЖЕНИЯ ЛИНЗЫ СТВОРНОГО ФОНАРЯ | 1941 |
|
SU69993A1 |
| Способ регулирования производительности насоса для перекачки жидкого переохлажденного кислорода | 1960 |
|
SU138492A1 |
Авторы
Даты
2011-08-20—Публикация
2009-03-27—Подача