Данная заявка испрашивает приоритет на основании находящейся на совместном рассмотрении предварительной заявки 60/661.030, поданной 14 марта 2005, раскрытие которой полностью включено в настоящую заявку посредством ссылки. Настоящее изобретение относится к улучшенным составам на основе тигециклина и способам получения данных составов. Составы согласно изобретению обладают повышенной стабильностью как в твердом состоянии, так и в виде раствора. Составы согласно изобретению содержат тигециклин, подходящий углевод и кислоту или буфер. Комбинация подходящего углевода и кислоты или буфера снижает разложение тигециклина, как объяснено ниже.
Настоящее изобретение имеет преимущества по сравнению с известным уровнем техники, обеспечивая стабильные составы на основе тигециклина и способы получения таких составов, которые обладают стабильностью по отношению к окислительному разложению и эпимеризации. Таким образом, эти составы являются более стабильными в растворенном, лиофилизированном, перерастворенном и/или разбавленном виде, чем составы на основе тигециклина, полученные способом, отличным от способа согласно изобретению.
Тигециклин представляет собой известный антибиотик семейства тетрациклина и является химическим аналогом миноциклина. Он может использоваться для лечения резистентных к лекарственным средствам бактерий, и, как было показано, эффективен в случаях, когда другие антибиотики не действуют. Например, он является активным против метициллин-резистентных Staphylococcus aureus, пенициллин-резистентных Streptococcus pneumoniae, ванкомицин-резистентных enterococci (D.J.Beidenbach et al., Diagnostic Microbiology and infectious Disease 40:173-177 (2001); H.W.Boucher et al., Antimicrobial Agents & Chemotherapy 442225-2229 (2000); P.A.Bradford Clin. Microbiat. Newsiett. 26: 163-168 (2004); D.Milatovic et al., Antimicrob. Agents Chemother. 47:400-404 (2003); R.Patel et al., Diagnostic Microbiotogy and infectious Disease 38:177-179 (2000); P.J.Petersen et al., Antimicrob. Agents Chemother. 46:2595-2601 (2002); и P.J.Petersen et al., Antimicrob. Agents Chemother. 43:738-744 (1999)) и против микроорганизмов, обладающих любой из двух основных форм резистентности к тетрациклину: за счет активного выведения антибиотика из клетки и защиты рибосомы (С.Betriu et al., Antimicrob. Agents Chemother. 48:323-325 (2004); Т.Hirata et al. Antimicrob. Agents Chemother. 48:2179-2184 (2004); и P.J.Petersen et al. Antimicrob. Agents Chemother. 43:738-744 (1999)).
Исторически тигециклин вводился внутривенно, так как, в общем случае, он показывает недостаточную биологическую доступность при пероральном введении. Внутривенные растворы в основном готовили непосредственно перед использованием, например введением пациенту, из лиофилизированных порошков, так как тигециклин разлагается в растворе главным образом путем окисления. Было бы предпочтительным, равно как и желательным, иметь состав тигециклина для внутривенного введения, который не требовал бы немедленного использования и мог бы оставаться стабильным в растворе в течение 24 часов.
Тигециклин в настоящее время производится в виде лиофилизированного порошка. Из-за склонности тигециклина к разложению данные порошки готовят в атмосфере, обедненной кислородом, и при низкой температуре для минимизации разложения. Подобные технологии являются дорогими, так как требуют специального оборудования и обработки.
Типичный процесс получения таких порошковых составов включает растворение тигециклина в воде (смешивание) и лиофилизацию (сушку сублимацией) раствора досуха с образованием твердых брикетов аморфного тигециклина. Эти брикеты затем помещают в атмосфере азота в закрытые пробками стеклянные флаконы и отправляют конечным потребителям, таким как больничные аптеки. Перед введением пациентам брикеты перерастворяют, часто в 0.9% физиологическом растворе, до концентрации, например, приблизительно 10 мг/мл. При этой концентрации в растворе тигециклин быстро разлагается и поэтому должен использоваться без промедления. Таким образом, эти перерастворенные осадки немедленно разбавляют (или смешивают) до приблизительно 1 мг/мл физиологическим раствором или другими фармацевтически приемлемыми растворителями в пакетах для внутривенного введения пациентам.
В таком разбавленном состоянии тигециклин готов к внутривенному введению пациенту. Однако при концентрации 1 мг/мл тигециклин должен использоваться в течение 6 ч после разбавления. Поскольку внутривенные вливания могут отнимать несколько часов, персонал больницы должен действовать так быстро, чтобы со времени смешения до времени введения дозы тигециклина пациенту прошло не более 6 ч. Было бы более предпочтительным обеспечить больничный персонал оперативностью и преимуществами, которые сопровождают более продолжительное время смешения и перерастворения так, чтобы, например, больничный фармацевт мог приготовить раствор за день до того, как он будет необходим для введения пациенту.
Такое малое время смешения и практически нулевое время перерастворения тигециклина имеют место вследствие того, что окисление тигециклина в растворе происходит относительно быстро. При настоящих условиях производства, хранении и введения самым распространенным путем разложения является окисление. Причиной, по которой окисление представляет собой самый распространенный путь разложения в предыдущих составах, является химическая структура тигециклина. Он содержит фенольную группу, а как известно из уровня техники органической химии, фенолы являются особенно склонными к окислению. Когда тигециклин растворен в воде до лиофилизации, рН является слабоосновным (приблизительно 7.8). Эта величина более высокая, чем рКа фенольной группы в тигециклине. Поэтому и в водных, и в физиологических растворах фенольная группа становится депротонированной и более склонной к реакции с кислородом, вследствие чего смешение тигециклина и лиофилизация осуществляются в атмосфере азота. Соответственно больничный персонал должен принимать меры по предотвращению не являющегося необходимым контакта с кислородом во время перерастворения и разбавления.
Если бы рН раствора тигециклина был меньше, чем рКа фенольной группы тигециклина, то окисление бы имело место, но в меньшей степени. В действительности наблюдалось, что окислительное разложение тигециклина действительно уменьшается, когда рН раствора снижен. При низком рН, однако, имеет место другой процесс разложения - эпимеризация. При более низких рН эпимеризация становится доминирующим путем разложения.
Тигециклин структурно отличается от своего эпимера только в одном отношении.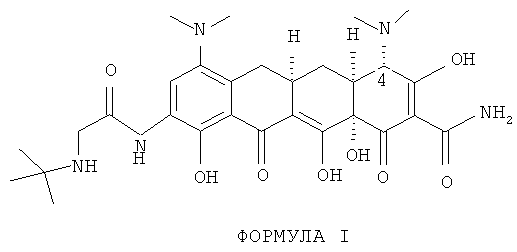
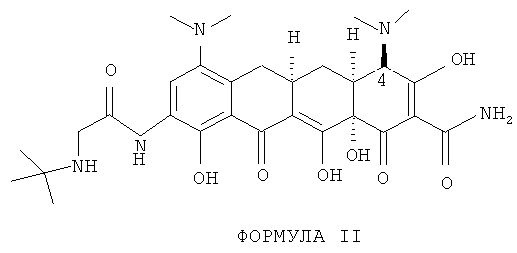
В тигециклине N-диметильная группа при углероде 4 находится в цис-положении по отношению к смежному водороду, как показано выше в Формуле I, тогда как в эпимере, Формула II, они находятся в транс-положении друг к другу, Хотя предполагают, что эпимер тигециклина является нетоксичным, он не обладает противобактериальной эффективностью тигециклина и потому является нежелательным продуктом разложения.
В лиофилизированном состоянии разложение тигециклина происходит по той же схеме, как и в растворе, но скорость разложения более низкая. Таким образом, когда тигециклин лиофилизирован в воде так, что рН составляет приблизительно 7.8, полученный лиофилизированный брикет демонстрирует окислительную деструкцию, хотя и с более низкой скоростью, чем в растворе. Аналогично, когда тигециклин лиофилизирован в кислом растворе, основным путем разложения является эпимеризация, которая протекает более медленно, чем в растворе.
Эпимеризация в основном представляет собой известный путь разложения в тетрациклинах, хотя скорость разложения может меняться в зависимости от тетрациклина. Скорость эпимеризации тигециклина является особенно высокой по сравнению с другими. В литературе, посвященной тетрациклинам, сообщается о нескольких способах, с помощью которых ученые пытались минимизировать образование эпимера в тетрациклинах. Согласно некоторым способам образование кальциевых, магниевых, цинковых или алюминиевыех солей с тетрациклинами, когда его осуществляют при основных рН в неводных растворах, ограничивает образование эпимера (Gordon. P.N., Stephens Jr., C.R., Noseworthy, M. M., Teare, F.W., U.K.Patent No. 901,107). В других способах (Tobkes, U.S. Patent No. 4,038,315) образование комплексного соединения с металлом осуществляют при кислых рН и затем получают стабильную твердую форму лекарственного средства.
Другие способы снижения образования эпимера включают поддержание рН во время обработки на уровне более чем приблизительно 6.0; избегание контакта с солями слабых кислот, такими как формиаты, ацетаты, фосфаты, или боронаты; избегание контакта с влагой, включая водные растворы. Относительно предохранения от влаги, Нозуорти и Шпигель (Noseworthy and Spiegel, U.S. Patent No. 3,026,248), и Нэш и Хегер (Nash and Haeger, U.S. Patent No. 3,219,529) предложили получение аналогов тетрациклина в неводных носителях для повышения стабильности лекарственного средства. Однако большинство носителей, включенных в эти изобретения, более подходят для местного, чем для парентерального применения. Также известно, что эпимеризация тетрациклина зависит от температуры, таким образом, производство и хранение тетрациклинов при низких температурах может также снизить скорость образования эпимера (Yuen, P.H., Sokoloski, Т.D., J. Pharm. Sci. 66: 1648-1650, 1977; Pawetczyk. E., Mattak. В. Pol. J. Pharmacol. Pharm. 34: 409-421, 1982). Несколько из этих способов были опробованы на примере тигециклина, но ни один не преуспел в снижении как образования эпимера, так и окислительного разложения без введения дополнительных деградантов. Было, например, обнаружено, что комплексообразование с металлами оказывает небольшой эффект как на образование эпимера, так и на разложение в общем случае, при основных рН.
Хотя использование фосфатного, ацетатного и цитратного буферов повышает стабильность в состоянии раствора, они, вероятно, ускоряют разложение тигециклина в лиофилизированном состоянии. Однако даже в отсутствие буфера эпимеризация представляет собой более серьезную проблему для тигециклина, чем для других тетрациклинов, таких как миноциклин.
Другие из перечисленных способов аналогично не снижали ни эпимеризацию, ни окислительное разложение. Хотя было обнаружено, что поддержание рН на уровне больше чем приблизительно 6.0 помогает уменьшить образование эпимера, но, как отмечено выше, такие условия приводят к большей чувствительности по отношению к кислороду. Относительно неводных носителей, несмотря на то, что вода, как известно, ускоряет разложение тигециклина, было бы непрактичным готовить медикамент для внутривенного введения, используя подобные носители.
В то время как было определено, что обработка при температурах ниже, чем комнатная температура, такой как ниже 10°С, снижает скорость разложения тигециклина, такая обработка является дорогой, и было бы предпочтительнее использовать состав, который не требовал бы дорогого охлаждения во время обработки.
Китайская заявка на патент CN 1390550A раскрывает, что миноциклин может быть скомбинирован с кислотой для повышения стабильности по отношению к окислительному разложению. Кроме того, раскрывается использование отвердителя, такого как маннитол. Данная ссылка ничего не сообщает о тигециклине, и при этом не предполагается, что углеводы могут использоваться для снижения как окисления, так и эпимеризации миноциклина в средах с низким рН. Действительно, миноциклин может быть введен в состав в виде соли гидрохлорида для продуктов для внутривенного введения без значительной эпимеризации. Однако в солях гидрохлорида тигециклина встречается значительная эпимеризация. Таким образом, миноциклин и тигециклин обладают различными свойствами эпимеризации.
В другом эксперименте миноциклин был лиофилизирован при рН приблизительно 5.0, и лиофилизированный брикет хранили в течение 20 дней при 40°С и относительной влажности 75%. По истечении 20 дней брикет проанализировали методом ВЭЖХ. Было получено, что эпимер миноциклина присутствовал на уровне 2.65 масс.%. В сравнительном эксперименте, когда был лиофилизирован тигециклин при рН приблизительно 5.0, и образец хранили в тех же условиях, но в течение лишь 4 дней, с последующим анализом образца методом ВЭЖХ, было получено, что эпимер тигециклина находился на уровне 5.40%, что вдвое больше даже при том, что тигециклин хранили 1/5 времени относительно миноциклина. Таким образом, тигециклин эпимеризуется с намного большей скоростью, чем миноциклин, и эпимеризация является намного более значительной проблемой для тигециклина, чем для миноциклина.
Настоящее изобретение ставит перед собой задачи по решению различных проблем и устранению недостатков технологии, известной из уровня техники, обеспечивая стабильные составы на основе тигециклина в твердом виде и виде раствора. Путем лиофилизации водного раствора, содержащего тигециклин и подходящий углевод при кислом рН, мы получили составы на основе тигециклина, которые были более устойчивы по сравнению с существующими составами по отношению, как к окислительному разложению, так и к эпимеризации. Поскольку рН был кислым, окислительное разложение было минимизировано. Кроме того, было обнаружено, что подходящие углеводы стабилизируют тигециклин по отношению к образованию эпимеров при кислых рН.
Составы согласно изобретению более устойчивы в лиофилизированном состоянии, чем существующие составы, и не требуют низкотемпературного или низкокислородного режима обработки. Такие составы, как ожидается, будут обладать большими временами стабильности при перерастворении и смешении, чем времена существующих составов. Например, в одном варианте реализации изобретения состав устойчив в течение 6 ч после перерастворения и устойчив в течение еще 18 ч после смешения. Такие увеличенные времена стабильности значительно облегчают использование тигециклина в больницах, обеспечивая необходимую оперативность больничного персонала при лечении пациентов.
Твердые составы согласно изобретению включают тигециклин, подходящий углевод, и кислоту или буфер.
Подходящие углеводы представляют собой углеводы, способные снижать образование эпимера по крайней мере в одной твердой форме, полученной по крайней мере при одном значении рН среды, по сравнению с твердой формой тигециклина, полученной в среде с таким же рН, в отсутствие подходящих углеводов. В одном варианте реализации величина рН среды находится в интервале от приблизительно 3.0 до приблизительно 7.0, таком как рН в пределах от приблизительно 4.0 до приблизительно 5.0, или от приблизительно 4.2 до приблизительно 4.8. В одном варианте реализации по меньшей мере одну твердую форму выбирают из порошков и лиофилизированных брикетов тигециклина. Примеры подходящих углеводов включают безводные, гидратированные, и сольватированные формы соединений, таких как лактоза, манноза, сахароза и глюкоза. Подходящие углеводы включают моно- и дисахариды, например моносахарид или дисахарид альдозы, предпочтительно дисахарид, такой как лактоза и сахароза. Лактоза является наиболее предпочтительной. Соответственно подходящие углеводы могут находиться в различных твердых формах. Например, лактоза включает различные твердые формы лактозы, такие как безводная лактоза, моногидрат лактозы или любая другая гидратированная или сольватированная форма лактозы. Лактоза и сахароза представляют собой дисахариды. Поэтому ожидают, что дисахариды как класс соединений будут работать в соответствии с изобретением.
Составы согласно изобретению включают растворы, такие как полученные до лиофилизации, содержащие тигециклин, подходящий углевод и кислоту или буфер. В некоторых вариантах реализации изобретения растворы могут храниться в течение нескольких часов до лиофилизации, чтобы обеспечить большую производственную гибкость. Кроме того, составы согласно изобретению включают лиофилизированные порошки или брикеты, содержащие тигециклин, подходящий углевод и кислоту или буфер.
В некоторых вариантах реализации изобретения используемый подходящий углевод является моногидратом лактозы, и мольное отношение тигециклина к моногидрату лактозы в лиофилизированном порошке или брикете составляет приблизительно от 1:0.2 до приблизительно 1:5. В некоторых вариантах реализации тигециклин находится в мольном отношении к моногидрату лактозы приблизительно от 1:1.6 до приблизительно 1:3.3.
Составы согласно изобретению также включают растворы, приготовленные из лиофилизированного порошка или брикета, например, путем перерастворения в физиологическом растворе или другом фармацевтически приемлемых растворителях. Составы согласно изобретению также включают растворы, полученные путем последующего разбавления перерастворенных растворов фармацевтически приемлемыми растворителями для использования в контейнерах для внутривенного введения.
Любой углевод, способный к снижению образования эпимера в изобретении, является подходящим углеводом, и данное изобретение не ограничено составами, использующими конкретно обозначенные углеводы.
Ожидается, что, например, производные сахара могут работать согласно изобретению, снижая образование эпимера. Таким образом, в тех случаях, когда производные сахара, такие как спирты сахаров, глюкозамины и алкильные сложные эфиры в чистом виде или в комбинации, снижают образование эпимера согласно изобретению, они являются подходящими углеводами. Аналогично, другие подходящие углеводы могут включать высшие сахариды, такие как полиозы; сложные углеводы, такие как гидроксиэтилкрахмал, декстран; и целлюлозу, такую как гидроксипропилметилцеллюлоза и гидроксипропилцеллюлоза. Далее ожидается, что комбинации углеводов, включая моносахариды и трисахариды, будут являтся подходящими углеводами и действовать, снижая образование эпимера согласно изобретению.
Кислоты и буферы согласно изобретению включают любую фармацевтически приемлемую кислоту или буфер, способный к изменению рН раствора тигециклин/подходящий углевод приблизительно от 3.0 до приблизительно 7.0, приблизительно от 4.0 до приблизительно 5.0 или приблизительно от 4.2 до приблизительно 4.8. Примеры таких кислот включают, но не ограничиваются ими, соляную кислоту, включая 1.0 н НСl, гентизиновую кислоту, молочную кислоту, лимонную кислоту, уксусную кислоту и фосфорную кислоту. Примеры подходящих буферов включают сукцинаты.
Соединения согласно изобретению могут быть получены с помощью большого количества приемлемых способов. Способы, описанные ниже, являются примерами и подразумевается, что они не ограничивают изобретение.
В одном способе согласно изобретению тигециклин растворяют в воде с образованием раствора. рН раствора далее понижают добавлением кислоты или буфера. Подходящий углевод затем растворяют в растворе, и раствор подвергают лиофилизации до сухого состояния с образованием лиофилизированного порошка или брикета.
Тигециклин может быть смешан с подходящим углеводом и растворен в воде. После того, как рН раствора доведен до кислого, раствор может быть подвергнут лиофилизации до сухого состояния с образованием лиофилизированного порошка или брикета.
Лиофилизация растворов согласно изобретению может быть проведена любыми фармацевтически приемлемыми способами. После лиофилизации составы согласно изобретению могут храниться в атмосфере инертного газа. такого как азот, чтобы далее замедлить процесс разложения, но, в отличие от существующих составов, содержащих тигециклин, такая обедненная кислородом атмосфера не является необходимой согласно изобретению.
Когда тигециклин скомбинирован с подходящим углеводом, может использоваться любая твердая форма тигециклина, которая достаточно растворима в воде. Такая твердая форма включает кристаллические полиморфы тигециклина, аморфные формы и соли.
В дополнение, при получении растворов тигециклина согласно изобретению для лиофилизации к водному раствору, содержащему тигециклин, добавляют кислоту или буфер в количестве достаточном, чтобы получить рН приблизительно от 3.0 и до приблизительно 7.0, включая приблизительно от 4.0 до приблизительно 5.0 и приблизительно от 4.2 до приблизительно 4.8.
Составы согласно изобретению могут быть приготовлены для использования в единичных дозировках. В данном варианте реализации растворы согласно изобретению подвергают лиофилизации в отдельных флаконах, таких как флаконы на 20 мл. После лиофилизации флаконы закрывают любыми фармацевтически приемлемыми пробками. Закрытые пробкой флаконы затем доставляют к месту использования.
В случае необходимости, содержимое флаконов может быть перерастворено путем добавления необходимого растворителя для достижения требуемой концентрации тигециклина. Концентрация перерастворенных растворов может быть легко определена рядовым специалистом в данной области. Может использоваться любой фармацевтически приемлемый растворитель. Примеры таких растворителей включают воду, физиологический раствор, такой как 0.9% солевой раствор, раствор Рингера с лактатом для инъекций и растворы декстрозы, включая 5%-ный раствор декстрозы (D5W).
Перерастворенные растворы согласно изобретению, в отличие от существующих составов, до разбавления могут храниться в перерастворенном состоянии. Смешение может осуществляться, например, в контейнере для внутривенного введения. Чтобы приготовить смесь, достаточное количество перерастворенного раствора смешивают в контейнере для внутривенного введения, содержащем фармацевтически приемлемый растворитель, такой как физиологический раствор или раствор декстрозы, такой как D5W. Концентрация перерастворенных растворов может быть легко определена рядовым специалистом в данной области. Время смешения для составов согласно изобретению может быть намного более длительным, чем время для существующих составов. После смешения раствор тигециклина готов к введению пациенту. Смесь может вводиться в чистом виде или вместе с другим фармацевтическим средством или составом.
Следующие шесть примеров поясняют различные варианты реализации изобретения и никоим образом не предназначены для ограничения изобретения. Каждый пример подробно описывает несколько экспериментов, где тигециклин с углеводом растворяли в водном кислом растворе, подвергали лиофилизации и проанализировали на продукты разложения методом ВЭЖХ. Условия ВЭЖХ для каждого примера по существу были одинаковыми. Таблицы, сопровождающие примеры, представляют результаты анализа ВЭЖХ, которые показывают продукты окислительного разложения, идентифицированные в таблицах по относительным временам удерживания (RRT) 0.50/MW 601 и RRT 0.55/MW 583, эпимер (RRT 0.74/MW 585), и общее количество тигециклина, находящегося в разных условиях (обозначенного в таблицах как "Тигециклин"). Во многих случаях, после того, как растворы подвергали лиофилизации, их помещали в условия ускоренного испытания стабильности при температуре 40°С и относительной влажности 75%. Данные условия являются промышленным стандартом, используемым для моделирования эффекта длительного хранения в нормальных условиях в течение срока годности.
В примере 1 растворы тигециклина, лактозы, и 1.0 н. НСl подвергали лиофилизации, и полученные брикеты помещали в камеры для исследования стабильности при температуре 40°С и относительной влажности 75% на 25 дней. По истечении 25 дней брикеты анализировали методом ВЭЖХ для идентификации продуктов разложения.
Подобный эксперимент подробно описан в Примере 2а. В нем лиофилизированные брикеты анализировали методом ВЭЖХ после хранения в течение 39 дней при температуре 40°С и относительной влажности 75%. Образцы брикетов двух экспериментов перерастворяли в D5W (5%-ная декстроза), и образцы от оставшихся брикетов перерастворяли в физиологическом растворе непосредственно перед анализом методом ВЭЖХ.
В эксперименте 2b после того, как лиофилизированные брикеты подвергали разложению в условиях, описанных в примере 2а, несколько брикетов перерастворяли в 0.9% физиологическом растворе, и растворы хранили в течение 6 ч. Другие брикеты перерастворяли в декстрозе. В конце 6-часового периода некоторые из этих образцов раствора, перечисленные в таблице 2b, анализировали методом ВЭЖХ.
Пример 2с иллюстрирует исследование стабильности в смешанных растворах. Перерастворенные растворы примера 2b выдерживали в течение 6 ч при концентрации приблизительно в 10 мг/мл, а затем их разбавляли до приблизительно 1 мг/мл, что является типичной концентрацией тигециклина для внутривенного введения, и их выдерживали в течение 18 ч, после чего был проведен анализ методом ВЭЖХ (таблица 2с).
В примере 3 использовали гентизиновую, а не соляную кислоту для снижения рН предварительно лиофилизированных растворов тигециклина. После лиофилизации брикеты подвергали разложению при температуре 40°С и относительной влажности 75% в течение 48 дней, затем анализировали методом ВЭЖХ.
Образцы примера 4 показывают влияние добавления лактозы или других углеводов на образование эпимера и восстановление тигециклина, при получении предварительно лиофилизированных растворов тигециклина. В каждом из примеров 4а, 4b и 4с указанные растворы готовили и подвергали лиофилизации. Каждый брикет подвергали разложению согласно параметрам, указанным в примерах 4а-4с, переводили в раствор и анализировали методом ВЭЖХ.
В примере 5 исследовали время выдержки, время между смешением и лиофилизацией и порядок смешения тигециклина и лактозы в качестве факторов, влияющих на образование эпимера и восстановление тигециклина. После лиофилизации брикетов их подвергали разложению при температуре 40°C и относительной влажности 75% в течение 48 дней, после чего проводили анализ методом ВЭЖХ. Обобщенные результаты анализов ВЭЖХ представлены в таблице 5.
Отношение концентраций лактозы и тигециклина было различным в экспериментах примера 6. При приготовлении растворов для лиофилизации изменяли отношение лактозы к тигециклину. Массовое отношение представлено в первой колонке таблицы 6. Растворы, каждый из которых имел рН приблизительно 5.0, затем подвергали лиофилизации до сухого состояния, и полученные брикеты подвергали разложению при температуре 40°C и относительной влажности 75% в течение 20 дней, после чего их анализировали методом ВЭЖХ.
Пример 1
Тигециклин (1880 мг) растворили в 75 мл воды Milli-Q с получением исходного раствора. Аликвоту данного исходного раствора, содержащую приблизительно 100 мг тигециклина, перенесли во флакон на 20 мл, содержащий 200 мг моногидрата лактозы. Другую аликвоту исходного раствора, содержащую приблизительно 100 мг тигециклина, поместили в пустой флакон на 20 мл. рН раствора не меняли ни в одном из этих двух растворов. Растворы затем подвергали лиофилизации до сухого состояния.
рН оставшегося исходного раствора понизили до приблизительно 6.0 добавлением 1.0 н. НСl. После доведения рН до приблизительно 6.0 аликвоту исходного раствора, содержащую приблизительно 100 мг тигециклина, перенесли во флакон на 20 мл, содержащий приблизительно 200 мг моногидрата лактозы и полученный раствор подвергли лиофилизации до сухого состояния. Оставшийся исходный раствор обработали 1.0 н. НСl до получения рН приблизительно 5.5, при этом значении 100 мг тигециклина из исходного раствора перенесли во флакон на 20 мл, содержащий 200 мг моногидрата лактозы. После растворения раствор подвергли лиофилизации до сухого состояния. Аналогично во флаконах на 20 мл получили образцы, содержащие растворы с приблизительно 100 мг тигециклина и приблизительно 200 мг лактозы, при величинах рН приблизительно 5.0 и приблизительно 4.5. Другой образец раствора приготовили при рН приблизительно 4.5 без лактозы. В каждом случае растворы впоследствии подвергали лиофилизации до сухого состояния. Лиофилизацию растворов осуществляли при заморозке до температуры минус 70°С с помощью сухого льда с ацетоном.
Лиофилизированные образцы помещали в камеру при температуре 40°С и относительной влажности 75% на 25 дней. Впоследствии образцы анализировали методом ВЭЖХ, и обобщенные данные результатов представлены ниже в таблице 1, которая показывает основные продукты разложения для каждого проанализированного брикета. Общая сумма 6 основных продуктов разложения, перечисленных в таблицах, не равна 100%, так как не все продукты разложения перечислены в таблице. Из 7 брикетов, проанализированных в примере 1, 5 представляли собой составы согласно изобретению, а первые два (содержащий только тигециклин без доведения рН и содержащий тигециклин и лактозу без доведения рН) являлись контрольными образцами.
Преимущества составов согласно изобретению будут очевидны из данного примера. Например, в составах, приготовленных без лактозы при рН приблизительно 4.5, было обнаружено только 74.70% тигециклина, тогда как эпимер присутствовал в количестве 23.51%. По сравнению с ними образцы, полученные при рН, равном 4.5, в присутствии лактозы, содержали эпимер в количестве лишь 2.53% и имели содержание тигециклина 97.17%.
0.74
Тигециклин + лактоза (без доведения рН)
рН 6.0 + лактоза
рН 5.5 + лактоза
рН 5.0 + лактоза
рН 4.5 (без лактозы)
рН 4.5 + лактоза
0.61
0.04
0.01
0.01
0.11
0.01
0.48
0.15
0.11
0.04
0.21
0.05
1.05
2.56
2.54
2.43
23.51
2.53
0.71
0.04
0.01
HO
0.14
НО
1.05
0.12
0.04
0.02
0.16
0.01
91.95
96.83
97.07
97.27
74.10
97.17
Пример 22а
Тигециклин (1700 мг) растворили в 85 мл воды Milli-Q с получением исходного раствора. Растворы, содержащие приблизительно 100 мг тигециклина и приблизительно 200 мг моногидрата лактозы, приготовили при величинах рН приблизительно 5.2, 5.0, 4.8 и 3.0 таким же образом, как готовили растворы, содержащие тигециклин/лактозу/НСl, в примере 1. Раствор тигециклина и лактозы при рН приблизительно 4.5 приготовили, добавляя 1.0 н. NaOH к исходному раствору с рН 3.0, с последующим растворением аликвоты исходного раствора, содержащего приблизительно 100 мг тигециклина, во флаконе на 20 мл, содержащем приблизительно 200 мг моногидрата лактозы. Все образцы подвергли лиофилизации (заморожены до температуры - 50°С с помощью сублимационных сушилок AdVantage/Virtis) до сухого состояния. Лиофилизированные образцы помещали в камеру при температуре 40°С и относительной влажности 75% на 39 дней, после чего их них отбирали меньшие образцы и анализировали методом ВЭЖХ. Данные представлены в таблице 2а.
2b. Через 39 дней лиофилизированные брикеты Примера 2а перерастворяли в 0.9% NaCl до концентрации 10 мг/мл тигециклина и хранили при комнатной температуре в течение 6 ч. Отдельные аликвоты растворов при рН приблизительно 5.0 и приблизительно 4.5 перерастворяли в 5% растворе декстрозы вместо физиологического раствора до концентрации приблизительно 10 мг/мл, и их хранили при комнатной температуре в течение 6 ч. Каждый из растворов затем анализировали методом ВЭЖХ, и результаты представлены в Таблице 2b.
Данные показывают, что составы согласно изобретению защищены от образования эпимера в перерастворенных растворах в течение 6 ч. Действительно, максимальное содержание эпимера в любом из этих примеров составляло только 2.45%, тогда как минимальное содержание тигециклина составляло 97.1%. В одном варианте реализации, когда рН составлял приблизительно 4.5, а в качестве растворителя использовался физиологический раствор, по истечении 6-часового периода после перерастворения присутствовало только 1.60% эпимера. В этом варианте реализации измеренное количество тигециклина составляло 98.15%, что в некоторых приложениях может представлять достаточную чистоту для использования в больничных условиях.
2с. Смешанные растворы тигециклина (1 мг/мл) были приготовлены путем разбавления перерастворенных растворов (пример 2b) в 0.9% NaCl или 5% декстрозе, в зависимости от того, какой растворитель использовался для перерастворения. Растворы затем хранили при комнатной температуре в течение 18 ч и анализировали методом ВЭЖХ. Результаты представленны в Таблице 2с.
Образец, полученный при рН приблизительно 4.5 с лактозой и без декстрозы, показал увеличение концентрации эпимера с 1.60% только до 1.80 % в промежутке времени между перерастворением и смешением, тогда как полное содержание тигециклина уменьшилось в этом образце лишь незначительно, от 98.15% до 97.97%. Данные, полученные для образца при рН 4.5, показывают, что образец является достаточно стабильным после хранения лиофилизированного брикета в условиях ускоренного разложения в течение 39 дней с последующими перерастворением в течение 6 ч и смешением в течение 18 ч.
0.74
рН 5.0 + лактоза
рН 5.0 + лактоза в 5% растворе декстрозы
рН 4.8 + лактоза
рН 4.5 + лактоза
рН 4.5 + лактоза в 5% растворе декстрозы
рН 3.0 + лактоза
0.01
0.01
0.01
0.01
0.01
0.01
0.07
0.08
0.02
0.03
0.02
0.02
2.20
2.21
2.15
1.37
1.35
1.34
НО
НО
НО
НО
НО
НО
0.01
0.01
HO
0.01
HO
НО
97.57
97.38
97.63
98.42
98.23
98.49
рН 5.0 + лактоза
рН 5.0 + лактоза в 5% растворе декстрозы
рН 4.8 + лактоза
рН 4.5 + лактоза
рН 4.5 + лактоза в 5% растворе декстрозы
рН 3.0 + лактоза
0.01
0.01
0.01
0.01
0.01
0.01
0.10
0.10
0.09
0.09
0.08
0.06
2.37
2.45
2.32
1.60
1.65
2.10
HO
0.01
HO
0.01
HO
НО
0.03
0.03
0.02
0.02
0.01
HO
97.33
97.10
97.41
98.15
97.96
97.70
Пример 3
Тигециклин (700 мг) растворили в 28 мл воды Milli-Q с получением исходного раствора. Аликвоту исходного раствора, содержащую приблизительно 100 мг тигециклина, перенесли во флакон на 20 мл в качестве контрольного образца. Образцы раствора тигециклина, лактозы и кислоты приготовили при рН приблизительно 5.8, 5.1 и 4.5 согласно способам примера 1 за исключением того, что использовали гентизиновую кислоту, а не 1.0 н. НСl для снижения рН исходного раствора. Приготовили дополнительные образцы растворов тигециклина без лактозы, один с рН приблизительно 5.1 и другой - с рН приблизительно 4.5. Все растворы заморозили до температуры минус 70°С (сухой лед с ацетоном) и подвергли лиофилизации до сухого состояния. Лиофилизированные образцы помещали в камеру при температуре 40°С и относительной влажности 75% на 48 дней, после чего анализировали методом ВЭЖХ. Данные сведены в Таблицу 3 и показывают, что данный состав работает согласно изобретению со снижением разложения.
Пример 4
4а. Тигециклин (1600 мг) растворили в 64 мл воды Milli-Q с получением исходного раствора, и два образца из раствора, каждая содержит приблизительно 100 мг тигециклина, поместили в два отдельных флакона на 20 мл, содержащие 160 мг моногидрата лактозы и 160 мг маннитола соответственно. Третий образец, содержащий приблизительно 100 мг тигециклина из исходного раствора, поместили в чистый флакон на 20 мл. рН остатка исходного раствора последовательно довели с помощью 1.0 н. HCl до приблизительно 7.0, 6.5 и 6.0, согласно методу, описанному в примере 1. Растворы образцов, каждый содержит приблизительно 100 мг тигециклина, поместили во флаконы на 20 мл, содержащие 160 мг моногидрата лактозы, 160 мг маннитола или без лактозы или маннитола при каждом значении рН. Полученные растворы подвергли лиофилизации (заморожены до температуры -70°С, сухой лед с ацетоном) до сухого состояния. Лиофилизированные образцы поместили в сушильный шкаф при температуре 40°С на 70 ч, а затем анализировали методом ВЭЖХ. Данные сведены в таблицу 4а.
4b. Тигециклин (1800 мг) растворили в 72 мл воды Milli-Q с получением исходного раствора. Аликвоты исходного раствора, содержащие приблизительно 100 мг тигециклина, поместили в три отдельных флакона на 20 мл, содержащих по приблизительно 200 мг моногидрата лактозы, фруктозы и сахарозы соответственно. рН исходного раствора последовательно довели с помощью 1.0 н. НСl до приблизительно 6.0 и 5.4, согласно методу, описанному в примере 1. При каждом значении рН аликвоты раствора, содержащие приблизительно 100 мг тигециклина, поместили во флаконы на 20 мл, содержащие по 200 мг одного из следующих углеводов: моногидрат лактозы, фруктоза или сахароза, и растворили. При каждом значении рН также приготовили растворы без углеводов. Растворы подвергли лиофилизации (заморожены до температуры -70°С, сухой лед с ацетоном) до сухого состояния. Лиофилизированные образцы поместили в сушильный шкаф при температуре 40°С на 89 ч и анализировали методом ВЭЖХ. Результаты сведены в Таблицу 4b.
4с. Тигециклин (1000 мг) растворили в 50 мл воды Milli-Q с получением исходного раствора. рН исходного раствора довели с помощью 1.0 н. HCl до приблизительно 5.0. Четыре аликвоты исходного раствора, каждая содержит приблизительно 100 мг тигециклина, поместили во флаконы на 20 мл, содержащие приблизительно 200 мг глюкозы, маннозы, рибозы и ксилозы соответственно, и растворили. Пятую аликвоту исходного раствора, содержащую приблизительно 100 мг тигециклина, поместили во флакон на 20 мл, содержащий приблизительно 125 мг треозы, и растворили. Все пять растворов подвергли лиофилизации (заморожены до температуры - 50°С с помощью сублимационных сушилок AdVantage/Virtis) до сухого состояния. Лиофилизированные образцы поместили в камеру при температуре 25°С и относительной влажности 60% на 42 дня и затем анализировали методом ВЭЖХ. Результаты сведены в таблицу 4с. Данные в таблицах 4а-4с предназначены для иллюстрирования влияния подходящих углеводов, таких как лактоза, на изобретение.
Пример 5
5а. Тигециклин (1000 мг) растворили в 40 мл воды Milli-Q с получением исходного раствора. рН фактор исходного раствора довели с помощью 1.0 н. НСl до приблизительно 5.0. При этом рН две аликвоты исходного раствора, каждая содержит 100 мг тигециклина, поместили отдельно в два флакона на 20 мл, каждый содержит приблизительно 200 мг моногидрата лактозы. Один образец немедленно заморозили до температуры -70°С (сухой лед с ацетоном), а другой образец перед заморозкой хранили при комнатной температуре в течение 5 ч. Замороженные образцы затем подвергли лиофилизации до сухого состояния. Лиофилизированные образцы поместили в камеру при температуре 40°С и относительной влажности 75% на 48 дней и анализировали методом ВЭЖХ. Результаты представлены в Таблице 5 как образцы «А».
5b. Моногидрат лактозы (750 мг) растворили в 15 мл воды Milli-Q. Тигециклин (375 мг) добавили к этому раствору, и рН довели до приблизительно 5.0 с помощью 1.0 н. НСl. При этой величине рН две аликвоты раствора, каждая содержит приблизительно 100 мг тигециклина и приблизительно 200 мг моногидрата лактозы, поместили в два флакона на 20 мл, соответственно. Раствор в одном флаконе немедленно заморозили до температуры -70°С (сухой лед с ацетоном). Раствор другого образца хранили перед заморозкой при комнатной температуре в течение 5 ч. Замороженные образцы подвергли лиофилизации до сухого состояния. Лиофилизированные образцы поместили в камеру при температуре 40°С и относительной влажности 75% на 48 дней и проанализированы методом ВЭЖХ. Результаты сведены в Таблице 5 как образцы «Вж». Данные «А» и «В» показывают, что составы согласно изобретению снижают образование продуктов разложения.
0.74
Пример 6
6а. Тигециклин (1700 мг) был растворен в 85 мл воды чистоты Milli-Q, с образованием исходного раствора. рН исходного раствора был доведен до приблизительно 5.0 с помощью 1.0 н. НСl. Четыре аликвоты исходного раствора, каждая содержащая приблизительно 100 мг тигециклина, были помещены отдельно в четыре флакона на 20 мл, содержащие приблизительно 50, 100, 200 и 300 мг моногидрата лактозы соответственно. После полного растворения лактозы образцы были подвергнуты лиофилизации (заморожены до температуры минус 50°С с помощью сублимационных сушилок AdVantage/Virtis) до сухого состояния. Лиофилизированные образцы были помещены в камеру при температуре 40°С и относительной влажности 75% на 4 дня и затем проанализированы методом ВЭЖХ. Результаты сведены в Таблице 6а и дают примеры составов согласно изобретению.
6b. Тигециклин (400 мг) был растворен в 20 мл воды чистоты Milli-Q, с образованием исходного раствора. рН исходного раствора был доведен до приблизительно 5.0 с помощью 1.0 н. НСl. Три аликвоты исходного раствора, каждая содержащая приблизительно 100 мг тигециклина, были помещены отдельно в три флакона на 20 мл, содержащие моногидрат лактозы приблизительно 15, 31 и 62 мг соответственно. После растворения образцы были подвергнуты лиофилизации (заморожены до температуры минус 50°С с помощью сублимационных сушилок AdVantage/Virtis) до сухого состояния. Лиофилизированные образцы были помещены в камеру при температуре 40°С и относительной влажности 75% на 20 дней и затем проанализированы методом ВЭЖХ. Результаты сведены в Таблицу 6b и показывают составы согласно изобретению.
601
583
0.74
585
528
556
585
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВЫ ДЛЯ ПАРЕНТЕРАЛЬНОЙ ДОСТАВКИ СОЕДИНЕНИЙ И ИХ ПРИМЕНЕНИЕ | 2007 |
|
RU2539387C2 |
| СОСТАВ ДЛЯ ОПТИЧЕСКОЙ ВИЗУАЛИЗАЦИИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2019 |
|
RU2802481C2 |
| НОВЫЕ СОСТАВЫ АЦЕТИЛАМИНОЯНТАРНОЙ КИСЛОТЫ | 2023 |
|
RU2836876C2 |
| Тетрациклиновая композиция | 2011 |
|
RU2647972C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ ЭМУЛЬСИИ ЛАКТУЛОЗЫ | 2013 |
|
RU2555349C2 |
| ШТАММ БАКТЕРИЙ RHODOCOCCUS RUBER - ДЕСТРУКТОР ПОЛИХЛОРИРОВАННЫХ БИФЕНИЛОВ | 2003 |
|
RU2262531C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ПРЕПАРАТИВНАЯ ФОРМА | 2004 |
|
RU2362560C2 |
| ФОТОСЕНСИБИЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2523380C1 |
| ГЕМОСТИМУЛИРУЮЩЕЕ СРЕДСТВО, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ СТИМУЛИРОВАНИЯ ГЕМОПОЭЗА | 2011 |
|
RU2482869C1 |
| ЛИПОПЕПТИДНЫЕ КОМПОЗИЦИИ И РОДСТВЕННЫЕ СПОСОБЫ | 2010 |
|
RU2607526C2 |
Настоящее изобретение относится к новым улучшенным составам в твердом состоянии и в виде раствора на основе тигециклина, и способам получения данных составов. Тигециклин, подходящий углевод и кислота или буфер, входящие в состав, обеспечивают его стабильность как в твердом виде, так и в виде раствора, что позволяет значительно облегчают использование тигециклина в больницах, обеспечивая необходимую оперативность больничного персонала при лечении пациентов. 3 н. и 21 з.п. ф-лы, 11 табл.
1. Фармацевтический состав, содержащий тигециклин, углевод, выбранный из лактозы, маннозы, сахарозы и глюкозы, и кислоту или буфер, при этом рН состава в растворе составляет от примерно 3,0 до примерно 7,0.
2. Состав по п.1, отличающийся тем, что углевод представляет собой лактозу.
3. Состав по п.1 или 2, отличающийся тем, что состав подвергнут лиофилизации.
4. Состав по любому из пп.1 или 2, отличающийся тем, что значение рН состава в растворе составляет от примерно 4,0 до примерно 5,0.
5. Состав по п.4, отличающийся тем, что рН состава в растворе составляет от примерно 4,2 до примерно 4,8.
6. Состав по любому из пп.1-2 или 5, отличающийся тем, что кислота представляет собой соляную кислоту.
7. Состав по любому из пп.1-2 или 5, отличающийся тем, что кислота представляет собой гентизиновую кислоту.
8. Состав по любому из пп.1-2 или 5, отличающийся тем, что рН состава в растворе составляет от примерно 4,5 до примерно 6,0.
9. Состав по п.8, отличающийся тем, что рН состава в растворе составляет от примерно 4,5 до примерно 5,5.
10. Состав по любому из пп.1-2 или 5, отличающийся тем, что указанный состав находится в твердой форме.
11. Способ получения фармацевтического состава по п.1, включающий
- комбинирование углевода, выбранного из лактозы, маннозы, сахарозы и глюкозы, с тигециклином и водой с получением раствора,
- снижение рН раствора до значения от примерно 3,0 до примерно 7,0 с помощью кислоты или буфера; и
- лиофилизацию раствора до сухого состояния с получением состава.
12. Способ по п.11, отличающийся тем, что углевод представляет собой лактозу.
13. Способ по п.11, дополнительно включающий комбинирование состава с солевым раствором, раствором Рингера с лактатом для инъекций или раствором декстрозы.
14. Способ по п.11 или п.12, отличающийся тем, что рН раствора снижают до величины от примерно 4,0 до примерно 5,0.
15. Способ по п.14, отличающийся тем, что рН раствора снижают до величины от примерно 4,2 до примерно 4,8.
16. Способ по любому из пп.11-13 или 15, отличающийся тем, что кислота представляет собой соляную кислоту.
17. Способ по любому из пп.11-13 или 15, отличающийся тем, что кислота представляет собой гентизиновую кислоту.
18. Способ по любому из пп.11, 12 или 15, отличающийся тем, что состав находится в твердой форме.
19. Способ по п.11 или 12, отличающийся тем, что рН раствора снижают до значения от примерно 4,5 до примерно 6,0.
20. Способ по п.19, отличающийся тем, что рН раствора снижают до значения от примерно 4,5 до примерно 5,5.
21. Фармацевтический состав, содержащий тигециклин, лактозу и соляную кислоту, при этом рН состава в растворе составляет от примерно 3,0 до примерно 7,0.
22. Состав по п.21, отличающийся тем, что рН состава в растворе составляет от примерно 4,5 до примерно 6,0.
23. Состав по п.22, отличающийся тем, что рН состава в растворе составляет от примерно 4,5 до примерно 5,5.
24. Состав по любому из пп.21-23, отличающийся тем, что указанный состав находится в твердой форме.
| Рентгеновский резонатор-монохроматор | 1986 |
|
SU1390550A1 |
| Garrison MW, Neumiller JJ, Setter SM., Tigecycline: an investigational glycylcycline antimicrobial with activity against resistant gram-positive organisms., Clinical Therapeutics, 2005, V.27, N 1, p.p.12-22 | |||
| Pawelczyk E, Matlak В., Kinetics of drug decomposition | |||
| Приспособление в центрифугах для регулирования количества жидкости или газа, оставляемых в обрабатываемом в формах материале, в особенности при пробеливании рафинада | 0 |
|
SU74A1 |
| Kinetics of degradation of minocycline in | |||
Авторы
Даты
2011-09-10—Публикация
2006-03-13—Подача