Область техники, к которой относится изобретение
Настоящее изобретение относится к составу для введения человеку или животному и способу его получения. В частности, настоящее изобретение относится к более стабильным фармацевтическим составам, таким как фармацевтические составы для внутривенного введения, и способу их получения.
Уровень техники изобретения
WO2008/139207 (включена в данный документ посредством ссылки) описывает меченые cMet-связывающие пептиды, подходящие для оптической визуализации in vivo. Пептиды подвергают мечению с помощью оптической репортерной группы, подходящей для визуализации в диапазоне от красной до ближней инфракрасной области спектра. Также описаны внутривенно вводимые оптические молекулярные обеспечивающие визуализацию cMet-связывающие пептиды, такие как молекулярные обеспечивающие визуализацию cMet-связывающие пептиды, которые могут быть использованы для ранней диагностики колоректального рака (CRC).
Более подробно, WO2008/139207 описывает водорастворимый циклический пептид из 26 аминокислот с высокой аффинностью по отношению к cMet человека, который содержит флуоресцентный оптический репортерный обеспечивающий визуализацию фрагмент, подходящий для визуализации организма млекопитающего in vivo. Он проявляет сильные флуоресцентные сигналы с пиковым возбуждением на длине волны 653 нм и пиковым излучением на длине волны 675 нм, что считают оптимальной областью длин волн для визуализации поверхностных повреждений.
Однако авторы настоящего изобретения отметили, что описанные агенты визуализации имеют плохой срок годности при хранении в растворе, и поэтому хранение и расщепление агентов визуализации до выполнения внутривенной инъекции могут быть проблемой. Кроме того, что касается внутривенного применения, агенты визуализации действуют благотворно при соответственных показателях рН и тоничности растворов для внутривенного введения.
Таким образом, задачей данного изобретения является обеспечение более стабильного состава для агентов визуализации, в частности агентов оптической визуализации, более конкретно агентов оптической визуализации, содержащих пептиды, такие как пептиды, описанные в WO2008/139207. Дополнительной задачей изобретения является обеспечение состава для агентов визуализации, в частности, агентов оптической визуализации, более конкретно агентов оптической визуализации, содержащих пептиды, такие как пептиды, описанные в WO2008/139207, и, которые иллюстрируют более хорошее перерастворение (восстановление при разведении), в частности, при соответственных показателях рН и/или тоничности для внутривенного применения.
Раскрытие Изобретения
Согласно первому аспекту изобретения, обеспечивают лиофилизированный состав, содержащий:
(i)активный фармацевтический ингредиент (API);
(ii) буферный агент; и
(iii) лиопротектор;
где API представляет собой агент визуализации, содержащий, по меньшей мере, один cMet-связывающий пептид, подходящий для оптической визуализации организма млекопитающего in vivo.
Оптическая визуализация организма млекопитающего может проходить in vivo.
Под термином «буферный агент» понимают рН-регулирующий агент. Буферный агент может представлять собой соединение или композицию (например, соль), которое(-ая) образует буферный раствор при растворении. Буферный агент может представлять собой дегидратированную буферную соль. Буферный агент может представлять собой, по меньшей мере, одно из следующего: кислоту (обычно слабую кислоту) и одну из ее солей, и основание (обычно слабое основание) и одну из его солей.
Любая ссылка на «лиопротектор» включает «криопротектор» и наоборот, ввиду того, что термины часто используются взаимозаменяемо в рамках данного изобретения.
Агент визуализации может содержать, по меньшей мере, один оптический репортер, подходящий для визуализации с использованием света с длиной волны в диапазоне от фиолетовой до ближней инфракрасной области спектра (400-1200 нм).
Агент визуализации может содержать соединение Формулы I:
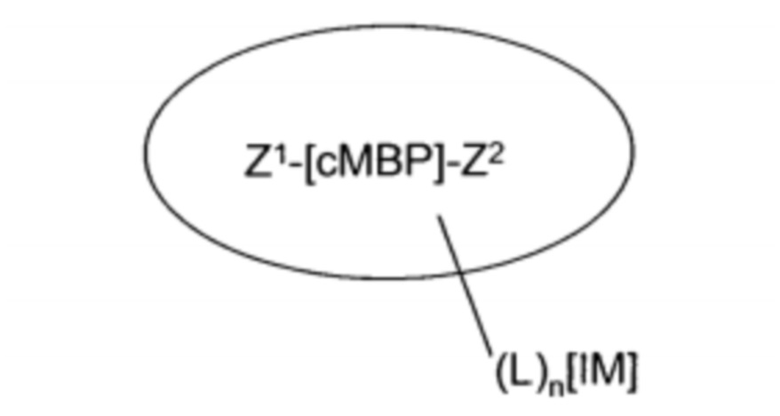
(Формула I)
где:
Z1 присоединен к N-концу сМВР и представляет собой Н или MIG;
Z2 присоединен к С-концу сМВР и представляет собой ОН, NH2, OBc или MIG,
где Bc представляет собой биосовместимый катион;
сМВР представляет собой cMet-связывающий циклический пептид из 17-30 аминокислот, который включает аминокислотную последовательность (SEQ ID NO:1):
Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6; где:
Xaa1 представляет собой Asn, His или Tyr;
Xaa2 представляет собой Gly, Ser, Thr или Asn;
Xaa3 представляет собой Thr или Arg;
Xaa4 представляет собой Ala, Asp, Glu, Gly или Ser;
Xaa5 представляет собой Ser или Thr;
Xaa6 представляет собой Asp или Glu;
и каждый из Cysa-d представляет собой остаток цистеина, так что остатки а и b, а также c и d циклизированы с образованием двух отдельных дисульфидных связей;
MIG представляет собой ингибирующую метаболизм группу, которая представляет собой биосовместимую группу, ингибирующую или подавляющую метаболизм пептида in vivo;
L представляет собой синтетическую линкерную группу формулы -(А)m-, где каждый А независимо представляет собой -CR2-, -CR=CR-, -C≡C-, -CR2CO2-, -CO2CR2-, -NRCO-, -CONR-, -NR(C=O)NR-, -NR(C=S)NR-, -SO2NR-, -NRSO2-, -CR2OCR2-, -CR2SCR2-, -CR2NRCR2-, С4-8-циклогетероалкиленовую группу, С4-8-циклоалкиленовую группу, С5-12-ариленовую группу, С3-12-гетероариленовую группу, аминокислоту, сахар или монодисперсную полиэтиленгликолевую (PEG) структурную единицу;
каждый R независимо выбран из Н, С1-4-алкила, С2-4-алкенила, С2-4-алкинила, С1-4-алкоксиалкила или С1-4-гидроксиалкила;
m равен целому числу от 1 до 20;
n равен целому числу 0 или 1;
IM представляет собой оптический репортерный визуализируемый фрагмент, подходящий для визуализации организма млекопитающего с использованием света с длиной волны в диапазоне от зеленой до ближней инфракрасной области спектра (400-1200 нм).
Термин "агент визуализации" означает соединение, подходящее для визуализации организма млекопитающего in vivo или ex vivo. Визуализация ex vivo при этом требует введения в организм млекопитающего, но также может включать удаление образца ткани или тому подобного и визуализацию того образца вне организма. В таком образце, состав используется in vivo, поскольку он вводится в организм млекопитающего, и используется ex vivo, поскольку визуализация происходит вне организма млекопитающего. Млекопитающее может представлять собой человеческий субъект. Визуализация может быть инвазивной (например, интраоперационной или эндоскопической) или неинвазивной. Способ визуализации может представлять собой эндоскопию. Хотя соединение Формулы I подходит для визуализации in vivo, оно также может иметь применения in vitro (например, для анализов количественного определения cMet в биологических образцах или визуализации cMet в образцах ткани). Агент визуализации может быть использован для визуализации in vivo.
Группа Z1 замещает аминогруппу последнего аминокислотного остатка. Таким образом, когда Z1 представляет собой Н, амино-конец сМВР оканчивается свободной группой NH2 последнего аминокислотного остатка. Группа Z2 замещает карбонильную группу последнего аминокислотного остатка. Таким образом, когда Z2 представляет собой ОН, карбокси-конец сМВР оканчивается свободной группой CO2H последнего аминокислотного остатка, и, когда Z2 представляет собой OBc, эта концевая карбоксильная группа ионизирована в виде группы CO2Bc.
Термин "группа, ингибирующая метаболизм" (MIG) означает биосовместимую группу, которая ингибирует или подавляет метаболизм сМВР-пептида in vivo либо по амино-концу (Z1), либо по карбокси-концу (Z2). Такие группы хорошо известны специалистам в данной области и выбраны подходящим образом, для амино-конца пептидов, из: N-ацилированных групп -NH(C=О)RG, где ацильная группа -(C=O)RG имеет RG, выбранный из C1-6-алкила, С3-10-арильных групп, или содержит полиэтиленгликолевую (PEG) структурную единицу. Подходящие группы PEG описаны ниже для линкерной группы (L). Такие группы PEG могут представлять собой биомодификаторы Формулы IA или IB. Такие аминоконцевые группы MIG могут представлять собой ацетил, бензилоксикарбонил или трифторацетил, обычно ацетил.
Подходящие группы, ингибирующие метаболизм, для пептидного карбоксильного конца включают: карбоксамид, трет-бутиловый сложный эфир, бензиловый сложный эфир, циклогексиловый сложный эфир, аминоспирт или полиэтиленгликолевую (PEG) структурную единицу. Подходящая группа MIG для карбоксильного концевого аминокислотного остатка сМВР-пептида является такой, где концевая аминогруппа аминокислотного остатка N-алкилирована C1-4-алкильной группой, необязательно метильной группой. Такие группы MIG могут представлять собой карбоксамид или PEG, и могут представлять собой карбоксамид.
Формула I означает, что фрагмент -(L)n[IM] может быть присоединен по любому подходящему положению Z1, Z2 или сМВР. В отношении Z1 или Z2, и в том и в другом случае фрагмент -(L)n[IM] может быть присоединен к группе MIG, где один из Z1/Z2 представляет собой MIG. Когда Z1 представляет собой Н, или Z2 представляет собой ОН, прикрепление фрагмента -(L)n[IM] по положению Z1 или Z2 дает соединения формул [IM]-(L)n-[cMBP]-Z2 или Z1-[cMBP]-(L)n-[IM], соответственно. Ингибирование метаболизма сМВР по одному из пептидных концов тоже может быть достигнуто путем присоединения фрагмента -(L)n[IM] таким образом, но -(L)n[IM] не охватывается определением MIG по настоящему изобретению.
Фрагмент -(L)n- Формулы I может быть присоединен по любому подходящему положению IM. Фрагмент -(L)n- либо занимает место имеющегося заместителя IM, либо ковалентно прикрепляется к имеющемуся заместителю IM. Фрагмент -(L)n- необязательно присоединяется через карбоксиалкильный заместитель IM.
Термин "cMet-связывающий циклический пептид" (сМВР) означает пептид, который связывается с высокоаффинным рецептором фактора роста гепатоцитов (HGF), также известным как cMet (c-Met или рецептор фактора роста гепатоцитов). Подходящие сМВР-пептиды имеют кажущуюся константу диссоциации (Kd) для cMet из комплекса cMet/HGF менее приблизительно 2 мкМ. сМВР-пептиды содержат остатки пролина, и известно, что такие остатки могут проявлять цис/транс-изомеризацию амидной связи основной цепи. Описанные в данном документе сМВР-пептиды включают любые такие изомеры.
Термин "биосовместимый катион" (Bc) означает положительно заряженный противоион, который образует соль с ионизированной отрицательно заряженной группой, где упомянутый положительно заряженный противоион является также нетоксичным и, следовательно, подходящим для введения в организм млекопитающего, особенно организм человека. Примеры подходящих биосовместимых катионов включают: щелочные металлы натрий или калий; щелочноземельные металлы кальций и магний; и ион аммония. Обычные биосовместимые катионы представляют собой натрий и калий, обычно натрий.
Термин "аминокислота" означает L- или D-аминокислоту, аналог аминокислоты (например, нафтилаланин) или миметик аминокислоты, которые могут быть природного происхождения или получены тонким синтезом, и могут быть оптически чистыми, то есть, в виде индивидуального энантиомера и поэтому хиральными, или в виде смеси энантиомеров. Для обозначения аминокислот в данном описании использованы общепринятые 3-буквенные или однобуквенные сокращения. Используемые аминокислоты могут быть оптически чистыми. Термин "миметик аминокислоты" означает синтетические аналоги существующих в природе аминокислот, которые являются изостерами, то есть, разработаны с возможностью имитировать стерическую и электронную структуру природного соединения. Такие изостеры хорошо известны специалистам в данной области и включают депсипептиды, ретро-инверсо-пептиды, тиоамиды, циклоалканы или 1,5-дизамещенные тетразолы, но не ограничены этим [см. М. Goodman, Biopolymers, 24, 137, (1985)].
Термин "пептид" означает соединение, содержащее две или более аминокислот, как определено выше, связанных пептидной связью (то есть, амидной связью, соединяющей амин одной аминокислоты с карбоксилом другой аминокислоты). Термин "миметик пептида" или "миметик" относится к биологически активным соединениям, которые имитируют биологическую активность пептида или белка, но более не являются пептидными по химической природе, то есть, они более не содержат никаких пептидных связей (то есть, амидных связей между аминокислотами). Здесь термин «миметик пептида» используют в более широком смысле для включения молекул, которые более не являются полностью пептидными по природе, таких как псевдопептиды, полупептиды и пептоиды.
Термин "оптический репортерный визуализируемый фрагмент" (IM) означает флуоресцентный краситель или хромофор, который может быть обнаружен напрямую или опосредованно в ходе процедуры оптической визуализации с использованием света в диапазоне длин волн от зеленой до ближней инфракрасной области спектра (400-1200 нм, необязательно 600-1000 нм). IM может иметь флуоресцентные свойства.
Одна из ролей линкерной группы -(А)m- Формулы I состоит в том, чтобы отдалять IM от активного сайта сМВР-пептида. Это особенно важно в том случае, когда визуализируемый фрагмент является относительно объемным, с тем, чтобы не ухудшалось взаимодействие с ферментом. Этого можно достичь комбинацией гибкости (например, в случае простых алкильных цепей), благодаря чему эта объемная группа имеет свободу для саморасположения вдали от активного сайта, и/или жесткости, такой как в случае циклоалкильного или арильного спейсера, который ориентирует IM вдали от активного сайта. Природа линкерной группы также может быть использована для модификации биораспределения агента визуализации. Таким образом, например, включение эфирных групп в линкер будет способствовать модификации связывания с белками плазмы. В том случае, когда -(А)m- содержит полиэтиленгликолевую (PEG) структурную единицу или пептидную цепь из 1-10 аминокислотных остатков, линкерная группа может иметь функцию модифицирования фармакокинетических параметров и скорости клиренса из крови агента визуализации in vivo. Такие "биомодифицирующие" линкерные группы могут ускорять клиренс агента визуализации из фоновой ткани, такой как мышечная или печеночная, и/или из крови, тем самым давая лучшее диагностическое изображение вследствие меньших фоновых помех. Биомодифицирующая линкерная группа также может быть использована для того, чтобы способствовать конкретному пути экскреции, например, через почки, в противоположность пути через печень.
Термин "сахар" означает моно-, ди- или трисахарид. Подходящие сахара включают: глюкозу, галактозу, мальтозу, маннозу и лактозу. Необязательно, сахар может быть функционализирован с обеспечением легкого связывания с аминокислотами. Так, например, глюкозаминное производное аминокислоты может быть конъюгировано с другими аминокислотами через пептидные связи. Глюкозаминное производное аспарагина (имеющееся в продаже от NovaBiochem) представляет собой один из таких примеров:
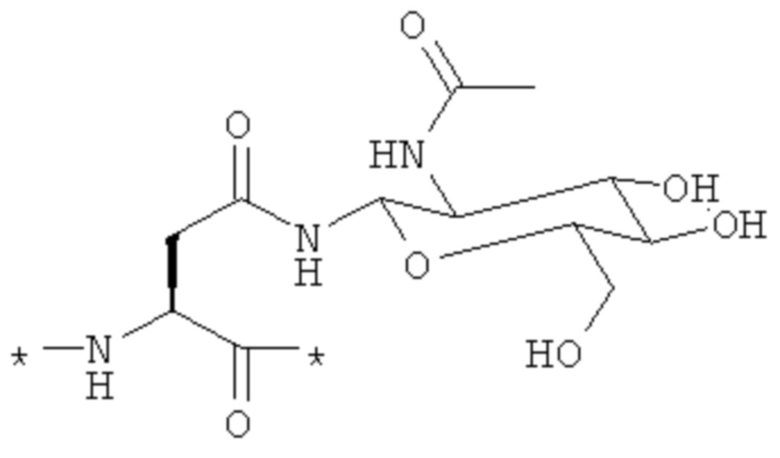
Молекулярная масса агента визуализации составляет подходящим образом вплоть до 8000 Дальтон. Необязательно, молекулярная масса находится в диапазоне от 2800 до 6000 Дальтон, обычно от 3000 до 4500 Дальтон, где молекулярная масса от 3200 до 4000 Дальтон является самой характерной.
Агенты визуализации по настоящему изобретению могут иметь оба пептидных конца, защищенных группами MIG, то есть, необязательно как Z1, так и Z2 представляют собой MIG, которые обычно будут различными. Как отмечено выше, один из Z1/Z2 необязательно может представлять собой -(L)n[IM]. Наличие обоих пептидных концов, замещенных таким образом, важно для применений визуализации in vivo, поскольку в противном случае можно было бы ожидать быстрый метаболизм с последующей потерей аффинности селективного связывания в отношении cMet. В том случае, когда и Z1 и Z2 представляют собой MIG, необязательно Z1 представляет собой ацетил, и Z2 представляет собой первичный амид. Z1 может представлять собой ацетил, и Z2 может представлять собой первичный амид, и фрагмент -(L)n[IM] может быть присоединен к боковой цепи в эпсилон-аминогруппе остатка лизина в сМВР.
сМВР-Пептиды по настоящему изобретению могут иметь Kd в отношении связывания cMet с комплексом cMet/HGF менее приблизительно 10 нМ (на основе измерений методом флуоресцентного поляризационного анализа), наиболее часто в диапазоне от 1 до 5 нМ, где Kd менее 3 нМ является идеальной.
Пептидная последовательность (SEQ ID NO:1):
Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6.
(SEQ ID NO:1)
сМВР Формулы I представляет собой последовательность 17-мерного пептида, ответственную, главным образом, за селективное связывание с cMet. Когда сМВР-пептид по настоящему изобретению содержит более 17 аминокислотных остатков, остальные аминокислоты могут представлять собой любую аминокислоту, за исключением цистеина. Дополнительные незащищенные остатки цистеина могут вызывать нежелательное скремблирование определенных дисульфидных мостиков Cysa-Cysb и Cysc-Cysd. Дополнительные пептиды предпочтительно содержат, по меньшей мере, один аминокислотный остаток с боковой цепью, подходящей для легкой конъюгации фрагмента -(L)n[IM]. Подходящие такие остатки включают остатки Asp или Glu для конъюгации с группами -(L)n[IM], функционализированными аминогруппами, или остаток Lys для конъюгации с группой -(L)n[IM], функционализированной карбоксигруппами или активным сложным эфиром. Аминокислотные остатки для конъюгации -(L)n[IM] подходящим образом являются локализованными вдали от 17-мерного связывающего участка сМВР-пептида (SEQ ID NO:1) и необязательно являются локализованными на С- или N-конце. Необязательно, аминокислотный остаток для конъюгации представляет собой остаток Lys.
Замещение остатка триптофана в SEQ ID NO:1 оценивали с помощью известных аминокислотных заместителей фенилаланина и нафтилаланина. Однако была обнаружена потеря аффинности в отношении cMet, что позволило предположить, что остаток триптофана важен для активности. Необязательно cMBP-пептид дополнительно содержит N-концевой остаток серина, что дает 18-мер (SEQ ID NO:2):
Ser-Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6.
(SEQ ID NO:2)
В дополнение к SEQ ID NO:1 или SEQ ID NO:2, сМВР может дополнительно включать одно из следующего:
(1) остаток Asp или Glu, или аналог такового, в пределах 4 аминокислотных остатков пептидного С- или N-конца сМВР-пептида, и -(L)nIM функционализирована аминогруппой, которая конъюгирована с боковой цепью в карбоксиле упомянутого остатка Asp или Glu, или аналога такового, с получением амидной связи;
(2) остаток Lys, или аналог такового, в пределах 4 аминокислотных остатков пептидного С- или N-конца сМВР-пептида, и -(L)nIM функционализирована карбоксильной группой, которая конъюгирована с боковой цепью в эпсилон-аминогруппе упомянутого остатка Lys, или аналога такового, с получением амидной связи.
Аналоги Asp и/или Glu могут включать одну или более аминокислот, выбираемых из 2-аминобутандиовой кислоты, 2-аминогександиовой кислоты, 2-аминогептандиовой кислоты, 2-аминооктандиовой кислоты, 2-аминононандиовой кислоты, 2-аимнодекандиовой кислоты, 2-аминоундекандиовой кислоты, и 2-аминододекандиовой кислоты.
Аналоги Lys могут включать одну или более аминокислот, выбираемых из 2,3-диаминопропановой кислоты, 2,4-диаминобутановой кислоты, 2,5-диаминопентановой кислоты, 2,7-диаминогептановой кислоты, 2,8-диаминооктановой кислоты, 2,9-диаминононановой кислоты, 2,10-диаминодекановой кислоты, 2,11-диаминоундекановой кислоты, 2,12-диаминододекановой кислоты.
сМВР-пептиды могут содержать 22-мерную аминокислотную последовательность (SEQ ID NO:3):
Ala-Gly-Ser-Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6-Gly-Thr.
(SEQ ID NO:3)
сМВР-пептиды могут иметь Xaa3, представляющий собой Arg.
сМВР-пептид может дополнительно содержать, в дополнение к SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3, по любому из N- или С-концов линкерный пептид, который выбирают из: -Gly-Gly-Gly-Lys- (SEQ ID NO:4), -Gly-Ser-Gly-Lys- (SEQ ID NO:5) или -Gly-Ser-Gly-Ser-Lys- (SEQ ID NO:6).
Остаток Lys линкерного пептида является обычной точкой локализации для конъюгации фрагмента -(L)n[IM]. Некоторые сМВР-пептиды содержат SEQ ID NO:3 вместе с линкерным пептидом SEQ ID NO:4, давая 26-мерную аминокислотную последовательность (SEQ ID NO:7):
Ala-Gly-Ser-Cysa-Tyr-Cysc-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cysd-Trp-Cysb-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys.
(SEQ ID NO:7)
сМВР-пептиды с SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3 и SEQ ID NO:7 могут иметь Z1=Z2=MIG, и могут иметь Z1=ацетил, и Z2=первичный амид.
Фрагмент -(L)n[IM] подходящим образом присоединяют к одной из групп Z1 или Z2 или аминоксилотному остатку сМВР-пептида, который отличается от cMet-связывающей последовательности SEQ ID NO:1. Возможные аминокислотные остатки и сайты конъюгации являются такими, как описано выше. В том случае, когда фрагмент -(L)n[IM] присоединен к Z1 или Z2, он может занимать место Z1 или Z2 при конъюгации по N- или С-концу и блокировать метаболизм in vivo таким образом.
Обычные группы IM имеют обширную делокализованную систему электронов, например, цианины, мероцианины, индоцианины, фталоцианины, нафталоцианины, трифенилметины, порфирины, пирилиевые красители, тиапирилиевые красители, скварилиевые красители, крокониевые красители, азулениевые красители, индоанилины, бензофеноксазиниевые красители, бензотиафенотиазиниевые красители, антрахиноны, нафтохиноны, индатрены, фталоилакридоны, трисфенохиноны, азокрасители, красители с внутримолекулярным и межмолекулярным переносом заряда и комплексы красителей, тропоны, тетразины, бис(дитиолен)овые комплексы, бис(бензол-дитиолат)ные комплексы, иоданилиновые красители, бис(S, O-дитиолен)овые комплексы. Флуоресцентные белки, такие как зеленый флуоресцентный белок (GFP) и модификации GFP, которые имеют различные свойства поглощения/испускания, также являются полезными. В некоторых контекстах используют комплексы некоторых редкоземельных металлов (например, европия, самария, тербия или диспрозия), так как они являются флуоресцентными нанокристаллами (квантовые точки).
Примеры хромофоров, которые могут быть использованы, включают: Atto 647, CF640R, Atto 647N, SiR650, CF633, Sulfo Cy5, T700-H, T700-F, CF647 SE, Quasar 670, Chromeo 642, Oyster 645, Oyster 647, Oyster 650, Iris 5, CyAL 5, IRDye 650, NIR4, AOI987, BODIPY® 650/665, DyLight 633, DyLight 650, DDAO (7-гидрокси-9H-(1,3-дихлор-9,9-диметилакридин-2-он), Chromis 645 C, Chromis 645 Z, Chromis 645 A, HiLyte 647, PromoFluor 647P, Dy-630, Dy-631, Dy-632, Dy-633, Dy-636, Dy-650, Dy-651, Dy-652, Dy-654, Tracy 645, Tracy 652, Флуоресцентный Красный NIR 782, Atto 655, Atto 680, CF660 C, CF660 R, Quasar 705, CF680, IRDye680RD, NIR2, IRDye680LT, HiLyte 680, IRDye700DX, Oyster 680, Iris 5.5, HROMIS LSS 670Z, CHROMIS LSS 690Z, DyLight 680 (Pierce), Фталоцианин Магния, Оксазин 750, SeTa-665, SeTa-667, SeTa-670, PromoFluor 670 (Promo Kine), Dy-682, PromoFluor 680, PromoFluor 700 P, Метиленовый Голубой, Флуоресцентный Красный NIR 730 Реакционноспособный, Флуоресцентный Красный NIR 781 Реакционноспособный, BM104, BM105 (сложный NHS-эфир BM104), SiR720, Atto 740, CF750, Sulfo Cy7, IRDye750, NIR3, DyLight 755, DY-732, DY-734, DY-752, PromoFluor 750 P, HiLyte 750, DY-776, NIR1, IRDye800RS, PromoFluor 770 P, DY-778, CHROMIS 770 C, ZW800-1, ZW800-3, IRIS 7G-WS, IR 780, ESNF31, CF770, Vivotag 800, IRDye800CW, Alexa Fluor 790, CF790, Oyster 800, CHROMIS 770 A, CHROMIS 800 C, CHROMIS 800 A, CHROMIS 830 C, CHROMIS 830 A, DyLight 800, DY-777, DY-782, DY-800, PromoFluor 780 P, NIR-797, PromoFluor 840 P, флуоресцеин, сульфородамин 101 (Texas Red), родамин B, родамин 6G, родамин 19, индоцианин зеленый, Cy2, Cy3B, Cy3.5, Cy5, Cy5.5, Cy7, Cy7.5, Морской Голубой, Тихоокеанский Синий, Oregon Green 488, Oregon Green 514, TAMRA (тетраметилродамин), TMR, Alexa Fluor 350, Alexa Fluor 430, Alexa Fluor 532, Alexa Fluor 546, Alexa Fluor 555, Alexa Fluor 568, Alexa Fluor 594, Alexa Fluor 633, Alexa Fluor 647, Alexa Fluor 660, Alexa Fluor 680, Alexa Fluor 700, и Alexa Fluor 750. Цианиновые красители и их производные и аналоги могут быть обычным образом использованы.
Особые примеры хромофоров, которые могут быть использованы, включают: Cy5, Cy5.5, Cy7, Cy7.5, Alexa Fluor 633, Alexa Fluor 647, Alexa Fluor 660, Alexa Fluor 680, Alexa Fluor 700, и Alexa Fluor 750, Atto 647, CF640R, Atto 647N, SiR650, CF633, Sulfo Cy5, T700-H, T700-F, CF647 SE, Quasar 670, Chromeo 642, Oyster 645, Oyster 647, Oyster 650, Iris 5, CyAL 5, IRDye 650, NIR4, AOI987, BODIPY® 650/665, DyLight 633, DyLight 650, DDAO (7-гидрокси-9H-(1,3-дихлор-9,9-диметилакридин-2-он), Chromis 645 C, Chromis 645 Z, Chromis 645 A, HiLyte 647, PromoFluor 647P, Dy-630, Dy-631, Dy-632, Dy-633, Dy-636, Dy-650, Dy-651, Dy-652, Dy-654, Tracy 645, Tracy 652, Флуоресцентный Красный NIR 782, Atto 655, Atto 680, CF660 C, CF660 R, Quasar 705, CF680, IRDye680RD, NIR2, IRDye680LT, HiLyte 680, IRDye700DX, Oyster 680, Iris 5.5, HROMIS LSS 670Z, CHROMIS LSS 690Z, DyLight 680 (Pierce), Фталоцианин Магния, Оксазин 750, SeTa-665, SeTa-667, SeTa-670, PromoFluor 670 (Promo Kine), Dy-682, PromoFluor 680, PromoFluor 700 P, Метиленовый Голубой, Флуоресцентный Красный NIR 730 Реакционноспособный, Флуоресцентный Красный NIR 781 Реакционноспособный, BM104, BM105 (сложный NHS-эфир BM104), SiR720, Atto 740, CF750, Sulfo Cy7, IRDye750, NIR3, DyLight 755, DY-732, DY-734, DY-752, PromoFluor 750 P, HiLyte 750, DY-776, NIR1, IRDye800RS, PromoFluor 770 P, DY-778, CHROMIS 770 C, ZW800-1, ZW800-3, IRIS 7G-WS, IR 780, ESNF31, CF770, Vivotag 800, IRDye800CW, Alexa Fluor 790, CF790, Oyster 800, CHROMIS 770 A, CHROMIS 800 C, CHROMIS 800 A, CHROMIS 830 C, CHROMIS 830 A, DyLight 800, DY-777, DY-782, DY-800, PromoFluor 780 P, NIR-797, PromoFluor 840 P и индоцианин зеленый. Licha и соавт. сделали обзор по красителям и конъюгатам красителей для оптической визуализации in vivo [Topics Curr.Chem., 222, 1-29 (2002); Adv.Drug Deliv.Rev., 57, 1087-1108 (2005)].
В большей степени особые примеры хромофоров, которые могут быть использованы, включают: Cy5, Cy5**, Alexa Fluor 647, BODIPY® 630, Atto 647, Oyster 647, IRDye650, BODIPY® 650, DY631, DY632, Cy5.5, IRDye 680RD, Alexa Fluor 660, и Alexa Fluor 680.
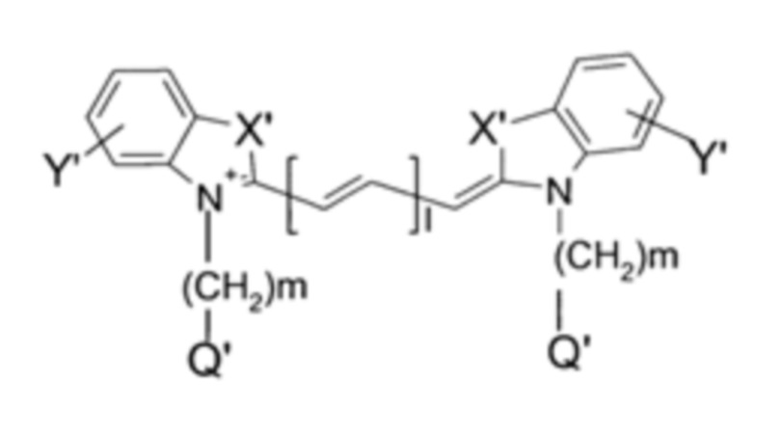
Цианиновые красители могут представлять собой флуорофоры Формулы II:
(Формула II)
где:
каждый X' независимо выбран из: -С(СН3)2, -S-, -О- или -С[(СН2)аСН3][(СН2)bM]-, где а равен целому числу от 0 до 5, b равен целому числу от 1 до 5, и М представляет собой группу G или выбран из SO3M1 или Н;
каждый Y' независимо представляет собой 1-4 группы, выбранные из группы, состоящей из: H, -CH2NH2, -SO3M1, -СН2СООМ1, -NCS и F, и, где группы Y' находятся по любому положению ароматического кольца;
Q' независимо выбран из группы, состоящей из: H, SO3M1, NH2, COOM1, аммония, сложноэфирных групп, бензила и группы G;
М1 представляет собой Н или Bc;
I равен целому числу от 1 до 3;
и m равен целому числу от 1 до 5;
где, по меньшей мере, один из X', Y' и Q' включает группу G;
G представляет собой реакционноспособную или функциональную группу, подходящую для присоединения к сМВР-пептиду.
Группа G взаимодействует с комплементарной группой сМВР-пептида, образуя ковалентную связь между флуорофором цианинового красителя и сМВР-пептидом. G может представлять собой реакционноспособную группу, которая может взаимодействовать с комплементарной функциональной группой пептида или, альтернативно, может включать функциональную группу, которая может взаимодействовать с реакционноспособной группой сМВР-пептида. Примеры реакционноспособных и функциональных групп включают: активные сложные эфиры; изотиоцианат; малеимид; галогенацетамид; галогенангидрид; гидразид; винилсульфон; дихлортриазин; фосфорамидит; гидроксил; аминогруппу; сульфгидрил; карбонил; карбоновую кислоту и тиофосфат. G может представлять собой активный сложный эфир.
Термин "активированный сложный эфир" или "активный сложный эфир" означает сложноэфирное производное ассоциированной карбоновой кислоты, которое предназначено для включения лучшей уходящей группы и, следовательно, для обеспечения более легкого реакционного взаимодействия с нуклеофилом, таким как амины. Примеры подходящих активных сложных эфиров представляют собой: N-гидроксисукцинимид (NHS), сульфо-сукцинимидиловый эфир, пентафторфенол, пентафтортиофенол, пара-нитрофенол, гидроксибензотриазол и РуВОР (то есть, гексафторфосфат бензотриазол-1-ил-окситрипирролидинофосфония). Активные сложные эфиры могут представлять собой N-гидроксисукцинимидные или пентафторфенольные сложные эфиры, особенно N-гидроксисукцинимидные сложные эфиры.
В одном варианте осуществления Формулы II:
каждый X' выбран из группы, состоящей из -С(СН3)2- и -С(СН3)[(СН2)4М]-,
где М представляет собой группу G или -SO3M1;
каждый Y' представляет собой SO3M1, Н или 1-4 атома F;
каждый Q' выбран из группы G и SO3M1;
I предпочтительно равен 2, и m предпочтительно равен 3, 4 или 5;
где в том случае, когда или X' или Q' представляет собой группу G, она может представлять собой сукцинимидиловый сложный эфир.
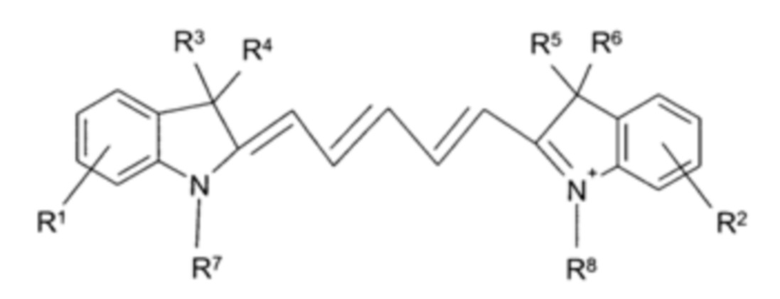
Цианиновый краситель может быть представлен Формулой III:
(Формула III)
где:
R1 и R2 независимо представляют собой Н или SO3M1, и, по меньшей мере, один из R1 и R2 представляет собой SO3M1, где М1 представляет собой Н или Bc;
R3 и R4 независимо представляют собой С1-4-алкил или C1-6-карбоксиалкил;
R5, R6, R7 и R8 независимо представляют собой группы Ra;
где Ra представляет собой С1-4-алкил, C1-6-карбоксиалкил или -(CH2)kSO3M1, где k равен целому числу 3 или 4;
при условии, что цианиновый краситель имеет всего 1-4 заместителя SO3M1 в группах R1, R2 и Ra.
Красители Формулы III могут быть выбраны таким образом, чтобы присутствовала, по меньшей мере, одна С1-6-карбоксиалкильная группа, с целью облегчения конъюгации с сМВР.
Возможные индивидуальные красители Формулы III сведены в Таблицу 1:
где Rf = -(CH2)5COOH.
Таблица 1: Химические Структуры Индивидуальных Цианиновых Красителей
Красители Формулы II, которые обычно используют, представляют собой Су5** и Alexa647, где Су5** является наиболее часто используемым.
В том случае, когда присутствует синтетическая линкерная группа (L), она может содержать концевые функциональные группы, которые облегчают конъюгацию с [IM] и Z1-[cMBP]-Z2. Когда L содержит пептидную цепь из 1-10 аминокислотных остатков, эти аминокислотные остатки могут быть выбраны из глицина, лизина, аргинина, аспарагиновой кислоты, глутаминовой кислоты или серина. Когда L содержит фрагмент PEG, он может содержать структурные единицы, полученные при олигомеризации монодисперсных PEG-подобных структур Формул IA (17-амино-5-оксо-6-аза-3,9,12,15-тетраоксагептадекановая кислота) или IB:
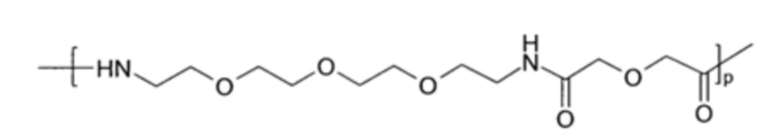
(Формула IA)
где p означает целое число от 1 до 10. Альтернативно, может быть использована PEG-подобная структура на основе производного пропионовой кислоты Формулы IB:
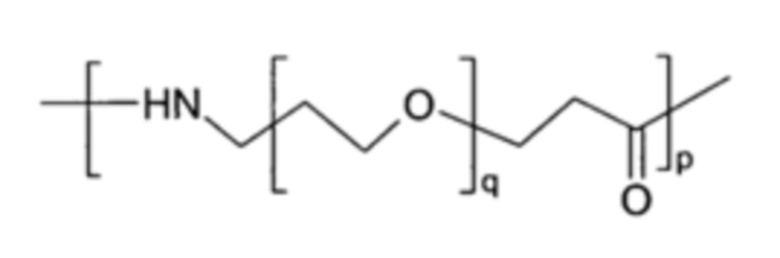
(Формула IB)
где p является таким, как определено для Формулы IA, и q означает целое число от 3 до 15. В Формуле IB, p может иметь значение 1 или 2, и q может иметь значение от 5 до 12.
В том случае, когда линкерная группа не содержит PEG или пептидную цепь, группы L имеют основную цепь соединенных атомов, которые образуют фрагмент -(А)m- из 2-10 атомов, наиболее предпочтительно из 2-5 атомов, где особенно предпочтительно из 2 или 3 атомов. Минимальная основная цепь линкерной группы из 2 атомов дает преимущество в том, что визуализируемый фрагмент хорошо отделен, в силу чего минимизировано любое нежелательное взаимодействие.
В формуле I, n может иметь значение 0 или 1, обычно 0, то есть, не присутствует никакая линкерная группа.
Агенты визуализации, которые описаны в данном документе, могут быть представлены Формулой IV (включающей SEQ ID NO:7):

(Формула IV)
где группа (L)n[IM] присоединена к эпсилон-аминогруппе остатка Lys. Агенты визуализации Формулы IV могут иметь M (N-концевой Ala), представляющую собой ацетил, и MIG (С-концевой Lys), представляющую собой первичный амид. В Формуле IV, n может быть равен нулю, и IM может представлять собой цианиновый краситель, обычно цианиновый краситель Формулы II. Могут быть использованы агенты визуализации Формулы IV, имеющие IM, представляющую собой Су5** или Alexa647, наиболее часто Су5**.
Пептиды формулы Z1-[cMBP]-Z2 могут быть получены способом получения, который включает в себя:
(i) твердофазный пептидный синтез линейного пептида, который имеет такую же пептидную последовательность, как и желаемый сМВР-пептид, и, в котором Cysa и Cysb не защищены, а остатки Cysc и Cysd имеют защитные группы для тиола;
(ii) отщепление от твердой подложки и обработку пептида со стадии (i) водным основанием в растворе с получением моноциклического пептида с первой дисульфидной связью, соединяющей Cysa и Cysb;
(iii) удаление с Cysc и Cysd защитных групп для тиола и циклизацию с получением второй дисульфидной связи, соединяющей Cysc и Cysd, с получением желаемого бициклического пептидного продукта Z1-[cMBP]-Z2.
Термин "защитная группа" означает группу, которая ингибирует или подавляет нежелательные химические реакции, но которая выполнена с возможностью быть достаточно реакционноспособной, в силу чего ее можно было удалить с интересующей функциональной группы в достаточно мягких условиях, которые не изменяют остальную часть молекулы. После удаления защиты получают желаемый продукт. Защитные группы для амина хорошо известны специалистам в данной области, и они подходящим образом выбраны из: Boc (где Boc представляет собой трет-бутилоксикарбонил), Fmoc (где Fmoc представляет собой флуоренилметоксикарбонил), трифторацетила, аллилоксикарбонила, Dde [то есть, 1-(4,4-диметил-2,6-диоксоциклогексилиден)-этил] или Npys (то есть, 3-нитро-2-пиридинсульфенил). Подходящие защитные группы для тиола представляют собой Trt (тритил), Асm (ацетамидометил), t-Bu (трет-бутил), трет-бутилтио, метоксибензил, метилбензил или Npys (3-нитро-2-пиридинсульфенил). Использование других защитных групп описано в "Protective Groups in Organic Synthesis", Theorodora W. Greene and Peter G.M.Wuts, (John Wiley & Sons, 1991). Обычные защитные группы для амина представляют собой Воc и Fmoc, наиболее часто Boc. Другие обычные защитные группы для тиола представляют собой Trt и Acm.
В Примерах 1 и 2 предоставлены дополнительные конкретные детали. Дополнительные подробности твердофазного пептидного синтеза описаны в Р. Lloyd-Williams, F. Albericio and E. Girald; Chemical Approaches to the Synthesis of Peptides and Proteins, CRC Press, 1997. сМВР-пептиды лучше всего хранить в атмосфере инертного газа и выдерживать в морозильной камере. При использовании в растворе, лучше всего избегать значений рН выше 7, так как это подвергает риску скремблирования дисульфидных мостиков, и рекомендуется избегать низких значений рН, поскольку это инициирует агрегацию пептида.
Общий способ получения агента визуализации по первому аспекту, включает одну из стадий (i)-(iv):
(i) реакционное взаимодействие cMBP-пептида формулы Z1-[cMBP]-Z2, где Z1 представляет собой H, и Z2 представляет собой MIG, с соединением формулы Y1-(L)n-[IM], что дает агент визуализации Формулы I, где [IM] конъюгирована в положении Z1;
(ii) реакционное взаимодействие cMBP-пептида формулы Z1-[cMBP]-Z2, где Z1=Z2=MIG, и cMBP включает остаток Asp или GIu в пределах 4 аминокислотных остатков пептидного C- или N-конца cMBP-пептида, и все другие остатки Asp/Glu cMBP-пептида защищены, с соединением формулы Y2-(L)n-[IM], что дает агент визуализации Формулы I, где [IM] конъюгирована в упомянутом остатке Asp или GIu cMBP-пептида;
(iii) реакционное взаимодействие cMBP-пептида формулы Z1-[cMBP]-Z3, где Z1 представляет собой MIG, и Z3 представляет собой группу Z2 или активированный сложный эфир, и все другие остатки Asp/Glu cMBP-пептида защищены, с соединением формулы Y2-(L)n-[IM], что дает агент визуализации Формулы I, где [IM] конъюгирована в положении Z2;
(iv) реакционное взаимодействие cMBP-пептида формулы Z1-[cMBP]-Z2, где Z1=Z2=MIG, и cMBP включает Lys в пределах 4 аминокислотных остатков пептидного C- или N-конца cMBP-пептида, с соединением формулы Y1-(L)n-[IM], что дает агент визуализации Формулы I, где [IM] конъюгирована в остатке Lys cMBP-пептида;
где Z, cMBP, Z , M , L, n и IM являются такими, как определено выше, и Z3 представляет собой группу Z2 или активированный сложный эфир;
Y1 представляет собой карбоновую кислоту, активированный сложный эфир, изотиоцианатную или тиоцианатную группу;
Y2 представляет собой аминогруппу.
Термины "активированный сложный эфир" или "активный сложный эфир" и их варианты осуществления являются такими, как описано выше. Y2 необязательно представляет собой первичную или вторичную аминогруппу, обычно первичную аминогруппу.
Соединение Z1-[cMBP]-Z2 может иметь обе группы: и Z1 и Z2, представляющие собой MIG. Обычные сМВР-пептиды и группы Z1/Z2 являются такими, как описано выше. В частности, характерно, что сМВР-пептид содержит остаток Asp, Glu или Lys для облегчения конъюгации, как описано для обычных сМВР-пептидов, описанных выше. Наиболее характерно, что сМВР-пептид содержит остаток Lys, как описано на стадии (iv).
Получение Z1-[cMBP]-Z2 описано выше. Пептид Z1-[cMBP]-Z3, где Z3 представляет собой активный сложный эфир, может быть получен из Z1-[cMBP]-Z2, где Z2 представляет собой ОН или биосовместимый катион (Bc), общепринятыми способами.
Оптические репортерные красители (IM), функционализированные подходящим образом для конъюгации с пептидами, доступны для приобретения от GE Healthcare Limited, Atto-Tec, Dyomics, Molecular Probes и других. Большинство таких красителей доступно в виде сложных NHS-эфиров.
Способы конъюгирования подходящих оптических репортеров (IM), в частности красителей, с аминокислотами и пептидами описаны в публикациях Licha (см. выше), а также Flanagan et al. [Bioconj. Chem., 8, 751-756 (1997)]; Lin et al, [ibid, 13, 605-610 (2002)] и Zaheer [Mol. Imaging, 1(4), 354-364 (2002)]. В способах конъюгирования линкерной группы (L) с сМВР-пептидом используют химические технологии, аналогичные тем, в которых участвуют красители как таковые (см. выше), и они известны в данной области.
В дополнение к SEQ ID NO:1, cMBP может дополнительно включать остаток Asp или Glu в пределах 4 аминокислотных остатков пептидного C- или N-конца cMBP-пептида, и -(L)nIM может быть функционализирован аминогруппой, которая конъюгирована с боковой цепью в карбоксиле упомянутого остатка Asp или Glu, что дает амидную связь.
В дополнение к SEQ ID NO:1, cMBP может включать остаток Lys в пределах 4 аминокислотных остатков пептидного C- или N-конца cMBP-пептида, и -(L)nIM может быть функционализирован карбоксильной группой, которая конъюгирована с боковой цепью в эпсилон-аминогруппе упомянутого остатка Lys, что дает амидную связь.
cMBP может включать аминокислотную последовательность либо SEQ ID NO:2 либо SEQ ID NO:3:
Ser-Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6 (SEQ ID NO:2);
Ala-Gly-Ser-Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6-Gly-Thr (SEQ ID NO:3).
Xaa3 может представлять собой Arg.
В дополнение к SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3, cMBP может дополнительно включать по любому из N- или С-концов линкерный пептид, который выбирают из -Gly-Gly-Gly-Lys (SEQ ID NO:4), -Gly-Ser-Gly-Lys- (SEQ ID NO:5) и -Gly-Ser-Gly-Ser-Lys (SEQ ID NO:6).
cMBP может иметь аминокислотную последовательность (SEQ ID NO:7):
Ala-Gly-Ser-Cysa-Tyr-Cysc-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cysd-Trp-Cysb-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys.
Как Z1, так и Z2, могут независимо представлять собой MIG.
Z1 может представлять собой ацетил, и Z2 может представлять собой первичный амид.
n может иметь значение 0.
IM может представлять собой краситель, имеющий максимум поглощения в диапазоне 600-1000 нм.
IM может представлять собой цианиновый краситель.
Цианиновый краситель может иметь Формулу III:

(Формула III)
где:
R1 и R2 независимо представляют собой Н или SO3M1, и, по меньшей мере, один из R1 и R2 представляет собой SO3M1, где М1 представляет собой Н или Bc;
R3 и R4 независимо представляют собой С1-4-алкил или C1-6-карбоксиалкил;
R5, R6, R7 и R8 независимо представляют собой группы Ra;
где Ra представляет собой С1-4-алкил, C1-6-карбоксиалкил или -(CH2)kSO3M1, где k означает целое число 3 или 4;
при условии, что цианиновый краситель имеет всего 1-4 заместителя SO3M1 в группах R1, R2 и Ra.
cMBP может иметь аминокислотную последовательность (SEQ ID NO:7):
Ala-Gly-Ser-Cysa-Tyr-Cysc-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cysd-Trp-Cysb-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys;
Z1 может представлять собой ацетил, и Z2 может представлять собой первичный амид; и
IM может представлять собой краситель, имеющий максимум поглощения в диапазоне 600-1000 нм, необязательно цианиновый краситель, необязательно цианиновый краситель, имеющий Формулу III:

(Формула III)
где:
R1 и R2 независимо представляют собой Н или SO3M1, и, по меньшей мере, один из R1 и R2 представляет собой SO3M1, где М1 представляет собой Н или Bc;
R3 и R4 независимо представляют собой С1-4-алкил или C1-6-карбоксиалкил;
R5, R6, R7 и R8 независимо представляют собой группы Ra;
где Ra представляет собой С1-4-алкил, C1-6-карбоксиалкил или -(CH2)kSO3M1, где k означает целое число 3 или 4;
при условии, что цианиновый краситель имеет всего 1-4 заместителя SO3M1 в группах R1, R2 и Ra.
Состав, при перерастворении, может иметь рН от приблизительно рН 6,3 до приблизительно рН 9, необязательно от приблизительно рН 6,3 до приблизительно рН 9, необязательно от приблизительно рН 6,5 до приблизительно рН 8,5, необязательно от приблизительно рН 6,8 до приблизительно рН 8,2, необязательно от приблизительно рН 6,8 до приблизительно рН 8, необязательно от приблизительно рН 7 до приблизительно рН 8.
Буферный агент может присутствовать в количестве, которое обеспечивает, при перерастворении, раствор, имеющий рН от приблизительно рН 6,3 до приблизительно рН 9, необязательно от приблизительно рН 6,3 до приблизительно рН 9, необязательно от приблизительно рН 6,5 до приблизительно рН 8,5, необязательно от приблизительно рН 6,8 до приблизительно рН 8,2, необязательно от приблизительно рН 6,8 до приблизительно рН 8, необязательно от приблизительно рН 7 до приблизительно рН 8.
Мольное соотношение API:буферный агент может представлять собой приблизительно 1 моль API:приблизительно 17 - приблизительно 47 моль буферного агента. Мольное соотношение API:буферный агент может представлять собой приблизительно 1 моль API:приблизительно 27 - приблизительно 47 моль буферного агента. Мольное соотношение API:буферный агент может представлять собой приблизительно 1 моль API:приблизительно 30 - приблизительно 47 моль буферного агента. Мольное соотношение API:буферный агент может представлять собой приблизительно 1 моль API:приблизительно 34 - приблизительно 47 моль буферного агента.
Мольное соотношение API:буферный агент может представлять собой приблизительно 1 моль API:приблизительно 27 - приблизительно 38 моль буферного агента. Мольное соотношение API:буферный агент может представлять собой приблизительно 1 моль API:приблизительно 30 - приблизительно 38 моль буферного агента. Мольное соотношение API:буферный агент может представлять собой приблизительно 1 моль API:приблизительно 34 - приблизительно 38 моль буферного агента.
Мольное соотношение API:буферный агент может представлять собой приблизительно 1 моль API:приблизительно 38 моль буферного агента.
Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 105 - приблизительно 216 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 105 - приблизительно 163 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 105 - приблизительно 154 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 105 - приблизительно 145 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 105 - приблизительно 141 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 105 - приблизительно 132 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 105 - приблизительно 129 моль лиопротектора.
Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 129 - приблизительно 216 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 129 - приблизительно 163 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 129 - приблизительно 154 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 129 - приблизительно 145 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 129 - приблизительно 141 моль лиопротектора. Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 129 - приблизительно 326 моль лиопротектора.
Мольное соотношение API:лиопротектор может представлять собой приблизительно 1 моль API:приблизительно 129 моль лиопротектора.
Состав может содержать от приблизительно 4 до приблизительно 12% по массе API, необязательно приблизительно 8 - приблизительно 10% по массе API, необязательно приблизительно 9% по массе API.
Состав может содержать от приблизительно 3 до приблизительно 35% по массе буферного агента, необязательно от приблизительно 7 до приблизительно 35% по массе буферного агента, необязательно от приблизительно 12 до приблизительно 35% по массе буферного агента, необязательно от приблизительно 15 до приблизительно 35% по массе буферного агента, необязательно от приблизительно 18 до приблизительно 35% по массе буферного агента, необязательно от приблизительно 25 до приблизительно 35% по массе буферного агента, необязательно от приблизительно 32 до приблизительно 35% по массе буферного агента, необязательно приблизительно 32% по массе буферного агента.
Состав может содержать от приблизительно 56 до приблизительно 91% по массе лиопротектора, необязательно от приблизительно 56 до приблизительно 82% по массе лиопротектора, необязательно от приблизительно 56 до приблизительно 77% по массе лиопротектора, необязательно от приблизительно 56 до приблизительно 75% по массе лиопротектора, необязательно от приблизительно 56 до приблизительно 72% по массе лиопротектора, необязательно от приблизительно 56 до приблизительно 66% по массе лиопротектора, необязательно от приблизительно 56 до приблизительно 58% по массе лиопротектора, необязательно приблизительно 58% по массе лиопротектора.
Должно быть ясно, что компоненты состава выбираются из условия, что общее количество составляет 100% по массе.
Состав может содержать, по меньшей мере, 40 мМ буферного агента.
Буферный агент может представлять собой, по меньшей мере, один буфер, выбираемый из фосфатного буфера и алканоламинового буфера. Фосфатный буфер может включать гидрофосфат и дигидрофосфат. Фосфатный буфер может быть гидратирован.
Алканоламиновый буфер может включать трис(гидроксиметил)аминометан. Алканоламиновый буфер может включать 2-амино-2-(гидроксиметил)пропан-1,3-диол.
Лиопротектор может представлять собой, по меньшей мере, одно вещество, выбираемое из сахара, спирта и сахарного спирта, и их производных. Необязательно лиопротектор представляет собой, по меньшей мере, одно вещество, выбираемое из сахара и сахарного спирта, и их производных. Необязательно лиопротектор представляет собой, по меньшей мере, одно вещество, выбираемое из моносахарида, дисахарида, олигосахарида, полисахарида, и их производных. Лиопротектор может представлять собой, по меньшей мере, одно вещество, выбираемое из сахарозы и маннита, и их производных. Лиопротектор может представлять собой манит, или его производное.
Состав может дополнительно содержать регулятор тоничности.
Лиопротектор может также служить в качестве регулятора тоничности, и в таком случае он обладает комбинированным действием и в качестве лиопротектора и регулятора тоничности.
Согласно второму аспекту изобретения, обеспечивают способ получения лиофилизированного состава, где способ включает в себя стадии:
а) обеспечения загрузки активного фармацевтического ингредиента (API), буферного агента, и лиопротектора во флакон для лиофилизации;
b) осуществления первой стадии удаления воды; и
c) осуществления второй стадии удаления воды;
где лиопротектор добавляют до того, как проводят лиофилизацию.
Первая стадия удаления воды может быть проведена при температуре приблизительно -30°С или ниже, необязательно приблизительно -35°С или ниже, необязательно приблизительно -38°С или ниже.
Вторая стадия удаления воды может быть проведена при температуре приблизительно 10°С или выше, необязательно приблизительно 15°С или выше, необязательно приблизительно 20°С или выше.
По меньшей мере, одна из стадий, выбираемых из первой и второй стадий удалении воды, может быть проведена при давлении 50 мкбар или менее. Необязательно обе стадии, выбираемые из первой и второй стадий удаления воды, могут быть проведены при давлении 50 мкбар или менее.
Лиофилизированный состав может представлять собой лиофилизированный состав по первому аспекту изобретения.
Согласно одному аспекту изобретения, обеспечивают лиофилизированный состав, полученный с применением второго аспекта изобретения.
Согласно третьему аспекту изобретения, обеспечивают фармацевтическую композицию, содержащую состав по первому аспекту изобретения и биосовместимый носитель, в форме, подходящей для введения млекопитающему.
Биосовместимый носитель может представлять собой растворитель, обычно водный растворитель, обычно воду. Растворитель может представлять собой текучую среду.
«Биосовместимый носитель» может представлять собой текучую среду, особенно жидкость, в которой агент визуализации может быть суспендирован или растворен из условия, чтобы композиция была физиологически переносимой, то есть, могла быть введена в организм млекопитающего без проявления токсичности или излишнего дискомфорта. Биосовместимый носитель представляет собой подходящим образом инъецируемый жидкий носитель, такой как стерильная апирогенная вода для инъекции; водный раствор, такой как физиологический раствор (который может быть преимущественно сбалансирован так, чтобы конечный продукт для инъекции был изотоническим); водный раствор одного или более веществ, регулирующих тоничность (например, солей катионов плазмы с биосовместимыми противоионами), сахара (например, глюкозу или сахарозу), сахарные спирты (например, сорбит или маннит), гликоли (например, глицерин) или другие неионные полиольные вещества (например, полиэтиленгликоли, пропиленгликоли и тому подобное). Биосовместимый носитель может представлять собой апирогенную воду для инъекции или изотонический физиологический раствор. Агенты визуализации и биосовместимый носитель, каждый из них, поставляются в подходящих флаконах или сосудах, которые включают герметичный контейнер, обеспечивающий поддержание стерильной целостности и/или радиоактивной безопасности, а также необязательно инертный газ в свободном пространстве над продуктом (например, азот или аргон), обеспечивающий при этом возможность добавления и извлечения растворов шприцем или канюлей. Предпочтительный такой контейнер представляет собой закрытый герметичной мембраной флакон, где газонепроницаемая заглушка прижата дополнительным укупорочным средством (как правило, алюминиевым). Упомянутая заглушка является подходящей для однократного или многократного прокалывания иглой для подкожных инъекций (например, герметичная заглушка с прижатой мембраной), при одновременном сохранении стерильной целостности. Такие контейнеры имеют дополнительное преимущество в том, что заглушка может выдерживать вакуум при необходимости (например, в случае смены газа в свободном пространстве над продуктом или дегазации растворов) и выдерживать изменения давления, такие как падения давления, при этом не допускает проникновения внешних атмосферных газов, таких как кислород или водяной пар.
Фармацевтическая композиция может иметь дозировку, подходящую для индивидуального пациента, и может быть предложена в подходящем шприце или контейнере.
Многодозовые контейнеры включают флакон с единым содержимым (например, объемом от 10 до 30 см3), который вмещает множество доз для пациента, причем разовые дозы для пациента, таким образом, могут быть извлечены в шприцы для клинического применения в различные интервалы времени в течение приемлемого срока годности препарата в соответствии с данной клинической ситуацией. Предварительно заполненные шприцы предназначены для вмещения однократной дозы для человека, или "стандартной дозы" и, таким образом, предпочтительно представляют собой одноразовые или другие шприцы, подходящие для клинического применения. Фармацевтические композиции могут иметь дозировку, подходящую для индивидуального пациента, и могут быть предложены в подходящем шприце или контейнере, как описано выше.
Фармацевтическая композиция может иметь рН от приблизительно рН 6,3 до приблизительно рН 9, необязательно от приблизительно рН 6,3 до приблизительно рН 9, необязательно от приблизительно рН 6,5 до приблизительно рН 8,5, необязательно от приблизительно рН 6,8 до приблизительно рН 8,2, необязательно от приблизительно рН 7 до приблизительно рН 8.
Согласно четвертому аспекту настоящего изобретения, предоставляют набор для приготовления фармацевтической композиции по третьему аспекту изобретения, где набор содержит состав по первому аспекту изобретения в такой стерильной твердой форме, при которой, после перерастворения в результате стерильной подачи биосовместимого носителя по третьему аспекту изобретения, происходит растворение, что дает желаемую фармацевтическую композицию.
Стерильная твердая форма может представлять собой лиофилизированное твердое вещество.
Согласно пятому аспекту изобретения, обеспечивают способ визуализации организма млекопитающего, который включает применение, по меньшей мере, одного из следующего, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения.
Должно быть ясно, что для применения in vivo, состав изготавливают в форме, подходящей для введения млекопитающему, например, путем перерастворения с помощью биосовместимого носителя.
Визуализация может быть проведена in vivo.
Визуализация может представлять собой оптическую визуализацию.
Термин "оптическая визуализация" означает любой способ, который позволяет получать изображение, для детектирования, определения стадии или диагностики заболевания, отслеживания развития заболевания или для отслеживания лечения заболевания, на основе взаимодействия со светом в диапазоне от красной до ближней инфракрасной области спектра (длина волны 400-1200 нм). Оптическая визуализация дополнительно включает все способы от прямой визуализации без использования какого-либо устройства до визуализации с использованием устройств, таких как различные видеоизмерительные приборы, катетеры и оборудование для оптической визуализации, например, автоматизированное оборудование для томографических изображений. Устройства и методы измерений включают: флуоресцентную визуализацию, люминесцентную визуализацию; эндоскопию; флуоресцентную эндоскопию; оптическую когерентную томографию; визуализацию по коэффициенту пропускания; регулируемую по времени визуализацию по коэффициенту пропускания; конфокальную визуализацию; нелинейную микроскопию; фотоакустическую визуализацию; акустооптическую визуализацию; спектроскопию; отражательную спектроскопию; интерферометрию; когерентную интерферометрию; диффузную оптическую томографию и опосредованную флуоресценцией диффузную оптическую томографию (непрерывно-волновые системы, системы для временного и частотного анализа), и измерение светорассеяния, поглощения, поляризации, люминесценции, времени жизни флуоресценции, квантового выхода и гашения флуоресценции, но не ограничиваются этим. Дополнительные подробности этих методов предоставлены в: (Tuan Vo-Dinh (редактор): "Biomedical Photonics Handbook" (2003), CRC Press LCC; Mycek & Pogue (редакторы): "Handbook of Biomedical Fluorescence" (2003), Marcel Dekker, Inc.; Splinter & Hopper: "An Introduction to Biomedical Optics" (2007), CRC Press LCC.
Визуализация может быть проведена с получением изображений сайтов сверхэкспрессии или локализации cMet.
Состав по первому аспекту изобретения или фармацевтической композиции по третьему аспекту изобретения могут быть введены в организм млекопитающего предварительно.
Способ оптической визуализации может использовать флуоресцентную отражательную визуализацию (Fluorescence Reflectance Imaging=FRI). При FRI, агент визуализации по настоящему изобретению вводят субъекту, подлежащему диагностике, и затем поверхность ткани субъекта облучают возбуждающим светом - обычно с возбуждением незатухающих волн (CW). Свет возбуждает репортерную молекулу (IM). Флуоресценцию от агента визуализации, которая генерируется возбуждающим светом, детектируют с помощью детектора флуоресценции. Возвращающийся свет может быть профильтрован для отделения флуоресцентного компонента (исключительно или частично). На основе флуоресцентного свечения формируется изображение. Обычно проводится минимальная обработка (без использования процессора для расчета оптических параметров, таких как время жизни, квантовый выход и т.д.), и данное изображение отображает интенсивность флуоресценции. Агент визуализации предназначен для концентрирования в пораженной области, с обеспечением более высокой интенсивности флуоресценции. Таким образом, болезненная область дает положительный контраст в картине интенсивности флуоресценции. Изображение может быть получено с использованием ПЗС-камеры или чипа, благодаря чему осуществима визуализация в режиме реального времени.
Длину волны возбуждения варьируют в зависимости от типа используемого красителя. Оборудование для генерирования возбуждающего света может представлять собой обычный источник возбуждающего света, такой как: лазер (например, ионный лазер, лазер на красителях или полупроводниковый лазер); источник галогенового света или источник ксенонового света. Различные оптические фильтры необязательно могут быть использованы для получения оптимальной длины волны возбуждения.
Cпособ FRI может включать следующие стадии:
a) облучают поверхность интересующей ткани возбуждающим светом;
b) детектируют флуоресценцию от агента визуализации, которая генерируется при возбуждении агента визуализации;
c) необязательно подвергают фильтрации свет, детектируемый детектором флуоресценции, с отделением флуоресцентного компонента; и
d) получают изображение поверхности интересующей ткани на основе флуоресцентного свечения на стадиях (b) или (c).
На стадии (a) возбуждающий свет может представлять собой незатухающую волну (CW) по природе.
Стадия (a) может быть проведена в организме млекопитающего.
В альтернативном способе визуализации используют FDPM (миграцию фотонов в частотной области). Это имеет преимущества по сравнению со способами, использующими незатухающую волну (CW), где важна большая глубина детектирования IM в ткани [Sevick-Muraca et al., Curr. Opin. Chem. Biol., 6, 642-650 (2002)]. В случае такой частотной/временной визуализации, обеспечивается преимущество, если IM имеет флуоресцентные свойства, которые можно модулировать в зависимости от глубины поражения ткани, подлежащей визуализации, и типа используемого оборудования.
Способ FDPM может включать стадии, где:
a) подвергают светорассеивающую биологическую ткань упомянутого организма млекопитающего, имеющую гетерогенную структуру, воздействию света от источника света, имеющего заранее установленную варьируемую по времени интенсивность, с обеспечением возбуждения агента визуализации, где ткань многократно рассеивает возбуждающий свет;
b) детектируют излучение многократно рассеянного света от ткани в ответ на упомянутое воздействие;
c) проводят количественное определение параметра флуоресценции по всей ткани на основании этого излучения путем установления ряда показателей с использованием процессора, где каждый из показателей соответствует уровню параметра флуоресценции в различных положениях в пределах этой ткани, где данный уровень параметра флуоресценции варьируется в зависимости от гетерогенной структуры этой ткани; и
d) генерируют изображение ткани путем построения изображения гетерогенной структуры ткани в соответствии с показателями стадии (c).
Способ оптической визуализации может включать флуоресцентную визуализацию, необязательно флуоресцентную эндоскопию.
Данный способ может быть использован для содействия детектированию, проведению диагностики, проведению хирургического вмешательства, определению стадии заболевания, проведению лечения, мониторингу лечения, отслеживанию прогрессирования заболевания или отслеживанию терапии.
Данный способ может быть использован для содействия детектированию, проведению диагностики, проведению хирургического вмешательства, определению стадии заболевания, проведению лечения, мониторингу лечения, отслеживанию прогрессирования заболевания или отслеживанию терапии рака, необязательно колоректального рака.
Согласно четвертому аспекту изобретения, обеспечивают способ детектирования, проведения диагностики, проведения хирургического вмешательства, определения стадии заболевания, проведения лечения, отслеживания лечения, мониторинга прогрессирования заболевания или отслеживания терапии, включающий в себя способ визуализации по пятому аспекту изобретения.
Согласно дополнительному аспекту изобретения, обеспечивают, по меньшей мере, один состав, выбираемый из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, для использования в качестве агента визуализации при визуализации организма млекопитающего.
Согласно дополнительному аспекту изобретения, обеспечивают, по меньшей мере, один состав, выбираемый из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, для использования в качестве лекарственного препарата.
Согласно дополнительному аспекту изобретения, обеспечивают, по меньшей мере, один состав, выбираемый из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, для использования в детектировании, проведении диагностики, проведении хирургического вмешательства, определении стадии заболевания, проведении лечения, отслеживании лечения, мониторинге прогрессирования заболевания или отслеживании терапии.
Согласно дополнительному аспекту изобретения, обеспечивают, по меньшей мере, один состав, выбираемый из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, для использования в детектировании, проведении диагностики, проведении хирургического вмешательства, определении стадии заболевания, проведении лечения, отслеживании лечения, мониторинге прогрессирования заболевания или отслеживании терапии одного или более состояний, выбираемых из предракового состояния и рака, необязательно одного или более раковых заболеваний, выбираемых из колоректального рака, рака пищевода, рака груди, рака предстательной железы, рака головы, рака шеи, рака яичников, рака прямой кишки, рака поджелудочной железы, рака щитовидной железы, рака желудка и саркомы.
Согласно дополнительному аспекту изобретения, обеспечивают, по меньшей мере, один состав, выбираемый из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, для использования в детектировании, проведении диагностики, проведении хирургического вмешательства, определении стадии заболевания, проведении лечения, отслеживании лечения, мониторинге прогрессирования заболевания или отслеживании терапии сайтов сверхэкспрессии или локализации cMet.
Согласно дополнительному аспекту изобретения, обеспечивают, по меньшей мере, один состав, выбираемый из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, для использования в получении изображения сайтов сверхэкспрессии или локализации cMet.
Согласно дополнительному аспекту изобретения, обеспечивают способ детектирования, проведения диагностики, проведения хирургического вмешательства, определения стадии заболевания, проведения лечения, отслеживания лечения, мониторинга прогрессирования заболевания или отслеживания терапии с использованием, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения.
Согласно дополнительному аспекту изобретения, обеспечивают способ визуализации организма млекопитающего с использованием, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения.
Согласно дополнительному аспекту изобретения, обеспечивают способ детектирования, проведения диагностики, проведения хирургического вмешательства, определения стадии заболевания, проведения лечения, отслеживания лечения, мониторинга прогрессирования заболевания или отслеживания терапии одного или более состояний, выбираемых из предракового состояния и рака, необязательно одного или более раковых заболеваний, выбираемых из колоректального рака, рака пищевода, рака груди, рака предстательной железы, рака головы, рака шеи, рака яичников, рака прямой кишки, рака поджелудочной железы, рака щитовидной железы, рака желудка и саркомы, с использованием, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения.
Согласно дополнительному аспекту изобретения, обеспечивают способ детектирования, проведения диагностики, проведения хирургического вмешательства, определения стадии заболевания, проведения лечения, отслеживания лечения, мониторинга прогрессирования заболевания или отслеживания терапии сайтов сверхэкспрессии или локализации cMet с использованием, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения.
Согласно дополнительному аспекту изобретения, обеспечивают способ получения изображения сайтов сверхэкспрессии или локализации cMet, необязательно in vivo, с использованием, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения.
Согласно дополнительному аспекту изобретения, обеспечивают применение, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения.
Согласно дополнительному аспекту изобретения, обеспечивают применение, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, в детектировании, проведении диагностики, проведении хирургического вмешательства, определении стадии заболевания, проведении лечения, отслеживании лечения, мониторинге прогрессирования заболевания или отслеживании терапии.
Согласно дополнительному аспекту изобретения, обеспечивают применение, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, в качестве агента визуализации.
Согласно дополнительному аспекту изобретения, обеспечивают применение, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, в детектировании, проведении диагностики, проведении хирургического вмешательства, определении стадии заболевания, проведении лечения, отслеживании лечения, мониторинге прогрессирования заболевания или отслеживании терапии одного или более состояний, выбираемых из предракового состояния и рака, необязательно одного или более раковых заболеваний, выбираемых из колоректального рака, рака пищевода, рака груди, рака предстательной железы, рака головы, рака шеи, рака яичников, рака прямой кишки, рака поджелудочной железы, рака щитовидной железы, рака желудка и саркомы.
Согласно дополнительному аспекту изобретения, обеспечивают применение, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, в детектировании, проведении диагностики, проведении хирургического вмешательства, определении стадии заболевания, проведении лечения, отслеживании лечения, мониторинге прогрессирования заболевания или отслеживании терапии сайтов сверхэкспрессии или локализации cMet.
Согласно дополнительному аспекту изобретения, обеспечивают применение, по меньшей мере, одного состава, выбираемого из состава по первому аспекту изобретения и фармацевтической композиции по третьему аспекту изобретения, в получении изображения сайтов сверхэкспрессии или локализации cMet, необязательно in vivo.
Альтернативные признаки и различные варианты осуществления согласно настоящему описанию применяются к каждому в отдельности аспекту и к каждому в отдельности варианту осуществления соответствующим образом.
Краткое Описание Чертежей
Далее варианты осуществления изобретения будут описаны, в качестве примера, со ссылкой на чертежи, где:
Фиг. 1 отражает API (EMI-137).
Подробное описание изобретения
Агент оптической визуализации, который описан в WO2008/139207, используют для проведения серии экспериментов, направленных на обнаружение более стабильного состава, который будет проявлять более хорошее перерастворение, в частности, при соответственных значениях рН и/или тоничности для внутривенного применения. Используемое соединение представляет собой EMI-137, которое показано на Фиг. 1.
В экспериментах, рассматриваемых ниже, используют ацетатную соль EMI-137, но все массы и вычисления с ними делают с использованием свободного иона.
После перерастворения, внутривенный лекарственный продукт должен представлять собой изотонический раствор и иметь физиологический рН, что позволит ему быть подходящим для внутривенного введения. Также он должен быть гомогенным и должен обеспечивать солюбилизацию без образования агломератов. Однако, при растворении в воде EMI-137 имеет рН 4,6, и показывает значительную степень образования более крупных структур или агломератов. Такая агломерация является только частично обратимой при повышении рН раствора, что делает его непригодным для внутривенного введения. Таким образом, требуется состав, который при перерастворении будет давать рН, подходящий для внутривенного введения, и, который будет в значительной мере гомогенным и в значительной мере свободным от агломератов или частиц. Кроме того, EMI-137 имеет сравнительно короткий срок годности, и, следовательно, в отношении практических целей и целей безопасности, является не очень пригодным в своей изолированной форме. Таким образом, требуется состав, который будет продлевать стабильность и срок годности EMI-137.
Получение EMI-137 и Визуализация с его использованием
Пример 1 предоставляет синтез cMBP-пептида (Соединение 1 (включающее SEQ ID NO:7)). Пример 2 предоставляет синтез родственного пептида в качестве отрицательного контроля, где пептидная последовательность Соединения 1 подвергнута скремблированию, с получением соединения 2, которое имеет следующую пептидную последовательность:
Thr-Gly-Glu-Cys-Thr-Cys-Pro-Tyr-Trp-Glu-Phe-Arg-Pro-Cys-Glu-Cys-Gly-Ser-Tyr-Ser-Gly-Ala-Gly-Gly-Gly-Lys
(SEQ ID NO:8).
Пример 3 предоставляет синтез цианинового красителя Cy5**. Пример 4 предоставляет синтез активного сложного эфира Cy5**. Пример 5 предоставляет конъюгацию цианиновых красителей с пептидами (cMBP-пептидом и контролем). Соединения 3 (включающие SEQ ID NO:7), 4 (включающие SEQ ID NO:8), 5 (включающие SEQ ID NO:7), 6 (включающие SEQ ID NO:7) и 7 (включающие SEQ ID NO:8) сравнивают в этом отношении. Пример 6 предоставляет способ определения аффинности пептидов по отношению к cMet in vitro. Результаты показывают, что связывание является селективным, даже в том случае, когда прикреплен оптический репортерный визуализируемый фрагмент (цианиновый краситель). Пример 7 предоставляет данные по проведению испытания in vivo Соединений 5 и 7 в животных моделях рака. Отмечено, что Соединение 5 проявляет превосходные соотношения опухоль:фон, тогда как Соединение 7 (отрицательный контроль) не делает никаких различий между опухолью и фоном.
Структуры Соединений приведены в Таблице 2 ниже.
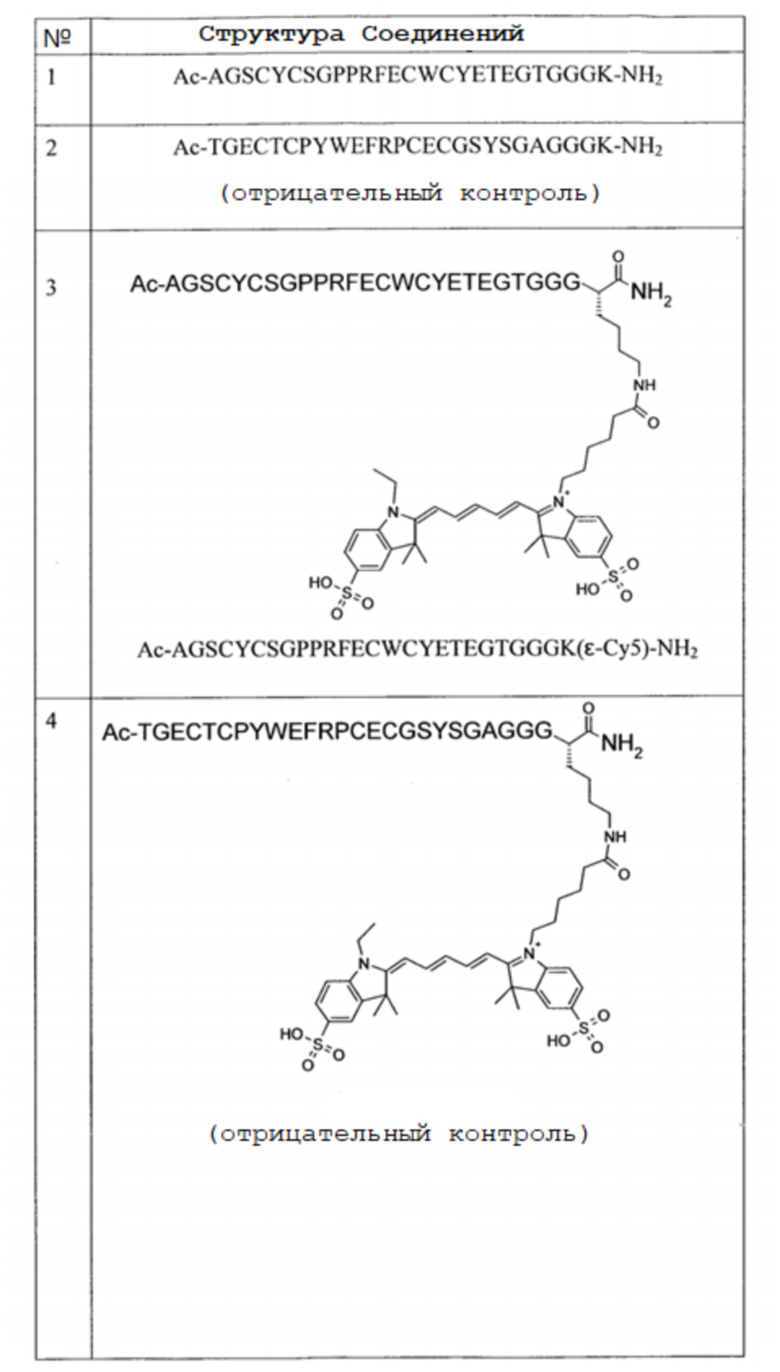
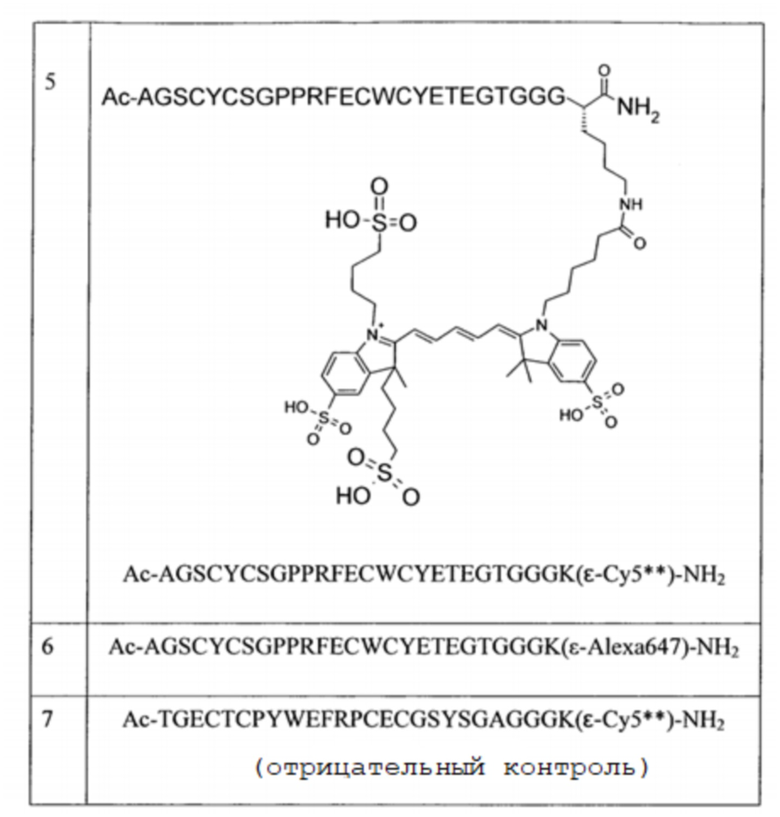
Таблица 2: Структуры Соединений
Пример 1: Синтез Соединения 1
Стадия (а): синтез защищенного линейного пептида-предшественника
Линейный пептид-предшественник имеет структуру:
Ac-Ala-Gly-Ser-Cys-Tyr-Cys(Acm)-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cys(Acm)-Trp-Cys-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys-NH2 (включающую SEQ ID NO:7).
Пептидил-смолу H-Ala-Gly-Ser(tBu)-Cys(Trt)-Tyr(tBu)-Cys(Acm)-Ser(tBu)-Gly-Pro-Pro-Arg(Pbf)-Phe-Glu(OtBu)-Cys(Acm)-Trp(Boc)-Cys(Trt)-Tyr(tBu)-Glu(OtBu)-Thr(ΨMe, Mepro)-Glu(OtBu)-Gly-Thr(tBu)-Gly-Gly-Gly-Lys(Boc)-полимер (включающую SEQ ID NO:7) синтезируют на пептидном синтезаторе Applied Biosystems 433A с использованием Fmoc-химии, начиная с 0,1 ммоль смолы Rink Amide Novagel. На стадиях сочетания наносят избыток, составляющий 1 ммоль предварительно активированных аминокислот (с использованием HBTU). В эту последовательность встраивают Glu-Thr-псевдопролин (Novabiochem 05-20-1122). Смолу переносят в продуваемый азотом аппарат и обрабатывают раствором уксусного ангидрида (1 ммоль) и NMM (1 ммоль), растворенных в DCM (5 мл), в течение 60 минут. Раствор ангидрида удаляют фильтрацией, и смолу промывают посредством DCM и сушат в потоке азота.
Одновременное удаление защитных групп боковой цепи и отщепление пептида от смолы осуществляют в TFA (10 мл), содержащей 2,5% TIS, 2,5% 4-тиокрезола и 2,5% воды, в течение 2 часов 30 минут. Смолу удаляют фильтрацией, TFA удаляют в вакууме и к остатку добавляют диэтиловый эфир. Образовавшийся осадок промывают диэтиловым эфиром и сушат на воздухе с предоставлением 264 мг неочищенного пептида.
Очистка посредством препаративной высокоэффективной жидкостной хроматографии (HPLC) (условия градиентного элюирования: 20-30% B в течение 40 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 10 мл/мин, колонка: Phenomenex Luna 5мкм С18 (2) 50×21,20 мм, детектирование: УФ 214 нм, время удерживания продукта: 30 мин) неочищенного пептида предоставляет 100 мг чистого линейного предшественника Соединения 1. Чистый продукт анализируют посредством аналитической HPLC (условия градиентного элюирования: 10-40% B в течение 10 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 0,3 мл/мин, колонка: Phenomenex Luna 3 мкм С18 (2) 50×2 мм, детектирование: УФ 214 нм, время удерживания продукта: 6,54 мин). Получение дополнительных характеристик продукта осуществляют с использованием масс-спектрометрии с ионизацией электрораспылением (МН22+ рассчитано: 1464,6, МН22+ обнаружено: 1465,1).
Стадия (b): Получение моноциклического Cys4-16 дисульфидного мостика
Cys4-16; Ac-Ala-Gly-Ser-Cys-Tyr-Cys(Acm)-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cys(Acm)-Trp-Cys-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys-NH2 (включающий SEQ ID NO:7).
Линейный предшественник со стадии (а) (100 мг) растворяют в смеси 5% DMSO/вода (200 мл) и рН этого раствора доводят до значения рН 6 с использованием аммиака. Реакционную смесь перемешивают в течение 5 суток. Затем рН этого раствора доводят до значения рН 2 с использованием TFA, и большую часть растворителя удаляют выпариванием в вакууме. Остаток (40 мл) впрыскивают порциями в колонку для препаративной HPLC для очистки продукта.
Очистка посредством препаративной HPLC (условия градиентного элюирования: 0% B в течение 10 мин, затем 0-40% B в течение 40 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 10 мл/мин, колонка: Phenomenex Luna 5 мкм C18 (2) 250×21,20 мм, детектирование: УФ 214 нм, время удерживания продукта: 44 мин) остатка дает 72 мг чистого моноциклического предшественника Соединения 1. Чистый продукт (в виде смеси изомеров Р1-Р3) анализируют посредством аналитической HPLC (условия градиентного элюирования: 10-40% B в течение 10 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой АСN/0,1% TFA, скорость потока: 0,3 мл/мин, колонка: Phenomenex Luna 3 мкм C18 (2) 50×2 мм, детектирование: УФ 214 нм, время удерживания продукта: 5,37 мин (Р1); 5,61 мин (Р2); 6,05 мин (Р3)). Получение дополнительной характеристики продукта осуществляют с использованием масс-спектрометрии с ионизацией электрораспылением (МН22+ рассчитано: 1463,6, МН22+ обнаружено: 1464,1 (Р1); 1464,4 (Р2); 1464,3 (Р3)).
Стадия (c): Получение вторичного Cys6-14 дисульфидного мостика (Соединение 1)
Моноциклический предшественник со стадии (b) (72 мг) растворяют в смеси 75% АсОН/вода (72 мл) под защитным слоем азота. Добавляют 1 М HCl (7,2 мл) и 0,05 М I2 в АсОН (4,8 мл) в указанном порядке, и эту смесь перемешивают в течение 45 мин. Добавляют 1М аскорбиновую кислоту (1 мл) с получением бесцветной смеси. Большую часть растворителей выпаривают в вакууме, и остаток (18 мл) разбавляют смесью вода/0,1% TFA (4 мл), и продукт очищают с использованием препаративной HPLC.
Очистка посредством препаративной HPLC (условия градиентного элюирования: 0% B в течение 10 мин, затем 20-30% B в течение 40 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 10 мл/мин, колонка: Phenomenex Luna 5 мкм C18 (2) 250×21,20 мм, детектирование: УФ 214 нм, время удерживания продукта: 43-53 мин) данного остатка дает 52 мг чистого Соединения 1. Чистый продукт анализируют посредством аналитической HPLC (условия градиентного элюирования: 10-40% B в течение 10 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 0,3 мл/мин, колонка: Phenomenex Luna 3 мкм C18 (2) 50×2 мм, детектирование: УФ 214 нм, время удерживания продукта: 6,54 мин). Получение дополнительных характеристик осуществляют с использованием масс-спектрометрии с ионизацией электрораспылением (МН22+ рассчитано: 1391,5, МН22+ обнаружено: 1392,5).
Пример 2: Синтез Соединения 2
Ac-Thr-Gly-Glu-Cys-Thr-Cys(Acm)-Pro-Tyr-Trp-Glu-Phe-Arg-Pro-Cys(Acm)-Glu-Cys-Gly-Ser-Tyr-Ser-Gly-Ala-Gly-Gly-Gly-Lys-NH2
Соединение 2 (включающее SEQ ID NO:8) представляет собой отрицательный контроль, где пептидная последовательность Соединения 1 была подвергнута скремблированию.
Стадия (а): синтез защищенного линейного пептида-предшественника
Пептидил-смолу H-Thr(tBu)-Gly-Glu(OtBu)-Cys(Trt)-Thr(tBu)-Cys(Acm)-Pro-Tyr(tBu)-Trp(Boc)-Glu(OtBu)-Phe-Arg(Pbf)-Pro-Cys(Acm)-Glu(OtBu)-Cys(Trt)-Gly-Ser(tBu)-Tyr(tBu)-Ser(ΨMe, Mepro)-Gly-Ala-Gly-Gly-Gly-Lys(Boc)-полимер (включающую SEQ ID NO:8) синтезируют на пептидном синтезаторе Applied Biosystems 433A с использованием Fmoc-химии, начиная с 0,1 ммоль смолы Rink Amide Novagel. На стадиях сочетания наносят избыток, составляющий 1 ммоль предварительно активированных аминокислот (с использованием HBTU). В эту последовательность встраивают Tyr-Ser-псевдопролин (Novabiochem 05-20-1014). Смолу переносят в продуваемый азотом аппарат и обрабатывают раствором уксусного ангидрида (1 ммоль) и NMM (1 ммоль), растворенных в DCM (5 мл), в течение 60 минут. Раствор ангидрида удаляют фильтрацией, и смолу промывают посредством DCM и сушат в потоке азота.
Одновременное удаление защитных групп боковой цепи и отщепление пептида от смолы осуществляют в TFA (10 мл), содержащей 2,5% TIS, 2,5% 4-тиокрезола и 2,5% воды, в течение 2 часов 10 минут. Смолу удаляют фильтрацией, TFA удаляют в вакууме и к остатку добавляют диэтиловый эфир. Образовавшийся осадок промывают диэтиловым эфиром и сушат на воздухе с получением 216 мг неочищенного пептида.
Очистка посредством препаративной HPLC (условия градиентного элюирования: 20-30% B в течение 40 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 50 мл/мин, колонка: Phenomenex Luna 5 мкм C18 (2) 250×50 мм, детектирование: УФ 214 нм, время удерживания продукта: 34,1 мин) неочищенного пептида дает чистый линейный предшественник отрицательного контроля DX-1662, растворенный в 200 мл смеси ACN/вода. Чистый продукт анализируют посредством аналитической HPLC (условия градиентного элюирования: 10-40% B в течение 5 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 0,6 мл/мин, колонка: Phenomenex Luna 3 мкм C18 (2) 20×2 мм, детектирование: УФ 214 нм, время удерживания продукта: 3,52 мин). Получение дополнительной характеристики продукта осуществляют с использованием масс-спектрометрии с ионизацией электрораспылением (МН22+ рассчитано: 1464,6, МН22+ обнаружено: 1464,9).
Стадия (b): Получение моноциклического Cys4-16 дисульфидного мостика
Cys4-16; Ac-Thr-Gly-Glu-Cys-Thr-Cys(Acm)-Pro-Tyr-Trp-Glu-Phe-Arg-Pro-Cys(Acm)-Glu-Cys-Gly-Ser-Tyr-Ser-Gly-Ala-Gly-Gly-Gly-Lys-NH2 (включающий SEQ ID NO:8)
К раствору линейного предшественника отрицательного контроля со стадии (а) (200 мл, см. 4.3.1) добавляют DMSO (10 мл), и рН этого раствора доводят до значения рН 7 с использованием аммиака. Реакционную смесь нагревают при 40°C в течение 18 часов, затем при 60°C в течение 60 мин. Значение рН этого раствора доводят до рН 2 с использованием TFA, и ACN удаляют выпариванием в вакууме. Этот остаток подвергают очистке методом препаративной HPLC.
Очистка посредством препаративной HPLC (условия градиентного элюирования: 0% B в течение 5 мин, затем 20-30% B в течение 60 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой АСN/0,1% TFA, скорость потока: 50 мл/мин, колонка: Phenomenex Luna 5 мкм C18 (2) 250×50 мм, детектирование: УФ 214 нм, время удерживания продукта: 29,6 мин) остатка дает чистый моноциклический предшественник отрицательного контроля в 100 мл смеси ACN/вода. Чистый продукт анализируют посредством аналитической HPLC (условия градиентного элюирования: 10-40% B в течение 5 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 0,6 мл/мин, колонка: Phenomenex Luna 3 мкм C18 (2) 20×2 мм, детектирование: УФ 214 нм, время удерживания продукта: 3,46 мин). Получение дополнительных характеристик осуществляют с использованием масс-спектрометрии с ионизацией электрораспылением (МН22+ рассчитано: 1463,6, МН22+ обнаружено: 1463,7).
Стадия (c): Получение вторичного Cys6-14 дисульфидного мостика (Соединение 2)
Cys4-16, 6-14; Ac-Thr-Gly-Glu-Cys-Thr-Cys-Pro-Tyr-Trp-Glu-Phe-Arg-Pro-Cys-Glu-Cys-Gly-Ser-Tyr-Ser-Gly-Ala-Gly-Gly-Gly-Lys-NH2 (включающий SEQ ID NO:8)
Раствор моноциклического предшественника отрицательного контроля со стадии (b) (100 мл) разбавляют посредством АсОН (100 мл). Добавляют 1М HCl (5 мл) и 0,05М I2 в АсОН (7 мл) в указанном порядке под защитным слоем аргона, и эту смесь перемешивают в течение 20 мин. Добавляют 1М аскорбиновую кислоту (1 мл) с получением бесцветной смеси. Большую часть растворителей выпаривают в вакууме, и остаток (30 мл) разбавляют смесью вода/0,1% TFA (100 мл), и продукт очищают с использованием препаративной HPLC. Очистка посредством препаративной HPLC (условия градиентного элюирования: 0% B в течение 10 мин, затем 20-30% B в течение 60 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 50 мл/мин, колонка: Phenomenex Luna 5 мкм C18 (2) 250×50 мм, детектирование: УФ 214 нм, время удерживания продукта: 32,8 мин) данного остатка дает 30 мг чистого Соединения 2. Чистый продукт анализируют посредством аналитической HPLC (условия градиентного элюирования: 10-40% B в течение 10 мин, где А представляет собой H2O/0,1% TFA, и В представляет собой ACN/0,1% TFA, скорость потока: 0,3 мл/мин, колонка: Phenomenex Luna 3 мкм C18 (2) 50×2 мм, детектирование: УФ 214 нм, время удерживания продукта: 6,54 мин). Получение дополнительных характеристик осуществляют с использованием масс-спектрометрии с ионизацией электрораспылением (МН22+ рассчитано: 1391,5, МН22+ обнаружено: 1392,5).
Пример 3: Синтез цианинового красителя 2-{(1Е,3Е,5Е)-5-[1-(5-карбоксипентил)-3,3-диметил-5-сульфо-1,3-дигидро-2H-индол-2-илиден]пента-1,3-диенил}-3-метил-1,3-бис(4-сульфобутил)-3H-индолий-5-сульфоната (Cy5**)
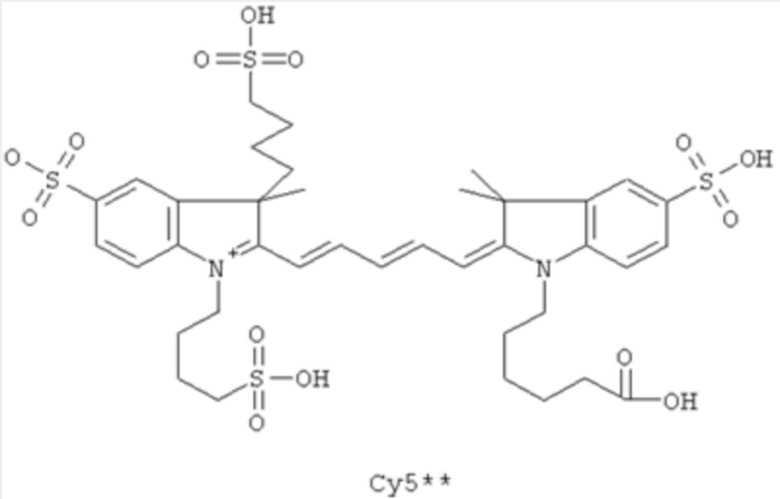
(3а) 5-Метил-6-оксогептан-1-сульфоновая кислота
К суспензии гидрида натрия (12,0 г, 60% NaH в минеральном масле) в DMF (100 мл) добавляют по каплям этил-2-метилацетоацетат (50 г) в DMF (25 мл) при охлаждении на ледяной бане в течение 1 часа (внутренняя температура 0-4°C). Эту смесь оставляют нагреваться до температуры окружающей среды в течение 45 минут при перемешивании, а затем снова охлаждают. Затем добавляют по каплям в течение 15 минут раствор 1,4-бутансультона (45 г) в DMF (25 мл). Конечную смесь нагревают при 60°C в течение 18 часов. Растворитель удаляют роторным испарением, и остаток распределяется между водой и диэтиловым эфиром. Водный слой собирают, промывают свежей порцией диэтилового эфира и подвергают роторному испарению с получением клейкой пены. Это промежуточное вещество растворяют в воде (100 мл) и добавляют гидроксид натрия (17,8 г) в течение 15 минут при перемешивании. Эту смесь нагревают при 90°C в течение 18 часов. Значение рН охлажденной реакционной смеси доводят до ~рН 2 добавлением концентрированной соляной кислоты (~40 мл). Раствор подвергают упариванию на роторном испарителе и сушат под вакуумом. Желтое твердое вещество промывают этанолом, содержащим 2% соляной кислоты (3×150 мл). Этанольный раствор фильтруют, упаривают на роторном испарителе и сушат под вакуумом с получением желтого твердого вещества. Выход 70 г.
(3b) Дикалиевая соль 2,3-диметил-3-(4-сульфобутил)-3Н-индол-5-сульфоновой кислоты
4-Гидразинобензолсульфоновую кислоту (40 г), 5-метил-6-оксогептан-1-сульфоновую кислоту (из 3а; 60 г) и уксусную кислоту (500 мл) смешивают и кипятят с обратным холодильником в течение 6 часов. Раствор отфильтровывают, выпаривают на роторном испарителе и сушат под вакуумом. Твердое вещество растворяют в метаноле (1 л). К этому добавляют 2М метанольный гидроксид калия (300 мл). Эту смесь перемешивают в течение 3 часов, и затем объем растворителя сокращают на 50% с использованием роторного испарения. Получающийся в результате осадок отфильтровывают, промывают метанолом и сушат под вакуумом. Выход 60 г. MS (LCMS): MH+ 362. Асс. Mass: Обнаружено 362,0729. МН+=C14H20NO6S2 требует m/z 362,0732 (-0,8 ppm (м.д.)).
(3c) Дикалиевая соль 2,3-диметил-1,3-бис(4-сульфобутил)-3Н-индолий-5-сульфоната
2,3-Диметил-3-(4-сульфобутил)-3Н-индол-5-сульфоновую кислоту (из 3b; 60 г) нагревают с 1,4-бутансультоном (180 г) и тетраметиленсульфоном (146 мл) при 140°C в течение 16 часов. Получающееся в результате красное твердое вещество промывают диэтиловым эфиром, растирают в порошок и сушат под вакуумом. Выход 60 г.
(3d) Су5** в виде соли TFA
K+-соль 1-(5'-карбоксипентил)-2,3,3-триметил-индоленийбромид-5-сульфоновой кислоты (2,7 г), малональдегид бис(фенилимин) моногидрохлорид (960 мг), уксусный ангидрид (36 мл) и уксусную кислоту (18 мл) нагревают при 120°C в течение 1 часа с получением темно-коричнево-красного раствора. Эту реакционную смесь охлаждают до температуры окружающей среды. К этой смеси добавляют 2,3-диметил-1,3-бис(4-сульфобутил)-3Н-индолий-5-сульфонат (из 3с; 8,1 г) и ацетат калия (4,5 г) и перемешивают в течение 18 часов при температуре окружающей среды. Получающийся в результате синий раствор осаждают с использованием этилацетата и сушат под вакуумом. Неочищенный краситель очищают посредством жидкостной хроматографии (Колонка с обращенной фазой C18 (RPC18). Условия градиентного элюирования: вода+0,1% TFA/MeCN+0,1% TFA). Фракции, содержащие основной пик красителя, собирают, объединяют и упаривают под вакуумом с получением указанного в заголовке красителя, 2 г. УФ/Вид. (Вода+0,1% ТFА): 650 нм. MS (Времяпролетная масс-спектрометрия с лазерной ионизацией и десорбцией из жидкой матрицы (MALDI-TOF)): MH+ 887,1. MH+=C38H50N2O14S4 требует m/z 887,1.
Пример 4: Синтез диизопропилэтиламинной соли 2-[(1Е,3Е,5Е)-5-(1-{6-[(2,5-диоксопирролидин-1-ил)окси]-6-оксогексил}-3,3-диметил-5-сульфо-1,3-дигидро-2H-индол-2-илиден)пента-1,3-диенил]-3-метил-1,3-бис(4-сульфобутил)-3H-индолий-5-сульфоната (сложный NHS-эфир Су5**)
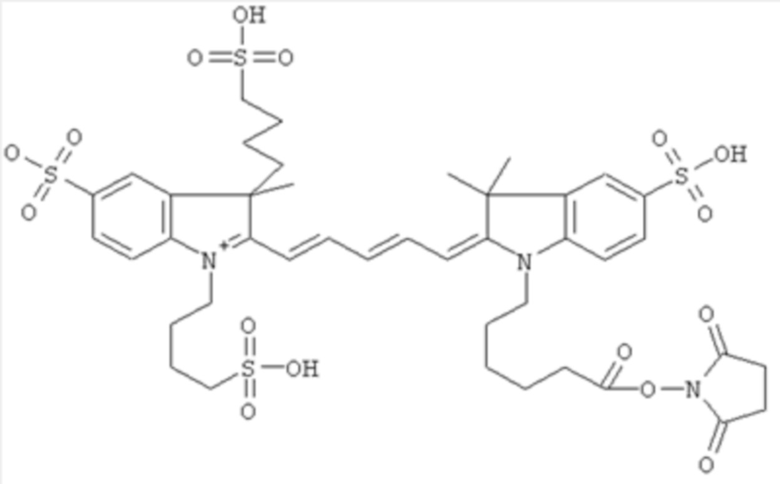
Су5** (Пример 3; 10 мг) растворяют в безводном DMSO (3 мл); к этому добавляют HSPyU (20 мг) и N, N'-диизопропилэтиламин (80 мкл). Получающийся в результате раствор перемешивают в течение 3 часов, по истечении которых выявляют завершение реакции посредством TLC (RPC18. Вода/МеСN). Краситель выделяют осаждением в этилацетате/диэтиловом эфире, отфильтровывают, промывают этилацетатом и сушат под вакуумом. УФ/Вид. (Вода) 650 нм. MS (MALDI-TOF) MH+ 983,5. MH+=C42H53N3O16S4 требует m/z 984,16.
Пример 5: Конъюгация красителей, синтез Соединений 3-7
Cys4-16, 6-14; Ac-Ala-Gly-Ser-Cys-Tyr-Cys-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cys-Trp-Cys-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys(Cy5)-NH2 (Соединение 3) (включающее SEQ ID NO:7)
Соединение 1 (10 мг), NMM (4 мкл) и сложный NHS-эфир Су5 (5,7 мг; GE Healthcare PAl 5104) растворяют в NMP (1 мл), и реакционную смесь перемешивают в течение 7 часов. Затем эту реакционную смесь разбавляют смесью 5% ACN/вода (8 мл), и продукт очищают с использованием препаративной HPLC.
Очистка посредством препаративной HPLC (условия градиентного элюирования: 5-50% B в течение 40 мин, где А представляет собой H2O/0,1% HCOOH, и В представляет собой ACN/0,1% HCOOH, скорость потока: 10 мл/мин, колонка: Phenomenex Luna 5 мкм С18 (2) 250×21,20 мм, детектирование: УФ 214 нм, время удерживания продукта: 35,5 мин) неочищенного пептида дает 8,1 мг чистого Соединения 3. Чистый продукт анализируют посредством аналитической HPLC (условия градиентного элюирования: 5-50% B в течение 10 мин, где А представляет собой H2O/0,1% HCOOH, и В представляет собой ACN/0,1% HCOOH, скорость потока: 0,3 мл/мин, колонка: Phenomenex Luna 3 мкм С18 (2) 50×2 мм, детектирование: УФ 214 нм, время удерживания продукта: 8,15 мин). Получение дополнительных характеристик осуществляют с использованием масс-спектрометрии с ионизацией электрораспылением (МН22+ рассчитано: 1710,6, МН22+ обнаружено: 1711,0).
Соединение 4 получают аналогичным образом; масс-спектрометрия с ионизацией электрораспылением (МН22+ рассчитано: 1710,6, МН22+ обнаружено: 1710,9).
Другие конъюгаты краситель-пептид (Соединения 5-7) получают аналогичными способами. Alexa647 закупают в Molecular Probes (А20106):
Соединение 5 (МН22+ рассчитано: 1825,7, МН22+ обнаружено: 1825,9),
Соединение 6 (МН22+ рассчитано: 1811,7, МН22+ обнаружено: 1812,0),
Соединение 7 (МН22+ рассчитано: 1825,7, МН22+ обнаружено: 1826,2).
Пример 6: анализ поляризации флуоресценции in vitro
Принцип метода поляризации флуоресценции может быть кратко описан следующим образом:
Монохроматический свет проходит через горизонтальный поляризационный фильтр и возбуждает флуоресцентные молекулы в образце. Только те молекулы, которые при надлежащей ориентации в вертикальной плоскости поляризации поглощают свет, становятся возбужденными и затем излучают свет. Излучаемый свет измеряют как в горизонтальной, так и в вертикальной плоскостях. Показатель анизотропии (А) представляет собой отношение интенсивностей света согласно следующему уравнению:
A = (интенсивность с горизонтальным поляризатором – интенсивность с вертикальным поляризатором)/(интенсивность с горизонтальным поляризатором + 2* интенсивность с вертикальным поляризатором)
Измерения анизотропии флуоресценции осуществляют в 384-луночных микропланшетах в объеме 10 мкл в буфере для связывания (забуференный фосфатом физиологический раствор (PBS), 0,01% Tween-20, pH 7,5) с использованием планшетного ридера поляризации флуоресценции Tecan Safire (Tecan, США) при 646 нм для возбуждения/678 нм для излучения. Концентрацию меченого красителем пептида поддерживают постоянной (20 нМ), и концентрации химеры cMet/Fc человека или мыши (R&D Systems) или Semaphorin 6A (R&D Systems) варьируют в диапазоне 0-150 нМ. Смеси для связывания уравновешивают в микропланшете в течение 10 минут при 30°C. Наблюдаемое изменение анизотропии согласуется с уравнением:
где robs представляет собой наблюдаемую анизотропию, rfree представляет собой анизотропию свободного пептида, rbound представляет собой анизотропию связанного пептида, KD представляет собой константу диссоциации, cMet представляет собой общую концентрацию cMet, и Р представляет собой общую концентрацию меченого красителем пептида. Это уравнение допускает, что синтетический пептид и рецептор образуют обратимый комплекс в растворе в стехиометрическом соотношении 1:1. Подгонку данных выполняют через нелинейную регрессию с использованием программного обеспечения GraphPad Prism, с получением значения KD (связывание по одному сайту).
Соединения 3 и 4 испытывают в отношении связывания с cMet человека и мыши (Fc химерой). Результаты показывают, что КD составляет 3 +/-1 нМ в отношении связывания Соединения 3 с сMet человека. Для Соединения 4 не наблюдают никакого связывания с сMet человека. Кроме того, Соединения 3 и 4 не показывают никакого связывания с cMet мыши в испытуемом диапазоне.
С использованием этого же способа обнаружено, что Соединение 5 имеет KD 1,1 нМ в отношении cMet человека.
Пример 7: Испытание Соединений 5 и 7 in vivo
(а) Животная модель
В данном исследовании используют 54 бестимусные мыши-самки BALB с/А nude (Bom). Использование этих животных одобрено местным комитетом по соблюдению этических норм исследования. BALB с/А nude представляет собой инбредную мышиную линию с нарушенной иммунологической реактивностью, имеющую высокую степень развития человеческих опухолей по сравнению с другими мышиными линиями nude. Мыши имеют 4-недельный возраст по прибытии и массу тела приблизительно 20 грамм в начале исследования. Животных помещают в индивидуально вентилируемые клетки (IVC, Scanbur BK) с фильтруемым через высокоэффективный воздушный фильтр (НЕРА) воздухом. Животные имеют неограниченный доступ к корму "Rat и Mouse nr. 3 Breeding" (Scanbur BK) и водопроводной воде, подкисляемой добавлением HCl до молярной концентрации 1 мМ (рН 3,0).
Клетки колоректального рака НСТ-15 происходят из карцином толстого кишечника человека и экспрессируют cMet, как сообщается в публикации Zeng et al. [Clin. Exp. Metastasis, 21, 409-417. (2004)]. Доказано, что эта клеточная линия является онкогенной при подкожной инокуляции мышам nude [Flatmark et al., Eur. J. Cancer 40, 1593-1598 (2004)].
Клетки НСТ-15 выращивают и готовят для подкожной инокуляции в среде RPMI (Sigma, номер по каталогу № R0883) с 10% сывороткой и пенициллином/стрептомицином. Исходные растворы изготавливают на пассаже номер четыре (Р4) и замораживают для хранения в жидком азоте при концентрации 3×107 клеток/флакон в культуральной среде, содержащей 5% диметилсульфоксид (DMSO). В день трансплантации, клетки подвергают быстрому оттаиванию в водяной бане, в которой установлена температура 37°C (приблизительно 2 мин), промывают и ресуспендируют в смеси PBS/2% сыворотки (центрифугирование при 1200 об/мин в течение 10 мин). Тщательное перемешивание клеток во флаконах обеспечивают каждый раз при их аспирации в дозирующий шприц. Клеточные суспензии объемом 0,1 мл вводят подкожной (s.c.) инъекцией в плечо и спину с помощью иглы с тонким каналом (25 G) тогда, когда животные находятся под действием щадящей газовой анестезии. Затем животных возвращают в свои клетки и оставляют для роста опухолей на 13-17 суток. Животным дают период акклиматизации, по меньшей мере, 5 суток перед процедурой инокуляции.
(b) Процедура
Все испытуемые вещества перерастворяют посредством PBS из лиофилизированного порошка. Небольшую стопку белой бумаги для принтера подвергают визуализации с получением плоскостного изображения, которое используют для коррекции неоднородностей освещения. Испытуемые вещества вводят внутривенной инъекцией в латеральную часть хвостовой вены при физической фиксации. Инъецируемый объем составляет 0,1 мл, что соответствует дозе 1 нмоль испытуемого вещества на животное. После инъекции животных возвращают в свои клетки. Животных умерщвляли непосредственно перед визуализацией путем смещения шейных позвонков. Для каждого испытуемого вещества оценивают момент времени оптимальной визуализации, основываясь на сравнении скоростей вымывания в коже и в мышечной ткани у ограниченного числа животных (n равен 1-6). Момент времени визуализации для Соединений 3 и 4 составляет 120 минут после инъекции. Для каждого животного делают паталогоанатомическое удаление подкожно выросших опухолей. Тонкую пластинку толщиной приблизительно 1,6 мм и диаметром приблизительно 3-4 мм отделяют от края одной из опухолей. Эту пластинку опухоли затем подвергают визуализации относительно участка нормальной толстой кишки из того же самого животного.
(с) Визуализация
Визуализацию осуществляют через клинический лапароскоп, выполненный с возможностью использования источника света с целью возбуждения репортерного соединения и фильтрующей системы для извлечения флуоресцентного компонента. Лазер с длиной волны 635 нм используют для возбуждения репортерной молекулы. Камеру Hamamatsu или СА ERG CCD используют в качестве детектора. Эта камера работает в режиме биннинга (возможности объединения пикселей на матрице) 2×2 с нулевым усилением. Стандартное время воздействия для визуализации толстой кишки составляет 10 сек. Калибровочные измерения системы показывают, что 10-секундное время воздействия с использованием данной системы визуализации животного соответствует 40-миллисекундному воздействию с использованием клинически релевантных источника света, поля зрения и расстояния до поверхности ткани. Распределение интенсивностей на изображении корректируют в отношении неоднородностей освещения с помощью калибровочных данных системы. Соотношение мишени к фону вычисляют по представляющим интерес участкам, помещенным поверх опухоли, и фону, состоящему из нормальной толстой кишки. Изображения оценивают визуально с использованием стандартной системы оценки, применяемой для получателя, выполняющего характеристический анализ.
(d) Результаты
Соединение 5 показывает соотношение опухоли к нормальной ткани 1,46:1, а соответствующий скремблированный контрольный пептид с тем же самым красителем (Соединение 7) показывает соотношение 1,04:1. Соединение 5 позволяет иметь легко идентифицируемую опухоль, тогда как при использовании Соединения 7 ничего невозможно различить относительно фона.
Получение Лиофилизированного Состава EMI-137
Необходимо проводить лиофилизацию состава эффективно (например, без встряхивания и коллапса (сплющивания)) с обеспечением однородного твердого вещества, которое является стабильным. Как отмечено ранее, рН для EMI-137 в воде имеет значение приблизительно 4,6, что не подходит для внутривенного введения. В связи с этим, дополнительным требованием к составу является то, что при перерастворении он должен иметь рН, который подходит для внутривенного введения. Кроме того, тоничность состава при перерастворении должна подходить для внутривенного введения. Дополнительным преимуществом для состава могла бы быть возможность хранения при комнатной температуре, хотя хранение при пониженной температуре в холодильнике также будет приемлемым.
Первоначальные исследования состава показывают, что составы, которые имеют рН менее приблизительно рН 6,8, обычно агломерируются. Следовательно, любой состав, который обеспечивает рН ниже 6,8, считается неприемлемым. Кроме того, известно, что при рН более приблизительно рН 8 (в некоторых случаях вплоть до приблизительно рН 9) существует риск расщепления дисульфидных мостиков (из которых в EMI-137 имеются два дисульфидных мостика). Таким образом, было бы полезно получить состав, который при перерастворении дает рН, который является достаточно высоким, чтобы обеспечить устранение агломерации, но является достаточно низким, чтобы снизить риск расщепления дисульфидных мостиков.
Таким образом, для поддержания рН раствора EMI-137 в пределах приемлемого диапазона при перерастворении, необходимо включить в состав буферный раствор до лиофилизации. Исследования показали, что вязкость раствора EMI-137 повышается в присутствии обогащенного хлоридом калия забуференного фосфатом физиологического раствора (PBS), и, что развивается значительное гелеобразование. Такой эффект гелеобразования не отмечают в том случае, когда EMI-137 растворяют в натрий-фосфатном буферном растворе при рН 7,4. Поэтому, использование NaCl и KCl исключают из рассмотрения (из-за проблем, связанных с гелеобразованием).
Процесс лиофилизации проводят так, как освещено в Таблице 3.
°C
Час:мин
Мкбар
Полуавтоматическое/Автоматическое
Давление укупоривания
80 Бар A
Воздух/азот
Таблица 3: Параметры лиофилизации
Лиофилизацию проводят следующим образом.
Составляющие составов, которые приведены в Таблицах 4А-4F ниже, добавляют в подходящий сосуд для лиофилизации. Следует отметить, что все перечисленные компоненты (включая буферный раствор) добавляют до лиофилизации.
Фазу загрузки выполняют при приблизительно -40°С. Затем температуру снижают до приблизительно -55°С. Скорость охлаждения может составлять приблизительно 1,5°С в минуту. Затем смесь выдерживают в стационарном режиме заморозки в течение, по меньшей мере, двух часов. Затем давление снижают до 50 мкБар, что занимает приблизительно 45 минут. Затем температуру повышают до приблизительно -38°С в течение фазы первичной сушки. Скорость нагревания может составлять приблизительно 1°С в минуту. Затем смесь выдерживают в стационарном режиме заморозки в течение приблизительно девяти суток. Затем смесь нагревают до приблизительно 30°С при скорости приблизительно 6,8°С в час в течение, по меньшей мере, десяти-часового периода (фазы перехода от первичной к вторичной сушке, или «фазы линейного изменения температуры»). Затем смесь выдерживают в стационарном режиме вторичной сушки в течение приблизительно шести часов. Затем смесь охлаждают до приблизительно 20°С при скорости приблизительно 1°С в минуту, до добавления газа в свободное пространство над продуктом (то есть, инертного газа, такого как аргон или азот), тем самым сбрасывая вакуум в сосуде для лиофилизации. Затем продукт выгружают/хранят при 5°С.
Стадию первичной сушки, фазу линейного изменения температуры и стадию вторичной сушки, каждую из них, проводят при размещении смеси под вакуумом приблизительно 50 мкбар. Это давление может вводиться на фазе первичной сушки и затем может поддерживаться до фазы хранения/выгрузки.
Использование буферного раствора, такого как раствор фосфата натрия, как известно, обуславливает сдвиг рН в зону низкого рН во время заморозки, и, в силу этого, ожидают, что будут возникать сложности с проведением лиофилизации состава без коллапса (сплющивания), поскольку температура стеклования замороженных концентратов будет низкой. По этой причине, текущее изобретение включает регулятор тоничности и лиопротектор в комбинации. Маннит представляет собой один из наиболее широко используемых и подтвержденных результатами лабораторных исследований объемообразующих агентов в лиофилизации, но имеет, как сообщается, несколько термических проблем и кристаллизационных сложностей, которые потенциально могут оказывать влияние на получение и на стабильность продукта. В этой связи, обычно полагают, что использование маннита как такового не является преимущественным при лиофилизации, и, как известно, обуславливает несколько проблем.
Поскольку комбинация буфера и лиопротекторов в настоящем изобретении трудно поддается лиофилизации без претерпевания коллапса лиофилизированной массы (таблетки), требуется цикл лиофилизации со специально подобранными параметрами. Цикл лиофилизации выбирают так, чтобы иметь достаточно низкие вакуум и температуру полки для достижения низкой температуры льда с предотвращением такого обратного плавления/коллапса лиофилизированной массы. Коллапс лиофилизированной массы должен быть исключен с тем, чтобы предотвратить образование более крупных структур/агломератов EMI-137 во время стадии сушки процесса лиофилизации (это, как обнаружено, происходит при рН менее 6,8 и является не полностью обратимым).
По завершении некоторых первоначальных исследований состава, и с учетом вышесказанного, выбирают следующие переменные для дальнейшего испытания:
Буферный раствор: фосфат натрия или Tris HCl (25, 40 и 55 мМ);
Лиопротектор: сахароза или манит.
Примеры Лиофилизированных Составов
Кандидаты состава исследуют с использованием факторного дизайна с четырьмя переменными, скомбинированного с дизайном смешанного уровня, который показан в Таблицах 4А-4F. Дизайн состоит из дробного двухуровнего дизайна с четырьмя переменными (образцы 1-8), четырьмя центральными точками (образцы 10-13) и дизайна смешанного уровня с тремя уровнями для активного фармацевтического ингредиента (API) и двумя уровнями для категориальных переменных типа буфера и типа лиопротектора (образцы 14-21). Кроме того, включают различные контрольные образцы (образцы 22-24). Также изучают два дополнительных образца (образцы 25 и 26). Образец 25 относится к композиции раствора до лиофилизации в 1 мл воды, и образец 26 относится к дополнительному обычному составу, который получают на основе результатов предыдущих образцов.
Таблица 4А: Дизайн скрининга составов (мг/мл)
Таблица 4B: Дизайн скрининга составов (мг)
Таблица 4С: Дизайн скрининга составов (ммоль)
Таблица 4D: Дизайн скрининга составов (мольное соотношение)
Таблица 4E: Дизайн скрининга составов (% масс./масса до лиофилизации)
Таблица 4F: Дизайн скрининга составов (% масс./масса после лиофилизации)
Отнесения к (1), (2), (3) и (4) в вышеприведенных Таблицах 4А-4F составляют следующее:
(1) 0,25 мг/мл безвод. NaH2PO4+3,25 мг/мл безвод. Na2HPO4
(2) 0,56 мг/мл безвод. NaH2PO4+7,14 мг/мл безвод. Na2HPO4
(3) 0,41 мг/мл безвод. NaH2PO4+5,19 мг/мл безвод. Na2HPO4
(4) 0,50877 мг/мл безвод. NaH2PO4 +6,49467 мг/мл безвод. Na2HPO4
Количества используемого безводного и гидратированного фосфата натрия приведены ниже в Таблице 5.
Таблица 5: Эквивалентное количество гидратированного фосфата натрия
Молярные массы, используемые в составах, являются следующими:
Дигидрофосфат натрия (безводный) = 119,98 г/моль
Гидрофосфат динатрия (безводный) = 141,96 г/моль
Tris HCl=121,14 г/моль
Маннит=182,17 г/моль
Сахароза=342,29 г/моль
EMI-137=3650,3 г/моль
Из приведенного выше видно, что диапазон для натрий-фосфатного буфера=4,26-18,6% масс./масса до лиофилизации и 9,78-35,22% масс./масса после лиофилизации, тогда как диапазон для Tris HCl-буфера=3,27-12,63% масс./масса до лиофилизации и 3,27-12,63% масс./масса после лиофилизации.
Материалы, используемые в составах, приведены в Таблице 6 ниже.
Таблица 6: Материалы, используемые в Составах для Скрининга
После скринингового изучения следует 4-недельное изучение предварительной стабильности при 25°С и 40°С. Серию экспериментов выполняют с возможностью обеспечения как скрининга выбранных буферов и лиопротекторов, так и испытания устойчивости релевантных концентраций API (целевая концентрация 4,8 мг/мл) при получении. Изучают диапазон ±10% около целевой концентрации. Данный дизайн также позволит выявить потенциальные взаимодействия между EMI-137, буфером и лиопротекторами. Поскольку все образцы изготавливают изотоническими, концентрация буфера и концентрация лиопротектора являются совместно изменяемыми переменными величинами. Параметры испытания показаны в Таблице 7. В дополнение к технологическому испытанию основного объема раствора до лиофилизации, испытание также включает образцы со стадии заморозки для выявления того факта, может ли потенциальная нестабильность быть связана с процессом заморозки или сушки.
н.п. = не применяется
Таблица 7: Параметры испытания
Результаты по лиофилизированным составам
Данные по стабильности в течение вплоть до 102 месяцев при 2-8°С, 61 месяца при 30°С и 6 месяцев при 40°С приведены, соответственно, в Таблицах 8А-8С, 9А-9С и 10 (используются следующие пояснения/сокращения: Amb=влажность окружающей среды, не регулируемая; NMT=не более чем; ND=не обнаружено; ---; не осуществлено; *момент времени отбора пробы через 24 месяца, отсроченный по причине летнего отпуска; **дополнительный момент времени отбора пробы).
Таблица 8А: Стабильность состава EMI-137, сохраняемого при 5°С в течение 102 месяцев
Таблица 8B: Стабильность состава EMI-137, сохраняемого при
Таблица 8С: Стабильность состава EMI-137, сохраняемого при 5°С в течение 102 месяцев
Таблица 9А: Стабильность состава EMI-137, сохраняемого при 30°С в течение 61 месяца
Таблица 9В: Стабильность состава EMI-137, сохраняемого при 30°С в течение 61 месяца
Таблица 9С: Стабильность состава EMI-137, сохраняемого при 30°С в течение 61 месяца
Таблица 10: Стабильность состава EMI-137, сохраняемого при 40°С в течение 6 месяцев
Параметры испытания показаны выше (Таблица 7). Степень чистоты оценивают с помощью HPLC с детектированием в УФ/видимой области спектра при 650 нм и выражают %-ых единицах площади пика. Агломерацию выражают через интенсивность рассеяния света, измеряемую с помощью фотонной корреляционной спектроскопии (PCS). Оценивание перерастворения и наблюдаемого внешнего вида следует системе оценки, разработанной для описания различных характеристик лиофилизированных таблеток.
Наблюдаемый внешний вид после лиофилизации
Как правило, хорошие объемообразующие свойства маннита придают очень хорошую структуру всем маннит-содержащим составам. Маннит-фосфат-содержащие таблетки, как оказалось, имеют неоднородный синий/белесоватый цвет на стенке флакона в отличие от маннит-Tris-HCl-содержащих составов. Поскольку лекарственное вещество имеет интенсивный синий цвет, такие цветовые градиенты становятся сильно выраженными. Неравномерный внешний вид, как полагают, проистекает частично из заведомо неупорядоченного характера заморозки и частично из свойств состава. При перерастворении в воде продукт представляет собой гомогенный раствор. Другие аналитические результаты, получаемые как первоначально, так и во время периода предварительной стабильности, показывают, что неравномерный внешний вид может рассматриваться как чисто косметическая проблема. Сахароза в комбинации с Tris-HCl обычно подвергается коллапсу/плавится в варьируемой степени во время лиофилизации. Отмечают значительное варьирование от флакона-к-флакону, поскольку 50% серии имеют лиофилизированные таблетки без заметного коллапса. При хранении при 40°С, подвергнутые частичному коллапсу куски постепенно превращаются в подвергнутый полному коллапсу материал, что отмечается уже через семь дней. Это может возникать из-за повышенной концентрации воды в подвергнутом коллапсу материале. Обширный коллапс, отмечаемый во время хранения, имеет негативное влияние на степень чистоты, перерастворение и на склонность к образованию агломератов.
Перерастворение после лиофилизации
Все забуференные составы, содержащие лиопротектор, легко перерастворяются при использовании мягкого взбалтывания в течение нескольких секунд. Эти результаты остаются неизменными для образцов, включающих не подвергнутые коллапсу и подвергнутые умеренному коллапсу куски, по истечении четырех недель хранения (25°С и 40°С). Подвергнутые обширному коллапсу лиофилизированные куски перерастворяются весьма затруднительно. Эти продукты также имеют низкую степень чистоты и содержат агломераты. Составы без лиопротекторов (образцы 22-24) требуют более длительного и энергичного смешивания для перерастворения, но при этом считаются приемлемыми.
рН
Для забуференных фосфатом натрия составов рН является стабильным во время лиофилизации, но снижается во время четырехнедельного хранения при 40°С. Tris-HCl-забуференные составы имеют снижение рН во время лиофилизации, но, как правило, являются более стабильными во время хранения при 40°С. Результаты по рН плохо поддаются интерпретации, и хемометрический анализ не дает ясной картины. Никакие тренды не могут быть отнесены на счет маннита или сахарозы. Однако, ясно, что повышение концентрации фосфатного буфера будет снижать падение рН во время хранения. При низкой концентрации буфера падение рН будет повышаться при более высокой концентрации EMI-137. Tris-HCl-содержащие составы являются еще более чувствительными к увеличению концентрации лекарственного вещества EMI-137. Это указывает на то, что концентрацию буфера следует выбирать в верхнем диапазоне испытания.
Агломераты (PCS)
Каждый состав испытывают с помощью фотонной корреляционной спектроскопии (PCS) на присутствие крупных структур/агломератов до и после лиофилизации, и в конце четырехнедельного периода предварительной стабильности. Соответствующие средним точкам составы (образцы 10-13) также испытывают по истечении одной недели и двух недель. Значения ниже приблизительно 20 кс/сек считают фоном и не относят к агломератам. До лиофилизации агломераты не обнаруживают ни в одном из основных объемов раствора. После лиофилизации все содержащие лиопротектор составы признают свободными от более крупных структур/агломератов. После четырех недель хранения при 40°С все образцы по-прежнему являются свободными от агломератов 4, за исключением образца, подвергнутого обширному коллапсу (образец 17), и незабуференного образца 24, содержащего EMI-137 в воде. Последний состав имеет рН 4,2. Агломерация при низком рН согласуется с предыдущими первоначальными сведениями. Забуференный фосфатом состав без лиопротектора (сахарозы или маннита), однако, содержит агломераты после лиофилизации (образец 23). Анализ перерастворенных образцов показывает присутствие крупных структур размером приблизительно 100 нм. Агломераты образуются во время процесса сушки, не в ходе стадии заморозки, так как в образцах, отобранных после заморозки, агломераты не обнаружены. Натрий-фосфатный буферный раствор, как известно, проявляет градиенты рН и сдвиг рН в сторону низких значений во время заморозки по причине различия растворимости и кристаллизации фосфатных солей. Отмечают значение рН, равное всего лишь 3,5. При таком рН агломераты могут образовываться в растворе EMI-137. Даже в замороженном состоянии, пролонгированный период при таком рН во время лиофилизации потенциально может привести к образованию агломератов. Полагают, что маннит и сахароза предотвращают протекание этого. (Лиопротектор не требуется в Tris-HCl-составах. Tris-HCl сдвигает рН в сторону высоких значений рН (>9) во время заморозки.) Сделан вывод, что значительное(-ый) обратное плавление/коллапс сказывается на уровне агломератов в лекарственном продукте и должно(-ен) быть исключен(-о). Подтверждено, что агломераты образуются при низком рН. При использовании фосфатного буфера в качестве составляющей во время лиофилизации, требуется лиопротектор для предотвращения образования более крупных структур/агломератов EMI-137 во время стадии сушки процесса лиофилизации.
Дифференциальная сканирующая калориметрия (DSC)
Составы, соответствующие средним точкам в дизайне получения составов, анализируют с использованием DSC в виде концентрированных заморозкой образцов. Образец объемом приблизительно 20 мкл помещают в герметизированный алюминиевый тигель и анализируют с помощью прибора Diamond DSC от Perkin Elmer. Образцы охлаждают до -80°С при скорости 5°С/мин и выдерживают при -80°С в течение 10 минут, затем нагревают до 24°С при скорости 5°С/мин в атмосфере азота. Все вычисления выполнены на основе данных, собранных после нагревания.
Составы, содержащие маннит
Состав, содержащий Tris-HCl-маннит, имеет сложные термограммы, показывающие три различных пика стеклования и два пика кристаллизации. Никакого видимого коллапса лиофилизированной таблетки не отмечают вопреки стеклованию ниже -60°С. Так вероятно происходит благодаря объемообразующим свойствам кристаллизованного маннита. Термограмма состава, содержащего фосфат-маннит, показывает два пика стеклования и один пик кристаллизации. Одно из стеклований происходит в диапазоне между -50°С и -60°С, что значительно ниже, чем рабочая температура обычного лиофилизатора на практике. Другое стеклование происходит при температуре около -41°С, которая находится близко к рабочему пределу при проектировании цикла лиофилизации. Если не принимать во внимание легкую усадку лиофилизированной таблетки, макроскопическое(-ий) обратное плавление/коллапс не происходит в содержащих фосфат-маннит составах. Ожидаемо, что манит подвергнется частичной кристаллизации, и, что кристаллизованной части маннита будет достаточно для того, чтобы придать механическую стабильность лиофилизированному продукту. Экзотермический пик кристаллизации, наблюдаемый при -27,6°С (T начала кристаллизации), соответствует температуре потенциального расстекловывания маннита, поскольку после нагревания состава может протекать рекристаллизация при температуре слегка выше Tg’ маннита (от -33°С до -27°С).
Составы, содержащие сахарозу
Термограммы для составов, содержащих сахарозу, показывают два термических явления, согласующиеся со стеклованиями при температурах, соответственно, сильно ниже -50°С и приблизительно -35°С - -37°С. Пики кристаллизации или эвтектического плавления отсутствуют для всех содержащих сахарозу составов, что согласуется с содержанием сахарозы. Однако, тепловой поток от реакций с очень небольшой кристаллизацией не будет заметен в случае перекрывания с намного более сильным тепловым потоком с низкотемпературной стороны эндотермического плавления воды. Значительный визуальный коллапс отмечают в некоторых флаконах, содержащих Tris-HCl-сахарозу, но не в случае состава, содержащего фосфат-сахарозу. DSC-данные можно было бы интерпретировать в пользу содержащего фосфат-сахарозу состава (13), тем не менее, приходят к заключению, что размер серии лишь из двенадцати флаконов является слишком небольшим для того, чтобы установить, возникает ли подобная проблема, как можно было бы ожидать, с содержащим фосфат-сахарозу составом.
Анализ в ближней инфракрасной области спектра (NIR)
Хорошо известно, что маннит имеет сильную склонность к кристаллизации из замороженных водных растворов, как во время охлаждения, так и повторного нагревания, и, как еще отмечают, продолжает кристаллизоваться после лиофилизации, поскольку процесс лиофилизации может производить частично аморфный, частично кристаллический материал. Кристаллизация во время лиофилизации может давать в результате различные аморфные полиморфные модификации (α, β, δ) и их смеси, что оставляет место для полиморфных превращений во время хранения.
Предварительные исследования с помощью анализа в NIR в сочетании с Методом главных компонентов (PCA) показывают наличие структурных различий между флаконами, что относят на счет различной степени кристаллизации.
Степень чистоты, оцениваемая с помощью HPLC
Профили степени чистоты, оцениваемой с помощью HPLC, показывают, что как содержащие фосфат, так и содержащие Tris-HCl составы имеют очень сходные профили степени чистоты и также сходные закономерности расщепления в сравнении с чистым EMI-137. Также, содержащие сахарозу и маннит составы имеют сходные профили степени чистоты. Обнаружены некоторые небольшие различия в соотношении между некоторыми из пиков. Ни в одном из составов, при сравнении с лекарственным веществом EMI-137, не обнаружены никакие новые пики. Похоже, что концентрация буфера не влияет на степень чистоты. Однако, во время визуального анализа внешнего вида отмечают, что сахароза в комбинации с Tris-HCl обуславливает вариабельность между флаконами в отношении подвергнутого коллапсу содержимого флаконов, то есть, некоторые флаконы имеют превосходный внешний вид содержимого, тогда как другие имеют подвергнутые значительному коллапсу лиофилизированные таблетки. Поскольку и Tris-HCl и фосфат натрия представляют собой вещества с низкой Tg’, размер серии из двенадцати флаконов считают слишком небольшим, чтобы выявить потенциальные сходные проблемы с содержащими фосфат-сахарозу составами.
Обобщенные результаты хемометрического анализа
Хемометрическое моделирование сфокусировано на изменениях степени чистоты, определяемой посредством HPLC, в зависимости от различных лиофилизированных составов в течение периода времени вплоть до четырех недель при 40°С, на химических изменениях, отражаемых в спектрах NIR, для выявления значительных изменений содержимого во флаконах с расщепленным лиофилизированным материалом относительно нерасщепленного лиофилизированного материала, и на изменениях в агломератах, измеряемых посредством PCS. Хемометрическое моделирование показывает, что все составы, содержащие Tris-HCl, имеют большее расщепление по сравнению с забуференными фосфатом составами, хотя это и не просто обнаружить на основе визуального сравнения данных HPLC по степени чистоты. Поверхности отклика в хемометрическом анализе показывают, что увеличение концентрации Tris-HCl приводит к повышенному расщеплению и химическим взаимодействиям. В общем и целом, делают вывод, что Tris-HCl-содержащие составы являются менее предсказуемыми, чем содержащие фосфат составы в отношении химического расщепления. Это подтверждается Методом главных компонентов (PCA) при анализе спектров NIR, получаемых для образцов 10-12 (соответствующих средним точкам в скрининге) и корреляции между NIR-данными и степенью чистоты по данным HPLC.
Хемометрические модели, построенные с содержащими фосфат натрия составами, являются точными и надежными. Забуференные фосфатом составы в комбинации с сахарозой являются химически очень стабильными в рамках испытуемого проектного поля составов, так как происходит весьма малое расщепление. Однако, для подтверждения того, что коллапс во время лиофилизации не будет потенциальной проблемой, потребовалось проведение дополнительных испытаний. Сделан вывод о том, что фосфат натрия в комбинации с маннитом, судя по всем проанализированным параметрам, дает адекватный состав.
Устойчивость/Проектное поле
Хотя HPLC-кривые показывают, что концентрация буфера, похоже, не является решающей для профиля расщепления, хемометрический анализ показывает, что увеличенная концентрация фосфата, как можно было ожидать, дает химически более стабильный продукт в том случае, когда состав включает в себя маннит. Поверхность отклика показывает особенно стабильный участок выше концентрации буфера 40 мМ, где расщепление не значительно зависит от концентрации EMI-137. Испытывают проектное поле ± 10% около целевой концентрации EMI-137. Это охватывает обычный диапазон нормативных требований для содержания лекарственного вещества. Обнаружено, что варьирование концентрации EMI-137 в пределах этого диапазона почти не влияет на степень чистоты при более высоких концентрациях буфера, что дает достаточную устойчивость составу во время изготовления. Поверхность отклика изменений рН демонстрирует, что увеличение концентрации натрий-фосфатного буфера уменьшает изменения рН во время хранения. Также подтверждено, что состав не будет устойчивым по отношению к изменениям концентрации EMI-137, если концентрация буфера будет слишком низкой. При концентрациях буфера выше 40 мМ изменения рН составляют менее 0,2 единиц рН, когда концентрация EMI-137 варьируется в пределах ±10% относительно целевой концентрации (4,8 мг/мл). Выше 50 мМ прогнозируемые изменения рН во время хранения являются небольшими и стабильными по отношению к варьированиям как концентрации EMI-137, так и концентрации буфера, что дает хорошую устойчивость составу во время изготовления. Многофакторный анализ показывает, что концентрация буфера может варьироваться между 40-55 мМ, где концентрация лекарственного вещества варьируется от 4,3 до 5,3 мг/мл без затрагивания качества лекарственного продукта.
Испытание аффинности по отношению к рецептору cMet in vitro
Образец 11 испытывают на его аффинность к рецептору c-Met, и получают данные по связыванию, эквивалентные данным для чистого лекарственного вещества EMI-137. Приходят к заключению, что состав, содержащий манит-40мМ фосфат, не оказывает отрицательное влияние на связывание пептида с рецептором мишени.
Обсуждение результатов для лиофилизированного состава
Как проиллюстрировано в приведенных выше таблицах, состав EMI-137 остается стабильным в течение длительного периода времени (102 месяца), даже при повышенной температуре, таким образом, он имеет продленный срок годности. Также следует отметить, что отсутствует тренд расщепления продукта во временных рамках измерения, что является доказательством исключительной стабильности. К тому же, удивительным является то, что в течение периода времени измерения практически не образуются родственные вещества (то есть, примеси), то есть, отсутствует склонность к их образованию. Кроме того, при перерастворении, состав имеет рН, подходящий для внутривенного введения (приблизительно рН 7,5), и солюбилизируется без агломерации. В дополнение к тому, сухое лиофилизированное твердое вещество сохраняет гетерогенный синий внешний вид. Также стоит отметить, что перерастворенный состав остается стабильным и в значительной мере свободным от родственных веществ в течение вплоть до 24 часов после перерастворения. Таким образом, показано, что состав EMI-137 является очень стабильным как в сухой (лиофилизированной), так и в перерастворенной форме.
На основе аналитических данных и хемометрического анализа сделаны выводы, приведенные ниже.
Необходимо иметь буфер в составе во время получения и лиофилизирования для поддержания нейтрального рН и исключения агломерации. Забуференные фосфатом натрия составы признают более устойчивыми, чем Tris-HCl-содержащие составы, на основе хемометрического анализа всех результатов. Минимальная концентрация фосфатного буфера должна составлять 40 мМ. Лиопротектор необходим для того, чтобы лиофилизировать забуференный фосфатом состав с предотвращением образования агломератов во время процесса сушки. Показано, что маннит имеет хорошую лиопротективную активность. Подвергнутые обширному коллапсу лиофилизированные таблетки перерастворяются с трудом, имеют плохую степень чистоты и склонность к образованию агломератов. Это не отмечают во флаконах с умеренным, но все равно отчетливо заметным обратным плавлением/коллапсом. Составы, содержащие фосфат натрия-сахарозу, считают химически наиболее устойчивыми составами, но потенциально они не являются столь устойчивыми с точки зрения лиофилизации. Лиофилизированные составы, содержащие фосфат натрия-маннит, имеют неоднородный внешний вид и являются менее «фармацевтически элегантными», чем составы, содержащие Tris-HCl-маннит, так как в лиофилизированных таблетках возникают цветовые градиенты. Предполагают, что это происходит на фазе заморозки, и приходят к выводу, что это приемлемо, поскольку продукт образует гомогенный раствор после перерастворения. Tris-HCl-содержащие составы, как правило имеют менее предсказуемые данные, и на основе хемометрического анализа эти составы считают потенциально более рискованным (тем не менее по-прежнему приемлемым) выбором. Общий вывод, сделанный на основе данного исследования, состоит в том, что состав, содержащий фосфат натрия-маннит, как полагают, обеспечивает удовлетворительный баланс риска, прогнозируемости и приемлемости на основе доступных данных по ограниченной предварительной стабильности, хемометрического анализа аналитических данных и рассмотрения устойчивости, тем не менее Tris-HCl и сахароза также могут быть независимо использованы в качестве альтернатив.
Сущность изобретения
Настоящее изобретение содержит сведения о том, что для того, чтобы получить адекватную стабильность API, необходим лиофилизированный состав лекарственного продукта. После перерастворения, лекарственный продукт должен представлять собой изотонический раствор и иметь физиологический рН, что делает его подходящим для внутривенного введения. EMI-137 в воде имеет рН 4,6 и проявляет значительную степень образования более крупных структур или агломератов. Такая агломерация является лишь частично обратимой после повышения рН раствора, что делает его непригодным для внутривенного введения. По существу, рН более 6,8 и менее 9 (или потенциально ниже) является преимущественным, поскольку образование агломератов в этом диапазоне рН не наблюдается. Такой диапазон рН должен поддерживаться во все периоды времени, и также должен применяться во время изготовления основного объема раствора лекарственного продукта. Так, для поддержания рН раствора EMI-137 в пределах приемлемого диапазона, полезно включать буфер к данному раствору перед лиофилизацией. Также полезно включать лиопротектор с целью обеспечения того, что EMI-137 не будет расщепляться во время лиофилизации, и регулятор тоничности (который может представлять собой тот же самый материал, что и лиопротектор) с целью обеспечения того, что перерастворенный продукт будет изотоническим и/или подходящим для внутривенного введения.
Использование буфера и лиопротектора/регулятора тоничности, как описано выше, обеспечивает однородное твердое вещество, которое является стабильным и, которое, при перерастворении, находится при рН и тоничности, которые подходят для внутривенного введения. К тому же, описываемый состав сохраняет достаточный (необходимый) рН во время лиофилизации, что позволяет предотвратить протекание агломерации, и, что не приводит к разрыву дисульфидных мостиков в EMI-137. Кроме того, состав может храниться при комнатной температуре в течение продленных периодов времени без заметного расщепления, и остается стабильным при перерастворении и после перерастворения.
Как отмечено выше, для поддержания рН раствора EMI-137 в пределах приемлемого диапазона при перерастворении, необходимо включать буфер перед лиофилизацией.
Различные модификации и вариации описанных вариантов осуществления изобретения, без отступления от объема и существа настоящего изобретения, будут очевидны специалистам в данной области. Хотя изобретение описано в связи с конкретными вариантами осуществления, следует понимать, что заявленное изобретение не должно чрезмерно (неправомерно) ограничиваться такими конкретными вариантами осуществления. На самом деле, различные модификации описанных вариантов осуществления изобретения, которые очевидны специалистам в данной области, как предполагается, охвачены настоящим изобретением.
Сокращения
Используют общепринятые однобуквенные или 3-буквенные сокращения аминокислот.
Acm: Ацетамидометил
ACN (или MeCN): Ацетонитрил
Boc: трет-Бутилоксикарбонил
DCM: Дихлорметан
DMF: Диметилформамид
DMSO: Диметилсульфоксид
Fmoc: 9-Флуоренилметоксикарбонил
HBTU: Гексафторфосфат O-бензотриазол-1-ил-N, N,N',N'-тетраметилурония
HPLC: Высокоэффективная жидкостная хроматография
HSPyU: Гексафторфосфат O-(N-сукцинимидил)-N, N,N',N'-тетраметиленурония
NHS: N-Гидрокси-сукцинимид
NMM: N-Метилморфолин
NMP : 1-Метил-2-пирролидинон
Pbf: 2,2,4,6,7-Пентаметилдигидробензофуран-5-сульфонил
PBS: Забуференный фосфатом физиологический раствор
tBu: трет-бутил
TFA: Трифторуксусная кислота
TIS: Триизопропилсилан
Trt: Тритил
Tris-HCl: 2-Амино-2-(гидроксиметил)-1,3-пропандиолгидрохлорид
Произвольный текст перечня последовательностей
SEQ ID NO:1
Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6
Xaa1 представляет собой Asn, His или Tyr;
Xaa2 представляет собой Gly, Ser, Thr или Asn;
Xaa3 представляет собой Thr или Arg;
Xaa4 представляет собой Ala, Asp, Glu, Gly или Ser;
Xaa5 представляет собой Ser или Thr; и
Xaa6 представляет собой Asp или Glu.
17-мерный cMET-связывающий пептид.
SEQ ID NO:2
Ser-Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6
Xaa1 представляет собой Asn, His или Tyr;
Xaa2 представляет собой Gly, Ser, Thr или Asn;
Xaa3 представляет собой Thr or Arg;
Xaa4 представляет собой Ala, Asp, Glu, Gly или Ser;
Xaa5 представляет собой Ser или Thr; и
Xaa6 представляет собой Asp или Glu.
18-мерный cMET-связывающий пептид.
SEQ ID NO:3
Ala-Gly-Ser-Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6-Gly-Thr
Xaa1 представляет собой Asn, His или Tyr;
Xaa2 представляет собой Gly, Ser, Thr или Asn;
Xaa3 представляет собой Thr или Arg;
Xaa4 представляет собой Ala, Asp, Glu, Gly или Ser;
Xaa5 представляет собой Ser или Thr; и
Xaa6 представляет собой Asp или Glu.
22-мерный cMET-связывающий пептид.
SEQ ID NO:4
Gly-Gly-Gly-Lys
Последовательность тетрамерного пептида, которая является частью cMET-связывающего пептида.
SEQ ID NO:5
Gly-Ser-Gly-Lys
Последовательность тетрамерного пептида, которая является частью cMET-связывающего пептида.
SEQ ID NO:6
Gly-Ser-Gly-Ser-Lys
Последовательность пятимерного пептида, которая является частью cMET-связывающего пептида.
SEQ ID NO:7
Ala-Gly-Ser-Cys-Tyr-Cys-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cys-Trp-Cys-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys
26-мерный cMET-связывающий пептид.
SEQ ID NO:8
Thr-Gly-Glu-Cys-Thr-Cys-Pro-Tyr-Trp-Glu-Phe-Arg-Pro-Cys-Glu-Cys-Gly-Ser-Tyr-Ser-Gly-Ala-Gly-Gly-Gly-Lys
26-мерный скремблированный cMET-связывающий пептид (отрицательный контроль).
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> GE Healthcare AS
<120> Состав и способ получения
<130> P150950.WO.01
<150> GB1804835.5
<151> 2018-03-26
<160> 8
<170> Программное обеспечение Версия PatentIn 3.5
<210> 1
<211> 17
<212> БЕЛОК
<213> Человек
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (2)..(2)
<223> Xaa в положении 2 может представлять собой Asn, His или Tyr.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (4)..(4)
<223> Xaa в положении 4 может представлять собой Gly, Ser, Thr или Asn.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (8)..(8)
<223> Xaa в положении 8 может представлять собой Thr или Arg.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (15)..(15)
<223> Xaa в положении 15 может представлять собой Ala, Asp, Glu, Gly или
Ser.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (16)..(16)
<223> Xaa в положении 16 может представлять собой Ser или Thr.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (17)..(17)
<223> Xaa в положении 17 может представлять собой Asp или Glu.
<400> 1
Cys Xaa Cys Xaa Gly Pro Pro Xaa Phe Glu Cys Trp Cys Tyr Xaa Xaa
1 5 10 15
Xaa
<210> 2
<211> 18
<212> БЕЛОК
<213> ЧЕЛОВЕК
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (3)..(3)
<223> Xaa в положении 3 может представлять собой Asn, His или Tyr.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (5)..(5)
<223> Xaa в положении 5 может представлять собой Gly, Ser, Thr или Asn.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (9)..(9)
<223> Xaa в положении 9 может представлять собой Thr или Arg.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (16)..(16)
<223> Xaa в положении 16 может представлять собой Ala, Asp, Glu, Gly или
Ser.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (17)..(17)
<223> Xaa в положении 17 может представлять собой Ser или Thr.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (18)..(18)
<223> Xaa в положении 18 может представлять собой Asp или Glu.
<400> 2
Ser Cys Xaa Cys Xaa Gly Pro Pro Xaa Phe Glu Cys Trp Cys Tyr Xaa
1 5 10 15
Xaa Xaa
<210> 3
<211> 22
<212> БЕЛОК
<213> Человек
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (5)..(5)
<223> Xaa в положении 5 может представлять собой Asn, His или Tyr.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (7)..(7)
<223> Xaa в положении 7 может представлять собой Gly, Ser, Thr или Asn.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (11)..(11)
<223> Xaa в положении 11 может представлять собой Thr или Arg.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (18)..(18)
<223> Xaa в положении 18 может представлять собой Ala, Asp, Glu, Gly или
Ser.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (19)..(19)
<223> Xaa в положении 19 может представлять собой Ser или Thr.
<220>
<221> ПРОЧИЙ_ПРИЗНАК
<222> (20)..(20)
<223> Xaa в положении 20 может представлять собой Asp или Glu.
<400> 3
Ala Gly Ser Cys Xaa Cys Xaa Gly Pro Pro Xaa Phe Glu Cys Trp Cys
1 5 10 15
Tyr Xaa Xaa Xaa Gly Thr
20
<210> 4
<211> 4
<212> БЕЛОК
<213> Человек
<400> 4
Gly Gly Gly Lys
1
<210> 5
<211> 4
<212> БЕЛОК
<213> Человек
<400> 5
Gly Ser Gly Lys
1
<210> 6
<211> 5
<212> БЕЛОК
<213> Человек
<400> 6
Gly Ser Gly Ser Lys
1 5
<210> 7
<211> 26
<212> БЕЛОК
<213> Человек
<400> 7
Ala Gly Ser Cys Tyr Cys Ser Gly Pro Pro Arg Phe Glu Cys Trp Cys
1 5 10 15
Tyr Glu Thr Glu Gly Thr Gly Gly Gly Lys
20 25
<210> 8
<211> 26
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> 26-мерный скремблированный cMET-связывающий пептид (отрицательный
контроль)
<400> 8
Thr Gly Glu Cys Thr Cys Pro Tyr Trp Glu Phe Arg Pro Cys Glu Cys
1 5 10 15
Gly Ser Tyr Ser Gly Ala Gly Gly Gly Lys
20 25
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕЧЕНЫЕ ПЕПТИДЫ, СВЯЗЫВАЮЩИЕ ФАКТОР РОСТА ГЕПАТОЦИТОВ (HGF), ДЛЯ ВИЗУАЛИЗАЦИИ | 2008 |
|
RU2473361C9 |
| КОМПОЗИЦИИ ПЕПТИДНЫХ РАДИОАКТИВНЫХ ИНДИКАТОРОВ | 2011 |
|
RU2594167C2 |
| Составы на основе антитела к CD19 | 2017 |
|
RU2748024C2 |
| Жидкая композиция | 2021 |
|
RU2838973C1 |
| КОНЪЮГАТЫ АНТИТЕЛА К cMet И ЛЕКАРСТВЕННОГО СРЕДСТВА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2740996C2 |
| ИНСУЛИН И ЕГО ПРОИЗВОДНЫЕ С ПОВЫШЕННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬ ЦИНК | 1997 |
|
RU2176646C2 |
| Комплекс аналога инсулина со сниженной аффинностью к инсулиновому рецептору и его применение | 2018 |
|
RU2779462C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛА К PCSK-9, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2782792C2 |
| СОВМЕСТНЫЕ СОСТАВЫ АНТИ-LAG3 АНТИТЕЛА И АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2822192C2 |
| МОНОКЛОНАЛЬНЫЕ АГЕНТЫ, СВЯЗЫВАЮЩИЕ сМЕТ, ИХ КОНЪЮГАТЫ С ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2744914C2 |

Группа изобретений относится к диагностике заболеваний. Предложены состав для оптической визуализации организма млекопитающего, способ его получения, фармацевтический состав и способ in vivo оптической визуализации организма млекопитающего. Лиофилизированный состав для применения при получении изображения сайтов сверхэкспрессии или локализации cMet содержит от 4 до 12% по массе активного фармацевтического ингредиента (API) формулы I, включающий по меньшей мере один cMet-связывающий пептид, от 3 до 35% по массе буферного агента и от 56 до 91% по массе лиопротектора. Состав при перерастворении имеет рН от 6,8 до 9. Состав применяют для визуализации in vivo и для анализов количественного определения cMet в биологических образцах или визуализации cMet в образцах ткани. Изобретения обеспечивают получение стабильного в течение длительного периода времени состава для оптической визуализации, который имеет хорошее восстановление при разведении при соответствующих показателях рН и тоничности для внутривенного применения. 4 н. и 38 з.п. ф-лы, 1 ил., 10 табл., 7 пр.
1. Лиофилизированный состав для применения при получении изображения сайтов сверхэкспрессии или локализации cMet, где лиофилизированный состав содержит:
(i) активный фармацевтический ингредиент (API);
(ii) буферный агент; и
(iii) лиопротектор;
где API представляет собой агент визуализации, содержащий по меньшей мере один cMet-связывающий пептид, подходящий для оптической визуализации организма млекопитающего, где агент визуализации включает соединение Формулы I:
(Формула I)
где:
Z1 присоединен к N-концу сМВР и представляет собой Н или MIG;
Z2 присоединен к С-концу сМВР и представляет собой ОН, NH2, OBc или MIG,
где Bc представляет собой биосовместимый катион;
сМВР представляет собой cMet-связывающий циклический пептид из 17-30 аминокислот, который содержит аминокислотную последовательность (SEQ ID NO:1):
Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6;
где: Xaa1 представляет собой Asn, His или Tyr;
Xaa2 представляет собой Gly, Ser, Thr или Asn;
Xaa3 представляет собой Thr или Arg;
Xaa4 представляет собой Ala, Asp, Glu, Gly или Ser;
Xaa5 представляет собой Ser или Thr;
Xaa6 представляет собой Asp или Glu;
и Cysa-d, каждый из них представляет собой такие остатки цистеина, что остатки а и b, а также c и d циклизованы с образованием двух отдельных дисульфидных связей;
MIG представляет собой ингибирующую метаболизм группу, которая представляет собой биосовместимую группу, ингибирующую или подавляющую метаболизм пептида in vivo;
L представляет собой синтетическую линкерную группу формулы -(А)m-, где каждый А независимо представляет собой -CR2-, -CR=CR-, -C≡C-, -CR2CO2-, -CO2CR2-, -NRCO-, -CONR-, -NR(C=O)NR-, -NR(C=S)NR-, -SO2NR-, -NRSO2-, -CR2OCR2-, -CR2SCR2-, -CR2NRCR2-, С4-8-циклогетероалкиленовую группу, С4-8-циклоалкиленовую группу, С5-12-ариленовую группу, С3-12-гетероариленовую группу, аминокислоту, сахар или монодисперсную полиэтиленгликолевую (PEG) структурную единицу;
каждый R независимо выбран из Н, С1-4-алкила, С2-4-алкенила, С2-4-алкинила, С1-4-алкоксиалкила или С1-4-гидроксиалкила;
m равен целому числу от 1 до 20;
n равен целому числу 0 или 1;
IM представляет собой оптический репортерный визуализирующий фрагмент, подходящий для визуализации организма млекопитающего с использованием света с длиной волны в диапазоне от фиолетовой до ближней инфракрасной области спектра (400-1200 нм);
где состав содержит от 4 до 12% по массе API, от 3 до 35% по массе буферного агента, и от 56 до 91% по массе лиопротектора; и где состав при перерастворении имеет рН от рН 6,8 до рН 9.
2. Лиофилизированный состав по п. 1, где в дополнение к SEQ ID NO:1 сМВР дополнительно включает остаток Asp или Glu, или аналог такового в пределах 4 аминокислотных остатков пептидного С- или N-конца сМВР-пептида, и -(L)nIM функционализирована аминогруппой, которая конъюгирована с боковой цепью в карбоксиле упомянутого остатка Asp или Glu, или аналога такового с получением амидной связи.
3. Лиофилизированный состав по п. 1 или 2, где в дополнение к SEQ ID NO:1 сМВР включает остаток Lys, или аналог такового в пределах 4 аминокислотных остатков пептидного С- или N-конца сМВР-пептида, и -(L)nIM функционализирована карбоксильной группой, которая конъюгирована с боковой цепью в эпсилон-аминогруппе упомянутого остатка Lys, или аналога такового с получением амидной связи.
4. Лиофилизированный состав по любому из пп. 1-3, где сМВР включает аминокислотную последовательность, представляющую собой или SEQ ID NO:2 или SEQ ID NO:3:
Ser-Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6 (SEQ ID NO:2);
Ala-Gly-Ser-Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6-Gly-Thr (SEQ ID NO:3).
5. Лиофилизированный состав по любому предшествующему пункту, где Xaa3 представляет собой Arg.
6. Лиофилизированный состав по любому предшествующему пункту, где в дополнение к SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3 сМВР дополнительно включает по любому из N- или С-концов линкерный пептид, который выбирают из -Gly-Gly-Gly-Lys- (SEQ ID NO:4), -Gly-Ser-Gly-Lys- (SEQ ID NO:5) и -Gly-Ser-Gly-Ser-Lys- (SEQ ID NO:6).
7. Лиофилизированный состав по любому предшествующему пункту, где сМВР включает аминокислотную последовательность (SEQ ID NO:7):
Ala-Gly-Ser-Cysa-Tyr-Cysc-Ser-Gly-Pro-Pro-Arg-Phe-Glu-Cysd-Trp-Cysb-Tyr-Glu-Thr-Glu-Gly-Thr-Gly-Gly-Gly-Lys.
8. Лиофилизированный состав по любому предшествующему пункту, где как Z1, так и Z2 независимо представляют собой MIG.
9. Лиофилизированный состав по любому предшествующему пункту, где Z1 представляет собой ацетил, и Z2 представляет собой первичный амид.
10. Лиофилизированный состав по любому предшествующему пункту, где n имеет значение 0.
11. Лиофилизированный состав по любому предшествующему пункту, где IM представляет собой краситель, имеющий максимум поглощения в диапазоне 600-1000 нм.
12. Лиофилизированный состав по п. 11, где IM представляет собой цианиновый краситель.
13. Лиофилизированный состав по п. 12, где цианиновый краситель имеет Формулу III:
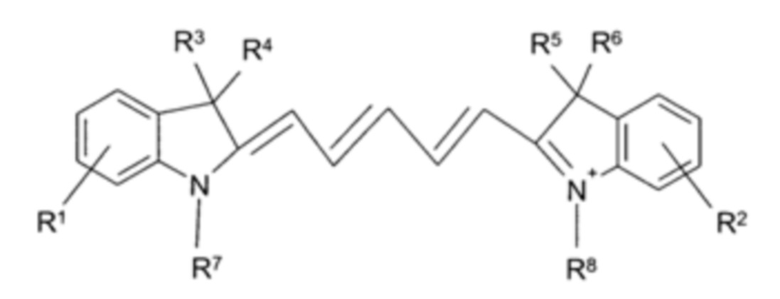
(Формула III)
где:
R1 и R2 независимо представляют собой Н или SO3M1, и, по меньшей мере, один из R1 и R2 представляет собой SO3M1, где М1 представляет собой Н или Bc;
R3 и R4 независимо представляют собой С1-4-алкил или C1-6-карбоксиалкил;
R5, R6, R7 и R8 независимо представляют собой группы Ra;
где Ra представляет собой С1-4-алкил, C1-6-карбоксиалкил или -(CH2)kSO3M1, где k означает целое число 3 или 4;
при условии, что цианиновый краситель имеет всего 1-4 заместителя SO3M1 в группах R1, R2 и Ra.
14. Лиофилизированный состав по любому предшествующему пункту, где состав при перерастворении имеет рН от рН 6,8 до рН 8,2, необязательно от рН 6,8 до рН 8, необязательно от рН 7 до рН 8.
15. Лиофилизированный состав по любому предшествующему пункту, где буферный агент присутствует в количестве, которое обеспечивает при перерастворении раствор, имеющий рН от рН 6,8 до рН 8,2, необязательно от рН 6,8 до рН 8, необязательно от рН 7 до рН 8.
16. Лиофилизированный состав по любому предшествующему пункту, где cостав содержит от 8 до 10% по массе API, необязательно 9% по массе API.
17. Лиофилизированный состав по любому предшествующему пункту, где состав содержит от 7 до 35% по массе буферного агента, необязательно от 12 до 35% по массе буферного агента, необязательно от 15 до 35% по массе буферного агента, необязательно от 18 до 35% по массе буферного агента, необязательно от 25 до 35% по массе буферного агента, необязательно от 32 до 35% по массе буферного агента, необязательно 32% по массе буферного агента.
18. Лиофилизированный состав по любому предшествующему пункту, где состав содержит от 56 до 82% по массе лиопротектора, необязательно от 56 до 77% по массе лиопротектора, необязательно от 56 до 75% по массе лиопротектора, необязательно от 56 до 72% по массе лиопротектора, необязательно от 56 до 66% по массе лиопротектора, необязательно от 56 до 58% по массе лиопротектора, необязательно 58% по массе лиопротектора.
19. Лиофилизированный состав по любому предшествующему пункту, где буферный агент представляет собой по меньшей мере один буферный агент, выбираемый из фосфатного буферного агента и алканоламинового буферного агента.
20. Лиофилизированный состав по п. 19, где фосфатный буферный агент включает гидрофосфат и дигидрофосфат, где необязательно фосфатный буферный агент гидратирован.
21. Лиофилизированный состав по п. 19 или 20, где алканоламиновый буферный агент представляет собой трис(гидроксиметил)аминометан.
22. Лиофилизированный состав по любому предшествующему пункту, где лиопротектор представляет собой по меньшей мере одно вещество, выбираемое из сахарозы и маннита, и их производных.
23. Лиофилизированный состав по любому предшествующему пункту, где лиопротектор представляет собой маннит или его производное.
24. Лиофилизированный состав по любому предшествующему пункту, где состав дополнительно содержит регулятор тоничности.
25. Лиофилизированный состав по любому предшествующему пункту, где лиопротектор также действует в качестве регулятора тоничности.
26. Способ получения лиофилизированного состава, где способ включает в себя следующие стадии:
а) обеспечивают загрузку активного фармацевтического ингредиента (API), буферного агента и лиопротектора в сосуд для лиофилизации;
b) проводят первую стадию удаления воды; и
c) проводят вторую стадию удаления воды;
где лиопротектор и буферный агент добавляют до того, как проводят лиофилизацию, и API представляет собой агент визуализации, содержащий по меньшей мере один cMet-связывающий пептид, подходящий для оптической визуализации организма млекопитающего, где агент визуализации включает соединение Формулы I:

(Формула I)
где:
Z1 присоединен к N-концу сМВР и представляет собой Н или MIG;
Z2 присоединен к С-концу сМВР и представляет собой ОН, NH2, OBc или MIG,
где Bc представляет собой биосовместимый катион;
сМВР представляет собой cMet-связывающий циклический пептид из 17-30 аминокислот, который содержит аминокислотную последовательность (SEQ ID NO:1):
Cysa-Xaa1-Cysc-Xaa2-Gly-Pro-Pro-Xaa3-Phe-Glu-Cysd-Trp-Cysb-Tyr-Xaa4-Xaa5-Xaa6;
где: Xaa1 представляет собой Asn, His или Tyr;
Xaa2 представляет собой Gly, Ser, Thr или Asn;
Xaa3 представляет собой Thr или Arg;
Xaa4 представляет собой Ala, Asp, Glu, Gly или Ser;
Xaa5 представляет собой Ser или Thr;
Xaa6 представляет собой Asp или Glu;
и Cysa-d, каждый из них представляет собой такие остатки цистеина, что остатки а и b, а также c и d циклизованы с образованием двух отдельных дисульфидных связей;
MIG представляет собой ингибирующую метаболизм группу, которая представляет собой биосовместимую группу, ингибирующую или подавляющую метаболизм пептида in vivo;
L представляет собой синтетическую линкерную группу формулы -(А)m-, где каждый А независимо представляет собой -CR2-, -CR=CR-, -C≡C-, -CR2CO2-, -CO2CR2-, -NRCO-, -CONR-, -NR(C=O)NR-, -NR(C=S)NR-, -SO2NR-, -NRSO2-, -CR2OCR2-, -CR2SCR2-, -CR2NRCR2-, С4-8-циклогетероалкиленовую группу, С4-8-циклоалкиленовую группу, С5-12-ариленовую группу, С3-12-гетероариленовую группу, аминокислоту, сахар или монодисперсную полиэтиленгликолевую (PEG) структурную единицу;
каждый R независимо выбран из Н, С1-4-алкила, С2-4-алкенила, С2-4-алкинила, С1-4-алкоксиалкила или С1-4-гидроксиалкила;
m равен целому числу от 1 до 20;
n равен целому числу 0 или 1;
IM представляет собой оптический репортерный визуализирующий фрагмент, подходящий для визуализации организма млекопитающего с использованием света с длиной волны в диапазоне от фиолетовой до ближней инфракрасной области спектра (400-1200 нм);
где состав содержит от 4 до 12% по массе API, от 3 до 35% по массе буферного агента, и от 56 до 91% по массе лиопротектора; и где состав при перерастворении имеет рН от рН 6,8 до рН 9.
27. Способ по п. 26, где первую стадию удаления воды проводят при температуре -30°С или ниже, необязательно -35°С или ниже, необязательно -38°С или ниже.
28. Способ по п. 26 или 27, где вторую стадию удаления воды проводят при температуре 10°С или выше, необязательно 15°С или выше, необязательно 20°С или выше.
29. Способ по любому из пп. 26-28, где по меньшей мере одну из стадий, выбираемых из первой и второй стадий удаления воды, проводят при давлении 50 мкбар или менее.
30. Способ по любому из пп. 26-29, где обе стадии, выбираемые из первой и второй стадий удаления воды, проводят при давлении 50 мкбар или менее.
31. Фармацевтическая композиция для применения при получении изображения сайтов сверхэкспрессии или локализации cMet, где фармацевтическая композиция содержит эффективное количество состава по любому из пп. 1-25 и биосовместимый носитель, в форме, подходящей для введения млекопитающему.
32. Фармацевтическая композиция по п. 31, где фармацевтическая композиция имеет рН от рН 6,8 до рН 9, необязательно от рН 6,8 до рН 8,2, необязательно от рН 7 до рН 8.
33. Способ in vivo оптической визуализации организма млекопитающего, который включает введение по меньшей мере одного состава, выбираемого из состава по любому из пп. 1-25 и фармацевтической композиции по п. 31 или 32 с получением изображений сайтов сверхэкспрессии или локализации cMet.
34. Способ по п. 33, где способ включает следующие стадии:
a) облучают поверхность интересующей ткани возбуждающим светом;
b) детектируют флуоресценцию от агента визуализации, которая генерируется при возбуждении агента визуализации;
c) необязательно подвергают фильтрации свет, детектируемый детектором флуоресценции, с отделением флуоресцентного компонента; и
d) получают изображение поверхности интересующей ткани на основе флуоресцентного свечения на стадиях (b) или (c).
35. Способ по п. 34, где возбуждающий свет на стадии (a) представляет собой незатухающую волну (CW) по природе.
36. Способ по п. 33, где способ включает следующие стадии:
a) подвергают светорассеивающую биологическую ткань упомянутого организма млекопитающего, имеющую гетерогенную структуру, воздействию света от источника света, имеющего заранее установленную варьируемую по времени интенсивность, с обеспечением возбуждения агента визуализации, где ткань многократно рассеивает возбуждающий свет;
b) детектируют излучение многократно рассеянного света от ткани в ответ на упомянутое воздействие;
c) проводят количественное определение параметра флуоресценции по всей ткани на основе этого излучения путем установления ряда показателей с использованием процессора, где каждый из показателей соответствует уровню параметра флуоресценции в различных положениях в пределах этой ткани, где уровень параметра флуоресценции варьируется в зависимости от гетерогенной структуры этой ткани; и
d) генерируют изображение ткани путем построения изображения гетерогенной структуры ткани в соответствии с показателями стадии (c).
37. Способ по любому из пп. 33-36, где способ оптической визуализации включает флуоресцентную визуализацию, необязательно флуоресцентную эндоскопию.
38. Способ по любому из пп. 33-37, где данный способ используют для содействия детектированию, проведению диагностики, проведению хирургического вмешательства, определению стадии заболевания, проведению лечения, мониторингу лечения, отслеживанию прогрессирования заболевания или мониторингу терапии.
39. Способ по любому из пп. 33-38, где данный способ используют для содействия детектированию, проведению диагностики, проведению хирургического вмешательства, определению стадии заболевания, проведению лечения, мониторингу лечения, отслеживанию прогрессирования заболевания или отслеживанию терапии одного или более состояний, выбираемых из предракового состояния и рака, необязательно одного или более раковых заболеваний, выбираемых из колоректального рака, рака пищевода, рака груди, рака предстательной железы, рака головы, рака шеи, рака яичников, рака прямой кишки, рака поджелудочной железы, рака щитовидной железы, рака желудка и саркомы.
40. Состав по любому из пп. 1-25 или фармацевтическая композиция по п. 31 или 32, для применения в детектировании, проведении диагностики, проведении хирургического вмешательства, определении стадии заболевания, мониторинге прогрессирования заболевания или мониторинге терапии.
41. Состав по любому из пп. 1-25 или фармацевтическая композиция по п. 31 или 32, для применения в детектировании, проведении диагностики, проведении хирургического вмешательства, определении стадии заболевания, мониторинге прогрессирования заболевания или мониторинге терапии одного или более состояний, выбираемых из предракового состояния и рака, необязательно одного или более раковых заболеваний, выбираемых из колоректального рака, рака пищевода, рака груди, рака предстательной железы, рака головы, рака шеи, рака яичников, рака прямой кишки, рака поджелудочной железы, рака щитовидной железы, рака желудка и саркомы.
42. Состав по любому из пп. 1-25 или фармацевтическая композиция по п. 31 или 32 для применения в детектировании, проведении диагностики, проведении хирургического вмешательства, определении стадии заболевания, мониторинге прогрессирования заболевания или мониторинге терапии сайтов сверхэкспрессии или локализации cMet.
| BURGGRAAF, J., et al | |||
| Detection of colorectal polyps in humans using an intravenously administered fluorescent peptide targeted against c-Met | |||
| Nature Medicine, 2015, v.21, no.8, p.955-961, Supplementary information | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| DI TOMMASO C | |||
| et al | |||
| Investigations on the lyophilisation of MPEG-hexPLA micelle | |||
Авторы
Даты
2023-08-29—Публикация
2019-03-26—Подача