Область техники
Данное изобретение относится, в основном, к способам лечения васкулярных и ишемических заболеваний путем введения композиций, которые ингибируют взаимодействие Dll4 с рецепторами Notch и/или активацию рецепторов Notch. Конкретнее это изобретение относится к способам лечения васкулярных и/или ишемических заболеваний глаз путем введения композиций, которые ингибируют взаимодействие Dll4 с рецепторами Notch.
Предпосылки изобретения
Ангиогенез является фундаментальным процессом, необходимым для нормального развития и роста тканей и органов, и включает образование новых кровеносных сосудов из предсуществующих сосудов. Ангиогенез и гомеостаз кровеносных сосудов тесно контролируется при помощи сильно регулируемой системы ангиогенных модуляторов. Отклонение от такого тесного контроля часто приводит к или связано с заболеванием.
Хотя нерегулируемый «чрезмерный» или аберрантный ангиогенез является характеристикой многочисленных болезненных состояний, недостаточный ангиогенез, утрата кровеносных сосудов или функциональная или структурная непроходимость кровеносных сосудов также может быть серьезной медицинской проблемой. Активация ангиогенеза и/или предупреждение регрессии существующих кровеносных сосудов целесообразны в ситуациях, где ткань становится ишемической, например при ретинальной, церебральный, сердечно-сосудистой ишемии и ишемии конечностей, и в условиях, где должно быть установлено, повторно установлено, усилено или расширено васкулярное обеспечение, например при заживлении мелких ран и после трансплантации тканей или органов, или для стимуляции образования коллатеральных сосудов или иного способа увеличения перфузии ткани или органа с нарушенной циркуляцией.
Путь передачи сигналов Notch представляет собой систему межклеточной связи, которая используется широким кругом эукариотов во многих биологических процессах, таких как дифференцировка, пролиферация и гомеостаз (Artavanis-Tsakonas et al. (1999) Science 284:770-776). Путь передачи сигналов Notch также вовлечен в контроль развития сосудов (Iso et al. (2003) Arterioscler Thromb Vasc Biol. 23:543-553).
Дельтаобразный 4 (Dl4) или дельтаобразный лиганд 4 (Dll4) (здесь и далее «Dll4») является членом семейства Дельта лигандов Notch, который проявляет в высокой степени селективную экспрессию мышечным эндотелием (Shutter et al. (2000) Genes Dev. 14:1313-1318). Dll4 является лигандом для рецепторов Notch, включая Notch 1 и Notch 4. Последовательности нуклеиновых кислот и аминокислот для Dll4 мыши и человека представлены в SEQ ID NO:1-2 и SEQ ID NO:3-4 соответственно. Были получены мыши с ген-меченым Dll4 (см., например, Duarte et al. (2004) Genes Dev. 18:2474-2478; Krebs et al. (2004) Genes Dev. 18:2469-2473; Gale et al. (2004) Proc Natl Acad Sci USA 101:15949-15954). Эти исследования показали, что Dll4 сильно экспрессировался на развивающихся кровеносных сосудах эмбриона мыши и что генетическая делеция даже одной аллели Dll4 приводила к эмбриональной летальности, связанной с характерными васкулярными нарушениями.
Краткое описание изобретения
Настоящее изобретение относится к способам лечения заболеваний, оказывающих влияние на сердечно-сосудистую систему при помощи веществ, способных блокировать взаимодействие Dll4 с его рецепторами (антагонисты Dll4). Предоставленные в данном описании экспериментальные результаты подтверждают использование антагонистов DH4 для лечения заболеваний, характеризующихся патологической реваскуляризацией и мышечной недостаточностью, где васкулярная недостаточность обусловлена утратой кровеносных сосудов или функциональными васкулярными изменениями, приводящими к недостаточному кровоснабжению тканей. Антагонисты Dll4, в частности, используются для лечения васкулярных заболеваний глаз, например диабетической ретинопатии, ретинопатии преждевременного развития и других офтальмологических заболеваний, характеризуемых патологическим ангиогенезом и/или ретинальной ишемией, такой как ретинальная венозная или артериальная непроходимость.
Показано, что патологическое ингибирование Dll4 оказывает несколько полезных эффектов в модели ишемической ретинопатии, включая уменьшение утраты кровеносных сосудов, когда применяется во время повреждения, приводящего к утрате кровеносных сосудов, и подавление развития патологических изменений в сосудистой сети, когда усиливается повторный рост более нормальных, функциональных кровеносных сосудов, когда применяется после установления ишемии.
Ожидается, что патологические вещества, которые ингибируют сигнальную систему Dll4, будут сходным образом полезны для лечения других форм ишемического повреждения, включая церебральную ишемию, ишемию сердца и ишемические состояния, воздействующие на конечности и другие органы или ткани тела. Ожидается также, что ингибиторы Dll4 будут клинически полезными при других состояниях, требующих установления или повторного установления васкулярного обеспечения, или будут иным способом полезны от усиления перфузии ткани. Примерами таких состояний являются артериовенозные мальформации, заживление мелких ран, трансплантация органа или ткани и плацентарная недостаточность. Как показано в экспериментальной работе, предоставленной ниже, ингибирование Dll4 предотвращает сужение и непроходимость артерий, свидетельствуя, что ингибиторы Dll4 должны быть эффективными при лечении системной или легочной гипертензии и родственных заболеваний.
В настоящее время показано, что антагонисты Dll4 эффективны для стимуляции продуктивного ангиогенеза как в норме, так и при патологических состояниях. В частности показано, что блокирование сигнального пути Dll4-Notch усиливает ангиогенное прорастание и пролиферацию эндотелиальных клеток сосудов в развивающейся ретинальной сосудистой сети и подавляет образование патологической, эктопической реваскуляризации и развитие артериовенозного анастомоза в пользу более адекватного сосудообразования в ишемической ретине. Кроме того, показано, что применение блокаторов Dll4 при сосудистом повреждении заметно уменьшает последующую утрату кровеносных сосудов. Эти обнаружения подтверждают применение антагониста Dll4 для лечения глазных заболеваний, характеризующихся васкулярными нарушениями, в особенности сопровождаемых ишемией и утратой нормальных сосудов. Примеры таких глазных заболеваний включают ишемические ретинопатии, такие как возрастная макулярная дегенерация, непроходимость центральной ретинальной вены или непроходимость ответвлений ретинальной вены, диабетическую ретинопатию и ретинопатию преждевременного развития.
В первом аспекте изобретение описывает способ лечения нарушения или заболевания глаз, характеризующегося васкулярными нарушениями, включающий введение антагониста Dll4 субъекту, нуждающемуся в таковом. Способ изобретения ускоряет рост функциональных нормальных сосудов, ингибирует рост аномальных или неправильных сосудов и препятствует патологической регрессии кровеносных сосудов.
В одном варианте осуществления антагонист Dll4 представляет собой антитело или фрагмент антитела, которое специфически связывается с Dll4 и блокирует связывание Dll4 с рецептором Notch (например, рецепторами Notch 1 и Notch 4). В другом варианте осуществления антагонист Dll4 по изобретению представляет собой белок или фрагмент белка, включающий внеклеточный домен Dll4 или его фрагмент, который в конкретных вариантах осуществления может быть слит с мультимеризированным компонентом и который связывается с рецепторами Notch, не активируя их, чем блокируются действия эндогенного Dll4.
Расстройство или заболевание глаз, подвергаемое лечению при помощи способа по изобретению, представляет собой расстройство офтальмологической сосудистой системы, характеризующееся наличием аномальных сосудов и/или утратой нормальных сосудов или функции нормальных сосудов. В конкретных вариантах осуществления подвергаемое лечению состояние или расстройство включает ретинопатию преждевременного развития, ишемическую ретинопатию, ретинальную венозную или артериальную непроходимость, диабетическую ретинопатию, хороидальную реваскуляризацию, возрастную дегенерацию желтого пятна, корнеальную реваскуляризацию, реваскулярную глаукому или корнеальную трансплантацию.
Антитело или фрагмент антитела, применяемый в способе по изобретению, может быть поликлональным или моноклональным, и может быть частично относящимся к человеку, химерным или полностью относящимся к человеку. Предпочтительно антитело представляет собой полностью моноклональное антитело человека или фрагмент моноклонального антитела. Фрагмент антитела может быть одноцепочечным антителом, ScFv, Fab или F(ab')2.
В случае когда антагонист Dll4 представляет собой белок или белковый фрагмент, фрагмент предпочтительно является внеклеточным доменом Dll4 или его фрагментом или модифицированным фрагментом и может быть слит с мультимеризированным компонентом. Мультимеризированный компонент является предпочтительно доменом иммуноглобулина, таким как, например, домен Fc, например Fc человека (SEQ ID NO:5). Белок может необязательно содержать сигнальную последовательность, которая может быть нативной для клетки, рекомбинантной или синтетической.
В расширенном аспекте способ по изобретению применим для лечения любого ишемического заболевания или состояния, вызванного недостаточным кровоснабжением, обусловленным утратой кровеносных сосудов и/или слабой перфузией, например ишемическим повреждением, церебральной ишемией, ишемией сердца, ишемическими состояниями, оказывающими влияние на конечности и другие органы или ткани, артериовенозными мальформациями, заживлением мелких ран, трансплантацией органа или ткани, плацентарной недостаточностью, артериальным сужением и непроходимостью, атеросклерозом и системной или пульмонарной гипертензией.
Во втором аспекте изобретение относится к применению вещества, способного ингибировать активность Dll4, при изготовлении лекарства для лечения, подавления или облегчения ишемического или васкулярного расстройства, где антагонистом Dll4 является антитело или фрагмент антитела, способного блокировать связывание Dll4 с рецептором Notch, или фрагмент Dll4, необязательно соединенный с мультимеризированным компонентом (таким как домен Fc). В одном варианте осуществления ишемическое или васкулярное расстройство представляет собой заболевание или состояние глаз, характеризующееся наличием аномальных кровеносных сосудов и/или утратой нормальных кровеносных сосудов или сосудистой функции. Глазное заболевание представляет собой ретинопатию преждевременного развития, ишемическую ретинопатию, ретинальную венозную или артериальную непроходимость, диабетическую ретинопатию, хороидальную реваскуляризацию, возрастную дегенерацию желтого пятна, корнеальную реваскуляризацию, неоваскулярную глаукому или корнеальную трансплантацию.
В другом варианте осуществления ишемическое или васкулярное расстройство представляет собой ишемическое повреждение, церебральную ишемию, ишемию сердца, ишемические состояния, влияющие на конечности и другие органы или ткани, артериовенозные мальформации, заживление мелких ран, трансплантацию органов или ткань, плацентарную недостаточность, сужение и непроходимость артерий, атеросклероз и системную или пульмональную гипертензию.
Другие предметы и преимущества станут очевидными из обзора следующего подробного описания.
Краткое описание фигур
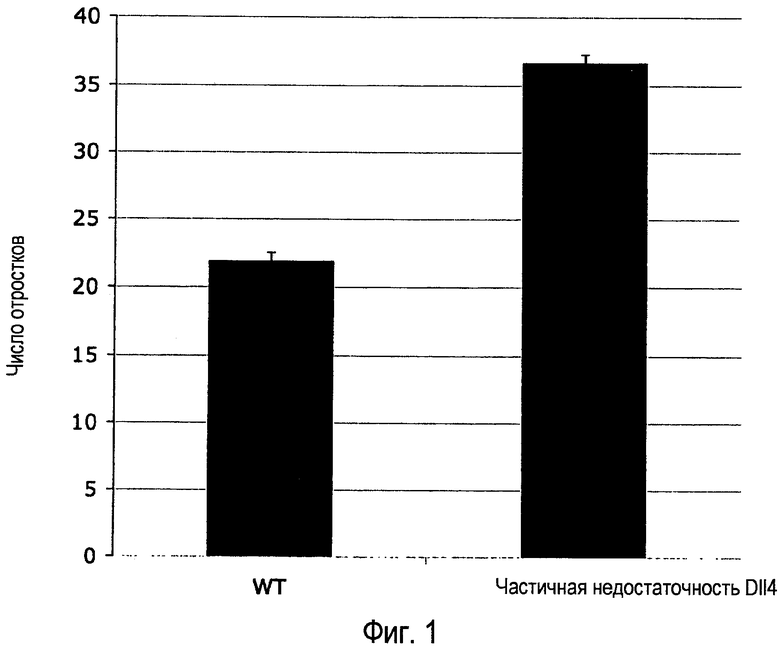
Фиг. 1. Генетическая делеция одной аллели Dll4 увеличивала число ангиогенных прорастаний в развитии ретинальной сосудистой системы. Число прорастаний количественно определяли в поле микроскопа при 100× увеличении. Результаты значительно различались при уровне p<0,00001.
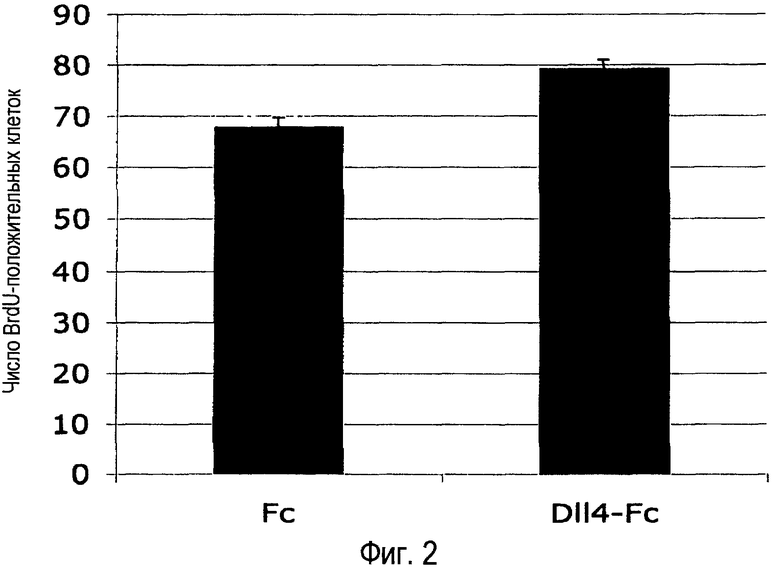
Фиг. 2. Внутриглазное введение Dll4-Fc увеличивало число пролиферирующих BrdU-положительных клеток в развитии ретинальной сосудистой системы. 4,15 мкг mDll4-hFc или 5 мкг контрольного белка hFc человека вводили в стекловидное тело 7-дневных детенышей мыши. Ретинальную сосудистую систему анализировали через 24 часа. Число BrdU-положительных клеток количественно определяли в поле микроскопа при 200× увеличении. Результаты значительно различались при уровне p<0,05.
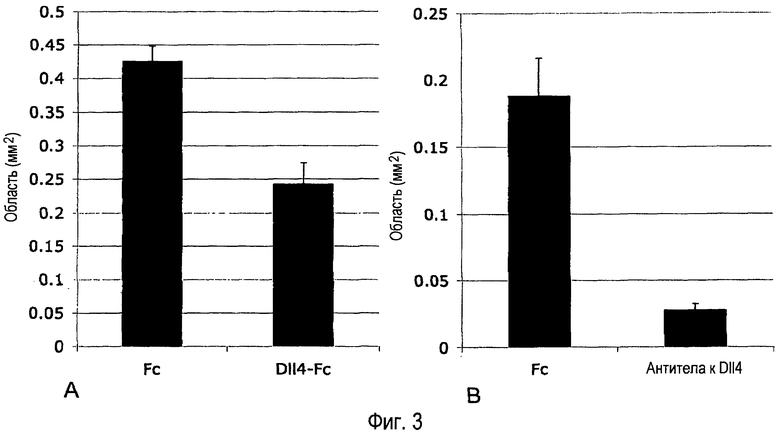
Фиг. 3A-B. Внутриглазное введение Dll4-Fc или антитела анти-Dll4 стимулирует возобновление роста ретинальных сосудов у мыши с индуцированной кислорода ишемической ретинопатией (OIR). (A) 0,48 мкг mDll4-hFc или 0,5 мкг контрольного белка hFc человека вводили в стекловидное тело 13-дневных (постнатальный день 13, или P13) OIR детенышей мыши. Ретинальную сосудистую систему анализировали на P17. (B) 2,55 мкг поликлонального антитела кролика анти-mDll4 или 5 мкг контрольного белка hFc человека вводили в стекловидное тело на P13. Ретинальную сосудистую систему анализировали на P17. В ретинальных микропрепаратах определяли аваскулярные области. Результаты значительно различались при уровнях p<0,0001 (A) и p<0,05 (B).
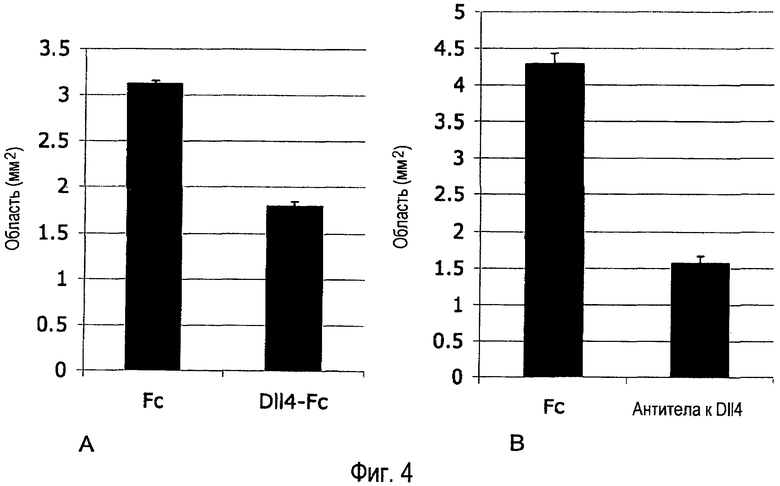
Фиг. 4A-B. Внутриглазное введение Dll4-Fc или антитела анти-Dll4 повышает образование патологической реваскуляризации в OIR. (A) 0,48 мкг mDll4-hFc или 0,5 мкг контрольного белка hFc человека вводили в стекловидное тело на P13. Ретинальную сосудистую систему анализировали на P17. (B) 2,55 мкг поликлонального антитела кролика анти-mDll4 или 5 мкг контрольного белка hFc человека вводили в стекловидное тело на P13. Ретинальную сосудистую систему анализировали на P17. Аномальные васкулярные области (области, содержащие эктопические васкулярные «пучки») определяли в ретинальных микропрепаратах. Результаты значительно различались при уровнях p<0,0001 (A) и p<0,05 (B).
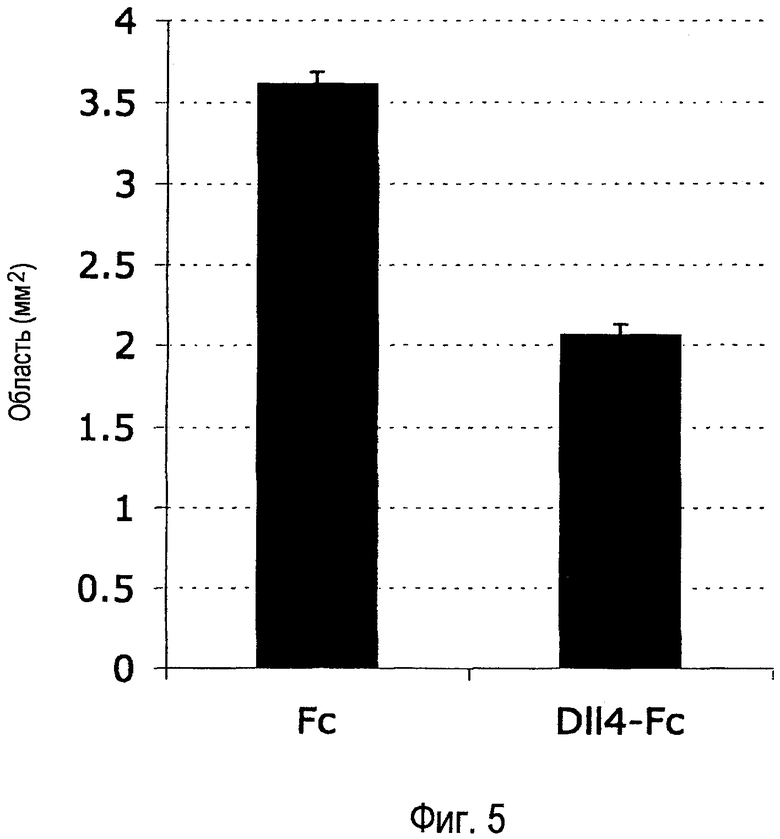
Фиг. 5. Внутриглазное введение Dll4-Fc улучшает ретинальную перфузию. 0,48 мкг mDll4-hFc или 0,5 мкг контрольного белка hFc человека вводили в стекловидное тело на P13. На P17 животным подвергали перфузии лектином томатов, меченным Texas Red, и ретинальную сосудистую систему анализировали на P17. Неперфузные васкулярные области измеряли в ретинальных микропрепаратах. Результаты значительно различались при уровне p<0,0005.
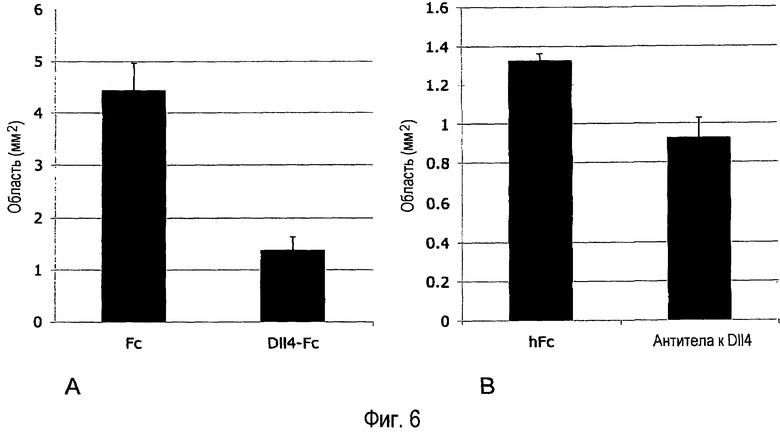
Фиг. 6A-B. Внутриглазное введение Dll4-Fc или антитела анти-Dll4 уменьшает ретинальную гипоксию/ишемию. (A) 4,1 мкг mDll4-hFc или 0,5 мкг контрольного белка hFc человека вводили в стекловидное тело на P12. HypoxyprobeTM-1 вводили в стекловидное тело за один час до забоя животных. Ретинальную сосудистую систему анализировали на P17. Hypoxyprobe-меченые области определяли в ретинальных микропрепаратах. (B) 2,55 мкг поликлонального антитела кролика анти-mDll4 или 5 мкг контрольного белка hFc человека вводили в стекловидное тело на P13. HypoxyprobeTM-1 вводили в стекловидное тело за один час до забоя животных. Ретинальную сосудистую систему анализировали на P17. Hypoxyprobe-меченые области определяли в ретинальных микропрепаратах. Результаты значительно различались при уровнях p<0,001 (A) и p<0,05 (B).
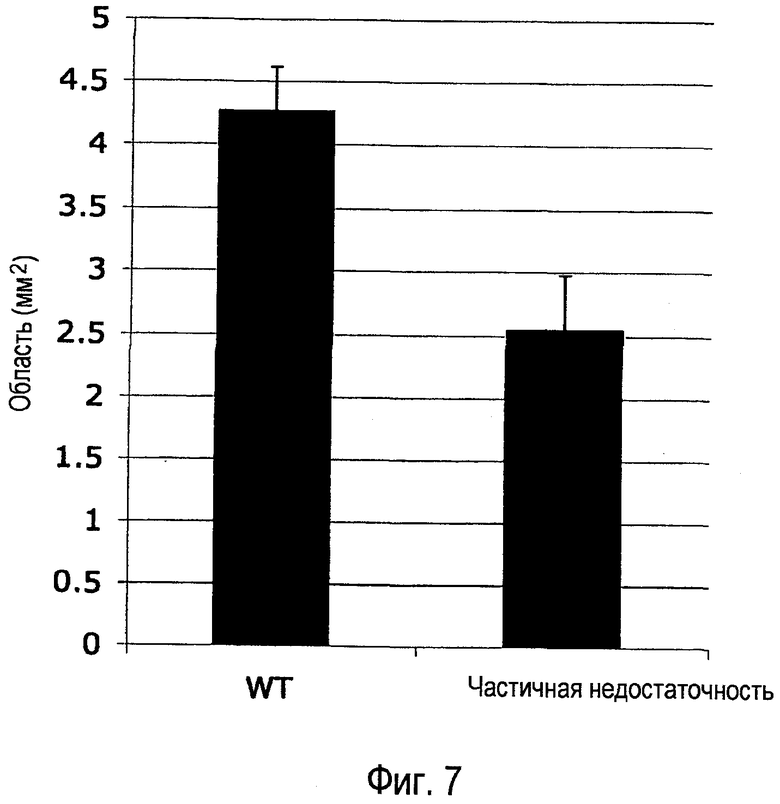
Фиг. 7. Генетическая делеция одной аллели Dll4 уменьшает утрату кровеносных сосудов, индуцированную воздействием гипероксии. Dll4+/lacZ и однопометных контрольных мышей дикого типа помещали в атмосферу 75% кислорода на P7. Ретинальную сосудистую систему анализировали в микропрепаратах на P12. Результаты значительно различались при уровне p<0,05.
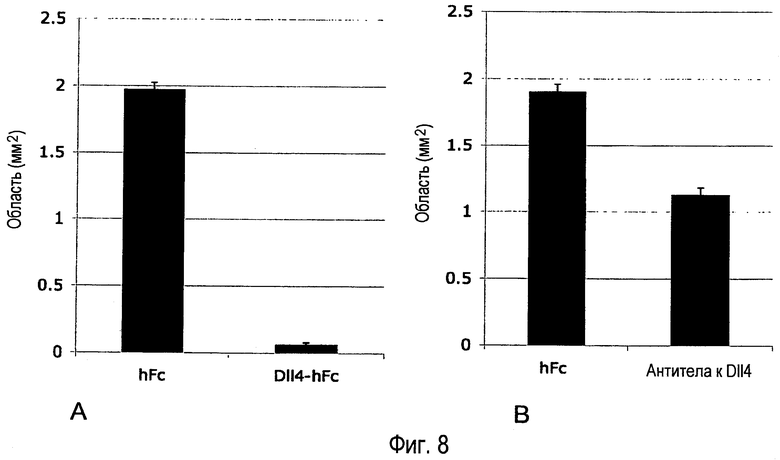
Фиг. 8A-B. Внутриглазное введение Dll4-Fc или антитела анти-Dll4 уменьшает или препятствует утрате кровеносных сосудов, индуцированной воздействием гипероксии. (A) 4,1 мкг mDll4-hFc или 0,5 мкг контрольного белка hFc человека вводили в стекловидное тело на P8. Детенышей помещали в атмосферу 75% кислорода на P9. Ретинальную сосудистую систему анализировали на P10. (B) 2,55 мкг поликлонального антитела кролика анти-mDll4 или 5 мкг контрольного белка hFc человека вводили в стекловидное тело на P8. Детенышей помещали в атмосферу 75% кислорода на P9. Ретинальную сосудистую систему анализировали на P10. Результаты значительно различались при уровнях p<0,00001 (A) и p<0,0001 (B).
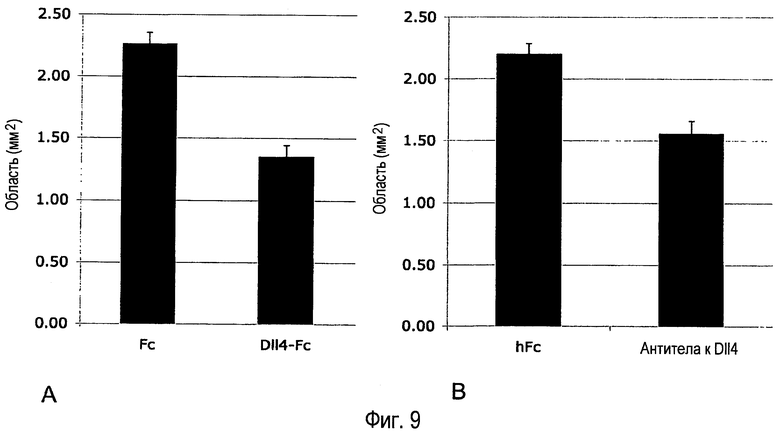
Фиг. 9A-B. Внутриглазное введение Dll4-Fc или антитела анти-Dll4 уменьшает ретинальную сосудистую непроходимость. (A) 4,1 мкг mDll4-hFc или 0,5 мкг контрольного белка hFc человека вводили в стекловидное тело на P8. Детенышей помещали в атмосферу 75% кислорода на P9. Детенышей подвергали перфузии с флуоресцентным лектином и ретинальную сосудистую систему анализировали на P10. (B) 2,55 мкг поликлонального антитела кролика анти-mDll4 или 5 мкг контрольного белка hFc человека вводили в стекловидное тело на P8. Детенышей помещали в атмосферу 75% кислорода на P9. Детенышей подвергали перфузии с флуоресцентным лектином и ретинальную сосудистую систему анализировали на P10. Результаты значительно различались при уровнях p<0,00001 (A) и p<0,0001 (B).
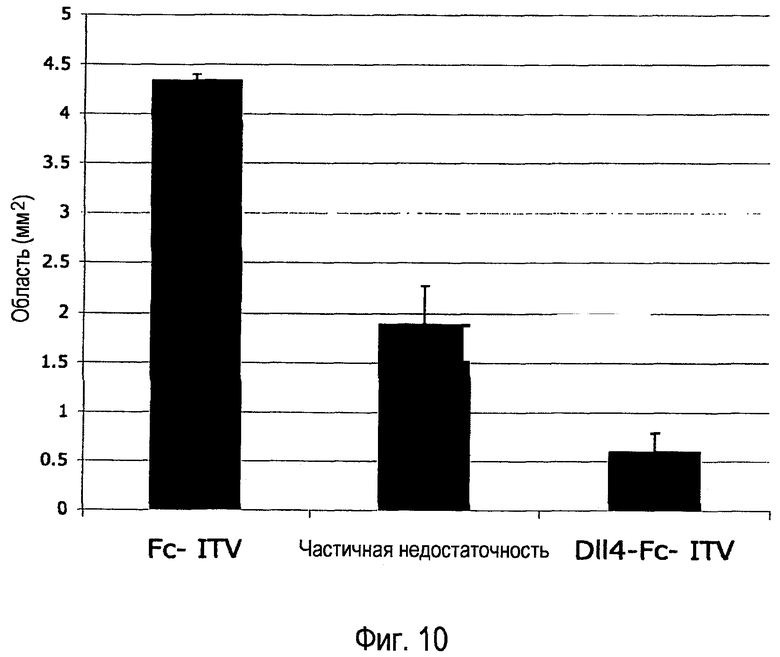
Фиг. 10. Внутриглазное введение Dll4-Fc уменьшает или препятствует утрате ретинальных кровеносных сосудов. 4,1 мкг mDll4-hFc или 0,5 мкг контрольного белка hFc человека вводили в стекловидное тело (ITV) или hDll4-hFc вводили в стекловидное тело с дозой 25 мг на кг массы тела на P7. Детенышей помещали в атмосферу 75% кислорода на P8. Ретинальную сосудистую систему анализировали на P9. Результаты значительно различались при уровнях p<0,0001.
Подробное описание
До описания способов по настоящему изобретению необходимо осознать, что это изобретение не ограничивается конкретными способами и описанными экспериментальными состояниями, поскольку такие способы и состояния могут изменяться. Также следует осознавать, что используемая в данном описании терминология служит лишь для описания конкретных вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения ограничивается только прилагаемой формулой изобретения.
Если не определено особо, все технические и научные термины, используемые в данном описании, обладают теми же значениями, что общепринято любым специалистом в области, к которой относится это изобретение. Хотя любые способы и материалы, сходные или эквивалентные таковым, описанным в данном описании, могут быть использованы в применении или проверке настоящего изобретения, сейчас описываются предпочтительные способы и материалы.
Определения
Под выражением «антагонист Dll4» подразумевают вещество, способное ингибировать биологическую активность Dll4 путем блокирования взаимодействия Dll4 с его рецепторами. Ингибирование активности Dll4 может происходить благодаря ингибированию активации рецептора либо антителом к Dll4, либо аналогом или фрагментом Dll4, который связывается, но не активирует рецептор (непродуктивное связывание). Распространенные ингибиторы включают, в качестве неограничивающих примеров, антитела, способные к распаду или ослаблению внутренних связей рецепторы, олигонуклеотидные аптамеры, пептиды или другие небольшие молекулы-антагонисты и их производные и модифицированные лиганды Dll4, которые связываются со своим рецептором Notch, однако не способны активировать передачу сигнала через такое связывание. Другие подходы включают воздействие на экспрессию гена, кодирующего Dll4, или блокирование активации рецептора Notch, например, при помощи siRNA или ингибиторов γ-секретазы соответственно.
«Нейтрализующее» или «блокирующее» антитело имеет отношение к антителу, чье связывание с Dll4 приводит к ингибированию биологической активности Dll4. Это ингибирование биологической активности Dll4 можно оценивать путем определения одного или нескольких индикаторов биологической активности Dll4. Эти индикаторы биологической активности Dll4 можно оценить при помощи одного или нескольких отдельных стандартных тестов in vitro или in vivo, известных в области (см. примеры ниже). Предпочтительно способность антитела нейтрализовать активность Dll4 оценивают путем ингибирования связывания Dll4 с рецептором Notch, таким как Notch1 и Notch4.
Общее описание
Путь передачи сигнала Notch является эволюционно консервативным и играет ключевые роли при определении судьбы клетки и дифференцировке во многих тканях во время эмбрионального и постнатального развития. Основные компоненты пути Notch экспрессируются в сосудистой системе, и генетическая делеция определенных компонентов Notch, включая Notch1, Notch1/Notch4, Jagged1, Dll1, Dll4, Hey1/Hey2 или преценилины, приводит к эмбриональной летальности, связанной с дефектами мышечной коррекции. Хотя большинство этих генов экспрессируются во многих тканях и типах клеток, Dll4 в значительной степени ограничен сосудистым эндотелием; это позволяет предположить, что Dll4 является ключевым лигандом для рецепторов Notch сосудистой системы.
Во время раннего эмбрионального развития генетическая делеция даже одной аллели Dll4 вызывает сильные васкулярные нарушения, которые приводят к эмбриональной летальности у большинства линий мышей. Действительно, среди множества генов, вовлеченных в образование и развитие сосудов и ангиогенез, гаплоидная недостаточность, как сообщалось, приводит к основным васкулярным дефектам и эмбриональной летальности только для Dll4 и VEGF-A. Ранняя эмбриональная летальность препятствует большинству экспериментальных манипуляций, делая их сложными для точного понимания роли Dll4 в васкулярном развитии и при патологических окружениях.
Для преодоления этого ограничения эффекты делеции гена Dll4 изучали на линии ICR, у которой гаплоидная недостаточность вызывает лишь ограниченную эмбриональную летальность. Васкулярный фенотип, наблюдаемый у этих мутантных мышей, сравнивали с фенотипом, полученным у мышей дикого типа, у которых путь передачи сигнала Dll4/Notch селективно подавлялся инъекцией в стекловидное тело растворимого ингибитора Dll4, Dll4-Fc или нейтрализованного поликлонального антитела против внеклеточного домена Dll4. Для этих экспериментов ретина была выбрана в качестве модельной системы для изучения биологии Dll4, поскольку ретинальная сосудистая система развивается постнатально стереотипным образом, который в высокой степени организован, во времени и в пространственном отношении.
Модель кислород-индуцированной ишемической ретинопатии (OIR) на мышах представляет собой хорошо охарактеризованную модель патологической реваскуляризации, ассоциированной с увеличенной экспрессией жизненно важного проангиогенного фактора, VEGF (Smith et al. 1994 Invest Ophthalmol Vis Sci 35:101-111; Neely et al. 1998 Am J. Pathol 153:665-670; Saint-Geniez et al. 2004 Int J Dev Biol 48:1045-1058), и следовательно, имеющей отношение к патологическому ангиогенезу, связанному с отличным болезненным состоянием (Ferrarra et al. 2005 Nature 438:967-974). Наконец, ретинальная сосудистая система полностью доступна экспериментальным манипуляциям, включая микроинъекции в стекловидное тело экспериментальных веществ.
Описываемые ниже эксперименты показывают, что и при нормальном ретинальном васкулярном развитии, и в модели OIR патологическое подавление пути передачи сигнала Dll4/Notch заметно усиливает ангиогенное прорастание и вызывает образование плотной первичной капиллярной сети. В соответствии с этим было обнаружено, что экспрессия эндогенного Dll4 особенно заметна в большинстве активных областей васкулярного роста как при нормальном развитии, так и в модели OIR. Более того, ингибирование Dll4 заметно подавляет образование аномальной сосудистой системы и препятствует непроходимости кровеносных сосудов и регрессии.
Антагонисты Dll4
Антагонисты Dll4 включают антитела к Dll4 и его фрагментам, способные блокировать связывание Dll4 с рецептором Notch, например Notch1; и белки или белковые фрагменты, включающие внеклеточный домен Dll4, который может быть слит с мультимеризированным компонентом; пептиды и полипептиды (см., например, публикацию патента США 2003/0229023 Oliner et al.).
Антитела к Dll4. Выражение «иммуноглобулин или антитело», как применяют в настоящем описании, относится к полипептиду или белку млекопитающего, включая человека, включающему участок структурной области гена иммуноглобулина или его фрагментов, который специфически связывает и распознает антиген, который в случае настоящего изобретения представляет белок Dll4 или его часть. Если предназначенное антитело или белок наподобие антитела использовать в качестве терапевтического средства для млекопитающего, участки связывания иммуноглобулинов следует получать из соответствующих иммуноглобулинов млекопитающего. Если молекула предназначается для нетерапевтического использования, такого как для диагностикумов и ELISAs, участки связывания иммуноглобулинов могут быть получены либо от человека либо от отличного от человека млекопитающего, такого как мышь. Гены иммуноглобулинов человека или фрагменты генов включают константные области κ, λ, α, γ, Δ, ε, и μ, а также большое число генов вариабельных участков иммуноглобулинов. Легкие цепи классифицируются как κ или λ. Тяжелые цепи классифицируются как γ, μ, α, Δ, или ε, которые, в свою очередь, определяют классы иммуноглобулинов IgG, IgM, IgA, IgD, и IgE соответственно. Внутри каждого класса IgG существуют различные изотипы (например, IgG1, IgG2 и т.д.), а также их аллотипы.
Типичная структурная единица иммуноглобулина (антитела) IgG человека содержит тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара имеет одну легкую цепь (около 25 кДа) и одну тяжелую цепь (около 50-70 кДа). N-конец каждой цепи определяет вариабельные участки приблизительно 100-110 или более аминокислот, ответственных в первую очередь за распознавание антигена. Термины «вариабельная легкая цепь» (VL) и «вариабельная тяжелая цепь» (VH) относятся к этим легким и тяжелым цепям соответственно.
Антитела существуют в качестве интактных иммуноглобулинов или в качестве количества хорошо охарактеризованных фрагментов, образуемых при расщеплении различными пептидазами. Например, пепсин расщепляет антитело ниже дисульфидных связей в области шарнира с образованием F(ab)'2, димера Fab, который сам по себе представляет собой легкую цепь, соединенную с VH-CH при помощи дисульфидной связи. F(ab)'2 может быть восстановлен в мягких условиях для разрушения дисульфидной связи в области шарнира, тем самым превращая димер F(ab)'2 в мономер Fab'. Мономер Fab' представляет собой в основном Fab с частью области шарнира. Несмотря на то что различные фрагменты антител описываются в терминах расщепления интактного антитела, любой специалист может оценить, что такие фрагменты можно синтезировать de novo либо химически, либо с использованием методологии рекомбинантных ДНК. Таким образом, термин антитело, как применяют в настоящем описании, также включает фрагменты антител, полученных либо модификацией целого антитела, или таковых, синтезированных de novo с использованием методологии рекомбинантных ДНК, или получаемый в результате анализа библиотек, таких как библиотеки на основе фага, E. coli или дрожжей (см., например, McCafferty et al. (1990) Nature 348:552-554).
Аналоги или белковые фрагменты Dll4. Антагонист Dll4 может быть фрагментом Dll4, необязательно соединенным с мультимеризированным компонентом. В конкретных вариантах осуществления фрагмент Dll4 может быть слит с мультимеризированным компонентом, таким как домен иммуноглобулина, укороченным доменом иммуноглобулина или аминокислотной последовательностью длиной от 1 до 500 аминокислот, необязательно включающий по крайней мере один остаток цистеина. В предпочтительном варианте осуществления мультимеризированным компонентом является домен иммуноглобулина, предпочтительно домен Fc, например Fc человека (SEQ ID NO:5). Белок или фрагмент белка может необязательно содержать сигнальную последовательность, которая может содержать любую последовательность, известную специалистам в области, для направления секреции полипептида или белка из клетки, включающую натуральную или синтетическую последовательности. Как правило, сигнальную последовательность помещают в начале аминоконца слитого белка по изобретению. Такая сигнальная последовательность может быть нативной для клетки, рекомбинантной или синтетической.
Внеклеточный домен Dll4 состоит из домена Delta/Serrate/Lag-2 (DSL) и восьми тандемных повторов, подобных эпидермальному фактору роста (EGF). Как правило, домены EGF обнаруживают расположенными на позиции приблизительно 218-251 (домен 1), 252-282 (домен 2), 284-322 (домен 3), 324-360 (домен 4), и 362-400 (домен 5), с доменом DSL в положении приблизительно 173-217 и N-концевым доменом в положении приблизительно 27-172 hDll4 (SEQ ID NO:2). В конкретных вариантах осуществления, антагонист Dll4 приблизительно содержит аминокислоты 27-172, 27-217, 218-400, 218-360, 218-322, или 218-282 последовательности SEQ ID NO:2, необязательно слитые с hFc (SEQ ID NO:5).
Способы введения
Изобретение предоставляет способы лечения, включающие введение субъекту эффективного количества вещества по изобретению. В предпочтительном аспекте вещество в значительной степени очищено (например, в значительной степени свободно от субстанций, которые ограничивают его действие или оказывают нежелательные побочные эффекты). Субъект предпочтительно является животным, например коровой, свиньей, лошадью, курицей, кошкой, собакой и т.д., и представляет собой предпочтительно млекопитающего и наиболее предпочтительно человека. В конкретном варианте осуществления может потребоваться введение фармацевтической композиции по изобретению локально в участок, нуждающийся в лечении; этого можно достичь, например, и без ограничения, путем локальной инфузии при хирургии, местном применении, например путем инъекции, при помощи катетера или при помощи имплантата.
Способы по изобретению можно успешно осуществлять путем введения в участок, нуждающийся в лечении, локальным введением, включающим введение в стекловидное тело, внутриглазное, периокулярное, подконъюнктивальное, околосклеральное, подъязычное или местное введение.
Комбинационная терапия
В различных вариантах осуществления способ по изобретению осуществляют с антагонистом Dll4, таким как антитело Dll4, в комбинации с одним или несколькими дополнительными соединениями или терапиями или медицинскими процедурами. Например, соответствующие терапевтические средства для применения в комбинации либо попеременно, либо одновременно включают слитые белки, способные связывать и ингибировать активность мышечного эндотелиального фактора роста (VEGF) (см. патенты США 7070959 и 7087411), иммуносупрессивные средства, такие как кортикостероиды, дексаметазон, циклоспорин A, FK506 или антиметаболические вещества (см. Barker, NH, et al., (2000) Clin Exp Opthal 28:357-360). Другие подходящие терапевтические средства для использования в комбинации либо попеременно, либо одновременно с антагонистом Dll4 по изобретению могут включать вещества, которые могут блокировать биологическую активность других членов семейства VEGF, таких как VEGF-C и VEGF-D.
ПРИМЕРЫ
Следующие примеры использованы для того, чтобы предоставить специалистам в данной области полное раскрытие и описание того, как подготовить и применить способы и композиции по изобретению, и не предназначены для ограничения объема того, что авторы расценивают как свое изобретение. Были предприняты усилия для обеспечения точности в отношении использованных численных значений (например, количества, площадные измерения, и т.д.), однако следует принять во внимание некоторые экспериментальные ошибки и отклонения.
Пример 1. Эффект генетической делеции одной аллели Dll4 на прорастание кровеносных сосудов в развивающейся ретинальной сосудистой системе.
Было предпринято исследование для определения эффектов частичной генетической недостаточности Dll4 на прорастание кровеносных сосудов во время нормального развития ретинального ангиогенеза.
Животные. Технология VelocigeneTM (Valenzuela et al. (2003) Nat. Biotechnol. 21:652-9; Патент США 6586251) была использована для замещения полной кодирующей области Dll4 репортерным геном β-галактозидазы в гибридных эмбриональных стволовых клетках мыши C57BL76:129. Химерные самцы были скрещены с самками ICR. В этом исследовании были использованы мыши Dll4+/lacZ, обратно скрещенные в течение 3 генераций с ICR (87,5% ICR).
Гистохимия и иммуноокрашивание. Детенышей мыши гуманно умерщвляли на P7. Глаза вылущивали и ретины отделяли, фиксировали ночь с 4% параформальдегидом, окрашивали FITC-меченым лектином I Griffonia simplicifolia (GS) (Vector Laboratories, Burlingame, CA), и готовили микропрепараты. Изображения были сделаны с использованием микроскопа Nikon (Melville, NY).
Количественный анализ. Измерения проводили с использованием программного обеспечения Scion Image. Каждая экспериментальная точка была получена, по меньшей мере, в трех повторностях. Для оценки статистической значимости были использованы t-тест Стьюдента и двухфакторный дисперсионный анализ.
Результаты. Периферическое переплетение было более плотным у мышей Dll4+/lacZ, чем у однопометных детенышей дикого типа. Изображения высокого качества демонстрировали, что плотное периферическое переплетение в ретинах мышей Dll4+/lacZ состояло из капилляров, которые были больше в диаметре, более сильно взаимосвязаны и чрезмерно соединены, так что в некоторых участках сосуды срастались с образованием синцития и, в дополнение, что было много больше отростков на фронте роста (Фиг. 1); также наблюдали филоподию в более внутренних частях переплетения с более чем нормальной частотой. Количественный анализ показал, что по сравнению с контролями дикого типа ретины мышей Dll4+/lacZ продемонстрировали 68% увеличение числа отростков на фронте роста поверхностной ретинальной сосудистой системы (Фиг. 1), а также более чем двукратное увеличение числа капиллярных взаимосвязей на единицу участка, приводящее к значительному увеличению мышечного покрытия. Несмотря на отмеченные морфологические изменения внутримышечная инъекция меченного флуоресцином лектина полностью заполнила развивающееся поверхностное васкулярное сплетение за исключением филоподии, простирающейся от конца клеток у мышей Dll4+/lacZ, как и у мышей дикого типа, показывая, что все компоненты развивающейся сосудистой системы имели просветы и были функциональными.
Пример 2. Эффект ингибирования Dll4/Notch Dll4-Fc или антителом анти-Dll4 на развитие ретинальной сосудистой системы.
Было предпринято исследование для определения эффектов патологического ингибирования пути передачи сигнала Dll4/Notch на пролиферацию эндотелиальных клеток и прорастание кровеносных сосудов во время нормально развивающегося ретинального ангиогенеза.
Антитела и реагенты. Dll4-Fc содержит внеклеточный домен Dll4 мыши или человека и часть Fc IgG человека. Dll4-Fc был экспрессирован в клетках CHO и аффинно очищен с использованием хроматографии с белком А. Антитело анти-Dll4 получали путем иммунизации кроликов рекомбинантным mDll4-hFc. Антисыворотку перед использованием частично очищали с использованием хроматографии с белком А.
Животные. Мыши C57/BI6 (Taconic) были использованы для изучения эффекта Dll4-Fc или нейтрализующего Dll4 антитела на развитие ретинальной сосудистой системы.
Микроинъекции в стекловидное тело. Микроинъекции в стекловидное тело (30-100 нл) исследуемых соединений проводили между экватором и корнеальной конечностью при помощи наноинжектора Drummond Scientific (BroPA), оснащенного стеклянной иглой.
Мечение BrdU. Пролиферирующие клетки метили введением BrdU (1 мг/кг в.б.) через 20 часов после микроинъекции в стекловидное тело hFc или Dll4-Fc. Ретины собирали на 4 часа позже и окрашивали антителами ant-BrdU (Dako North America, Inc., Carpinteria, CA) и VE-Cadherin (BD PharMingen, San Diego,CA).
Результаты. Для изучения эффекта локальной интраретинальной недостаточности при передаче сигнала Dll4/Notch и невторичного по отношению к недетектируемому системному нарушению растворимый вариант Dll4 (обозначен Dll4-Fc), который связывается с рецепторами Notch без их активации, блокируя тем самым действия эндогенного Dll4, или нейтрализующее поликлональное антитело, специфическое для внеклеточного домена Dll4, инъецировали в стекловидное тело мышей дикого типа. Через три дня после введения в стекловидное тело любого блокатора Dll4 ретинальные сосуды проявляли морфологические изменения, которые имеют сходство с васкулярными нарушениями, обнаруженными у мышей Dll4+/lacZ, включающие резко увеличенную плотность кровеносных сосудов и размер сосудов. Более того, эти характерные морфологические изменения происходят быстро, ясно проявляясь в течение 24 часов.
Мечение BrdU также демонстрирует увеличенную пролиферацию эндотелиальных клеток в течение 24 часов блокады Dll4 (Фиг. 2). Наблюдаемое ~17% увеличение скорости пролиферации может дать более чем 50% увеличение числа клеток в течение 3-4 времен удвоения.
Пример 3. Эффект Dll4-Fc и антитела анти-Dll4 на ретинальную васкуляризацию, перфузию и васкулярные нарушения у мышей с OIR.
Было предпринято исследование для определения эффектов Dll4-Fc и антитела анти-Dll4 на рост ретинальных сосудов, образование васкулярных нарушений и ретинальную перфузию при кислород-индуцированной ишемической ретинопатии (OIR).
Для определения того, играет ли путь передачи сигнала Dll4/Notch роль в патологическом ангиогенезе, а также во время нормального развития, была использована модель OIR. В модели OIR воздействие на детенышей мышей гипероксии на P7 приводит к быстрой облитерации капилляров в главной ретине. При последующем возврате к комнатному воздуху на P12 аваскулярная зона становится строго гипоксической, что в свою очередь вызывает обширную аномальную реваскуляризацию, характеризующуюся эктопическим ростом сосудов в стекловидном теле (эпиретинальные васкулярные «пучки») и образованием аномальных артериовенозных шунтов; главные части ретины остаются в значительной степени аваскулярными в течение продолжительного периода времени.
Животные и модель OIR. Мыши C57/BI6 (Taconic) были использованы для изучения эффекта Dll4-Fc или нейтрализующего Dll4 антитела на ретинальную реваскуляризацию в OIR. OIR была получена следующим способом, разработанным Smith et al. (Invest. Ophthalmol. Vis. Sci. 1994, 35:101-111). Вкратце, детенышей мышей и их самок помещали в атмосферу 75% кислорода от постнатальных дней (P)7 до P12 и затем возвращали к комнатному воздуху. Воздействие гипероксии индуцирует быструю вазооблитерацию в главной ретине. Когда мышей возвращали к комнатному воздуху (P12), утрата сосудов в главной ретины приводила к сильной гипоксии/ишемии, которая, в свою очередь, стимулирует описанные выше патологические васкулярные изменения.
Для мечения доступных кровеносных сосудов 50 мл меченого Texas red лектина Lycopersicon esculentum (LE) (1 мг/мл; Vector Laboratories, CA) инъецировали в левый желудочек сердца и предоставили циркулировать в течение 5 мин.
Результаты. Ингибирование Dll4/Notch Dll4-Fc или антителом анти-Dll4 улучшало патологическую реваскуляризацию (Фиг. 3A-B), стимулировало рост новых кровеносных сосудов (Фиг. 4A-B) и улучшало ретинальную реперфузию (Фиг. 5).
Dll4-Fc, или антитело анти-Dll4, или контрольный белок (hFc) инъецировали в стекловидное тело на P13 через день после возвращения к комнатному воздуху, значительно позже завершения вазооблитерации. Когда ретины оценивали на P17, введение Dll4-Fc или антитела анти-Dll4 драматически подавляло эктопический рост патологических неоваскулярных пучков в стекловидном теле (Фиг. 1), а также препятствовало образованию аномальных артериовенозных шунтов. Области, охваченные неоваскулярными пучками, уменьшились на 43% в ретинах, обработанных Dll4-Fc, и на 85% в ретинах, обработанных антителом анти-Dll4, в обоих случаях по сравнению с обработанными hFc контрольными ретинами.
Более того, было обнаружено, что Dll4-Fc и антитело анти-Dll4 стимулируют более обширное прорастание новых сосудов из капилляров и вен, граничащих с аваскулярной зоной, что приводило к более быстрому повторному росту кровеносных сосудов в главной ретине, где сосудистая система была истощена, уменьшая таким образом аваскулярную ретинальную область (Фиг. 4A-B). Аваскулярные области уменьшились на 43% в ретинах, обработанных Dll4-Fc, и на 63% в ретинах, обработанных антителом анти-Dll4. Особенно значительным был обширный повторный рост капилляров, происходящих из вен в аваскулярной зоне обработанных Dll4-Fc ретин. Таким образом, ослабление сигнального пути Dll4/Notch способствует распространению новых сосудистых отростков вдоль ретинальной поверхности и ослабляет образование эпиретинальной реваскуляризации, что приводит к более быстрому повторному образованию поверхностного васкулярного сплетения. Вновь образованные сосуды были функциональными и проявляли улучшенную ретинальную повторную перфузию, что подтверждается 45% уменьшением неперфузной области в обработанных Dll4-Fc ретинах (Фиг. 5).
Пример 4. Эффект Dll4-Fc и антитела анти-Dll4 на ретинальную гипоксию/ишемию в модели OIR.
Было предпринято исследование для определения эффектов Dll4-Fc и антитела анти-Dll4 на ретинальную гипоксию/ишемию в модели OIR патологической реваскуляризации.
Чрезмерный рост кровеносных сосудов при определенных обстоятельствах может препятствовать нормальной циркуляции крови и уменьшать оксигенацию ткани. Для проверки того, может ли ингибирование Dll4/Notch улучшать оксигенацию ткани, для детектирования гипоксии ткани и определения эффекта воздействия Dll4-Fc на ретинальную гипоксию/ишемию в неинвазивном тесте был использован HYPOXYPROBETM-1 (Chemicon). HYPOXYPROBETM-1 инъецировали внутрибрюшинно в количестве 100 мг/кг за один час до сбора ретин для оценки.
Результаты. Рост функциональных новых сосудов, следующий за введением ингибиторов Dll4/Notch в стекловидное тело, эффективно уменьшал гипоксию/ишемию ткани, что доказывается 69% и на 30% уменьшением HYPOXYPROBE-положительные области в ретинах, обработанных Dll4-Fc или антителом анти-Dll4 соответственно. (Фиг. 6A-B).
Пример 5. Генетическая делеция одной аллели Dll4 уменьшает индуцированную гипероксией вазооблитерацию.
Было предпринято исследование для определения эффектов частичной генетической недостаточности Dll4 на индуцированную гипероксией регрессию кровеносных сосудов.
Животные. Мыши Dll4+/lacZ, обратно скрещенные в течение 3 генераций с ICR (87,5% ICR), были получены, как описано выше. Из-за рецессивной (rd/rd) мутации ретинальный слой фоторецепторных клеток начинает образовываться на P12 у мышей ICR. Следовательно, для устранения возможных вторичных эффектов утраты фоторецептора на ретинальной сосудистой системе, для оценки поздних стадий ретинального развития и для всех OIR-экспериментов мыши Dll4+/lacZ (87,5% ICR) были обратно скрещены с C57BL/6 для получения мышей Rd/rd, которые не проявляли дегенерацию фоторецептора.
Детенышей мышей помещали в атмосферу 75% кислорода от постнатальных дней (P)7 до P12. Ретины собирали и ретинальную сосудистую систему анализировали в микропрепаратах.
Результаты. Уменьшенная экспрессия Dll4 в ретинальной сосудистой системе мышей Dll4+/lacZ частично препятствует индуцированной гипероксией утрате ретинальных кровеносных сосудов (Фиг. 7). В модели OIR воздействие гипероксии на детенышей мыши на P7 приводит к быстрой непроходимости и облитерации капилляров в главной ретине. Для определения того, может ли ингибирование Dll4/Notch обладать защитным эффектом на кровеносные сосуды, был проанализирован эффект частичной генетической дефектности у мышей Dll4+/lacZ на индуцированную гипероксией вазооблитерацию. Оценивание животных на P12 (с тем, чтобы оценить степень гипероксидной вазооблитерации) позволило обнаружить, что вазооблитерация уменьшилась на 40% у мышей Dll4+/lacZ по сравнению с однопометными контрольными животными дикого типа, что позволило предположить, что ингибиторы Dll4 могут защищать существующие кровеносные сосуды от регрессии.
Пример 6. Эффекты Dll4-Fc и антитела анти-Dll4 на индуцированную гипероксией вазооблитерацию.
Было предпринято исследование для определения эффектов ингибирования Dll4/Notch Dll4-Fc и антителом анти-Dll4 на индуцированную гипероксией регрессию кровеносных сосудов.
Животные. Мыши C57/BI6 (Taconic) были использованы для изучения эффекта Dll4-Fc или нейтрализующего Dll4 антитела на кислород-индуцированную ретинальную вазооблитерацию. Микроинъекции в стекловидное тело исследуемых соединений проводили в постнатальный день 8. В постнатальный день 9 детенышей помещали в атмосферу 75% кислорода. Ретины собирали через 24 часа и ретинальную сосудистую систему анализировали в микропрепаратах.
Результаты. Инъекция в стекловидное тело Dll4-Fc или антитела анти-Dll4 существенно уменьшала области облитерирующей сосудистой системы на 97% и 41% соответственно (Фиг. 8A-B).
Пример 7. Эффекты Dll4-Fc и антитела анти-Dll4 на индуцированную гипероксией непроходимость кровеносных сосудов.
Было предпринято исследование для определения эффектов ингибирования Dll4/Notch Dll4-Fc и антителом анти-Dll4 на индуцированную гипероксией непроходимость кровеносных сосудов. Все процедуры проводили, как описано выше.
Обработка Dll4-Fc и антителом анти-Dll4 уменьшала неперфузионные ретинальные области на 40% и 29% соответственно (Фиг. 9A-B).
Пример 8. Эффекты системного введения Dll4-Fc на индуцированную гипероксией регрессию кровеносных сосудов.
Было предпринято исследование для определения эффектов системного воздействия Dll4-Fc на индуцированную гипероксией регрессию кровеносных сосудов.
4,1 мкг hDll4-hFc или 5 мкг контрольного белка hFc человека инъецировали в стекловидное тело (ITV) или hDll4-hFc инъецировали внутрибрюшинно в дозе 25 мг на кг массы тела на P7. Детенышей помещали в атмосферу 75% кислорода на P8 и ретинальную сосудистую систему анализировали на P9. Все другие процедуры осуществляли, как описано выше.
Результаты. Как локальное (в стекловидное тело), так и системное (внутрибрюшинно) введение Dll4-Fc уменьшало области облитерирующей сосудистой системы на 86% и 56% соответственно, свидетельствуя, что независимо от способа введения ингибиторы Dll4 можно эффективно применять для защиты кровеносных сосудов от регрессии (Фиг. 10).
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕВАСКУЛЯРИЗАЦИЯ ИШЕМИЧЕСКОЙ ТКАНИ СЕТЧАТКИ И СПОСОБ ЕЕ СКРИНИНГА | 2006 |
|
RU2401124C2 |
| ИЗОЛИРОВАННЫЕ ПОПУЛЯЦИИ МИЕЛОИДОПОДОБНЫХ КЛЕТОК КОСТНОГО МОЗГА И СПОСОБЫ ЛЕЧЕНИЯ С НИМИ | 2006 |
|
RU2418856C2 |
| НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, КОДИРУЮЩАЯ СЛИТЫЙ БЕЛОК, СОСТОЯЩИЙ ИЗ РАСТВОРИМОГО ВНЕКЛЕТОЧНОГО ФРАГМЕНТА ЧЕЛОВЕЧЕСКОГО Dll4 И КОНСТАНТНОЙ ЧАСТИ ТЯЖЕЛОЙ ЦЕПИ ЧЕЛОВЕЧЕСКОГО IgG4 | 2021 |
|
RU2787060C1 |
| СПОСОБ МОДУЛИРОВАНИЯ ВАСКУЛЯРИЗАЦИИ | 2005 |
|
RU2378006C2 |
| СПОСОБ ЛЕЧЕНИЯ РЕТИНОПАТИИ ПРИ НЕДОНОШЕННОСТИ И РОДСТВЕННЫХ РЕТИНОПАТИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2403906C2 |
| ВЫДЕЛЕННЫЕ ПОПУЛЯЦИИ МИЕЛОПОДОБНЫХ КЛЕТОК И СПОСОБЫ ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ ТАКИХ ПОПУЛЯЦИЙ | 2007 |
|
RU2473686C2 |
| ГЕМАТОПОЭТИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ И СПОСОБЫ ЛЕЧЕНИЯ НЕОВАСКУЛЯРНЫХ ЗАБОЛЕВАНИЙ ГЛАЗ С ИХ ПОМОЩЬЮ | 2006 |
|
RU2389497C2 |
| АНТИТЕЛА ЧЕЛОВЕКА К ДЕЛЬТА-ПОДОБНОМУ ЛИГАНДУ-4 ЧЕЛОВЕКА | 2007 |
|
RU2448979C2 |
| АНТИТЕЛА ПРОТИВ DLL4 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2415869C2 |
| ГЕМАТОПОЭТИЧЕСКИЕ СТВОЛОВЫЕ КЛЕТКИ И СПОСОБЫ ЛЕЧЕНИЯ НЕОВАСКУЛЯРНЫХ ЗАБОЛЕВАНИЙ ГЛАЗ С ИХ ПОМОЩЬЮ | 2004 |
|
RU2345780C2 |






Изобретение относится к области медицины и касается терапевтических способов лечения васкулярных заболеваний глаз антагонистами дельтаобразного лиганда (Dll4). Сущность изобретения включает применение антагониста дельтаобразного лиганда Dll4 в производстве лекарства для предотвращения или снижения утраты кровеносных сосудов и/или промотирования продуктивного ангиогенеза у пациента, имеющего ишемическое повреждение или сосудистую недостаточность. В качестве антагониста Dll4 оно включает антитело или фрагмент антитела, которое специфически связывает Dll4 и блокирует его связывание с рецептором Notch. Изобретение также включает применение антагониста дельтаобразного лиганда (Dll4) для предотвращения или снижения утраты кровеносных сосудов и/или промотирования продуктивного ангиогенеза у пациента, имеющего ишемическое повреждение или сосудистую недостаточность. Преимущество изобретения заключается в создании лекарства для лечения васкулярных и ишемических заболеваний глаз. 2 н. и 12 з.п. ф-лы, 10 ил.
1. Применение антагониста дельтаобразного лиганда 4 (Dll4) при производстве лекарства для предотвращения или снижения утраты кровеносных сосудов и/или промотирования продуктивного ангиогенеза у пациента, имеющего ишемическое повреждение или сосудистую недостаточность, где антагонист Dll4 включает антитело или фрагмент антитела, которое специфически связывает Dll4 и блокирует связывание Dll4 с рецептором Notch или включает внеклеточный домен Dll4, необязательно соединенный с мультимеризированным компонентом.
2. Применение по п.1, где антитело к Dll4 или фрагмент антитела является поликлональным или моноклональным.
3. Применение по п.2, где антитело или фрагмент антитела является гуманизированным, химерным или является антителом или фрагментом антитела, полностью относящимся к человеку.
4. Применение по п.3, где фрагмент антитела представляет собой одноцепочечное антитело, Fab или F(ab')2.
5. Примененеие по п.1, где мультимеризованный компонент представляет собой домен Fc IgG.
6. Применение по любому из пп.1-5, где подвергаемым лечению субъектом является человек и где ишемическое повреждение или сосудистая недостаточность выбрана из ретинопатии преждевременного развития, ишемической ретинопатии, ретинальной венозной или артериальной непроходимости и диабетической ретинопатии.
7. Применение по любому из пп.1-5, где подвергаемым лечению субъектом является человек и где ишемическое повреждение или сосудистая недостаточность выбрана из церебральной ишемии, ишемии сердца, ишемических состояний, влияющих на конечности, артериовенозной мальформации, заживления мелких ран, плацентарной недостаточности, сужения и непроходимости артерий, атеросклероза и системной или пульмональной гипертензии.
8. Применение антагониста дельтаобразного лиганда 4 (Dll4) для предотвращения или снижения утраты кровеносных сосудов и/или промотирования продуктивного ангиогенеза у пациента, имеющего ишемическое повреждение или сосудистую недостаточность, где антагонист Dll4 включает антитело или фрагмент антитела, которое специфически связывает Dll4 и блокирует связывание Dll4 с рецептором Notch или включает внеклеточный домен Dll4, необязательно соединенный с мультимеризированным компонентом.
9. Применение по п.8, где антитело к Dll4 или фрагмент антитела является поликлональным или моноклональным.
10. Применение по п.9, где антитело или фрагмент антитела является гуманизированным, химерным или является антителом или фрагментом антитела, полностью относящимся к человеку.
11. Применение по п.10, где фрагмент антитела представляет собой одноцепочечное антитело, Fab или F(ab')2.
12. Примененеие по п.8, где мультимеризованный компонент представляет собой домен Fc IgG.
13. Применение по любому из пп.8-12, где подвергаемым лечению субъектом является человек и где ишемическое повреждение или сосудистая недостаточность выбрана из ретинопатии преждевременного развития, ишемической ретинопатии, ретинальной венозной или артериальной непроходимости и диабетической ретинопатии.
14. Применение по любому из пп.8-12, где подвергаемым лечению субъектом является человек и где ишемическое повреждение или сосудистая недостаточность выбрана из церебральной ишемии, ишемии сердца, ишемических состояний, влияющих на конечности, артериовенозной мальформации, заживления мелких ран, плацентарной недостаточности, сужения и непроходимости артерий, атеросклероза и системной или пульмональной гипертензии.
| US 2006030529 A1, 09.02.2006 | |||
| US 2006134121 A1, 22.06.2006 | |||
| CLAXTON S., FRUTTIGER M | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Patterns, 2004, v.5, №1, pp.123-127. | |||
Авторы
Даты
2011-09-27—Публикация
2007-08-07—Подача