Область техники
Изобретение относится к области биомолекулярной фармакологии, биотехнологии и генетической инженерии и касается молекул нуклеиновых кислот и кодируемых ими новых растворимых белков – функциональных антагонистов Dll4 (Delta-like ligand 4) человека, способных блокировать сигнальные пути Dll4-Notch,а также способа их получения.
Уровень техники
Dll4 — трансмембранный белок, являющийся лигандом для рецепторов Notch, включая Notch1 и Notch4. Активируя указанные рецепторы, Dll4 участвует в ангиогенезе, отрицательно регулирует пролиферацию и миграцию эндотелиальных клеток и ангиогенное прорастание. Многочисленными опытами показано, что блокирование взаимодействия Dll4 с его рецепторами позволяет стимулировать продуктивный ангиогенез в ишемизированных тканях, улучшая их окисигенацию и поступление питательных веществ. Блокирование взаимодействия Dll4 с его рецепторами также оказывает противовоспалительное воздействие в отношении эндотелия сосудов за счет подавления экспрессии ангиотензиногена и оказывает вазодилатирующий эффект (Lobovetal. The Dll4/Notch pathway controls postangiogenic blood vessel remodeling and regression by modulating vasoconstriction and blood flow // Blood, 2011, Vol 117, Number 24:6728-37doi: 10.1182/blood-2010-08-302067). Помимо этого, известно противораковое действие ингибиторов взаимодействия Dll4 с его рецепторами, которое может достигаться за счет нескольких механизмов, включая подавление эксрессии клеточного онкогена MYC, стимуляции непроизводительного ангиогенеза в опухоли, ведущего к ее неперфузии и др.
Одним из подходов к блокированию взаимодействия Dll4 с его рецепторами является создание конкурентных антагонистов, связывающихся с рецепторами Notch, но не вызывающих его активации.
В литературе описан антагонист дельтаобразного лиганда Dll4, представляющий собой слитый полипептид Dll4-Fc, который может участвовать в регуляции ангиогенеза. В частности, обнаружено, что внутрибрюшинное введение мышам с ишемизированными конечностями препарата Dll4-Fc в концентрации 2,5 мг/кг стимулирует рост и созревание новых сосудов и таким образом улучшает кровоснабжение конечностей (Liu R. Еt al. Inhibition of Notch signaling by Dll4-Fc promotes reperfusion of acutely ischemic tissues // Biochemical and Biophysical Research Communications, 2012, Vol. 418, No 1, p. 173—179).
Использование слитого полипептида Dll4-Fc в качестве модулятора Notch-сигналлинга, стимуляции роста сосудов, регуляции кровяного давления и маркеров воспаления также опубликовано в статье Lobov et al.,Blood, 2011.
Известен способ лечения ишемических васкулярных заболеваний глаза антагонистами Dll4, описанный в патенте EP2054082B1. При осуществлении этого способа для предотвращения или снижения утраты кровеносных сосудов и/или промотирования продуктивного ангиогенеза у пациента, имеющего ишемическое повреждение или сосудистую недостаточность, применяют антагонист дельтаобразного лиганда 4 (Dll4), включающий внеклеточный домен Dll4, необязательно соединенный с мультимеризированным компонентом. В конкретных вариантах осуществления антагонист Dll4 приблизительно содержит аминокислоты 27-172, 27-217, 218-400, 218-360, 218-322, или 218-282 аминокислотной последовательности белка Dll4 (SEQ ID NO: 1).
В способе активации ангиогенеза, описанном в US2007213266A1, пациентам вводят эффективное количество терапевтического полипептида, представляющего собой внеклеточную часть белка Dll4, в одном из вариантов осуществления описанного способа — DSL-домен белка Dll4.
Однако осуществление описанных выше подходов имеет ряд ограничений: аффинность связывания известных терапевтических полипептидов с Notch-рецептором недостаточно высока, а большой размер терапевтических полипептидов приводит к низкой скорости их проникновения в ткани и обуславливает высокую дозу вводимого пациенту препарата, что, в свою очередь, может приводить к сенсибилизации пациента и другим нежелательным эффектам. Также, использование молекул Dll4-Fc с полноразмерным экстраклеточным доменом Dll4 в составе, может приводить к активации передачи сигнала Notch. На сегодняшний день, несмотря на многообещающий потенциал, все еще нет клинически одобренных лекарственных средств на основе слитого пептида Dll4-Fc.
Предлагаемое изобретение обладает рядом улучшенных свойств по сравнению с аналогами, и поэтому расширяет круг имеющихся кандидатов для лечения заболеваний, механизм воздействия которых основан на блокировании взаимодействия Dll4 с рецепторами Notch.
Сущность изобретения
Задачей настоящего изобретения является расширение арсенала технических средств для лечения заболеваний сердечно-сосудистой системы, ишемических состояний, воспалительных состояний в сосудах и онкологических заболеваний, стимулирования терапевтического ангиогенеза. В частности, задача касается получения новых высокоэффективных полипептидных препаратов – антагонистов Dll4, обладающих высокой аффинностью к рецептору Notch, относительно небольшими размерами и не активирующих при взаимодействии передачу Notch-сигнала; также задача касается разработки нуклеотидных последовательностей, кодирующих такие полипептиды и являющихся экспрессионной основой для их получения.
Решение поставленной задачи осуществляется путем создания слитого белка hDll4-hFc, являющегося антагонистом Dll4, в структуру которого входит фрагмент растворимой внеклеточной части белка Dll4 человека, включающий следующие функциональные субъединицы: домен DSL белка Dll4 (173—217 SEQ ID NO: 1),по меньшей мере пять доменов EGF-подобных повторов белка Dll4, представленных фрагментами 218—251, 252—282, 284—322, 324—360, 362—400 последовательности SEQ ID NO: 1;а также константная часть тяжелой цепи (Fc-фрагмент) IgG4 человека. При этом Fc-фрагмент IgG4 человека присоединен к фрагменту белка Dll4 с С-конца непосредственно или посредством линкерной последовательности.
В некоторых вариантах осуществления изобретения слитый белок дополнительно включает 1-3 домена EGF-подобных повторов белка Dll4, представленных фрагментами 402—438, 440—476 и 480—518 последовательности SEQ ID NO: 1.Другими словами, слитый белок дополнительно включает по меньшей мере один из доменов 6-8 EGF-подобных повторов белка Dll4, расположенный(-х) с С-конца фрагмента белка Dll4, причем порядок расположения этих доменов 6-8 EGF-подобных повторов может быть любым.
В некоторых вариантах осуществления изобретения Fc-фрагмент IgG4 человека соединен с фрагментом белка Dll4 безлинкерно. В некоторых других вариантах осуществления изобретения Fc-фрагмент IgG4 человека соединен с фрагментом белка Dll4 через линкерный пептид. В некоторых частных вариантах осуществления изобретения линкерный пептид представляет собой дипептид GS.
В некоторых вариантах осуществления изобретения фрагмент растворимой внеклеточной части белка Dll4 человека включен в структуру слитого белка в виде последовательности SEQ ID NO: 6.
В некоторых вариантах осуществления изобретения константная часть тяжелой цепи (Fc-фрагмент) человеческого IgG4 имеет последовательность SEQ ID NO: 7.
В некоторых вариантах осуществления изобретения слитый белок дополнительно включает сигнальную последовательность, локализованную на N-конце слитого белка.
В некоторых частных вариантах осуществления изобретения слитый белок имеет аминокислотную последовательность SEQ ID NO: 2.
В некоторых других частных вариантах осуществления изобретения слитый белок имеет аминокислотную последовательность SEQ ID NO: 4.
Поставленная задача также решается путем создания изолированной молекулы нуклеиновой кислоты, кодирующей такой слитый белок.
В некоторых частных вариантах осуществления изобретения молекула нуклеиновой кислоты имеет последовательность SEQ ID NO: 3.
В некоторых других частных вариантах осуществления изобретения молекула нуклеиновой кислоты имеет последовательность SEQ ID NO: 5.
Указанная задача также решается путем создания экспрессирующего вектора, несущего нуклеотидную последовательность, соответствующую последовательности изолированной молекулы нуклеиновой кислоты, кодирующей такой слитый белок, под контролем регуляторных элементов, необходимых для экспрессии данной нуклеотидной последовательности в клетке-хозяине; а также путем создания клетки-хозяина, включающей экспрессирующий вектор, описанный в настоящей заявке, обеспечивающей эффективную продукцию такого слитого белка с использованием вышеуказанной молекулы нуклеиновой кислоты. В некоторых вариантах воплощения изобретения в качестве таких клеток выступают клетки млекопитающих (в некоторых частных вариантах воплощения изобретения – клетки яичников китайских хомячков (CHO)).
Решение поставленной задачи также достигается при применении вышеуказанного слитого белка для лечения широкого спектра ишемических состояний (в частности ишемии нижних конечностей), сердечно-сосудистых заболеваний, онкологических заболеваний, лечения сосудистых осложнений инфекционных заболеваний, включая COVID-19.
Также решение поставленной задачи достигается при осуществлении способа лечения широкого спектра ишемических состояний (в частности ишемии нижних конечностей), сердечно-сосудистых заболеваний, онкологических заболеваний, лечения сосудистых осложнений инфекционных заболеваний, включая COVID-19, включающего введение пациенту слитого белка по изобретению. Согласно изобретению, такой белок вводят пациенту в терапевтически эффективном количестве предпочтительно в составе фармацевтической композиции.
При осуществлении изобретения достигаются следующие технические результаты:
- созданы новые варианты терапевтического агента на основе слитого (гибридного) белка hDll4-hFc, содержащего функциональные домены DSL и EGF-подобных повторов (от пяти до восьми) белка Dll4, слитые с константной частью (Fc-доменом) иммуноглобулина человека IgG4, и способного селективно блокировать Notch-сигналинг, а также разработаны нуклеотидные последовательности, кодирующие такие слитые белки и являющиеся экспрессионной основой для их получения;
- разработанные гибридные конструкции обладают только минимальной эффекторной функцией антитело-зависимой клеточной цитотоксичности и не обладает комплемент-зависимой цитотоксичностью, что снижает возможный риск воспалительных реакций и сенсибилизацию при использовании терапевтического агента на основе слитого (гибридного) белка hDll4-hFc;
- разработанные гибридные конструкции включают минимальный фрагмент белка Dll4 человека (DSL-домен и, минимально, первые 5 доменов EGF-подобных повторов), необходимый и достаточный для взаимодействия с Notch-рецепторами;
- разработанные гибридные конструкции не включают MNNL-домен белка Dll4 человека, принимающего участие в активации передачи Notch-сигнала;
- разработанные гибридные конструкции имеют относительно небольшую молекулярную массу, что повышает эффективность продукции этих молекул в клетках млекопитающих и улучшает их свойства, связанные со скоростью и эффективностью проникновения в ткани;
- разработанные гибридные конструкции, за счет отсутствия в конструкции MNNL-домена, обладают пониженной способностью к агрегации и улучшенной растворимостью;
- связывание разработанных гибридных конструкций с Notch-рецепторами не приводит к их активации, за счет отсутствия в конструкции MNNL-домена, в результате чего такое связывание обеспечивает эффективное блокирование Notch-сигналинга.
Краткое описание чертежей
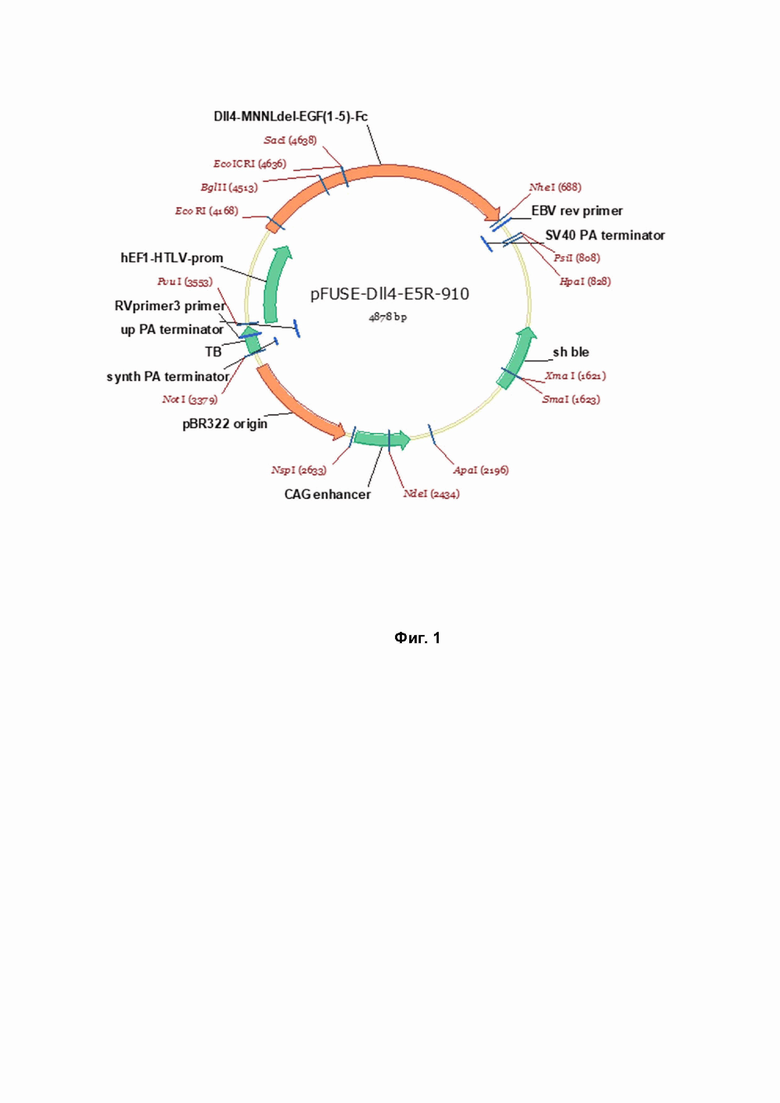
Фиг.1. Схема экспрессирующего вектора, содержащего нуклеотидную последовательность, кодирующую слитый белок, имеющий аминокислотную последовательность SEQ ID NO: 2.
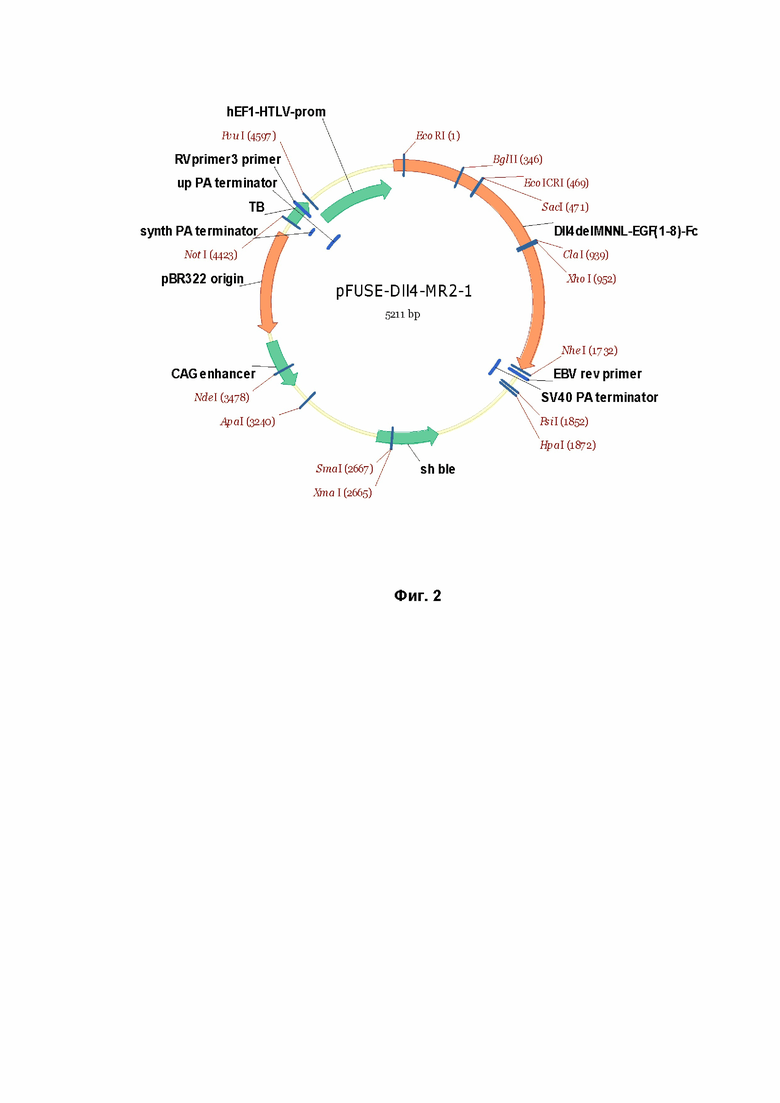
Фиг.2. Схема экспрессирующего вектора, содержащего нуклеотидную последовательность, кодирующую слитый белок, имеющий аминокислотную последовательность SEQ ID NO: 4.
Определения и термины
Следующие термины и определения применяются в данном документе, если иное не указано явно. Ссылки на методики, используемые при описании данного изобретения, относятся к хорошо известным методам, включая изменения этих методов и замену их эквивалентными методами, известными специалистам.
В документах данного изобретения термины «включает», «включающий» и т.п., а также «содержит», «содержащий» и т.п. интерпретируются как означающие «включает, помимо всего прочего» (или «содержит, помимо всего прочего»). Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Термины «полипептид», «белок» и «пептид» используют в настоящем документе взаимозаменяемо, и все они означают полимер из аминокислотных остатков. Эти термины также могут использоваться в настоящем описании взаимозаменяемо при обозначении конечного продукта, получаемого в результате экспрессии в клетке-хозяине последовательности нуклеиновой кислоты.
Под «слитым белком» («гибридным белком», «рекомбинантным белком», «слитым полипептидом», «рекомбинантным полипептидом», «гибридной конструкцией») понимают конструкцию из двух или более частей полипептидной природы, ковалентно связанных между собой, образующейся в результате экспрессии рекомбинантной молекулы ДНК, в которой соединены друг с другом в одной рамке считывания кодирующие участки, соответственно, двух или нескольких разных генов или их фрагментов.
Термин «изолированный» («выделенный») имеет свое общепринятое значение, известное среднему специалисту в данной области техники, и при использовании в отношении выделенной нуклеиновой кислоты или выделенного полипептида используется без ограничения для обозначения нуклеиновой кислоты или полипептида, которые, благодаря человеку, существуют отдельно от своего нативного окружения и поэтому не являются продуктом природы. Выделенная нуклеиновая кислота или полипептид могут существовать в очищенной форме или могут существовать в ненативном окружении, в таком как, например, клетка-хозяин.
Термин «синонимичная замена» относится к нуклеотидной последовательности, имеющей последовательность нуклеотидов, которая может отличаться от референсной последовательности нуклеиновой кислоты на одну или более замен, которые не ведут к изменению аминокислотной последовательности белка, кодируемой данной молекулой нуклеиновой кислоты. В связи с тем, что генетический код является «вырожденным», то есть различные по нуклеотидной последовательности триплеты могут кодировать одну и ту же аминокислоту, синонимичные замены в нуклеотидной последовательности не приводят к изменению аминокислотной последовательности белка.
Термин «лиганд-ловушка» (от англ. Decoyligand, также трап) относится к гибридным белкам, состоящим из внеклеточного домена лиганда молекулы-мишени (рецептора) и Fc-домена иммуноглобулина. Внеклеточный домен лиганда отвечает за связывание мишени, а Fc-домен осуществляет димеризацию гибридного белка. Последнее необходимо для увеличения эффективности связывания и обеспечения большей стабильности высокомолекулярного комплекса. В рамках настоящего изобретения «лиганд -ловушка» состоит из определенных фрагментов растворимого внеклеточного фрагмента человеческого белка Dll4 (DSL-домен и, минимально, первые 5 доменов EGF-подобных повторов), и константной части тяжелой цепи IgG4 человека.
Термин «лечение» означает излечение, замедление, остановку, либо реверсию прогрессирования заболевания или нарушения. В настоящем документе «лечение» также означает смягчение симптомов, ассоциированных с заболеванием или нарушением.
Под «терапевтически эффективным количеством (терапевтической дозой)» подразумевается количество лекарственного средства, вводимого пациенту, при котором у него с наибольшей вероятностью проявится ожидаемый терапевтический эффект. Точное требуемое количество может меняться от субъекта к субъекту в зависимости от многочисленных факторов, таких как тяжесть заболевания, возраст, масса тела, общее состояние организма, комбинированное лечение с другими препаратами и др. Введение лекарственного средства по изобретению субъекту, нуждающемуся в лечении и/или профилактике заболевания или состояния, осуществляется в дозе, достаточной для достижения терапевтического эффекта. При проведении лечения и/или профилактики введение может осуществляться как разово, так и несколько раз в день, чаще в виде курсового введения на протяжении времени, достаточного для достижения терапевтического эффекта (от нескольких дней до недели, нескольких недель и до месяцев), при этом курсы введения лекарственного средства могут проводиться повторно. В частности, при среднетяжелых формах заболевания разовая доза, кратность и/или длительность введения лекарственного средства по изобретению могут быть увеличены. Предпочтительно слитый белок по изобретению вводят пациенту в составе фармацевтической композиции, включающей, помимо активного компонента, фармацевтически приемлемые носители и/или наполнители.
Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
Подробное описание изобретения
В настоящем изобретении предлагаются конструкции ДНК, кодирующие слитые белки (рекомбинантные полипептиды) hDll4-hFc– антагонисты Dll4, блокирующие сигнальный путь Notch, но обладающие сравнительно небольшими размерами по сравнению с лигандами-ловушками, использующими полноразмерный эктодомен белка человека Dll4, что обеспечивает их улучшенные свойства, касающиеся скорости и эффективности проникновения в ткани, продукции белка в клетках млекопитающих, а также отсутствия активации передачи Notch-сигнала при связывании.
В частности, изобретение относится к нуклеотидным конструкциям, кодирующим полипептиды, содержащие функциональные домены DSL и EGF-подобных повторов (от пяти до восьми) белка Dll4, слитые с константной частью (Fc-доменом) иммуноглобулина человека IgG4, hDll4-hFc.
Естественная последовательность белка Dll4 человека состоит из 685 аминокислот (ак) (SEQ ID NO: 1). В состав белка входит сигнальный пептид (1—26 ак SEQ ID NO: 1), трансмембранный домен (530—550 ак SEQ ID NO: 1), домен Delta/Serrate/Lag-2 (DSL, 173—217 ак SEQ ID NO: 1) и восемь тандемных повторов, подобных эпидермальному фактору роста (домены EGF-подобных повторов) (218—251, 252—282, 284—322, 324—360, 362—400, 402—438, 440—476, 480—518 ак SEQ ID NO: 1). В составе белка выделяется экстраклеточная часть (27-529 ак SEQ ID NO: 1) и цитоплазматическая часть (551-685 ак SEQ ID NO: 1), при этом N-терминальный конец Dll4 (27-172 ак SEQ ID NO: 1) формирует отдельный функциональный домен MNNL.В уровне технике известны работы различных авторов по изучению структуры и роли различных доменов белка Dll4 во взаимодействии с рецепторами Notch и передачи сигналов (см., например, Luca et al. Structural basis for Notch1 engagement of Delta-like 4 // Science, 2015, Vol 347, Issue 6224,pp. 847-853 doi: 10.1126/science.1261093; Hirano et al. Delta-like 1 and Delta-like 4 differently require their extracellular domains for triggering Notch signaling in mice // Elife 2020; 9: e50979. Publishedonline 2020 Jan 16 doi: 10.7554/eLife.50979), однако на настоящий момент все тонкости и особенности Notch-сигналинга до конца еще не изучены.
В рамках настоящего изобретения в процессе разработки новых высокоэффективных полипептидных препаратов – антагонистов Dll4 было сделано предположение, что отсутствие в гибридном полипептиде MNNL-домена позволит обеспечить блокирование Notch-сигналинга. В соответствии с поставленной задачей были созданы нуклеотидные последовательности, кодирующие терапевтические молекулы, обладающие свойствами селективно блокировать передачу Notch-сигнала, которые представляют собой гибридные полипептиды-антагонисты Dll4 (hDll4-hFc). Данные белковые молекулы включают в себя функциональные домены DSL и EGF-подобных повторов (по меньшей мере, первые пять доменов) белка Dll4, слитые с константной частью (Fc-фрагментом) человеческого IgG4. Блокировка передачи Notch-сигнала при взаимодействии с рецептором Notch достигается за счет отсутствия в терапевтической молекуле MNNL-домена, который участвует в передаче сигнала. Такая конструкция обуславливает, с одной стороны, антагонистические свойства молекулы по изобретению, а с другой -уменьшенный размер молекулы. Размер молекулы по изобретению также может быть дополнительно уменьшен при уменьшении количества доменов EGF-подобных повторов (как показали проведенные эксперименты, антагонистические свойства молекулы сохраняются при включении от 5 до 8 доменов EGF). Согласно изобретению, функциональные домены белка Dll4 могут быть слиты с константной частью тяжелой цепи IgG4 человека как непосредственно (т.е. безлинкерно), так и посредством линкерной последовательности. Слитый белок hDll4-hFc по изобретению также может необязательно содержать сигнальную последовательность, которая может включать любую последовательность, известную квалифицированному специалисту в области управления секрецией полипептида или белка из клетки, и включать природные или синтетические последовательности. Обычно сигнальная последовательность размещается на N-конце слитого белка по настоящему изобретению.
В частных вариантах осуществления изобретения рекомбинантные полипептиды по изобретению включают в себя DSL-домен Dll4 и EGF(1-5)-домены белка Dll4 или DSL-домен Dll4 и EGF(1-8)-домены белка Dll4 и представляют собой растворимые рекомбинантные лиганды-ловушки (трапы) – антагонисты Dll4. Такие молекулы ингибируют путь передачи сигнала Notch, специфически связываясь с рецепторами Notch1 и Notch4. При этом не происходит активации Notch-пути, вместо этого молекулы hDll4-hFc препятствуют связыванию рецепторов Notch с эндогенными полноразмерными активирующими лигандами. Сигнальные пути Notch1 и Notch4 вовлечены в контроль роста кровеносных сосудов, а их ингибирование за счет действия hDll4-hFc приводит к активации роста новых сосудов (терапевтическому ангиогенезу) в ишемических тканях и улучшает раневое заживление. Специфическое ингибирование сигнальных путей Notch за счет использования антагонистов Dll4 может использоваться для лечения широкого спектра сердечно-сосудистых заболеваний, онкологических заболеваний, а также для лечения сосудистых осложнений инфекционных заболеваний, включая COVID-19.
Изобретение позволяет получить полипептиды с высокой аффинностью к Notch-рецепторам человека, но с уменьшенной молекулярной массой по сравнению с природными белками Dll4, а также по сравнению с молекулами Dll4-Fc, описанными ранее. Уменьшение размеров рекомбинантных полипептидов позволяет увеличить скорость их проникновения в ткани организма, уменьшить необходимые дозы вводимого пациентам препарата (фармацевтической композиции) на их основе и уменьшить затраты на синтез описанных рекомбинантных полипептидов.
Препараты на основе описанных рекомбинантных полипептидов могут быть использованы для лечения ишемических заболеваний различных органов и тканей. Ишемия — уменьшение кровоснабжения участка тела, органа или ткани вследствие ослабления или прекращения притока к нему артериальной крови. Ишемия может быть обусловлена различными факторами и возникает при несоответствии объема кровотока потребностям органа. Существует ряд терапевтических подходов к решению проблем восстановления кровотока и лечения ишемических повреждений различных тканей, одним из которых является терапевтический ангиогенез — индуцированное медицинскими препаратами формирование новых функционирующих сосудов на основе уже существующих.
Описанные конструкции ДНК позволяют получать молекулы hDll4-hFc, которые обладают малой молекулярной массой и высокой биодоступностью и могут быть использованы для стимулирования терапевтического ангиогенеза, лечения широкого спектра ишемических состояний (в частности ишемии нижних конечностей), сердечно-сосудистых заболеваний, онкологических заболеваний, лечения сосудистых осложнений инфекционных заболеваний, включая COVID-19, и других заболеваний, связанных с патологической активностью Notch рецепторов или в тех случаях, когда целесообразно модулирование работы сигнального пути Dll4-Notch.
Слитые белки (рекомбинантные полипептиды), являющиеся объектом настоящего изобретения, могут быть получены следующим образом.
Растворимые рекомбинантные полипептиды-антагонисты Dll4 производят в результате экспрессии кодирующих их нуклеотидных последовательностей в эукариотических клеточных линиях, с последующей очисткой синтезированных рекомбинантных белков при помощи аффинной, ионобменной или гидрофобной хроматографии, применяемых по отдельности или в различных сочетаниях друг с другом, а также при помощи иных способов очистки белков. Соответствующие нуклеотидные последовательности получают при помощи комбинирования участков ДНК, кодирующих выбранные домены Dll4, с последовательностью ДНК, кодирующей Fc-фрагмент IgG4 человека. В некоторых частных вариантах изобретения молекулы нуклеиновой кислоты, кодирующие такие полипептиды-антагонисты Dll4, имеют нуклеотидную последовательность, соответствующую SEQ ID NO: 3 или SEQ ID NO: 5.
Также указанная задача решается путем создания экспрессирующего вектора, содержащего данную молекулу нуклеиновой кислоты под контролем регуляторных элементов, необходимых для экспрессии данной нуклеиновой кислоты в клетке-хозяине. В предпочтительных вариантах изобретения в качестве клетки-хозяина, включающей такой экспрессирующий вектор, могут выступать клетки яичников китайских хомячков CHO (например, клеточные линии CHO-К1 или CHO DG44), адаптированные для производства терапевтических белков. В настоящем изобретении экспрессирующий вектор предпочтительно подбирается для экспрессии гетерологичных последовательностей в клетках млекопитающих, но в некоторых вариантах изобретения экспрессирующий вектор может быть выбран для экспрессии в других системах, таких как, например, клетки насекомых, дрожжевые или бактериальные клетки. Соответственно, каждый экспрессирующий вектор имеет свой набор регуляторных элементов, позволяющих проводить экспрессию гетерологичной последовательности (продукта) в клетке-хозяине, таких как промоторы и/или энхансеры, последовательности Козак, polyA последовательности и другие регуляторные последовательности. А также может иметь последовательности, кодирующие лидерные (сигнальные) пептиды, обеспечивающие секрецию рекомбинантных полипептидов во внеклеточную среду. Терминация синтеза белка с заданной изолированной последовательности нуклеиновой кислоты определяется добавлением к ней с 3’-конца в одной рамке считывания одного или нескольких стоп-кодонов.
После трансфекции вектора в клетки эукариотической клеточной линии происходит синтез рекомбинантного полипептида и его секреция в культуральную бессывороточную среду. Полученный рекомбинантный полипептид очищают из среды при помощи, как правило, аффинной хроматографии на белок протеин-A или белок протеин-G, однако могут использоваться и другие методы очистки белков.
Единство данного изобретения достигается за счет использования во всех конструкциях общей минимальной последовательности Dll4, осуществляющей взаимодействие с Notch-рецепторами. Данная последовательность представлена аминокислотами 21-254 в SEQ ID NO: 2 и в SEQ ID NO: 4, и соответствует последовательности SEQ ID NO: 6 и аминокислотам 171-404 в SEQ ID NO: 1. Она включает DSL и домены EGF(1-5)-подобных повторов белка человека Dll4, которые необходимы и достаточны для взаимодействия с рецепторами Notch1 и Notch4. При этом они не содержат MNNL-домена Dll4, который участвует в активации передачи Notch-сигнала.
В настоящем изобретении антагонист Dll4 содержит аминокислоты 171-404 белка Dll4. Данный регион не включает участок 27-172, соответствующий MNNL-домену (в отличие, в том числе, от полипептидов, известных из патента EP2054082B1), за счет чего молекулы по изобретению не могут приводить к активации рецепторов Notch. Кроме того, делеция MNNL-домена снижает агрегацию белка и улучшает его растворимость, что приводит к повышению продукции белка по сравнению со слитыми полипептидами, в которых используется полноразмерный экстраклеточный домен Dll4.Таким образом, настоящее изобретение является уникальным и представляет собой новый тип молекул, которые не были описаны ранее.
Сущность технического решения заключается в создании нуклеотидных последовательностей (в частных вариантах, SEQ ID NО: 3 и SEQ ID NО: 5), которые кодируют соответствующие гибридные белки с последовательностями (в частных вариантах, соответственно, SEQ ID NО: 2 и SEQ ID NО: 4), включающими две основные функциональные части. Первая из которых соответствует части внеклеточного домена человеческого Dll4, и в представленных частных вариантах воплощения изобретения соответствует аминокислотам 21-254 для SEQ ID NО: 2 и аминокислотам 21-365 для SEQ ID NО: 4. Общая последовательность Dll4, объединяющая эти конструкции, соответствует последовательности SEQ ID NО: 6. Вторая функциональная часть кодирует константную часть тяжёлой цепи человеческого IgG4 (SEQ ID NО: 7) и в представленных частных вариантах воплощения изобретения соответствует аминокислотам 257-482 для SEQ ID NО: 2 и аминокислотам 368-593 для SEQ ID NО: 4.
Кодирующие нуклеотидные последовательности (в том числе SEQ ID NО: 3 и SEQ ID NО: 5) могут быть изменены для оптимизации уровня экспрессии в клетках определенного типа. При использовании гетерологичных систем экспрессии (например, клетки насекомых, бактериальные или дрожжевые клетки) может потребоваться оптимизация кодонов в последовательности (замена редко используемых в организме кодонов на часто используемые). Это можно сделать с помощью алгоритмов, реализованных во многих имеющихся алгоритмах для проектирования последовательностей, например, Codon optimizer, Gene Designer, или OPTIMIZER. Для промышленного производства слитых белков, последовательности, соответствующие SEQ ID NО: 3 и SEQ ID NО: 5, могут быть переклонированы в любой другой вектор, позволяющий осуществлять наработку и секрецию целевых полипептидов в культуральную жидкость, с целью последующей очистки продуктов. В частности, в качестве такого вектора может быть выбран вектор Freedom pCHO 1.0 (ThermoFisher).
Экспрессия гибридной конструкции в клетках млекопитающих возможна при помощи создания стабильных клонов-продуцентов после трансфекции клеток этой конструкцией. Может быть использована трансфекция электропорацией или с использованием трансфецирующего реагента, такого как Lipofectamine 2000. Данная гибридная конструкция может быть также использована для введения в лентивирусную конструкцию и последующего заражения клеток. Для увеличения выхода гибридного белка в клетках млекопитающих возможно использование различных подходов. Методы оптимизации известны специалистам и описаны, например, в (Almoetal. Better and faster: improvements and optimization for mammalian recombinant protein production // Curr Opin Struct Biol. 2014 Jun;26:39-43).
Предлагаемые продукты являются ранее не создававшейся комбинацией нуклеотидных последовательностей генома человека (и обладают общей последовательностью, соответствующей Fc-фрагменту человеческого IgG4, слитой в одной рамке считывания с фрагментом(-и) последовательности Dll4 человека) и призваны быть экспрессионной основой для производства слитого белка hDll4-hFc, обладающего целым комплексом улучшенных фармакологических свойств, а именно: (1) минимальной эффекторной функцией антитело-зависимой клеточной цитотоксичности (antibody-dependent cellular cytotoxicity - ADCC) и комплемент-зависимой цитотоксичности (complement-dependent cytotoxicity - CDC) благодаря использованию константной части иммуноглобулина человека IgG4-изотипа; (2) относительно небольшой молекулярной массой, что повышает эффективность продукции этих молекул в клетках млекопитающих и улучшает их свойства, связанные со скоростью и эффективностью проникновения в ткани; (3) способности эффективно блокировать Notch-сигналинг за счет наличия функциональных доменов, необходимых для эффективного связывания с Notch-рецепторами;(4) неспособности вызвать активацию Notch-рецепторов (за счет отсутствия в конструкции MNNL-домена), а также (5) пониженной способностью белка к агрегации иего улучшенной растворимостью. После прохождения испытаний по безопасности на животных и клинических испытаний, слитый белок по настоящему изобретению может быть включен в состав фармацевтической композиции для лечения заболеваний сердечно-сосудистой системы, ишемических состояний, воспалительных состояний в сосудах и онкологических заболеваний, стимулирования терапевтического ангиогенеза.
Нижеследующие примеры приведены в целях раскрытия характеристик настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Конструирование плазмид
Для конструирования плазмид с заявляемыми нуклеотидными последовательностями была использована последовательность, кодирующая белок человека Dll4, полученная из плазмиды RG212628 (OriGene, Dll4 (NM_019074) Human Tagged ORF clone).
Фрагменты Dll4 были выбраны на основе биоинформатического анализа последовательности и, соответствующие кодирующие их нуклеотидные последовательности, были использованы для последующего клонирования. Для клонирования участков, соответствующих аминокислотам 21-254 для SEQ ID NO: 2 и аминокислотам 21-365 для SEQ ID NO: 4, были подобраны следующие праймеры:
DLL4DMF: AAgaattcctaccgggtcatctgcagtgacaacta (SEQ ID NO: 8)
DLL4DMDE5R: TAGGATCCGTCCACTTTCTTCTCGCAGTTGGA (SEQ ID NO: 9)
DLL4DMR2: TAGGATCCGCTGCCCACAAAGCCATAAGGGCA (SEQ ID NO: 10).
В праймеры были включены сайты рестрикции для рестриктаз EcoRI (прямой праймер DLL4DMF) и BamHI (обратные праймеры DLL4DMDE5R и DLL4DMR2)
Проведена ПЦР со следующими условиями: 95°С 1 мин, 30 циклов (95°С 10 сек, 63°С 10 сек, 72°С 2 мин), 72°С 5 мин. Компоненты реакции: полимераза – ExTaqTakara (TakaraBio), буфер, содержащий Mg2+ для ExTaq-полимеразы (TakaraBio), по 12 пкмоль каждого из праймеров и 0,25 мM смеси трифосфатов нуклеотидов (TakaraBio). После ПЦР: ПЦР продукт очищали набором для очистки ПЦР продуктов PCRPurificationkitQIAquick (QiaGeneCat.No 28106). Концентрация и соответствие предсказанному молекулярному весу проверяли при помощи гель-электрофореза в 1% агарозе (ТАЕ буфер). Полученные ПЦР продукты были использованы для дальнейшего конструирования.
Для клонирования целевых последовательностей использовался вектор pFUSE-hIgG4-Fc2(InvivoGen), который позволяет получить слитые с Fc-доменом IgG4 последовательности и проводить исследование их свойств. Вектор обрабатывали рестриктазами EcoRI и BglII (Thermo), а ПЦР-продукт обрабатывали рестриктазами EcoRI и BamHI (Thermo) в течение 1 часа при 37°С, очищали с помощью PCRPurificationkitQIAquick (Thermo) и лигировали, используя 1 Ед (ME) лигазы (Thermo) по протоколу производителя. Лигазной смесью трансформировали компетентные клетки E.coliXL10-Gold и высевали на среду LB, содержащую зеоцин.
Чашки инкубировали в термостате в течение ночи при 37°C. На следующий день проверяли по 20 колоний из каждой лигазной смеси на присутствие нужной вставки, для этого часть колонии разводили в 20 мкл воды и кипятили в течение 5 минут. После охлаждения смесь откручивали и использовали 1 мкл в качестве матрицы в реакции ПЦР. Присутствие вставки проверяли после электрофореза ПЦР продуктов. Из двух колоний, содержащих вставку, выделяли плазмидную ДНК и секвенировали на секвенаторе AppliedBiosystems 3500 по инструкции производителя, используя праймеры PROMF2 (прямой) и FC (обратный).
PROMF2: GCCTGACCCTGCTTGCTCAACT(SEQ ID NO: 11)
FC: CTCACGTCCACCACCACGCA(SEQ ID NO: 12)
Сконструированные в результате плазмиды, содержащие целевые нуклеотидные последовательности, показаны на Фиг. 1 и 2.
Пример 2. Продукция рекомбинантных полипептидов
Для трансфекции клеток CHO выделяли особо чистую (“transfectiongrade”) плазмидную ДНК с помощью набора EndoFreePlasmidMaxiKit (Qiagen) по протоколу фирмы-производителя. Линеаризацию обеих конструкций осуществляли по сайту Not1 (Thermo). Для трансфекции добавляли 20 мкг линеаризованного вектора на 100 мкл клеточной суспензии с концентрацией 5х107 клеток/мл. Электропорация проводилась по протоколу: 3 импульса по 1130 В продолжительностью 20 мс. Селекцию начинали через 48 часов после трансфекции путем добавления антибиотика зеоцина в концентрации 500 мкг/мл и продолжали ее при дальнейших пересевах. Среда для культивирования: Dynamis + 6 мМ Glutamax + 0,5% anticlumpingreagentB (Lonza, Швейцария) + 500 мкг/мл зеоцин. Культивирование осуществляли в шейкере-СО2-инкубаторе MultitronCell (Infors, Швейцария) в атмосфере 5%-ного СО2 при температуре 37 °С и относительной влажности 95% в колбах Эрнленмейера (Сorning, США) объемом 125 мл (перемешивание 120 об/мин). Концентрацию целевых полипептидов в культуральной жидкости определяли методом бислойной интерферометрии с использованием биосенсоров ProteinA и системы Оctet К2 (Fortebio, Pall, США) в режиме реального времени. Оценивалось связывание Fc-фрагмента слитых белков с иммобилизованным на сенсоре ProteinA. При культивировании данных пулов в режиме fed-batch была подтверждена продукция слитых полипептидов и их секреция в культуральной жидкости. Уровень продукции слитых белков, соответствующих последовательностям SEQ ID NО: 2 и SEQ ID NО: 4 был значимо больше уровня продукции гибридного белка hDll4-hFc, содержащего полноразмерный экстраклеточный домен Dll4. Наибольший уровень продукции достигался для молекулы, соответствующей SEQ ID NО: 2, что подтверждает вывод о том, что малые размеры молекулы и отсутствие MNNL-домена играют принципиальную роль для продукции белка в клетках CHO. Данный факт имеет принципиальное значение для промышленного производства белка, так как эффективная продукция позволит удешевить стоимость производства лекарственной субстанции.
Пример 3. Оценка функциональной активности полученных рекомбинантных полипептидов
Для оценки функциональной активности полученных рекомбинантных полипептидов hDll4-hFc используются стандартные методы и подходы:
(1) сравнительный анализ связывания рекомбинантного полипептида hDll4-hFc с рецепторами-мишенями Notch1 и Notch4 методом белковой ко-иммунопреципитации;
(2) исследование кинетики связывания рекомбинантного полипептида hDll4-hFc с рецепторами-мишенями Notch1 и Notch4 при помощи анализа изменения угла полного внутреннего отражения за счет эффекта поверхностного плазмонного резонанса;
(3) исследование эффективности подавления Notch-сигналинга в клетках при добавлении рекомбинантного полипептида hDll4-hFc при помощи отПЦР в режиме реального времени, в частности изменения экспрессии генов-мишеней HEY1, HEY2, HES1 и HES5,
(4) исследование ангиогенной активности рекомбинантного полипептида hDll4-hFc в модели эндотелиальных клеток пупочной вены человека (англ. HUVEC – Human umbilical vein endothelial cells).
Ниже приведена подробная методика проводимых экспериментов:
(1) По результатам анализа литературы наиболее вероятными природными мишенями полученного рекомбинантного полипептида hDll4-hFc являются белки Notch1 и Notch4. В рамках изучения биологических свойств hDll4-hFc в качестве мишеней используются рекомбинантные белки человека Notch1 и Notch4, наработанные в суспензионной культуре клеток HEK293 и очищенные методом жидкостной хроматографии высокого давления (HPLC). На первом этапе анализа они конъюгируются с биотином методом активированных эфиров с последующей очисткой на обессоливающих колонках. Полипептид hDll4-hFc нарабатывается в суспензионной культуре клеток CHO и очищается методом жидкостной хроматографии на сефарозе с Protein А. Далее к биотинилированным белкам-мишеням добавляется исследуемый полипептид в молярном соотношении 1:1 в фосфатно-солевом буфере (PBS, 1x, pH=7.4) с добавлением БСА, смесь инкубируют при комнатной температуре. Затем комплексы полипептид-мишень инкубируют с магнитными микросферами DynabeadsM280 (Invitrogen, США) с иммобилизованным на их поверхности стрептавидином, промывают и элюируют в соответствии с протоколом производителя. Далее полученные комплексы очищают, и связанный hDll4-hFc детектируют при помощи Вестерн-блоттинга.
(2) Для оценки кинетики связывания полученного полипептида hDll4-hFc с Notch1 и Notch4 используют метод поверхностного плазмонного резонанса в системе BioRad Proteon XPR36. Для этого полученные ранее биотинилированные рекомбинантные белки Notch1 и Notch4 иммобилизируют на чипе, покрытом стрептавидином, в буфере HBS-EP (pH=7.4). После этого через аналитическую ячейку пропускается буфер HBS-EP, содержащий варьирующие концентрации hDll4-hFc. При пропускании раствора происходит ассоциация полипептида hDll4-hFc с белками-мишенями. Далее оценивается диссоциация полипептида и мишени. Раствор свободного биотина используется для блокировки незанятых стрептавидиновых сайтов в ячейках с Notch1, Notch4 и в контроле. Анализ данных осуществляют в соответствии с протоколом производителя.
(3) Оценку экспрессии генов HEY1, HEY2, HES1 и HES5 проводят на модели первичной линии HUVEC. Для этого очищенный как описано в методике (1) полипептид hDll4-hFc добавляют к суспензии клеток HUVEC и инкубируют при 37ºС в CO2-инкубаторе. В качестве контроля используют клетки HUVEC без добавления белка (буферный раствор). Далее клетки осаждают на центрифуге, и из них выделяют тотальную РНК. Концентрацию полученной РНК измеряют с помощью флуориметра Qubit 2.0 (Invitrogen, США). Удаление ДНК осуществляют с помощью TurboDNA free набора (Invitrogen). Затем проводят реакцию обратной транскрипции, для чего отбирают одинаковое количество РНК из различных образцов (опыт и контроль). Для обратной транскрипции используют Superscript III (Invitrogen) и случайные гексамеры в качестве затравки. После этого проводят ПЦР в режиме реального времени на амплификаторе CFX96 Bio-Rad с использованием смеси SsoFastEvaGreensupermix (Bio-Rad). Последовательности праймеров для амплификации представлены ниже:
HES1 - F: AAGAAAGATAGCTCGCGGCA(SEQ ID NO: 13)
HES1 - R: TACTTCCCCAGCACACTTGG(SEQ ID NO: 14)
HES5 - F: GATTCCTCTGTGTGGGTGGATG(SEQ ID NO: 15)
HES5 -R: GATTTTATTATGGCGGCTTCGG(SEQ ID NO: 16)
HEY1 - F: CCTTCCCCTTCTCTTTCGGC(SEQ ID NO: 17)
HEY1 -R: AAAAGCTCCGATCTCCGTCC(SEQ ID NO: 18)
HEY2 - F: AAGGCGTCGGGATCGGATAA(SEQ ID NO: 19)
HEY2 -R: AGAGCGTGTGCGTCAAAGTAG(SEQ ID NO: 20)
GAPDH - F: CCATCACCATCTTCCAGGAG(SEQ ID NO: 21)
GAPDH -R: AATGAGCCCCAGCCTTCTCC(SEQ ID NO: 22).
(4) Для оценки ангиогенной активности полученного рекомбинантного белка-трапа hDll4-hFc используют стандартную методику на основе культивирования первичных эндотелиальных клеток пупочной вены человека HUVEC в трехмерном матриксе. Для этого первичные эндотелиальные клетки изолируют из пупочной вены новорожденных, а затем культивируют в обогащенной среде M199 с добавлением 20% эмбриональной телячьей сыворотки и коктейля антибиотиков (пенициллина и стрептомицина) в культуральных флаконах. При достижении клетками 70-80% конфлюэнтности культуру пассируют по стандартной методике до 2-го пассажа. За два часа до переноса клеток в трехмерный матрикс (матригель), они переводятся на обедненную среду EBM-2 с добавлением 0,2% эмбриональной телячьей сыворотки.
Далее суспензия клеток HUVEC в концентрации 5x108 клеток/мл смешивается с эквивалентным объемом матригеля. После этого 50 мкл смеси наносят по центру лунки в 24-луночные планшеты. Исследуемый рекомбинантный белок hDll4-hFc в варьирующих концентрациях добавляют к клеткам в 1 мл среды EBM-2 спустя час после нанесения и инкубации при 37ºС. Каждый эксперимент проводится в трех повторах. В качестве контроля используют клетки без добавления рекомбинантного белка. Затем клетки инкубируют в течение 72 часов в CO2-инкубаторе и фиксируют 4% формалином в PBS.
Анализ формирования первичных сосудов (эндотелиальных трубочек) проводится методом конфокальной микроскопии. После фиксации капель матригеля проводится их пермеабилизация 0,5% раствором детергента Triton X-100. Далее проводится окрашивание клеток мембранным красителем BDP 505/515 и ядерным красителем DAPI на микроскопе Leica TCS SP5 (Leica, Германия). Характеризация первичных сосудов проводится при помощи программного обеспечения.
Рекомбинантные полипептиды hDll4-hFc обладают высокой селективностью связывания с рецепторами-мишенями Notch1 и Notch4, не приводя к их активации, в результате чего такое связывание обеспечивает эффективное блокирование Notch-сигналинга, проявляющееся, в частности, в активации роста новых сосудов (ангиогенной активности) в ишемических тканях.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
--->
Перечень последовательностей
<110> Общество с ограниченной ответственностью "Пальмира Биофарма" /
"PALMIRA BIOPHARMA" Limited Liability Company
<120> НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, КОДИРУЮЩАЯ СЛИТЫЙ БЕЛОК, СОСТОЯЩИЙ
ИЗ РАСТВОРИМОГО ВНЕКЛЕТОЧНОГО ФРАГМЕНТА ЧЕЛОВЕЧЕСКОГО Dll4 И КОНСТАНТНОЙ
ЧАСТИ ТЯЖЕЛОЙ ЦЕПИ ЧЕЛОВЕЧЕСКОГО IgG4
<130> 455032
<160> 22
<170> BiSSAP 1.3.6
<210> 1
<211> 685
<212> PRT
<213> Homo sapiens
<400> 1
Met Ala Ala Ala Ser Arg Ser Ala Ser Gly Trp Ala Leu Leu Leu Leu
1 5 10 15
Val Ala Leu Trp Gln Gln Arg Ala Ala Gly Ser Gly Val Phe Gln Leu
20 25 30
Gln Leu Gln Glu Phe Ile Asn Glu Arg Gly Val Leu Ala Ser Gly Arg
35 40 45
Pro Cys Glu Pro Gly Cys Arg Thr Phe Phe Arg Val Cys Leu Lys His
50 55 60
Phe Gln Ala Val Val Ser Pro Gly Pro Cys Thr Phe Gly Thr Val Ser
65 70 75 80
Thr Pro Val Leu Gly Thr Asn Ser Phe Ala Val Arg Asp Asp Ser Ser
85 90 95
Gly Gly Gly Arg Asn Pro Leu Gln Leu Pro Phe Asn Phe Thr Trp Pro
100 105 110
Gly Thr Phe Ser Leu Ile Ile Glu Ala Trp His Ala Pro Gly Asp Asp
115 120 125
Leu Arg Pro Glu Ala Leu Pro Pro Asp Ala Leu Ile Ser Lys Ile Ala
130 135 140
Ile Gln Gly Ser Leu Ala Val Gly Gln Asn Trp Leu Leu Asp Glu Gln
145 150 155 160
Thr Ser Thr Leu Thr Arg Leu Arg Tyr Ser Tyr Arg Val Ile Cys Ser
165 170 175
Asp Asn Tyr Tyr Gly Asp Asn Cys Ser Arg Leu Cys Lys Lys Arg Asn
180 185 190
Asp His Phe Gly His Tyr Val Cys Gln Pro Asp Gly Asn Leu Ser Cys
195 200 205
Leu Pro Gly Trp Thr Gly Glu Tyr Cys Gln Gln Pro Ile Cys Leu Ser
210 215 220
Gly Cys His Glu Gln Asn Gly Tyr Cys Ser Lys Pro Ala Glu Cys Leu
225 230 235 240
Cys Arg Pro Gly Trp Gln Gly Arg Leu Cys Asn Glu Cys Ile Pro His
245 250 255
Asn Gly Cys Arg His Gly Thr Cys Ser Thr Pro Trp Gln Cys Thr Cys
260 265 270
Asp Glu Gly Trp Gly Gly Leu Phe Cys Asp Gln Asp Leu Asn Tyr Cys
275 280 285
Thr His His Ser Pro Cys Lys Asn Gly Ala Thr Cys Ser Asn Ser Gly
290 295 300
Gln Arg Ser Tyr Thr Cys Thr Cys Arg Pro Gly Tyr Thr Gly Val Asp
305 310 315 320
Cys Glu Leu Glu Leu Ser Glu Cys Asp Ser Asn Pro Cys Arg Asn Gly
325 330 335
Gly Ser Cys Lys Asp Gln Glu Asp Gly Tyr His Cys Leu Cys Pro Pro
340 345 350
Gly Tyr Tyr Gly Leu His Cys Glu His Ser Thr Leu Ser Cys Ala Asp
355 360 365
Ser Pro Cys Phe Asn Gly Gly Ser Cys Arg Glu Arg Asn Gln Gly Ala
370 375 380
Asn Tyr Ala Cys Glu Cys Pro Pro Asn Phe Thr Gly Ser Asn Cys Glu
385 390 395 400
Lys Lys Val Asp Arg Cys Thr Ser Asn Pro Cys Ala Asn Gly Gly Gln
405 410 415
Cys Leu Asn Arg Gly Pro Ser Arg Met Cys Arg Cys Arg Pro Gly Phe
420 425 430
Thr Gly Thr Tyr Cys Glu Leu His Val Ser Asp Cys Ala Arg Asn Pro
435 440 445
Cys Ala His Gly Gly Thr Cys His Asp Leu Glu Asn Gly Leu Met Cys
450 455 460
Thr Cys Pro Ala Gly Phe Ser Gly Arg Arg Cys Glu Val Arg Thr Ser
465 470 475 480
Ile Asp Ala Cys Ala Ser Ser Pro Cys Phe Asn Arg Ala Thr Cys Tyr
485 490 495
Thr Asp Leu Ser Thr Asp Thr Phe Val Cys Asn Cys Pro Tyr Gly Phe
500 505 510
Val Gly Ser Arg Cys Glu Phe Pro Val Gly Leu Pro Pro Ser Phe Pro
515 520 525
Trp Val Ala Val Ser Leu Gly Val Gly Leu Ala Val Leu Leu Val Leu
530 535 540
Leu Gly Met Val Ala Val Ala Val Arg Gln Leu Arg Leu Arg Arg Pro
545 550 555 560
Asp Asp Gly Ser Arg Glu Ala Met Asn Asn Leu Ser Asp Phe Gln Lys
565 570 575
Asp Asn Leu Ile Pro Ala Ala Gln Leu Lys Asn Thr Asn Gln Lys Lys
580 585 590
Glu Leu Glu Val Asp Cys Gly Leu Asp Lys Ser Asn Cys Gly Lys Gln
595 600 605
Gln Asn His Thr Leu Asp Tyr Asn Leu Ala Pro Gly Pro Leu Gly Arg
610 615 620
Gly Thr Met Pro Gly Lys Phe Pro His Ser Asp Lys Ser Leu Gly Glu
625 630 635 640
Lys Ala Pro Leu Arg Leu His Ser Glu Lys Pro Glu Cys Arg Ile Ser
645 650 655
Ala Ile Cys Ser Pro Arg Asp Ser Met Tyr Gln Ser Val Cys Leu Ile
660 665 670
Ser Glu Glu Arg Asn Glu Cys Val Ile Ala Thr Glu Val
675 680 685
<210> 2
<211> 482
<212> PRT
<213> искусственная последовательность
<220>
<223> гибридный белок
<400> 2
Met Tyr Arg Met Gln Leu Leu Ser Cys Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser Tyr Arg Val Ile Cys Ser Asp Asn Tyr Tyr Gly Asp
20 25 30
Asn Cys Ser Arg Leu Cys Lys Lys Arg Asn Asp His Phe Gly His Tyr
35 40 45
Val Cys Gln Pro Asp Gly Asn Leu Ser Cys Leu Pro Gly Trp Thr Gly
50 55 60
Glu Tyr Cys Gln Gln Pro Ile Cys Leu Ser Gly Cys His Glu Gln Asn
65 70 75 80
Gly Tyr Cys Ser Lys Pro Ala Glu Cys Leu Cys Arg Pro Gly Trp Gln
85 90 95
Gly Arg Leu Cys Asn Glu Cys Ile Pro His Asn Gly Cys Arg His Gly
100 105 110
Thr Cys Ser Thr Pro Trp Gln Cys Thr Cys Asp Glu Gly Trp Gly Gly
115 120 125
Leu Phe Cys Asp Gln Asp Leu Asn Tyr Cys Thr His His Ser Pro Cys
130 135 140
Lys Asn Gly Ala Thr Cys Ser Asn Ser Gly Gln Arg Ser Tyr Thr Cys
145 150 155 160
Thr Cys Arg Pro Gly Tyr Thr Gly Val Asp Cys Glu Leu Glu Leu Ser
165 170 175
Glu Cys Asp Ser Asn Pro Cys Arg Asn Gly Gly Ser Cys Lys Asp Gln
180 185 190
Glu Asp Gly Tyr His Cys Leu Cys Pro Pro Gly Tyr Tyr Gly Leu His
195 200 205
Cys Glu His Ser Thr Leu Ser Cys Ala Asp Ser Pro Cys Phe Asn Gly
210 215 220
Gly Ser Cys Arg Glu Arg Asn Gln Gly Ala Asn Tyr Ala Cys Glu Cys
225 230 235 240
Pro Pro Asn Phe Thr Gly Ser Asn Cys Glu Lys Lys Val Asp Gly Ser
245 250 255
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
260 265 270
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
275 280 285
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
290 295 300
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
305 310 315 320
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
325 330 335
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
340 345 350
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
355 360 365
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
370 375 380
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
385 390 395 400
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
405 410 415
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
420 425 430
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
435 440 445
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
450 455 460
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
465 470 475 480
Gly Lys
<210> 3
<211> 1446
<212> DNA
<213> искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая гибридный белок
<400> 3
atgtacagga tgcaactcct gtcttgcatt gcactaagtc ttgcacttgt cacgaattcc 60
taccgggtca tctgcagtga caactactat ggagacaact gctcccgcct gtgcaagaag 120
cgcaatgacc acttcggcca ctatgtgtgc cagccagatg gcaacttgtc ctgcctgccc 180
ggttggactg gggaatattg ccaacagcct atctgtcttt cgggctgtca tgaacagaat 240
ggctactgca gcaagccagc agagtgcctc tgccgcccag gctggcaggg ccggctgtgt 300
aacgaatgca tcccccacaa tggctgtcgc cacggcacct gcagcactcc ctggcaatgt 360
acttgtgatg agggctgggg aggcctgttt tgtgaccaag atctcaacta ctgcacccac 420
cactccccat gcaagaatgg ggcaacgtgc tccaacagtg ggcagcgaag ctacacctgc 480
acctgtcgcc caggctacac tggtgtggac tgtgagctgg agctcagcga gtgtgacagc 540
aacccctgtc gcaatggagg cagctgtaag gaccaggagg atggctacca ctgcctgtgt 600
cctccgggct actatggcct gcattgtgaa cacagcacct tgagctgcgc cgactccccc 660
tgcttcaatg ggggctcctg ccgggagcgc aaccaggggg ccaactatgc ttgtgaatgt 720
ccccccaact tcaccggctc caactgcgag aagaaagtgg acggatctta tggtccccca 780
tgcccaccat gcccagcacc tgagttcctg gggggaccat cagtcttcct gttcccccca 840
aaacccaagg acactctcat gatctcccgg acccctgagg tcacgtgcgt ggtggtggac 900
gtgagccagg aagaccccga ggtccagttc aactggtacg tggatggcgt ggaggtgcat 960
aatgccaaga caaagccgcg ggaggagcag ttcaacagca cgtaccgtgt ggtcagcgtc 1020
ctcaccgtcc tgcaccagga ctggctgaac ggcaaggagt acaagtgcaa ggtctccaac 1080
aaaggcctcc cgtcctccat cgagaaaacc atctccaaag ccaaagggca gccccgagag 1140
ccacaggtgt acaccctgcc cccatcccag gaggagatga ccaagaacca ggtcagcctg 1200
acctgcctgg tcaaaggctt ctaccccagc gacatcgccg tggagtggga gagcaatggg 1260
cagccggaga acaactacaa gaccacgcct cccgtgctgg actccgacgg ctccttcttc 1320
ctctacagca ggctaaccgt ggacaagagc aggtggcagg aggggaatgt cttctcatgc 1380
tccgtgatgc atgaggctct gcacaaccac tacacacaga agagcctctc cctgtctccg 1440
ggtaaa 1446
<210> 4
<211> 593
<212> PRT
<213> искусственная последовательность
<220>
<223> гибридный белок
<400> 4
Met Tyr Arg Met Gln Leu Leu Ser Cys Ile Ala Leu Ser Leu Ala Leu
1 5 10 15
Val Thr Asn Ser Tyr Arg Val Ile Cys Ser Asp Asn Tyr Tyr Gly Asp
20 25 30
Asn Cys Ser Arg Leu Cys Lys Lys Arg Asn Asp His Phe Gly His Tyr
35 40 45
Val Cys Gln Pro Asp Gly Asn Leu Ser Cys Leu Pro Gly Trp Thr Gly
50 55 60
Glu Tyr Cys Gln Gln Pro Ile Cys Leu Ser Gly Cys His Glu Gln Asn
65 70 75 80
Gly Tyr Cys Ser Lys Pro Ala Glu Cys Leu Cys Arg Pro Gly Trp Gln
85 90 95
Gly Arg Leu Cys Asn Glu Cys Ile Pro His Asn Gly Cys Arg His Gly
100 105 110
Thr Cys Ser Thr Pro Trp Gln Cys Thr Cys Asp Glu Gly Trp Gly Gly
115 120 125
Leu Phe Cys Asp Gln Asp Leu Asn Tyr Cys Thr His His Ser Pro Cys
130 135 140
Lys Asn Gly Ala Thr Cys Ser Asn Ser Gly Gln Arg Ser Tyr Thr Cys
145 150 155 160
Thr Cys Arg Pro Gly Tyr Thr Gly Val Asp Cys Glu Leu Glu Leu Ser
165 170 175
Glu Cys Asp Ser Asn Pro Cys Arg Asn Gly Gly Ser Cys Lys Asp Gln
180 185 190
Glu Asp Gly Tyr His Cys Leu Cys Pro Pro Gly Tyr Tyr Gly Leu His
195 200 205
Cys Glu His Ser Thr Leu Ser Cys Ala Asp Ser Pro Cys Phe Asn Gly
210 215 220
Gly Ser Cys Arg Glu Arg Asn Gln Gly Ala Asn Tyr Ala Cys Glu Cys
225 230 235 240
Pro Pro Asn Phe Thr Gly Ser Asn Cys Glu Lys Lys Val Asp Arg Cys
245 250 255
Thr Ser Asn Pro Cys Ala Asn Gly Gly Gln Cys Leu Asn Arg Gly Pro
260 265 270
Ser Arg Met Cys Arg Cys Arg Pro Gly Phe Thr Gly Thr Tyr Cys Glu
275 280 285
Leu His Val Ser Asp Cys Ala Arg Asn Pro Cys Ala His Gly Gly Thr
290 295 300
Cys His Asp Leu Glu Asn Gly Leu Met Cys Thr Cys Pro Ala Gly Phe
305 310 315 320
Ser Gly Arg Arg Cys Glu Val Arg Thr Ser Ile Asp Ala Cys Ala Ser
325 330 335
Ser Pro Cys Phe Asn Arg Ala Thr Cys Tyr Thr Asp Leu Ser Thr Asp
340 345 350
Thr Phe Val Cys Asn Cys Pro Tyr Gly Phe Val Gly Ser Gly Ser Tyr
355 360 365
Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro
370 375 380
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
385 390 395 400
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp
405 410 415
Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
420 425 430
Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val
435 440 445
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
450 455 460
Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys
465 470 475 480
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
485 490 495
Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr
500 505 510
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
515 520 525
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
530 535 540
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys
545 550 555 560
Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu
565 570 575
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
580 585 590
Lys
<210> 5
<211> 1779
<212> DNA
<213> искусственная последовательность
<220>
<223> нуклеотидная последовательность, кодирующая гибридный белок
<400> 5
atgtacagga tgcaactcct gtcttgcatt gcactaagtc ttgcacttgt cacgaattcc 60
taccgggtca tctgcagtga caactactat ggagacaact gctcccgcct gtgcaagaag 120
cgcaatgacc acttcggcca ctatgtgtgc cagccagatg gcaacttgtc ctgcctgccc 180
ggttggactg gggaatattg ccaacagcct atctgtcttt cgggctgtca tgaacagaat 240
ggctactgca gcaagccagc agagtgcctc tgccgcccag gctggcaggg ccggctgtgt 300
aacgaatgca tcccccacaa tggctgtcgc cacggcacct gcagcactcc ctggcaatgt 360
acttgtgatg agggctgggg aggcctgttt tgtgaccaag atctcaacta ctgcacccac 420
cactccccat gcaagaatgg ggcaacgtgc tccaacagtg ggcagcgaag ctacacctgc 480
acctgtcgcc caggctacac tggtgtggac tgtgagctgg agctcagcga gtgtgacagc 540
aacccctgtc gcaatggagg cagctgtaag gaccaggagg atggctacca ctgcctgtgt 600
cctccgggct actatggcct gcattgtgaa cacagcacct tgagctgcgc cgactccccc 660
tgcttcaatg ggggctcctg ccgggagcgc aaccaggggg ccaactatgc ttgtgaatgt 720
ccccccaact tcaccggctc caactgcgag aagaaagtgg acaggtgcac cagcaacccc 780
tgtgccaacg ggggacagtg cctgaaccga ggtccaagcc gcatgtgccg ctgccgtcct 840
ggattcacgg gcacctactg tgaactccac gtcagcgact gtgcccgtaa cccttgcgcc 900
cacggtggca cttgccatga cctggagaat gggctcatgt gcacctgccc tgccggcttc 960
tctggccgac gctgtgaggt gcggacatcc atcgatgcct gtgcctcgag tccctgcttc 1020
aacagggcca cctgctacac cgacctctcc acagacacct ttgtgtgcaa ctgcccttat 1080
ggctttgtgg gcagcggatc ttatggtccc ccatgcccac catgcccagc acctgagttc 1140
ctggggggac catcagtctt cctgttcccc ccaaaaccca aggacactct catgatctcc 1200
cggacccctg aggtcacgtg cgtggtggtg gacgtgagcc aggaagaccc cgaggtccag 1260
ttcaactggt acgtggatgg cgtggaggtg cataatgcca agacaaagcc gcgggaggag 1320
cagttcaaca gcacgtaccg tgtggtcagc gtcctcaccg tcctgcacca ggactggctg 1380
aacggcaagg agtacaagtg caaggtctcc aacaaaggcc tcccgtcctc catcgagaaa 1440
accatctcca aagccaaagg gcagccccga gagccacagg tgtacaccct gcccccatcc 1500
caggaggaga tgaccaagaa ccaggtcagc ctgacctgcc tggtcaaagg cttctacccc 1560
agcgacatcg ccgtggagtg ggagagcaat gggcagccgg agaacaacta caagaccacg 1620
cctcccgtgc tggactccga cggctccttc ttcctctaca gcaggctaac cgtggacaag 1680
agcaggtggc aggaggggaa tgtcttctca tgctccgtga tgcatgaggc tctgcacaac 1740
cactacacac agaagagcct ctccctgtct ccgggtaaa 1779
<210> 6
<211> 234
<212> PRT
<213> Homo sapiens
<220>
<223>фрагментбелка
<400> 6
Tyr Arg Val Ile Cys Ser Asp Asn Tyr Tyr Gly Asp Asn Cys Ser Arg
1 5 10 15
Leu Cys Lys Lys Arg Asn Asp His Phe Gly His Tyr Val Cys Gln Pro
20 25 30
Asp Gly Asn Leu Ser Cys Leu Pro Gly Trp Thr Gly Glu Tyr Cys Gln
35 40 45
Gln Pro Ile Cys Leu Ser Gly Cys His Glu Gln Asn Gly Tyr Cys Ser
50 55 60
Lys Pro Ala Glu Cys Leu Cys Arg Pro Gly Trp Gln Gly Arg Leu Cys
65 70 75 80
Asn Glu Cys Ile Pro His Asn Gly Cys Arg His Gly Thr Cys Ser Thr
85 90 95
Pro Trp Gln Cys Thr Cys Asp Glu Gly Trp Gly Gly Leu Phe Cys Asp
100 105 110
Gln Asp Leu Asn Tyr Cys Thr His His Ser Pro Cys Lys Asn Gly Ala
115 120 125
Thr Cys Ser Asn Ser Gly Gln Arg Ser Tyr Thr Cys Thr Cys Arg Pro
130 135 140
Gly Tyr Thr Gly Val Asp Cys Glu Leu Glu Leu Ser Glu Cys Asp Ser
145 150 155 160
Asn Pro Cys Arg Asn Gly Gly Ser Cys Lys Asp Gln Glu Asp Gly Tyr
165 170 175
His Cys Leu Cys Pro Pro Gly Tyr Tyr Gly Leu His Cys Glu His Ser
180 185 190
Thr Leu Ser Cys Ala Asp Ser Pro Cys Phe Asn Gly Gly Ser Cys Arg
195 200 205
Glu Arg Asn Gln Gly Ala Asn Tyr Ala Cys Glu Cys Pro Pro Asn Phe
210 215 220
Thr Gly Ser Asn Cys Glu Lys Lys Val Asp
225 230
<210> 7
<211> 226
<212> PRT
<213> Homo sapiens
<220>
<223> Fc-фрагмент IgG4
<400> 7
Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly
1 5 10 15
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
20 25 30
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
35 40 45
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
50 55 60
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
65 70 75 80
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
85 90 95
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
100 105 110
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
115 120 125
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
130 135 140
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
145 150 155 160
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
165 170 175
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
180 185 190
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
195 200 205
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
210 215 220
Gly Lys
225
<210> 8
<211> 35
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 8
aagaattcct accgggtcat ctgcagtgac aacta 35
<210> 9
<211> 32
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 9
taggatccgt ccactttctt ctcgcagttg ga 32
<210> 10
<211> 32
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 10
taggatccgc tgcccacaaa gccataaggg ca 32
<210> 11
<211> 22
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 11
gcctgaccct gcttgctcaa ct 22
<210> 12
<211> 20
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 12
ctcacgtcca ccaccacgca 20
<210> 13
<211> 20
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 13
aagaaagata gctcgcggca 20
<210> 14
<211> 20
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 14
tacttcccca gcacacttgg 20
<210> 15
<211> 22
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 15
gattcctctg tgtgggtgga tg 22
<210> 16
<211> 22
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 16
gattttatta tggcggcttc gg 22
<210> 17
<211> 20
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 17
ccttcccctt ctctttcggc 20
<210> 18
<211> 20
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 18
aaaagctccg atctccgtcc 20
<210> 19
<211> 20
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 19
aaggcgtcgg gatcggataa 20
<210> 20
<211> 21
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 20
agagcgtgtg cgtcaaagta g 21
<210> 21
<211> 20
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 21
ccatcaccat cttccaggag 20
<210> 22
<211> 20
<212> DNA
<213> искусственная последовательность
<220>
<223> праймер
<400> 22
aatgagcccc agccttctcc 20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО К NOTCH4 ЧЕЛОВЕКА | 2016 |
|
RU2720280C2 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746550C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ CD20/ЧЕЛОВЕЧЕСКОМУ РЕЦЕПТОРУ ТРАНСФЕРРИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2753390C1 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С ROR2 | 2018 |
|
RU2784586C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ БЕТА-АМИЛОИДУ/ЧЕЛОВЕЧЕСКОМУ РЕЦЕПТОРУ ТРАНСФЕРРИНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2730682C1 |
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
| ПОЛИСПЕЦИФИЧЕСКИЕ ПОЛИПЕПТИДНЫЕ КОНСТРУКЦИИ, ОБЛАДАЮЩИЕ ОГРАНИЧЕННЫМ СВЯЗЫВАНИЕМ С СD3, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2813816C2 |
Изобретение относится к области биотехнологии, конкретно к получению функциональных антагонистов Dll4 (Delta-like ligand 4) человека, и может быть использовано для рекомбинантного получения слитого белка на основе растворимого внеклеточного фрагмента человеческого Dll4, состоящего только из домена DSL и доменов EGF-подобных повторов белка Dll4, расположенных в порядке, соответствующем природной последовательности, и не включающего MNNL-домен, при этом фрагмент Dll4 соединен с константной частью тяжелой цепи IgG4 человека. Изобретение обеспечивает получение гибридных конструкций, которые обладают только минимальной эффекторной функцией антитело-зависимой клеточной цитотоксичности, не обладают комплемент-зависимой цитотоксичностью и имеют относительно небольшую молекулярную массу, что повышает эффективность продукции этих молекул в клетках млекопитающих и улучшает их свойства, связанные со скоростью и эффективностью проникновения в ткани; обладают пониженной способностью к агрегации и улучшенной растворимостью, а также обеспечивают эффективное блокирование Notch-сигналинга за счет отсутствия в конструкции MNNL-домена. 4 н. и 14 з.п. ф-лы, 2 ил., 3 пр.
1. Слитый белок - антагонист Dll4, содержащий:
а) фрагмент растворимой внеклеточной части белка Dll4 человека, состоящий только из домена DSL и доменов EGF-подобных повторов белка Dll4, расположенных в порядке, соответствующем природной последовательности, и не включающий MNNL-домен, причем домены EGF-подобных повторов представляют собой по меньшей мере домены 1-5 EGF-подобных повторов белка Dll4;
б) Fc-фрагмент IgG4 человека, присоединенный к фрагменту белка Dll4 (а) с С-конца безлинкерно или посредством линкерной последовательности.
2. Слитый белок по п.1, в котором домен DSL белка Dll4 имеет аминокислотную последовательность, соответствующую положениям 173-217 последовательности SEQ ID NO: 1, а домены EGF-подобных повторов белка Dll4 имеют аминокислотные последовательности, соответствующие положениям 218-251, 252-282, 284-322, 324-360 и 362-400 последовательности SEQ ID NO: 1.
3. Слитый белок по п.1, в котором Fc-фрагмент IgG4 человека имеет аминокислотную последовательность SEQ ID NO: 7.
4. Слитый белок по п.1, дополнительно включающий по меньшей мере один из доменов 6-8 EGF-подобных повторов белка Dll4, расположенный(-е) с С-конца фрагмента белка Dll4 (а), причем порядок расположения этих доменов 6-8 EGF-подобных повторов может быть любым.
5. Слитый белок по п.4, в котором домены 6-8 EGF-подобных повторов белка Dll4 имеют аминокислотные последовательности, соответствующие положениям 402-438, 440-476 и 480-518 последовательности SEQ ID NO: 1.
6. Слитый белок по п.1, в котором Fc-фрагмент IgG4 человека (б) соединен с фрагментом белка Dll4 (а) безлинкерно.
7. Слитый белок по п.1, в котором Fc-фрагмент IgG4 человека (б) соединен с фрагментом белка Dll4 (а) через линкерный пептид.
8. Слитый белок по п.7, в котором Fc-фрагмент IgG4 человека (б) соединен с фрагментом белка Dll4 (а) через линкерный пептид GS.
9. Слитый белок по п.1, в котором фрагмент белка Dll4 имеет аминокислотную последовательность SEQ ID NO: 6.
10. Слитый белок по п.1, дополнительно включающий сигнальную последовательность, локализованную на N-конце слитого белка.
11. Слитый белок по п.1, имеющий аминокислотную последовательность SEQ ID NO: 2.
12. Слитый белок по п.4, имеющий аминокислотную последовательность SEQ ID NO: 4.
13. Изолированная молекула нуклеиновой кислоты, кодирующая слитый белок по любому из пп.1-12.
14. Изолированная молекула нуклеиновой кислоты по п.13, имеющая последовательность SEQ ID NO: 3.
15. Изолированная молекула нуклеиновой кислоты по п.13, имеющая последовательность SEQ ID NO: 5.
16. Экспрессирующий вектор, имеющий в своем составе последовательность нуклеиновой кислоты по любому из пп.13-15 под контролем регуляторных элементов, необходимых для ее экспрессии в клетке-хозяине.
17. Клетка, способная экспрессировать слитый белок по любому из пп.1-12, не являющаяся эмбриональной клеткой человека и трансфецированная экспрессирующим вектором по п.16.
18. Клетка по п.17, представляющая собой клетку яичников китайского хомячка (СНО).
| US 20080107648 A1, 08.05.2008, WO 2018220446 A1, 06.12.2018, RU 2689522 C1, 28.05.2019, GLAESNER W | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2022-12-28—Публикация
2021-10-11—Подача