Область, к которой относится изобретение
В общих чертах, настоящее изобретение относится к области молекулярной биологии. Более конкретно настоящее изобретение относится к анти-DLL4-антителам и к их применению.
Предшествующий уровень техники
Обеспечение кровоснабжения является основной потребностью для многих физиологических и патологических процессов. Для активного роста тканей, таких как эмбрионы и опухоли, необходимо адекватное кровоснабжение. Такое кровоснабжение обеспечивается благодаря продуцированию проангиогенных факторов, стимулирующих образование новых кровеносных сосудов в процессе, называемом ангиогенезом. Образование сосудов является сложным, но планомерным биологическим процессом, включающим в себя все или многие из следующих стадий: a) пролиферацию эндотелиальных клеток (EC) из существующих EC или их дифференцировку из клеток-предшественников; b) миграцию и коалесценцию EC с образованием канатико-подобных структур; c) тубулогенез сосудистых канатиков с образованием сосудов, имеющих центральный просвет; d) разрастание существующих канатиков или сосудов с образованием вторичных сосудов; e) последующее ремоделирование и образование новых форм из первичного сосудистого сплетения; и f) рекрутинг периэндотельальных клеток в эндотелиальные сосуды, что сообщает этим сосудам поддерживающие и модуляторные функции, где указанными клетками являются перициты для небольших капилляров, клетки гладких мышц для более крупных сосудов и клетки миокарда в сердце. Hanahan, Science 277:48-50 (1997); Hogan & Kolodziej, Nat. Rev. Genet. 3:513-23 (2002); Lubarsky & Krasnow, Cell 112:19-28 (2003).
В настоящее время хорошо известно, что ангиогенез участвует в патогенезе различных заболеваний. Такими заболеваниями являются солидные опухоли и метастазы, атеросклероз, ретролентальная фиброплазия, гемангиомы, хроническое воспаление, внутриглазные неоваскулярные заболевания, такие как пролиферативные ретинопатии, например диабетическая ретинопатия, возрастная дегенерация желтого пятна (AMD), неоваскулярная глаукома, иммунное отторжение имплантированной ткани роговицы и других тканей, ревматоидный артрит и псориаз. Folkman et al., J. Biol. Chem. 267:10931-34 (1992); Klagsbrun et al., Annu. Rev. Physiol. 53:217-39 (1991); и Garner A., “Vascular diseases,” In: Pathobiology of Ocular Disease. A Dynamic Approach, Garner A., Klintworth GK, eds., 2nd Edition (Marcel Dekker, NY, 1994), pp.1625-1710.
В случае роста опухоли ангиогенез, очевидно, играет решающую роль в переходе от гиперплазии к неоплазии и в обеспечении поступления питательных элементов, необходимых для роста опухолей и образования метастазов. Folkman et al., Nature 339:58 (1989). Неоваскуляризация способствует преимущественному росту опухолевых клеток и приобретению ими пролиферативной автономии по сравнению с нормальными клетками. Развитие опухоли обычно начинается с одной аберрантной клетки, которая может пролиферироваться только до размера в несколько кубических миллиметров, что обусловлено определенным расстоянием от доступного капиллярного ложа, и такая клетка может оставаться «спящей», то есть она может не подвергаться дальнейшему росту и диссеминированию в течение длительного периода. Затем некоторые опухолевые клетки приобретают ангиогенный фенотип с активацией эндотелиальных клеток, которые после пролиферации и созревания образуют новые капиллярные кровеносные сосуды. Эти новообразованные сосуды не только способствуют продолжению роста первичной опухоли, но также диссеминированию и реколонизации метастатических опухолевых клеток. В соответствии с этим наблюдается корреляция между плотностью микрососудов в опухолевых срезах и выживаемостью пациентов, страдающих раком молочной железы и некоторыми другими опухолями. Weidner et al., N. Engl. J. Med. 324:1-6 (1991); Horak et al., Lancet 340:1120-24 (1992); Macchiarini et al., Lancet 340:145-46 (1992). Точные механизмы, регулирующие переключение ангиогенеза, пока еще не установлены, хотя и вероятно, что неоваскуляризация опухолевой массы является результатом общего соотношения множества стимуляторов и ингибиторов ангиогенеза (Folkman, Nat. Med. 1(1):27-31 (1995)).
Процесс развития сосудов строго регулируется. В настоящее время уже известно, что большое число молекул, главным образом секретируемых факторов, продуцируемых окружающими клетками, регулируют дифференцировку, пролиферацию, миграцию и коалесценцию ЕС с образованием канатико-подобных структур. Так, например, васкулярный эндотелиальный фактор роста (VEGF) был идентифицирован как ключевой фактор, участвующий в стимуляции ангиогенеза и в индуцировании проницаемости сосудов. Ferrara et al., Endocr. Rev. 18:4-25 (1997). Обнаружение того факта, что потеря даже одного аллеля VEGF приводит к гибели эмбриона, указывает на незаменимую роль, которую играет этот фактор в развитии и дифференцировке сосудистой системы. Кроме того, было показано, что VEGF является ключевым медиатором неоваскуляризации, ассоциированной с развитием опухолевых и внутриглазных заболеваний. Ferrara et al., Endocr. Rev. см. выше. мРНК VEGF сверхэкспрессируется большинством исследуемых человеческих опухолей. Berkman et al., J. Clin. Invest. 91:153-59 (1993); Brown et al., Human Pathol. 26:86-91 (1995); Brown et al., Cancer Res. 53:4727-35 (1993); Mattern et al., Brit. J. Cancer 73:931-34 (1996); Dvorak et al., Am. J. Pathol. 146:1029-39 (1995).
Кроме того, уровни концентрации VEGF во внутриглазной жидкости в значительной степени коррелируют с активной пролиферацией кровеносных сосудов у пациентов с диабетической ретинопатией и другой ассоциированной с ишемией ретинопатией. Aiello et al., N. Engl. J. Med. 331:1480-87 (1994). Кроме того, были проведены исследования, которые выявили локализацию VEGF в хороидальных неоваскулярных мембранах у пациентов, страдающих AMD. Lopez et al., Invest. Ophthalmol. Vis. Sci. 37:855-68 (1996).
Нейтрализующие анти-VEGF-антитела подавляют рост различных человеческих опухолевых клеточных линий у «голых» мышей (Kim et al., Nature 362:841-44 (1993); Warren et al., J. Clin. Invest. 95:1789-97 (1995); Borgstrum et al., Cancer Res. 56:4032-39 (1996); Melnyk et al., Cancer Res. 56:921-24 (1996)), также ингибируют внутриглазной ангиогенез в моделях ишемических заболеваний сетчатки (Adamis et al., Arch. Ophthalmol. 114:66-71 (1996)). Поэтому моноклональные анти-VEGF-антитела или другие ингибиторы действия VEGF являются перспективными кандидатами на их применение для лечения опухолевых и различных внутриглазных неоваскулярных заболеваний. Такие антитела описаны, например, в EP 817648, опубликованном 14 января 1998; в заявках WO 98/45331 и WO 98/45332, опубликованных 15 октября 1998. Одно из анти-VEGF-антител, бевацизумаб, было разрешено Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA) к его применению в комбинации с химиотерапией для лечения конкретных раковых заболеваний, фрагмент анти-VEGF-антитела, ранибизумаб, был разрешен FDA к применению для лечения возрастной (мокрой) дегенерации желтого пятна. В настоящее время оба этих лекарственных средства проходят клинические испытания.
Очевидно, что необходимость получения агентов, которые обладают клиническими признаками, являющимися оптимальными для разработки терапевтических средств, остается актуальной. Изобретение, описанное в настоящей заявке, удовлетворяет этим требованием и имеет другие преимущества.
Все цитируемые здесь работы, включая патентные заявки и публикации, во всей их полноте включены в настоящее описание посредством ссылки.
Описание сущности изобретения
Настоящее изобретение частично основано на идентификации различных DLL4-связывающих агентов (таких как иммуноконъюгаты, антитела и их фрагменты). DLL4 представляет собой важную и предпочтительную терапевтическую мишень, и настоящее изобретение относится к композициям и к способам, основанным на связывании с DLL4. Описанные здесь DLL4-связывающие агенты согласно изобретению представляют собой важные терапевтические и диагностические средства, которые могут быть использованы для лечения патологических состояний, ассоциированных с экспрессией и/или активностью каскада реакций DLL4-рецептора Notch. В соответствии с этим настоящее изобретение относится к способам, композициям, наборам и промышленным изделиям, ассоциированным с DLL4-связыванием.
Настоящее изобретение относится к антителам, которые связываются (например, специфически связываются) с DLL4.
В одном из своих аспектов настоящее изобретение относится к выделенному анти-DLL4-антителу, где полноразмерная IgG-форма антитела специфически связывается с человеческим DLL4 с аффинностью связывания примерно 1 нМ или более или примерно 500 пМ или более. Как хорошо известно специалистам, аффинность связывания лиганда с его рецептором может быть определена с помощью различных анализов и выражена различными количественными величинами. В соответствии с этим в одном из вариантов изобретения аффинность связывания выражена величинами Kd и представляет собой природную аффинность связывания (например, с минимальными эффектами авидности). Обычно и предпочтительно аффинность связывания измеряют in vitro в бесклеточной или в клеточной среде. Для измерения аффинности связывания может быть использован любой из известных анализов, включая описанные здесь анализы, например Biacore®, радиоиммуноанализ (РИА) и ELISA. В некоторых вариантах изобретения выделенное анти-DLL4-антитело связывается с человеческим и мышиным DLL4 с аналогичной аффинностью, то есть аффинность связывания с человеческим DLL4 превышает аффинность связывания с мышиным DLL4 не более чем в 100 раз или менее. В некоторых вариантах изобретения аффинность связывания с человеческим DLL4 превышает аффинность связывания с мышиным DLL4 не более чем в 10 раз или менее. В некоторых вариантах изобретения антитело специфически связывается с мышиным DLL4 с аффинностью связывания примерно 1 нМ или более или примерно 500 пМ или более.
В одном из своих аспектов настоящее изобретение относится к выделенному анти-DLL4-антителу, где полноразмерная IgG-форма антитела специфически связывается с человеческим DLL4 с kon примерно 2×105 или более или примерно 1×105 или более. Как хорошо известно специалистам, kon связывания лиганда с его рецептором может быть определена с помощью различных анализов и выражена различными количественными величинами.
В одном из своих аспектов настоящее изобретение относится к выделенному антителу, которое связывается с лиганд-связывающей областью DLL4. В некоторых вариантах изобретения, выделенное антитело связывается с полипептидом, включающим внеклеточный домен DLL4 или состоящим, или, в основном, состоящим из этого домена. В некоторых вариантах изобретения выделенное антитело связывается с полипептидом, включающим, состоящим или, в основном, состоящим из них, аминокислоты 252-282, 1-252, 1-286, 1-324 и/или 219-286 человеческого DLL4.
В одном из своих аспектов настоящее изобретение относится к выделенному анти-DLL4-антителу, которое конкурирует с рецептором Notch за связывание с DLL4.
В одном из своих аспектов настоящее изобретение относится к выделенному анти-DLL4-антителу, которое ингибирует, снижает и/или блокирует биологическую активность DLL4.
В одном из аспектов изобретения анти-DLL4-антитело согласно изобретению включает:
(a) по меньшей мере одну, две, три, четыре, пять или шесть последовательностей гипервариабельных областей (HVR), выбранных из группы, состоящей из:
(i) HVR-L1, содержащей последовательность A1-A11, где A1-A11 представляет собой RASQDVSTAVA (SEQ ID NO:10);
(ii) HVR-L2, содержащей последовательность B1-B7, где B1-B7 представляет собой SASFLYS (SEQ ID NO:11);
(iii) HVR-L3, содержащей последовательность C1-C9, где C1-C9 представляет собой QQSYNGPST (SEQ ID NO:15);
(iv) HVR-H1, содержащей последовательность D1-D10, где D1-D10 представляет собой GFTFTDNWIS (SEQ ID NO:1);
(v) HVR-H2, содержащей последовательность E1-E18, где E1-E18 представляет собой GVINPNSGATEYADSVKG (SEQ ID NO:5) и
(vi) HVR-H3, содержащей последовательность F1-F15, где F1-F15 представляет собой VYYCARDNFGGYFDY (SEQ ID NO:9); и
(b) по меньшей мере один вариант HVR, где указанный вариант последовательности HVR имеет модификацию по меньшей мере одного остатка последовательности, представленной в SEQ ID NO:1-18.
В одном из аспектов изобретения анти-DLL4-антитело согласно изобретению включает:
(a) по меньшей мере одну, две, три, четыре или пять последовательностей гипервариабельных областей (HVR), выбранных из группы, состоящей из:
(i) HVR-L1, содержащей последовательность A1-A11, где A1-A11 представляет собой RASQDVSTAVA (SEQ ID NO:10);
(ii) HVR-L2, содержащей последовательность B1-B7, где B1-B7 представляет собой SASFLYS (SEQ ID NO:11);
(iii) HVR-L3, содержащей последовательность C1-C9, где C1-C9 представляет собой QQSVNGPAT (SEQ ID NO:14);
(iv) HVR-H1, содержащей последовательность D1-D10, где D1-D10 представляет собой GFSFRDNWIS (SEQ ID NO:2);
(v) HVR-H2, содержащей последовательность E1-E18, где E1-E18 представляет собой GVINPNSGSTDYADSVKG (SEQ ID NO:3);
(vi) HVR-H3, содержащей последовательность F1-F15, где F1-F15 представляет собой VYYCARDNFGGYFDY (SEQ ID NO:9); и
(b) по меньшей мере один вариант HVR, где указанный вариант последовательности HVR имеет модификацию по меньшей мере одного остатка последовательности, представленной в SEQ ID NO:1-18.
В одном из аспектов изобретения анти-DLL4-антитело согласно изобретению включает:
(a) по меньшей мере одну, две, три, четыре или пять последовательностей гипервариабельных областей (HVR), выбранных из группы, состоящей из:
(i) HVR-L1, содержащей последовательность A1-A11, где A1-A11 представляет собой RASQDVSTAVA (SEQ ID NO:10);
(ii) HVR-L2, содержащей последовательность B1-B7, где B1-B7 представляет собой SASFLYS (SEQ ID NO:11);
(iii) HVR-L3, содержащей последовательность C1-C9, где C1-C9 представляет собой QQSYTGTVT (SEQ ID NO:18);
(iv) HVR-H1, содержащей последовательность D1-D10, где D1-D10 представляет собой GFTFTDNWIS (SEQ ID NO:1);
(v) HVR-H2, содержащей последовательность E1-E18, где E1-E18 представляет собой GYISPNSGFTYYADSVKG (SEQ ID NO:8) and
(vi) HVR-H3, содержащей последовательность F1-F15, где F1-F15 представляет собой VYYCARDNFGGYFDY (SEQ ID NO:9); и
(b) по меньшей мере один вариант HVR, где указанный вариант последовательности HVR имеет модификацию по меньшей мере одного остатка последовательности, представленной в SEQ ID NO:1-18.
В одном из своих аспектов настоящее изобретение относится к антителу, содержащему одну, две, три, четыре, пять или шесть HVR, где каждая HVR включает последовательность или состоит, или, в основном, состоит из последовательности, выбранной из группы, состоящей из SEQ ID NO:1-18, и где SEQ ID NO:10 соответствует HVR-L1, SEQ ID NO:11 соответствует HVR-L2, SEQ ID NO:12, 13, 14, 15, 16, 17 или 18 соответствуют HVR-L3, SEQ ID NO:1 или 2 соответствуют HVR-H1, SEQ ID NO:3, 4, 5, 6, 7 или 8 соответствуют HVR-H2, SEQ ID NO:9 соответствует HVR-H3. В одном из вариантов изобретения антитело согласно изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая из этих областей включает в указанном порядке SEQ ID NO:10, 11, 12, 1, 3, 9. В одном из вариантов изобретения антитело согласно изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая из этих областей включает в указанном порядке SEQ ID NO:10, 11, 13, 1, 4, 9. В одном из вариантов изобретения антитело согласно изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая из этих областей включает в указанном порядке SEQ ID NO:10, 11, 14, 2, 3, 9. В одном из вариантов изобретения антитело согласно изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая из этих областей включает в указанном порядке SEQ ID NO:10, 11, 15, 1, 5, 9. В одном из вариантов изобретения антитело согласно изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая из этих областей включает в указанном порядке SEQ ID NO:10, 11, 16, 1, 6, 9. В одном из вариантов изобретения антитело согласно изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая из этих областей включает в указанном порядке SEQ ID NO:10, 11, 17, 1, 7, 9. В одном из вариантов изобретения антитело согласно изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая из этих областей включает в указанном порядке SEQ ID NO:10, 11, 18, 1, 8, 9.
Варианты HVR в антителе согласно изобретению могут иметь модификации в одном или нескольких (например, в двух, трех, четырех, пяти или более) остатках в HVR.
В одном из вариантов изобретения вариант HVR-L3 содержит 1-6 (1, 2, 3, 4, 5 или 6) замен в любой комбинации в нижеследующих положениях: 91 (S или W), 92 (Y или F), 93 (T, N или S), 94 (T или G), 95 (P, Q, A или T) и/или 96 (P, S, A или V).
В одном из вариантов изобретения вариант HVR-H2 содержит 1-4 (1, 2, 3 или 4) замен в любой комбинации в нижеследующих положениях: 50 (V, L или Y), 52 (N или S), 52a (P или S) или 53 (N, Q, T или I).
Буквы в скобках после каждого положения указывают на репрезентативное замещение (то есть репрезентативную замену) аминокислот; и как очевидно специалисту в данной области, допустимость замены одной аминокислоты другой аминокислотой в соответствии с описанным здесь изобретением может быть оценена рутинными известными и/или описанными здесь методами.
В одном из своих аспектов настоящее изобретение относится к антителу, включающему область HVR-H1, содержащую последовательность SEQ ID NO:1 или 2. В одном из своих аспектов настоящее изобретение относится к антителу, включающему область HVR-H2, содержащую последовательность SEQ ID NO:3, 4, 5, 6, 7 или 8. В одном из своих аспектов настоящее изобретение относится к антителу, включающему область HVR-H3, содержащую последовательность SEQ ID NO:9. В одном из своих вариантов настоящее изобретение относится к антителу, включающему область HVR-L1, содержащую последовательность SEQ ID NO:10. В одном из своих вариантов настоящее изобретение относится к антителу, включающему область HVR-L2, содержащую последовательность SEQ ID NO:11. В одном из своих вариантов настоящее изобретение относится к антителу, включающему область HVR-L3, содержащую последовательность SEQ ID NO:12, 13, 14, 15, 16, 17 или 18.
В одном из своих аспектов настоящее изобретение относится к антителу, включающему по меньшей мере одну, по меньшей мере две или все три нижеследующие последовательности:
(i) последовательность HVR-H1, содержащую последовательность SEQ ID NO:1;
(ii) последовательность HVR-H2, содержащую последовательность SEQ ID NO:5;
(iii) последовательность HVR-H3, содержащую последовательность SEQ ID NO:9.
В одном из своих аспектов настоящее изобретение относится к антителу, включающему по меньшей мере одну, по меньшей мере две или все три нижеследующие последовательности:
(i) последовательность HVR-L1, содержащую последовательность SEQ ID NO:10;
(ii) последовательность HVR-L2, содержащую последовательность SEQ ID NO:11;
(iii) последовательность HVR-L3, содержащую последовательность SEQ ID NO:15.
В одном из своих аспектов настоящее изобретение относится к антителу, включающему по меньшей мере одну, по меньшей мере две или все три нижеследующие последовательности:
(i) последовательность HVR-H1, содержащую последовательность SEQ ID NO:1;
(ii) последовательность HVR-H2, содержащую последовательность SEQ ID NO:8;
(iii) последовательность HVR-H3, содержащую последовательность SEQ ID NO:9.
В одном из своих аспектов настоящее изобретение относится к антителу, включающему по меньшей мере одну, по меньшей мере две или все три нижеследующие последовательности:
(i) последовательность HVR-L1, содержащую последовательность SEQ ID NO:10;
(ii) последовательность HVR-L2, содержащую последовательность SEQ ID NO:11;
(iii) последовательность HVR-L3, содержащую последовательность SEQ ID NO:18.
Аминокислотные последовательности SEQ ID NO:1-18 пронумерованы для каждой отдельной HVR (то есть H1, H2 или H3), как показано на фигурах 1a и 1b, где указанная нумерация соответствует системе нумерации Кэбата, описанной ниже.
В одном из своих аспектов настоящее изобретение относится к антителам, включающим последовательности HVR тяжелой цепи, как показано на фигурах 1a и 1b.
В одном из своих аспектов настоящее изобретение относится к антителам, включающим последовательности HVR легкой цепи, как показано на фигурах 1a и 1b.
Некоторые варианты антител согласно изобретению включают вариабельный домен легкой цепи гуманизованного антитела 4D5 (huMAb4D5-8) (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также описанного в патенте США № 6407213 и Lee et al., J. Mol. Biol. (2004), 340(5):1073-93)), представленного ниже в SEQ ID NO:52.
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys 107 (SEQ ID NO:52) (остатки HVR подчеркнуты).
В одном из вариантов изобретения последовательность вариабельного домена легкой цепи huMAb4D5-8 модифицирована в одном или нескольких положениях 30, 66 и 91 (Asn, Arg и His указаны выше жирным шрифтом/курсивом соответственно). В одном из вариантов изобретения модифицированная последовательность huMAb4D5-8 содержит Ser в положении 30, Gly в положении 66 и/или Ser в положении 91. В соответствии с этим в одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен легкой цепи, имеющий последовательность, представленную ниже в SEQ ID NO:53:
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys 107 (SEQ ID NO:53) (остатки HVR подчеркнуты).
Замененные остатки в huMAb4D5-8 указаны выше жирным шрифтом/курсивом.
Антитела согласно изобретению могут содержать любую подходящую последовательность каркасного домена в вариабельной области при условии, что активность связывания с DLL4 будет, в основном, сохраняться. Так, например, в некоторых вариантах изобретения антитела согласно изобретению содержат консенсусную последовательность каркасной области человеческой тяжелой цепи подгруппы III. В одном из вариантов этих антител консенсусная последовательность каркасных областей содержит замену в положении 71, 73 и/или 78. В некоторых вариантах этих антител, в положении 71 присутствует A, в положении 73 присутствует T и/или в положении 78 присутствует A. В одном из вариантов изобретения указанные антитела включают каркасные последовательности вариабельного домена тяжелой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также описанного в патентах США №№ 6407213 и 5821337 и в публикации Lee et al., J. Mol. Biol. (2004), 340(5):1073-93). В одном из вариантов изобретения эти антитела также включают консенсусную последовательность каркасной области человеческой легкой цепи κI. В одном из вариантов изобретения указанные антитела включают последовательности HVR легкой цепи huMAb4D5-8 (описанные в патентах США №№ 6407213 и 5821337). В одном из вариантов изобретения указанные антитела включают последовательности вариабельного домена легкой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также описанного в патентах США №№ 6407213 и 5821337 и Lee et al., J. Mol. Biol. (2004), 340(5):1073-93).
В одном из вариантов изобретения указанное антитело согласно изобретению включает вариабельный домен тяжелой цепи, где каркасная последовательность включает последовательность SEQ ID NO:19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 и/или 37, последовательности HVR H1, H2 и H3 представляют собой SEQ ID NO:1, 5 и/или 9 соответственно. В одном из вариантов изобретения антитело согласно изобретению включает вариабельный домен легкой цепи, где каркасная последовательность включает последовательность SEQ ID NO:38, 39, 40 и/или 41, последовательности HVR L1, L2 и L3 представляют собой SEQ ID NO:10, 11 и/или 15 соответственно.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, где каркасная последовательность включает последовательность SEQ ID NO:19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 и/или 37, последовательности HVR H1, H2 и H3 представляют собой SEQ ID NO:2, 3 и/или 9 соответственно. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен легкой цепи, где каркасная последовательность включает последовательность SEQ ID NO:38, 39, 40 и/или 41, последовательности HVR L1, L2 и L3 представляют собой SEQ ID NO:10, 11 и/или 14 соответственно.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, где каркасная последовательность включает последовательность SEQ ID NO:19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 и/или 37, последовательности HVR H1, H2 и H3 представляют собой SEQ ID NO:1, 8 и/или 9 соответственно. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен легкой цепи, где каркасная последовательность включает последовательность SEQ ID NO:38, 39, 40 и/или 41, последовательности HVR L1, L2 и L3 представляют собой SEQ ID NO:10, 11 и/или 18 соответственно.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, где каркасная последовательность включает последовательность SEQ ID NO:46, 47, 48 и/или 49, последовательности HVR H1, H2 и H3 представляют собой SEQ ID NO:1, 5 и/или 9 соответственно. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен легкой цепи, где каркасная последовательность включает последовательность SEQ ID NO:42, 43, 44 и/или 45, последовательности HVR L1, L2 и L3 представляют собой SEQ ID NO:10, 11 и/или 15 соответственно.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, где каркасная последовательность включает последовательность SEQ ID NO:46, 47, 48 и/или 49, последовательности HVR H1, H2 и H3 представляют собой SEQ ID NO:2, 3 и/или 9 соответственно. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен легкой цепи, где каркасная последовательность включает последовательность SEQ ID NO:42, 43, 44 и/или 45, последовательности HVR L1, L2 и L3 представляют собой SEQ ID NO:10, 11 и/или 14 соответственно.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, где каркасная последовательность включает последовательность SEQ ID NO:46, 47, 48 и/или 49, последовательности HVR H1, H2 и H3 представляют собой SEQ ID NO:1, 8 и/или 9 соответственно. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен легкой цепи, где каркасная последовательность включает последовательность SEQ ID NO:42, 43, 44 и/или 45, последовательности HVR L1, L2 и L3 представляют собой SEQ ID NO:10, 11 и/или 18 соответственно.
В одном из вариантов изобретения антитело согласно изобретению подвергают аффинному созреванию с достижением нужной аффинности связывания с мишенью. В одном из примеров аффинно зрелое антитело согласно изобретению содержит замену в одном или нескольких положениях аминокислот H28, H30, H31, H32, H33, L91, L92, L93, L94, L95 и/или L96. В одном из примеров аффинно зрелое антитело согласно изобретению содержит одну или несколько из нижеследующих замен: (a) в тяжелой цепи, V50L, V50Y, N52S, P52aS, N53Q, N53T, N53I, S56A, S56F, T57S, D58E, D58I, D58A, D58Y, или (b), в легкой цепи, S91W, Y92F, T93N, T93S, T94G, P95Q, P95A, P95T, P96S, P96A, P96V.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID NO:54. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен легкой цепи, включающий последовательность SEQ ID NO:55. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID NO:54, и вариабельный домен легкой цепи, включающий последовательность SEQ ID NO:55.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID NO:56. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен легкой цепи, включающий последовательность SEQ ID NO:57. В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID NO:56, и вариабельный домен легкой цепи, включающий последовательность SEQ ID NO:57.
В одном из вариантов изобретения антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID NO:58. В одном из вариантов изобретения, антитело согласно изобретению содержит вариабельный домен легкой цепи, включающий последовательность SEQ ID NO:59. В одном из вариантов изобретения, антитело согласно изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID NO:58, и вариабельный домен легкой цепи, включающий последовательность SEQ ID NO:59.
В одном из своих аспектов настоящее изобретение относится к антителу, которое конкурирует с любыми вышеупомянутыми антителами за связывание с DLL4. В одном из своих аспектов настоящее изобретение относится к антителу, которое связывается с таким же эпитопом на DLL4, с которым связывается любое из вышеупомянутых антител.
Как известно специалистам и как подробно описано ниже, положения/границы аминокислот, определяющие гипервариабельную область антитела, могут варьироваться в зависимости от окружающих аминокислот и от различных дефиниций, известных специалистам (описанных ниже). Некоторые положения в вариабельном домене могут рассматриваться как гибридные гипервариабельные положения, где эти положения, очевидно, могут присуствовать в гипервариабельной области в соответствии с одним рядом признаков, могут присуствовать и вне гипервариабельной области в соответствии с другим рядом признаков. Одно или несколько из этих положений может также находиться в удлиненных гипервариабельных областях (как подробно определено ниже).
В некоторых вариантах изобретения указанным антителом является моноклональное антитело. В некоторых вариантах изобретения указанным антителом является поликлональное антитело. В некоторых вариантах изобретения указанное антитело выбрано из группы, состоящей из химерного антитела, аффинно зрелого антитела, гуманизованного антитела и человеческого антитела. В некоторых вариантах изобретения указанным антителом является фрагмент антитела. В некоторых вариантах изобретения указанным антителом является Fab, Fab', Fab'-SH, F(ab')2 или scFv.
В одном из вариантов изобретения указанным антителом является химерное антитело, например антитело, включающее антигенсвязывающие последовательности, происходящие от не-человеческого донора и присоединенные к гетерологичной не-человеческой, человеческой или гуманизованной последовательности (например, последовательностям каркасного и/или константного домена). В одном из вариантов изобретения указанным не-человеческим донором является мышь. В одном из вариантов изобретения, антигенсвязывающая последовательность является синтетической, например, она может быть получена посредством мутагенеза (например, путем скрининга методом фагового представления и т.п.). В одном из вариантов изобретения химерное антитело согласно изобретению имеет мышиные V-области и человеческую С-область. В одном из вариантов изобретения мышиная V-область легкой цепи присоединена к человеческой легкой цепи каппа. В одном из вариантов изобретения мышиная V-область тяжелой цепи присоединена к человеческой С-области IgG1.
Гуманизованными антителами согласно изобретению являются антитела, имеющие аминокислотные замены в FR и аффинно зрелые варианты с заменами в присоединенных CDR. Замененные аминокислоты в CDR или FR не ограничиваются аминокислотами, присутствующими в антителе-доноре или реципиенте. В других вариантах изобретения антитела согласно изобретению также содержат замены аминокислотных остатков в Fc-области, которые улучшают эффекторную функцию, включая улучшение CDC- и/или ADCC-функции и усиление цитолиза B-клеток. Другими антителами согласно изобретению являются антитела, имеющие специфические замены, повышающие стабильность. В других вариантах изобретения антитела согласно изобретению содержат замены аминокислотных остатков в Fc-области, которые ослабляют эффекторную функцию, включая ослабление CDC- и/или ADCC-функции и/или ослабление цитолиза B-клеток. В некоторых вариантах изобретения антитела согласно изобретению характеризуются пониженным уровнем связывания (например, отсутствием связывания) с фактором C1q человеческой системы комплемента и/или с человеческим Fc-рецептором на природных клетках-киллерах (NK). В некоторых вариантах изобретения антитела согласно изобретению характеризуются пониженным уровнем связывания (например, отсутствием связывания) с человеческим FcγRI, FcγRIIA и/или FcγRIIIA. В некоторых вариантах изобретения антитела согласно изобретению принадлежат к классу IgG (например, IgG1 или IgG4) и содержат по меньшей мере одну мутацию в E233, L234, G236, D265, D270, N297, E318, K320, K322, A327, A330, P331 и/или P329 (нумерация проводилась в соответствии с Европейской системой нумерации (EU)). В некоторых вариантах изобретения указанные антитела включают мутацию L234A/L235A или D265A/N297A.
В одном из своих аспектов настоящее изобретение относится к антителам против полипептидов DLL4, содержащим любую из описанных здесь антигенсвязывающих последовательностей, где указанные антитела против полипептидов DLL4 специфически связываются с DLL4.
Антитела согласно изобретению связываются (например, специфически связываются) с DLL4, в некоторых вариантах изобретения, они могут модулировать один или несколько видов DLL4-ассоциированных эффектов, включая, но не ограничиваясь ими, ослабление или блокирование активации рецептора Notch, ослабление или блокирование молекулярного сигнала, передаваемого после передачи сигнала рецептора Notch, нарушение или блокирование связывания рецептора Notch с DLL4 и/или стимуляцию пролиферации эндотелиальных клеток и/или ингибирование дифференцировки эндотелиальных клеток и/или ингибирование артериальной дифференциации и/или ингибирование сосудистой перфузии опухоли, и/или лечение и/или предупреждение развития опухоли, клоточно-пролиферативного расстройства или рака; и/или лечение или предупреждение расстройства, ассоциированного с экспрессией и/или активностью DLL4 и/или лечение или предупреждение расстройства, ассоциированного с экспрессией и/или активностью рецептора Notch. В некоторых вариантах изобретения, антитело согласно изобретению специфически связывается с DLL4. В некоторых вариантах изобретения антитело специфически связывается с внеклеточным доменом DLL4 (ECD). В некоторых вариантах изобретения антитело специфически связывается с полипептидом, состоящим или, в основном, состоящим из внеклеточного домена DLL4. В некоторых вариантах изобретения антитело специфически связывается с DLL4 с KD примерно 1 нМ или более, или примерно 500 пМ или более. В некоторых вариантах изобретения антитело специфически связывается с человеческим DLL4 с kon примерно 2×105 или более, или примерно 1×105 или более. В некоторых вариантах изобретения антитело согласно изобретению ослабляет, ингибирует и/или блокирует активность DLL4 in vivo и/или in vitro. В некоторых вариантах изобретения антитело конкурирует с DLL4-лигандом за связывание с DLL4 (ослабляет и/или блокирует связывание рецептора Notch с DLL4).
В одном из своих аспектов настоящее изобретение относится к композициям, содержащим одно или несколько антител согласно изобретению и носитель. В одном из вариантов изобретения указанный носитель является фармацевтически приемлемым.
В одном из своих аспектов настоящее изобретение относится к нуклеиновым кислотам, кодирующим анти-DLL4-антитело согласно изобретению.
В одном из своих аспектов настоящее изобретение относится к векторам, содержащим нуклеиновую кислоту согласно изобретению.
В одном из своих аспектов настоящее изобретение относится к композициям, содержащим одну или несколько нуклеиновых кислот согласно изобретению и носитель. В одном из вариантов изобретения указанный носитель является фармацевтически приемлемым.
В одном из своих аспектов настоящее изобретение относится к клеткам-хозяевам, содержащим нуклеиновую кислоту или вектор согласно изобретению. Указанным вектором может быть вектор любого типа, например рекомбинантный вектор, такой как экспрессионный вектор. При этом могут быть использованы любые клетки-хозяева. В одном из вариантов изобретения клеткой-хозяином является прокариотическая клетка, например E.coli. В одном из вариантов изобретения клеткой-хозяином является эукариотическая клетка, например клетка млекопитающего, такая как клетка яичника китайского хомячка (CHO).
В одном из своих аспектов настоящее изобретение относится к способам получения антитела согласно изобретению. Так, например, настоящее изобретение относится к способам получения анти-DLL4-антитела (которое, как определено в настоящей заявке, является полноразмерным антителом или фрагментом антитела) или иммуноконъюгата, где указанный способ включает экспрессию в подходящей клетке-хозяине рекомбинантного вектора согласно изобретению, кодирующего указанное антитело (или его фрагмент), и выделение указанного антитела.
В одном из своих аспектов настоящее изобретение относится к промышленному изделию, включающему контейнер и композицию, содержащуюся в этом контейнере, где указанная композиция включает одно или несколько анти-DLL4-антител согласно изобретению. В одном из вариантов изобретения указанная композиция также содержит антиангиогенный агент. В одном из вариантов изобретения указанным антиангиогенным агентом является анти-VEGF-антитело, например бевацизумаб. В одном из вариантов изобретения указанная композиция содержит нуклеиновую кислоту согласно изобретению. В одном из вариантов изобретения указанная композиция, содержащая антитело, также содержит носитель, который, в некоторых вариантах изобретения, является фармацевтически приемлемым. В одном из вариантов изобретения в указанном контейнере присутствует вторая композиция, где указанная вторая композиция содержит антиангиогенный агент. В одном из вариантов изобретения указанным антиангиогенным агентом является анти-VEGF-антитело, например бевацизумаб. В одном из вариантов изобретения промышленное изделие согласно изобретению также включает инструкции по введению указанной(ых) композиции(й) (например, антитела) индивидууму (например, инструкции по применению любого из описанных здесь способов).
В одном из своих аспектов настоящее изобретение относится к набору, содержащему первый контейнер, включающий композицию, содержащую одно или несколько анти-DLL4-антител согласно изобретению, и второй контейнер, включающий буфер. В одном из вариантов изобретения указанный буфер является фармацевтически приемлемым. В одном из вариантов изобретения композиция, содержащая антитело, также содержит носитель, который, в некоторых вариантах изобретения, является фармацевтически приемлемым. В одном из вариантов изобретения указанный набор также включает инструкции по введению указанной композиции (например, антитела) индивидууму.
В одном из своих аспектов настоящее изобретение относится к применению анти-DLL4-антитела согласно изобретению в целях приготовления лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль и/или клеточно-пролиферативное расстройство. В некоторых вариантах изобретения указанным расстройством является патологическое состояние, ассоциированное с ангиогенезом.
В одном из своих аспектов настоящее изобретение относится к применению нуклеиновой кислоты согласно изобретению в целях приготовления лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль и/или клеточно-пролиферативное расстройство. В некоторых вариантах изобретения указанным расстройством является патологическое состояние, ассоциированное с ангиогенезом.
В одном из своих аспектов настоящее изобретение относится к применению экспрессионного вектора согласно изобретению в целях приготовления лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль и/или клеточно-пролиферативное расстройство. В некоторых вариантах изобретения указанным расстройством является патологическое состояние, ассоциированное с ангиогенезом.
В одном из своих аспектов настоящее изобретение относится к применению клетки-хозяина согласно изобретению в целях приготовления лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль и/или клеточно-пролиферативное расстройство. В некоторых вариантах изобретения указанным расстройством является патологическое состояние, ассоциированное с ангиогенезом.
В одном из своих аспектов настоящее изобретение относится к применению промышленного изделия согласно изобретению в целях приготовления лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль и/или клеточно-пролиферативное расстройство. В некоторых вариантах изобретения указанным расстройством является патологическое состояние, ассоциированное с ангиогенезом.
В одном из своих аспектов настоящее изобретение относится к применению набора согласно изобретению в целях приготовления лекарственного средства для терапевтического и/или профилактического лечения заболевания, такого как рак, опухоль и/или клеточно-пролиферативное расстройство. В некоторых вариантах изобретения указанным расстройством является патологическое состояние, ассоциированное с ангиогенезом.
Настоящее изобретение относится к способам и композициям, которые могут быть применены для лечения патологических состояний, ассоциированных с экспрессией и/или активностью DLL4, например с повышенной или пониженной экспрессией и/или активностью, или нежелательной экспрессией и/или активностью DLL4.
В одном из своих аспектов настоящее изобретение относится к способам лечения или предупреждения опухоли, рака и/или клеточно-пролиферативного расстройства, ассоциированных с повышенной экспрессией и/или активностью DLL4, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении.
В одном из своих аспектов настоящее изобретение относится к способам ослабления, ингибирования, блокирования или предупреждения роста опухоли или раковой опухоли, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении.
В одном из своих аспектов настоящее изобретение относится к способам лечения опухоли, рака и/или клеточно-пролиферативного расстройства, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении.
В одном из своих аспектов настоящее изобретение относится к способам ингибирования ангиогенеза, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении.
В одном из своих аспектов настоящее изобретение относится к способам лечения патологического состояния, ассоциированного с нарушением ангиогенезов, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении. В некоторых вариантах изобретения указанным патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, рак и/или клеточно-пролиферативное расстройство. В некоторых вариантах изобретения указанным патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
Способы согласно изобретению могут быть применены для лечения любого релевантного патологического состояния. Репрезентативные расстройства описаны в настоящей заявке, и такими расстройствами являются раковые заболевания, выбранные из группы, состоящей из мелкоклеточного рака легких, нейробластомы, меланомы, карциномы молочной железы, рака желудка, рака прямой и ободочной кишки (CRC) и гепатоцеллюлярной карциномы, включая метастазы указанных раковых заболеваний.
Способы согласно изобретению могут также включать дополнительные стадии лечения. Так, например, в одном из вариантов изобретения указанный способ дополнительно включает стадию, в которой клетку- и/или ткань-мишень (например, раковую клетку) подвергают лучевой терапии или химиотерапии, или обрабатывают антиангиогенным агентом.
В другом своем аспекте настоящее изобретение относится к способам детектирования DLL4, где указанные способы включают детектирование комплекса «DLL4-анти-DLL4-антитело» в образце. Используемый здесь термин «детектирование» включает качественное и/или количественное детектирование (на измеримых уровнях) в присутствии или в отсутствие контроля.
В другом своем аспекте настоящее изобретение относится к способам диагностики расстройства, ассоциированного с экспрессией и/или активностью DLL4, где указанные способы включают детектирование комплекса «DLL4-анти-DLL4-антитело» в биологическом образце, взятом у пациента, страдающего указанным расстройством или с подозрением на указанное расстройство. В некоторых вариантах изобретения экспрессия DLL4 является повышенной или аномальной. В некоторых вариантах изобретения указанным расстройством является опухоль, рак и/или клеточно-пролиферативное расстройство.
В другом своем аспекте настоящее изобретение относится к любому из описанных здесь анти-DLL4-антител, где указанное анти-DLL4-антитело содержит детектируемую метку.
В другом своем аспекте настоящее изобретение относится к комплексу, состоящему из любых описанных здесь анти-DLL4-антител и DLL4. В некоторых вариантах изобретения указанный комплекс присутствует in vivo или in vitro. В некоторых вариантах изобретения указанный комплекс включает раковые клетки. В некоторых вариантах изобретения анти-DLL4-антитело является детектируемо меченным.
Краткое описание графического материала
Фигура 1а, b: Последовательности петли HVR тяжелой цепи и легкой цепи анти-DLL4-антител. На этих фигурах представлены последовательности HVR тяжелой цепи, H1, H2 и H3, и последовательности HVR легкой цепи, L1, L2 и L3. Последовательности пронумерованы следующим образом: клон 152.26 (HVR-H1 представляет собой SEQ ID NO:1; HVR-H2 представляет собой SEQ ID NO:3; HVR-H3 представляет собой SEQ ID NO:9; HVR-L1 представляет собой SEQ ID NO:10; HVR-L2 представляет собой SEQ ID NO:11; HVR-L3 представляет собой SEQ ID NO:12); клон 152.26.6 (HVR-H1 представляет собой SEQ ID NO:1; HVR-H2 представляет собой SEQ ID NO:4; HVR-H3 представляет собой SEQ ID NO:9; HVR-L1 представляет собой SEQ ID NO:10; HVR-L2 представляет собой SEQ ID NO:11; HVR-L3 представляет собой SEQ ID NO:13); клон 152.26.14 (HVR-H1 представляет собой SEQ ID NO:2; HVR-H2 представляет собой SEQ ID NO:3; HVR-H3 представляет собой SEQ ID NO:9; HVR-L1 представляет собой SEQ ID NO:10; HVR-L2 представляет собой SEQ ID NO:11; HVR-L3 представляет собой SEQ ID NO:14); клон 152.26.20 (HVR-H1 представляет собой SEQ ID NO:1; HVR-H2 представляет собой SEQ ID NO:5; HVR-H3 представляет собой SEQ ID NO:9; HVR-L1 представляет собой SEQ ID NO:10; HVR-L2 представляет собой SEQ ID NO:11; HVR-L3 представляет собой SEQ ID NO:15); клон 152.26.34 (HVR-H1 представляет собой SEQ ID NO:1; HVR-H2 представляет собой SEQ ID NO:6; HVR-H3 представляет собой SEQ ID NO:9; HVR-L1 представляет собой SEQ ID NO:10; HVR-L2 представляет собой SEQ ID NO:11; HVR-L3 представляет собой SEQ ID NO:16); клон 152.26.40 (HVR-H1 представляет собой SEQ ID NO:1; HVR-H2 представляет собой SEQ ID NO:7; HVR-H3 представляет собой SEQ ID NO:9; HVR-L1 представляет собой SEQ ID NO:10; HVR-L2 представляет собой SEQ ID NO:11; HVR-L3 представляет собой SEQ ID NO:17); и клон 152.26.82 (HVR-H1 представляет собой SEQ ID NO:1; HVR-H2 представляет собой SEQ ID NO:8; HVR-H3 представляет собой SEQ ID NO:9; HVR-L1 представляет собой SEQ ID NO:10; HVR-L2 представляет собой SEQ ID NO:11; HVR-L3 представляет собой SEQ ID NO:18).
Положения аминокислот пронумерованы в соответствии с системой нумерации Кэбата, как описано ниже.
Фигуры 2 и 3: репрезентативные акцепторные человеческие консенсусные последовательности каркасной области, которые используются для осуществления настоящего изобретения с применением нижеследующих идентификаторов последовательности:
Консенсусные каркасные последовательности вариабельной области тяжелой цепи (VH) (фиг.2a, b)
Консенсусная последовательность человеческой каркасной области VH подгруппы I минус CDR по Кэбату (SEQ ID NO:19)
Консенсусная последовательность человеческой каркасной области VH подгруппы I минус удлиненные гипервариабельные области (SEQ ID NO:20-22)
Консенсусная последовательность человеческой каркасной области VH подгруппы II минус CDR по Кэбату (SEQ ID NO:23)
Консенсусная последовательность человеческой каркасной области VH подгруппы I минус удлиненные гипервариабельные области (SEQ ID NO:24-26)
Консенсусная последовательность человеческой каркасной области VH подгруппы II минус удлиненные
Консенсусная последовательность человеческой каркасной области VH подгруппы III минус CDR по Кэбату (SEQ ID NO:27)
Консенсусная последовательность человеческой каркасной области VH подгруппы III минус удлиненные гипервариабельные области (SEQ ID NO:28-30)
Акцепторная последовательность человеческой каркасной области VH минус CDR по Кэбату (SEQ ID NO:31)
Акцепторная последовательность человеческой каркасной области VH минус удлиненные гипервариабельные области (SEQ ID NO:32-33)
Акцепторная последовательность 2 человеческой каркасной области VH минус CDR по Кэбату (SEQ ID NO:34)
Акцепторная последовательность 2 человеческой каркасной области VH минус удлиненные гипервариабельные области (SEQ ID NO:35-37)
Консенсусные последовательности каркасной области вариабельной области легкой цепи (VL) (фиг.3)
Консенсусная последовательность человеческой каркасной области цепи каппа VL подгруппы I (SEQ ID NO:38)
Консенсусная последовательность человеческой каркасной области цепи каппа VL подгруппы II (SEQ ID NO:39)
Консенсусная последовательность человеческой каркасной области цепи каппа VL подгруппы III (SEQ ID NO:40)
Консенсусная последовательность человеческой каркасной области цепи каппа VL подгруппы IV (SEQ ID NO:41)
Фигура 4: Последовательности каркасной области легкой и тяжелой цепей huMAb4D5-8. Числа в верхнем индексе выделенные жирным шрифтом указывают на положения аминокислот, пронумерованные по Кэбату.
Фигура 5: Модифицированные/измененные последовательности каркасной области легкой и тяжелой цепей huMAb4D5-8. Числа в верхнем индексе выделенные жирным шрифтом указывают на положения аминокислот, пронумерованные по Кэбату.
Фигура 6: Вариабельные области тяжелой цепи и вариабельные области легкой цепи клонов антител 26.20, 26.14 и 26.82.
Фигура 7: DLL4-опосредуемая передача сигнала Notch регулирует пролиферацию ЭК. a-c, f: анализы на разрастание HUVEC в 3-мерных фибриновых гелях. Анти-DLL4-антитело (YW26.82) или DBZ стимулируют разрастание HUVECs (a). Ki67-окрашивание показало, что анти-DLL4-антитело или DBZ вызывают гиперпролиферацию HUVEC (b). Анти-DLL4-антитело или DBZ повышают уровень разрастания HUVEC в присутствии SF-кондиционированной среды (c). d, h: Системная доставка анти-DLL4-антитела вызывает массивную аккумуляцию ЭК в сетчатке новорожденных. Изображения сосудистой системы сетчатки, полученные на конфокальном микроскопе с небольшим увеличением (вверху) и с большим увеличением (внизу) (окрашивание изолектином). (d): Ki67-окрашивание указывало на увеличение уровня пролиферации ЭК в сетчатке новорожденных, обработанной анти-DLL4-антителом (h). e: активация Notch под действием иммобилизованного DLL4 приводила к ингибированию пролиферации HUVEC. f: Анти-VEGF-антитело ингибировало разрастание HUVEC в присутствии или в отсутствие DBZ. g: Регуляция VEGFR2 под действием Notch. Количественный ПЦР-анализ на экспрессию VEGFR2 в ответ на блокаду Notch в культуре клеток HUVEC в 3-мерном фибриновом геле (7 дней) под действием анти-DLL4-антитела или DBZ (слева) или активация Notch в культуре клеток HUVEC в 2-мерном геле (36 часов) под действием иммобилизованного DLL4 (справа). Анти-DLL4-антитело и DBZ использовали при 5 мкг/мл и 0,08 мкМ, соответственно (a-c, e-g).
Фигура 8: DLL4-опосредуемая передача сигнала Notch регулирует дифференцировку ЭК. a: Полость-подобные структуры (белые стрелки), образованные клетками HUVEC, растущими в фибриновых гелях, элиминировались в присутствии анти-DLL4-антитела или DBZ. Вместо этого эти разрастания были плотно упакованы клетками (черные стрелки). b: Регуляция TGFβ2 под действием Notch. Количественный ПЦР-анализ экспрессии TGFβ2 в ответ на блокаду Notch в культуре клеток HUVEC в 3-мерном фибриновом геле (7 дней) под действием анти-DLL4-антитела или DBZ (слева) или активация Notch в культуре клеток HUVEC в 2-мерном геле (36 часов) под действием иммобилизованного DLL4 (справа). c: Анти-DLL4-антитело блокирует развитие артерий. Изображения сетчатки, окрашенной альфа-актином гладкой мышцы (ASMA) и изолектином, полученные для новорожденной мыши на конфокальном микроскопе. Новорожденных мышей обрабатывали как показано на Фиг.1d. d: Изображения окрашенной ASMA и изолектином сетчатки, полученные на конфокальном микроскопе для взрослой мыши. 8-недельных мышей обрабатывали PBS или анти-DLL4-антителом (10 мг/кг, два раза в неделю) в течение двух недель.
Фигура 9: Селективное блокирование DLL4 и/или VEGF нарушает ангиогенез опухоли и ингибирует рост опухоли. a-f: Результаты, полученные для опухолевых моделей: HM7 (a), Colo205 (b), Calu6 (c), MDA-MB-435 (d), MV-522 (e) и WEHI3 (f). Представлен средний объем опухоли со среднеквадратической ошибкой. g-h: Гистологический анализ сосудов опухолей. Иммуногистохимический анализ на анти-CD31-антитела, проводимый на срезах опухолей EL4, взятых у контрольных мышей и у мышей, обработанных анти-DLL4-антителом и анти-VEGF-антителом (g): Перфузия лектина и окрашивание анти-CD31-антителом в срезах опухоли EL4 (h). i-p: Результаты, полученные для опухолевых моделей: SK-OV-3X1 (i), LL2 (j), EL4 (k), H1299 (l), SKMES-1(m), MX-1(n), SW620(o) и LS174T(p).
Фигура 10: DLL4/Notch не играет важной роли в гомеостазе мышиной тонкой кишки. Были проведены иммуногистохимические исследования тонкого кишечника, взятого у контрольных мышей (a, d, g, j), у мышей, обработанных анти-DLL4-антителом (10 мг/кг, два раза в неделю в течение 6 недель) (b, e, h, k), и у мышей, обработанных DBZ (30 мкмоль/кг ежедневно в течение 5 дней) (c, f, i, l). Как показало окрашивание H&E (a, b, c) и альциановым синим (d, e, f), DBZ вызывает замену популяции клеток TA бокаловидными клетками. Такое изменение полностью отсутствовало после обработки анти-DLL4-антителом. Окрашивание Ki67 (g, h, i) и HES-1 (j, k, l) дополнительно подтвердило, что анти-DLL4-антитело неспособно имитировать действие DBZ.
Фигура 11: Характеризация анти-DLL4-антитела. a: Картирование эпитопа моноклонального анти-DLL4-антитела (Mab) YW26.82. Схематическое представление набора мутантов DLL4, экспрессируемых в виде C-концевых гибридных белков щелочной фосфатазы (ЩФ) в человеческой плаценте. Среду, кондиционированную клетками 293T и содержащую гибридные белки, тестировали на 96-луночных микротитрационных планшетах, сенсибилизированных очищенным анти-DLL4-антителом (YW26.82, 0,5 мкг/мл). Связанный DLL4.AP детектировали с использованием 1-Step PNPP (Pierce) в качестве субстрата и измеряли оптическую плотность (OD) на 405 нм. b-d: Селективное связывание YW26.82 с DLL4. 96-луночные планшеты Nunc MaxiSorp™ покрывали очищенными рекомбинантными белками, как указано выше (1 мкг/мл). Связывание YW26.82 в указанных концентрациях измеряли с помощью ELISA-анализа. Связанные антитела детектировали с помощью конъюгата «античеловеческое антитело - ПХ» с использованием TMB в качестве субстрата и измеряли оптическую плотность (OD) на 405 нм. В качестве аналитического контроля использовали анти-HER2-антитело и рекомбинантный ErbB2-ECD (b). FACS-анализ клеток 293, временно трансфецированных вектором, полноразмерным DLL4, Jag1 или DLL1. Значительный уровень связывания YW26.82 детектировался только на DLL4-трансфецированных клетках (верхняя панель). Экспрессию Jag1 и DLL1 подтверждали путем связывания рекомбинантного крысиного Notch1-Fc (rrNotch1-Fc, средняя панель) и рекомбинантного крысиного Notch2-Fc (rrNotch2-Fc, нижняя панель) соответственно. YW26.82, rrNotch1-Fc или rrNotch2-Fc (систему R& D) использовали в концентрации 2 мкг/мл, затем использовали козье антитело против человеческого IgG, конъюгированное с ФЭ (1:500, Jackson ImmunoResearch) (c). Анти-DLL4-антитело блокировало связывание DLL4-AP, но не DLL1-AP, с нанесенным rNotch1, при вычисленной IC50 ~12 нМ (левая панель). Анти-DLL4-антитело блокировало связывание DLL4-His, но не Jag1-His, с нанесенным rNotch1, при вычисленной IC50 ~8 нМ (правая панель) (d). e: Специфическое связывание YW26.82 с эндогенно экспрессируемым DLL4. FACS-анализ HUVEC, трансфецированных контрольной или DLL4-специфической киРНК. YW26.82 использовали при 2 мкг/мл, затем использовали козье антитело против человеческого IgG, конъюгированное с ФЭ (1:500, Jackson ImmunoResearch) (e).
Фигура 12: Позитивная регуляция DLL4 посредством активации Notch. HUVEC стимулировали иммобилизованным C-концевым His-меченным человеческим DLL4 (аминокислоты 1-404) в отсутствие или в присутствии DBZ (0,08 мкM). Через 36 часов после стимуляции эндогенную экспрессию DLL4 оценивали с помощью FACS-анализа, проводимого с использованием анти-DLL4-антитела.
Подробное описание изобретения
Настоящее изобретение относится к анти-DLL4-антителам, которые могут быть использованы, например, для лечения или предупреждения патологических состояний, ассоциированных с экспрессией и/или активностью DLL4, например с повышенной экспрессией и/или активностью или с нежелательной и/или активностью DLL4. В некоторых вариантах изобретения антитела согласно изобретению используются для лечения опухоли, рака и/или клеточно-пролиферативного расстройства. В некоторых вариантах изобретения антитела согласно изобретению используются для лечения патологического состояния, ассоциированного с ангиогенезом.
В другом аспекте изобретения анти-DLL4-антитела согласно изобретению могут быть использованы в качестве реагентов для детектирования и/или выделения DLL4, например для детектирования DLL4 в тканях и клетках различных типов.
Настоящее изобретение также относится к способам получения анти-DLL4-антител и полинуклеотидов, кодирующих анти-DLL4-антитела.
Общие методы
Описанные или цитируемые здесь методы и процедуры, по существу, хорошо известны специалистам и обычно применяются в соответствии со стандартной методикой, известной специалистам, например с широко применяемой методикой, описанной в руководствах Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel, et al. eds., (2003)); the series METHODS IN ENZYMOLOGY (Academic Press, Inc.): PCR 2: A PRACTICAL APPROACH (M. J. MacPherson, B. D. Hames и G. R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) ANTIBODIES, A LABORATORY MANUAL, and ANIMAL CELL CULTURE (R. I. Freshney, ed. (1987)).
Определения
“Выделенное” антитело представляет собой антитело, которое было идентифицировано и отделено от компонентов его природного окружения и/или выделено из таких компонентов. Примесными компонентами его природного окружения являются вещества, которые могут негативно влиять на диагностическое или терапевтическое применение указанного антитела, и такими веществами могут быть ферменты, гормоны и другие белковые или не-белковые растворенные вещества. В предпочтительных вариантах изобретения указанное антитело может быть очищено (1) более чем на 95% по массе антитела, как может быть определено методом Лаури, наиболее предпочтительно более чем на 99% по массе антитела, (2) до уровня, достаточного для продуцирования N-концевой или внутренней аминокислотной последовательности, состоящей, по меньшей мере, из 15 остатков, с использованием секвенатора с центрифужными чашками, или (3) до гомогенности, оцениваемой с помощью электрофореза в ПААГ-ДСН в восстанавливающих или в невосстанавливающих условиях с использованием кумасси синего или предпочтительно серебряного красителя. Выделенным антителом является антитело in situ в рекомбинантных клетках, поскольку в них отсутствует, по меньшей мере, один компонент природного окружения этого антитела. Аналогичным образом выделенным антителом является антитело в среде, окружающей рекомбинантные клетки. Однако обычно выделенное антитело может быть получено по меньшей мере в одну стадию очистки.
«Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которая была идентифицирована и отделена по меньшей мере от одной примесной молекулы нуклеиновой кислоты, с которой она обычно ассоциируется в природном источнике нуклеиновой кислоты, кодирующей антитело. Выделенная молекула нуклеиновой кислоты имеет форму или структуру, отличающиеся от формы или структуры природной молекулы. Следовательно, выделенные молекулы нуклеиновой кислоты отличаются от молекул нуклеиновой кислоты, присутствующих в природных клетках. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно экспрессируют антитело, где, например, молекула нуклеиновой кислоты присутствует в хромосоме в положении, отличающемся от положения этой нуклеиновой кислоты в природных клетках.
Используемый здесь термин “остаток вариабельного домена, пронумерованный по Кэбату” или “аминокислотное положение, пронумерованное по Кэбату” и их варианты, означает систему, используемую для нумерации вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи антител, описанной в справочнике по антителам Кэбата (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). В соответствии с этой системой нумерации фактическая первичная аминокислотная последовательность может содержать меньшее число или дополнительное число аминокислот, соответствующее укороченной или удлиненной FR- или CDR-области вариабельного домена. Так, например, вариабельный домен тяжелой цепи может включать инсерцию одной аминокислоты (остатка 52а в соответствии с нумерацией Кэбата) после остатка 52 Н2, и остатки (например, остатки 82а, 82b и 82с и т.п. в соответствии с нумерацией Кэбата), встроенные после остатка 82 FR тяжелой цепи. Нумерация остатков данного антитела по Кэбату может быть осуществлена после выравнивания его последовательности в областях гомологии со “стандартной” последовательностью, пронумерованной по Кэбату.
Используемые здесь термины “по существу, аналогичный” или “по существу, тот же самый” означают достаточно высокую степень сходства между двумя численными величинами (обычно между одной величиной, соответствующей антителу согласно изобретению, и другой величиной, соответствующей эталонному/сравниваемому антителу) именно, такую степень сходства, которая позволяла бы специалисту в данной области считать различие между этими двумя величинами несущественным или биологически и/или статистически незначимым в отношении их биологических свойств, определяемых указанными величинами (например, величинами Kd). Различия между указанными двумя величинами составляют предпочтительно менее чем примерно 50%, более предпочтительно менее чем примерно 40%, еще более предпочтительно менее чем примерно 30%, еще более предпочтительно менее чем примерно 20%, наиболее предпочтительно менее чем примерно 10% по сравнению с величинами эталонного/сравниваемого антитела.
Термин “аффинность связывания”, по существу, означает силу суммарных нековалентных взаимодействий одного сайта связывания молекулы (например, антитела) с его партнером по связыванию (например, с антигеном). Если это не оговорено особо, то используемый здесь термин “аффинность связывания” означает природную аффинность связывания, при которой происходит взаимодействие 1:1 между членами пар связывания (например, антитела с антигеном). Аффинность связывания молекулы Х с ее партнером Y, в общих чертах, может называться константой диссоциации (Kd). Аффинность может быть определена стандартными методами, известными специалистам, включая описанные здесь методы. Низкоаффинные антитела обычно связываются с антигеном с меньшей скоростью и имеют тенденцию легко диссоциироваться, тогда как высокоаффинные антитела обычно связываются с антигеном с большей скоростью и имеют тенденцию оставаться связанными в течение более длительного периода времени. Специалистам в данной области известны различные методы измерения аффинности связывания, и для осуществления настоящего изобретения может быть применен любой из этих методов. Конкретные репрезентативные варианты осуществления изобретения описаны ниже.
В одном из вариантов изобретения “Kd” или “величину Kd” согласно изобретению определяют с помощью анализа на связывание с радиоактивно меченным антигеном (РИА), осуществляемого с использованием Fab-варианта представляющего интерес антитела и его антигена, описанного ниже, где указанный анализ позволяет измерять аффинность связывания Fab с антигеном в растворе путем уравновешивания Fab минимальной концентрацией 125I-меченого антигена в присутствии титрационного набора немеченых антигенов, с последующей иммобилизацией связанного антигена на планшете, сенсибилизированном антителом против Fab-фрагмента (Chen et al. (1999) J. Mol. Biol. 293:865-881). В целях создания соответствующих условий для анализа микротитрационные планшеты (Dynex) сенсибилизируют в течение ночи 5 мкг/мл связывающего анти-Fab-антитела (Cappel Labs) в 50 мМ карбонате натрия (рН 9,6), затем блокируют 2%-ным (масс/об) альбумином бычьей сыворотки в PBS в течение 2-5 часов при комнатной температуре (приблизительно при 23°С). В неадсорбирующем планшете (Nunc # 269620), 100 пМ или 26 пМ 125I-антигена смешивают с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой анти-VEGF-антитела, Fab-12, Presta et al. (1997) Cancer Res. 57:4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи, однако для гарантии достижения равновесия инкубирование может быть проведено в течение более длительного периода времени (например, 65 часов). После этого смеси переносят в планшет для иммобилизации и инкубируют при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и планшет восемь раз промывают 0,1% Твином-20 в PBS. После сушки планшетов добавляют 150 мкл/лунку сцинтилляционной жидкости (MicroScintТМ-20; Packard), и планшеты подсчитывают на гамма-счетчике Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, которые составляют 20% или менее от максимального связывания, отбирают для их использования в анализах на конкурентное связывание. В соответствии с другим вариантом изобретения Kd или величину Kd измеряют в анализе методом поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С с использованием чипов СМ5 с иммобилизованным на них антигеном при величине единиц отклика (RU), составляющей ~10. Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ), затем инъецируют при скорости потока 5 мкл/мин до достижения величины единиц отклика (RU) связанного белка, составляющей ~10. После инъекции антигена, для блокирования непрореагировавших групп вводят 1М этаноламин. Для измерения кинетики реакции вводят инъекции двукратных серийных разведений Fab (0,78 нМ - 500 нМ) в PBS, содержащем 0,05% твина® 20 (PBSТ) при 25°С и при скорости потока приблизительно 25 мкл/мин. Скорость ассоциации (kon) и скорость диссоциации (koff) вычисляют с использованием простой лангмюровской модели связывания 1:1 (BIAcore Evaluation Software version 3.2) при одновременном построении сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Кd) вычисляют как отношение koff/kon. См., например, Chen, Y., et al. (1999) J. Mol. Biol. 293:865-881. Если скорость ассоциации превышает 106 М-1 · с-1, как было определено выше методом поверхностного плазмонного резонанса, то такая скорость ассоциации может быть определена методом гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ антитела против антигена (в Fab-форме) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, как было измерено на спектрометре, таком как спектрофотометр, снабженный ограничителем потока (Aviv Instrumtnts), или на спектрофотометре SLM-Aminco серии 8000 (ThermoSpectronic), снабженном кюветой для перемешивания, содержащей красный краситель.
“Скорость ассоциации” или “kon” согласно изобретению может быть также определена описанным выше методом поверхностного плазмонного резонанса с использованием BIAcoreTM-2000 или BIAcoreTM-3000 (BIAcore, Inc., Piscataway, NJ) при 25°С и с использованием чипов СМ5 с иммобилизованным на них антигеном при величине единиц отклика (RU), составляющей ~10. Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Антиген разводят 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (~0,2 мкМ), затем инъецируют при скорости потока 5 мкл/мин до достижения величины единиц отклика (RU) связанного белка, составляющей ~10. После инъекции антигена, для блокирования непрореагировавших групп вводят 1М этаноламин. Для измерения кинетики реакции инъецируют двукратные серийные разведения Fab (0,78 нМ-500 нМ) в PBS, содержащем 0,05% твина® 20 (PBSТ) при 25°С и при скорости потока приблизительно 25 мкл/мин. Скорость ассоциации (kon) и скорости диссоциации (koff) вычисляют с использованием простой лангмюровской модели связывания 1:1 (BIAcore Evaluation Software version 3.2) при одновременном построении сенсорограмм ассоциации и диссоциации. Константу равновесной диссоциации (Кd) вычисляют как отношение koff/kon. См., например, Chen, Y., et al. (1999) J. Mol. Biol. 293:865-881. Однако если скорость ассоциации превышает 106 М-1·с-1, как было определено выше с помощью анализа методом поверхностного плазмонного резонанса, то такую скорость ассоциации предпочтительно определяют методом гашения флуоресценции, который позволяет измерять увеличение или уменьшение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, полоса пропускания 16 нм) при 25°С для 20 нМ антитела против антигена (в Fab-форме) в PBS, рН 7,2, в присутствии возрастающих концентраций антигена, измеренных на спектрометре, таком как спектрофотометр, снабженный ограничителем потока (Aviv Instrumеtnts), или на спектрофотометре SLM-Aminco серии 8000 (ThermoSpectronic), снабженном кюветой для перемешивания.
Используемый здесь термин “вектор” означает молекулу нуклеиновой кислоты, способную переносить другую нуклеиновую кислоту, к которой она присоединена. Одним типом векторов является “плазмида”, представляющая собой кольцевую двухцепочечную ДНК-петлю, с которой могут быть лигированы дополнительные ДНК-сегменты. Другим типом вектора является фаговый вектор. Еще одним типом вектора является вирусный вектор, в котором дополнительные ДНК-сегменты могут быть лигированы с вирусным геномом. Некоторые векторы способны автономно реплицироваться в клетке-хозяине, в которую они были введены (например, бактериальные векторы, имеющие бактериальный ориджин репликации, и эписомные векторы млекопитающих). Другие векторы (например, не-эписомные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина после их введения в указанную клетку-хозяина, в результате чего они могут реплицироваться вместе с геномом хозяина. Кроме того, некоторые векторы способны регулировать экспрессию генов, к которым они были функционально присоединены. Такие векторы называются здесь “рекомбинантными экспрессионными векторами” (или просто “рекомбинантными векторами”). В общих чертах, экспрессионные векторы, обычно применяемые в методах рекомбинантных ДНК, часто имеют форму плазмид. В настоящем описании термины “плазмида” и “вектор” могут быть взаимозаменяемыми, поскольку плазмида является наиболее распространенной формой вектора.
Используемые здесь термины “полинуклеотид” или “нуклеиновая кислота” являются взаимозаменяемыми и означают полимеры любой длины, состоящие из нуклеотидов, и такими полимерами являются ДНК и РНК. Нуклеотидами могут быть дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть включен в полимер посредством ДНК- или РНК-полимеразы, либо посредством реакции синтеза. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. Если это необходимо, то модификация нуклеотидной структуры может быть осуществлена до или после сборки полимера. Нуклеотидные последовательности могут прерываться не-нуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после синтеза, например путем его конъюгирования с меткой. Модификациями других типов являются, например, “кэпы”; замена одного или нескольких природных нуклеотидов их аналогами; межнуклеотидные модификации, такие как, например, модификации путем введения незаряженных связей (например, метилфосфонатов, фосфотриэфиров, фосфоамидатов, карбаматов и т.п.) и заряженных связей (например, фосфортиоатов, фосфордитиоатов и т.п.); модификации, содержащие боковые группы, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин, и т.п.); модификации, содержащие интеркалирующие агенты (например, акридин, псорален и т.п.); модификации, содержащие хелатообразующие агенты (например, металлы, радиоактивные металлы, бор, металлы-окислители и т.п.); модификации, содержащие алкилирующие агенты; модификации, содержащие модифицированные связи (например, альфа-аномерные нуклеиновые кислоты и т.п.), также немодифицированные формы полинуклеотида(ов). Кроме того, любые гидроксильные группы, обычно присутствующие в сахарах, могут быть заменены, например, фосфонатными группами и фосфатными группами; защищены стандартными защитными группами; или активированы с образованием дополнительных связей с дополнительными нуклеотидами; либо они могут быть конъюгированы с твердыми или полутвердыми носителями. 5'- и 3'-концевые ОН могут быть фосфорилированы или замещены аминами или органическими “кэпирующими” группами, состоящими из 1-20 атомов углерода. Другие гидроксилы могут быть также дериватизированы стандартными защитными группами. Полинуклеотиды могут также содержать аналогичные формы сахаров, таких как рибоза или дезоксирибоза, известных специалистам, включая, например, 2'-О-метил-рибозу-2'-О-аллилрибозу; 2'-фтор- или 2'-азидорибозу; карбоциклические аналоги сахаров; альфа-аномерные сахара; эпимерные сахара, такие как арабиноза, ксилоза или ликсоза; сахар пиранозу, сахар фуранозу; седогептулозу; ациклические аналоги и основные нуклеозидные аналоги, такие как метилрибозид. Одна или несколько фосфодиэфирных связей могут быть заменены альтернативными линкерными группами. Такими альтернативными линкерными группами являются, но не ограничиваются ими, варианты, в которых фосфат заменен Р(О)S (“тиоат”), Р(S)S (“дитиоат”), (О)NR2 (“амидат”), Р(О)R, Р(О)ОR', СО или СН2 (“формацеталь”), где каждый из R или R' независимо представляет собой Н или замещенный или незамещенный алкил (С1-20), необязательно содержащий эфирную связь (-О-), арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все связи в полинуклеотиде должны быть идентичными. Вышеприведенное описание относится ко всем используемым здесь полинуклеотидам, включая РНК и ДНК.
Используемый здесь термин “олигонуклеотид”, в общих чертах, означает короткие, в основном, одноцепочечные, обычно синтетические полинуклеотиды, длина которых составляет, главным образом, но необязательно, менее чем примерно 200 нуклеотидов. Термины “олигонуклеотид” и “полинуклеотид” не являются взаимоисключающими. Вышепривиденное описание полинуклеотидов может в равной степени и полностью относиться к олигонуклеотидам.
“Процент (%) идентичности аминокислотных последовательностей” пептидов или полипептидов определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в конкретной пептидной или полипептидной последовательности, после выравнивания этих последовательностей и введения в них “пробелов”, если это необходимо, для достижения максимального процента идентичности последовательностей, причем какие-либо консервативные замены не рассматриваются как часть идентичных последовательностей. Выравнивание, осуществляемое в целях определения процента идентичности аминокислотных последовательностей, может быть проведено различными методами, известными специалистам, например, с использованием общедоступных компьютерных программ, таких как программы BLAST, BLAST-2, ALIGN или MеgAlign (DNASTAR). Специалист в данной области может самостоятельно определить соответствующие параметры выравнивания, включая использование любых алгоритмов, необходимых для достижения оптимального выравнивания по всей длине сравниваемых последовательностей. Однако в целях настоящего изобретения % идентичности аминокислотных последовательностей вычисляют с применением компьютерных программ ALIGN-2, используемой для сравнения последовательностей. Компьютерная программа ALIGN-2, предназначенная для сравнения последовательностей, была разработана фирмой Genentech, Inc. и указанный исходный код был зарегистрирован в документации для пользователей в Ведомстве по копирайту США, Вашингтон, D.C., 20559, под регистрационным номером U.S. Copyright Registration № TXU510087. Программа ALIGN-2 является общедоступной программой, поставляемой фирмой Genentech, Inc., South San Francisco, California. Программа ALIGN-2 должна быть составлена для применения в операционной системе UNIX, предпочтительно в цифровой системе UNIX V4.0D. Все параметры сравнения последовательностей были установлены в программе ALIGN-2 и не изменялись.
В случае если для сравнения аминокислотных последовательностей используется программа ALIGN-2, то % идентичности данной аминокислотной последовательности А с данной аминокислотной последовательностью В (которая альтернативно может быть названа данной аминокислотной последовательностью А, имеющей или составляющей определенный % идентичности с данной аминокислотной последовательностью В) вычисляют следующим образом:
100·Х/Y,
где Х представляет собой число аминокислотных остатков, которые были оценены как полностью соответствующие при выравнивании последовательностей с использованием программы ALIGN-2, с помощью которой проводили сравнение последовательностей А и В, и где Y представляет собой полное число аминокислотных остатков в последовательности В. При этом следует отметить, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то % идентичности аминокислотной последовательности А аминокислотной последовательности В не равен % идентичности аминокислотной последовательности В аминокислотной последовательности А.
Если это не оговорено особо, то общий % идентичности используемых здесь аминокислотных последовательностей вычисляли как описано в предыдущем параграфе с использованием компьютерной программы ALIGN-2.
Используемый здесь термин «DLL4» (который является синонимом термину «дельта-подобный 4”), означает, если это не оговорено особо или не следует из контекста изобретения, любой нативный или модифицированный (природный или синтетический) полипептид DLL4. Термин «нативная последовательность», в частности, охватывает природные усеченные или секретированные формы (например, последовательность внеклеточного домена), природные варианты (например, альтернативно сплайсированные формы) и природные аллельные варианты. Термин «DLL4 дикого типа», в основном, означает полипептид, содержащий аминокислотную последовательность природного белка DLL4. Термин «последовательность DLL4 дикого типа”, в основном, означает аминокислотную последовательность, присутствующую в природном DLL4.
Используемый здесь термин «рецептор Notch» (который является синонимом термину «Notch»), означает, если это не оговорено особо или не следует из контекста изобретения, любой нативный или модифицированный (природный или синтетический) полипептид рецептора Notch. У человека присутствует четыре рецептора Notch (Notch1, Notch2, Notch3 и Notch4). Используемый здесь термин «рецептор Notch» включает любой один или все четыре человеческих рецептора Notch. Термин «нативная последовательность», в частности, охватывает природные усеченные или секретированные формы (например, последовательность внеклеточного домена), природные варианты (например, альтернативно сплайсированные формы) и природные аллельные варианты. Термин «рецептор Notch дикого типа», в основном, означает полипептид, содержащий аминокислотную последовательность природного белка рецептора Notch. Термин «последовательность рецептора Notch дикого типа”, в основном, означает аминокислотную последовательность, присутствующую в природном рецепторе Notch.
Используемые здесь термины «антитело» и «иммуноглобулин» являются синонимами, употребляемыми в самом широком смысле, и включают моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела, мультиспецифические антитела (например, биспецифические антитела, при условии, что они обладают нужной биологической активностью), также могут включать некоторые фрагменты антител (более подробно описанные ниже). Антитело может быть человеческим, гуманизованным и/или аффинно зрелым.
Термин “вариабельный” относится к некоторым частям вариабельных доменов, которые имеют значительные отличия в последовательностях различных антител и участвуют в связывании каждого конкретного антитела с его конкретным антигеном, также определяют специфичность каждого конкретного антитела по отношению к его конкретному антигену. Однако вариабельность неравномерно распределяется по всем вариабельным доменам антител. Она концентрируется в трех сегментах, называемых комплементарность-определяющими областями (СDR) или гипервариабельными областями (HVR), присутствующими в вариабельных доменах как легкой, так и тяжелой цепи. Наиболее высококонсервативные части вариабельных доменов называются каркасными областями (FR). Каждый вариабельный домен нативной тяжелой и легкой цепей содержит четыре FR, имеющих, главным образом, β-складчатую конфигурацию и соединенных тремя СDR, которые образуют петли, соединяющие, в некоторых случаях, образующие часть β-складчатой структуры. Гипервариабельные области (СDR) в каждой цепи удерживаются в непосредственной близости друг от друга посредством FR, и, вместе СDR другой цепи, участвуют в образовании антигенсвязывающего сайта антител (см. Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, National Institutes of Health, Bethesda, MD (1991)). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но обладают различными эффекторными функциями, такими как участие антитела в антитело-зависимой клеточной цитотоксичности.
Гидролиз антител папаином приводит к продуцированию двух идентичных антигенсвязывающих фрагментов, называемых Fab-фрагментами, каждый из которых имеет один антигенсвязывающий сайт, и другого Fc-фрагмента, обозначение которого указывает на его способность к быстрой кристаллизации. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который имеет два антигенсвязывающих сайта и обладает способностью перекрестно связываться с антигеном.
«Fv» представляет собой минимальный фрагмент антитела, содержащий полноразмерный сайт распознавания антигена и антигенсвязывающий сайт антитела. В двухцепочечном Fv эта область состоит из димера, который включает один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи, жестко связанные нековалентной связью. В одноцепочечном Fv один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи может быть ковалентно связан гибким пептидным линкером, в результате чего легкая и тяжелая цепи могут ассоциироваться друг с другом с образованием «димерной» структуры, аналогичной структуре двухцепочечного Fv. Он имеет такую конфигурацию, при которой три CDR каждого вариабельного домена взаимодействуют друг с другом и определяют антигенсвязывающий сайт на поверхности димера VН-VL. В целом, шесть CDR сообщают данному антителу антигенсвязывающую специфичность. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных к антигену) может обладать способностью распознавать антиген и связываться с этим антигеном, хотя, возможно, с более низкой аффинностью, чем полный сайт связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов несколькими остатками, присоединенными у карбокси-конца домена СН1 тяжелой цепи, включая один или несколько цистеинов от шарнирной области антитела. Fab'-SH представляет собой Fab', в котором цистеиновый(е) остаток(тки) константных доменов имеют свободную тиоловую группу. По своей природе F(ab')2-фрагменты антитела продуцируются как пары Fab'-фрагментов, которые связаны между собой шарнирными цистеиновыми остатками. Известны также и другие химические связи фрагментов антител.
«Легкие цепи» антител (иммуноглобулинов), происходящих от позвоночных любого вида, могут быть отнесены к одному из двух абсолютно различных типов цепей, называемых каппа (k) и лямбда (λ), исходя из аминокислотных последовательностей их константных доменов.
Иммуноглобулины в зависимости от аминокислотной последовательности константного домена их тяжелых цепей могут быть отнесены к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть также разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие иммуноглобулинам различных классов, обозначаются α, δ, ε, γ и μ соответственно. Субъединичные структуры и трехмерные конфигурации иммуноглобулинов различных классов хорошо известны специалистам.
«Фрагменты антител» содержат только часть интактного антитела, где указанная часть, если она присутствует в интактном антителе, предпочтительно сохраняет, по меньшей мере, одну функцию, предпочтительно большинство функций или все функции, обычно присущие такой части природного интактного антитела. Примерами фрагментов антител являются Fab-, Fab'-, F(ab')2- и Fv-фрагменты; диантитела; линейные антитела; молекулы одноцепочечных антител; и мультиспецифические антитела, образованные из фрагментов антител. В одном из вариантов изобретения фрагмент антитела содержит антигенсвязывающий сайт интактного антитела, поэтому он сохраняет свою способность связываться с антигеном. В другом варианте изобретения фрагмент антитела, например фрагмент, содержащий Fc-область, если он присутствует в интактной антителе, сохраняет, по меньшей мере, одну из биологических функций, обычно присущих Fc-области интактного антитела, таких как связывание с FcRn, способность модулировать время полужизни антитела, ADCC-функция и связывание с комплементом. В одном из вариантов изобретения фрагментом антитела является одновалентное антитело, которое имеет время полужизни in vivo, в основном, аналогичное времени полужизни интактного антитела. Так, например, такой фрагмент антитела может содержать антигенсвязывающую область, присоединенную к последовательности Fc и способную сообщать указанному фрагменту стабильность in vivo.
Используемые здесь термины “гипервариабельная область”, “HVR” или “HV” означают области вариабельного домена антитела, которые являются в данной последовательности гипервариабельными и/или образуют петли определенной структуры. В общих чертах, указанные антитела содержат шесть гипервариабельных областей; три области в VH (Н1, Н2, Н3) и три области в VL (L1, L2, L3). В настоящей заявке используется ряд гипервариабельных областей, который входит в объем настоящего изобретения. Гипервариабельные области (комплементарность-определяющие области (CDR)) по Кэбату обладают высокой степенью вариабельности последовательности и находят наиболее частое применение (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed., Public Health Service, National Institutes of Health, Bethesda, MD. (1991)). Вместо определения гипервариабельных областей по Кэбату Чотия предложил определять гипервариабельные области по локализации структурных петель (Chothia & Lesk, J. Mol.Biol. 196:901-917 (1987)). Определение гипервариабельных областей AbМ представляет собой компромисс между “CDR” по Кэбату и “структурными петлями” по Чотия, и такие определения используются в компьютерной программе по моделированию антител Oxford Molecular's AbМ. “Контактные” гипервариабельные области определяют исходя из анализа имеющихся сложных кристаллических структур. Остатки каждой из этих гипервариабельных областей приводятся ниже:
Термин “гипервариабельные области” может включать “удлиненные гипервариабельные области”, именно: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 (L3) в VL; и 26-35 (Н1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н3) в VH. Остатки вариабельных доменов для каждого из указанных определений пронумерованы по Кэбату и др., см. выше.
“Каркасными” или “FR” остатками являются остатки вариабельных доменов, за исключением остатков гипервариабельных областей, определенных выше.
Используемый здесь термин «моноклональное антитело» означает антитело, происходящее от популяции, в основном, гомогенных антител, то есть отдельные антитела, входящие в такую популяцию, являются идентичными и/или связываются с одним и тем же (одними и теми же) эпитопом(ами), за исключением возможных вариантов, которые могут образовываться в процессе продуцирования моноклонального антитела, где указанные варианты, в основном, присутствуют в незначительных количествах. Таким моноклональным антителом обычно является антитело, содержащее полипептидную последовательность, связывающуюся с мишенью, где указанную связывающуюся с мишенью полипептидную последовательность получают способом, который включает отбор одной связывающейся с мишенью полипептидной последовательности из множества полипептидных последовательностей. Так, например, такой способ отбора может представлять собой отбор уникального клона из множества клонов, таких как пул гибридомных клонов, фаговых клонов или рекомбинантных ДНК-клонов. При этом следует отметить, что выбранная связывающаяся с мишенью последовательность может быть также модифицирована, например, для повышения аффинности к мишени, для гуманизации связывающейся с мишенью последовательности, для улучшения ее продуцирования в клеточной культуре, для снижения ее иммуногенности in vivo, для создания мультиспецифического антитела и т.п., и что указанное антитело, содержащее модифицированную мишень-связывающую последовательность, также представляет собой моноклональное антитело согласно изобретению. В отличие от препаратов поликлональных антител, которыми обычно являются различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против одной детерминанты на антигене. Препараты моноклональных антител, помимо их специфичности, обладают и другими преимуществами, то есть они обычно не содержат других примесных иммуноглобулинов. Термин «моноклональный» определяет характер антитела, полученного, в основном, из гомогенной популяции антител, но не означает, что это антитело должно быть продуцировано каким-либо конкретным методом. Так, например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены различными методами, включая, например, гибридомный метод (например, Kohler et al., Nature, 256:495 (1975); Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681, (Elsevier, N.Y., 1981)), методы рекомбинантных ДНК (см., например, патент США № 4816567), технологии фагового представления (см., например, Clackson et al., Nature, 352:624-628 (1991); Marks et al., J. Mol. Biol., 222:581-597 (1991); Sidhu et al., J. Mol. Biol. 338(2):299-310 (2004); Lee et al., J.Mol.Biol.340(5):1073-1093 (2004); Fellouse, Proc. Nat. Acad. Sci. USA 101(34):12467-12472 (2004); и Lee et al. J. Immunol. Methods 284(1-2):119-132 (2004), и методы продуцирования человеческих или гуманизованных антител у животных, которые имеют части или все локусы человеческого иммуноглобулина или гены, кодирующие последовательности человеческого иммуноглобулина (см., например, WO 1998/24893; WO 1996/34096; WO 1996/33735; WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al., Year in Immuno., 7:33 (1993); патенты США № 5545806; 5569825; 5591669 (все от GenPharm); 5545807; WO 1997/17852; патенты США № 5545807; 5545806; 5569825; 5625126; 5633425 и 5661016; Marks et al., Bio/Technology, 10: 779-783 (1992); Lonberg et al., Nature, 368: 856-859 (1994); Morrison, Nature, 368: 812-813 (1994); Fishwild et al., Nature Biotechnology, 14: 845-851 (1996); Neuberger, Nature Biotechnology, 14: 826 (1996); and Lonberg and Huszar, Intern. Rev. Immunol., 13: 65-93 (1995).
«Гуманизованные» формы не-человеческих антител (например, мышиных антител) представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую от не-человеческого иммуноглобулина. По большей части гуманизованные антитела представляют собой человеческие иммуноглобулины (антитело реципиента), в которых остатки, происходящие от гипервариабельной области данного антитела-реципиента, заменены остатками, происходящими от гипервариабельной области не-человеческого антитела (донорного антитела), такого как мышиное антитело, крысиное антитело, кроличье антитело или антитело приматов, не являющихся человеком, где указанные антитела обладают нужной специфичностью, аффинностью и связывающей способностью. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина заменены соответствующими не-человеческими остатками. Кроме того, гуманизованные антитела могут содержать остатки, не обнаруженные в антителе реципиента или в антителе донора. Эти модификации вводят для улучшения свойств антитела. В общих чертах, гуманизованное антитело может содержать, в основном, все или по меньшей мере один, обычно два вариабельных домена, в которых все или почти все гипервариабельные петли соответствуют гипервариабельным петлям не-человеческого иммуноглобулина, и все или почти все FR представляют собой FR с последовательностью человеческого иммуноглобулина. Гуманизованное антитело также содержит, но необязательно, по меньшей мере часть константной области иммуноглобулина (Fc), обычно области человеческого иммуноглобулина. Более подробное описание см. у Jones et al. Nature, 321:522-525 (1986); Riechmann et al. Nature 332:323-329 (1998) и у Presta Curr. Op. Struct. Biol., 2:593-596 (1992). См. также нижеследующие обзорные статьи и цитируемые там работы: Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994).
«Химерные антитела» (иммуноглобулины) имеют часть тяжелой и/или легкой цепи, идентичную или гомологичную соответствующим последовательностям антител, происходящих от конкретного вида или принадлежащих к конкретному классу или подклассу, остальная(ые) цепь(и) идентична(ы) или гомологична(ы) соответствующим последовательностям антител, происходящих от другого вида или принадлежащих к другому классу или подклассу антител, также от фрагментов таких антител, при условии, что они обладают нужной биологической активностью (патент США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Используемое здесь гуманизованное антитело представляет собой подпоследовательность химерных антител.
«Одноцепочечный Fv-фрагмент» или «scFv-фрагмент» антител включает домены VH и VL антитела, где указанные домены присутствуют в одной полипептидной цепи. Обычно полипептид scFv также содержит между доменами VH и VL полипептидный линкер, который обеспечивает образование scFv со структурой, необходимой для связывания с антигеном. Описание scFv можно найти в работе Pluckthun «The Pharmacology of Monoclonal Antibodies», vol. 113, Rosenburg & Moore eds., Springer-Verlag, New York, pp.269-315 (1994).
Термин «антиген» означает предварительно определенный антиген, с которым может селективно связываться антитело. Антигеном-мишенью может быть полипептид, углевод, нуклеиновая кислота, липид, гаптен или другое природное или синтетическое соединение. Предпочтительным антигеном-мишенью является полипептид.
Термин “диантитела” означает небольшие фрагменты антител с двумя антигенсвязывающими сайтами, где указанные фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL). Если линкер является слишком коротким для образования пары между двумя доменами на одной и той же цепи, то домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих сайта. Диантитела более подробно описаны, например, в ЕР 404097; в WO 93/11161 и у Hollinger et al. Proc. Natl. Acad. Sci., USA, 90:6444-6448 (1993).
«Человеческое антитело» представляет собой антитело, имеющее аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, продуцируемого у человека и/или полученного любыми описанными здесь методами конструирования человеческих антител. Такое определение человеческого антитела, в частности, исключает гуманизованное антитело, содержащее не-человеческие антигенсвязывающие остатки.
«Аффинно зрелое» антитело представляет собой антитело, имеющее одну или несколько модификаций в одной или нескольких CDR, что позволяет повышать аффинность данного антитела к антигену, по сравнению с родительским антителом, не имеющим такой(их) модификации(й). Предпочтительные аффинно зрелые антитела имеют наномолярные или даже пикомолярные аффинности по отношению к антигену-мишени. Аффинно зрелые антитела получают известными методами. В публикации Marks и др. (Bio/Technology 10:779-783 (1992) описано созревание аффинности в результате перестановки доменов VH и VL. Неспецифический мутагенез CDR и/или каркасных остатков описан в публикациях Barbas et al., Proc. Natl. Acad. Sci., USA, 91:3809-3813 (1994); Schier et al., Gene 169:147-155 (1995); Yelton et al., J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995) и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
Термин «эффекторные функции» антител означает биологические активности, присущие Fc-области (Fc-области нативной последовательности или Fc-области варианта аминокислотной последовательности) антитела и варьирующиеся в зависимости от изотипа антитела. Примерами эффекторых функций антитела являются связывание с С1q и комплемент-зависимая цитотоксичность; связывание с Fc-рецептором; антитело-зависимая клеточно-опосредованная цитотоксичность (ADCC); фагоцитоз; негативная регуляция рецепторов клеточной поверхности (например, В-клеточного рецептора); и активация В-клеток.
“Антитело-зависимая клеточно-опосредованная цитотоксичность” или “ADCC” означает форму цитотоксичности, при которой секретированный Ig, связанный с Fc-рецепторами (FcR), присутствующими на некоторых цитотоксических клетках (например, природных клетках-киллерах (NK), нейтрофилах и макрофагах), позволяет этим цитотоксическим эффекторым клеткам специфически связываться с антигенсодержащими клетками-мишенями и вызывать гибель клеток-мишеней под действием цитотоксинов. Эти антитела «вооружают» цитотоксические клетки и являются абсолютно необходимыми для такого цитолиза. Первичные клетки, опосредующие ADCC, то есть NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные, полученные для экспрессии FcR на гемопоэтических клетках, систематизированы в таблице 3 на странице 464 Ravetch & Kinet Annu. Rev. Immunol. (1991) 9:457-92. Для оценки ADCC-активности представляющей интерес молекулы может быть проведен анализ на ADCC in vitro, такой как анализ, описанный в патентах США №№ 5500362 или 5821337, или Presta, в патенте США № 6737056. Эффекторными клетками, подходящими для таких анализов, являются мононуклеарные клетки периферической крови (МКПК) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы может быть оценена in vivo, например, на модели животного, такой как модель, описанная Clynes et al., Proc. Natl. Acad. Sci., USA, 95:652-656 (1998).
«Человеческие эффекторные клетки» представляют собой лейкоциты, которые экспрессируют один или несколько FcR и осуществляют эффекторные функции. Предпочтительно такие клетки экспрессируют по меньшей мере FcγRIII и осуществляют эффекторную ADCC-функцию. Примерами человеческих лейкоцитов, опосредующих ADCC, являются мононуклеарные клетки периферической крови (МКПК), природные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы, при этом предпочтительными являются МКПК и NK. Эффекторные клетки могут быть выделены из природного источника, например из крови.
Термины «Fc-рецептор» или «FcR» используются для описания рецептора, который связывается с Fc-областью антитела. Предпочтительным FcR является человеческий FcR с нативной последовательностью. Кроме того, предпочтительным FcR является FcR, который связывается с антителом IgG (гамма-рецептор), и рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторами FcγRII являются FcγRIIA (“активирующий рецептор”) и FcγRIIB (“ингибирующий рецептор”), которые имеют аналогичные аминокислотные последовательности, отличающиеся, главным образом, своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене активирующий мотив иммунорецептора на основе тирозина (ITAM). Ингибирующий рецептор FcγRIIB содержит в своем цитоплазматическом домене ингибирующий мотив иммунорецептора на основе тирозина (ITIM). (см. обзор М. Daeron, Annu. Rev. Immunol., 15:203-234 (1997)). FcR описаны в публикациях Ravetch & Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods, 4:25-34 (1994) и de Haas et al., J. Lab. Clin. Med., 126:330-41 (1995). Используемый здесь термин “FcR” также охватывает и другие FcR, включая FcR, которые будут идентифицированы в будущем. Этот термин также включает рецептор, имеющийся у новорожденных, FcRn, который является ответственным за передачу материнских IgG плоду (Guyer et al., J. Immunol., 117:587 (1976) и Kim et al., J. Immunol., 24:249 (1994)), и регулирует гомеостаз иммуноглобулинов. В WO 00/42072 (Presta) описаны варианты антител с повышенным или пониженным уровнем связывания с FcR. Содержание данной патентной публикации конкретно вводится в настоящее описание посредством ссылки. См., также Shields et al. J. Biol. Chem. 9(2): 6591-6604 (2001).
Методы измерения уровня связывания с FcRn известны специалистам (см., например, Ghetie 1997, Hinton, 2004). Связывание с человеческим FcRn in vivo и время полужизни полипептидов, обладающих высокой аффинностью связывания с человеческим FcRn, в сыворотке, могут быть оценены, например, у трансгенных мышей или в трансфецированных человеческих клеточных линиях, экспрессирующий человеческий FcRn, или у приматов, которым были введены варианты полипептидов Fc.
“Комплемент-зависимая цитотоксичность” или “CDС” означает лизис клеток-мишеней в присутствии комплемента. Классический путь активации комплемента инициируется связыванием первого компонента системы комплемента (С1q) с антителами (соответствующего подкласса), которые связываются с их когнатным антигеном. Для оценки активации комплемента может быть проведен анализ на CDС, например, как описано Gazzano-Santoro et al., J. Immunol. Methods, 202:163 (1996).
Полипептидные варианты, имеющие модифицированные аминокислотные последовательности Fc-области и обладающие повышенной или пониженной способностью связываться с C1q, описаны в патенте США № 6194551B1 и в WO 99/51642. Содержание этих патентных публикаций конкретно вводится в настоящее описание посредством ссылки. См. также Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
Термин «полипептид, содержащий Fc-область» означает полипептид, такой как антитело или иммуноадгезин (определение см. ниже), которые содержат Fc-область. C-концевой лизин (остаток 447 в соответствии с Европейской системой нумерации EU) Fc-области может быть удален, например, в процессе очистки полипептида или путем рекомбинантного конструирования нуклеиновой кислоты, кодирующей данный полипептид. В соответствии с этим композиция, содержащая полипептид, имеющий Fc-область согласно изобретению, может содержать полипептиды с остатком K447; полипептиды, где все K447 были удалены; или смесь полипептидов, содержащих и не содержащих остаток K447.
“Блокирующее” антитело или “антитело-антагонист” представляет собой антитело, ингибирующее или снижающее биологическую активность антигена, с которым оно связывается. Предпочтительные блокирующие антитела или антитела-антагонисты, в основном, или полностью ингибируют биологическую активность антигена.
Используемый здесь термин “антитело-агонист” означает антитело, которое имитирует по меньшей мере одну из функциональных активностей представляющего интерес полипептида.
«Акцептораная человеческая каркасная область», используемая в целях настоящего изобретения, представляет собой каркасную область, содержащую аминокислотную последовательность каркасной области VL или VH, происходящей от каркасной области человеческого иммуноглобулина или от консенсусной каркасной области человеческого иммуноглобулина. Акцепторная человеческая каркасная область, «происходящая от» каркасной области человеческого иммуноглобулина или от консенсусной каркасной области человеческого иммуноглобулина, может включать ту же самую аминокислотную последовательность, либо она может содержать аминокислотную последовательность с уже имеющимися модификациями. В случае если аминокислотные модификации уже присутствуют, то предпочтительно, чтобы их число составляло не более чем 5, предпочтительно 4 или менее или 3 или менее. В случае если аминокислотные модификации уже присутствуют в VH, то предпочтительно, чтобы такие модификации присутствовали только в трех, двух или в одном из положений 71H, 73H и 78H; так, например, аминокислотными остатками в таких положениях могут быть 71A, 73T и/или 78A. В одном из вариантов изобретения последовательность акцепторной человеческой каркасной области VL идентична последовательности каркасной области VL человеческого иммуноглобулина или консенсусной последовательности каркасной области человеческого иммуноглобулина.
«Консенсусная последовательность человеческой каркасной области» представляет собой каркасную область, которая имеет наиболее часто встречающийся аминокислотный остаток в наборе из каркасных последовательностей VL или VH человеческого иммуноглобулина. Вообще говоря, последовательности VL или VH человеческого иммуноглобулина выбирают из подгруппы последовательностей вариабельного домена. Обычно подгруппа таких последовательностей представляет собой подгруппу, описанную Кэбатом и др. В одном из вариантов изобретения подгруппой для VL является подгруппа каппа I, описанная Кэбатом и др. В одном из вариантов изобретения подгруппой для VН является подгруппа III, описанная Кэбатом и др.
«Консенсусная последовательность каркасной области VH подгруппы III» включает консенсусную последовательность, происходящую от аминокислотных последовательностей в вариабельной области тяжелой цепи подгруппы III, описанной Кэбатом и др. В одном из вариантов изобретения консенсусная аминокислотная последовательность каркасной области VH подгруппы III содержит по меньшей мере часть или все нижеследующие последовательности: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO:42)-H1-WVRQAPGKGLEWV (SEQ ID NO:43)-H2-RFTISRDNSKNTLYLQMNSLRAEDTAVYYC (SEQ ID NO:44)-H3-WGQGTLVTVSS (SEQ ID NO:45).
«Консенсусная последовательность каркасной области VL подгруппы I» включает консенсусную последовательность, происходящую от аминокислотных последовательностей в вариабельной области легкой цепи каппа подгруппы I, описанной Кэбатом и др. В одном из вариантов изобретения консенсусная аминокислотная последовательность каркасной области VL подгруппы I содержит по меньшей мере часть или все нижеследующие последовательности:
DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO:46)-L1-WYQQKPGKAPKLLIY (SEQ ID NO:47)-L2-GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO:48)-L3-FGQGTKVEIK (SEQ ID NO:49).
Термин «расстройство» или «заболевание» означает любое состояние, которое восприимчиво к лечению веществом/молекулой или способом согласно изобретению. Такими расстройствами являются хронические и острые расстройства или заболевания, включая патологические состояния, которые создают у данного млекопитающего предрасположенность к рассматриваемому расстройству. Неограничивающими примерами описанных здесь расстройств, подвергаемых лечению, являются злокачественные и доброкачественные опухоли: карцинома, бластома и саркома.
Термины “клеточно-пролиферативное расстройство” и “пролиферативное расстройство” означают расстройства, ассоциированные с определенной степенью аномальной пролиферации клеток. В одном из вариантов изобретения указанным клеточно-пролиферативным расстройством является рак.
Используемый здесь термин “опухоль” означает все неопластические клетки, подвергающиеся росту и пролиферации, независимо от того, являются ли они доброкачественными или злокачественными, и все предраковые и раковые клетки и ткани. Используемые здесь термины “рак”, “раковый”, “клеточно-пролиферативное расстройство”, “пролиферативное расстройство” и “опухоль” не являются взаимоисключающими.
Используемые здесь термины “рак” и “раковый” относятся к физиологическому состоянию млекопитающих, которое обычно характеризуется нерегулируемым ростом/пролиферацией клеток. Примерами раковых заболеваний являются, но не ограничиваются ими, карцинома, лимфома, бластома, саркома и лейкоз. Более конкретными примерами таких раковых заболеваний являются плоскоклеточный рак, мелкоклеточный рак легких, не-мелкоклеточный рак легких, аденокарцинома легких, плоскоклеточная карцинома легких, рак брюшной полости, гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатома, рак молочной железы, рак толстой кишки, рак прямой и ободочной кишки, карцинома эндометрия или матки, карцинома слюнной железы, рак почек, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карцинома печени, рак желудка, меланома и различные типы рака головы и шеи. Нарушение ангиогенеза может приводить к развитию многих расстройств, которые могут быть подвергнуты лечению композициями и способами согласно изобретению. Такими расстройствами являются не-неопластические и неопластические состояния. Неопластическими расстройствами являются, но не ограничиваются ими, состояния, описанные выше. Не-неопластическими состояниями являются, но не ограничиваются ими, нежелательная или аберрантная гипертрофия, артрит, ревматоидный артрит (РА), псориаз, псориазные бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, диабетическая и другие пролиферативные ретинопатии, включая ретинопатию недоношенных или ретролентальную фиброплазию, неоваскулярная глаукома, старческая дегенерация желтого пятна, диабетический отек желтого пятна, неоваскуляризация роговицы глаза, неоваскуляризация трансплантата роговицы глаза, отторжение трансплантата роговицы глаза, неоваскуляризация сетчатки/сосудистой оболочки глаза, неоваскуляризация угла глазного яблока (покраснение глаза), неоваскулярное заболевание глаз, рестеноз сосудов, артериовенозные мальформации (АВМ), менингиома, гемангиома, ангиофиброма, гиперплазия щитовидной железы (включая болезнь Грейвса), заболевания, ассоциированные с трансплантацией роговицы глаза и других тканей; хроническое воспаление, воспаление легких, острое поражение легких/респираторный дистресс-синдром взрослых (РДСВ), сепсис, первичная легочная гипертензия, злокачественные экссудаты в области легких, отек головного мозга (например, ассоциированный с инсультом/закрытым повреждением/травмой головы), синовит, образование паннуса при РА, оссифицирующий миозит, гипертрофия костей, остеоартрит (ОА), не поддающийся лечению асцит, поликистоз яичника, эндометриоз, заболевания, ассоциированные с секвестрацией жидкости в третьем пространстве (полости полых органов) (панкреатит, туннельный синдром, ожоги, заболевание кишечника), фиброма матки, преждевременные роды, хроническое воспаление, такое как ВЗК (болезнь Крона и язвенный колит), отторжение почечного аллотрансплантата, воспалительное заболевание кишечника, нефротический синдром, нежелательный или аберрантный рост тканевой массы (не-раковых тканей), гемофилическая артропатия, гипертрофированные рубцы, подавление роста волос, синдром Ослера-Вебера, пиогенная гранулема, ретролентальная фиброплазия, склеродермия, трахома, васкулярная адгезия (сращение сосудов), синовит, дерматит, преэклампсия, асциты, выпоты в область перикарда (например, ассоциированные с перикардитом) и плевральные выпоты.
Используемый здесь термин “лечение” означает клиническое вмешательство в целях изменения природных процессов, происходящих в организме индивидуума и в клетках, подвергаемых лечению, и такое лечение может быть профилактическим, либо оно может быть осуществлено в процессе развития клинической патологии. Желательными эффектами лечения являются предотвращение рецидива или снижение частоты рецидивов, ослабление симптомов, уменьшение любых прямых или опосредованных патологических последствий заболевания, предупреждение метастазов, снижение степени прогрессирования заболевания, ослабление или снижение степени патологического состояния, также ремиссия или улучшение прогноза. В некоторых вариантах изобретения антитела согласно изобретению используются для замедления развития заболевания или расстройства.
Термин «индивидуум» означает позвоночное, предпочтительно млекопитающее, наиболее предпочтительно человек. Термин «млекопитающие» включает, но не ограничивается ими, сельскохозяйственных животных (таких как коровы), животных, участвующих в спортивных состязаниях, домашних питомцев (таких как кошки, собаки и лошади), приматов, мышей и крыс.
«Млекопитающими», подвергаемыми лечению, являются любые животные, классифицированные как млекопитающие, включая человека, домашних и сельскохозяйственных животных, также животных, содержащихся в зоопарках, животных, участвующих в спортивных состязаниях или домашних питомцев, таких как собаки, лошади, кошки, коровы и т.п. Предпочтительным млекопитающим является человек.
Термин “эффективное количество” означает количество, которое является эффективным в определенных дозах и в течение определенного периода времени, необходимых для достижения нужного терапевтического или профилактического результата.
“Терапевтически эффективное количество” вещества/молекулы согласно изобретению, агониста или антагониста может варьироваться в зависимости от таких факторов, как патологическое состояние, возраст, пол и масса индивидуума, также способность данного вещества/молекулы, агониста или антагониста вырабатывать нужный ответ у индивидуума. Терапевтически эффективным количеством также является количество, при введении которого терапевтически благоприятные эффекты указанного вещества/молекулы, агониста или антагониста преобладают над любыми их токсическими или побочными эффектами. Термин “профилактически эффективное количество” означает количество, которое является эффективным в определенных дозах и в течение определенного периода времени, необходимых для достижения нужного профилактического результата. Поскольку профилактическую дозу вводят индивидуумам перед началом развития заболевания или на ранней стадии развития заболевания, то обычно, но необязательно, такое профилактически эффективное количество должно быть меньше терапевтически эффективного количества.
Используемый здесь термин “цитотоксическое средство” означает вещество, ингибирующее или предотвращающее функцию клеток и/или вызывающее деструкцию клеток. Этот термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, Р32 и радиоактивные изотопы Lu), химиотерапевтические средства, например метотрексат, адриамицин, винкаалкалоиды (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как токсины в виде небольших молекул, или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты, и различные противоопухолевые или противораковые средства, описанные ниже. Ниже описаны и другие цитотоксические средства. Противоопухолевое средство вызывает деструкцию опухолевых клеток.
“Химиотерапевтическое средство” представляет собой химическое соединение, используемое для лечения рака. Примерами химиотерапевтических средств являются алкилирующие агенты, такие как тиотепа и циклофосфамид цитоксан®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (а в частности, буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, маринол®); бета-лапахон; лапахол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (гикамтин®), СРТ-11 (иринотекан, камптозар®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги, такие как адозелезин, карзелезин и бизелезин); подофилотоксин; подофиллиновая кислота; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, КW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотные аналоги горчичного газа, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый аналог горчичного газа; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности, калихеамицин гамма II и калихеамицин омега II (см., например, Agnew, Chem. Intl. Ed. Engl., 33:183-186 (1994)); динемицин, включая динемицин А; эсперамицин, также неокарзиностатиновый хромофор и родственные хромофоры, такие как хромопротеиновые энедииновые антибиотики), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксирубицин адриамицин® (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадренергические средства, такие как аминоглютетимид, митотан, трилостан; заменитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидный гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтанзиноиды, такие как майтазин и анзамитоцины; митогуазон; митоксантрон; мопидамнол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантон; 2-этилгидразид; прокарбиазцин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (а в частности, токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин (элдизин®, филдезин®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); тиотепа; таксоиды, например, паклитаксел Таксол® (Bristol-Myers Squibb Oncology, Princeton, N.J.); не содеражащий кремофора АбраксанТМ, сконструированная на основе альбумина композиция из наночастиц паклитаксела (American Pharmaceuticals Partners, Schaumberg, Illinois) и доцетаксел Таксотер® (Rhone-Poulenc Rorer, Antony, France); хлоранбуцил; гемцитабин (Гемзар®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (Велбан®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (Онковин®); оксалиплатин; лейковорин; винорелбин (Навелбин®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноиды, такие как ретиноевая кислота; капецитабин (Кселода®); фармацевтически приемлемые соли, оксиды или производные всех вышеуказанных соединений, также комбинации из двух или более вышеуказанных соединений, такие как СНОР, где указанная аббревиатура используется в комбинированной терапии и означает циклофосфамид, доксорубицин, винкристин и преднизолон, и FOLFOX, где указанная аббревиатура используется в комбинированной терапии и означает оксалиплатин (Элоксатин®), 5-FU и лейкововин.
В это определение также входят противогормональные средства, регулирующие, снижающие, блокирующие или ингибирующие действие гормонов, которые могут стимулировать рост раковой опухоли, и эти средства часто применяются для системного или общего лечения. Такими средствами могут быть сами гормоны. Примерами таких средств являются антиэстрогены и селективные модуляторы рецептора эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен Нолвадекс®), ралоксифен Эвиста®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен Фарестон®; антипрогестероны; ингибиторы рецептора эстрогена (ERD); средства, подавляющие или блокирующие функции яичников, например, агонисты рилизинг-фактора лютеинизирующего гормона (LHRH), такие как Лупрон® и ацетат лейпролида Элигард®, ацетат гозерелина, ацетат бузерелина и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, ингибирующие фермент ароматазу и регулирующие продуцирование эстрогенов в коре надпочечника, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола Мегаза®, экземестан Аромазин®, форместан, фадрозол, ворозол Ривизор®, летрозол Фемара® и анастрозол Аримидекс®. Кроме того, в такое определение химиотерапевтических средств входят бифосфонаты, такие как клодронат (например, Бонефос® или Остак®), этидронат Дидрокал®, NE-58095, золедроновая кислота/золедронат Зомета®, алендронат Фозамакс®, памидронат Аредия®, тилудронат Скелид® или ризедронат Актонел®, также троксацитабин (нуклеозидный аналог 1,3-диоксоланцитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, ингибирующие экспрессию генов пути передачи сигнала, участвующих в нежелательной пролиферации клеток, такие как, например, РКС-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина Тератопа® и вакцины, применяемые в генотерапии, например вакцина Алловектин®, вакцина Лейвектин® и вакцина Ваксид®; ингибитор топоизомеразы 1 Луртотекан®; rmRH Абареликс®; дитозилат лапатиниба (ингибитор тирозинкиназы, состоящий из двух небольших молекул Erb-2 и EGFR, также известный как GW 572016) и фармацевтически приемлемые соли, оксиды или производные всех вышеуказанных соединений.
Используемый здесь термин “рост-ингибирующее средство” означает соединение или композицию, ингибирующие рост клеток (таких как клетки, экспрессирующие DLL4), либо in vitro, либо in vivo. Таким образом, средством, ингибирующим рост клеток, может быть средство, значительно снижающее процент клеток (таких как клетки, экспрессирующие DLL4) в фазе S. Примерами средств, ингибирующих рост клеток, являются средства, блокирующие прохождение клеточного цикла (в другой фазе, кроме фазы S), такие как средства, индуцирующие блокирование фазы G1 и фазы М. Классическими средствами, блокирующими фазу М, являются винкаалкалоиды (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средствами, блокирующими фазу G1, также блокирующими переход в фазу S, являются, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в публикации The Molecular Basis of Cancer, Mendelsohn & Israel, eds., Chapter 1, entitled “Cell cycle regulation, oncogenes and antineoplastic drugs”, Murakami et al. (WB Saunders: Philadelphia, 1995), в частности, на стр.13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, получаемые из дерева тис. Доцетаксел (Таксотер®, Rhone-Poulenc Rorer), получаемый из Европейского тиса, представляет собой полусинтетический аналог паклитаксела (Таксола®, Bristol-Myers Squibb). Паклитаксел и доцетаксел индуцируют сборку микротрубочек из тубулиновых димеров и стабилизируют микротрубочки путем предупреждения деполимеризации, что приводит к ингибированию митоза клеток.
“Доксорубицин” представляет собой антрациклиновый антибиотик. Доксорубицин имеет полное химическое название (8S-цис)-10-[(3-амино-2,3,6-тридезокси-α-L-ликсо-гексапиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтацендион.
Термин “противоопухолевая композиция” означает композицию, которая может быть использована для лечения рака и содержащая по меньшей мере одно активное терапевтическое средство, например «противораковое средство». Примерами терапевтических средств (противораковых средств, также называемых здесь «противоопухолевым средством») являются, но не ограничиваются ими, например, химиотерапевтические средства, рост-ингибирующие средства, цитотоксические средства, средства, используемые в лучевой терапии, антиангиогенные средства, апоптотические средства, антитубулиновые средства, токсины и другие средства для лечения рака, например нейтрализующее анти-VEGF-антитело, антагонист VEGF, анти-HER-2-антитело, анти-CD20-антитело, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR, эрлотиниб, ингибитор COX-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одним или несколькими рецепторами ErbB2, ErbB3, ErbB4 или VEGF, ингибиторы тирозинкиназных рецепторов тромбоцитарного фактора роста (PDGF) и/или фактор стволовых клеток (SCF) (например, мезилат иматиниба (Gleevec ® Novartis)), TRAIL/Apo2L, и другие биологически активные средства и органические химические соединения и т.п.
Используемый в данной заявке термин “пролекарство” означает предшественник или производное фармацевтически активного вещества, которые по сравнению с родительским лекарственным средством являются менее цитотоксичными по отношению к опухолевым клеткам и способны ферментативно активироваться или превращаться в более активную зрелую форму. См., например, Wilman, “Prodrugs in Cancer Chemotherapy” Biochemical Society Transactions, 14, pp.375-382, 615th Meeting Belfast (1986) и Stella et al. “Prodrugs: A Chemical Approach to Targeted Drug Delivery”, Directed Drug Delivery, Borchardt et al., (ed.), pp.247-267, Humana Press (1985). Пролекарствами согласно изобретению являются, но не ограничиваются ими, фосфатсодержащие пролекарства; тиофосфатсодержащие пролекарства; сульфатсодержащие пролекарства; пептидсодержащие пролекарства; лекарственные средства, модифицированные D-аминокислотой; гликозилированные пролекарства; β-лактамсодержащие пролекарства; пролекарства, содержащие необязательно замещенный феноксиацетамид; или пролекарства, содержащие, но необязательно, замещенный фенилацетамид; 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное цитотоксическое свободное лекарственное средство. Примерами цитотоксических лекарственных средств, которые могут быть дериватизированы с получением пролекарственной формы для ее использования в настоящем изобретении, являются, но не ограничиваются ими, химиотерапевтические средства, описанные выше.
Термин «антиангиогенное средство» или «ингибитор ангиогенеза» означает вещество с небольшой молекулярной массой, полинуклеотид (включая, например, ингибирующую РНК (РНКи или киРНК)), полипептид, выделенный белок, рекомбинантный белок, антитело или его конъюгаты или гибридные белки, которые прямо или опосредованно ингибируют ангиогенез, васкулогенез или нежелательную проницаемость сосудов. Так, например, антиангиогенным средством является антитело или другой антагонист, направленный против ангиогенного агента, определенные выше, например антитела против VEGF, антитела против рецепторов VEGF, фрагменты растворимых рецепторов VEGF или небольшие молекулы, блокирующие передачу сигнала рецептора VEGF (например, PTK787/ZK2284, SU6668, SUTENT®/SU11248 (малат сунитиниба), AMG706 или молекулы, описанные, например, в Международной патентной заявке WO 2004/113304). Антиангиогенными средствами также являются природные ингибиторы ангиогенеза, например антиостатин, эндостатин и т.п. См., например, Klagsbrun and D'Amore, Annu. Rev. Physiol., 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2003) (например, таблицу 3, в которой перечислены антиангиогенные средства для лечения злокачественной меланомы); Ferrara & Alitalo, Nature Medicine 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) (например, таблица 2, в которой перечислены антиангиогенные факторы); и Sato Int. J. Clin. Oncol., 8:200-206 (2003) (например, таблицу 1, в которой перечислены антиангиогенные средства, используемые в клинических испытаниях).
Композиции согласно изобретению и способы их получения
Настоящее изобретение относится к композициям, включая фармацевтические композиции, содержащие анти-DLL4-антитело, и к полинуклеотидам, содержащим последовательности, кодирующие анти-DLL4-антитело. Используемые здесь композиции содержат одно или несколько антител, связывающихся с DLL4, и/или один или несколько полинуклеотидов, содержащих последовательности, кодирующие одно или несколько антител, связывающихся с DLL4. Такие композиции могут также содержать подходящие носители, такие как фармацевтически приемлемые наполнители, включая буферы, хорошо известные специалистам.
Настоящее изобретение также охватывает варианты выделенных антител и полинуклеотидов. Настоящее изобретение также охватывает варианты, в основном, чистых антител и полинуклеотидов.
Анти-DLL4-антителами согласно изобретению являются предпочтительно моноклональные антитела. В объем настоящего изобретения также входят Fab, Fab'-, Fab'-SH- и F(ab')2-фрагменты рассматриваемых здесь анти-DLL4-антител. Указанные фрагменты антител могут быть получены традиционными способами, такими как ферментативный гидролиз, либо они могут быть продуцированы методами рекомбинантных ДНК. Указанные фрагменты антител могут быть химерными или гуманизованными. Эти фрагменты могут быть использованы в диагностических или терапевтических целях, описанных ниже.
Моноклональные антитела получают из популяции, в основном, гомогенных антител, то есть отдельные антитела, входящие в состав такой популяции, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в небольших количествах. Таким образом, термин «моноклональный» определяет характер антитела, которое не является смесью дискретных антител.
Моноклональные анти-DLL4-антитела согласно изобретению могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature, 256:495 (1975), либо они могут быть получены методами рекомбинантных ДНК (патент США № 4816567).
В гибридомном методе мышь или другое подходящее животное-хозяин, такое как хомячок, иммунизируют для вырабатывания у него лимфоцитов, продуцирующих или способных продуцировать антитела, специфически связывающиеся с белком, используемым для иммунизации. Антитела против DLL4 обычно вырабатываются у животных после многократных подкожных (sc) или внутрибрюшинных (ip) инъекций DLL4 и адъюванта. DLL4 может быть получен хорошо известными методами, некоторые из которых более подробно описаны ниже. Так, например, рекомбинантное продуцирование DLL4 описано ниже. В одном из вариантов изобретения животных иммунизируют производным DLL4, которое содержит внеклеточный домен (ECD) DLL4, присоединенный к Fc-части тяжелой цепи иммуноглобулина. В предпочтительном варианте изобретения животных иммунизуют гибридным белком DLL4-IgG1. Животных обычно иммунизируют монофосфориллипидом A (MPL)/дикриномиколятом трегалозы (TDM) для вырабатывания ответа против иммуногенных конъюгатов или производных DLL4 (Ribi Immunochem. Research, Inc., Hamilton, MT), и полученный раствор инъецируют чрескожно во множество участков. Через две недели животным вводят ударную дозу. Еще через 7-14 дней у животных берут кровь, и сыворотку анализируют на титры анти-DLL4-антител. Животным вводят ударную дозу до тех пор, пока титр не будет достигать «плато» (то есть постоянного уровня).
Альтернативно лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты подвергают слиянию с миеломными клетками с использованием подходящего агента для слияния, такого как полиэтиленгликоль, в результате чего образуются гибридомные клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и культивируют в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, ингибирующих рост или выживание не-слитых родительских миеломных клеток. Так, например, если родительские миеломные клетки не содержат фермента гипоксантин-гуанин-фосфорибозилтрансферазы (HGPRT или HPRT), то культуральная среда, используемая для получения гибридом, обычно включает гипоксантин, аминоптерин и тимидин (среда НАТ), то есть вещества, предупреждающие рост HGPRT-дефицитных клеток.
Предпочтительными миеломными клетками являются клетки, которые способны подвергаться эффективному слиянию, поддерживать стабильное продуцирование высоких уровней антител выбранными антитело-продуцирующими клетками и являются чувствительными к среде, такой как среда НАТ. Из этих клеток предпочтительными миеломными клеточными линиями являются мышиные миеломные линии, такие как клеточные линии, происходящие от клеток мышиных опухолей МОРС-21 и МРС-11, имеющихся в институте Salk Institute Cell Distribution Center, San Diego, California, USA, и клеток SP-2 или Х63-Ag8-653, имеющихся в Американской коллекции типовых культур, Rockville, Maryland USA. Для продуцирования человеческих моноклональных антител также используются человеческие миеломные клеточные линии и гетеромиеломные клеточные линии “мышь - человек” (Kozbor J. Immunol., 133:3001 (1984) & Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду для роста гибридомных клеток анализируют на продуцирование моноклональных антител против DLL4. Специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют предпочтительно путем иммунопреципитации или путем проведения in vitro анализа на связывание, такого как радиоиммуноанализ (РИА) или твердофазный иммунноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела может быть, например, определена с помощью анализа Скэтчарда, описанного Munson et al., Anal. Biochem., 107:220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела с нужной специфичностью, аффинностью и/или активностью, клоны могут быть субклонированы путем проведения процедур лимитирующего разведения и культивированы стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящими культуральными средами, предназначенными для достижения данной цели, являются, например, среда D-MEM или RPMI-1640. Кроме того, гибридомные клетки могут быть выращены in vivo в качестве асцитных опухолей у животных.
Моноклональные антитела, секретированные субклонами, соответствующим образом выделяют из культуральной среды, асцитной жидкости или сыворотки путем проведения стандартных процедур очистки иммуноглобулинов, таких как, например, хроматография на белке А-сефарозе, хроматография на гидроксиапатитах, гель-электрофорез, диализ или аффинная хроматография.
Анти-DLL4-антитела согласно изобретению могут быть получены с использованием комбинаторных библиотек для скрининга на клоны синтетических антител с нужной активностью или активностями. В принципе, клоны синтетических антител отбирают путем скрининга фаговых библиотек, содержащих фаг, который представляет различные фрагменты вариабельной области антитела (Fv), присоединенные к белку оболочки фага. Такие фаговые библиотеки подвергают пэннингу с помощью аффинной хроматографии против нужного антигена. Клоны, экспрессирующие Fv-фрагменты, способные связываться с нужным антигеном, подвергают адсорбции на антигене и тем самым их отделению от несвязывающихся клонов в библиотеке. Затем связывающиеся клоны элюируют с антигена, после чего число этих клонов может быть увеличено путем проведения дополнительных циклов адсорбции/элюирования антигена. Любое из анти-DLL4-антител согласно изобретению может быть получено с применением подходящей процедуры скрининга антигена для отбора на представляющий интерес клон фага с последующим конструированием полноразмерного клона анти-DLL4-антитела с использованием последовательностей Fv, происходящих от представляющего интерес клона фага, и подходящих последовательностей константной области (Fc), описанных Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3.
Антигенсвязывающий домен антитела образуется из двух вариабельных (V) областей, состоящих примерно из 110 аминокислот, одна из которых находится в легкой цепи (VL), другая в тяжелой цепи (VH), и в этих вариабельных областях присутствуют три гипервариабельные петли или комплементарность-определяющие области (CDR). Вариабельные домены могут быть функционально представлены на фаге либо как одноцепочечные Fv- (scFv)-фрагменты, в которых VH и VL ковалентно связаны друг с другом посредством короткого гибкого пептида, либо как Fab-фрагменты, в которых каждый их этих вариабельных доменов присоединен к константному домену и подвергается нековалентному взаимодействию, как описано Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Используемые здесь scFv-кодирующие фаговые клоны и Fab-кодирующие фаговые клоны, в целом, называются «фаговыми Fv-клонами» или «Fv-клонами».
Наборы генов VH и VL могут быть отдельно клонированы с помощью полимеразной цепной реакции (ПЦР) и подвергнуты неспецифической рекомбинации в фаговых библиотеках, затем они могут быть проанализированы на антигенсвязывающие клоны, как описано в публикации Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Библиотеки от иммунизованных источников позволяют получить антитела, обладающие высокой аффинностью к иммуногену, и при этом не требуют проведения процедуры конструирования гибридом. Альтернативно может быть клонирован набор человеческих антител дикого типа с получением одного источника человеческих антител против не-аутоантигенов, также аутоантигенов широкого ряда, не прибегая при этом к какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). И наконец, исходные библиотеки могут быть также синтезированы путем клонирования неаранжированных сегментов V-гена из стволовых клеток и с использованием ПЦР-праймеров, содержащих рандомизированную последовательность, кодирующую в высокой степени вариабельные CDR3-области, в целях достижения реаранжировки in vitro, как описано Hoogenboom & Winter, J. Mol. Biol., 227: 381-388 (1992).
Для представления фрагментов антител путем их присоединения к минорному оболочечному белку pIII используют нитчатый фаг. Фрагменты антител могут быть представлены в виде одноцепочечных Fv-фрагментов, в которых домены VH и VL присоединены на одной и той же полипептидной цепи посредством гибкого полипептидного спейсера, например, как описано Marks et al., J. Mol. Biol., 222: 581-597 (1991), или в виде Fab-фрагментов, в которых одна цепь присоединена к pIII, другая секретируется в периплазму бактериальной клетки хозяина, где происходит сборка структуры оболочечного белка Fab, который отображается на поверхности фага посредством замены некоторых из оболочечных белков дикого типа, например, как описано в публикации Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991).
Обычно нуклеиновые кислоты, содержащие гены, кодирующие фрагменты антител, получают из иммунных клеток, взятых у человека или животных. Если необходимо получить библиотеку, состоящую преимущественно из клонов анти-DLL4-антител, то индивидуума иммунизируют DLL4 для вырабатывания у него гуморального ответа, затем для конструирования библиотеки выделяют клетки селезенки и/или циркулирующие В-клетки, не принадлежащие к популяции лимфоцитов периферической крови (ЛПК). В предпочтительном варианте изобретения библиотеку генов фрагментов человеческого антитела, содержащую преимущественно клоны анти-DLL4-антитела, получают посредством вырабатывания ответа в виде продуцирования анти-DLL4-антител у трансгенных мышей, несущих массив функциональных генов человеческого иммуноглобулина (и не содержащих функциональной системы продуцирования эндогенного антитела), где такая DLL4-иммунизация будет приводить к образованию В-клеток, продуцирующих человеческие антитела против DLL4. Генерирование трансгенных мышей, продуцирующих человеческое антитело, описано ниже.
Дополнительное обогащение клеточной популяции реактивными анти-DLL4-антителами может быть достигнуто с помощью подходящей процедуры скрининга для выделения В-клеток, экспрессирующих DLL4-специфическое мембрано-связанное антитело, например путем разделения клеток с помощью DLL4-аффинной хроматографии или адсорбции клеток на DLL4, меченном флуорохромом, и последующего клеточного сортинга с активацией флуоресценции (FACS).
Альтернативно использование клеток селезенки и/или В-клеток или других ЛПК, взятых от неиммунизованного донора, обеспечивает лучшее представление возможного репертуара антител, также позволяет конструировать библиотеку антител у животных любого вида (у человека или у других животных), у которых DLL4 не является антигенным. Для создания библиотек, включающих конструкцию генов антител in vitro, у индивидуума берут стволовые клетки и выделяют нуклеиновые кислоты, кодирующие не-аранжированные сегменты генов антител. Представляющие интерес иммунные клетки могут быть выделены у животных различных видов, таких как человек, мыши, крысы, зайцеобразные, волки, собаки, кошки, свиньи, коровы, лошади, птицы и т.п.
Нуклеиновую кислоту, кодирующую сегменты генов вариабельных областей антитела (включая VH- и VL-сегменты), выделяют из представляющих интерес клеток и амплифицируют. В случае использования библиотек реаранжированных генов VH и VL нужная ДНК может быть получена путем выделения геномной ДНК или мРНК из лимфоцитов с последующим проведением полимеразной цепной реакции (ПЦР) с использованием праймеров, соответствующих 5'- и 3'-концам реаранжированных генов VH и VL, описанных в публикации Orlandi et al., Proc. Natl. Acad. Sci. (USA), 86: 3833-3837 (1989), и тем самым получения различных наборов V-генов для экспрессии. V-гены могут быть амплифицированы из кДНК и геномной ДНК с использованием обратных праймеров у 5'-конца экзона, кодирующего зрелый V-домен, и прямых праймеров, полученных на основе J-сегмента, как описано в публикациях Orlandi et al. (1989) и Ward et al., Nature, 341: 544-546 (1989). Однако для амплификации из кДНК обратные праймеры могут быть также получены на основе лидерного экзона, как описано в публикации Jones et al., Biotechnol., 9: 88-89 (1991), прямые праймеры могут быть введены в константную область, как описано в публикации Sastry et al., Proc. Natl. Acad. Sci. (USA), 86: 5728-5732 (1989). Для максимизации комплементарности могут быть получены вырожденные праймеры, описанные в публикации Orlandi et al. (1989) или Sastry et al. (1989). Предпочтительно разнообразие библиотек максимизируют с использованием ПЦР-праймеров, нацеленных на каждое семейство V-генов, в целях амплификации всех имеющихся аранжировок VH и VL, присутствующих в образце нуклеиновой кислоты иммунной клетки, например методом, описанным в публикации Marks et al., J. Mol. Biol., 222: 581-597 (1991), или методом, описанным в публикации Orum et al., Nucleic Acids Res., 21: 4491-4498 (1993). Для клонирования амплифицированной ДНК в экспрессионные векторы в ПЦР-праймер могут быть введены редкие рестрикционные сайты в качестве метки у одного конца, как описано Orlandi et al. (1989), либо такое введение может быть осуществлено с помощью ПЦР-амплификации с использованием меченого праймера, как описано Clackson et al., Nature, 352: 624-628 (1991).
Наборы синтетически реаранжированных генов V могут быть получены in vitro из V-генных сегментов. Большинство сегментов человеческих генов VH были клонированы и секвенированы (как сообщалось в публикации Tomlinson et al., J. Mol. Biol., 227: 776-798 (1992)), затем картированы (как сообщалось в публикации Matsuda et al., Nature Genet., 3: 88-94 (1993); и эти клонированные сегменты (включая все основные конформации петли H1 и H2) могут быть использованы для получения различных наборов генов VH с использованием ПЦР-праймеров, кодирующих петли H3, имеющие различные последовательности и различные длины, как описано в публикации Hoogenboom и Winter, J. Mol. Biol., 227: 381-388 (1992). Могут быть также получены наборы VH, имеющие все разнообразие последовательностей, сосредоточенное в длинной петле H3 одной длины, как описано в публикации Barbas et al., Proc. Natl. Acad. Sci. USA, 89: 4457-4461 (1992). Были клонированы и секвенированы человеческие сегменты Vκ и Vλ (как сообщалось в публикации Williams & Winter, Eur. J. Immunol., 23: 1456-1461 (1993)) и такие сегменты могут быть использованы для получения синтетических наборов легких цепей. Наборы синтезированных генов V, полученных на основе складчатой структуры ряда VH и VL, и L3 и H3 различной длины, будут кодировать антитела со значительно варьирующейся структурой. После амплификации кодирующей ДНК гена V сегменты гена V зародышевой линии могут быть реаранжированы in vitro методами, описанными в публикации Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
Наборы фрагментов антител могут быть сконструированы путем объединения наборов генов VH и VL несколькими путями. Каждый набор может быть создан в различных векторах, и эти векторы подвергают рекомбинации in vitro, например, как описано в публикации Hogrefe et al., Gene, 128: 119-126 (1993), или in vivo путем комбинаторного инфицирования, например, системой loxP, описанной в публикации Waterhouse et al., Nucl. Acids Res., 21: 2265-2266 (1993). В методе рекомбинации in vivo используется двухцепочечная природа Fab-фрагментов для устранения ограничения, налагаемого на размер библиотеки и связанного с эффективностью трансформации E. coli. Исходные наборы VH и VL клонируют отдельно: один - в фагмиду, другой - в фаговый вектор. Затем две библиотеки объединяют путем инфицирования бактерии, содержащей фагмиду, фагом, так, чтобы каждая клетка содержала различные комбинации, размер библиотеки был ограничен только числом присутствующих клеток (примерно 1012 клонов). Оба вектора содержат сигналы рекомбинации in vivo, в результате чего гены VH и VL подвергаются рекомбинации с образованием одного репликона и совместно упаковываются в фаговые вирионы. Эти огромные библиотеки представляют большое число различных антител с высокой аффинностью (Kd -1 примерно 10-8 M).
Альтернативно такие наборы могут быть последовательно клонированы в один и тот же вектор, например, как описано в публикации Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991), либо они могут быть собраны вместе с помощью ПЦР, затем клонированы, например, как описано в публикации Clackson et al., Nature, 352: 624-628 (1991). ПЦР-сборка может быть также осуществлена для присоединения ДНК VH и VL к ДНК, кодирующей гибкий пептидный спейсер, с образованием наборов одноцепочечных Fv (scFv). В еще одном методе «ПЦР-сборка в клетках» применяется для объединения генов VH и VL в лимфоцитах с помощью ПЦР с последующим клонированием наборов сцепленных генов, как описано в публикации Embleton et al., Nucl. Acids Res., 20: 3831-3837 (1992).
Антитела, продуцируемые исходными библиотеками (природными или синтетическими), могут иметь невысокую аффинность (Kd -1 примерно от 106 дo 107 M-1), однако созревание аффинности может быть также смоделировано in vitro путем конструирования и повторного отбора из вторичных библиотек, как описано в публикации Winter et al. (1994), см. выше. Так, например, мутация может быть введена случайно in vitro с использованием полимеразной реакции с вероятностью ошибки (reported in Leung et al., Technique, 1: 11-15 (1989)) в методе, описанном Hawkins et al., J. Mol. Biol., 226: 889-896 (1992) или методе, описанном Gram et al., Proc. Natl. Acad. Sci USA, 89: 3576-3580 (1992). Кроме того, созревание аффинности может быть осуществлено посредством случайной мутации одной или нескольких CDR, например, с помощью ПЦР, проводимой с использованием праймеров, несущих рандомизированную последовательность, охватывающую представляющую интерес CDR в отдельно выбранных Fv-клонах, и с помощью скрининга клонов с более высокой аффинностью. В заявке WO 9607754 (опубликованной 14 марта 1996 года) описан метод индуцирования мутагенеза в гипервариабельной области легкой цепи иммуноглобулина с получением библиотеки генов легкой цепи. Другим эффективным методом является рекомбинация доменов VH или VL, отобранных с помощью фагового представления, с наборами природных вариантов V-домена, выделенных у неиммунизованных доноров, и скрининг на более высокую аффинность, проводимый в несколько раундов перестановки цепей, как описано в публикации Marks et al., Biotechnol., 10: 779-783 (1992). Этот метод позволяет продуцировать антитела и фрагменты антител с аффинностями в пределах 10-9 M.
Последовательности нуклеиновой кислоты и аминокислотные последовательности DLL4 известны специалистам. Последовательность нуклеиновой кислоты, кодирующая DLL4, может быть сконструирована с использованием аминокислотной последовательности нужной области DLL4. Альтернативно последовательность кДНК (или ее фрагменты) депонирована в GenBank под рег. № NM_019074. DLL4 представляет собой трансмембранный белок. Внеклеточная область содержит 8 EGF-подобных повторов, также домен DSL, который является консервативным для всех лигандов Notch и необходимым для связывания с рецептором. Предсказанный белок также содержит трансмембранную область и цитоплазматический «хвост», не содержащий каких-либо каталитических мотивов. Человеческий белок DLL4 представляет собой белок из 685 аминокислот и содержит следующие области: сигнальный пептид (аминокислоты 1-25); MNNL (аминокислоты 26-92); DSL (аминокислоты 155-217); EGF-подобную область (аминокислоты 221-251); EGF-подобную область (аминокислоты 252-282); EGF-подобную область (аминокислоты 284-322); EGF- подобную область (аминокислоты 324-360); EGF-подобную область (аминокислоты 366-400); EGF-подобную область (аминокислоты 402-438); EGF-подобную область (аминокислоты 440-476); EGF-подобную область (аминокислоты 480-518); трансмембранную область (аминокислоты 529-551); цитоплазматический домен (аминокислоты 552-685). Человеческий DLL4 имеет регистрационный номер NM_019074, мышиный DLL4 имеет регистрационный номер NM_019454.
ДНК, кодирующие DLL4, могут быть получены различными методами, известными специалистам. Такими методами являются, но не ограничивается ими, химический синтез, проводимый любыми методами, описанными в публикации Engels et al., Agnew. Chem. Int. Ed. Engl., 28: 716-734 (1989), такими как методы с использованием триэфира, фосфита, фосфорамидита и Н-фосфоната. В одном из вариантов изобретения для конструирования DLL4-кодирующей ДНК используют кодоны, являющиеся предпочтительными при экспрессии в клетках-хозяевах. Альтернативно ДНК, кодирующая DLL4, может быть выделена из геномной библиотеки или библиотеки кДНК.
После конструирования молекулы ДНК, кодирующей DLL4, эту молекулу ДНК функционально присоединяют к последовательности регуляции экспрессии в экспрессионном векторе, таком как плазмида, где указанная регуляторная последовательность распознается клеткой-хозяином, трансформированной данным вектором. В общих чертах, плазмидные векторы содержат последовательности репликации и регуляторные последовательности, происходящие от видов, совместимых с клеткой-хозяином. Такой вектор обычно содержит сайт репликации, также последовательности, кодирующие белки, позволяющие осуществлять фенотипический отбор в трансформированных клетках. Подходящие векторы для экспрессии в прокариотических и в эукариотических клетках-хозяевах известны специалистам, и некоторые из них более подробно описаны ниже. При этом могут быть использованы эукариотические организмы, такие как дрожжи, или клетки, происходящие от многоклеточных организмов, таких как млекопитающие.
ДНК, кодирующая DLL4, может быть, но необязательно, функционально присоединена к секреторной лидерной последовательности, что может приводить к секреции продукта экспрессии клеткой-хозяином в культуральной среде. Примерами секреторных лидерных последовательностей являются stII, экотин, lamB, ГД (глутамат-дегидрогеназа) вируса герпеса, lpp, щелочная фосфотаза, инвертаза и альфа-фактор. В настоящем изобретении может быть также использована лидерная последовательность белка А, состоящая из 36 аминокислот (Abrahmsen et al., EMBO J., 4: 3901 (1985)).
Клетки-хозяева трансфецируют, предпочтительно трансформируют вышеописанными экспрессионными или клонирующими векторами согласно изобретению и культивируют в подходящих питательных средах, модифицированных, если это необходимо, для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
Термин «трансфекция» означает поглощение экспрессионного вектора клеткой-хозяином независимо от того, экспрессирует ли она какие-либо кодирующие последовательности или нет. Различные методы трансфекции известны среднему специалисту в данной области, и такими методами являются, например, CaPO4-преципитация и электропорация. Успешную трансфекцию обычно определяют по любому признаку, указывающему на присутствие указанного вектора в клетке-хозяине. Методы трансфекции хорошо известны специалистам, и некоторые из них более подробно описаны в настоящей заявке.
Термин «трансформация» означает введение ДНК в организм так, чтобы она могла реплицироваться как внехромосомный элемент или как хромосомный компонент. В зависимости от используемой клетки-хозяина трансформацию осуществляют с применением стандартных методов, подходящих для таких клеток. Методы трансформации хорошо известны специалистам и некоторые из них более подробно описаны в настоящей заявке.
Прокариотические клетки-хозяева, используемые для продуцирования DLL4, могут быть культивированы, в основном, как описано в руководстве Sambrook et al., см. выше.
Клетки-хозяева млекопитающих, используемые для продуцирования DLL4, могут быть культивированы в различных средах, которые хорошо известны специалистам, и некоторые из которых описаны в настоящей заявке.
Клетки-хозяева, описанные в настоящей заявке, включают клетки в культуре in vitro, также клетки животного-хозяина.
Очистка DLL4 может быть осуществлена хорошо известными методами, некоторые из которых описаны в настоящей заявке.
Очищенные DLL4 могут быть связаны с соответствующей матрицей, такой как сферы с агарозным гелем, акриламидные сферы, стеклянные шарики, целлюлоза, различные акриловые сополимеры, гидроксилметакрилатные гели, сополимеры полиакриловой и полиметакриловой кислоты, найлон, нейтральные и ионные носители и т.п., в целях их использования в аффинной хроматографии для разделения клонов, представленных на фагах. Присоединение белка DLL4 к матрице может быть осуществлено любыми методами, описанными в Methods in Enzymology, vol. 44 (1976). Методы, обычно применяемые для присоединения лигандов белков к полисахаридным матрицам, например агарозе, декстрану или целлюлозе, включают активацию носителя циангалогенидами и последующее связывание первичных алифатических или ароматических аминов пептидных лигандов с активированной матрицей.
Альтернативно DLL4 может быть использован для покрытия лунок адсорбционных планшетов и экспрессирован на клетках-хозяевах, прикрепленных к адсрорбционным планшетам, либо он может быть использован в клеточном сортинге или конъюгирован с биотином для связывания со сферами, покрытыми стрептавидином, либо он может быть использован в любом другом известном методе для пэннинга библиотек фагового представления.
Образцы фаговых библиотек подвергают контактированию с иммобилизованным DLL4 в условиях, подходящих для связывания по меньшей мере части фаговых частиц с адсорбентом. Обычно для имитации физиологических условий выбирают соответствующие рН, ионную силу, температуру и т.п. Фаги, связанные с твердой фазой, промывают, затем элюируют кислотой, например, как описано в публикации Barbas et al., Proc. Natl. Acad. Sci USA, 88: 7978-7982 (1991), или щелочью, например, как описано в публикации Marks et al., J. Mol. Biol., 222: 581-597 (1991), или путем конкурентного связывания с антигеном DLL4, например, в соответствии с процедурой, аналогичной процедуре, осуществляемой в методе конкурентного связывания с антигеном, как описано в публикации Clackson et al., Nature, 352: 624-628 (1991). Фаги могут быть подвергнуты 20-1000-кратному обогащению в одном раунде отбора. Кроме того, обогащенные фаги могут быть выращены в бактериальной культуре и подвергнуты дополнительным раундам отбора.
Эффективность отбора зависит от многих факторов, включая кинетику диссоциации во время промывки, и от способности множества фрагментов антитела одновременно связываться с антигеном на одном фаге. Антитела с быстрой кинетикой диссоциации (и слабой аффинностью связывания) могут быть фиксированы благодаря кратковременным промывкам, применению мультивалентного фагового представления и высокой плотности покрытия антигена на твердой фазе. Такая высокая плотность не только позволяет стабилизировать фаг благодаря мультивалентным взаимодействиям, но также благоприятствует повторному связывания фага, который является диссоциированным. Отбор антител со слабой кинетикой диссоциацией (и с высокой аффинностью связывания) может быть улучшен благодаря более длительным промывкам и применению моновалентного фагового представления, описанного в публикации Bass et al., Proteins, 8: 309-314 (1990) и в WO 92/09690, также благодаря низкой плотности покрытия антигена, как описано в публикации Marks et al., Biotechnol., 10: 779-783 (1992).
Может быть проведен отбор между фаговыми антителами с различными аффинностями, даже с немного отличающейся аффинностью по отношению к DLL4. Однако случайная мутация выбранного антитела (например, внесенная при осуществлении некоторых из описанных выше методов созревания аффинности), вероятно, будет приводить к образованию множества мутантов, большинство из которых будут связываться с антигеном, некоторые из них с еще большей аффинностью. При ограниченном уровне DLL4 редкий фаг с высокой аффинностью может выдержать такую конкуренцию. Для сохранения всех мутантов с более высокой аффинностью фаги могут быть инкубированы с избытком биотинилированного DLL4, но этот биотинилированный DLL4 должен иметь более низкую молярную концентрацию, чем молярная константа аффинности мишени для DLL4. Затем фаги с высокой аффинностью связывания могут быть захвачены парамагнитными сферами, покрытыми стрептавидином. Такой «равновесный захват» дает возможность проводить отбор антител по их аффинности связывания с чувствительностью, которая позволяет из большого избытка фагов с меньшей аффинностью выделить мутантные клоны, имеющие лишь в два раза более высокую аффинность. Условия, используемые для промывки фагов, связанных с твердой фазой, могут быть также изменены для выявления их отличий исходя из кинетики диссоциации.
Клоны анти-DLL4-антител могут быть отобраны по их активности. В одном из своих вариантов настоящее изобретение относится к анти-DLL4-антителам, которые блокируют связывание рецептора Notch (такого как Notch1, Notch2, Notch3 и/или Notch4) с DLL4, но не блокируют связывание рецептора Notch со вторым белком. Fv-клоны, соответствующие таким анти-DLL4-антителам, могут быть отобраны путем: (1) выделения клонов анти-DLL4-антител из фаговой библиотеки как описано выше, и, но необязательно, амплификации выделенной популяции фаговых клонов путем культивирования такой популяции в подходящем бактериальном хозяине; (2) выбора DLL4 и второго белка, против которого необходимо продуцировать блокирующую и не-блокирующую активность соответственно; (3) адсорбции фаговых клонов анти-DLL4-антител на иммобилизованном DLL4; (4) использования избытка второго белка для элюирования любых нежелательных клонов, распознающих DLL4-связывающиеся детерминанты, которые перекрываются со связывающими детерминантами второго белка или имеют общие с ним связывающие детерминанты; и (5) элюирования клонов, которые остаются адсорбированными после проведения стадии (4). Клоны с нужными блокирующими/неблокирующими свойствами могут быть также, но необязательно, обогащены путем проведения одной или нескольких повторных процедур отбора, описанных в настоящей заявке.
ДНК, кодирующая продуцируемые гибридомой моноклональные антитела или Fv-клоны фагового представления согласно изобретению, могут быть легко выделены и секвенированы в соответствии со стандартными процедурами (например, с использованием олигонуклеотидных праймеров, которые способны специфически амплифицировать представляющие интерес кодирующие области тяжелой и легкой цепей из гибридомы или фаговой ДНК-матрицы). После выделения эта ДНК может быть встроена в экспрессионные векторы, которые затем трансфецируют в клетки-хозяева, такие как клетки E.coli, обезьяньи клетки СОS, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые в иных случаях не продуцируют белок иммуноглобулина, в результате чего в этих рекомбинантных клетках-хозяевах синтезируются нужные моноклональные антитела. Обсуждение рекомбинантной экспрессии антитело-кодирующей ДНК в бактериях можно найти в обзорных статьях Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) и Pluckthun, Immunol. Revs., 130:151-188 (1992).
ДНК, кодирующая Fv-клоны согласно изобретению, может быть объединена с известными последовательностями ДНК, кодирующими константные области тяжелой цепи и/или легкой цепи (например, соответствующие последовательности ДНК могут быть получены, как описано в публикации Kabat et al., см. выше) с образованием клонов, кодирующих полноразмерные тяжелые и/или легкие цепи или их фрагменты. Следует отметить, что в этих целях могут быть использованы константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и такие константные области могут быть получены от человека или животных любых видов. В определение используемого здесь термина «химерное» и «гибридное» антитело входит Fv-клон, происходящий от ДНК вариабельного домена животного одного вида (например, человека), который был затем присоединен к ДНК константной области животного другого вида с образованием кодирующей(их) последовательности(ей) «гибрида» полноразмерной тяжелой цепи и/или легкой цепи. В предпочтительном варианте изобретения Fv-клон, происходящий от ДНК человеческого вариабельного домена, присоединяют к ДНК человеческой константной области с образованием кодирующей(их) последовательности(ей) для всех человеческих полноразмерных тяжелых и/или легких цепей и/или их фрагментов.
ДНК, кодирующая анти-DLL4-антитело, происходящее от гибридомы согласно изобретению, может быть также модифицирована, например, путем замены гомологичных мышиных последовательностей, происходящих от гибридомного клона, кодирующей последовательностью для человеческих константных доменов тяжелой и легкой цепи (например, как в способе, описанном Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 (1984)). ДНК, кодирующая антитело, происходящее от гибридомы или Fv-клона, или его фрагмент, может быть также модифицирована путем ковалентного связывания иммуноглобулин-кодирующей последовательности с полноразмерной последовательностью, кодирующей не-иммуноглобулиновый полипептид, или с ее частью. Таким образом могут быть получены «химерные» или «гибридные» антитела, обладающие специфичностью связывания с антителами, происходящими от Fv-клона или гибридомного клона.
Фрагменты антител
Настоящее изобретение охватывает фрагменты антител. В некоторых случаях предпочтительней использовать фрагменты антител, не полноразмерные антитела. Чем меньше размер фрагментов, тем быстрее их клиренс и выше вероятность улучшения доставки в солидные опухоли.
Для получения фрагментов антител были разработаны различные методы. Традиционно эти фрагменты образуются в результате протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако эти фрагменты могут продуцироваться непосредственно рекомбинантными клетками-хозяевами. Fab-, Fv- и scFv-фрагменты антител могут экспрессироваться в клетках E.coli и секретироваться из этих клеток, что облегчает продуцирование этих фрагментов в больших количествах. Фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно Fab'-SH-фрагменты могут быть непосредственно выделены из E.coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом F(ab')2-фрагменты могут быть выделены непосредственно из культуры рекомбинантной клетки-хозяина. Fab- и F(ab')2-фрагменты с увеличенным временем полужизни in vivo, содержащие остатки эпитопа, связывающегося с рецептором «спасения», описаны в патенте США № 5869046. Специалистам известны и другие способы получения фрагментов антител. В других вариантах изобретения, выбранным антителом является одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185, патенты США №№ 5571894 и 5587458. Fv и sFv принадлежат только к тем видам, которые содержат интактные комбинированные сайты, лишенные константных областей, поэтому они могут быть подходящими для снижения уровней неспецифического связывания при их использовании in vivo. Гибридные scFv-белки могут быть сконструированы с получением гибрида эффекторного белка у амино- или карбокси-конца scFv. См. Antibody Engineering, ed. Borrebaeck, см. выше. Фрагментом антитела может быть также “линейное антитело”, например антитело, описанное в патенте США № 5641870. Такие линейные фрагменты антител могут быть моноспецифическими или биспецифическими.
Гуманизованные антитела
Настоящее изобретение охватывает гуманизованные антитела. Специалистам известны различные методы гуманизации не-человеческих антител. Так, например, гуманизованное антитело может иметь один или несколько введенных в него аминокислотных остатков, происходящих от источника, не являющегося человеком. Эти не-человеческие аминокислотные остатки часто называют “импортными” остатками, которые обычно берут из “импортного” вариабельного домена. Гуманизация может быть осуществлена, в основном, методом Винтера (Winter) и сотрудниками (Jones et al. (1986) Nature 321:522-525; Riechmann et al. (1988) Nature 332:323-327; Verhoeyen et al. (1988) Science 239:1534-1536), путем замены последовательностей гипервариабельной области соответствующими последовательностями человеческого антитела. В соответствии с этим такие “гуманизованные” антитела представляют собой химерные антитела (патент США № 4816567), в которых, в основном, меньшая часть по сравнению с вариабельным доменом интактного человеческого антитела заменена соответствующей последовательностью, происходящей от не-человеческого антитела. Фактически гуманизованные антитела обычно представляют собой человеческие антитела, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки каркасной области (FR) заменены остатками, происходящими от аналогичных участков антител грызунов.
Для снижения антигенности при создании гуманизованных антител очень важно выбрать вариабельные домены как легкой, так и тяжелой цепи человеческого антитела. В соответствии с так называемым методом подгонки последовательность вариабельного домена антитела грызуна скринируют по всей библиотеке известных последовательностей вариабельных доменов человеческого антитела. Затем человеческую последовательность, которая является наиболее схожей с последовательностью грызунов, берут в качестве человеческой каркасной области для создания гуманизованного антитела (Sims et al. (1993) J. Immunol. 151:2296; Chothia et al. (1987), J. Mol. Biol. 196:901). В другом методе используют конкретную каркасную область, происходящую от консенсусной последовательности всех человеческих антител конкретной подгруппы легких или тяжелых цепей. Та же самая каркасная область может быть использована для нескольких различных гуманизованных антител (Carter et al. (1992), Proc. Natl. Acad. Sci., USA, 89:4285; Presta et al. (1993), J. Immunol, 151:2623).
Важно также то, что антитела могут быть гуманизованы с сохранением высокой аффинности по отношению к данному антигену и других благоприятных биологических свойств. В соответствии с одним из методов, для достижения этой цели гуманизованные антитела могут быть получены путем анализа исходных последовательностей и различных концептуальных гуманизованных продуктов с использованием трехмерных моделей родительских и гуманизованных последовательностей. Трехмерные иммуноглобулиновые модели являются общедоступными и хорошо известны специалистам. Существуют компьютерные программы, которые иллюстрируют и представляют вероятные трехмерные конформационные структуры отобранных последовательностей-кандидатов иммуноглобулинов. Исследование этих представлений позволяет проанализировать вероятную роль данных остатков в функционировании последовательностей иммуноглобулина-кандидата, то есть остатков, которые влияют на способность иммуноглобулина-кандидата связываться с его антигеном. Таким образом, остатки FR могут быть выбраны из реципиентных и “импортных” последовательностей и объединены, в результате чего может быть получено желаемое антитело с нужными свойствами, такими как повышенная аффинность по отношению к антигену(ам)- мишени(ям). В общих чертах, остатки гипервариабельной области непосредственно влияют на связывание с антигеном, в основном, участвуют в таком связывании.
Человеческие антитела
Человеческие анти-DLL4-антитела согласно изобретению могут быть сконструированы путем объединения последовательности(ей) вариабельного домена Fv-клона, выбранной(ых) из библиотек фагового представления, происходящих от человека, с известной(ыми) последовательностью(тями) человеческого константного домена, как описано выше. Альтернативно человеческие моноклональные анти-DLL4-антитела согласно изобретению могут быть получены гибридомным методом. Человеческие миеломные клеточные линии и гетеромиеломные клеточные линии «мышь - человек», используемые для продуцирования человеческих моноклональных антител, описаны, например, в публикациях Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991).
В настоящее время могут быть получены трансгенные животные (например, мыши), которые будут способны после иммунизации продуцировать полный репертуар человеческих антител без продуцирования эндогенного иммуноглобулина. Так, например, сообщалось, что гомозиготная делеция гена области стыка в тяжелой цепи (JН) антитела у химерных и мутантных мышей зародышевой линии приводит к полному ингибированию продуцирования эндогенного антитела. Перенос набора генов иммуноглобулина человеческой зародышевой линии таким мутантным мышам зародышевой линии может приводить к продуцированию человеческих антител после стимуляции антигеном. См., например, Jakobovits et al., Proc. Natl. Acad. Sci., USA, 90:2551 (1993); Jakobovits et al., Nature 362:255-258 (1993); Bruggerman et al., Year in Immunol, 7:33 (1993).
Для получения человеческих антител от животных, не являющихся человеком, например грызунов, где человеческое антитело обладает такой же аффинностью и специфичностью по отношению к исходному не-человеческому антителу, может быть также применен метод перестановки генов. В соответствии с этим методом, который также называется «импринтингом эпитопа», вариабельную область тяжелой или легкой цепи фрагмента не-человеческого антитела, полученную методами фагового представления, описанными выше, заменяют набором человеческих генов V-домена с получением популяции химер «не-человеческая цепь/человеческая цепь scFv или Fab». Отбор с использованием антигена позволяет выделять химеры «не-человеческая цепь/человеческая цепь scFv или Fab», где указанная человеческая цепь восстанавливает антигенсвязывающий сайт, разрушенный после удаления соответствующей не-человеческой цепи в первичном клоне фагового представления, то есть эпитоп определяет (закрепляет) выбор партнера для человеческой цепи. Если этот процесс повторить для замены оставшейся не-человеческой цепи, то может быть получено человеческое антитело (см. заявку PCT WO 93/06213, опубликованную 1 апреля, 1993). В отличие от традиционного способа гуманизации не-человеческих антител путем присоединения CDR, этот способ позволяет получить полностью человеческие антитела, которые не имеют остатков FR или CDR, происходящих не от человека.
Биспецифические антитела
Биспецифические антитела представляют собой моноклональные, предпочтительно человеческие или гуманизованные антитела, которые обладают специфичностью связывания по меньшей мере с двумя различными антигенами. В данном случае одной из специфичностей связывания является специфичность связывания с DLL4, другой специфичностью является специфичность к любому другому антигену. Репрезентативные биспецифические антитела могут связываться с двумя различными эпитопами белка DLL4. Биспецифические антитела могут быть также использованы для определения локализации цитотоксических агентов в клетках, которые экспрессируют DLL4. Такие антитела имеют DLL4-связывающую ветвь, и ветвь, которая связывается с цитотоксическим агентом (например, с сапорином, антителом против интерферона-α, винкаалкалоидом, цепью рицина А, метотрексатом или гаптеном, связанным с радиоактивным изотопом). Биспецифические антитела могут быть получены в виде полноразмерных антител или фрагментов антител (например, биспецифических F(ab')2-антител).
Методы получения биспецифических антител известны специалистам. Традиционное рекомбинантное продуцирование биспецифических антител основано на коэкспрессии двух пар тяжелой цепи - легкой цепи иммуноглобулина, где две тяжелые цепи обладают различной специфичностью (Millstein & Cuello, Nature, 305:537 (1983)). Эти гибридомы (квадромы) из-за рандомизированного набора тяжелой и легкой цепей иммуноглобулина продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна молекула имеет “правильную” биспецифическую структуру. Очистка такой “правильной” молекулы, которую обычно осуществляют путем постадийного проведения аффинной хроматографии, достаточно затруднена и дает низкий выход продукта. Аналогичные процедуры описаны в заявке WO93/08829, опубликованной 13 мая 1993, и в работе Traunecker et al., EMBO J., 10:3655 (1991).
В соответствии с другим и более предпочтительным подходом вариабельные домены антитела с нужными специфичностями связывания (объединенные сайты “антитело-антиген”) присоединяют к последовательностям константного домена иммуноглобулина. Такое слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области, СН2 и СН3. При этом предпочтительно, чтобы по меньшей мере в одном из гибридов присутствовала первая константная область тяжелой цепи (СН1), содержащая сайт, необходимый для связывания с легкой цепью. ДНК, кодирующую гибриды тяжелой цепи иммуноглобулина и, если это необходимо, легкой цепи иммуноглобулина, встраивают в отдельные экспрессионные векторы, и ко-трансфецируют в подходящий организм-хозяин. Это обеспечивает высокую степень гибкости при коррекции соотношений трех полипептидных фрагментов в тех вариантах изобретения, в которых неравные содержания трех полипептидных цепей, используемых в данной конструкции, дают оптимальные выходы. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессионный вектор, если экспрессия по меньшей мере двух полипептидных цепей при равных соотношениях дает высокие выходы, или если такие соотношения не имеют решающего значения.
В предпочтительном варианте такого подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина, имеющей первую специфичность связывания, в одной ветви, и гибридной пары “тяжелая цепь - легкая цепь” иммуноглобулина (обеспечивающей вторую специфичность связывания) в другой ветви. Было обнаружено, что такая асимметричная структура облегчает отделение нужного биспецифического соединения от нежелательных комбинаций иммуноглобулиновых цепей, поскольку присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает простой способ его выделения. Этот способ описан в WO 94/04690. Более подробное описание получения биспецифических антител можно найти, например, в работе Suresh et al., Methods in Enzymology, 121:210 (1986).
В соответствии с другим подходом граница между парой молекул антитела может быть сконструирована в целях максимизации процента гетеродимеров, выделенных из рекомбинантной клеточной культуры. Такая граница, предпочтительно содержит по меньшей мере часть домена СН3 константного домена антитела. В этом методе небольшие боковые цепи одной или нескольких аминокислот в пограничной области первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозина или триптофана). В пограничной области второй молекулы антитела создают компенсирующие “полости”, имеющие размер, идентичный или аналогичный размеру более крупной(ых) боковой(ых) цепи(ей), путем замены крупных боковых цепей аминокислот более мелкими боковыми цепями (например, аланина или треонина). Это позволяет увеличить выход гетеродимеров по отношению к другим нежелательным конечным продуктам, таким как гомодимеры.
Биспецифическими антителами являются перекрестно-связанные или «гетероконъюгированные» антитела. Так, например, одно из антител в гетероконъюгате может быть связано с авидином, другое с биотином. Было высказано предположение, что такие антитела могут быть, например, нацеливать клетки иммунной системы на нежелательные клетки (патент США № 4676980), поэтому они могут быть использованы для лечения ВИЧ-инфекций (WO 91/00360, WO 92/00373 и EP 03089). Гетероконъюгированные антитела могут быть получены с применением любых стандартных методов перекрестного связывания. Подходящие перекрестно-связывающие агенты хорошо известны специалистам и описаны в патенте США № 4676980 наряду с различными методами перекрестного связывания.
Методы продуцирования биспецифических антител из фрагментов антител были также описаны в литературе. Так, например, биспецифические антитела могут быть получены путем химического связывания. В работе Brennan et al., Science, 229:81 (1985) описана процедура, в которой интактные антитела подвергают протеолитическому расщеплению с образованием F(ab')2-фрагментов. Эти фрагменты восстанавливают в присутствии агента, образующего дитиоловый комплекс, такого как арсенит натрия, для стабилизации смежных дитиолов и предотвращения образования межмолекулярной дисульфидной связи. Затем полученные Fab'-фрагменты превращают в производные тионитробензоата (TNВ). После этого одно из производных Fab'-TNВ снова превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого Fab'-TNВ-производного, в результате чего получают биспецифическое антитело. Такие продуцированные биспецифические антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
Последние достижения в данной области позволяют проводить прямое выделение из E.coli Fab'-SH-фрагментов, которые могут быть химически связаны с образованием биспецифических антител. В работе Shalaby et al., J. Exp. Med. 175:217-225 (1992) описано продуцирование полностью гуманизованной молекулы F(ab')2 биспецифического антитела. Каждый Fab'-фрагмент был отдельно секретирован из E.coli и подвергнут прямому химическому связыванию in vitro с образованием биспецифического антитела. Полученное таким образом биспецифическое антитело обладает способностью связываться с клетками, сверхэкспрессирующими рецептор НЕR2 и с нормальными человеческими Т-клетками, также запускать литическую активность человеческих цитотоксических лимфоцитов, направленную против человеческих клеток-мишеней опухоли молочной железы.
Были также описаны другие методы получения и выделения фрагментов биспецифического антитела непосредственно из рекомбинантной клеточной культуры. Так, например, биспецифические антитела были продуцированы с использованием “лейциновых молний”. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии, происходящие от белков Fos и Jun, были присоединены к Fab'-частям двух других антител путем лигирования генов. Гомодимеры антитела были восстановлены в шарнирной области с образованием мономеров, затем снова окислены с образованием гетеродимеров антитела. Этот метод может быть также использован для продуцирования гомодимеров антитела. Технология “диантител”, описанная Hollinger et al., Proc. Natl. Acad. Sci., USA, 90:6444-6448 (1993), обеспечивает альтернативный механизм получения фрагментов биспецифического антитела. Эти фрагменты содержат вариабельный домен тяжелой цепи (VН), соединенный с вариабельным доменом легкой цепи (VL) посредством линкера, который является слишком коротким для создания пары между двумя доменами одной и той же цепи. В соответствии с этим VН- и VL-домены одного фрагмента вынуждены спариваться с комплементарными VL- и VH-доменами другого фрагмента, образуя тем самым два антигенсвязывающих сайта. Также была описана другая стратегия получения фрагментов биспецифического антитела с использованием одноцепочечных Fv(sFv)-димеров. См. Gruber et al., J. Immunol., 152:5368 (1994).
Рассматриваются также антитела с более чем двумя валентностями. Так, например, могут быть получены и триспецифические антитела. Tutt et al., J. Immunol. 147:60 (1991).
Поливалентные антитела
Поливалентное антитело может быть быстрее интернализовано (и/или оно может быстрее подвергаться катаболизму), чем двухвалентное антитело, благодаря экспрессии антигена в клетке, с которым связываются антитела. Антителами согласно изобретению могут быть поливалентные антитела (не принадлежащие к классу IgM) с тремя или более антигенсвязывающими сайтами (например, четырехвалентные антитела), которые могут быть легко продуцированы посредством рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи данного антитела. Поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих сайтов. Предпочтительный домен димеризации содержит (или состоит из них) Fc-область или шарнирную область. В этом случае антитело может содержать Fc-область и три или более антигенсвязывающих сайта, расположенных от амино-конца по отношению к Fс-области. Описанное здесь предпочтительное поливалентное антитело содержит (или состоит из них) от трех примерно до восьми антигенсвязывающих сайтов, предпочтительно четыре антигенсвязывающих сайта. Поливалентное антитело содержит по меньшей мере одну полипептидную цепь (а предпочтительно две полипептидных цепи), где указанная(ые) полипептидная(ые) цепь(и) содержит(ат) два или более вариабельных доменов. Так, например, полипептидная(ые) цепь(и) может (могут) содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидную цепь Fc-области, X1 и X2 представляют собой аминокислоту или полипептид, и n равно 0 или 1. Так, например, полипептидная(ые) цепь(и) может (могут) содержать: цепь «VH-CH1-гибкий линкер-VH-CH1-Fc-область»; или цепь «VH-CH1-VH-CH1-Fc-область». Поливалентное антитело согласно изобретению также предпочтительно содержит по меньшей мере два (а предпочтительно четыре) полипептида вариабельного домена легкой цепи. Описанное здесь поливалентное антитело может, например, содержать примерно от двух до восьми полипептидов вариабельного домена легкой цепи. Рассматриваемые здесь полипептиды вариабельного домена легкой цепи содержат вариабельный домен легкой цепи, также, но необязательно, домен CL.
Варианты антител
В некоторых вариантах изобретения рассматривается модификация(и) аминокислотной последовательности описанных здесь антител. Так, например, может оказаться желательным повысить аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела получают путем введения соответствующих нуклеотидных замен в нуклеиновую кислоту, кодирующую антитело, или путем пептидного синтеза. Такими модификациями являются, например, делеции и/или инсерции и/или замены остатков в аминокислотных последовательностях антитела. При этом в конечную конструкцию могут быть введены любые комбинации делеций, инсерций и замен при условии, что такая конечная конструкция будет обладать нужными свойствами. Аминокислотные модификации могут быть введены в рассматриваемую аминокислотную последовательность антитела в процессе получения такой последовательности.
Метод, применяемый для идентификации некоторых остатков или областей антитела, которые имеют предпочтительную локализацию для мутагенеза, называется “аланин-сканирующим мутагенезом” и описан Cunningham & Wells (1989), Science, 244:1081-1085. В этом методе остаток или группу нужных остатков (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) идентифицируют и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно аланином или полиаланином) для влияния на взаимодействие этих аминокислот с антигеном. Затем локализацию аминокислот, проявляющих функциональную чувствительность к таким заменам, уточняют путем введения дополнительных или других модификаций в положения замены. Так, например, положение для введения замены в аминокислотную последовательность может быть определено заранее, тогда как природа мутации per se необязательно должна быть определена заранее. Так, например, для анализа эффективности мутации в данном сайте Ala-сканирующий или неспецифический мутагенез осуществляют в нужном кодоне или в нужной области, и экспрессированные иммуноглобулины скринируют на нужную активность.
Вставками в аминокислотные последовательности являются вставки у амино- и/или карбокси-концов, образующие гибриды, имеющие длину от одного остатка до полипептидов, содержащих сто или более остатков, также вставки внутри последовательности, состоящие из одного или множества аминокислотных остатков. Примерами концевых инсерций является антитело с N-концевым метионильным остатком или антитело, присоединенное к цитотоксическому полипептиду. Другими инсерционными вариантами молекулы антитела являются гибриды, например N- или С-концов антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Гликозилирование полипептидов обычно является либо N-связанным либо О-связанным. N-связанное гликозилирование означает присоединение углеводной группы к боковой цепи аспарагинового остатка. Трипептидные последовательности “аспарагин-Х-серин” и “аспарагин-Х-треонин”, где Х означает любую аминокислоту, за исключением пролина, представляют собой последовательности распознавания для ферментативного присоединения углеводной части к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде способствует созданию потенциального сайта гликозилирования. О-связанное гликозилирование означает присоединение одного из сахаров, таких как N-ацетилгалактозамин, галактоза или ксилоза к гидроксиаминокислоте, главным образом, к серину или треонину, хотя ими могут быть также 5-гидроксипролин или 5-гидроксилизин.
Присоединение сайтов гликозилирования к антителу обычно осуществляют путем такой модификации аминокислотной последовательности, в результате которой эта аминокислотная последовательность будет содержать одну или несколько вышеописанных трипептидных последовательностей (для сайтов N-связанного гликозилирования). Такая модификация может быть также осуществлена путем добавления к последовательности одного или нескольких сериновых или треониновых остатков или их замены в последовательности исходного антитела (для сайтов О-связанного гликозилирования).
Если антитело содержит Fc-область, то может быть модифицирован углевод, присоединенный к этой области. Так, например, антитела, имеющие углевод со зрелой структурой, в котором отсутствует фукоза и который присоединен к Fc-области антитела, описаны в заявке на патент США № 2003/0157108, (Presta, L.). См. также US 2004/0093621 A1 (Kyowa Hakko Kogyo Co., Ltd). Антитела, содержащие в своем углеводе N-ацетилглюкозамин (GlcNAc), разделяющий молекулу антитела пополам, где указанный углевод присоединен к Fc-области антитела, описаны в WO 03/011878, Jean-Mairet et al., и в патенте США № 6602684, Umana et al. Антитела, имеющие по меньшей мере один галактозный остаток в олигосахариде, присоединенном к Fc-области антитела, описаны в WO 1997/30087, Patel et al. См. также заявки WO 98/58964 (Raju, S.) и WO 99/22764 (Raju, S.), которые относятся к антителам с модифицированным углеводом, присоединенным к Fc-области антитела. См. также заявку США 2005/0123546 (Umana et al.), в которой описаны антигенсвязывающие молекулы с модифицированным гликозилированием.
Предпочтительный с точки зрения настоящего изобретения вариант гликозилирования включает Fc-область, где углеводная структура, присоединенная к Fc-области, не содержит фукозу. Такие варианты обладают улучшенной ADCC-функцией. Fc-область также содержит, но необязательно, одну или несколько аминокислотных замен, которые также улучшают ADCC-функцию, например замены в положениях 298, 333 и/или 334 Fc-области (нумерация остатков дана по Европейской системе нумерации). Публикациями, в которых описаны “дефукозилированные” или “дефицитные по фукозе” антитела, являются, например, заявки на патент США №№ 2003/0157108; WO 2001/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035778; WO 2005/053742; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примерами клеточных линий, продуцирующих дефукозилированные антитела, являются клетки Lec13 CHO, дефицитные по фукозилированию белка (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); заявка на патент США № 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., в частности пример 11), и дефицитные клеточные линии, такие как клетки СНО, дефицитные по гену альфа-1,6-фукозилтрансферазы, FUT8, (Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004)).
Вариантом другого типа является вариант аминокислотной замены. Такие варианты антител имеют в своей молекуле по меньшей мере один аминокислотный остаток, замененный другим остатком. Сайтами, которые представляют наибольший интерес для мутагенеза путем замен, являются гипервариабельные области, однако могут также рассматриваться FR-модификации. Консервативные замены представлены в табл.1 под заголовком «Предпочтительные замены». Если такие замены приводят к изменению биологической активности, то могут быть введены более значительные замены, называемые в табл.1 «репрезентативными заменами», или также описанные ниже в разделе, относящемся к классу аминокислот, затем полученные продукты могут быть скринированы.
Значительные изменения биологических свойств антитела могут быть достигнуты путем выбора замен, которые значительно отличаются по своему влиянию на (а) структуру полипептидного остова в области замены, например складчатую или спиральную конформацию, (b) заряд или гидрофобность молекулы в нужном сайте, или (с) объем боковой цепи. Природные остатки подразделяются на нижеследующие группы по общим свойствам боковых цепей:
(1) гидрофобные остатки: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные остатки: Cys, Ser, Thr, Asn, Gln;
(3) кислотные остатки: Asp, Glu;
(4) основные остатки: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro; и
(6) ароматические остатки: Trp, Tyr, Phe.
Не-консервативные замены приводят к заменам члена одного из этих классов членом другого класса.
Одним из репрезентативных вариантов замены является замена одного или нескольких остатков гипервариабельной области родительского антитела (например, гуманизованного или человеческого антитела). В общих чертах, полученный(ые) вариант(ы), выбранный(ные) для дальнейшей разработки, будет способствовать улучшению биологических свойств по сравнению со свойствами родительского антитела, от которого они происходят. Стандартный способ генерирования таких вариантов с заменами предусматривает созревание аффинности с применением метода фагового представления. Для этого несколько сайтов гипервариабельной области (например, 6-7 сайтов) подвергают мутации для генерирования всех возможных аминокислотных замен в каждом сайте. Генерированные таким образом антитела могут быть представлены на частицах нитчатого фага в виде гибридов с продуктом гена III, упакованных в каждой частице фага М13. Затем варианты, представленные на фаге, скринируют на их биологическую активность (например, аффинность связывания), как описано в настоящей заявке. Для идентификации сайтов гипервариабельной области, являющихся кандидатами на модификацию, может быть осуществлен аланин-сканирующий мутагенез, который позволяет идентифицировать остатки гипервариабельной области, играющие важную роль в связывании с антигеном. Альтернативно или дополнительно может оказаться полезным проанализировать кристаллическую структуру комплекса антиген-антитело для идентификации контактных участков между антителом и антигеном. Такие контактные остатки и соседние остатки являются кандидатами на замену, осуществляемую в соответствии с разработанными здесь способами. После генерирования таких вариантов панель этих вариантов подвергают скринингу, описанному в настоящей заявке, и антитела, обнаруживающие превосходные свойства в одном или нескольких релевантных анализах, могут быть выбраны для дальнейшего исследования.
Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотных последовательностей антитела, получают различными методами, известными специалистам. Такими методами являются, но не ограничивается ими, выделение из природного источника (в случае природных вариантов аминокислотных последовательностей) или получение с помощью опосредуемого олигонуклеотидом (или сайт-направленного) мутагенеза, ПЦР-мутагенеза и кластерного мутагенеза ранее полученного варианта или немодифицированного варианта антитела.
Может оказаться желательным введение одной или нескольких модификаций аминокислот в Fc-области иммуноглобулиновых полипептидов согласно изобретению с получением варианта Fc-области. Вариант Fc-области может содержать последовательность человеческой Fc-области (например, человеческой Fc-области IgG1, IgG2, IgG3 или IgG4), включающую аминокислотную модификацию (например, замену) в одном или нескольких положениях аминокислот, включая положение шарнирного цистеина. В соответствии с настоящим описанием и известным уровнем техники следует отметить, что в некоторых вариантах изобретения антитело, используемое в способах согласно изобретению, может содержать одну или несколько модификаций по сравнению с аналогом антитела дикого типа, например в Fc-области. Тем не менее такие антитела должны, по существу, сохранять свойства его аналога дикого типа, необходимые для его терапевтического применения. Так, например, считается, что некоторые модификации могут быть введены в Fc-область, что будет приводить к изменению (то есть к улучшению или ослаблению) связывания с C1q и/или комплемент-зависимой цитотоксичности (CDC), например, как описано в WO 99/51642. См., также Duncan & Winter Nature 322:738-40 (1988); патент США №. 5648260; патент США №. 5624821; и заявку WO 94/29351, в которых рассматриваются другие примеры вариантов Fc-области. В WO 00/42072 (Presta) и WO 2004/056312 (Lowman) описаны варианты антител с повышенным или пониженным уровнем связывания с FcRs. Содержание этих патентных публикаций конкретно вводится в настоящее описание посредством ссылки. См., также Shields et al. J. Biol. Chem. 9(2): 6591-6604 (2001). Антитела с более длительным временем полужизни и с повышенным уровнем связывания с Fc-рецептором, имеющимся у новорожденных, (FcRn), который является ответственным за передачу материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) and Kim et al., J. Immunol. 24:249 (1994)), описаны в US 2005/0014934 A1 (Hinton et al.). Такие антитела включают Fc-область с одной или несколькими описанными заменами, которые повышают уровень связывания Fc-области с FcRn. Полипептидные варианты с модифицированными аминокислотными последовательностями в Fc-области и с повышенной или пониженной способностью к связыванию с C1q описаны в патенте США № 6194551B1 и в WO 99/51642. Содержание этих патентных публикаций конкретно вводится в настоящее описание посредством ссылки. См. также Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
Производные антител
Антитела согласно изобретению могут быть дополнительно модифицированы так, чтобы они содержали другие не-белковые молекулы, которые известны специалистам и являются легко доступными. Предпочтительными молекулами, подходящими для дериватизации антител, являются водорастворимые полимеры. Неограничивающими примерами водорастворимых полимеров являются полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (гомополимеры или статистические сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. При промышленном изготовлении следует отдать предпочтение пропиональдегиду полиэтиленгликоля благодаря его стабильности в воде. Этот полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединяемых к антителу, может варьироваться, и если присоединяют более чем один полимер, то эти полимеры могут иметь одинаковые или различные молекулы. В общих чертах, число и/или тип полимеров, используемых для дериватизации, могут быть выбраны исходя из нескольких факторов, включая, но не ограничиваясь ими, конкретные свойства или функции антитела, которые должны быть улучшены, независимо от конкретных условий терапии, при которых будет использоваться указанное производное антитела и т.п.
Скрининг антител с нужными свойствами
Антитела согласно изобретению могут быть охарактеризованы по их физическим/химическим свойствам и биологическим функциям с помощью различных анализов, известных специалистам. В некоторых вариантах изобретения антитела характеризуются по любому одному или нескольким свойствам, таким как связывание с DLL4; и/или ослабление или блокирование активации рецептора Notch; и/или ослабление или блокирование молекулярного сигнала, передаваемого после передачи сигнала рецептора Notch, и/или нарушение или блокирование связывания рецептора Notch с DLL4; и/или стимуляция пролиферации эндотелиальных клеток; и/или ингибирование дифференцировки эндотелиальных клеток; и/или ингибирование артериальной дифференциации; и/или ингибирование сосудистой перфузии опухоли; и/или лечение и/или предупреждение развития опухоли, клеточно-пролиферативного расстройства или рака; и/или лечение или предупреждение расстройства, ассоциированного с экспрессией и/или активностью DLL4; и/или лечение или предупреждение расстройства, ассоциированного с экспрессией и/или активностью рецептора Notch.
Очищенные антитела могут быть также охарактеризованы с помощью различных анализов, включая, но не ограничиваясь ими, N-концевое секвенирование, анализ аминокислот, эксклюзионная хроматография в не-денатурирующих условиях, жидкостная хроматография высокого давления (ЖХВД), масс-спектрометрия, ионообменная хроматография и гидролиз папаином.
В некоторых вариантах изобретения продуцируемые здесь антитела анализируют на их биологическую активность. В некоторых вариантах изобретения антитело согласно изобретению тестируют на их антигенсвязывающую активность. Анализами на связывание с антигеном, которые известны специалистам и могут быть использованы в настоящей заявке, являются, но не ограничиваются ими, любой из анализов на прямое или конкурентное связывание, проводимых такими методами, как вестерн-блот-анализы, радиоиммуноанализы, ELISA (твердофазный иммуноферментный анализ), «сэндвич»-иммуноанализы, анализы с применением иммунопреципитации, флуоресцентные иммуноанализы и иммуноанализы с использованием белка А. Репрезентативные анализы на связывание с антигеном описаны ниже в разделе «Примеры».
В еще одном своем варианте настоящее изобретение относится к моноклональным анти-DLL4-антителам, которые конкурируют с антителами 26.6, 26.14, 26.20, 26.34 и/или 26.82 за связывание с DLL4. Такими антителами-конкурентами являются антитела, распознающие эпитоп DLL4, который является аналогичным эпитопу или перекрывается с эпитопом DLL4, распознаваемым антителами 26.6, 26.14, 26.20, 26.34 и/или 26.82. Такие антитела-конкуренты могут быть получены путем скрининга супернатантов на анти-DLL4 гибридому по конкурентному связыванию иммобилизованного DLL4 с мечеными антителами 26.6, 26.14, 26.20, 26.34 и/или 26.82. Супернатант гибридомы, содержащий антитело-конкурент, будет способствовать снижению количества связанного меченого антитела, детектируемого в рассматриваемой смеси для конкурентного связывания по сравнению с количеством связанного меченого антитела, детектируемого в контрольной смеси для связывания, содержащей иррелевантное антитело (или вообще не содержащей антитела). Любой из описанных здесь анализов на конкурентное связывание является подходящим для его применения в вышеописанной процедуре.
В другом свое аспекте настоящее изобретение относится к моноклональному анти-DLL4-антителу, содержащему одну или несколько (например, 2, 3, 4, 5 и/или 6) HVR антител 26.6, 26.14, 26.20, 26.34 и/или 26.82. Моноклональное анти-DLL4-антитело, содержащее одну или несколько HVR антител 26.6, 26.14, 26.20, 26.34 и/или 26.82, может быть сконструировано путем присоединения одной или нескольких HVR антител 26.6, 26.14, 26.20, 26.34 и/или 26.82 к матричной последовательности антитела, например к последовательности человеческого антитела, которое наиболее соответствует мышиной последовательности родительского антитела или консенсусной последовательности всех человеческих антител в конкретной подгруппе легкой цепи или тяжелой цепи родительского антитела, и экспрессии полученной(ых) химерной(ых) последовательности(ей) вариабельной области легкой и/или тяжелой цепи в присутствии или в отсутствие сопутствующей(их) последовательности(ей) константной области в рекомбинантных клетках-хозяевах, описанных в настоящей заявке.
Анти-DLL4-антитела согласно изобретению, обладающие уникальными свойствами, описанными в настоящей заявке, могут быть получены путем скрининга клонов анти-DLL4 гибридом на нужные свойства любым стандартным методом. Так, например, если желательно использовать моноклональное анти-DLL4-антитело, блокирующее или неблокирующее связывание рецепторов Notch с DLL4, то такое антитело-кандидат может быть протестировано в анализе на конкурентное связывание, таком как ELISA на конкурентное связывание, где лунки планшетов покрывают DLL4, затем на эти покрытые планшеты наносят раствор антитела, в избыточном количестве представляющего интерес рецептора Notch, и связанное антитело подвергают ферментативному детектированию, например контактированию связанного антитела с ПХ-конъюгированным анти-Ig-антителом или биотинилированным анти-Ig-антителом с развитием цветовой ПХ-реакции, например, путем проявления планшетов с использованием стрептавидина-ПХ и/или пероксида водорода, и детектирования цветовой ПХ-реакции с помощью спектрофотометрии на 490 нм в планшет-ридере для ELISA.
В одном из своих вариантов настоящее изобретение относится к модифицированному антителу, которое обладает некоторыми, но не всеми эффекторными функциями, что делает его желательным антителом-кандидатом для применения в различных целях, где время полужизни антитела in vivo является важным фактором, некоторые эффекторные функции (такие как комплемент-зависимая цитотоксичность и ADCC) не являются необходимыми или даже являются нежелательными. В некоторых вариантах изобретения измеряют Fc-активности продуцируемого иммуноглобулина для гарантии сохранения только нужных свойств. Анализы на цитотоксичность in vitro и/или in vivo могут быть проведены для подтверждения ослабления/истощения CDC- и/или ADCC-активностей. Так, например, могут быть проведены анализы на связывание с Fc-рецептором (FcR) для гарантии того, что антитело не будет связываться с FcγR (а следовательно, вероятно, не будет обладать ADCC-активностью), но будет сохранять свою способность связываться с FcRn. Первичные клетки, опосредующие ADCC, то есть NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Данные, полученные для экспрессии FcR на гемопоэтических клетках, систематизированы в таблице 3 на странице 464 публикации Ravetch & Kinet Annu. Rev. Immunol. 9:457-92 (1991). Пример in vitro анализа для оценки ADCC-активности представляющей интерес молекулы описан в патентах США № 5500362 или 5821337. Эффекторными клетками, подходящими для таких анализов, являются мононуклеарные клетки периферической крови (МКПК) и природные клетки-киллеры (NK). Альтернативно или дополнительно ADCC-активность представляющей интерес молекулы может быть оценена in vivo, например, на модели животного, такой как модель, описанная Clynes et al. Proc. Natl. Acad. Sci.A 95:652-656 (1998). Для подтверждения того, что данное антитело не обладает способностью связываться с C1q, следовательно, не обладает CDC-активностью, могут быть также проведены анализы на связывание с C1q. Для оценки активации комплемента может быть проведен анализ на CDC, например анализ, описанный в публикации Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Определение уровня связывания с FcRn и клиренса/времени полужизни in vivo может быть также осуществлено методами, известными специалистам, например, описанными в разделе «Примеры».
Векторы, клетки-хозяева и рекомбинантные методы
Для рекомбинантного продуцирования антитела согласно изобретению нуклеиновую кислоту, кодирующую такое антитело, выделяют и встраивают в реплицируемый вектор для последующего клонирования (амплификации ДНК) или экспрессии. ДНК, кодирующая антитело, может быть легко выделена и секвенирована в соответствии со стандартными процедурами (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела). Для этой цели подходящими являются многие векторы. Выбор вектора отчасти зависит от используемой клетки-хозяина. Обычно предпочтительными клетками-хозяевами являются либо прокариотические клетки либо эукариотические клетки (обычно клетки млекопитающих). Следует отметить, что для этой цели могут быть использованы константные области любого изотипа, включая константные области IgG, IgМ, IgА, IgD и IgЕ, и что такие константные области могут быть получены от человека или животных любых видов.
а. Генерирование антител с использованием прокариотических клеток-хозяев
i. Конструирование вектора
Полинуклеотидные последовательности, кодирующие полипептидные компоненты антитела согласно изобретению, могут быть получены стандартными рекомбинантными методами. Нужные полинуклеотидные последовательности могут быть выделены и секвенированы из антитело-продуцирующих клеток, таких как гибридомные клетки. Альтернативно полинуклеотиды могут быть синтезированы с помощью синтезатора нуклеотидов или ПЦР-методами. После получения последовательностей, кодирующих полипептиды, эти последовательности встраивают в рекомбинантный вектор, способный реплицироваться и экспрессировать гетерологичные полинуклеотиды в прокариотических хозяевах. В целях настоящего изобретения могут быть использованы многие доступные и известные векторы. Выбор соответствующего вектора зависит, главным образом, от размера нуклеиновых кислот, встраиваемых в указанный вектор, и от конкретной клетки-хозяина, трансформируемой этим вектором. Каждый вектор содержит различные компоненты в зависимости от его функции (амплификации или экспрессии гетерологичного полинуклеотида или того и другого) и от его совместимости с конкретной клеткой-хозяином, в которой он находится. Компонентами векторов обычно являются, но не ограничиваются ими, ориджин репликации, селективный маркерный ген, промотор, сайт связывания с рибосомой (RBS), сигнальная последовательность, вставка гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
В основном, плазмидные векторы, содержащие репликон и регуляторные последовательности, происходящие от видов, совместимых с клеткой-хозяином, используются вместе с этими же хозяевами. Такой вектор обычно содержит сайт репликации, также последовательности-маркеры, способствующие проведению фенотипического отбора в трансформированных клетках. Так, например, E.coli обычно трансформируют плазмидой рВR322, происходящей от E.coli определенного вида. рВR322 содержит гены, кодирующие резистентность к ампициллину (Аmp) и к тетрациклину (Теt), и позволяет легко идентифицировать трансформированные клетки. рВR322 и ее производные или другие микробные плазмиды или бактериофаг могут также содержать промоторы, которые могут быть использованы этим микробным организмом для экспрессии эндогенных белков, либо они могут быть модифицированы так, чтобы они содержали такие промоторы. Примеры производных рВR322, используемых для экспрессии конкретных антител, подробно описаны в патенте США № 5648237, Carter et al.
Кроме того, фаговые векторы, содержащие репликон и регуляторные последовательности, совместимые с микроорганизмом-хозяином, могут быть использованы в качестве трансформирующих векторов в комбинации с этими хозяевами. Так, например, бактериофаг, такой как λGEMTM-11, может быть использован для получения рекомбинантного вектора, который может быть применен для трансформации восприимчивых клеток-хозяев, таких как E.coli LЕ392.
Экспрессионный вектор согласно изобретению может содержать две или более пар промотор-цистрон, кодирующих каждый из полипептидных компонентов. Промотором является нетранслируемая регуляторная последовательность, локализованная выше (со стороны 5'-конца) от цистрона, модулирующего ее экспрессию. Прокариотические промоторы обычно подразделяются на два класса - индуцибельные и конститутивные. Индуцибельным промотором является промотор, который инициирует повышение уровней транскрипции цистрона, находящегося под его контролем, в ответ на изменения условий культивирования, например, в присутствии или в отсутствие питательных элементов или при изменении температуры.
Большинство промоторов, распознаваемых различными потенциальными клетками-хозяевами, хорошо известны специалистам. Выбранный промотор может быть функционально присоединен к цистронной ДНК, кодирующей легкую или тяжелую цепь, путем выделения промотора из ДНК-источника посредством ее гидролиза рестриктирующими ферментами и встраивания выделенной промоторной последовательности в вектор согласно изобретению. Нативная промоторная последовательность и многие гетерологичные промоторы могут быть использованы для прямой амплификации и/или экспрессии генов-мишеней. В некоторых вариантах изобретения используются гетерологичные промоторы, поскольку они по сравнению с нативным промотором для нужных полипептидов позволяют значительно повышать уровень транскрипции и увеличивать выходы экспрессируемого гена-мишени.
Промоторами, подходящими для использования в прокариотических хозяевах, являются промотор РhoA, промоторные системы β-галактамазы и лактозы, промоторная система триптофана (trp) и гибридные промоторы, такие как промотор tac или trc. Однако могут быть также использованы и другие промоторы, которые являются функциональными в бактериях (например, другие известные бактериальные или фаговые промоторы). Нуклеотидные последовательности этих промоторов были опубликованы, что облегчает специалистам в данной области проводить их функциональное лигирование с цистронами, кодирующими нужные легкие и тяжелые цепи (Siebenlist et al. (1980) Cell 20:269), с использованием линкеров или адаптеров для доставки всех требуемых рестрикционных сайтов.
В одном из аспектов изобретения каждый цистрон в рекомбинантном векторе содержит такой компонент, как секреторная сигнальная последовательность, регулирующая транслокацию экспрессируемых полипептидов через мембрану. В общих чертах, указанной сигнальной последовательностью может быть компонент вектора либо такой последовательностью может быть часть нужного ДНК-полипептида, встраиваемого в этот вектор. Сигнальной последовательностью, выбранной в целях осуществления изобретения, должна быть последовательность, распознаваемая и процессируемая (то есть отщепляемая сигнальной пептидазой) клеткой-хозяином. В случае использования прокариотических клеток-хозяев, не распознающих и не процессирующих сигнальные последовательности, которые являются нативными для гетерологичных полипептидов, эту сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы, состоящей из лидерной последовательности щелочной фосфатазы, пенициллиназы, lpp или термостабильного энтеротоксина II (SТII), LamB, PhoE, PelB, OmpA и МВР. В одном из вариантов изобретения сигнальными последовательностями, используемыми в обоих цистронах экспрессионной системы, являются сигнальные последовательности SТII или их варианты.
В другом аспекте изобретения продуцирование иммуноглобулинов согласно изобретению может происходить в цитоплазме клетки-хозяина, поэтому в данном случае не требуется присутствия секретирующих сигнальных последовательностей в каждом цистроне. В соответствии с этим легкие и тяжелые цепи иммуноглобулина экспрессируются и подвергаются укладке и сборке с образованием функциональных иммуноглобулинов в цитоплазме. Некоторые штаммы хозяев (например, trxB --штаммы E.coli) имеют соответствующие условия в цитоплазме, которые благоприятствуют образованию дисульфидных связей, и тем самым способствуют правильной укладке и сборке субъединиц экспрессируемого белка. Proba & Pluckthun, Gene, 159:203 (1995).
Прокариотическими клетками-хозяевами, подходящими для экспрессии антител согласно изобретению, являются архебактерии (Archaebacteria) и эубактерии (Eubacteria), такие как грамотрицательныые или грамположительные микроорганизмы. Примерами подходящих бактерий являются Esсherichia (например, E.coli), Bacilli (например, B.subtilis), энтеробактерии, бактерии вида Pseudomonas (например, P.aeruginosa), Salmonella typhimurium, Serratia marcescаns, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном из вариантов изобретения используются грамотрицательные клетки. В одном из вариантов изобретения в качестве хозяев согласно изобретению используются клетки E.coli. Примерами штаммов E.coli являются штамм W3110 (Bachmann, Cellular & Molecular Biology, vol. 2 (Washington, D.C.: American Society for Microbiology, 1987), pp.1190-1219; АТСС, номер депозита № 27325) и их производные, включая штамм 33D3, имеющий генотип W3110 ΔfhuA (ΔtonA) ptr3 laq Iq lacL8 ΔompTΔ(nmpc-fepE)degP41 kanR (патент США № 5639635). Подходящими также являются и другие штаммы и их производные, такие как E.coli 294 (АТСС 31446), E.coli В, E.coliλ 1776 (АТСС 31537) и E.coli RV308 (ATCC 31608). Эти примеры являются иллюстративными, но не органичивающими. Методы конструирования производных любой из вышеупомянутых бактерий, имеющих определенные генотипы, известны специалистам и описаны, например, в публикации Bass et al., Proteins 8:309-314 (1990). Обычно соответствующие бактерии необходимо отбирать с учетом реплицируемости репликона в клетках бактерии. Так, например, бактерии E.coli, Serratia или Salmonella могут быть подходящими для их использования в качестве хозяина, если для доставки репликона используются хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410. Обычно клетки-хозяева должны секретировать минимальные количества протеолитических ферментов, поэтому в клеточную культуру желательно включать дополнительные ингибиторы протеазы.
ii. Продуцирование антител
Клетки-хозяева трансформируют вышеуказанными экспрессионными векторами и культивируют в стандартной питательной среде, модифицированной так, чтобы она была подходящей для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
Термин “трансформация” означает введение ДНК в прокариотического хозяина так, чтобы эта ДНК либо реплицировалась в виде внехромосомного элемента либо интегрировалась в хромосому. В зависимости от используемой клетки-хозяина трансформацию осуществляют стандартными методами, подходящими для таких клеток. Бактериальные клетки, содержащие прочные барьеры, такие клеточные стенки, обычно обрабатывают кальцием, именно хлоридом кальция. В другом методе трансформации используют полиэтиленгликоль/ДМСО. Еще одним методом трансформации является электропорация.
Прокариотические клетки, используемые для продуцирования полипептидов согласно изобретению, культивируют в среде, известной специалистам и подходящей для культивирования выбранных клеток-хозяев. Примерами подходящей среды являются бульон Луриа (LВ) с необходимыми питательными добавками. В некоторых вариантах изобретения такая среда также содержит средство для отбора, выбранное исходя из конструирования экспрессионного вектора, которое способствуют селективному росту прокариотических клеток, содержащих экспрессионный вектор. Так, например, в среду для культивирования клеток, экспрессирующих ген резистентности к ампициллину, добавляют ампициллин.
Помимо источников углерода, азота и неорганического фосфата в среду могут быть также включены любые необходимые добавки в соответствующих концентрациях, вводимые как отдельно, так и в смеси с другими добавками или средой, такими как комплексный источник азота. Культуральная среда может, но необязательно, содержать один или несколько восстанавителей, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолята, дитиоэритритола и дитиотреитола.
Прокариотические клетки-хозяева культивируют при соответствующих температурах. Для культивирования E.coli предпочтительной температурой является, например, температура примерно от 20°С до 39°С, более предпочтительно примерно от 25°С до 37°С, еще более предпочтительно примерно при 30°С. рН среды может варьироваться в пределах примерно от 5 до 9 в зависимости, главным образом, от организма хозяина. Для E.coli рН составляет предпочтительно примерно от 6,8 до 7,4, более предпочтительно примерно 7,0.
Если в экспрессионном векторе согласно изобретению используется индуцибельный промотор, то экспрессия белка индуцируется в условиях, подходящих для активации данного промотора. В одном из аспектов изобретения для регуляции транскрипции полипептидов используются промоторы РhoA. В соответствии с этим трансформированные клетки-хозяева культивируют в среде для индуцирования с ограниченным содержанием фосфата. Предпочтительной средой с ограниченным содержанием фосфата является среда С.R.А.Р. (см., например, Simmons et al., J. Immunol. Methods (2002) 263:133-147). В комбинации с используемой векторной конструкцией могут быть использованы и различные другие индукторы, известные специалистам.
В одном из вариантов изобретения экспрессируемые полипептиды согласно изобретению секретируются в периплазму клеток-хозяев и могут быть выделены из этой периплазмы. Выделение белка, главным образом, осуществляют путем дизрупции микроорганизма, обычно такими методами, как осмотический шок, обработка ультразвуком или лизис. После дизрупции клеток клеточный дебрис или целые клетки могут быть удалены путем центрифугирования или фильтрации. Эти белки могут быть дополнительно очищены, например, с помощью хроматографии на аффинной смоле. Альтернативно белки могут транспортироваться в клеточную среду и отделяться от нее. Клетки могут быть удалены из культуры, супернатант культуры может быть подвергнут фильтрации и концентированию для дополнительной очистки полученных белков. Экспрессированные полипептиды могут быть затем выделены и идентифицированы хорошо известными методами, такими как электрофорез в полиакриламидном геле (ПААГ) и Вестерн-блот-анализ.
В одном из аспектов изобретения антитела продуцируют в большом количестве посредством ферментации. Для получения рекомбинантных белков могут быть проведены различные крупномасштабные процедуры ферментации в культуре с подпиткой. Крупномасштабную ферментацию проводят в ферментере емкостью по меньшей мере 1000 л, предпочтительно, примерно от 1000 до 100000 л. Такие ферментеры снабжены лопастной мешалкой для равномерного распределения кислорода и микроэлементов, в частности глюкозы (предпочтительного источника углерода/энергии). Термин “лабораторная ферментация”, в общих чертах, означает ферментацию в ферментере объемом не более чем примерно 100 л, и такой объем может варьироваться примерно от 1 л до 100 л.
В процессе ферментации индуцирование экспрессии белков обычно инициируют после того как клетки, культивируемые в подходящих условиях, достигнут нужной плотности, например OD550, составляющей примерно 180-220, то есть ранней стационарной фазы. В комбинации с используемой векторной конструкцией могут быть использованы и различные другие индукторы, известные специалистам и описанные выше. Перед индуцированием клетки могут быть культивированы в течение меньшего периода времени. Клетки обычно индуцируют в течение примерно 12-50 часов, хотя время индуцирования может быть увеличено или уменьшено.
Для увеличения выхода продукта и для улучшения качества полипептидов согласно изобретению могут быть изменены различные условия ферментации. Так, например, для обеспечения “правильной” сборки и укладки секретированных полипептидов антител могут быть использованы дополнительные векторы, в которых происходит сверхэкспрессия белков-шаперонов, таких как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил- цис,транс-изомераза с шаперонной активностью), и которые предназначены для ко-трансформации прокариотических клеток-хозяев. Было продемонстрировано, что белки-шапероны облегчают правильную укладку и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen et al. (1999) J. Bio. Chem. 274:19601-19605; Georgiou et al., патент США № 6083715; Georgiou et al., патент США № 6027888; Bothmann & Pluckthun (2000) J. Biol. Chem. 275:17100-17105; Ramm & Pluckthun (2000) J. Biol. Chem. 275:17106-17113; Arie et al. (2001) Mol. Microbiol. 39:199-210.
Для минимизации протеолиза экспрессируемых гетерологичных белков (а в частности, белков, которые являются протеолитически чувствительными) в настоящем изобретении могут быть использованы некоторые штаммы-хозяева, дефицитные по протеолитическим ферментам. Так, например, штаммы клеток-хозяев могут быть модифицированы для введения генетической(их) мутации(й) в гены, кодирующие известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их комбинации. Некоторые дефицитные по протеазе штаммы E.coli являются доступными и описаны, например, в публикации Joly et al. (1998), см. выше; Georgiou et al., патент США № 5264365; Georgiou et al., патент США № 5508192; Hara et al., Microbial Drug Resistance, 2:63-72 (1996).
В одном из вариантов изобретения штаммы E.coli, дефицитные по протеолитическим ферментам и трансформированные плазмидами, сверхэкспрессирующими один или несколько белков-шаперонов, используются в качестве клеток-хозяев в экспрессионной системе согласно изобретению.
iii. Очистка антител
Могут быть применены стандартные методы очистки белков, известные специалистам. Примерами подходящих методов очистки являются следующие процедуры очистки: фракционирование на иммуноаффинных или ионообменных колонках, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на двуокиси кремния или на катионообменной смоле, такой как DЕАЕ, хроматофокусирование, электрофорез в ДСН-ПААГ, преципитация сульфатом аммония и гель-фильтрация с использованием, например, сефадекса G-75.
В одном из аспектов изобретения для иммуноаффинной очистки полноразмерных продуктов антител согласно изобретению используют белок А, иммобилизованный на твердой фазе. Белок А представляет собой 41 кД-белок клеточной стенки, происходящий от Staphylococcus aureus, который с высокой аффинностью связывается с Fc-областью антител. Lindmark et al. (1983), J. Immunol. Meth. 62:1-13. Твердой фазой, на которой иммобилизован белок А, является предпочтительно колонка, имеющая стеклянную поверхность или кремнийсодержащую поверхность, более предпочтительно стеклянная колонка с регулируемым размером пор или колонка с нанесенной на нее кремниевой кислотой. В некоторых вариантах указанная колонка покрыта реагентом, таким как глицерин, для предотвращения неспецифического присоединения примесей.
В первой стадии очистки препарат, полученный из клеточной культуры, описанной выше, наносят на твердую фазу с иммобилизованным на ней белком А для специфического связывания представляющего интерес антитела с белком А. Затем твердую фазу промывают для удаления примесей, неспецифически связанных с твердой фазой. И наконец, представляющее интерес антитело отделяют от твердой фазы путем элюирования.
b. Продуцирование антител с использованием эукариотических клеток-хозяев
Компонентами векторов обычно являются, но не ограничиваются ими, один или несколько из следующих компонентов: сигнальная последовательность, ориджин репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
(i) Компонент сигнальная последовательность
Вектор, используемый в эукариотических клетках-хозяевах, может также содержать сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления у N-конца зрелого белка, или представляющий интерес полипептид. Выбранной гетерологичной сигнальной последовательностью предпочтительно является последовательность, которая распознается и процессируется (то есть отщепляется сигнальной пептидазой) клеткой-хозяином. Для экспрессии в клетках млекопитающих используются сигнальные последовательности млекопитающих, также вирусные секреторные лидерные последовательности, например сигнальная последовательность gD вируса простого герпеса.
ДНК для такой области предшественника лигируют с антитело-кодирующей ДНК с сохранением рамки считывания.
(ii) Ориджин репликации
Обычно такой компонент как ориджин репликации не является необходимым для экспрессионных векторов млекопитающих. Так, например, ориджин репликации SV40 обычно используется только потому, что он содержит ранний промотор.
(iii) Компонент селективный ген
Экспрессионный и клонирующий векторы могут содержать селективный ген, также называемый селективным маркером. Обычно селективные гены кодируют белки, которые (а) сообщают резистентность к антибиотиками или к другим токсинам, например к ампициллину, неомицину, метотрексату или тетрациклину, (b) компенсируют дефицит, обусловленный ауксотрофией, если это необходимо, или (с) обеспечивают доставку важных питательных веществ, которые не поступают из комплексных сред.
Одним из примеров схемы отбора является использование лекарственного средства, прекращающего рост клетки-хозяина. Клетки, которые были успешно трансформированы гетерологичным геном, продуцируют белок, сообщающий резистентность к лекарственному средству и тем самым способствующий выживанию этих клеток в селективной среде. Для такого доминантного отбора могут быть использованы лекарственные средства, такие как неомицин, микофеноловая кислота и гигромицин.
Другими примерами подходящих селективных маркеров для клеток млекопитающих являются маркеры, которые позволяют идентифицировать клетки, способные встраивать в свой геном антитело-кодирующую нуклеиновую кислоту, например такие маркеры, как ген DHFR, тимидинкиназы, металлотионеина-I и II, предпочтительно гены, кодирующие металлотионеин приматов, ген аденозин-дезаминазы, орнитин-декарбоксилазы и т.п.
Так, например, клетки, трансформированные селективным геном DHFR, сначала идентифицируют путем культивирования всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. Если используется DHFR дикого типа, то подходящей клеткой-хозяином является клеточная линия яичника китайского хомячка (СНО), дефицитная по DHFR-активности (например, АТСС СRL-9069).
Альтернативно клетки-хозяева (в частности, хозяева дикого типа, содержащие эндогенный DHFR), трансформированные или ко-трансформированные ДНК-последовательностями, кодирующими антитело, белок DHFR дикого типа и другой селективный маркер, такой как аминогликозид-3'-фосфотрансфераза (АРН), могут быть отобраны путем культивирования клеток в среде, содержащей агент для отбора по селективному маркеру, такой как аминогликозидный антибиотик, например канамицин, неомицин или G418. См. патент США № 4965199.
(iv) Компонент промотор
Экспрессионные и клонирующие векторы обычно содержат промотор, распознаваемый организмом-хозяином и функционально присоединенный к нуклеиновой кислоте, кодирующей полипептид антитела. Промоторные последовательности, подходящие для эукариотов, известны специалистам. Фактически все гены эукариотов имеют АТ-богатую область, локализованную приблизительно в области, расположенной на 25-30 нуклеотидов выше от сайта инициации транскрипции. Другой такой последовательностью, локализованной приблизительно в области, расположенной на 70-80 нуклеотидов выше от сайта инициации транскрипции многих генов, является область CNCAAT, где N может означать любой нуклеотид (SEQ ID NO:60). У 3'-конца большинства эукариотических генов расположена последовательность ААТААА, которая может служить сигналом для присоединения poly A-хвоста к 3'-концу кодирующей последовательности (SEQ ID NO:61). Все указанные последовательности могут быть соответствующим образом встроены в эукариотические экспрессионные векторы.
Транскрипция полипептидов антител из векторов, присутствующих в клетках-хозяевах млекопитающих, регулируется, например, промоторами, полученными из геномов таких вирусов, как полиомавирус, вирус оспы домашней птицы, аденовирус (такой как аденовирус 2), вирус коровьей папиломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В и обезьяний вирус 40 (SV40); гетерологичными промоторами млекопитающих, например промотором актина или промотором иммуноглобулина; и промоторами белков теплового шока, при условии, что такие промоторы являются совместимыми с системами клеток-хозяев.
Ранние и поздние промоторы вируса SV40 обычно получают в виде рестрикционного фрагмента SV40, который также содержит ориджин репликации вируса SV40. Предранний промотор человеческого цитомегаловируса обычно получают в виде рестрикционного HindIII-фрагмента Е. Система экспрессии ДНК в клетках-хозяевах млекопитающих, полученная на основе коровьего папиломавируса, используемого в качестве вектора, описана в патенте США № 4419446. Модификация этой системы описана в патенте США № 4601978. Альтернативно в качестве промотора может быть использован вирус саркомы Рауса, имеющий длинный концевой повтор.
(v) Компонент энхансерный элемент
Транскрипция ДНК, кодирующей полипептид антитела согласно изобретению в высших эукариотах, часто усиливается при встраивании в вектор энхансерной последовательности. В настоящее время известно много энхансерных последовательностей, происходящих от генов млекопитающих (генов глобина, эластазы, альбумина, α-фетопротеина и инсулина). Однако обычно используется энхансер от вируса эукариотической клетки. Примерами являются энхансер вируса SV40, локализованный в поздней области ориджина репликации (100-270 п.н.), энхансер раннего промотора цитомегаловируса, энхансер полиомавируса, локализованный в поздней области ориджина репликации, и энхансеры адновируса. См. также публикацию Yaniv, Nature 297:17-18 (1982), в которой описаны энхансерные элементы для активации эукариотических промоторов. Энхансер может быть встроен в вектор в 5'- или 3'-положении по отношению к последовательности, кодирующей полипептид антитела, но предпочтительно чтобы он был локализован в 5'-положении от промотора.
(vi) Компонент сайт терминации транскрипции
Экспрессионные векторы, используемые в эукариотических клетках-хозяевах, обычно также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно расположены со стороны 5'-конца, иногда со стороны 3'-конца от нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибированные в виде полиаденилированных фрагментов в нетранслированной части мРНК, кодирующей антитело. В качестве такого компонента, как сайт терминации транскрипции, может быть использована область полиаденилирования коровьего гормона роста. См. заявку WO 94/11026 и имеющееся там описание экспрессионных векторов.
(vii) Отбор и трансформация клеток-хозяев
Клетками-хозяевами, подходящими для клонирования или экспрессии ДНК в вышеописанных векторах, являются описанные здесь клетки высших эукариотов, включая клетки-хозяева позвоночных. Размножение клеток позвоночных в культуре (в тканевой культуре) уже стало рутинной процедурой. Примерами подходящих линий клеток-хозяев млекопитающих являются клеточная линия CV1 почек обезьяны, трансформированная SV40 (COS-7, ATCC CRL 1651); клеточная линия почек человеческого эмбриона (клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen. Virol. 36:59 (1977)); клетки почек детеныша хомячка (ВНК, АТСС CCL 10); клетки яичника китайского хомячка/DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); мышиные клетки Сертоли (ТM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почек обезьяны (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почек собак (MDCK, ATCC CCL 34); клетки печени лабораторной крысы Buffalo (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (HepG2, HB 8065); опухолевые клетки мышиной молочной железы (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annal N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC5; клетки FS4 и клеточная линия человеческой гепатомы (Hep G2).
Клетки-хозяева трансформируют вышеописанными экспрессионными или клонирующими векторами для продуцирования антитела и культивируют в подходящих питательных средах, модифицированных, если это необходимо, для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
(viii) Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования антитела согласно изобретению, могут быть культивированы в различных средах. Средами, подходящими для культивирования клеток-хозяев, являются коммерчески доступные среды, такие как среда Хэмса F10 (Sigma), минимальная поддерживающая среда ((МЕМ)(Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла (DMEM), Sigma). Кроме того, в качестве культуральной среды для культивирования клеток-хозяев может быть использована любая среда, описанная в публикации Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), в патентах США №№ 4767704, 4657866, 4927762, 4560655 или 5122469; в WO 90103430; в WO 87/00195 или в патенте США Re.№ 30985. В любую из этих сред могут быть добавлены, если это необходимо, гормоны и/или другие факторы роста (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия и фосфат кальция и магния), буферы (такие как HEPES), нуклеотиды (такие как аднозин и тимидин), антибиотики (такие как лекарственное средство гентамицинТМ), микроэлементы (определенные как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярных дозах) и глюкоза или эквивалентный источник энергии. Могут быть также включены любые другие необходимые добавки в соответствующих концентрациях, известных специалистам в данной области. Условия культивирования, такие как температура, рН и т.п., аналогичны условиям, ранее используемым для экспрессии выбранных клеток-хозяев, и известны среднему специалисту в данной области.
(ix) Очистка антитела
C применением техники рекомбинантных ДНК антитело может быть продуцировано внутри клеток либо оно может быть непосредственно секретировано в среду. Если в первой стадии антитело продуцируется внутри клеток, то затем клеточный дебрис или клетки-хозяева, или их лизированные фрагменты удаляют, например, путем центрифугирования или ультрафильтрации. Если антитело секретируется в среду, то обычно сначала концентрируют супернатанты, полученные из таких экспрессионных систем, с использованием коммерчески доступного фильтра для концентрирования белков, например устройства для ультрафильтрации Amicon или Millipore Pellicon®. Для ингибирования протеолиза в любой из предшествующих стадий может быть использован ингибитор протеазы, такой как PMSF, для предупреждения размножения случайно вносимых примесных микроорганизмов могут быть использованы антибиотики.
Композиция антитела, полученная из клеток, может быть очищена, например, с помощью хроматографии на гидроксиаппатитах, гель-электрофореза, диализа и аффинной хроматографии, при этом предпочтительным методом очистки является аффинная хроматография. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, присутствующего в данном антителе. Белок А может быть использован для очистки антител, содержащих тяжелые цепи γ1, γ2 или γ4 человеческого иммуноглобулина (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Для всех мышиных изотипов и для человеческой цепи γ3 рекомендуется G-белок (Guss et al., EMBO J. 5:15671575 (1986)). В качестве матрицы, с которой связывается аффинный лиганд, наиболее часто используется агароза, но могут быть использованы и другие матрицы. Однако механически стабильные матрицы, такие как стекло с регулируемым размером пор или поли(стиролдивинил)бензол, обеспечивают более высокую скорость потока и позволяют сократить время обработки, чем это может быть достигнуто с использованием агарозы. Если антитело содержит домен СН3, то для его очистки может быть использована смола Bakerbond ABXTM (J.T. Baker, Phillipsburg, N.J.). В зависимости от выделяемого антитела могут быть также применены и другие методы очистки белка, такие как фракционирование на ионообменной колонке, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на двуокиси кремния, хроматография на гепарин-сефарозеТМ, хроматография на анионо- или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, электрофорез в ДСН-ПААГ и преципитация сульфатом аммония.
После проведения любой(ых) предварительной(ых) стадии(й) очистки смесь, содержащая представляющее интерес антитело и примеси, может быть подвергнута гидрофобной хроматографии при низком рН с использованием элюирующего буфера при рН примерно 2,5-4,5, предпочтительно при низкой концентрации соли (например, примерно 0-0,25 М).
Иммуноконъюгаты
Настоящее изобретение также относится к иммуноконъюгатам (которые являются синонимами терминов «конъюгаты антитело - лекарственное средство» или «ADC»), включающим любые из описанных здесь анти-DLL4-антител, конъюгированных с цитотоксическим агентом, таким как химиотерапевтическое средство, лекарственное средство, рост-ингибирующий агент, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения или его фрагменты), или радиоактивный изотоп (то есть радиоактивный конъюгат).
Использование конъюгатов “антитело - лекарственное средство” в целях местной доставки цитотоксических или цитостатических агентов, то есть лекарственных средств для уничтожения или подавления опухолевых клеток при лечении рака (Syrigos & Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz & Springer (1997) Adv. Drg. Del. Rev. 26:151-172; патент США № 4975278), теоретически позволяет осуществлять направленную доставку лекарственного средства в опухоли и обеспечивать его аккумуляцию внутри клеток, тогда как системное введение этих неконъюгированных лекарственных средств может приводить к продуцированию уровней токсичности, которые являются неприемлемыми для нормальных клеток, также недостаточными для опухолевых клеток, которые необходимо уничтожить (Baldwin et al., 1986, Lancet pp. (Mar. 15, 1986):603-05; Thorpe, 1985, “Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review” in Monoclonal Antobodies 84:Biological And Clinical Applications, A. Pinchera et al. (eds.), pp. 475-506). Таким образом, желательно, чтобы максимальная эффективность сочеталась с минимальной токсичностью. Сообщалось, что в этих стратегиях могут быть использованы как поликлональные, так и моноклональные антитела (Rowland et al., 1986, Cancer Immunol. Immunother. 21:183-87). Лекарственными средствами, используемыми в этих способах, являются дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986), см. выше). Токсинами, используемыми в конъюгатах “антитело - токсин”, являются бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, и небольшие молекулы-токсины, такие как гельданамицин (Mandler et al., (2000) Jour of the Nat. Cancer Inst. 92(19):1573-1581; Mandler et al., (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al., (2002) Bioconjugate Chem. 13:786-791), майтанзиноиды (ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихеамицин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (1993) Cancer Res. 53:3336-3342). Токсины могут оказывать свое цитотоксическое и цитостатическое действие в соответствии с механизмами, включающими связывание с тубулином, связывание с ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства при их конъюгировании с крупными антителами или лигандами рецепторов белков имеют тенденцию к потере активности или уменьшению активности.
Зевалин (Zevalin®) (ибритумомаб тиуксетан, Biogen/Idec) представляет собой конъюгат “антитело - радиоизотоп”, состоящий из мышиного моноклонального антитела IgG1-каппа, направленного против антигена CD20, присутствующего на поверхности нормальных и злокачественных В-лимфоцитов, и радиоактивных изотопов 111In или 90Y, связанных с хелатообразующим комплексом “тиомочевина - линкер” (Wiseman et al. (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al. (2002) Blood 99(12):4336-42; Witzig et al. (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al. (2002) J. Clin. Oncol. 20(15):3262-69). Хотя зевалин обладает активностью против В-клеточной не-ходжкинской лимфомы (НХЛ), однако, его введение приводит к тяжелой и хронической цитопении у большинства пациентов. В 2000 г. было получено разрешение на применение препарата милотарг (MylotargТМ (гемтузумаб озогамицин, Wyeth Pharmacеuticals), то есть конъюгата “антитело - лекарственное средство”, состоящего из антитела против человеческого CD33, связанного с калихеамицином, для лечения острого миелоидного лейкоза путем инъекции указанного препарата (Drugs of the Future (2000) 25(7):686; патенты США №№ 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Кантузумаб мертанзин (Immunogen, Inc.), конъюгат “антитело - лекарственное средство”, состоящий из антитела против человеческого CD42, связанного посредством дисульфидного линкера SРР с майтанзиноидным лекарственным средством, DM1, был использован в испытаниях фазы II для лечения раковых опухолей, экспрессирующих СаnAg, таких как раковые опухоли толстой кишки, поджелудочной железы, желудка и т.п. MLN-2704 (Millenium Pharm., BZL Biologics, Immunogen Inc.), конъюгат “антитело - лекарственное средство”, состоящий из моноклонального антитела против мембраносвязанного антигена предстательной железы (PSMA), присоединенного к майтанзиноидному лекарственному средству, DМ1, находится на стадии исследования его возможного применения для лечения опухолей предстательной железы. Ауристатиновые пептиды, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, были конъюгированы с химерными моноклональными антителами cBR96 (специфичными к антигену Lewis Y на карциномах) и cAC10 (специфичным к CD30 на гематологических злокачественных опухолях) (Doronina et al (2003) Nature Biotechnology 21(7):778-784) и находятся на стадии разработки терапевтических средств.
Химиотерапевтические средства, используемые для получения иммуноконъюгатов, описаны в настоящей заявке (например, выше). Ферментативно активными токсинами и их фрагментами, которые могут быть использованы для этих целей, являются А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (от Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белка диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, заявку WO 93/21232, опубликованную 28 октября 1993 года. Для продуцирования радиоактивно конъюгированных антител могут быть использованы различные радионуклиды. Примерами таких радионуклидов являются 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антитела и цитотоксического лекарственного средства получают с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилтиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Так, например, иммунотоксин рицин может быть получен как описано в публикации Vitetta et al. Science, 238:1098 (1987). 14С-меченая 1-изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (МХ-DTPA) является репрезентативным хелатообразующим агентом для конъюгирования радионуклида с антителом. См. WO 94/11026.
В настоящем изобретении также рассматриваются конъюгаты антитела и одного или нескольких низкомолекулярных токсинов, таких как калихеамицин, майтанзиноиды, доластатины, ауристатины, трихотецен и СС1065, и производные этих токсинов, обладающие токсической активностью.
i. Майтанзин и майтанзиноиды
В одном из вариантов изобретения иммуноконъюгат содержит антитело (полноразмерное антитело или его фрагменты) согласно изобретению, конъюгированное с одной или несколькими молекулами майтанзиноида.
Майтанзиноиды представляют собой митотические ингибиторы, которые действуют посредством ингибирования полимеризации тубулина. Майтанзин был впервые выделен у восточно-африканской землеройки Maytenus serrata (патент США № 3896111). Затем было обнаружено, что некоторые микробы также продуцируют майтанзиноиды, такие как майтанзинол и сложные эфиры С-3-майтанзинола (патент США № 4151042). Синтетический майтанзинол и его производные и аналоги описаны, например, в патентах США №№ 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 и 4371533.
Молекулы майтанзиноидных лекарственных средств являются привлекательными молекулами лекарственных средств для использования в конъюгатах «антитело - лекарственное средство», поскольку они (i) могут быть относительно легко получены путем ферментации или химической модификации и дериватизации продуктов ферментации, (ii) являются пригодными для дериватизации функциональными группами, подходящими для конъюгирования посредством присоединения не-дисульфидных линкеров к антителам, (iii) являются стабильными в плазме и (iv) являются эффективными против различных опухолевых клеточных линий.
Иммуноконъюгаты, содержащие майтанзиноиды, способы их получения и их терапевтическое применение, описаны, например, в патентах США №№ 5208020, 5416064 и в Европейском патенте ЕР 0425235В1, которые во всей своей полноте вводятся в настоящую заявку посредством ссылки. В публикации Liu et al. Proc. Natl. Acad. Sci., USA, 93:8618-8623 (1996) описаны иммуноконъюгаты, содержащие майтанзиноид, обозначенный DМ1, который был связан с моноклональным антителом С242, направленным против рака ободочной кишки человека. Было обнаружено, что указанный конъюгат является в высокой степени цитотоксичным для культивированных раковых клеток толстой кишки и обладает противоопухолевой активностью в анализе на рост опухоли in vivo. В публикации Chari et al., Cancer Research 52:127-131 (1992) описаны иммуноконъюгаты, в которых майтанзиноид был конъюгирован посредством дисульфидного линкера с мышиным антителом А7, связывающимся с антигеном, присутствующим на клеточных линиях рака толстой кишки человека, или с другим мышиным моноклональным антителом ТА.1, которое связывается с онкогеном HER-2/neu. Цитотоксичность конъюгата «ТА.1-майтанзиноид» была протестирована in vitro на клеточной линии рака молочной железы человека SК-ВR-3, которая экспрессирует 3×105 поверхностных антигенов HER-2 на клетку. Этот конъюгат лекарственного средства достигал степени цитотоксичности, аналогичной цитотоксичности свободного майтанзиноидного лекарственного средства, и такая цитотоксичность может быть повышена путем увеличения числа молекул майтанзиноида на молекулу антитела. Конъюгат “А7-майтанзиноид” обнаруживал низкую системную цитотоксичность у мышей.
Конъюгаты “антитело - майтанзиноид” получают путем химического связывания антитела с молекулой майтанзиноида, где указанное связывание не приводит к значительному снижению биологической активности антитела или молекулы майтанзиноида. См., например, патент США №5208020 (который во всей своей полноте вводится в настоящее описание посредством ссылки). Молекулы майтанзиноида, присутствующие в данном конъюгате, в среднем в количестве 3-4 молекулы на одну молекулу антитела, обнаруживают эффективность в повышении цитотоксичности по отношению к клеткам-мишеням, но при этом не оказывают негативного влияния на функцию или растворимость антитела, хотя предполагается, что даже одна молекула токсина на антитело по сравнению с неконъюгированным антителом будет повышать цитотоксичность конъюгата. Майтанзиноиды хорошо известны специалистам и могут быть синтезированы известными методами, либо они могут быть выделены из природных источников. Подходящие майтанзиноиды описаны, например, в патенте США № 5208020 и в других патентах и в непатентных публикациях, описанных выше. Предпочтительными майтанзиноидами являются майтанзинол и аналоги майтанзинола, имеющие модификации в ароматическом кольце или в других положениях молекулы майтанзинола, такие как различные сложные эфиры майтанзинола.
Для создания конъюгатов «антитело - майтанзиноид» может быть использовано множество линкерных групп, известных специалистам, включая, например, группы, описанные в патенте США № 5208020 или в Европейском патенте ЕР 0425235В1, и в публикации Chari et al., Cancer Research 52:127-131 (1992) и в заявке на патент США № 10/960602, поданной 8 октября 2004, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. Конъюгаты «антитело - майтанзиноид», содержащие линкерный компонент SMCC, могут быть получены как описано в заявке на патент США № 10/960602, поданной 8 октября 2004 года. Линкерными группами являются дисульфидные группы, тиоэфирные группы, группы, чувствительные к воздействию кислоты, фотохимически неустойчивые группы, группы, чувствительные к действию пептидазы, или группы, чувствительные к действию эстеразы, описанные в вышеупомянутых патентах, при этом предпочтительными являются дисульфидные и тиоэфирные группы. Дополнительные линкерные группы описаны и проиллюстрированы в настоящей заявке.
Конъюгаты “антитело - майтанзиноид” могут быть получены с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Особенно предпочтительными связывающими агентами для создания дисульфидной связи являются N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 [1978]) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPР).
Линкер может быть присоединен к молекуле майтанзиноида в различных положениях в зависимости от типа связи. Так, например, сложноэфирная связь может быть образована посредством реакции с гидроксильной группой стандартными методами связывания. Такая реакция может осуществляться в положении С-3, имеющем гидроксильную группу, в положении С-14, модифицированном гидроксиметилом, в положении С-15, модифицированном гидроксильной группой, и в положении С-20, имеющем гидроксильную группу. В предпочтительном варианте изобретения указанная связь образуется в положении С-3 майтанзинола или его аналога.
ii. Ауристатины и доластатины
В некоторых вариантах изобретения иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с доластатинами или с пептидными аналогами доластатина и их производными, также с ауристатинами (патенты США №№ 5635483, 5780588). Было обнаружено, что доластатины и ауристатины негативно влияют на динамику образования микротрубочек, гидролиз GTP и деление ядер и клеток (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584), и обладают противораковой (патент США 5663149) и противогрибковой активностью (Pettit et al. (1998) Antimicrob. Agents Chemother. 42:2961-2965). Молекулы доластатиновых или ауристатиновых лекарственных средств могут быть присоединены к антителу у N(амино)-конца или у С(карбокси)-конца молекулы пептидного лекарственного средства (WO 02/088172).
Репрезентативными вариантами ауристатина являются молекулы лекарственного средства, содержащие присоединенный к N-концу монометилауристатин, DE и DF, и описанные в заявке на патент США рег. № 10/983340, озаглавленной «Monomethylvaline Compounds Capable of Conjugation to Ligands” и поданной 5 ноября, 2004 года, где описание указанной заявки во всей своей полноте вводится в настоящее описание посредством ссылки.
Обычно пептидные молекулы лекарственного средства могут быть получены путем образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи могут быть образованы, например, методом синтеза в жидкой фазе (см. E. Schröder and K. Lübke, “The Peptides”, volume 1, pp.76-136, 1965, Academic Press), хорошо известным специалистам в области пептидного синтеза. Молекулы ауристатиновых/доластатиновых лекарственных средств могут быть получены методами, описанными в патентах США №№5635483 и 5780588; и в публикациях Pettit et al (1989) J. Am. Chem. Soc. 111:5463-5465; Pettit et al (1998) Аnti-Cancer Drug Design 13:243-277; Pettit, G.R., et al. Synthesis, 1996, 719-725; and Pettit et al (1996) J. Chem. Soc. Perkin Trans. 1 5:859-863. См., также публикацию Doronina (2003) Nat. Biotechnol. 21(7):778-784; и заявку на патент США рег. № 10/983340, озаглавленную «Monomethylvaline Compounds Capable of Conjugation to Ligands» и поданную 5 ноября, 2004 года, где указанная заявка во всей своей полноте вводится в настоящее описание посредством ссылки (в данной заявке описаны, например, линкеры и методы получения монометилвалиновых соединений, таких как MMAE и MMAF, конъюгированных с линкерами).
iii. Калихеамицин
В других вариантах изобретения иммуноконъюгат содержит антитело согласно изобретению, конъюгированное с одной или несколькими молекулами калихеамицина. Антибиотики семейства калихеамицинов способны продуцировать двухцепочечные ДНК-разрывы в субпикомолярных концентрациях. Описание получения конъюгатов семейства калихеамицинов можно найти в патентах США №№ 5712354, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5977296 (все патенты принадлежат компании American Cyanamid Company). Структурными аналогами калихеамицина, которые могут быть использованы в этих целях, являются, но не ограничиваются ими, γ1 I, α2 I, α3 I, N-ацетил-γ1 I, PSAG и θ1 I (см. Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и вышеупомянутые патенты США, принадлежащие компании American Cyanamid). Другим противоопухолевым лекарственным средством, с которым может быть конъюгировано антитело, является средство QFA, которое представляет собой антифолат. Калихеамицин и QFA имеют внутриклеточные активные сайты и с трудом проходят через плазматическую мембрану. Поэтому поглощение этих агентов клетками путем интернализации, опосредуемой антителом, приводит к значительному усилению их цитотоксических эффектов.
iv. Другие цитотоксические средства
Другими противоопухолевыми средствами, которые могут быть конъюгированы с антителами согласно изобретению, являются ВСNU, стрептозоцин, винкристин и 5-фторурацил, семейство агентов, известных под общим названием комплекс LL-Е33288, описанный в патентах США №№ 5053394, 5770710, также эсперамицины (патент США № 5877296).
Ферментативно активными токсинами и их фрагментами, которые могут быть использованы в этих целях, являются А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (от Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, белка диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. См., например, заявку WO 93/21232, опубликованную 28 октября 1993 года.
В настоящем изобретении также рассматривается иммуноконъюгат, образуемый антителом и соединением, обладающим нуклеолитической активностью (например, рибонуклеазой или ДНК-эндонуклеазой, такой как дезоксирибонуклеаза; ДНКазой).
Для селективной деструкции опухоли может быть использовано антитело, которое может содержать высокорадиоактивный атом. Для продуцирования радиоактивно конъюгированных антител могут быть использованы различные радиоактивные изотопы. Примерами таких радионуклидов являются 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32Р, 212Рb и радиоактивные изотопы Lu. Если указанный конъюгат используется для детекции, то он может содержать радиоактивный атом для сцинтиграфических исследований, например 99mТс или 123I, или спин-метку для визуализации методом ядерного магнитного резонанса (ЯМР) (известной так же как МР-визуализация, МРВ), такую как иод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки могут быть включены в конъюгат известными методами. Так, например, пептид может быть синтезирован биологическими методами либо он может быть синтезирован методом химического синтеза аминокислот с использованием подходящих аминокислотных предшественников, включающих, например, фтор-19 вместо водорода. Такие метки, как 99mТс или 123I, 186Re, 188Re и 111In, могут быть присоединены посредством цистеинового остатка пептида. Иттрий-90 может быть присоединен посредством лизинового остатка. Для введения иода-123 может быть применен метод IODOGEN (Fraker et al. (1978) Biochem. Biophys. Res. Commun. 80:49-57). Другие методы подробно описаны в публикации «Monoclonal Antibodies in Immunoscintigraphy” (Chatal, CRC Press 1989).
Конъюгаты антитела и цитотоксического лекарственного средства могут быть получены с использованием различных бифункциональных белок-связывающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат-HCl), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаральдегид), бис-азидосоединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Так, например, иммунотоксин рицин может быть получен как описано в публикации Vitetta et al. Science, 238:1098 (1987). 14С-меченая 1-изотиоцианатобензил-3-метилдиэтилентриаминопентауксусная кислота (МХ-DTPA) является репрезентативным хелатообразующим агентом для конъюгирования радионуклида с антителом. См. WO 94/11026. Линкером может быть “отщепляемый линкер”, облегчающий высвобождение цитотоксического лекарственного средства в клетке. Так, например, могут быть использованы линкеры, чувствительные к воздействию кислоты; линкеры, чувствительные к действию пептидазы, фотохимически неустойчивые линкеры, диметиловые линкеры или дисульфидсодержащие линкеры (Chari et al., Cancer Research 52:127-131 (1992), патент США № 5208020).
Соединениями, специально рассматриваемыми в настоящем изобретении, являются, но не ограничиваются ими, ADC, полученные с использованием перекрестносвязывающих реагентов, таких как BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, сульфо-SMPB и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, поставляются фирмой Pierce Biotechnology, Inc., Rockford, IL., USA). См. руководство по применению и каталог (Application Handbook and Catalog), 2003-2004, стр. 467-498.
v. Получение конъюгатов “антитело - лекарственное средство”
В конъюгатах “антитело - лекарственное средство” (ADC) согласно изобретению антитело (Ab) конъюгировано с одной или с несколькими молекулами лекарственного средства (D) посредством линкера (L), где, например, на одну молекулу антитела приходится примерно от 1 до 20 молекул лекарственного средства. Конъюгаты ADC формулы I могут быть получены несколькими способами, предусматривающими проведение реакций органического химического синтеза с использованием условий и реагентов, известных специалистам, где указанные способы включают: (1) реакцию взаимодействия нуклеофильной группы антитела с двухвалентным линкерным реагентом с образованием Ab-L посредством ковалентной связи, затем реакцию взаимодействия с молекулой лекарственного средства D; и (2) реакцию взаимодействия нуклеофильной группы молекулы лекарственного средства с двухвалентным линкерным реагентом с образованием D-L посредством ковалентной связи, затем реакцию взаимодействия с нуклеофильной группой антитела. Дополнительные методы получения ADC описаны ниже:
Ab-(L-D)р (I)
Линкер может состоять из одного или более линкерных компонентов. Репрезентативными примерами линкерных компонентов являются 6-малеимидокапроил («MC»), малеимидопропаноил («MP»), валин-цитруллин («val-cit»), аланин-фенилаланин («ala-phe»), п-аминобензилоксикарбонил («PAB»), N-сукцинимидил-4-(2-пиридилтио)пентаноат («SPP»), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат («SMCC») и N-сукцинимидил-(4-иодацетил)аминобензоат («SIAB»). Специалистам известны и другие линкерные компоненты, некоторые из которых описаны в настоящей заявке. См., также заявку на патент США рег. № 10/983340, озаглавленную «Monomethylvaline Compounds Capable of Conjugation to Ligands» и поданную 5 ноября, 2004 года, где указанная заявка во всей своей полноте вводится в настоящее описание посредством ссылки.
В некоторых вариантах изобретения линкер может содержать аминокислотные остатки. Репрезентативными аминокислотными линкерными компонентами являются дипептид, трипептид, тетрапептид или пентапептид. Репрезентативными дипептидами являются валин-цитруллин (vc или val-cit) и аланин-фенилаланин (af или ala-phe). Репрезентативными трипептидами являются глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотными остатками, входящими в состав аминокислотного линкерного компонента, являются природные аминокислотные остатки, также небольшие аминокислоты и не-природные аминокислотные аналоги, такие как цитруллин. Аминокислотные линкерные компоненты могут быть сконструированы и оптимизированы по их селективности в отношении ферментативного расщепления конкретными ферментами, например опухоль-ассоциированной протеазой, катепсином В, C и D или плазминовой протеазой.
Нуклеофильными группами, присутствующими на антителах, являются, но не ограничиваются ими: (i) N-концевые аминогруппы, (ii) аминогруппы боковой цепи, например лизина, (iii) тиоловые группы боковой цепи, например цистеина, и (iv) гидроксильные или аминогруппы сахаров, где указанное антитело является гликозилированным. Аминогруппы, тиольные группы и гидроксильные группы являются нуклеофильными и могут подвергаться реакции взаимодействия с образованием ковалентных связей с электрофильными группами на линкерных молекулах или линкерных реагентах, включая: (i) активные сложные эфиры, такие как NНS-эфиры, HOBt-эфиры, галогенформиаты и галегенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы. Некоторые антитела имеют восстанавливаемые межцепьевые дисульфиды, то есть цистеиновые мостики. Для конъюгирования с линкерными реагентами антитела могут быть сделаны реакционноспособными путем их обработки восстановителем, таким как DТТ (дитиотреитол). Каждый цистеиновый мостик теоретически может образовывать два реакционноспособных тиоловых нуклеофила. В антитела могут быть введены дополнительные нуклеофильные группы посредством реакции взаимодействия лизинов с 2-иминотиоланом (реагентом Траута), что будет приводить к превращению амина в тиол. Реакционноспособные тиоловые группы могут быть включены в антитело (или его фрагмент) путем введения одного, двух, трех, четырех или более цистеиновых остатков (например, получения мутантных антител, содержащих один или несколько неприродных цистеиновых аминокислотных остатков).
Конъюгаты “антитело - лекарственное средство” согласно изобретению могут быть также получены путем модификации антитела с введением в него электрофильных групп, которые могут реагировать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Сахара гликозилированных антител могут быть окислены, например, периодатными окислителями с образованием альдегидных или кетоновых групп, которые могут реагировать с аминогруппой линкерных реагентов или молекул лекарственного средства. Полученные иминовые группы шиффова основания могут образовывать стабильную связь либо они могут быть восстановлены, например, борогидридными реагентами с образованием стабильных аминовых связей. В одном из вариантов изобретения реакция взаимодействия углеводной части гликозилированного антитела с галактозооксидазой или с метапериодатом натрия может приводить к образованию карбонильных (альдегидных и кетоновых) групп в белке, которые могут реагировать с соответствующими группами на лекарственном средстве (Hermanson, Bioconjugate Techniques). В другом варианте изобретения белки, содержащие N-концевые сериновые или треониновые остатки, могут реагировать с метапериодатом натрия с образованием альдегида вместо первой аминокислоты (Geoghegan & Stroh (1992), Bioconjugate Chem. 3:138-146; патент США № 5362852). Такой альдегид может взаимодействовать с молекулой лекарственного средства или с линкерным нуклеофилом.
Аналогичным образом нуклеофильными группами на молекуле лекарственного средства являются, но не ограничиваются ими, аминогруппы, тиольные, гидроксильные, гидразидные, оксимовые, гидразиновые, тиосемикарбазоновые, гидразинкарбоксилатные и арилгидразидные группы, способные реагировать, с образованием ковалентных связей, с электрофильными группами на линкерных молекулах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как NНS-эфиры, HOBt-эфиры, галогенформиаты и галегенангидриды кислот; (ii) алкил- и бензилгалогениды, такие как галогенацетамиды; (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Альтернативно гибридный белок, содержащий антитело и цитотоксическое средство, может быть получен, например, рекомбинантными методами или методом пептидного синтеза. Длина ДНК может составлять соответствующие области, кодирующие две части конъюгата, либо смежные друг с другом, либо разделенные областью, кодирующей линкерный пептид, который не оказывает негативного влияния на желаемые свойства данного конъюгата.
В еще одном варианте изобретения указанное антитело может быть конъюгировано с “рецептором” (таким как стрептавидин) для его предварительного нацеливания на опухоль, где указанный конъюгат “антитело - рецептор” вводят пациенту с последующим удалением несвязанного конъюгата из кровотока с использованием агента для клиренса, затем вводят “лиганд” (например, авидин), конъюгированный с цитотоксическим средством (например, радионуклеотидом).
Фармацевтические композиции
Терапевтические композиции, содержащие антитело согласно изобретению, получают в удобных для хранения формах путем смешивания антитела, имеющего нужную степень чистоты, с необязательными физиологически приемлемыми носителями, наполнителями или стабилизаторами (Remington; The Science and Practice of Pharmacy, 20th edition (2000)) с получением водных растворов, лиофилизованных препаратов или других сухих препаратов. Приемлемые носители, наполнители или стабилизаторы в используемых дозах и концентрациях должны быть нетоксичными для реципиентов, и ими являются буферы, такие как фосфат, цитрат, гистидин и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензэтония; фенолоспирт, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные полипептиды (имеющие примерно менее чем 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; металлокомплексы (например, комплексы Zn - белок); и/или неионогенные поверхностно-активные вещества, такие как твинТМ, плюроникТМ или полиэтиленгликоль (ПЭГ).
Описанная здесь композиция может также содержать несколько активных соединений, необходимых для конкретного показания, предпочтительно имеющих дополнительные активности, не оказывающие негативного влияния друг на друга. Такие молекулы могут присутствовать в комбинации в количествах, эффективных для применения в нужных целях.
Активные ингредиенты могут быть также заключены в микрокапсулу, полученную, например, методами коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозную или желатиновую микрокапсулу и полиметилметакрилатную микрокапсулу соответственно, в системы для доставки коллоидальных лекарственных средств (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такая методика описана в руководстве Remington: The Science and Practice of Pharmacy 20th edition (2000).
Композиции, используемые для введения in vivo, должны быть стерильными. Это может быть легко достигнуто путем фильтрации через стерильные фильтрующие мембраны.
Могут быть получены препараты пролонгированного высвобождения. Подходящими примерами препаратов пролонгированного высвобождения являются полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих иммуноглобулин согласно изобретению, где указанные матрицы имеют форму готовых изделий, например пленок или микрокапсул. Примерами матриц пролонгированного высвобождения являются полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, неразлагаемый сополимер этилена-винилацетата, разлагаемые сополимеры молочной кислоты - гликолевой кислоты, такие как LUPRON DEPOTТМ (микросферы для инъекций, состоящие из сополимера молочной кислоты - гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляная кислота. Полимеры, такие как сополимер этилена - винилацетата и сополимер молочной кислоты - гликолевой кислоты способны высвобождать молекулы в течение более 100 дней, некоторые гидрогели высвобождают белки за более короткие периоды времени. Если инкапсулированные иммуноглобулины сохраняются в организме в течение длительного периода времени, то они могут денатурироваться или агрегироваться под воздействием влаги при 37оС, что приводит к потере биологической активности и к возможным изменениям иммуногенности. Для стабилизации в зависимости от конкретного механизма могут быть разработаны рациональные стратегии. Так, например, если было обнаружено, что механизмом агрегации является образование межмолекулярной S-S-связи посредством тиодисульфидного обмена, то стабилизация может быть достигнута путем модификации сульфгидрильных остатков, лиофилизации из кислотных растворов, регуляции содержания влаги с использованием соответствующих добавок и получения конкретных композиций на основе полимерной матрицы.
Применения
Антитело согласно изобретению может быть использовано, например, в терапевтических методах in vitro, ex vivo и in vivo.
В одном из своих аспектов настоящее изобретение относится к способам лечения или предупреждения опухоли, рака или клеточно-пролиферативного расстройства, ассоциированного с повышенной экспрессией и/или активностью DLL4, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении.
В одном из своих аспектов настоящее изобретение относится к способам ослабления, ингибирования, блокирования или предупреждения роста опухоли или раковой опухоли, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении.
В одном из своих аспектов настоящее изобретение относится к способам лечения опухоли, рака и/или клеточно-пролиферативного расстройства, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении.
В одном из своих аспектов настоящее изобретение относится к способам ингибирования ангиогенеза, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении.
В одном из своих аспектов настоящее изобретение относится к способам лечения патологического состояния, ассоциированного с ангиогенезом, где указанные способы включают введение эффективного количества анти-DLL4-антитела индивидууму, нуждающемуся в таком лечении. В некоторых вариантах изобретения указанным патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, рак и/или клеточно-пролиферативное расстройство. В некоторых вариантах изобретения указанным патологическим состоянием, ассоциированным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
Кроме того, по меньшей мере некоторые антитела согласно изобретению могут связываться с антигеном, происходящим от других видов. В соответствии с этим антитела согласно изобретению могут быть использованы для связывания с антигеном, обладающим специфической активностью, например, в клеточной культуре, содержащей указанный антиген, и в организме человека или других млекопитающих, имеющих антиген, с которым перекрестно реагирует антитело согласно изобретению (например, у шимпанзе, павианов, игрунок, собакоподобных обезьян и макак-резусов, также свиней или мышей). В одном из вариантов изобретения антитело согласно изобретению может быть использовано для ингибирования антигенной активности путем контактирования указанного антитела с антигеном так, чтобы осуществлялось ингибирование активности антигена. Предпочтительным антигеном является человеческая белковая молекула.
В одном из вариантов изобретения антитело согласно изобретению может быть использовано в способе связывания антигена у индивидуума, страдающего расстройством, ассоциированным с повышенным уровнем экспрессии и/или активности антигена, где указанный способ включает введение данному индивидууму антитела согласно изобретению для его связывания с антигеном. Предпочтительным антигеном является человеческая белковая молекула, предпочтительным индивидуумом является человек. Альтернативно указанным индивидуумом может быть млекопитающее, экспрессирующее антиген, с которым связывается антитело согласно изобретению. Кроме того, указанным индивидуумом может быть млекопитающее, которому был введен указанный антиген (например, путем прямого введения антигена или экспрессии антигенного трансгена). Антитело согласно изобретению может быть введено человеку в терапевтических целях. Кроме того, антитело согласно изобретению может быть введено млекопитающему, не являющемуся человеком (например, примату, свинье или мыши) и экспрессирующему антиген, с которым перекрестно реагирует иммуноглобулин, в целях лечения этого млекопитающего, либо оно может быть введено животному с моделью человеческого заболевания. Что касается животного-модели, то такие животные могут быть использованы для оценки терапевтической эффективности антител согласно изобретению (например, для определения доз и времени введения).
Антитела согласно изобретению могут быть использованы для лечения, ингибирования, замедления прогрессирования, предупреждения/замедления возникновения рецидивов, улучшения динамики или предупреждения заболеваний, расстройств или состояний, ассоциированных с экспрессией и/или активностью одной или нескольких молекул антигена.
Репрезентативными расстройствами являются карцинома, лимфома, бластома, саркома и лейкоз или лимфоидные злокачественные опухоли. Более конкретными примерами таких раковых заболеваний являются плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, не-мелкоклеточный рак легких, аденокарцинома легких и плоскоклеточная карцинома легких, рак брюшной полости, гепатоцеллюлярный рак, рак желудка, включая рак желудочно-кишечного тракта; рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, рак мочевых путей, гепатома, рак молочной железы, рак толстой кишки, рак прямой кишки, рак ободочной кишки, карцинома эндометрия или матки, карцинома слюнных желез, рак почек, рак предстательной железы, рак вульвы, рак щитовидной железы, карцинома печени, карцинома заднего прохода, карцинома пениса, меланома, множественная миелома и В-клеточная лимфома, рак головного мозга, также рак головы и шеи, и ассоциированные с ними метастазы. В некоторых вариантах изобретения указанное раковое заболевание выбрано из группы, состоящей из мелкоклеточного рака легких, нейробластомы, меланомы, карциномы молочной железы, рака желудка, рака ободочной кишки (СRC) и гепатоцеллюлярной карциномы. В некоторых вариантах изобретения указанное раковое заболевание выбрано из группы, состоящей из не-мелкоклеточного рака легких, рака ободочной кишки и карциномы молочной железы, включая метастазы указанных раковых заболеваний.
В некоторых вариантах изобретения иммуноконъюгат, содержащий антитело, конъюгированное с одним или несколькими цитотоксическими агентами, вводят указанному пациенту. В некоторых вариантах изобретения иммуноконъюгат и/или антиген, с которым он связывается, интернализуется в клетке, что приводит к повышению терапевтической эффективности иммуноконъюгата, направленной на уничтожение клетки-мишени, с которой он связывается. В одном из вариантов изобретения цитотоксический агент подавляет нуклеиновую кислоту или ингибирует ее активность в клетке-мишени. В одном из вариантов изобретения указанный цитотоксический агент подавляет полимеризацию микротрубочек или препятствует такой полимеризации. Примерами указанных цитотоксических агентов являются любые из описанных здесь химиотерапевтических средств (таких как майтанзиноид, ауристатин, доластатин или калихеамицин), радиоактивный изотоп, или рибонуклеаза или ДНК-эндонуклеаза.
Антитела согласно изобретению, взятые отдельно или в комбинации с другими композициями, могут быть использованы в терапевтических целях. Так, например, антитело согласно изобретению может быть введено вместе с другим антителом, химиотерапевтическим(и) средством(ами) (включая смеси химиотерапевтических средств), с другим(и) цитотоксическим(и) средством(ами), антиангиогенным(и) средством(ами), цитокинами и/или рост-ингибирующим(и) средством(ами). Если антитело согласно изобретению ингибирует рост опухоли, то может оказаться особенно желательным его объединение с одним или несколькими другими терапевтическими средствами, которые также ингибируют рост опухоли, например, с анти-VEGF агентами, включая антитела против VEGF. Альтернативно или дополнительно пациент может быть подвергнут комбинированной лучевой терапии (например, облучением внешним пучком или терапии с использованием радиоактивно меченого агента, такого как антитело). Такой указанной выше комбинированной терапией является комбинированное введение (где два или более агентов включены в одну или ту же или в отдельные композиции) и отдельное введение, при котором антитело согласно изобретению может быть введено до и/или после проведения вспомогательной терапии.
Комбинированная терапия
Как было указано выше, настоящее изобретение относится к комбинированной терапии, при которой анти-DLL4-антитело вводят одновременно с проведением другой терапии. Так, например, анти-DLL4-антитела используются в комбинациях с противораковой терапией или с терапией, направленной против образования новых сосудов, для лечения различных неопластических или не-неопластических состояний. В одном из вариантов изобретения указанное неопластическое или не-неопластическое состояние характеризуется патологическим расстройством, ассоциированным с аберрантным или нежелательным ангиогенезом. Анти-DLL4-антител может быть введено последовательно или в комбинации с другим средством, эффективным для таких целей, либо в виде одной композиции, либо в виде отдельных композиций. Альтернативно или дополнительно может быть введено множество ингибиторов DLL4.
Введение анти-DLL4-антитела может быть осуществлено одновременно с другими средствами, например, в виде одной композиции или в виде двух или более отдельных композиций с применением одного и того же или различных способов введения. Альтернативно или дополнительно введение может быть осуществлено последовательно в любом порядке. В некоторых вариантах изобретения интервалы между введением двух или более композиций могут составлять от нескольких минут до нескольких дней или от нескольких недель до нескольких месяцев. Так, например, сначала может быть введено противораковое средство, затем ингибитор DLL4. Однако рассматривается также одновременное введение анти-DLL4-антитела с другими средствами или введение сначала анти-DLL4-антитела, затем введение другого средства.
Эффективное количество терапевтических средств, вводимое в комбинации с анти-DLL4-антителом, назначается врачом или ветеринаром. Для достижения максимального эффекта лечения указанных состояний вводимую дозу соответствующим образом корректируют. Доза также зависит от таких факторов, как тип используемого терапевтического средства и от конкретного пациента, подвергаемого лечению. Подходящими дозами противоракового средства являются дозы, которые используются в современной терапии, и эти дозы могут быть снижены благодаря комбинированному действию (синергическому действию) противоракового средства и анти-DLL4-антитела. В некоторых вариантах изобретения комбинация ингибиторов усиливает эффективность одного ингибитора. Термин «потенцировать» означает повышать эффективность терапевтического средства, вводимого в обычной или допустимой дозе. См. также раздел настоящей заявки, озаглавленный «Фармацевтические композиции».
Обычно анти-DLL4-антитела и противораковые средства являются подходящими для лечения одних и тех же или аналогичных заболеваний путем предотвращения или ослабления патологического расстройства, такого как рост опухоли или рост раковых клеток. в одном из вариантов изобретения, указанным противораковым средством является антиангиогенное средство.
Ангиогенная терапия при раке представляет собой стратегию лечения рака, целью которой является ингибирование развития кровеносных сосудов опухоли, необходимых для подачи питательных веществ, требуемых для роста опухоли. Поскольку ангиогенез происходит как при росте первичной опухоли, так и при метастазах, то лечение антиангиогенными средствами, осуществляемое в соответствии с настоящим изобретением, может приводить к ингибированию роста опухоли в месте образования первичной опухоли, также к предупреждению развития метастазов опухоли, образующихся в других участках, что позволяет воздействовать на опухоль другими терапевтическими средствами.
Многие антиангиогенные средства были идентифицированы и известны специалистам, включая средства, перечисленные в настоящей заявке, например, в разделе «Определения» и средства, описанные, например в публикациях Carmeliet & Jain, Nature 407:249-257 (2000); Ferrara et al., Nature Reviews:Drug Discovery, 3:391-400 (2004); и Sato Int. J. Clin. Oncol., 8:200-206 (2003). См. также заявку на патент США US 20030055006. В одном из вариантов изобретения, анти-DLL4-антитело используется в комбинации с нейтрализующим анти-VEGF-антителом (или его фрагментом) и/или другим антагонистом VEGF или антагонистом рецептора VEGF, включая, но не ограничиваясь ими, например, растворимый рецептор VEGF (например, VEGFR-1, VEGFR-2, VEGFR-3, нейропиллины (например, NRP1, NRP2)), их фрагменты, аптамеры, способные блокировать VEGF или VEGFR, нейтрализующие анти-VEGFR-антитела, низкомолекулярные ингибиторы тирозинкиназ VEGFR (RTK), антисмысловые последовательности для VEGF, рибозимы против VEGF или рецепторов VEGF, варианты антагонистов VEGF; и любые их комбинации. Альтернативно или дополнительно пациенту помимо антагониста VEGF и другого средства могут быть, но необязательно, одновременно введены два или более ингибиторов ангиогенеза. В некоторых вариантах изобретения один или несколько дополнительных терапевтических средств, например противораковых средств, могут быть введены в комбинации с анти-DLL4-антителом, антагонистом VEGF и антиангиогенным средством.
В некоторых аспектах изобретения другими терапевтическими методами, подходящими для комбинированной терапии опухоли с использованием анти-DLL4-антитела, является другая противораковая терапия (например, хирургическое вмешательство, лечение радиологическими средствами (например, лучевая терапия или введение радиоактивных веществ), химиотерапия, лечение противораковыми средствами, перечисленными в настоящей заявке и известными специалистам, или их комбинации). Альтернативно или дополнительно пациенту могут быть одновременно введены два или более антител, связывающихся с одними и теми же или с двумя или более различными антигенами, описанными в настоящей заявке. Иногда может также оказаться предпочтительным введение пациенту одного или нескольких цитокинов.
Химиотерапевтические средства
В некоторых своих аспектах настоящее изобретение относится к способу блокирования или снижения роста опухоли или раковых клеток, где указанный способ включает введение эффективных количеств антагониста DLL4 и/или ингибитора(ов) ангиогенеза и одного или нескольких химиотерапевтических средств пациенту, восприимчивому к развитию рака, или пациенту, у которого был диагностирован рак. Различные химиотерапевтические средства могут быть использованы в комбинированных способах лечения согласно изобретению. Репрезентативный и неограничивающий список рассматриваемых химиотерапевтических средств приводится в настоящей заявке в разделе «Определения».
Как очевидно для каждого среднего специалиста в данной области, соответствующие дозы химиотерапевтических средств приблизительно аналогичны дозам, уже применяемым в клинической терапии, где указанные химиотерапевтические средства вводят отдельно или в комбинации с другими химиотерапевтическими средствами. Дозы могут варьироваться в зависимости от состояния, подвергаемого лечению. Врач, назначающий данное лечение, может самостоятельно вычислить соответствующую дозу для каждого отдельного индивидуума.
Настоящее изобретение также относится к способам и композициям для ингибирования или предупреждения рецидивирующего роста опухоли или раковых клеток. Термин «рецидивирующий рост опухоли или раковых клеток» используется для определения состояния, которым страдает данный индивидуум, или состояния, лечение которого одним или несколькими методами терапии (например, противораковой терапии, такой как химиотерапия, лучевая терапия, хирургическое вмешательство, гормональная терапия и/или биологическая терапия/иммунотерапия, терапия анти-VEGF-антителом, в частности стандартный терапевтический метод лечения конкретного ракового заболевания), не является клинически адекватным или дает лишь кратковременный благоприятный эффект, поэтому такие пациенты нуждаются в дополнительной эффективной терапии. Используемый здесь термин может также означать состояние «невосприимчивости/резистентности» пациента, например состояние пациента, у которого наблюдается определенный ответ на данную терапию, но при этом возникают побочные эффекты; или пациента, у которого развивается резистентность, не наблюдается ответа на данную терапию или не наблюдается удовлетворительного ответа на данную терапию и т.п. В различных вариантах изобретения раковым заболеванием является рецидивирующий рост опухоли или раковых клеток, при которых не наблюдается заметного уменьшения числа раковых клеток или не наблюдается их увеличения, либо не наблюдается уменьшения размера опухоли или наблюдается его увеличения, либо не наблюдается какого-либо дополнительного уменьшения размера раковой опухоли или числа раковых клеток. Установление рецидивирующего роста раковой опухоли или раковых клеток может быть осуществлено любым методом in vivo или in vitro, известным специалистам, который включают анализ на эффективность подавления раковых клеток, где термины «рецидив» или «резистентность», или «невосприимчивость» употребляются в их общепринятом смысле. Примером рецидивирующего роста опухоли является опухоль, резистентная к лечению анти-VEGF-антителом.
Настоящее изобретение относится к способам блокирования или ослабления рецидивирующего роста опухоли или раковых клеток у индивидуума, где указанные способы включают введение индивидууму одного или нескольких анти-DLL4-антител в целях блокирования или ослабления рецидивирующего роста опухоли или раковых клеток. В некоторых вариантах изобретения антагонист может быть введен после проведения противораковой терапии. В некоторых вариантах изобретения анти-DLL4-антитела вводят одновременно с проведением противораковой терапии. Альтернативно или дополнительно терапию анти-DLL4-антителом проводят поочередно с другой противораковой терапией, и такая терапия может быть осуществлена в любом порядке. Настоящее изобретение также охватывает способы введения одного или нескольких ингибирующих антител для предупреждения развития или рецидива ракового заболевания у пациентов, предрасположенных к развитию такого ракового заболевания. Обычно такой индивидуум подвергался (или подвергается) комбинированной противораковой терапии. В одном из вариантов изобретения противораковой терапией является лечение антиангиогенным средством, например антагонистом VEGF. Антиангиогенными средствами являются средства, известные специалистам и перечисленные в настоящей заявке в разделе «Определения». В одном из вариантов изобретения антиангиогенным средством является нейтрализующее анти-VEGF-антитело или его фрагмент (например, AVASTIN® (Genentech, South San Francisco, CA) или LUCENTIS® (Genentech, South San Francisco, CA)), Y0317, M4, G6, B20, 2C3 и т.п.). См., например, патенты США №№ 6582959, 6884879, 6703020; заявки WO 98/45332; WO 96/30046; WO 94/10202; EP 0666868B1; заявки на патенты США №№20030206899, 20030190317, 20030203409 и 20050112126; Popkov et al., Journal of Immunological Methods 288:149-164 (2004); и WO 2005012359. Дополнительные средства могут быть введены в комбинации с антагонистом VEGF и анти-DLL4-антителом для блокирования или ослабления рецидивирующего роста опухоли или раковых клеток, например, см. раздел, озаглавленный здесь «Комбинированная терапия».
Антитело согласно изобретению (и вспомогательное терапевтическое средство) вводят различными способами, включая парентеральное, подкожное, внутрибрюшинное, внутрилегочное и интраназальное введение, если необходимо местное лечение, то антитело вводят в пораженный участок или в стекловидное тело. Парентеральной инфузией является внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Кроме того, подходящим способом введения антитела является периодическое вливание, в частности вливание антитела в уменьшающихся дозах. Такие дозы могут быть введены любым подходящим способом, например путем инъекций, таких как внутривенные или подкожные инъекции, и эти дозы отчасти зависят от того, является ли такое введение периодическим или постоянным.
Антитело-содержащую композицию согласно изобретению приготавливают, разделяют на дозы и вводят в соответствии с хорошо известной медицинской практикой. Факторами, учитываемыми для приготовления таких композиций, являются конкретное расстройство, подвергаемое лечению, конкретное млекопитающее, подвергаемое лечению, клиническое состояние конкретного пациента, этиологический фактор, вызывающий данное расстройство, участок, на который направлено данное средство, способ введения, схема введения и другие факторы, известные практическим врачам. Указанное антитело должно быть, но необязательно, приготовлено в виде композиции с одним или несколькими современными средствами, используемыми для предупреждения или лечения рассматриваемого расстройства. Эффективное количество таких других средств зависит от количества антитела согласно изобретению, присутствующих в данной композиции, типа расстройства или способа его лечения и от других факторов, обсуждаемых выше. Указанные другие средства обычно вводятся в тех же самых дозах и теми же способами, которые обычно использовались ранее, либо эти дозы составляют примерно 1-99% от используемых ранее доз.
Для предупреждения или лечения заболевания подходящие дозы антитела согласно изобретению (используемого отдельно или в комбинации с другими средствами, такими как химиотерапевтические средства) зависят от типа заболевания, подвергаемого лечению, типа антитела, тяжести и курса лечения заболевания, независимо от того, вводят ли указанное антитело в профилактических или терапевтических целях, от проводимого ранее лечения, от истории болезни пациента и его восприимчивости к антителу и от назначения лечащего врача. Такое антитело может быть введено пациенту один раз или несколько раз во время проведения курса лечения. В зависимости от типа и тяжести заболевания начальная предварительно установленная доза антитела, вводимого пациенту, составляет примерно от 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг - 10 мг/кг), независимо от того, осуществляют ли одноразовое или многократное введение или непрерывную инфузию данного антитела. Типичная суточная доза может составлять примерно от 1 мкг/кг до 100 мг/кг или более в зависимости от вышеупомянутых факторов. Для повторного введения в течение нескольких дней или более в зависимости от состояния лечение может проводиться до тех пор, пока не будет достигнуто желаемое подавление симптомов заболевания. Репрезентативная доза антитела может составлять примерно от 0,05 мг/кг до 10 мг/кг. Так, например, пациенту могут быть введены одна или несколько доз, составляющих примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любые их комбинации). Такие дозы могут быть введены периодически, например еженедельно или раз в три недели (например, пациенту может быть введено примерно от двух до двадцати, например, примерно шесть доз антитела). При этом сначала может быть введена более высокая доза, затем могут быть введены одна или несколько более низких доз. Репрезентативная схема введения доз включает введение начальной дозы, составляющей примерно 4 мг/кг, с последующим еженедельным введением поддерживающей дозы, составляющей примерно 2 мг/кг антитела. Однако могут быть применены и другие схемы введения. Мониторинг эффекта такой терапии может быть легко проведен стандартными методами и с применением стандартных анализов.
Анти-DLL4-антитела согласно изобретению могут быть использованы в анализах для детектирования уровня экспрессии DLL4 (таких как диагностические или прогностические анализы) в конкретных клетках или тканях, где указанные антитела метят как описано ниже и/или иммобилизуют на нерастворимой матрице.
В другом своем аспекте настоящее изобретение относится к способам детектирования DLL4, где указанные способы включают детектирование комплекса «DLL4 - анти-DLL4-антитело» в образце. Используемый здесь термин «детектирование» включает качественное и/или количественное детектирование (определение уровней) в присутствии или в отсутствие контроля.
В другом своем аспекте настоящее изобретение относится к способам диагностики расстройства, ассоциированного с экспрессией и/или активностью DLL4, где указанные способы включают детектирование комплекса «DLL4 - анти-DLL4-антитело» в биологическом образце, взятом у пациента, страдающего указанным расстройством, или у пациента с подозрением на такое расстройство. В некоторых вариантах изобретения экспрессией DLL4 является повышенный уровень экспрессии или аномальная (нежелательная) экспрессия. В некоторых вариантах изобретения указанным расстройством является опухоль, рак и/или клеточно-пролиферативное расстройство.
В другом своем аспекте настоящее изобретение относится к любому из описанных здесь анти-DLL4-антител, где указанное анти-DLL4-антитело содержит детектируемую метку.
В другом своем аспекте настоящее изобретение относится к комплексу, состоящему из любого из описанных здесь анти-DLL4-антител и DLL4. В некоторых вариантах изобретения указанный комплекс присутствует in vivo или in vitro. В некоторых вариантах изобретения указанный комплекс содержит раковую клетку. В некоторых вариантах изобретения анти-DLL4-антитело является детектируемо меченым.
Анти-DLL4-антитела могут быть использованы для детектирования DLL4 в любом одном из ряда хорошо известных аналитических методов детекции. Так, например, биологический образец может быть проанализирован на DLL4 путем взятия образца из нужного источника, смешивания образца с анти-DLL4-антителом с образованием комплекса «антитело/DLL4» с любым DLL4, присутствующим в данной смеси, и детектирования любого комплекса «антитело/DLL4», присутствующего в данной смеси. Биологический образец может быть получен для анализа методами, известными специалистам и подходящими для анализа конкретного образца. Методы смешивания образца с антителами и методы детектирования комплекса «антитело/DLL4» выбирают в зависимости от типа применяемого анализа. Такими анализами являются иммуногистохимический анализ, конкурентный анализ и «сэндвич»-анализ, также анализы на стерическое ингибирование.
В методах анализа на DLL4 используются один или несколько из нижеследующих реагентов, таких как: меченый аналог DLL4, иммобилизованный аналог DLL4, меченое анти-DLL4-антитело, иммобилизованное анти-DLL4-антитело и стерические конъюгаты. Меченые реагенты также известны как «метки».
Используемой меткой является любая детектируемая функциональная группа, которая не влияет на связывание DLL4 и анти-DLL4-антитела. Известно, что в иммуноанализах используются различные метки, и примерами таких меток являются молекулы, которые могут быть детектированы непосредственно, такие как флуорохром, хемилюминесцентное вещество и радиоактивные метки, также молекулы, такие как ферменты, которые для их детектирования должны быть подвергнуты реакции взаимодействия или дериватизации. Примерами таких меток являются радиоизотопы 32P, 14C, 125I, 3H и 131I, флуорофоры, такие как хелатные комплексы редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например люцифераза светляка и бактериальная люцифераза (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидаза хрена (ПХ), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахарид-оксидазы, например глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфат-дегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантин-оксидаза, присоединенные к ферменту, который использует пероксид водорода для окисления красителя-предшественника, такого как ПХ; лактопероксидаза или микропероксидаза; биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и т.п.
Для ковалентного связывания этих меток с белками или полипептидами применяются стандартные методы. Так, например, для мечения антител вышеописанными флуоресцентными, хемилюминесцентными и ферментыми метками могут быть использованы связывающие реагенты, такие как диальдегиды, карбодиимиды, дималеимиды, бисимидаты, бис-диазотированный бензидин и т.п. См., например, патенты США №№. 3940475 (флуориметрия) и 3645090 (ферменты; Hunter et al., Nature, 144: 945 (1962); David et al., Biochemistry, 13: 1014-1021 (1974); Pain et al., J. Immunol. Methods, 40: 219-230 (1981); и Nygren, J. Histochem. and Cytochem., 30: 407-412 (1982). Предпочтительными метками, используемыми в настоящей заявке, являются такие ферменты как пероксидаза хрена и щелочная фосфатаза. Конъюгирование такой метки, включая ферменты, с данным антителом представляет собой стандартную технологическую процедуру, применяемую в методах иимуноанализов и известную среднему специалисту в данной области. См., например, O'Sullivan et al., "Methods for the Preparation of Enzyme-antibody Conjugates for Use in Enzyme Immunoassay," in Methods in Enzymology, ed. J.J. Langone and H. Van Vunakis, Vol. 73 (Academic Press, New York, New York, 1981), pp. 147-166.
Для проведения некоторых аналитических методов необходима иммобилизация реагентов. Иммобилизация приводит к отделению анти-DLL4-антитела от любого DLL4, оставшегося в растворе в свободном состоянии. Такую процедуру обычно осуществляют путем инсолюбилизации анти-DLL4-антитела или аналога DLL4 перед проведением процедуры анализа, как это происходит при адсорбции на не растворимой в воде матрице или поверхности (Bennich et al.., патент США №3720760), путем ковалентного связывания (например, перекрестного связывания с глутаральдегидом) или путем последующей инсолюбилизации анти-DLL4-антитела или аналога DLL4, например посредством иммунопреципитации.
Экспрессия белков в образце может быть оценена в соответствии с протоколами иммуногистохимического анализа и окрашивания. Было показано, что иммуногистохимическое окрашивание тканевых срезов представляет собой надежный метод оценки или детектирования присутствия белков в образце. Иммуногистохимические (ИГХ) методы предусматривают использование антитела для зондирования и визуализации клеточных антигенов in situ, обычно с использованием хромогенных или флуоресцентных реагентов. Для приготовления образца может быть использован образец ткани или клетки, взятый у млекопитающего (обычно у человека). Примерами таких образцов являются, но не ограничиваются ими, раковые клетки, такие как раковые клетки толстой кишки, молочной железы, предстательной железы, яичника, легких, желудка, поджелудочной железы, лимфомы и лейкоза. Образец может быть получен с применением различных процедур, известных специалистам, включая, но не ограничиваясь ими, хирургическая операция, аспирация или биопсия. Ткань может быть свежей или замороженной. В одном из вариантов изобретения образец фиксируют и заливают в парафин или т.п. Образец ткани может быть фиксирован (то есть пресервирован) стандартными методами. Среднему специалисту в данной области известно, что выбор фиксирующего вещества зависит от целей гистологического окрашивания образца или какого-либо другого анализа. Среднему специалисту в данной области также известно, что время фиксации зависит от размера образца ткани и от используемого фиксирующего вещества.
Иммуногистохимический (ИГХ) анализ может быть осуществлен в комбинации с другими методами, такими как морфологическое окрашивание и/или флуоресцентная гибридизация in-situ. Специалистам известны два общих метода ИГХ-анализа: прямой и непрямой анализы. В соответствии с первым анализом связывание антитела с антигеном-мишенью (например, DLL4) определяют прямым методом. В указанном прямом анализе используют меченый реагент, такой как флуоресцентная метка или меченное ферментом «первое» антитело, которое может быть визуализировано без взаимодействия с другим антителом. В типичном непрямом анализе неконъюгированное «первое» антитело связывается с антигеном, затем меченое «второе» антитело связывается с первым антителом. Если «второе» антитело конъюгировано с ферментой меткой, то для визуализации антигена добавляют хромогенный или флуорогенный субстрат. Амплификация сигнала может происходить в результате реакции нескольких «вторых» антител с различными эпитопами на «первом» антителе.
«Первое» и/или «второе» антитело, используемое для иммуногистохимического анализа, обычно метят детектируемой молекулой. Существует множество меток, которые могут быть, в основном, разделены на группы в соответствии с описанными ниже категориями.
Помимо процедур получения образца, обсуждаемых выше, может оказаться желательной дополнительная обработка срезов ткани, осуществляемая до, во время или после проведения ИГХ-анализа. Так, например, могут быть применены методы восстановления эпитопа, такие как нагревание образца ткани в цитратном буфере (см., например, Leong et al. Appl. Immunohistochem. 4(3):201 (1996)).
После проведения необязательной стадии блокирования срез ткани обрабатывают «первым» антителом в течение определенного периода времени и в подходящих условиях, достаточных для связывания первого антитела с белковым антигеном-мишенью в образце ткани. Соответствующие условия, подходящие для достижения данной цели, могут быть определены путем рутинного экспериментирования. Уровень связывания антитела с образцом определяют с использованием любой одной из детектируемых меток, обсуждаемых выше. Предпочтительной меткой является ферментная метка (например, HRPO), которая катализирует химическое превращение хромогенного субстрата, такого как 3,3'-диаминобензидиновый хромоген. Предпочтительно указанную ферментативную метку конъюгируют с антителом, которое специфически связывается с «первым» антителом (например, «первым» антителом является кроличье поликлональное антитело, «вторым» антителом является козье антикроличье антитело).
Приготовленные таким образом образцы могут быть получены в виде гистологических срезов и нанесены на предметные стекла. Затем эти предметные стекла анализируют под микроскопом и оценивают в соответствии с критериями интенсивности окрашивания, обычно используемыми специалистами в рутинных процедурах анализа. Интенсивность окрашивания может быть оценена по следующим критериям в табл.2:
Обычно в иммуногистохимическом анализе оценка картины окрашивания примерно 2+ или выше является диагностической и/или прогностической. В некоторых вариантах изобретения в иммуногистохимическом анализе оценка картины окрашивания примерно 1+ или выше является диагностической и/или прогностической. В других вариантах изобретения оценка картины окрашивания примерно 3 или выше является диагностической и/или прогностической. При этом следует отметить, что если клетки и/или ткани опухоли или аденомы толстой кишки оценивают с помощью иммуногистохимического анализа, то окрашивание обычно определяют или оценивают в опухолевых клетках и/или тканях (а не в стромальных или окружающих тканях, которые могут присутствовать в образце).
Существуют также и другие аналитические методы, известные как конкурентные анализы или «сэндвич»-анализы, и такие методы широко используются в промышленности по изготовлению коммерчески доступных диагностических средств.
Конкурентные анализы основаны на способности аналога меченого DLL4 конкурировать с тестируемым образцом DLL4 за связывание с ограниченным числом антигенсвязывающих сайтов анти-DLL4-антитела. Анти-DLL4-антитело обычно подвергают инсолюбилизации до или после конкурентного связывания, затем метку и DLL4, связанные с анти-DLL4-антителом, отделяют от несвязанной метки и DLL4. Такое разделение осуществляют путем декантирования (где указанный партнер по связыванию был предварительно подвергнут инсолюбилизации) или путем центрифугирования (где партнер по связыванию был осажден после конкурентной реакции). Количество тестируемого образца DLL4 обратно пропорционально количеству связанной метки, как было определено по количеству вещества-маркера. Были построены кривые «доза - ответ» по известным количествам DLL4, и полученные результаты сравнивали с результатами теста для определения количества DLL4, присутствующего в тестируемом образце. Если в качестве детектируемых маркеров используются ферменты, то такие анализы называются ELISA-системами.
Конкурентный анализ другого типа, называемый «гомогенным» анализом, не предусматривает разделения фаз. В данном случае конъюгат фермента с DLL4 получают и используют так, чтобы анти-DLL4-антитело при его связывании с DLL4 могло модифицировать ферментативную активность. В этом случае DLL4 или его иммунологически активные фрагменты конъюгируют с ферментом, таким как пероксидаза, посредством бифункционального органического мостика. Конъюгаты, предназначенные для использования с анти-DLL4-антителом, выбирают так, чтобы связывание анти-DLL4-антитела приводило к ингибированию или потенцированию ферментативной активности метки. Этот метод per se широко применяется на практике и называется EMIT.
В методах гомогенного анализа с применением стерического затруднения используются стерические конъюгаты. Эти конъюгаты синтезируют путем ковалентного связывания низкомолекулярного гаптена с небольшим фрагментом DLL4 так, чтобы антитело против гаптена было, по существу, неспособно связываться с данным конъюгатом одновременно с анти-DLL4-антителом. В этой процедуре анализа DLL4, присутствующий в тестируемом образце, будет связываться с анти-DLL4-антителом, что позволяет антителу против гаптена связываться с данным конъюгатом и приводить к изменению свойств гаптенового конъюгата, например к изменению интенсивности флуоресценции в том случае, если гаптеном является флуорофор.
«Сэндвич»-анализы, в частности, могут быть использованы для определения DLL4 или анти-DLL4-антител. В последовательно проводимых «сэндвич»-анализах иммобилизованное анти-DLL4-антитело используют для адсорбции тестируемого образца DLL4, затем тестируемый образец удаляют путем промывки, и связанный DLL4 используют для адсорбции «второго» меченого анти-DLL4-антитела, после чего связанное вещество отделяют от остальной метки. Количество связанной метки прямо пропорционально количеству тестируемого образца DLL4. В «одновременно» проводимых «сэндвич»-анализах тестируемый образец не отделяют от метки перед добавлением меченого анти-DLL4-антитела. В образцах, тестируемых на присутствие DLL4, применяется последовательно проводимый «сэндвич»-анализ, в котором в качестве одного антитела используется моноклональное анти-DLL4-антитело, в качестве другого антитела используется поликлональное анти-DLL4-антитело.
Выше были описаны лишь репрезентативные анализы на DLL4. Другие методы, применяемые в настоящее время, или методы, которые будут разработаны в будущем и в которых для определения DLL4 будет использоваться анти-DLL4-антитело, входят в объем рассматриваемых методов, включая описанные здесь биоанализы.
Промышленные изделия
В другом своем аспекте настоящее изобретение относится к промышленному изделию, содержащему материалы, используемые для лечения, предупреждения и/или диагностики описанных выше расстройств. Промышленное изделие содержит контейнер и этикетку или вкладыш, вложенный в упаковку или наклеенный на контейнер. Подходящими контейнерами являются, например, бутыли, флаконы, шприцы и т.п. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Этот контейнер содержит композицию, которая сама по себе или в комбинации с другой(ими) композицией(ями) является эффективной для лечения, предупреждения и/или диагностики данного состояния, и может иметь стерильное входное отверстие (например, таким контейнером может быть пакет для внутривенного введения раствора или сосуд, имеющий пробку, протыкаемую безыгольной иглой для инъекций). В данной композиции по меньшей мере одним активным агентом является антитело согласно изобретению. На этикетке или во вкладыше, вложенном в упаковку, должно быть указано, что такая композиция используется для лечения данного конкретного заболевания, такого как рак. Кроме того, указанное промышленное изделие может включать (а) первый контейнер с содержащейся в нем композицией, включающей антитело согласно изобретению, и (b) второй контейнер с содержащейся в нем композицией, включающей дополнительное терапевтическое средство, включая, например, химиотерапевтическое средство или антиангиогенное средство, включая, например, анти-VEGF-антитело (например, бевацизумаб). В этом варианте изобретения промышленное изделие согласно изобретению может дополнительно содержать вложенный в упаковку вкладыш, в котором указано, что композиции, содержащие «первое» и «второе» антитело, могут быть использованы для лечения конкретного состояния, например рака. Альтернативно или дополнительно указанное промышленное изделие может также содержать второй (или третий) контейнер, включающий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать и другие материалы, необходимые для коммерческого производства и для потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Ниже приводятся примеры способов и композиций согласно изобретению. При этом следует отметить, что исходя из приведенного выше общего описания изобретения могут быть осуществлены и другие различные варианты изобретения.
ПРИМЕРЫ
Материалы и методы
Коммерчески доступные реагенты, описанные в примерах, использовали в соответствии с инструкциями производителей, если это не оговорено особо. Источником клеток, используемых в нижеследующих примерах и во всем описании изобретения, является Американская коллекция типовых культур, American Type Culture Collection Manassas, VA 20108, и эти клетки идентифицируют по их регистрационным номерам ATCC®. Работы, цитируемые в примерах, перечислены после примеров. Все эти работы вводятся в настоящее описание посредством ссылки.
Пример 1: Материалы и методы
В примерах были использованы следующие материалы и методы.
Анализ HUVEC на сферах с фибриновым гелем. Анализ HUVEC на сферах с фибриновым гелем подробно описан в литературе (Nakatsu, M. N. et al. Microvasc Res 66, 102-12 (2003)). Вкратце, 3 сферы Cytodex™ (Amersham Pharmacia Biotech) покрывали 350-400 клетками HUVEC на сферу. Примерно 200 сфер, покрытых HUVEC, заливали в фибриновый сгусток в одну из лунок 12-луночного планшета для культивирования тканей. На верхнюю часть сгустка высевали 8×104 клеток SF. Анализы завершали на 7-9-й день для проведения иммуноокрашивания и визуализации. В некоторых экспериментах разрастание HUVEC визуализировали путем окрашивания конъюгированным с биотином анти-CD31 антителом (клон WM59, eBioscience) и стрептавидином-Cy3. Для окрашивания ядер HUVEC фибриновые гели фиксировали в течение ночи в 2% параформальдегиде (PFA) и окрашивали 4',6-диамидино-2-фенилиндолом (DAPI, Sigma). Для окрашивания Ki67 фибриновые гели обрабатывали 10× трипсином-EDTA в течение 5 минут для удаления верхнего слоя SF, затем нейтрализовали 10% FBS в PBS и фиксировали в течение ночи в 4% PFA. Затем фибриновые гели блокировали 10% козьей сывороткой в PBST в течение 4 часов, после чего инкубировали в течение ночи с кроличьим антимышиным Ki67 (готовый к употреблению клон Sp6, LabVision), затем осуществляли детектирование с использованием «второго» Cy3-конъюгированного антитела против кроличьих IgG (Jackson ImmunoResearch). Все ночные процедуры инкубирования проводили при 4°C.
Исследование сетчатки новорожденных мышей. Новорожденным мышам CD1 от одного и того же помета i.p. инъекцировали PBS или YW26.82 (10 мг/кг) на P1 и P3. Глаза извлекали на P5 и фиксировали 4% PFA в PBS в течение ночи. Иссеченные сетчатки блокировали 10% козьей сывороткой в PBST в течение 3 часов, затем инкубировали в течение ночи с «первыми» антителами. Первая смесь включала биотинилированный изолектин B4 (25 мкг/мл, Bandeiraea simplicifolia; Sigma), и один из нижеследующих компонентов, таких как кроличье антимышиное Ki67 (1:1, готовый к употреблению клон Sp6, Lab Vision) или мышиное Cy3-конъюгированное антитело против альфа-SMA (1:2000, Sigma-Aldrich) и 10% сыворотку в PBLEC (1% тритон X-100, 0,1 мM CaCl2, 0,1 мM MgCl2, 0,1 мM MnCl2 в PBS, pH 6,8). Затем сетчатки промывали в PBST и инкубировали в течение ночи с комбинацией «второго» антитела и стрептавидина Alexa Fluor® 488 (1:200; Molecular Probes) и с Cy3-конъюгированным антителом против кроличьих IgG (1:200; Jackson ImmunoResearch). После завершения окрашивания сетчатки фиксировали 4% PFA в PBS. Все ночные процедуры инкубирования проводили при 4°C. Изображения гистологических срезов сетчатки получали на предметном стекле с помощью конфокальной флуоресцентной микроскопии.
Модели опухоли. Были использованы 8-10-недельные самки «голых» мышей с врожденным отсутствием природных клеток-киллеров. Для генерирования подкожных опухолей мышам в правый задний бок инъецировали 0,1 мл клеточной суспензии, содержащей 50% матригеля (BD Bioscience). Каждой мыши инъецировали 5×106 раковых клеток человеческой толстой кишки HM7, 10×106 клеток карциномы человеческой толстой кишки Colo205, 10×106 клеток карциномы легких человека Calu6, 10×106 клеток карциномы легких человека MV-522, 10×106 клеток мышиного лейкоза WEHI-3, 10×106 клеток мышиной лимфомы EL4, 10×106 клеток рака яичника человека SK-OV-3 X1, 10×106 клеток мышиного рака легких LL2, 10×106 клеток лейкоза/лимфомы EL4 или 10×106 клеток немелкоклеточного рака легких H1299. Для получения модели человеческой меланомы MDA-MB-435 мышам в жировое тело молочной железы инъецировали 0,1 мл клеточной (5×106) суспензии, содержащей 50% матригель. Анти-DLL4-антитело YW26.82 вводили i.p. (10 мг/кг массы тела, два раза в неделю). Для получения следующих моделей опухоли каждой исследуемой мыши в правый бок подкожно имплантировали фрагмент опухоли (1 мм3): не-мелкоклеточного рака легких SKMES-1, рака молочной железы человека MX-1, рака прямой и ободочной кишки человека SW620 и человеческой аденокарциномы LS174T. Размер опухоли оценивали с помощью штангенциркуля. Объем опухоли (мм3) определяли путем измерения длины (l) и ширины (w) и вычисляли по формуле (V = lw 2/2). Каждая группа включала 10-15 животных. Статистическое сравнение групп обработки осуществляли с помощью двухстороннего т-критерия Стьюдента.
Мечение и иммуногистохимический анализ сосудов опухоли.
Мышей анестезировали изофлураном. Затем i.v. инъецировали ФИТЦ-меченый лектин Lycopersicon esculentum (150 мкг в 150 мкл 0,9% NaCl; Vector Laboratories) и оставляли на 5 минут для его поступления в кровоток, затем осуществляли системную перфузию. Сосудистую сеть подвергали транскардиальной перфузии 1% PFA в PBS в течение 3 минут. Опухоли удаляли и фиксировали путем погружения в то же самое фиксирующее вещество на 2 часа, после чего инкубировали в течение ночи в 30% сахарозе для криозащиты, затем заливали в OCT. Срезы (толщиной 4 мкм) окрашивали антителом против мышиного CD31 (1:50, BD Pharmingen), затем козьим антителом против крысиных IgG Alexa 594 (1:800, Molecular Probes).
Гистологический и иммуногистохимический анализ мышиной тонкой кишки.
Были получены фиксированные в формалине и залитые в парафин срезы тканей мышиной тонкой кишки толщиной 3 мкм. Гистохимическую идентификацию клеток тонкой кишки осуществляли с использованием альцианового синего в соответствии с рекомендациями производителей (PolyScientific). Для окрашивания анти-Ki67 антителом срезы предварительно обрабатывали раствором для восстановления мишени (S1700, DAKO) и инкубировали с кроличьим анти-Ki67-антителом (1:200, клон SP6, Neomarkers). «Второе» козье антикроличье антитело в концентрации 7,5 г/мл (Vector labs) детектировали с использованием набора Vectastain ABC Elite Kit (Vector labs). Все Ki67-окрашенные срезы подвергали контрастному окрашиванию гематоксилином Мейера. Для окрашивания HES-1 использовали антитело против крысиного HES-1 (клон NM1, MBL, International), затем TSA-HRP.
Интерференция РНК. Набор дуплексов короткой интерферирующей РНК (киРНК) (SMART), нацеленных на человеческий DLL4, и контрольную не-нацеленную киРНК (Si Control Non-Target siRNA #2) закупали у компании Dharmacon. Дуплексы киРНК (50 нМ) трансфецировали в клетки HUVEC при 40% конфлюэнтности с использованием реагента OptiMEM-1® и липофектаминаТМ 2000 (Invitrogen). FACS-анализ проводили через 48 часов после трансфекции киРНК. Ниже представлены последовательности набора SMART из 4 киРНК, нацеленных на DLL4:
CAACTGCCCTTATGGCTTTTT (SEQ ID NO:62) (олигонуклеотид 1, смысловая последовательность),
AAAGCCATAAGGGCAGTTGTT (SEQ ID NO:63) (олигонуклеотид 1, антисмысловая последовательность),
CAACTGCCCTTCAATTTCATT (SEQ ID NO:64) (олигонуклеотид 2, смысловая последовательность),
TGAAATTGAAGGGCAGTTGTT (SEQ ID NO:65) (олигонуклеотид 2, антисмысловая последовательность),
TGACCAAGATCTCAACTACTT (SEQ ID NO:66) (олигонуклеотид 3, смысловая последовательность),
GTAGTTGAGATCTTGGTCATT (SEQ ID NO:67) (олигонуклеотид 3, антисмысловая последовательность),
GGCCAACTATGCTTGTGAATT (SEQ ID NO:68) (олигонуклеотид 4, смысловая последовательность),
TTCACAAGCATAGTTGGCCTT (SEQ ID NO:69) (олигонуклеотид 4, антисмысловая последовательность).
Лиганд Notch: ELISA-анализ на блокирование Notch. 96-луночные микротитрационные планшеты покрывали рекомбинантным крысиным Notch1-Fc (rrNotch1-Fc, R&D Systems) в концентрации 0,5 мкг/мл. В этом анализе использовали кондиционированную среду, содержащую DLL4-AP (аминокислоты 1-404 DLL4, присоединенные к щелочной фосфатазе (AP) человеческой плаценты). Для получения кондиционированной среды клетки 293 были временно трансфецированы DLL4-AP-экспрессирующей плазмидой с использованием реагента Fugen6 (Roche Molecular Biochemicals). Через пять дней после трансфекции кондиционированную среду собирали, фильтровали и помещали на хранение при 4°C. Очищенные антитела, которые титровали начиная от 0,15 и до 25 мкг/мл, предварительно инкубировали в течение 1 часа при комнатной температуре с DLL4-AP-кондиционированной средой при разведении, которое обеспечивало 50% максимально достижимое связывание с покрытым rrNotch1-Fc. Затем смесь антитела/DLL4-AP добавляли в rrNotch1-Fc-покрытый планшет в течение 1 часа при комнатной температуре, после чего планшеты несколько раз промывали PBS. Связанный DLL4-AP детектировали с использованием реагента 1-Step PNPP (Pierce), используемого в качестве субстрата, и измеряли оптическую плотность (OD) на 405 нм. Идентичный анализ осуществляли с использованием DLL1-AP (человеческого DLL1, аминокислоты 1-445). Аналогичные анализы осуществляли с использованием очищенного DLL4-His (C-концевого His-меченого человеческого DLL4, аминокислоты 1-404) и Jag1-His (R & D system). Связанные His-меченые лиганды детектировали с использованием мышиного анти-His mAb (1 мкг/мл, Roche Molecular Biochemicals), биотинилированного козьего антимышиного антитела (Jackson ImmunoResearch) и стрептавидина-AP (Jackson ImmunoResearch).
Экстракция РНК и количественная ОТ-ПЦР в реальном времени. Экстракцию полноразмерной РНК из HUVEC в 2-мерной культуре осуществляли с использованием набора RNeasy® Mini Kit (Qiagen) в соответствии с инструкциями производителей. Для экстракции полноразмерной РНК из клеток HUVEC, растущих в фибриновых гелях, эти фибриновые гели обрабатывали 10× трипсином-EDTA (Gibco) в течение 5 минут для удаления верхнего слоя фибробластов, затем нейтрализовали 10% FBS в PBS. После этого фибриновые сгустки удаляли из лунок для культивирования ткани и подвергали центрифугированию (10K в течение 5 минут) в микропробирках для удаления избыточной жидкости. Полученные гелевые «гранулы» подвергали лизису с использованием буфера для лизиса (с помощью набора RNeasy® Mini Kit), затем обрабатывали как и в случае HUVEC в 2-мерной культуре. Качество РНК оценивали с использованием 6000 наночипов с РНК и биоанализатора Agilent 2100 (Agilent Technologies). Количественные ОТ-ПЦР в реальном времени проводили с тремя повторностями с использованием ПЦР-системы в реальном времени 7500 (Applied Biosystems). В качестве эталонного гена для нормализации использовали человеческий ген GAPDH. Уровни экспрессии выражали как средняя (± среднеквадратическая ошибка) кратность изменений мРНК по отношению к контролю для 3 отдельных определений. Ниже представлены последовательности прямого и обратного праймера и зондов для VEGFR2, TGFβ2 и GAPDH.
TGFb2
Прямой праймер: GTA AAG TCT TGC AAA TGC AGC TA (SEQ ID NO:70)
Обратный праймер: CAT CAT CAT TAT CAT CAT CAT TGT C (SEQ ID NO:71)
Зонд: AAT TCT TGG AAA AGT GGC AAG ACC AAA AT (SEQ ID NO:72)
VEGFR2
Прямой праймер: CTT TCC ACC AGC AGG AAG TAG (SEQ ID NO:73)
Обратный праймер: TGC AGT CCG AGG TCC TTT (SEQ ID NO:74)
Зонд: CGC ATT TGA TTT TCA TTT CGA CAA CAG A (SEQ ID NO:75)
GAPDH
Прямой праймер: GAA GAT GGT GAT GGG ATT TC (SEQ ID NO:76)
Обратный праймер: GAA GGT GAA GGT CGG AGT C (SEQ ID NO:77)
Зонд: CAA GCT TCC CGT TCT CAG CC (SEQ ID NO:78)
Пример 2: Генерирование фаговых анти-DLL4-антител
Библиотеки синтезированных фаговых антител конструировали на одной каркасной области (гуманизованное анти-ErbB2-антитело, 4D5) путем введения вариабельности в гипервариабельные области (CDR) тяжелой и легкой цепей (Lee, C. V. et al. J Mol Biol 340, 1073-93 (2004); Liang, W. C. et al. J Biol Chem 281, 951-61 (2006)). Пэннинг на планшетах с исходными библиотеками осуществляли в целях проведения анализа на His-меченый человеческий DLL4 (аминокислоты 1-404), иммобилизованный на иммунопланшетах MaxiSorp™. После четырех раундов обогащения клоны произвольно собирали и конкретные связывающиеся клоны идентифицировали с использованием фагового ELISA. Полученные hDLL4-связывающиеся клоны были затем скринированы с использованием His-меченого мышиного белка DLL4 для идентификации перекрестно-связывающихся клонов. Для каждого позитивного фагового клона вариабельные области тяжелой и легкой цепей субклонировали в экспрессионные векторы pRK, которые были сконструированы так, чтобы они были способны экспрессировать полноразмерные цепи IgG. Конструкции тяжелой и легкой цепи котрансфецировали в клетки 293 или CHO, и экспрессированные антитела выделяли из бессывороточной среды на аффинной колонке с белком А. Очищенные антитела тестировали с помощью ELISA на блокирование взаимодействия DLL4 с крысиным Notch1-Fc и с помощью FACS на связывание со стабильными клеточными линиями, экспрессирующими либо полноразмерный человеческий DLL4 либо мышиный DLL4. Для созревания аффинности фаговые библиотеки с тремя различными комбинациями CDR-петель (CDR-L3, -H1 и -H2), происходящих от представляющего интерес исходного клона, конструировали с применением стратегии мягкой рандомизации так, чтобы каждое выбранное положение было модифицировано с получением остатка не-дикого типа или чтобы поддерживалось соотношение остатков не-дикого типа к остаткам дикого типа, составляющее примерно 50:50 . Затем клоны с высокой аффинностью идентифицировали в четыре раунда пэннинга в жидкой фазе, проводимого для анализа на человеческие и мышиные His-меченые белки DLL4 в условиях постоянно возрастающей жесткости.
Пример 3: Характеризация анти-DLL4-антител
Для определения аффинности связывания анти-DLL4 Mab проводили измерение с использованием поверхностного плазмонного резонанса (SRP) на устройстве BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ). Вкратце, биосенсорные чипы с карбоксиметилированным декстраном (CM5, BIAcore Inc.) активировали гидрохлоридом N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщиков. Анти-DLL4-антитело разводили 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл, затем инъецировали при скорости потока 5 мкл/минуту до достижения величины единиц отклика (RU) связанного антитела, составляющей примерно 500. Затем для блокирования непрореагировавших групп вводили 1М этаноламин. Для измерения кинетики реакции вводили инъекции двухкратных серийных разведений человеческих или мышиных молекул DLL4-His (0,7 нМ-500 нМ) в PBS, содержащем 0,05% твинаТМ 20 при 25°С и при скорости потока 25 мкл/мин. Скорость ассоциации (kon) и скорость диссоциации (koff) вычисляли с использованием простой лангмюровской модели связывания 1:1 (BIAcore Evaluation Software version 3.2). Константу равновесной диссоциации (Кd) вычисляли как отношение koff/kon. Результаты этого эксперимента представлены в табл.3. Антитело YW26.81 давало аналогичные величины Kd для человеческого и мышиного DLL4 (величины Kd составляли 0,1 нМ и 0,09 нМ соответственно), что позволяет проводить оценку эффективного действия антител на мышиных моделях.
Аффинность и кинетика связывания анти-DLL4-антител с человеческим и мышиным DLL4. «NA» означает, что измерения не проводили
Пример 4: Дополнительная характеризация анти-DLL4-антитела
Картирование эпитопов анти-DLL4 Mab YW26.82: Анти-DLL4 Mab 26.82 распознавало детерминанту связывания, присутствующую в EGF-подобном повторе # 2 (EGL2) человеческого внеклеточного домена DLL4 (ECD). EGL2 содержит аминокислоты 252-282 человеческого ECD DLL4. Вкратце, мутанты ECD DLL4 были экспрессированы как гибридные белки со щелочной фосфатазой и было проанализировано их связывание с антителом. На фиг.11a схематически представлен набор мутантов DLL4, экспрессируемых в виде С-концевых гибридных белков с щелочной фосфатазой (AP) в плаценте человека. В скобках указаны последовательности DLL4, включенные в гибридные белки. Среду, кондиционированную клетками 293T и содержащую гибридные белки, тестировали на 96-луночных микротитрационных планшетах, покрытых очищенным анти-DLL4 Mab (YW26.82, 0,5 мкг/мл). Связанный DLL4.AP детектировали с использованием реагента 1-Step PNPP (Pierce) в качестве субстрата и измеряли оптическую плотность OD на 405 нм. Mab YW26.82 связывалось с конструкциями, содержащими домен EGL2 DLL4, и не связывалось с конструкцией, не содержащей домена EGL2 DLL4. Эти результаты показали, что анти-DLL4 Mab YW 26.82 распознавало эпитоп в домене EGL2 человеческого ECD DLL4.
Mab YW26.82 селективно связывается с мышиным и человеческим DLL4. 96-луночные планшеты Nunc Maxisorp покрывали очищенными рекомбинантными белками как указано выше (1 мкг/мл). Связывание YW26.82 в указанных концентрациях измеряли с помощью ELISA. Связанные антитела детектировали с помощью ПХ-конъюгированного античеловеческого антитела с использованием TMB в качестве субстрата и измеряли оптическую плотность OD на 450 нм. В качестве аналитического контроля использовали анти-HER2-антитело и рекомбинантный ErbB2-ECD (фиг.11b). Результаты этого эксперимента представлены на фигуре 11b. Mab YW26.82 связывалось с человеческим и мышиным DLL4 и не связывалось с человеческим DLL1 и человеческим JAG1 на детектируемом уровне. Эти результаты показали, что Mab YW26.82 селективно связывается с DLL4.
FACS-анализ клеток 293, временно трансфецированных вектором, полноразмерным DLL4, Jag1 или DLL1, также продемонстрировал, что Mab YW26.82 селективно связывается с DLL4. Как показано на фиг.11c, значительный уровень связывания YW26.82 детектировался только на DLL4-трансфецированных клетках (верхняя панель). На DLL1- или Jag1-трансфецированных клетках какого-либо значимого связывания не наблюдалось. Экспрессия Jag1 и DLL1 была подтверждена посредством связывания рекомбинантного крысиного Notch1-Fc (rrNotch1-Fc, средняя панель) и рекомбинантного крысиного Notch2-Fc (rrNotch2-Fc, нижняя панель) соответственно. YW26.82, rrNotch1-Fc или rrNotch2-Fc (R & D system) использовали при 2 мкг/мл, затем использовали ФЭ-конъюгированное козье антитело против человеческих IgG (1:500, Jackson ImmunoResearch).
Эксперименты на конкурентное связывание показали, что Mab YW26.82 эффективно и селективно блокирует взаимодействие Notch с DLL4, но не с другими лигандами Notch. Как показано на фиг.11d, анти-DLL4 Mab блокирует связывание DLL4-AP, но не DLL1-AP, с покрытым rNotch1, при вычисленном IC50 ~12 нМ (левая панель). Анти-DLL4 Mab блокирует связывание DLL4-His, но не Jag1-His, с покрытым rNotch1, при вычисленном IC50 ~8 нМ (правая панель).
Анти-DLL4 Mab YW26.82 специфически связывалось с эндогенно экспрессируемым DLL4 в эндотелиальных человеческих клетках пупочной вены (HUVEC). Был проведен FACS-анализ HUVEC, трансфецированных контрольной или DLL4-специфической киРНК. YW26.82 использовали при 2 мкг/мл, затем использовали ФЭ-конъюгированное козье антитело против человеческого IgG (1:500, Jackson ImmunoResearch). Результаты этого эксперимента представлены на фиг.11e. При этом наблюдалось связывание с нетрансфецированными HUVEC (контроль) и с HUVEC, трансфецированными контрольной киРНК. В противоположность этому уровень связывания с HUVEC, трансфецированных киРНК DLL4, значительно снижался. Эти эксперименты продемонстрировали, что анти-DLL4 Mab YW26.82 специфически связывается с эндогенно экспрессируемым DLL4 в HUVEC.
Пример 5: Обработка анти-DLL4-антителом приводит к повышению уровня пролиферации эндотелиальных клеток in vitro
Эндотелиальные клетки человеческой пупочной вены (HUVEC), растущие в фибриновых гелях в присутствии совместно культивированных клеток фибробластов кожи человека (SF), дают отростки, имеющие четко выраженную полость-подобную структуру (Nakatsu, M. N. et al. Microvasc Res 66, 102-12 (2003)). Добавление анти-DLL4-антитела YW26.82 приводит к заметному увеличению длины и числа отростков (фиг.7a). Протеолитический процессинг Notch, катализируемый γ-секретазной активностью белкового комплекса, является основной стадией в процессе активации Notch (Baron, M. Semin Cell Dev Biol 14, 113-9 (2003)). Интересно отметить, что ингибитор γ-секретазы дибензазепин (DBZ) (van Es, J. H. et al. Nature 435, 959-63 (2005); Milano, J. et al. Toxicol Sci 82, 341-58 (2004)) оказывает такое же влияние на разрастание HUVEC. Принимая во внимание, что эти две обработки действуют по различным механизмам, следует отметить, что значительный уровень прорастания явно обусловлен ослаблением передачи сигнала Notch. Ki67-окрашивание показало, что усиленное прорастание ЭК вызвано повышением уровня пролиферации клеток (фиг.7b). В исходном анализе, проводимом в фибриновом геле, разрастание HUVEC и последующее образование полостей подтверждали путем совместного культивирования с клетками SF. При замене клеток SF кондиционированной средой, анти-DLL4 Mab и DBZ еще обладали способностью усиливать разрастание HUVEC (фиг.1c), что подтверждает автономную роль ЭК в передаче сигнала DLL4/Notch. В обратном эксперименте активация Notch иммобилизованным белком DLL4 приводила к значительному ингибированию роста клеток (фиг.7e). Эти результаты позволяют предположить, что состояние активации передачи сигнала DLL4/Notch тесно связано с пролиферацией ЭК.
Пример 6: Обработка анти-DLL4-антителом приводит к повышению уровня пролиферации эндотелиальных клеток in vivo
В сетчатке мышей сразу после рождения развивается стереотипический сосудистый рисунок в хорошо определенной последовательности событий (Stone, J. & Dreher, Z. J Comp Neurol 255, 35-49 (1987); Gerhardt, H. et al. J. Cell Biol. 161, 1163-77 (2003); Fruttiger, M. Invest Ophthalmol Vis Sci 43, 522-7 (2002)). Явно выраженная и динамическая экспрессия DLL4 в растущих ЭК в сетчатке новорожденных мышей позволяет предположить о возможной роли DLL4 в регуляции развития сосудов сетчатки (Claxton, S. & Fruttiger, M. Gene Expr Patterns 5, 123-7 (2004)). Системная доставка YW26.82 приводила к значительному изменению сосудистой сети сетчатки. В сетчатке происходила массивная аккумуляция ЭК, в результате чего образовывалась складчатая структура с примитивной сосудистой морфологией (фиг.7d). В ЭК наблюдалось значительное увеличение интенсивности Ki67-мечения, что указывает на усиление пролиферации ЭК (фиг.7h). Поэтому такой гиперпролиферативный фенотип ЭК сетчатки после блокады DLL4 у новорожденных мышей подтвердил данные in vitro.
Пример 7: Основная роль DLL4/Notch в регуляции пролиферации эпителиальных клеток
VEGF регулирует несколько фундаментальных процессов в ЭК (Ferrara, N. Exs, 209-31 (2005); Coultas, L. et al. Nature 438, 937-45 (2005)). Однако в этой связи не очень понятно, каким образом сигналы VEGF интегрируются в сложных процессах образования сосудов, таких как артериофенозная (AV) дифференциация и иерархическая сосудистая организация, то есть события, которые, как очевидно, требуют дополнительных в высокой степени скоординированных путей передачи сигнала. Генетические исследования, проводимые на рыбе зебре, дают основание предположить, что VEGF действует перед каскадом реакций Notch во время артериальной эндотелиальной дифференциации (Lawson, N. D. et al. Development 128, 3675-83 (2001)). Авторами настоящего изобретения было обнаружено, что VEGF-стимуляция HUVEC приводит к повышению уровня поверхностной экспрессии DLL4 (данные не приводятся), что соответствует недавно высказанному сообщению об активации мРНК DLL4 посредством VEGF-стимуляции (Patel, N. S. et al. Cancer Res 65, 8690-7 (2005)). Интересно отметить, что сам DLL4 активируется после активации Notch (фиг.12), что дает основание предположить о существовании механизма позитивной обратной связи, благодаря которому DLL4 эффективно передает сигнал VEGF на путь Notch. Вкратце, HUVEC стимулировали иммобилизованным C-концевым His-меченым человеческим DLL4 (аминокислоты 1-404) в отсутствие или в присутствии DBZ (0,08 мкM). Через 36 часов после стимуляции эндогенную экспрессию DLL4 оценивали с помощью FACS-анализа, проводимого с использованием анти-DLL4-антитела.
Следует отметить, что гиперпролиферация ЭК, возникающая в результате блокирования передачи сигнала Notch, все же зависит от VEGF. В культуре 3-мерного фибринового геля обработка анти-VEGF Mab приводит к прекращению значительного уровня разрастания ЭК в присутствии или в отсутствие DBZ (фиг.7f), что повышает вероятность того, что гиперпролиферативное поведение может быть отчасти обусловлено усилением сигнала VEGF. Действительно, блокирование Notch под действием YW26.82 или DBZ приводит к активации VEGFR2 (фиг.7g). И наоборот, активация Notch под действием иммобилизованного DLL4 подавляет экспрессию VEGFR2 (фиг.7g). Поэтому хотя VEGF может действовать перед прохождением каскада реакций DLL4/Notch, однако DLL4/Notch способен к тонкой настройке ответа посредством негативной регуляции экспрессии VEGFR2.
Пример 8: Обработка анти-DLL4-антителом блокирует дифференцировку эндотелиальных клеток и развитие артерий
Помимо повышения уровня пролиферации ЭК антагонистическое действие DLL4/Notch приводит к резкому морфологическому изменению отростков ЭК в фибриновом геле. Многоклеточные полость-подобные структуры, в основном, отсустствовали (фиг.8a), что позволяет предположить о нарушении дифференцировки ЭК. В сетчатках, обработанных моноклональным антителом Mab YW26.82, характерная картина радиально чередующихся артерий и вен была в значительной степени нарушена. Окрашивание антителом против α-актина гладкой мышцы (ASMA), которое ассоциируется с артериями сетчатки, полностью отсутствовало (фиг.8c). Такое наблюдение очень напоминало нарушение развития артерий у DLL4+/--эмбрионов. Эти данные, со всех точек зрения, подтверждают, что DLL4/Notch играет главную роль в регуляции дифференцировки ЭК.
Пример 9: Экспрессия TFGβ ассоциируется с активированным состоянием Notch
Аналогично каскаду реакций Notch передача сигнала TGFβ зависит от его окружения и оказывает различные и часто противоположные действия на ингибирование дифференцировки, пролиферации и роста клеток. Кроме того, каскад реакций TGFβ участвует в процессах развития сосудов (Urness, L. D. et al, Nat Genet 26, 328-31 (2000); Oshima, M. et al, Dev Biol 179, 297-302 (1996); Larsson, J. et al. Embo J 20, 1663-73 (2001)). Так, например, дефицит киназы 1, подобной рецептору активина (ALK1), то есть специфическому рецептору TGFβ типа I ЭК, приводит к образованию примитивной сетчатой структуры ЭК в желточных мешках и к недостаточной артериовенозной функции (AVM), то есть общего фенотипа, присущего мышам с нарушением передачи сигнала Notch (Urness, L. D. et al, Nat Genet 26, 328-31 (2000); Iso, T. et al, Arterioscler Thromb Vasc Biol 23, 543-53 (2003)). Это натолкнуло авторов настоящего изобретения на мысль об иследовании возможной взаимосвязи между этими двумя каскадами реакций. Авторами настоящего изобретения было обнаружено, что экспрессия TGFβ2 (фиг.8b) непосредственно связана с активированным состоянием Notch, что позволяет предположить, что каскад реакций TGFβ может проходить после каскада реакций Notch. В целом, данные, полученные авторами настоящего изобретения, подтверждают модель, в которой система DLL4/Notch, служащая в качестве «линии передачи сигнала», интегрирует сигналы VEGF посредством регуляции экспрессии DLL4 и направляет TGFβ-путь на стимуляцию дифференцировки ЭК.
Пример 10: Обработка анти-DLL4-антителом ингибирует рост опухоли in vivo
Для полного выявления возможной роли передачи сигнала DLL4/Notch в процессе ангиогенеза опухоли авторами настоящего изобретения было исследовано влияние блокирования DLL4 на рост опухоли в преклинических моделях опухоли (фиг.9a-d). В моделях с ксенотрансплантатами опухолей HM7, Colo205 и Calu6 (фиг.9a-c) обработка антителом YW26.82 была инициирована после стабильного развития опухоли (после достижения размера опухоли ≥250 мм3). Во всех трех моделях различие в скоростях роста опухоли у контрольной группы и групп обработки становилось заметным через три дня после введения дозы. Объем опухоли у группы обработки оставался неизменным в течение двухнедельной обработки. Помимо подкожных опухолей анти-DLL4 Mab также ингибировало рост опухолей в жировом теле мышиной молочной железы. В модели опухоли MDA-MB-435 обработку начинали через 14 дней после инъекции опухолевых клеток. Различие кривых роста опухолей у контрольной группы и у групп обработки наблюдалось через шесть дней после введения дозы и становилось все более заметным по мере продолжения обработки (фиг.9d).
Авторами настоящего изобретения было также исследовано влияние блокирования DLL4 и/или VEGF на рост большого числа опухолей у преклинических моделей опухолей (фиг.9e-f; i-p). В моделях ксенотрансплантата опухолей MV-522 и WEHI3 обработка антителом YW26.82 и/или анти-VEGF-антителом была инициирована после стабильного развития опухоли (после достижения размера опухоли ≥250 мм3). В модели MV-522 обработка антителом YW26.82 и анти-VEGF-антителом приводила к ингибированию роста отдельных опухолей, комбинация из двух обработок давала еще больший эффект. В модели WEHI3 обработка анти-VEGF-антителом не оказывала какого-либо влияния на рост опухоли, обработка антителом YW26.82 приводила к значительному ингибированию роста опухоли. В моделях SK-OV-3X1, LL2, EL4, H1299, SKMES-1, MX-1, SW620 и LS174T обработка антителом YW26.82 (5 мг/кг, i.р., два раза в неделю) и/или обработка анти-VEGF-антителом (5 мг/кг, i.р., два раза в неделю) была проведена после стабильного развития опухолей. В каждой из этих моделей обработка одним антителом YW26.82 приводила к ингибированию роста опухоли. Кроме того, во всех моделях, в которых была протестирована указанная комбинация, антитело YW26.82 обнаруживало повышенную эффективность в комбинации с анти-VEGF-антителом.
Пример 11: Обработка анти-DLL4-антителом приводит к усилению пролиферации опухолевых эндотелиальных клеток
В исследованиях на ингибирование роста опухоли авторами настоящего изобретения была использована модель опухоли мышиной лимфомы EL4 для гистологического анализа сосудистой системы. Авторами настоящего изобретения было обнаружено, что обработка анти-DLL4 Mab приводит к резкому увеличению плотности эндотелиальных клеток (фиг.9g). В противоположность этому анти-VEGF-антитело дает абсолютно противоположный эффект (фиг.9g), хотя обе эти обработки обнаруживают аналогичную эффективность в этой модели.
Пример 12: Обработка анти-DLL4-антителом приводит к ингибированию перфузии сосудистой системы опухоли
Поскольку in vitro блокирование каскада реакций DLL4/Notch ухудшает образование полость-подобной структуры эндотелиальными клетками (фиг.8a), то было проведено исследование для того, чтобы определить, вызывает ли обработка анти-DLL4 Mab аналогичное нарушение сосудистой системы опухоли и влияет ли она на эффективное поступление крови. Системная перфузия ФИТЦ-лектином показала, что обработка анти-DLL4 Mab приводит к значительному снижению уровня мечения опухолевых сосудов лектином (фиг.9h). Следует отметить, что, как было показано, нарушение артериовенозной (АV) функции у ALK1-дефицитных мышей приводит к нарушению кровообращения (Urness, L. D. et al, Nat Genet 26, 328-31 (2000)). Принимая во внимание важную роль передачи сигнала DLL4/Notch в AV-дифференциации, следует отметить, что в сетчатке эмбрионов и новорожденных мышей анти-DLL4 Mab может влиять на конкретные события жизненного цикла опухолевых ЭК и вызывать нарушение направленного кровотока. Действительно, в опухолях Colo205, обработанных анти-DLL4 Mab, имеются области, где высокая плотность ЭК ассоциируется с низким содержанием жизнеспособных опухолевых клеток, что обусловлено слабой сосудистой функцией. Для лучшего понимания природы конкретных сосудистых нарушений были проведены дополнительные исследования с применением методов визуализации сосудистой системы.
Пример 13: DLL4/Notch не играет важной роли в гомеостазе мышиной тонкой кишки
Принимая во внимание плейотропную роль передачи сигнала Notch в регуляции гомеостаза самообновляюшихся систем у новорожденных, основная проблема общего ингибирования Notch заключается в том, что такое ингибирование может иметь негативный эффект. Так, например, передача сигнала Notch необходима для сохранения недифференцированных клеток-предшественников крипты в тонком кишечнике (van Es, J. H. et al. Nature 435, 959-63 (2005); Fre, S. et al. Nature 435, 964-8 (2005)). Действительно, ингибиторы γ-секретазы, которые должны без взякого различия блокировать все активности Notch, вызывают нежелательные побочные эффекты у грызунов, что обусловлено увеличением массы бокаловидных клеток в компартменте крипты (Milano, J. et al. Toxicol Sci 82, 341-58 (2004); Wong, G. T. et al. J Biol Chem 279, 12876-82 (2004)). Авторами настоящего изобретения были проведены иммуногистохимические анализы тонкого кишечника мышей, обработанных анти-DLL4 Mab. В отличие от DBZ-обработки каких-либо различий в профилях дифференцировки или пролиферации эпителиальных клеток крипты у групп, обработанных анти-DLL4 Mab, и у контрольной группы после 6-недельной обработки не наблюдалось (фиг.10). Кроме того, анти-DLL4 Mab не оказывало влияния на экспрессию гена-мишени Notch для HES-1 в быстро делящейся и временно амплифицирующейся популяции (TA) (фиг.10). Эти результаты подтверждают мнение, что передача сигнала DLL4/Notch в значительной степени зависит от сосудистой системы.
Пример 14: Обработка анти-DLL4-антителом не влияет на сосудистую сеть сетчатки взрослых мышей
Хотя блокирование DLL4 оказывает сильное влияние на развитие сосудистой системы сетчатки у новорожденных мышей, однако введение анти-DLL4-антитела не оказывало заметного влияния на сосудистую систему сетчатки взрослого животного (фиг.8d). Таким образом, передача сигнала DLL4/Notch играет решающую роль в процессе активного ангиогенеза, однако она играет менее важную роль в поддержании нормальной сосудистой системы. В подтверждение этого мнения можно отметить, что в процессе обработки анти-DLL4 Mab какой-либо заметной потери массы или гибели мышей с опухолью, которым вводили дозу 10 мг/кг два раза в неделю в течение 8 недель, не наблюдалось. В опухолевых моделях анти-DLL4 Mab и анти-VEGF-антитело оказывали противоположное действие на сосудистую систему опухоли, что позволяет сделать предположение о существовании неперекрывающихся механизмов их действия.
Хотя представленное выше изобретение подробно описано на примерах, которые приводятся для иллюстрации и лучшего понимания настоящего изобретения, однако приведенное выше описание изобретения и примеры его осуществления не должны рассматриваться как ограничение объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ NRR Notch1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2476443C2 |
| АНТИТЕЛА ПРОТИВ NOTCH2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2580029C2 |
| АНТИТЕЛА К JAGGED И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2666990C2 |
| АНТИТЕЛА ПРОТИВ EphB4 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2450020C2 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2010 |
|
RU2570639C2 |
| АНТИТЕЛА К ЭФРИНУ В2 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2451031C2 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |
| АНТИТЕЛА ПРОТИВ FGFR3 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2568066C2 |
| АНТИТЕЛА ПРОТИВ AXL И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2577986C2 |
| АНТИ-LRP6 АНТИТЕЛА | 2011 |
|
RU2587625C2 |
























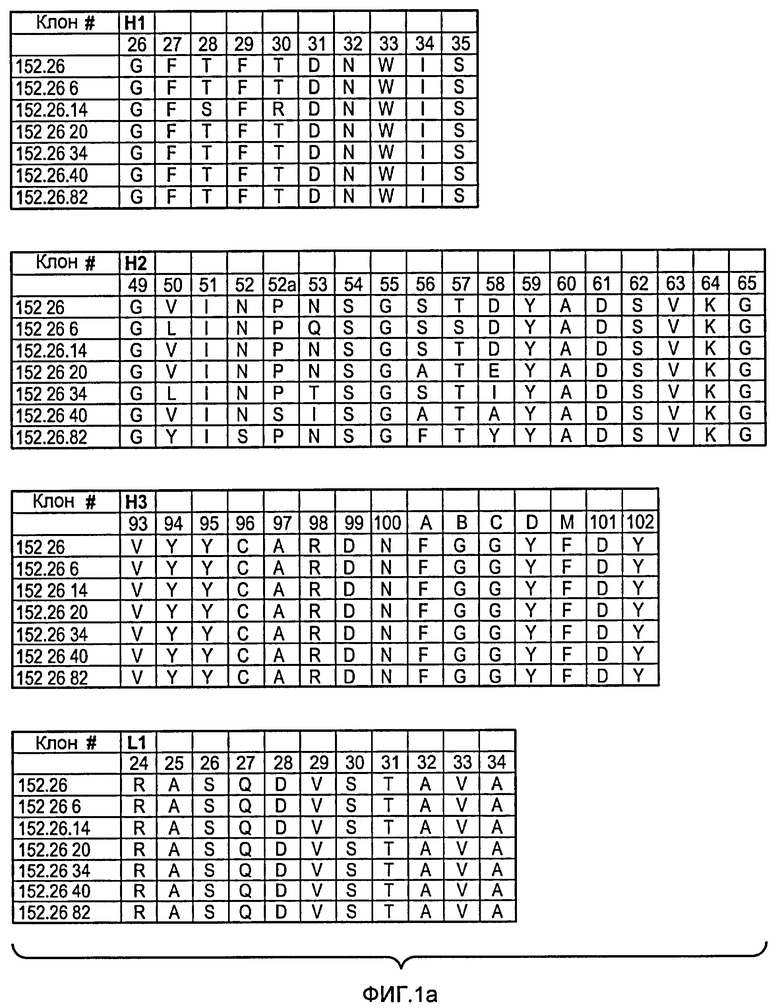
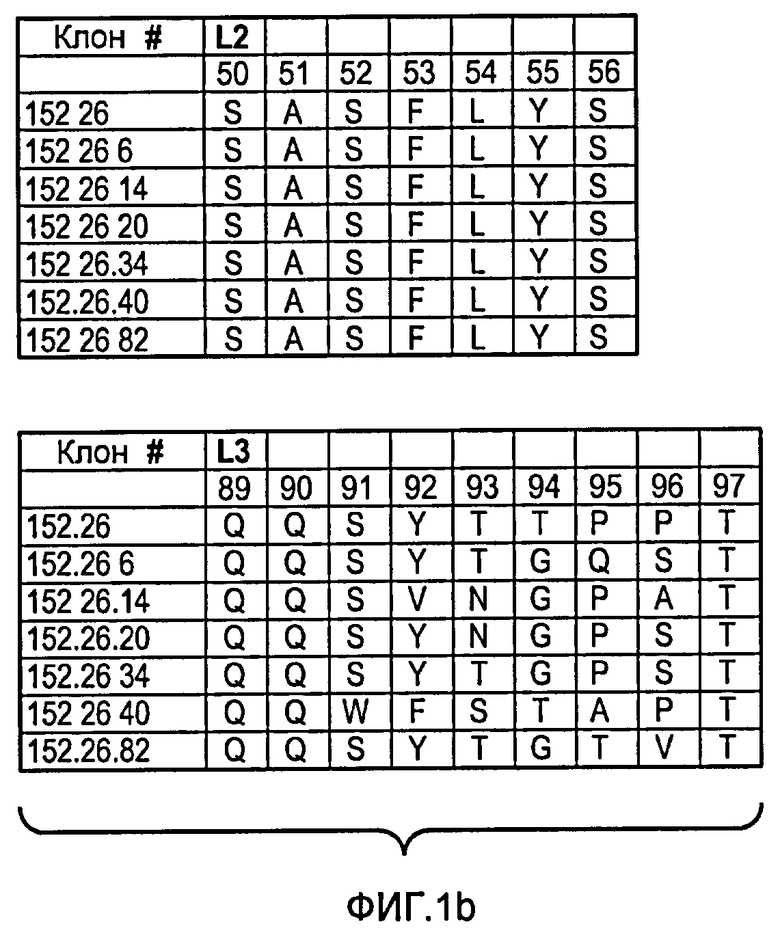
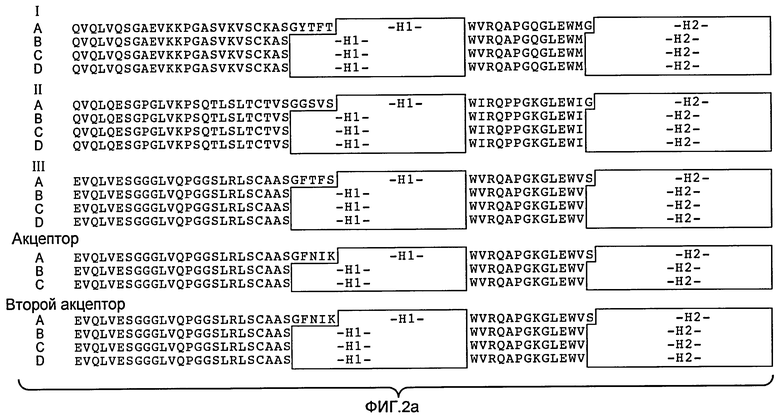
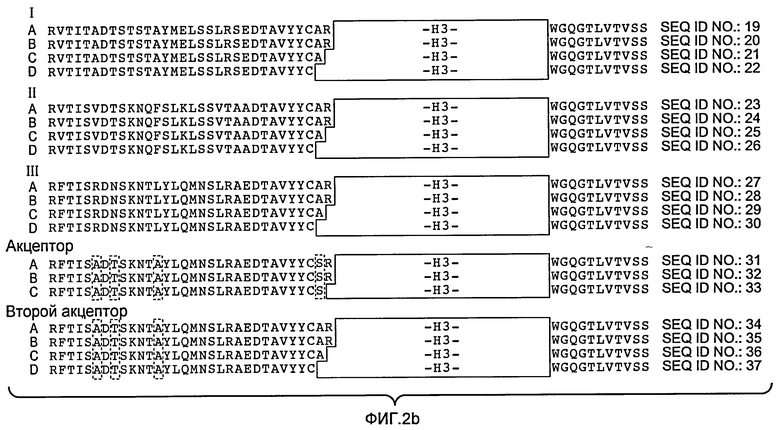
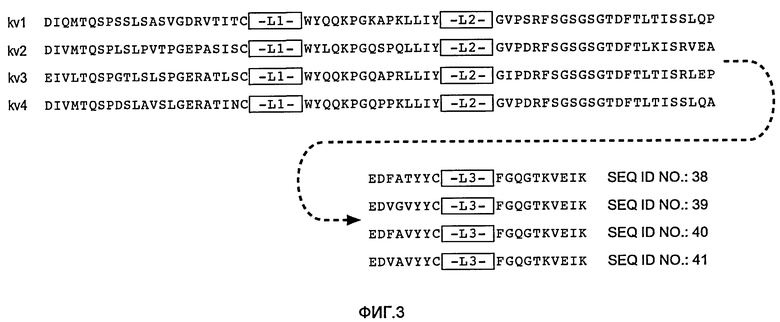



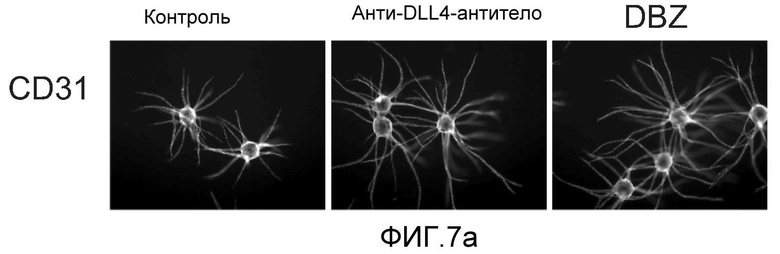
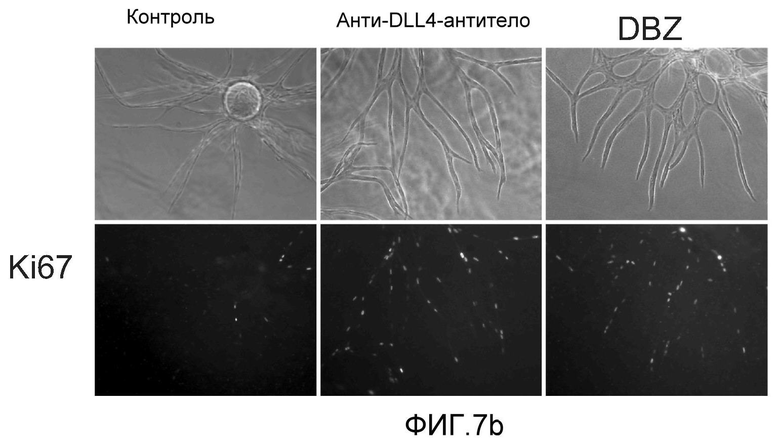
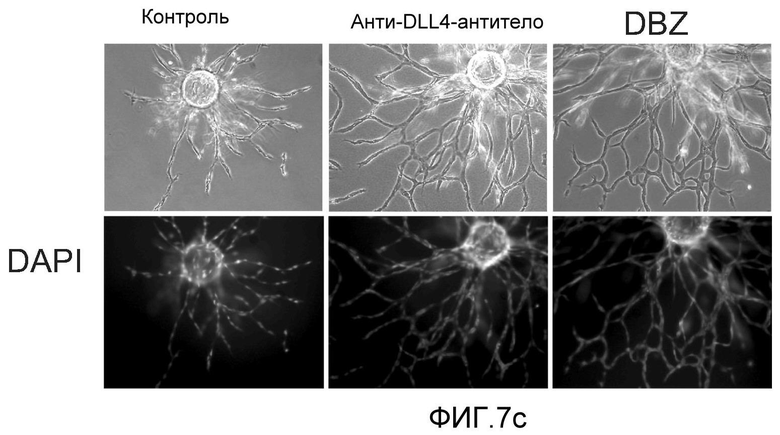
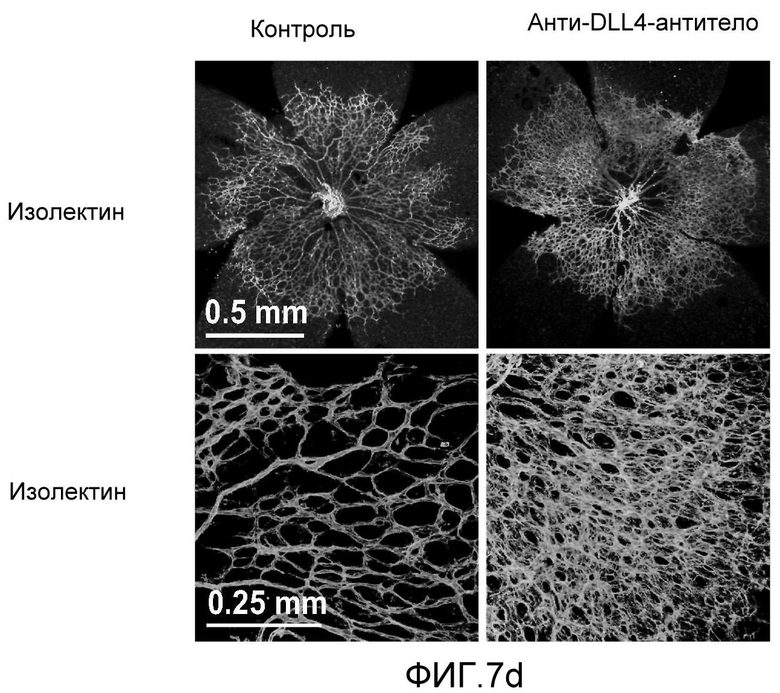
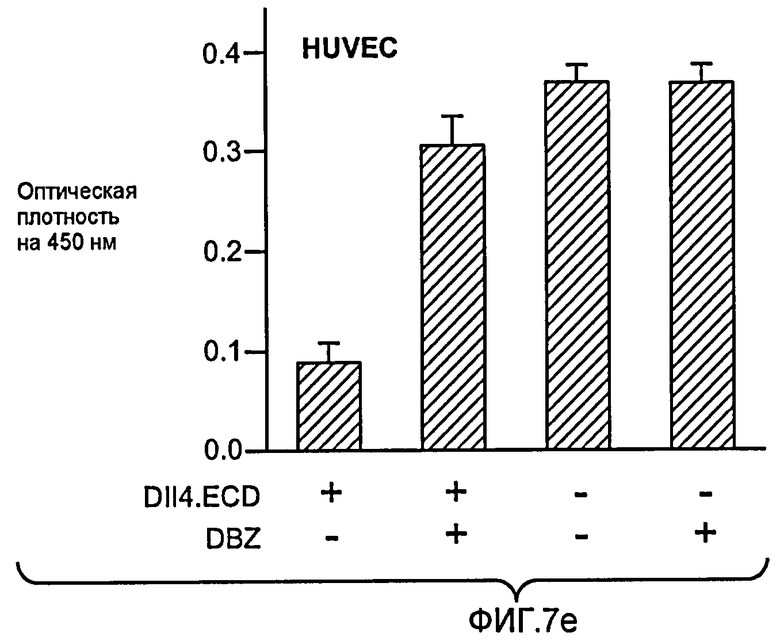
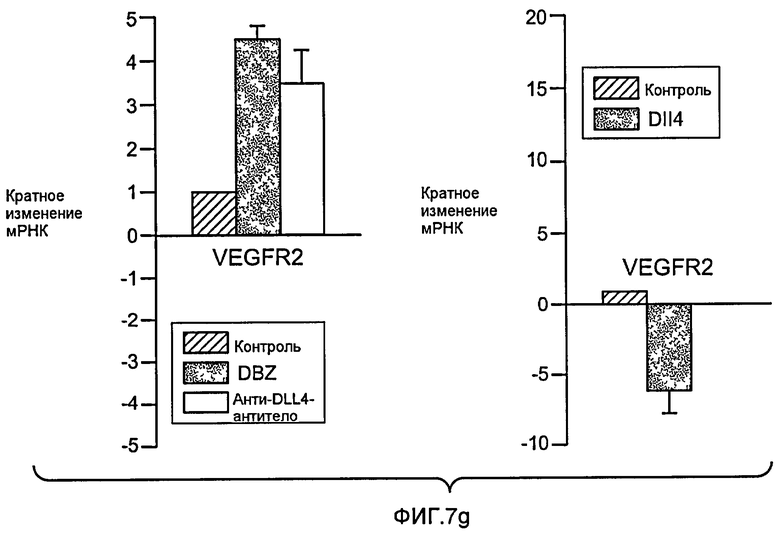
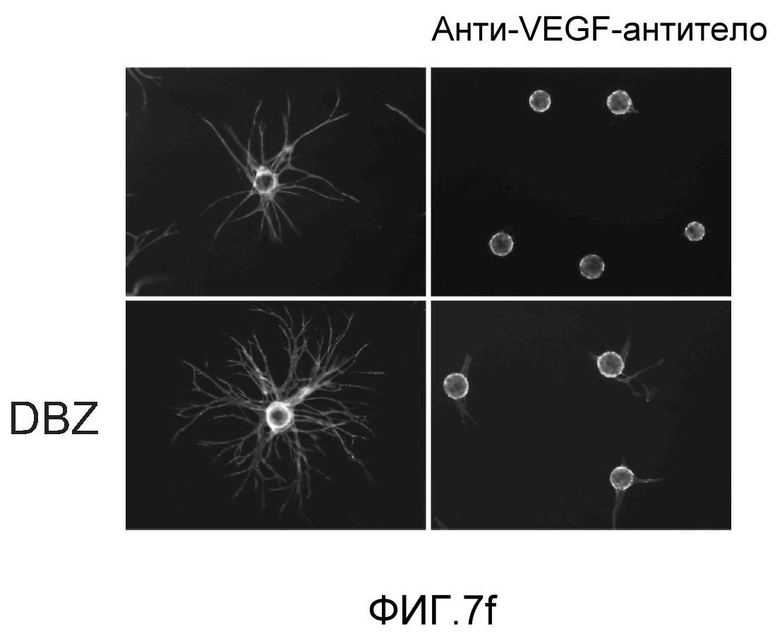
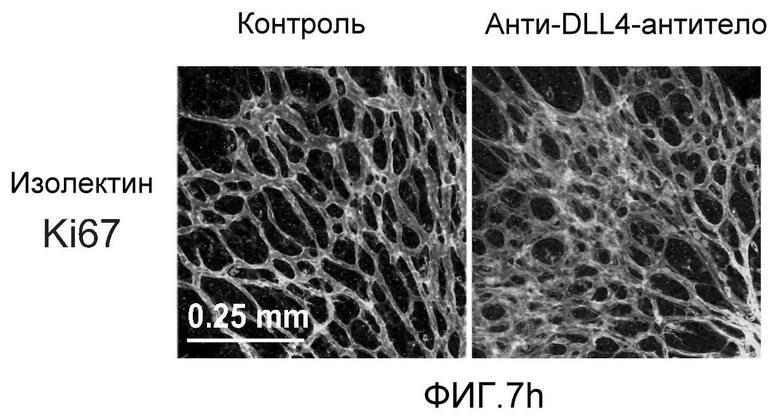
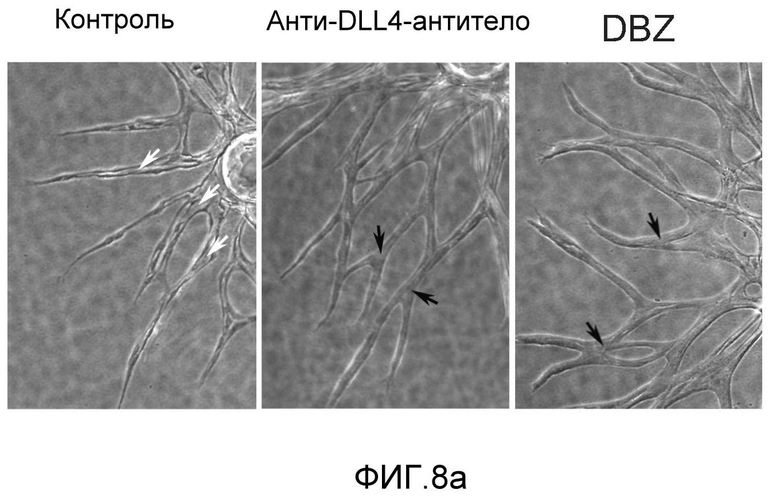
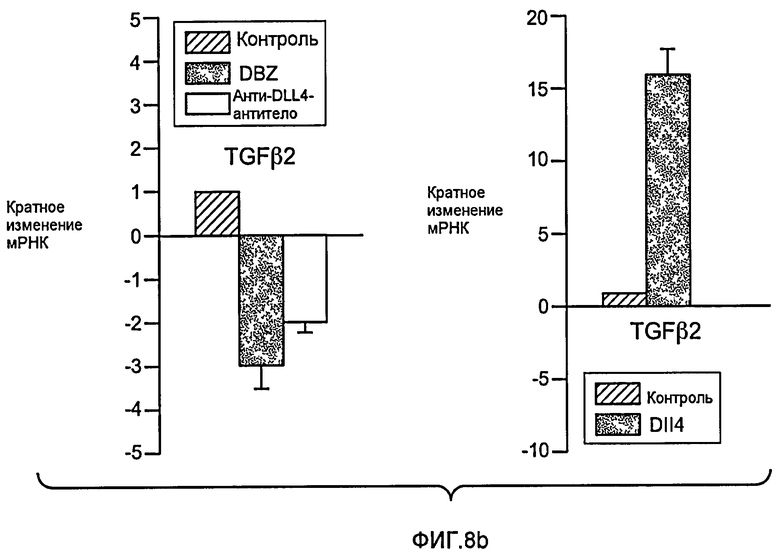
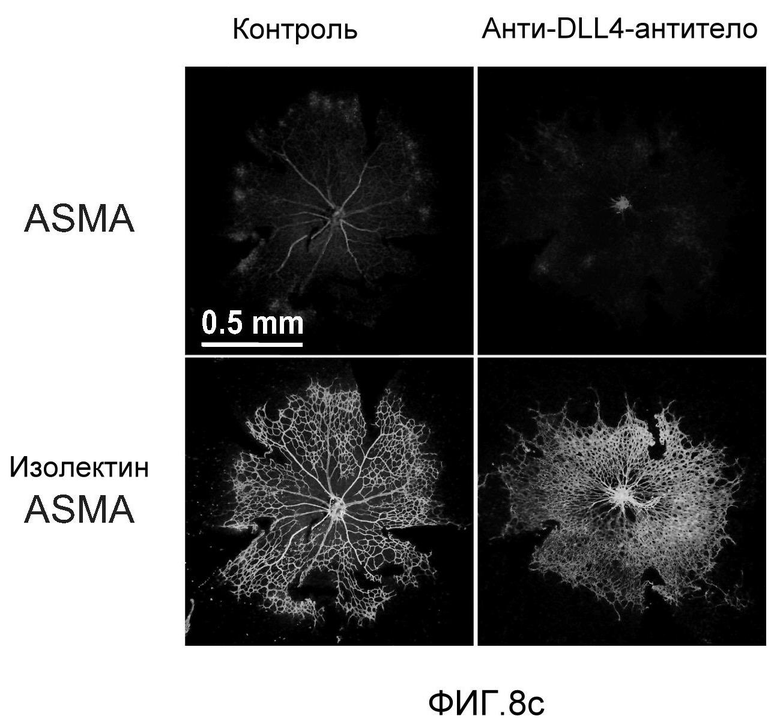
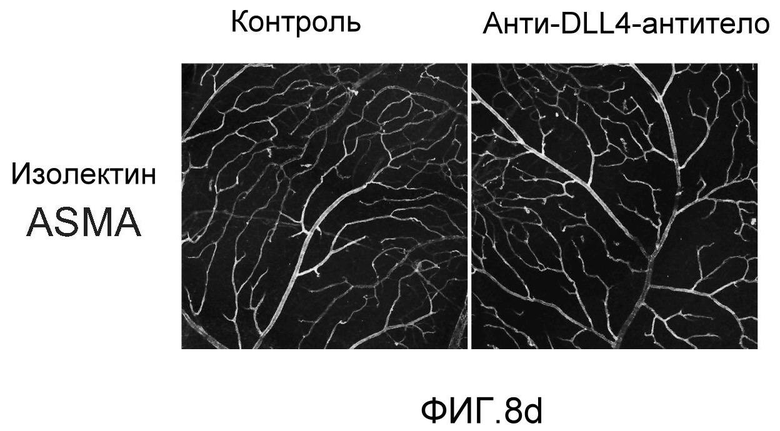
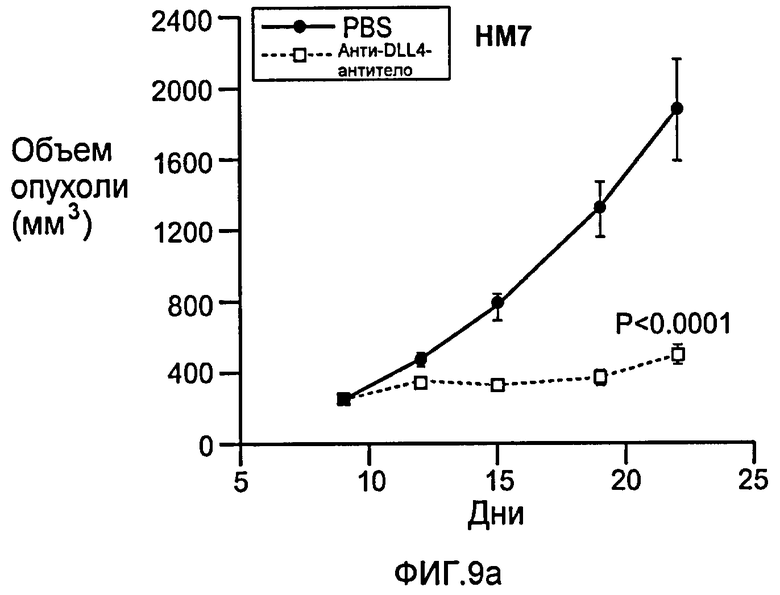
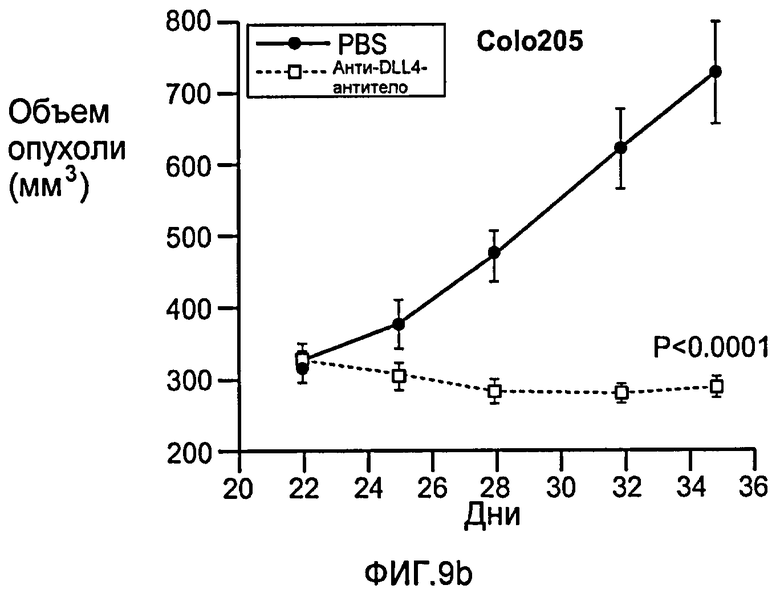
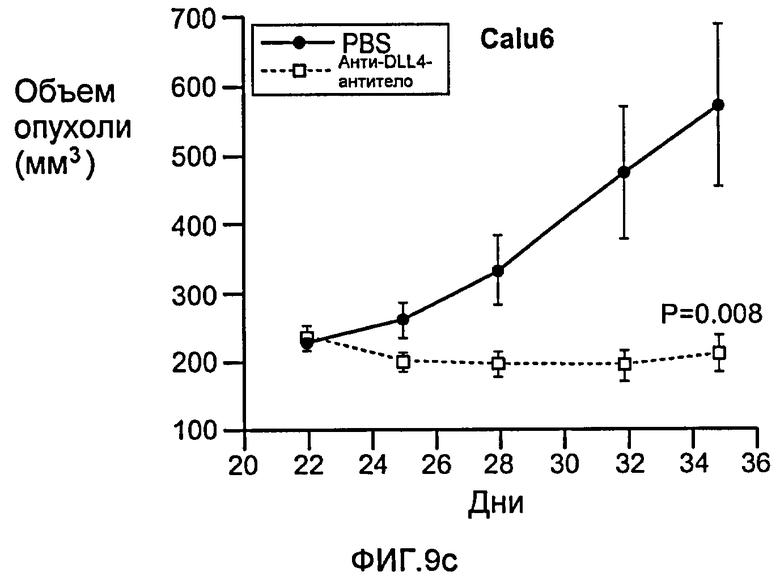
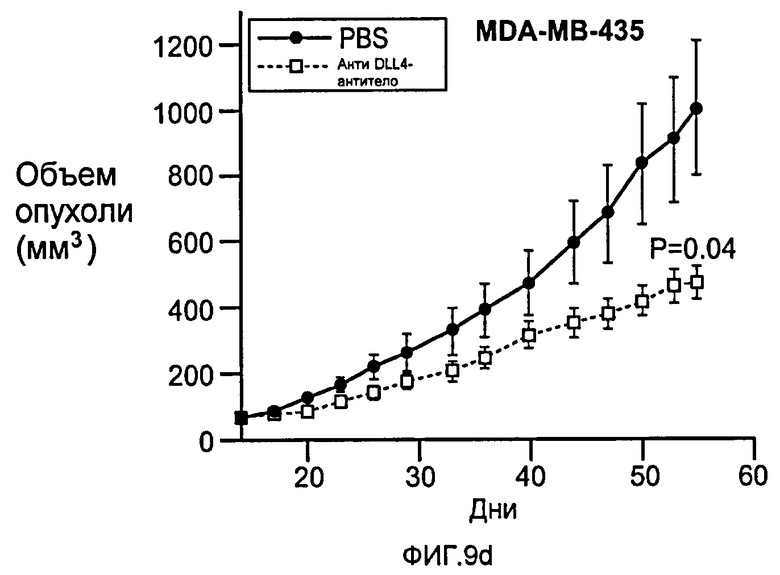
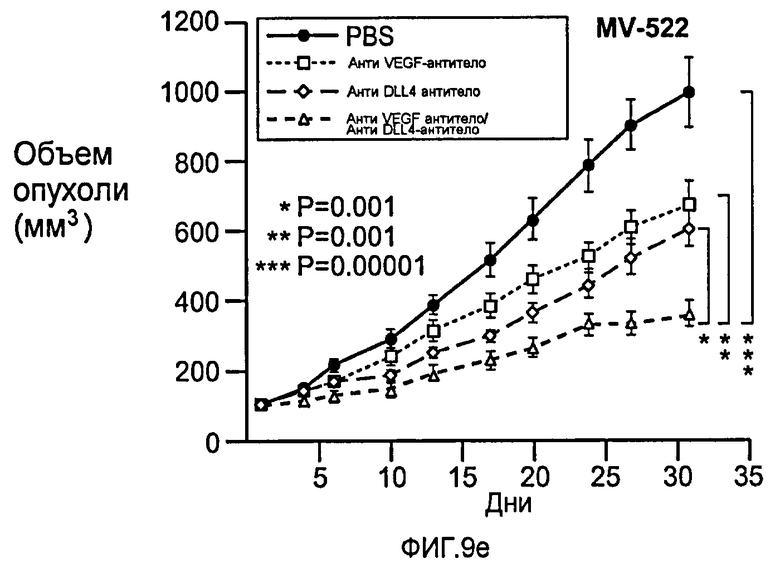
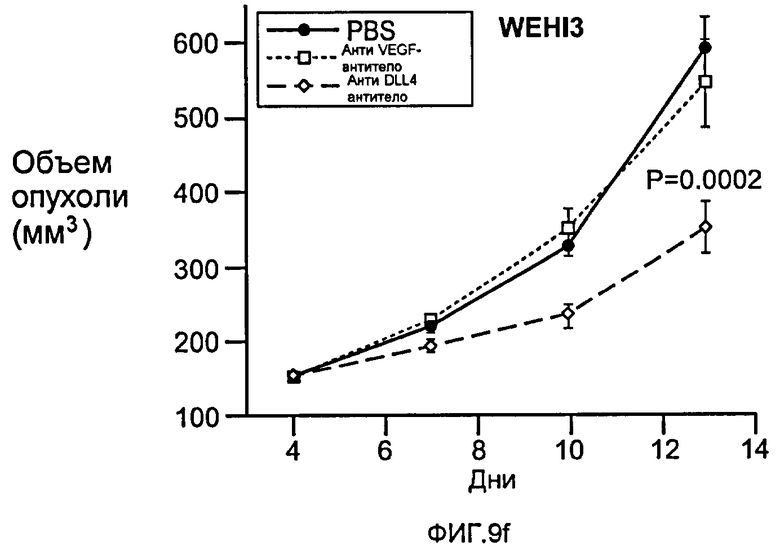
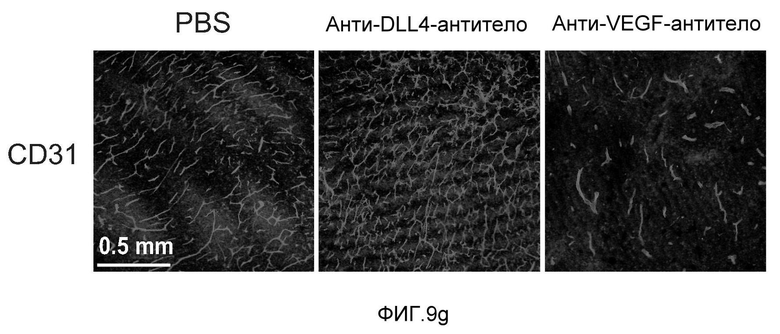
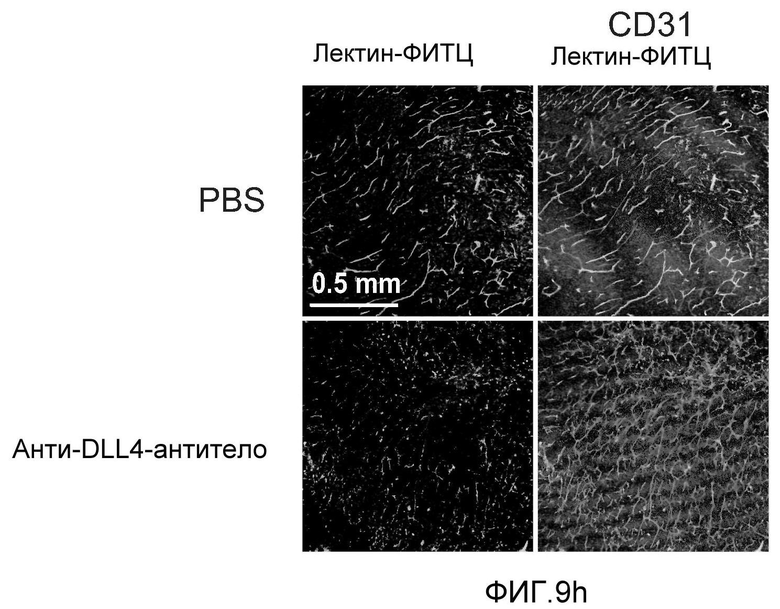
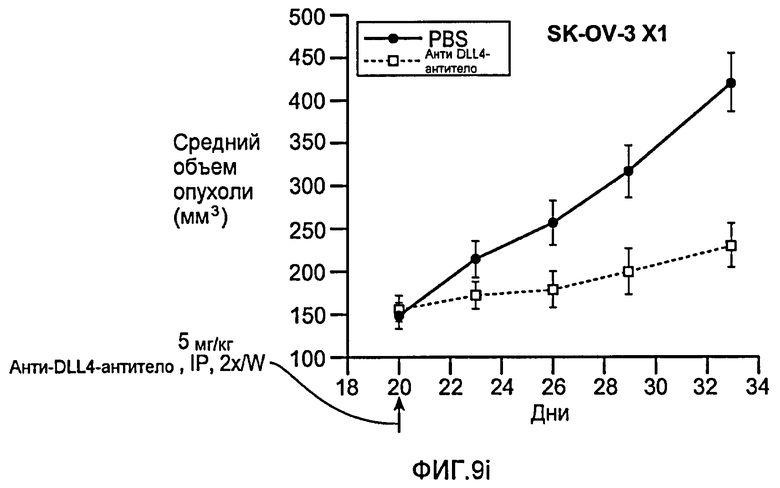
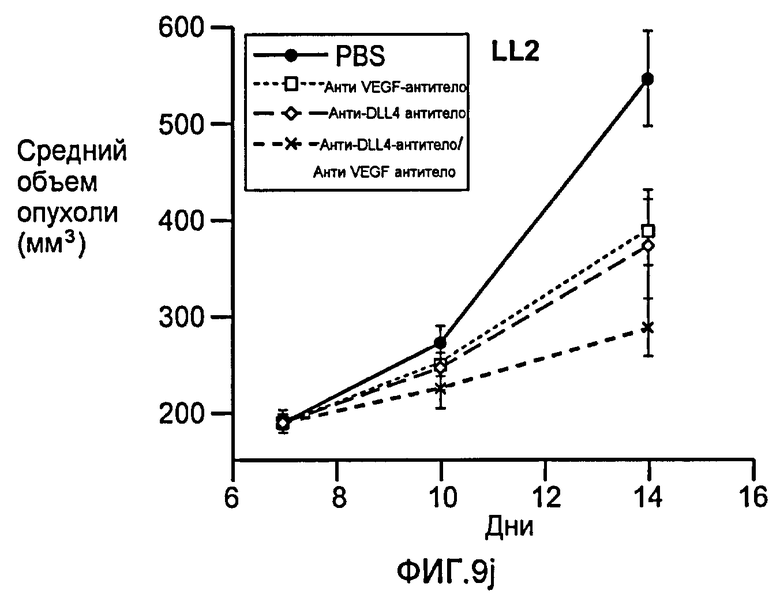
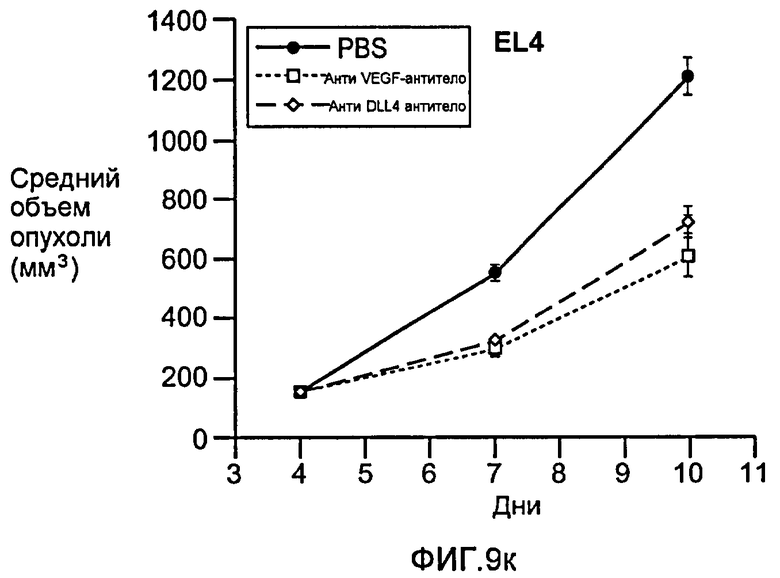
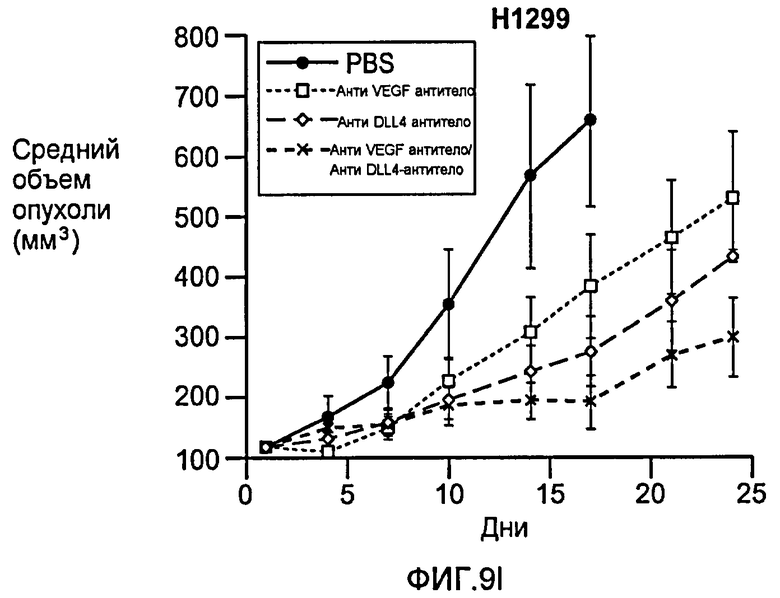
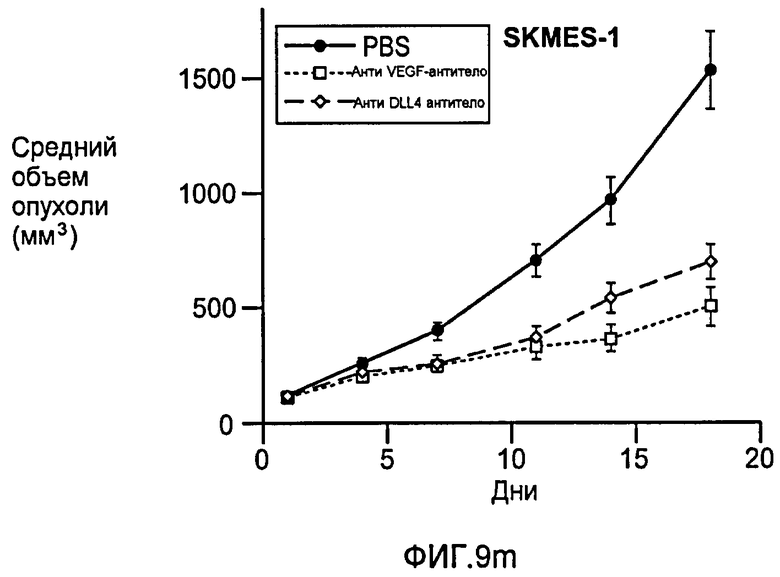
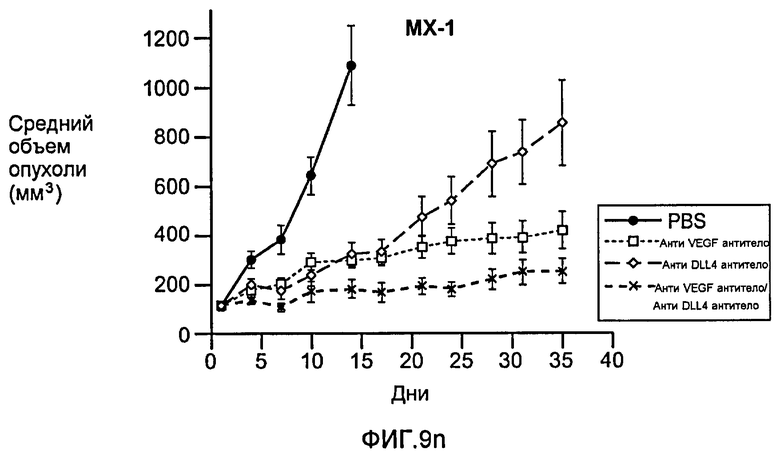
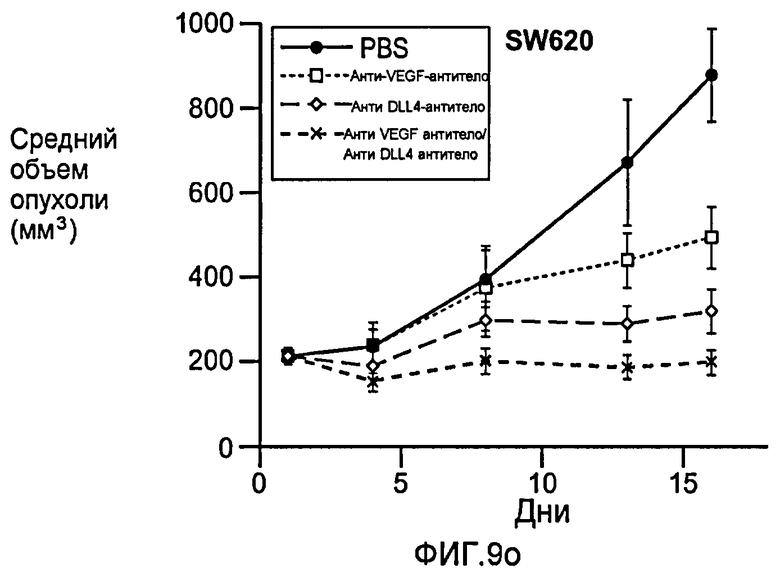
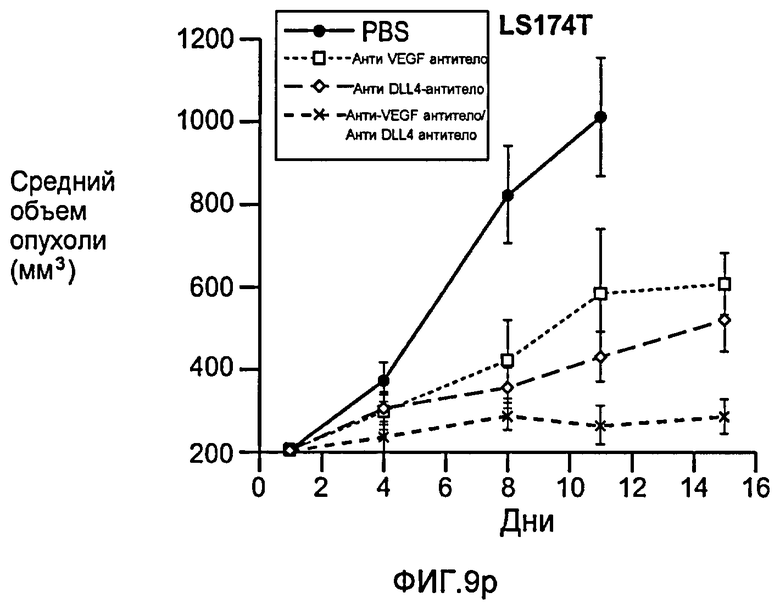
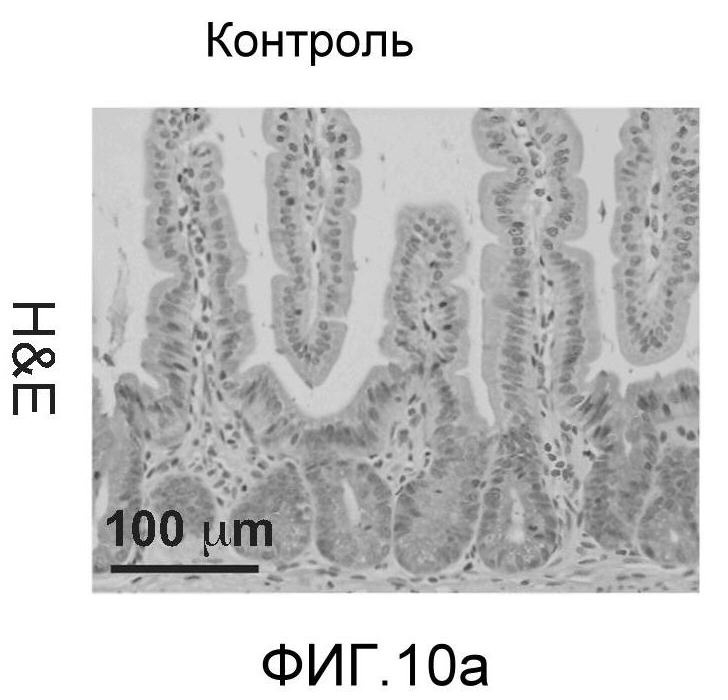
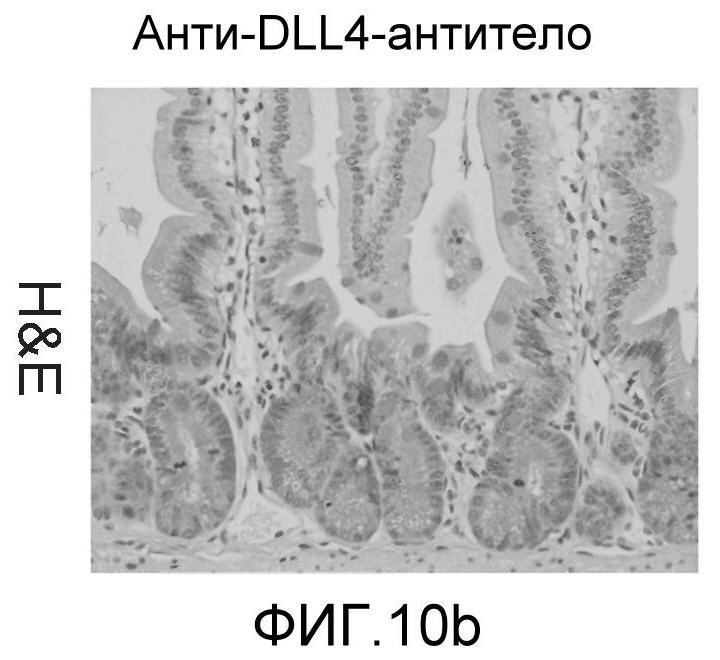
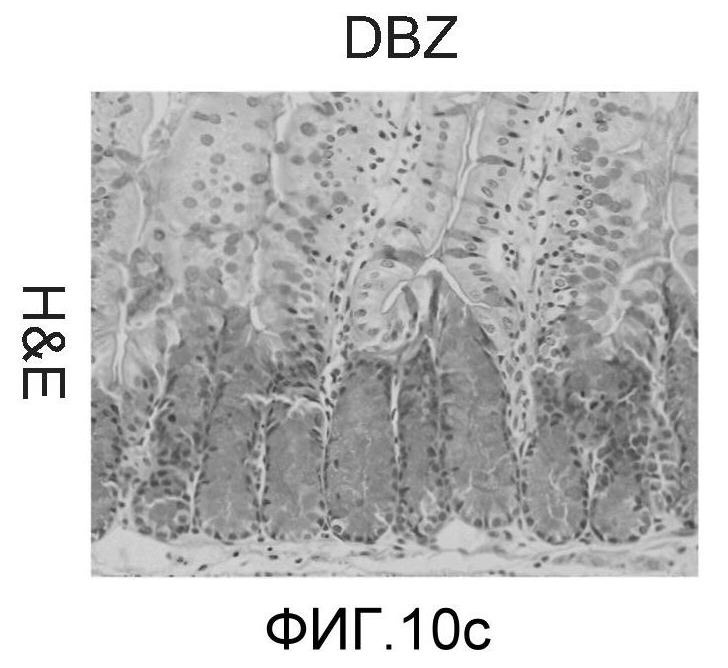
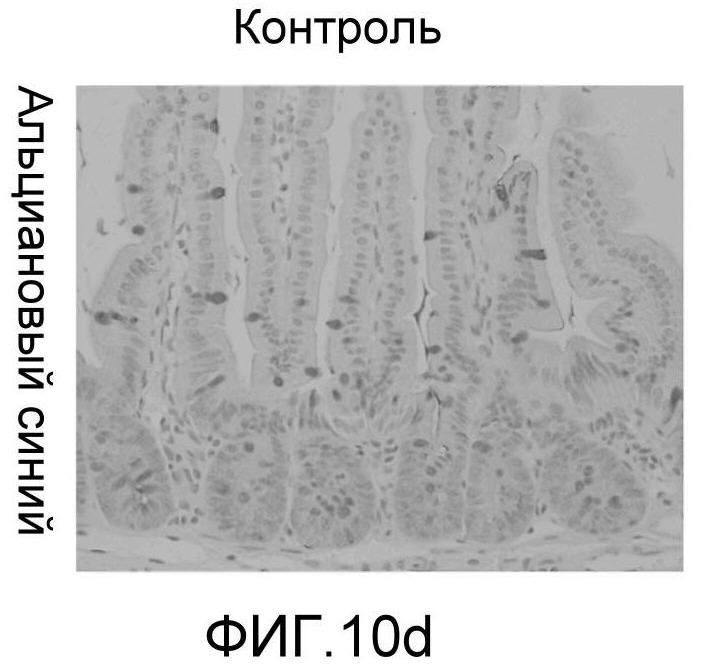
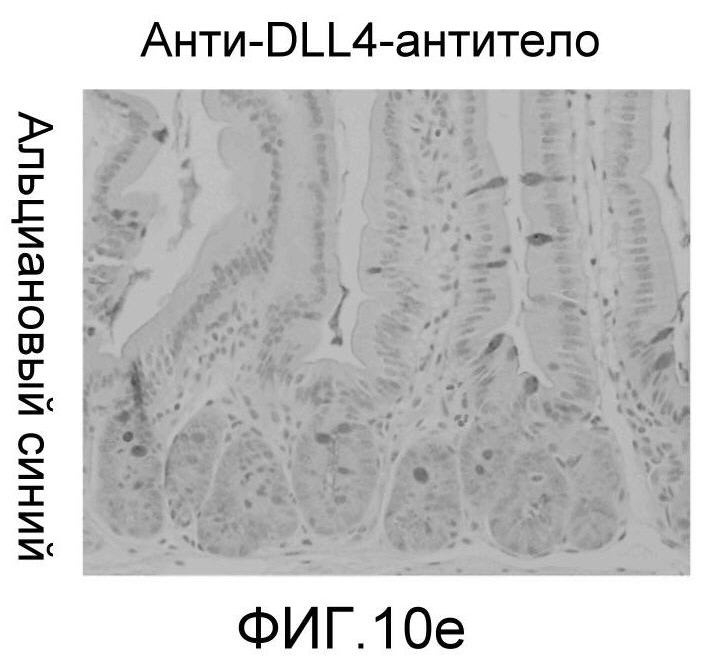
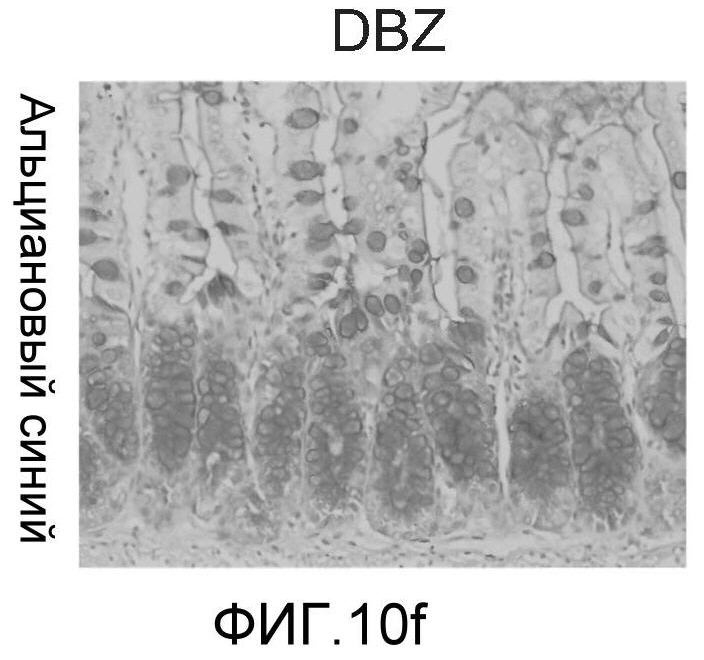
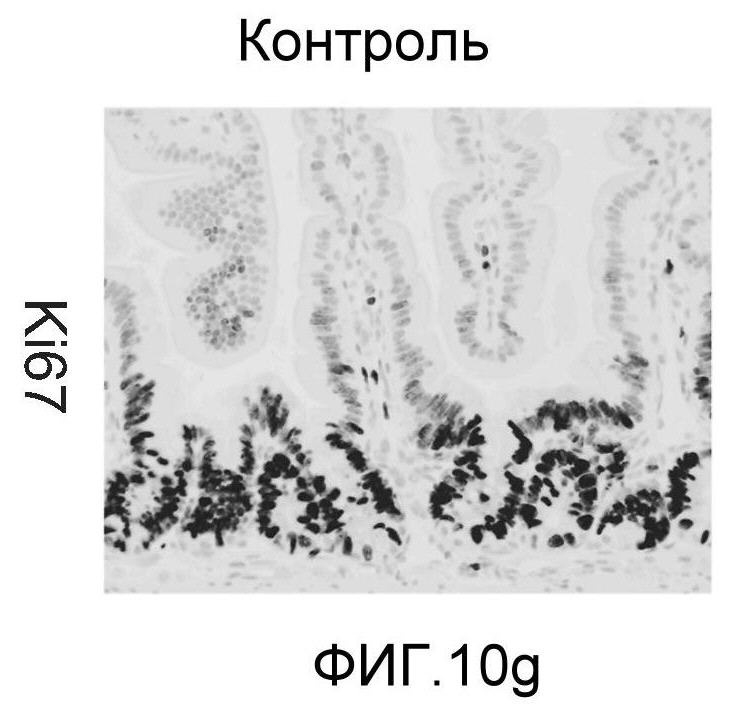
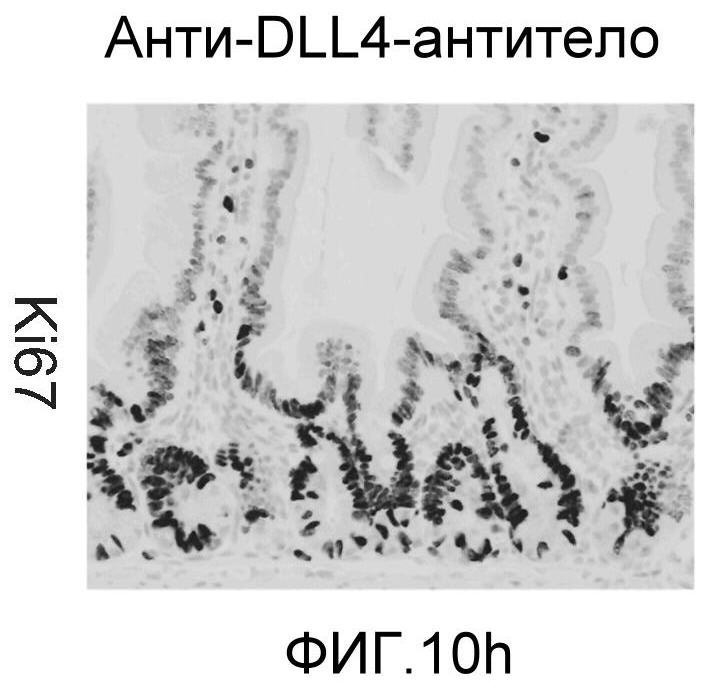
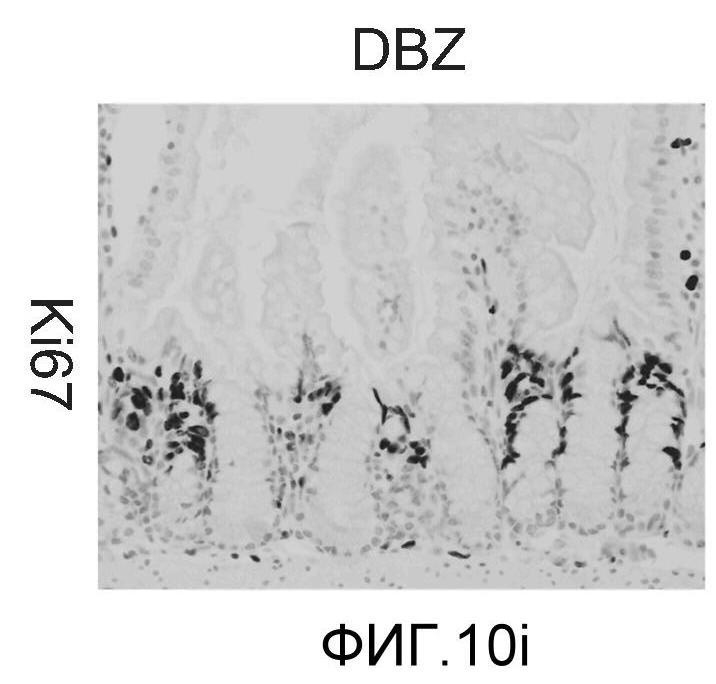
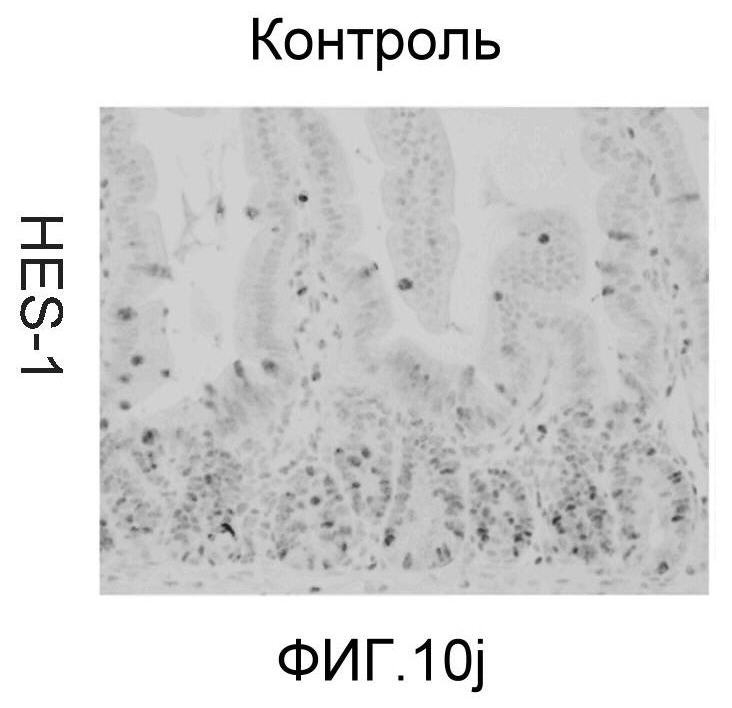
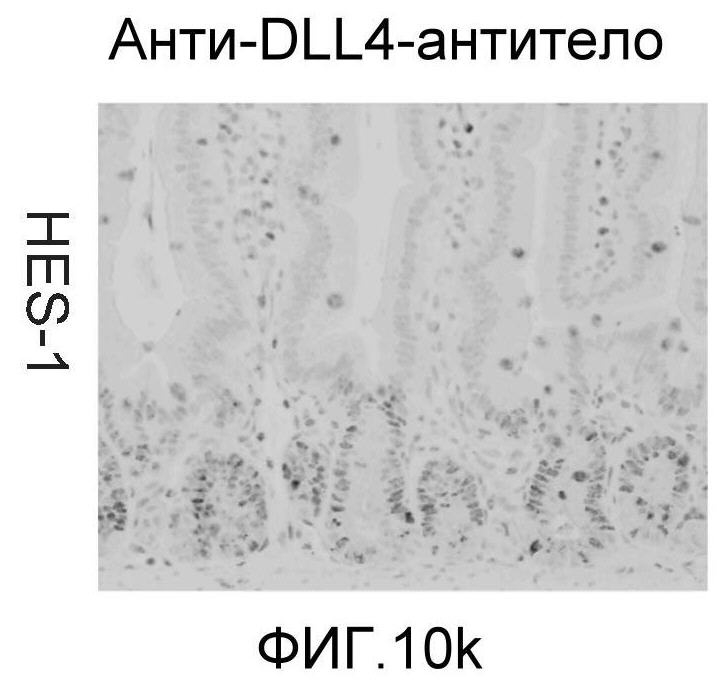
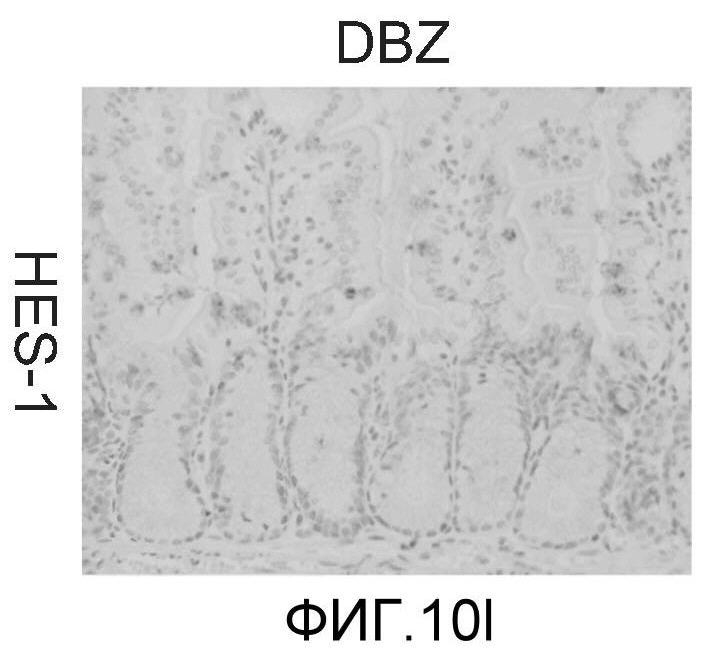
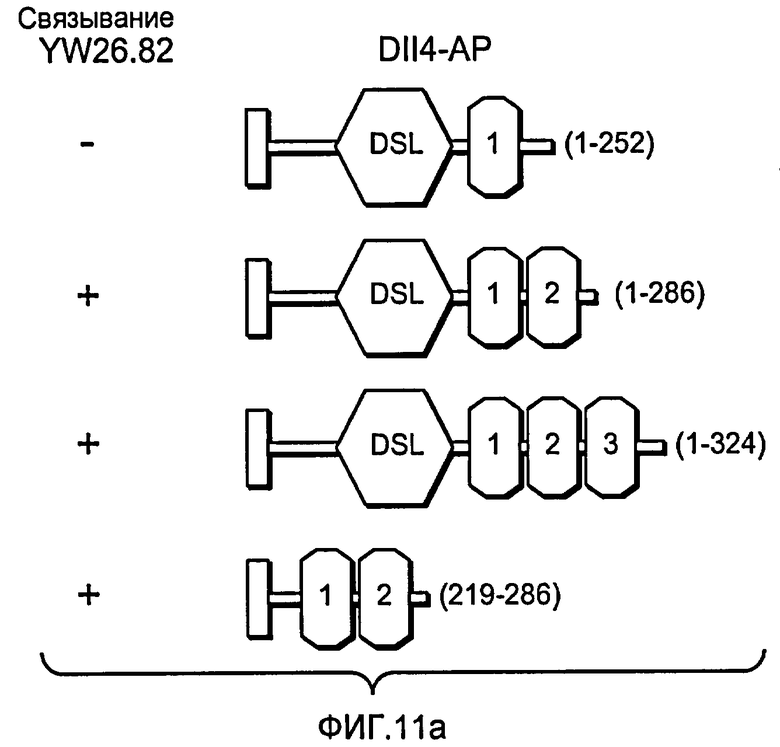
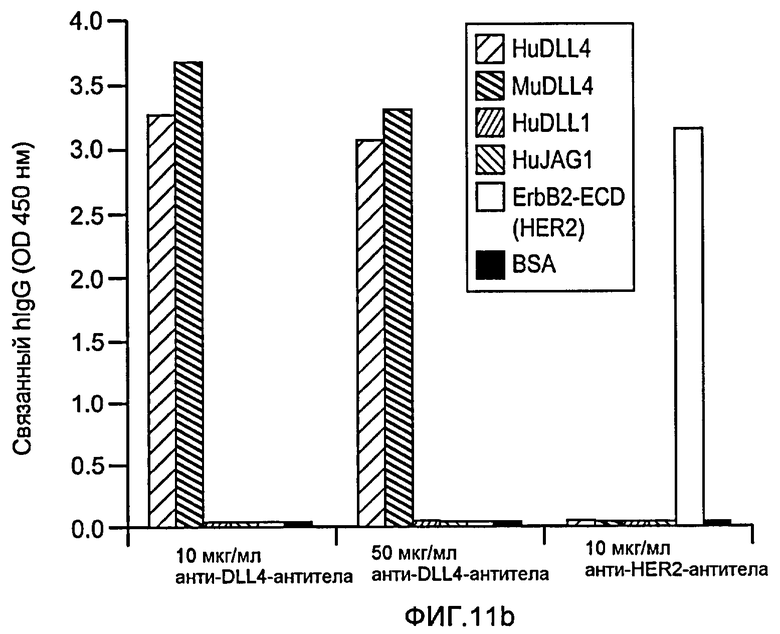
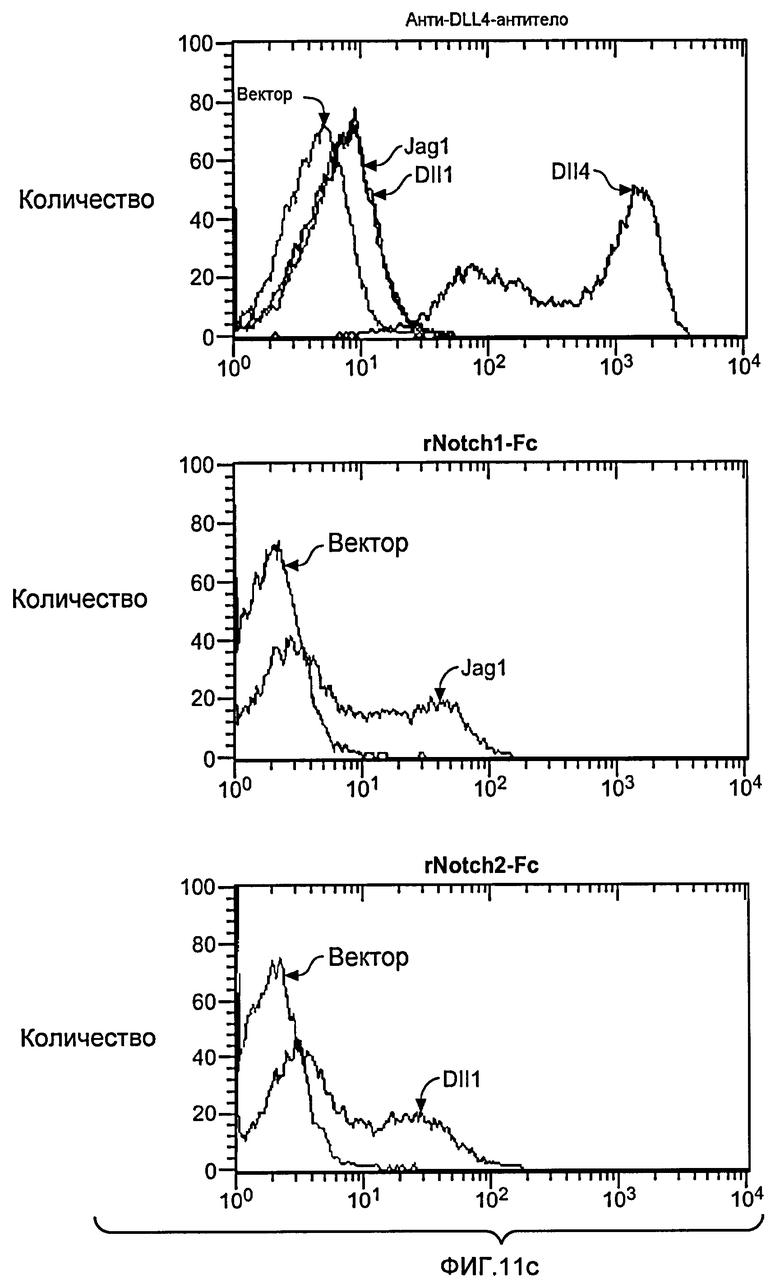
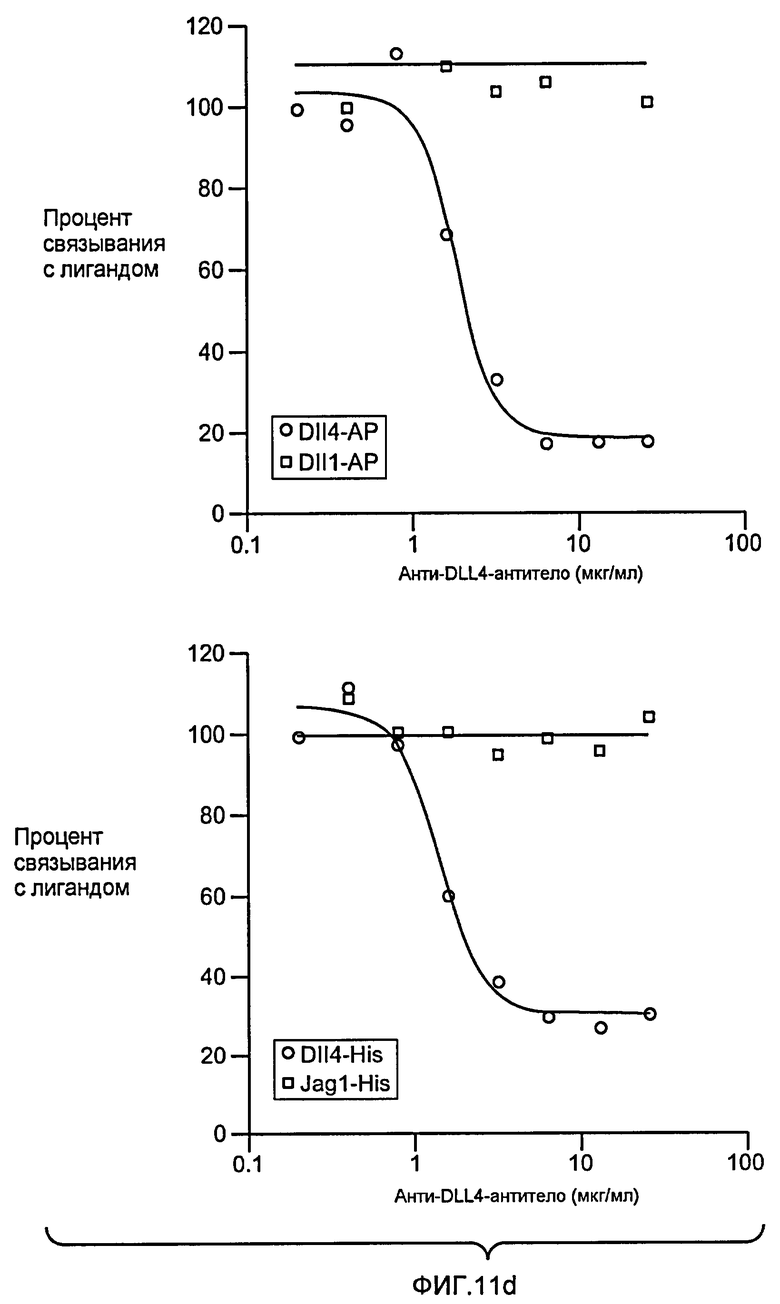
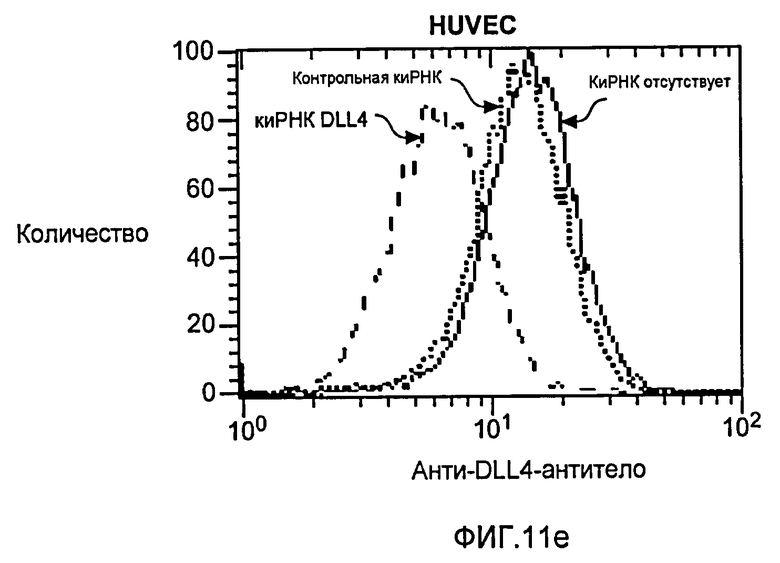
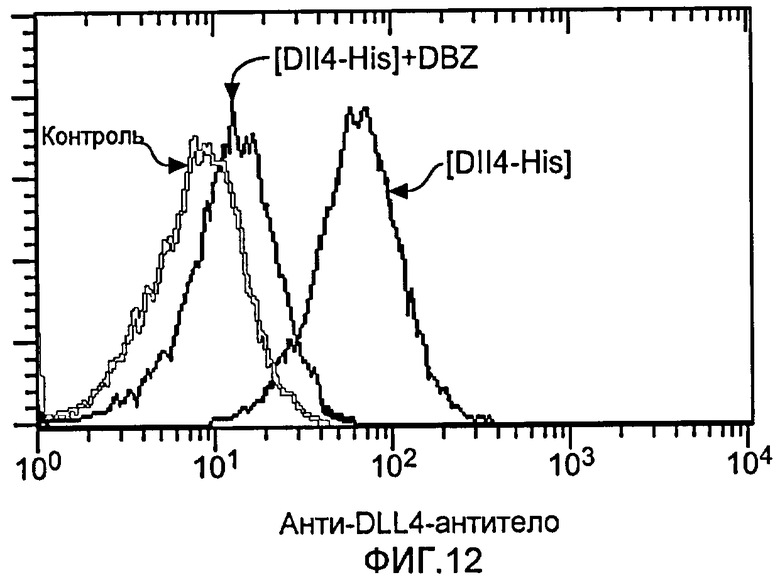
Изобретение относится к биотехнологии и представляет собой анти-DLL4-антитело, кодирующий полинуклеотид, вектор, клетка-хозяин, способ получения антитела, композиции, включающие такие антитела, и способы их применения. Изобретение может эффективно использоваться для лечения или предупреждения патологических состояний, ассоциированных с экспрессией и/или активностью DLL4. 11 н. и 16 з.п. ф-лы, 12 ил., 3 табл.
1. Выделенное анти-DLL4-антитело, содержащее шесть HVR, где каждая HVR включает в себя, состоит или по существу состоит из последовательности, выбранной из группы, состоящей из SEQ ID NO:1-18, причем SEQ ID NO:10 соответствует HVR-L1, SEQ ID NO:11 соответствует HVR-L2, SEQ ID NO:12, 13, 14, 15, 16, 17 или 18 соответствует HVR-L3, SEQ ID NO:1 или 2 соответствует HVR-H1, SEQ ID NO:3, 4, 5, 6, 7 или 8 соответствует HVR-H2, и SEQ ID NO:9 соответствует HVR-H3.
2. Антитело по п.1, содержащее HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая из этих областей содержит соответственно либо SEQ ID NO:10, 11, 14, 2, 3 и 9; либо SEQ ID NO:10, 11, 15, 1,5 и 9; либо SEQ ID NO:10, 11, 16, 1, 6 и 9; либо SEQ ID NO:10, 11, 17, 1, 7 и 9; либо SEQ ID NO:10, 11, 18, 1,8 и 9.
3. Антитело по п.1 или 2, где по меньшей мере часть каркасной последовательности представляет собой человеческую консенсусную каркасную последовательность.
4. Антитело по п.1 или 2, содержащее человеческую консенсусную каркасную последовательность подгруппы каппа.
5. Антитело по п.1 или 2, содержащее человеческую консенсусную каркасную последовательность тяжелой цепи подгруппы III.
6. Антитело по п.5, где указанное антитело имеет замену в одном или нескольких из положений 71, 73 и 78, причем указанными заменами являются соответственно замены R71A, N73T и N78A.
7. Полинуклеотид, кодирующий антитело по любому из пп.1-6.
8. Вектор экспрессии, содержащий полинуклеотид по п.7.
9. Клетка-хозяин, способная экспрессировать экзогенный генетический материал, содержащая вектор по п.8.
10. Клетка-хозяин по п.9, являющаяся прокариотической клеткой, эукариотической клеткой или клеткой млекопитающего.
11. Способ получения анти-DLL4-антитела, предусматривающий (а) экспрессию вектора по п.8 в подходящей клетке-хозяине и (b) выделение указанного антитела.
12. Способ по п.11, где указанной клеткой-хозяином является прокариотическая клетка или эукариотическая клетка.
13. Способ детектирования DLL4, предусматривающий детектирование комплекса DLL4 и анти-DLL4-антитела по п.1 в биологическом образце.
14. Способ диагностики расстройства, ассоциированного с экспрессией DLL4, предусматривающий детектирование комплекса DLL4 и анти-DLL4-антитела по п.1 в биологическом образце, полученном у пациента, страдающего указанным расстройством, или у пациента с подозрением на такое расстройство.
15. Способ по п.13 или 14, где указанное анти-DLL4-антитело метят подходящим для детектирования образом.
16. Композиция для модулирования патологических состояний, ассоциированных с экспрессией и/или активностью DLL4, содержащая эффективное количество анти-DLL4-антитела по любому из пп.1-6.
17. Композиция для модулирования патологических состояний, ассоциированных с экспрессией и/или активностью DLL4, содержащая эффективное количество полинуклеотида по п.7.
18. Композиция по п.16 или 17, которая дополнительно содержит носитель.
19. Способ лечения опухоли, рака или расстройства клеточной пролиферации, предусматривающий введение индивидууму, нуждающемуся в таком лечении, эффективного количества антитела по любому из пп.1-6.
20. Способ по п.19, где указанным опухолевым, раковым или клеточно-пролиферативным заболеванием является рак толстой кишки, рак легких или рак молочной железы.
21. Способ по п.19 или 20, дополнительно предусматривающий введение эффективного количества антиангиогенного средства.
22. Способ по п.21, где указанным антиангиогенным средством является антагонист фактора роста сосудистого эндотелия (VEGF).
23. Способ по п.22, где указанным антагонистом VEGF является анти-VEGF-антитело.
24. Способ по п.23, где указанным анти-VEGF4-антителом является бевацизумаб.
25. Способ по любому из пп.19-20 или 22-24, дополнительно предусматривающий введение эффективного количества химиотерапевтического средства.
26. Способ повышения эффективности антиангиогенного средства у индивидуума, страдающего патологическим состоянием, ассоциированным с ангиогенезом, предусматривающий введение индивидууму, помимо антиангиогенного средства, эффективного количества антитела по любому из пп.1-6.
27. Способ по п.26, где указанным патологическим состоянием, ассоциированным с ангиогенезом, является опухоль, рак и/или расстройство клеточной пролиферации, или внутриглазное неоваскулярное заболевание.
| LIU ZJ, ET AL | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| FASEB J | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| PATEL NS, ET AL | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2011-04-10—Публикация
2007-06-06—Подача