ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области синтеза лекарственных средств и, в частности, относится к регулятору-производному стероида, способу его получения и его применению.
УРОВЕНЬ ТЕХНИКИ
Рецептор ГАМКА (гамма-аминомасляная кислота) представляет собой химически управляемый канал на клеточной мембране и относится к ионному рецептору. Рецептор ГАМКА широко распространен в нервной системе и может связываться с ингибирующим нейромедиатором ГАМК, что приводит к открытию хлоридных каналов и ингибированию нейронов. Регулятор рецептора ГАМКА (тетрагидропрогестерон) является положительным регулятором рецептора ГАМКА. Связывание тетрагидропрогестерона и регулятора внутрисинаптического рецептора ГАМКА может увеличить частоту открытия хлоридного канала на рецепторе и приток хлорид-ионов, тем самым увеличивая фазный ток, оказывая быстрое ингибирующее действие, снижая возбудимость нервов и обеспечивая противотревожное и антидепрессивное действие. Связывание тетрагидропрогестерона и внесинаптического рецептора ГАМКА обеспечивает непрерывный ток хлорид-ионов и опосредует длительное и устойчивое ингибирующее действие. Тетрагидропрогестерон может также увеличивать содержание нейротрофического фактора мозга (BDNF), способствовать регенерации нейронов гиппокампа и обеспечивает нейропротекторное действие, тем самым облегчая симптомы тревоги и депрессии; но конкретный механизм действия пока не ясен.
Большое депрессивное расстройство (БДР) представляет собой распространенное хроническое и рецидивирующее заболевание. Бремя и вызываемые им неблагоприятные последствия становятся все более серьезными. За последние 40 лет исследования и клиническое применение антидепрессантов значительно расширились. Однако большинству антидепрессантов (флуоксетин, пароксетин, сертралин, флувоксамин, циталопрам и т.д.) требуется от 2 до 4 недель для оказания действия. Клиническое лечение пациентов с большим депрессивным расстройством, особенно пациентов с суицидальными наклонностями, часто должно быть немедленным и быстрым, поэтому существует острая необходимость в разработке быстродействующих антидепрессантов.
За последние два десятилетия в исследованиях и разработках методов лечения депрессии было мало нововведений. Целью разработки регулятора рецептора ГАМКА является изменение ожиданий пациентов путем изменения схемы лечения БДР. В случае успешной разработки регулятор рецептора ГАМКА может стать первым лекарственным препаратом, обеспечивающим действительно новый механизм действия для лечения депрессии, более чем за два десятилетия. В настоящее время иностранные фармацевтические компании, в том числе Sage Therapeutics и Marinus и др., делают все возможное, чтобы разработать регуляторы рецепторов ГАМКА.
Опубликованные патентные заявки, относящиеся к регуляторам рецепторов ГАМКА, включают: WO 2003077919, WO 2014169833, WO 2016061537, WO 2015180679 и WO 2015027227.
Регуляторы рецепторов ГАМКА, являющиеся популярной мишенью в фармацевтической промышленности, в настоящее время имеют хорошие перспективы для применения.
Во-первых, регуляторы рецепторов ГАМКА могут применяться при большом депрессивном расстройстве (БДР). Ежегодная заболеваемость БДР в Китае составляет около 2%, поэтому существует огромный рыночный потенциал.
Во-вторых, существующим антидепрессантам требуется длительное время, обычно от 3 до 4 недель, для оказания действия, они имеют высокий показатель неэффективности до 40% и требуют длительного приема лекарственного препарата. Регуляторы рецепторов ГАМКА могут обеспечить значительное антидепрессивное действие в течение 24 часов, и действие может длиться от нескольких дней до двух недель.
В-третьих, регулятор рецептора ГАМКА может удовлетворить потребность в лечении пациентов с БДР при пероральном приеме один раз в сутки.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является создание соединения формулы (I), его стереоизомера или его фармацевтически приемлемой соли, где структура соединения формулы (I) представляет собой следующую:
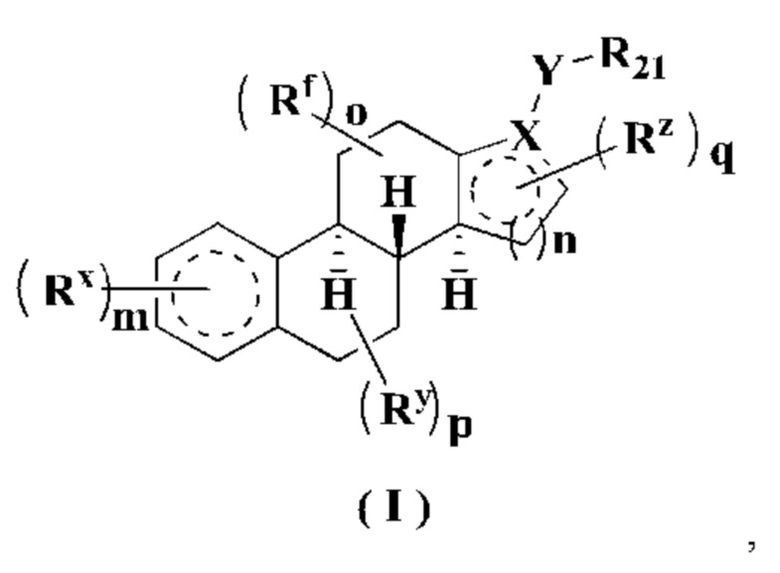
где:
X выбран из группы, состоящей из -CR17- и -N-;
Y выбран из группы, состоящей из -CR23R24-, -S(CH2)n1-, -P(CH2)n1-, -O(CH2)n1-, -(CH2)n1NR22-,

Rx, Ry, Rz и Rf являются одинаковыми или разными, и каждый из них независимо выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, тиола, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, тиола, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
или любые две смежные или несмежные группы из Rx, Ry, Rz и Rf могут быть связаны с образованием циклоалкила, гетероциклила, арила или гетероарила, где циклоалкил, гетероциклил, арил или гетероарил необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного ар ила, замещенного или незамещенного гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24;
или любые две смежные группы из Rx, Ry, Rz и Rf могут образовывать двойную связь;
R21 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, (CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
когда X представляет собой -CR17-, R17 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, гидрокси, амино, алкенила, алкинила, циклоалкила, гетероциклила, арила и гетероарила, где каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, замещенного или незамещенного алкила, галогена, гидрокси, замещенного или незамещенного амино, оксо, нитро, циано, алкенила, алкинила, алкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила;
или R17 и любая группа из Rx, Ry, Rz и Rf могут быть связаны с образованием циклоалкила, гетероциклила, арила или гетероарила, где циклоалкил, гетероциклил, арил или гетероарил необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящий из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24;
R22 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, (CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R23, R24, R25 и R26 являются одинаковыми или разными, и каждый из них независимо выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, гидрокси, амино, алкенила, алкинила, циклоалкила, гетероциклила, арила и гетероарила, где каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, замещенного или незамещенного алкила, галогена, гидрокси, замещенного или незамещенного амино, оксо, нитро, циано, алкенила, алкинила, алкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила;
m представляет собой целое число, равное 0, 1, 3, 4, 5, 6, 7, 8, 9 или 10;
n представляет собой целое число, равное 0, 1, 2 или 3;
о представляет собой целое число, равное 0, 1, 2, 3, 4 или 5;
р представляет собой целое число, равное 0, 1, 2, 3, 4, 5 или 6;
q представляет собой целое число, равное 0, 1, 2, 3, 4, 5 или 6;
m1 представляет собой целое число, равное 0, 1 или 2, и
n1 представляет собой целое число, равное 0, 1, 2, 3, 4 или 5.
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (I-A), его стереоизомер или его фармацевтически приемлемую соль:

где:
Y выбран из группы, состоящей из -S(CH2)n1-,

R3a и R3b являются одинаковыми или разными, и каждый из них независимо выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, тиола, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1S(O)NR23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R23 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, тиола, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R5, R6, R15a, R15b, R16a, R16b и R19 являются одинаковыми или разными, и каждый из них независимо выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1S(O)NR23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R23 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
или любые две смежные или несмежные группы из R5, R6, R15a, R15b, R16a, R16b и R19 могут быть связаны с образованием циклоалкила, гетероциклила, арила или гетероарила, где циклоалкил, гетероциклил, арил или гетероарил необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R17 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, гидрокси, амино, алкенила, алкинила, циклоалкила, гетероциклила, арила и гетероарила, где каждый из алкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, замещенного или незамещенного алкила, галогена, гидрокси, замещенного или незамещенного амино, оксо, нитро, циано, алкенила, алкинила, алкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила;
или R17 и любая группа из R16a и R16b могут быть связаны с образованием циклоалкила, гетероциклила, арила или гетероарила, где циклоалкил, гетероциклил, арил или гетероарил необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24;
R21 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, (CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
n представляет собой целое число, равное 0, 1, 2 или 3;
R22-R26, m1 и n1 являются такими, как определено для соединения формулы (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (II), его стереоизомер или его фармацевтически приемлемую соль:
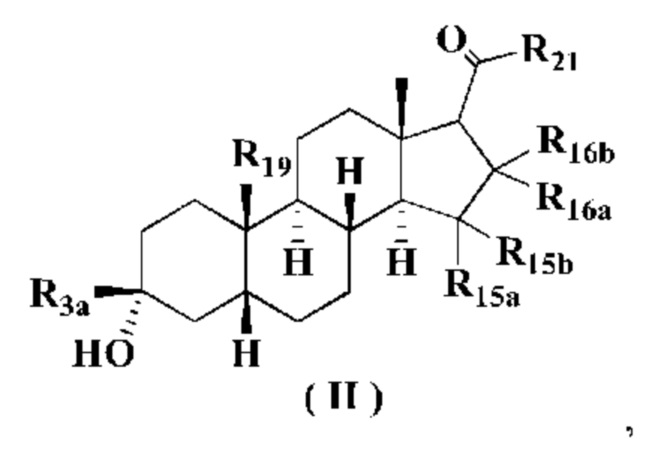
где:
R3a выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, тиола, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1S(O)(NR23)R24, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R23 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, тиола, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R15a, R15b, R16a и R16b являются одинаковыми или разными, и каждый из них независимо выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, (CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1S(O)(NR23)R24, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R23 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26 и R15a, R15b, R16a и R16b одновременно не представляют собой атом водорода;
или любые две смежные или несмежные группы из R15a, R15b, R16a и R16b могут быть связаны с образованием циклоалкила, гетероциклила, арила или гетероарила, где циклоалкил, гетероциклил, арил или гетероарил необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R19 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, тиола, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1S(O)(NR23)R24, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R23 и -(CH2)n1NR23S(O)m1R24;
R21, R23-R26, m1 и n1 являются такими, как определено для соединения формулы (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (III), его стереоизомер или его фармацевтически приемлемую соль:

где:
R15a, R16a и R21 являются такими, как определено для соединения формулы (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (IV), его стереоизомер или его фармацевтически приемлемую соль:

где:
Z выбран из группы, состоящей из -CR23R24-, -(CH2)n1NR23- и -(CH2)n1O(CH2)n2-, и предпочтительно представляет собой метилен;
кольцо А выбрано из группы, состоящей из циклоалкила, гетероциклила, арила или гетероарила, где каждый из циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
каждый Ra является одинаковым или разным, и каждый из них выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, (CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1S(O)(NR23)R24, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R23 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R15a выбран из группы, состоящей из атома водорода, алкила, галогеналкила, алкокси, галогена, амино, гидрокси, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1S(O)m1R23 и -(CH2)n1NR23R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, циклоалкила, гетероциклила, арила и гетероарила;
R16a выбран из группы, состоящей из атома водорода, алкила, галогеналкила, алкокси, галогена, амино, гидрокси, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1S(O)m1R23 и -(CH2)n1NR23R24;
или R15a и R16a могут образовывать циклоалкил или гетероциклил, где циклоалкил или гетероциклил необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, циклоалкила, гетероциклила, арила и гетероарила, и R15a и R16a одновременно не представляют собой атом водорода;
каждый из R23 и R24 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила и гетероарила, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R25-R26, m1, n1 и x являются такими, как определено для соединения формулы (II).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (IV-A), его стереоизомер или его фармацевтически приемлемую соль:

R15a выбран из группы, состоящей из атома водорода, алкила, галогеналкила, алкокси, галогена, амино, гидрокси, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1S(O)m1R23 и -(CH2)n1NR23R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, циклоалкила, гетероциклила, арила и гетероарила;
кольцо A, Ra и х являются такими, как определено для соединения формулы (IV).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (V), его стереоизомер или его фармацевтически приемлемую соль:

где:
R15a, R16a, Ra и x являются такими, как определено для соединения формулы (IV).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (V), его стереоизомер или его фармацевтически приемлемую соль:

где:
R15a, R16a, Ra и х являются такими, как определено для соединения формулы (V).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (VI), его стереоизомер или его фармацевтически приемлемую соль:

где:
каждый Rd является одинаковым или разным, и каждый из них выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1S(O)(NR23)R24, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R23 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
у представляет собой целое число, равное 0, 1, 3 или 4;
кольцо A, Z, Ra, R23-R26, m1, n1 и х являются такими, как определено для соединения формулы (IV).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (VI-A), его стереоизомер или его фармацевтически приемлемую соль:

где:
кольцо A, Z, Ra, Rd, R23-R26, m1, n1, x и у являются такими, как определено для соединения формулы (VI).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (VII), его стереоизомер или его фармацевтически приемлемую соль:

где:
Y выбран из группы, состоящей из -S(CH2)n1-,
R21 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R22-R26, m1 и n1 являются такими, как определено для соединения формулы (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (VIII), его стереоизомер или его фармацевтически приемлемую соль:

где:
R21 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R23-R26, m1 и n1 являются такими, как определено для соединения формулы (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (IX), его стереоизомер или его фармацевтически приемлемую соль:

где:
Y выбран из группы, состоящей из -S(CH2)n1-, 

R21 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(CH2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26; и
n представляет собой целое число, равное 0, 1 или 2;
R22-R26, m1 и n1 являются такими, как определено для соединения формулы (I).
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I) представляет собой соединение формулы (X), его стереоизомер или его фармацевтически приемлемую соль:

где:
М выбран из группы, состоящей из -CR23- и кислорода;
Y выбран из группы, состоящей из -S(CH2)n1-, 

R21 выбран из группы, состоящей из атома водорода, атома дейтерия, алкила, дейтерированного алкила, галогеналкила, алкокси, галогеналкокси, галогена, амино, нитро, гидрокси, циано, алкенила, алкинила, циклоалкила, гетероциклила, арила, гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23, -(CH2)n1NR23R24, -(СН2)n1C(O)NR23R24, -(CH2)n1NR23C(O)R24 и -(CH2)n1NR23S(O)m1R24, где каждый из алкила, галогеналкила, циклоалкила, гетероциклила, арила и гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, алкила, галогеналкила, галогена, амино, оксо, нитро, циано, гидрокси, алкенила, алкинила, алкокси, галогеналкокси, гидроксиалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, -(CH2)n1R25, -(CH2)n1OR25, -(CH2)n1SR25, -(CH2)n1C(O)R25, -(CH2)n1C(O)OR25, -(CH2)n1S(O)m1R25, -(CH2)n1NR25R26, -(CH2)n1C(O)NR25R26, -(CH2)n1C(O)NHR25, -(CH2)n1NR25C(O)R26 и -(CH2)n1NR25S(O)m1R26;
R22-R26, m1 и n1 являются такими, как определено для соединения формулы (I).
В предпочтительном варианте осуществления настоящего изобретения в соединении формулы (I), его стереоизомере или его фармацевтически приемлемой соли кольцо А выбрано из группы, состоящей из:

В предпочтительном варианте осуществления настоящего изобретения предложено соединение любой формулы, его стереоизомер или его фармацевтически приемлемая соль,
где:
Z выбран из группы, состоящей из -СН2-, -CH2NH-, -CH2O-, -СН2-, -NH- и -NHSO2-;
Y выбран из группы, состоящей из -С(О)-, -C(O)CH2-, -С(O)O-, -C(O)CH2NH-, -C(O)CH2O-, -SCH2-, -S(O)CH2-, -S(O)2CH2-, -P(O)R23-, -C(O)NH- и -C(O)NHSO2-; где Ra выбран из группы, состоящей из атома водорода, галогена, амино, циано, нитро, C1-6 алкила, С2-6 алкинила, С3-6 циклоалкила, С1-6 галогеналкила, С3-8 галогенциклоалкила, С1-6 алкокси, С1-6 гидроксиалкила, -(CH2)n1OR23, -(CH2)n1SR23, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1C(O)NR23R24 и -(CH2)n1S(O)m1R23, где каждый из C1-6 алкила, С2-6 алкинила, С3-6 циклоалкила, С1-6 галогеналкила, С3-6 галогенциклоалкила, С1-6 алкокси и С1-6 гидроксиалкила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома водорода, галогена, циано, гидрокси, С1-6 алкила, С3-6 циклоалкила и 3-6-членного гетероциклила;
Rd выбран из группы, состоящей из атома водорода, галогена, амино, циано, нитро, C1-6 алкила, С2-6 алкинила, С3-6 циклоалкила, С1-6 галогеналкила, С3-8 галогенциклоалкила, C1-6 алкокси и C1-6 гидроксиалкила;
R23 и R24 являются одинаковыми или разными, и каждый из них независимо выбран из группы, состоящей из C1-6 алкила, С3-8 циклоалкила и 3-8-членного гетероциклила, где каждый из C1-6 алкила, С3-8 циклоалкила и 3-8-членного гетероциклила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, галогена, гидрокси, С1-3 алкила, амино, оксо, нитро, циано, С2-6 алкенила, С2-6 алкинила, C1-6 алкокси, C1-6 гидроксиалкила, С3-8 циклоалкила, -(CH2)n1NR25R26, 3-8-членного гетероциклила, 6-10-членного арила и 5-12-членного гетероарила.
В предпочтительном варианте осуществления настоящего изобретения предложено соединение любой формулы, его стереоизомер или его фармацевтически приемлемая соль, где:
R15a выбран из группы, состоящей из атома водорода, C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, галогена, амино, гидрокси, С3-8 циклоалкила, С3-8 галогенциклоалкила, 3-8-членного гетероциклила, 6-10-членного арила, 5-12-членного гетероарила, -(CH2)n1R23, -(CH2)n1OR23, -(CH2)n1C(O)OR23, -(CH2)n1SR23, -(CH2)n1S(O)m1R23 и -(CH2)n1NR23R24, где каждый из C1-6 алкила, C1-6 галогеналкила, C1-6 алкокси, С3-8 циклоалкила, С3-8 галогенциклоалкила, 3-8-членного гетероциклила, 6-10-членного арила и 5-12-членного гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома водорода, галогена, циано, гидрокси, нитро, C1-6 алкила, C1-6 галогеналкила, С3-6 циклоалкила, -(CH2)n1NR25R26 и 3-6-члеиного гетероциклила;
R16a выбран из группы, состоящей из атома водорода, галогена, циано, C1-6 алкила и С1-6 галогеналкила;
или R15a и R16a могут образовывать С3-8 циклоалкил, где С3-8 циклоалкил необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома водорода, C1-6 алкила, C1-6 галогеналкила и галогена, и R15a и R16a одновременно не представляют собой атом водорода;
R23 и R24 являются одинаковыми или разными, и каждый из них независимо выбран из группы, состоящей из атома водорода, C1-6 алкила, С3-8 циклоалкила и 3-8-членного гетероциклила, где каждый из C1-6 алкила, С3-8 циклоалкила и 3-8-членного гетероциклила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из атома дейтерия, галогена, гидрокси, С1-6 алкила, амино, оксо, нитро, циано, С2-6 алкенила, С2-6 алкинила, C1-6 алкокси, C1-6 гидроксиалкила, С3-8 циклоалкила, -(CH2)n1NR25R26, 3-8-членного гетероциклила, 6-10-членного арила и 5-12-членного гетероарила.
В предпочтительном варианте осуществления настоящего изобретения соединение формулы (I), его стереоизомер или его фармацевтически приемлемая соль выбрано из группы, состоящей из:






Настоящее изобретение, кроме того, относится к фармацевтической композиции, содержащей терапевтически эффективное количество любого из соединения формулы (I), его стереоизомера или его фармацевтически приемлемой соли и один или более чем один фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
Настоящее изобретение, кроме того, относится к применению любого из соединения формулы (I), его стереоизомера или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции для получения лекарственного средства, регулирующего рецептор ГАМКА.
Настоящее изобретение, кроме того, относится к применению соединения формулы (I), его стереоизомера или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции для получения лекарственного средства для лечения заболевания, связанного с центральной нервной системой (ЦНС), которое выбрано из группы, состоящей из расстройства сна, расстройства настроения, расстройства шизофренического спектра, спазматического расстройства, расстройства памяти и/или когнитивного расстройства, дискинезии, расстройства личности, расстройства аутистического спектра, боли, черепно-мозговой травмы, сосудистого заболевания, расстройства, связанного со злоупотреблением психоактивными веществами, и/или синдрома отмены или звона в ушах.
Настоящее изобретение, кроме того, относится к соединению формулы (I), его стереоизомеру или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции для применения при лечении заболевания, связанного с ЦНС.
Настоящее изобретение, кроме того, относится к способу предупреждения и/или лечения заболевания, связанного с ЦНС, включающему введение пациенту терапевтически эффективного количества соединения формулы (I), его стереоизомера или его фармацевтически приемлемой соли, или содержащей их фармацевтической композиции.
ОПРЕДЕЛЕНИЯ
Если не указано иное, термины, используемые в описании и формуле изобретения, имеют приведенные ниже значения:
Термин «алкил» относится к насыщенной алифатической углеводородной группе, которая представляет собой группу с прямой или разветвленной цепью, содержащую от 1 до 20 атомов углерода, предпочтительно алкилу, содержащему от 1 до 8 атомов углерода, более предпочтительно алкилу, содержащему от 1 до 6 атомов углерода, и наиболее предпочтительно алкилу, содержащему от 1 до 3 атомов углерода. Неограничивающие примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, 2-метилбутил, 3-метилбутил, н-гексил, 1-этил-2-метилпропил, 1,1,2-триметилпропил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил, н-гептил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилпентил, 2,4-диметилпентил, 2,2-диметилпентил, 3,3-диметилпентил, 2-этилпентил, 3-этилпентил, н-октил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилгексил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил, н-нонил, 2-метил-2-этилгексил, 2-метил-3-этилгексил, 2,2-диэтилпентил, н-децил, 3,3-диэтилгексил, 2,2-диэтилгексил и их различные разветвленные изомеры. Алкильная группа может быть замещенной или незамещенной. В случае, если она является замещенной, группа (группы) заместителя может быть замещена(ны) в любой доступной соединительной точке. Группа (группы) заместителя предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, оксо, карбокси и алкоксикарбонила. Алкил согласно настоящему изобретению предпочтительно выбран из группы, состоящей из метила, этила, изопропила, трет-бутила, галогеналкила, дейтерированного алкила, алкоксизамещенного алкила и гидроксизамещенного алкила.
Термин «алкилен» относится к алкилу, атом водорода которого дополнительно замещен, например, «метилен» относится к -СН2-, «этилен» относится к -(СН2)2-, «пропилен» относится к -(СН2)3-, «бутилен» относится к -(СН2)4- и т.п. Термин «алкенил» относится к алкилу, как определено выше, который состоит по меньшей мере из двух атомов углерода и по меньшей мере из одной двойной углерод-углеродной связи, например, этенилу, 1-пропенилу 2-пропенилу, 1-, 2- или 3-бутенилу и т.п. Алкенильная группа может быть замещенной или незамещенной. Когда она является замещенной, группа (группы) заместителя предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио и гетероциклилтио.
Термин «циклоалкил» относится к насыщенной или частично ненасыщенной моноциклической или полициклической углеводородной группе, имеющей от 3 до 20 атомов углерода, предпочтительно от 3 до 12 атомов углерода, предпочтительно от 3 до 8 атомов углерода и более предпочтительно от 3 до 6 атомов углерода. Неограничивающие примеры моноциклического циклоалкила включают циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогексадиенил, циклогептил, циклогептатриенил, циклооктил и тому подобное. Полициклический циклоалкил включает циклоалкил, имеющий спиро-кольцо, конденсированное кольцо или мостиковое кольцо. Циклоалкил предпочтительно представляет собой циклопропил.
Термин «спироциклоалкил» относится к 5-20-членной полициклической группе с отдельными кольцами, соединенными через один общий атом углерода (называемый спироатомом), где кольца могут содержать одну или несколько двойных связей, но ни одно из колец не имеет полностью сопряженной π-электронной системы. Спироциклоалкил предпочтительно представляет собой 6-14-членный спироциклоалкил и более предпочтительно 7-10-членный спироциклоалкил. По количеству спироатомов, общих между кольцами, спироциклоалкил можно подразделить на моноспироциклоалкил, диспироциклоалкил или полиспироциклоалкил, и спироциклоалкил предпочтительно представляет собой моноспироциклоалкил или диспироциклоалкил, и более предпочтительно 4-членный/4-членный, 4-членный/5-членный, 4-членный/6-членный, 5-членный/5-членный или 5-членный/6-членный моноспироциклоалкил.
Неограничивающие примеры спироциклоалкила включают:

и также включают спироциклоалкил, в котором циклоалкил и гетероциклил связаны посредством одного спироатома, их неограничивающие примеры включают:

Термин «конденсированный циклоалкил» относится к 5-20-членной полностью углеродной полициклической группе, где каждое кольцо в системе имеет смежную общую пару атомов углерода с другим кольцом, где, где одно или более колец могут содержать одну или несколько двойных связей, но ни одно из колец не имеет полностью сопряженной π-электронной системы. Конденсированный циклоалкил предпочтительно представляет собой 6-14-членный конденсированный циклоалкил и более предпочтительно 7-10-членный конденсированный циклоалкил. По количеству входящих в него колец конденсированный циклоалкил можно подразделить на бициклический, трициклический, тетрациклический или полициклический конденсированный циклоалкил, и конденсированный циклоалкил предпочтительно представляет собой бициклический или трициклический конденсированный циклоалкил, и более предпочтительно 5-членный/5-членный или 5-членный/6-членный бициклический конденсированный циклоалкил. Неограничивающие примеры конденсированного циклоалкила включают:
Термин «мостиковый циклоалкил» относится к 5-20-членной полностью углеродной полициклической группе, где каждые два кольца в системе имеют два общих несвязанных атома углерода, где кольца могут иметь одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной π-электронной системы. Мостиковый циклоалкил предпочтительно представляет собой 6-14-членный мостиковый циклоалкил и более предпочтительно 7-10-членный мостиковый циклоалкил. По количеству входящих в него колец мостиковый циклоалкил можно подразделить на бициклический, трициклический, тетрациклический или полициклический мостиковый циклоалкил, и мостиковый циклоалкил предпочтительно представляет собой бициклический, трициклический или тетрациклический мостиковый циклоалкил, и более предпочтительно бициклический или трициклический мостиковый циклоалкил. Неограничивающие примеры мостикового циклоалкила включают:

Циклоалкильное кольцо может быть конденсировано с кольцом арила, гетероарила или гетероциклила, где кольцо, связанное с исходной структурой, представляет собой циклоалкил. Неограничивающие примеры включают инданил, тетрагидронафтил, бензоциклогептил и тому подобное. Циклоалкил может быть необязательно замещенным или незамещенным. Когда он является замещенным, группа (группы) заместителя предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, оксо, карбокси и алкоксикарбонила.
Термин «гетероциклил» относится к 3-20-членной насыщенной или частично ненасыщенной моноциклической или полициклической углеводородной группе, в которой один или более атомов кольца представляют собой гетероатомы, выбранные из группы, состоящей из N, О и S(O)m (где m представляет собой целое число от 0 до 2), но исключая -O-O-, -O-S- или -S-S- в кольце, при этом оставшиеся атомы кольца являются атомами углерода. Предпочтительно гетероциклил имеет от 3 до 12 атомов кольца, где от 1 до 4 атомов представляют собой гетероатомы; более предпочтительно от 3 до 10 атомов кольца; и наиболее предпочтительно от 3 до 8 атомов кольца. Неограничивающие примеры моноциклического гетероциклила включают пирролидинил, имидазолидинил, тетрагидрофуранил, тетрагидротиенил, дигидроимидазолил, дигидрофуранил, дигидропиразолил, дигидропирролил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперазинил, пиранил, 1,4-диазациклил и т.п., и предпочтительно тетрагидрофуранил, пиразолидинил, морфолинил, 1,4-диазациклил, пиперазинил и пиранил. Полициклический гетероциклил включает гетероциклил, имеющий спиро-кольцо, конденсированное кольцо или мостиковое кольцо. Гетероциклил, содержащий спирокольцо, конденсированное кольцо или мостиковое кольцо, необязательно связан с другой группой посредством одинарной связи или дополнительно связан с другими циклоалкилом, гетероциклилом, арилом и гетероарилом посредством любых двух или более атомов кольца.
Термин «спирогетероциклил» относится к 5-20-членной полициклической гетероциклильной группе с отдельными кольцами, соединенными посредством одного общего атома (называемого спироатомом), где один или более атомов кольца представляют собой гетероатомы, выбранные из группы, состоящей из N, О и S(O)m (где m представляет собой целое число от 0 до 2), с оставшиимся атомы кольца, являющиеся атомами углерода, где кольца могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной π-электронной системы. Спирогетероциклил предпочтительно представляет собой 6-14-членный спирогетероциклил и более предпочтительно 7-10-членный спирогетероциклил. По количеству спироатомов, общих между кольцами, спирогетероциклил можно подразделить на моноспирогетероциклил, диспирогетероциклил или полиспирогетероциклил и спирогетероциклил предпочтительно представляет собой моноспирогетероциклил или диспирогетероциклил, и более предпочтительно 4-членный/4-членный, 4-членный/5-членный, 4-членный/6-членный, 5-членный/5-членный или 5 -членный/6-членный моноспирогетероциклил. Неограничивающие примеры спирогетероциклила включают:
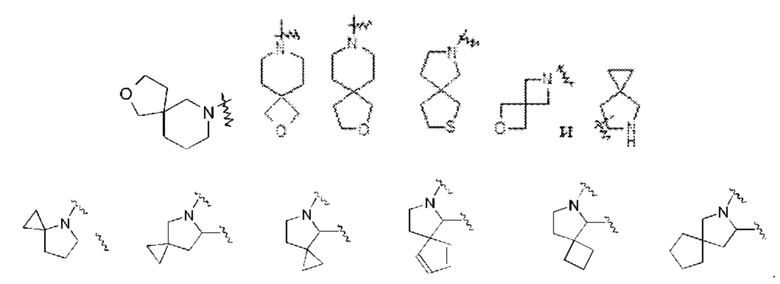
Термин «конденсированный гетероциклил» относится к 5-20-членной полициклической гетероциклильной группе, где каждое кольцо в системе имеет общую смежную пару атомов с другим кольцом, где одно или более колец могут содержать одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной π-электронной системы, и где один или более атомов кольца представляют собой гетероатомы, выбранные из группы, состоящей из N, О и S(O)m (где m представляет собой целое число от 0 до 2), причем оставшиеся атомы кольца являются атомами углерода. Конденсированный гетероциклил предпочтительно представляет собой 6-14-членный конденсированный гетероциклил и более предпочтительно 7-10-членный конденсированный гетероциклил. По количеству входящих в него колец конденсированный гетероциклил можно подразделить на бициклический, трициклический, тетрациклический или полициклический конденсированный гетероциклил, и предпочтительно бициклический или трициклический конденсированный гетероциклил, и более предпочтительно 5-членный/5-членный или 5-членный/6-членный бициклический конденсированный гетероциклил. Неограничивающие примеры конденсированного гетероциклила включают:

Термин «мостиковый гетероциклил» относится к 5-14-членной полициклической гетероциклильной группе, где каждые два кольца в системе имеет два общих несвязанных атома, где кольца могут иметь одну или более двойных связей, но ни одно из колец не имеет полностью сопряженной π-электронной системы, и где один или более атомов кольца представляют собой гетероатомы, выбранные из группы, состоящей из N, О и S(O)m (где m представляет собой целое число от 0 до 2), причем оставшиеся атомы кольца являются атомами углерода. Мостиковый гетероциклил предпочтительно представляет собой 6-14-членный мостиковый гетероциклил и более предпочтительно 7-10-членный мостиковый гетероциклил. По количеству входящих в него колец мостиковый гетероциклил можно подразделить на бициклический, трициклический, тетрациклический или полициклический мостиковый гетероциклил, и мостиковый гетероциклил предпочтительно представляет собой бициклический, трициклический или тетрациклический мостиковый гетероциклил, и более предпочтительно бициклический или трициклический мостиковый гетероциклил. Неограничивающие примеры мостикового гетероциклила включают:

Кольцо гетероциклила может быть конденсировано с кольцом арила, гетероарила или циклоалкила, где кольцо, связанное с исходной структурой, представляет собой гетероциклил. Неограничивающие примеры включают:
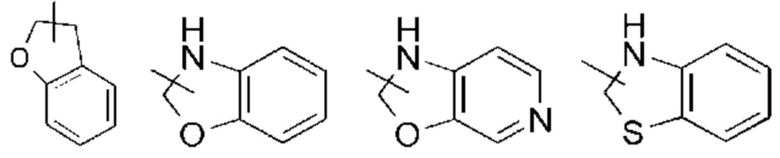 и т.п.
и т.п.
Гетероциклил может быть необязательно замещенным или незамещенным. Когда он является замещенным, группа (группы) заместителя предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, оксо, карбокси и алкоксикарбонила.
Термин «ар ил» относится к 6-14-членному полностью углеродному моноциклическому или полициклическому конденсированному кольцу (т.е. каждое кольцо в системе имеет общую смежную пару атомов углерода с другим кольцом в системе), имеющему сопряженную π-электронную систему, предпочтительно 6-10-членному ар илу, например, фенилу и нафтилу. Арил более предпочтительно представляет собой фенил. Кольцо арила может быть конденсировано с кольцом гетероарила, гетероциклила или циклоалкила, где кольцо, связанное с исходной структурой, представляет собой кольцо арила. Неограничивающие примеры включают:

Арил может быть замещенным или незамещенным. Когда он является замещенным, группа (группы) заместителя предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, карбокси и алкоксикарбонила.
Термин «гетероарил» относится к 5-12-членной гетероароматической системе, имеющей от 1 до 4 гетероатомов, выбранных из группы, состоящей из О, S и N. Гетероарил предпочтительно представляет собой 5-10-членный гетероарил и более предпочтительно 5- или 6-членный гетероарил, например, имидазолил, фур ил, тиенил, тиазолил, пиразолил, оксазолил, пирролил, триазолил, тетразолил, пиридил, пиримидинил, тиадиазолил, пиразинил и т.п., предпочтительно триазолил, тетразолил, тиенил, имидазолил, пиразолил, пиридазинил, пиримидинил, тиазолил, оксазолил, изоксазолил или пиримидинил, и более предпочтительно триазолил, тетразолил, пиразолил, пиридил, пиридазинил, пиримидинил, тиазолил, оксазолил, изоксазолил или имидазолил. Кольцо гетероарила может быть конденсировано с кольцом арила, гетероциклила или циклоалкила, где кольцо, связанное с исходной структурой, представляет собой кольцо гетероарила. Неограничивающие примеры включают:

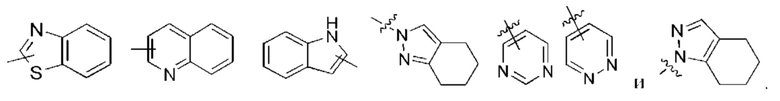
Гетероарил может быть необязательно замещенным или незамещенным. Когда он является замещенным, группа (группы) заместителя предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, карбокси и алкоксикарбонила.
Термин «алкокси» относится к группе -О-(алкил) или -O-(незамещенный циклоалкил), где алкил представляет собой такой, как определено выше. Неограничивающие примеры алкокси включают метокси, этокси, пропокси, бутокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси. Алкокси может быть необязательно замещенным или незамещенным. Когда он является замещенным, группа (группы) заместителя предпочтительно представляет собой одну или более групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкилтио, алкиламино, галогена, тиола, гидрокси, нитро, циано, циклоалкила, гетероциклила, арила, гетероарила, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, карбокси и алкоксикарбонила.
«Галогеналкил» относится к алкильной группе, замещенной одним или более атомами галогена, где алкил представляет собой такой, как определено выше.
«Галогеналкокси» относится к алкоксигруппе, замещенной одним или более атомами галогена, где алкокси представляет собой такой, как определено выше.
«Гидроксиалкил» относится к алкильной группе, замещенной гидроксигруппой(ами), где алкил представляет собой такой, как определено выше.
«Алкенил» относится к цепочечному алкенилу, также известному как алкеновая группа, который представляет собой группу с прямой или разветвленной цепью, содержащую от 2 до 20 атомов углерода, предпочтительно алкенилу, имеющему от 2 до 8 атомов углерода, более предпочтительно алкенилу, имеющему от 2 до 6 атомов углерода и наиболее предпочтительно алкенилу, имеющему от 2 до 3 атомов углерода. Алкенил может быть дополнительно замещен другой родственной группой, например, алкилом, алкенилом, алкинилом, алкокси, алкилтио, алкиламино, галогеном, тиолом, гидрокси, нитро, циано, циклоалкилом, гетероциклилом, арилом, гетероарилом, циклоалкокси, гетероциклоалкокси, циклоалкилтио, гетероциклилтио, карбокси или алкоксикарбонилом.
«Алкинил» относится к (СН≡С-), которая представляет собой группу с прямой или разветвленной цепью, содержащую от 2 до 20 атомов углерода, предпочтительно алкинилу, имеющему от 2 до 8 атомов углерода, более предпочтительно алкинилу, имеющему от 2 до 6 атомов углерода, и наиболее предпочтительно алкинилу, имеющему от 2 до 3 атомов углерода. Алкинил может быть дополнительно замещен другой родственной группой, например алкилом, алкенилом, алкинилом, алкокси, алкилтио, алкиламино, галогеном, тиолом, гидрокси, нитро, циано, циклоалкилом, гетероциклилом, арилом, гетероарилом, циклоалкокси, гетероциклоалкокси, циклоалкилтиотио, карбокси и алкоксикарбонилом.
«Гидрокси» относится к группе -ОН.
«Галоген» относится к фтору, хлору, брому или йоду.
«Амино» относится к группе -NH2.
«Циано» относится к группе -CN.
«Нитро» относится к группе -NO2.
«Карбокси» относится к группе -С(O)ОН.
«THF» относится к тетрагидрофурану.
«EtOAc» относится к этил ацетату.
«МеОН» относится к метанолу.
«DMF» относится к N,N-диметилформамиду
«DIPEA» относится к диизопропилэтиламину.
«TFA» относится к трифторуксусной кислоте.
«MeCN» относится к ацетонитрилу.
«DMA» относится к N,N-диметилацетамиду.
«Е12О» относится к диэтиловому эфиру.
«DCE» относится к 1,2-дихлорэтану.
«DIPEA» относится к N,N-диизопропилэтиламину.
«NBS» относится к N-бромсукцинимиду.
«NIS» относится к N-иодосукцинимиду.
«Cbz-Cl» относится к бензилхлорформиату.
«Pd2(dba)3» относится к трис(дибензилиденацетон)дипалладию.
«Dppf» относится к 1,1'-бисдифенилфосфиноферроцену.
«HATU» относится к 2-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфату.
«KHMDS» относится к гексаметилдисилазиду калия.
«LiHMDS» относится к бис(триметилсилил)амиду лития.
«MeLi» относится к метиллитию.
«n-BuLi» относится к н-бутиллитию.
«NaBH(OAc)3» относится к триацетоксиборгидриду натрия.
Различные выражения, такие как «X выбран из группы, состоящей из А, В или С», «X выбран из группы, состоящей из А, В и С», «X представляет собой А, В или С», «X представляет собой А, В и С» и т.п. имеют один и тот же смысл, то есть X может представлять собой одно или более из А, В и С.
Атом водорода согласно настоящему изобретению может быть замещен его изотопом дейтерием. Любой из атомов водорода в соединениях из примеров настоящего изобретения также может быть замещен атомом дейтерия.
«Необязательный» или «необязательно» означает, что описанное далее явление или обстоятельство может, но не обязательно должно, происходить, и такое описание включает ситуацию, в которой явление или обстоятельство происходит или не происходит. Например, «гетероциклил, необязательно замещенный алкилом» означает, что алкильная группа может, но не обязательно должна, присутствовать, и такое описание включает ситуацию, когда гетероциклил замещен алкилом, и когда гетероциклил не замещен алкилом.
«Замещенный» относится к одному или более атомам водорода в группе, предпочтительно до 5 и более предпочтительно от 1 до 3 атомов водорода, независимо замещенных соответствующим числом заместителей. Разумеется, заместители существуют только в возможных для них химических положениях. Специалист в данной области техники способен определить, возможно или невозможно провести замещение с помощью экспериментов или теоретических знаний, не прилагая чрезмерных усилий. Например, комбинация амино- или гидроксигрупп, имеющих свободные атомы водорода, и атомов углерода, имеющих ненасыщенные связи (такие как олефиновые), может быть нестабильной.
«Фармацевтическая композиция» относится к смеси одного или более описанных соединений согласно настоящему изобретению или их физиологически/фармацевтически приемлемых солей или пролекарств с другими химическими компонентами и другими компонентами, такими как физиологически/фармацевтически приемлемые носители и вспомогательные вещества. Назначение фармацевтической композиции состоит в том, чтобы облегчить введение соединения в организм, что способствует абсорбции активного ингредиента, необходимой для проявления биологической активности.
«Фармацевтически приемлемая соль» относится к соли соединения согласно настоящему изобретению, которая является безопасной и эффективной при применении у млекопитающих и обладает желаемой биологической активностью.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение будет дополнительно описано со ссылкой на следующие примеры, которые не следует рассматривать как ограничивающие объем настоящего изобретения.
ПРИМЕРЫ
Структуры соединений согласно настоящему изобретению идентифицировали с помощью ядерного магнитного резонанса (ЯМР) и/или жидкостной хроматографии с масс-спектрометрией (ЖХ-МС). Сдвиги ЯМР (δ) приведены в миллионных долях (м. д.). Спектры ЯМР определяли на приборе Bruker AVANCE-400. Растворители для определения представляли собой дейтерированный диметилсульфоксид (DMSO-d6), дейтерированный метанол (CDCl3) и дейтерированный хлороформ (CD3OD), а внутренний стандарт представлял собой тетраметилсилан (ТМС).
Жидкостную хроматографию с масс-спектрометрией (ЖХ-МС) проводили на масс-спектрометре Agilent 1200 Infinity Series. Высокоэффективную жидкостную хроматографию (ВЭЖХ) проводили на жидкостном хроматографе высокого давления Agilent 1200DAD (хроматографическая колонка Sunfire С18 150×4,6 мм) и жидкостном хроматографе высокого давления Waters 2695-2996 (хроматографическая колонка Gimini С18 150×4,6 мм).
Силикагелевые пластины Yantai Huanghai HSGF254 или Qingdao GF254 использовали в качестве пластины для тонкослойной хроматографии на силикагеле (ТСХ). Размер силикагелевой пластины, используемой в ТСХ, составлял от 0,15 до 0,2 мм, а размер силикагелевой пластины, используемой при очистке продукта, составлял от 0,4 мм до 0,5 мм. Силикагель Yantai Huanghai размером от 200 до 300 меш обычно использовали в качестве носителя для колоночной хроматографии.
Исходные вещества, используемые в примерах настоящего изобретения, известны и коммерчески доступны, или могут быть синтезированы путем принятия или в соответствии с методами, известными в данной области техники.
Если не указано иное, все реакции согласно настоящему изобретению проводили при непрерывном перемешивании магнитной мешалкой в атмосфере сухого азота или аргона, растворитель был сухим, а температура реакции была в градусах Цельсия.
Пример 1
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагид роциклопропа[4,5] циклопента[1,2-a] фенантрен-7-ил)этан-1-он

Стадия 1: получение
(3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-16-(фенилсульфинил)гексадекагидро-17Н-циклопента[а] фенантрен-17-она

Трет-бутилат калия (2,3 г, 20,7 ммоль) растворяли в безводном тетрагидрофуране (200 мл) и продували реакционную систему азотом. К вышеуказанному раствору добавляли (3R, 5R, 8R,9R, 10S,13S,14S)-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он (3 г, 10,3 ммоль) с получением оранжевого раствора, который затем перемешивали при 25°С в течение 10 минут. Добавляли метил бензол сульфинат (3,2 г, 20,7 ммоль), после чего реакционный раствор перемешивали при 30°С в течение получаса. К реакционному раствору добавляли воду (100 мл), чтобы прервать реакцию, и экстрагировали водную фазу этилацетатом (100 мл×3). Органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 50/1-3/1) с получением (3R, 5R, 8R,9R, 10S,13S,14S)-3-гидрокси-3,13-диметил-16-(фенилсульфинил)гексадекагидро-17Н-циклопента[а]фенантрен-17-она (3,5 г, выход: 82%).
Стадия 2: получение
(3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-1,2,3,4,5,6,7,8,9,10,11,12,13,14-тетрадекагидро-17Н-циклопента[а]фенантрен-17-она

(3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-16-(фенилсульфинил)гексадекагидро-17Н-циклопента[а]фенантрен-17-он растворяли в ксилоле (50 мл) и продували реакционную систему азотом. Добавляли карбонат натрия (24,7 г, 0,17 моль), после чего реакционный раствор перемешивали при 140°С в течение ночи. Реакционный раствор фильтровали и концентрировали органическую фазу. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 50/1-3/1) с получением (3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-1,2,3,4,5,6,7,8,9,10,11,12,13,14-тетрадекагидро-17Н-циклопента[а]фенантрен-17-она (1,5 г, выход: 62%).
1Н ЯМР (400 МГц, CDCl3) δ 7,53 (dd, J=5,9, 1,2 Гц, 1H), 6,03 (dd, J=6,0, 3,2 Гц, 1H), 2,42-2,33 (m, 1H), 1,90-1,79 (m, 4Н), 1,76-1,66 (m, 2Н), 1,58-1,48 (m, 5Н), 1,47-1,37 (m, 4Н), 1,36-1,23 (m, 7Н), 1,08 (s, 3Н).
Стадия 3: получение
(2R,4aS,4bR,6aS,7aS,8aS,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилгексадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7(1Н)-она

Триметилсульфоксид (0,92 г, 4,2 ммоль) растворяли в безводном диметилсульфоксиде (10 мл) и продували реакционную систему азотом. Добавляли гидрид натрия (168 мг, 4,2 ммоль), после чего реакционный раствор перемешивали в течение 1 часа. Добавляли раствор (3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-1,2,3,4,5,6,7,8,9,10,11,12,13,14-тетрадекагидро-17Н-циклопента[а]фенантрен-17-она (1,0 г, 3,5 ммоль) в диметилсульфоксиде (5 мл), после чего реакционный раствор перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду (50 мл), чтобы прервать реакцию, и экстрагировали водную фазу этилацетатом (50 мл×3). Органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 50/1-3/1) с получением (2R,4aS,4bR,6aS,7aS,8aS,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилгексадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7(1Н)-она (0,75 г, выход: 71%).
1Н ЯМР (400 МГц, CDCl3) δ 2,06-2,00 (m, 1H), 1,97-1,91 (m, 1H), 1,88-1,79 (m, 3Н), 1,78-1,67 (m, 6Н), 1,63-1,54 (m, 2Н), 1,48-1,39 (m, 3Н), 1,37-1,25 (m, 9Н), 1,15-1,05 (m, 2Н), 0,96 (s, 3Н).
Стадия 4. Получение (2R,4aS,4bR,6aS,7aS,8aR,8bR,8cR,10aR)-7-этилиден-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-a]фенантрен-2-ола

PPh3EtBr (14,8 г, 40 ммоль) растворяли в безводном диметилсульфоксиде (50 мл) и продували реакционную систему азотом. Добавляли гидрид натрия (1,6 г, 40 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Добавляли (2R,4aS,4bR,6aS,7aS,8aS,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилгексадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7(1Н)-он (0,6 г, 2,0 ммоль), после чего реакционный раствор перемешивали при 100°С в течение ночи. Реакционный раствор охлаждали до комнатной температуры. К реакционному раствору добавляли воду (200 мл), чтобы прервать реакцию, и экстрагировали водную фазу этилацетатом (200 мл×2). Органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 50/1-3/1) с получением (2R,4aS,4bR,6aS,7aS,8aR,8bR,8cR,10aR)-7-этилиден-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-2-ола (0,5 г, выход: 81%).
Стадия 5. Получение
(2R,4aS,4bR,6aS,7aS,8aR,8bR,8cR,10aR)-7-(1-гидроксиэтил)-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-2-ола

(R,4aS,4bR,6aS,7aS,8aR,8bR,8cR,10aR)-7-этилиден-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-2-ол (0,4 г, 1,3 ммоль) растворяли в безводном тетрагидрофуране (10 мл). Раствор охлаждали до 0°С, после чего по каплям добавляли ВН3/THF (12,7 мл, 12,7 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 3 часов, и ТСХ (тонкослойная хроматография) показала завершение реакции. Реакционный раствор охлаждали до 0°С, после чего медленно добавляли 3 М водный раствор NaOH (4 мл) с последующим добавлением Н2О2 (3 мл). Реакционный раствор перемешивали при комнатной температуре в течение 2 часов, и ТСХ показала завершение реакции. Добавляли этилацетат (50 мл), после чего последовательно промывали реакционный раствор насыщенным водным раствором Na2S2O3 (30 мл) и водой (30 мл). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта (0,4 г, выход: 100%, неочищенный), который сразу же использовали на следующей стадии.
Стадия 6: получение
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-она

(2R,4aS,4bR,6aS,7aR,8aR,8bR,8cR,10aR)-7-(1-гидроксиэтил)-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-2-ол (0,4 г, 1,2 ммоль) растворяли в дихлорметане (20 мл). Добавляли РСС (хлорхромат пиридиния) (0,52 г, 40 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и концентрировали органическую фазу. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 50/1-3/1) с получением 1-((2R,4aS,4bR,6а8,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-она (0,35 г, выход: 83%).
1Н ЯМР (400 МГц, CDCl3) δ 2,74 (d, J=4,1 Гц, 1H), 2,21 (s, 3Н), 1,97-1,91 (m, 1H), 1,87-1,62 (m, 7Н), 1,56-1,50 (m, 1H), 1,44-1,21 (m, 15Н), 1,12-1,00 (m, 1H), 0,90-0,83 (m, 1H), 0,72 (s, 3Н), 0,44-0,36 (m, 1H).
Пример 2 Получение
1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила

Стадия 1: получение
2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилалоктадекагидроциклопропа[4,5]циклопента[1,2-a]фенантрен-7-ил)этан-1-она

1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (70 мг, 0,21 ммоль) растворяли в метаноле (3 мл). К раствору добавляли каплю бромистого водорода с последующим добавлением жидкого брома (41 мг, 0,25 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли воду (20 мл) и экстрагировали водную фазу этилацетатом (20 мл×2). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта (87 мг, выход: 100%, неочищенный), который сразу же использовали на следующей стадии.
Стадия 2: получение
1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила

2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (87 мг, 0,21 ммоль), 1H-пиразол-4-карбонитрил (59 мг, 0,64 ммоль) и карбонат калия (145 мг, 1,05 ммоль) растворяли в тетрагидрофуране (2 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила (33 мг, выход: 37%).
МС m/z (масса/заряд) (ESI (ионизация распылением в электрическом поле)): 404,2 [М-H2O+Н]+.
1H ЯМР (400 МГц, CDCl3) δ 7,88 (s, 1H), 7,82 (s, 1H), 5,24-5,13 (m, 2Н), 2,84 (d, J=2,7 Гц, 1H), 1,98-1,92 (m, 1H), 1,87-1,77 (m, 4Н), 1,76-1,66 (m, 3Н), 1,57-1,51 (m, 1H), 1,46-1,24 (m, 15Н), 1,12-1,02 (m, 1H), 1,00-0,96 (m, 1H), 0,78 (s, 3Н), 0,54-0,46 (m, 1H).
Пример 3 и пример 4 Получение
1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрила (3)
1-(2-((2R,4aS,4bR,6aS,7R,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрила(4)

2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (80 мг, 0,19 ммоль), 1H-пиразол-4-карбонитрил (55 мг, 0,58 ммоль) и карбонат калия (131 мг, 0,95 ммоль) растворяли в тетрагидрофуране (3 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрила (34,7 мг, выход: 42%) и 1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрила (3,7 мг, выход: 4,5%).
Пример 3:
МС m/z (ESI): 404,2 [M-H2O+H]+
1Н ЯМР (400 МГц, CDCl3) δ 7,50 (d, J=2,4 Гц, 1H), 6,74 (d, J=2,4 Гц, 1H), 5,29-5,13 (m, 2Н), 2,83 (d, J=2,9 Гц, 1H), 1,97-1,92 (m, 1H), 1,86-1,79 (m, 4Н), 1,73-1,64 (m, 3Н), 1,58-1,52 (m, 1H), 1,43-1,27 (m, 15Н), 1,12-0,96 (m, 2Н), 0,79 (s, 3Н), 0,53-0,44 (m, 1H).
Пример 4:
МС m/z (ESI): 404,2 [М-H2O+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,52 (d, J=2,4 Гц, 1H), 6,75 (d, J=2,4 Гц, 1H), 5,11-4,96 (m, 2Н), 2,92 (s, 1H), 1,93-1,87 (m, 1H), 1,82-1,74 (m, 2Н), 1,72-1,62 (m, 4Н), 1,51 (s, 1H), 1,46-1,24 (m, 15Н), 1,18-1,09 (m, 2Н), 1,04 (s, 3Н), 0,89-0,84 (m, 1H), 0,46-0,40 (m, 1H).
Пример 5
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктароциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(трифторметил)-1Н-пиразол-1-ил)этан-1-он

Стадия 1: получение
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(трифторметил)-1Н-пиразол-1 -ил)этан-1-она

2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (60 мг, 0,15 ммоль), 4-(трифторметил)-1Н-пиразол (60 мг, 0,44 ммоль) и карбонат калия (104 мг, 0,75 ммоль) растворяли в тетрагидрофуране (3 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(трифторметил)-1H-пиразол-1-ил)этан-1-она (22,2 мг, выход: 33%).
МС m/z (ESI): 465,3 [М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,74 (s, 1H), 7,73 (s, 1H), 5,25-5,09 (m, 2Н), 2,83 (d, J=3,6 Гц, 1H), 2,00-1,91 (m, 1H), 1,89-1,79 (m, 4Н), 1,78-1,65 (m, 3H), 1,58-1,52 (m, 1H), 1,47-1,22 (m, 15Н), 1,15-0,95 (m, 2Н), 0,79 (s, 3H), 0,52-0,44 (m, 1H).
Пример 6
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагид роциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-он

Стадия 1: получение
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а] фенантрен-7-ил)-2-(3-(трифторметил)-1H-пиразол-1 -ил)этан-1-она

2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (80 мг, 0,2 ммоль), 3-(трифторметил)-1H-пиразол (80 мг, 0,6 ммоль) и карбонат калия (138 мг, 1,0 ммоль) растворяли в тетрагидрофуране (5 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(3-(трифторметил)-1H-пиразол-1 -ил)этан-1-она (17 мг, выход: 18%).
МС m/z (ESI): 447,3 [M-H2O+H]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,49 (d, J=1,9 Гц, 1H), 6,60 (d, J=1,9 Гц, 1H), 5,27 -5,13 (m, 2Н), 2,83 (d, J=3,7 Гц, 1H), 1,99-1,90 (m, 1H), 1,89-1,76 (m, 4Н), 1,75-1,61 (m, 3H), 1,58-1,50 (m, 1H), 1,50-1,21 (m, 15Н), 1,13-0,96 (m, 2Н), 0,79 (s, 3H), 0,52-0,45 (m, 1H).
Пример 7 и пример 8
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а] фенантрен-7-ил)-2-(2Н-1,2,3 -триазол-2-ил)этан-1-он (7)
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5] циклопента[1,2-а] фенантрен-7-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-он (8)

Стадия 1: получение
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5] циклопента[1,2-а] фенантрен-7-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-она (2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(1Н-1,2,3-триазол-1 -ил)этан-1 -она (8)

2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилокта декагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (80 мг, 0,19 ммоль), 1H-1,2,3-триазол (40 мг, 0,58 ммоль) и карбонат калия (131 мг, 0,95 ммоль) растворяли в тетрагидрофуране (3 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1 -она (7) (9,2 мг, выход: 12%) и
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1 -она (8) (17, 8 мг, выход: 23%). Пример 7:
МС m/z (ESI): 380,3 [M-H2O+H]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,69 (s, 2Н), 5,55-5,36 (m, 2Н), 2,82 (d, J=4,1 Гц, 1H), 1,99-1,92 (m, 1H), 1,87-1,74 (m, 4Н), 1,73-1,52 (m, 5Н), 1,47-1,26 (m, 14Н), 1,14-0,98 (m, 2Н), 0,84 (s, 3H), 0,52-0,43 (m, 1H).
Пример 8:
МС m/z (ESI): 398,3 [М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,76 (s, 1H), 7,66 (s, 1H), 5,52-5,35 (m, 2Н), 2,87 (d, J=3,9 Гц, 1H), 2,02-1,92 (m, 1H), 1,89-1,78 (m, 4Н), 1,76-1,65 (m, 3H), 1,59-1,52 (m, 1H), 1,48-1,23 (m, 15Н), 1,15-0,98 (m, 2Н), 0,80 (s, 3H), 0,56-0,45 (m, 1H).
Пример 9 и пример 10
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(2Н-тетразол-2-ил)этан-1 -он (9)
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(1 Н-тетразол-1 -ил)этан-1 -он (10)

Стадия 1: получение
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5] циклопента[1,2-а] фенантрен-7-ил)-2-(2Н-тетразол-2-ил)этан-1-она (9) и 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(1Н-тетразол-1-ил)этан-1-она (10)

2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилокта декагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (50 мг, 0,12 ммоль), 1H-тетразол (26 мг, 0,37 ммоль) и карбонат калия (83 мг, 0,6 ммоль) растворяли в тетрагидрофуране (3 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(2Н-тетразол-2-ил)этан-1-она (9) (11,6 мг, выход: 24%) и 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(1Н-тетразол-1-ил)этан-1-она (10) (4,4 мг, выход: 9%).
Пример 9:
МС m/z (ESI): 381,2 [M-H2O+H]+
1Н ЯМР (400 МГц, CDCl3) δ8,58 (s, 1H), 5,74-5,62 (m, 2Н), 2,88 (d, J=3,8 Гц, 1H), 1,97-1,91 (m, 1H), 1,87-1,79 (m, 4Н), 1,75-1,64 (m, 3Н), 1,58-1,55 (m, 1H), 1,45-1,35 (m, 7Н), 1,34-1,24 (m, 8Н), 1,14-1,01 (m, 2Н), 0,85 (s, 3Н), 0,56-0,48 (m, 1H).
Пример 10:
МС m/z (ESI): 399,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ8,77 (s, 1H), 5,57-5,39 (m, 2Н), 2,90 (s, 1H), 2,00-1,91 (m, 1H), 1,88-1,79 (m, 4Н), 1,76-1,65 (m, 3Н), 1,59-1,56 (m, 1H), 1,46-1,37 (m, 7Н), 1,35-1,24 (m, 8Н), 1,13-0,99 (m, 2Н), 0,79 (s, 3Н), 0,58-0,49 (m, 1H).
Пример 11
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилсульфонил)пиперазин-1-ил)этан-1-она


2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилокта декагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (50 мг, 0,12 ммоль), 1-(метилсульфонил)пиперазин (60 мг, 0,36 ммоль) и карбонат калия (83 мг, 0,6 ммоль) растворяли в тетрагидрофуране (3 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилсульфонил)пиперазин-1-ил)этан-1-она (13,7 мг, выход: 23%).
МС m/z (ESI): 493,2 [М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 3,63 (br, 2Н), 3,47 (br, 4Н), 2,93 (br, 4Н), 2,82 (s, 3Н), 2,73 (s, 1H), 1,90-1,88 (m, 1H), 1,86-1,81 (m, 2Н), 1,81-1,70 (m, 3Н), 1,70-1,64 (m, 2Н), 1,57-1,50 (m, 1H), 1,41 (s, 5Н), 1,34-1,22 (m, 10Н), 1,12-0,99 (m, 1H), 0,92-0,85 (m, 1H), 0,73 (s, 3Н), 0,49-0,39 (m, 1H).
Пример 12
1-((3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он

Стадия 1: получение (3R,5R,8R,9R,10S,13S,14S,16R)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-она
Триметилсилилтрифлат (5,6 мл, 31,0 ммоль) по каплям добавляли к раствору (3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-она (3 г, 10,3 ммоль) и триэтиламина (36,0 мл, 258,2 ммоль) в толуоле (45 мл), и полученный реакционный раствор нагревали с обратным холодильником в течение 2 часов. Реакционный раствор охлаждали, промывали насыщенным бикарбонатом натрия и экстрагировали н-гексаном. Органическую фазу концентрировали досуха с получением неочищенного продукта (((3R,5R,8R,9R,10S,13S,14S)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-3,17-диил)бис(окси))бис(триметилсилана). Селективный фторсодержащий реагент (4,0 г, 11,4 ммоль) добавляли к раствору (((3R,5R,8R,9R,10S,13S,14S)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-3,17-диил)бис(окси))бис(триметилсилана) в N,N-диметилформамиде (25 мл), и перемешивали полученный реакционный раствор при комнатной температуре в течение 2 часов с получением (3R,5R,8R,9R,10S,13S,14S,16R)-16-фтор-3,13-диметил-3-((триметилсилил)окси)гексадекагидро-17Н-циклопента[а]фенантрен-17-она. Добавляли раствор фторида тетрабутиламмония в тетрагидрофуране (11,4 мл, 1 М) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор экстрагировали этилацетатом и трижды промывали насыщенным солевым раствором. Органическую фазу концентрировали досуха и полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 6:4) с получением (3R,5R,8R,9R,10S,13S,14S,16R)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-17H-циклопента[а]фенантрен-17-она (2,0 г, выход: 50,9%).
1Н ЯМР (400 МГц, CDCl3) δ 5,09 (dd, J=50,6, 7,5 Гц, 1H), 2,18-1,58 (m, 10Н), 1,54-1,01 (m, 14Н), 0,92 (s, 3Н).
19F ЯМР (376 МГц, CDCl3) δ минус 192,59.
Стадия 2: получение (3R,5R,8R,9R,10S,13S,14S,16R)-17-этилиден-16-фтор-3,13-диметилгексадекагидро-1H-циклопента[а]фенантрен-3-ола

Гидрид натрия (123 мг, 3,08 ммоль, 60 мас. %) добавляли к раствору этилтрифенилфосфонийбромида (1,2 г, 3,24 ммоль) в диметилсульфоксиде (20 мл) порциями в атмосфере азота, и перемешивали полученный реакционный раствор при комнатной температуре в течение 1 часа. Добавляли (3R,5R,8R,9R,10S,13S,14S,16R)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-17H-циклопента[а]фенантрен-17-он (200 мг, 0,65 ммоль) и нагревали реакционный раствор до 70°C в атмосфере азота в течение ночи. Реакционный раствор охлаждали и добавляли насыщенный солевой раствор. Для доведения рН до 6 добавляли 1 Н соляную кислоту и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали насыщенным солевым раствором и концентрировали досуха с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир:этилацетат = 7:3) с получением (3R,5R,8R,9R,10S,13S,14S,16R)-17-этилиден-16-фтор-3,13-диметилгексадекагидро-1H-циклопента[а]фенантрен-3-ола (80 мг, выход: 38,5%).
1Н ЯМР (400 МГц, CDCl3) δ 5,71-5,59 (m, 1H), 5,12 (dt, J=57,2, 7,0 Гц, 1H), 2,27-2,11 (m, 2Н), 1,92-1,24 (m, 21Н), 1,22-1,09 (m, 4Н), 1,06 (s, 3Н).
19F ЯМР (376 МГц, CDCl3) 5 минус 153,69.
Стадия 3: получение (3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-17-(1-гидроксиэтил)-3,13-диметилгексадекагидро-1H-циклопента[а]фенантрен-3-ола

(3R,5R,8R,9R,10S,13S,14S,16R)-17-этилиден-16-фтор-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол (80 мг, 0,25 ммоль) растворяли в безводном тетрагидрофуране (50 мл). По каплям добавляли раствор борана в тетрагидрофуране (1 М, 2,5 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение 1 часа. Реакционный раствор охлаждали ледяной водой и медленно по каплям добавляли раствор гидроксида натрия (3 М, 1 мл) при выделении большого количества газа. Медленно по каплям добавляли пероксид водорода (25%, 0,58 мл), после чего реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор экстрагировали этилацетатом, промывали раствором тиосульфата натрия и насыщенным солевым раствором и сушили с получением (3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-17-(1-гидроксиэтил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола (80 мг), который сразу же использовали на следующей стадии.
1Н ЯМР (400 МГц, CDCl3) δ 5,47-5,16 (m, 1H), 4,22-4,05 (m, 1H), 2,42-2,17 (m, 1H), 1,94-0,93 (m, 27Н), 0,87 (s, 3Н).
19F ЯМР (376 МГц, CDCl3) δ минус 178,27.
Стадия 4: получение
1-((3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она

Хлорхромат пиридиния (102 мг, 0,47 ммоль) добавляли к раствору (3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-17-(1-гидроксиэтил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола (80 мг) в ацетоне (2 мл), и полученный реакционный раствор подвергали взаимодействию при 60°C в течение 6 часов. Реакционный раствор концентрировали досуха и полученный остаток очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 5:2) с получением 1-((3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она (22 мг, выход: 25%).
1Н ЯМР (400 МГц, CDCl3) δ 5,64-5,35 (m, 1H), 2,44-2,09 (m, 6Н), 1,97-1,75 (m, 4Н), 1,74-1,00 (m, 20Н), 0,98-0,68 (m, 2Н).
19F ЯМР (376 МГц, CDCl3) δ минус 168,20.
Пример 13
1-(2-((3R,5R,8R,9R,10S,13S,14S,15R)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

Стадия 1: (3R,5R,8R,9R,10S,13S,14S,15R)-3-гидрокси-3,13,15-триметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он

3,0 М метилмагнийбромид (8,5 мл, 25,5 ммоль) и 20 мл безводного тетрагидрофурана добавляли в сухую круглодонную колбу объемом 100 мл. Реакционную систему продували азотом и охлаждали до 0°C. Добавляли йодид меди (3,94 г, 20,7 ммоль), после чего реакционный раствор перемешивали при 0°C в течение 1 часа. (3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-1,2,3,4,5,6,7,8,9,10,11,12,13,14-тетрадекагидро-17Н-циклопента[а]фенантрен-17-он (2 г, 6,9 ммоль) растворяли в 10 мл безводного тетрагидрофурана и полученный раствор медленно по каплям добавляли в реакционную систему. Реакционный раствор перемешивали в течение 3 часов, и ТСХ показала завершение реакции. Добавляли насыщенный раствор хлорида аммония, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир:этилацетат = 2:1) с получением (3R,5R,8R,9R,10S,13S,14S,15R)-3-гидрокси-3,13,15-триметилгексадекагидро-17H-циклопента[а]фенантрен-17-она (1,56 г, выход: 75%).
1Н ЯМР (400 МГц, CDCl3) δ 2,51-2,42 (m, 2Н), 2,24 (d, J=17,6 Гц, 1H), 1,89-1,63 (m, 7Н), 1,54-1,18 (m, 16Н), 1,10 (d, J=7,6 Гц, 3Н), 1,03 (s, 3Н).
Стадия 2: (3R,5R,8R,9R,10S,13S,14S,15R,Е)-17-этилиден-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол

Этилтрифенилфосфонийбромид (18,5 г, 50 ммоль) растворяли в безводном диметилсульфоксиде (50 мл) и продували реакционную систему азотом. Добавляли гидрид натрия (2,0 г, 50 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Добавляли (3R,5R,8R,9R,10S,13S,14S,15R)-3-гидрокси-3,13,15-триметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он (1,52 г, 5 ммоль), после чего реакционный раствор перемешивали при 100°C в течение ночи. Реакционный раствор охлаждали до комнатной температуры. К реакционному раствору добавляли воду (200 мл), чтобы прервать реакцию, и экстрагировали водную фазу этилацетатом (200 мл×2). Органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 50/1-3/1) с получением (3R,5R,8R,9R,10S,13S,14S,15R,Е)-17-этилиден-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола (1,37 г, выход: 86%).
Стадия 3: (3R,5R,8R,9R,10S,13S,14S,15R,17S)-17-((R)-1-гидроксиэтил)-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол

(3R,5R,8R,9R,10S,13S,14S,15R,Е)-17-этилиден-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол (1,37 мг, 4,33 ммоль) растворяли в безводном тетрагидрофуране (50 мл). Раствор охлаждали до 0°C, после чего по каплям добавляли ВН3/THF (43 мл, 43 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 3 часов, и ТСХ показала завершение реакции. Реакционный раствор охлаждали до 0°C, после чего медленно добавляли 3 М водный раствор NaOH (40 мл) с последующим добавлением Н2О2 (30 мл). Реакционный раствор перемешивали при комнатной температуре в течение 2 часов, и ТСХ показала завершение реакции. Добавляли этилацетат (50 мл), после чего последовательно промывали реакционный раствор насыщенным водным раствором Na2S2O3 (30 мл) и водой (30 мл). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта (1,37 г), который сразу же использовали на следующей стадии.
Стадия 4: 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он
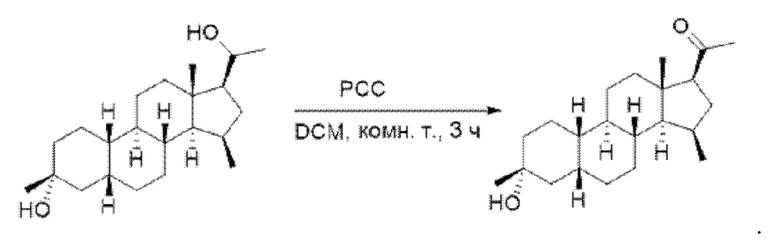
(3R,5R,8R,9R,10S,13S,14S,15R,17S)-17-((R)-1-гидроксиэтил)-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол (1,37 г, неочищенный) растворяли в дихлорметане (30 мл). Добавляли РСС (1,8 г, 8,66 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и концентрировали органическую фазу. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 1/1) с получением 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она (780 мг, выход для двух стадий: 54,3%).
1Н ЯМР (400 МГц, CDCl3) δ 2,49 (dd, J=8,8, 10,4 Гц, 1H), 2,14-2,03 (m, 5Н), 1,95-1,79 (m, 5Н), 1,69-1,06 (m, 18Н), 0,96 (d, J=7,2 Гц, 3Н), 0,78 (s, 3Н).
Стадия 5: 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он

1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (333 мг, 1 ммоль) растворяли в метаноле (10 мл). К раствору добавляли каплю бромистого водорода с последующим добавлением жидкого брома (176 мг, 1,1 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли воду (20 мл) и экстрагировали водную фазу этилацетатом (20 мл×2). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта (413 мг, неочищенный), который сразу же использовали на следующей стадии.
Стадия 6: 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил
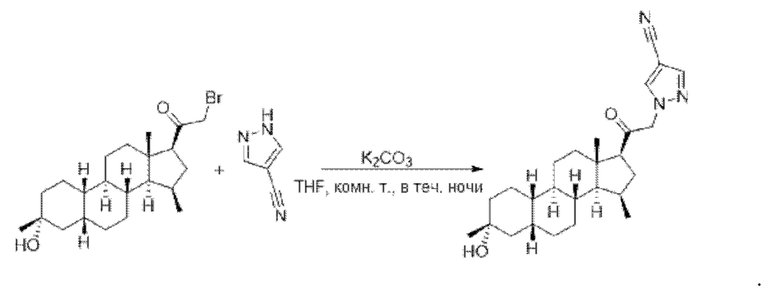
2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (82 мг, 0,2 ммоль), 1H-пиразол-4-карбонитрил (28 мг, 0,3 ммоль) и карбонат калия (54 мг, 0,3 ммоль) растворяли в безводном тетрагидрофуране (5 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила (41 мг, выход: 48%).
1Н ЯМР (400 МГц, CDCl3) δ 7,86 (s, 1H), 7,81 (s, 1H), 5,01 (d, J=17,9 Гц, 1H), 4,90 (d, J=17,9 Гц, 1H), 2,62-2,48 (m, 1H), 2,30-2,06 (m, 3Н), 2,04-1,75 (m, 7Н), 1,75-1,04 (m, 15Н), 0,99 (d, J=7,1 Гц, 3Н), 0,84 (s, 3Н).
МС m/z (ESI): 424,6 [М+Н]+.
Пример 14 и пример 15
1-(2-((3R,5R,10S,13S,16R)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-1H-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (14)
1-(2-((3R,5R,10S,13S,16S)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (15)

Пример 14 и пример 15 были синтезированы по следующей специальной схеме:

Пример 14: МС m/z (ESI): 428,3 [M+1]+.
Пример 15: МС m/z (ESI): 428,3 [M+1]+.
Пример 16 и пример 17
1-(2-((3R,5R,10S,13S,16R)-3-гидрокси-3,13-диметил-16-(трифторметил)гексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (16)
1-(2-((3R,5R,10S,13S,16S)-3-гидрокси-3,13-диметил-16-(трифторметил)гексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (17)

Пример 16 и пример 17 были синтезированы по следующей специальной схеме:

Пример 16: МС m/z (ESI): 478,3 [M+1]+.
Пример 17: МС m/z (ESI): 478,3 [M+1]+.
Пример 18
2-(4-хлор-1Н-пиразол-1-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8bR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он

В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 4-хлор-1H-пиразол, соответственно, был получен 2-(4-хлор-1Н-пиразол-1-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (21,9 мг, выход: 26%).
МС m/z (ESI): 431,2 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ7,45 (d, J=11,8 Гц, 2Н), 5,17-5,01 (m, 2Н), 2,81 (d, J=3,5 Гц, 1H), 1,99-1,91 (m, 1H), 1,86-1,79 (m, 3Н), 1,77-1,62 (m, 3Н), 1,57-1,49 (m, 3Н), 1,44-1,20 (m, 14Н), 1,12-0,96 (m, 2Н), 0,78 (s, 3Н), 0,51-0,44 (m, 1Н).
Пример 19
(2R,4aS,4bR,6aS,7S,8bR,8cR,10aR)-2-гидрокси-2,6а-диметил-N-фенилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-карбоксамид
Пример 19 был синтезирован по следующей специальной схеме:

Пример 20
1-(2-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-15-(изопропиламино)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

Пример 20 был синтезирован по следующей специальной схеме:

MC m/z (ESI): 467,3 [M+1]+.
Пример 21
1-(2-((3,5R,8R,9R,10S8,13R,14S,17S)-3-гидрокси-15-(изопропилсульфонил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

Пример 21 был синтезирован по следующей специальной схеме:

MC m/z(ESI): 516,3 [М+1]+.
Пример 23
1-(2-((2R,4aS,4bR,6aS,7S,8bR,8cR,10aR)-2-гидрокси-2-(метоксиметил)-6а-метилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

Пример 23 был синтезирован по следующей специальной схеме:

МС m/z (ESI): 452,3 [M+1]+.
Пример 24
1-((2R,4aS,4bR,6aS,7S,8bR,8cR,10aR)-2-гидрокси-2-(метоксиметил)-6а-метилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-метил-1Н-пиразол-1-ил)этан-1-он

Пример 25
1-(2-((2R,4aR,4bS,6aS,8bS,8cR,10aR)-2-гидроксиметил-4a-(метоксиметил)-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

Пример 25 был синтезирован по следующей специальной схеме:

МС m/z (ESI): 466,3 [M+1]+.
Пример 26
1-(2-((2R,4aR,4bS,6aS,8bS,8cR,10aR)-2-гидроксиметил-4а-(метоксиметил)-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрил

МС m/z (ESI): 466,3 [M+1]+.
Пример 33 и пример 34
3-циклопропил-1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (33)
5-циклопропил-1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (34)


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 5-циклопропил-1Н-пиразол-4-карбонитрил, соответственно, были получены 3-циклопропил-1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (33) (19,2 мг, выход: 21%) и 5-циклопропил-1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (34) (3,0 мг, выход: 3,3%).
Пример 33:
MC m/z (ESI): 462,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ7,73 (s, 1H), 5,14-4,98 (m, 2Н), 2,80 (d, J=2,2 Гц, 1H), 2,05-1,89 (m, 2Н), 1,86-1,78 (m, 4Н), 1,75-1,64 (m, 3Н), 1,58-1,52 (m, 2Н), 1,46-1,33 (m, 7Н), 1,33-1,20 (m, 7Н), 1,14-0,92 (m, 6Н), 0,76 (s, 3Н), 0,53-0,43 (m, 1H).
Пример 34:
MC m/z (ESI): 462,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ7,69 (s, 1H), 5,33-5,13 (m, 2Н), 2,85 (d, J=3,8 Гц, 1H), 2,00-1,92 (m, 1H), 1,86-1,79 (m, 3Н), 1,76-1,62 (m, 4H), 1,60-1,51 (m, 2H), 1,45-1,34 (m, 7H), 1,34-1,22 (m, 7H), 1,17-0,94 (m, 7H), 0,81 (s, 3Н), 0,54-0,45 (m, 1H).
Пример 37A и пример 37В
1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-3-метил-1Н-пиразол-4-карбонитрил (37А)
1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-5-метил-1Н-пиразол-4-карбонитрил (37В)

В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 3-метил-1H-пиразол-4-карбонитрил, соответственно, была получена смесь примера 37А и примера 37В (приблизительно 3:1) (25,9 мг, белое твердое вещество, выход: 39,3%). Затем смесь дополнительно разделяли с помощью препаративной хроматографии с получением 1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-3-метил-1Н-пиразол-4-карбонитрила (37А) и 1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-5-метил-1Н-пиразол-4-карбонитрила (37В).
Пример 37А: МС m/z (ESI): 436,3[М+Н]+
Пример 37В: МС m/z (ESI): 436,3[М+Н]+
Пример 40
2-((2,4-дифторфенил)амино)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он

В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 2,4-дифторанилин, соответственно, был получен 2-((2,4-дифторфенил)амино)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (3,9 мг, белое твердое вещество, выход: 3,9%).
МС m/z (ESI): 458,3[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 6,84-6,75 (m, 2Н), 6,65-6,59 (m, 1H), 4,12 (dd, J1=5,2 Гц, J2=24,8 Гц, 2Н), 3,61-3,27 (br, 1H), 2,80 (d, J=3,6 Гц, 1H), 2,01-1,77 (m, 10Н), 1,76-1,56 (m, 3Н), 1,53-1,46 (m, 1H), 1,28-1,19 (m, 10Н), 1,00-0,93 (m, 2Н), 0,73 (m, 3Н), 0,50-0,44 (m, 1H).
Пример 41 и пример 42
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(2Н-пиразоло[3,4-с]пиридин-2-ил)этан-1-он
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(1Н-пиразоло[3,4-с]пиридин-1-ил)этан-1-он


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 1Н-пиразоло[3,4-с]пиридин, соответственно, были получены 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(2Н-пиразоло[3,4-с]пиридин-2-ил)этан-1-он (41) (5,4 мг, выход: 6,2%) и 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(1Н-пиразоло[3,4-с]пиридин-1-ил)этан-1-он (42) (7,0 мг, выход: 8%).
Пример 41:
МС m/z (ESI): 448,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 9,43 (s, 1H), 8,39 (s, 1H), 8,19 (d, J=6,4 Гц, 1H), 8,08 (d, J=6,4 Гц, 1H), 5,77-5,61 (m, 2Н), 2,96 (s, 1H), 2,01-1,92 (m, 1H), 1,88-1,81 (m, 4Н), 1,74-1,69 (m, 3Н), 1,59-1,55 (m, 2Н), 1,48-1,43 (m, 5Н), 1,33-1,27 (m, 9Н), 1,10-1,05 (m, 2Н), 0,85 (s, 3Н), 0,60-0,54 (m, 1H).
Пример 42:
МС m/z (ESI): 448,3 [М+Н]+
1H ЯМР (400 МГц, CDCl3) δ 9,16 (s, 1H), 8,34 (d, J=5,8 Гц, 1H), 8,25 (s, 1H), 7,87 (d, J=5,2 Гц, 1H), 5,72-5,60 (m, 2Н), 2,96 (d, J=3,9 Гц, 1H), 2,01-1,94 (m, 1H), 1,87-1,81 (m, 4Н), 1,75-1,67 (m, 3Н), 1,58-1,52 (m, 2Н), 1,44-1,39 (m, 5Н), 1,33-1,25 (m, 9Н), 1,12-1,02 (m, 2Н), 0,86 (s, 3Н), 0,56-0,50 (m, 1H).
Пример 46
2-(4-фтор-1Н-пиразол-1-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 4-фторпиразол, соответственно, был получен 2-(4-фтор-1Н-пиразол-1-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (6,2 мг, белое твердое вещество, выход: 7,7%).
МС m/z (ESI): 415,2[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,37 (d, J=4,0 Гц, 1H), 7,32 (d, J=4,0 Гц, 1H), 5,03 (d, J=3,6 Гц, 2Н), 2,80 (d, J=3,6 Гц, 1H), 2,01-1,93 (m, 2Н), 1,85-1,80 (m, 3Н), 1,73-1,61 (m, 6Н), 1,41-1,32 (m, 9Н), 1,27 (s, 3Н), 1,12-1,02 (m, 2Н), 0,99-0,96 (m, 1H), 0,78 (s, 3Н), 0,50-0,44 (m, 1Н).
Пример 51
Этил-1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбоксилат


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и этил-1H-пиразол-4-карбоксилат, соответственно, был получен этил-1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбоксилат (29,6 мг, белое твердое вещество, выход: 43%).
MC m/z (ESI): 469,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,95 (s, 2Н), 5,32-4,99 (m, 2Н), 4,36-4,24 (m, 2Н), 2,83 (s, 1H), 1,99-1,92 (m, 1H), 1,87-1,79 (m, 3Н), 1,72-1,52 (m, 6Н), 1,49-1,16 (m, 17Н), 1,14-0,96 (m, 2Н), 0,83 (s, 3Н), 0,53-0,44 (m, 1H).
Пример 53, пример 54А и пример 54В
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(5-метокси-2Н-бензо[d][1,2,3]триазол-2-ил)этан-1-он (53)
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(6-метокси-1H-бензо[d][1,2,3]триазол-1-ил)этан-1-он (54А)
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(5-метокси-1H-бензо[d][1,2,3]триазол-1-ил)этан-1-он (54В)


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 6-метокси-1Н-бензо[d][1,2,3]триазол, соответственно, были получены 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(5-метокси-2Н-бензо[d][1,2,3]триазол-2-ил)этан-1-он (11,8 мг, выход: 13,6%) и смесь примера 54А и примера 54В (приблизительно 1:1) (34 мг, выход: 39%). Затем смесь дополнительно разделяли с помощью препаративной хроматографии с получением 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(6-метокси-1Н-бензо[d][1,2,3]триазол-1-ил)этан-1-она (54А) и 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(5-метокси-1Н-бензо[d][1,2,3]триазол-1-ил)этан-1-она (54В).
Пример 53:
МС m/z (ESI): 478,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ7,74 (d, J=10,1 Гц, 1H), 7,14-7,03 (m, 2Н), 5,73-5,59 (m, 2Н), 3,88 (s, 3Н), 2,88 (d, J=4,1 Гц, 1H), 2,01-1,93 (m, 1H), 1,86-1,78 (m, 4Н), 1,74-1,63 (m, 3Н), 1,55-1,51 (m, 1H), 1,46-1,25 (m, 15Н), 1,15-1,00 (m, 2Н), 0,88 (s, 3Н), 0,53-0,45 (m, 1H).
Пример 54А:
МС m/z (ESI): 478,3 [М+Н]+
Пример 54В:
МС m/z (ESI): 478,3 [М+Н]+
Пример 59
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(4-(трифторметил)-1Н-пиразол-1-ил)этан-1-он


2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (82 мг, 0,2 ммоль), 4-(трифторметил)-1Н-пиразол (41 мг, 0,3 ммоль) и карбонат калия (54 мг, 0,3 ммоль) растворяли в безводном тетрагидрофуране (5 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(4-(трифторметил)-1Н-пиразол-1-ил)этан-1-она (24,6 мг, выход: 26%).
1Н ЯМР (400 МГц, CDCl3) δ 7,72 (s, 2Н), 5,00 (d, J=16 Гц, 1H), 4,90 (d, J=16 Гц, 1H), 2,58-2,54 (m, 1H), 1,88-1,83 (m, 2Н), 1,69-1,58 (m, 5Н), 1,50-1,25 (m, 19Н), 0,98 (d, J=8,0 Гц, 3Н), 0,85 (s, 3Н).
МС m/z (ESI): 467,3 [М+Н]+
Пример 60
1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрил (60)

Стадия 1: получение 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрил (12,5 мг, выход: 20,2%).
МС m/z (ESI): 424,1[М+Н]+.
*Н ЯМР (400 МГц, CDCl3) δ 7,48 (d, J=2,4 Гц, 1H), 6,73 (d, J=2,4 Гц, 1H), 5,07-4,84 (m, 2Н), 2,55 (t, J=8,1 Гц, 1H), 2,33-1,06 (m, 25Н), 0,98 (d, J=7,0 Гц, 3Н), 0,84 (s, 3Н).
Пример 61 и пример 132
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-он (61)
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-он (132)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-она и 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, были получены 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-он (9,5 мг, выход: 16,3%) и 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-он (13 мг, выход: 22,3%).
Пример 61:
MC m/z (ESI): 400,2[М+Н]+.
1H ЯМР (400 МГц, CDCl3) δ 7,68 (s, 2Н), 5,29-5,15 (m, 2Н), 2,52 (t, J=8,0 Гц, 1H), 2,17-1,29 (m, 24Н), 1,15-1,05 (m, 1H), 0,97 (d, J=7,0 Гц, 3Н), 0,87 (s, 3Н).
Пример 132:
MC m/z (ESI): 400,2[М+Н]+.
1H ЯМР (400 МГц, CDCl3) δ7,77 (s, 1H), 7,65 (s, 1H), 5,32-5,02 (m, 2Н), 2,60 (t, J=9,1 Гц, 1H), 2,30-2,12 (m, 2Н), 1,99-1,27 (m, 22Н), 1,17-1,06 (m, 1H), 0,99 (d, J=6,9 Гц, 3Н), 0,84 (s, 3Н).
Пример 62
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(5-метил-2Н-тетразол-2-ил)этан-1-он (62)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(5-метил-2Н-тетразол-2-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(5-метил-2Н-тетразол-2-ил)этан-1-он (4,7 мг, выход: 7%).
MC m/z (ESI): 415,3[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 5,36 (s, 2Н), 2,57 (s, 3Н), 2,27-2,11 (m, 2Н), 2,00-198 (m, 1H), 1,87-1,83 (m, 5Н), 1,77-1,57 (m, 6Н), 1,52-1,30 (m, 12Н), 1,11 (s, 2Н), 0,98 (d, J=7,0 Гц, 3Н), 0,88 (s, 3Н).
Пример 63
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-тетразол-2-ил)этан-1-он


2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (82 мг, 0,2 ммоль), 2Н-тетразол (21 мг, 0,3 ммоль) и карбонат калия (54 мг, 0,3 ммоль) растворяли в безводном тетрагидрофуране (5 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-тетразол-2-ил)этан-1-она (15,7 мг, выход: 20%).
МС m/z (ESI): 401,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 8,58 (s, 1H), 4,46 (s, 2Н), 2,62-2,58 (m, 1H), 1,89-1,84 (m, 2Н), 1,70-1,26 (m, 23Н), 0,99 (d, J=8,0 Гц, 3Н), 0,88 (s, 3Н).
Пример 64
2-(2,4-дифторфенокси)-1-((3R,5R,8R,9R,10S,13S,14S8,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (64)

Стадия 1: получение 2-(2,4-дифторфенокси)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она (64)

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 2-(2,4-дифторфенокси)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (34 мг, выход: 45%).
МС m/z (ESI): 461,3[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 6,91-6,82 (m, 2Н), 6,77 (ddd, J=9,1, 5,3, 1,6 Гц, 1H), 4,56 (q, J=16,7 Гц, 2Н), 2,74-2,68 (m, 1H), 2,27-2,14 (m, 1H), 2,13-1,99 (m, 1H), 1,95-1,74 (m, 4Н), 1,74-1,61 (m, 3Н), 1,57 (s, 3Н), 1,52-1,35 (m, 4Н), 1,36-1,18 (m, 6Н), 1,21-1,00 (m, 3Н), 0,98 (d, J=7,2 Гц, 3Н), 0,82 (s, 3Н).
Пример 69
3-циклопропил-1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (69)

Стадия 1: получение 3-циклопропил-1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила (69)

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 3-циклопропил-1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (30 мг, выход: 41%).
МС m/z (ESI): 464,3[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,71 (s, 1H), 4,82 (q, J=17,9 Гц, 2Н), 2,51-2,46 (m, 1H), 2,27-2,18 (m, 1H), 2,19-2,08 (m, 1H), 2,04-1,91 (m, 2Н), 1,90-1,80 (m, 4Н), 1,68-1,60 (m, 4Н), 1,57 (s, 3Н), 1,51-1,29 (m, 8Н), 1,18-1,03 (m, 3Н), 1,02-0,95 (m, 7Н), 0,82 (s, 3Н).
Пример 71
1-(2-((3R,5R,8R,9R,10S,13S,14S,15S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

Стадия 1: (3R,5R,8R,9R,10S,13S,14S,15S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он

1,0 М циклопропилмагнийбромид (12,7 мл, 12,7 ммоль) и 20 мл безводного тетрагидрофурана добавляли в сухую круглодонную колбу объемом 100 мл. Реакционную систему продували азотом и охлаждали до 0°C. Добавляли йодид меди (1,97 г, 10,4 ммоль), после чего реакционный раствор перемешивали при 0°C в течение 1 часа. (3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-1,2,3,4,5,6,7,8,9,10,11,12,13,14-тетрадекагидро-17Н-циклопента[а]фенантрен-17-он (1 г, 3,5 ммоль) растворяли в 10 мл безводного тетрагидрофурана и полученный раствор медленно по каплям добавляли в реакционную систему. Реакционный раствор перемешивали в течение 3 часов, и ТСХ показала завершение реакции. Добавляли насыщенный раствор хлорида аммония, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент : петролейный эфир : этилацетат = 2:1) с получением (3R,5R,8R,9R,10S,13S,14S,15S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-она (1,11 г, выход: 96%).
1Н ЯМР (400 МГц, CDCl3) δ 2,45-2,30 (m, 2Н), 1,85-1,76 (m, 9Н), 1,59-1,52 (m, 5Н), 1,59-1,27 (m, 12Н), 1,11-0,98 (m, 1H), 0,67-0,64 (m, 1H), 0,47-0,43 (m, 1H), 0,22-0,18 (m, 1H), 0,09-0,07 (m, 1H).
Стадия 2: (3R,5R,8R,9R,10S,13S,14S,15S,Е)-15-циклопропил-17-этилиден-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол

Этилтрифенилфосфонийбромид (12,5 г, 33 ммоль) растворяли в безводном диметилсульфоксиде (50 мл) и продували реакционную систему азотом. Добавляли гидрид натрия (1,32 г, 33 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Добавляли (3R,5R,8R,9R,10S,13S,14S,15S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он (1,1 г, 3,3 ммоль), после чего реакционный раствор перемешивали при 60°C в течение ночи. Реакционный раствор охлаждали до комнатной температуры. К реакционному раствору добавляли воду (200 мл), чтобы прервать реакцию, и экстрагировали водную фазу этилацетатом (200 мл×2). Органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 50/1-3/1) с получением (3R,5R,8R,9R,10S,13S,14S,15S,Е)-15-циклопропил-17-этилиден-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола (0,67 г, выход: 59%).
1Н ЯМР (400 МГц, CDCl3) δ 5,15-5,09 (m, 1H), 2,45-2,38 (m, 1H), 2,38-2,18 (m, 2Н), 1,90-1,07 (m, 28Н), 0,86-0,78 (m, 1H), 0,56-0,50 (m, 1H), 0,38-0,32 (m, 1H), 0,12-0,02 (m, 2Н).
Стадия 3: (3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-17-((R)-1-гидроксиэтил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенатрен-3-ол
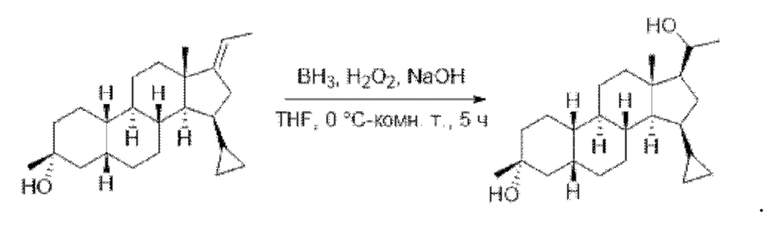
(3R,5R,8R,9R,10S,13S,14S,15S,Е)-15-циклопропил-17-этилиден-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол (0,67 мг, 1,96 ммоль) растворяли в безводном тетрагидрофуране (20 мл). Раствор охлаждали до 0°C, после чего по каплям добавляли ВН3/THF (9,8 мл, 9,8 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 3 часов, и ТСХ показала завершение реакции. Реакционный раствор охлаждали до 0°C, после чего медленно добавляли 3 М водный раствор NaOH (10 мл) с последующим добавлением пероксида водорода (8 мл). Реакционный раствор перемешивали при комнатной температуре в течение 2 часов, и ТСХ показала завершение реакции. Добавляли этилацетат (50 мл), после чего последовательно промывали реакционный раствор насыщенным водным раствором Na2S2O3 (30 мл) и водой (30 мл). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта (0,71 г), который сразу же использовали на следующей стадии.
Стадия 4: 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он

(3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-17-((R)-1-гидроксиэтил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенатрен-3-ол (0,71 г, неочищенный) растворяли в дихлорметане (20 мл). Добавляли хлорхромат пиридиния (1,27 г, 5,88 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор фильтровали и концентрировали органическую фазу. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 1/1) с получением 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она (480 мг, выход для двух стадий: 68,3%).
1Н ЯМР (400 МГц, CDCl3) δ 2,45-2,40 (m, 1H), 2,18-2,10 (m, 4Н), 1,99-1,03 (m, 24Н), 0,84-0,79 (m, 4H), 0,60-0,53 (m, 1H), 0,43-0,38 (m, 1H), 0,14-0,02 (m, 2H).
Стадия 5: 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он

1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (107 мг, 0,3 ммоль) растворяли в метаноле (5 мл). К раствору добавляли каплю бромистого водорода с последующим добавлением жидкого брома (56 мг, 0,35 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 1 часа. К реакционному раствору добавляли воду (20 мл) и экстрагировали водную фазу этилацетатом (20 мл×2). Органические фазы объединяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта (120 мг, неочищенный), который сразу же использовали на следующей стадии.
Стадия 6: 1-(2-((3R,5R,8R,9R,10S,13S,14S,15S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (60 мг, 0,14 ммоль), 1H-пиразол-4-карбонитрил (28 мг, 0,3 ммоль) и карбонат калия (54 мг, 0,3 ммоль) растворяли в безводном тетрагидрофуране (5 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор фильтровали и концентрировали фильтрат. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-(2-((3R,5R,8R,9R,10S,13S,14S,15S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила (31 мг, выход: 49%).
МС m/z (ESI): 450,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,86 (s, 1H), 7,81 (s, 1H), 5,02 (d, J=16,0 Гц, 1H), 4,92 (d, J=16,0 Гц, 1H), 2,51-2,47 (m, 1H), 2,09-1,71 (m, 9Н), 1,48-1,10 (m, 16Н), 0,90 (s, 3Н), 0,83-0,79 (m, 1H), 0,62-0,58 (m, 1H), 0,45-0,40 (m, 1H), 0,14-0,11 (m, 1H), 0,05-0,02 (m, 1H).
Пример 72
1-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрил (72)

Стадия 1: получение 1-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрила
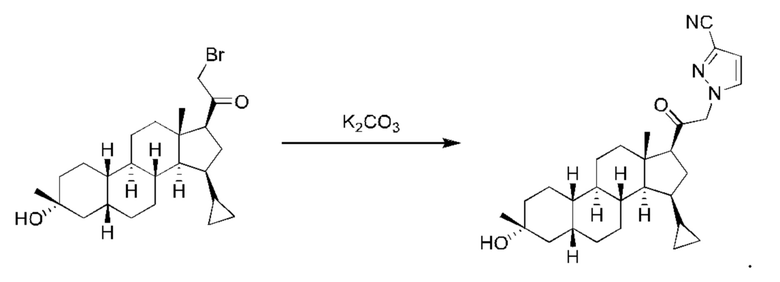
В соответствии с примером 5 в качестве исходного вещества использовали 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрил (20 мг, выход: 20%).
МС m/z (ESI): 432,2[М-H2O+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,49 (d, J=2,4 Гц, 1H), 6,73 (d, J=2,4 Гц, 1H), 4,98 (dd, J=40,0, 17,8 Гц, 2Н), 2,52-2,45 (m, 1H), 2,24-2,13 (m, 1H), 2,11-2,03 (m, 1H), 2,04-1,95 (m, 2Н), 1,90-1,82 (m, 2Н), 1,75-1,66 (m, 2Н), 1,54-1,23 (m, 16Н), 1,18-1,05 (m, 2Н), 0,93-0,79 (m, 4Н), 0,63-0,55 (m, 1H), 0,45-0,37 (m, 1H), 0,18-0,09 (m, 1H), 0,08-0,01 (m, 1H).
Пример 73 и пример 145
1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-он (73)
1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-он (145)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-она и 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-она
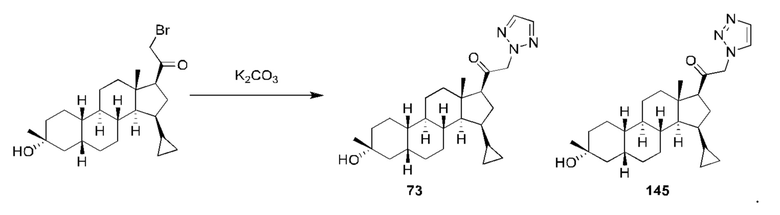
В соответствии с примером 5 в качестве исходного вещества использовали 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, были получены 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-он (7,6 мг, выход: 7,8%) и 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-он (11,6 мг, выход: 11,9%).
Пример 73:
МС m/z (ESI): 408,3[М-H2O+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,68 (s, 2Н), 5,24 (s, 2Н), 2,49-2,42 (m, 1H), 2,23-2,14 (m, 1H), 2,10-1,94 (m, 3Н), 1,91-1,81 (m, 3Н), 1,75-1,66 (m, 2Н), 1,48-1,24 (m, 15Н), 1,17-1,04 (m, 2Н), 0,94 (s, 3Н), 0,86-0,76 (m, 1H), 0,63-0,54 (m, 1H), 0,45-0,38 (m, 1H), 0,14-0,01 (m, 2H).
Пример 145:
MC m/z (ESI): 426,3[M+H]+
1H ЯМР (400 МГц, CDCl3) δ 7,78 (s, 1H), 7,67 (s, 1H), 5,22 (dd, J=47,1, 17,8 Гц, 2H), 2,59-2,50 (m, 1H), 2,25-2,15 (m, 1H), 2,14-1,98 (m, 2H), 1,96-1,79 (m, 3H), 1,76-1,58 (m, 6H), 1,56-1,25 (m, 12H), 1,22-1,04 (m, 2H), 0,91 (s, 3H), 0,87-0,77 (m, 1H), 0,62-0,55 (m, 1H), 0,47-0,36 (m, 1H), 0,18-0,02 (m, 2H).
Пример 74
1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(5-метил-2Н-тетразол-2-ил)этан-1-он (74)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(5-метил-2Н-тетразол-2-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(5-метил-2Н-тетразол-2-ил)этан-1-он (8,5 мг, выход: 9%).
MC m/z (ESI): 441,3[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 5,36 (s, 2Н), 2,57 (s, 3Н), 2,54-2,47 (m, 1H), 2,25-2,15 (m, 1H), 2,13-1,95 (m, 3Н), 1,92-1,79 (m, 3Н), 1,77-1,66 (m, 2Н), 1,50-1,24 (m, 15Н), 1,18-1,05 (m, 2Н), 0,94 (s, 3Н), 0,87-0,78 (m, 1H), 0,63-0,55 (m, 1H), 0,45-0,37 (m, 1H), 0,17-0,02 (m, 2H).
Пример 81
1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (81)
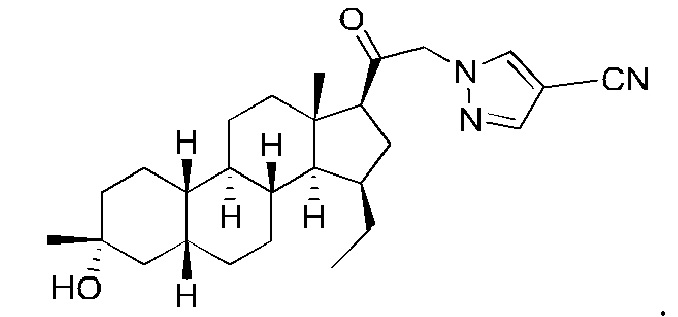
Стадия 1: (3R,5R,8R,9R,10S,13S,14S,15R)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-17H-циклопента[а]фенантрен-17-он

Тетрагидрофуран (15 мл) добавляли в трехгорлую колбу объемом 100 мл, после чего добавляли бромид этилмагния (10 мл, 1М, 10 ммоль) при 0°C в атмосфере азота с последующим добавлением йодида меди (1,6 г, 8,4 ммоль). Реакционный раствор перемешивали при 0°C в течение 1 часа. (3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-1,2,3,4,5,6,7,8,9,10,11,12,13,14-тетрадекагидро-17Н-циклопента[а]фенантрен-17-он (800 мг, 2,8 ммоль) растворяли в тетрагидрофуране (5 мл) и полученный раствор медленно по каплям добавляли к реакционному раствору, который затем перемешивали при 0°C в течение 4 часов. Добавляли насыщенный водный раствор хлорида аммония, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом (20 мл). Органическую фазу промывали солевым раствором (10 мл×3), сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 3/1) с получением (3R,5R,8R,9R,10S,13S,14S,15R)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-17H-циклопента[а]фенантрен-17-она (750 мг, выход: 84,9%).
1Н ЯМР (400 МГц, CDCl3) δ 2,37-2,30 (m, 1H), 2,15-2,02 (m, 2Н), 1,91-1,31 (m, 17Н), 1,27 (s, 3Н), 1,24-1,03 (m, 4Н), 0,98 (s, 3Н), 0,90 (t, J=7,3 Гц, 3Н).
Стадия 2: (3R,5R,8R,9R,10S,13S,14S,15R)-15-этил-17-этилиден-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол

Диметилсульфоксид (20 мл) добавляли в трехгорлую колбу объемом 100 мл, после чего в атмосфере азота добавляли этилтрифенилфосфонийбромид (8,7 г, 23,5 ммоль). Порциями добавляли гидрид натрия (60%) (940 мг, 23,5 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 1 часа. (3R,5R,8R,9R,10S,13S,14S,15R)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он (750 мг, 2,35 ммоль) растворяли в диметилсульфоксиде (5 мл) и полученный раствор медленно по каплям добавляли к реакционному раствору, который затем перемешивали в атмосфере азота при 80°C в течение 5 часов. Реакционный раствор охлаждали до комнатной температуры. Добавляли насыщенный водный раствор хлорида аммония, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом (50 мл). Органическую фазу промывали солевым раствором (20 мл×3), сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 3/1) с получением (3R,5R,8R,9R,10S,13S,14S,15R)-15-этил-17-этилиден-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола (580 мг, выход: 71,7%).
1Н ЯМР (400 МГц, CDCl3) δ 5,22-5,06 (m, 1H), 2,54-2,39 (m, 1H), 2,28-2,09 (m, 2Н), 1,96-1,80 (m, 4Н), 1,78-1,59 (m, 6Н), 1,55-1,33 (m, 11Н), 1,26 (s, 3Н), 1,20-1,08 (m, 3Н), 1,05 (s, 3Н), 0,82 (t, J=7,3 Гц, 3Н).
Стадия 3: (3R,5R,8R,9R,10S,13S,14S,15R,17R)-15-этил-17-(1-гидроксиэтил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол

В соответствии со стадией 3 примера 71 в качестве исходного вещества использовали (3R,5R,8R,9R,10S,13S,14S,15R)-15-ethyl-17-этилиден-3,13-диметилгексадекагидро-1H-циклопента[а]фенантрен-3-ол, соответственно, был получен (3R,5R,8R,9R,10S,13S,14S,15R,17R)-15-этил-17-(1-гидроксиэтил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол (600 мг, выход: 98,1%).
Стадия 4:
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он

В соответствии со стадией 4 примера 71 в качестве исходного вещества использовали (3R,5R,8R,9R,10S,13S,14S,15R,17R)-15-этил-17-(1-гидроксиэтил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол, соответственно, был получен 1-((3R, 5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (500 мг, выход: 83,8%).
1H ЯМР (400 МГц, CDCl3) δ 2,51 (t, J=8,0 Гц, 1H), 2,12 (s, 3Н), 2,00-1,30 (m, 20Н), 1,28 (s, 3Н), 1,25-1,00 (m, 4Н), 0,84 (t, J=7,2 Гц, 3Н), 0,73 (s, 3Н).
Стадия 5: 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он

В соответствии со стадией 5 примера 71 в качестве исходного вещества использовали
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекаг идро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (500 мг, выход: 81,4%).
Стадия 6: 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

В соответствии со стадией 6 примера 71 в качестве исходного вещества использовали
2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (24 мг, выход: 38,8%).
MC m/z (ESI): 438,2[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,86 (s, 1H), 7,81 (s, 1H), 5,08-4,78 (m, 2Н), 2,58 (t, J=8,0 Гц, 1H), 2,07-1,29 (m, 20Н), 1,28 (s, 3Н), 1,27-1,06 (m, 4Н), 0,85 (t, J=7,3 Гц, 3Н), 0,79 (s, 3Н).
Пример 91
2-(4-хлор-1Н-пиразол-1-ил)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (91)
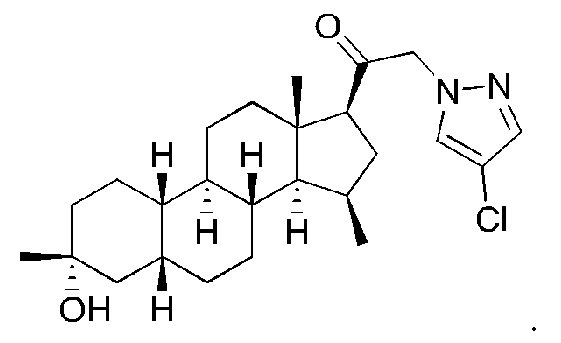
Стадия 1: получение 2-(4-хлор-1Н-пиразол-1-ил)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 2-(4-хлор-1H-пиразол-1-ил)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (10 мг, выход: 14%).
МС m/z (ESI): 433,3[М+Н]+
1H ЯМР (400 МГц, CDCl3) δ 7,45 (s, 1H), 7,41 (s, 1H), 4,86 (q, J=17,9 Гц, 2Н), 2,61-2,44 (m, 1H), 2,30-2,07 (m, 2Н), 2,02-1,91 (m, 1H), 1,86-1,80 (m, 4Н), 1,76-1,57 (m, 4Н), 1,51-1,38 (m, 6Н), 1,37-1,20 (m, 6Н), 1,20-1,03 (m, 2Н), 0,98 (d, J=7,1 Гц, 3Н), 0,83 (s, 3Н).
Пример 92 и пример 93
2-(5-фтор-2H-бензо[d][1,2,3]триазол-2-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[l,2-a]фенантрен-7-ил)этан-1-он (92)
2-(5-фтор-1H-бензо[d][1,2,3]триазол-1-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[l,2-a]фенантрен-7-ил)этан-1-он (93А) и
2-(6-фтор-1H-бензо[d][1,2,3]триазол-1-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-a]фенантрен-7-ил)этан-1-он (93В)

В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 5-фтор-2Н-бензо[d][1,2,3]триазол, соответственно, были получены 2-(5-фтор-2H-бензо[d][1,2,3]триазол-2-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (11,5 мг, белое твердое вещество, выход: 12,7%) и смесь примера 93А и примера 93В (приблизительно 3:2) (21,6 мг, белое твердое вещество, выход: 23,9%). Затем смесь дополнительно разделяли с помощью препаративной хроматографии с получением 2-(5-фтор-1H-бензо[d][1,2,3]триазол-1-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-она и 2-(6-фтор-1H-бензо[d][1,2,3]триазол-1-ил)-1-(2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-она.
Пример 92:
МС m/z (ESI): 466,2[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,87 (dd, J1=9,2 Гц, J2=4,8 Гц, 1H), 7,47 (dd, J1=9,2 Гц, J2=2,0 Гц, 1H), 7,23-7,18 (m, 1H), 5,73 (dd, J1=17,6 Гц, J2=4,4 Гц, 2Н), 2,90 (d, J=4,0 Гц, 1H), 1,99-1,96 (m, 1H), 1,85-1,81 (m, 4Н), 1,74-1,63 (m, 3Н), 1,57-1,38 (m, 10Н), 1,30-1,11 (m, 6Н), 1,14-1,01 (m, 2Н), 0,88 (s, 3Н), 0,53-0,48 (m, 1Н).
Пример 93А:
МС m/z (ESI): 466,2[М+Н]+
Пример 93В:
МС m/z (ESI): 466,2[М+Н]+
Пример 94
2-(2,4-дифторфенокси)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он

В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 2,4-дифторфенол, соответственно, был получен 2-(2,4-дифторфенокси)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (27,4 мг, белое твердое вещество, выход: 38,6%).
МС m/z (ESI): 441,2[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 6,93-6,80 (m, 2Н), 6,79-6,74 (m, 1H), 4,77 (dd, J1=16,8 Гц, J2=3,6 Гц, 2Н), 2,93 (d, J=3,2 Гц, 1H), 1,89-1,76 (m, 5Н), 1,75-1,60 (m, 3Н), 1,55-1,50 (m, 1H), 1,46-1,41 (m, 6H), 1,27-1,11 (m, 9H), 0,98-0,95 (m, 1H), 0,94-0,89 (m, 1H), 0,76 (s, 3H), 0,46-0,39 (m, 1H).
Пример 95
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-метил-1Н-пиразол-1-ил)этан-1-он

В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 4-метил, соответственно, был получен 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-метил-1Н-пиразол-1-ил)этан-1-он (12,6 мг, белое твердое вещество, выход: 15,7%).
МС m/z (ESI): 411,3[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,44 (s, 1H), 7,26 (s, 1H), 5,23 (m, 2Н), 2,83 (d, J=4,4 Гц, 1H), 2,13 (s, 3Н), 1,98-1,85 (m, 2Н), 1,83-1,69 (m, 9Н), 1,60-1,56 (m, 1H), 1,40-1,27 (m, 12Н), 1,09-1,01 (m, 2Н), 0,80 (s, 3Н), 0,48-0,45 (m, 1H).
Пример 96
2-((4-фторфенил)амино)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он

Стадия 1: получение 2-((4-фторфенил)амино)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она

2-бром-1-((3R,5R,8R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (50 мг, 0,12 ммоль) растворяли в тетрагидрофуране (3 мл). Добавляли 4-фторанилин (42 мг, 0,2 ммоль) и триэтиламин (60 мг, 0,6 ммоль) и перемешивали реакционный раствор при комнатной температуре в течение 12 часов. Реакционный раствор концентрировали и очищали полученный остаток с помощью высокоэффективной жидкостной хроматографии с получением 2-((4-фторфенил)амино)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она (7 мг, белое твердое вещество, выход: 13%).
MC m/z (ESI): 442,3[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 6,95-6,86 (m, 2Н), 6,59-6,53(m, 2Н), 3,95-3,85(m, 2Н), 2,55-2,47 (m, 1H), 2,25-2,15 (m, 2Н), 1,90-1,80 (m, 5Н), 1,75-1,25 (m, 18Н), 1,00 (d, J=8,0 Гц, 3Н), 0,81 (s, 3Н).
Пример 97
2-((4-фторфенил)амино)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и п-фторанилин, соответственно, был получен 2-((4-фторфенил)амино)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (14,9 мг, желтое масло, выход: 26,7%).
МС m/z (ESI): 440,2[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,00-6,95 (m, 2Н), 6,91-6,83 (m, 2Н), 4,19 (dd, J1=20,0 Гц, J2=2,8 Гц, 2Н), 2,80 (d, J=4,0 Гц, 1H), 1,92-1,58 (m, 14Н), 1,45-1,40 (m, 8Н), 1,27 (s, 3Н), 1,09-0,91 (m, 2Н), 0,69 (s, 3Н), 0,48-0,43 (m, 1H).
Пример 98
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(1Н-имидазол-1-ил)этан-1-он


В соответствии с примером 63 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и имидазол, соответственно, был получен 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(1Н-имидазол-1-ил)этан-1-он (23,3 мг, белое твердое вещество, выход: 34,4%).
МС m/z (ESI): 397,2[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,48 (s, 1H), 7,12 (s, 1H), 6,88 (s, 1H), 4,98-4,87 (m, 2Н), 2,82 (d, J=2,8 Гц, 1H), 1,94-1,91 (m, 1H), 1,85-1,81 (m, 4Н), 1,70-1,53 (m, 10Н), 1,41-1,28 (ш, 9Н), 1,13-0,95 (m, 2Н), 0,78 (s, 3Н), 0,52-0,46 (m, 1H).
Пример 99 и пример 100
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4,5,6,7-тетрагидро-1Н-индазол-1-ил)этан-1-он
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4,5,6,7-тетрагидро-2Н-индазол-2-ил)этан-1-он


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 4,5,6,7-тетрагидро-2Н-индазол, соответственно, были получены 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4,5,6,7-тетрагидро-1Н-индазол-1-ил)этан-1-он (99) (5,5 мг, белое твердое вещество, выход: 6,8%) и 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4,5,6,7-тетрагидро-2Н-индазол-2-ил)этан-1-он (100) (3,1 мг, белое твердое вещество, выход: 3,8%).
Пример 99:
MC m/z (ESI): 415,3[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,12 (s, 1H), 5,14-5,05 (m, 2Н), 2,80 (d, J=4,0 Гц, 1H), 2,69 (t, J=6,0 Гц, 2Н), 2,56 (t, J=6,0 Гц, 2Н), 1,97-1,93 (m, 1H), 1,85-1,61 (m, 12Н), 1,55-1,52 (m, 2Н), 1,43-1,21 (m, 13Н), 1,11-0,94 (m, 2H), 0,79 (s, 3Н), 0,48-0,42 (m, 1H).
Пример 100:
MC m/z (ESI): 415,3[M+H]+
1H ЯМР (400 МГц, CDCl3) δ 7,50 (s, 1H), 5,74-5,35 (m, 2H), 2,89 (d, J=4,0 Гц, 1H), 2,58 (t, J=6,0 Гц, 2H), 2,48 (t, J=6,0 Гц, 2H), 1,96-1,91 (m, 1H), 1,80-1,72 (m, 8H), 1,40-1,22 (m, 19H), 1,12-0,99 (m, 2H), 0,82 (s, 3H), 0,51-0,45 (m, 1H).
Пример 101
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(5-метил-1Н-тетразол-1-ил)этан-1-он


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 5-метил-1Н-4-тетразол, соответственно, был получен 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(5-метил-1Н-тетразол-1-ил)этан-1-он (19 мг, белое твердое вещество, выход: 23,5%).
МС m/z (ESI): 413,2[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 5,58 (dd, J1=17,6 Гц, J2=7,6 Гц, 2Н), 2,86 (d, J=4,0 Гц, 1H), 2,57 (s, 3Н), 1,96-1,93 (m, 1H), 1,89-1,61 (m, 8Н), 1,55-1,22 (m, 14Н), 1,14-0,97 (m, 3Н), 0,84 (s, 3Н), 0,47-0,53 (m, 1Н).
Пример 102
2-(4-(азетидин-1-карбонил)-1Н-пиразол-1-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и азетидин-1-ил(1Н-пиразол-4-ил)метанон, соответственно, был получен 2-(4-(азетидин-1-карбонил)-1Н-пиразол-1-ил)-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он (10,0 мг, выход: 14,3%).
МС m/z (ESI): 480,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,85-7,80 (m, 1H), 7,80-7,74 (m, 1H), 5,20-5,05 (m, 2Н), 4,53-4,10 (m, 4Н), 2,82 (d, J=3,3 Гц, 1H), 2,44-2,31 (m, 2Н), 1,98-1,90 (m, 1H), 1,86-1,79 (m, 3Н), 1,74-1,64 (m, 3Н), 1,57-1,53 (m, 2Н), 1,44-1,24 (m, 15Н), 1,13-0,97 (m, 2Н), 0,79 (s, 3Н), 0,51-0,44 (m, 1H).
Пример 103
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-нитро-1Н-пиразол-1-ил)этан-1-он


В соответствии с примером 5 в качестве исходных веществ использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он и 4-нитро-1Н-пиразол, соответственно, был получен 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-нитро-1Н-пиразол-1-ил)этан-1-он (32,5 мг, выход: 60%).
МС m/z (ESI): 424,2 [M+H-H2O]+
1Н ЯМР (400 МГц, CDCl3) δ8,20 (s, 1H), 8,09 (s, 1H), 5,26-5,09 (m, 2Н), 2,85 (s, 1H), 1,98-1,91 (m, 1H), 1,87-1,79 (m, 4Н), 1,74-1,65 (m, 3Н), 1,56-1,52 (m, 2Н), 1,47-1,35 (m, 7Н), 1,34-1,24 (m, 7Н), 1,13-0,97 (m, 2Н), 0,79 (s, 3Н), 0,55-0,47 (m, 1H).
Пример 104
(3R,5R,8R,9R,10S,13S,14S,16R,178)-17-ацетил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-16-карбонитрил (104)

Стадия 1: получение
(3R,5R,8R,9R,10S,13S,14S,16R,17S)-17-ацетил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-16-карбонитрила

1-((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (270 мг, 0,853 ммоль), хлорид аммония (250 мг, 4,69 ммоль) и 18-краун-6 (23 мг, 0,853 ммоль) добавляли к смешанному раствору диметилсульфоксида (7 мл) и воды (2 мл) при 85°C с последующим добавлением смешанного раствора цианида натрия (230 мг, 4,69 ммоль), диметилсульфоксида (4 мл) и воды (1 мл). Реакционный раствор перемешивали при 85°C в течение 16 часов. Добавляли воду (30 мл), после чего экстрагировали реакционный раствор этилацетатом (20 мл×3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении до сухости, и полученный остаток очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат = 1:1) с получением (3R,5R,8R,9R,10S,13S,14S,16R,17S)-17-ацетил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-16-карбонитрила в виде белого твердого вещества (250 мг, выход: 85%).
Пример 105
1-(2-((3R,5R,8R,9R,10S,13S,14R,17S)-3-гидрокси-3,13-диметил-15-(нитрометил)гекс адекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

Пример 105 был синтезирован по следующей специальной схеме:

MC m/z (ESI): 469,3 [M+1]+.
Пример 121
3-циклопропил-1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил

Стадия 1: получение 3-циклопропил-1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он, соответственно, был получен 3-циклопропил-1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (19,2 мг, выход: 21%).
МС m/z (ESI): 462,3 [М+Н]+
1H ЯМР (400 МГц, CDCl3) δ 7,73 (s, 1Н), 5,13-4,95 (m, 2Н), 2,80 (d, J=2,2 Гц, 1Н), 2,04-1,89 (m, 2Н), 1,86-1,79 (m, 3Н), 1,76-1,63 (m, 3Н), 1,58-1,49 (m, 3Н), 1,46-1,21 (m, 14Н), 1,12-0,93 (m, 6Н), 0,76 (s, 3Н), 0,51-0,43 (m, 1Н).
Пример 122
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилтио)-1Н-пиразол-1-ил)этан-1-он(122)

Стадия 1: получение 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилтио)-1Н-пиразол-1-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он, соответственно, был получен 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилтио)-1Н-пиразол-1-ил)этан-1-он (8,7 мг, выход: 16%).
МС m/z (ESI): 443,2 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,54 (s, 1Н), 7,45 (s, 1Н), 5,17-5,00 (m, 2Н), 2,81 (d, J=3,8 Гц, 1Н), 2,35 (s, 3Н), 1,99-1,91 (m, 1Н), 1,88-1,76 (m, 4Н), 1,73-1,63 (m, 3Н), 1,55-1,50 (m, 1Н), 1,43-1,18 (m, 15Н), 1,12-0,97 (m, 2Н), 0,79 (s, 3Н), 0,50-0,41 (m, 1Н).
Пример 123 и пример 124
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилсульфинил)-1Н-пиразол-1-ил)этан-1-он (123) и 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилсульфонил)-1Н-пиразол-1-ил)этан-1-он(124)

Стадия 1: получение 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилсульфинил)-1Н-пиразол-1-ил)этан-1-она и 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилсульфонил)-1Н-пиразол-1-ил)этан-1-она
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-a]фенантрен-7-ил)-2-(4-(метилтио)-1H-пиразол-1-ил)этан-1-он (80 мг, 0,18 ммоль) растворяли в дихлорметане (10 мл) и охлаждали раствор до минус 78°С. Добавляли м-хлорпероксибензойную кислоту (55 мг, 0,27 ммоль) и перемешивали реакционный раствор в течение 1 часа. Добавляли воду (10 мл), после чего промывали реакционный раствор насыщенным водным раствором бикарбоната натрия (10 мл). Органическую фазу отделяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилсульфинил)-1Н-пиразол-1-ил)этан-1-она (17,2 мг, выход: 20%) и 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(метилсульфонил)-1Н-пиразол-1-ил)этан-1-она (20,4 мг, выход: 25%).
Пример 123:
МС m/z (ESI): 441,3 [M-H2O+H]+
1Н ЯМР (400 МГц, CDCl3) δ 7,85 (s, 1Н), 7,83 (s, 1Н), 5,30-5,09 (m, 2Н), 2,91 (s, 3Н): 2,85-2,82 (m, 1Н), 1,98-1,90 (m, 1Н), 1,87-1,78 (m, 3Н), 1,75-1,50 (m, 8Н), 1,47-1,21 (m, 12Н), 1,13-0,96 (m, 2Н), 0,79 (s, 3Н), 0,54-0,45 (m, 1Н).
Пример 124:
МС m/z (ESI): 457,2 [M-H2O+H]+
1Н ЯМР (400 МГц, CDCl3) δ 7,94 (s, 1Н), 7,87 (s, 1Н), 5,26-5,10 (m, 2Н), 3,14 (s, 3Н): 2,85 (d, J=2,7 Гц, 1Н), 1,98-1,91 (m, 1Н), 1,87-1,79 (m, 3Н), 1,76-1,64 (m, 3Н), 1,59-1,52 (m, 1Н), 1,50-1,18 (m, 16Н), 1,15-0,96 (m, 2Н), 0,79 (s, 3Н), 0,55-0,46 (m, 1Н).
Пример 125
3-фтор-4-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтокси)бензонитрил (125)

Стадия 1: получение 3-фтор-4-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтокси)бензонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он, соответственно, был получен 3-фтор-4-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтокси)бензонитрил (12,5 мг, выход: 18%).
МС m/z (ESI): 44S,2 [M-H2O+H]+
1Н ЯМР (400 МГц, CDCl3) δ 7,43-7,33 (m, 2Н), 6,91-6,84 (m, 1Н), 4,91 (s, 2Н), 2,96-2,88 (m, 1Н), 1,90-1,76 (m, 4Н), 1,75-1,62 (m, 3Н), 1,55-1,26 (m, 17Н), 1,12-1,04 (m, 1Н), 0,98-0,92 (m, 1Н), 0,78 (s, 3Н), 0,50-0,41 (m, 1Н).
Пример 126
5-фтор-2-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтокси)бензонитрил (126)

Стадия 1: получение 5-фтор-2-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтокси)бензонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он, соответственно, был получен 5-фтор-2-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтокси)бензонитрил (11,4 мг, выход: 10%).
МС m/z (ESI): 44S,2 [M-H2OH]+
1Н ЯМР (400 МГц, CDCl3) δ 7,34-7,28 (m, 1Н), 7,25-7,18 (m, 1Н), 6,78-6,72 (m, 1Н), 4,91-4,78 (m, 2Н), 2,99 (d, J=3,3 Гц, 1Н), 1,91-1,78 (m, 4Н), 1,76-1,64 (m, 3Н), 1,57-1,25 (m, 17Н), 1,08-0,92 (m, 2Н), 0,78 (s, 3Н), 0,50-0,40 (m, 1Н).
Пример 127
1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрил(127)

Стадия 1: получение 1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он, соответственно, был получен 1-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитр ил (1S,0 мг, выход: 31,8%).
МС m/z (ESI): 429,2 [M-H2O+H]+
1Н ЯМР (400 МГц, CDCl3) δ 7,21 (s, 1Н), 5,38 (q, J=18,0 Гц, 2Н), 2,87 (d, J=3,0 Гц, 1Н), 1,97-1,91 (m, 1Н), 1,88-1,75 (m, 4Н), 1,76-1,64 (m, 3Н), 1,58-1,51 (m, 1Н), 1,48-1,26 (m, 15Н), 1,15-0,99 (m, 2Н), 0,83 (s, 3Н), 0,58-0,48 (m, 1Н).
Пример 128
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(оксазол-2-ил)-1Н-пиразол-1-ил)этан-1-он (128)

Стадия 1: получение 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(оксазол-2-ил)-1Н-пиразол-1-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он, соответственно, был получен 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(4-(оксазол-2-ил)-1Н-пиразол-1-ил)этан-1-он (16,0 мг, выход: 14%).
МС m/z (ESI): 464,3 [М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 7,89 (s, 1Н), 7,79 (s, 1Н), 7,73 (s, 1Н), 7,13 (s, 1Н), 5,27-5,13 (m, 2Н), 2,85 (d, J=4,0 Гц, 1Н), 2,01-1,93 (m, 1Н), 1,87-1,65 (m, ПН), 1,58-1,50 (m, 1Н), 1,44-1,22 (m, 11Н), 1,14-0,98 (m, 2Н), 0,81 (s, 3Н), 0,53-0,44 (m, 1Н).
Пример 129
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(пиридазин-4-илокси)этан-1-он (129)

Стадия 1: получение 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(пиридазин-4-илокси)этан-1-она
В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он, соответственно, был получен 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-(пиридазин-4-илокси)этан-1-он (16,0 мг, выход: 26%).
MC m/z (ESI): 425,3 [M+H]+
1Н ЯМР (400 МГц, CDCl3) δ 7,88 (s, 1Н), 7,61 (d, J=6,8 Гц, 1Н), 6,53 (d, J=6,8 Гц, 1Н), 5,17-4,85 (m, 2Н), 2,83 (s, 1Н), 1,99-1,90 (m, 1Н), 1,88-1,78 (m, 3Н), 1,76-1,54 (m, 10Н), 1,46-1,25 (m, 10Н), 1,14-0,95 (m, 2Н), 0,79 (s, 3Н), 0,55-0,46 (m, 1Н).
Пример 130
1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-((2-(трифторметил)пиримидин-5-и л)окси)этан-1-он

Стадия 1: получение 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-((2-(трифторметил)пиримидин-5-ил)окси) этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он, соответственно, был получен 1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6a-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-((2-(трифторметил)пиримидин-5-ил)окси)этан-1-он (23,0 мг, выход: 38,3%).
MC m/z (ESI): 493,2[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ S,45 (s, 2Н), 5,01 (s, 2Н), 2,86 (s, 1Н), 1,89 (m, 1Н), 1,83 (m, 4Н), 1,75 (dm, 1Н), 1,68 (m, 2Н), 1,57 (m, 1Н), 1,38 (m, 8Н), 1,31 (m, 2Н), 1,28 (s, 3Н), 1,26-1,20 (m, 1Н), 1,13-1,03 (m, 1Н), 0,96 (m, 1Н), 0,80 (s, 3Н), 0,48 (m, 1Н).
Пример 131
1-((3R,5R,8R,9R,10S,13S,14S,15R,178)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-он (131)

Стадия 1: 1-((3R,5R8,R9,R10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-он

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-он (20,5 мг, выход: 30,1%).
МС m/z (ESI): 467,2[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,49-7,43 (m, 1Н), 6,59 (d, J=2,4 Гц, 1Н), 5,14-4,85 (m, 2Н), 2,54 (t, J=S,1 Гц, 1Н), 2,26-2,08 (m, 2Н), 2,02-1,93 (m, 1Н), 1,90-1,79 (m, 4Н), 1,74-1,59 (m, 3Н), 1,57-1,19 (m, 14Н), 1,21-1,04 (m, 1Н), 0,98 (d, J=7,0 Гц, 3Н), 0,84 (s, 3Н).
Пример 133
2-(4-(азетидин-1-карбонил)-1Н-пиразол-1-ил)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он(133)

Стадия 1: 2-(4-(азетидин-1-карбонил)-1Н-пиразол-1-ил)-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,178)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 2-(4-(азетидин-1-карбонил)-1Н-пиразол-1-ил)-1-((3R,5R,8R,9R,10S,13S,14S,15R,178)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (12,0 мг, выход: 21%).
МС m/z (ESI): 482,3[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,78 (s, 2Н), 5,00-4,77 (m, 2Н), 4,38-4,25 (m, 4Н), 2,54 (t, J=7,6 Гц, 1Н), 2,43-2,32 (m, 2Н), 2,26-2,08 (m, 2Н), 1,98-1,96 (m, 1Н), 1,88-1,83 (m, 3Н), l,69-l,62(m, 5Н), 1,48-1,42 (m, 4Н), 1,38-1,26 (m, 9Н), 1,16-1,07 (m, 2Н), 0,98 (d, J=7,0 Гц, 3Н), 0,84 (s, 3Н).
Пример 134
3-хлор-1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,178)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (134)

Стадия 1: получение 3-хлор-1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,178)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен продукт 3-хлор-1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (37 мг, выход: 55,3%).
МС m/z (ESI): 456,2[М-Н]-.
1Н ЯМР (400 МГц, CDCl3) δ 7,81 (s, 1Н), 5,03-4,75 (m, 2Н), 2,54 (t, J=S,0 Гц, 1Н), 2,31-2,13 (m, 2Н), 1,93-1,06 (m, 23Н), 0,99 (d, J=7,1 Гц, 3Н), 0,83 (s, 3Н).
Пример 135
1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрил (135)

Стадия 1: получение 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен продукт 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрил (18 мг, выход: 27,5%).
MC m/z (ESI): 447,2[М-Н]-.
1Н ЯМР (400 МГц, CDCl3) δ 7,20 (s, 1Н), 5,23-5,07 (m, 2Н), 2,68-2,52 (m, 1Н), 2,28-1,36 (m, 21Н), 1,28 (s, 3Н), 1,18-1,08 (m, 1Н), 1,00 (d, J=6,9 Гц, 3Н), 0,88 (s, 3Н).
Пример 136
3-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)тиазолидин-2,4-дион (136)

Стадия 1: 3-(2-((3R,5R,8R,9R,10S,13S,14S,15R,178)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)тиазолидин-2,4-диона

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,178)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 3-(2-((3R,5R,8R,9R,10S,13S,14S,15R,178)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)тиазолидин-2,4-дион (24,0 мг, выход: 31,5%).
MC m/z (ESI): 430,2 [M-H2O+H]+
1Н ЯМР (400 МГц, CDCl3) δ 4,37 (s, 2Н), 4,04-3,98 (m, 2Н), 2,56-2,49 (m, 1Н), 2,22-2,03 (m, 2Н), 1,91-1,81 (m, 4Н), 1,73-1,61 (m, 3Н), 1,47-1,26 (m, 15Н), 1,17-1,05 (m, 2Н), 0,97 (d, J=7,1 Гц, 3Н), 0,81 (s, 3Н).
Пример 137
1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,178)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрил (137)

Стадия 1: получение 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрила
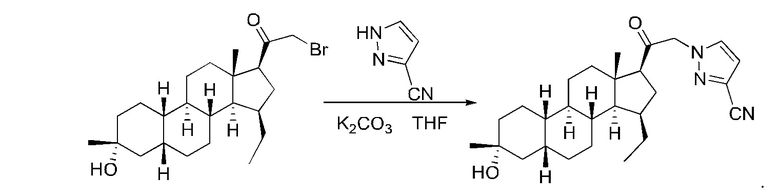
В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен продукт 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитр ил (16 мг, выход: 25,9%).
МС m/z (ESI): 43S,2[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,49 (d, J=2,5 Гц, 1Н), 6,73 (d, J=2,4 Гц, 1Н), 5,22-4,78 (m, 2Н), 2,57 (t, J=8,0 Гц, 1Н), 2,15-1,30 (m, 20Н), 1,28 (s, 3Н), 1,16-1,03 (m, 4Н), 0,84 (t, J=7,3 Гц, 3Н), 0,79 (s, 3Н).
Пример 138
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13,15-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-он(138)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13,15-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен продукт 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13,15-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-он (23 мг, выход: 33,9%).
MC m/z (ESI): 481,3[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,47 (d, J=4,0 Гц, 1Н), 6,59 (d, J=4,0 Гц 1Н), 5,07-4,89 (m, 2Н), 2,56 (t, J=9,3 Гц, 1Н), 2,20-1,29 (m, 20Н),1,28 (s, 3Н), 1,27-1,03 (m, 4Н),0,84 (t, J=7,3 Гц, 3Н), 0,80 (s, 3Н).
Пример 139
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(5-метил-2Н-тетразол-2-ил)этан-1-он (139)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(5-метил-2Н-тетразол-2-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,178)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен продукт 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(5-метил-2Н-тетразол-2-ил)этан-1-он (13,5 мг, выход: 22,3%).
МС m/z (ESI): 429,3[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 5,39-5,29 (m, 2Н), 2,63-2,57 (m, 1Н), 2,56 (s, 3Н), 2,10-1,30 (m, 20Н), 1,28 (s, 3Н), 1,27-1,05 (m, 4Н), 0,87-0,81 (m, 6Н).
Пример 140 и пример 141
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-он (140)
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-он(141)

Стадия 1: получение 1-((3R, 5R, 8R, 9R, 10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-д иметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-она и 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-д иметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-она
В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, были получены продукты 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-он (17 мг, выход: 29,1%) и 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-1,2,3-триазол-2-ил)этан-1-он (9,2 мг, выход: 15,7%).
Пример 140:
МС m/z (ESI): 414,3[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,77 (s, 1Н), 7,67 (s, 1Н), 5,37-5,09 (m, 2Н), 2,62 (t, J=9,2 Гц, 1Н), 2,28-1,20 (m, 25Н), 1,16-1,05 (m, 2Н), 0,85 (t, J=7,3 Гц, 3Н), 0,80 (s, 3Н). Пример 141:
МС m/z (ESI): 414,3[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,68 (s, 2Н), 5,28-5,20 (m, 2Н), 2,54 (t, J=8,0 Гц, 1Н), 1,99-1,23 (m, 25Н), 1,13-1,06 (m, 2Н), 0,88-0,78 (m, 6Н).
Пример 142
1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,178)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрил (142)

Стадия 1: 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен продукт 1-(2-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрил (5 мг, выход: 9,2%).
МС m/z (ESI): 463,2[М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,21 (s, 1Н), 5,29-5,02 (m, 2Н), 2,61 (t, J=9,3 Гц, 1Н), 2,24-1,34 (m, 19Н), 1,28 (s, 3Н), 1,26-1,02 (m, 5Н), 0,92-0,76 (m, 6Н).
Пример 143
1-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрил (143)

Стадия 1: получение 1-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3,5-дикарбонитрил (19,6 мг, выход: 18%).
МС m/z (ESI): 473,2[М-H]-
1Н ЯМР (400 МГц, CDCl3) δ 7,20 (s, 1Н), 5,24-5,09 (m, 2Н), 2,58-2,50 (m, 1Н), 2,26-2,07 (m, 2Н), 2,06-1,95 (m, 2Н), 1,90-1,80 (m, 2Н), 1,78-1,66 (m, 2Н), 1,58-1,22 (m, 16Н), 1,19-1,06 (m, 2Н), 0,94 (s, 3Н), 0,87-0,78 (m, 1Н), 0,64-0,56 (m, 1Н), 0,45-0,39 (m, 1Н), 0,18-0,02 (m, 2Н).
Пример 144
1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13,15-диметил гексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-он (144)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13,15-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13,15-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(3-(трифторметил)-1Н-пиразол-1-ил)этан-1-он (1S,0 мг, выход: 23%).
МС m/z (ESI): 491,3[М-Н]-
1Н ЯМР (400 МГц, CDCl3) δ 7,47 (d, J=2,0 Гц, 1Н), 6,59 (d, J=2,0 Гц, 1Н), 5,08-4,90 (m, 2Н), 2,53-2,42 (m, 1Н), 2,24-1,94 (m, 4Н), 1,91-1,79 (m, 3Н), 1,78-1,66 (m, 2Н), 1,52-1,22 (m, 15Н), 1,18-1,02 (m, 2Н), 0,91 (s, 3Н), 0,88-0,76 (m, 1Н), 0,65-0,54 (m, 1Н): 0,48-0,36 (m, 1Н), 0,18-0,00 (m, 2Н).
Пример 146
1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-тетразол-2-ил)этан-1-он (146)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-тетразол-2-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-тетразол-2-ил)этан-1-он (12,9 мг, выход: 13,2%).
MC m/z (ESI): 409,3[М-Н2О+Н]+
1Н ЯМР (400 МГц, CDCl3) δ S,57 (s, 1Н), 5,46 (s, 2Н), 2,58-2,47 (m, 1Н), 2,24-1,94 (m, 4Н), 1,93-1,80 (m, 3Н), 1,77-1,66 (m, 2Н), 1,50-1,21 (m, 15Н), 1,18-1,06 (m, 2Н), 0,95 (s, 3Н), 0,87-0,78 (m, 1Н), 0,64-0,55 (m, 1Н), 0,46-0,38 (m, 1Н), 0,17-0,01 (m, 2Н).
Пример 147
3-хлор-1-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил(147)

Стадия 1: получение 3-хлор-1-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадека гидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 3-хлор-1-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитр ил (13,5 мг, выход: 17,4%).
МС m/z (ESI): 482,2[М-H]-
1Н ЯМР (400 МГц, CDCl3) δ 7,82 (s, 1Н), 5,01-4,76 (m, 2Н), 2,55-2,41 (m, 1Н): 2,22-1,94 (m, 4Н), 1,91-1,77 (m, 3Н), 1,76-1,66 (m, 2Н), 1,56-1,24 (m, 15Н), 1,18-1,04 (m, 2Н), 0,90 (s, 3Н), 0,87-0,75 (m, 1Н), 0,64-0,53 (m, 1Н), 0,46-0,38 (m, 1Н), 0,17-0,02 (m, 2Н).
Пример 148
3-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)тиазолидин-2,4-дион(148)

Стадия 1: получение 3-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)тиазолидин-2,4-диона

В соответствии с примером 5 в качестве исходного вещества использовали 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 3-(2-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтил)тиазолидин-2,4-дион (10,0 мг, выход: 13%).
МС m/z (ESI): 456,2 [М-Н2О+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 4,38 (s, 2Н), 4,04 (s, 2Н), 2,51-2,43 (m, 1Н), 2,24-2,00 (m, 4Н), 1,91-1,80 (m, 3Н), 1,75-1,67 (m, 2Н), 1,49-1,27 (m, 15Н), 1,17-1,05 (m, 2Н), 0,88 (s, 3Н), 0,84-0,78 (m, 1Н), 0,62-0,53 (m, 1Н), 0,46-0,36 (m, 1Н), 0,15-0,01 (m, 2Н).
Пример 149
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-тетразол-2-ил)этан-1-он (149)

Стадия 1: получение (3R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-тетразол-2-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен продукт 1-(3R,5R,8R,9R,10S,13S,14S,15R,17S)-15-этил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-(2Н-тетразол-2-ил)этан-1-он (11 мг, белое твердое вещество, выход: 18,8%).
МС m/z (ESI): 397,2[М-H2O+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 8,57 (s, 1Н), 5,50-5,41 (m, 2Н), 2,62 (t, J=8,5 Гц, 1Н), 2,29-1,30 (m, 20Н), 1,28 (s, 3Н), 1,27-1,05 (m, 4Н), 0,85-0,82 (m, 6Н).
Пример 150
1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-((2-(трифторметил)пиримидин-5-ил)окси)этан-1-он (150)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-((2-(трифторметил)пиримидин-5-ил)окси)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-((3R,5R,8R,9R,10S,13S,14S,15R,17S)-3-гидрокси-3,13,15-триметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-((2-(трифторметил)пиримидин-5-ил)окси)этан-1-он (16,1 мг, выход: 19%).
МС m/z (ESI): 477,3[М-H2O+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 8,44 (s, 2Н), 4,85-4,71 (m, 2Н), 2,67-2,57 (m, 1Н), 2,30-2,10 (m, 2Н), 1,93-1,81 (m, 4Н), 1,74-1,61 (m, 3Н), 1,48-1,23 (m, 15Н), 1,18-1,06 (m, 2Н), 1,00 (d, J=7,1 Гц, 3Н), 0,87 (s, 3Н).
Пример 151
1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-((2-(трифторметил)пиримидин-5-ил)окси)этан-1-он (151)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-((2-(трифторметил)пиримидин-5-ил)окси)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 1-((3R,5R,8R,9R,10S,13S,14S,15S,17S)-15-циклопропил-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-((2-(трифторметил)пиримидин-5-ил)окси)этан-1-он (22,9 мг, выход: 27,6%).
МС m/z (ESI): 503,3[М-H2O+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 8,44 (s, 2Н), 4,87-4,69 (m, 2Н), 2,62-2,50 (m, 1Н), 2,25-1,96 (m, 3Н), 1,92-1,84 (m, 3Н), 1,77-1,66 (m, 2Н), 1,54-1,23 (m, 15Н), 1,18-1,04 (m, 2Н), 0,93 (s, 3Н), 0,87-0,78 (m, 1Н), 0,65-0,56 (m, 1Н), 0,49-0,38 (m, 1Н), 0,20-0,02 (m, 2Н).
Пример 152
3-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)тиазолидин-2,4-дион (152)

Стадия 1: получение 3-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)тиазолидин-2,4-диона

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)этан-1-он, соответственно, был получен 3-(2-((2R,4aS,4bR,6aS,7S,7aS,8aR,8bR,8cR,10aR)-2-гидрокси-2,6а-диметилоктадекагидроциклопропа[4,5]циклопента[1,2-а]фенантрен-7-ил)-2-оксоэтил)тиазолидин-2,4-дион (7,1 мг, выход: 9,3%).
МС m/z (ESI): 446,2[М+Н]+
1Н ЯМР (400 МГц, CDCl3) δ 4,66-4,50 (m, 2Н), 4,04 (s, 2Н), 2,78 (d, J=4,0 Гц, 1Н), 1,98-1,92 (m, 1Н), 1,85-1,52 (m, 11Н), 1,44-1,24 (m, 12Н), 1,13-0,97 (m, 2Н), 0,77 (s, 3Н), 0,49-0,41 (m, 1Н).
Пример 157
1-((8S,9S,13S,14S,17S)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)этан-1-он (157)

Стадия 1: получение (8R,9S,13S,14S)-3-(бензилокси)-13-метил-6,7,8,9,11,12,13,14,15,16-декагидро-17Н-циклопента[а]фенантрен-17-она

(8R,9S,13S,14S)-3-гидрокси-13-метил-6,7,8,9,11,12,13,14,15,16-декагидро-17Н-циклопента[а]фенантрен-17-он (4,1 г, 15 ммоль) и раствор дихлорметана/метанола (1/1, 50 мл) добавляли в трехгорлую колбу объемом 100 мл с последующим добавлением карбоната калия (6,2 г, 45 ммоль) и бензилбромида (7,6 г, 45 ммоль). Реакционный раствор нагревали с обратным холодильником при 65°С в течение 5 часов. Реакционный раствор охлаждали, фильтровали и промывали метанолом. Реакционный раствор концентрировали и очищали полученный остаток с помощью колоночной хроматографии с петролейным эфиром/этилацетатом (1/3) с получением (8R,9S,13S,14S)-3-(бензилокси)-13-метил-6,7,8,9,11,12,13,14,15,16-декагидро-17Н-циклопента[а]фенантрен-17-она (5 г, выход: 93%).
1H ЯМР (400 МГц, CDCl3) δ 7,45-7,29 (m, 5Н), 7,20 (d, J=8,5 Гц, 1Н), 6,79 (dd, J=8,6, 2,7 Гц, 1Н), 6,73 (d, J=2,6 Гц, 1Н), 5,04 (s, 2Н), 2,95-2,85 (m, 2Н), 2,50 (dd, J=18,8, 8,5 Гц, 1Н), 2,43-2,36 (m, 1Н), 2,30-2,23 (m, 1Н), 2,20-1,94 (m, 4Н), 1,63-1,40 (m, 6Н), 0,91 (s, 3Н).
Стадия 2: получение (8S,9S,13S,14S)-3-(бензилокси)-17-этилиден-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрена

Трет-бутилат калия (7,8 г, 70 ммоль) суспендировали в тетрагидрофуране (100 мл). Медленно добавляли этилтрифенилфосфонийбромид (26,3 г, 70 ммоль) при 0°С и перемешивали реакционный раствор при 60°С в течение 2 часов. К вышеуказанному реакционному раствору добавляли (8R,9S,13S,14S)-3-(бензилокси)-13-метил-6,7,8,9,11,12,13,14,15,16-декагидро-17Н-циклопента[а]фенантрен-17-он. После взаимодействия при 60°С в течение 2 часов реакционный раствор охлаждали до комнатной температуры. Добавляли насыщенный водный раствор хлорида аммония, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали насыщенным солевым раствором, сушили, фильтровали и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии с петролейным эфиром с получением (8S,9S,13S,14S)-3-(бензилокси)-17-этилиден-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрена (5 г, выход: 96%).
Стадия 3: получение 1-((8S,9S,13S,14S)-3-(бензилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)этан-1-ола
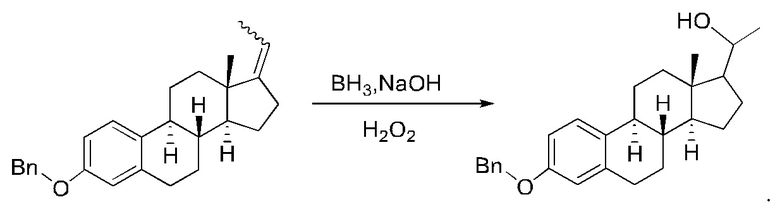
(8S,9S,13S,14S)-3-(бензилокси)-17-этилиден-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен (2,5 г, 6,9 ммоль) растворяли в безводном тетрагидрофуране (50 мл). По каплям добавляли раствор борана в тетрагидрофуране (1 М, 20 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение 1 часа. Реакционный раствор охлаждали ледяной водой и медленно по каплям добавляли раствор гидроксида натрия (10%, 15 мл) при выделении большого количества газа. Медленно по каплям добавляли пероксид водорода (30%, 20 мл) и перемешивали реакционный раствор при комнатной температуре в течение 2 часов. Реакционный раствор экстрагировали этилацетатом, промывали раствором тиосульфата натрия и насыщенным солевым раствором и сушили с получением продукта (2,5 г), который сразу же использовали на следующей стадии.
Стадия 4: получение 1-((8S,9S,13S,14S,17S)-3-(бензилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)этан-1-она

1-((8S,9S,13S,14S)-3-(бензилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)этан-1-ол (2,5 г, 6,5 ммоль) растворяли в дихлорметане (30 мл). Добавляли хлорхромат пиридиния (2,06 г, 9,6 ммоль) и перемешивали реакционный раствор при комнатной температуре в течение 12 часов. Реакционный раствор фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный остаток очищали с помощью колоночной хроматографии с петролейным эфиром/этилацетатом (1/5) с получением 1-((8S,9S,13S,14S,17S)-3-(бензилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)этан-1-она (1,6 г, выход: 65%).
1Н ЯМР (400 МГц, CDCl3) δ 7,44-7,28 (m, 5Н), 7,20 (d, J=8,6 Гц, 1Н), 6,78 (dd, J=8,5, 2,6 Гц, 1Н), 6,72 (d, J=2,6 Гц, 1Н), 5,03 (s, 2Н), 2,90-2,80 (m, 2Н), 2,61 (t, J=9,1 Гц, 1Н), 2,40-2,17 (m, 4Н), 2,15 (s, 3Н), 1,96-1,27 (m, 9Н), 0,65 (s, 3Н).
Стадия 5: получение 1-((8S,9S,13S,14S,17S)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)этан-1-она

1-((8S,9S,13S,14S,17S)-3-(бензилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)этан-1-он (200 мг, 0,52 ммоль) растворяли в смеси метанол/тетрагидрофуран (5 мл/5 мл). Добавляли гидроксид палладия на активированном угле (30 мг, 20%) и подвергали взаимодействию реакционный раствор в атмосфере водорода при 45°С в течение 12 часов с получением конечного продукта 1-((8S,9S,13S,14S,17S)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)этан-1-она (50 мг, выход: 32%).
MC m/z(ESI):298,1 [М]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,15 (d, J=8,4 Гц, 1Н), 6,63 (dd, J=8,4, 2,6 Гц, 1Н), 6,56 (d, J=2,6 Гц, 1Н), 4,62 (s, 1Н), 2,92-2,74 (m, 2Н), 2,62 (t, J=9,1 Гц, 1Н), 2,40-2,17 (m, 4Н), 2,16 (s, 3Н), 1,95-1,30 (m, 9Н), 0,65 (s, 3Н).
Пример 158
1-((8S,9S,13S,14S,17S)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-он (158)

Стадия 1: получение 1-((8S,9S,13S,14S,17S)-3-(бензилокси)-2-бром-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)-2-бромэтан-1-она

1-((8S,9S,13S,14S,17S)-3-(бензилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)этан-1-он (300 мг, 0,78 ммоль) растворяли в метаноле (15 мл). Добавляли пять капель раствора бромистого водорода с последующим добавлением по каплям жидкого брома (255 мг, 1,6 ммоль). После перемешивания при комнатной температуре в течение 2 часов реакционный раствор выливали в ледяную воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали досуха с помощью ротационного испарения с получением 300 мг продукта 1-((8S,9S,13S,14S,17S)-3-(бензилокси)-2-бром-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)-2-бромэтан-1-она, который сразу же использовали на следующей стадии.
Стадия 2: получение 1-((8S,9S,13S,14S,17S)-3-(бензилокси)-2-бром-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-она

1-((8S,9S,13S,14S,17S)-3-(бензилокси)-2-бром-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)-2-бромэтан-1-он (300 мг, 0,55 ммоль) растворяли в тетрагидрофуране (10 мл). Добавляли карбонат цезия (536 мг, 1,65 ммоль) и 1,2,3-триазол (190 мг, 2,7 ммоль) и реакционный раствор подвергали взаимодействию при 35°С в течение 5 часов. Реакционный раствор фильтровали и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии с петролейным эфиром/этилацетатом (1/1) с получением 1-((8S,9S,13S,14S,17S)-3-(бензилокси)-2-бром-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-она (70 мг, желтое твердое вещество, выход: 20%).
МС m/z (ESI): 534,1/536,1(50/50) [М+Н]+.
Стадия 2: получение 1-((8S,9S,13S,14S,17S)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-она

1-((8S,9S,13S,14S,17S)-3-(бензилокси)-2-бром-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-он (70 мг, 0,13 ммоль) растворяли в смеси метанол/тетрагидрофуран (5 мл/5 мл). Добавляли гидроксид палладия на активированном угле (30 мг, 20%) и реакционный раствор подвергали взаимодействию в атмосфере водорода при 45°С в течение 12 часов. Реакционный раствор фильтровали и концентрировали с получением 1-((8S,9S,13S,14S,17S)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-ил)-2-(1Н-1,2,3-триазол-1-ил)этан-1-она (30 мг, белое твердое вещество, выход: 62,6%).
МС m/z (ESI):366,1 [М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,78 (s, 1Н), 7,67 (s, 1Н), 7,15 (d, J=8,0 Гц, 1Н), 6,65 (dd, J=6,4, 2,4 Гц, 1Н), 6,60-6,56 (m, 1Н), 5,40-5,15 (m, 2Н), 5,04 (s, 1Н), 2,89-2,70 (m, 3Н), 2,40-2,21 (m, 3Н), 1,96-1,27 (m, 10Н), 0,71 (s, 3Н).
Пример 159
((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)диметилфосфиноксид (159)
Стадия 1: получение (3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-она

(3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он (5 г, 17 ммоль) (Shanghai Yinling Pharmaceutical Technology Co., Ltd.), 2,6-лутидин (4,5 г, 42,5 ммоль) и безводный дихлорметан (80 мл) последовательно добавляли в круглодонную колбу объемом 100 мл. Реакционную систему охлаждали до 0°С на бане с ледяной водой и по каплям добавляли трет-бутилдиметилсилилтрифторметансульфонат (9 г, 34 ммоль). Реакционную систему нагревали до комнатной температуры и перемешивали в течение ночи. ТСХ показала завершение реакции. Реакционный раствор разбавляли дихлорметаном. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 20:1) с получением (3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-она (6,2 г, выход: 90,1%).
1Н ЯМР (400 МГц, CDCl3) δ 2,37 (dd, J=18,8, 8,0 Гц, 1Н), 2,06-1,97 (m, 1Н), 1,90-1,84 (m, 1Н), 1,75-1,68 (m, 5Н), 1,59-1,55 (m, 1Н), 1,47-0,89 (m, 17Н), 0,80 (s, 3Н), 0,79 (s, 9Н), 0,00 (m, 6Н).
Стадия 2: получение (3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-илтрифторметансульфоната

(3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он (1,2 г, 3 ммоль) и 50 мл безводного тетрагидрофурана последовательно добавляли в круглодонную колбу объемом 100 мл. Реакционную систему охлаждали до минус 78°С и к реакционной системе по каплям добавляли раствор гексаметилдисилазида калия в тетрагидрофуране (3 мл, 3 ммоль). Реакционный раствор перемешивали при минус 78°С в течение 1 часа, после чего к реакционной системе по каплям добавляли N-фенилбис(трифторметансульфонимид) (1,29 г, 3,6 ммоль), растворенный в 5 мл безводного тетрагидрофурана. После завершения добавления реакционный раствор естественным образом нагревали до комнатной температуры и перемешивали в течение ночи. После завершения реакции добавляли насыщенный раствор хлорида аммония, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: петролейный эфир) с получением (3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-илтрифторметансульфоната (1,4 г, выход: 87%).
1Н ЯМР (400 МГц, CDCl3) δ 5,56 (s, 1Н), 2,27-2,18 (m, 1Н), 2,00-1,93 (m, 1Н), 1,80-1,61 (m, 7Н), 1,49-1,23 (m, 15Н), 0,97 (s, 3Н), 0,86 (s, 9Н), 0,08 (s, 6Н).
Стадия 3: получение ((3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)диметилфосфиноксида

(3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-илтрифторметан сульфонат (840 мг, 1,57 ммоль), диметилфосфиноксид (146 мг, 1,89 ммоль), диацетат палладия (35 мг, 0,16) ммоль), 1,4-бис(дифенилфосфино)бутан (69 мг, 0,16 ммоль), N,N-диизопропилэтиламин (1,6 г, 12,6 ммоль) и 10 мл безводного диметилсульфоксида последовательно добавляли в круглодонную колбу объемом 100 мл. Реакционную систему продували азотом, медленно нагревали до 120°С и перемешивали в течение ночи. После завершения реакции реакционную систему охлаждали до комнатной температуры. Добавляли воду, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: дихлорметан/метанол = 10/1) с получением ((3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)диметилфосфиноксида (642 мг, выход: 88%).
1Н ЯМР (400 МГц, CDCl3) δ 6,54 (dd, J=10,8, 1,6 Гц, 1Н), 2,33-2,27 (m, 1Н), 2,11-2,01 (m, 2Н), 1,66-1,58 (m, 12Н), 1,48-1,1,13 (m, 15Н), 1,00 (s, 3Н), 0,86 (s, 9Н), 0,07 (s, 6Н).
Стадия 4: получение ((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)диметилфосфиноксида

((3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)диметилфосфиноксид (642 мг, 1,38 ммоль) растворяли в 5 мл безводного тетрагидрофурана в круглодонной колбе объемом 100 мл и добавляли к реакционной системе 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (5 мл). Реакционный раствор перемешивали при 60°С в течение ночи. После завершения реакции реакционную систему охлаждали до комнатной температуры. Добавляли воду, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: дихлорметан/метанол = 10/1) с получением ((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)диметилфосфиноксида (170 мг, выход: 35%).
1Н ЯМР (400 МГц, CDCl3) δ 6,57-6,54 (m, 1Н), 2,45 (br, 1Н), 2,35-2,28 (m, 1Н), 2,12-2,00 (m, 2Н), 1,87-1,70 (m, 4Н), 1,67-1,14 (m, 23Н), 1,00 (s, 3Н).
Стадия 5: получение ((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)диметилфосфиноксида

((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)диметилфосфиноксид (100 мг, 0,29 ммоль), палладий на угле (100 мг, 10%) и 10 мл этилацетата добавляли в круглодонную колбу объемом 100 мл. Реакционную систему продували водородом три раза и проводили реакцию при 1 атмосфере в течение ночи. После завершения реакции реакционный раствор фильтровали через целит для удаления избытка палладия на угле и концентрировали фильтрат с помощью ротационного испарения досуха. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением ((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)диметилфосфиноксида (39,5 мг, выход: 39%).
МС m/z (ESI): 353,3 [М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 2,13-1,62 (m, 22Н), 1,35-1,27 (m, 8Н), 1,16-1,06 (m, 4Н), 0,99 (s, 3Н).
Пример 160
((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксид (160)

Стадия 1: получение ((3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксида

(3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-илтрифторметансульфонат (350 мг, 0,65 ммоль), дифенилфосфиноксид (158 мг, 0,78 ммоль), диацетат палладия (35 мг, 0,16) ммоль), 1,4-бис(дифенилфосфино)бутан (69 мг, 0,16 ммоль), N,N-диизопропилэтиламин (660 мг, 5,2 ммоль) и 10 мл безводного диметилсульфоксида последовательно добавляли в круглодонную колбу объемом 100 мл. Реакционную систему продували азотом, медленно нагревали до 120°С и перемешивали в течение ночи. После завершения реакции реакционную систему охлаждали до комнатной температуры. Добавляли воду, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: дихлорметан/метанол = 10/1) с получением ((3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксида (290 мг, выход: 76%).
1Н ЯМР (400 МГц, CDCl3) δ 7,85-7,80 (m, 2Н), 7,67-7,62 (m, 2Н), 7,59-7,40 (m, 6Н), 6,01-5,98 (m, 1Н), 2,31-2,25 (m, 1Н), 2,09-2,02 (m, 2Н), 1,89-1,10 (m, 21Н), 1,07 (s, 3Н), 0,86 (s, 9Н), 0,07 (s, 6Н).
Стадия 2: получение ((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксида

((3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксид (270 мг, 0,46 ммоль) растворяли в 5 мл безводного тетрагидрофурана в круглодонной колбе объемом 100 мл и добавляли к реакционной системе 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (5 мл). Реакционный раствор перемешивали при 60°С в течение ночи. После завершения реакции реакционную систему охлаждали до комнатной температуры. Добавляли воду, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: дихлорметан/метанол = 10/1) с получением ((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксида (120 мг, выход: 55%).
1Н ЯМР (400 МГц, CDCl3) δ 6,57-6,54 (m, 1Н), 2,45 (br, 1Н), 2,35-2,28 (m, 1Н), 2,12-2,00 (m, 2Н), 1,87-1,70 (m, 4Н), 1,67-1,14 (m, 26Н), 1,00 (s, 3Н).
Стадия 3: получение ((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксида

((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксид (120 мг, 0,25 ммоль), палладий на угле (120 мг, 10%) и 10 мл этилацетата добавляли в круглодонную колбу объемом 100 мл. Реакционную систему продували водородом три раза и проводили реакцию при 1 атмосфере в течение ночи. После завершения реакции реакционный раствор фильтровали через целит для удаления избытка палладия на угле и концентрировали фильтрат с помощью ротационного испарения досуха. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением ((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксида (40 мг, выход: 33%).
MC m/z (ESI): 477,3 [М+Н]+.
1Н ЯМР (400 МГц, CDCl3) δ 7,91-7,83 (m, 4Н), 7,54-7,44 (m, 6Н), 2,37-2,15 (m, 2Н), 2,11-2,09 (m, 1Н), 2,07-1,95 (m, 6Н), 1,84-1,04 (m, 22Н).
31Р ЯМР (162 МГц, CDCl3) δ 30,00.
Пример 161
1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)этан-1-он (161)

Стадия 1: получение (8R,10R,13S,14S)-10,13-диметил-17-оксо-2,7,8,9,10,11,12,13,14,15,16,17-додекагидро-1H-циклопента[а]фенантрен-3-илацетата

(8R,10R,13S,14S)-10,13-диметил-1,6,7,8,9,10,11,12,13,14,15,16-додекагидро-3Н-циклопента[а]фенантрен-3,17(2Н)-дион (19,0 г, 66,43 ммоль) растворяли в этилацетате (500 мл) и добавляли уксусный ангидрид (100 мл) и хлорную кислоту (0,5 мл). Реакционный раствор перемешивали при комнатной температуре в течение 1 часа, и ТСХ показал; завершение реакции. К реакционному раствору добавляли насыщенный раствор карбонат; натрия (300 мл). Органическую фазу промывали насыщенным раствором карбоната натри: (300 мл*2) и насыщенным солевым раствором (300 мл), сушили над безводным сульфатом натрия и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат: петролейный эфир = 0-40%) с получение» (8R,10R,13S,14S)-10,13-диметил-17-оксо-2,7,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-илацетата (13,0 г, выход: 59,7%).
1Н ЯМР (400 МГц, CDCl3) δ: 5,71 (s, 1Н), 5,42 (t, J=2,4 Гц, 1Н), 2,51-2,43 (m, 2Н) 2,34-2,27 (m, 1Н), 2,18-2,04 (m, 5Н), 2,00-1,69 (m, 6Н), 1,62-1,27 (m, 5Н), 1,13-1,06 (m, 1Н) 1,03 (s, 3Н), 0,92 (s, 3Н).
Стадия 2: получение (8R,10R,13S,14S)-6-гидрокси-10,13-диметил-1,6,7,8,9,10,11,12,13,14,15,16-додекагидро-3Н-циклопента[а]фенантрен-3,17(2Н)-диона

(8R,10R,13S,14S)-10,13-диметил-17-оксо-2,7,8,9,10,11,12,13,14,15,16,17-додекагидро-1Н-циклопента[а]фенантрен-3-илацетат (5,0 г, 15,24 ммоль) растворяли в этаноле (18(мл) и добавляли м-хлорпероксибензойную кислоту (5,0 г, 24,71 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 3 часов, и ЖХ/МС показал; завершение реакции. Добавляли насыщенный раствор карбоната натрия (200 мл), после чего экстрагировали реакционный раствор этилацетатом (300 мл). Органическую фазу промывали насыщенным раствором карбоната натрия (200 мл*2) и насыщенным солевым раствором (200 мл), сушили над безводным сульфатом натрия и концентрировали с получением (8R,10R,13S,14S)-6-гидрокси-10,13-диметил-1,6,7,8,9,10,11,12,13,14,15,16-додекагидро-3Н-циклопента[а]фенантрен-3,17(2Н)-диона (3,5 г, выход): 76,0%).
МС m/z (ESI): 303,0 [М+Н]+.
Стадия 3: получение (8R,10R,13S,14S)-6-гидрокси-10,13-диметилтетрадекагидро-3Н-циклопента[а]фенантрен-3,17(2Н)-диона

(8R,10R,13S,14S)-6-гидрокси-10,13-диметил-1,6,7,8,9,10,11,12,13,14,15,16-додекагидро-3Н-циклопента[а]фенантрен-3,17(2Н)-дион (8,0 г, 26,5 ммоль) растворяли в пиридине (50 мл) и к вышеуказанному раствору добавляли 10% катализатор Линдлара Pd (2,0 г). Реакционную систему снабжали водородным баллоном, трижды продували водородом и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор фильтровали и осадок на фильтре промывали этилацетатом (30 мл). Фильтрат разбавляли этилацетатом (200 мл) и промывали 1 Н соляной кислотой (100 мл*2). Органическую фазу промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат : петролейный эфир = 1:1) с получением (8R,10R,13S,14S)-6-гидрокси-10,13-диметилтетрадекагидро-3Н-циклопента[а]фенантрен-3,17(2Н)-диона (2,0 г, выход: 25,0%).
1H ЯМР (400 МГц, DMSO-d6) δ: 4,60 (s, 1Н), 3,51 (m, 1Н), 2,45-2,31 (m, 3Н), 2,06-1,82 (m, 7Н), 1,69-1,51 (m, 5Н), 1,48-1,23 (m, 5Н), 1,14 (s, 3Н), 0,82 (s, 3Н).
Стадия 4: получение (6R,8R,10S,13S,14S)-13-метилтетрадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-3,17-диона
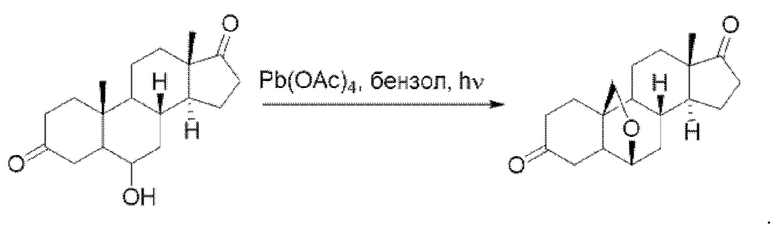
(8R,10R,13S,14S)-6-гидрокси-10,13-диметилтетрадекагидро-3Н-циклопента[а]фенантрен-3,17(2Н)-дион (1,0 г, 3,29 ммоль) растворяли в смеси бензол (50 мл)/пиридин (0,8 мл) и добавляли к вышеуказанному раствору тетраацетат свинца (7,3 г, 16,5 ммоль). Реакционный раствор перемешивали под лампой накаливания (500 Вт) в течение 2 часов, после чего реакцию останавливали. К реакционному раствору добавляли этилацетат (100 мл) для осаждения большого количества твердого вещества, после чего реакционный раствор фильтровали. Фильтрат промывали 1 Н соляной кислотой (50 мл*2). Органическую фазу промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат : петролейный эфир = 1:2) с получением (6R,8R,10S,13S,14S)-13-метилтетрадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-3,17-диона (600 мг, выход: 60,0%).
1H ЯМР (400 МГц, CDCl3) δ: 4,25-4,22 (m, 1Н), 4,06 (d, J=8,4 Гц, 1H,), 3,39 (d, J=8,4 Гц, 1Н), 2,63-2,44 (m, 3Н), 2,35-2,06 (m, 5Н), 1,98-1,80 (m, 4Н), 1,72-1,24 (m, 8Н), 0,96 (s, 3Н).
Стадия 5: получение (3R,6R,8R,10S,13S,14S)-3-гидрокси-3,13-диметилтетрадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17(1Н)-она

2,6-ди-трет-бутил-п-метилфенол (3,5 г, 15,9 ммоль) и толуол (35 мл) добавляли в трехгорлую колбу. По каплям добавляли 2М триметилалюминий (4 мл, 8 ммоль) при 0-10°С в атмосфере азота. После завершения добавления реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор охлаждали до минус 78°С в бане с сухим льдом/ацетоном и по каплям добавляли (6R,8R,10S,13S,14S)-13-метилтетрадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-3,17-дион (0,8 г, 2,65 ммоль), растворенный в толуоле (30 мл), после чего реакционный раствор подвергали взаимодействию при минус 78°С в течение 1 часа. Добавляли 3 М метилмагнийбромид (2,3 мл, 6,9 ммоль), после чего реакционный раствор подвергали взаимодействию при минус 78°С в течение 1 часа. Добавляли насыщенный раствор хлорида аммония (50 мл), после чего экстрагировали реакционный раствор этилацетатом (120 мл). Органическую фазу промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат : петролейный эфир = 1:1) с получением (3R,6R,8R,10S,13S,14S)-3-гидрокси-3,13-диметилтетрадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17(1Н)-она (400 мг, выход: 47,5%).
1H ЯМР (400 МГц, CDCl3) δ: 4,15-4,12 (m, 1Н), 3,96 (d, J=8,0 Гц, 1Н), 3,32 (d, J=8,0 Гц, 1Н), 2,48-2,41 (m, 1Н), 2,13-2,03 (m, 1Н), 1,92-1,79 (m, 5Н), 1,75-1,63 (m, 3Н), 1,60-1,43 (m, 6Н), 1,38-1,10 (m, 7Н), 0,92 (s, 3Н).
Стадия 6: получение (3R,6R,8S,10S,13S,14S)-17-этилиден-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-3-ола

Этилтрифенилфосфонийбромид (11,65 г, 31,4 ммоль) растворяли в диметилсульфоксиде (25 мл). Добавляли 60% гидрид натрия (1,26 г, 31,4 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в атмосфере азота в течение 1 часа. (3R,6R,8R,10S,13S,14S)-3-гидрокси-3,13-диметилтетрадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17(1Н)-он (0,5 г, 1,57 ммоль) растворяли в диметилсульфоксиде (5 мл), после чего нагревали реакционный раствор до 60°С и подвергали взаимодействию в течение 16 часов. Добавляли насыщенный раствор хлорида аммония (50 мл), после чего экстрагировали реакционный раствор этилацетатом (60 мл). Органическую фазу последовательно промывали насыщенным раствором карбоната натрия (50 мл*2) и насыщенным солевым раствором (300 мл), сушили над безводным сульфатом натрия и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат : петролейный эфир = 1:3) с получением (3R,6R,8S,10S,13S,14S)-17-этилиден-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-3-ола (350 мг, выход: 67,6%).
1H ЯМР (400 МГц, CDCl3) δ: 5,12-5,09 (m, 1Н), 4,15-4,12 (m, 1Н), 3,96 (d, J=8,0 Гц, 1Н), 3,26 (d, J=8,0 Гц, 1Н), 2,39-2,13 (m, 3Н), 1,91-1,85 (m, 3Н), 1,70-1,50 (m, 12Н), 1,30-1,07 (m, 8Н), 0,91 (s, 3Н).
Стадия 7: получение (3R,6R,8S,10S,13S,14S,17S)-17-((S)-1-гидроксиэтил)-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-3-ола
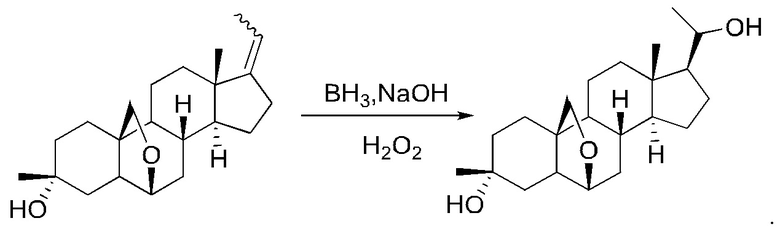
(3R,6R,8S,10S,13S,14S)-17-этилиден-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-3-ол (250 мг, 0,76 ммоль) растворяли в тетрагидрофуране (8 мл) и охлаждали раствор до 0°С. Добавляли раствор борана в тетрагидрофуране (1 М, 15 мл, 15 ммоль) и перемешивали реакционный раствор при комнатной температуре в течение 3 часов. Реакционный раствор охлаждали до 0°С и по каплям добавляли гидроксид натрия (3 М, 10 мл). После завершения добавления по каплям добавляли пероксид водорода (30%, 8 мл) и реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор разбавляли этилацетатом (60 мл) и промывали насыщенным раствором тиосульфата натрия (30 мл). Органическую фазу промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали с получением (3R,6R,8S,10S,13S,14S,17S)-17-((S)-1-гидроксиэтил)-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-3-ола (260 мг, выход: 100%), который сразу же использовали на следующей стадии без дополнительной очистки.
Стадия 8: получение 1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)этан-1-она

(3R,6R,8S,10S,13S,14S,17S)-17-((S)-1-гидроксиэтил)-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-3-ол (260 мг, 0,75 ммоль) растворяли в дихлорметане (10 мл) и охлаждали раствор до 0°С. Добавляли РСС (322 мг, 1,5 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 3 часов. ТСХ показала завершение реакции. Реакционный раствор фильтровали и осадок на фильтре промывали этилацетатом (20 мл). Фильтрат разбавляли этилацетатом (30 мл) и промывали насыщенным раствором тиосульфата натрия (30 мл). Органическую фазу промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат : петролейный эфир = 1:2) с получением 1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)этан-1-она (150 мг, выход: 57,8%).
1H ЯМР (400 МГц, CDCl3) δ: 4,14-4,12 (m, 1Н), 3,94 (d, J=7,6 Гц, 1Н), 3,27 (d, J=7,6 Гц, 1Н), 2,53 (t, J=8,8 Гц, 1Н), 2,18-2,04 (m, 5Н), 1,91-1,86 (m, 3Н), 1,70-1,49 (m, 10Н), 1,34-1,49 (m, 8Н), 0,66 (s, 3Н).
Пример 162
1-(2-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (162)

Стадия 1: получение 2-бром-1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)этан-1-она
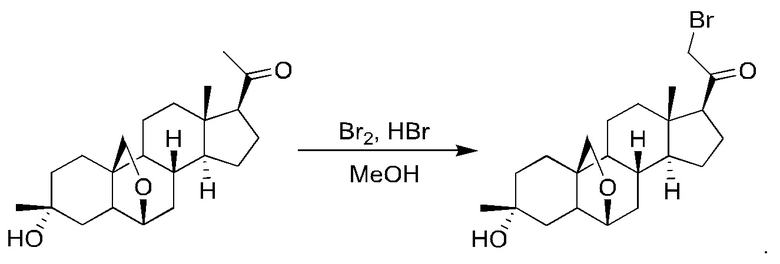
1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)этан-1-он (135 мг, 0,39 ммоль) растворяли в метаноле (6 мл). Добавляли каплю бромистого водорода с последующим добавлением 5 капель жидкого брома при перемешивании при комнатной температуре, после чего реакционный раствор перемешивали при комнатной температуре в течение 1 часа. ТСХ показала завершение реакции. Добавляли насыщенный раствор бикарбоната натрия (30 мл), после чего экстрагировали реакционный раствор этилацетатом (50 мл). Органическую фазу промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали с получением 2-бром-1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)этан-1-она (160 мг, выход: 96,5%), который сразу же использовали на следующей стадии без дополнительной очистки.
Стадия 2: получение 1-(2-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила

2-бром-1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)этан-1-он (85 мг, 0,2 ммоль) и 4-цианопиразол (92 мг, 1,0 ммоль) растворяли в тетрагидрофуране (5 мл) и добавляли карбонат калия (138 мг, 1,0 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 16 часов, и ТСХ и ЖХ/МС показали завершение реакции. Реакционный раствор фильтровали и концентрировали. Полученный остаток очищали с помощью препаративной флэш-хроматографии с получением 1-(2-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила (29,7 мг, выход: 34,0%).
MC m/z (ESI): 438,3 [М+Н]+.
1H ЯМР (400 МГц, CDCl3) δ: 7,87 (s, 1Н), 7,81 (s, 1Н), 5,01-4,87 (m, 2Н), 4,15-4,12 (m, 1Н), 3,93 (d, J=8,4 Гц, 1Н), 3,28 (d, J=8,4 Гц, 1Н), 2,60 (t, J=6,8 Гц, 1Н), 2,22-2,08 (m, 2Н), 1,91-1,49 (m, 13Н), 1,39-1,24 (m, 6Н), 1,19-1,13 (m, 2Н), 0,72 (s, 3Н).
Пример 163
1-(2-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрил (163)

Получение 1-(2-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрила

2-бром-1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)этан-1-он (80 мг, 0,19 ммоль) и 4-цианопиразол (88 мг, 0,95 ммоль) растворяли в тетрагидрофуране (5 мл) и добавляли карбонат калия (130 мг, 0,95 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 16 часов, и ТСХ и ЖХ/МС показали завершение реакции. Реакционный раствор фильтровали и концентрировали. Полученный остаток очищали с помощью препаративной флэш-хроматографии с получением 1-(2-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)-2-оксоэтил)-1Н-пиразол-3-карбонитрила (36,5 мг, выход: 44,4%).
МС m/z (ESI): 438,3 [М+Н]+.
1H ЯМР (400 МГц, CDCl3) δ: 7,49 (d, J=2,0 Гц, 1Н), 7,76 (d, J=2,0 Гц, 1Н), 5,10-4,90 (m, 2Н), 4,15-4,12 (m, 1Н), 3,94 (d, J=8,0 Гц, 1Н), 3,28 (d, J=8,0 Гц, 1Н), 2,60 (t, J=8,8 Гц, 1Н), 2,21-2,09 (m, 2Н), 1,91-1,50 (m, 13Н), 1,39-1,24 (m, 6Н), 1,19-1,13 (m, 2Н), 0,72 (s, 3Н).
Пример 164
1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)-2-(4-(трифторметил)-1Н-пиразол-1-ил)этан-1-он (164)

Получение 1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)-2-(4-(трифторметил)-1Н-пиразол-1-ил)этан-1-она

2-бром-1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)этан-1-он (80 мг, 0,19 ммоль) и 4-трифторметилпиразол (128 мг, 0,95 ммоль) растворяли в тетрагидрофуране (5 мл) и добавляли карбонат калия (130 мг, 0,95 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 16 часов, и ТСХ и ЖХ/МС показали завершение реакции. Реакционный раствор фильтровали и концентрировали. Полученный остаток очищали с помощью препаративной флэш-хроматографии с получением 1-((3R,6R,8S,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-6,10-(эпоксиметано)циклопента[а]фенантрен-17-ил)-2-(4-(трифторметил)-1Н-пиразол-1-ил)этан-1-она (29,5 мг, выход: 32,7%).
МС m/z (ESI): 481,2 [М+Н]+.
1H ЯМР (400 МГц, CDCl3) δ: 7,72 (s, 2Н), 5,01-4,87 (m, 2Н), 4,15-4,12 (m, 1Н), 3,94 (d, J=8,0 Гц, 1Н), 3,28 (d, J=8,0 Гц, 1Н), 2,60 (t, J=8,8 Гц, 1Н), 2,22-2,09 (m, 2Н), 1,91-1,45 (m, 13Н), 1,39-1,24 (m, 6Н), 1,19-1,13 (m, 2Н), 0,73 (s, 3Н).
Пример 165
1-(2-((1S,4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилоктадекагидрохризен-1-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (165)

Стадия 1: получение (3R,5R,8R,9R,10S,13S,14S)-3,13-диметил-17-оксогексадекагидро-1Н-циклопента[а]фенантрен-3-ила ацетата

(3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он (580 мг, 2,0 ммоль) растворяли в уксусном ангидриде (15 мл). Добавляли пиридин (158 мг, 2,0 ммоль) и реакционный раствор подвергали взаимодействию в атмосфере N2 при 80°С в течение ночи. Реакционный раствор концентрировали при пониженном давлении для удаления уксусного ангидрида. К полученному остатку добавляли Н2О (20 мл), после чего смесь экстрагировали ЕА (этилацетат) (15 мл×3). Фазы ЕА объединяли, последовательно промывали Н2О (20 мл) и насыщенным солевым раствором (20 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии с получением (3R,5R,8R,9R,10S,13S,14S)-3,13-диметил-17-оксогексадекагидро-1Н-циклопента[а]фенантрен-3-ила ацетата (560 мг, выход: 84%).
1Н ЯМР (400 МГц, CDCl3) δ 2,44 (dd, J=19,2, S,1 Гц, 1Н), 2,24-2,06 (m, 1Н), 1,97 (s, 3Н), 1,96-1,76 (m, 8Н), 1,71-1,57 (m, 3Н), 1,55 (s, 3Н), 1,55-0,99 (m, 10Н), 0,87 (s, 3Н).
Стадия 1: получение этил-2-((3R,5R,8R,9R,10S,13S,14S)-3-ацетокси-17-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-диазоацетата

(3R,5R,8R,9R,10S,13S,14S)-3,13-диметил-17-оксогексадекагидро-1Н-циклопента[а]фенантрен-3-ила ацетат (400 мг, 1,2 ммоль) и этилдиазоацетат (206 мг (1,8 ммоль) растворяли в THF (15 мл). Реакционный раствор охлаждали до минус 70°С и по каплям добавляли LDA (2 мл). После завершения добавления по каплям реакционный раствор подвергали взаимодействию при той же температуре в течение 1 часа. Добавляли раствор АсОН (400 мг) в простом эфире (20 мл), подогревали реакционный раствор до комнатной температуры и добавляли Н2О (50 мл). Реакционный раствор экстрагировали простым эфиром (25 мл×2). Фазы простого эфира объединяли, последовательно промывали Н2О (50 мл), насыщенным раствором NaHCO3 (30 мл) и насыщенным солевым раствором (30 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении досуха. Полученный остаток очищали с помощью колоночной хроматографии с получением этил-2-((3R,5R,8R,9R,10S,13S,14S)-3-ацетокси-17-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-диазоацетата (500 мг, выход: 93%).
1Н ЯМР (400 МГц, CDCl3) δ 4,70 (bs, 1Н), 4,36-4,17 (m, 2Н), 2,24-2,11 (m, 1Н), 2,00 (s, 3Н), 1,96-1,87 (m, 2Н), 1,85-1,83(m, 4Н), 1,74-1,58 (m, 4Н), 1,55 (s, 3Н), 1,52-1,35 (m, 2Н), 1,32 (t, J=7,1 Гц, 3Н), 1,29-1,17 (m, 4Н), 1,17-0,94 (m, 5Н), 0,92 (s, 3Н), 0,91-0,81 (m, 1Н).
Стадия 3: получение этил-(4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-ацетокси-8,12а-диметил-1-оксооктадекагидрохризен-2-карбоксилата

Этил-2-((3R,5R,8R,9R,10S,13S,14S)-3-ацетокси-17-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-диазоацетат (500 мг, 1,1 ммоль) растворяли в диметиловом эфире этиленгликоля (10 мл). Добавляли димер ацетата родия (5,0 мг), и реакционный раствор подвергали взаимодействию в атмосфере N2 при комнатной температуре в течение 0,5 часа. Реакционный раствор фильтровали для удаления нерастворимого вещества и концентрировали фильтрат при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии с получением этил-(4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-ацетокси-8,12а-диметил-1-оксооктадекагидрохризен-2-карбоксилата (436 мг, выход: 93%).
1Н ЯМР (400 МГц, CDCl3) δ 12,35 (s, 0,82Н), 4,13 (q, J=7,1 Гц, 2Н), 3,63 (dd, J=13,5, 6,0 Гц, 0,15Н), 2,27 (dd, J=16,2, 6,1 Гц, 1Н), 2,14-1,96 (m, 2Н), 1,89 (s, 3Н), 1,88-1,65 (m, 7Н), 1,58 (dd, J=20,4, 10,4 Гц, 3Н), 1,48 (s, 3Н), 1,36-1,13 (m, 8Н), 1,11-1,04 (m, 2Н), 1,03 (s, 3Н), 0,99-0,88 (m, 3Н).
Стадия 4: получение
(4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилгексадекагидрохризен-1(2Н)-о
на

КОН (4,0 г) растворяли в метаноле (60 мл). Добавляли этил-(4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-ацетокси-8,12а-диметил-1-оксооктадекагидрохризен-2-карбоксилат (400 мг), после чего реакционный раствор нагревали с обратным холодильником в атмосфере N2 в течение 1 часа. Реакционный раствор охлаждали до комнатной температуры и выливали в ледяную воду (150 мл). После перемешивания в течение 20 минут реакционный раствор фильтровали. Осадок на фильтре промывали небольшим количеством воды и ацетона и сушили с получением (4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилгексадекагидрохризен-1(2Н)-о на (320 мг).
1H ЯМР (400 МГц, CDCl3) δ 2,61 (td, J=14,0, 6,8 Гц, 1Н), 2,25-2,15 (m, 1H), 2,11-2,00 (m, 1H), 1,87 (dd, J=9,8, 7,7 Гц, 2Н), 1,84-1,70 (m, 5H), 1,67-1,57 (m, 3H), 1,56-1,47 (m, 2Н), 1,45-1,27 (m, 7H), 1,26 (s, 3H), 1,20-1,10 (m, 1H), 1,08 (s, 3H), 1,07-0,91 (m, 2Н).
Стадия 5: получение (2R,4а8,4bR,6а8,10а8,10bR,12aR)-7-этилиден-2,6а-диметилоктадекагидрохризен-2-ола

В соответствии со стадией 4 примера 1 в качестве исходного вещества использовали
(4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилгексадекагидрохризен-1(2Н)-он, соответственно, был получен (2R,4aS,4bR,6aS,10aS,10bR,12aR)-7-этилиден-2,6а-диметилоктадекагидрохризен-2-ол (288 мг).
Стадия 6: получение (2R,4aS,4bR,6aS,7S,10aS,10bR,12aR)-7-(1-гидроксиэтил)-2,6а-диметилоктадекагидрохризен-2-ола

В соответствии со стадией 5 примера 1 в качестве исходного вещества использовали
(2R,4aS,4bR,6aS,10aS,10bR,12aR)-7-этилиден-2,6а-диметилоктадекагидрохризен-2-ол, соответственно, был получен (2R,4aS,4bR,6aS,7S,10aS,10bR,12aR)-7-(1-гидроксиэтил)-2,6а-диметилоктадекагидрохризен-2-ол (150 мг, содержащий небольшое количество примесей), который сразу же использовали на следующей стадии без очистки.
Стадия 7: получение 1-((1S,4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилоктадекагидрохризен-1-ил)этан-1-она

В соответствии со стадией 6 примера 1 в качестве исходного вещества использовали
(2R,4aS,4bR,6aS,7S,10aS,10bR,12aR)-7-(1-гидроксиэтил)-2,6а-диметилоктадекагидрохризен-2-ол, соответственно, был получен
1-((1S,4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилоктадекагидрохризен-1-ил)этан-1-он (80 мг, содержащий небольшой количество примесей), который сразу же использовали на следующей стадии без очистки.
Стадия 8: получение
2-бром-1-((1S,4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилоктадекагидрохризен-1-ил)этан-1-она

В соответствии со стадией 1 примера 2 в качестве исходного вещества использовали 1-((1S,4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилоктадекагидрохризен-1-ил)этан-1-он, соответственно, был получен 2-бром-1-((1S,4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилоктадекагидрохризен-1-ил)этан-1-он (50 мг, содержащий небольшое количество примесей), который сразу же использовали на следующей стадии без очистки.
Стадия 9: получение 1-(2-((1S,4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилоктадекагидрохризен-1-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((1S,4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилоктадекагидрохризен-1-ил)этан-1-он, соответственно, был получен 1-(2-((1S,4aS,4bR,6aR,8R,10aS,10bR,12aS)-8-гидрокси-8,12а-диметилоктадекагидрохризен-1-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (5,5 мг).
1H ЯМР (400 МГц, CDCl3) δ 7,87 (s, 1H), 7,83 (s, 1H), 5,06-4,88 (m, 2H), 2,47 (d, J=4,9 Гц, 1H), 1,90-1,81 (m, 2H), 1,78-1,67 (m, 5H), 1,58-1,50 (m, 6H), 1,41-1,34 (m, 4H), 1,29-1,24 (m, 9H), 0,99 (s, 3H), 0,96-0,83 (m, 3H).
Пример 166
1-((2-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтокси)метил)циклопропан-1-карбонитрил (166)

Стадия 1: получение 1-((2-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)-2-оксоэтокси)метил)циклопропан-1-карбонитрила

2-бром-1-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (80 мг, 0,2 ммоль), 1-(гидроксиметил)циклопропан-1-карбонитрил (29 мг, 0,3 ммоль) и карбонат калия (138 мг, 1,0 ммоль) растворяли в N,N-диметилацетамиде (3 мл) и перемешивали полученный реакционный раствор при 70°С в течение ночи. К реакционному раствору добавляли воду (20 мл) и экстрагировали водную фазу этилацетатом (20 мл × 2). Органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат: 50/1-3/1) с получением 1-((2-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклоп ента[а]фенантрен-17-ил)-2-оксоэтокси)метил)циклопропан-1-карбонитрила (10 мг, выход: 12%).
1Н ЯМР (400 МГц, CDCl3) δ 4,21-4,09 (m, 2H), 3,53 (s, 2H), 2,61-2,54 (m, 1H), 2,21-2,12 (m, 1H), 1,90-1,78 (m, 4H), 1,75-1,61 (m, 4H), 1,49-1,40 (m, 5H), 1,34-1,26 (m, 13H), 1,10-1,04 (m, 4H), 0,63 (s, 3H).
Пример 167
1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)тио)метил)-1Н-пиразол-4-карбонитрил

Стадия 1: получение (3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-тиона

(3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-тион (1,2 г, 3 ммоль), 2,4-бис(п-метоксифенил)-1,3-дитиадифосфетан-2,4-сульфид (971 мг, 2,4 ммоль) и 20 мл безводного толуола последовательно добавляли в сухую круглодонную колбу объемом 100 мл. Реакционную систему продували аргоном, нагревали с обратным холодильником и перемешивали в течение ночи. После завершения реакции реакционный раствор фильтровали через нейтральный глинозем и концентрировали фильтрат с помощью ротационного испарения досуха. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: петролейный эфир : этилацетат = 50/1) с получением (3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидр о-17Н-циклопента[а]фенантрен-17-тиона (860 мг, выход: 68%).
1H ЯМР (400 МГц, CDCl3) δ 2,90 (dd, J=8,4, 21,6 Гц, 1Н), 2,63-2,55 (m, 1H), 1,97-1,93 (m, 2H), 1,73-1,17 (m, 22H), 0,84 (s, 3H), 0,79 (s, 9H), 0,07 (s, 6H).
Стадия 2: получение (3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-тиола

(3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-тион (860 мг, 2 ммоль) и 30 мл безводного тетрагидрофурана добавляли в сухую круглодонную колбу объемом 100 мл. Реакционную систему охлаждали до 0°С и по каплям добавляли 1,0 М три-трет-бутоксилитийалюминийгидрид (6 мл, 6 ммоль). Реакционный раствор перемешивали при 0°С в течение 2 часов и перемешивали при комнатной температуре в течение 1 часа. ТСХ показала завершение реакции. Добавляли насыщенный раствор бикарбоната натрия, чтобы осторожно прервать реакцию, и экстрагировали реакционный раствор дихлорметаном. Органические фазы объединяли, промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения с получением неочищенного продукта, который сразу же использовали на следующей стадии без очистки.
1H ЯМР (400 МГц, CDCl3) δ 2,60-2,58 (m, 1H), 2,10-2,07 (m, 1H), 1,72-0,98 (m, 25H), 0,79 (s, 9H), 0,64 (s, 3H), 0,04(s, 6H).
Стадия 3: получение 1-(гидроксиметил)-1Н-пиразол-4-карбонитрила

1Н-пиразол-4-карбонитрил (930 мг, 10 ммоль), 30% водный раствор формальдегида (8 г, 100 ммоль) и 10 мл метанола добавляли в круглодонную колбу объемом 100 мл. Реакционную систему перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали досуха с помощью ротационного испарения с получением 1-(гидроксиметил)-1Н-пиразол-4-карбонитрила (900 мг, 73%).
1H ЯМР (400 МГц, CDCl3) δ 8,05 (s, 1H), 7,87 (s, 1H), 4,96-4,80 (m, 2H). Стадия 4: получение 1-(хлорметил)-1Н-пиразол-4-карбонитрила
1-(гидроксиметил)-1Н-пиразол-4-карбонитрил (900 мг, 7,3 ммоль), триэтиламин (1,5 г, 14,6 ммоль) и 20 мл дихлорметана добавляли в круглодонную колбу объемом 100 мл. П-толуолсульфонилхлорид (2,1 г, 11 ммоль) добавляли порциями при перемешивании и реакционную систему перемешивали при комнатной температуре в течение ночи. Добавляли воду, чтобы прервать реакцию, и экстрагировали реакционный раствор дихлорметаном. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: петролейный эфир/этилацетат = 10/1) с получением 1-(хлорметил)-1Н-пиразол-4-карбонитрила (790 мг, 76,7%). 1H ЯМР (400 МГц, CDCl3) δ 8,08 (s, 1H), 7,89 (s, 1H), 5,87 (s, 2H).
Стадия 5: получение 1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)тио)метил)-1Н-пиразол-4-карбонитрила

(3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексаде кагидро-17Н-циклопента[а]фенантрен-17-тиол (210 мг, 0,5 ммоль), 1-(хлорметил)-1Н-пиразол-4-карбонитрил (72 мг, 0,6 ммоль), карбонат калия (136 мг, 1 ммоль), йодид натрия (10 мг, каталитическое количество) и 5 мл безводного N,N-диметилформамид добавляли в сухую круглодонную колбу объемом 100 мл. Реакционную систему нагревали до 60°С и перемешивали в течение ночи. Реакционный раствор охлаждали до комнатной температуры. Добавляли воду, чтобы прервать реакцию, и экстрагировали реакционный раствор дихлорметаном. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат = 10/1) с получением 1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгекса декагидро-1Н-циклопента[а]фенантрен-17-ил)тио)метил)-1H-пиразол-4-карбонитрила (170 мг, выход: 64,5%).
1H ЯМР (400 МГц, CDCl3) δ 8,10 (s, 1Н), 7,79 (s, 1H), 5,18 (dd, J=14,4, 19,2 Гц, 2Н), 2,62 (t, J=7,2 Гц, 1H), 2,05-1,98 (m, 2Н), 1,90-0,90 (m, 24H), 0,86 (s, 9H), 0,72 (s, 3H), 0,07 (s, 6H).
Стадия 6:
1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)тио)метил)-1H-пиразол-4-карбонитрила

1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)тио)метил)-1Н-пиразол-4-карбонитрил (170 мг, 0,32 ммоль) растворяли в 5 мл безводного тетрагидрофурана в круглодонной колбе объемом 100 мл и добавляли в реакционную систему 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (5 мл). Реакционный раствор перемешивали при 60°С в течение ночи. После завершения реакции реакционную систему охлаждали до комнатной температуры. Добавляли воду, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: петролейный эфир/этилацетат = 1/1) с получением 1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)тио)метил)-1Н-пиразол-4-карбонитрила (100 мг, выход: 75%).
1H ЯМР (400 МГц, CDCl3) δ 8,09 (s, 1H), 7,79 (s, 1H), 5,28-5,02 (m, 2H), 2,58 (t, J=9,4 Гц, 1H), 2,12-1,93 (m, 1H), 1,89-0,94 (m, 26H), 0,72 (s, 3Н).
Пример 168 и пример 169 1-(((S)-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)сульфинил)метил)-1Н-пиразол-4-карбонитрил (168)
1-(((R)-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)сульфинил)метил)-1Н-пиразол-4-карбонитрил (169)

1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)тио)метил)-1Н-пиразол-4-карбонитрил (25 мг, 0,06 ммоль) растворяли в 5 мл безводного дихлорметана в круглодонной колбе объемом 100 мл. При минус 20°С добавляли м-хлорпероксибензойную кислоту (15 мг, 0,073 ммоль) и перемешивали реакционный раствор при этой температуре в течение 1 часа. После завершения реакции добавляли насыщенный раствор бикарбоната натрия, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-(((S)-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)сульфинил)метил)-1Н-пиразол-4-карбонитрила (7,5 мг, 29%) и 1-(((R)-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)сульфинил)метил)-1Н-пиразол-4-карбонитрила (6,5 мг, выход: 25%).
Пример 168
МС m/z (ESI): 430,3 [М+Н]+
1H ЯМР (400 МГц, CDCl3) δ 8,06 (s, 1H), 7,90 (s, 1H), 5,21 (d, J=12,0 Гц, 1Н), 5,03 (d, J=12,0 Гц, 1H), 2,54 (t, J=9,2 Гц, 1H), 2,12-1,93 (m, 2H), 1,85-1,02 (m, 25H), 0,89 (s, 3Н).
Пример 169:
МС m/z (ESI): 430,3 [M+H]+
1H ЯМР (400 МГц, CDCl3) δ 8,10 (s, 1H), 7,91 (s, 1H), 5,18 (d, J=13,6 Гц, 1H), 5,03 (d, J=13,6 Гц, 1H), 2,32 (t, J=8,8 Гц, 1H), 2,05-1,94 (m, 2H), 1,85-1,12 (m, 25H), 1,05 (s, 3Н).
Пример 170
1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)сульфонил)метил)-1Н-пиразол-4-карбонитрил (170)

Стадия 1: получение 1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)сульфонил)метил)-1Н-пиразол-4-карбонитрила
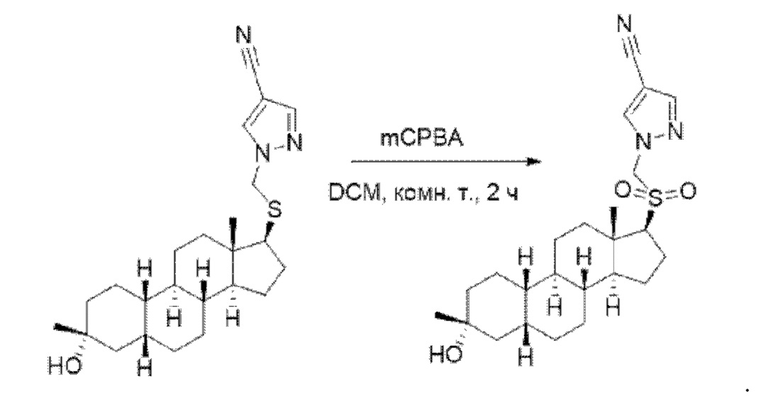
1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)тио)метил)-1Н-пиразол-4-карбонитрил (25 мг, 0,06 ммоль) растворяли в 5 мл безводного дихлорметана в круглодонной колбе объемом 100 мл. При 0°С добавляли м-хлорпероксибензойную кислоту (30 мг, 0,15 ммоль) и перемешивали реакционный раствор при комнатной температуре в течение 2 часов. После завершения реакции добавляли насыщенный раствор бикарбоната натрия, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью препаративной высокоэффективной жидкостной хроматографии с получением 1-((((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопен та[а]фенантрен-17-ил)сульфонил)метил)-1Н-пиразол-4-карбонитрила (9,1 мг, 34%).
МС m/z (ESI): 446,3 [М+Н]+
1H ЯМР (400 МГц, CDCl3) δ 8,13 (s, 1H), 7,89 (s, 1H), 5,24 (d, J=14,8 Гц, 1Н), 5,02 (d, J=14,8 Гц, 1H), 2,88 (t, J=9,2 Гц, 1H), 2,24-2,18 (m, 1H), 2,11-1,92 (m, 3H), 1,84-1,00 (s, 26H).
Пример 171
((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-цикло пента[а]фенантрен-17-ил)метилфенилфосфиноксид (171)

Стадия 1: получение ((3R,5R,8R,9R,10S,13S,14S,17S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)метилфенилфосфиноксида

(3R,5R,8R,9R,10S,13S,14S,17S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-илтрифторметансульфонат (230 мг, 0,43 ммоль), метилфенилфосфиноксид (92 мг, 0,64 ммоль), диацетат палладия (10 мг, 0,04) ммоль), 1,4-бис(дифенилфосфино)бутан (18 мг, 0,04 ммоль), N,N-диизопропилэтиламин (443 мг, 3,4 ммоль) и 10 мл безводного диметилсульфоксида последовательно добавляли в круглодонную колбу объемом 100 мл. Реакционную систему продували азотом, медленно нагревали до 120°С и перемешивали в течение ночи. После завершения реакции реакционную систему охлаждали до комнатной температуры. Добавляли воду, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: дихлорметан/метанол = 10/1) с получением ((3R,5R,8R,9R,10S,13S,14S,)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)метилфенилфосфиноксида (170 мг, выход: 75%).
1H ЯМР (400 МГц, CDCl3) δ 7,77-7,72 (m, 2H), 7,55-7,48 (m, 3H), 6,53-6,50 (m, 1H), 2,44-1,16 (m, 27H), l,00(s, 3H), 0,86 (s, 9H), 0,05 (s, 6H).
Стадия 2: получение ((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)метилфенилфосфиноксида
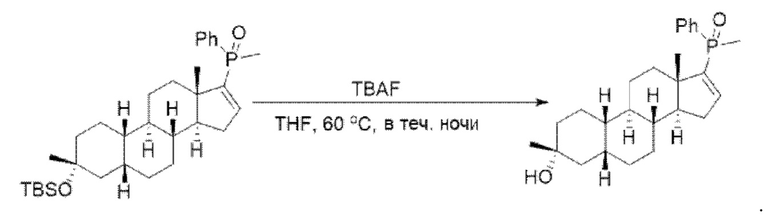
((3R,5R,8R,9R,10S,13S,14S)-3-((трет-бутилдиметилсилил)окси)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)метилфенилфосфиноксид (170 мг, 0,32 ммоль) растворяли в 5 мл безводного тетрагидрофурана в круглодонной колбе объемом 100 мл и добавляли к реакционной системе 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (5 мл). Реакционный раствор перемешивали при 60°С в течение ночи. После завершения реакции реакционную систему охлаждали до комнатной температуры. Добавляли воду, чтобы прервать реакцию, и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (элюент: дихлорметан/метанол = 10/1) с получением ((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)дифенилфосфиноксида (50 мг, выход: 38%).
Стадия 3: получение
((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)метилфенилфосфиноксида

((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)метилфенилфосфиноксид (50 мг, 0,12 ммоль), палладий на угле (50 мг, 10%) и 10 мл этилацетата добавляли в круглодонную колбу объемом 100 мл. Реакционную систему продували водородом три раза и проводили реакцию при 1 атмосфере в течение ночи. После завершения реакции реакционный раствор фильтровали через целит для удаления избытка палладия на угле и концентрировали фильтрат с помощью ротационного испарения досуха. Полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением ((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)метилфенилфосфиноксида (10 мг, выход: 20%).
МС m/z (ESI): 415,3 [М+Н]+.
1H ЯМР (400 МГц, CDCl3) δ 7,79-7,74 (m, 2Н), 7,55-7,50 (m, 3H), 2,41-2,34 (m, 1H), 2,03-1,60 (m, 12H), 1,55-0,73 (m, 21H).
Пример 172
1-((3R,5R,8R,9R,10S,13S,14S)-13-метил-3-(метиламино)гексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она гидрохлорид

Стадия 1: получение (3S,5R,8R,9R,10S,13S,14S)-3-гидрокси-13-метилгексадекагидро-17Н-циклопента[а]фенантрен-17-она

(5R,8R,9R,10S,13S,14S)-13-метилтетрадекагидро-ЗН-циклопента[а]фенантрен-3,17(2Н)-дион (5,90 г, 21,50 ммоль) растворяли в безводном тетрагидрофуране (150 мл) при минус 78°С. Реакционную систему продували азотом и к реакционной системе по каплям добавляли триизобутилборогидрид калия (1,0 М в THF, 32,25 мл, 32,25 ммоль). Реакционный раствор подвергали взаимодействию при минус 78°С в течение 3 часов. Последовательно по каплям добавляли водный раствор гидроксида натрия (10 мас. %, 56,6 мл) и пероксид водорода (82,6 мл), после чего реакционный раствор перемешивали при комнатной температуре в течение получаса. Добавляли насыщенный тиосульфат натрия (100 мл), после чего реакционный раствор перемешивали при комнатной температуре в течение 10 минут. Реакционный раствор экстрагировали этилацетатом (100 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной флэш-хроматографии (петролейный эфир : этилацетат: 4:1) с получением (3S,5R,8R,9R,10S,13S,14S)-3-гидрокси-13-метилгексадекагидро-17Н-циклопента[а]фенантрен-17-она (5,0 г, белое твердое вещество, выход: 84%).
Стадия 2: получение (3S,5R,8R,9R,10S,13S,14S)-17-этилиден-13-метилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола

Гидрид натрия (1,45 г, 36,18 ммоль, 60% в минеральном масле) порциями добавляли к раствору этилтрифенилфосфонийбромида (13,44 г, 36,18 ммоль) в диметилсульфоксиде (100 мл) в атмосфере азота. Реакционный раствор перемешивали при комнатной температуре в течение 1 часа и по каплям добавляли раствор (3S,5R,8R,9R,10S,13S,14S)-3-гидрокси-13-метилгексадекагидро-17Н-циклопента[а]фенантрен-17-она в диметилсульфоксиде (40 мл). Реакционный раствор нагревали до 60°С в течение ночи в атмосфере азота. Реакционный раствор охлаждали до комнатной температуры. Добавляли насыщенный солевой раствор (200 мл), после чего экстрагировали реакционный раствор дихлорметаном (50 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом натрия и концентрировали досуха с помощью ротационного испарения. Полученный неочищенный продукт очищали с помощью колоночной флэш-хроматографии (петролейный эфир : этилацетат: 10:1) с получением (3S,5R,8R,9R,10S,13S,14S)-17-этилиден-13-метилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола (1,60 г, белое твердое вещество, выход: 76,7%).
1H ЯМР (400 МГц, CDCl3) δ 5,14-5,08 (m, 1H), 4,13-4,11 (m, 1H), 2,40-2,33 (m, 1H), 2,28-2,11 (m, 3H), 1,91-1,83 (m, 1H), 1,74-1,58 (m, 8H), 1,47-1,38 (m, 5H), 1,38-1,34 (m, 2H), 1,29-1,07 (m, 7H), 0,88 (s, 3H).
Стадия 3: получение (3S,5R,8R,9R,10S,13S,14S)-17-этилиден-13-метилгексадекагидро-1Н-циклопента[а]фенантрен-3-метансульфоната

(3S,5R,8R,9R,10S,13S,14S)-17-этилиден-13-метилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол (0,40 г, 1,39 ммоль) растворяли в дихлорметане (20 мл) при комнатной температуре. Последовательно по каплям добавляли пиридин (0,33 г, 4,16 ммоль) и метансульфонилхлорид (0,32 г, 2,77 ммоль), после чего реакционный раствор подвергали взаимодействию при комнатной температуре в течение ночи. После завершения реакции реакционный раствор разбавляли дихлорметаном (40 мл) и промывали насыщенным солевым раствором (10 мл × 3). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали с помощью ротационного испарения досуха. Полученный неочищенный продукт очищали с помощью колоночной флэш-хроматографии (петролейный эфир : этилацетат: 10:1) с получением (3S,5R,8R,9R,10S,13S,14S)-17-этилиден-13-метилгексадекагидро-1Н-циклопента[а]фенантрен-3-илметансульфоната (0,30 г, белое твердое вещество, выход: 59%).
Стадия 4: получение (3R,5R,8R,9R,10S,13S,14S)-17-этилиден-N,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-амина

(3S,5R,8R,9R,10S,13S,14S)-17-этилиден-13-метилгексадекагидро-1Н-циклопента[а]фенантрен-3-ил метансульфонат (0,20 г, 0,55 ммоль) добавляли в пробирку для проведения реакций под воздействием микроволнового излучения (10 мл) при комнатной температуре, и в реакционную систему по каплям добавляли спиртовой раствор метиламина (3 мл). Пробирку для проведения реакций под воздействием микроволнового излучения закрывали и нагревали до 80°С в течение ночи. Реакционный раствор охлаждали до комнатной температуры и концентрировали с помощью ротационного испарения досуха. Полученный остаток растворяли в этилацетате (20 мл). Органические фазы промывали насыщенным солевым раствором (20 мл × 3), объединяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали с помощью ротационного испарения досуха. Полученный неочищенный продукт очищали с помощью колоночной флэш-хроматографии (дихлорметан: метанол: триэтиламин: 300:10:3) с получением (3R,5R,8R,9R,10S,13S,14S)-17-этилиден-N,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-амина (70 мг, бесцветное масло, выход: 42,4%).
МС m/z (ESI): 302,5 [М+Н]+.
Стадия 5: получение 1-((3R,5R,8R,9R,10S,13S,14S)-13-метил-3-(метиламино)гексадекагидро-1Н-циклопента[а] фенантрен-17-ил)этан-1-ола

(3R,5R,8R,9R,10S,13S,14S)-17-этилиден-N,13-диметилгексадекагидро-1Н-циклопен та[а]фенантрен-3-амин (0,07 г, 0,23 ммоль) растворяли в безводном тетрагидрофуране (3 мл) на ледяной бане, после чего по каплям добавляли раствор борана в тетрагидрофуране (1,0 М в THF, 2,32 мл, 2,32 ммоль). Реакционный раствор подвергали взаимодействию в течение 3 часов. Последовательно по каплям добавляли раствор гидроксида натрия (3 Н, 1 мл) и пероксид водорода (0,3 мл), после чего реакционный раствор перемешивали при комнатной температуре в течение получаса. Реакционный раствор разбавляли этилацетатом (20 мл) и промывали насыщенным солевым раствором (10 мл × 3). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали досуха с помощью ротационного испарения с получением неочищенного продукта
1-((3R,5R,8R,9R,10S,13S,14S)-13-метил-3-(метиламино)гексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-ола (40 мг, бесцветное масло, неочищенный продукт).
МС m/z (ESI): 320,5 [М+Н]+.
Стадия 6: получение 1-((3R,5R,8R,9R,10S,13S,14S)-13-метил-3-(метиламино)гексадекагидро-1Н-циклопента[а] фенантрен-17-ил)этан-1-она

1-((3R,5R,8R,9R,10S,13S,14S)-13-метил-3-(метиламино)гексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-ол (40 мг 0,125 ммоль) растворяли в дихлорметане (5 мл) при комнатной температуре. Добавляли хлорхромат пиридиния (54 мг, 0,25 ммоль), после чего реакционный раствор подвергали реакции при комнатной температуре в течение 3 часов. Реакционный раствор разбавляли дихлорметаном (20 мл) и промывали насыщенным раствором тиосульфата натрия (10 мл × 3). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали с помощью ротационного испарения досуха. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (дихлорметан: метанол: 30:1) с получением 1-((3R,5R,8R,9R,10S,13S,14S)-13-метил-3-(метиламино)гексадекагидро-1Н-циклопента[а] фенантрен-17-ил)этан-1-она (15 мг, белое твердое вещество, выход: 37,7%).
МС m/z (ESI): 318,5 [М+Н]+
1H ЯМР (400 МГц, CDCl3) δ 3,61-3,55 (m, 1Н), 2,55-2,50 (m, 1H), 2,47 (s, 3H), 2,11 (s, 3H), 2,01-1,92 (m, 3H), 1,78-1,56 (m, 8H), 1,43-1,01 (m, 13H), 0,61 (s, 3H).
Пример 173
1-((3R,5R,8R,9R,10S,13S,14S,17S)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (173)

Стадия 1: получение (3R,5R,8R,9R,10S,13S,14S,16R)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-она

Триметилсилилтрифлат (5,6 мл, 31,0 ммоль) по каплям добавляли к раствору (3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-она (3 г, 10,3 ммоль) и триэтиламина (36,0 мл, 258,2 ммоль) в толуоле (45 мл), и полученный реакционный раствор нагревали с обратным холодильником в течение 2 часов. Реакционный раствор охлаждали, промывали насыщенным бикарбонатом натрия и экстрагировали н-гексаном. Органическую фазу концентрировали досуха с получением неочищенного продукта (((3R,5R,8R,9R,10S,13S,14S)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-3,17-диил)бис(окси))бис(триметилсилана). Селективный фторсодержащий реагент (4,0 г, 11,4 ммоль) добавляли к раствору (((3R,5R,8R,9R,10S,13S,14S)-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-3,17-диил)бис(окси))бис(триметилсилана) в N,N-диметилформамиде (25 мл), и перемешивали полученный реакционный раствор при комнатной температуре в течение 2 часов с получением (3R,5R,8R,9R,10S,13S,14S,16R)-16-фтор-3,13-диметил-3-((триметилсилил)окси)гексадекагидро-17Н-циклопента[а]фенантрен-17-она. Добавляли раствор фторида тетрабутиламмония в тетрагидрофуране (11,4 мл, 1 М) и перемешивали полученный реакционный раствор при комнатной температуре в течение ночи. Реакционный раствор экстрагировали этилацетатом и трижды промывали насыщенным солевым раствором. Органическую фазу концентрировали досуха и полученный неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 6:4) с получением (3R,5R,8R,9R,10S,13S,14S,16R)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-она (2,0 г, выход: 50,9%).
1H ЯМР (400 МГц, CDCl3) δ 5,09 (dd, J=50,6, 7,5 Гц, 1Н), 2,18-1,58 (m, ЮН), 1,54 - 1,01 (m, 14H), 0,92 (s, 3H).
19F ЯМР (376 МГц, CDCl3) δ минус 192,59.
Стадия 2: получение (3R,5R,8R,9R,10S,13S,14S,16R)-17-этилиден-16-фтор-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола

Гидрид натрия (123 мг, 3,08 ммоль, 60 мас. %) добавляли к раствору этилтрифенилфосфонийбромида (1,2 г, 3,24 ммоль) в диметилсульфоксиде (20 мл) порциями в атмосфере азота, и перемешивали полученный реакционный раствор при комнатной температуре в течение 1 часа. Добавляли (3R,5R,8R,9R,10S,13S,14S,16R)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-17Н-циклопента[а]фенантрен-17-он (200 мг, 0,65 ммоль) и нагревали реакционный раствор до 70°С в атмосфере азота в течение ночи. Реакционный раствор охлаждали и добавляли насыщенный солевой раствор. Для доведения рН до 6 добавляли 1 Н соляную кислоту и экстрагировали реакционный раствор этилацетатом. Органическую фазу промывали насыщенным солевым раствором и концентрировали досуха с получением неочищенного продукта. Неочищенный продукт очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 7:3) с получением (3R,5R,8R,9R,10S,13S,14S,16R)-17-этилиден-16-фтор-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола (80 мг, выход: 38,5%).
1H ЯМР (400 МГц, CDCl3) δ 5,71-5,59 (m, 1Н), 5,12 (dt, J=57,2, 7,0 Гц, 1Н), 2,27-2,11 (m, 2H), 1,92-1,24 (m, 21H), 1,22-1,09 (m, 4H), 1,06 (s, 3H).
19F ЯМР (376 МГц, CDCl3) δ минус 153,69.
Стадия 3: получение (3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-17-(1-гидроксиэтил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола

(3R,5R,8R,9R,10S,13S,14S,16R)-17-этилиден-16-фтор-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ол (80 мг, 0,25 ммоль) растворяли в безводном тетрагидрофуране (50 мл). По каплям добавляли раствор борана в тетрагидрофуране (1 М, 2,5 мл) и перемешивали полученный реакционный раствор при комнатной температуре в течение 1 часа. Реакционный раствор охлаждали ледяной водой и медленно по каплям добавляли раствор гидроксида натрия (3 М, 1 мл) при выделении большого количества газа. Медленно по каплям добавляли пероксид водорода (25%, 0,58 мл) и перемешивали реакционный раствор при комнатной температуре в течение 2 часов. Реакционный раствор экстрагировали этилацетатом, промывали раствором тиосульфата натрия и насыщенным солевым раствором и сушили с получением (3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-17-(1-гидроксиэтил)-3,13-диметилгексадекагидр о-1Н-циклопента[а]фенантрен-3-ола (80 мг), который сразу же использовали на следующей стадии.
1H ЯМР (400 МГц, CDCl3) δ 5,47-5,16 (m, 1H), 4,22-4,05 (m, 1H), 2,42-2,17 (m, 1H), 1,94-0,93 (m, 27H), 0,87 (s, 3H).
19F ЯМР (376 МГц, CDCl3) δ минус 178,27.
Стадия 4: получение 1-((3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она

Хлорхромат пиридиния (102 мг, 0,47 ммоль) добавляли к раствору (3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-17-(1-гидроксиэтил)-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-3-ола (80 мг) в ацетоне (2 мл), и полученный реакционный раствор подвергали взаимодействию при 60°С в течение 6 часов. Реакционный раствор концентрировали досуха и полученный остаток очищали с помощью колоночной хроматографии (петролейный эфир : этилацетат = 5:2) с получением 1-((3R,8R,9R,10S,13S,14S,16R,17S)-16-фтор-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она (22 мг, выход: 25%).
1H ЯМР (400 МГц, CDCl3) δ 5,64-5,35 (m, 1H), 2,44-2,09 (m, 6H), 1,97-1,75 (m, 4H), 1,74-1,00 (m, 20H), 0,98-0,68 (m, 2H).
19F ЯМР (376 МГц, CDCl3) δ минус 168,20.
Пример 174
1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)этан-1-он (174)

Стадия 1: получение 1-((3R,5R,8R,9R,10S,13S,14S,17R)-17-бром-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она
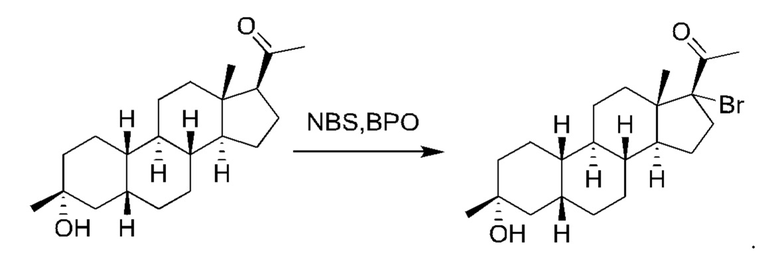
1-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (600 мг, 1,872 ммоль) растворяли в четыреххлористом углероде (10 мл). Добавляли N-бромсукцинимид (666 мг, 3,744 ммоль) и бензоилпероксид (48 мг, 0,187 ммоль), после чего реакционный раствор перемешивали при 80°С в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры. Добавляли воду (30 мл), после чего экстрагировали реакционный раствор этилацетатом (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат = 8/1) с получением 1-((3R,5R,8R,9R,10S,13S,14S,17R)-17-бром-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она (светло-желтое твердое вещество, 400 мг, выход: 54%).
1H ЯМР (400 МГц, CDCl3) δ 3,09-3,01 (m, 1H), 2,38 (s, 3H), 2,32-2,20 (m, 1H), 2,10-1,98 (m, 1H), 1,97-1,72 (m, 7H), 1,71-1,58 (m, 1H), 1,57-0,94 (m, 15H), 0,89-0,81 (m, 1Н), 0,76 (s, 3Н).
Стадия 2: получение 1-((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она

1-((3R,5R,8R,9R,10S,13S,14S,17R)-17-бром-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а] фенантрен-17-ил)этан-1-он (400 мг, 1 ммоль) растворяли в безводном толуоле (10 мл). Добавляли 1,8-диазабициклоундек-7-ен (913 мг, 6 ммоль), после чего реакционный раствор перемешивали при 110°С в течение 16 часов. Реакционный раствор охлаждали до комнатной температуры. Добавляли воду (20 мл), после чего экстрагировали реакционный раствор этилацетатом (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат = 4/1) с получением 1-((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она (бесцветное масло, 160 мг, выход: 51%).
1H ЯМР (400 МГц, CDCl3) δ 6,69 (dd, J=3,1, 1,7 Гц, 1Н), 2,41-2,28 (m, 2H), 2,25 (s, 3Н), 2,07-1,93 (m, 1Н), 1,89-1,76 (m, 3Н), 1,71-1,69 (m, 4H), 1,53-1,41 (m, 5H), 1,37-1,29 (m, 4H), 1,27 (s, 3Н), 1,24-1,07 (m, 3Н), 0,89 (s, 3H).
Стадия 3: получение 1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)этан-1-она

Гидрид натрия (45 мг, 1,136 ммоль, 60%) суспендировали в диметилсульфоксиде (2 мл). Добавляли триметилсульфоксид (100 мг, 0,451 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 1 часа. Добавляли смешанный раствор 1-((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она (90 мг, 0,284 ммоль) и тетрагидрофурана (2 мл), после чего реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Добавляли воду (15 мл), после чего экстрагировали реакционный раствор этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (15 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат = 4/1) с получением 1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)этан-1-она (бесцветное масло, 40 мг, выход: 43%).
1H ЯМР (400 МГц, CDCl3) δ 2,26-2,18 (m, 1H), 1,95 (s, 3H), 1,92-1,85 (m, 1H), 1,81 (m, 2H), 1,72-1,53 (m, 5H), 1,46-1,29 (m, 7H), 1,29-1,17 (m, 7H), 1,16-1,00 (m, 3H), 0,94 (s, 3H), 0,91-0,78 (m, 2H).
Пример 175
1-(2-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (175)

Стадия 1: получение 2-бром-1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)этан-1-она

1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)этан-1-он (40 мг, 0,121 ммоль) растворяли в метаноле (2 мл). Добавляли каплю бромистого водорода и 2 капли жидкого брома, после чего реакционный раствор перемешивали при комнатной температуре в течение 1,5 часов. Добавляли воду (15 мл), после чего экстрагировали реакционный раствор этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (15 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 2-бром-1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)этан-1-она (50 мг, неочищенный продукт).
Стадия 2: получение 1-(2-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила

2-бром-1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)этан-1-он (40 мг, 0,098 ммоль) растворяли в тетрагидрофуране (5 мл). Добавляли 4-цианопиразол (11 мг, 0,0118 ммоль) и карбонат калия (27 мг, 0,196 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Добавляли воду (15 мл), после чего экстрагировали реакционный раствор этилацетатом (10 мл × 2). Органические фазы объединяли, промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-(2-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила (18 мг, выход: 44%).
МС m/z (ESI): 422,2 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,76 (s, 1Н), 7,74 (s, 1H), 5,11 (d, J=18,0 Гц, 1Н), 4,91 (d, J=18,0 Гц, 1Н), 3,61-3,49 (m, 1Н), 2,96 (d, J=8,7 Гц, 1Н), 2,17-2,05 (m, 2H), 1,90-1,70 (m, 5H), 1,68-1,5 (m, 7H), 1,45-1,35 (m, 5H), 1,34-1,01 (m, 7H), 0,65 (s, 3H).
Пример 176
1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)-2-(4-(трифторметил)-1Н-пиразол-1-ил)этан-1-он (176)

Стадия 1: получение 1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)-2-(4-(трифторметил)-1Н-пиразол-1-ил)этан-1-она

2-бром-1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)этан-1-он (40 мг, 0,098 ммоль) растворяли в тетрагидрофуране (5 мл). Добавляли 3-цианопиразол (11 мг, 0,0118 ммоль) и карбонат калия (27 мг, 0,196 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Добавляли воду (15 мл), после чего экстрагировали реакционный раствор этилацетатом (10 мл x 2). Органические фазы объединяли, промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-((2aR,4R,6aS,6bR,8aS,8bS,9aS,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидроциклопропа[3,4]циклопента[1,2-а]фенантрен-8b(2Н)-ил)-2-(4-(трифторметил)-1Н-пиразол-1-ил)этан-1-она (18 мг, выход: 44%).
МС m/z (ESI): 465,2 [M+H]+
1H ЯМР (400 МГц, CDCl3) δ 7,74 (s, 1Н), 7,70 (s, 1H), 4,90 (d, J=17,3 Гц, 1Н), 4,71 (d, J=17,3 Гц, 1Н), 2,18 (m, 1Н), 2,10-2,03 (m, 1Н), 1,81 (m, 3H), 1,76-1,58 (m, 4H), 1,57 - 1,32 (m, ЮН), 1,26 (s, 3H), 1,19-1,00 (m, 4H), 0,98 (s, 3H), 0,92 (m, 2H).
Пример 177
1-(2-((2aR,4R,6aS,6bR,8aS,8bS,9aR,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидро-8bH-нафто[2',1':4,5]индено[1,2-b]оксирен-8b-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрил (177)

Стадия 1: получение 1-((2aR,4R,6aS,6bR,8aS,8bS,9aR,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидро-8bH-нафто[2',1':4,5]индено[1,2-b]оксирен-8b-ил)этан-1-она

1-((3R,5R,8R,9R,10S,13S,14S)-3-гидрокси-3,13-диметил-2,3,4,5,6,7,8,9,10,11,12,13,14,15-тетрадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (80 мг, 0,242 ммоль) растворяли в метаноле (5 мл) и воде (1 мл). Добавляли пероксид водорода (1,3 мл) и гидроксид натрия (30 мг, 0,75 ммоль), после чего реакционный раствор перемешивали при 0°С в течение 16 часов. Добавляли воду (15 мл), после чего экстрагировали реакционный раствор этилацетатом (15 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении, и полученный остаток очищали с помощью колоночной хроматографии (петролейный эфир/этилацетат = 4/1) с получением 1-((2aR,4R,6aS,6bR,8aS,8bS,9aR,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидро-8bH-нафто[2',1':4,5]индено[1,2-b]оксирен-8b-ил)этан-1-она (60 мг, выход: 75%).
1H ЯМР (400 МГц, CDCl3) δ 3,66 (s, 1H), 2,03 (s, 3H), 1,94 (m, 1H), 1,87-1,75 (m, 3H), 1,74-1,61 (m, 3H), 1,47 (m, 2H), 1,43-1,37 (m, 4H), 1,35-1,30 (m, 3H), 1,25 (s, 6H), 1,17-1,07 (m, 3H), 1,03 (s, 3H).
Стадия 2: получение 2-бром-1-((2aR,4R,6aS,6bR,8aS,8bS,9aR,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидро-8bH-нафто[2',1':4,5]индено[1,2-b]оксирен-8b-ил)этан-1-она

1-((2aR,4R,6aS,6bR,8aS,8bS,9aR,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидро-8bH-нафто[2',1':4,5]индено[1,2-b]оксирен-8b-ил)этан-1-он (50 мг, 0,15 ммоль) растворяли в метаноле (3 мл). Добавляли каплю бромистого водорода и 2 капли жидкого брома, после чего перемешивали реакционный раствор при комнатной температуре в течение 8 часов. Добавляли воду (10 мл), после чего экстрагировали реакционный раствор этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (15 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 2-бром-1-((2aR,4R,6aS,6bR,8aS,8bS,9aR,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидро-8bH-нафто[2',1':4,5]индено[1,2-b]оксирен-8b-ил)этан-1-она (60 мг, неочищенный продукт).
Стадия 3: получение 1-(2-((2aR,4R,6aS,6bR,8aS,8bS,9aR,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидро-8bH-нафто[2',1':4,5]индено[1,2-b]оксирен-8b-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила

2-бром-1-((2aR,4R,6aS,6bR,8aS,8bS,9aR,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидро-8bH-нафто[2',1':4,5]индено[1,2-b]оксирен-8b-ил)этан-1-он (60 мг, 0,146 ммоль) растворяли в тетрагидрофуране (3 мл). Добавляли 4-цианопиразол (20 мг, 0,219 ммоль) и карбонат калия (60 мг, 0,438 ммоль), после чего реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Добавляли воду (15 мл), после чего экстрагировали реакционный раствор этилацетатом (10 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (15 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографии с получением 1-(2-((2aR,4R,6aS,6bR,8aS,8bS,9aR,10aS,10bR)-4-гидрокси-4,8а-диметилгексадекагидро-8bН-нафто[2',1':4,5]индено[1,2-b]оксирен-8b-ил)-2-оксоэтил)-1Н-пиразол-4-карбонитрила (18 мг, выход: 29%).
МС m/z (ESI): 424,2 [M+H]+
1H ЯМР (400 МГц, CDCl3) δ 7,84 (s, 1H), 7,82 (s, 1H), 5,07 (d, J=18,3 Гц, 1Н), 4,87 (d, J=18,3 Гц, 1H), 3,85 (s, 1H), 2,03 (dd, J=13,1, 5,6 Гц, 1H), 1,94-1,91 (m, 1H), 1,84-1,78 (m, 3H), 1,76-1,64 (m, 3H), 1,52-1,28 (m, 10H), 1,26 (s, 4H), 1,19-1,09 (m, 3H), 1,07 (s, 3H).
Пример 178
(3R,5R,8R,9R,10S,13S,14S,16R,17S)-3-гидрокси-3,13-диметил-17-(2-(4-(трифторметил)-1Н-пиразол-1-ил)ацетил)гексадекагидро-1Н-циклопента[а]фенантрен-16-карбонитрил (178)

Стадия 1: получение (3R,5R,8R,9R,10S,13S,14S,16R,17S)-17-(2-бромацетил)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-16-карбонитрила

(3R,5R,8R,9R,10S,13S,14S,16R,17S)-17-ацетил-3-гидрокси-3,13-диметилгексадекаги дро-1Н-циклопента[а]фенантрен-16-карбонитрил (120 мг, 0,349 ммоль) растворяли в метаноле (3 мл). Добавляли жидкий бром (83 мг, 0,524 ммоль) и каплю бромистого водорода, после чего реакционный раствор перемешивали при комнатной температуре в течение 5 часов. Добавляли воду (30 мл), после чего экстрагировали реакционный раствор этилацетатом (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали досуха при пониженном давлении с получением (3R,5R,8R,9R,10S,13S,14S,16R,17S)-17-(2-бромацетил)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-16-карбонитрила (140 мг, неочищенный продукт).
Стадия 2: получение (3R,5R,8R,9R,10S,13S,14S,16R,17S)-3-гидрокси-3,13-диметил-17-(2-(4-(трифторметил)-1Н-пиразол-1-ил)ацетил)гексадекагидро-1Н-циклопента[а]фенантрен-16-карбонитрила

Смесь
(3R,5R,8R,9R,10S,13S,14S,16R,17S)-17-(2-бромацетил)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а] фенантрен-16-карбонитрила (100 мг, 0,23 ммоль), 4-(трифторметил)-1Н-пиразола (63 мг, 0,46 ммоль), карбоната калия (95 мг, 0,69 ммоль) и тетрагидрофурана (5 мл) перемешивали при комнатной температуре в течение 16 часов. Добавляли воду (20 мл), после чего экстрагировали реакционный раствор этилацетатом (20 мл × 3). Органические фазы объединяли, промывали насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали досуха при пониженном давлении и полученный неочищенный продукт очищали с помощью высокоэффективной жидкостной хроматографией с получением (3R,5R,8R,9R,10S,13S,14S,16R,17S)-3-гидрокси-3,13-диметил-17-(2-(4-(трифторметил)-1Н-пиразол-1-ил)ацетил)гексадекагидро-1Н-циклопента[а]фенантрен-16-карбонитрила (25 мг, выход: 23%).
МС m/z (E8I): 478,2 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,76 (s, 1H), 7,74 (s, 1H), 5,01 (dd, J=77,6, 18,0 Гц, 2Н), 3,65-3,36 (m, 1H), 2,96 (d, J=8,7 Гц, 1H), 2,18-2,04 (m, 2Н), 1,89-1,71 (m, 5H), 1,69-1,60 (m, 5H), 1,46-1,39 (m, 5H), 1,32-1,25 (m, 5H), 1,24-1,03 (m, 3H), 0,65 (s, 3H).
Пример 179
2-(1-гидрокси-4-аминоадамантан)-1-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (179)

Стадия 1: получение 2-(1-гидрокси-4-аминоадамантан)-1-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-она

В соответствии с примером 5 в качестве исходного вещества использовали 2-бром-1-((3R,5R,8R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он, соответственно, был получен 2-(1-гидрокси-4-аминоадамантан)-1-((3R,5R,8R,9R,10S,13S,14S,17S)-3-гидрокси-3,13-диметилгексадекагидро-1Н-циклопента[а]фенантрен-17-ил)этан-1-он (7,5 мг, выход: 10,2%).
1H ЯМР (400 МГц, CDCl3) δ 3,55 (d, J=2,8 Гц, 2Н), 2,72 (s, 1H), 2,50 (t, J=8,9 Гц, 1H), 2,29-0,93 (m, 40H), 0,64 (s, 3Н).
Биологический анализ и оценка
Настоящее изобретение дополнительно описано ниже в сочетании со следующими тестовыми примерами, которые не предназначены для ограничения объема настоящего изобретения.
I. Исследование способности соединения согласно настоящему изобретению связывать рецептор ГАМКд
1.1. Цель эксперимента: целью этого тестового примера является измерение способности соединения аллостерически ингибировать связывание блокатора ионных каналов (трет-бутилбициклофосфоротионат (TBPS)) с рецептором ГАМК-А.
Оборудование для эксперимента:


1.2 Методики экспериментов
1.2.1 Извлечение клеточной мембраны коры головного мозга:
1. Выделяют кору головного мозга самцов крыс Sprague-Dawley.
2. К коре головного мозга добавляют предварительно охлажденный 0,32 М раствор сахарозы (добавляют одну таблетку ингибитора протеаз на 100 мл) (объем раствора сахарозы в 10 раз превышал объем коры головного мозга). Смесь измельчают порциями в стеклянном гомогенизаторе тканей объемом 50 мл и хорошо перемешивают.
3. Смесь центрифугируют при 1500 g, 4°С в течение 10 минут и собирают супернатант.
4. Смесь центрифугируют при 20000 g, 4°С в течение 30 минут и отбрасывают супернатант.
5. Осадок повторно суспендируют в предварительно охлажденном натрий-фосфатном буфере (PBS) (добавляют одну таблетку ингибитора протеазы на 100 мл). На одну крысу добавляют в среднем 4 мл PBS и смесь хорошо перемешивают с помощью стеклянного гомогенизатора тканей.
6. Смесь центрифугируют при 10000 g, 4°С в течение 10 минут и отбрасывают супернатант.
7. Стадии 5 и 6 повторяют трижды.
8. Наконец, осадок повторно суспендируют в 4 объемах PBS. Полученный раствор разливают, замораживают в жидком азоте и хранят при минус 80°С.
9. Концентрацию белка измеряют методом бицинхониновой кислоты (ВСА).
1.2.2 Анализ связывания 35S-TBPS
1. 230 мкл PBS добавляют в каждую лунку планшета с лунками объемом 1,1 мл.
2. В каждую лунку добавляют 60 мкл раствора мембраны клеток коры головного мозга (5 мкг/мкл) и смесь хорошо перемешивают.
3. Добавляют тестируемое соединение (3 мкл на лунку) и инкубируют планшет при 25°С в течение 5 минут. Концентрация DMSO составляла 1%. Начальная концентрация соединения составляла 1 мкМ, и выполняют последовательное 3-кратное разбавление с получением в общей сложности 8 последовательно изменяющихся концентраций и 2 параллельных анализов. 1% DMSO используют в качестве отрицательного контроля, а 10 мкМ Р026-2 используют в качестве положительного контроля.
4. Добавляют ГАМК до конечной концентрации 5 мкМ и инкубируют при 25°С в течение 5 минут. Готовят 1 мМ раствор ГАМК, и 1,5 мкл раствора добавляют в каждую лунку.
5. Добавляют 35S-TBPS до конечной концентрации 2 нМ. Концентрация маточного раствора изотопа составляла 9,7 мкМ. После 100-кратного разведения PBS в каждую лунку добавляют 6 мкл разбавленного раствора изотопа.
6. Планшет инкубируют при 4°С в течение 20 часов.
7. Планшет FilterMate GF/C предварительно обрабатывали 0,5% PEI и инкубируют при 4°С в течение 1 часа.
8. Планшет FilterMate GF/C дважды промывают с универсальным сборщиком, каждый раз по 50 мл PBS.
9. Реакционный раствор переносят в планшет GF/C и каждую лунку промывают 4 раза 900 мкл PBS.
10. Промытый планшет GF/C помещают при 55°С и сушат в течение 10 минут.
11. В каждую лунку добавляют 40 мкл сцинтиллирующего раствора и считывают значение СРМ с помощью TopCount.
1.2.3 Метод обработки экспериментальных данных:
В эксперименте значение СРМ (импульсов в минуту) считывали с помощью TopCount. Согласно показаниям высокой контрольной (DMSO) и низкой контрольной (10 мкМ положительное соединение) экспериментальных групп, % ингибирования рассчитывали по следующей формуле:

IC50 соединения рассчитывали по следующей 4-параметрической нелинейной логической формуле:

где:
Х представляет собой логарифм концентрации соединения,
Y представляет собой % ингибирования.
Действие соединения согласно настоящему изобретению на активность связывания TBPS определяли с помощью вышеуказанного теста, и измеренные значения 1C 50 показаны в таблице 1.


Вывод: соединения из примеров настоящего изобретения обладают значительным ингибирующим действием на активность связывания TBPS.
II. Фармакокинетический анализ на мышах Balb/c
1. Цель исследования:
В качестве подопытных животных использовали мышей Balb/c. Исследовали фармакокинетический профиль соединений примеров 2, 3, 5, 6, 9, 13, 59, 60, 61, 63, 71-74, 81, 103, 130, 134, 135, 137, 138, 140, 141, 143, 145 и 146 у мышей (плазма и ткань головного мозга) при пероральном введении в дозе 5 мг/кг.
2. Протокол исследования
2.1 Исследуемые соединения:
Соединения примеров 59, 60, 61, 63, 71-74, 81, 103, 130, 134, 135, 137, 138, 140, 141, 143, 145 и 146 настоящего изобретения, полученные заявителем.
2.2 Подопытные животные:
Самцы мышей Balb/c были приобретены у Shanghai Jiesijie Laboratory Animal Co., LTD, с сертификатом №: SCXK (Shanghai) 2013-0006 N0.311620400001794.
2.3 Введение:
В каждой группе было 24 самца мышей Balb/c. После ночного голодания мышам Balb/c перорально вводят исследуемое соединение в дозе 5 мг/кг и при объеме введения 10 мл/кг.
2.4 Сбор образцов:
Из сердца берут 0,2 мл крови перед введением и через 0, 0,5, 1, 2, 4, 6, 8 и 24 часа после введения. Образцы хранят в пробирках с EDTA-K2 и центрифугируют в течение 6 минут при 4°С, 6000 об/мин для отделения плазмы. Образцы плазмы хранят при минус 80°С. Мышей умерщвляют с помощью CO2, всю ткань головного мозга извлекают, взвешивают, помещают в центрифужную пробирку на 2 мл и хранят при минус 80°С.
2.5 Обработка образцов:
1) 160 мкл ацетонитрила добавляют к 40 мкл образца плазмы для осаждения, после чего смесь центрифугируют в течение 5-20 минут при 3500 × g.
2) 90 мкл ацетонитрила, содержащего внутренний стандарт (100 нг/мл), добавляют к 30 мкл образцов гомогената плазмы и головного мозга для осаждения, после чего смесь центрифугируют в течение 8 минут при 13000 об/мин.
3) Берут 70 мкл обработанного супернатанта, добавляют к 70 мкл воды и перемешивают на вортекс смесителе в течение 10 минут. Отбирают 20 мкл смеси для анализа концентрации исследуемого соединения с помощью ЖХ/МС/МС. Прибор для анализа методом ЖХ/МС/МС: АВ Sciex API 4000 Qtrap.
2.6 Анализ методом жидкостной хроматографии
Условия проведения жидкостной хроматографии: насос Shimadzu LC-20AD.
Хроматографическая колонка: Agilent ZORBAX XDB-C18 (50х2,1 мм, 3,5 мкм);
Подвижная фаза: элюент А представлял собой 0,1% раствор муравьиной кислоты в воде, а элюент В представлял собой ацетонитрил.
Скорость потока: 0,4 мл/мин
Время элюирования: 0-4,0 мин, элюент представлял собой следующий:

3. Результаты исследования и анализ
Основные параметры фармакокинетики рассчитывали с помощью WinNonlin 6.1. Результаты фармакокинетического исследования на мышах приведены в таблице 2 ниже:

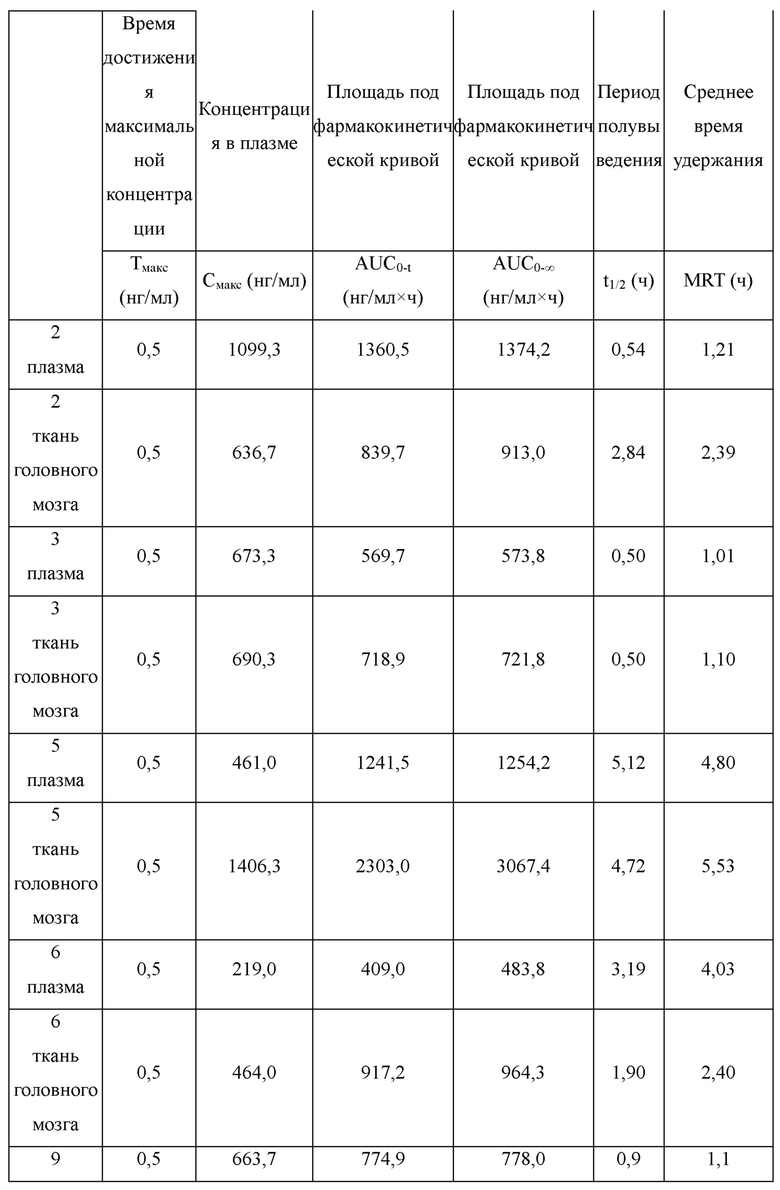




Из результатов фармакокинетического исследования на мышах в таблице можно видеть, что соединения из примеров настоящего изобретения показали хорошие метаболические свойства, и как величина экспозиции AUC, так и максимальная концентрация лекарственного средства в крови Смаке показали хорошие результаты.
III. Фармакодинамическое исследование in vivo на модели принудительного плавания на мышах
3.1 Цель эксперимента
Антидепрессивное действие соединения оценивали на модели принудительного плавания на мышах.
3.2 Основные инструменты и реактивы, использованные в эксперименте
3.2.1 Инструменты
Устройство для принудительного плавания (JLBehv-FSC-4, Shanghai Jiliang Software Technology Co., Ltd.).
3.2.2 Реагенты
Натрий-карбоксиметилцеллюлоза (КМЦ-Na, SLBV9664, Sigma)
Tween 80 (BCBV8843, Sigma)
3.2.3 Исследуемые соединения
Заявителем были получены соединения примера 2, примера 3, примера 5, примера 6, примера 9, примера 13, примеров 59-63, примеров 71-74, примера 103, примера 135, примера 137, примера 145 и примера 146 настоящего изобретения.
3.3 Методики эксперимента
3.3.1 Адаптация:
Самцов мышей ICR (25-35 г) адаптировали к среде проведения исследования за 3 дня перед тестом принудительного плавания.
В соответствии с планом исследования мышей случайным образом распределяли на группы за день до проведения испытания в соответствии с массой тела, по 12 мышей в каждой группе. Перед началом испытания соединения согласно каждому примеру вводили внутрижелудочно в соответствии с их Tmax в головном мозге в фармакокинетическом исследовании у мышей, следующим образом:
1) Модельная группа (раствор 0,5% КМЦ-Na - 1% Tween 80, перорально, 10 мл/кг);
2) Соединения примера 2, примера 3, примера 5, примера 6, примера 9, примеров 59-63, примеров 71-73, примера 103, примера 135, примера 137, примера 145 и примера 146 (10 мг/кг, п/о, 10 мл/кг); примера 13 и примера 74 (5 мг/кг, п/о, 5 мл/кг).
При введении соединения каждого примера суспендировали в растворе 0,5% КМЦ-Na + 1% Tween 80 до желаемой концентрации.
3.3.2 Исследование принудительного плавания:
Через 0,5-1 час после введения мышей ICR помещали в устройство для принудительного плавания (прозрачный стеклянный барабан (глубина воды 18 см, температура воды 25-26°С), одна мышь на резервуар) и заставляли плавать в течение 6 минут. Устройство для принудительного плавания регистрировало время свободного плавания на поверхности мышей ICR в течение всех 6 минут, и данные последних четырех минут использовались для анализа данных. Мышей вынимали сразу после теста на плавание, вытирали насухо и помещали обратно в их исходные клетки.
Примечание: критерием определения времени неподвижности является то, что мышь перестает сопротивляться в воде и свободно плавает на поверхности, и наблюдаются лишь легкие движения конечностей, чтобы голова оставалась на поверхности воды.
3.4 Анализ данных
Процент времени свободного плавания на поверхности = 100 * время свободного плавания на поверхности/240 с.
3.5 Данные исследования

3.6 Результаты испытания
Из приведенных выше результатов можно видеть, что соединения из примеров настоящей заявки могут значительно сократить совокупное время неподвижности мышей, вынужденных плавать, и имеют значительное антидепрессивное действие.
Время неподвижности в течение последних четырех минут соединений примера 3, примера 60, примера 61, примера 72, примера 73, примера 137 и примера 146 имело очень значительную разницу по сравнению с таковым в референсной группе.
IV. Фармакодинамическое исследование in vivo на модели индуцированной PTZ (пентилентетразол) эпилепсии у мышей
4.1 Цель исследования
Была создана модель индуцированной PTZ эпилепсии у мышей CD-1, и противоэпилептическое действие соединений примера 3, примера 60, примера 61 и примера 74 было оценено с использованием этой модели.
4.2 Метод проведения исследования
4.2.1 Подопытные животные
50 самцов мышей CD-1 были приобретены у Beijing Vital River Laboratory Animal Technology Co. Ltd. Подопытных животных адаптировали в помещении для животных в третьем здании Shanghai ChemPartner Co., Ltd за 7 дней до испытания. Средняя масса тела животных в день испытания составляла 32,2±0,2 грамма. Среда для кормления: 5 животных на клетку, комнатная температура 23±2°С, 12/12 часов светового и темного цикла, свободный доступ к пище и воде.
Для проведения исследования мышей случайным образом распределяли на группы в день исследования.
4.2.2 Исследуемые соединения
Соединения примера 3, примера 60, примера 61 и примера 74 (полученные заявителем). Исследуемые соединения хранили в холодильнике при 4°С.


4.2.1 Оборудование для исследования
Стерильный одноразовый шприц на 1 мл с иглой (приобретен у Zhejiang Kangdelai Medical Devices Co., Ltd.)
Пипетка: Eppendorf Research Plus (100-1000 мкл)
Вортекс смеситель: Kylin-Bell Vortex 5
Ультразвуковой прибор: ультразвуковой очиститель JL-360
Весы: прецизионные весы METTLER TOLEDO XS204
Весы: электронные весы METTLER TOLEDO XS6002S
Коробка из оргстекла: длина 25 см * ширина 15 см * высота 15 см с одной непрозрачной боковой стенкой, изготовлена на заказ Suzhou Fengshi Laboratory Animal Equipment Co., Ltd
3-канальный таймер: Oregon/Модель №WB-388.
4.2.2 Распределение подопытных животных на группы
1) Носитель/PTZ: 0,5% КМЦ-Na + 1% Tween-80 (10 мл/кг, п/о), вводимый за 0,5 часа до введения PTZ; PTZ (120 мл/кг, п/к), вводимый перед исследованием;
2) 3 мг/кг соединений из примеров/PTZ: соединения примера 3, примера 60, примера 61 и примера 74 (3 мг/кг, 10 мл/кг, п/о), вводимых за 0,5 ч до введения PTZ; PTZ (120 мл/кг, п/к), вводимый перед исследованием.
4.3 Методики эксперимента
4.3.1 Состав растворителя
1) 0,5% КМЦ-Na + 1%Tween-80 (вводимый объем: 10 мл/кг):
1 г натрий-карбоксиметилцеллюлозы точно взвешивали и добавляли в бутыль объемом 250 мл с растворителем, затем добавляли 150 мл бидистиллированной воды. Смесь перемешивали при комнатной температуре в течение 4 часов с помощью магнитной мешалки до получения однородного и прозрачного раствора. Медленно добавляли 2 мл Tween-80 и перемешивали смесь при комнатной температуре в течение 3 часов до получения однородного и прозрачного раствора. Раствор медленно переносили в мерную колбу объемом 200 мл и добавляли бидистиллированную воду до постоянного объема 200 мл. Раствор переносили в бутыль с растворителем объемом 250 мл и перемешивали в течение 1 часа с помощью магнитной мешалки для получения однородного и прозрачного раствора.
2) 30% гидроксипропил-β-циклодекстрина:
30,6122 г гидроксипропил-β-циклодекстрина (чистота: 98%) точно взвешивали и добавляли в бутыль объемом 100 мл с растворителем, затем добавляли 60 мл бидистиллированной воды. Смесь перемешивали на вортекс смесителе в течение 3 минут и обрабатывали ультразвуком при комнатной температуре в течение 15 минут для получения однородного и прозрачного раствора. Добавляли бидистиллированную воду добавляли до постоянного объема 100 мл, перемешивали на вортекс смесителе в течение 1 минуты и обрабатывали ультразвуком при комнатной температуре в течение 5 минут для получения однородного и прозрачного раствора.
4.3.2 Состав исследуемого соединения
1) 12 мг/мл PTZ (доза: 120 мг/кг; вводимый объем: 10 мл/кг):
248 мг PTZ точно взвешивали и добавляли в коричневую колбу объемом 40 мл, затем добавляли 20,667 мл физиологического раствора. Смесь перемешивали на вортекс смесителе в течение 2 минут и обрабатывали ультразвуком при комнатной температуре в течение 2 минут для получения однородного и прозрачного раствора (концентрация: 15 мг/мл).
2) 0,3 мг/мл соединений примера 5 или примера 23 (доза: 3 мг/кг; вводимый объем: 10 мл/кг):
Отбирали определенное количество 0,5% КМЦ-Na + 1% Tween-8 и добавляли в колбу, содержащую определенное количество соединений примера 5 или примера 23. Смесь перемешивали на вортекс смесителе в течение 3 минут и обрабатывали ультразвуком при комнатной температуре в течение 15 минут для получения однородной суспензии (концентрация: 0,3 мг/мл).
4.3.3 Метод проведения исследования
1) Подопытных животных перевели в операционную для адаптации к окружающей среде за 1 час до исследования;
2) Животные были случайным образом распределены на группы, помечены и взвешены;
3) Соединения примера 3, примера 60, примера 61 и примера 74 вводили соответственно за 1 час до введения PTZ, или 0,5% КМЦ-Na + 1% Tween-80, соединения примера 3, примера 60, примера 61 и примера 74 вводили соответственно за 0,5 часа до введения PTZ;
4) PTZ (120 мг/кг) вводили подкожно перед наблюдением за ходом исследования, и эту временную точку учитывали как точку начала наблюдения;
5) После введения PTZ животное сразу помещали в бокс для наблюдения и наблюдали в течение 30 минут, и регистрировали следующее: а) инкубационный период первых клонических судорог, b) инкубационный период первых генерализованных тонических судорог, с) количество клонических судорог, d) количество генерализованных тонических судорог, е) время, когда животное погибло, 6) если у животного не было судорог в течение 30-минутного периода наблюдения, инкубационный период регистрировали равным 1800 секундам, а количество судорог регистрировали равным 0.
Клонические судороги: генерализованные клонические судороги у животных длятся более 3 секунд и сопровождается падением;
Тонические судороги: конечности выпрямляются под углом на 90° к телу;
6) Возможные побочные действия, вызванные лекарственным средством после введения, наблюдались и регистрировались, и их можно разделить на четыре уровня:
Отсутствуют: нормальный
Легкий седативный эффект
Умеренный седативный эффект
Сильный седативный эффект
7) Тест проводили с 12:00 до 16:30.
4.4 Адаптация к окружающей среде
Подопытных животных перевели в операционную для адаптации к окружающей среде за 1 час до исследования.
4.5 Распределение на группы и введение
Мышей случайным образом распределяли, помечали и взвешивали; по 10 мышей на группу. Исследуемое соединение вводили перорально в объеме 10 мл/кг за 30-60 минут до введения PTZ.
4.6 Моделирование и исследование PTZ
PTZ (120 мг/кг) вводили подкожно перед наблюдением за ходом исследования, и эту временную точку учитывали как начальную точку наблюдения; после введения PTZ животное сразу помещали в бокс для наблюдения и наблюдали в течение 30 минут, и регистрировали следующее: а) инкубационный период первых клонических судорог, b) инкубационный период первых генерализованных тонических судорог, с) количество клонических судорог, d) количество генерализованных тонических судорог, е) время, когда животное погибло. Если у животного не было судорог в течение 30-минутного периода наблюдения, инкубационный период регистрировали равным 1800 секундам и количество припадков регистрировали равным 0.
4.7 Анализ данных
Все данные измерений были выражены как среднее значение ± стандартная ошибка среднего (СОС) и проанализированы с помощью статистического программного обеспечения Prism 6.0.
4.7 Данные, полученные в ходе исследования


4.9 Результаты исследования
Соединения из примеров значительно продлевали инкубационный период клонических судорог и генерализованных тонических судорог, и снижали количество клонических судорог и генерализованных тонических судорог по сравнению с контрольной группой. Соединения из примеров могут защитить от смерти 60-100% животных, значительно продлить инкубационный период смерти и обладают хорошим противоэпилептическим действием.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕГУЛЯТОРЫ ПРОИЗВОДНЫХ СТЕРОИДОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2803499C1 |
| НЕЙРОАКТИВНЫЕ СТЕРОИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2830163C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2019 |
|
RU2809023C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 2018 |
|
RU2810331C2 |
| МОДУЛЯТОРЫ SHIP1 И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2014 |
|
RU2679805C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ УЛУЧШЕНИЯ КАЧЕСТВА МЫШЦ | 2015 |
|
RU2724329C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ ЦНС | 2015 |
|
RU2733756C2 |
| СТЕРОИДЫ, ВЫСВОБОЖДАЮЩИЕ ОКСИД АЗОТА | 2008 |
|
RU2442790C2 |
| Макрогетероциклические нуклеозидные производные и их аналоги, получение и применение | 2017 |
|
RU2731385C1 |
| СОДЕРЖАЩАЯ ПРОИЗВОДНОЕ С ТРЕМЯ КОНДЕНСИРОВАННЫМИ КОЛЬЦАМИ СОЛЬ ИЛИ КРИСТАЛЛИЧЕСКАЯ ФОРМА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2020 |
|
RU2835105C1 |
Изобретение относится к соединению формулы (IV), его стереоизомеру или его фармацевтически приемлемой соли и его применению для получения лекарственного средства, активирующего рецептор ГАМКА, а также для лечения заболевания, связанного с центральной нервной системой (ЦНС), которое выбрано из группы, состоящей из расстройства сна, расстройства настроения, расстройства шизофренического спектра, спазматического расстройства, расстройства памяти и/или когнитивного расстройства, дискинезии, расстройства личности, расстройства аутистического спектра, боли, черепно-мозговой травмы, сосудистого заболевания, расстройства, связанного со злоупотреблением психоактивными веществами, и/или синдрома отмены или звона в ушах. Технический результат: создание новых регуляторов ГАМКА, обладающих хорошей активностью и превосходным метаболизмом in vivo. В общей формуле (IV) Z выбран из группы, состоящей из -CH2- и -CH2NH-; кольцо A выбрано из группы, состоящей из 3-8-членного гетероциклила, содержащего один или два гетеоратома, выбранных из N и S, фенила и 5-10-членного гетероарила, содержащего от одного до четырех гетероатомов, выбранных из N, где каждый из 3-8-членного гетероциклила, фенила и 5-10-членного гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из С1-3 алкила, С1-3 галогеналкила, галогена, оксо, нитро, циано, метокси, циклопропила, -(CH2)n1SR25, -(CH2)n1C(O)R25 и -(CH2)n1C(O)OR25; каждый Ra является одинаковым или разным, и каждый из них выбран из группы, состоящей из атома водорода, С1-3 алкила, С1-3 галогеналкила, метокси, галогена, нитро, циано, циклопропила, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23 и -(CH2)n1S(O)(NR23)R24, где каждый из С1-3 алкила и циклопропила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из циано и гидрокси; R15a выбран из группы, состоящей из С1-3 алкила, С1-3 галогеналкила, галогена, циклопропила, -(CH2)n1OR23 и -(CH2)n1SR23; R16a представляет собой атом водорода; или R15a и R16a могут образовывать циклопропил, где циклопропил необязательно дополнительно замещен одним или более галогеном; x представляет собой целое число, равное 0, 1 или 3. Остальные значения переменных указаны в формуле изобретения. 3 н. и 9 з.п. ф-лы, 3 табл., 179 пр.

1. Соединение формулы (IV), его стереоизомер или его фармацевтически приемлемая соль:
 ,
,
где:
Z выбран из группы, состоящей из -CH2- и -CH2NH-;
кольцо A выбрано из группы, состоящей из 3-8-членного гетероциклила, содержащего один или два гетеоратома, выбранных из N и S, фенила и 5-10-членного гетероарила, содержащего от одного до четырех гетероатомов, выбранных из N, где каждый из 3-8-членного гетероциклила, фенила и 5-10-членного гетероарила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из С1-3 алкила, С1-3 галогеналкила, галогена, оксо, нитро, циано, метокси, циклопропила, -(CH2)n1SR25, -(CH2)n1C(O)R25 и -(CH2)n1C(O)OR25;
каждый Ra является одинаковым или разным, и каждый из них выбран из группы, состоящей из атома водорода, С1-3 алкила, С1-3 галогеналкила, метокси, галогена, нитро, циано, циклопропила, -(CH2)n1C(O)R23, -(CH2)n1C(O)OR23, -(CH2)n1S(O)m1R23 и -(CH2)n1S(O)(NR23)R24, где каждый из С1-3 алкила и циклопропила необязательно дополнительно замещен одним или более заместителями, выбранными из группы, состоящей из циано и гидрокси;
R15a выбран из группы, состоящей из С1-3 алкила, С1-3 галогеналкила, галогена, циклопропила, -(CH2)n1OR23 и -(CH2)n1SR23;
R16a представляет собой атом водорода;
или R15a и R16a могут образовывать циклопропил, где циклопропил необязательно дополнительно замещен одним или более галогеном;
R23 выбран из группы, состоящей из атома водорода, С1-3 алкила и 3-8-членного гетероциклила, содержащего один гетероатом, выбранный из N, где 3-8-членный гетероциклил необязательно дополнительно замещен одним или более заместителями, выбранными из галогена;
R24 выбран из группы, состоящей из метила;
R25 выбран из группы, состоящей из С1-3 алкила и 3-8-членного гетероциклила, содержащего один гетероатом, выбранный из N, где 3-8-членный гетероциклил необязательно дополнительно замещен одним или более заместителями, выбранными из галогена;
n1 представляет собой целое число, равное 0;
m1 представляет собой целое число, равное 0, 1 или 2; и
x представляет собой целое число, равное 0, 1 или 3,
или соединение, его стереоизомер или его фармацевтически приемлемая соль:


 и
и  .
.
2. Соединение формулы (IV), его стереоизомер или его фармацевтически приемлемая соль по п. 1, представляющее собой соединение формулы (IV-A), его стереоизомер или его фармацевтически приемлемую соль:

R15a, кольцо A, Z, Ra и x являются такими, как определено в п. 1.
3. Соединение формулы (IV), его стереоизомер или его фармацевтически приемлемая соль по п. 1, представляющее собой соединение формулы (V), его стереоизомер или его фармацевтически приемлемую соль:
 ,
,
где:
R15a, R16a, Ra и x являются такими, как определено в п. 1.
4. Соединение формулы (IV), его стереоизомер или его фармацевтически приемлемая соль по п. 1 или 3, представляющее собой соединение формулы (V-A), его стереоизомер или его фармацевтически приемлемую соль:
 ,
,
где:
R15a, R16a, Ra и x являются такими, как определено в п. 3.
5. Соединение формулы (IV), его стереоизомер или его фармацевтически приемлемая соль по п. 1, представляющее собой соединение формулы (VI), его стереоизомер или его фармацевтически приемлемую соль:
 ,
,
где:
каждый Rd представляет собой атом водорода или галоген;
y представляет собой целое число, равное 0 или 1;
кольцо A, Z, Ra и x являются такими, как определено в п. 1.
6. Соединение формулы (IV), его стереоизомер или его фармацевтически приемлемая соль по п. 1, представляющее собой соединение формулы (VI-A), его стереоизомер или его фармацевтически приемлемую соль:
 ,
,
где:
кольцо A, Z, Ra, Rd, x и y являются такими, как определено в п. 5.
7. Соединение формулы, его стереоизомер или его фармацевтически приемлемая соль по любому из пп. 1-2 и 5-6, где кольцо A выбрано из группы, состоящей из:

 и
и  .
.
8. Соединение любой формулы, его стереоизомер или его фармацевтически приемлемая соль по любому из пп. 1-7, где Z выбран из группы, состоящей из -CH2-;
Ra выбран из группы, состоящей из атома водорода, галогена, циано, нитро, C1-3 алкила, циклопропила, C1-3 галогеналкила, метокси, -SR23, -C(O)R23 и -C(O)OR23;
Rd выбран из атома водорода;
R23 выбран из группы, состоящей из атома водорода, C1-3 алкила и 3-8-членного гетероциклила, содержащего один гетероатом, который выбран из N, где 3-8-членный гетероциклил необязательно дополнительно замещен одним или более заместителями, выбранными из галогена.
9. Соединение любой формулы, его стереоизомер или его фармацевтически приемлемая соль по любому из пп. 1-8,
где:
R15a выбран из группы, состоящей из C1-3 алкила и циклопропила;
или R15a и R16a могут образовывать циклопропил.
10. Соединение формулы (IV), его стереоизомер или его фармацевтически приемлемая соль по любому из пп. 1-9, выбранное из группы, состоящей из:










11. Применение соединения формулы (IV), его стереоизомера или его фармацевтически приемлемой соли по любому из пп. 1-10 для получения лекарственного средства, активирующего рецептор ГАМКА.
12. Применение соединения формулы (IV), его стереоизомера или его фармацевтически приемлемой соли по любому из пп. 1-10 для лечения заболевания, связанного с центральной нервной системой (ЦНС), которое выбрано из группы, состоящей из расстройства сна, расстройства настроения, расстройства шизофренического спектра, спазматического расстройства, расстройства памяти и/или когнитивного расстройства, дискинезии, расстройства личности, расстройства аутистического спектра, боли, черепно-мозговой травмы, сосудистого заболевания, расстройства, связанного со злоупотреблением психоактивными веществами, и/или синдрома отмены или звона в ушах.
| WO 2014169831 A1, 23.10.2014 | |||
| WO 1993003732 A1, 04.03.1993 | |||
| WO 2016061537 A1, 21.04.2016 | |||
| CN 105339381 B, 27.04.2018 | |||
| CN 104136452 A, 05.11.2014 | |||
| НОВЫЕ СТЕРОИДНЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ РАСТВОРИМОСТЬЮ В ВОДЕ И УСТОЙЧИВОСТЬЮ К МЕТАБОЛИЗМУ, И СПОСОБЫ ИХ ПРИГОТОВЛЕНИЯ | 2007 |
|
RU2458065C2 |
Авторы
Даты
2023-06-05—Публикация
2019-01-31—Подача