Область техники, к которой относится изобретение
Настоящее изобретение относится к новым соединениям, производным 4-(3-бензоиламинофенил)-6,7-диметокси-2-метиламинохиназолина.
Уровень техники
Для лечения зуда, вызванного атопическим заболеванием, таким как атопический дерматит, в качестве терапевтического агента применяют противовоспалительные лекарственные средства, такие как стероид, антигистаминный агент или тому подобное.
Однако стероидное лекарственное средство почти не оказывает непосредственного противозудного действия, и ослабление зуда указанным выше агентом является только побочным действием, полученным в результате ингибирующего кожное воспаление действия. Соответственно, требуется некоторый период времени, пока не будет достигнуто такое противозудное действие. Кроме того, эффективность антигистаминного агента является спорной, и нет сообщений, явно демонстрирующих его эффективность при зуде.
Зуд является типичным симптомом атопического дерматита. Постоянный зуд вызывает потерю сосредоточенности или бессонницу и, тем самым, значительно ухудшает качество жизни (QOL). Как описано выше, поскольку для стероидного лекарственного средства требуется некоторый период времени для проявления его противозудного действия и антигистаминный агент во многих случаях является неэффективным, зуд все же не полностью устраняется этими лекарственными средствами.
Кроме того, еще не открыт противозудный агент, эффективный не только для зуда, вызванного атопическим заболеванием, но также зуда, устойчивого к стероидному лекарственному средству и/или антигистаминному агенту (смотри непатентные документы 1-3).
Между прочим, соединение настоящего изобретения, которое представлено формулой (I), входит в объем соединений изобретения, описанного в патентном документе 1.
Однако соединение, представленное формулой (I), в частности, не описано в вышеуказанном патентном документе 1. Соединение, описанное в патентном документе 1, которое имеет структуру, аналогичную структуре соединения, представленного формулой (I), является соединением, представленным следующей структурной формулой:
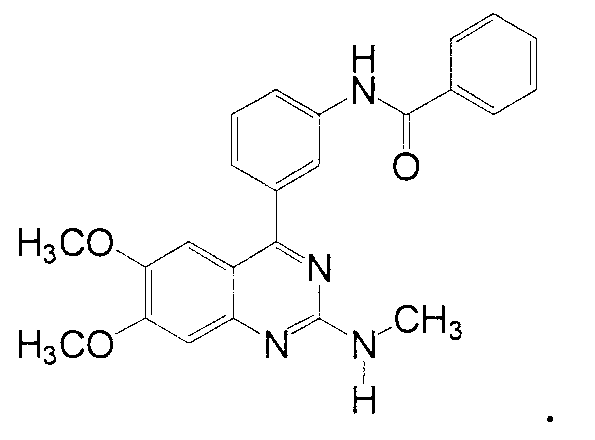
Кроме того, описано, что соединение патентного документа 1 обладает ингибирующим PDE4 действием, и поэтому вышеуказанное соединение обладает противовоспалительным действием, основанным на ингибирующем PDE4 действии. Так, в патентном документе 1 описано, что вышеуказанное соединение является эффективным для лечения псориаза, основанного на противовоспалительном действии, но в указанной выше публикации не описано, не предложено применение вышеуказанного соединения для устранения зуда, вызванного атопическим заболеванием.
Далее, патентный документ 1 не описывает, не предполагает, что соединение, описанное в публикации 1, является эффективным для устранения зуда, для которого стероидное лекарственное средство или антигистаминный агент является неэффективным.
[Непатентный документ 1] Lancet 2003; 361: 690-694.
[Непатентный документ 2] Lancet 2003; 361: 151-160.
[Непатентный документ 3] Arch. Dermatol. 1999; 135: 1522-1525.
[Патентный документ 1] WO 99/37622.
Описание изобретения
Проблемы, которые разрешаются изобретением
Задачей настоящего изобретения является предоставление безопасного соединения, которое эффективно действует на зуд, вызванный атопическим заболеванием, или зуд, для которого с ранней стадии является неэффективным стероидное лекарственное средство или тому подобное.
Способ разрешения проблем
В результате интенсивных исследований авторы настоящего изобретения создали настоящее изобретение. То есть настоящее изобретение относится к:
(1) соединению, представленному формулой (I), его соли или его гидрату:

где R представляет собой гидроксил, С1-6алкокси, необязательно замещенный С1-6алкокси, или амино, необязательно замещенный С1-6алкилом;
(2) соединению, его соли или его гидрату согласно указанному выше пункту (1), в котором R-C(=O)-, где R представляет собой гидроксил, С1-6алкокси, необязательно замещенный С1-6алкокси, или амино, необязательно замещенный С1-6алкилом, находится в мета- или пара-положении;
(3) соединению, его соли или его гидрату согласно указанному выше пункту (1) или (2), где R представляет собой гидроксил, С1-3алкокси, необязательно замещенный С1-3алкокси, или амино, необязательно замещенный С1-3алкилом;
(4) соединению, его соли или его гидрату согласно указанному выше пункту (1) или (2), где R представляет собой гидроксил, метокси, этокси, 1-пропокси, 2-пропокси, метоксиэтокси, амино, метиламино, диметиламино, этиламино или диэтиламино;
(5) метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоте, ее соли или ее гидрату;
этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоте, ее соли или ее гидрату;
N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилтерефталамиду, его соли или его гидрату;
изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоте, ее соли или ее гидрату;
изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевой кислоте, ее соли или ее гидрату;
2-метоксиэтиловому эфиру N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты, его соли или его гидрату или
2-метоксиэтиловому эфиру N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталамовой кислоты, его соли или его гидрату;
(6) метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоте, ее соли или ее гидрату;
(7) этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоте, ее соли или ее гидрату;
(8) N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилтерефталамиду, его соли или его гидрату;
(9) изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоте, ее соли или ее гидрату;
(10) изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевой кислоте, ее соли или ее гидрату;
(11) 2-метоксиэтиловому эфиру N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты, его соли или его гидрату или
(12) 2-метоксиэтиловому эфиру N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталамовой кислоты, его соли или его гидрату;
(13) фармацевтической композиции, включающей в себя в качестве активного ингредиента соединение, его соль или его гидрат согласно любому из указанных выше пунктов от (1) до (12);
(14) противозудному агенту для атопического заболевания, включающему в себя в качестве активного ингредиента соединение, его соль или его гидрат согласно любому из указанных выше пунктов от (1) до (12);
(15) противозудному агенту согласно указанному выше пункту (14), где атопическим заболеванием является атопический дерматит;
(16) противозудному агенту для зуда, для которого стероидное лекарственное средство и/или антигистаминный агент являются неэффективными, включающему в себя в качестве активного ингредиента соединение, его соль или его гидрат согласно любому из указанных выше пунктов от (1) до (12);
(17) противозудному агенту согласно любому из указанных выше пунктов от (14) до (16), где лекарственной формой является препарат для наружного применения.
Настоящее изобретение относится также к
(Р1) соединению, представленному формулой (II), его соли или его гидрату:

где RP представляет собой гидроксил, С1-6алкокси или амино, необязательно замещенный С1-6алкилом;
(Р2) соединению, его соли или его гидрату согласно указанному выше пункту (Р1), в котором RP-C(=O)-, где RP представляет собой гидроксил, С1-6алкокси или амино, необязательно замещенный С1-6алкилом, находится в мета- или пара-положении;
(Р3) соединению, его соли или его гидрату согласно указанному выше пункту (Р1) или (Р2), где RP представляет собой гидроксил, С1-3алкокси или амино, необязательно замещенный С1-3алкилом;
(Р4) соединению, его соли или его гидрату согласно указанному выше пункту (Р1) или (Р2), где RP представляет собой гидроксил, метокси, этокси, амино, метиламино, диметиламино, этиламино или диэтиламино;
(Р5) метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоте, ее соли или ее гидрату;
этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоте, ее соли или ее гидрату или
N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилтерефталамиду, его соли или его гидрату;
(Р6) фармацевтической композиции, включающей в себя в качестве активного ингредиента соединение, его соль или его гидрат согласно любому из указанных выше пунктов от (Р1) до (Р5);
(Р7) противозудному агенту для атопического заболевания, включающему в себя в качестве активного ингредиента соединение, его соль или его гидрат согласно любому из указанных выше пунктов от (Р1) до (Р5);
(Р8) противозудному агенту согласно указанному выше пункту (Р7), где атопическим заболеванием является атопический дерматит;
(Р9) противозудному агенту для зуда, для которого стероидное лекарственное средство и/или антигистаминный агент является неэффективным, включающему в себя в качестве активного ингредиента соединение, его соль или его гидрат согласно любому из указанных выше пунктов от (Р1) до (Р5);
(Р10) противозудному агенту согласно любому из указанных выше пунктов от (Р7) до (Р9), где лекарственной формой является препарат для наружного применения.
Действие изобретения
На основании результатов описываемых ниже испытаний обнаружено, что соединение настоящего изобретения обладает превосходным противозудным действием и обладает также превосходным действием в отношении метаболизма. Согласно этому соединение настоящего изобретения является полезным в качестве противозудного агента для зуда, вызванного атопическим заболеванием, inter alia, атопическим дерматитом, или зуда, для которого стероидное лекарственное средство и/или антигистаминный агент является неэффективным.
Краткое описание графических материалов
На фигуре 1 показано число почесываний (царапаний) у мышей, индуцированных оксазолоном (примеры 1, 4 и 5).
На фигуре 2 показаны оценки показателей кожных симптомов (через 1 день) мышей, индуцированных оксазолоном (примеры 1, 4 и 5).
На фигуре 3 показана порошковая рентгенограмма кристаллов, полученных в примере 22.
На фигуре 4 показана порошковая рентгенограмма кристаллов, полученных в примере 23.
На фигуре 5 показана порошковая рентгенограмма кристаллов, полученных в примере 24.
На фигуре 6 показана порошковая рентгенограмма кристаллов, полученных в примере 25.
На фигуре 7 показана порошковая рентгенограмма кристаллов, полученных в примере 26.
На фигуре 8 показана порошковая рентгенограмма кристаллов, полученных в примере 27.
На фигуре 9 показано число почесываний (царапаний) у мышей, индуцированных оксазолоном (примеры 7, 14 и 21).
На фигуре 10 показаны оценки показателей кожных симптомов (через 1 день) мышей, индуцированных оксазолоном (примеры 7, 14 и 21).
На фигуре 11 показаны оценки показателей кожных симптомов (через 4 дня) мышей, индуцированных оксазолоном (примеры 7, 14 и 21).
На фигуре 12 показано число почесываний (царапаний) у мышей, индуцированных оксазолоном (пример 20).
На фигуре 13 показаны оценки показателей кожных симптомов (через 1 день) мышей, индуцированных оксазолоном (пример 20).
На фигуре 14 показаны оценки показателей кожных симптомов (через 4 дня) мышей, индуцированных оксазолоном (пример 20).
На фигуре 15 показана эффективность соединения Е6005 примера 1 по сравнению с соединением бетаметазона.
Лучший способ осуществления изобретения
Настоящее изобретение будет описано подробно ниже.
В настоящем описании структурная формула соединения может означать для удобства определенный тип изомера. Настоящее изобретение включает в себя все изомеры, образованные на основании структуры соединения, такие как геометрический изомер, оптический изомер, стереоизомер или таутомер, и изомерную смесь. Таким образом, соединение настоящего изобретения не ограничивается описаниями формулы, представленной для удобства, но оно может быть любым из таких изомеров или их смесью. Согласно этому соединение настоящего изобретения может существовать в виде оптически активной формы и рацемической формы. Настоящее изобретение включает любую из таких оптически активных форм и рацемических форм и не ограничивается какой-либо из них. Кроме того, в соединении настоящего изобретения может также существовать полиморфизм. Такой кристаллический полиморфизм не ограничивается любым из полиморфов, и соединение настоящего изобретения может быть либо индивидуальной кристаллической формой, либо их смесью. Кроме того, настоящее изобретение включает в себя также аморфную форму, и соединение настоящего изобретения включает в себя ангидрат (безводную форму) и гидрат. Кроме того, настоящее изобретение включает в себя также так называемый метаболит, который образуется в результате метаболизма in vivo (окисления, восстановления, гидролиза, конъюгации и т.д.) соединения (I) настоящего изобретения. Далее в настоящее изобретение включено также соединение (так называемое пролекарство), которое образует соединение (I) настоящего изобретения в результате метаболизма in vivo (окисления, восстановления, гидролиза, конъюгации и т.д.).
Определения терминов, символов и других значений, применяемых в настоящем описании, будут объясняться ниже, и настоящее изобретение будет описано подробно ниже.
Термин «С1-6алкил» применяют в настоящем описании для обозначения алкильной группы с неразветвленной или разветвленной цепью, содержащей 1-6 атомов углерода. Конкретные примеры С1-6алкила могут включать в себя метил, этил, 1-пропил (н-пропил), 2-пропил (изопропил), 2-метил-1-пропил (изобутил), 2-метил-2-пропил (трет-бутил), 1-бутил (н-бутил), 2-бутил (втор-бутил), 1-пентил, 2-пентил, 3-пентил, 2-метил-1-бутил, 3-метил-1-бутил, 2-метил-2-бутил, 3-метил-2-бутил, 2,2-диметил-1-пропил, 1-гексил, 2-гексил, 3-гексил, 2-метил-1-пентил, 3-метил-1-пентил, 4-метил-1-пентил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 2-метил-3-пентил, 3-метил-3-пентил, 2,3-диметил-1-бутил, 3,3-диметил-1-бутил, 2,2-диметил-1-бутил, 2-этил-1-бутил, 3,3-диметил-2-бутил и 2,3-диметил-2-бутил.
Предпочтительные примеры могут включать в себя С1-3алкил, такой как метил, этил, 1-пропил (н-пропил), 2-пропил (изопропил), 2-метил-1-пропил (изобутил), 2-метил-2-пропил (трет-бутил), 1-бутил (н-бутил) или 2-бутил (втор-бутил). Более предпочтительные примеры могут включать в себя метил и этил.
Термин «С1-6алкокси» применяют в настоящем описании для обозначения оксигруппы, с которой связан указанный выше «С1-6алкил». Конкретные примеры С1-6алкокси могут включать в себя метокси, этокси, 1-пропокси, 2-пропокси, 2-метил-1-пропокси, 2-метил-2-пропокси, 1-бутокси, 2-бутокси, 1-пентокси, 2-пентилокси, 3-пентилокси, 2-метил-1-бутокси, 3-метил-1-бутокси, 2-метил-2-бутокси, 3-метил-2-бутокси, 2,2-диметил-1-пропокси, 1-гексилокси, 2-гексилокси, 3-гексилокси, 2-метил-1-пентокси, 3-метил-1-пентилокси, 4-метил-1-пентокси, 2-метил-2-пентокси, 3-метил-2-пентокси, 4-метил-2-пентокси, 2-метил-3-пентилокси, 3-метил-3-пентилокси, 2,3-диметил-1-бутокси, 3,3-диметил-1-бутокси, 2,2-диметил-1-бутокси, 2-этил-1-бутокси, 3,3-диметил-2-бутокси и 2,3-диметил-2-бутокси.
Предпочтительные примеры могут включать в себя С1-3алкокси, такие как метокси, этокси, 1-пропокси и 2-пропокси. Более предпочтительным примером является метокси.
Кроме того, примеры «С1-6алкокси, необязательно замещенного С1-6алкокси» или «С1-3алкокси, необязательно замещенного С1-3алкокси» в определениях R могут включать в себя метоксиметокси, этоксиметокси, метоксиэтокси и этоксиэтокси.
Примеры «амино, необязательно замещенного С1-6алкилом» в настоящем описании могут включать в себя амино, моно-С1-6алкиламино, который замещен указанным выше С1-6алкилом (например, метиламино, этиламино, трет-бутиламино и т.д.) и ди-С1-6алкиламино (например, диметиламино, диэтиламино, метилэтиламино и т.д.).
Предпочтительные примеры могут включать в себя амино, моно-С1-3алкиламино и ди-С1-3алкиламино. Более предпочтительные примеры могут включать в себя амино и монометиламино.
Тип «соли», применяемой в настоящем описании, конкретно не ограничивается, если она является солью, образованной с соединением настоящего изобретения, и является фармакологически приемлемой. Примеры такой соли могут включать в себя соль неорганической кислоты, соль органической кислоты, соль неорганического основания, соль органического основания и соль кислотной или основной аминокислоты.
Предпочтительные примеры соли неорганической кислоты могут включать в себя гидрохлорид, гидробромид, сульфат, нитрат и фосфат. Предпочтительные примеры соли органической кислоты могут включать в себя ацетат, сукцинат, фумарат, малеат, тартрат, цитрат, лактат, стеарат, бензоат, метансульфонат, этансульфонат, п-толуолсульфонат и бензолсульфонат.
Предпочтительные примеры соли неорганического основания включают в себя соли щелочных металлов, такие как соль натрия или соль калия; соли щелочноземельных металлов, такие как соль кальция или соль магния; соли алюминия и соли аммония. Предпочтительные примеры соли органического основания могут включать в себя соль диэтиламина, соль диэтаноламина, соль меглумина и соль N,N'дибензилэтилендиамина.
Предпочтительные примеры соли кислотной аминокислоты могут включать в себя аспартат и глутамат. Предпочтительные примеры соли основной аминокислоты могут включать в себя соль аргинина, соль лизина и соль орнитина.
В настоящем описании R-C(=O) в формуле (I) (где R представляет собой гидроксил, С1-6алкокси, необязательно замещенный С1-6алкокси, или амино, необязательно замещенный С1-6алкилом) может быть связан с любым из положений замещения, а именно орто-, мета- или пара-положением кольца бензола, с которым он связан. Он предпочтительно связан в мета- или пара-положении. Таким образом, соединение, представленное нижеследующей формулой (I') или (I”), является предпочтительным
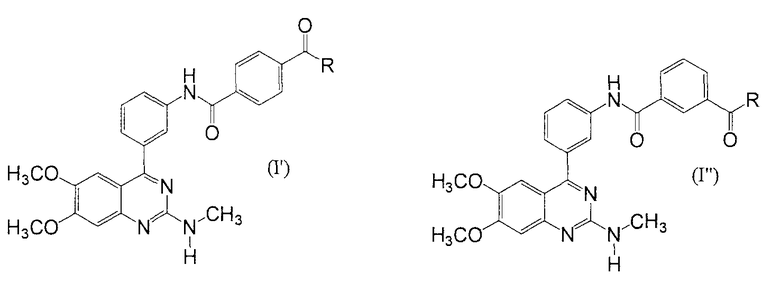
[где R имеет такие же значения, как значения, описанные выше]. Более предпочтительные примеры такого соединения могут включать в себя
метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту, ее соль или ее гидрат;
этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту, ее соль или ее гидрат и
N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилтерефталамид, его соль или его гидрат.
Термин «атопическое заболевание» применяют в настоящем описании для обозначения атопического дерматита, крапивницы, бронхиальной астмы, аллергического ринита, аллергического конъюнктивита и т.д.
Когда соединение данного изобретения нужно применять в качестве лекарственного средства, его обычно смешивают с подходящими фармацевтическими ингредиентами для получения фармацевтических продуктов для использования. Тем не менее, не следует отвергать применение лекарственного вещества соединения изобретения в виде формы лекарственного средства.
Фармацевтические ингредиенты могут включать в себя эксципиенты, связывающие вещества, смазывающие вещества, дезинтегрирующие агенты, красящие агенты, агенты, корректирующие вкус, эмульгаторы, поверхностно-активные вещества, агенты, содействующие растворению, изотонизирующие агенты, буферные агенты, консерванты, антиоксиданты, стабилизаторы, агенты, усиливающие адсорбцию, и тому подобное, все из которых обычно применяют в лекарственных средствах. При желании для применения эти агенты можно комбинировать.
Эксципиенты могут включать в себя, например, лактозу, белый нетвердый сахар, глюкозу, кукурузный крахмал, маннит, сорбит, крахмал, альфа-крахмал, декстрин, кристаллическую целлюлозу, тонкоизмельченный кремниевый ангидрид, силикат алюминия, силикат кальция, алюминометасиликат магния, гидрофосфат кальция и тому подобное.
Связывающие вещества могут включать в себя, например, поливиниловый спирт, метилцеллюлозу, этилцеллюлозу, аравийскую камедь, трагакант, желатин, шеллак, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, поливинилпирролидон, макрогол и тому подобное.
Смазывающие вещества могут включать в себя, например, стеарат магния, стеарат кальция, стеарилфумарат натрия, тальк, полиэтиленгликоль, коллоидальный оксид кремния и тому подобное.
Дезинтегрирующие агенты могут включать в себя, например, кристаллическую целлюлозу, агар, желатин, карбонат кальция, гидрокарбонат натрия, цитрат кальция, декстрин, пектин, слабозамещенную гидроксипропилцеллюлозу, карбоксиметилцеллюлозу, кальциевую соль карбоксиметилцеллюлозы, натриевую соль кроскармеллозы, карбоксиметилкрахмал, натриевую соль карбоксиметилцеллюлозы и тому подобное.
Красящие агенты могут включать в себя полуторный оксид железа, желтый полуторный оксид железа, кармин, жженый сахар, бета-каротен, оксид титана, тальк, натриевую соль фосфата рибофлавина, желтый алюминиевый лак и тому подобное, которые были разрешены в качестве добавок для лекарственных средств.
Агенты, корректирующие вкус, могут включать в себя какао-порошок, ментол, ароматический порошок, масло мяты, борнеол, порошкообразную кору коричного дерева и тому подобное.
Эмульгаторы или поверхностно-активные вещества могут включать в себя стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионовую кислоту, лецитин, моностеарат глицерина, эфир сахарозы и жирной кислоты, эфир глицерина и жирной кислоты и тому подобное.
Агенты, содействующие растворению, могут включать в себя полиэтиленгликоль, пропиленгликоль, бензилбензоат, этанол, холестерин, триэтаноламин, карбонат натрия, цитрат натрия, полисорбат 80, никотинамид и тому подобное.
Суспендирующие агенты могут включать в себя помимо поверхностно-активных веществ гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, метилцеллюлозу, гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу и гидроксипропилцеллюлозу.
Изотонизирующие агенты могут включать в себя глюкозу, хлорид натрия, маннит, сорбит и тому подобное.
Буферные агенты могут включать в себя фосфатные, ацетатные, карбонатные, цитратные буферы и тому подобное.
Консерванты могут включать в себя метилпарабен, пропилпарабен, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусную кислоту, сорбиновую кислоту и тому подобное.
Антиоксиданты могут включать в себя сульфит, аскорбиновую кислоту, альфа-токоферол и тому подобное.
Стабилизаторы могут включать в себя стабилизаторы, обычно применяемые в лекарственных средствах.
Агенты, усиливающие адсорбцию, могут включать в себя усиливающие адсорбцию агенты, обычно применяемые в лекарственных средствах.
Фармацевтические продукты, описанные выше, могут включать в себя пероральные агенты, такие как таблетки, порошки, гранулы, капсулы, сиропы, пастилки и лекарственные формы для ингаляции; препараты для наружного применения, такие как суппозитории, мази, глазные мази, пластыри, глазные растворы, назальные капли, глазные капли, примочки и лосьоны и инъекции. Предпочтительным препаратом является препарат для наружного применения, который непосредственно действует на пораженный участок.
Пероральные агенты можно подходящим образом комбинировать с описанными выше вспомогательными средствами для получения препаратов. Кроме того, на поверхности таких агентов, если необходимо, можно нанести покрытия.
Агенты для наружного применения можно подходящим образом комбинировать с вспомогательными средствами, в частности эксципиентами, связывающими веществами, агентами, корректирующими вкус, эмульгаторами, поверхностно-активными веществами, агентами, содействующими растворению, суспендирующими агентами, изотонизирующими агентами, консервантами, антиоксидантами, стабилизаторами или агентами, усиливающими абсорбцию, с образованием препаратов.
Инъекции можно подходящим образом комбинировать с вспомогательными средствами, в частности, эмульгаторами, поверхностно-активными веществами, агентами, содействующими растворению, суспендирующими агентами, изотонизирующими агентами, консервантами, антиоксидантами, стабилизаторами или агентами, усиливающими абсорбцию, с образованием препаратов.
Дозы фармацевтического препарата настоящего изобретения различаются в зависимости от тяжести симптомов, возраста, пола, массы тела, лекарственной формы, типа солей, различий в чувствительности к агенту, определенного типа заболевания или тому подобного. В общем в случае перорального введения доза фармацевтического препарата настоящего изобретения составляет приблизительно между 30 мкг и 10 г (предпочтительно между 0,1 мг и 100 мг) для взрослого человека в день. В случае препарата для наружного применения она составляет между 30 мкг и 20 г (предпочтительно между 100 мкг и 10 г) для взрослого человека в день. В случае инъекции она составляет между 30 мкг и 1 г (предпочтительно между 100 мкг и 500 мг) для взрослого человека в день. Указанную выше дозу применяют в виде одного введения или ее разделяют на 2-6 введений в день.
Неочищенные соединения и различные типы реагентов, применяемые при получении соединения настоящего изобретения, могут быть в форме соли, гидрата или сольвата. Такие неочищенные соединения и реагенты различаются в зависимости от исходного соединения, применяемого растворителя или тому подобного. Типы таких неочищенных соединений и реагентов, в частности, не ограничивают, если они не ингибируют реакцию. Применяемые растворители также являются различными в зависимости от исходных неочищенных соединений, реагентов или тому подобного. Очевидно, что тип такого растворителя конкретно не ограничивают, если он не ингибирует реакцию и растворяет исходные вещества до определенной степени. Когда соединение (I) настоящего изобретения получают в свободной форме, такую свободную форму можно превратить в соль, которая может быть образована указанным выше соединением (I), или его гидрат согласно обычным методам.
Соединение (I) настоящего изобретения получают в форме соли или гидрата соединения (I), эти компоненты можно превратить в свободную форму указанного выше соединения (I) обычными методами.
Кроме того, полученные различные изомеры (например, геометрический изомер, оптический изомер, поворотный изомер, стереоизомер, таутомер и т.д.) соединения (I) настоящего изобретения можно очистить и выделить обычным методом разделения, таким как перекристаллизация, метод диастереомерной соли, ферментативный метод разделения, различные типы хроматографии (например, тонкослойная хроматография, колоночная хроматография, газовая хроматография и т.д.).
Далее будет описан способ получения соединения настоящего изобретения, которое представлено формулой (I).
Соединение, представленное формулой (I), можно получить способом А, способом В или способом С, как описано ниже. Кроме того, соединение можно также получить способом D, который описан в WO 99/37622.
Способ А, способ В и способ С будут описаны подробно ниже. Однако способ получения соединения настоящего изобретения не ограничивается ими.
(Способ А)

[где R1 представляет собой С1-6алкил].
Способом А является способ, по которому соединению (А-3) дают возможность взаимодействовать с соединением (В-2), которое является хлорангидридом кислоты, в инертном растворителе в присутствии или в отсутствие основания, так чтобы получить соединение (I-1) настоящего изобретения.
В качестве такого соединения (В-2) можно применять известное соединение, коммерчески доступное соединение или соединение, которое можно легко получить из коммерчески доступного соединения способом, который обычно применяют специалисты в данной области. Примеры такого соединения (В-2) могут включать в себя метиловый эфир 4-хлоркарбонилбензойной кислоты и тому подобное.
Соединение (В-2) можно применять в количестве, в 1-10 раз, предпочтительно в 1-2 раза превышающем молярный эквивалент соединения (А-3).
Тип применяемого растворителя специально не ограничивают, если он растворяет исходные вещества до определенной степени и не ингибирует реакцию в данной стадии. Примеры растворителя могут включать в себя ароматические углеводороды, такие как толуол, бензол или ксилол; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, диметоксиэтан или диоксан; галогенированные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан или тетрахлорид углерода; органические основания, такие как пиридин, 2-, 3- или 4-пиколин; воду и смеси указанных растворителей. Предпочтительными примерами являются тетрагидрофуран или пиридин.
Тип применяемого здесь основания специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Примеры основания могут включать в себя неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия или карбонат цезия; и органические основания, такие как пиридин или триэтиламин. Предпочтительным примером является пиридин.
Вышеуказанное основание можно применять в количестве, в 1-10 раз, предпочтительно в 1-4 раза превышающем молярный эквивалент соединения (А-3).
Температура реакции зависит от применяемого растворителя и реагента. Обычно она находится между -30°С и 180°С и предпочтительно между 0°С и 100°С.
Время реакции зависит от применяемого растворителя и температуры реакции. Оно обычно составляет между 0,5 и 200 часами и предпочтительно между 1 и 100 часами.
(Способ В)
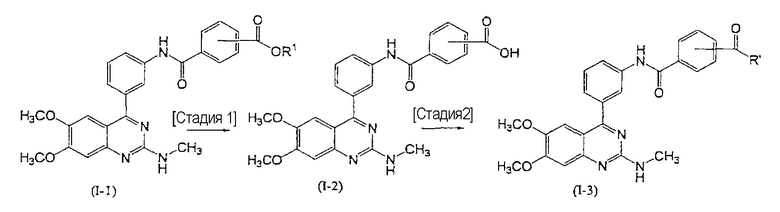
[где R1 имеет такие же значения, как значения, описанные выше, и R' представляет собой С1-6алкокси, необязательно замещенный С1-6алкокси, или амино, необязательно замещенный С1-6алкилом].
Способ В является способом, который включает в себя стадию 1 получения карбоновой кислоты, соединения (I-2), в результате реакции гидролиза сложного эфира, соединения (I-1), и стадию 2 этерификации или амидирования указанной выше карбоновой кислоты, соединения (I-2), так чтобы получить соединение (I-3) настоящего изобретения.
<Стадия 1: реакция гидролиза>
Соединение (I-2) получают в результате реакции основного гидролиза соединения (I-1) в инертном растворителе.
Тип применяемого растворителя специально не ограничивают, если он растворяет исходные вещества до определенной степени и не ингибирует реакцию в данной стадии. Примеры растворителя могут включать в себя ароматические углеводороды, такие как толуол, бензол или ксилол; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, диметоксиэтан или диоксан; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, трет-бутанол или этиленгликоль; воду и смеси указанных растворителей. Предпочтительными примерами являются метанол или тетрагидрофуран.
Тип применяемого здесь основания специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Примеры основания могут включать в себя неорганические основания, такие как гидроксид натрия, гидроксид калия, гидроксид лития, карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, карбонат цезия или их водный раствор; и органические основания, такие как пиридин или триэтиламин. Предпочтительным примером является водный раствор гидроксида натрия.
Вышеуказанное основание можно применять в количестве, в 1-100 раз, предпочтительно в 1-20 раз превышающем молярный эквивалент соединения (I-1).
Температура реакции зависит от применяемого растворителя и реагента. Обычно она находится между -30°С и 180°С и предпочтительно между 0°С и 100°С.
Время реакции зависит от применяемого растворителя и температуры реакции. Оно обычно составляет между 0,5 и 200 часами и предпочтительно между 1 и 100 часами.
<Стадия 2: этерификация или амидирование соединения (I-2)>
Соединение (I-3) получают в результате реакции конденсации соединения (I-2) с соответствующим спиртом или амином с применением агента конденсации в инертном растворителе в присутствии или в отсутствие основания.
В качестве такого соответствующего спирта или амина можно применять известное соединение, коммерчески доступное соединение или соединение, которое можно легко получить из коммерчески доступного соединения способом, который обычно применяют специалисты в данной области. Примеры такого соединения могут включать в себя метанол, этанол и метиламин.
Указанный выше спирт или амин можно применять в количестве, в 1-10 раз, предпочтительно в 1-3 раза превышающем молярный эквивалент соединения (I-2).
Тип применяемого растворителя специально не ограничивают, если он растворяет исходные вещества до определенной степени и не ингибирует реакцию в данной стадии. Примеры растворителя могут включать в себя ароматические углеводороды, такие как толуол, бензол или ксилол; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, диметоксиэтан или диоксан; сложные эфиры, такие как метилацетат, этилацетат, пропилацетат или диэтилкарбонат; амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфорамид или N-метилпирролидон, и смесь указанных растворителей. Предпочтительным примером является диметилформамид.
Тип применяемого здесь агента конденсации специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Примеры агента конденсации могут включать в себя карбодиимиды, такие как дициклогексилкарбодиимид (DCC) или N-(3-диметиламинопропил)-N'-этилкарбодиимид (EDC:WSC); и фосфиновые агенты конденсации, такие как гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР) или диэтилцианофосфонат (DEPC). Предпочтительным примером применяемого здесь агента конденсации является WSC.
Вышеуказанный агент конденсации можно применять в количестве, в 1-10 раз, предпочтительно в 1-3 раза превышающем молярный эквивалент соединения (I-2).
Тип применяемого здесь основания специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Примеры основания могут включать в себя водные растворы неорганических оснований, таких как гидроксид натрия, гидроксид калия, гидроксид лития, карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия или карбонат цезия; и органические основания, такие как пиридин или триэтиламин. Предпочтительным примером является триэтиламин.
Вышеуказанное основание можно применять в количестве, в 1-10 раз, предпочтительно в 1-3 раза превышающем молярный эквивалент соединения (I-2).
При желании в качестве добавки для ускорения реакции можно применять 4-диметиламинопиридин или 1-гидроксибензотриазол.
Вышеуказанную добавку можно применять в количестве, в 0,1-10 раз, предпочтительно в 0,1-3 раза превышающем молярный эквивалент соединения (I-2).
Температуру реакции специально не ограничивают. Обычно она находится между -30°С и 180°С и предпочтительно между 0°С и 80°С.
Время реакции специально не ограничивают. Оно обычно составляет между 0,5 и 200 часами и предпочтительно между 1 и 100 часами.
Следует отметить, что настоящую стадию можно также проводить методом смешанного ангидрида с применением этилхлорформиата, этилацетата или тому подобного.
(Способ С)

[где R имеет такие же значения, как значения, описанные выше].
Данный способ является способом, по которому соединение (А-3) подвергают реакции конденсации с соответствующей карбоновой кислотой (В-3) с применением агента конденсации в инертном растворителе в присутствии или в отсутствие основания, так чтобы получить соединение (I).
В качестве такого соединения (В-3) можно применять известное соединение, коммерчески доступное соединение или соединение, которое можно легко получить из коммерчески доступного соединения способом, который обычно применяют специалисты в данной области. Примером такого соединения (В-3) является монометиловый эфир терефталевой кислоты, который можно легко получить из терефталевой кислоты.
Соединение (В-3) можно применять в количестве, в 1-10 раз, предпочтительно в 1-3 раза превышающем молярный эквивалент соединения (А-3).
Тип применяемого растворителя специально не ограничивают, если он растворяет исходные вещества до определенной степени и не ингибирует реакцию в данной стадии. Примеры растворителя могут включать в себя ароматические углеводороды, такие как толуол, бензол или ксилол; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, диметоксиэтан или диоксан; сложные эфиры, такие как метилацетат, этилацетат, пропилацетат или диэтилкарбонат; амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфорамид или N-метилпирролидон, и смесь указанных растворителей. Предпочтительным примером является диметилформамид.
Тип применяемого здесь агента конденсации специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Примеры агента конденсации могут включать в себя карбодиимиды, такие как дициклогексилкарбодиимид (DCC) или N-(3-диметиламинопропил)-N'-этилкарбодиимид (EDC:WSC); и фосфиновые агенты конденсации, такие как гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР) или диэтилцианофосфонат (DEPC). Предпочтительным примером применяемого здесь агента конденсации является WSC.
Вышеуказанную добавку можно применять в количестве, в 1-10 раз, предпочтительно в 1-3 раза превышающем молярный эквивалент соединения (А-3).
Тип применяемого здесь основания специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Примеры основания могут включать в себя водные растворы неорганических оснований, таких как гидроксид натрия, гидроксид калия, гидроксид лития, карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия или карбонат цезия; и органические основания, такие как пиридин или триэтиламин. Предпочтительным примером является триэтиламин.
Вышеуказанное основание можно применять в количестве, в 1-10 раз, предпочтительно в 1-3 раза превышающем молярный эквивалент соединения (А-3).
При желании в качестве добавки для ускорения реакции можно применять 4-диметиламинопиридин или 1-гидроксибензотриазол.
Вышеуказанную добавку можно применять в количестве, в 0,1-10 раз, предпочтительно в 0,1-3 раза превышающем молярный эквивалент соединения (А-3).
Температура реакции зависит от применяемого растворителя и реагента. Обычно она находится между -30°С и 180°С и предпочтительно между 0°С и 80°С.
Время реакции зависит от применяемого растворителя и температуры реакции. Оно обычно составляет между 0,5 и 200 часами и предпочтительно между 1 и 100 часами.
Следует отметить, что настоящую стадию можно также проводить методом смешанного ангидрида с применением этилхлорформиата, этилацетата или тому подобного.
(Способ получения промежуточного соединения)
Соединение (А-3), которое является промежуточным соединением, обычно применяемым в способах А, В и С, можно получить способом, описанным в примере получения 7 WO 99/37622. Помимо указанного выше способа соединение (А-3) синтезируют, например, нижеследующим способом получения промежуточного соединения:

[где Еа независимо представляет собой водород или С1-6алкил или два Еа вместе образуют С2-3алкилен, необязательно замещенный метилом].
Настоящий способ получения включает в себя: стадию 1, в которой соединение (А-1) и соединение (В-1), действующее в качестве борметаллсодержащего реагента, подвергают реакции сочетания, подобной реакции Сузуки, в инертном растворителе, в присутствии палладиевого(0) катализатора в атмосфере инертного газа или без такой атмосферы, в присутствии или в отсутствие основания и в присутствии или в отсутствие добавок, так чтобы получить соединение (А-2), и стадию 2 превращения атома хлора соединения (А-2) в метиламиногруппу, так чтобы получить соединение (А-3), которое является промежуточным соединением получения соединения настоящего изобретения.
<Стадия 1: реакция сочетания>
Настоящая стадия является стадией, в которой соединению (А-1) предоставляют возможность взаимодействовать с соединением (В-1) в инертном растворителе в присутствии палладиевого(0) катализатора, в присутствии основания, в присутствии или в отсутствие добавок и в атмосфере инертного газа или без такой атмосферы, так чтобы получить промежуточное соединение (А-2).
Настоящую стадию можно проводить согласно публикациям, описанным в S. P. Stanforth, Tetrahedron (1998), 54, 263., N. Miyaura, A. Suzuki, Chem. Rev. (1995), 95, 2457 и т.д. Более определенно, настоящую стадию можно проводить соответственно условиям реакции, операциям, проводимым после реакции, методу очистки и т.д., которые описаны в приведенном ниже примере получения 1.
Соединение (А-1) является известным соединением. Коммерчески доступный продукт можно купить и применять в качестве соединения (А-1).
Тип соединения (В-1), применяемого для сочетания, специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Примеры соединения (В-1) могут включать в себя 3-аминофенилбороновую кислоту, его 1/2-сульфат и его гидрат. Предпочтительно применяют 1/2-сульфат 3-аминофенилбороновой кислоты.
Соединение (В-1) можно применять в количестве, в 0,5-10 раз, предпочтительно в 0,5-1,5 раза превышающем молярный эквивалент соединения (А-1).
Тип применяемого растворителя специально не ограничивают, если он растворяет исходные вещества до определенной степени и не ингибирует реакцию в данной стадии. Определенные примеры растворителя могут включать в себя амиды, такие как формамид, диметилформамид, диметилацетамид, гексаметилфосфортриамид или N-метилпирролидон; ароматические углеводороды, такие как толуол, бензол, ксилол или мезитилен; простые эфиры, такие как диэтиловый простой эфир, диизопропиловый простой эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, изоамиловый спирт, диэтиленгликоль, глицерин, октанол, циклогексанол или метилцеллозольв; нитрилы, такие как ацетонитрил или изобутиронитрил; сульфоксиды, такие как диметилсульфоксид или сульфолан; сложные эфиры, такие как метилацетат, этилацетат, пропилацетат или диэтилкарбонат; воду и смешанный растворитель из указанных растворителей. Предпочтительные примеры могут включать в себя толуол, тетрагидрофуран, этилацетат, воду и смешанный растворитель из указанных растворителей.
Тип применяемого палладиевого(0) катализатора специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Примеры палладиевого(0) катализатора могут включать в себя тетракис(трифенилфосфин)палладий, трис(дибензилиденацетон)дипалладий, бис(дибензилиденацетон)палладий, бис(три-трет-бутилфосфин)палладий, палладиевую чернь, различные типы комплексов палладия, которые становятся палладиевыми(0) предшественниками, как описано ниже, и палладиевый(0) катализатор, генерированный в реакционной системе в результате комбинации с различными типами лигандов, как описано ниже.
То есть различные типы палладиевых комплексов, которые становятся палладиевыми(0) предшественниками, специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Конкретные примеры таких палладиевых комплексов могут включать в себя ацетат палладия, [1,1'-бис(дифенилфосфино)ферроцен)дихлорпалладий, дихлорбис(три-о-толилфосфин)палладий, дихлорбис(трициклогексилфосфин)палладий. Тип лиганда специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Конкретные примеры такого лиганда включают в себя 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP), 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос), три-трет-бутилфосфин, три-(4-метилфенил)фосфин, три-2-фурилфосфин, 2-(ди-трет-бутилфосфино)бифенил, 2-(дициклогексилфосфино)бифенил, трициклогексилфосфин, 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил, 1,1'-бис(дифенилфосфино)ферроцен, тетрафторборат ди-трет-бутилфосфония и 1,3-бис-(2,4,6-триметилфенил)имидазол-2-илиден. Предпочтительным примером является тетракис(трифенилфосфин)палладий(0).
Вышеуказанный палладиевый(0) катализатор можно применять в количестве, составляющем 0,01-5-кратное, предпочтительно 0,01-0,1-кратное количество молярного эквивалента соединения (А-1).
Тип применяемого основания специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Конкретные примеры основания могут включать в себя неорганические основания, такие как трикалийфосфат, тринатрийфосфат, карбонат цезия, карбонат калия, карбонат натрия, гидрокарбонат цезия, гидрокарбонат калия, гидрокарбонат натрия, ацетат натрия, гидроксид бария, гидроксид калия, фторид калия или фторид цезия; алкоксиды металлов, такие как этоксид натрия или трет-бутоксид натрия; ацетаты щелочных металлов, такие как ацетат натрия или ацетат калия; и органические основания, такие как триэтиламин. Предпочтительным основанием является карбонат натрия.
Вышеуказанное основание можно применять в количестве, в 1-100 раз, предпочтительно в 1-20 раз превышающем молярный эквивалент соединения (А-1).
Тип применяемой добавки специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Конкретные примеры добавки могут включать в себя хлорид лития, хлорид натрия, бромид лития, бромид натрия и бромид тетрабутиламмония.
Вышеуказанную добавку можно применять в количестве, в 1-100 раз, предпочтительно в 1-10 раз превышающем молярный эквивалент соединения (А-1).
Температуру реакции специально не ограничивают. Обычно она находится между -30°С и 180°С и предпочтительно между 0°С и 100°С.
Время реакции специально не ограничивают. Оно обычно составляет между 0,5 и 200 часами и предпочтительно между 1 и 100 часами.
Когда реакцию проводят в атмосфере инертного газа, тип такого инертного газа конкретно не ограничивают, если он не ингибирует реакцию настоящей стадии. Конкретные примеры его могут включать в себя аргон или азот.
<Стадия 2>
Настоящая стадия является стадией, в которой соединению (А-2) предоставляется возможность взаимодействовать с метиламином в инертном растворителе, так чтобы получить соединение (А-3).
Вышеуказанный метиламин можно применять в количестве, в 1-200 раз и предпочтительно в 1-40 раз превышающем молярный эквивалент соединения (А-2).
Тип применяемого растворителя специально не ограничивают, если он растворяет исходные вещества до определенной степени и не ингибирует реакцию в данной стадии. Примеры растворителя могут включать в себя ароматические углеводороды, такие как толуол, бензол или ксилол; простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, диметоксиэтан или диоксан; спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, трет-бутанол или диэтиленгликоль; воду и смеси указанных растворителей. Предпочтительными примерами являются изопропанол и тетрагидрофуран.
Метод добавления применяемого метиламина специально не ограничивают, если может быть получено представляющее интерес соединение и не образуются неотделяемые побочные продукты. Например, метиламин можно добавлять в форме газа, раствора, такого как раствор в метаноле, этаноле, тетрагидрофуране или воде, или соли, такой как гидрохлорид. Метиламин предпочтительно применяют в виде раствора в метаноле.
Температуру реакции специально не ограничивают. Она обычно находится между -30°С и 180°С и предпочтительно между 0°С и 150°С.
Время реакции конкретно не ограничивают. Оно обычно составляет между 0,5 и 200 часами и предпочтительно между 1 и 100 часами.
В настоящей стадии обычно применяют герметичный под давлением реактор, такой как реактор из нержавеющей стали.
Кристаллы соединения (I) настоящего изобретения можно стабильно получать в промышленном масштабе получением соединения (I), растворением указанного выше соединения нагреванием в определенном растворителе и затем охлаждением полученного раствора при перемешивании для кристаллизации или перекристаллизацией полученного соединения.
Примеры
Соединение настоящего изобретения можно получить способами, описанными в нижеследующих примерах. Однако эти примеры представлены только для целей иллюстрации. Во всяком случае, не предполагается, что описываемые ниже конкретные примеры ограничивают объем изобретения. Кроме того, в объеме настоящего изобретения могут быть сделаны различные модификации.
Соединения, с которыми связаны названия публикаций или тому подобное, получали согласно таким публикациям или т.п.
Пример получения 1
Синтез 3-(2-хлор-6,7-диметоксихиназолин-4-ил)фениламина

Двадцать пять граммов 2,4-дихлор-6,7-диметоксихиназолина суспендируют в 2,25 л смешанного раствора, состоящего из смеси толуол:тетрагидрофуран:2н. раствор карбоната натрия = 1:1:1. К реакционной смеси добавляют 21,5 г 1/2 сульфата 3-аминофенилбороновой кислоты и смесь дегазируют, атмосферу в реакционном сосуде заменяют азотом. К реакционной смеси добавляют 2,23 г тетракис(трифенилфосфин)палладия(0) с последующим перемешиванием при 60°С в атмосфере азота. Через восемнадцать часов после начала реакции к реакционной смеси добавляют 1,2 г тетракис(трифенилфосфин)палладия(0) и перемешивание продолжают. Спустя тридцать часов к реакционной смеси дополнительно добавляют 1,2 г тетракис(трифенилфосфин)палладия(0) и перемешивание далее продолжают. Спустя сорок восемь часов после начала реакции реакционную смесь охлаждают и затем ее переносят в делительную воронку, чтобы отделить органический слой. Полученный органический слой промывают 300 мл насыщенного раствора соли и затем сушат над безводным сульфатом магния. Осушитель удаляют пропусканием органического слоя через 250 г силикагеля. Силикагель промывают 1,5 л этилацетата и полученные органические слои объединяют и концентрируют досуха. Остаток растирают с 200 мл этилацетата и полученное твердое вещество затем отделяют фильтрованием. Твердое вещество промывают 100 мл диэтилового эфира и 200 мл смешанного растворителя, состоящего из смеси н-гептан:этилацетат = 1:1, и сушат при аэрации, получая при этом 28,2 г представляющего интерес продукта. Выход: 92,5%.
1Н ЯМР (ДМСО-d6) δ (м.д.): 3,86 (3Н, с), 4,01 (3Н, с), 5,40 (2Н, ушир.), 6,79 (1Н, дд, J=1,6, 8,0 Гц), 6,93 (1Н, ушир. д, J=8,0 Гц), 7,02 (1Н, т, J=1,6 Гц), 7,24 (1Н, т, J=8,0 Гц), 7,41 (1Н, с), 7,43 (1Н, с).
Пример получения 2
Синтез [4-(3-аминофенил)-6,7-диметоксихиназолин-2-ил]метиламина

Четырнадцать граммов 3-(2-хлор-6,7-диметоксихиназолин-4-ил)фениламина суспендируют в 135 мл смешанного растворителя, состоящего из смеси тетрагидрофуран:изопропанол = 2:1. К реакционной смеси добавляют 89 мл раствора метиламина в метаноле и реакционную смесь перемешивают в герметичном под давлением трубчатом реакторе при 130°С в течение 24 часов. После предоставления реакционной смеси возможности охладиться до комнатной температуры ее разбавляют 300 мл этилацетата и затем промывают 300 мл воды. Водный слой экстрагируют 100 мл этилацетата и объединенный органический слой промывают 100 мл насыщенного раствора соли. Органический слой отделяют и затем сушат над безводным сульфатом магния. Осушитель удаляют фильтрованием, органический слой концентрируют досуха и образовавшийся остаток растирают со смешанным растворителем, состоящим из смеси этилацетат:тетрагидрофуран = 3:1. Полученное твердое вещество отделяют фильтрованием и фильтрат затем промывают этилацетатом и сушат при аэрации, получая при этом 10 г представляющего интерес продукта. Фильтрат адсорбируют на колонке с 50 г силикагеля и затем элюируют смешанным растворителем, состоящим из смеси этилацетат:метанол = 9:1, и элюат концентрируют досуха. Остаток растирают с этилацетатом и полученное твердое вещество затем отделяют фильтрованием. Твердое вещество промывают диэтиловым эфиром и сушат при аэрации, получая при этом 1,4 г представляющего интерес продукта. Общий выход: 82,9%.
1Н ЯМР (CDCl3) δ (м.д.): 3,12 (3Н, д, J=5,2 Гц), 3,80 (2Н, ушир. с), 3,82 (3Н, с), 4,03 (3Н, с), 5,30 (1Н, ушир.), 6,83 (1Н, дд, J=1,6, 8,0 Гц), 6,99 (1Н, т, J=1,6 Гц), 7,04 (1Н, ушир. д, J=8,0 Гц), 7,07 (1Н, с), 7,15 (1Н, с), 7,30 (1Н, т, J=8,0 Гц).
Пример получения 3
Альтернативный способ синтеза 3-(2-хлор-6,7-диметоксихиназолин-4-ил)фениламина (пример получения 1)
К 634 г карбоната натрия (5,98 моль) добавляют 2,91 кг воды в атмосфере азота с последующим перемешиванием для растворения. К раствору добавляют 3,0 л тетрагидрофурана, 431 г моногидрата 3-аминофенилбороновой кислоты (2,78 моль), 30,4 г трифенилфосфина (0,116 моль) и 26,0 г дихлорпалладия (0,116 моль) в указанном порядке. К смеси по каплям добавляют раствор 2,4-дихлор-6,7-диметоксихиназолина (600 г; 2,32 моль) в тетрагидрофуране (12,0 л) на протяжении 2 часов при перемешивании при 60°С с последующим перемешиванием при такой же температуре в течение 16 часов. К смеси добавляют 3,0 кг 5% раствора хлорида натрия и 12,0 л тетрагидрофурана в указанном порядке и смесь перемешивают при 50°С в течение 1 часа и дают ей возможность охладиться до 25°С. Смесь фильтруют через целит для удаления нерастворимого вещества, фильтрат переносят в делительную воронку и органический слой отделяют. К отделенному органическому слою добавляют 150 г безводного сульфата магния и 60,0 г активированного угля, смесь перемешивают при 50°С в течение 1 часа и предоставляют ей возможность охладиться до 25°С. Смесь фильтруют через целит для удаления нерастворимого вещества и фильтрат концентрируют при пониженном давлении. К остатку добавляют 6,0 л воды и смесь перемешивают при комнатной температуре в течение 1 часа, осажденные кристаллы собирают фильтрованием. Собранные кристаллы сушат при 50°С и при пониженном давлении, получая при этом 730 г представляющего интерес продукта. Выход: 62,1%.
Пример получения 4
Альтернативный способ синтеза [4-(3-аминофенил)-6,7-диметоксихиназолин-2-ил]метиламина (пример получения 2)
Двести граммов неочищенного 3-(2-хлор-6,7-диметоксихиназолин-4-ил)фениламина (содержание 124 г; 0,394 моль) суспендируют в смешанном растворителе, состоящем из 1,2 л тетрагидрофурана и 0,6 л изопропанола. К смеси добавляют 1,2 л раствора метиламина в метаноле и смесь перемешивают в автоклаве SUS при 90°С в течение 15 часов. Реакционной смеси дают возможность охладиться до 25°С и концентрируют при пониженном давлении. К остатку добавляют 1,0 л воды и 4,0 л хлороформа, смесь перемешивают при 50°С в течение 0,5 часа и дают ей возможность охладиться до 25°С. Смесь фильтруют через целит для удаления нерастворимого вещества, фильтрат переносят в делительную воронку и органический слой отделяют. К отделенному органическому слою добавляют 50,0 г безводного сульфата магния и 20,0 г активированного угля, смесь перемешивают при 50°С в течение 1 часа и дают ей возможность охладиться до 25°С. Смесь фильтруют через целит для удаления нерастворимого вещества и фильтрат концентрируют при пониженном давлении. К остатку добавляют 904 мл хлороформа, смесь перемешивают при 50°С в течение 1 часа и перемешивают на протяжении ночи после выключения нагревателя. Затем смесь перемешивают на ледяной бане в течение 2 часов и осажденные кристаллы собирают фильтрованием. Собранные кристаллы сушат при 50°С и при пониженном давлении, получая при этом 76,3 г представляющего интерес продукта. Выход: 38,7%.
Пример 1
Синтез метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты

К раствору 16,8 г [4-(3-аминофенил)-6,7-диметоксихиназолин-2-ил]метиламина и 8,6 г пиридина, растворенных в 300 мл тетрагидрофурана, добавляют 11,8 г метилового эфира 4-хлоркарбонилбензойной кислоты при комнатной температуре с последующим перемешиванием в течение 24 часов. К реакционной смеси добавляют 100 мл диметилсульфоксида, смесь распределяют между смешанным растворителем, состоящим из 2000 мл этилацетата и 1000 мл тетрагидрофурана, и 1000 мл насыщенного раствора гидрокарбоната натрия, органический слой отделяют. Водный слой далее экстрагируют смешанным растворителем, состоящим из 500 мл этилацетата и 500 мл тетрагидрофурана. Объединенный органический слой затем промывают 1000 мл насыщенного раствора гидрокарбоната натрия и 1000 мл насыщенного раствора соли в указанном порядке и сушат над безводным сульфатом магния. Осушитель удаляют фильтрованием с применением подушки 100 г основного силикагеля с последующим тщательным промыванием 2000 мл этилацетата. Объединенный элюат концентрируют при пониженном давлении и полученный неочищенный продукт суспендируют и растирают в смешанном растворителе, состоящем из 100 мл тетрагидрофурана и 500 мл диэтилового эфира. Осажденные кристаллы собирают фильтрованием, промывают дважды 100 мл диэтилового эфира и сушат при аэрации при 50°С в течение 5 часов, получая при этом 13,8 г кристаллов указанного в заголовке соединения (выход: 53,2%).
1Н ЯМР (ДМСО-d6) δ (м.д.): 2,88 (3Н, д, J=4,4 Гц), 3,74 (3Н, с), 3,89 (3Н, с), 3,92 (3Н, с), 6,99 (1Н, c), 7,00 (1Н, ушир. c), 7,17 (1Н, с), 7,46 (1Н, д, J=8,0 Гц), 7,55 (1Н, т, J=8,0 Гц), 7,87 (1Н, ушир. д, J=8,0 Гц), 8,08 (4Н, с), 8,20 (1Н, ушир. с), 10,61 (1Н, с).
Пример 2
Синтез гидрохлорида N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты
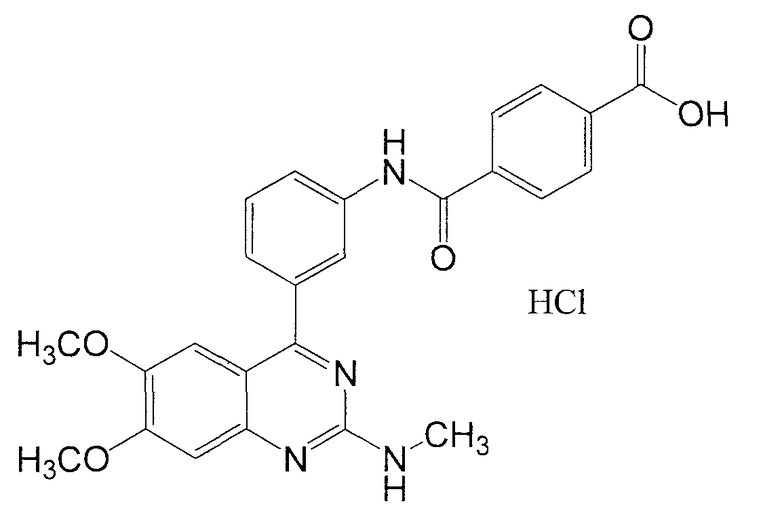
К раствору 2,5 г метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты в смешанном растворителе, состоящем из 50 мл тетрагидрофурана и 25 мл метанола, добавляют 11,3 мл 5н. раствора гидроксида натрия с последующим перемешиванием при комнатной температуре в течение 12 часов. Реакционную смесь подкисляют добавлением 5н. хлористоводородной кислоты и полученное твердое вещество затем отделяют фильтрованием, промывают 10 мл воды и 20 мл простого эфира и сушат при аэрации, получая при этом 2,5 г представляющего интерес продукта. Выход: 95,3%.
1Н ЯМР (ДМСО-d6) δ (м.д.): 3,05 (3Н, ушир. с), 3,82 (3Н, с), 3,98 (3Н, с), 7,32 (1Н, c), 7,54 (1Н, ушир. д, J=8,0 Гц), 7,55 (1Н, ушир. с), 7,61 (1Н, т, J=8,0 Гц), 7,91 (1Н, д, J=8,0 Гц), 8,06 (4Н, с), 8,35 (1Н, ушир. с), 10,71 (1Н, с).
Пример 3
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N',N'-диметилтерефталамида

К раствору 100 мг гидрохлорида N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты в 2 мл диметилформамида добавляют 60 мг WSC, 41 мг 1-гидроксибензотриазола, 42 мкл триэтиламина и 10 мг 4-диметиламинопиридина с последующим перемешиванием смеси в течение 30 минут. К реакционной смеси добавляют 200 мкл раствора диметиламина в тетрагидрофуране с последующим перемешиванием при комнатной температуре в течение 15 часов. К реакционной смеси добавляют 2 мл тетрагидрофурана и реакционную смесь распределяют после добавления насыщенного раствора гидрокарбоната натрия. Органический слой экстрагируют 10 мл этилацетата, промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Безводный сульфат магния удаляют фильтрованием и органический слой концентрируют досуха, остаток растирают со смешанным растворителем, состоящим из смеси этилацетат:н-гептан = 1:1. Полученное твердое вещество отделяют фильтрованием, промывают диэтиловым эфиром и сушат при аэрации, получая при этом 85 мг представляющего интерес продукта. Выход: 87%.
1Н ЯМР (CD3OD) δ (м.д.): 3,01 (3Н, с), 3,05 (3Н, с), 3,13 (3Н, с), 3,83 (3Н, c), 3,99 (3Н, c), 7,11 (1Н, с), 7,27 (1Н, с), 7,52 (1Н, ддд, J=1,6, 1,6, 8,0 Гц), 7,57 (2Н, д, J=8,4 Гц), 7,58 (1Н, т, J=8,4 Гц), 7,81 (1Н, ддд, J=1,6, 2,0, 8,0 Гц), 8,04 (2Н, д, J=8,4 Гц), 8,19 (1Н, т, J=2,0 Гц).
Нижеследующие соединения примеров 4-10 синтезировали способами, аналогичными способу примера 3, с применением соединения примера 2 в качестве исходного соединения и с применением также соответствующего спирта или амина.
Пример 4
Синтез этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты

1Н ЯМР (ДМСО-d6) δ (м.д.): 1,33 (3Н, т, J=7,2 Гц), 2,84 (3Н, д, J=4,8 Гц), 3,74 (3Н, c), 3,91 (3Н, c), 4,34 (2Н, кв, J=7,2 Гц), 6,99 (1Н, с), 7,00 (1Н, ушир. с), 7,17 (1Н, с), 7,47 (1Н, д, J=8,0 Гц), 7,55 (1Н, т, J=8,0 Гц), 7,88 (1Н, ушир. д, J=8,0 Гц), 8,08 (4Н, с), 8,20 (1Н, ушир. с), 10,61 (1Н, с).
Пример 5
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилтерефталамида

1Н ЯМР (ДМСО-d6) δ (м.д.): 2,81 (3Н, д, J=4,4 Гц), 2,90 (3Н, д, J=5,2 Гц), 3,75 (3Н, c), 3,93 (3Н, c), 6,99 (1Н, с), 7,01 (1Н, ушир. с), 7,18 (1Н, с), 7,46 (1Н, д, J=8,0 Гц), 7,55 (1Н, т, J=8,0 Гц), 7,89 (1Н, ушир. д, J=8,0 Гц), 7,96 (2Н, д, J=8,8 Гц), 8,04 (2Н, д, J=8,8 Гц), 8,21 (1Н, т, J=1,6 Гц), 8,59 (1Н, ушир.), 10,53 (1Н, с).
Пример 6
Синтез пропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты

1Н ЯМР (ДМСО-d6) δ (м.д.): 0,99 (3Н, т, J=7,6 Гц), 1,76 (2Н, м), 2,90 (3Н, д, J=5,2 Гц), 3,76 (3Н, c), 3,93 (3Н, c), 4,28 (2Н, т, J=6,8 Гц), 7,01 (1Н, с), 7,03 (1Н, ушир. с), 7,19 (1Н, с), 7,49 (1Н, д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,90 (1Н, ушир. д, J=8,0 Гц), 8,11 (4Н, с), 8,22 (1Н, ушир. с), 10,65 (1Н, с).
Пример 7
Синтез изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты
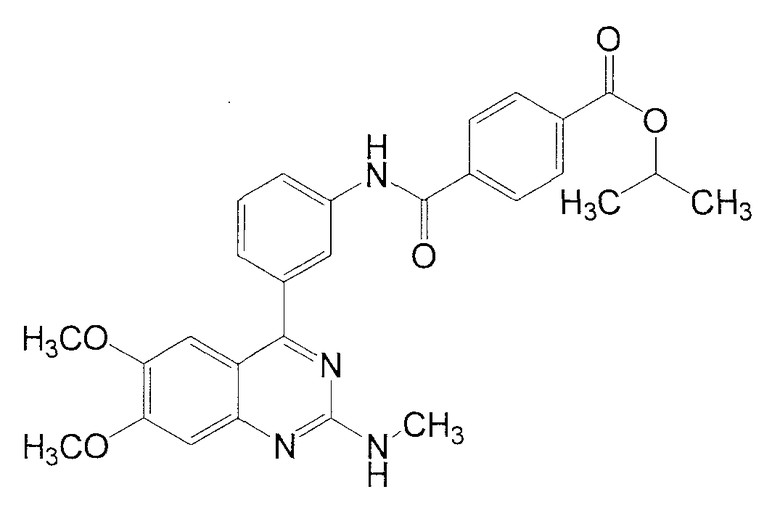
1Н ЯМР (ДМСО-d6) δ (м.д.): 1,35 (6Н, д, J=6,4 Гц), 2,90 (3Н, д, J=5,2 Гц), 3,76 (3Н, c), 3,93 (3Н, c), 5,18 (1Н, м), 7,01 (1Н, с), 7,03 (1Н, ушир. с), 7,19 (1Н, с), 7,49 (1Н, д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,91 (1Н, ушир. д, J=8,0 Гц), 8,09 (4Н, с), 8,22 (1Н, ушир. с), 10,65 (1Н, с).
Пример 8
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-этилтерефталамида
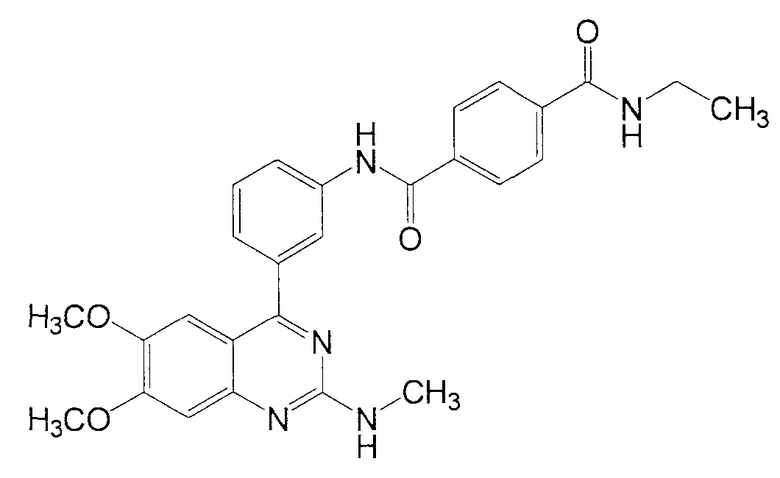
1Н ЯМР (ДМСО-d6) δ (м.д.): 1,15 (3Н, т, J=7,2 Гц), 2,91 (3Н, д, J=4,8 Гц), 3,32 (2Н, м), 3,76 (3Н, c), 3,94 (3Н, c), 7,01 (1Н, с), 7,03 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,91 (1Н, ушир. д, J=8,0 Гц), 7,98 (2Н, д, J=8,4 Гц), 8,06 (2Н, д, J=8,4 Гц), 8,22 (1Н, ушир. с), 8,64 (1Н, т, J=5,6 Гц), 10,55 (1Н, с).
Пример 9
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-пропилтерефталамида
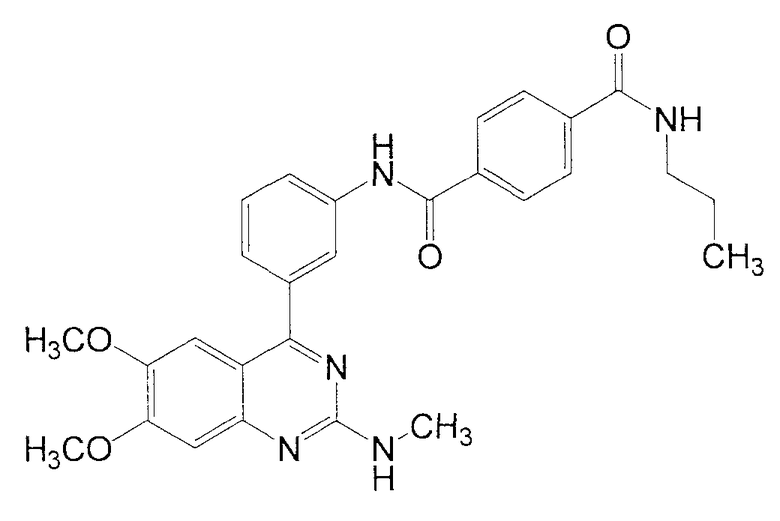
1Н ЯМР (ДМСО-d6) δ (м.д.): 0,91 (3Н, т, J=7,6 Гц), 1,56 (2Н, м), 2,91 (3Н, д, J=4,8 Гц), 3,25 (2Н, кв, J=6,0 Гц), 3,76 (3Н, c), 3,94 (3Н, c), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,91 (1Н, ушир. д, J=8,0 Гц), 7,98 (2Н, д, J=8,4 Гц), 8,06 (2Н, д, J=8,4 Гц), 8,22 (1Н, ушир. с), 8,62 (1Н, т, J=6,0 Гц), 10,55 (1Н, с).
Пример 10
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-изопропилтерефталамида
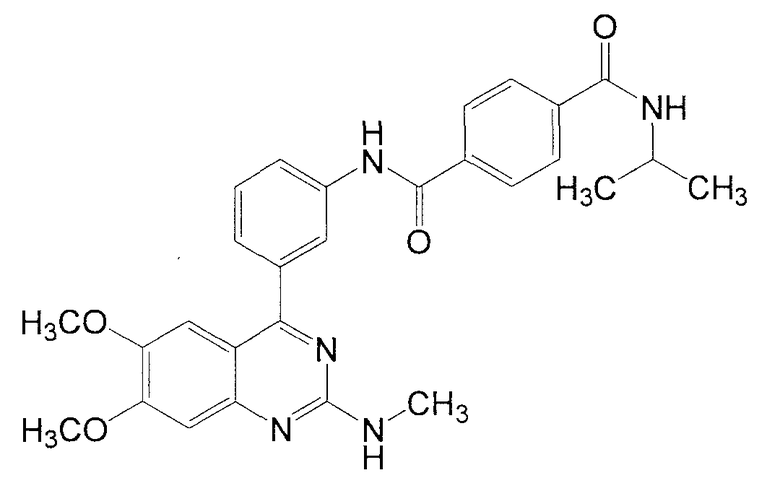
1Н ЯМР (ДМСО-d6) δ (м.д.): 1,19 (6Н, д, J=6,8 Гц), 2,91 (3Н, д, J=4,8 Гц), 3,76 (3Н, c), 3,94 (3Н, c), 4,12 (1Н, м), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,92 (1Н, ушир. д, J=8,0 Гц), 7,98 (2Н, д, J=8,4 Гц), 8,05 (2Н, д, J=8,4 Гц), 8,22 (1Н, ушир. с), 8,34 (1Н, д, J=7,6 Гц), 10,55 (1Н, с).
Пример 11
Синтез метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевой кислоты

Смесь 2,00 г (6,44 ммоль) 3-(2-хлор-6,7-диметоксихиназолин-4-ил)фениламина, 1,75 г (9,71 ммоль) монометилового эфира изофталевой кислоты, 2,7 мл триэтиламина, 1,00 г гидрата 1-гидроксибензотриазола и 2,00 г гидрохлорида WSC суспендируют в 15 мл диметилформамида с последующим перемешиванием при комнатной температуре на протяжении ночи. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над сульфатом магния. После фильтрования остаток, полученный дистилляцией растворителя при пониженном давлении, затем подвергают колоночной хроматографии (этилацетат-гептан). После этого твердое вещество, осажденное смесью этилацетат-гексан, собирают фильтрованием и сушат при аэрации, получая при этом 2,65 г указанного в заголовке соединения (выход: 87%).
1Н ЯМР (ДМСО-d6) δ (м.д.): 2,91 (3Н, д, J=4,8 Гц), 3,76 (3Н, c), 3,92 (3Н, c), 3,93 (3Н, с), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,72 (1Н, т, J=8,0 Гц), 7,92 (1Н, ушир. д, J=8,0 Гц), 8,17 (1Н, ушир. д, J=8,0 Гц), 8,22 (1Н, т, J=1,6 Гц), 8,26 (1Н, ушир. д, J=8,0 Гц), 8,56 (1Н, т, J=1,6 Гц), 10,67 (1Н, с).
Пример 12
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевой кислоты

К раствору 2,49 г (5,27 ммоль) соединения примера 11, получаемого выше, в смешанном растворителе, состоящем из 40 мл тетрагидрофурана и 40 мл этанола, добавляют 15 мл 1н. водного раствора гидроксида натрия с последующим перемешиванием при комнатной температуре на протяжении ночи. Реакционную смесь нейтрализуют 15 мл 1н. хлористоводородной кислоты и к ней добавляют 60 мл воды. Осажденное твердое вещество собирают фильтрованием и сушат под горячим воздухом, получая при этом 3,31 г указанного в заголовке соединения.
1Н ЯМР (ДМСО-d6) δ (м.д.): 2,91 (3Н, д, J=4,8 Гц), 3,76 (3Н, c), 3,94 (3Н, c), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,20 (1Н, с), 7,48 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,69 (1Н, т, J=8,0 Гц), 7,92 (1Н, ушир. д, J=8,0 Гц), 8,15 (1Н, ушир. д, J=8,0 Гц), 8,22 (1Н, ушир. д, J=8,0 Гц), 8,23 (1Н, т, J=1,6 Гц), 8,56 (1Н, т, J=1,6 Гц), 10,65 (1Н, с).
Нижеследующие соединения примеров 13-19 синтезировали способами, аналогичными способу примера 3, с применением соединения вышеуказанного примера 12 в качестве исходного соединения и с применением также соответствующего спирта или амина.
Пример 13
Синтез этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевой кислоты

1Н ЯМР (ДМСО-d6) δ (м.д.): 1,36 (3Н, т, J=7,2 Гц), 2,91 (3Н, д, J=4,8 Гц), 3,76 (3Н, c), 3,93 (3Н, c), 4,38 (2Н, кв, J=7,2 Гц), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,71 (1Н, т, J=8,0 Гц), 7,92 (1Н, ушир. д, J=8,0 Гц), 8,17 (1Н, ушир. д, J=8,0 Гц), 8,22 (1Н, т, J=1,6 Гц), 8,25 (1Н, ушир. д, J=8,0 Гц), 8,54 (1Н, т, J=1,6 Гц), 10,67 (1Н, с).
Пример 14
Синтез пропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевой кислоты

1Н ЯМР (ДМСО-d6) δ (м.д.): 0,99 (3Н, т, J=7,2 Гц), 1,76 (2Н, квт, J=7,2, 6,8 Гц), 2,91 (3Н, д, J=4,4 Гц), 3,76 (3Н, c), 3,93 (3Н, c), 4,29 (2Н, т, J=6,8 Гц), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,49 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,72 (1Н, т, J=8,0 Гц), 7,91 (1Н, ушир. д, J=8,0 Гц), 8,18 (1Н, ушир. д, J=8,0 Гц), 8,22 (1Н, т, J=1,6 Гц), 8,25 (1Н, ушир. д, J=8,0 Гц), 8,54 (1Н, т, J=1,6 Гц), 10,67 (1Н, с).
Пример 15
Синтез изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевой кислоты

1Н ЯМР (ДМСО-d6) δ (м.д.): 1,36 (6Н, д, J=6,4 Гц), 2,91 (3Н, д, J=4,8 Гц), 3,76 (3Н, c), 3,93 (3Н, c), 5,19 (1Н, септет, J=6,4 Гц), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,71 (1Н, т, J=8,0 Гц), 7,91 (1Н, ушир. д, J=8,0 Гц), 8,15 (1Н, ушир. д, J=8,0 Гц), 8,21 (1Н, т, J=1,6 Гц), 8,24 (1Н, ушир. д, J=8,0 Гц), 8,52 (1Н, т, J=1,6 Гц), 10,67 (1Н, с).
Пример 16
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилизофталамида

1Н ЯМР (ДМСО-d6) δ (м.д.): 2,82 (3Н, д, J=4,4 Гц), 2,91 (3Н, д, J=4,8 Гц), 3,76 (3Н, c), 3,93 (3Н, c), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,64 (1Н, т, J=8,0 Гц), 7,91 (1Н, ушир. д, J=8,0 Гц), 8,02 (1Н, ушир. д, J=8,0 Гц), 8,10 (1Н, ушир. д, J=8,0 Гц), 8,22 (1Н, т, J=1,6 Гц), 8,42 (1Н, т, J=1,6 Гц), 8,60 (1Н, ушир. кв, J=4,8 Гц), 10,58 (1Н, с).
Пример 17
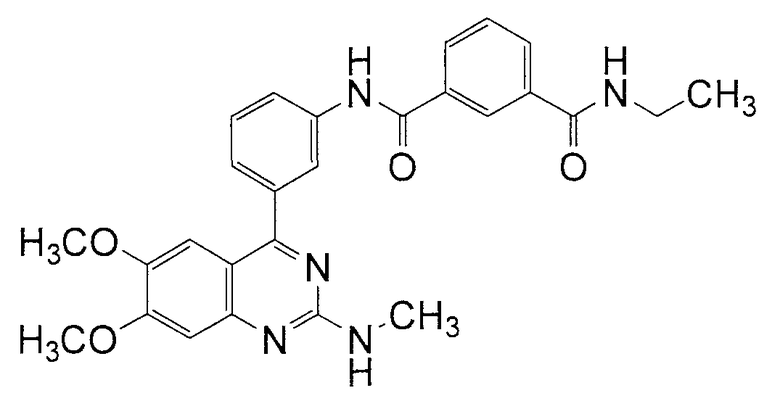
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-этилизофталамида
1Н ЯМР (ДМСО-d6) δ (м.д.): 1,15 (3Н, т, J=7,2 Гц), 2,91 (3Н, д, J=4,4 Гц), 3,33 (2Н, кв, J=7,2 Гц), 3,76 (3Н, c), 3,93 (3Н, с), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,63 (1Н, т, J=8,0 Гц), 7,92 (1Н, ушир. д, J=8,0 Гц), 8,03 (1Н, ушир. д, J=8,0 Гц), 8,09 (1Н, ушир. д, J=8,0 Гц), 8,22 (1Н, т, J=1,6 Гц), 8,42 (1Н, т, J=1,6 Гц), 8,63 (1Н, ушир. т, J=5,4 Гц), 10,58 (1Н, с).
Пример 18
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-пропилизофталамида

1Н ЯМР (ДМСО-d6) δ (м.д.): 0,91 (3Н, т, J=7,2 Гц), 1,56 (2Н, квт, J=7,2, 6,4 Гц), 2,91 (3Н, д, J=4,4 Гц), 3,25 (2Н, дт, J=6,4, 5,4 Гц), 3,76 (3Н, c), 3,93 (3Н, с), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,63 (1Н, т, J=8,0 Гц), 7,92 (1Н, ушир. д, J=8,0 Гц), 8,04 (1Н, ушир. д, J=8,0 Гц), 8,09 (1Н, ушир. д, J=8,0 Гц), 8,22 (1Н, т, J=1,6 Гц), 8,42 (1Н, т, J=1,6 Гц), 8,62 (1Н, ушир. т, J=5,4 Гц), 10,59 (1Н, с).
Пример 19
Синтез N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-изопропилизофталамида
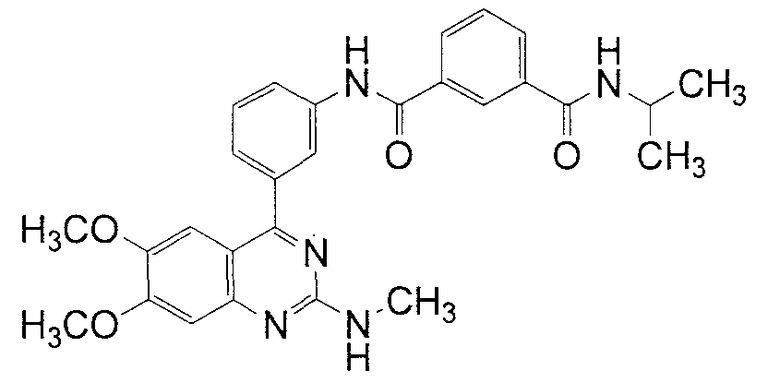
1Н ЯМР (ДМСО-d6) δ (м.д.): 1,19 (6Н, д, J=6,4 Гц), 2,91 (3Н, д, J=4,4 Гц), 3,76 (3Н, c), 3,93 (3Н, с), 4,13 (1Н, септет, J=6,4 Гц), 7,01 (1Н, с), 7,02 (1Н, ушир. с), 7,19 (1Н, с), 7,48 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,62 (1Н, т, J=8,0 Гц), 7,93 (1Н, ушир. д, J=8,0 Гц), 8,04 (1Н, ушир. д, J=8,0 Гц), 8,08 (1Н, ушир. д, J=8,0 Гц), 8,22 (1Н, т, J=1,6 Гц), 8,40 (1Н, ушир. д), 8,41 (1Н, т, J=1,6 Гц), 10,59 (1Н, с).
Пример 20
2-Метоксиэтиловый эфир N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты
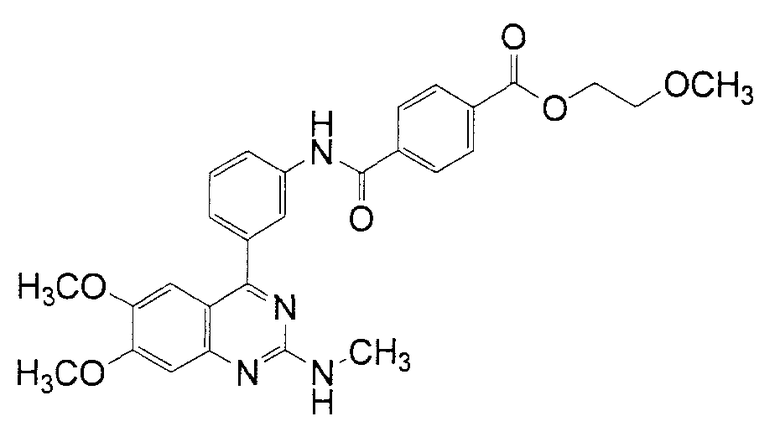
Смесь, состоящую из 55 мг (0,11 ммоль) гидрохлорида N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты, 40 мкл (0,51 ммоль) 2-метоксиэтанола, 47 мкл триэтиламина, 17 мг гидрата 1-гидроксибензотриазола и 35 мг гидрохлорида WSC суспендируют в 2 мл диметилформамида с последующим перемешиванием при комнатной температуре на протяжении ночи. Реакционную смесь выливают в воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и затем сушат над сульфатом магния. Остаток, полученный фильтрованием и дистилляцией растворителя при пониженном давлении, подвергают колоночной хроматографии на силикагеле (этилацетат-гептан). После этого твердое вещество, осажденное смесью этилацетат-гексан, собирают фильтрованием и сушат при аэрации, получая при этом 40 мг указанного в заголовке соединения (выход: 70%).
1Н ЯМР (ДМСО-d6) δ (м.д.): 2,91 (3Н, д, J=4,8 Гц), 3,32 (3Н, с), 3,69 (2Н, м), 3,76 (3Н, с), 3,93 (3Н, с), 4,45 (2Н, м), 7,01 (1Н, с), 7,03 (1Н, ушир. с), 7,19 (1Н, с), 7,49 (1Н, ушир. д, J=7,6 Гц), 7,57 (1Н, т, J=7,6 Гц), 7,90 (1Н, ушир. д, J=7,6 Гц), 8,11 (4Н, с), 8,12 (1Н, т, J=1,8 Гц), 10,65 (1Н, с).
Пример 21
2-Метоксиэтиловый эфир N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталамовой кислоты
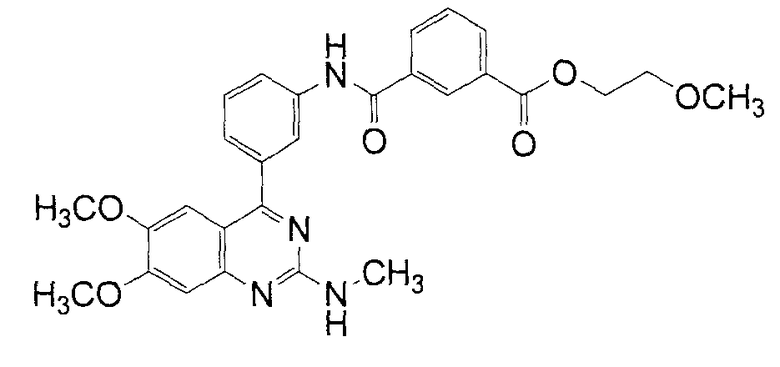
Указанное в заголовке соединение получают способом, который является эквивалентным способу примера 3, с применением соединения примера 12 в качестве исходного соединения и с применением также 2-метоксиэтанола.
1Н ЯМР (ДМСО-d6) δ (м.д.): 2,91 (3Н, д, J=4,8 Гц), 3,32 (3Н, с), 3,69 (2Н, м), 3,76 (3Н, с), 3,93 (3Н, с), 4,46 (2Н, м), 7,01 (1Н, с), 7,03 (1Н, ушир. с), 7,19 (1Н, с), 7,49 (1Н, ушир. д, J=8,0 Гц), 7,57 (1Н, т, J=8,0 Гц), 7,73 (1Н, т, J=8,0 Гц), 7,92 (1Н, ушир. д, J=8,0 Гц), 8,17 (1Н, дт, J=8,0, 1,6 Гц), 8,22 (1Н, т, J=1,6 Гц), 8,26 (1Н, дт, J=8,0, 1,6 Гц), 8,54 (1Н, т, J=1,6 Гц), 10,68 (1Н, с).
Пример 22
Безводные кристаллы 1 метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (пример 1)
К 75,28 мг соединения, полученного в примере 1, добавляют 9 мл ацетонитрила и смесь нагревают на масляной бане для растворения, и раствору дают возможность охладиться до комнатной температуры. Осадок собирают фильтрованием и сушат при 50°С на протяжении ночи, получая при этом указанные в заголовке кристаллы.
Пример 23
Безводные кристаллы 2 метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (пример 1)
К 52,93 мг соединения, полученного в примере 1, добавляют 12 мл 2-пропанола, смесь нагревают на масляной бане для растворения и раствору дают возможность охладиться до комнатной температуры. Осадок собирают фильтрованием и сушат при 50°С на протяжении ночи, получая при этом указанные в заголовке кристаллы.
Пример 24
Кристаллы 1 гидрата метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (пример 1)
К 75,71 мг соединения, полученного в примере 1, добавляют 15 мл ацетона, смесь нагревают на масляной бане для растворения и раствору дают возможность охладиться до комнатной температуры. Осадок собирают фильтрованием и сушат при 50°С на протяжении ночи, получая при этом указанные в заголовке кристаллы.
Пример 25
Кристаллы 2 гидрата метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (пример 1)
К 75,88 мг соединения, полученного в примере 1, добавляют 16 мл метанола, смесь нагревают на масляной бане для растворения и раствору дают возможность охладиться до комнатной температуры. Осадок собирают фильтрованием и сушат при 50°С на протяжении ночи, получая при этом указанные в заголовке кристаллы.
Пример 26
Кристаллы 3 гидрата метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (пример 1)
К 49,90 мг соединения, полученного в примере 1, добавляют 2 мл тетрагидрофурана, смесь нагревают на масляной бане для растворения и раствору дают возможность охладиться до комнатной температуры. После этого к смеси добавляют 10 мл воды и оставляют ее для стояния. Осадок собирают фильтрованием и сушат при 50°С на протяжении ночи, получая при этом указанные в заголовке кристаллы.
Пример 27
Аморфная метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовая кислота (пример 1)
К 36,49 мг соединения, полученного в примере 1, добавляют 0,2 мл диметилсульфоксида для растворения соединения. После этого к смеси дополнительно добавляют 10 мл воды и смесь выдерживают при стоянии. Осадок собирают фильтрованием и сушат при 50°С на протяжении ночи, получая при этом указанное в заголовке аморфное вещество.
Пример 28
Альтернативный способ получения безводных кристаллов 1 метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (пример 1)
Суспензию, состоящую из 10,00 г (55,51 ммоль) монометилтерефталата и 90 мл 1,2-диметоксиэтана, перемешивают при охлаждении ее на охлаждающей бане при 10°С. К суспензии добавляют 2,0 мл N,N-диметилформамида и 6,61 г (52,75 ммоль) тионилхлорида в указанном порядке. Суспензию перемешивают при нагревании при 60°С-65°С в течение 1 часа и дают ей возможность охладиться. Затем суспензию дополнительно перемешивают при охлаждении на ледяной бане. Затем к смеси по каплям добавляют 6,83 г (52,82 ммоль) диизопропилэтиламина. Затем реакционную смесь перемешивают при комнатной температуре. Спустя тридцать минут после достижения внутренней температуры 20°С перемешивание заканчивают. Реакционную смесь помещают в 200-мл колбу в форме баклажана с последующим измерением ее содержимого и получением 109,49 г смешанного раствора, состоящего из [смеси хлорангидрида монометилтерефталата/диизопропилэтиламина] (содержание хлорангидрида монометилтерефталата: 8,89 г), в виде светло-рыжевато-коричневого раствора.
Затем суспензию, состоящую из 9,50 г (30,00 ммоль) [4-(3-аминофенил)-6,7-диметоксихиназолин-2-ил]метиламина и 380 мл тетрагидрофурана, перемешивают при охлаждении при 0°С. К суспензии по каплям добавляют на протяжении 1 часа 80,71 г указанного выше смешанного раствора, состоящего из [смеси хлорангидрида монометилтерефталата/диизопропилэтиламина] (содержание хлорангидрида монометилтерефталата: 6,55 г; 33,00 ммоль). Смесь затем перемешивают при 0°С в течение 11 часов. Затем к реакционной смеси при охлаждении при 0°С добавляют 190 мл этилацетата и затем по каплям к смеси добавляют 380 г 5% раствора гидрокарбоната натрия. Реакционную смесь переносят в делительную воронку и добавляют 190 мл этилацетата. После экстракции органический слой отделяют и промывают 190 г 5% раствора хлорида натрия и 190 мл воды (дважды) в указанном порядке. Органический слой концентрируют при пониженном давлении и при 40°С. К остатку добавляют 143 мл метанола и смесь перемешивают при нагревании до 40°С. Через тридцать три минуты после начала перемешивания температуру масляной бани устанавливают при 75°С. Затем через 30 минут после того как внутренняя температура достигнет 60°С, температуру масляной бани устанавливают при 50°С. Когда внутренняя температура снизится до 55°С, к смеси по каплям добавляют 143 мл 2-пропанола. Затем внутреннюю температуру постепенно понижают до 27,3°С и смесь затем перемешивают при 20°С в течение 17 часов. Осажденные кристаллы подвергают вакуумному фильтрованию и образовавшийся продукт промывают смешанным растворителем, состоящим из 14,3 мл метанола и 14,3 мл 2-пропанола. Образовавшийся продукт подвергают отсасыванию в вакуумной линии в течение 10 минут для удаления жидкости, получая при этом 15,72 г неочищенного, представляющего интерес продукта (влажная масса; содержание представляющего интерес продукта: 13,31 г) в виде светло-желтых кристаллов (выход: 93,9%).
Суспензию, состоящую из 15,48 г неочищенного, представляющего интерес продукта (влажная масса) (содержание представляющего интерес продукта: 13,11 г; 27,00 ммоль) и 40 мл диметилсульфоксида перемешивают при нагревании при 60°С и кристаллы растворяют. Полученный раствор подвергают осветляющему фильтрованию и промывают 10 мл диметилсульфоксида. Фильтрат переносят в 1000-мл четырехгорлый стеклянный сосуд, который был предварительно нагрет рубашкой с горячей водой при 60°С, и остаток промывают 10 мл диметилсульфоксида. Смесь затем перемешивают при нагревании при 60°С. После этого к указанному раствору по каплям добавляют 119 мл 2-пропанола и в смесь помещают 49,3 мг затравочных кристаллов представляющего интерес продукта. После этого к смеси по каплям дополнительно добавляют 60 мл 2-пропанола. Эту суспензию перемешивают при 60°С в течение 2 часов, температуру рубашки устанавливают 80°С и суспензию непрерывно перемешивают при нагревании в течение 16,5 часа. Затем к суспензии по каплям добавляют 120 мл 2-пропанола и через 3 часа к суспензии дополнительно добавляют 362 мл 2-пропанола. После этого смесь постепенно охлаждают до 20°С (10°С/час) и затем ее перемешивают при такой же температуре. Через пять часов осажденные кристаллы собирают фильтрованием и кристаллы промывают смешанным растворителем, состоящим из 2,6 мл диметилсульфоксида и 24 мл 2-пропанола. Кристаллы дополнительно промывают 40 мл 2-пропанола и затем отсасывают в вакуумной линии для удаления жидкости. Полученные кристаллы сушат при пониженном давлении, получая при этом 9,84 г представляющего интерес продукта в виде желтых кристаллов (выход: 73,7%).
Для подтверждения действия соединения настоящего изобретения в качестве противозудного агента авторы настоящего изобретения провели нижеследующее испытание.
Пример испытания 1
Оценка действия соединений на модели поведения с почесыванием (царапаньями), индуцированным оксазолоном
<Метод испытания>
В качестве испытуемых животных применяли коммерчески доступных 5-недельных самок мышей (Japan SLC, Inc. and CRJ, Inc.). Для акклиматизации мышей выдерживали в течение 7 дней предварительного периода выращивания. После этого для испытания применяли только животных, у которых не были обнаружены изменения в общем состоянии и масса тела благоприятно повысилась.
(1) Сенсибилизация и индукция
Сенсибилизацию проводили нанесением один раз 20 мкл раствора в ацетоне (Wako Pure Chemical Industries, Ltd.), который содержал 0,5% 4-этоксиметилен-2-фенил-2-оксазолин-5-она (далее сокращенно называемого «оксазолоном», Sigma) на каждую из левой и правой ушных раковин 6-недельных мышей, которые прошли период акклиматизации.
Индукцию проводили нанесением 10 мкл 0,3% оксазолона на левую ушную раковину каждой мыши, всего 3 раза, при интервалах нанесения 2-3 дня от пятого дня после сенсибилизации.
(2) Измерение числа почесываний (царапаний)
Для объективной оценки действия соединений число почесываний (царапаний) каждой мыши автоматически измеряли с применением устройства Micro Act device (NeuroScience, Inc.). Кусочек магнита (диаметр: 1 мм; длина: 3 мм; NeuroScience) вводили в кожу левой задней лапы каждой мыши, анестезированной диэтиловым простым эфиром (Wako Pure Chemical Industries, Ltd.) не позднее чем за день до измерения. Сразу после того как было индуцировано поведение с царапаньями нанесением оксазолона, мышь переносили в камеру (диаметр: 11 см; высота: 18 см) со спиралью. После этого электрический ток, индуцированный движением магнита, введенного в лапу мыши, измеряли в течение определенного периода времени. Характеристическую форму волны, которая отражает такое поведение с царапаньем, детектировали устройством Micro Act и частоту появления волны детектированной формы подсчитывали как число царапаний.
(3) Оценка действия испытуемых соединений
Приготовление испытуемых соединений: соединения примеров 1, 4, 5, 7, 14, 20 и 21 приготовляли так, чтобы они имели концентрацию 0,1-0,3% в расчете на концентрацию смешанного растворителя (ацетон:этанол = 1:1).
Что касается групп испытуемых соединений, проводили определения действия для 5 следующих групп: (1) нормальная группа - группа применения смешанного растворителя (ацетон:этанол = 1:1); (2) контрольная группа - группа применения смешанного растворителя (ацетон:этанол = 1:1); (3) группа применения соединения примера 1; (4) группа применения соединения примера 4 и (5) группа применения соединения примера 5. Кроме того, проводили определения действия для 5 следующих групп: (1) нормальная группа - группа применения смешанного растворителя (ацетон:этанол = 1:1); (2) контрольная группа - группа применения смешанного растворителя (ацетон:этанол = 1:1); (3) группа применения соединения примера 7; (4) группа применения соединения примера 14 и (5) группа применения соединения примера 21. Кроме того, проводили определения действия для 3 следующих групп: (1) нормальная группа - группа применения смешанного растворителя (ацетон:этанол = 1:1); (2) контрольная группа - группа применения смешанного растворителя (ацетон:этанол = 1:1); (3) группа применения соединения примера 20. Мышей распределяли по таким группам, так чтобы число царапаний становилось постоянным на основе числа царапаний, полученных во время 2-й индукции.
Оценка действия испытуемого соединения: десять микролитров испытуемого соединения (только смешанный растворитель (ацетон:этанол = 1:1) применяли для нормальной группы и контрольной группы) вводили за 1 час до 3-го нанесения оксазолона. Оценку действия испытуемого соединения проводили с применением в качестве индикатора числа царапаний, полученных в течение 2 часов после индукции вследствие 3-го нанесения оксазолона (смешанный растворитель (ацетон:этанол = 1:1) применяли для нормальной группы). Кроме того, другую оценку действия проводили на основе кожного симптома. То есть при обнаружении царапаний, полученных перед 3-м нанесением оксазолона и через 1 день или 4 дня после нанесения, а именно для каждого из пунктов (1) царапина и (2) кровотечение/эрозия определяли 4 степени интенсивности от 0 до 3 (0: не имеется симптомов; 1: слабые симптомы; 2: умеренные симптомы и 3: серьезные симптомы). Таким образом, с применением разности в оценках в баллах, полученных до и после индукции оксазолоном в качестве индикатора, оценивали поведение по царапаньям. Такую степень интенсивности определяли для каждого пункта и общую оценку в баллах определяли как оценку в баллах каждого из индивидуумов.
<Результаты испытания>
(1) Результаты измерения в отношении числа царапаний показаны на фигурах 1, 9 и 12 (нормальная группа: n=11; другие группы: n=17 на фигуре 1; каждая группа: n=10 на фигурах 9 и 12).
(2) Результаты измерения в отношении кожных симптомов показаны на фигурах 2, 10, 11, 13 и 14.
Фигуры 2, 10 и 13 являются графиками, построенными на основе величины, полученной вычитанием оценки в баллах, полученной перед введением, из оценки в баллах, полученной через 1 день после введения, и фигуры 11 и 14 являются графиками, построенными на основе величины, полученной вычитанием оценки в баллах, полученной перед введением, из оценки в баллах, полученной через 4 дня после введения (нормальная группа: n=11; другие группы: n=17 на фигуре 2; нормальная группа: n=8; другие группы: n=9 на фигурах 10 и 11; каждая группа: n=8 на фигурах 13 и 14).
Из этих результатов было обнаружено, что соединения настоящего изобретения подавляют поведение с царапаньем, а также подавляют повреждение в виде кожных симптомов, вызванных таким поведением с царапаньем, тем самым проявляя превосходное противозудное действие.
Пример испытания 2
Эксперимент для оценки индукции активности фермента, метаболизирующего лекарственное средство (CYP), с применением замороженных гепатоцитов человека
<Операции испытания»
Замороженные гепатоциты человека (XenoTeck) быстро размораживали при 37°С и жизнеспособные клетки получали с применением набора выделения гепатоцитов (Nosan Corporation). После того как полученные клетки разводили охлажденной льдом средой Е William's (10% FBS, +PSG) с получением концентрации 5×105 жизнеспособных клеток/мл, клетки засевали на 48-луночном, покрытом коллагеном планшете (BD Biosciences) при концентрации 1×105 клеток/см2, и культивировали при 37°С в атмосфере с 5% СО2 в течение 24 часов. Затем среду заменяли Hepato-STIM (зарегистрированный товарный знак: BD Biosciences) (+EGF, PSG, -FBS) и клетки дополнительно культивировали при 37°С в атмосфере с 5% СО2 в течение 24 часов. Hepato-STIM (+EGF, PSG, -FBS) применяли в качестве культуральной среды и клетки инкубировали с культуральной средой, содержащей испытуемое соединение, β-нафтофлавон (далее кратко обозначаемый как β-NF, SIGMA), применяемый в качестве положительного контроля CYPIA человека, или рифампицин (далее кратко обозначаемый как Rif, Wako Pure Chemical Industries, Ltd.), применяемый в качестве положительного контроля CYP3A4 человека, при 37°С в атмосфере с 5% СО2 в течение приблизительно 48 часов. Культуральную среду, содержащую испытуемое соединение, β-NF или Rif, заменяли каждые 24 часа. Каждое из испытуемого соединения, β-NF и Rif, растворяли в диметилсульфоксиде (ДМСО: Wako Pure Chemical Industries, Ltd.) и культуральную среду, содержащую испытуемое соединение (конечные концентрации: 1, 3 и 10 мкМ), β-NF (конечная концентрация 10 мкМ) или Rif (конечная концентрация 10 мкМ), получали добавлением их к Hepato-STIM (+EGF, PSG, -FBS), соответственно. Было установлено, что конечная концентрация ДМСО составляла 0,1%, и культуральную среду, содержащую 0,1% ДМСО, применяли для контроля. После завершения обработки клетки промывали один раз PBS и общую РНК очищали с применением набора для очистки общей РНК (Applied Biosystems). Очищенную общую РНК подвергали реакции обратной транскрипции с применением реагентов TaqMan Reverse Transcription Reagents (Applied Biosystems) для синтеза кДНК, где oligo dT применяли в качестве праймера. Реакцию проводили с применением системы ПЦР Gene Amp 9700 при 25°С в течение 10 минут, затем при 48°С в течение 60 минут. Затем обратную транскриптазу деактивировали при 95°С в течение 10 минут. Уровни мРНК для CYP1A1 и GAPDH количественно определяли с применением набора реагентов SYBR Green PCR Core Reagents Kit (Applied Biosystems) и уровни мРНК для CYP1A2 и уровни мРНК для CYP3A4 измеряли с применением набора реагентов Taqman PCR Core Reagents Kit (Applied Biosystems) и системы детекции ABI Prism 7900 Sequence Detection System (Applied Biosystems). Последовательности праймеров и условия ПЦР, применяемые для количественного определения каждой мРНК, показаны в таблицах 1 и 2 соответственно.
Последовательности праймеров

Условия ПЦР
<Вычисление способности индуцировать CYP>
Способность испытуемого соединения индуцировать CYP1A1 вычисляли следующим образом.
Способность испытуемого соединения индуцировать CYP1A1 (%) = {[(количество мРНК CYP1A1 в обработанных испытуемым соединением клетках)/(количество мРНК GAPDH в обработанных испытуемым соединением клетках)/[(количество мРНК CYP1A1 в контрольных клетках)/(количество мРНК GAPDH в контрольных клетках)]-1}/{[(количество мРНК CYP1A1 в обработанных положительным контролем клетках)/(количество мРНК GAPDH в обработанных положительным контролем клетках)]/[(количество мРНК CYP1A1 в контрольных клетках)/(количество мРНК GAPDH в контрольных клетках)]-1}×100.
Способность индуцировать CYP1A2 или CYP3A4 вычисляли таким же способом, как описано выше.
<Результаты испытаний>
Результаты, относящиеся к соединениям примеров 1, 4, 5, 7, 14, 16, 20 и 21, показаны в таблице 3. В качестве сравнительного примера применяли соединение, описанное как пример 1 в WO 99/37622, (4-(3-бензоиламинофенил)-6,7-диметокси-2-метиламинохиназолин.
Результаты показали, что соединения настоящего изобретения не проявляют никакой активности в отношении индукции CYPs, тогда как активность в отношении индукции CYPs наблюдали в сравнительном примере.
Способность к индукции по сравнению
с положительным контролем (%)
Измеряли рентгенограммы кристаллов и аморфного соединения, полученных в примерах 22-27. Такое измерение проводили согласно методу измерения порошковой рентгенограммы, описанному в общих испытаниях в Фармакопее Японии, в следующих условиях.
(Аппаратура)
Система рентгеновского дифференциального термического анализа (ДТА) Rigaku: (изготовлена Rigaku Corporation).
(Метод операции)
Образец измельчали в агатовой ступке и затем наносили на медную пластину. Затем измерение проводили в следующих условиях.
Применяемое рентгеновское излучение: лучи CuKα.
Напряжение трубки: 40 кВ.
Ток трубки: 200 мА.
Щелевая расходимость пучка лучей: 1/2 градуса.
Приемная щель: 0,3 мм.
Щель рассеяния: 1/2 градуса.
Скорость сканирования: 2°/мин.
Ступень сканирования: 0,02°.
Диапазон сканирования (2θ): от 5° до 40°.
Порошковые рентгенограммы кристаллов и аморфного вещества, полученных в примерах 22-27, показаны на фигурах 3-8. Кроме того, характеристические пики углов дифракции (2θ) суммированы в таблице 4.
Промышленная применимость
Настоящее изобретение предлагает агент, применимый для устранения зуда, вызванного атопическим заболеванием или тому подобным.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОСТАВЫ НА ОСНОВЕ ИНГИБИТОРОВ PDE-4 ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2768826C2 |
| Ингибитор вируса гепатита В (ВГВ) | 2019 |
|
RU2726456C1 |
| ПРОИЗВОДНЫЕ 3-ОКСО-1-ЦИКЛОБУТЕНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2296753C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ АЦЕТАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ И ИНГИБИТОРЫ ПРОТЕАЗ НА ИХ ОСНОВЕ | 1997 |
|
RU2181360C2 |
| ХИНОЛИНОВЫЕ И ХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2000 |
|
RU2256654C2 |
| АЗОЛИЛЬНЫЕ ПРОИЗВОДНЫЕ ХИНОЛИНА И ХИНАЗОЛИНА, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ ПРИМЕНЕНИЕ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2283841C2 |
| СОЕДИНЕНИЯ 7-ФЕНИЛПИРАЗОЛОПИРИДИНА | 2003 |
|
RU2327699C2 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА | 2018 |
|
RU2779477C2 |
| НОВОЕ ПРОИЗВОДНОЕ БЕНЗОТРИАЗОЛА, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ЭКТОНУКЛЕОТИДПИРОФОСФАТАЗЫ-ФОСФОДИЭСТЕРАЗЫ, И ЕГО ПРИМЕНЕНИЕ | 2022 |
|
RU2824598C1 |
| НОВЫЕ ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2007 |
|
RU2443687C2 |




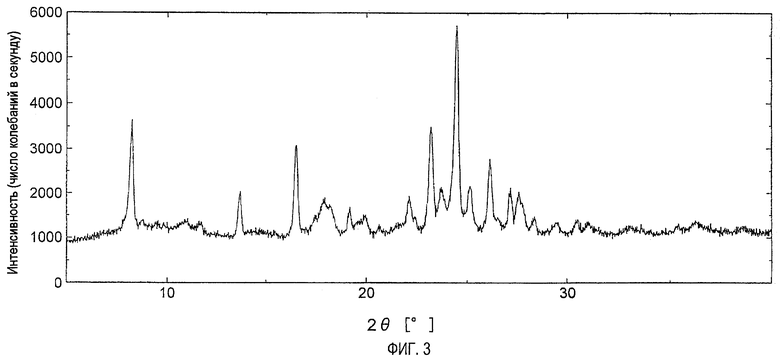
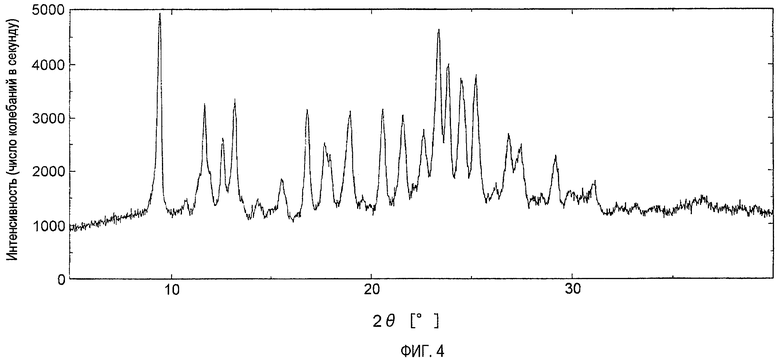

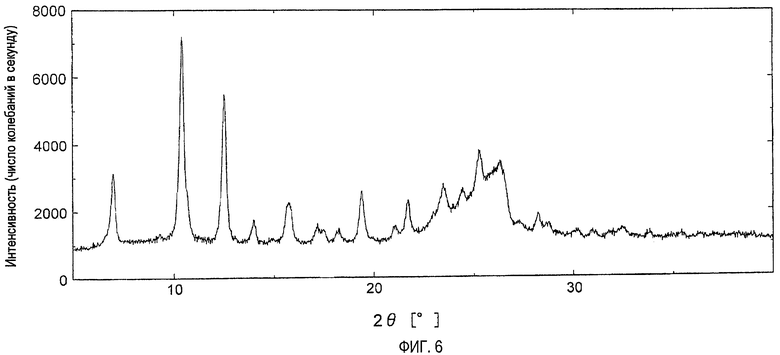

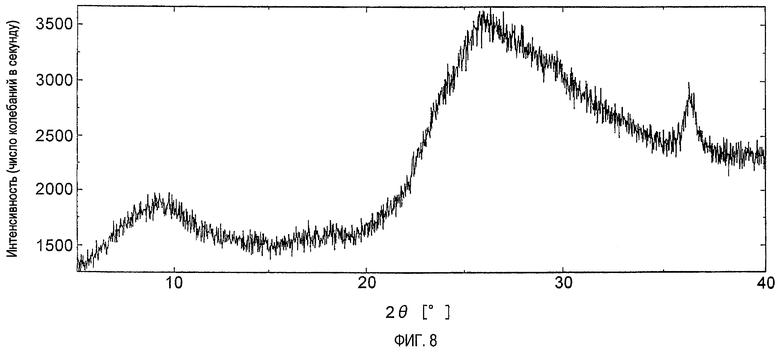
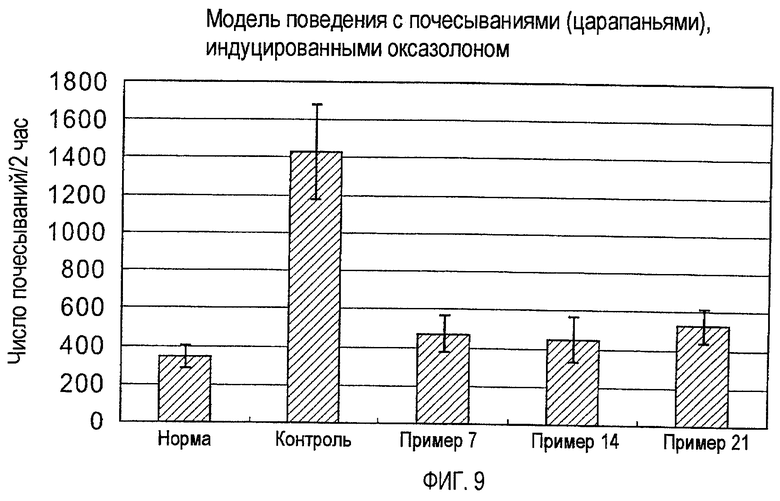
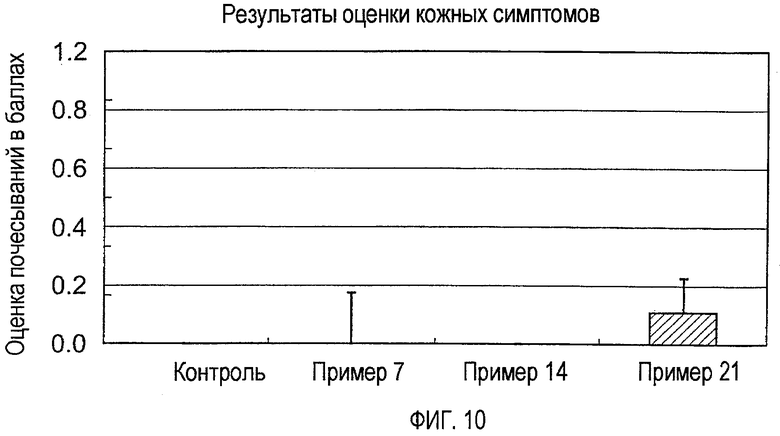

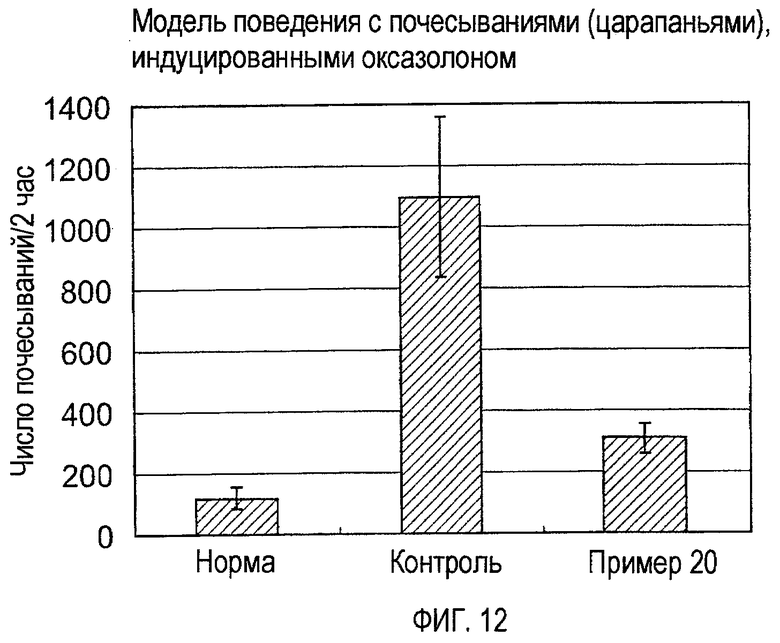
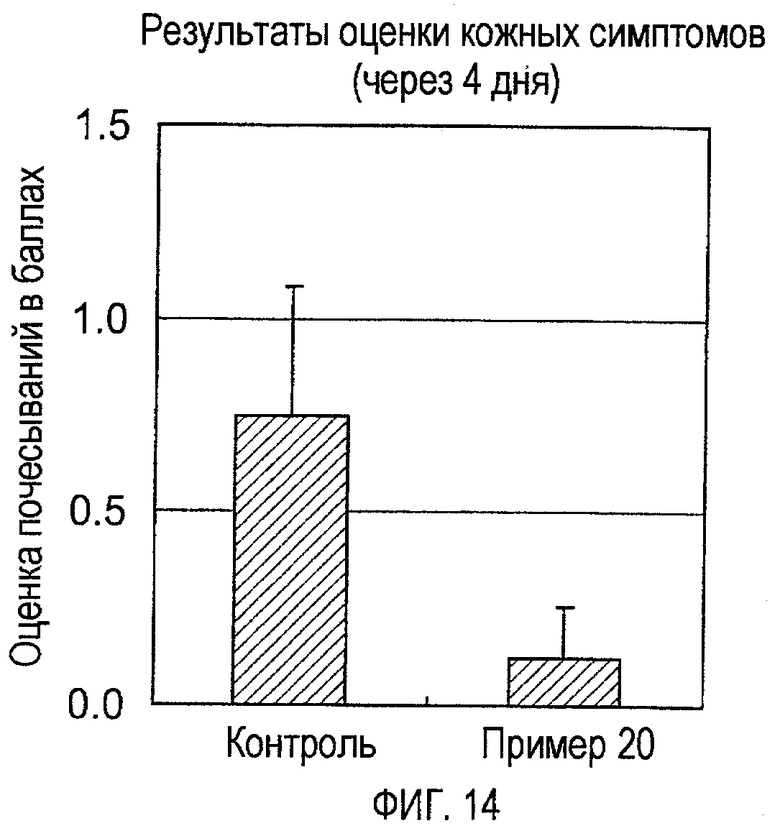

Изобретение относится к новым соединениям, представленным нижеследующей формулой (I), или их фармакологически приемлемым солям, обладающим противозудным действием. Соединения настоящего изобретения могут быть использованы как противозудное средство при атопическом заболевании, таком как атопический дерматит, в случае, когда стероидное лекарственное средство является неэффективным. В формуле (I)
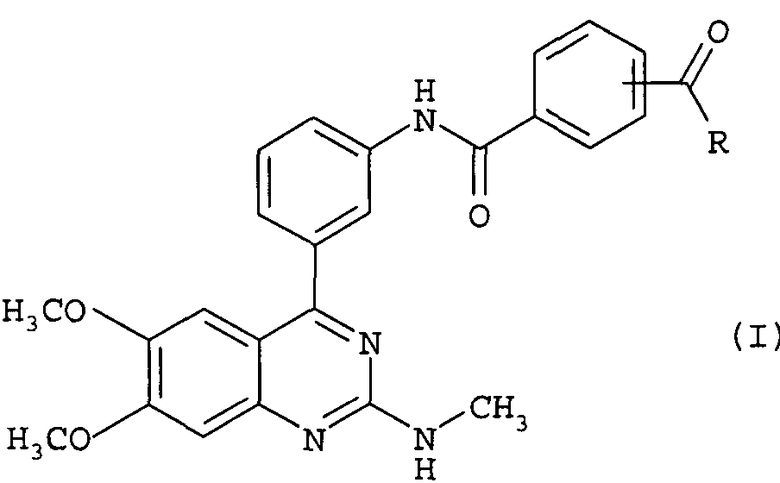
R представляет собой С1-6алкокси, необязательно замещенный метокси, или амино монозамещенный С1-6алкилом, где группа R-C(=O)- присоединена в мета- или пара-положении. 5 н. и 16 з.п. ф-лы, 15 ил., 4 табл.
1. Соединение, представленное формулой (I), или его фармакологически приемлемая соль
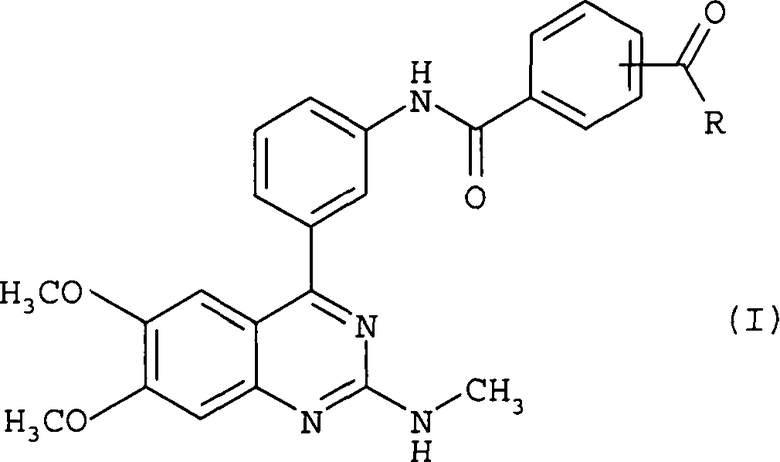
где R представляет собой С1-6алкокси, необязательно замещенный метокси, или амино, монозамещенный С1-6алкилом, где группа R-C(=O)-, присоединена в мета- или параположении.
2. Соединение или его фармакологически приемлемая соль по п.1, где R представляет собой С1-3алкокси, необязательно замещенный метокси, или амино, монозамещенный С1-3алкилом.
3. Соединение или его фармакологически приемлемая соль по п.1, где R представляет собой метокси, этокси, 1-пропокси, 2-пропокси, метоксиэтокси, метиламино или этиламино.
4. Соединение или его фармакологически приемлемая соль по п.1 или 2, выбранное из следующей группы:
метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовая кислота,
этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовая кислота,
N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилтерефталамид,
изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовая кислота,
изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевая кислота,
2-метоксиэтиловый эфир N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты, или
2-метоксиэтиловый эфир N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталамовой кислоты.
5. Соединение по п.4, представляющее собой метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту или ее фармакологически приемлемую соль.
6. Соединение по п.4, представляющее собой этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту или ее фармакологически приемлемую соль.
7. Соединение по п.4, представляющее собой N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилтерефталамид или ее фармакологически приемлемую соль.
8. Соединение по п.4, представляющее собой изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту или ее фармакологически приемлемую соль.
9. Соединение по п.4, представляющее собой изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевую кислоту или ее фармакологически приемлемую соль.
10. Соединение по п.4, представляющее собой 2-метоксиэтиловый эфир N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты или ее фармакологически приемлемую соль.
11. Соединение по п.4, представляющее собой 2-метоксиэтиловый эфир N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталамовой кислоты или ее фармакологически приемлемую соль.
12. Фармацевтическая композиция, обладающая противозудным действием, включающая в себя в качестве активного ингредиента эффективное количество соединения по любому из пп.1-11 или его фармакологически приемлемую соль.
13. Противозудное средство для атопического заболевания, представляющее собой соединение по любому из пп.1-11 или его фармакологически приемлемую соль.
14. Противозудное средство по п.13, где атопическим заболеванием является атопический дерматит.
15. Противозудное средство для устранения зуда, для которого стероидное лекарственное средство является неэффективным, представляющее собой соединение по любому из пп.1-11 или его фармакологически приемлемую соль.
16. Противозудное средство по любому из пп.13-15 в форме лекарственного препарата для наружного применения.
17. Способ уменьшения зуда у субъекта, включающий назначение субъекту соединения по любому из пп.1-11 или его фармакологически приемлемой соли.
18. Способ по п.17, при котором субъект страдает от атопического заболевания.
19. Способ по п.18, при котором атопическим заболеванием является атонический дерматит.
20. Способ по п.17, при котором стероидные лекарственные средства неэффективны в отношении зуда.
21. Способ по любому из пп.17-20, при котором противозудное средство применяют в форме препарата для наружного применения.
| Валковая дробилка | 1982 |
|
SU1052254A1 |
| HANIFIN J.M | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| SCHMIDT B.M.W | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2011-10-20—Публикация
2007-02-20—Подача