Ссылка на родственные заявки
[0001] Данная заявка испрашивает приоритет и преимущество согласно предварительной заявке на патент США №62/347006, поданной 7 июня 2016 г., предварительной заявке на патент США №62/449753, поданной 24 января 2017 г., и предварительной заявки на патент США №62/488495, поданной 21 апреля 2017 г., полное содержание которых таким образом включено посредством ссылки в данный документ.
КРАТКОЕ ОПИСАНИЕ
[0002] Варианты осуществления, представленные в данном документе, направлены на состав для местного применения, содержащий соединение, представленное формулой (I), его соль или его гидрат, растворитель и основу:
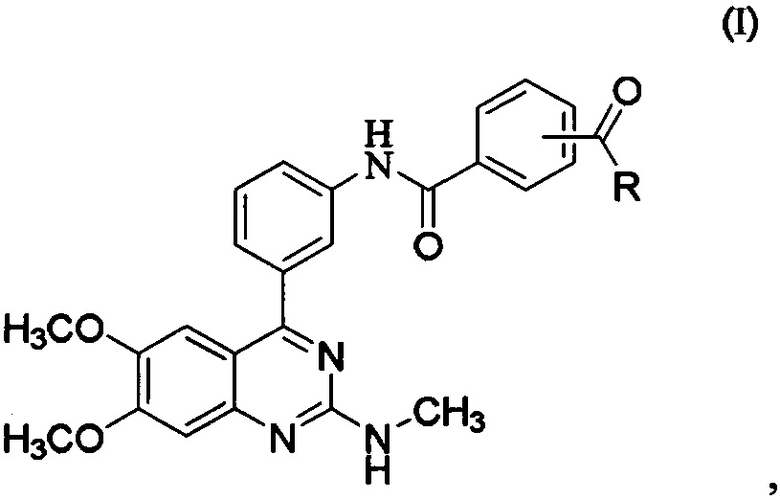
где R представляет собой гидроксил, С1-6алкокси, необязательно замещенный С1-6алкокси, или амино, необязательно замещенный С1-6алкилом, причем состав для местного применения содержит более приблизительно 30% по весу растворителя. В некоторых вариантах осуществления состав для местного применения содержит менее приблизительно 10% основы. В некоторых вариантах осуществления состав для местного применения дополнительно содержит усилитель абсорбции, средство для предотвращения отделения, воду, фармацевтически приемлемое вспомогательное вещество или их комбинацию. В некоторых вариантах осуществления состав для местного применения дополнительно содержит два или более средства для предотвращения отделения. В некоторых вариантах осуществления общее количество средств для предотвращения отделения составляет более приблизительно 40%. В некоторых вариантах осуществления состав для местного применения содержит от приблизительно 5% до приблизительно 20% по весу усилителя абсорбции. В некоторых вариантах осуществления суммарное количество растворителя и усилителя абсорбции составляет 35-70% по весу.
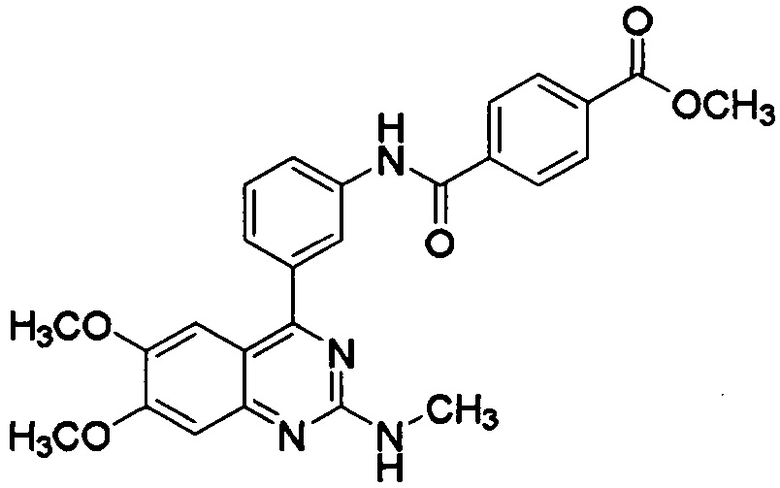
[0003] В некоторых вариантах осуществления соединение, представленное формулой (I), представляет собой метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту (RVT-501) со структурой:
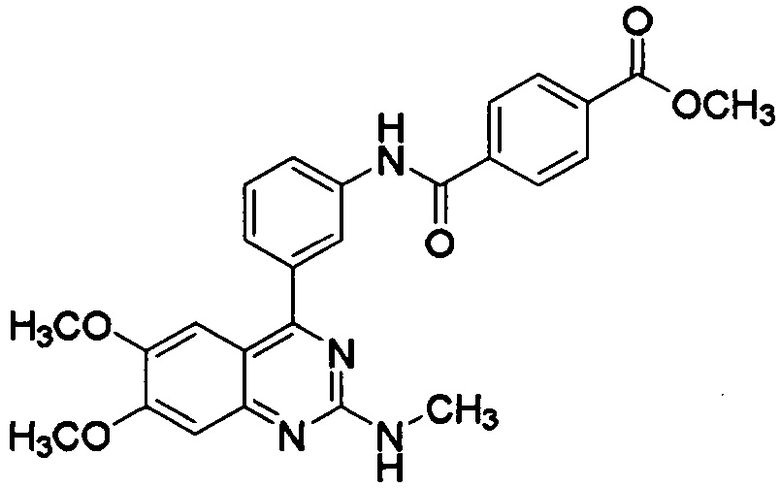
[0004] В некоторых вариантах осуществления основа выбрана из группы, состоящей из петролатума, парафина, жидкого парафина, микрокристаллического воска, карнаубского воска, белого пчелиного воска и их комбинации.
[0005] В некоторых вариантах осуществления растворитель выбран из группы, состоящей из полиэтиленгликоля со средней молекулярной массой 200-600, дипропиленгликоля, бензилового спирта, полиоксиэтиленового эфира сорбита и жирной кислоты, моноэтилового эфира диэтиленгликоля, пропиленгликоля, олеилового эфира полиоксиэтилена, октилфенилового эфира полиоксиэтилена, лаурилового эфира полиоксиэтилена, полиоксиэтилена-касторового масла, олеиновой кислоты и их комбинации.
[0006] В некоторых вариантах осуществления состав для местного применения может дополнительно содержать усилитель абсорбции. В некоторых вариантах осуществления усилитель абсорбции выбран из группы, состоящей из изопропилмиристата, этилмиристата, октилдодецилмиристата, изопропилпальмитата, изостеарилпальмитата, изопропилизостеарата, бутилстеарата, этилолеата, децилолеата, диизопропилсебацината, диэтилсебацината, диизопропиладипата, диэтиладипата, диэтилфталата и их комбинации.
[0007] В некоторых вариантах осуществления состав для местного применения может дополнительно содержать средство для предотвращения отделения. В некоторых вариантах осуществления средство для предотвращения отделения выбрано из группы, состоящей из полиэтиленгликоля со средней молекулярной массой 1000-50000, полиоксиэтилена-гидрогенизированного касторового масла, стеариновой кислоты, олеиновой кислоты, сорбитанмоностеарата, сорбитанмоноолеата, сорбитансесквиолеата, сорбитантриолеата, сложных эфиров глицерина и жирных кислот и их комбинации.
[0008] В некоторых вариантах осуществления сложные эфиры глицерина и жирных кислот выбраны из группы, состоящей из Geleol™ (глицеринмоностеарата 40-55; моноглицеридов и диглицеридов NF), глицеринмоностеарата, диглицерилизостеарата и гексаглицерилполирицинолеата. В некоторых вариантах осуществления можно использовать два или более средств для предотвращения отделения. В некоторых вариантах осуществления средство для предотвращения отделения представляет собой полиэтиленгликоль со средней молекулярной массой 1000-50000 и сложные эфиры глицерина и жирных кислот. В некоторых вариантах осуществления сложные эфиры глицерина и жирных кислот представляют собой глицеринмоностеарат. В некоторых вариантах осуществления сложные эфиры глицерина и жирных кислот представляют собой Geleol™. Без ограничения теорией полагают, что использование Geleol™, который включает глицерилдистеарат, а также глицеринмоностеарат, в составе для местного применения может способствовать получению лучшего эмульгатора.
[0009] Некоторые варианты осуществления, представленные в данном документе, направлены на способ предотвращения отделения жидких ингредиентов в составе для местного применения, включающий смешивание полиэтиленгликоля со средней молекулярной массой 1000-50000 и сложных эфиров глицерина и жирных кислот в составе для местного применения согласно вариантам осуществления, представленным в данном документе.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0010] Для более полного понимания природы и преимуществ настоящего изобретения, следует сделать ссылку на следующее подробное описание, взятое совместно с прилагаемыми графическими материалами, на которых:
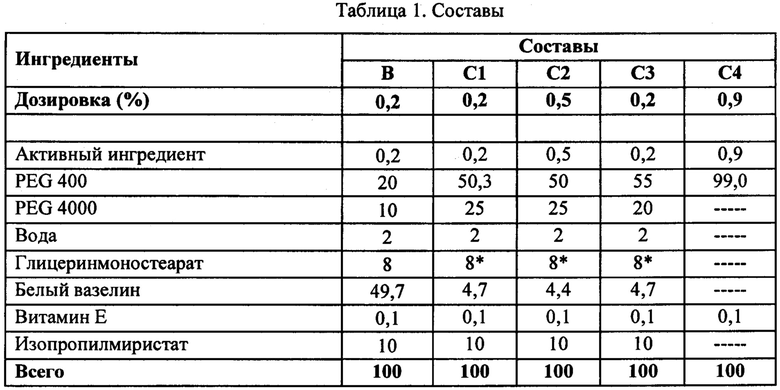
[0011] на фиг. 1 показано среднее количество (мкг) соединения формулы (I) согласно вариантам осуществления, представленным в данном документе, собранное с рогового слоя у каждого донора через 24 часа после нанесения состава для местного применения согласно вариантам осуществления, представленным в данном документе;
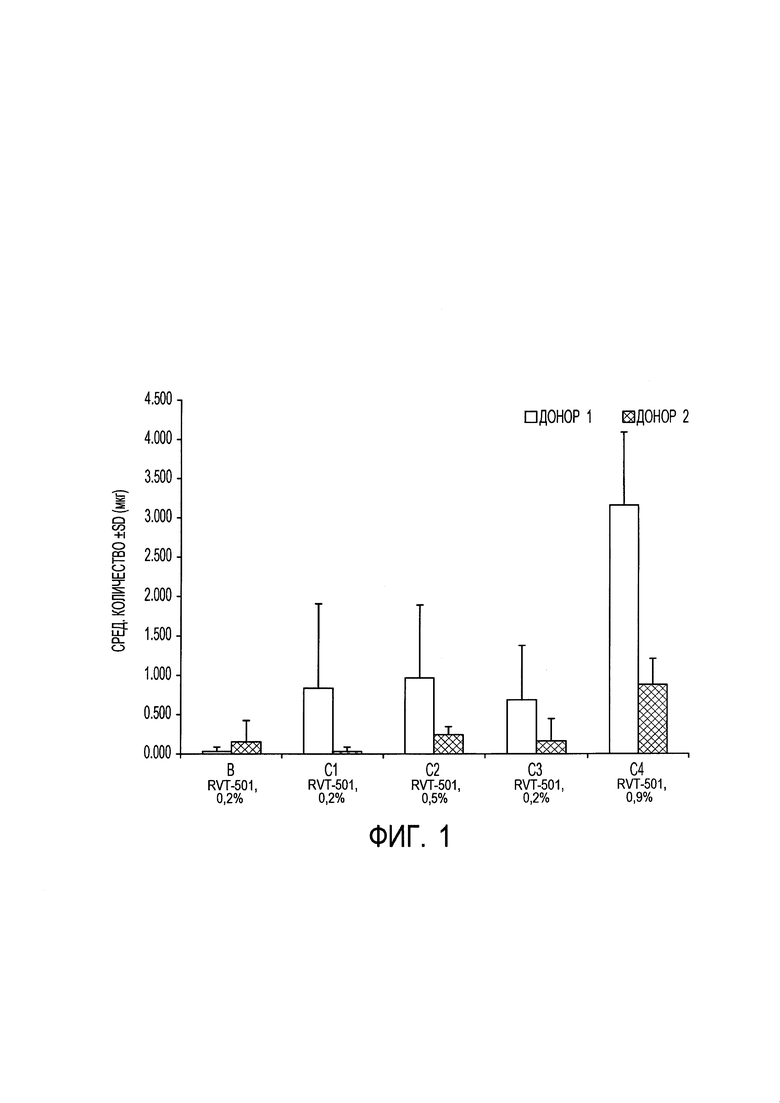
[0012] на фиг. 2 показано среднее количество (мкг) соединения формулы (I) согласно вариантам осуществления, представленным в данном документе, собранное с эпидермиса у каждого донора через 24 часа после нанесения состава для местного применения согласно вариантам осуществления, представленным в данном документе;
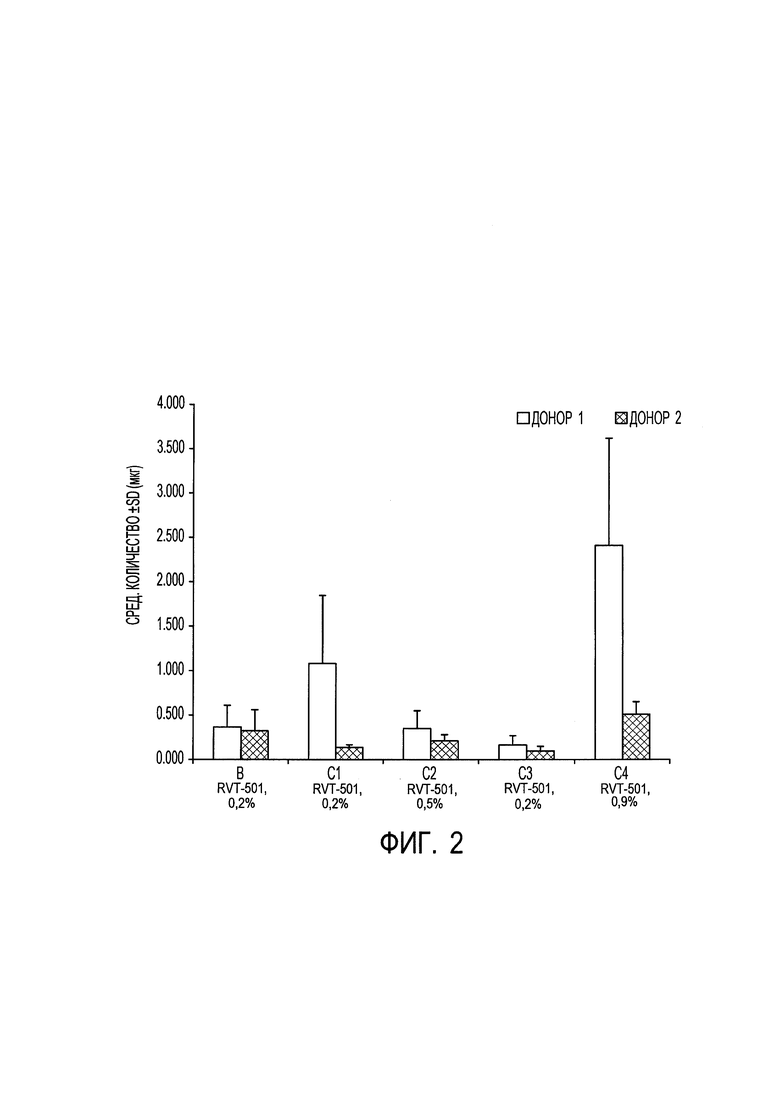
[0013] на фиг. 3 показано среднее количество (мкг) соединения формулы (I) согласно вариантам осуществления, представленным в данном документе, собранное с дермы у каждого донора через 24 часа после нанесения состава для местного применения согласно вариантам осуществления, представленным в данном документе;
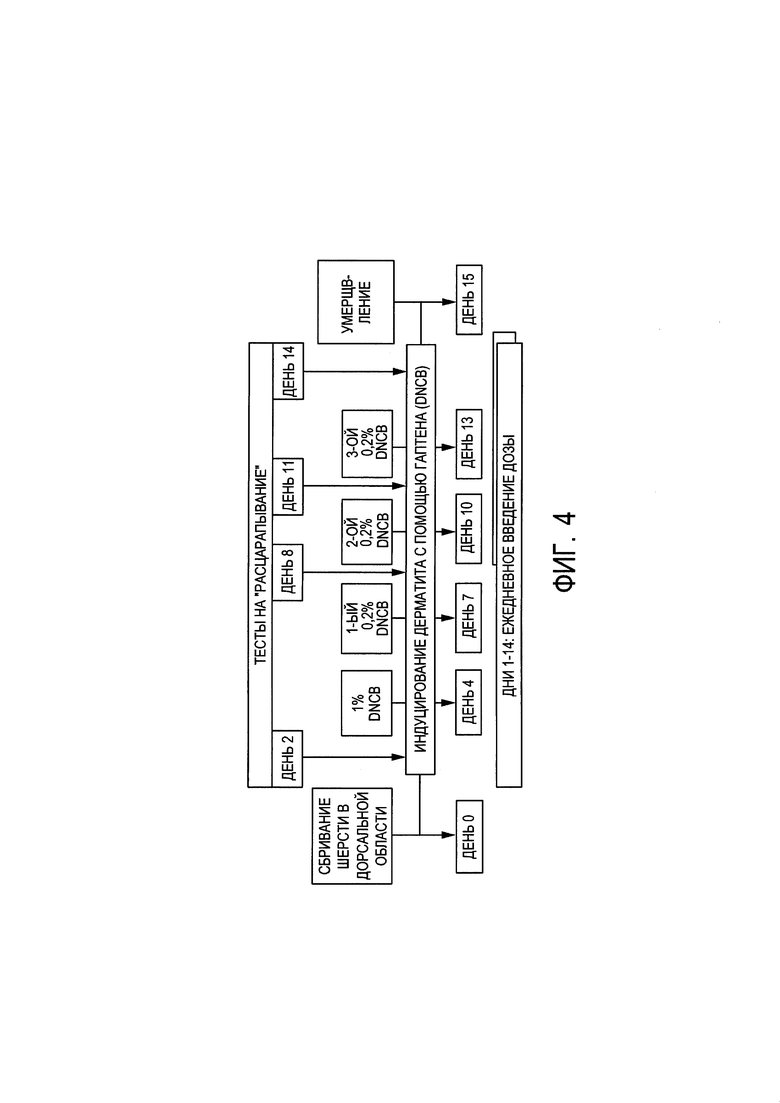
[0014] на фиг. 4 показан график времени для протокола, используемого в примере 2;
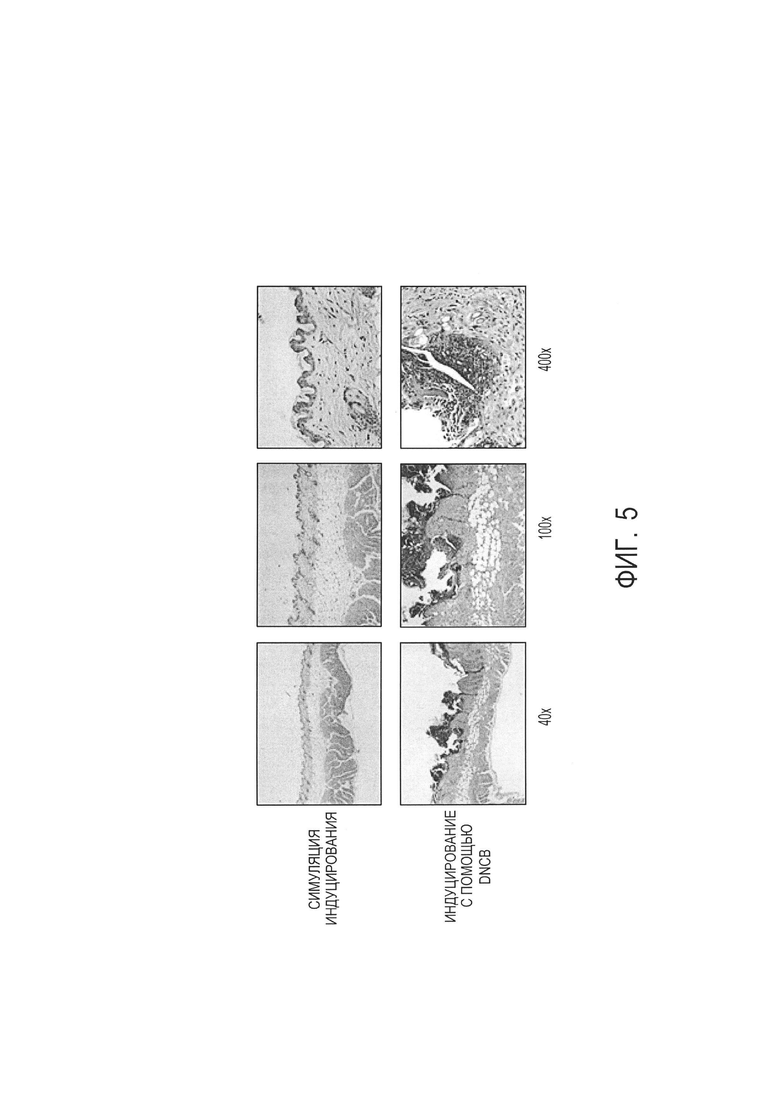
[0015] на фиг. 5 показано окрашивание гематоксилином и эозином нормальной кожи по сравнению с кожей с повреждениями в результате атонического дерматита. Отметим эпидермальную гиперплазию, гиперкератоз, образование язв и инфильтрацию иммуноцитов в подвергнутой индуцированию с помощью DNCB;
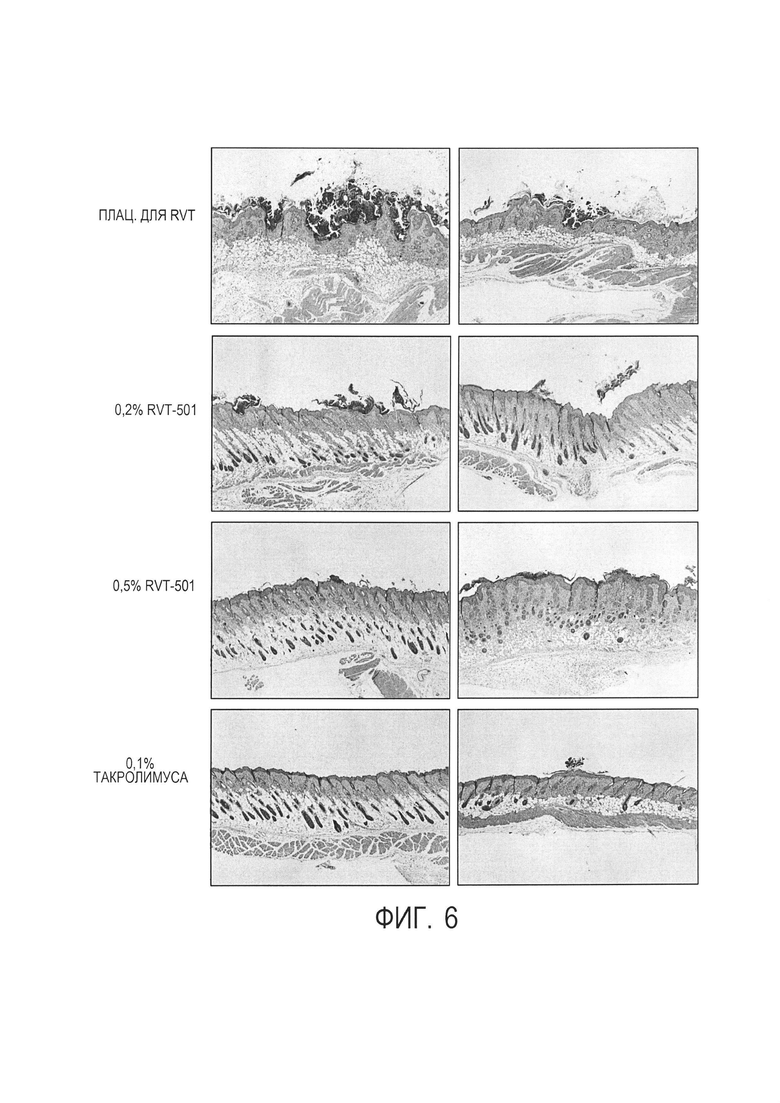
[0016] на фиг. 6 показано окрашивание гематоксилином и эозином срезов кожи, обработанных профилактически (слева) или терапевтически (справа) в отношении повреждений кожи в результате атопического дерматита при увеличении в 40 раз;
[0017] на фиг. 7 показаны выбранные данные о цитокине из профилактических (сверху) и терапевтических (снизу) исследований. Охарактеризованные цитокины представляют собой IL-6 (слева), IL-17 (посередине) и TNF-α (справа). Данные собирали для образцов кожи на 15 день в каждом исследовании и прогоняли в панели LUMINEX;
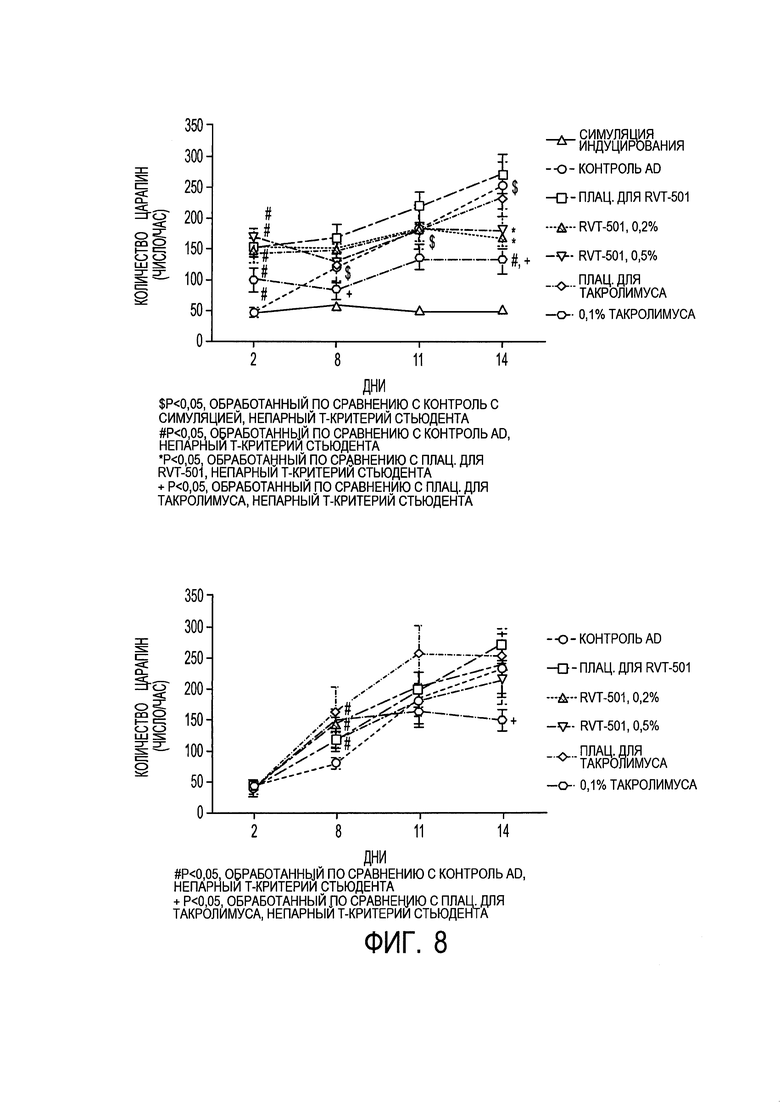
[0018] на фиг. 8 показаны результаты анализа в отношении расцарапывания в профилактическом (сверху) и терапевтическом (снизу) исследовании.
ПОДРОБНОЕ ОПИСАНИЕ
[0019] Перед описанием композиций и способов по настоящему изобретению следует понять, что данное изобретение не ограничено описанными конкретными способами, составами, композициями или методиками, поскольку они могут изменяться. Также следует понять, что терминология, используемая при описании, представлена только для целей описания конкретных версий или вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который будет ограничен только прилагаемой формулой изобретения. Если не указано иное, все технические и научные термины, используемые в данном документе, имеют такие же значения, которые обычно понимаются специалистом с обычной квалификацией в данной области техники. Хотя любые способы и материалы, подобные или эквивалентные описанным в данном документе, могут быть использованы в осуществлении на практике или тестировании вариантов осуществления настоящего изобретения, предпочтительные способы, устройства и материалы теперь будут описаны. Все публикации, упомянутые в данном документе, включены посредством ссылки во всей их полноте. Ничто в настоящем документе не должно толковаться как признание того, что изобретение не имеет права преподносить такое раскрытие на основании предшествующего изобретения.
[0020] Ингибитор фосфодиэстеразы 4 (который далее сокращен как ингибитор PDE4) является лекарственным средством, которое подавляет действие фермента фосфодиэстеразы, который разлагает циклический AMP (который далее сокращают как сАМР) и, в результате, имеет эффект повышения внутриклеточных концентраций сАМР для расслабления гладкой мышцы и подавления активации воспалительных клеток. Некоторые ингибиторы PDE4 плохо абсорбируются кожей при использовании в виде продукта для местного применения. Таким образом, для улучшения способности в отношении абсорбции может быть иногда необходимо включать в состав жидкий ингредиент, такой как большое количество растворителя для растворения соединения или усилитель абсорбции. Однако это может вызывать разделение фаз и отделения жидких компонентов от состава. Следовательно, целью данного раскрытия является обеспечение состава для местного применения, который обеспечивает высокую абсорбцию ингибитора PDE4 и не приводит к отделению компонента.
Соединение формулы (I)
[0021] В вариантах осуществления, представленных в данном документе, раскрыто соединение, представленное формулой (I), его соль или его гидрат.
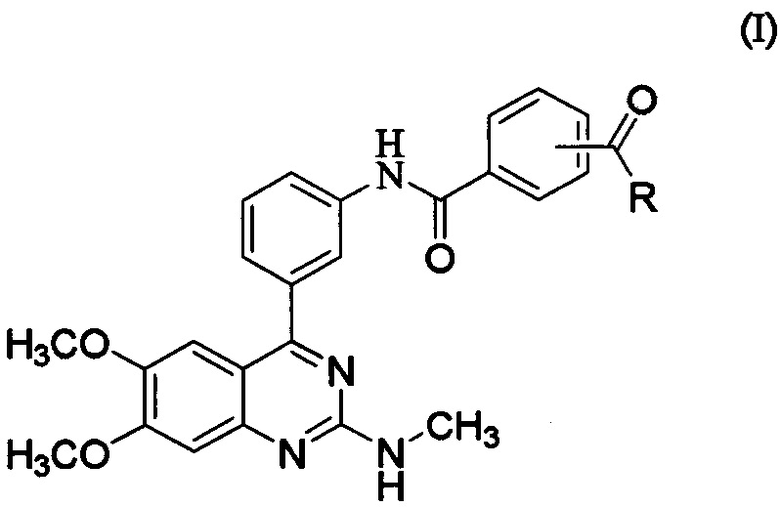
[0022] где R представляет собой гидроксил, С1-6алкокси, необязательно замещенный С1-6алкокси, или амино, необязательно замещенный С1-6алкилом.
[0023] Примеры соединения, представленного формулой (I), включают метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту; гидрохлорид N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N',N'-диметилтерефталамид; этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилтерефталамид; пропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту; изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил]-N'-этилтерефталамид; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-пропилтерефталамид; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-изопропилтерефталамид; метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевую кислоту; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевую кислоту; этил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевую кислоту; пропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевую кислоту; изопропил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталевую кислоту; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-метилизофталамид; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-этилизофталамид; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-пропилизофталамид; N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]-N'-изопропилизофталамид; сложный 2-метоксиэтиловый эфир N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты и сложный 2-метоксиэтиловый эфир N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]изофталамовой кислоты. В некоторых вариантах осуществления соединение, представленное формулой (I), представляет собой метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту (RVT-501) со структурой:
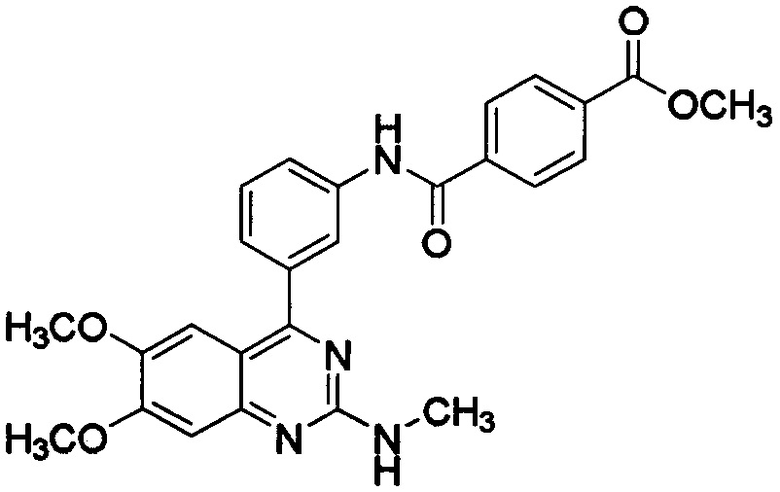
Соединение и способы получения такого соединения дополнительно описаны в патентах США №№7939540 и 8530654, каждый из которых таким образом включен посредством ссылки во всей своей полноте.
[0024] Оптические изомеры-Диастереомеры-Геометрические изомеры-Таутомеры. Соединения, описанные в данном документе, могут содержать центр асимметрии и могут, таким образом, существовать в виде энантиомеров. Если соединения согласно данному изобретению имеют два или более центра асимметрии, они могут дополнительно существовать в виде диастереомеров. Варианты осуществления, представленные в данном документе, включают все такие возможные стереоизомеры в виде практически чистых выделенных энантиомеров, их рацемических смесей, а также смесей диастереомеров. Формулы показаны без определенной стереохимии в определенных положениях. Варианты осуществления, представленные в данном документе, включают все стереоизомеры таких формул и их фармацевтически приемлемые соли. Диастереоизомерные пары энантиомеров можно разделять, например, фракционной кристаллизацией из подходящего растворителя, и пару энантиомеров, полученную таким образом, можно разделять на отдельные стереоизомеры традиционными способами, например, путем использования оптически активной кислоты или основания в качестве средства для разделения или на колонке для хиральной HPLC. Кроме того, любой энантиомер или диастереомер соединения общей формулы можно получать посредством стереоспецифического синтеза, используя оптически чистые исходные материалы или реагенты с известной конфигурацией. Варианты осуществления, описанные в данном документе, включают все изомеры соединения формулы (I), раскрытого в данном документе, такие как геометрический изомер, оптический изомер, стереоизомер или таутомер и смесь изомеров. Варианты осуществления, представленные в данном документе, включают как рацемическую форму, так и оптически активную форму. Варианты осуществления дополнительно включают одну кристаллическую форму или их смесь. Кроме того, варианты осуществления, представленные в данном документе, также включают аморфную форму, ангидратную и гидратную форму соединения. Кроме того, варианты осуществления, представленные в данном документе, также включают метаболиты, соли, гидраты и пролекарства соединений, раскрытых в данном документе.
[0025] Термин "С1-6алкил" используют в описании настоящего изобретения для обозначения линейной или разветвленной алкильной группы, содержащей 1-6 атомов углерода. Конкретные примеры С1-6алкила могут включать метил, этил, 1-пропил (н-пропил), 2-пропил (изопропил), 2-метил-1-пропил (изобутил), 2-метил-2-пропил (трет-бутил), 1-бутил (н-бутил), 2-бутил (втор-бутил), 1-пентил, 2-пентил, 3-пентил, 2-метил-1-бутил, 3-метил-1-бутил, 2-метил-2-бутил, 3-метил-2-бутил, 2,2-диметил-1-пропил, 1-гексил, 2-гексил, 3-гексил, 2-метил-1-пентил, 3-метил-1-пентил, 4-метил-1-пентил, 2-метил-2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 2-метил-3-пентил, 3-метил-3-пентил, 2,3-диметил-1-бутил, 3,3-диметил-1-бутил, 2,2-диметил-1-бутил, 2-этил-1-бутил, 3,3-диметил-2-бутил и 2,3-диметил-2-бутил. Варианты осуществления могут включать С1-3алкил, такой как метил, этил, 1-пропил (н-пропил), 2-пропил (изопропил), 2-метил-1-пропил (изобутил), 2-метил-2-пропил (трет-бутил), 1-бутил (н-бутил) или 2-бутил (втор-бутил). Некоторые варианты осуществления могут включать метил и этил.
[0026] Термин "С1-6алкокси" используют в описании настоящего изобретения для обозначения оксигруппы, с которой определенный выше "С1-6алкил" связан. Конкретные примеры С1-6алкокси могут включать метокси, этокси, 1-пропокси, 2-пропокси, 2-метил-1-пропокси, 2-метил-2-пропокси, 1-бутокси, 2-бутокси, 1-пентокси, 2-пентилокси, 3-пентилокси, 2-метил-1-бутокси, 3-метил-1-бутокси, 2-метил-2-бутокси, 3-метил-2-бутокси, 2,2-диметил-1-пропокси, 1-гексилокси, 2-гексилокси, 3-гексилокси, 2-метил-1-пентокси, 3-метил-1-пентилокси, 4-метил-1-пентокси, 2-метил-2-пентокси, 3-метил-2-пентокси, 4-метил-2-пентокси, 2-метил-3-пентилокси, 3-метил-3-пентилокси, 2,3-диметил-1-бутокси, 3,3-диметил-1-бутокси, 2,2-диметил-1-бутокси, 2-этил-1-бутокси, 3,3-диметил-2-бутокси, 2,3-диметил-2-бутокси и т.п. Некоторые варианты осуществления могут включать С1-3алкокси, такие как метокси, этокси, 1-пропокси и 2-пропокси. В некоторых вариантах осуществления С1-3алкокси представляет собой метокси. Кроме того, примеры "С1-6алкокси, необязательно замещенного С1-6алкокси" в определениях R могут включать метоксиметокси, этоксиметокси, метоксиэтокси и этоксиэтокси.
[0027] Примеры "амино, необязательно замещенного Cl-6-алкилом" в настоящем описании могут включать амино, моно-С1-6алкиламино, который замещен вышеуказанным С1-6алкилом (например, метил амино, этил амино, трет-бутиламино и т.д.), ди-С1-6алкиламино (например, диметиламино, диэтиламино, метилэтиламино и т.д.) и т.п.
[0028] Некоторые варианты осуществления могут включать амино, моно-С1-3алкиламино и ди-С1-3алкиламино. В некоторых вариантах осуществления амино, необязательно замещенный С1-6алкилом, может включать амино и монометиламино.
[0029] В некоторых вариантах осуществления соль соединений, описанных в данном документе, может включать соль неорганической кислоты, соль органической кислоты, неорганическую основную соль, органическую основную соль, кислотную или основную соль аминокислоты или подобное. В некоторых вариантах осуществления соль неорганической кислоты может включать гидрохлорид, гидробромид, сульфат, нитрат, фосфат или подобное. В некоторых вариантах осуществления соль можно выбирать из гидрохлорида, гидробромида, сульфата или фосфата. В некоторых вариантах осуществления соль органической кислоты может включать ацетат, сукцинат, фумарат, малеат, тартрат, цитрат, лактат, стеарат, бензоат, метансульфонат, этансульфонат, п-толуолсульфонат или бензолсульфонат. В некоторых вариантах осуществления соль может представлять собой метансульфонат или п-толуолсульфонат.
[0030] В некоторых вариантах осуществления неорганическая основная соль может включать соли щелочных металлов, такие как соль натрия или соль калия; соли щелочноземельных металлов, такие как соль кальция или соль магния; соли алюминия; соли аммония или подобные. В некоторых вариантах осуществления органическая основная соль может включать диэтиламинную соль, диэтаноламинную соль, меглюминовую соль, N,N'-дибензилэтилендиаминную соль или подобные.
[0031] В некоторых вариантах осуществления кислотная соль аминокислоты может включать аспартат и глутамат. В некоторых вариантах осуществления основная соль аминокислоты может включать соль аргинина, соль лизина, соль орнитина или подобные.
Способ получения соединения формулы (I)
[0032] Соединение, представленное формулой (I), можно получать, например, с помощью способа, описанного ниже.
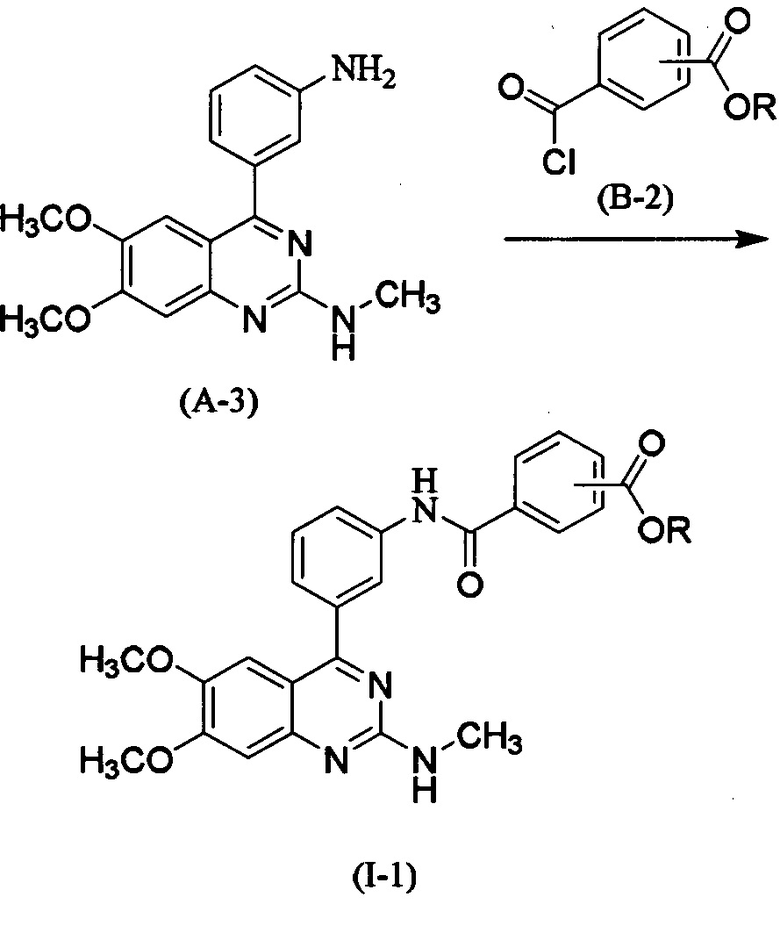
где Rl представляет собой Cl-6алкил.
[0033] В некоторых вариантах осуществления представлен способ получения соединения формулы (I), причем способ включает проведение реакции соединения (А-3) с соединением (В-2), которое представляет собой хлорангидрид, в инертном растворителе в присутствии или в отсутствие основания, с получением соединения (I-1) согласно вариантам осуществления, представленным в данном документе.
[0034] Соединение (А-3) можно получать посредством примера получения 7 из WO 99/37622. Можно использовать соединение (В-2), которое является известным соединением, коммерчески доступным соединением или соединением, которое можно легко получать из коммерчески доступного соединения с помощью способа, который обычно выполняется специалистами в данной области техники. Примеры соединения (В-2) могут включать сложный метиловый эфир 4-хлоркарбонилбензойной кислоты и т.п. Соединение (В-2) можно использовать в количестве в 1-10 раз и предпочтительно в 1-2 раза больше мольного эквивалента соединения (А-3).
[0035] В некоторых вариантах осуществления растворитель может включать ароматические углеводороды, такие как толуол, бензол, ксилол и т.п.; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диметоксиэтан, диоксан и т.п.; галогенированные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан или тетрахлорид углерода; органические основания, такие как пиридин, 2-, 3- или 4-пиколин и т.п.; воду или их комбинацию. В некоторых вариантах осуществления растворитель может включать тетрагидрофуран или пиридин. В некоторых вариантах осуществления растворитель для проведения реакции может представлять собой полиэтиленгликоль.
[0036] В некоторых вариантах осуществления основание для проведения реакции может включать неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, карбонат цезия и т.п.; и органические основания, такие как пиридин, триэтиламин и т.п. Предпочтительным примером является пиридин. В некоторых вариантах осуществления основание для проведения реакции можно использовать в количестве в 1-10 раз и предпочтительно в 1-4 раза больше мольного эквивалента соединения (А-3). Температура реакции зависит от растворителя для проведения реакции и используемого реагента. В некоторых вариантах осуществления температура реакции, как правило, составляет от приблизительно -30°С до приблизительно 180°С и предпочтительно от приблизительно 0°С до приблизительно 100°С. Время реакции зависит от используемого растворителя для проведения реакции и температуры реакции. В некоторых вариантах осуществления время реакции составляет от приблизительно 0,5 до приблизительно 200 часов. В некоторых вариантах осуществления время реакции составляет от приблизительно 1 до приблизительно 100 часов.
[0037] В некоторых вариантах осуществления способ получения соединения, представленного формулой (I), включает осуществление гидролиза и эстерификации или амидирования соединения (I-1) при необходимости. В некоторых вариантах осуществления, если соединение, представленное формулой (I), получают в свободной форме, такую свободную форму можно превратить в соль или гидрат согласно обычным способам. Кроме того, в некоторых вариантах осуществления, если соединение, представленное формулой (I), получают в виде соли или гидрата, эти соединения можно превращать в свободную форму согласно обычным способам.
Составы для местного применения
[0038] Варианты осуществления, представленные в данном документе, направлены на состав для местного применения, содержащий соединение, представленное формулой (I), его соль, его производное или его гидрат, растворитель и основу:
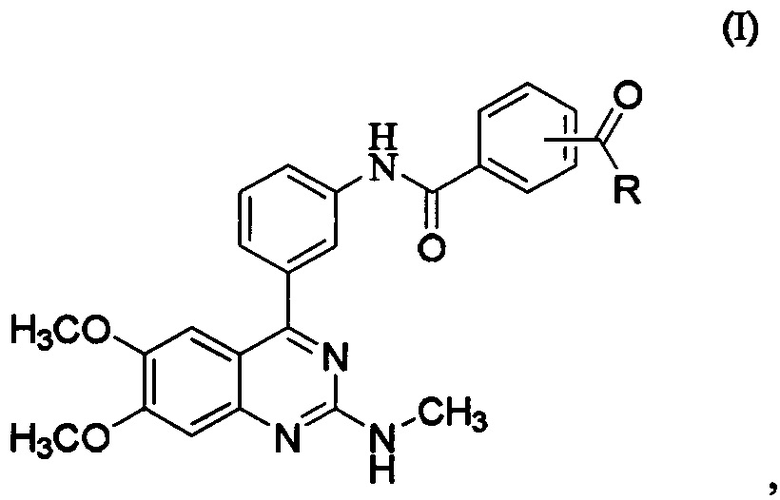
[0039] где R представляет собой гидроксил, С1-6алкокси, необязательно замещенный С1-6алкокси, или амино, необязательно замещенный Cl-6алкилом, причем состав для местного применения содержит более приблизительно 30% по весу растворителя. В некоторых вариантах осуществления состав для местного применения содержит менее приблизительно 10% основы. В некоторых вариантах осуществления состав для местного применения содержит от приблизительно 5% до приблизительно 20% по весу усилителя абсорбции. В некоторых вариантах осуществления суммарное количество растворителя и усилителя абсорбции составляет 35-70% по весу. В некоторых вариантах осуществления состав для местного применения дополнительно содержит усилитель абсорбции, средство для предотвращения отделения, воду, фармацевтически приемлемое вспомогательное вещество или их комбинацию.
[0040] В некоторых вариантах осуществления соединение формулы (I) представляет собой ингибитор PDE4. Однако соединение, представленное формулой (I), или его соль, или его гидрат может иметь недостаточные свойства в отношении абсорбции кожей при использовании в виде состава для местного применения. Иллюстративные преимущества составов для местного применения, раскрытых в данном документе, состоят в том, что составы согласно вариантам осуществления, представленным в данном документе, улучшают способности в отношении абсорбции для соединения, представленного формулой (I), его соли, пролекарства, метаболита или гидрата, в то же время предотвращая отделение компонентов от состава, за счет чего обеспечивается повышение стабильности состава.
[0041] В некоторых вариантах осуществления состав для местного применения может представлять собой препарат в виде мази, препарат в виде, препарат в виде крема, препарат в виде пластыря, препарат в виде глазной мази, препарат в виде суппозитория или подобные. В некоторых вариантах осуществления состав для местного применения представляет собой препарат в виде мази.
[0042] Активный ингредиент в составе для местного применения согласно настоящему изобретению представляет собой соединение, представленное формулой (I), его соль, его аналог, его производное или его гидрат
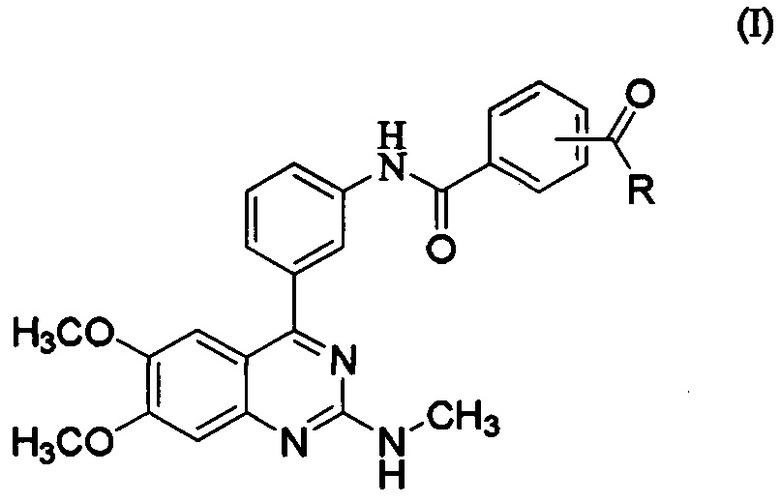
[0043] где R представляет собой гидроксил, С1-6алкокси, необязательно замещенный С1-6алкокси, или амино, необязательно замещенный С1-6алкилом. В некоторых вариантах осуществления активный ингредиент представляет собой метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту (RVT-501):
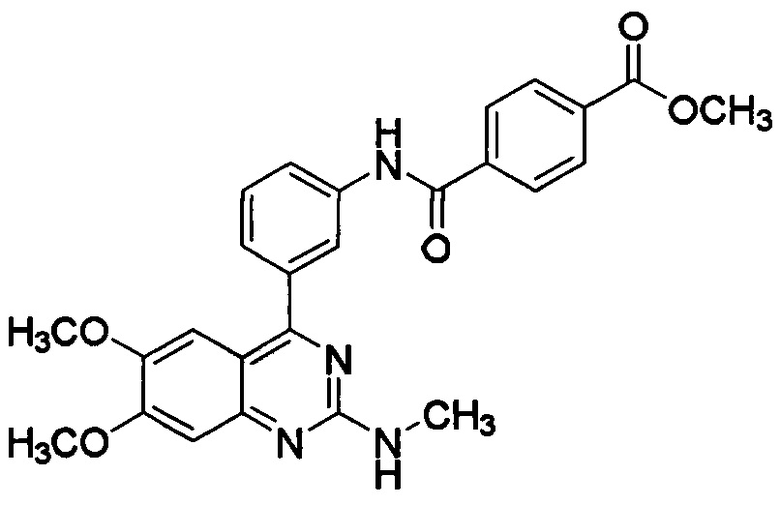 .
.
[0044] Некоторые варианты осуществления направлены на состав для местного применения, содержащий растворитель и основу помимо активного ингредиента. Полагают, что, если продукт для местного применения составлен посредством смешивания активного ингредиента и основы, способности в отношении абсорбции кожей могут стать недостаточными. Способность кожи абсорбировать активный ингредиент в составе для местного применения по настоящему изобретению можно улучшить посредством добавления растворителя.
[0045] Любой растворитель, обычно используемый для состава для местного применения, можно использовать, включая без ограничения полиэтиленгликоль со средней молекулярной массой 200-600, дипропиленгликоль, бензиловый спирт, полиоксиэтиленовый эфир сорбита и жирной кислоты, моноэтиловый эфир диэтиленгликоля, пропиленгликоль, олеиловый эфир полиоксиэтилена, октилфениловый эфир полиоксиэтилена, лауриловый эфир полиоксиэтилена, полиоксиэтилен-касторовое масло, олеиновую кислоту или их комбинацию. В некоторых вариантах осуществления растворитель представляет собой полиэтиленгликоль со средней молекулярной массой 200-600.
[0046] При использовании в данном документе термин "метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовая кислота" или "RVT-501" также должен относиться к альтернативным названиям соединения, включая сложный метиловый эфир N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты, метил-4-[(3-[6,7-диметокси-2-(метиламино)хиназолин-4-ил]фенил)карбамоил]бензоат и метил-4-[({3-[6,7-диметокси-2-(метиламино)хиназолин-4-ил]фенил} амино)карбонил]бензоат.
[0047] При использовании в данном документе термин "полиэтиленгликоль" относится к полимеру, содержащему мономерные звенья этиленгликоля формулы -О-СН2-СН2-. Подходящие полиэтиленгликоли могут содержать свободную гидроксильную группу на каждом конце полимерной молекулы или могут содержать одну или несколько гидроксильных групп, этерифицированных низшим алкилом, например, метильной группой. Также подходящими являются производные полиэтиленгликолей, содержащие способные вступать в реакцию эстерификации карбоксигруппы. Число после дефиса в названии относится к средней молекулярной массе полимера. В некоторых вариантах осуществления средняя молекулярная масса полиэтиленгликоля со средней молекулярной массой 200-600 составляет от приблизительно 200 до приблизительно 600. В некоторых вариантах осуществления средняя молекулярная масса полиэтиленгликоля составляет приблизительно 400. Подходящие полиэтиленгликоли включают без ограничения полиэтиленгликоль-200, полиэтиленгликоль-300, полиэтиленгликоль-400 и полиэтиленгликоль-600. В некоторых вариантах осуществления полиэтиленгликоль представляет собой полиэтиленгликоль-400. Подходящие полиэтиленгликоли включают без ограничения серии Carbowax™ и Carbowax™ Sentry (доступные от Dow), серию Lipoxol™ (доступную от Brenntag), серию Lutrol™ (доступную от BASF) и серию Pluriol™ (доступную от BASF).
[0048] При использовании в данном документе полиэтиленгликоль со средней молекулярной массой 200-600 относится к полиэтиленгликолю со средней молекулярной массой от приблизительно 200 до приблизительно 600 по результату тестирования средней молекулярной массы. В некоторых вариантах осуществления средняя молекулярная масса полиэтиленгликоля со средней молекулярной массой 200-600 составляет от приблизительно 200 до приблизительно 500, от приблизительно 200 до приблизительно 400, от приблизительно 300 до приблизительно 600, от приблизительно 300 до приблизительно 500, от приблизительно 300 до приблизительно 400 или значение в любом из этих диапазонов. В некоторых вариантах осуществления растворитель представляет собой полиэтиленгликоль-400 со средней молекулярной массой 380-420 по результату тестирования средней молекулярной массы.
[0049] В некоторых вариантах осуществления основа может быть любой основой, обычно используемой в составе для местного применения. В некоторых вариантах осуществления основа может быть маслянистой основой, включая без ограничения петролатум, сквалан, парафин, жидкий парафин, микрокристаллический воск, карнаубский воск, белый пчелиный воск и т.п. В некоторых вариантах осуществления основа представляет собой петролатум. При использовании в данном документе петролатум означает смесь полутвердых насыщенных углеводородов, обычно получаемых из нефти. В некоторых вариантах осуществления петролатум представляет собой белый вазелин, минеральное масло, вазелиновое масло, желтый вазелин, янтарный вазелин, вазолименты, космолин, саксолин, станолин, вазелин, холодный гудрон или их комбинацию. В некоторых вариантах осуществления основа представляет собой белый вазелин. В некоторых вариантах осуществления основа представляет собой белый вазелин согласно фармакопее США (USP).
[0050] В некоторых вариантах осуществления состав для местного применения дополнительно содержит усилитель абсорбции и/или средство для предотвращения отделения. Полагают, что способность кожи абсорбировать активный ингредиент можно дополнительно улучшить посредством добавления усилителя абсорбции. Кроме того, полагают, что отделение ингредиентов (в частности, растворителя и усилителя абсорбции) из состава для местного применения согласно вариантам осуществления, представленным в данном документе, можно предотвратить путем добавления средства для предотвращения отделения и, таким образом, можно обеспечить улучшенную стабильность.
[0051] В некоторых вариантах осуществления состав для местного применения может дополнительно содержать усилитель абсорбции. В некоторых вариантах осуществления усилитель абсорбции может представлять собой любой усилитель абсорбции, обычно используемый в составе для местного применения. В некоторых вариантах осуществления усилитель абсорбции может представлять собой изопропилмиристат, этилмиристат, октилдодецилмиристат, изопропилпальмитат, изостеарилпальмитат, изопропилизостеарат, бутилстеарат, этилолеат, децилолеат, диизопропилсебацинат, диэтилсебацинат, диизопропиладипат, диэтиладипат, диэтилфталат или их комбинацию. В некоторых вариантах осуществления усилитель абсорбции представляет собой изопропилмиристат.
[0052] В некоторых вариантах осуществления состав для местного применения может дополнительно содержать средство для предотвращения отделения. В некоторых вариантах осуществления средство для предотвращения отделения может представлять собой любое средство для предотвращения отделения, используемое в составе для местного применения. В некоторых вариантах осуществления средство для предотвращения отделения может представлять собой полиэтиленгликоль со средней молекулярной массой 1000-50000, полиоксиэтилен-гидрогенизированное касторовое масло, стеариновую кислоту, олеиновую кислоту, сорбитанмоностеарат, сорбитанмоноолеат, сорбитансесквиолеат, сорбитантриолеат, сложный эфир глицерина и жирных кислот, другие подобные средства или их комбинацию. В некоторых вариантах осуществления сложный эфир глицерина и жирной кислоты может представлять собой глицеринмоностеарат, диглицерилизостеарат, гексаглицерилполирицинолеат или другие подобные средства, или их комбинацию. В некоторых вариантах осуществления сложный эфир глицерина и жирной кислоты представляет собой глицеринмоностеарат. В некоторых вариантах осуществления глицеринмоностеарат представляет собой глицеринмоностеарат 40-55, продаваемый под торговым названием моно- и диглицериды NF Geleol™. Во избежание сомнений при использовании в данном документе термин "глицеринмоностеарат" может быть взаимозаменяемым с "глицерилмоностеаратом".
[0053] В некоторых вариантах осуществления можно использовать два или более средств для предотвращения отделения. В некоторых вариантах осуществления средство для предотвращения отделения представляет собой полиэтиленгликоль со средней молекулярной массой 1000-50000 и сложные эфиры глицерина и жирных кислот. В некоторых вариантах осуществления средство для предотвращения отделения представляет собой полиэтиленгликоль со средней молекулярной массой 1000-50000 и глицеринмоностеарат. В некоторых вариантах осуществления средство для предотвращения отделения представляет собой полиэтиленгликоль со средней молекулярной массой 1000-50000 и глицеринмоностеарат или другие подобные средства. Полагают, что отделение растворителя, в частности полиэтиленгликоля со средней молекулярной массой 200-600, можно предотвратить путем использования полиэтиленгликоля со средней молекулярной массой 1000-50000. Кроме того, полагают, что отделение усилителя абсорбции, в частности изопропилмиристата, можно предотвратить путем использования глицеринмоностеарата, или Geleol™, или других подобных средств.
[0054] В некоторых вариантах осуществления полиэтиленгликоль с молекулярной массой 1000-50000 относится к полиэтиленгликолю со средней молекулярной массой 1000-50000 по результату тестирования средней молекулярной массы. В некоторых вариантах осуществления средняя молекулярная масса полиэтиленгликоля с молекулярной массой 1000-50000 составляет от приблизительно 1000 до приблизительно 50000, от приблизительно 1000 до приблизительно 45000, от приблизительно 1000 до приблизительно 40000, от приблизительно 1000 до приблизительно 30000, от приблизительно 1000 до приблизительно 25000, от приблизительно 1000 до приблизительно 20000, от приблизительно 1000 до приблизительно 15000, от приблизительно 1000 до приблизительно 10000, от приблизительно 1000 до приблизительно 5000 или значение в любом из этих диапазонов. В некоторых вариантах осуществления средняя молекулярная масса полиэтиленгликоля может составлять 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10000, 15000, 20000, 25000, 30000, 35000, 40000, 45000, 50000 или диапазон между любыми двумя из этих значений. В некоторых вариантах осуществления полиэтиленгликоль представляет собой полиэтиленгликоль-4000. В некоторых вариантах осуществления средство для предотвращения отделения представляет собой полиэтиленгликоль-4000 со средней молекулярной массой 3600-4400 по результату тестирования средней молекулярной массы. В некоторых вариантах осуществления полиэтиленгликоль-4000 представляет собой полиэтиленгликоль-4000 согласно USP. В некоторых вариантах осуществления полиэтиленгликоль-4000 представляет собой полиэтиленгликоль-4000 согласно японской фармакопее.
[0055] В некоторых вариантах осуществления состав для местного применения может дополнительно содержать воду. В некоторых вариантах осуществления состав для местного применения может содержать очищенную воду. Полагают, что разложение активного ингредиента можно подавлять посредством добавления воды.
[0056] В некоторых вариантах осуществления состав для местного применения может дополнительно содержать краситель, ароматизатор, консервант, антиоксидант, стабилизатор, средство улучшения применимости, фармацевтически приемлемое вспомогательное вещество или их комбинацию.
[0057] В некоторых вариантах осуществления краситель может быть выбран из полуторного оксида железа, желтого полуторного оксида железа, кармина, карамельного красителя, бета-каротина, оксида титана, талька, рибофлавина, фосфата натрия, желтого алюминиевого лака или их комбинации. В некоторых вариантах осуществления ароматизатор можно выбирать из какао-порошка, ментолового масла, ментола, лимонного масла, борнеола, порошка корицы, аскорбиновой кислоты, лимонной кислоты, виннокаменной кислоты, яблочной кислоты, аспартама, ацесульфама калия или их комбинации.
[0058] В некоторых вариантах осуществления консервант может быть выбран из метилпарабена, пропилпарабена, хлорбутанола, бензилового спирта, фенетилового спирта, дегидроуксусной кислоты, сорбиновой кислоты или их комбинации.
[0059] В некоторых вариантах осуществления антиоксидант может включать сульфитные соли, аскорбиновую кислоту, токоферол, ликопен, зеленый чай, плод кофейного дерева, ресвератрол, виноградные косточки, ниацинамид, генистеин, феруловую кислоту, идебенон, кофермент Q10, ретинол, витамин А, лютеин, зеаксантин, астаксантин, альфа-липоевую кислоту, цинк, медь, бета-каротин или их комбинацию.
[0060] В некоторых вариантах осуществления стабилизатор может включать аскорбиновую кислоту, соль эдетовой кислоты, эриторбиновую кислоту, токоферол и т.п.или их комбинацию.
[0061] В некоторых вариантах осуществления средство улучшения применимости может включать полиоксиэтилен-40-гидрогенизированное касторовое масло, полиоксиэтилен-60-гидрогенизированное касторовое масло и т.п.или их комбинацию.
[0062] В некоторых вариантах осуществления активный ингредиент может присутствовать в количестве от приблизительно 0,001% до приблизительно 10% по весу. В некоторых вариантах осуществления активный ингредиент может присутствовать в количестве от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 1%, от приблизительно 0,001% до приблизительно 0,5%, от приблизительно 0,01% до приблизительно 0,5%, от приблизительно 0,05% до приблизительно 0,5%, от приблизительно 0,1% до приблизительно 1%, от приблизительно 0,4% до приблизительно 0,6%, от приблизительно 0,3% до приблизительно 0,7%, от приблизительно 0,2% до приблизительно 0,9%, от приблизительно 0,1% до приблизительно 0,5%, от приблизительно 0,2% до приблизительно 0,5% по весу или в значении в любом из этих диапазонов. В некоторых вариантах осуществления активный ингредиент может присутствовать в количестве приблизительно 0,001%, приблизительно 0,01%, приблизительно 0,03%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,25%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,75%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 3,0% или приблизительно 5% по весу или диапазон между любыми двумя из этих значений.
[0063] В некоторых вариантах осуществления растворитель может присутствовать в количестве более приблизительно 30% по весу. В некоторых вариантах осуществления растворитель может присутствовать в количестве от более приблизительно 30% по весу до приблизительно 60% по весу. В некоторых вариантах осуществления растворитель может присутствовать в количестве от приблизительно 35% по весу до приблизительно 60%, от приблизительно 35% до приблизительно 55%, от приблизительно 35% до приблизительно 50%, от приблизительно 40% до приблизительно 60% или от приблизительно 40% до приблизительно 55%, от приблизительно 40% до приблизительно 50% по весу. В некоторых вариантах осуществления растворитель может присутствовать в количестве приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60% или приблизительно 65% по весу или диапазон между любыми двумя из этих значений.
[0064] В некоторых вариантах осуществления основа может присутствовать в количестве менее приблизительно 10% по весу. В некоторых вариантах осуществления основа может присутствовать в количестве от приблизительно 0,001% до приблизительно 10% по весу. В некоторых вариантах осуществления основа может присутствовать в количестве от приблизительно 0,1% по весу до приблизительно 10%, от приблизительно 0,5% до приблизительно 10%, от приблизительно 1% до приблизительно 10%, от приблизительно 2,5% до приблизительно 10% или от приблизительно 4% до приблизительно 10%, от приблизительно 0,1% до приблизительно 7%, от приблизительно 0,5% до приблизительно 7%, от приблизительно 1% до приблизительно 7%, от приблизительно 2,5% до приблизительно 7% или от приблизительно 4% до приблизительно 7%, от приблизительно 4% до приблизительно 5% по весу. В некоторых вариантах осуществления основа может присутствовать в количестве приблизительно 0,1%, приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4%, приблизительно 4,5%, приблизительно 5%, приблизительно 6%, приблизительно 7%, приблизительно 8%, приблизительно 9% или приблизительно 10% по весу или диапазон между любыми двумя из этих значений. В некоторых вариантах осуществления усилитель абсорбции может присутствовать в количестве от приблизительно 5% до приблизительно 20% по весу. В некоторых вариантах осуществления усилитель абсорбции может присутствовать в количестве приблизительно 5%, приблизительно 10%, приблизительно 15% или приблизительно 20% по весу или диапазон между любыми двумя из этих значений.
[0065] В некоторых вариантах осуществления общее количество средства для предотвращения отделения может составлять от приблизительно 20% до приблизительно 50% по весу. В некоторых вариантах осуществления общее количество средства для предотвращения отделения может составлять более приблизительно 25%. В некоторых вариантах осуществления общее количество средства для предотвращения отделения может составлять от приблизительно 25% до приблизительно 50% по весу, от приблизительно 25% до приблизительно 40% по весу, от приблизительно 25% до приблизительно 35% по весу или от приблизительно 30% до приблизительно 50% по весу. В некоторых вариантах осуществления общее количество средства для предотвращения отделения может составлять приблизительно 25%, приблизительно 30%, приблизительно 33%, приблизительно 35%, приблизительно 40%, приблизительно 45% или приблизительно 50% по весу или диапазон между любыми двумя из этих значений.
[0066] В некоторых вариантах осуществления вода может присутствовать в количестве от приблизительно 0,1% до приблизительно 5% по весу. В некоторых вариантах осуществления вода может присутствовать в количестве от приблизительно 0,3% до приблизительно 4%, от приблизительно 0,3% до приблизительно 3%, от приблизительно 0,5% до приблизительно 3% или от приблизительно 0,5% до приблизительно 2%. В некоторых вариантах осуществления вода может присутствовать в количестве приблизительно 0,1%, приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4%, приблизительно 4,5% или приблизительно 5% или диапазон между любыми двумя из этих значений.
[0067] В некоторых вариантах осуществления количество растворителя и усилителя абсорбции составляет от приблизительно 40% до приблизительно 70% по весу. В некоторых вариантах осуществления количество растворителя и усилителя абсорбции может составлять от приблизительно 40% до приблизительно 65% по весу, от приблизительно 40% до приблизительно 60% по весу, от приблизительно 40% до приблизительно 55% по весу или от приблизительно 40% до приблизительно 50% по весу. В некоторых вариантах осуществления количество растворителя и усилителя абсорбции может составлять приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 40%, приблизительно 60%, приблизительно 65% или приблизительно 70% по весу или диапазон между любыми двумя из этих значений
[0068] В некоторых вариантах осуществления состав для местного применения может быть выбран из состава, описанного в таблице 1 ниже. В некоторых вариантах осуществления состав для местного применения может быть выбран из состава С1, состава С2, состава С3 или состава С4, описанных в таблице 1 ниже. В некоторых вариантах осуществления составы для местного применения, используемые в способе согласно вариантам осуществления, представленным в данном документе, могут содержать эффективное количество соединения, представленного формулой (I), его соли, его аналога или его гидрата, где R представляет собой гидроксил, С1-6алкокси, необязательно замещенный С1-6алкокси, или амино, необязательно замещенный С1-6алкилом, растворитель и основу, причем состав для местного применения содержит более приблизительно 30% по весу растворителя. В некоторых вариантах осуществления основа присутствует в количестве от приблизительно 0,001% до менее приблизительно 10% по весу состава для местного применения. В некоторых вариантах осуществления соединение, представленное формулой (I), присутствует в количестве от приблизительно 0,2% до приблизительно 1% по весу состава для местного применения. В некоторых вариантах осуществления соединение, представленное формулой (I), присутствует в количестве от приблизительно 0,2% до приблизительно 0,6% по весу состава для местного применения. В некоторых вариантах осуществления соединение, представленное формулой (I), присутствует в количестве приблизительно 0,5% по весу состава для местного применения.
[0069] В некоторых вариантах осуществления состав для местного применения дополнительно содержит усилитель абсорбции, средство для предотвращения отделения, воду, фармацевтически приемлемое вспомогательное вещество или их комбинацию. В некоторых вариантах осуществления средство для предотвращения отделения предусматривает два или более средств для предотвращения отделения. В некоторых вариантах осуществления общее количество средства для предотвращения отделения составляет более приблизительно 40% по весу состава для местного применения. В некоторых вариантах осуществления усилитель абсорбции присутствует в количестве от приблизительно 5% до приблизительно 20% по весу состава для местного применения. В некоторых вариантах осуществления суммарное количество растворителя и усилителя абсорбции составляет от 35% по весу до 70% по весу состава для местного применения.
[0070] В некоторых вариантах осуществления соединение, представленное формулой (I), представляет собой метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту (RVT-501).
[0071] В некоторых вариантах осуществления основа выбрана из группы, состоящей из петролатума, парафина, жидкого парафина, микрокристаллического воска, карнаубского воска, белого пчелиного воска и их комбинации.
[0072] В некоторых вариантах осуществления растворитель выбран из группы, состоящей из полиэтиленгликоля со средней молекулярной массой 200-600, дипропиленгликоля, бензилового спирта, полиоксиэтиленового эфира сорбита и жирной кислоты, моноэтилового эфира диэтиленгликоля, пропиленгликоля, олеилового эфира полиоксиэтилена, октилфенилового эфира полиоксиэтилена, лаурилового эфира полиоксиэтилена, полиоксиэтилена-касторового масла, олеиновой кислоты и их комбинации.
[0073] В некоторых вариантах осуществления усилитель абсорбции выбран из группы, состоящей из изопропилмиристата, этилмиристата, октилдодецилмиристата, изопропилпальмитата, изостеарилпальмитата, изопропилизостеарата, бутилстеарата, этилолеата, децилолеата, диизопропилсебацината, диэтилсебацината, диизопропиладипата, диэтиладипата, диэтилфталата и их комбинации.
[0074] В некоторых вариантах осуществления средство для предотвращения отделения выбрано из группы, состоящей из полиэтиленгликоля со средней молекулярной массой 1000-50000, полно ксиэтилена-гидрогенизированного касторового масла, стеариновой кислоты, олеиновой кислоты, сорбитанмоностеарата, сорбитанмоноолеат, сорбитансесквиолеата, сорбитантриолеата, сложных эфиров глицерина и жирных кислот и их комбинации.
[0075] В некоторых вариантах осуществления сложные эфиры глицерина и жирных кислот выбраны из группы, состоящей из глицеринмоностеарата 40-55, продаваемого под торговым названием Geleol™ (моноглицериды и диглицериды NF), глицеринмоностеарата, диглицерилизостеарата и гексаглицерилполирицинолеата. В некоторых вариантах осуществления два или более средств для предотвращения отделения представляют собой полиэтиленгликоль со средней молекулярной массой 1000-50000 и сложные эфиры глицерина и жирных кислот. В некоторых вариантах осуществления растворитель присутствует в количестве приблизительно 50% по весу, основа присутствует в количестве приблизительно 4,4% по весу, средство для предотвращения отделения присутствует в количестве приблизительно 33% по весу, и усилитель абсорбции присутствует в количестве приблизительно 10% по весу.
[0076] В некоторых вариантах осуществления состав для местного применения можно применять раз в сутки, два раза в сутки, раз в две недели, раз в неделю, три раза в неделю, каждые две недели, через день, раз в месяц, каждые два месяца, каждые три месяца или как указано на упаковке или врачом для достижения необходимого клинического результата.
[0077] В некоторых вариантах осуществления состав для местного применения согласно вариантам осуществления, представленным в данном документе, можно изготавливать согласно общим способам изготовления состава для местного применения. Используя мазь в качестве примера, иллюстративный способ может быть следующим: сначала соединение, представленное формулой (I), его соль или его гидрат, который представляет собой активный ингредиент, растворяют в растворителе при нагревании от 70°С до 80°С (раствор I). При этом усилитель абсорбции и средство для предотвращения отделения и другие ингредиенты добавляют в основу, при необходимости, и растворяют при нагревании от 70°С до 80°С. Затем раствор I и воду, при необходимости, добавляют в полученную смесь, и смесь перемешивают при 70-80°С в течение приблизительно 3 минут. Перемешивание продолжают до тех пор, пока смесь не охладится до приблизительно 32°С (приблизительно температуры поверхности кожи человека) и до завершения получения мази. При необходимости антиоксидант можно добавлять в растворитель.
СПОСОБЫ ПРИМЕНЕНИЯ СОСТАВОВ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ
[0078] Варианты осуществления, представленные в данном документе, также направлены на способы лечения дерматологического состояния с применением составов для местного применения согласно вариантам осуществления, представленных в данном документе. В некоторых вариантах осуществления способ лечения дерматологического состояния включает введение состава для местного применения согласно вариантам осуществления, описанным в данном документе. В некоторых вариантах осуществления состав для местного применения применяют местным путем. В некоторых вариантах осуществления дерматологическое состояние может быть выбрано из дерматита, такого как без ограничения атопический дерматит, себорейный дерматит, алопецию, контактный дерматит, псориаз, крапивницу, экзему, ожоги, солнечные ожоги, панкреатит, гепатит, лишай Вильсона, склерит, склеродермию, дерматомиозит или их комбинация. В некоторых вариантах осуществления дерматологическое состояние может представлять собой зуд, связанный с любым из указанных состояний.
[0079] В некоторых вариантах осуществления состав для местного применения, используемый в способе согласно вариантам осуществления, представленным в данном документе, представляет собой состав, раскрытый в таблице 1 ниже. В некоторых вариантах осуществления состав для местного применения, используемый в способе согласно вариантам осуществления, представленным в данном документе, представляет собой состав, выбранный из состава С1, состава С2, состава С3 или состава С4, описанных в таблице 1 ниже. В некоторых вариантах осуществления составы для местного применения, используемые в способе согласно вариантам осуществления, представленным в данном документе, могут содержать эффективное количество соединения, представленного формулой (I), его соли или его гидрата, где R представляет собой гидроксил, С1-6алкокси, необязательно замещенный C1-6алкокси, или амино, необязательно замещенный С1-6алкилом, растворитель и основу, причем состав для местного применения содержит более приблизительно 30% по весу растворителя. В некоторых вариантах осуществления основа присутствует в количестве от приблизительно 0,001% до менее приблизительно 10% по весу состава для местного применения. В некоторых вариантах осуществления соединение, представленное формулой (I), присутствует в количестве от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 1%, от приблизительно 0,001% до приблизительно 0,5%, от приблизительно 0,01% до приблизительно 0,5%, от приблизительно 0,05% до приблизительно 0,5%, от приблизительно 0,1% до приблизительно 1%, от приблизительно 0,4% до приблизительно 0,6%, от приблизительно 0,3% до приблизительно 0,7%, от приблизительно 0,2% до приблизительно 0,9%, от приблизительно 0,1% до приблизительно 0,5%, от приблизительно 0,2% до приблизительно 0,5% по весу состава для местного применения, диапазон между двумя этими значениями или любое значение в вышеуказанных диапазонах. В некоторых вариантах осуществления соединение, представленное формулой (I), может присутствовать в количестве приблизительно 0,001%, приблизительно 0,01%, приблизительно 0,03%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,25%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,75%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 3,0% или приблизительно 5% по весу или диапазон между любыми двумя из этих значений. В некоторых вариантах осуществления соединение, представленное формулой (I), присутствует в количестве приблизительно 0,2%. В некоторых вариантах осуществления соединение, представленное формулой (I), присутствует в количестве приблизительно 0,5%.
[0080] В некоторых вариантах осуществления состав для местного применения дополнительно содержит усилитель абсорбции, средство для предотвращения отделения, воду или их комбинацию. В некоторых вариантах осуществления состав для местного применения может дополнительно содержать краситель, ароматизатор, консервант, антиоксидант, стабилизатор, фармацевтически приемлемое вспомогательное вещество, средство улучшения применимости или их комбинацию.
[0081] В некоторых вариантах осуществления средство для предотвращения отделения предусматривает два или более средств для предотвращения отделения. В некоторых вариантах осуществления общее количество средства для предотвращения отделения составляет более приблизительно 40% по весу состава для местного применения. В некоторых вариантах осуществления усилитель абсорбции присутствует в количестве от приблизительно 5% до приблизительно 20% по весу состава для местного применения. В некоторых вариантах осуществления суммарное количество растворителя и усилителя абсорбции составляет от 35% по весу до 70% по весу состава для местного применения.
[0082] В некоторых вариантах осуществления соединение, представленное формулой (I), представляет собой метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовую кислоту (RVT-501). В некоторых вариантах осуществления соединение, представленное формулой (I), представляет собой гидрохлорид N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты.
[0083] В некоторых вариантах осуществления основа выбрана из группы, состоящей из петролатума, парафина, жидкого парафина, микрокристаллического воска, карнаубского воска, белого пчелиного воска и их комбинации.
[0084] В некоторых вариантах осуществления растворитель выбран из группы, состоящей из полиэтиленгликоля со средней молекулярной массой 200-600, дипропиленгликоля, бензилового спирта, полиоксиэтиленового эфира сорбита и жирной кислоты, моноэтилового эфира диэтиленгликоля, пропиленгликоля, олеилового эфира полиоксиэтилена, октилфенилового эфира полиоксиэтилена, лаурилового эфира полиоксиэтилена, полиоксиэтилена-касторового масла, олеиновой кислоты и их комбинации.
[0085] В некоторых вариантах осуществления усилитель абсорбции выбран из группы, состоящей из изопропилмиристата, этилмиристата, октилдодецилмиристата, изопропилпальмитата, изостеарилпальмитата, изопропилизостеарата, бутилстеарата, этилолеата, децилолеата, диизопропилсебацината, диэтилсебацината, диизопропиладипата, диэтиладипата, диэтилфталата и их комбинации.
[0086] В некоторых вариантах осуществления средство для предотвращения отделения выбрано из группы, состоящей из полиэтиленгликоля со средней молекулярной массой 1000-50000, полиоксиэтилена-гидрогенизированного касторового масла, стеариновой кислоты, олеиновой кислоты, сорбитанмоностеарата, сорбитанмоноолеат, сорбитансесквиолеата, сорбитантриолеата, сложных эфиров глицерина и жирных кислот и их комбинации.
[0087] В некоторых вариантах осуществления сложные эфиры глицерина и жирных кислот выбраны из группы, состоящей из глицеринмоностеарата 40-55, продаваемого под торговым названием Geleol™ (моноглицериды и диглицериды NF), глицеринмоностеарата, диглицерилизостеарата и гексаглицерилполирицинолеата. В некоторых вариантах осуществления два или более средств для предотвращения отделения представляют собой полиэтиленгликоль со средней молекулярной массой 1000-50000 и сложные эфиры глицерина и жирных кислот. В некоторых вариантах осуществления растворитель присутствует в количестве приблизительно 50% по весу, основа присутствует в количестве приблизительно 4,4% по весу, средство для предотвращения отделения присутствует в количестве приблизительно 33% по весу, и усилитель абсорбции присутствует в количестве приблизительно 10% по весу.
[0088] Количество соединения формулы (I), подлежащее введению, представляет такое количество, которое является терапевтически эффективным. Доза, подлежащая введению, будет зависеть от характеристик субъекта, лечение которого осуществляют, например, конкретного животного, лечение которого осуществляют, возраста, веса, состояния здоровья, типов сопутствующего лечения, если такое есть, и частоты применения средств лечения, и может быть легко определена специалистом в данной области техники (например, врачом).
[0089] Следует также отметить, что при использовании в данном документе и прилагаемой формуле изобретения, форма единственного числа включает ссылки на множественное, если контекст явно не указывает иное. Таким образом, например, ссылка на "средство для предотвращения отделения" является ссылкой на одно или несколько средств для предотвращения отделения и их эквиваленты, известные специалистам в данной области техники, и т.д.
[0090] При использовании в данном документе термин "приблизительно" означает плюс или минус 10% от численного значения, с которым его используют. Таким образом, приблизительно 50% означает в диапазоне 45%-55%.
[0091] "Введение" при использовании в сочетании с терапевтическими средствами означает введение терапевтического средства непосредственно в целевую ткань или на нее или введение терапевтического средства пациенту, при этом терапевтическое средство положительно влияет на ткань, на которую оно целенаправленно воздействует. Таким образом, при использовании в данном документе, термин "введение" при использовании в сочетании с гидролизатом эластина может включать без ограничения, обеспечение гидролизата эластина в ткани-мишени или на ней; системного обеспечения гидролизата эластина у пациента посредством, например, внутривенной инъекции, при которой терапевтическое средство достигает целевой ткани; обеспечение гидролизата эластина в виде его кодирующей последовательности к целевой ткани (например, с помощью так называемых методик генной терапии). "Введение" состава может осуществляться посредством инъецирования, местного применения или любым способом в комбинации с любыми известными методиками. Такие комбинированные методики включают нагревание, облучение и ультразвук.
[0092] Термин "субъект" при использовании в данном документе включает без ограничения людей и отличных от людей позвоночных, таких как дикие, домашние и сельскохозяйственные животные.
[0093] Термин "улучшает" используют для передачи того, что настоящее изобретение изменяет или внешний вид, форму, характеристики и/или физические свойства ткани, в отношении которой его применяют, наносят или вводят. Изменение формы может быть показано любым из следующего или в комбинации улучшение внешнего вида кожи; уменьшение симптомов заболевания.
[0094] Термин "подавление" включает введение соединения настоящего изобретения для предотвращения начала появления симптомов, облегчения симптомов или устранения заболевания, состояния или нарушения.
[0095] Под "фармацевтически приемлемым" понимают носитель, разбавитель или вспомогательное вещество, которое должно быть совместимым с другими ингредиентами состава и не быть вредным для его получателя. Выбор фармацевтически приемлемого носителя, разбавителя или вспомогательного вещества можно определять по его пригодности для режима лечения заболевания или рассматриваемого медицинского состояния, и ссылку можно сделать на стандартный справочник, такой как Goodman & Gilman's The Pharmacological Basis of Therapeutics. 11th ed. New York: McGraw-Hill; 2005, который таким образом включен посредством ссылки во всей своей полноте.
[0096] Если не указано иное, термин "кожа" означает наружную оболочку или покрытие тела, состоящее из дермы и эпидермиса и находящееся на подкожной основе.
[0097] При использовании в данном документе термин "терапевтическое средство" означает средство, используемое для лечения, контроля, облегчения симптомов, предотвращения или улучшения нежелательного состояния или заболевания у пациента. Отчасти, варианты осуществления настоящего изобретения направлены на лечение рака или снижение пролиферации клеток.
[0098] "Терапевтически эффективное количество" или "эффективное количество" композиции представляет собой заранее определенное количество, рассчитанное для достижения необходимого эффекта, т.е. для ингибирования, блокирования или изменения активации, миграции или пролиферации клеток. Активность, рассматриваемая в данных способах, включает как медицинское терапевтическое, так и/или профилактическое лечение, в случае необходимости. Конкретная доза соединения, вводимая согласно данному изобретению для получения терапевтического и/или профилактического эффектов, будет, конечно, определяться конкретными обстоятельствами каждого случая, включая, например, вводимое соединение, путь введения и состояние, лечение которого осуществляют. Соединения эффективны в широком диапазоне доз и, например, дозы в сутки будут обычно находиться в диапазоне от 0,001 до 10 мг/кг, обычно в диапазоне от 0,01 до 1 мг/кг. Однако будет понятно, что вводимое эффективное количество будет определяться врачом ввиду соответствующих обстоятельств, включая состояние, лечение которого осуществляют, выбор соединения, подлежащего введению, и выбранный путь введения, и, таким образом, вышеуказанные диапазоны доз не предназначены для ограничения объема настоящего изобретения каким-либо образом. Терапевтически эффективное количество соединения по настоящему изобретению обычно представляет такое количество, что при его введении в физиологически приемлемой композиции с вспомогательными веществами, оно достаточно для достижения эффективной системной концентрации или местной концентрации в ткани.
[0099] Термины "лечить," "получавший лечение" или "осуществление лечения" при использовании в данном документе относятся как к терапевтическому лечению и профилактическим или предупреждающим мерам, причем у объекта предупреждается или замедляется (облегчается) нежелательное физиологическое состояние, нарушение или заболевание, или к получению полезных или необходимых клинических результатов. Для целей данного изобретения полезные или необходимые клинические результаты включают без ограничения облегчение симптомов; сокращение длительности состояния, нарушения или заболевания; стабилизацию (т.е. отсутствие ухудшения) состояния в случае состояния, нарушения или заболевания; отсрочку начала или замедление развития состояния, нарушения или заболевания; улучшение состояния, нарушения или болезненного состояния; и ремиссию (или частичную, или полную), или явную, или неявную, или коррекцию или улучшение состояния, нарушения или заболевания. Лечение предусматривает обеспечение клинически значимой реакции без чрезмерных уровней побочных эффектов. Лечение также предусматривает увеличение выживаемости по сравнению с предполагаемой выживаемостью, если не получать лечение.
[00100] Данное изобретение и варианты осуществления, иллюстрирующие способ, и используемые материалы, можно более полно понять со ссылкой на следующие неограничивающие примеры.
ПРИМЕР 1 ИССЛЕДОВАНИЕ ПРОНИКНОВЕНИЯ ЧЕРЕЗ КОЖУ
[00101] Исследование было предназначено для оценки проникновения активного ингредиента, метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (RVT-501), в трупную кожу человека и через нее из 4 составов и 1 раствора на основе лекарственного средства, используя модель Франца in vitro конечной дозы с трупной кожей человека. Фосфатно-буферный солевой раствор; рН 7,4±0,1 использовали в качестве принимающей среды. В каждую ячейку один раз вводили дозу 10 мкл/см2 соответствующего состава с применением пипетки прямого вытеснения. В заранее выбранные значения времени после внесения дозы 500 мкл аликвоту принимающей среды удаляли посредством отвода для отбора проб для ячейки Франца и замещали равным объемом свежей принимающей среды. Стеклянную палочку использовали для распределения состава равномерно, покрывая всю площадь поверхности кожи. По завершению исследования ячейки разбирали и кожу аккуратно удаляли из каждой ячейки. Каждый срез кожи дважды промывали 0,5 мл раствора для экстракции (принимающей среды) для сбора неабсорбированного состава с поверхности кожи. Кожу аккуратно разделяли на эпидермис и дерму с помощью пинцета. В каждый флакон как с эпидермисом, так и дермой добавляли раствор для гомогенизации (фосфатно-буферный солевой раствор, рН 7,4). Ткани гомогенизировали с помощью шарикового гомогенизатора (OMNI Bead Ruptor 24.)
*Глицеринмоностеарат, моно- и диглицериды, NF, продаваемые под торговым названием Geleol™, представляет собой глицеринмоностеарат, используемый в составах C1, С2 и С3.
[00102] Целью данного исследования была оценка проникновения метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (RVT-501) в трупную кожу человека и через нее из 4 составов (В, C1, С2 и С3) и 1 раствора на основе лекарственного средства (С4). Результаты показали самое большое проникновение метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (RVT-501) из раствора на основе PEG-400 (С4). Это было ожидаемо, поскольку С4 использовали в качестве положительного контроля в исследовании. Уровни лекарственного средства были ниже предела количественного определения в принимающей среде через 24 часа для всех протестированных составов. Результаты от донора 1 указывали на то, что С1 характеризуется большим проникновением по сравнению с В, С2 и С3. Однако результаты для донора 2 показали, что три состава характеризуются практически равным проникновением. В общем, для донора 1 была показана тенденция к большему прониканию, чем для донора 2. Отмечали, что донор 1 был на вид тоньше донора 2. Кроме того, дозозависимый эффект не наблюдали между двумя дозами, 0,2% и 0,5%. Поскольку аналогичную тенденцию для С1, характеризующегося большим проникновением, не наблюдали для обоих доноров, можно сделать вывод, что составы В, C1, С2 и С3 характеризовались практически равным проникновением в роговой слой (фиг. 1), эпидермис (фиг. 2) и дерму (фиг. 3).
ПРИМЕР 2. ЛЕЧЕНИЕ АТОПИЧЕСКОГО ДЕРМАТИТА
[00103] Атопический дерматит (AD) индуцировали у самки мыши NC/Nga без специфической патогенной микрофлоры (SPF) (n=8/группу), возрастом 8-12 недель, путем повторных чрезкожных введений динитрохлорбензола (DNCB) на кожу дорсальной области ушек и спину в дни 4, 7, 10 и 13. Мыши NC/Nga представляют собой установленную мышиную модель для атопического дерматита. См. Suto et al. NC/Nga mice: a mouse model for atopic dermatitis; Int Arch Allergy Immunol. 1999; 120 Suppl 1: 70-5; и Gao et al., Establishment of allergic dermatitis in NC/Nga mice as a model for severe atopic dermatitis, Biol. Pharm. Bull. 2004 Sep; 27 (9): 1376-81.
[00104] Проводили исследование профилактического эффекта и исследование терапевтического эффекта.
1. Исследование профилактического эффекта: 0,2% состав (С1), 0,5% состав (С2), плацебо для RVT-501, плацебо для такролимуса, 0,1% такролимуса или без обработки (контроль AD) на дни 1-14 или симуляция индуцирования с помощью AD.
2. Исследование терапевтического эффекта: 0,2% состав (С1), 0,5% состав (С2), плацебо для активного ингредиента, плацебо для такролимуса, 0,1% такролимуса или без обработки (контроль AD) на дни 8-14. См. фиг. 4.
[00105] Анализы в отношении "расцарапывания" проводили на дни 2, 8, 11, 14 в обоих исследованиях. Образцы кожи собирали для гистопатологии и анализа на цитокины на день 15. Гистопатология кожи мышей с симуляцией индуцирования относительно индуцирования DNCB показала явное наличие атопического дерматита. См. фиг. 5.
[00106] Срезы кожи исследовали на день 15 на связанную с AD патологию. Профилактическая обработка с помощью 0,5% состава (С2) или 0,1% такролимуса уменьшала повреждения в результате AD, индуцированные DNCB, на микроскопическом уровне. См. фиг. 6, левая колонка. В качестве терапевтической обработки 0,5% состав (С2) и 0,1% такролимуса имел тенденцию к уменьшению тяжести повреждения в результате AD. См. фиг. 6, правая колонка.
[00107] Образцы кожи собирали для анализа на цитокины в конце каждого исследования для получения ответа на вопрос, как различные виды обработки влияли на эти иммуномодуляторы. Профилактическое введение метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (RVT-501) значительно снижало уровни G-CSF, GM-CSF, KC, MIP-1α и TNF-α дозозависимым образом. Кроме того, 0,5% состав (С2) снижал уровни IL-3, IL-6, IL-17, МСР-1 и MIP-1β. Терапевтически, для II-1β было показано значительное дозозависимое снижение уровня при обработке с помощью метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовой кислоты (RVT-501). Значительные снижения уровня с помощью 0,5% состава (С2) также отмечали для IL-3, эотаксина, G-CSF, GM-CSF, КС, MIP-1α, MIP-β и TNF-α. В качестве терапевтического средства 0,1% такролимуса значительно снижали уровни IL-1α, IL-1β, IL-4, IL-5, IL-10, IL-12(p40), IL-13, эотаксина, GM-CSF, KC, MCP-1, MIP-1α, MIP-1β, RANTES и TNF-α. Снижение уровня данных воспалительных цитокинов и хемокинов вероятно способствует уменьшению инфильтрации иммуноцитов, что видно по гистопатологии в обоих исследованиях с 0,5% составом (С2) и 0,1% такролимуса. См. фиг. 7.
[00108] Все группы обработки показали значительное уменьшение "расцарапывания" относительно плацебо в исследовании профилактического эффекта. В качестве терапевтического средства 0,1% такролимуса показали значительное уменьшение "расцарапывания" на день 14. См. фиг. 8.
[00109] ВЫВОДЫ: Исследование профилактического эффекта показало, что 0,5% состав RVT-501 (С2) значительно уменьшал образование язв на коже и сохранял структуру кожи по сравнению с животными в группах контроля с плацебо для активного ингредиента и контроля AD. 0,5% состав RVT-501 (С2) также значительно снижал события "расцарапывания" на D14, толщину уха, показатель поражения кожи при AD и несколько связанных с AD провоспалительных цитокинов по сравнению с плацебо для RVT-501; все из которых по-видимому показывают дозозависимую реакцию для составов от 0,2% до 0,5% (С1 и С2, соответственно). Исследование терапевтического эффекта показало значительное снижение показателя поражения кожи при AD относительно плацебо для активного ингредиента, которое по-видимому является дозозависимым, а имеет тенденцию к уменьшению образования язв и толщины уха с 0,5% составом RVT-501 (С2), хотя эти последние изменения не достигают статистической значимости. Терапевтическая обработка установленных повреждений при AD у мышей также показала значительное снижение уровней связанных с AD провоспалительных цитокинов, хотя эти эффекты не были настолько заметными, как на день 14 профилактической обработки.
[00110] В общем, значительные снижения уровней "расцарапывания", микроскопической гистопатологии кожи и воспалительных цитокинов наблюдали с 0,5% составом RVT-501 (С2) и 0,1% такролимуса, вводимых профилактически. Тенденция к достижению значимой разницы была видна с составом 0,5% RVT-501 (С2), вводимым терапевтически, и может достигаться в модели, где возможно более длительная обработка. Следовательно, вводимая местно метил-N-[3-(6,7-диметокси-2-метиламинохиназолин-4-ил)фенил]терефталамовая кислота (RVT-501) по-видимому является эффективным средством лечения для атопического дерматита.
[00111] Хотя настоящее изобретение было описано довольно подробно со ссылкой на его определенные предпочтительные варианты осуществления, возможны другие варианты. Таким образом, сущность и объем прилагаемой формулы изобретения не должен быть ограничен описанием и предпочтительными вариантами, содержащимися в данном описании.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА | 2007 |
|
RU2431632C2 |
| СОСТАВ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 1995 |
|
RU2181592C2 |
| НЕРЕАКЦИОННОСПОСОБНЫЕ ГИДРОФИЛЬНЫЕ ПОЛИМЕРЫ С КОНЦЕВЫМИ СИЛОКСАНАМИ И ОБЛАСТИ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2565591C2 |
| Фармацевтический состав для ингибиторов гистондеацетилазы | 2011 |
|
RU2625758C2 |
| АДЪЮВАНТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2412595C1 |
| БОРИНОВЫЕ КОМПОЗИЦИИ | 2010 |
|
RU2521248C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДВУХНИТЕВУЮ РИБОНУКЛЕИНОВУЮ КИСЛОТУ, ПОДАВЛЯЮЩУЮ ЭКСПРЕССИЮ КОМПОНЕНТА КОМПЛЕМЕНТА C5 | 2020 |
|
RU2833504C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ | 2015 |
|
RU2703557C1 |
| СПОСОБЫ И СИСТЕМЫ ДЛЯ ВЫЩЕЛАЧИВАНИЯ СИЛИКОНОВЫХ ГИДРОГЕЛЕВЫХ ОФТАЛЬМОЛОГИЧЕСКИХ ЛИНЗ | 2006 |
|
RU2399492C2 |
| НОВЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1999 |
|
RU2240121C2 |

Изобретение относится к составу для местного применения для лечения дерматологического состояния, выбранного из атопического дерматита, себорейного дерматита, алопеции, контактного дерматита, псориаза, крапивницы, экземы, ожогов, солнечного ожога, панкреатита, гепатита, лишая Вильсона, склерита, склеродермии, дерматомиозита или их комбинации, содержащему от 0,2% до 0,9% по весу состава для местного применения соединения, представленного формулой (I) 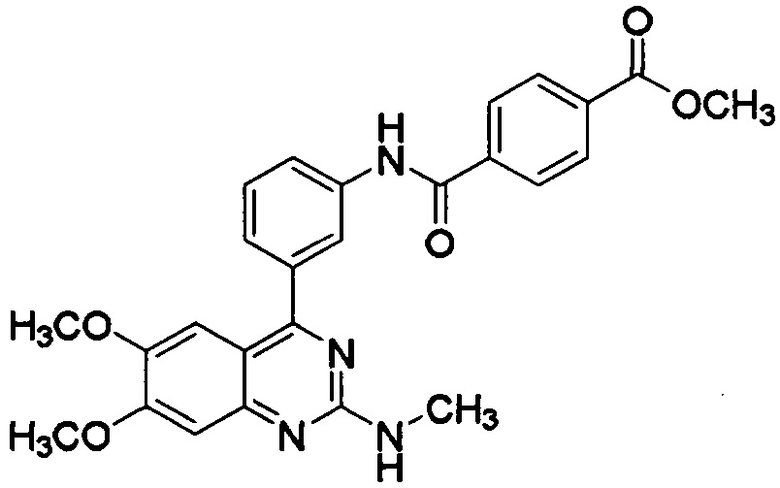 , или его фармацевтически приемлемой соли, два средства для предотвращения отделения, содержащих 20-40% полиэтиленгликоля, имеющего среднюю молекулярную массу 4000 кДа, и 7,2-8,8% глицеринмоностеарата по весу состава для местного применения, от 40% до 60% по весу состава для местного применения PEG 400 в качестве растворителя, от 4% до 6% по весу состава для местного применения белого вазелина в качестве основы, и 9-11% по весу состава для местного применения изопропилмиристата в качестве усилителя абсорбции, где фармацевтически приемлемая соль выбрана из группы, состоящей из гидрохлорида, гидробромида, сульфата, нитрата, фосфата, ацетата, сукцината, фумарата, малеата, тартрата, цитрата, лактата, стеарата, бензоата, метансульфоната, этансульфоната, п-толуолсульфоната или бензолсульфоната. 2 н. и 11 з.п. ф-лы, 8 ил., 1 табл., 2 пр.
, или его фармацевтически приемлемой соли, два средства для предотвращения отделения, содержащих 20-40% полиэтиленгликоля, имеющего среднюю молекулярную массу 4000 кДа, и 7,2-8,8% глицеринмоностеарата по весу состава для местного применения, от 40% до 60% по весу состава для местного применения PEG 400 в качестве растворителя, от 4% до 6% по весу состава для местного применения белого вазелина в качестве основы, и 9-11% по весу состава для местного применения изопропилмиристата в качестве усилителя абсорбции, где фармацевтически приемлемая соль выбрана из группы, состоящей из гидрохлорида, гидробромида, сульфата, нитрата, фосфата, ацетата, сукцината, фумарата, малеата, тартрата, цитрата, лактата, стеарата, бензоата, метансульфоната, этансульфоната, п-толуолсульфоната или бензолсульфоната. 2 н. и 11 з.п. ф-лы, 8 ил., 1 табл., 2 пр.
1. Состав для местного применения для лечения дерматологического состояния, выбранного из атопического дерматита, себорейного дерматита, алопеции, контактного дерматита, псориаза, крапивницы, экземы, ожогов, солнечного ожога, панкреатита, гепатита, лишая Вильсона, склерита, склеродермии, дерматомиозита или их комбинации, содержащий от 0,2% до 0,9% по весу состава для местного применения соединения, представленного формулой (I), или его фармацевтически приемлемой соли,
два средства для предотвращения отделения, содержащих 20-40% полиэтиленгликоля, имеющего среднюю молекулярную массу 4000 кДа, и 7,2-8,8% глицеринмоностеарата по весу состава для местного применения,
от 40% до 60% по весу состава для местного применения PEG 400 в качестве растворителя,
от 4% до 6% по весу состава для местного применения белого вазелина в качестве основы, и
9-11% по весу состава для местного применения изопропилмиристата в качестве усилителя абсорбции,
где фармацевтически приемлемая соль выбрана из группы, состоящей из гидрохлорида, гидробромида, сульфата, нитрата, фосфата, ацетата, сукцината, фумарата, малеата, тартрата, цитрата, лактата, стеарата, бензоата, метансульфоната, этансульфоната, п-толуолсульфоната или бензолсульфоната.
2. Состав для местного применения по п. 1, где соединение, представленное формулой (I), присутствует в количестве 0,45% - 0,55% по весу состава для местного применения.
3. Состав для местного применения по п. 1, дополнительно содержащий воду.
4. Состав для местного применения по п. 1, где суммарное количество растворителя и усилителя абсорбции составляет от 31,5% до 77% по весу состава для местного применения.
5. Состав для местного применения по п. 1, который содержит дополнительную основу, выбранную из группы, состоящей из петролатума, парафина, жидкого парафина, микрокристаллического воска, карнаубского воска, белого пчелиного воска и любой их комбинации.
6. Состав для местного применения по п. 1, который содержит дополнительный растворитель, выбранный из группы, состоящей из полиэтиленгликоля со средней молекулярной массой от 180 до 660, дипропиленгликоля, бензилового спирта, полиоксиэтиленового эфира сорбита и жирной кислоты, моноэтилового эфира диэтиленгликоля, пропиленгликоля, олеилового эфира полиоксиэтилена, октилфенилового эфира полиоксиэтилена, лаурилового эфира полиоксиэтилена, полиоксиэтилена-касторового масла, олеиновой кислоты и любой их комбинации.
7. Состав для местного применения по п. 6, где дополнительный растворитель представляет собой полиэтиленгликоль со средней молекулярной массой от 180 до 660.
8. Состав для местного применения по п. 1, который содержит дополнительный усилитель абсорбции, выбранный из группы, состоящей из этилмиристата, октилдодецилмиристата, изопропилпальмитата, изостеарилпальмитата, изопропилизостеарата, бутилстеарата, этилолеата, децилолеата, диизопропилсебацината, диэтилсебацината, диизопропиладипата, диэтиладипата, диэтилфталата и любой их комбинации.
9. Состав для местного применения по п. 1, который содержит дополнительное средство для предотвращения отделения, выбранное из группы, состоящей из полиэтиленгликоля со средней молекулярной массой 1000-50000, полиоксиэтилена-гидрогенизированного касторового масла, стеариновой кислоты, олеиновой кислоты, сорбитанмоностеарата, сорбитанмоноолеата, сорбитансесквиолеата, сорбитантриолеата, сложных эфиров глицерина и жирных кислот и любой их комбинации.
10. Состав для местного применения по п. 9, где дополнительное средство для предотвращения отделения представляет собой полиэтиленгликоль со средней молекулярной массой от 3240 до 4840.
11. Состав для местного применения по п. 9, где сложные эфиры глицерина и жирных кислот выбраны из группы, состоящей из моноглицеридов, диглицеридов, моноглицеролстеаратов, диглицеролстеаратов, триглицеролстеаратов, диглицерилизостеарата, гексаглицерилполирицинолеата и любой их комбинации.
12. Состав для местного применения по п. 1, где растворитель присутствует в количестве 45-55% по весу, основа присутствует в количестве 3,96-4,84% по весу, средство для предотвращения отделения присутствует в количестве 29,7–36,3% по весу, и усилитель абсорбции присутствует в количестве 9-11% по весу.
13. Способ лечения атопического дерматита у субъекта, включающий введение терапевтически эффективного количества состава для местного применения по п. 1.
| US 2011021545 A1, 27.01.2011 | |||
| WO 2006085127 A1, 17.08.2006 | |||
| US 8530654 B2, 10.09.2013 | |||
| СПОСОБ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА У ДЕТЕЙ | 2006 |
|
RU2348423C2 |
| СПОСОБ ЛЕЧЕНИЯ АТОПИЧЕСКОГО ДЕРМАТИТА У ДЕТЕЙ ПРИ ДИАГНОСТИРОВАННОЙ ЦИТОМЕГАЛОВИРУСНОЙ ИНФЕКЦИИ | 2007 |
|
RU2402776C2 |
Авторы
Даты
2022-03-24—Публикация
2017-06-07—Подача