Настоящее изобретение относится к промотору, обладающему органоспецифической активностью у растений, его применению, а также трансгенным растениям.
Согласно Nilson (2000), с точки зрения запасающей способности растения, представляющие пищевую ценность, могут быть разделены на 3 группы. Урожай, собираемый с первой группы, к которой относятся такие растения как капуста, брокколи, цветная капуста, спаржа и шпинат, включает в себя листья, побеги, цветы и почки. Части этих растений обладают низкой способностью сохранять воду и демонстрируют быстрое увядание после сбора урожая. Ко второй группе принадлежат растения с мясистыми плодами, такие как, например томат, тыква и груши. Плоды этих растений демонстрируют созревание и увядание во время хранения. К третьей группе растений относят двухгодичные растения. Растения с двухгодичным жизненным циклом, такие как сахарная свекла, цикорий, морковь, лук или артишок, в течение первого года развивают запасающий орган, который на второй год способствует образованию листьев и семян.
Запасающие органы подвергаются многочисленным физиологическим изменениям, происходящим после сбора урожая, которые оказывают влияние на качество запасающих органов и количество содержащихся в них веществ. Физиологические изменения могут быть следствием механической обработки во время выкапывания, например повреждений и ушибов, а также последствием хранения и связанной с этим потери воды, вынужденного или естественного состояния покоя или результатом адаптации к холоду.
Для того чтобы в запасающем органе могли произойти изменения обмена веществ после сбора урожая, необходим целенаправленный процесс, который предпочтительно будет регулироваться специфическим промотором. При этом известны гены, которые активируются в побегах спаржи или в цветах брокколи после сбора урожая. Напротив, в запасающих органах растений такие гены не известны, так что указания на подходящие промоторы до сих пор отсутствовали.
Таким образом, задача настоящего изобретения заключается в получении такого промотора, с помощью которого можно будет оказывать влияние на физиологические изменения обмена веществ в запасающих органах растений после сбора урожая. В соответствии с изобретением, решение поставленной задачи осуществляют с помощью промотора, обладающего отличительными признаками по п.1.
Прежде всего, будут пояснены некоторые термины, которые применяются в данной заявке:
В контексте данного изобретения запасающие органы растения представляют собой органы, которые служат для запасания углеводов, таких как сахароза, крахмал или инулин, и/или азотистых соединений, таких как белки и аминокислоты. Типичным запасающим органом, например, является корень или гипокотиль. Запасающие органы в виде побега представляют собой клубни картофеля, топинамбура и сухие стебли сахарного тростника. Также запасающими органами являются корневые клубни, которые встречаются у ямса, маниоки и батата.
Жизненный цикл двухлетних растений происходит в течение двухгодичного периода развития. В течение первого года у растения образуется запасающий орган. На второй год происходит формирование цветов и семян с использованием резервных веществ запасающего органа.
Под промотором понимают последовательность нуклеиновой кислоты, которая при необходимости управляет экспрессией гена в зависимости от эндогенных и экзогенных факторов. К таким факторам относятся, например, индукторы, репрессоры и похожие ДНК-связывающие белки, а также влияние со стороны внешней среды. Один промотор может состоять из множества элементов. Тем не менее, он включает в себя, по меньшей мере, один регуляторный элемент, отвечающий за транскрипцию генов, находящихся под его контролем.
Промотор, который в каком-либо запасающем органе более активен после сбора урожая, чем до сбора, то есть, активность которого является индуцируемой, демонстрирует, например, в собранных корнях активность, измеряемую с помощью РНК-блоттинга, которая при сопоставимых условиях исследования в корнях до сбора урожая обнаруживается как менее 20%, предпочтительнее менее 10% и в особенности менее 5%. Эта специфичность может возникать сначала спустя некоторое время после выкапывания и во время хранения.
"Производным" промотора является укороченный или удлиненный или идентичный отдельными частями вариант или гомолог этого промотора, обладающий теми же или по существу тем же свойствами.
"Прямое противогрибковое или антибактериальное действие" означает, что генные продукты обладают непосредственным противогрибковым действием, при котором они, например, разрушают клеточную стенку или кодируют синтазы фитоалексина или метаболиты, которые вмешиваются в обмен веществ грибов или бактерий, препятствуя ему.
"Непрямое противогрибковое или антибактериальное действие" означает, что генные продукты активируют гены защиты растения. К таким генам относятся, например гены устойчивости, компоненты трансдукции сигналов (такие как киназы, фосфатазы), транскрипционные факторы или ферменты, продуцирующие сигнальные вещества (такие как ферменты, приводящие к образованию этилена, салициловой кислоты или жасмоната, ферменты, приводящие к образованию реактивных форм кислорода, ферменты, приводящие к образованию монооксида азота).
Под "заражением" понимают минимальное время, за которое после проникновения в ткань хозяина будет подготовлен обмен веществ гриба (или рост грибов). К нему относится, например развитие гифов или образование специфичных инфицирующих структур, таких как проникающие гифы и апрессории.
Термин "гомология" здесь означает, по меньшей мере, 70% гомологию области ДНК, которая может быть определена с использованием известных способов, например, путем компьютерного сравнения последовательностей (S. F. Altschul et al., 1990, Basic Local Alignment search tool, J.Mol. Biol. 215: 403-410).
"Комплементарная последовательность нуклеотидов" означает в отношении двухцепочечной ДНК, что одна из цепей ДНК, комплементарная второй цепи ДНК, имеет нуклеотидные последовательности, которые соответствуют основаниям первой нити согласно основным правилам спаривания оснований.
Применяемый здесь термин "гибридизировать" означает гибридизацию в обычных условиях, которые описаны в Sambrook et al. (1989), предпочтительно в строгих условиях. Строгие условия гибридизации представляют собой, например, гибридизацию в 4×SSC (раствор хлорида и цитрата натрия - sodium chloride - sodium citrate) при 65°С и последующую многократную отмывку в 0,1×SSC при 65°С в течение, в общей сложности, одного часа. Менее строгие условия представляют собой, например, гибридизацию в 4×SSC при 37°С и последующую многократную отмывку в 1×SSC при комнатной температуре. "Строгие условия гибридизации" также могут означать гибридизацию при 68°С в 0,25 М фосфате натрия, рН 7,2, 7% додецилсульфате натрия (SDS - sodium dodecyi sulphate), 1 мМ этилендиаминтетрауксусной кислоте (ЭДТА) и 1% бычьем сывороточном альбумине (БСА) в течение 16 часов с последующей двукратной отмывкой 2×SSC и 0,1% SDS при 68°С.
Изобретение далее будет подробнее пояснено со ссылкой на фигуры и примеры.
Промотор по настоящему изобретению активен в запасающих органах растений, таких как корень сахарной свеклы, моркови и цикория или клубни картофеля, после сбора урожая. Напротив, перед сбором урожая в запасающих или других органах не обнаруживают никакой активности или обнаруживают очень низкую активность. Это свойство можно использовать для улучшения обмена веществ в запасающих органах после сбора урожая. Применяя этот промотор, можно получать также трансгенные растения и такие части этих растений, как семена.
Предпочтительно активность промотора по изобретению в запасающих органах может быть выявлена с помощью РНК-блоттинга, которая при сопоставимых условиях исследования в запасающих органах до сбора урожая обнаруживается как менее 20%, предпочтительно менее 10% и в особенности менее 5%.
В следующем воплощении изобретения промотор включает
а) последовательность нуклеотидов в соответствии с SEQ ID NO:1 или
б) последовательность нуклеотидов в соответствии с SEQ ID NO:2 или
в) последовательность нуклеотидов в соответствии с SEQ ID NO:3 или
г) последовательность нуклеотидов в соответствии с SEQ ID NO:4 или
д) последовательность нуклеотидов в соответствии с SEQ ID NO:5 или
е) последовательность нуклеотидов, комплементарную последовательностям нуклеотидов с а) по д) или
ж) последовательность нуклеотидов, которая гибридизируется с одной из последовательностей нуклеотидов с а) по е).
Также могут быть предсказаны производные такого промотора. Такие производные подробнее определены ниже и включают в себя также ДНК-фрагменты промотора, как они изображены на картах рестрикции, а также ДНК-фрагменты, которые могут быть получены при применении не указанных специально имеющихся в продаже рестрикционных эндонуклеаз.
Настоящее изобретение также относится к трансгенным растениям, которые трансформированы с помощью промотора по настоящему изобретению.
Настоящее изобретение также относится к применению промотора по настоящему изобретению или производных для получения трансгенных растений, обладающих одним или более из следующих свойств:
а) улучшенным обменом углеводов в запасающих органах после сбора урожая
б) улучшенным метаболизмом азота в запасающих органах после сбора урожая
в) улучшенной устойчивостью к стрессу вследствие высыхания и улучшенным водным статусом в запасающих органах после сбора урожая
г) улучшенной холодо- и морозостойкостью в запасающих органах после сбора урожая
д) улучшенной устойчивостью/толерантностью против патогенов в запасающих органах после сбора урожая
е) улучшенным вторичным обменом веществ в запасающих органах после сбора урожая.
Промотор по настоящему изобретению может быть использован также для расщепления сахара в созревшей сахарной свекле и сокращения или увеличения накопления инвертированного сахара. Для этого в созревший корень вводят, например ингибиторы инвертаз, и активность клеточных инвертаз подавляется.
Промотор по настоящему изобретению также может быть использован для достижения усиленного использования инулина и продукции длинноцепочечных молекул инулина в корне цикория. Для этого снижают или предотвращают разрушение инулина в созревшем цикории, в котором снижена активность фруктозилэкзогидролазы в корне после сбора урожая путем введения антисмысловой или интерференционной РНК.
Промотор по настоящему изобретению также может быть использован для снижения "сладости из-за хранения в холоде" у созревших и хранящихся клубней картофеля. Для этого в созревшие клубни вводят ингибиторы инвертаз, и активность клеточных инвертаз подавляется.
Далее, промотор по настоящему изобретению также может быть использован для снижения содержания экстрагируемого "вредного азота", такого как аминокислоты, в запасающих органах растений после сбора урожая. Повышенная концентрация соединений азота в запасающих органах часто снижает питательно-физиологическую ценность продуктов урожая или затрудняет выделение запасных питательных веществ, таких как сахароза, из корней сахарной свеклы. Уменьшение уровня экстрагируемого "вредного азота" в корне может быть достигнуто путем усиленного включения аминокислот в белки в запасающих органах, опосредуемого действием промоторов. В противоположность аминокислотам белки могут осаждаться во время получения сахара из сахарной свеклы и поэтому они не являются экстрагируемыми.
Промотор по настоящему изобретению также может быть использован для улучшения холодо- и морозостойкости запасающих органов. Для этого, например, с помощью промотора обеспечивают экспрессию транскрипционных факторов, отвечающих за устойчивость к холоду или морозу, или белков, обеспечивающих защиту от холода или мороза.
С помощью промотора по настоящему изобретению также может быть улучшена устойчивость созревших запасающих органов к болезням. Многочисленные почвенные грибы, такие как представители вида Fusahum spp., или бактерии, такие как Erwinia carotovora, возбудитель влажного гниения картофельных клубней, могут инфицировать созревшие запасающие органы. С помощью комбинации индуцибельного промотора с геном, продукт которого осуществляет прямое или непрямое противогрибковое или антибактериальное действие, могут обеспечивать устойчивость к грибам или бактериям и улучшать способность запасающих органов к хранению.
Наконец, промотор по настоящему изобретению также может быть использован для улучшения вторичного обмена веществ в запасающих органах. Клубни картофеля являются важнейшим источником витамина С в центральной Европе. Содержание витамина С в клубнях уменьшается во время хранения. С помощью промоторов расщепление витамина могут предотвращать или, по крайней мере, снижать.
Графические материалы
На Фиг.1 с помощью РНК-блоттинга показана индукция гена PHI (postharvest induced - индуцируемый после сбора урожая) 7, 20, 153 и 227 сахарной свеклы после сбора урожая корней свеклы. Была проанализирована экспрессия генов в листьях и корнях сахарной свеклы непосредственно перед созреванием (0 д) и затем в различные моменты времени после созревания. Для этого корни хранили в течение 1, 4, 7, 14, 21, 28 и 35 дней при 17°С или 1, 4 и 14 дней при 26-28°С. В каждом случае 10 мкг тотальной РНК на каждый момент времени разделяли в денатурирующем агарозном геле с добавлением формальдегида и гибридизировали с кДНК-фрагментом генов PHI7, PHI20, РН1153 и PHI227.
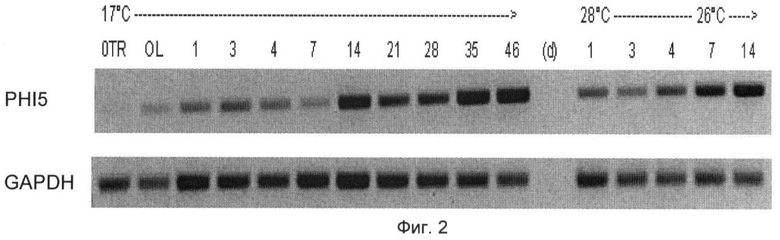
На Фиг.2 с помощью полимеразной цепной реакции с обратной транскриптазой показана индукция гена PHI (индуцируемый после сбора урожая) 5 в корнях после сбора урожая сахарной свеклы. Транскрипт PHI5 выявляется очень слабо в корнях свеклы и слабо в листьях непосредственно перед созреванием (0 д). В кДНК-библиотеках, выделенных из РНК корней, хранящихся в течение 1, 4, 7, 14, 21, 28, 35 и 46 дней при 17°С или 1, 3, 4, 7 и 14 дней при 26-28°С, выявили большое количество транскрипта PHI5. Индикатор экспрессии генов глицеролальдегид-3-фосфатдегидрогеназы (GAPDH - glyceraldehyde-3-phosphate dehydrogenase) демонстрирует, что для полимеразной цепной реакции с обратной транскриптазой использовали одинаковые количества кДНК.
На Фиг.3 показан вектор гена-репортера PHI5-luc-kan с трансляционным слиянием между промотором PHI5 и геном люциферазы Photinus pyralis. Промотор PHI5 занимает в векторе PHI5-luc-kan нуклеотидные позиции 1-1587 нуклеотидной последовательности SEQ ID NO:1 и может быть выделен из вектора с помощью HindIII и BspHI и комбинирован с другими генами.
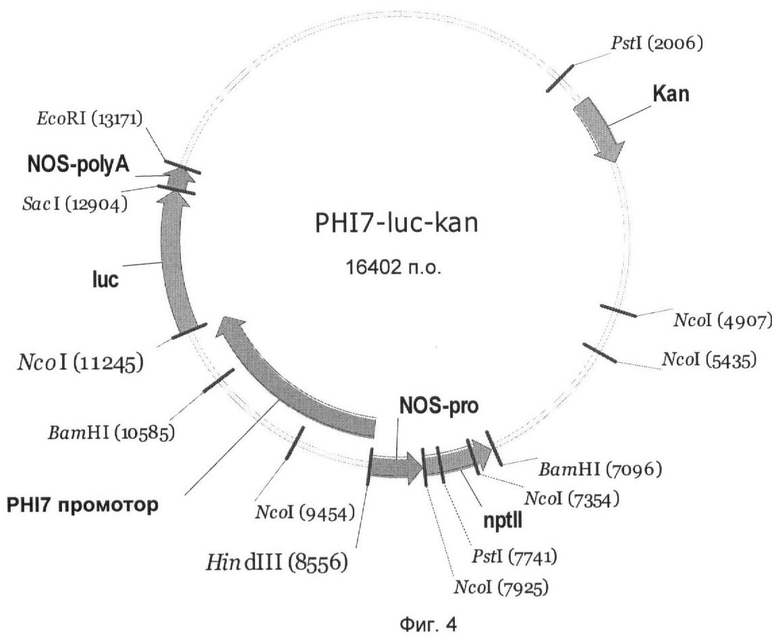
На Фиг.4 показан вектор гена-репортера PHI7-luc-kan с трансляционным слиянием между промотором PHI7 и геном люциферазы Photinus pyralis. Промотор PHI7 занимает в векторе PHI7-luc-kan нуклеотидные позиции 1-2695 нуклеотидной последовательности SEQ ID NO:2 и может быть выделен из вектора с помощью HindIII и NcoI и комбинирован с другими генами.
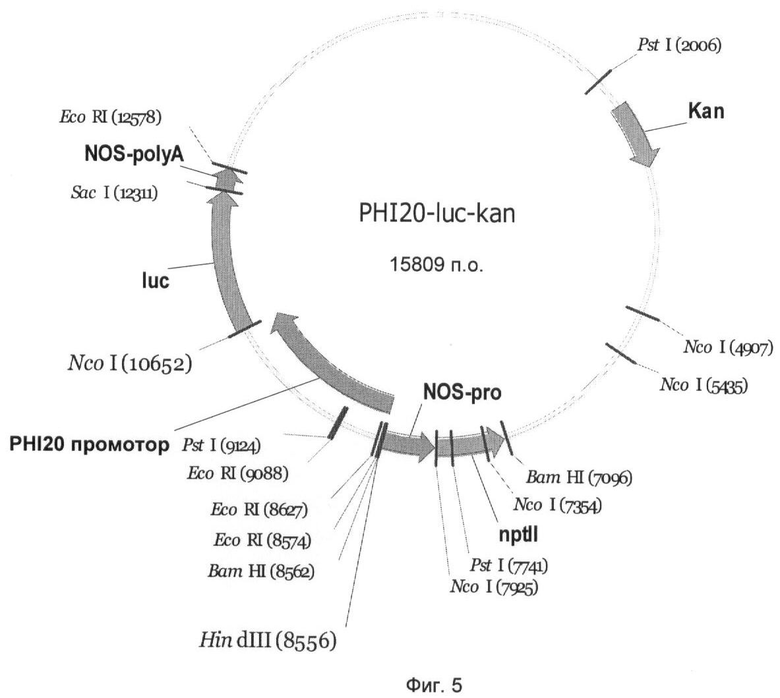
На Фиг.5 показан вектор гена-репортера PHI20-luc-kan с трансляционным слиянием между промотором PHI20 и геном люциферазы Photinus pyralis. Промотор PHI20 занимает в векторе PHI20-luc-kan нуклеотидные позиции 1-2102 нуклеотидной последовательности SEQ ID NO:3 и может быть выделен из вектора с помощью HindIII и NcoI и комбинирован с другими генами.
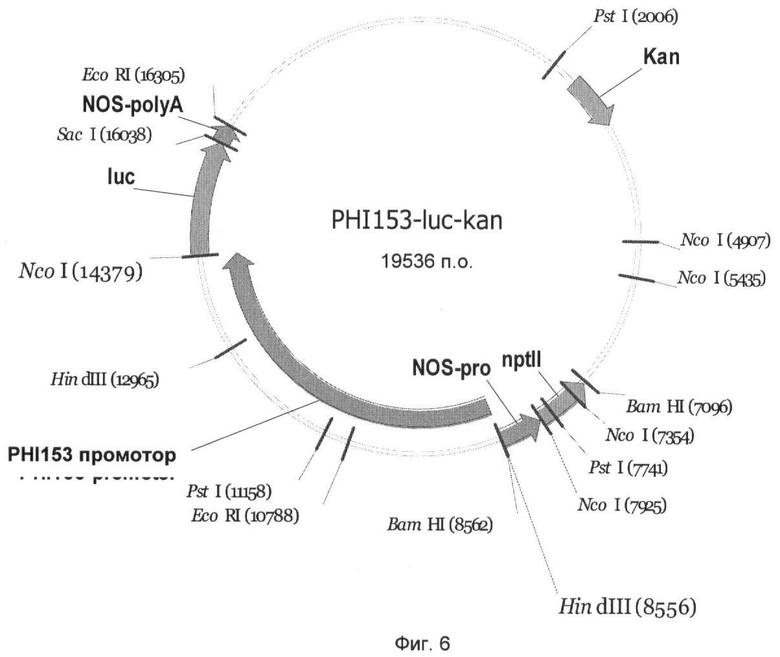
На Фиг.6 показан вектор гена-репортера PHI153-luc-kan с трансляционным слиянием между промотором PHI153 и геном люциферазы Photinus pyralis. Промотор PHI153 занимает в векторе PHI153-luc-kan нуклеотидные позиции 1-5829 нуклеотидной последовательности SEQ ID NO:4 и может быть выделен из вектора с помощью HindIII и NcoI и комбинирован с другими генами.
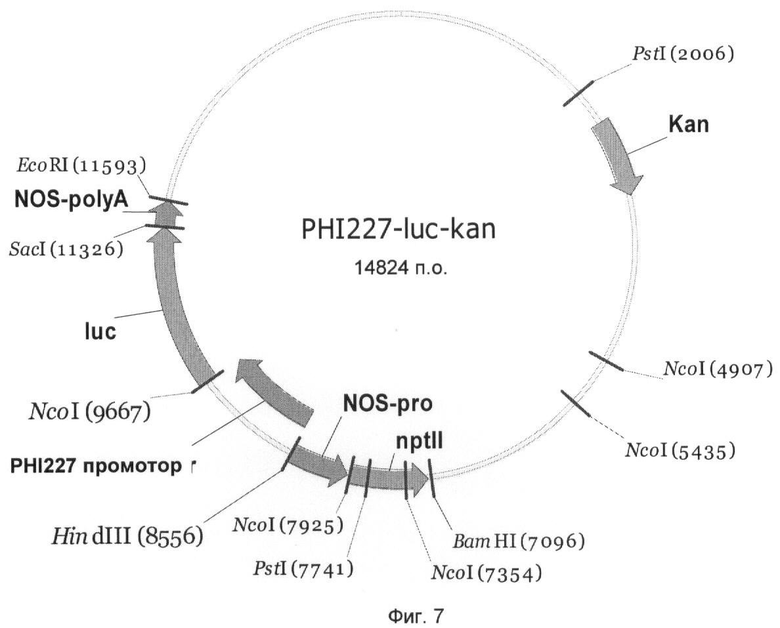
На Фиг.7 показан вектор гена-репортера PHI227-luc-kan с трансляционным слиянием между промотором PHI227 и геном люциферазы Photinus pyralis. Промотор PHI227 занимает в векторе PHI227-luc-kan нуклеотидные позиции 1-1117 нуклеотидной последовательности SEQ ID NO:5 и может быть выделен из вектора с помощью HindIII и NcoI и комбинирован с другими генами.
Доказательство индукции экспрессии генов PHI 7, 20, 154 и 227 в собранных корнях сахарной свеклы
Сахарную свеклу сеяли в поле весной и культивировали в соответствии с общеупотребительной сельскохозяйственной практикой. Запасающие корни растений в возрасте 24 недель собирали осенью, и их поверхность повреждали путем обработки в промышленной бетономешалке (Attika) в течение 30 с для того, чтобы вызвать типичные повреждения и удары, которые причиняет механическая уборка. Затем, одни запасающие органы хранили при 17°С, а другие при 26-28°С. Из свекл, которые хранили при 17°С, на 1, 3, 4, 7, 14, 21, 28, 35 и 46 день после сбора урожая, и из свекл, которые хранили при 26-28°С, на 1, 3, 4, 7, и 14 день после сбора урожая, отбирали по 5 свекл и выделяли тотальную РНК в соответствии с Logemann et al. (1987).
Исследование экспрессии генов, индуцируемой после сбора урожая, осуществляли с помощью РНК-блоттинга в соответствии с Sambrook et al. (1989). Для этого в каждом случае в денатурирующем агарозном геле с формальдегидом разделяли по 10 мкг тотальной РНК из листьев и свекл, которые были выкопаны непосредственно перед сбором урожая (0 д), а также РНК из свекл, которые хранили в течение 1-35 дней. Разделенную при помощи электрофореза РНК наносили на нейлоновую мембрану Hybond N (Amersham Pharmacia Biotech, Freiburg) с помощью техники капиллярного блоттинга. Радиоактивное мечение кДНК-клона гена PHI 7, 20, 153 и 227 (в каждом случае 20 нг) осуществляли с использованием 50 мКи 32Р-дАТФ (6000 Ки/мМоль, Amersham Pharmacia Biotech, Freiburg) с помощью набора случайных праймеров Prime-It II (Stratagene GmbH, Heidelberg) в соответствии с указаниями производителя. Наконец, РНК-фильтр гибридизовали с мечеными зондами, отмывали и проявляли на рентгеновской пленке.
Перед сбором урожая ген PHI7 не экспрессировался в листьях и очень слабо экспрессировался в запасающем корне. После сбора урожая и при хранении происходила сильная индукция гена PHI7 в корне. Индукция была сильнее при 28°С, чем при 17°С (Фиг.1).
Перед сбором урожая ген PHI20 слабо экспрессировался и в листьях и в корнях сахарной свеклы. После сбора урожая и при хранении происходила значительная и длительная индукция гена PHI20 в запасающих органах. Индукция была сопоставима при 17°С и 28°С (Фиг.1).
Ген PHI153 не экспрессировался перед сбором урожая ни в листьях, ни в запасающем корне сахарной свеклы. После сбора урожая и при хранении происходила значительная индукция гена PHI153 в корне. Индукция была сопоставима при 17°С и 28°С (Фиг.1).
Перед урожаем ген PHI227 слабо экспрессировался и в листьях и в корнях сахарной свеклы. После урожая и при хранении происходила значительная индукция и сильная длительная экспрессия гена PHI227 в корне. Индукция была сопоставима при 17°С и 28°С (Фиг.1).
Доказательство индукции экспрессии гена PHI5 в собранных корнях сахарной свеклы
Для того, чтобы доказать индукцию экспрессии PHI5 после сбора урожая в корнях сахарной свеклы, провели полимеразную цепную реакцию с обратной транскриптазой. Из 5 мкг тотальной РНК, выделенной из листьев и корней, которые были взяты с поля непосредственно перед сбором урожая (0 д), получили кДНК-библиотеки с помощью набора для синтеза кДНК RevertAid H Minus (MBI Permentas) в соответствии с указаниями производителя. Остальные кДНК-библиотеки были получены из РНК, выделенных из свеклы, которую хранили в течение 1, 3, 4, 7, 14, 21, 28, 35 и 46 дней при 17°С и которую хранили в течение 1, 3, 4, 7 и 14 дней при 26-28°С. Экспрессию гена показали с использованием праймеров PHI5-1 (GTG САА GGA ТТС TGG САС CCG TCG GTG G) и PHI5-2 (СТА TGG GCC GCG GCA GAT CCA GGT AGC G) с помощью Taq-полимеразы (Q-Biogene) в соответствии и указаниями производителя. Для контроля выявляли экспрессию гена глицеролальдегид-3-фосфатдегидрогеназы (GAPDH) с праймерами GAPDH-1 (ATG TTT AAG TAG GAC AGT GTT САС G) и GAPDH-2 (ATG TGA AGG TCT GAC TTG TAT TCG Т) для уверенности, что для полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР) использовали одинаковые количества кДНК.
С помощью исследования методом ОТ-ПЦР показали, что перед сбором урожая (0 д) ген PHI5 слабо экспрессируется в листьях и очень незначительно в корнях. В свекле, которую хранили при 17°С и 28°С, показали значительную экспрессию и индукцию гена PHI5 в запасающих органах после сбора урожая и во время хранения (Фиг.2). В свекле, которую хранили при 17°С, через 1-7 дней после сбора урожая четко показали более слабую экспрессию гена PHI5, чем после 14-46 дней. В свекле, которую хранили при 26-28°С, на 1 и 3 день после сбора урожая четко показали более слабую экспрессию гена PHI5, чем на 4, 7 и 14 день. Экспрессия гена GAPDH была одинаковой во всех образцах (Фиг.2). Эти результаты показывают, что экспрессия гена PHI5 индуцируется после сбора урожая. Однако в первый день хранения индукция, которая была физиологически вызвана последствиями механического выкапывания, отчетливо слабее по сравнению с периодом более позднего хранения и связанными с этим физиологическими изменениями.
Классификация промоторов PHI
Все из перечисленных промоторов PHI5, PHI7, PHI20, РНН 53 и PHI227 были индуцированы после сбора урожая в корне сахарной свеклы в результате процесса сбора урожая и последующего хранения запасающих органов (Фиг.1 и 2). Наряду с этим главным свойством индуцироваться после сбора урожая, эти пять промоторов различаются по основной активности перед сбором урожая, влиянию на них выкапывания и влиянию хранения на кинетику индукции, а также влиянию температуры хранения на силу индукции промотора. Эти различия позволяют выделить четыре подкласса промоторов, индуцируемых после урожая.
Промотор PHI153 принадлежит к первому подклассу PHI-промоторов, для представителей которого не были выявлены транскрипты генов в запасающих органах перед сбором урожая.
Промоторы PHI20 и PHI227 принадлежат ко второму классу PHI-промоторов, которые проявляют слабую активность перед сбором урожая, и индукция которых была одинаково сильной после сбора урожая как при пониженной (17°С), так и при повышенной температуре (28°С).
Промотор PHI7 принадлежит к третьему подклассу промоторов, представители которого проявляли слабую активность в запасающих органах перед сбором урожая, и индукция промоторов этого подкласса была отчетливо более сильной при повышенной температуре (28°С), чем при пониженной (17°С).
Промотор PHI5 принадлежит к четвертому подклассу PHI-промоторов, которые проявляют слабую активность в запасающих органах перед сбором урожая, и активность которых из-за механических последствий сбора урожая являлась умеренной, а во время хранения вырастала сильнее.
Слияние промоторов PHI5, PHI7, PHI20, PHI153 и PHI227 с геном люциферазы Photinus pyralis
Чтобы выявить активность промоторов PHI5, PHI7, PHI20, PHI153 и PHI227 в сахарной свекле, их сливали с геном люциферазы Photinus pyralis и трансформировали ими сахарную свеклу. Для этого промотор PHI5 как фрагмент HindIII-BspHI, и промоторы PHI7, PHI20, PHI153 и PHI227 как фрагменты HindIII-NcoI клонировали в бинарном векторе pGPTV-kan (Becker et al., 1992).
Созданные векторы получили названия PHI5-luc-kan (Фиг.3), PHI7-luc-kan (Фиг.4), PHI20-luc-kan (Фиг.5), PHI153-luc-kan (Фиг.6) и PHI227-luc-kan (Фиг.7). Бинарными векторами трансформировали штамм Agrobacterium tumefaciens C58C1 с резидентной плазмидой pGV2260 с помощью способа прямой трансформации ДНК (An, 1987). Селекцию рекомбинантного клона A. tumefaciens осуществляли с применением антибиотика канамицина (50 мг/л).
Трансформацию сахарной свеклы осуществляли в соответствии с Lindsey et al. (1991) с применением антибиотика канамицина. Трансгенность растений проверяли с помощью ПЦР. Применение праймера GTG GAGAG G CTATTCG GTA и CCACCATGATATTCGGCAAG приводило к амплификации фрагмента ДНК размером 553 п.о. с гена nptll. ПЦР осуществляли с использованием 10 нг геномной ДНК при концентрации праймеров 0,2 мкМ с температурой отжига 55°С в мультициклере РТС-200 (MJ Research, Watertown, USA).
Ген люциферазы вектора PHI5-luc-kan (Фиг.3) может высвобождаться как фрагмент BspHI-SacI, а гены люциферазы векторов PHI7-luc-kan (Фиг.4), PHI20-luc-kan (Фиг.5), PHI153-luc-kan (Фиг.6) и PHI227-luc-kan (Фиг.7) могут высвобождаться как фрагмент NcoI-SacI и замещаться на другой экспрессирующийся ген, такой как, например, ингибитор инвертазы. Для этого экспрессирующийся ген должен быть представлен также в виде фрагмента NcoI-SacI. Альтернативно, промотор PHI5 как фрагмент HindIII-BspHI, и промоторы PHI7, PHI20, РНМ 53 и PHI227 как фрагменты HindIII-NcoI могут быть выделены и введены в подходящие экспрессионный векторы.
Доказательство активности промотора PHI5 в хранящихся корнях сахарной свеклы
Трансгенную сахарную свеклу, которую трансформировали конструкцией гена-репортера PHI5-luc-kan, высаживали в тепличных условиях. Растения собирали в возрасте двадцати недель, и корни хранили в течение шести недель. Активность промоторов анализировали в корнях и листьях перед сбором урожая и через каждую неделю в хранящихся корнях, измеряя ген-репортер.
Активность люциферазы Photinus pyralis определяли посредством системы выявления люциферазы Lucifearse Assay System (Promega, Mannheim, Deutschland) в люминометре Sirius (Berthold Detection System GmbH, Pforzheim, Deutschland) в соответствии с указаниями производителя. Для получения экстракта фермента, подходящего для измерения, определяли, прежде всего, массу образцов ткани. Образцы листьев гомогенизировали с добавлением морского песка в 10 объемах (об./масс.) пассивного лизирующего буфера (ПЛБ) в ступке, а пробы корней гомогенизировали в ручном кухонном блендере. Жидкий супернатант переносили в пробирки типа эппендорф объемом 1,5 мл и центрифугировали в течение 5 мин при 4°С и 20000 g. Прозрачный супернатант отбирали и использовали по 10 мкл диффузионного сока для измерения активности люциферазы Photinus.
В то время как промотор PHI5 перед сбором урожая был очень слабо активен в корнях и листьях, его активность увеличивалась до сильной или очень сильной в собранных и хранящихся корнях, взятых у 8 независимых трансформантов. В соответствии с результатами исследования с использованием гена-репортера и независимыми результатами ПЦР с обратной транскриптазой, активность промотора PHI5 в корнях сахарной свеклы после сбора урожая была индуцирована в значительной степени.
Трансгенные растения, обладающие особенными свойствами
С применением промоторов по настоящему изобретению могут быть получены трансгенные растения, обладающие особенными свойствами:
а) улучшенным обменом углеводов в запасающих органах после сбора урожая
б) улучшенным метаболизмом азота в запасающих органах после сбора урожая
в) улучшенной устойчивостью к стрессу вследствие высыхания и улученным водным статусом в запасающих органах после сбора урожая
г) улучшенной холодо- и морозостойкостью в запасающих органах после сбора урожая
д) улучшенной устойчивостью/толерантностью против патогенов в запасающих органах после сбора урожая
е) улучшенным вторичным обменом веществ в запасающих органах после сбора урожая.
Улучшенный обмен углеводов в запасающих органах растений после сбора урожая
Метаболизм углеводов в запасающем органе растений можно быть многосторонне улучшить, применяя промоторы по настоящему изобретению. Механические повреждения во время выкапывания и физиологические изменения при хранении сахарной свеклы и моркови приводят после сбора урожая к усиленному гидролизу и выпариванию сахарозы и накоплению инвертированного сахара (Burba 1973, Smed et at., 1996, Galindo et al., 2004). Возникающие потери сахара в объеме 0,01-0,025% в день снижают количество сахара, выделяемого из сахарной свеклы. Образование инвертированного сахара приводит к технологическим трудностям при получении сахара в промышленном масштабе (Burba, 1976).
Промоторы по настоящему изобретению могут быть использованы для снижения гидролиза сахарозы и образования инвертированного сахара. Для этого после сбора урожая могут усиливать экспрессию подходящих ингибиторов инвертаз или снижать экспрессию генов эндогенных синтаз сахарозы или гена инвертазы с помощью введения антисмысловой или интерференционной РНК.
Промоторы по настоящему изобретению также могут быть использованы для увеличения продукции полифруктанов, таких как инулин, и обеспечения продукции длинноцепочечных инулиновых молекул в корнях цикория. Для этого в собранном цикории могут сокращать или предотвращать распад инулина путем снижения активности фруктозилэкзогидролазы в корнях после сбора урожая с помощью введения антисмысловой или интерференционной РНК.
Улучшенный метаболизм азота в запасающих органах после сбора урожая
Промоторы по настоящему изобретению могут применяться для снижения содержания экстрагируемого "вредного" азота, такого как аминокислоты, в запасающих органах растений после сбора урожая. Повышенная концентрация соединений азота в запасающих органах часто снижает питательную ценность продуктов сбора урожая или усложняет выделение запасных веществ, таких как сахароза, из сахарной свеклы. Усиливая экспрессию соответствующих ферментов, транскрипционных факторов, запасаемых белков и т.п., достигают усиления включения аминокислот в состав белков. Во время производства сахара в противоположность неэкстрагируемым аминокислотам белки могут быть выделены из сахарной свеклы.
Повышение устойчивости запасающих органов против почвенных фитопатогенных грибов и бактерий
Промотор по настоящему изобретению в комбинации с геном или несколькими генами также может применяться для проявления прямого или непрямого противогрибкового действия в запасающих органах растений. Противогрибковое действие приводит к повышенной устойчивости или толерантности против грибов после сбора урожая и во время хранения.
Для этого промотор трансляционно или транскрипционно сливают с генами защиты от патогенов, генные продукты которых обладают прямым или непрямым противогрибковым или антибактериальным действием. Комбинации промотор-ген внедряют в бинарный трансформационный вектор pGPTV и вводят в сахарную свеклу, морковь и картофель путем трансформации, опосредованной A. tumefaciens. Трансгенность растений проверяют с помощью ПЦР, как было описано выше, а экспрессию гена в корнях или клубнях проверяют с помощью РНК-блоттинга. В тестах на устойчивость выявляют повышенную устойчивость против грибов или бактерий в запасающих органах.
Неожиданно оказалось, что экспрессия генов защиты от патогенов, индуцированная после сбора урожая, не приводит к часто наблюдаемой низкорослости или понижению урожайности, вызванных конститутивной экспрессией во время вегетативного развития растения (Heil and Baldwin, 2002).
Ссылки:
1. Altschul, S.F. et al. (1990). Basic Local Alignment search tool, J.Mol. Biol. 215: 403-410
2. An, G. (1987). Binary Ti vectors for plant transformation and promoter analysis. Methods Enzymol. 153, 292-305.
3. Becker D, Kemper E, Schell J, and Masterson R. (1992). New plant binary vectors with selectable markers located proximal to the left T-DNA border. Plant Mol Biol. 20(6): 1195-7.
4. Burba, M. (1976). Atmung und Saccharosestoffwechsel lagernder Zuckerrüben. Zeitschrift für die Zuckerindustrie 26: 647-658.
5. Galindo, F.G., Herppich, W., Gekas, V., and Sjöholm, I. (2004). Factors affecting quality and postharvest properties of vegetables: Integration of water relations and metabolism. Critical Reviews in Food Science and Nutrition 44:139-154.
6. Heil, M. and Baldwin, I. T. (2002). Fitness costs of induced resistance: emerging experimental support for a slippery concept. Trends Plant Sei. 2002 Feb; 7(2):61-7.
7. Lindsey, K1. Gallois, P., and Eady, C. (1991) Regeneration and transformation of sugar beet by Agrobacterium tumefaciens. Plant Tissue Culture Manual B7: 1-13; Kluwer Academic Publishers.
8. Logemann, E., Parniske. M., Hahlbrock, K. (1995). Modes of expression and common structural features of the complete Phenylalanine ammonia-lyase gene family in parsley. Proc Natl Acad Sci USA. 1995 92(13):5905-9.
9. Nilsson, T. (2000). Postharvest storage and handling of vegetables., In Fruit and Vegetable Quality (an integrated view), Seite 96-121. Herausgeber Shewfew, R. L. and Bruckner, В., Technomic Publishing Inc.
10. Sambrook, J., Fritsch, E..F., and Maniatis, T (1989). In Molecular Cloning, A Laboratrory Manual (Cold Spring Harbor Laboratory Press, New York).
11. Smed, E., Augustinussen, E., and Stensen, J. K. (1996). Loss of sugar in injured sugar beet losses from lifting, storing and washing. Proceedings of the 59th HRB Congress.
| название | год | авторы | номер документа |
|---|---|---|---|
| АУТОАКТИВИРУЮЩИЙСЯ БЕЛОК УСТОЙЧИВОСТИ | 2006 |
|
RU2375453C2 |
| ПАТОГЕН-ИНДУЦИРУЕМЫЙ СИНТЕТИЧЕСКИЙ ПРОМОТОР | 2007 |
|
RU2406761C2 |
| ЛЮЦИФЕРАЗЫ | 1995 |
|
RU2192467C2 |
| НОВЫЕ РАСТИТЕЛЬНЫЕ ЦИС-РЕГУЛЯТОРНЫЕ ЭЛЕМЕНТЫ ДЛЯ РАЗРАБОТКИ ПАТОГЕН-ЧУВСТВИТЕЛЬНЫХ ХИМЕРНЫХ ПРОМОТОРОВ | 2012 |
|
RU2660569C2 |
| РЕПОРТЕРНАЯ СИСТЕМА НА ОСНОВЕ ЛЕНТИВИРУСНЫХ РЕПОРТЕРНЫХ КОНСТРУКЦИЙ ДЛЯ ИЗУЧЕНИЯ БЕЛОК-БЕЛКОВЫХ ВЗАИМОДЕЙСТВИЙ | 2015 |
|
RU2639539C2 |
| МУТАНТНАЯ ЛЮЦИФЕРАЗА (ВАРИАНТЫ), ДНК, КОДИРУЮЩАЯ УКАЗАННУЮ ЛЮЦИФЕРАЗУ, И ВЕКТОР ДЛЯ ЭКСПРЕССИИ УКАЗАННОГО БЕЛКА | 1996 |
|
RU2210594C2 |
| ЛИНИЯ КЛЕТОК PIGAS, СОДЕРЖАЩАЯ СТАБИЛЬНО ИНТЕГРИРОВАННЫЙ В ГЕНОМ САЙТ СВЯЗЫВАНИЯ ТРАНСКРИПЦИОННОГО ФАКТОРА STAT-1 | 2015 |
|
RU2619643C1 |
| РЕГУЛЯТОРНЫЕ МОЛЕКУЛЫ НУКЛЕИНОВЫХ КИСЛОТ ДЛЯ УСИЛЕНИЯ СЕМЯ-СПЕЦИФИЧНОЙ И/ИЛИ СЕМЯ-ПРЕДПОЧТИТЕЛЬНОЙ ГЕННОЙ ЭКСПРЕССИИ В РАСТЕНИЯХ | 2010 |
|
RU2559534C2 |
| ИНДУЦИРУЕМАЯ ГЕРБИЦИДНАЯ УСТОЙЧИВОСТЬ | 1996 |
|
RU2181380C2 |
| НОВЫЕ ГЕНЫ РАСТЕНИЙ И ИХ ПРИМЕНЕНИЕ | 2000 |
|
RU2241749C2 |






Изобретение относится к биотехнологии. Описан промотор, обладающий органспецифической активностью в растениях, отличающийся тем, что он проявляет более высокую активность в запасающих органах растений при хранении при 17°С или 26-28°С, чем в других органах растений, и тем, что его активность после сбора урожая запасающих органов изменяется и является более высокой, чем до сбора урожая запасающих органов. Изобретение может быть использовано для получения промотора, с помощью которого можно оказывать влияние на физиологические изменения обмена веществ в запасающих органах растений после сбора урожая. 1 з.п. ф-лы, 7 ил.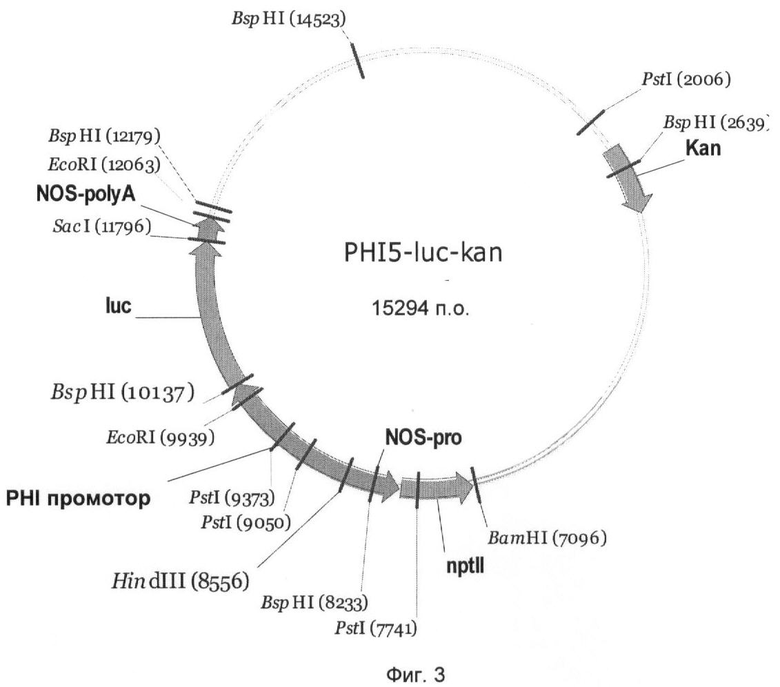
1. Промотор, обладающий органспецифической активностью в растениях, отличающийся тем, что он проявляет более высокую активность в запасающих органах растений при хранении при 17°С или 26-28°С, чем в других органах растений, и тем, что его активность после сбора урожая запасающих органов изменяется и является более высокой, чем до сбора урожая запасающих органов.
2. Промотор по п.1, отличающийся тем, что его активность в запасающих органах может быть измерена с помощью РНК-блоттинга, причем эта активность, выявляемая при сравнимых условиях исследования до сбора урожая запасающих органов, обнаруживается как менее 20%, предпочтительнее менее 10% и в особенности менее 5%.
| Бурильная установка | 1979 |
|
SU812917A1 |
| RU 94032101 A1, 27.05.1996. | |||
Авторы
Даты
2011-11-10—Публикация
2005-11-23—Подача