Изобретение относится к области синтеза 1,3-дикарбонильных соединений, конкретно к способу получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты формулы:
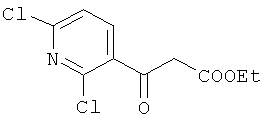
который находит применение как предшественник антибактериальных [Пат. US 3590036, C07D 213/50, C07D 213/61, C07D 213/64, C07D 213/73, C07D 213/74, C07D 213/77, C07D 213/85, C07D 471/04, C07D 213/00, C07D 471/00, (IPC1-7): C07D 39/10. Naphthyridine-3-carboxylic acids, their derivatives and preparation thereof/ Lesher G.Y., Gruett D. - 1971] и противоопухолевых производных 1,8-нафтиридина [Yasunori T. Synthesis and Structure-Activity Relationships of Novel 7-Substituted 1,4-Dihydro-4-oxo-1-(2-thiazolyl)-1,8-naphthyridine-3-carboxylic Acids as Antitumor Agents. Part 2 [Text] / T. Yasunori, T. Kyoji, S. Koh-ichiro et.al. // J. Med. Chem. - 2004. - Vol. 47. - P. 2097-2109].
Известен способ получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты путем взаимодействия калия 3-оксо-3-этоксипропаноата с 1-(2,6-дихлорникотиноил)-1H-имидазолом [Yasunori Т. Synthesis and Structure-Activity Relationships of Novel 7-Substituted 1,4-Dihydro-4-oxo-1-(2-thiazolyl)-1,8-naphthyridine-3-carboxylic Acids as Antitumor Agents. Part 2 [Text] / T. Yasunori, T. Kyoji, S. Koh-ichiro et.al. // J. Med. Chem. - 2004. - Vol.47. - P.2097-2109].
Этот способ реализуется путем последовательной обработки 2,6-дихлорникотиновой кислоты N,N'-карбонилдиимидазолом в смеси абсолютных ацетонитрила и тетрагидрофурана с образованием 1-(2,6-дихлорникотиноил)-1H-имидазола. Параллельно к суспензии калия 2-оксо-3-этоксипропаноата в абсолютном ацетонитриле при охлаждении льдом прибавляется безводный хлорид магния и триэтиламин и полученная смесь перемешивается 5 часов. После этого к реакционной массе прибавляется приготовленный, как описано выше, раствор 1-(2,6-дихлорникотиноил)-1H-имидазола в смеси абсолютного тетрагидрофурана и ацетонитрила. Реакционная масса перемешивается 15 часов. В ходе подкисления реакционной массы разбавленной соляной кислотой, последующей экстрактивной обработки этилацетатом получают технический продукт с выходом 93%. Дополнительная очистка полученного продукта достигается путем перегонки при пониженном давлении.
Этот способ характеризуется целым рядом существенных недостатков. Во-первых, для его реализации необходимо использование 1-(2,6-дихлорникотиноил)-1H-имидазола - дорогостоящего ацилирующего агента, получаемого in situ из 2,6-дихлорникотиновой кислоты и N,N'-карбонилдиимидазола. Во-вторых, синтез проводится в смеси безводных ацетонитрила и тетрагидрофурана, а экстрактивная обработка выполняется с применением этилацетата. В результате используются три различных органических растворителя, образующие смесь, не подлежащую регенерации. В-третьих, при проведении синтеза происходит побочное образование имидазола, который также не регенерируется.
Наиболее близким является способ получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты путем обработки калия 3-оксо-3-этоксипропаноата полученным in situ 2,6-дихлорникотиноилхлоридом (из 2,6-дихлорникотиновой кислоты и оксалилхлорида в дихлорметане) в присутствии хлорида магния и триэтиламина в безводном ацетонитриле [WO 2008/060693, 22.05.2008]. После отгонки растворителя реакционная масса разбавляется этилацетатом и обрабатывается соляной кислотой. Органическая фаза отделяется, промывается насыщенным раствором хлорида натрия, осушается сульфатом натрия и фильтруется. После отгонки растворителя в вакууме получается технический продукт с выходом 83%, который дополнительно очищается перекристаллизацией из смеси метанола и воды с образованием целевого вещества. Чистота получаемого вещества составляет 95%, а выход - 74%. Абсолютно идентичный способ описан также в другом литературном источнике [WO 2006/034113, 30.03.2006].
Предложенный метод обладает рядом существенных недостатков, снижающих его препаративную ценность.
Во-первых, для получения хлорангидрида 2,6-дихлорникотиновой кислоты используется дорогостоящий хлорирующий агент - оксалилхлорид. Во-вторых, в синтезе используется технический хлорангидрид без дополнительной очистки, что привносит в реакционную массу дополнительные примеси с предыдущей технологической стадии.
Во-вторых, для проведения синтеза используется ацетонитрил - токсичный растворитель, который неограниченно смешивается с водой. В связи с этим возникает необходимость предварительной отгонки растворителя от реакционной смеси в вакууме перед обработкой соляной кислотой. Это усложняет процесс выделения целевого вещества и делает его менее технологичным.
В-третьих, получаемый технический продукт требует дополнительной очистки, что еще более усложняет процесс его получения и приводит к снижению выхода.
Задачей предлагаемого технического решения является разработка нового технологичного способа получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты, позволяющего проводить синтез в мягких условиях с использованием доступных реагентов и получением целевого продукта с высокими выходом и степенью чистоты.
Техническим результатом является повышение технологичности синтеза, а также увеличение выхода и чистоты заявляемого соединения.
Предлагаемый технический результат достигается в способе получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты общей формулы:

заключающийся в ацилировании калия 3-оксо-3-этоксипропаноата 2,6-дихлорникотиноилхлоридом в присутствии безводного растворителя, триэтиламина и хлорида магния, с последующей обработкой реакционной массы водным раствором соляной кислоты и выделением целевого продукта, при этом в качестве растворителя используют этилацетат, при мольном соотношении 2,6-дихлорникотиноилхлорида:калия 3-оксо-3-этоксипропаноата, равном 1:1.4-1.6.
Сущностью предлагаемого способа является ацилирование калия 3-оксо-3-этоксипропаноата 2,6-дихлорникотиноилхлоридом в среде безводного этилацетата и кислотный гидролиз/декарбоксилирование полученного интермедиата синтеза:
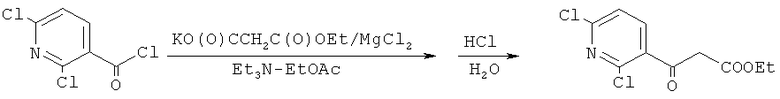
Преимуществом данного способа является возможность получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты с выходом, близким к количественному, не требующего дополнительной очистки. Кроме этого при проведении синтеза используется доступный ацилирующий агент - 2,6-дихлорникотиноилхлорид, а синтез проводится в этилацетате. Таким образом, растворитель после синтеза и экстракции удается практически полностью регенерировать, а также избежать использования дорогостоящего 1-(2,6-дихлорникотиноил)-1H-имидазола и N,N'-карбонилдиимидазола.
Предлагаемый способ осуществляется следующим образом.
Получение этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты.
К взвеси калия 3-оксо-3-этоксипропаноата в безводном этилацетате прибавляют безводный триэтиламин, охлаждают полученную смесь до 0°С и при перемешивании прибавляют к ней безводный хлорид магния. Реакционную массу перемешивают еще 15 мин при охлаждении и продолжают перемешивание при температуре 35-45°С 6 ч. После этого охлаждают полученную суспензию до -8°С. К охлажденной смеси при перемешивании в течение 15 минут прибавляют раствор свежеперегнанного 2,6-дихлорникотиноилхлорида в безводном этилацетате. Полученную смесь перемешивают еще 1 час при охлаждении, а затем еще сутки при комнатной температуре, после чего вновь охлаждают до -8°С. К охлажденной смеси медленно приливают 12%-ный водный раствор соляной кислоты, перемешивают еще 30 минут, отделяют органическую фазу, а водную извлекают этилацетатом. Объединенные органические вытяжки промывают водой до нейтральной среды, сушат безводным сульфатом магния, фильтруют через тонкий слой силикагеля для ТСХ и удаляют растворитель на водяной бане при пониженном давлении. В остатке получают чистый этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты в виде вязкого масла янтарного цвета.
Изобретение иллюстрируется следующими примерами.
Пример 1. Этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты.
К взвеси 13.6 г (0.08 моль) калия 3-оксо-3-этоксипропаноата в безводном этилацетате (125 мл) прибавляют безводный триэтиламин (28 мл, 20.3 г, 0.20 моль), охлаждают полученную смесь до 0°С и при перемешивании прибавляют к ней безводный хлорид магния (9.1 г, 0.096 моль). Реакционную массу перемешивают еще 15 мин при охлаждении и продолжают перемешивание при температуре 35-45°С 6 ч. После этого охлаждают полученную суспензию до -8°С. К охлажденной смеси при перемешивании в течение 15 минут прибавляют раствор свежеперегнанного 2,6-дихлорникотиноилхлорида (12 г, 57 ммоль) в безводном этилацетате (50 мл). Полученную смесь перемешивают еще 1 час при охлаждении, а затем еще сутки при комнатной температуре, после чего вновь охлаждают до -8°С. К охлажденной смеси медленно приливают 12%-ный водный раствор соляной кислоты (150 мл), перемешивают еще 30 минут, отделяют органическую фазу, а водную извлекают этилацетатом (3*75 мл). Объединенные органические вытяжки промывают водой до нейтральной среды, сушат безводным сульфатом магния, фильтруют через тонкий слой силикагеля для ТСХ и удаляют растворитель на водяной бане при пониженном давлении. В остатке получают чистый этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты в виде вязкого масла янтарного цвета.
Выход - 14.6 г (98%). Rf=0.79 (пластины NanoSILGUR 20/UV254, элюент - хлороформ - этилацетат (4:1, по объему)). Содержание основного вещества (по ВЭЖХ) - 97.1%.
1H-ЯМР-спектр (300 MГц, СDСl3) δ, м.д, 12.55 - 12.39 (м, 1 Н, ОН (енол)), 7.97-7.81 (м, 1 Н, С4H (ароматический)), 7.38-7.21 (м, 1 Н, С5H (ароматический)), 5.74-5.59 (м, 1 Н, СН (енол)), 4.25-4.09 (м, 2 Н, СН2СН3), 4.05-3.99 (м, 1 Н, СН2 (кето-форма)), 1.32-1.15 (м, 3 Н, CH2СН3).
Соотношения исходных реагентов: 2,6-дихлорникотиноилхлорид: калия 3-оксо-3-этоксипропаноат составляют 1:1.4.
Пример 2. Этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты.
Выполняют аналогично примеру 1 за исключением соотношения исходных реагентов: 2,6-дихлорникотиноилхлорид: калия 3-оксо-3-этоксипропаноат составляют 1:1.5.
Выход этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты - 96%.
Пример 3. Этиловый эфир 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты.
Выполняют аналогично примеру 1 за исключением соотношения исходных реагентов: 2,6-дихлорникотиноилхлорид: калия 3-оксо-3-этоксипропаноат составляют 1:1.6.
Выход этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты - 94%.
Как следует из представленных примеров, предложенный способ получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты является технологичным, позволяет получать целевой продукт в мягких условиях с использованием доступных реагентов с высокими выходом и степенью чистоты.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛОВОГО ЭФИРА 2-МЕТИЛ-3-ОКСО-4-(2,6-ДИФТОРФЕНИЛ)ПЕНТАНОВОЙ КИСЛОТЫ | 2012 |
|
RU2490252C1 |
| ПРОИЗВОДНЫЕ 4,1-БЕНЗОКСАЗЕПИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ СКВАЛЕНСИНТЕТАЗЫ У МЛЕКОПИТАЮЩИХ, СПОСОБ ИНГИБИРОВАНИЯ РОСТА ГРИБКОВ У МЛЕКОПИТАЮЩИХ | 1993 |
|
RU2145603C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ОКСО-4-ЦИАНО-1,2-ДИГИДРОПИРИДИН-3-КАРБОКСАМИДОВ | 2011 |
|
RU2475480C1 |
| ПРОИЗВОДНЫЕ ИЗОИНДОЛОНА В ВИДЕ (3 АR, 7 АR)- ИЛИ (3 АRS, 7 АRS)-ФОРМ ИЛИ ИХ СМЕСЕЙ ИЛИ ИХ ГИДРОХЛОРИДЫ, ЯВЛЯЮЩИЕСЯ АНТАГОНИСТАМИ ВЕЩЕСТВА Р | 1990 |
|
RU2012559C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛ 5-МЕТИЛ-3-(3-ФЕНОКСИФЕНИЛ)-1-ФЕНИЛ-1Н-ПИРАЗОЛИЛ-4-КАРБОКСИЛАТА | 2015 |
|
RU2582127C1 |
| ПРОИЗВОДНЫЕ ПИРИДОНКАРБОНОВОЙ КИСЛОТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2151770C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2124503C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3-ПРОПЕНИЛЦЕФЕМА ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1987 |
|
RU2010796C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-ЗАМЕЩЕННЫХ АЛКИЛ 3-ОКСОБУТАНОАТОВ | 2003 |
|
RU2254328C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОНТУРАЦЕТАМА ИЗ ФЕНИБУТА | 2024 |
|
RU2827339C1 |
Изобретение относится к области синтеза 1,3-дикарбонильных соединений, конкретно к способу получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты формулы:
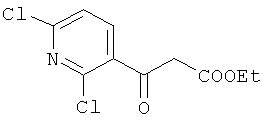
Способ заключается в ацилировании калия 3-оксо-3-этоксипропаноата 2,6-дихлорникотиноилхлоридом в присутствии безводного растворителя, триэтиламина и хлорида магния с последующей обработкой реакционной массы водным раствором соляной кислоты и выделением целевого продукта, отличающийся тем, что в качестве растворителя используют этилацетат, при этом мольное соотношение 2,6-дихлорникотиноилхлорида: калия 3-оксо-3-этоксипропаноата равно 1:1.4-1.6. Техническим результатом является повышение технологичности синтеза, а также увеличение выхода и чистоты заявляемого соединения.
Способ получения этилового эфира 3-оксо-3-(2,6-дихлорпиридин-3-ил)пропановой кислоты общей формулы

заключающийся в ацилировании калия 3-оксо-3-этоксипропаноата 2,6-дихлорникотиноилхлоридом в присутствии безводного растворителя, триэтиламина и хлорида магния, с последующей обработкой реакционной массы водным раствором соляной кислоты и выделением целевого продукта, отличающийся тем, что в качестве растворителя используют этилацетат, при этом мольное соотношение 2,6-дихлорникотиноилхлорида:калия 3-оксо-3-этоксипропаноата равно 1:1.4-1.6.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2011-12-10—Публикация
2010-07-19—Подача