Изобретение относится к биотехнологии, инженерной энзимологии и может быть использовано в производстве биопрепаратов. Полимеры находят все большее применение в медицине, в биопромышленности, в пищевой промышленности, в частности при иммобилизации ферментов. Под иммобилизацией ферментов понимается присоединение их молекул к поверхности носителя посредством физических или химических взаимодействий.
Применение ферментных препаратов в технологических процессах и использование его в медицине и ветеринарии в лечебных целях связано с нерациональной тратой фермента, используемого для определенной цели.
Обрабатываемый материал загрязняется ферментным препаратом, и проблема получения новых форм препарата многократного использования, то есть пролонгированного действия, весьма актуальна. Способ иммобилизации ферментов на полимерном носителе позволил разработать технологию получения энзима (на примере трипсина) пролонгированного действия, что сокращает объемы использования препарата, облегчает условия хранения его с сохранением высокой активности.
Изобретение относится к биотехнологии, инженерной энзимологии и может быть использовано в научно-исследовательской работе, в биологической промышленности при применении полимерных материалов в процессе иммобилизации ферментов. Известны различные способы иммобилизации фермента /1, 2/. Иммобилизация может быть осуществлена: физической или химической адсорбцией, ковалентным присоединением к растворимым и нерастворимым полимерам, сшивкой их белковых молекул, внедрением в гели, в мембраны. Известно включение фермента в структуру геля полиакриламида, пришивка фермента к полистиролу /1, 2/. Иммобилизованный трипсин получают путем связывания фермента с поликремниевой кислотой, с сывороточным альбумином с помощью глутарового альдегида, иммобилизации с применением порошка металлического титана. Недостатком таких способов является малая прочность фермента с носителем. Энзимная активность фермента зависит от ряда факторов - конформации их белковых молекул, внешнего и внутреннего торможения, стерического затруднения, стабильности при хранении и при повышении температуры, изменении рН среды и других факторов.
Известен способ получения иммобилизованного фермента (пероксидазы) на альгинатном волокне, который непрочен и обладает низкой активностью /3/. Указанный способ получения иммобилизованного фермента включает обработку полимерного носителя на основе модифицированного полистирола водным раствором энзима (пероксидазы хрена в присутствии бикарбоната натрия при 0-4°С с продолжительностью процесса 20 ч). Недостатками способа являются низкая удельная активность иммобилизованного фермента (пероксидазы), длительность и многостадийность процесса иммобилизации. Для повышения удельной активности препарата проводят модифицирование кремнеземного носителя 2-3% декстраном /3/. Недостатком этого технического решения является хрупкость материала, легко подвергающаяся абразивной эрозии, кремнеземные матрицы гидролитически нестабильны при щелочных значениях рН, адсорбционные свойства приводят к нежелательным эффектам неспецифической сорбции субстратов.
Известен способ /4/ иммобилизации путем обработки энзима (каталазы) иммуноглобулином и полистиролом, что приводит к устойчивости фермента и возможности его использования для многократного употребления. Способ ковалентного присоединения ферментов к поверхности носителя заключается в химической модификации фермента аналогом мономера. Недостатком является использование токсичных реагентов (на примере, хлорангидрида акриловой кислоты). При модификации путем внутримолекулярного сшивания фермента бифункциональными реагентами требуются дополнительная очистка фермента, проведение аллергологических и токсикологических исследований /4/.
Существует способ получения иммобилизованных ферментов с помощью реакции комплексообразования с полииодидами и молекулярным йодом. Активность ферментов после иммобилизации составляет 70-87% от контроля и сохраняется до 1 мес /5/.
Известен способ иммобилизации ферментов (щелочной фосфатазы, пероксидазы, папаина, а-химотрипсина), который состоит в том, что органический носитель - хемосорбционное волокно на основе сополимера акрилонитрила с 2,5 винилпиридином (марки ВИОН АН-1) обрабатывают водными растворами различных ферментов. Недостатком способа является низкая активность иммобилизованных ферментов, которая составляет 45-75%. Время полуинактивации 14-16 суток /6/.
Известен биокатализатор, у которого фермент (ферменты) включают в матрицу полимерного геля на основе поливинилового спирта (ПВС). При этом препарат диспергируют в водном растворе ПВС с последующим замораживанием полученной дисперсии при -5…-40°С в течение 4-48 ч и дальнейшим размораживанием. Данное техническое решение наиболее близкое к заявленному и принято за прототип. Биокатализатор с наполнителем на основе трипсина, сшитого в присутствии синтетического полимера N-винилпирролидона с виниламином, содержит 2,5 мас.% трипсина и 11 мас.% ПВС. Ферментная активность полученного биокатализатора при гидролизе n-нитроанилида Na-бензоил-DL-аргинина (измерена в 0,3 М Na-фосфатном буфере, рН 8,0; 25°С) составляет 81% от активности исходного препарата трипсина в расчете на 1 мг белка. В гранулированном виде биокатализатор состоит из наполнителя на основе частиц сшитого трипсина с содержанием 14 мас.% и ПВС - 13,6 мас.%. Ферментативная активность полученного биокатализатора при гидролизе n-нитроанилида Na-бензоил-DL-аргинина (измерена в 0,3 М Na-фосфатном буфере, рН 8,0; 25°С) составляет 75% от активности исходного препарата трипсина в расчете на 1 мг белка /7/. Данное техническое решение представляет интерес, но технологически сложно и длительно в исполнении, требует использования криогеля, замораживание полученной дисперсии. В гранулированном виде активность препарата составляет 75% от исходной активности фермента 111.
Предложен способ иммобилизации фермента (на примере трипсина), заключающийся в том, что при иммобилизации трипсина использовали как органические, так и неорганические носители. Из неорганических носителей применяли двуокись кремния (аэросил, белую сажу), а из органических - фторсодержащие полимеры. Первые не дали эффекта, а использование полимерного носителя (фторсодержащего), инертного к различным средам и стойкого к температурным воздействиям, способствует иммобилизации фермента. Технический результат заявляемого способа состоит в том, что используют полимерный носитель для получения иммобилизованного фермента с высокой активностью. Способ осуществляют следующим образом.
Пример 1.
В работе исследовали получение ферментных препаратов пролонгированного действия путем иммобилизации на полимерном носителе протеолитического фермента трипсина. В качестве носителя применяли фторсодержащие полимеры - сополимер винилиденфторида и гексафторпропилена (СКФ-26); фторэласт А1201 (СКФ-26 В); сополимер винилиденфторида и перфторметилвинилового эфира (СКФ-260 ВРТ).
Каучуки СКФ-26 и СКФ-260 ВРТ и А1201 развальцовывали при температуре 37°С, включение трипсина в структуру полимера проводили постепенно при смешении на вальцах (или смесителях типа "Бенбери", "Интермикс"). Количество фермента варьировали от 0,0025 до 0,25 г на 1 г полимера, без сшивающего агента и с сшивающим агентом класса пиперазина в количестве 0,04 г - соединение 1,4 бис(2-меркаптобензтиазолилметилен)-пиперазин формулы:
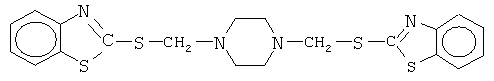
Иммобилизованные образцы получали в виде пластин толщиной около 1 мм. Исходные полимеры и иммобилизованные образцы трипсина на носителе сравнивались при набухании в дистиллированной воде (табл.1).
При концентрации иммобилизованного трипсина 0,0025-0,025 г в полимере наименьшее набухание отмечено для каучука СКФ-26, при концентрации 0,25 г набухание увеличивается у всех полимеров. Исследование иммобилизованного трипсина при набухании в водной среде показало, что рН практически находится на уровне контроля до введения трипсина в матрицу полимера. Сшивающий агент в количестве 0,04 г на 1 г носителя стабилизирует композиции с содержанием фермента 0,0025- 0,025 г, что приводит к наименьшей электропроводности их растворов.
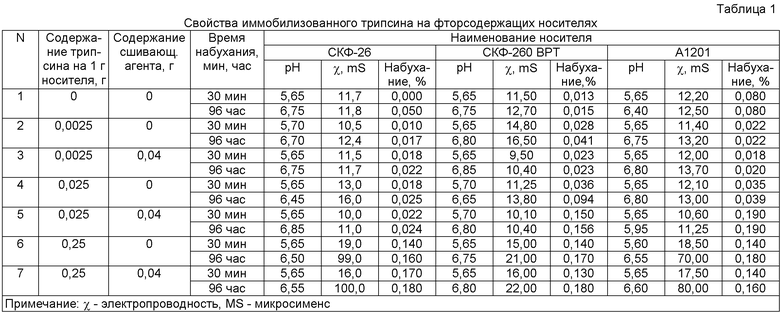
Электропроводность раствора при введении 0,25 г фермента после 96 часов набухания у композиции на основе СКФ-26, А1201 составляет соответственно 100 и 80 9/LS, а у композиции на основе СКФ-260 ВРТ - 22 мS.
Пример 2.
Заявленный иммобилизованный и контрольный трипсин оценивали по протеолитической и диспергирующей активности с помощью 0,25% раствора трипсина, которую определяли при диспергировании в течение 30 мин тканей перепелиных (ПЭ) и куриных эмбрионов (КЭ) (табл.2). Для приготовления растворов фермента применяют буферные растворы с рН 7,2-7,4, что необходимо при культивировании клеток. При получении первичной культуры клеток используют эмбрионы кур 8-10-дневного и перепелов 8-9-дневного возраста. В асептических условиях измельченную ткань эмбрионов помещают в плоскодонную колбу вместимостью 1-1,5 л и заливают теплым (37°С) 0,18-0,25% раствором трипсина из расчета 800 мл трипсина на 400-500 тушек эмбрионов. Время трипсинизации перепелиных эмбрионов составляло 20 мин (при однократной трипсинизации) или 2 раза по 10 мин (при двукратной трипсинизации) и 35 мин с эмбрионами кур. Полученную суспензию фильтруют через 2-слойный марлевый фильтр в центрифужный флакон, в который заранее заливают сыворотку крупного рогатого скота (КРС) из расчета концентрации в суспензии 2-3%. Отфильтрованную клеточную суспензию центрифугируют 10-15 мин при 1200 об/мин. После центрифугирования трипсин сливают, а к клеточному осадку добавляют среду, содержащую 10% сыворотки КРС. Клеточную суспензию собирают в один сосуд, тщательно перемешивают под факелами через 3-4 слойный фильтр. Клеточную суспензию вносят в ростовую среду, содержащую 10% сыворотки КРС и антибиотики (пеницилин - 100 ед./мл, стрептомицин - 100 мкг/мл) и нистатин (50 мкг/мл), затем расфасовывают в культуральную посуду.
Иммобилизованный трипсин на носителях в виде образцов из расчета получения 0,25% раствора фермента стерилизовали химическим способом (раствором первомура - (смеси в соотношении 1:1- 3% раствора перекиси водорода и 1% раствора муравьиной кислоты)) с последующей промывкой стерильной водой или буфером; или же обработкой спиртовым раствором и стерильным буферным раствором. Опытные стерильные образцы использовали для рабочих растворов трипсина на буферном растворе подобно контрольному нативному трипсину.
Результаты культивирования клеток после трипсинизации иммобилизованным трипсином и контрольным трипсином приведены в табл.2. Посевная доза составляла 600-700 тыс. на 1 мл.
Как видно из табл.2, протеолитическая активность иммобилизованных образцов была на уровне контроля. Испытания иммобилизованного фермента в качестве диспергирующего агента показали возможность использования его при трипсинизации тканей ПЭ и КЭ.
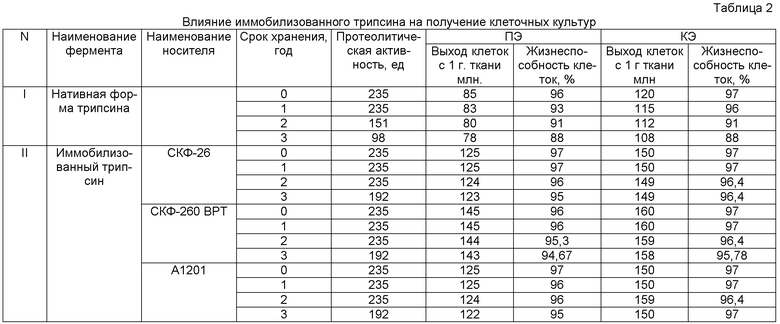
По результатам опыта выход клеток с единицы ткани находился на уровне контроля. Ферментативное диспергирование иммобилизованным трипсином позволило получить жизнеспособные клетки, которые использовали при монослойном культивировании клеток перепелиных и куриных эмбрионов. Срок хранения иммобилизованных образцов составляет 3 года (срок наблюдения) по сравнению с нативной формой фермента (2 года).
Пример 3.
Иммобилизованный трипсин использовали многократно после промывки стерильным буферным раствором и дистиллированной водой. После пятикратного использования иммобилизованного фермента выход клеток с 1 г ткани и жизнеспособность практически не менялись. При соблюдении стерильности рост клеток обеспечивался на уровне контроля и выше. Проведенные исследования показали возможность получения иммобилизованного фермента трипсина, который можно использовать неоднократно (табл.3).
Предлагаемый способ иммобилизации фермента (на примере трипсина) позволяет получить препарат с высокой активностью исходного энзима, что составляет 100% по сравнению с прототипом (76-81%) и обеспечивает удержание фермента в пределах частиц носителя. Иммобилизация фермента увеличивает срок хранения до 3 лет (срок наблюдения) по сравнением с исходным препаратом. Выход клеток и их жизнеспособность, полученных при использовании иммобилизованного фермента (трипсина), сохраняется при многократном использовании.
Источники информации
1. Иммобилизованные клетки и ферменты. Методы. / Под ред. Дж. Вудворда. - М.: Мир, 1988.
2. Иммобилизованные ферменты. Современное состояние и перспективы / В 2 т. Под ред. И.В. Березина, В.К. Антонова, К. Мартеника. - М.: МГУ, 1976. - Т. 1 - 296 с.- Т. 2. - 358 с.
3. Патент RU 2005784, C12N 11/14, C12N 11/10.
4. Патент RU 2016901, С12 N 11/02, 9108.
5. Патент RU 2157405, С12 N 11/14.
6. Патент RU 2054481, С12 N 11/08.
7. Патент RU 2233327, С12 N 11/0804, 11/18.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО БИОКАТАЛИЗАТОРА ДЛЯ СИНТЕЗА ВОДНЫХ РАСТВОРОВ АМИДОВ | 2011 |
|
RU2500814C2 |
| ИММОБИЛИЗОВАННЫЙ БИОКАТАЛИЗАТОР ДЛЯ МИКРОБИОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ ПЕКТИНАЗ | 2008 |
|
RU2383618C1 |
| ИММОБИЛИЗОВАННЫЙ БИОКАТАЛИЗАТОР, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ЭТОГО БИОКАТАЛИЗАТОРА | 2002 |
|
RU2253677C2 |
| ИММОБИЛИЗОВАННЫЙ БИОКАТАЛИЗАТОР ДЛЯ БИОЛОГИЧЕСКОЙ ОЧИСТКИ ЖИРОСОДЕРЖАЩИХ СТОЧНЫХ ВОД И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2315102C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ТРИПСИНА, ГИАЛУРОНОВОЙ КИСЛОТЫ И ПОЛИСАХАРИДОВ, МОДИФИЦИРОВАННЫХ ВИНИЛОВЫМИ МОНОМЕРАМИ | 2020 |
|
RU2750376C1 |
| БИОКАТАЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2002 |
|
RU2233327C2 |
| Биокатализатор для деструкции ксантана на основе иммобилизованных клеток симбиотической смеси бактерий | 2022 |
|
RU2806184C1 |
| СПОСОБ БИОРАЗЛОЖЕНИЯ ФОСФОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В СОСТАВЕ РЕАКЦИОННЫХ МАСС, ПОЛУЧАЕМЫХ ПОСЛЕ ХИМИЧЕСКОГО УНИЧТОЖЕНИЯ ВЕЩЕСТВА ТИПА Vx | 2009 |
|
RU2408724C2 |
| Способ получения активированных носителей | 1977 |
|
SU859372A1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННОГО БИОКАТАЛИЗАТОРА И БИОКАТАЛИЗАТОР ДЛЯ ПРОИЗВОДСТВА СПИРТОСОДЕРЖАЩИХ НАПИТКОВ | 2006 |
|
RU2322499C2 |
Осуществляют иммобилизацию трипсина смешением полимерного носителя, в качестве которого используют сополимер винилиденфторида и гексафторпропилена, фторэласт, сополимер винилиденфторида и перфторметилвинилового эфира и сшивающего агента. Количество фермента варьируют от 0,0025 до 0,25 г на 1 г носителя и сшивающего агента - 1,4 бис(2-меркаптобензтиазолилметилен)-пиперазина в количестве 0,01-0,04 г на 1 г носителя. Смешение проводят на вальцах или в смесителе при температуре 37°С. Полученный иммобилизованный фермент обладает высокой протеолитической активностью нативного препарата и диспергирующей активностью, необходимой для получения полноценных клеточных культур. Иммобилизация фермента увеличивает срок хранения до 3 лет и приводит к устойчивости фермента и возможности его многократного использования. 3 табл.
Способ иммобилизации трипсина на полимерном носителе, включающий смешение носителя, в качестве которого используют сополимер винилиденфторида и гексафторпропилена (СКФ-26); фторэласт А1201 (СКФ-26 В); сополимер винилиденфторида и перфторметилвинилового эфира (СКФ-260 ВРТ), трипсина в количестве 0,0025-0,25 г и сшивающего агента 1,4 бис(2-меркаптобензтиазолилметилен)-пиперазина 0,01-0,04 г на 1 г носителя, при этом смешение проводят на вальцах или в смесителе при температуре 37°С.
| БИОКАТАЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2002 |
|
RU2233327C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММОБИЛИЗОВАННЫХ ФЕРМЕНТОВ | 1993 |
|
RU2054481C1 |
| КИЛЬДЕЕВА Н.Р | |||
| и др | |||
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| Химические волокна, 1980, №6, с.24-25 | |||
| ВИРНИК А.Д., ГОСТИЩЕВ В.К., КИЛЬДЕЕВА Н.Р | |||
| и др | |||
| Получение пленок и волокон, содержащих протеолитические ферменты | |||
| Прикладная биохимия и микробиология | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2011-12-27—Публикация
2010-06-17—Подача