Область техники, к которой относится изобретение
Изобретение относится к области токсикологии и санитарно-гигиенических измерительных технологий, а именно к способам измерения и испытания с использованием жизнеспособных микроорганизмов.
В частности, изобретение предназначено для определения биологической активности (биотоксичности) наноуглерода, структурированного в виде нанотрубок или фуллеренов. Задача тестирования биотоксичности подобных объектов определяется тем, что в силу своей малой размерности и большой удельной поверхности наноматериалы могут обладать совершенно иными биологическими (в том числе токсическими) свойствами, нежели вещества в обычном физико-химическом состоянии. В этой связи необходимость комплексной токсикологической оценки каждого индивидуального наноматериала закреплена в «Концепции токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов», утвержденной постановлением Главного государственного санитарного врача Российской Федерации от 31 октября 2007 г., №79.
Таким образом, заявляемый способ предназначен для использования в научно-исследовательских центрах токсикологии и экотоксикологии, а также лабораториях центров гигиены, санитарии и эпидемиологии и специальных служб федеральных органов исполнительной власти, осуществляющих ведомственный санитарно-эпидемиологический надзор в сфере в сфере защиты прав потребителей и благополучия человека.
Уровень техники
Использование нанотехнологий и наноматериалов является одним из наиболее интригующих направлений развития науки и техники в XXI веке. К настоящему времени в мире уже зарегистрировано и выпускается более 1800 наименований наноматериалов (т.е. структур в диапазоне размеров до 100 нанометров). Учитывая, что в перспективе ожидается тесный контакт человека с наноматериалами, изучение вопросов потенциальных рисков их использования представляется первостепенной задачей. В настоящее время такие исследования начаты в США (FDA), Евросоюзе, а также в ряде международных организаций (ВОЗ, ФАО, ILSI).
Повышенное внимание к этой проблеме определяется тем обстоятельством, что наноматериалы могут обладать совершенно иными физико-химическими свойствами и биологической активностью, чем те же вещества в форме сплошных фаз или макроскопических дисперсий. Соответственно они относятся к принципиально новым видам материалов и продукции, характеристика потенциального риска которых для здоровья человека и состояния среды обитания во всех случаях является обязательной.
Первые способы изучения биологической активности наноуглерода были связаны с использованием в качестве объекта воздействия лабораторных животных - мышей, крыс и кроликов. Однако полученные результаты оказались достаточно противоречивыми, и не столько дали ответ на поставленные вопросы, сколько вызвали множество новых. Так в работах [1, 2] сообщается о потенциальной токсичности углеродных нанотрубок при аэрозольном применении, ведущей к формированию в легких специфических гранулем. Сходные эффекты были обнаружены и в работе [3] при накожном нанесении наноуглерода, что также сопровождалось образованием гранулем и изменениями в клетках периферической крови, хотя и не вело к развитию летальных эффектов во всем диапазоне изученных концентраций. С другой стороны, в работе [4] сообщается об ограниченной реакционной способности углеродных наноматериалов и положительных медицинских эффектах углеродных нанотрубок при регенерации костной ткани. В свою очередь, в работе [5] делается вывод об очень низкой токсичности углеродных наноматериалов высокой степени очистки.
С точки зрения заявителя причина подобной неопределенности заключается не только в чрезвычайном разнообразии углеродных наноматериалов, но и в том, что исследованию их эффектов в сложных биологических системах не предшествовало тестирование на более однозначно реагирующих молекулярных и клеточных моделях с формированием базовых представлений о природе биологической активности наноуглерода.
Неоценимую роль в решении данной задачи могут сыграть микроорганизмы, имеющие высокую степень биохимического сходства с высшими организмами и за счет этого демонстрирующие значимые корреляции оценок биотоксичности с результатами, полученными с использованием более сложных моделей. Выражаясь словами Нобелевского лауреата 1965 года Жака Люсьена Моно (Jacques Lucien Monod): «Что верно для бактерии Escherichia coli, то верно и для слона». В итоге простота организации, высокая скорость обмена веществ и энергии, а также некоторые другие физиологические особенности делают бактерии наиболее удобным и распространенным инструментом для проведения биотестирования.
Среди используемых сенсорных микроорганизмов одним из наиболее востребованных вариантов являются люминесцирующие (спонтанно светящиеся) бактерии, что объясняется следующими основными моментами: 1) ферментная система генерации свечения таких бактерий тесно интегрирована с основными энергетическими потоками бактериальной клетки, в связи с чем она быстро и чувствительно изменяет свою активность при воздействии токсических веществ; 2) интенсивность свечения может с высокой точностью количественно оцениваться в режиме реального времени, что позволяет быстро и качественно определять показатели биотоксичности большого количества анализируемых проб [6].
Наиболее распространенной в мире системой для биолюминесцентного биотестирования является «Microtox», производимый компанией AZUR Environmental (США) и включающий в свой состав лиофилизированные морские люминесцирующие бактерии вида Vibrio fischeri, штамм NRRL В-11177 [7]. Технология проведения биотестирования с его использованием закреплена ISO №11348 «Water Quality - Determination of the Inhibitory Effect of Water Samples on the Light Emission of Vibrio fischeri (Luminescent Bacteria Test)».
Принцип метода заключается в формировании контакта сенсорного микроорганизма с анализируемой пробой и контрольным (свободным от токсиканта) образцом. При этом экологические особенности Vibrio fischeri, в естественных условиях обитающего в морской воде, обуславливают необходимость внесения в анализируемую пробу NaCl до конечной концентрации 2-3%, а также создание контрольной пробы на основе очищенной (дистиллированной) воды с аналогичным содержанием NaCl. После 30-минутной (в экспрессном варианте 5-минутной) инкубации измеряют интенсивность свечения в опытной (Iо) и контрольной (Iк) кюветах с использованием специального регистрирующего устройства - биолюминометра и по его результатам рассчитывают коэффициенты токсичности анализируемой пробы (7) по формуле Т=((Iк-Iо)/Iк)×100%, где Iк - интенсивность свечения в контрольной кювете, Iо - интенсивность свечения в опытной кювете. Величины Т<20% характеризуют исследуемый образец как нетоксичный, Т от 20 до 50% - как токсичный и Т≥50% - как сильно токсичный.
За более чем 20-летний период использования тест-система «Microtox» положительно зарекомендовала себя для исследования качества промышленных, сточных и природных вод, почвы и донных осадков, а также определения степени токсичности вновь синтезируемых химических соединений и фармацевтических препаратов. В частности, доступная для использования компьютерная база данных «Computox» (Environment Canada), содержащая определенные с ее использованием токсикологические величины ЕС50, превышает 1500 наименований химических веществ.
Однако распространение данного способа для оценки биотоксичности наноуглерода заставило констатировать наличие существенных ограничений.
Первое из них заключается в сложности создания седиментационно и агрегативно стабильных суспензий наноуглерода в воде и, тем более, в присутствии ускоряющего коагуляцию электролита (2-3% NaCl). Следствием этого является недостаточная интенсивность контакта сенсорного микроорганизма с тестируемыми частицами наноуглерода, ведущая к снижению или полному отсутствию его влияния на уровень биолюминесценции. Так проведенное с использованием тест-системы «Microtox» исследование одностенных углеродных нанотрубок и С60-фуллеренов [8, 9] оценивало данные соединения наноуглерода как нетоксичные, что вступало в противоречие с результатами исследований, основанных на использовании иных способов оценки токсичности.
Частичное решение этой задачи может быть достигнуто путем замены морского микроорганизма Vibrio fischeri на пресноводные люминесцирующие микроорганизмы, в частности рекомбинантный штамм Escherichia coli К12 TG1 с клонированными luxCDABE генами Photobacterium leiognathi, выпускаемый в Российской Федерации под коммерческим названием «Эколюм» [10]. Целесообразность подобной замены определяется исключением необходимости внесения в анализируемые образцы дополнительных количеств NaCl с соответствующим использованием в качестве контроля химически чистой дистиллированной воды при отсутствии иных существенных отличий в процедуре проведения биотестирования. В частности, с использованием подобного подхода реализована «Методика определения токсичности химических веществ, полимеров, материалов и изделий с помощью бактериального теста «Эколюм» [11]. По совокупности существенных признаков данное техническое решение может быть признано способом-прототипом. Однако основанный на его использовании вариант оценки биотоксичности наноуглерода из доступной авторам научно-технической литературы не известен.
Другое важное ограничение использования биолюминесцентного способа оценки наноуглерода определяется его способностью к поглощению и рассеиванию света, испускаемого сенсорными микроорганизмами. Следствием этого могут являться искаженные (заниженные) результаты регистрации интенсивности биолюминесценции в опытных пробах, ведущие к формированию ошибочных значений величин индексов токсичности. Известное решение этой задачи заключается в использовании так называемого «теста вспышки» (англ. - flash assay) [12], сутью которого является кинетическое определение интенсивности свечения в первую секунду после смешивания анализируемой пробы с сенсорным микроорганизмом, а также после 15 или 30 минут совместной инкубации. Достигаемым положительным эффектом является исключение влияния цветности и мутности анализируемых проб на результат исследования, а недостатками - необходимость использования только специального дорогостоящего автоматизированного оборудования, позволяющего проводить одновременное внесение/смешивание анализируемых проб и регистрацию свечения в кинетическом режиме с децисекундными интервалами.
Таким образом, основными причинами, препятствующими получению требуемого результата при использовании способа-прототипа, являются: 1) отсутствие подходов, обеспечивающих контакт люминесцирующих микроорганизмов с тестируемыми частицами наноуглерода как следствия седиментационной и агрегативной нестабильности их суспензий; 2) искажающее влияние оптических свойств тестируемых суспензий наноуглерода на результат определения интенсивности свечения находящихся в них сенсорных люминесцирующих микроорганизмов.
Альтернативные подходы, ведущие к устранению данных недостатков, в доступной литературе не описаны.
Таким образом, заявляемый способ не известен из уровня техники, т.е. является новым.
Сущность изобретения
Техническим результатом, на достижение которого направлен заявляемый способ, является повышение точности и чувствительности определения биотоксичности наноуглерода.
Сущностью заявляемого способа, сформулированной на уровне функционального обобщения и лежащей в его основе, является следующее:
- биотоксичность наноуглерода (НУ) определяется степенью его диспергированности в исследуемой пробе, каковая может быть повышена предварительным суспендированием НУ в органических растворителях с меньшей, чем у воды, степенью полярности и последующей обработкой ультразвуком; при этом исключение оптических свойств суспензий НУ на результат его биотестирования с использованием люминесцирующих бактерий может быть достигнуто введением поправочной величины, учитывающей закономерности распространения излучаемого света в исследуемой суспензии.
Соответственно при реализации заявляемого способа определения биотоксичности наноуглерода с использованием люминесцирующих бактерий характеристика действий, порядок их выполнения и условия осуществления в сравнении со способом-прототипом [11] представляются следующим образом (таблица 1).
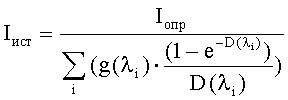
На первом этапе определения биотоксичности наноуглерода проводят три последовательных действия: 1) навеску анализируемого образца НУ вносят в стеклянные емкости с органическим растворителем с меньшей, чем у воды, степенью полярности: диметилсульфоксидом (диэлектрическая проницаемость 45) или этанолом (диэлектрическая проницаемость 24); 2) емкость обрабатывают ультразвуком, например, помещая ее на 30 минут в источник ванного типа; 3) переносят часть полученной суспензии в химически чистую дистиллированную воду таким образом, чтобы конечная концентрация ДМСО или этанола равнялась 2,5% по конечному объему.
Содержание этапа принципиально отличается от способа-прототипа, не предусматривающего подобной пробоподготовки и ориентированного на исследование биотоксичности водорастворимых форм химических соединений. В то же время основная масса соединений наноуглерода являются лиофобными (гидрофобными) соединениями, при внесении в водную среду формирующими не истинные растворы, а дисперсные системы. Соответственно в результате предлагаемой пробоподготовки создаются условия для повышения степени дисперсности суспензий НУ, обеспечивающей выявление его истинной биологической активности.
На втором этапе определения биотоксичности наноуглерода формируют серии из трех опытных и трех контрольных проб в объеме 900 мкл, последние из которых представляют собой 2,5% растворы органических растворителей, использованных на первом этапе для повышения дисперсности суспензий НУ (диметилсульфоксида или этанола). В данные пробы вносят идентичные количества (по 100 мкл) бактериального люминесцирующего биосенсора «Эколюм», в качестве активного начала содержащего клетки Escherichia coli К12 с клонированными luxCDABE генами P.leiognathi. Образцы выдерживают в течение 30 минут при +22-24°C.
Содержание этапа - формирование токсического эффекта присутствующих в пробе соединений наноуглерода в отношении сенсорного микроорганизма, проявляющегося в снижении уровня его биолюминесценции, - принципиально не отличается от такового в способе-прототипе.
Содержанием третьего этапа является аппаратная регистрация интенсивности свечения сенсорного микроорганизма в опытной (Iопр) и контрольной (Iк) пробах с использованием предназначенного для этого прибора - биолюминометра. В дальнейшем с целью исключения влияния собственных оптических свойств тестируемых суспензий наноуглерода на результат оценки их биотоксичности проводят исследование светопоглощения (D) суспензии НУ с использованием предназначенного для этого прибора-спектрофотометра (спектрофлуориметра), после чего проводят расчет истинной интенсивности свечения сенсорного микроорганизма (Iист) с учетом поправочной величины, учитывающей закономерности распространения излучаемого света в тестируемой суспензии. Полученные значения используют для итогового расчета коэффициента токсичности (Т) анализируемого образца по формуле Т=((Iк-Iист)/Iк)×100%. При величинах Т<20% образец оценивают как нетоксичный, при 20%≤Т<50% - как токсичный и при Т≥50% - как сильно токсичный.
Содержание этапа - регистрация результата реакции и расчет уровня биотоксичности исследуемой пробы - имеет существенные отличия от такового в способе-прототипе, так как предусматривает учет и исключение искажающего влияния собственных оптических свойств суспензии наноуглерода на результат ее биолюминесцентного биотестирования. Сказанное определяет необходимость определения светопоглощения исследуемой пробы с использованием предназначенного для этого прибора - спектрофотометра (спектрофлюориметра). Зарегистрированные значения в дальнейшем используются для расчета истинной интенсивности свечения сенсорного микроорганизма (Iист) в зависимости от светопоглощающих свойств исследуемых суспензий наноуглерода (D) и определенного в эксперименте уровня свечения бактериального люминесцирующего биосенсора (Iопр) по формуле:
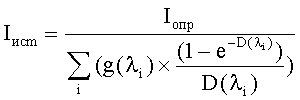
где:
Iист - истинная интенсивность свечения сенсорного микроорганизма;
Iопр - определенный в эксперименте уровень свечения бактериального люминесцирующего биосенсора;
g(λi) - доля свечения биосенсора (в долях единицы от общей интенсивности свечения), регистрируемого на определенной длине волны в диапазоне 420-580 нм;
D(λi) - величина светопоглощения исследуемой суспензии наноуглерода на данной длине волны.
Возможность получения технического результата при выполнении перечисленных действий в указанных интервалах значений определяется следующим комплексом причинно-следственных связей.
1. Соединения наноуглерода (НУ) представляют собой лиофобные (в рассматриваемом случае - гидрофобные) частицы, в водной среде формирующие грубодисперсные седиментационно и агрегативно неустойчивые суспензии. Для увеличения степени дисперсности подобных систем предлагается их создание на основе растворителей с меньшей, чем у воды, величиной диэлектрической проницаемости - ДП (диметилсульфоксиде, ДП=45 или этаноле, ДП=24) с последующим переносом части сформировавшихся суспензий в водную среду. При этом использование иных растворителей, в том числе с еще более низкими значениями диэлектрической проницаемости (бензол, ДП=2,27; толуол, ДП=2,3; серуглерод, ДП=2,64; трихлорметан, ДП=4,64 и т.д.) при реализации заявляемого способа является невозможным в силу их собственной выраженной токсичности (см. также п.2). В свою очередь, вероятной причиной, лежащей в основе достигаемой стабилизации суспензий наноуглерода, является адсорбционно-сольватационный механизм, заключающийся в снижении поверхностной энергии при адсорбции стабилизатора и молекул дисперсной среды на поверхности частиц НУ. Экспериментальные доказательства эффективности заявляемого подхода получены при оценке седиментационной устойчивости различным образом сформированных суспензий НУ, исследованной путем их центрифугирования при различных кратностях g (ускорения силы тяжести).
2. Обоснование допустимой конечной концентрации диметилсульфоксида или этанола было дано на основе экспериментального изучения влияния различных концентраций данных растворителей на уровень биолюминесценции используемого при реализации заявляемого способа сенсорного штамма Escherichia coli К12 с клонированными luxCDABE генами P.leiognathi. При этом в качестве оптимальной концентрации, не вызывающей тушения биолюминесценции и, одновременно, позволяющей вносить в суспензию максимальные количества тестируемого НУ, была установлена таковая на уровне 2,5% от конечного объема пробы. Для прочих исследованных растворителей с низкими значениями диэлектрической проницаемости подобные концентрации оказывались не менее чем в 8-10 раз ниже, что свидетельствовало об их собственной выраженной биотоксичности в отношении использованного сенсорного микроорганизма.
3. Дополнительным действием, предлагаемым для повышения степени дисперсности суспензий наноуглерода, является их обработка ультразвуком (УЗ), ведущая к механическому разобщению частиц НУ. Экспериментальные доказательства целесообразности подобного действия были получены при оценке седиментационной устойчивости различным образом сформированных суспензий НУ, исследованной путем их центрифугирования при различных кратностях g (ускорения силы тяжести). При этом проведение подобных исследований после различного по времени УЗ-воздействия в качестве достаточной позволило установить его 30-минутную продолжительность. Дальнейшее увеличение времени УЗ-воздействия уже не вело к достоверному росту дисперсности формируемых суспензий. В отдельной серии экспериментов также установлено, что сочетание диметилсульфоксида или этанола с УЗ-воздействием повышает дисперсность суспензий наноуглерода более значительно, чем каждое из названных действий по отдельности.
4. Достигаемое повышение степени дисперсности наноуглерода одновременно сопровождается снижением ее светопропускающих свойств, что объясняется следующим комплексом причинно-следственных связей: 1) пока размер частиц НУ намного превышает длину волны света, значения поглощения являются пропорциональными площади их поверхности; 2) по мере приближения размера частиц НУ к длине световой волны поглощение света единицей площади поверхности увеличивается. Данное обстоятельство зарегистрировано экспериментально при оценке светопоглощения суспензий, сформированных на основе идентичных весовых количеств НУ, но с использованием способа-прототипа и заявляемого способа. Одновременно оно создает препятствие для реализации биолюминесцентного тестирования биотоксичности наноуглерода, заключающееся в поглощении доли излучаемого сенсорным микроорганизмом света при его прохождении через исследуемую суспензию и ведущее к регистрации искаженных (заниженных) значений светимости.
5. Для исключения искажающего влияния собственных оптических свойств суспензии наноуглерода на результат биолюминесцентного биотестирования предложен порядок коррекции определенных значений биолюминесценции с учетом оптических свойств исследуемой пробы. При этом новизна подобного действия определяется следующими основными моментами: 1) производимые расчеты хотя и основаны на использовании закона Бугера-Ламберта-Бера, описывающего характер ослабления света при его распространении в поглощающей среде, но в связи с тем, что закон описывает монохроматический пучок света, производимые расчеты предусматривают произведение вычислений для n-ого количества длин волн; 2) анализируемый диапазон длин волн определяется спектром световой эмиссии используемого сенсорного штамма Escherichia coli K12 с клонированными luxCDABE генами P.leiognathi (420-580 нм) с учетом определенных для него значений доли от суммарной световой эмиссии, излучаемой в каждом спектральном диапазоне; 3) при проведении вычислений учитывается, что свет (биолюминесценция) возникает внутри анализируемой пробы, соответственно перед попаданием на регистратор (фотоэлектронный умножитель) проходя через разные по толщине слои исследуемой суспензии наноуглерода. Экспериментальная проверка подобного подхода позволила констатировать его адекватность для решения поставленной задачи, что проявлялось в коррекции (повышении) значений истинной интенсивности свечения сенсорного микроорганизма (Iист), пропорциональной значениям светопоглощения тестируемой суспензии наноуглерода.
В целом, резюмируя приведенные выше материалы о сущности заявляемого способа, характеристике действий, порядке их выполнения и условия осуществления, можно констатировать, что заявляемый способ не следует из уровня техники и по этому показателю должен быть оценен как соответствующий критерию «изобретательский уровень».
Сведения, подтверждающие возможность осуществления изобретения
Для определения биотоксичности наноуглерода методом биолюминесцентного биотестирования в стерильную стеклянную емкость вносят его навеску в количестве, задаваемом целями исследования.
В дальнейшем последовательность выполнения действий при осуществлении заявляемого способа, их условия и режимы являются следующими:
1) для достижения диспергирования наноуглерода к его навеске добавляют органический растворитель-диметилсульфоксид или этанол категории ч.д.а., после чего интенсивно смешивают пипетированием;
2) стеклянную емкость со взвесью наноуглерода в органическом растворителе помещают в источник ванного типа, где обрабатывают ультразвуком в течение 30 минут;
3) часть полученной суспензии переносят в дистиллированную химически чистую воду таким образом, чтобы конечная концентрация органического растворителя равнялась 2,5% по конечному объему;
4) формируют серии из трех опытных и трех контрольных проб в объеме 900 мкл каждая, последние из которых представляют собой 2,5% раствор использованного органического растворителя в дистиллированной химически чистой воде;
5) во флакон коммерчески доступного люминесцирующего биосенсора «Эколюм», содержащего лиофилизированный рекомбинантный штамм Escherichia coli К12 с клонированными luxCDABE генами P.leiognathi, вносят 10 мл дистиллированной воды, несколько раз встряхивают, выдерживают в течение 30 мин в холодильной установке при +2-4°C для стабилизации уровня свечения, после чего доводят температуру до комнатной +22-24°C;
6) в опытные и контрольные пробы вносят по 100 мкл биосенсора и интенсивно смешивают пипетированием;
7) кюветы с опытными и контрольными пробами выдерживают в идентичных условиях в течение 30 минут при +22-24°C;
8) кюветы последовательно помещают в измерительную ячейку биолюминометра и замеряют уровень свечения в видимой сине-зеленой области спектра при 420-580 нм в течение 30-60 секунд, значения интенсивности свечения в трех опытных (Iопр) и трех контрольных (Iк) пробах усредняют;
9) с использованием спектрофотометра (спектрофлюориметра) проводят исследование светопоглощения (D) тестируемой суспензии наноуглерода в диапазоне 420-580 нм;
10) на основе проведенных измерений проводят расчет истинной интенсивности свечения сенсорного микроорганизма (Iист) в зависимости от светопоглощающих свойств исследуемой суспензии наноуглерода (D) и определенного уровня свечения бактериального люминесцирующего биосенсора (Iопр) по формуле:
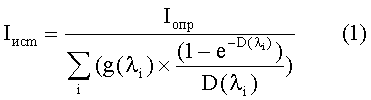
где Iист - истинная интенсивность свечения сенсорного микроорганизма; Iопр - определенный в эксперименте уровень свечения бактериального люминесцирующего биосенсора; g(λi) - доля свечения биосенсора (в долях единицы от общей интенсивности свечения), регистрируемого на определенной длине волны в диапазоне 420-580 нм; D(λi) - величина светопоглощения исследуемой суспензии наноуглерода на данной длине волны.
11) производят окончательный расчет биотоксичности Т исследуемой пробы наноуглерода по формуле Т=((Iк-Iист)/Iк)×100%;
12) при величинах Т<20% соединение наноуглерода оценивают как нетоксичное, при Т от 20 до 50% - как токсичное и при Т≥50% - как сильно токсичное.
Использование описанной последовательности действий при оценке биотоксичности девяти различных соединений наноуглерода позволило продемонстрировать возможность осуществления изобретения, а также преимущество заявляемого способа по сравнению со способом-прототипом.
Так водные седиментационно и аггрегационно нестабильные суспензии НУ по результатам биолюминесцентного анализа с использованием способа-прототипа были оценены как биотоксичные только в трех из девяти исследованных случаев. В частности, биотоксичность была детектирована у образцов одностенных углеродных нанотрубок, непосредственно изолированных из реакционной зоны; одностенных углеродных нанотрубок, прошедших процедуру экстракции толуолом и кислотной обработки HCl и HNO3 с последующим тепловым окислением на воздухе, а также С60-фуллеренов, функционализированных аминными группами. Одновременно проведенный анализ позволил связать значительную долю тестируемой биотоксичности НУ с присутствием в них примесных химических элементов. При этом достоверная зависимость ингибиции бактериальной биолюминесценции и рассчитываемых на этой основе значений биотоксичности от присутствия отдельных металлов в препаратах НУ зафиксирована для Cr (P<0,01), а также Ni, Zn, Y, Sm, Gd и Ho (P<0,05). Сказанное определило и существование для водных суспензий НУ сильной положительной корреляционной связи между суммарным показателем присутствия в них примесных веществ (Ксум) и определенных величин биотоксичности (r=0,747; P<0,05). Таким образом, использование способа-прототипа позволяет выявлять не столько собственную биологическую активность (биотоксичность) наноуглерода, сколько эффекты присутствующих в них технологических примесей.
С другой стороны, использование заявляемого способа, предусматривающего повышение степени диспергированности наноуглерода, сопровождалось увеличением выявляемых значений его биотоксичности. В частности, в случае использования диметилсульфоксида и последующей обработки ультразвуком в качестве биотоксичных могли быть оценены 7 из 9 изученных препаратов, а при использовании этанола с последующей обработкой ультразвуком - 6 из 9. Одновременно использование заявляемого способа сопровождалось утратой значимости примесного состава НУ в определении их биотоксичности (значения коэффициента корреляции r от 0,255 до 0,393; P>0,05), тем самым выявляя именно собственную биологическую активность наноуглерода.
Пример
Для исследования биотоксичности углеродного наноматериала (С60-фуллерена) было сделано несколько навесок в количестве 2,96 мг, соответствующих его 4×10-6 М.
При проведении исследований по способу-прототипу навеску исследуемого углеродного наноматериала помещали в стеклянный сосуд, заливали 5-кратным объемом химически чистой дистиллированной воды с pH 7.0-7.4 и выдерживали в течение 24 часов. Полученную суспензию разводили дистиллированной водой до концентрации 100 мкМ, из которой формировали серию из трех опытных проб. В качестве контроля формировали серию из трех проб химически чистой дистиллированной воды, использованной для суспендирования наноуглерода. Полученные опытные и контрольные образцы в объеме по 900 мкл вносили в измерительные кюветы, после чего туда же добавляли по 100 мкл суспензии сенсорных люминесцирующих бактерий Escherichia coli К12 с клонированными luxCDABE генами P.leiognathi, восстановленных из лиофилизированного состояния из коммерчески доступного препарата «Эколюм» (НВО «Иммунотех», Россия). После 30-минутной инкубации при +22-24°С кюветы с образцами помещали в прибор, регистрирующий биологическое свечение, - биолюминометр «Биотокс» (ООО «Нера-С», Россия) и замеряли уровень биолюминесценции в контроле и опыте. Индекс токсичности (Т) рассчитывали по формуле Т=((Iк-Iо)/Iк)×100%, где Iк - интенсивность свечения в контрольной кювете, Iо - интенсивность свечения в опытной кювете.
Результаты, полученные с использованием способа-прототипа, позволили зафиксировать индекс токсичности на уровне Т=-129% (значение свечения в опытном образце превышало таковое в контрольном), что в соответствии с существующими нормативами заставляло оценивать исследованный образец С60-фуллерена как нетоксичный. Параллельно проведенный эксперимент по определению жизнеспособности использованных сенсорных микроорганизмов после контакта с С60-фуллерном также не выявил развития бактерицидного эффекта.
При проведении исследований по способу-прототипу навески исследуемого углеродного наноматериала помещали в стеклянный сосуд, в который вносили 1 мл диметилсульфоксида, после чего интенсивно смешивали пипетированием. В дальнейшем сосуд помещали в источник ванного типа «Сапфир ТТЦ» (ЗАО ПКФ «Сапфир», Россия), где обрабатывали ультразвуком в течение 30 минут. На следующем этапе часть полученной суспензии переносили в химически чистую дистиллированную воду с pH 7.0-7.4 таким образом, чтобы конечная концентрация диметилсульфоксида составила 2,5% по конечному объему, а концентрация С60-фуллерена равнялась 100 мкМ. В качестве контроля использовали серии из трех проб 2,5% раствора соответствующего органического растворителя в дистиллированной химически чистой воде. Подготовленные подобным образом опытные и контрольные пробы вносили в измерительные кюветы в объемах по 900 мкл, после чего туда же добавляли по 100 мкл суспензии люминесцирующих бактерий Escherichia coli К12 с клонированными luxCDABE генами P.leiognathi, восстановленных из лиофилизированного состояния из коммерчески доступного препарата «Эколюм» (НВО «Иммунотех», Россия). После 30-минутной инкубации при +22-24°C кюветы с образцами помещали в прибор регистрирующий биологическое свечение - биолюминометр «Биотокс» (OOO «Нера-С», Россия), замеряли уровень люминесценции в контроле и опыте, после чего проводили расчет индексов токсичности (Т) по приведенной выше формуле.
Параллельно определялось светопоглощение исследуемых проб наноуглерода (D) в спектральном диапазоне 420-580 нм с использованием предназначенного для этого прибора - спектрофлюориметра «Флюорат-02-Панорама» (НПФ «Люмекс», Россия). Зарегистрированные значения в дальнейшем использовали для расчета истинной интенсивности свечения сенсорного микроорганизма (Iист) в зависимости от светопоглощающих свойств исследуемых суспензий наноуглерода (D) и определенного в эксперименте уровня свечения бактериального люминесцирующего биосенсора (Iопр) по формуле:
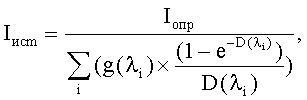
где Iист - истинная интенсивность свечения сенсорного микроорганизма; Iопр - определенный в эксперименте уровень свечения бактериального люминесцирующего биосенсора; g(λi) - доля свечения использованного штамма Escherichia coli К12 с клонированными luxCDABE генами Р.leiognathi на определенной длине волны в диапазоне 420-580 нм в долях единицы от общей интенсивности свечения, заранее определенная с использованием прибора «Флюорат-02-Панорама» (НПФ «Люмекс», Россия); D(λi) - величина светопоглощения исследуемой суспензии С60-фуллерена на данной длине волны.
Результаты, полученные с использованием заявляемого способа, позволили выявить биотоксичность исследуемого препарата С60-фуллерена, характеризующуюся значением индекса токсичности на уровне Т=26%, что в соответствии с действующими нормативами заставляло оценивать данный образец наноуглерода как токсичный. Параллельно проведенный эксперимент по определению жизнеспособности использованных сенсорных микроорганизмов после контакта с С60-фуллерном также позволил зафиксировать развитие бактерицидного эффекта в отношении более чем 20% взятых в опыт клеток-мишеней, что согласуется с описанными выше данными, полученными биолюминесцентным методом.
Таким образом, положительным результатом, достигнутым при использовании заявляемого способа, явилось повышение чувствительности и точности определения биотоксичности наноуглерода (в частности, С60-фуллерена), в том числе связанной с развитием бактерицидного эффекта в отношении сенсорного микроорганизма.
Источники информации

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ЦИТОТОКСИЧНОСТИ НАНОМАТЕРИАЛОВ НА ОСНОВЕ ОКСИДА ЦИНКА | 2015 |
|
RU2587630C1 |
| СПОСОБ БИОХЕМИЛЮМИНЕСЦЕНТНОЙ ОЦЕНКИ ТОКСИЧНОСТИ РУБЦОВОЙ ЖИДКОСТИ IN VITRO | 2013 |
|
RU2603104C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БИОЛОГИЧЕСКОЙ (АНТИМИКРОБНОЙ) АКТИВНОСТИ ДЕФЕНСИНОВ И ИХ ПРОИЗВОДНЫХ | 2009 |
|
RU2405835C1 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ 1,3-ДИГИДРОКСИБЕНЗОЛА В КАЧЕСТВЕ СЕНСИБИЛИЗАТОРОВ БАКТЕРИАЛЬНЫХ КЛЕТОК К ПОВРЕЖДАЮЩЕМУ ВОЗДЕЙСТВИЮ НАНОСТРУКТУРИРОВАННЫХ СОЕДИНЕНИЙ УГЛЕРОДА | 2014 |
|
RU2598731C2 |
| ПРИМЕНЕНИЕ ПЕНТААМИНОФУЛЛЕРЕНОВ В КАЧЕСТВЕ ПРОТИВОМИКРОБНЫХ СРЕДСТВ И ПРОТИВОМИКРОБНАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2011 |
|
RU2501785C2 |
| Набор lux-биосенсоров для детекции токсичных продуктов неполного окисления несимметричного диметилгидразина в среде | 2015 |
|
RU2626569C2 |
| НАБОР lux-БИОСЕНСОРОВ ДЛЯ ОПРЕДЕЛЕНИЯ ДЕТЕРГЕНТОВ ГИДРОФОБНОЙ ПРИРОДЫ В СРЕДЕ | 2007 |
|
RU2355760C1 |
| БИОХЕМИЛЮМИНЕСЦЕНТНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ ФАГОЦИТАРНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ | 2007 |
|
RU2366953C2 |
| НАБОР lux-БИОСЕНСОРОВ ДЛЯ ОПРЕДЕЛЕНИЯ ГЕНОТОКСИЧНЫХ ПРОДУКТОВ НЕПОЛНОГО ОКИСЛЕНИЯ НЕСИММЕТРИЧНОГО ДИМЕТИЛГИДРАЗИНА В СРЕДЕ | 2014 |
|
RU2569156C1 |
| НАБОР LUX-БИОСЕНСОРОВ ДЛЯ ОПРЕДЕЛЕНИЯ ГЕПТИЛА В СРЕДЕ | 2005 |
|
RU2297450C2 |
Проводят подготовку пробы: навеску исследуемых форм наноуглерода диспергируют в 1 мл органических растворителей с меньшей, чем у воды, степенью полярности - диметилсульфоксиде или этаноле. Затем перемешивают и обрабатывают ультразвуком в течение 30 мин. Переносят полученную суспензию наноуглерода в водную среду до конечной концентрации использованного растворителя 2,5%. Вносят в созданную и контрольную пробы жизнеспособный сенсорный рекомбинантный люминесцирующий штамм Escherichia coli К12 с клонированными luxCDABE генами люминесцентной системы Photobacterium leiognathi. Инкубируют 60-180 мин, измеряют интенсивность свечения и параллельно определяют оптические свойства тестируемой суспензии. Определяют индекс токсичности (Т), при этом рассчитывают истинную интенсивность свечения штамма (Iист) по сравнению с контролем с той же концентрацией растворителя, учитывающую светопоглощающие свойства исследуемой суспензии (D) и определенного в эксперименте уровня свечения бактериального люминесцирующего биосенсора (Iопр). Изобретение позволяет повысить точность и чувствительность определения биотоксичности наноуглерода за счет введения поправочной величины - истинной интенсивности свечения штамма (Iист), учитывающей закономерности распространения излучаемого света в исследуемой суспензии.
Способ определения биотоксичности наноуглерода путем исследования влияния на интенсивность свечения (Iист) рекомбинантного люминесцирующего штамма Escherichia coli К12 с генами люминесцентной системы Photobacterium leiognathi по сравнению с интенсивностью его свечения в контроле (Iк) и последующего вычисления индекса токсичности по формуле Т=((Iк-Iиcт)/Iк)·100%, отличающийся тем, что навеску исследуемых соединений наноуглерода предварительно диспергируют в органическом растворителе с меньшей, чем у воды, степенью полярности - диметилсульфоксиде или этаноле; тщательно перемешивают и обрабатывают ультразвуком; полученные суспензии переносят в водную среду до конечной концентрации использованного растворителя 2,5%; после чего в созданную исследуемую и контрольную пробу, представляющую собой 2,5%-ный водный раствор диметилсульфоксида или этанола, вносят люминесцирующий штамм и после совместной инкубации в течение 60-180 мин измеряют интенсивность свечения, параллельно в диапазоне длин волн биолюминесценции сенсорного штамма (λi) определяют оптические свойства тестируемой суспензии наноуглерода, на основании чего проводят расчет истинной интенсивности свечения сенсорного микроорганизма (Iист) в зависимости от светопоглощающих свойств исследуемых суспензий наноуглерода (D) и определенного в эксперименте уровня свечения бактериального люминесцирующего биосенсора (Iопр) по формуле
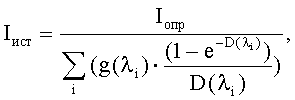
где Iист - истинная интенсивность свечения сенсорного микроорганизма;
Iопр - определенный в эксперименте уровень свечения бактериального люминесцирующего биосенсора;
g(λi) - доля свечения биосенсора (в долях единицы от общей интенсивности свечения);
D(λi) - коэффициент светопоглощения исследуемой суспензии наноуглерода на данной длине волны.
| ZARUBINA А.Р | |||
| ЕТ AL | |||
| Biotesting the biological effects of single-wall carbon nanotubes using bioluminescent bacteria test system, nanotechnologies in Russia | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| OBRAZTSOVA E.A | |||
| ЕТ AL | |||
| Bactericidal action of single - walles carbon nanotubes | |||
| MOSCOW UNIVERSITY PHYSICS BULLETIN | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| FARRE M | |||
| ЕТ AL. | |||
Авторы
Даты
2011-12-27—Публикация
2010-02-09—Подача