Изобретение относится к оценке степени загрязнения окружающей среды несимметричным диметилгидразином (НДМГ) и генотоксичными продуктами его окисления, а также может быть использовано в исследованиях биологических объектов.
Известен способ определения НДМГ и продуктов его окисления в окружающей среде физико-химическими средствами [1-3]. Сущность этого способа заключается в проведении фотометрического анализа продуктов распада НДМГ или высокоразрешающего хроматографического (газовая хроматография) разделения химических соединений с масс-спектрометрическим детектированием [1], и идентификации НДМГ и его продуктов распада с помощью методов ЯМР и инфракрасной спектроскопии [2]. Недостатком химических методов является необходимость использования дорогостоящей аппаратуры, а также сложность проведения анализа в связи с высокой нестабильностью НДМГ [3].
В настоящее время широкое распространение для определения загрязнения окружающей среды токсичными веществами получили методы биотестирования с использованием lux-биосенсоров. Известны методы, основанные на тушении биолюминесценции токсикантами, в которых используется механизм ингибирующего действия ядовитых веществ на метаболизм клетки, в основном на дыхательную цепь, что опосредованно влияет на люциферазную реакцию, вызывая ослабление интенсивности биолюминесценции клеток. В этой серии методик, используемых в качестве экспресс-контроля токсичности природных сред, наибольшее распространение в странах Европы и в США получил т.н. «Микротокс» (Microtox 5ТМ), в котором в качестве биосенсора используются лиофилизированные морские бактерии Photobacterium phosphoreum. В России в подобных тестах используется генно-инженерный штамм Escherichia coli, с генами lux-оперона морских люминесцирующих бактерий Photobacterium leiognathi («Эколюм-08») [4]. Недостатком метода является неспецифичность реакции и невысокая чувствительность. Для идентификации химического соединения, вызвавшего уменьшение интенсивности свечения клеток, требуется дополнительный анализ.
Известно также обнаружение токсикантов с использованием lux-биосенсоров на основе бактерий Е. coli, содержащих плазмиды с lux-генами под контролем индуцируемых стрессовых промоторов [5]. Эти lux-биосенсоры, как указано в приведенном патенте США, были использованы для определения нитратов, фенолов, бензина и других токсикантов, но не использовались для обнаружения в среде НДМГ или продуктов его окисления.
Для определения в среде НДМГ использовался набор lux-биосенсоров в патенте РФ 2297450 [6]. НДМГ, являясь сильным восстановителем, при попадании в окружающую среду взаимодействует с атмосферным кислородом с образованием стабильных продуктов окисления, некоторые из которых являются генотоксичными [7, 8, 9]. Важной составляющей генотоксичности производных окисления НДМГ составляет алкилирующее соединение N-нитрозодиметиламин (НДМА). В патенте РФ 2569156 [10] для детекции алкилирующей активности продуктов неполного окисления НДМГ, к которым относится НДМА, использовался PalkA промотор, транскрипционно-слитый с luxCDABE кассетой, остальные биосенсоры были теми же, что и в патенте [6].
Техническим результатом предложенного изобретения является возможность быстрой детекции малых концентраций НДМГ и его токсичных производных в окружающей среде. Чувствительность предложенного набора к токсичным продуктам неполного окисления НДМГ по сравнению с прототипом возросла примерно в 5 раз. Измерения не требуют дорогой и сложной аппаратуры, возможны как в стационарных, так и в полевых условиях.
Для достижения этого результата предложено использовать набор lux-биосенсоров на основе бактерий Е. coli, трансформированных гибридными плазмидами с lux-генами под контролем индуцируемых стрессовых промоторов PoxyR, PcolD, PalkA, PsoxS и PgrpE. В предложенном наборе промоторы PoxyR, РcolD используются вместо PkatG и РrесА соответственно, остальные промоторы, как в патенте [10], а именно PalkA, PsoxS и PgrpE - В результате трансформации клеток Е. coli гибридными плазмидами, содержащими lux-гены под контролем вышеописанных промоторов получены цельноклеточные биосенсоры: Е. coli pAlkA-lux, Е. coli pOxyR-lux, E.coli pSoxS-lux и E.coli pColD-lux, E.coli pGrpE-lux.
В предложенном изобретении для определения токсичных продуктов неполного окисления НДМГ использована группа биосенсоров, обладающих большей чувствительностью к малым концентрациям токсикантов, чем биосенсоры, применяемые ранее. При попадании токсиканта в среду сигнал (биолюминесценция) клеток индуцируется (увеличивается).
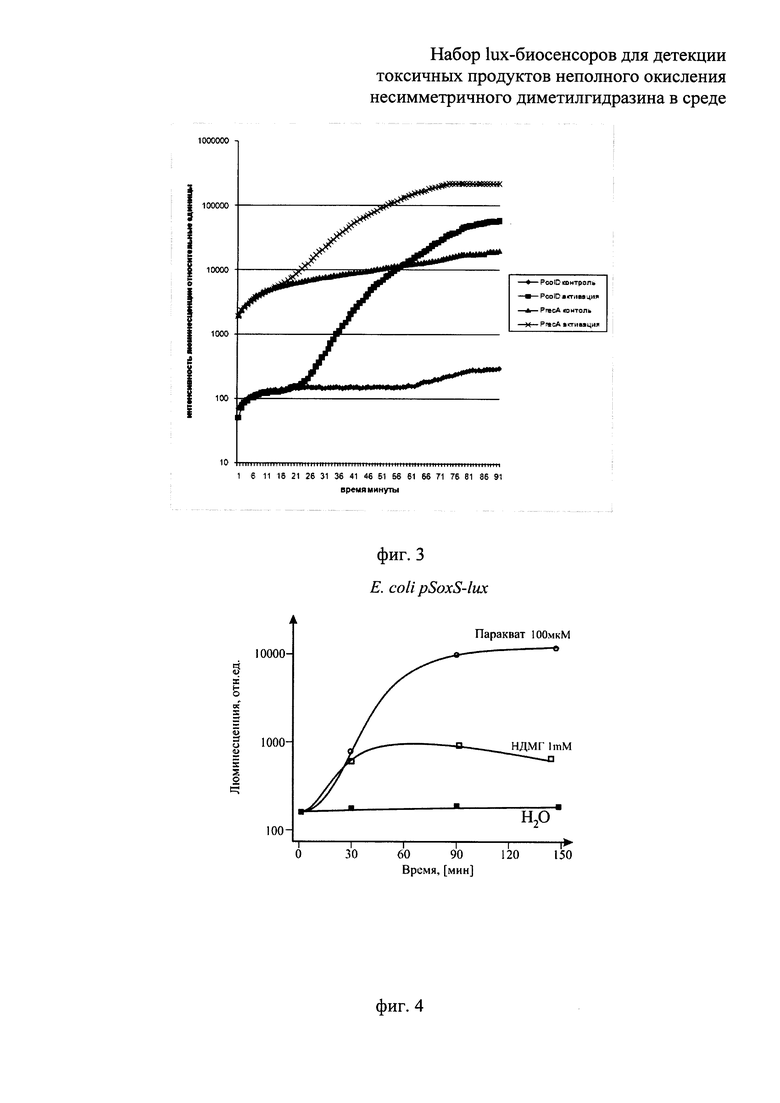
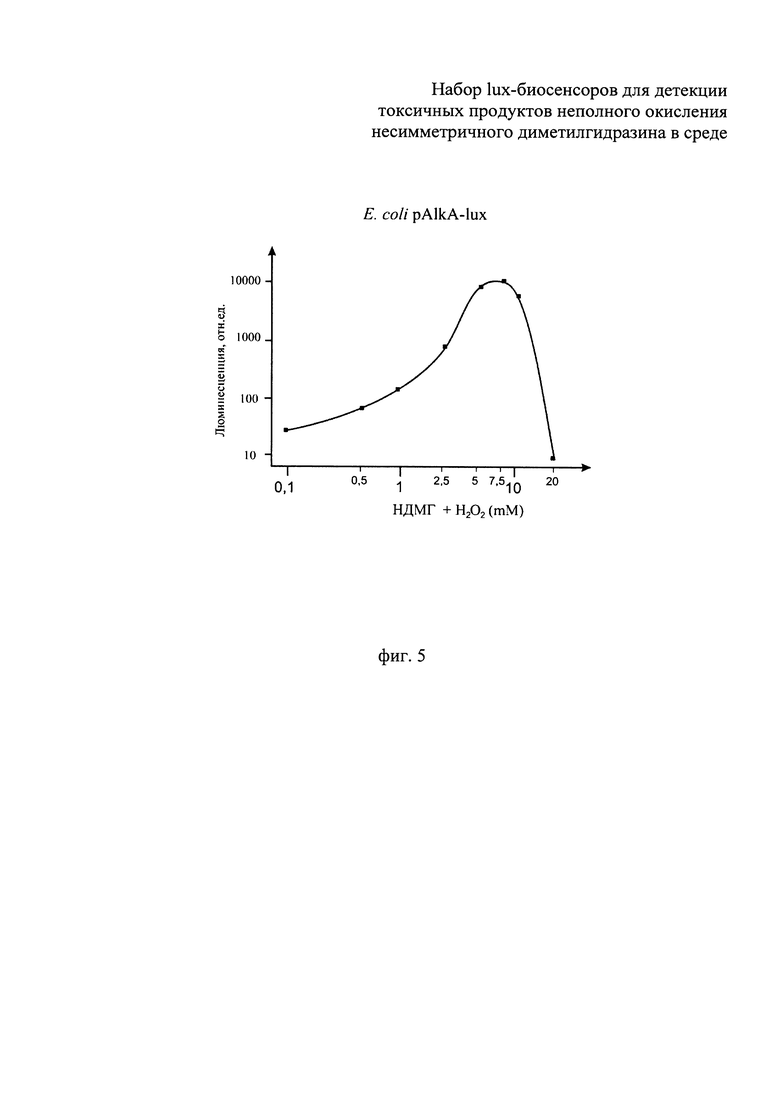
Сущность изобретения поясняется прилагаемыми графиками, где на фиг.1 показано сравнение люминесценции биосенсоров Е. coli pOxyR-lux и Е. coli pKatG-lux в зависимости от времени их инкубирования, в среде с присутствием перекиси водорода в концентрации, близкой к пороговой, 3 мкМ. На фиг.2 - приведена зависимость люминесценции биосенсоров Е. coli pOxyR-lux и Е. coli pKatG-lux от количества продуктов неполного окисления НДМГ во влажной почве. На фиг. 3 показано сравнение реакции биосенсоров Е. coli pRecA-lux и Е. coli pColD-lux на митомицин С. На фиг. 4 показана реакция биосенсора Е. coli pSoxS-lux, на продукты неполного окисления НДМГ атмосферным кислородом (в зависимости от времени действия и концентрации НДМГ). На фиг. 5 приведена зависимость эффективности действия продуктов неполного окисления НДМГ от степени окисления НДМГ перекисью водорода для биосенсора с промотором РAlkA.
В процессе действия продуктов неполного окисления НДМГ на клетку происходит индукция биолюминесценции у биосенсоров Е. coli pAlkA-lux, Е. coli pOxyR-lux, Е. coli pSoxS-lux и E.coli pColD-lux, но не для биосенсора Е. coli pGrpE-lux, являющегося контрольным (поэтому данные для биосенсора PgrpE::lux не приводятся). Как видно из графиков, представленных на фиг. 2, 4, 5, при выдерживании проб с НДМГ и продуктами его неполного окисления наблюдается со временем значительное усиление (примерно в 10-100 раз) интенсивности биолюминесценции клеток - биосенсоров. На фиг. 1 показана люминесценция биосенсоров Е. coli pOxyR-lux и Е. coli pKatG-lux при добавлении клеткам биосенсора (180 мкл культуры) 20 мкл перекиси водорода до конечной концентрации, близкой к пороговой, 3 мкМ. Как видно из фиг. 1, биосенсор Е. coli pOxyR-lux показывает существенно более высокую амплитуду индукции. Как видно из данных, приведенных на фиг. 2, люминесценция биосенсоров Е. coli pOxyR-lux и Е. coli pKatG-lux от количества продуктов неполного окисления НДМГ во влажной почве существенно различается. Биосенсор Е. coli pOxyR-lux обладает более высокой чувствительностью и амплитудой индукции к малым концентрациям производных НДМГ. Для этих измерений образцы влажной почвы (1/1 - почва/вода) инкубировались в присутствии НДМГ в различных концентрациях. Затем аликвоты надосадочной жидкости из полученных образцов добавлялись в кювету с биосенсорными штаммами. По оси абсцисс на фиг. 2 отложена концентрация НДМГ в кювете (имея в виду, что в реальности после инкубации в основном в образцах присутствуют продукты неполного окисления НДМГ, а не сам НДМГ). На фиг.3 продемонстрирована люминесценция биосенсоров Е. coli pRecA-lux и Е. coli pColD-lux на митомицин С (10-6 М/л в пробе). По полученным данным можно судить, что Е. coli pOxyR-lux и Е. coli pColD-lux обладают повышенной чувствительностью к специфическим токсикантам и, следовательно, способны к детекции более низких концентраций продуктов неполного окисления НДМ. Результаты, приведенные на фиг.5, показывают, что биосенсор Е. coli pAlkA-lux увеличивает люминесценцию в зависимости от степени окисления НДМГ перекисью водорода. Согласно данным масс-спектрометрического анализа при обработке НДМГ перекисью водорода возникает алкилирующее соединение N-нитрозодиметиламин [8]. Как видно из приведенных на фиг.5 данных, амплитуда ответа биосенсора Е. coli pAlkA-lux зависит от количества алкилирующих соединений, возникающих при окислении НДМГ [10].
У бактерий можно выделить регуляторные системы, специфически реагирующие на токсиканты, действующие на: 1) клеточные мембраны, 2) белки, 3) хромосому (ДНК), а также 4) индуцирующие в клетке окислительный стресс. В качестве биосенсора на токсиканты, действующие на клеточные белки, предложено использовать промотор PgrpE. Этот промотор в бактериальном геноме расположен перед генами «теплового шока» и открывается лишь при появлении в клетке модифицированных, денатурированных белков. В роли биосенсора на ДНК-тропные агенты используется SOS-промотор PColD и промотор, отвечающий за экспрессию гликозилазы РAlkA. Промотор РColD открывается лишь при индукции повреждений в геноме, т.е. в молекулах ДНК, останавливающих репликационную вилку. Для детекции алкилирования ДНК (данные повреждения зачастую не останавливают репликационную вилку и не вызывают индукцию SOS ответа) был использован промотор РAlkA. Для детекции веществ, индуцирующих в клетке окислительный стресс (образующих в клетке гидроксильный радикал, супероксид-ион-радикал, перекись водорода) были использованы промоторы PoxyR и PsoxS. Промотор PoxyR специфически реагирует на перекись водорода, органические пероксиды. Промотор PsoxS открывается при появлении в среде супероксид-анион-радикала.
Следует отметить, что появление в клетке активных форм кислорода, фиксируемых промоторами PoxyR и PsoxS, приводит к окислительным повреждениям ДНК. Таким образом, супероксид анион радикал и перекись водорода, возникающие при восстановлении атмосферного кислорода несимметричным диметилгидразином, являются существенной стороной генотоксичного воздействия на клетку продуктов окисления НДМГ [7].
В данном изобретении сконструированы основанные на этих индуцируемых промоторах специфические lux-биосенсоры. Все используемые промоторы с соответствующими регуляторными участками были получены из генома бактерий Escherichia coli К12 MG1655 с помощью метода ПЦР с использованием специальных, синтезированных праймеров. В качестве вектора использовали беспромоторный вектор с репликоном ColE1 и геном blа, определяющим резистентность к ампициллину (селективный маркер). Встраивание промоторной области в плазмиду проводили по сайтам ЕсоRI-ВаmHI. В качестве lux-кассеты был выбран lux-оперон Photorhabdus luminescens, состоящий из пяти генов, luxCDABE. Данная кассета имеет два преимущества: во-первых, люцифераза Ph. luminescens (гены luxAB) отличается сравнительно высокой термостабильностью, а, во-вторых, к суспензии клеток не надо добавлять субстрат люциферазной реакции - алифатический альдегид, так как он синтезируется в клетке при помощи белков, кодируемых генами luxCDE [11].
Полученными конструкциями трансформированы клетки Escherichia coli методом электропорации [12]. В результате получены следующие цельноклеточные биосенсоры: Е. coli pAlkA-lux, Е. coli pOxyR-lux, Е. coli pSoxS-lux и E.coli pColD-lux, E.coli pGrpE-lux.
Методика измерения влияния токсиканта на биолюминесценцию биосенсора была примерно одинаковой для всех lux-биосенсоров.
Определение генотоксичных продуктов неполного окисления НДМГ в среде с помощью lux-биосенсоров требует проведения следующих операций.
1. Приготовление проб, содержащих соответствующие биосенсоры;
- выращивание клеток Е. coli, являющихся биосенсорами, до экспоненциальной фазы (OD=0,2-0,4);
- отбор проб по 200 мкл в виалы (6-8 виал для каждого биосенсора).
2. Добавление к пробам НДМГ или жидкой среды с НДМГ в различных концентрациях;
- приготовление для каждого биосенсора положительного и отрицательного контролей. В качестве положительного контроля используют НДМГ (разведенный в воде) в концентрации 20 мкг/мл (отрицательный контроль - дистиллированная вода);
- добавление по 20 мкл исследуемой среды к каждой пробе каждого биосенсора;
(Все пробы следует приготовить в двойном или тройном экземплярах и затем использовать средние значения полученных экспериментальных величин).
3. Измерение интенсивностей биолюминесценции проб в течение 1-2 часов для биосенсоров Е. coli pOxyR-lux, Е. coli pSoxS-lux и Е. coli pGrpE-lux. Для биосенсора Е. coli pColD-lux и Е. coli pAlkA-lux измерение следует проводить 2,5-3 часа. Однако наличие высоких концентраций токсичных производных в среде фиксируется уже через 15-20 минут.
4. Обработка полученных результатов. Полученные графики на контрольных образцах сравнивают с исследуемым образцом.
Культуру клеток, содержащих гибридную плазмиду с соответствующим промотором и lux-кассетой, растили при 28°С или 37°С на качалке до ранней или средней экспоненциальной фазы (OD=0,2-0,4). Аликвоты этой культуры (по 200 мкл) переносили в стерильные виалы и добавляли в них по 10 мкл тестируемого вещества требуемой концентрации. Для приготовления образцов с продуктами неполного окисления НДМГ в почве применяли следующую методику. Образцы влажной почвы (1/1 - почва/вода) инкубировались в присутствии НДМГ в различных концентрациях при комнатной температуре 7 дней. Затем аликвоты надосадочной жидкости из полученных образцов добавлялись в кювету с биосенсорными штаммами. В контрольную пробирку добавляли 10 мкл дистиллированной воды. Затем пробы инкубировали без перемешивания при 30°С и через каждые 15 мин измеряли интенсивность биолюминесценции при комнатной температуре. Усиление сигнала фиксировалось уже через 15-20 мин - время, необходимое для синтеза люциферазы. Максимальный ответ биосенсора, как правило, наблюдался через 40-60 мин (в случае промоторов РColD и РalkA максимальный сигнал фиксировался через 90-120 мин) и при оптимальной концентрации токсиканта превышал начальный сигнал в 100-1000 раз.
В результате наших исследований было показано, что основными промоторами, открывающимися при воздействии на клетки генотоксичных продуктов неполного окисления НДМГ, являются промоторы PalkA, PoxyR, PsoxS, РсоlD. Биосенсор с промотором PgrpE не изменял интенсивность биолюминесценции. Поэтому данные по данному промотору не приведены на фиг. 1-5.
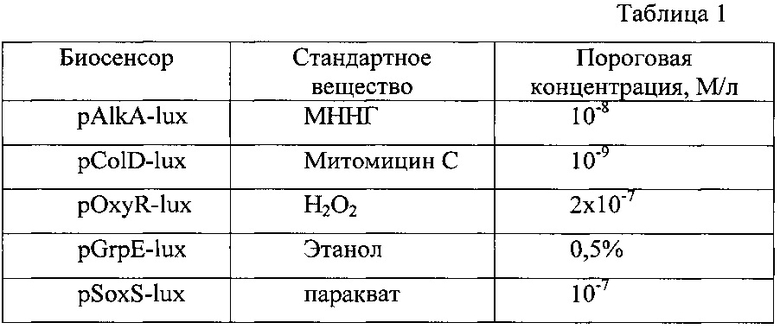
В табл.1 приведены данные о минимальных (пороговых) концентрациях стандартных, специфических для данного промотора веществ, индуцирующих заметный (в 2-3 раза) эффект усиления биолюминесценции, в конструированных lux-биосенсорах (митомицин С индуцирует повреждения в ДНК, этанол - в белках, перекись водорода и паракват как генератор супероксид-ион-радикалов индуцируют окислительный стресс, нитрозогуанидин (N'-метил-N'-нитро-N-нитрозогуанидин H2NC(=NH)NHNO) (МННГ) алкилирует ДНК).
НДМГ, по всей видимости, в отличие от представленных в табл. 1 соединений, не обладает высокой специфичностью к тому или другому биосенсору, так как в связи с высокой реакционной активностью (очень сильный восстановитель) способен повреждать макромолекулы. В результате появляется большой набор продуктов окисления НДМГ, а также органических соединений из водной среды и почвы, взаимодействующих с внесенным НДМГ. Поэтому оптимальным решением проблемы фиксации токсичных производных неполного окисления НДМГ в среде является использование всех вышеуказанных luх-биосенсоров.
Так как промотор PoxyR открывается лишь при воздействии перекиси водорода на белок-регулятор OxyR (окисление активного центра [Fe-S]), а промотор PsoxS открывается лишь при воздействии супероксид-анион-радикала, то можно считать доказанным, что действие НДМГ на бактериальную клетку в основном определяется формированием активных форм кислорода, в частности, гидроперекиси и супероксид-анион-радикала (в результате восстановления кислорода воздуха до перекиси водорода).
Гидроперекись, образованная в результате химических реакций НДМГ H2NN(CH3)2 в основном с кислородом O2, открывает промотор РохуR, причем столь же эффективно, как и перекись водорода, используемая в качестве стандарта:
O2+H2NN(CH3)2=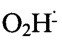 (супероксид-радикал) + HNN(CH3)2, причем супероксид-радикал быстро переходит в перекись водорода:
(супероксид-радикал) + HNN(CH3)2, причем супероксид-радикал быстро переходит в перекись водорода:
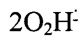 =Н2O2+O2,
=Н2O2+O2,
Превращение супероксид-анион-радикала в перекись водорода происходит как спонтанно, так и в результате действия клеточного фермента супероксид-дисмутазы.
Действие НДМГ на ДНК и, соответственно, на промотор PcolD, в начальной стадии носит косвенный характер и определяется в основном формирующимися активными формами кислорода. Этот вывод следует из данных о влиянии перекиси водорода на биосенсор pColD-lux, а также из данных по снижению активации промотора PcolD в присутствии каталазы [7]. Дальнейшее окисление НДМГ приводит к появлению алкилирующих соединений, взаимодействующих с ДНК, фиксируемых биосенсором Е. coli pAlkA-lux. Взаимодействие НДМГ с гумусом почв приводит к появлению соединений, приводящих к повреждениям в ДНК, вызывающим SOS-ответ бактерий, не снимающийся в присутствии каталазы (неопубликованные данные).
Влияние НДМГ на биосенсор Е. coli pGrpE-lux практически отсутствует, поэтому данный биосенсор служит отрицательным контролем в данном наборе биосенсоров.
Изобретение позволяет создать высокочувствительный, дешевый и быстрый тест-метод на основе измерения интенсивности биолюминесценции.
Источники информации
1. Дмитриев О.Ю., Иваненко С.И., Овсянников Д.А., Смирнова С.С., Чистова Ж.А. В Сб. «Труды Российской инженерной академии, Секция «Инженерные проблемы стабильности и конверсии», Выпуск 11. «Экологические проблемы разработки и эксплуатации ракетно-космической техники», Москва, СИП РИА, 2004 г. стр. 40-43.
2. Лопырев В.А., Долгушин Г.В., Ласкин Б.М. (2001) Журнал Рос.хим. об-ва им. Д.И. Менделеева, т. XLV, №5-6, стр. 149-156.
3. Кузнецова Л.В. В Сб. «Труды Российской инженерной академии, Секция «Инженерные проблемы стабильности и конверсии», Выпуск 12. «Экологические проблемы разработки и эксплуатации ракетно-космической техники», Москва, СИП РИА, 2004 г., стр. 24-25.
4. Патент РФ 2366953, МПК G01N 33/487, опубл. 2009.
5. Патент США №5683868, МПК C12N 1/21, опубл. 1997.
6. Патент РФ 2297450, МПК C12N 1/21, опубл. 2007.
7. Zavilgelsky, G.В.; Kotova, V. Yu.; Manukhov, I. V. (2007) Action of 1,1 -dimethylhydrazine on bacterial cells is determined by hydrogen peroxide. // Mutation research-genetic toxicology and environmental mutagenesis. Volume: 634 Issue: 1-2 P. 172-176.
8. Горянин И.И., Котова В.Ю., Краснопеева Е.Д., Чубуков П.А., Балабанов В.П., Чалкин С.Ф., Шатров Т.Я., Завильгельский Г.Б., Манухов И.В. Определение генотоксического действия 1,1-диметилгидразина алкилирующими соединениями, возникающими при его окислении, и перекисью водорода. // Труды Московского физико-технического института. 2013. Т. 5. №1-17. С. 103-111.
9. Anti Poso, Arte von Wright, Jukka Gynther (1995) Mutation Research. V. 332, РР/ 63-71.
10. Патент РФ 2569156, МПК C12N 1/21, опубл. 2015 – прототип.
11. Завильгельский Г.Б., Зарубина А.П., Манухов И.В. (2002) Молекулярная биология, т. 36. стр. 792-804.
12. http://molbiol.ru/protocol/03_05.html.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР lux-БИОСЕНСОРОВ ДЛЯ ОПРЕДЕЛЕНИЯ ГЕНОТОКСИЧНЫХ ПРОДУКТОВ НЕПОЛНОГО ОКИСЛЕНИЯ НЕСИММЕТРИЧНОГО ДИМЕТИЛГИДРАЗИНА В СРЕДЕ | 2014 |
|
RU2569156C1 |
| НАБОР LUX-БИОСЕНСОРОВ ДЛЯ ОПРЕДЕЛЕНИЯ ГЕПТИЛА В СРЕДЕ | 2005 |
|
RU2297450C2 |
| НАБОР lux-БИОСЕНСОРОВ ДЛЯ ОПРЕДЕЛЕНИЯ ДЕТЕРГЕНТОВ ГИДРОФОБНОЙ ПРИРОДЫ В СРЕДЕ | 2007 |
|
RU2355760C1 |
| Набор стрессиндуцируемых lux-биосенсоров на основе клеток Bacillus subtilis для исследования механизмов токсичности | 2022 |
|
RU2811895C2 |
| Бактериальный lux-биосенсор с повышенной чувствительностью для детекции ацильных производных гомосерин лактона | 2020 |
|
RU2777196C2 |
| Бактериальный lux-биосенсор на основе промотора гена бактериальной ДНК-полимеразы II | 2023 |
|
RU2832445C1 |
| Способ определения токсичности химических веществ, генерирующих активные формы кислорода | 2016 |
|
RU2614267C1 |
| Штамм бактерии Escherichia coli/pTdcR-TurboYFP, обладающий чувствительностью к терагерцовому излучению | 2018 |
|
RU2691308C1 |
| Способ определения генотоксичности химических веществ | 2016 |
|
RU2614122C1 |
| Способ выявления из естественных сред перспективных пробиотических штаммов | 2021 |
|
RU2772351C1 |
Изобретение относится к биохимии, биотехнологии и генной инженерии, в частности к набору lux-биосенсоров, состоящему из проб клеток Escherichia coli, трансформированных плазмидами с бактериальными luxCDABE-генами под контролем индуцируемых стрессовых промоторов PalkA, PoxyR, PsoxS, PcolD и РgrpE. Настоящее изобретение может быть использовано при оценке степени загрязнения окружающей среды токсичными продуктами неполного окисления несимметричного диметилгидразина (НДМГ). Настоящее изобретение позволяет быстро в стационарных или полевых условиях определить содержание генотоксичных продуктов неполного окисления НДМГ в окружающей среде. 5 ил., 1 табл.
Набор lux-биосенсоров для детекции токсичных продуктов неполного окисления НДМГ в окружающей среде, состоящий из пробы клеток Escherichia coli, трансформированных плазмидой, содержащей бактериальные luxCDABE гены под контролем промотора PoxyR, пробы клеток Е. coli, трансформированных плазмидой, содержащей бактериальные luxCDABE гены под контролем промотора PcolD, пробы клеток Е. coli, трансформированных плазмидой, содержащей бактериальные luxCDABE гены под контролем промотора Psoxs, пробы клеток Е. coli, трансформированных плазмидой, содержащей бактериальные luxCDABE гены под контролем промотора PalkA, пробы клеток Е. coli, трансформированных плазмидой, содержащей бактериальные luxCDABE гены под контролем промотора PgrpE.
| НАБОР lux-БИОСЕНСОРОВ ДЛЯ ОПРЕДЕЛЕНИЯ ГЕНОТОКСИЧНЫХ ПРОДУКТОВ НЕПОЛНОГО ОКИСЛЕНИЯ НЕСИММЕТРИЧНОГО ДИМЕТИЛГИДРАЗИНА В СРЕДЕ | 2014 |
|
RU2569156C1 |
| МАНУХАНОВ И.В., Структура Lux-оперонов и механизмы регуляции типа "Quorum sensins" у морских бактерий, Автореферат диссертации, Москва, 2011, 42 с., с.30-35, табл | |||
| МАНУХАНОВ И.В | |||
| и др., Использование Lux-биосенсоров для детекции НДГМ в почве, Двойные технологии, 2008, No.3, с.50-55 | |||
| TARTAGLIA LA, et al., Identification and molecular analysis of oxyR-regulated promoters important for the bacterial adaptation to oxidative stress, J | |||
| Mol | |||
| Biol., 1989, 210(4), pp.709-719. | |||
Авторы
Даты
2017-07-28—Публикация
2015-12-17—Подача