ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к лечению субъекта, страдающего кохлеарным тиннитусом, которое заключается во введении указанному субъекту эффективного количества производного 1-аминоалкилциклогексана.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Тиннитус, который часто упоминается как "звон в ушах", представляет собой ощущение звуков при отсутствии внешнего источника акустических сигналов. Тиннитус был определен как "ощущение звука, которое происходит исключительно из-за активности внутри нервной системы без какой-либо соответствующей механической, вибрационной активности в улитке уха, то есть, тиннитус представляет собой фантомное слуховое ощущение" (Jastreboff et al., J Am Acad Audiol 2000; 11(3): 162-177). Тиннитус часто сочетается с пониженной переносимостью звуков (т.е. гиперакузией).
Патофизиология субъективного тиннитуса малопонятна, а специфический патогенез тиннитуса неизвестен. Тиннитус могут вызывать многие факторы окружающей среды и факторы, индуцированные веществами. К числу наиболее часто упоминаемых факторов такого рода относятся острая акустическая травма, профессиональный шум и развлекательная музыка. В целом, представляется, что тиннитус является результатом нейронной дисфункции в проводящем пути слуха. Высшие слуховые центры ошибочно воспринимают эту дисфункцию как звук, что может привести к функциональным изменениям в слуховом отделе нервной системы. Не способствующие адаптации функциональные изменения в кортикальных структурах могут привести к нарушению баланса между возбуждающей и тормозящей нейротрансмиссией и, в результате этого, к более тяжелому тиннитусу. Во всех случаях потенциальное нарушение функции в путях проведения слуха и слуховой зоне коры головного мозга связано с активностью предлобной коры и лимбической системы.
В большинстве случаев (95%) ощущение тиннитуса имеет чисто субъективную природу, то есть, невозможно идентифицировать какой-либо источник звуковых сигналов и, следовательно, нельзя услышать звук извне. В таких случаях проводят врачебное обследование для исключения объективного тиннитуса, то есть восприятия больным звука, вызванного реальным источником звуковых волн, например, звука, исходящего от турбулентного потока в кровеносных сосудах и достигающего улитки. Тиннитус можно классифицировать в соответствии с его продолжительностью и степенью проявления (например, тяжестью или причиняемым неудобством) (McCombe et al., Clin Otolaryngol 2001; 26(5): 388-393 и Davis et al., Epidemiology of Tinnitus. In: Tyler R, editor. Tinnitus Handbook. San Diego: Singular Publishing Group; 2000. p.1-23). Что касается влияния тиннитуса на жизнь, то он может доставлять больному тяжелое неудобство и сопровождаться социальными и физиологическими осложнениями.
Также было предложено далее подразделять тиннитус на две группы (периферический тиннитус и центральный тиннитус) на основе восприятия тиннитуса пораженными субъектами. Предположительно считается, что периферический (или кохлеарный) тиннитус берет начало в периферической нервной системе и улитке, а происхождение центрального тиннитуса связано со слуховой зоной коры головного мозга.
Некоторое представление о происхождении той формы заболевания, которая связана с улиткой, дает физиология улитки. В улитке обнаружены два ряда волосковых клеток. Наружные волосковые клетки (OHC) при наличии звука активно сокращаются, таким образом, усиливая поступающие сигналы с низкой осцилляцией и модулируя реакцию внутренних волосковых клеток (IHC). Воздействие шумов, включая постоянный, повторяющийся контакт с громкими звуками или даже одноразовую "взрывную травму", может повредить волосковые клетки улитки, особенно их хрупкие стереоцилии (реснички). Поскольку OHC нуждаются в кислороде значительно сильнее, чем IHC, они более чувствительны к шуму, ототоксическим лекарствам, травме и т.д. Из-за утраты активного усиления звуков повреждение OHC может привести к сокращению динамического диапазона слуховой системы и нарушениям частотной избирательности. Неуправляемое сокращение поврежденных OHC может приводить к стимуляции IHC и биоэлектрическим нервным потенциалам, которые воспринимаются головным мозгом как звуки. Повреждение IHC может привести к аномальному смещению стереоцилий, что вызывает деполяризацию клеток, способствующую неконтролируемому выбросу нейротрансмиттеров, а это, в свою очередь, вновь может вызвать ощущение звука при отсутствии его реального источника (Baguley, Br Med Bull. 2002; 63: 195-212).
Со временем в патологический процесс могут вовлекаться более высокие уровни звуковоспринимающих путей, и ощущение тиннитуса уже не будет зависеть от кохлеарной патологии. На этой стадии заболевания имеет место массивное центральное усиление, запускаемое патологическим когнитивным фокусированием. Предположительно установлены усилительные механизмы обратной связи между лимбической системой и когнитивными областями ЦНС (Zenner, Ziel. Dtsch Arztebl. 2001; 37: 2361-2365).
Наряду с тем, что большое количество афферентных, главным образом, глутаматергических нервных волокон берут свое начало в IHC (Furness, et al., J Neurosci. 2003 Dec 10; 23(36): 11296-11304), OHC являются мишенью эфферентных нервных волокон, причем главным эфферентным нейротрансмиттером в улитке является ацетилхолин (Dallos et al., J Neurosci. 1997 Mar 15; 17(6): 2212-2226). Полагают, что определенный вклад в тиннитус дает избыток глутамата в кохлеарных нейронах. Поэтому было разработано несколько подходов к лечению тиннитуса, основанных на применении веществ, блокирующих рецепторы NMDA, таких как акампросат или кароверин. Исследования с этими веществами продемонстрировали ограниченный успех, возможно потому, что целью лечения была, главным образом, афферентная часть слуховой системы, тогда как эфферентная нейротрансмиссия затрагивалась лишь в минимальной степени.
Maison et al. (J Neurosci. 2002 Dec 15; 22(24): 10838-10846) также описывают эфферентную защиту от акустической травмы за счет избыточной экспрессии комплекса никотиновых ацетилхолинорецепторов α9/α10.
Однако до сих пор не существует хорошо обоснованных и специфических медицинских способов лечения тиннитуса, которые были бы способны обеспечить воспроизводимое уменьшение тиннитуса и ослабить его жизненные последствия по сравнению с эффектами плацебо (Dobie, Laryngoscope 1999; 109(8): 1202-1211; Eggermont et al., Trends Neurosci 2004; 27(11): 676-682; and Patterson et al., Int Tinnitus J 2006; 12(2): 149-159). Таким образом, существует потребность в фармацевтических продуктах, которые были бы эффективны в лечении или предупреждении тиннитуса.
Было обнаружено, что такие 1-аминоалкилциклогексаны как нерамексан (также известный как 1-амино-1,3,3,5,5-пентаметилциклогексан) полезны в терапии различных заболеваний, особенно некоторых неврологических заболеваний, включая болезнь Альцгеймера и невропатическую боль. Такие 1-аминоалкилциклогексаны как нерамексан подробно раскрыты в патентах США №№6034134 и 6071966, предметное содержание которых включено в качестве ссылки. Полагают, что терапевтическое действие таких 1-аминоалкилциклогексанов как нерамексан связано с подавлением эффектов избыточного глутамата в рецепторах N-метил-D-аспартата (NMDA) нервных клеток, и по этим соображениям такие соединения также классифицируются как антагонисты NMDA или антагонисты рецепторов NMDA. Было также раскрыто, что нерамексан проявляет активность в качестве антагониста никотиновых рецепторов α9/α10 (Plazas, et al., Eur J Pharmacol., 2007 Jul. 2; 566(1-3): 11-19).
Патент США №6034134 раскрывает, что 1-аминоалкилциклогексаны могут быть полезны при лечении тиннитуса вследствие их антагонистической активности к рецепторам NMDA.
Авторы настоящего изобретения открыли, что такие 1-аминоалкилциклогексаны как нерамексан эффективны при лечении кохлеарного тиннитуса.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к производному 1-аминоалкилциклогексана для лечения или предупреждения кохлеарного тиннитуса у нуждающегося в этом субъекта.
В следующем аспекте настоящее изобретение относится к применению производного 1-аминоалкилциклогексана в производстве лекарственного средства для лечения или предупреждения кохлеарного тиннитуса у нуждающегося в этом субъекта. Производное 1-аминоалкилциклогексана может представлять собой нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат.
В следующем аспекте изобретения такое лечение проводят в промежутке от трех (3) до двенадцати (12) месяцев со времени начального проявления тиннитуса (например, лечение начинают в промежутке от трех (3) до двенадцати (12) месяцев (включая промежуток от трех (3) до восьми (8) месяцев) после того, как у субъекта впервые проявился тиннитус). Производное 1-аминоалкилциклогексана может представлять собой нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат.
В следующем аспекте изобретения (применительно к такому лечению) субъект поражен тиннитусом в сочетании с потерей слуха или тиннитусом в сочетании с незначительной потерей слуха.
В следующем аспекте изобретение относится к производному 1-аминоалкилциклогексана для лечения или предупреждения тиннитуса, сочетающегося с потерей слуха или незначительной потерей слуха, и к применению производного 1-аминоалкилциклогексана в производстве лекарственного средства для лечения или предупреждения тиннитуса, сочетающегося с потерей слуха или незначительной потерей слуха, у нуждающегося в этом субъекта.
В следующем аспекте изобретение относится к производному 1-аминоалкилциклогексана для лечения или предупреждения тиннитуса, причем лечение проводят в промежутке от трех до двенадцати месяцев со времени начального проявления тиннитуса (подострый тиннитус) или лечение проводят в промежутке от трех до восьми месяцев со времени начального проявления тиннитуса, а также к применению производного 1-аминоалкилциклогексана для изготовления лекарственного средства для лечения или предупреждения тиннитуса, причем лечение проводят в промежутке от трех до двенадцати месяцев со времени начального проявления тиннитуса или лечение проводят в промежутке от трех до восьми месяцев со времени начального проявления тиннитуса.
Следующий аспект изобретения относится к производному 1-аминоалкилциклогексана (например, нерамексану или его фармацевтически приемлемой соли, такой как нерамексана мезилат) в лекарственном составе с немедленным или модифицированным высвобождением для лечения кохлеарного тиннитуса.
Следующий аспект изобретения относится к определенному выше производному или применению, причем субъекту вводят производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) и по меньшей мере одно добавочное фармацевтическое средство, заведомо эффективное в лечении тиннитуса.
Следующий аспект изобретения относится к определенному выше производному или применению, причем субъекту вводят производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) и по меньшей мере одно добавочное фармацевтическое средство, выбранное из антидепрессантов или средств против тревожности (таких как селективные ингибиторы обратного захвата серотонина (SSRI), ингибиторы обратного захвата серотонина-норэпинефрина (SNRI), норадренергические и специфические серотонинергические антидепрессанты (NASSA), ингибиторы обратного захвата норэпинефрина (норадреналина) (NRI), ингибиторы обратного захвата норэпинефрина-допамина или агонисты серотонина 1A), антагонистов допамина, альфа-2-дельта-лигандов и антагонистов NK1.
Следующий аспект изобретения относится к производному 1-аминоалкилциклогексана (например, нерамексану или его фармацевтически приемлемой соли, такой как нерамексана мезилат) в комбинации с другими терапевтическими способами лечения тиннитуса и, необязательно, по меньшей мере с одним фармацевтически приемлемым носителем или наполнителем.
Следующий аспект изобретения относится к производному 1-аминоалкилциклогексана (например, нерамексану или его фармацевтически приемлемой соли, такой как нерамексана мезилат) в комбинации с добавочным фармацевтическим средством, выбранным из антидепрессантов или средств против тревожности (таких как селективные ингибиторы обратного захвата серотонина (SSRI), ингибиторы обратного захвата серотонина-норэпинефрина (SNRI), норадренергические и специфические серотонинергические антидепрессанты (NASSA), ингибиторы обратного захвата норэпинефрина (норадреналина) (NRI), ингибиторы обратного захвата норэпинефрина-допамина или агонисты серотонина 1A), антагонистов допамина, альфа-2-дельта-лигандов и антагонистов NK1 и, необязательно, по меньшей мере с одним фармацевтически приемлемым носителем или наполнителем.
Следующий аспект изобретения относится к производному 1-аминоалкилциклогексана (например, нерамексану или его фармацевтически приемлемой соли, такой как нерамексана мезилат) в комбинации с добавочным фармацевтическим средством, выбранным из антидепрессантов или средств против тревожности (таких как селективные ингибиторы обратного захвата серотонина (SSRI), ингибиторы обратного захвата серотонина-норэпинефрина (SNRI), норадренергические и специфические серотонинергические антидепрессанты (NASSA), ингибиторы обратного захвата норэпинефрина (норадреналина) (NRI), ингибиторы обратного захвата норэпинефрина-допамина или агонисты серотонина 1A), антагонистов допамина, альфа-2-дельта-лигандов и антагонистов NK1 и, необязательно, по меньшей мере с одним фармацевтически приемлемым носителем или наполнителем для лечения или предупреждения тиннитуса.
Далее настоящее изобретение относится к способу лечения или предупреждения кохлеарного тиннитуса у нуждающегося в этом субъекта, причем указанный способ включает введение эффективного количества производного 1-аминоалкилциклогексана или его фармацевтически приемлемой соли (например, нерамексана или его фармацевтически приемлемой соли, такой как нерамексана мезилат) в фармацевтически приемлемом носителе.
Следующий аспект изобретения относится к такому способу, при котором лечение проводят в промежутке от трех до двенадцати месяцев со времени начального проявления тиннитуса.
Следующий аспект изобретения относится к такому способу, при котором лечение проводят в промежутке от трех до восьми месяцев со времени начального проявления тиннитуса.
Следующий аспект изобретения относится к такому способу, при котором тиннитус сочетается с потерей слуха, включая незначительную потерю слуха.
Следующий аспект изобретения относится к такому способу, при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) вводят в диапазоне доз от примерно 5 мг до примерно 150 мг в день или при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) вводят в диапазоне от примерно 5 мг до примерно 100 мг в день, или при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) вводят в диапазоне доз от примерно 5 мг до примерно 75 мг в день, или при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) вводят в дозе примерно 50 мг в день, или при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) вводят в дозе примерно 75 мг в день.
Следующий аспект изобретения относится к такому способу, при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) вводят один раз в день, два раза в день (b.i.d.) или три раза в день.
Следующий аспект изобретения относится к такому способу, при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) вводят два раза в день (b.i.d.).
Следующий аспект изобретения относится к такому способу, при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) вводят в лекарственном составе с немедленным высвобождением.
Следующий аспект изобретения относится к такому способу, при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) вводят в лекарственном составе с модифицированным высвобождением.
Далее настоящее изобретение относится к способу лечения или предупреждения кохлеарного тиннитуса у нуждающегося в этом субъекта, причем указанный способ включает введение эффективного количества производного 1-аминоалкилциклогексана или его фармацевтически приемлемой соли (например, нерамексана или его фармацевтически приемлемой соли, такой как нерамексана мезилат), а также добавочного фармацевтического средства, заведомо эффективного в лечении или предупреждении тиннитуса.
Следующий аспект изобретения относится к способу лечения или предупреждения тиннитуса, в частности, кохлеарного тиннитуса у нуждающегося в этом субъекта, причем указанный способ включает введение производного 1-аминоалкилциклогексана или его фармацевтически приемлемой соли (например, нерамексана или его фармацевтически приемлемой соли, такой как нерамексана мезилат) и добавочного фармацевтического средства, причем добавочное фармацевтическое средство выбирают из антидепрессантов или средств против тревожности (таких как селективные ингибиторы обратного захвата серотонина (SSRI), ингибиторы обратного захвата серотонина-норэпинефрина (SNRI), норадренергические и специфические серотонинергические антидепрессанты (NASSA), ингибиторы обратного захвата норэпинефрина (норадреналина) (NRI), ингибиторы обратного захвата норэпинефрина-допамина или агонисты серотонина 1A), антагонистов допамина, альфа-2-дельта-лигандов и антагонистов NK1.
Следующий аспект изобретения относится к такому способу, при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) и добавочное фармацевтическое средство вводят совместно.
Следующий аспект изобретения относится к такому способу, при котором производное 1-аминоалкилциклогексана (например, нерамексан или его фармацевтически приемлемую соль, такую как нерамексана мезилат) и добавочное фармацевтическое средство вводят в одном лекарственном составе.
Далее настоящее изобретение относится к способу лечения тиннитуса у нуждающегося в этом субъекта, причем указанный способ включает введение эффективного количества производного 1-аминоалкилциклогексана или его фармацевтически приемлемой соли (например, нерамексана или его фармацевтически приемлемой соли, такой как нерамексана мезилат) в фармацевтически приемлемом носителе, причем лечение проводят в промежутке от трех до двенадцати месяцев со времени начального проявления тиннитуса.
Следующий аспект изобретения относится к такому способу, при котором лечение проводят в промежутке от трех до восьми месяцев со времени начального проявления тиннитуса.
Далее настоящее изобретение относится к способу лечения или предупреждения тиннитуса, сочетающегося с потерей слуха (включая незначительную потерю слуха), у нуждающегося в этом субъекта, причем указанный способ включает введение эффективного количества производного 1-аминоалкилциклогексана или его фармацевтически приемлемой соли (например, нерамексана или его фармацевтически приемлемой соли, такой как нерамексана мезилат) в фармацевтически приемлемом носителе.
Далее настоящее изобретение относится к фармацевтической композиции для лечения или предупреждения кохлеарного тиннитуса, содержащей терапевтически эффективное количество производного 1-аминоалкилциклогексана или его фармацевтически приемлемой соли (например, нерамексана или его фармацевтически приемлемой соли, такой как нерамексана мезилат), а также по меньшей мере один фармацевтически приемлемый носитель или наполнитель.
Далее настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество производного 1-аминоалкилциклогексана или его фармацевтически приемлемой соли (например, нерамексана или его фармацевтически приемлемой соли, такой как нерамексана мезилат) в комбинации с добавочным фармацевтическим средством, заведомо эффективным для лечения или предупреждения тиннитуса, а также, по меньшей мере, с одним фармацевтически приемлемым носителем или наполнителем.
На чертеже показаны данные поискового исследования по лечению тиннитуса нерамексаном, демонстрирующие изменение балльной оценки по вопроснику Tinnitus-Beeinträchtigungs-Fragebogen (TBF-12) (т.е. германской версии вопросника Tinnitus Handicap Inventory или THI) в конце лечения в дозовой группе 50 мг по сравнению с плацебо.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При использовании здесь термин "тиннитус" включает, но, не ограничиваясь ими, все проявления субъективного и объективного тиннитуса, а также его острые, подострые и хронические формы. Он также включает кохлеарный тиннитус и тиннитус, сочетающийся с потерей слуха или незначительным снижением слуха.
При использовании здесь термин "кохлеарный тиннитус" относится к тиннитусу в частотном диапазоне потери слуха. Термин "кохлеарный тиннитус" включает моторный тиннитус, кохлеарный моторный тиннитус или тиннитус волосковых клеток. Кохлеарный тиннитус могут вызывать токсичные лекарства (например, такие петлевые диуретики как фуросемид, такие аминогликозиды как гентамицин) или воздействие громкого звука (например, акустическая травма, хронический профессиональный шум).
При использовании здесь термин "подострый тиннитус" включает тиннитус продолжительностью от трех (3) до двенадцати (12) месяцев.
При использовании здесь термин "потеря слуха" (или "ухудшение слуха") означает полную или частичную потерю способности замечать звуки или различать между собой разные звуки. Потерю слуха диагностируют клинически по увеличению порога слышимости на тональной аудиограмме. Уровень порога слышимости для левого/правого уха в децибелах (дБ) можно рассчитать как среднюю величину по фактическим цифрам на разных частотах при записи тональной аудиограммы, т.е. как средний уровень порога слышимости на частотах 0,25, 0,5, 1, 2 и 4 кГц. Существуют разные степени потери слуха. Потеря слуха определяется здесь как "незначительная потеря слуха" (или "незначительное ухудшение слуха"), если уровень порога слышимости находится в пределах 20-40 децибел (дБ). Тиннитус, индуцированный шумами, в сочетании с потерей слуха может быть вызван острыми или хроническими воздействиями. Самой частой причиной тиннитуса в сочетании с потерей слуха, индуцированного шумами, является длительное воздействие избыточного шума, однако такой тиннитус в сочетании с потерей слуха могут вызывать и чрезвычайно громкие звуки. Нейросенсорный тиннитус в сочетании с потерей слуха развивается вследствие нечувствительности внутреннего уха или функционального нарушения в слуховом отделе нервной системы. Нейросенсорный тиннитус в сочетании с потерей слуха могут вызывать аномалии в волосковых клетках кортиева органа улитки.
В рамках настоящей заявки термин "субъект" охватывает млекопитающих, включая животных и человека.
Термин производное 1-аминоалкилциклогексана используется здесь для описания соединения, которое представляет собой 1-аминоалкилциклогексан, или соединения, полученного из 1-аминоалкилциклогексана, например, фармацевтически приемлемые соли 1-аминоалкилциклогексанов. Существующие производные 1-аминоалкилциклогексана также могут быть описаны как "производные 1-аминоциклогексана".
Производные 1-аминоалкилциклогексана, предлагаемые настоящим изобретением, могут быть описаны общей формулой (I):

где R* означает -(CH2)n-(CR6R7)m-NR8R9,
где n+m = 0, 1 или 2,
где радикалы от R1 до R7 независимо друг от друга могут быть выбраны из группы, состоящей из водорода и C1-6алкила, где R8 и R9 независимо друг от друга могут быть выбраны из группы, состоящей из водорода и C1-6алкила, или вместе представляют собой низший алкилен -(CH2)x-, в котором x составляет величину от 2 до 5, включительно, а также их оптические изомеры, энантиомеры, гидраты и фармацевтически приемлемые соли.
Неограничивающие примеры 1-аминоалкилциклогексанов, доступных для применения в соответствии с настоящим изобретением, включают:
1-амино-1,3,5-триметилциклогексан,
1-амино-1(транс),3(транс),5-триметилциклогексан,
1-амино-1(цис),3(цис),5-триметилциклогексан,
1-амино-1,3,3,5-тетраметилциклогексан,
1-амино-1,3,3,5,5-пентаметилциклогексан (нерамексан),
1-амино-1,3,5,5-тетраметил-3-этилциклогексан,
1-амино-1,5,5-триметил-3,3-диэтилциклогексан,
1-амино-1,5,5-триметил-цис-3-этилциклогексан,
1-амино-(1S,5S)цис-3-этил-1,5,5-триметилциклогексан,
1-амино-1,5,5-триметил-транс-3-этилциклогексан,
1-амино-(1R,5S)транс-3-этил-1,5,5-триметилциклогексан,
1-амино-1-этил-3,3,5,5-тетраметилциклогексан,
1-амино-1-пропил-3,3,5,5-тетраметилциклогексан,
N-метил-1-амино-1,3,3,5,5-пентаметилциклогексан,
N-этил-1-амино-1,3,3,5,5-пентаметилциклогексан,
N-(1,3,3,5,5-пентаметилциклогексил)пирролидин,
3,3,5,5-тетраметилциклогексилметиламин,
1-амино-1,3,3,5(транс)-тетраметилциклогексан (аксиальная аминогруппа),
3-пропил-1,3,5,5-тетраметилциклогексиламина полугидрат,
1-амино-1,3,5,5-тетраметил-3-этилциклогексан,
1-амино-1,3,5-триметилциклогексан,
1-амино-1,3-диметил-3-пропилциклогексан,
1-амино-1,3(транс),5(транс)-триметил-3(цис)-пропилциклогексан,
1-амино-1,3-диметил-3-этилциклогексан,
1-амино-1,3,3-триметилциклогексан,
цис-3-этил-1(транс)-3(транс)-5-триметилциклогексамин,
1-амино-1,3(транс)-диметилциклогексан,
1,3,3-триметил-5,5-дипропилциклогексиламин,
1-амино-1-метил-3(транс)-пропилциклогексан,
1-метил-3(цис)-пропилциклогексиламин,
1-амино-1-метил-3(транс)-этилциклогексан,
1-амино-1,3,3-триметил-5(цис)-этилциклогексан,
1-амино-1,3,3-триметил-5(транс)-этилциклогексан,
цис-3-пропил-1,5,5-триметилциклогексиламин,
транс-3-пропил-1,5,5-триметилциклогексиламин,
N-этил-1,3,3,5,5-пентаметилциклогексиламин,
N-метил-1-амино-1,3,3,5,5-пентаметилциклогексан,
1-амино-1-метилциклогексан,
N,N-диметил-1-амино-1,3,3,5,5-пентаметилциклогексан,
2-(3,3,5,5-тетраметилциклогексил)этиламин,
2-метил-1-(3,3,5,5-тетраметилциклогексил)пропил-2-амин,
2-(1,3,3,5,5-пентаметилциклогексил)этиламина полугидрат,
N-(1,3,3,5,5-пентаметилциклогексил)пирролидин,
1-амино-1,3(транс),5(транс)-триметилциклогексан,
1-амино-1,3(цис),5(цис)-триметилциклогексан,
1-амино-(1R,5S)транс-5-этил-1,3,3-триметилциклогексан,
1-амино-(1S,5S)цис-5-этил-1,3,3-триметилциклогексан,
1-амино-1,5,5-триметил-3(цис)-изопропилциклогексан,
1-амино-1,5,5-триметил-3(транс)-изопропилциклогексан,
1-амино-1-метил-3(цис)-этилциклогексан,
1-амино-1-метил-3(цис)-метилциклогексан,
1-амино-5,5-диэтил-1,3,3-триметилциклогексан,
1-амино-1,3,3,5,5-пентаметилциклогексан,
1-амино-1,5,5-триметил-3,3-диэтилциклогексан,
1-амино-1-этил-3,3,5,5-тетраметилциклогексан,
N-этил-1-амино-1,3,3,5,5-пентаметилциклогексан,
N-(1,3,5-триметилциклогексил)пирролидин или пиперидин,
N-[1,3(транс),5(транс)-триметилциклогексил]пирролидин или пиперидин,
N-[1,3(цис),5(цис)-триметилциклогексил]пирролидин или пиперидин,
N-(1,3,3,5-тетраметилциклогексил)пирролидин или пиперидин,
N-(1,3,3,5,5-пентаметилциклогексил)пирролидин или пиперидин,
N-(1,3,5,5-тетраметил-3-этилциклогексил)пирролидин или пиперидин,
N-(1,5,5-триметил-3,3-диэтилциклогексил)пирролидин или пиперидин,
N-(1,3,3-триметил-цис-5-этилциклогексил)пирролидин или пиперидин,
N-[(1S,5S)цис-5-этил-1,3,3-триметилциклогексил]пирролидин или пиперидин,
N-(1,3,3-триметил-транс-5-этилциклогексил)пирролидин или пиперидин,
N-[(1R,5S)транс-5-этил,3,3-триметилциклогексил]пирролидин или пиперидин,
N-(1-этил-3,3,5,5-тетраметилциклогексил)пирролидин или пиперидин,
N-(1-пропил-3,3,5,5-тетраметилциклогексил)пирролидин или пиперидин,
N-(1,3,3,5,5-пентаметилциклогексил)пирролидин,
а также их оптические изомеры, диастереомеры, энантиомеры, гидраты, фармацевтически приемлемые соли и смеси.
Производные 1-аминоалкилциклогексана (например, нерамексан, 1-амино-1,3,3,5,5-пентаметилциклогексан) раскрыты в патентах США №№6034134 и 6071966. Производные 1-аминоалкилциклогексана (например, нерамексан) в соответствии с изобретением могут быть использованы в виде любых фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов и пролекарств, и любые ссылки на производные 1-аминоалкилциклогексана (например, на нерамексан) в этом описании следует воспринимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам и пролекарствам.
При использовании термина антидепрессанты или средства против тревожности (такие как селективные ингибиторы обратного захвата серотонина (SSRI), ингибиторы обратного захвата серотонина-норэпинефрина (SNRI), норадренергические и специфические серотонинергические антидепрессанты (NASSA), ингибиторы обратного захвата норэпинефрина (норадреналина) (NRI), ингибиторы обратного захвата норэпинефрина-допамина или агонисты серотонина 1A) включает: флуоксетин, флувоксамин, пароксетин, циталопрам, эсциталопрам, сертралин, бупропион, дезипрамин, ребоксетин, вилоксазин, амиртазапин, милнаципран, нефазодон, венлафаксин, десвенлафаксин, дулоксетин, миртазапин, атомоксетин, буспирон и их фармацевтически приемлемые соли.
При использовании здесь термин антагонист допамина включает транс-1-{4-[2-[4-(2,3-дихлорфенил)-пиперазин-1-ил]-этил]-циклогексил}-3,3-диметилмочевину и ее фармацевтически приемлемые соли.
При использовании здесь термин альфа-2-дельта-лиганд включает габапентин, прегабалин, фенибут, PF-2393296, PF-293765 и их фармацевтически приемлемые соли.
При использовании здесь термин антагонист NK1 включает апрепитант, фосапрепитант, вестипитант, касопитант, AV-608, диопетин и LY-686017, а также их фармацевтически приемлемые соли.
Фармацевтически приемлемые соли включают, но не ограничиваясь ими, кислотно-аддитивные соли, такие как соли, полученные при добавлении соляной, метилсульфоновой, бромистоводородной, иодистоводородной, хлорной, серной, азотной, фосфорной, уксусной, пропионовой, гликолевой, молочной, пировиноградной, малоновой, янтарной, фумаровой, винной, лимонной, бензойной, угольной, коричной, миндальной, метансульфоновой, этансульфоновой, гидроксиэтансульфоновой, бензолсульфоновой, п-толуолсульфоновой, циклогексансульфаминовой, салициловой, п-аминосалициловой, 2-феноксибензойной и 2-ацетоксибензойной кислоты. Все указанные соли (или другие аналогичные соли) могут быть изготовлены общепринятыми способами. Природа соли некритична при том условии, что она не является токсичной и существенным образом не препятствует проявлению желательной фармакологической активности.
Термин "аналог" или "производное" используется в общепринятом фармацевтическом смысле для ссылки на молекулу, которая по своей структуре сходна с эталонной молекулой (такой как нерамексан), но была модифицирована целенаправленным и контролируемым образом для замены одного или более специфических заместителей эталонной молекулы альтернативным заместителем, тем самым создавая молекулу, которая по своей структуре сходна с эталонной молекулой. Синтез и скрининг аналогов (например, с применением структурного и/или биохимического анализа) для идентификации немного модифицированных вариантов известного соединения, которые могут обладать улучшенными или смещенными свойствами (такими как повышенная мощность и/или избирательность по отношению к специфическому целевому типу рецепторов, большей способностью проникать через гематоэнцефалические барьеры млекопитающих, меньшими побочными эффектами и т.д.) представляют собой подход к разработке лекарств, который хорошо известен в фармацевтической химии.
Термин "лечить" означает ослабление или облегчение по меньшей мере одного симптома заболевания у субъекта. В смысловых рамках настоящего изобретения термин "лечить" также означает приостановку, задержку начала (то есть период, предшествующий клиническим проявлениям заболевания) и/или снижение риска развития или ухудшения заболевания.
Термин "терапевтически эффективный (ая, ое)" применительно к дозе или количеству относится к количеству соединения или фармацевтической композиции, достаточному для получения такого результата, как желательная активность при введении в организм нуждающегося в этом млекопитающего.
Фраза "фармацевтически приемлемый (ая, ое)" при использовании применительно к композициям, предлагаемым изобретением, относится к молекулярным объектам и другим ингредиентам таких композиций, которые физиологически переносимы и в типичном случае не вызывают нежелательных реакций при введении млекопитающему (например, человеку). В типичном случае термин "фармацевтически приемлемый (ая, ое)" означает официальное разрешение к применению регулятивным органом федерального правительства или властей штата либо перечисление в фармакопее США или другой общепризнанной фармакопее для применения на млекопитающих и, более конкретно, на человеке.
Термин "носитель" применительно к фармацевтическим композициям, предлагаемым изобретением, относится к разбавителю, наполнителю или переносчику, вместе с которым вводят активное соединение (например, нерамексан). В качестве указанных фармацевтических носителей могут быть использованы такие стерильные жидкости, как вода, солевые растворы, водные растворы декстрозы, водные растворы глицерина и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, в частности, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Подходящие фармацевтические носители описаны в ссылке "Remington's Pharmaceutical Sciences" by A.R.Gennaro, 20th Edition.
Термин "около" или "приблизительно" обычно означает отклонение в пределах 20%, альтернативно, в пределах 10%, включая отклонение в пределах 5% от указанной величины или диапазона. В альтернативном варианте, особенно в биологических системах, термин "приблизительно" означает отклонение в пределах десятичного логарифма (т.е. порядка величины), включая удвоенное значение данной величины.
В сочетании с предлагаемыми способами настоящее изобретение также предлагает фармацевтические композиции, содержащие терапевтически эффективное количество производного 1-аминоалкилциклогексана (например, нерамексана). Композиции, предлагаемые изобретением, могут дополнительно содержать носитель или наполнитель (фармацевтически приемлемые). Композиции могут быть представлены в лекарственных формах, предназначенных для введения один раз в день, два раза в день или три раза в день.
Активный ингредиент (например, нерамексан, такой как нерамексана мезилат) или композицию, предлагаемую настоящим изобретением, можно применять для лечения по меньшей мере одного из указанных нарушений, причем медикамент адаптирован или соответствующим образом приготовлен для специфического введения, как это раскрыто здесь (например, для введения один раз в день, два раза в день или три раза в день). С этой целью упаковочный вкладыш и/или информационная памятка для больного содержат соответствующую информацию.
Активный ингредиент (например, нерамексан, такой как нерамексана мезилат) или композицию, предлагаемую настоящим изобретением, можно использовать для изготовления лекарственного средства для лечения по меньшей мере одного из указанных нарушений, причем лекарственное средство адаптировано или соответствующим образом приготовлено для специфического введения, как это раскрыто здесь (например, для введения один раз в день, два раза в день или три раза в день). С этой целью упаковочный вкладыш и/или информационная памятка для больного содержат соответствующую информацию.
Предлагаемая настоящим изобретением лекарственная форма производного 1-аминоалкилциклогексана (например, нерамексана) может представлять собой твердую, полутвердую или жидкую лекарственную форму в соответствии со следующим.
Производные 1-аминоалкилциклогексана, предлагаемые настоящим изобретением (например, нерамексан), можно вводить перорально, топически, парентерально или через слизистые оболочки (например, буккально, посредством ингаляции или ректально) в дозированных лекарственных составах, содержащих традиционные нетоксичные фармацевтически приемлемые носители. Еще в одном варианте осуществления изобретения производное 1-аминоалкилциклогексана для введения педиатрическим субъектам может быть представлено в жидкой лекарственной форме с вкусо-ароматическими добавками (например, с запахом и вкусом мяты). Производные 1-аминоалкилциклогексана, предлагаемые настоящим изобретением, можно вводить перорально в лекарственной форме капсул, таблеток и т.п. либо в полутвердой или жидкой лекарственной форме (см. ссылку Remington's Pharmaceutical Sciences, 20th Edition, by A.R.Gennaro).
Для перорального введения в лекарственной форме таблеток или капсул производные 1-аминоалкилциклогексана, рассматриваемые в настоящем изобретении (например, нерамексан), можно комбинировать с такими нетоксичными, фармацевтически приемлемыми наполнителями, как связующие агенты (например, желатинированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза), заполнителями (например, лактозой, сахарозой, глюкозой, маннитом, сорбитом и другими редуцирующими и нередуцирующими сахарами, микрокристаллической целлюлозой, сульфатом кальция или вторичным кислым фосфорнокислым кальцием), скользящими веществами (например, стеаратом магния, тальком или диоксидом кремния, стеариновой кислотой, стеарилфумаратом натрия, бегенатом глицерина, стеаратом кальция и т.п.), дезинтегрирующими агентами (например, картофельным крахмалом или натриевой солью гликолята крахмала) или смачивающими агентами (например, лаурилсульфатом натрия), с красящими и вкусовыми/ароматизирующими агентами, желатином, подсластителями, природными и синтетическими смолами (такими как гуммиарабик, трагакант или альгинаты), буферными солями, карбоксиметилцеллюлозой, полиэтиленгликолем, восками и т.д.
Таблетки могут быть покрыты концентрированным сахарным раствором, который может содержать, например, гуммиарабик, желатин, тальк, двуокись титана и т.п. В альтернативном варианте таблетки могут быть покрыты полимером, который растворяется в сильно летучем органическом растворителе или в смеси органических растворителей. В специфических вариантах осуществления изобретения нерамексан входит в состав таблеток с немедленным высвобождением (IR) или модифицированным высвобождением (MR). Твердые лекарственные формы с немедленным высвобождением позволяют высвободить весь активный ингредиент или его большую часть в течение короткого промежутка времени, например, 60 минут или менее, что делает возможным быстрое всасывание лекарства (лекарственные составы с немедленным высвобождением таких 1-аминоалкилциклогексанов, как нерамексан, раскрыты в опубликованных патентных заявках США №№2006/0002999 и 2006/0198884, предметное содержание которых включено в качестве ссылки). Твердые пероральные лекарственные формы с модифицированным высвобождением обеспечивают замедленное высвобождение активного ингредиента на протяжении длительного времени, что направлено на поддержание терапевтически эффективного уровня в плазме в течение столь же длительного времени и/или на модификацию других фармакокинетических свойств активного ингредиента (лекарственные составы с модифицированным высвобождением нерамексана раскрыты в опубликованной патентной заявке США №2007/0141148, предметное содержание которой включено в качестве ссылки). Например, нерамексана мезилат может быть представлен в лекарственной форме с модифицированным высвобождением (включая таблетки с модифицированным высвобождением) для доставки нерамексана мезилата в дозе 50 мг.
Для лекарственных составов в виде желатиновых капсул производные 1-аминоалкилциклогексана, рассматриваемые в настоящем изобретении (например, нерамексан), можно смешивать, например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы активных веществ с применением либо вышеупомянутых наполнителей для таблеток, например, лактозы, сахарозы, сорбита, маннита, крахмалов (например, картофельного крахмала, кукурузного крахмала или амилопектина), производных целлюлозы, либо желатина. Твердые желатиновые капсулы также могут быть заполнены жидкими или полутвердыми лекарственными составами.
Производные 1-аминоалкилциклогексана, рассматриваемые в настоящем изобретении (например, нерамексан), также можно вводить в микросферах или микрокапсулах, например, изготовленных из полигликолевой кислоты/молочной кислоты (PGLA) (см., например, патенты США №№5814344, 5100669 и 4849222, публикации PCT №№ WO 95/11010 и WO 93/07861). Для достижения управляемого высвобождения лекарства можно использовать биосовместимые полимеры, включая, например, полимолочную кислоту, полигликолевую кислоту, сополимеры полимолочной и полигликолевой кислот, полиэпсилон-капролактон, полигидроксимасляную кислоту, полиортоэфиры, полиацетали, полигидропираны, полицианоакрилаты и поперечно сшитые или алифатические блок-сополимеры гидрогелей.
Также можно использовать включение производных 1-аминоалкилциклогексана в состав полутвердых или жидких лекарственных форм. Производное 1-аминоалкилциклогексана (например, нерамексан) может занимать от 0,1 до 99% по весу в составе лекарства, более специфически - от 0,5 до 20% по весу в составе лекарства, предназначенного для инъекций, и от 0,2 до 50% по весу в составе лекарства, предназначенного для перорального введения.
В одном из вариантов осуществления изобретения производное 1-аминоалкилциклогексана (например, нерамексан) вводят больному в лекарственном составе с модифицированным высвобождением. Лекарственные формы с модифицированным высвобождением являются средством для улучшения согласованности больных с лечением и для обеспечения эффективной и безопасной терапии за счет снижения частоты неблагоприятных реакций на лекарство. По сравнению с лекарственными формами немедленного высвобождения лекарства с модифицированным высвобождением можно применять для пролонгирования фармакологического действия после введения, а также для уменьшения вариабельности концентрации лекарства в плазме в интервале между дозами, то есть для элиминации или уменьшения острых пиков.
Лекарственная форма с модифицированным высвобождением может содержать стержень, либо покрытый лекарством, либо заключающий в себе лекарство. Существующий стержень покрывают полимером, модифицирующим высвобождение, внутри которого диспергировано лекарство. Полимер, модифицирующий высвобождение, постепенно распадается, то есть высвобождает лекарство на протяжении длительного времени. Таким образом, самый наружный слой композиции эффективно сокращается, посредством чего регулирует диффузию лекарства в покровном слое, когда композиция вступает в контакт с водной окружающей средой, т.е. с содержимым желудочно-кишечного тракта. Чистая скорость диффузии лекарства зависит, главным образом, от способности желудочного сока проникать через покровный слой или матрицу и от растворимости лекарства, как такового.
Еще в одном варианте осуществления изобретения производное 1-аминоалкилциклогексана (например, нерамексан) включают в жидкий лекарственный состав для перорального применения. Жидкие препараты для перорального введения могут, например, иметь форму растворов, сиропов, эмульсий или суспензий либо могут быть представлены в виде сухого продукта для восстановления водой или другим подходящим носителем перед применением. Можно удобным образом готовить препараты для перорального введения, обеспечивающие управляемое или отсроченное высвобождение активного соединения. Жидкие пероральные лекарственные составы 1-аминоалкилгексанов, таких как нерамексан, описаны в международной заявке PCT № PCT/US 2004/037026, предметное содержание которой включено в качестве ссылки.
Рассматриваемые в настоящем изобретении производные 1-аминоалкилциклогексана (например, нерамексан), представленные в жидкой форме для перорального введения, можно комбинировать с нетоксичными, фармацевтически приемлемыми, инертными носителями (например, этанолом, глицерином, водой), с суспендирующими агентами (например, сиропом сорбита, производными целлюлозы или гидрогенизированными пищевыми жирами), с эмульгирующими агентами (например, лецитином или гуммиарабиком), неводными носителями (например, миндальным маслом, жирными эфирами, этиловым спиртом или фракционированными растительными маслами), с консервантами (например, метил- или пропил-п-гидроксибензоатами или сорбиновой кислотой) и т.п. Для стабилизации лекарственных форм также можно добавлять такие стабилизирующие агенты, как антиоксиданты (BHA, BHT, пропилгаллат, аскорбат натрия, лимонную кислоту). Например, растворы могут содержать по весу приблизительно от 0,2% до 20% нерамексана с использованием для баланса сахара и смеси этанола, воды, глицерина и пропиленгликоля. В необязательном порядке такие жидкие лекарственные составы могут содержать красители, вкусовые добавки/ароматизаторы, сахарин и карбоксиметилцеллюлозу, как загуститель, либо другие наполнители.
Еще в одном варианте осуществления изобретения терапевтически эффективное количество производного 1-аминоалкилциклогексана (например, нерамексана) вводят в виде перорального раствора, содержащего консервант, подсластитель, солюбилизатор и растворитель. Пероральный раствор может включать один или более буферов, вкусо-ароматических агентов или добавочных наполнителей. В следующем варианте осуществления изобретения к жидкому пероральному раствору производного нерамексана добавляют перечную мяту или другой вкусо-ароматический наполнитель.
Для введения посредством ингаляции производные 1-аминоалкилциклогексана, предлагаемые настоящим изобретением (например, нерамексан), могут удобным образом доставляться в форме аэрозольного спрея, поступающего из баллончика, находящегося под давлением, или из небулайзера (распылителя) с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, двуокиси углерода или другого подходящего газа. В случае применения аэрозоля, находящегося под давлением, единицу дозирования можно определить при помощи клапана, подающего отмеренное количество. Для применения в ингаляторе или инсуффляторе (порошковдувателе) можно изготовить капсулы и картриджи, например, из желатина, содержащие порошковую смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал.
Растворы для парентерального введения посредством инъекции можно готовить в виде водного раствора или водорастворимой фармацевтически приемлемой соли активного вещества, например, в приблизительной концентрации от 0,5% до 10% по весу. Эти растворы также могут содержать стабилизирующие агенты и/или буферные агенты и могут удобным образом поставляться в ампулах с разными стандартными дозами.
Лекарственные составы, предлагаемые изобретением, можно доставлять парентерально, т.е. посредством внутривенного (i.v.), интрацеребровентрикулярного (i.c.v.), подкожного (s.c.), интраперитонеального (i.p.), внутримышечного (i.m.), субдермального (s.d.) или интрадермального (i.d.) введения прямой инъекцией, например, болюсной инъекцией или непрерывным вливанием. Лекарственные составы для инъекции могут быть представлены в стандартной дозовой форме, например, в ампулах или многодозовых контейнерах с добавленным консервантом. В альтернативном варианте активный ингредиент может быть представлен в виде порошка для восстановления перед применением подходящим носителем, например, апирогенной водой.
Изобретение также предлагает фармацевтическую упаковку или набор, включающий один или более контейнеров, содержащих производное 1-аминоалкилциклогексана (например, нерамексан) и, необязательно, добавочные ингредиенты лекарственного состава. В специфическом варианте осуществления изобретения предлагается нерамексан в виде перорального раствора (2 мг/мл) для введения при помощи шприца емкостью 2 чайные ложки (дозировка KORC®). Каждый оральный шприц снабжен контрольными метками для измерения с линиями на правой стороне шприца (направленного наконечником вниз), которые представляют единицы в tsp (чайных ложках), и такими же метками на левой стороне, которые представляют единицы в мл.
Оптимальное терапевтически эффективное количество можно определить экспериментально, принимая во внимание точный способ введения лекарства, показания, по которым вводят лекарство, индивидуальные особенности субъекта (например, вес тела, общее состояние здоровья, возраст, пол и т.д.), а также предпочтения и опыт лечащего врача или ветеринара.
Дозированные формы для ректального применения могут представлять собой растворы или суспензии, либо могут быть изготовлены в виде суппозиториев или удерживающих клизм, содержащих нерамексан в смеси с нейтральной жировой основой, а также в виде желатиновых ректальных капсул, содержащих активные вещества в смеси с растительным маслом или парафиновым маслом.
Токсичность и терапевтическую эффективность композиций, предлагаемых изобретением, можно определить посредством стандартных фармацевтических процедур на экспериментальных животных, например, определяя LD50 (дозу, летальную для 50% выборки) и ED50 (дозу, терапевтически эффективную для 50% выборки). Соотношение доз, производящих терапевтический и токсический эффект, называется терапевтическим индексом и может быть выражено в виде соотношения LD50/ED50. Предпочтительны такие композиции, которые демонстрируют большие терапевтические индексы.
Подходящие ежедневные дозы активных соединений, рассматриваемых в изобретении, при терапевтическом лечении человека составляют приблизительно 0,01-10 мг/кг веса тела при пероральном введении и 0,001-10 мг/кг веса тела при парентеральном введении. Например, для взрослых подходящие ежедневные дозы нерамексана (например, нерамексана мезилата) находятся в диапазоне приблизительно от примерно 5 мг до примерно 150 мг в день, например, приблизительно от примерно 5 мг до примерно 120 мг, приблизительно от примерно 5 мг до примерно 100 мг или приблизительно от примерно 5 мг до примерно 75 мг, или приблизительно от примерно 5 мг до примерно 50 мг, например, 25 мг или 37,5 мг или 50 мг в день. Например, ежедневную дозу можно подобрать по весу, например, 50 мг в день при весе тела до 90 кг или 75 мг в день для больных с весом тела ≥90 кг. Также применимо эквимолярное количество другой фармацевтически приемлемой соли, сольвата, изомера, конъюгата, пролекарства или производного, например, нерамексана гидрохлорида. Для педиатрических субъектов в возрасте 4-14 лет нерамексан (например, нерамексана мезилат) можно вводить в пероральной жидкой лекарственной форме в приблизительной дозе от примерно 0,5 мг в день до максимальной дозы 10 мг в день.
Ежедневные дозы, указанные здесь, можно вводить, например, в виде одной или двух дозовых единиц один, два или три раза в день. Следовательно, подходящие дозы в расчете на единицу дозирования могут представлять собой ежедневную дозу, разделенную (например, поровну) между числом единиц дозирования, вводимых за день, то есть, в типичном случае будут примерно равны суточной дозе или ее половине, трети, четверти либо шестой части. Таким образом, дозы в расчете на единицу дозирования можно рассчитать, исходя из каждой ежедневной дозы, указанной здесь. Например, суточную (ежедневную) дозу 5 мг можно рассматривать в виде дозовых единиц 5 мг, 2,5 мг, 1,67 мг, 1,25 мг и 0,83 мг в зависимости от выбранного режима введения лекарства. В соответствии с этим, суточную дозу 150 мг можно представить, например, в виде приблизительных дозовых единиц 150 мг, 75 мг, 50 мг, 37,5 мг и 25 мг для соответствующих режимов дозирования лекарства.
Продолжительность лечения может быть кратковременной, например, составлять несколько недель (например, 8-14 недель) или долговременной: до тех пор, пока лечащий врач не сочтет, что дальнейшее введение лекарства не является необходимым.
Производные 1-аминоалкилциклогексана, предлагаемые настоящим изобретением (например, нерамексан), можно применять в виде монотерапии или в комбинации с другим лекарственным средством, предписанным для лечения тиннитуса.
Термин "комбинация" применительно к активным ингредиентам используется здесь для определения единой фармацевтической композиции (рецептуры), содержащей два активных средства (например, фармацевтической композиции, содержащей производное 1-аминоалкилциклогексана, такое как нерамексан, и другое фармацевтическое средство, предписанное для лечения тиннитуса) или двух разных фармацевтических композиций, каждая из которых содержит активное средство (например, композиции, содержащей производное 1-аминоалкилциклогексана, такое как нерамексан, и композиции, содержащей другое фармацевтическое средство, предписанное для лечения тиннитуса), которые предназначены для совместного введения.
В смысловых рамках настоящего изобретения термин "совместное введение" используется для ссылки на введение производного 1-аминоалкилциклогексана, такого как нерамексан, и другого активного средства (например, другого средства, предписанного для лечения кохлеарного тиннитуса) одновременно в одной композиции, одновременно в разных композициях или последовательно. Однако для того, чтобы последовательное введение можно было считать "совместным", производное 1-аминоалкилциклогексана, такое как нерамексан, и второе активное средство необходимо вводить раздельно с некоторым интервалом по времени, который, тем не менее, позволяет получить полезный результирующий эффект при лечении кохлеарного тиннитуса у млекопитающего.
ПРИМЕРЫ ХАРАКТЕРНЫХ ЛЕКАРСТВЕННЫХ СОСТАВОВ
При помощи обычно применяемых растворителей, вспомогательных агентов и носителей активные ингредиенты можно перерабатывать в таблетки, покрытые таблетки, капсулы, капельные растворы, суппозитории, инъекционные и инфузионные препараты и т.п. и применять их в терапевтических целях через пероральный, ректальный, парентеральный и дополнительные способы введения. Таблетки, пригодные для перорального введения, можно изготовить, пользуясь общепринятыми методиками таблетирования. Последующий пример приведен только в качестве иллюстрации и не должен восприниматься как ограничивающий сферу изобретения.
ПРИМЕР ЛЕКАРСТВЕННОГО СОСТАВА 1: Таблетки нерамексана мезилата с немедленным высвобождением
Следующие таблицы представляют состав таблеток нерамексана с немедленным высвобождением в дозировках 12,5, 25,0, 37,5 и 50,0 мг, включая активные компоненты, покровные агенты и другие наполнители.
Таблетки нерамексана мезилата 12,5 мг, покрытые пленкой
[мг]
Таблетки нерамексана мезилата 25,0 мг, покрытые пленкой
[мг]
Таблетки нерамексана мезилата 37,5 мг, покрытые пленкой
[мг]
Таблетки нерамексана мезилата 50,0 мг, покрытые пленкой
[мг]
Следующий пример иллюстрирует изобретение, не ограничивая его сферу.
ПРИМЕР 1: Двойное слепое поисковое исследование по лечению тиннитуса нерамексаном с контролем плацебо
Цель этого поискового проекта заключалась в проведении клинического испытания по оценке эффективности нерамексана при лечении тиннитуса. Основной целью этого исследования было сравнение эффективности, переносимости и безопасности нерамексана мезилата в трех разных дозировках (25, 50 или 75 мг в день) с плацебо на больных с субъективным тиннитусом, по меньшей мере, средней тяжести.
План исследования
В двойном слепом, многоцентровом, рандомизированном исследовании в параллельных группах с контролем плацебо оценивалась эффективность нерамексана на субъектах, страдающих тиннитусом, по меньшей мере, средней тяжести. Приблизительно по 100 больных, которые соответствовали специальным критериям включения и не соответствовали ни одному специальному критерию исключения, были случайным образом приписаны к одной из четырех групп двойного слепого лечения (нерамексана мезилат 25, 50, 75 мг в день или плацебо), что в общей сложности составило приблизительно 400 больных.
Двойной слепой 16-недельный период лечения состоял из 4-недельного периода повышения дозы и 12-недельного периода лечения фиксированной дозой при неизменном поддержании приема лекарства два раза в день. Однако в случае плохой переносимости исследователь мог принять решение о снижении дозы нерамексана на 25 мг в день (или плацебо, соответственно). После фазы лечения имел место 4-недельный период контрольного наблюдения без активного лечения и без ограничений сопутствующей терапии. В целом, в этом исследовании было предусмотрено семь плановых посещений: скрининг, начальная оценка, а также посещения в конце 4-й, 8-й, 12-й, 16-й и 20-й недели.
Плановые посещения для оценки каждого больного проводились следующим образом:
Посещение 1 (скрининг): После подписания формы соглашения субъект проходил врачебное обследование и тестирование в клинической лаборатории. Пригодность больного для исследования оценивали по соответствию критериям включения/исключения. Проводили первоначальное собеседование по тиннитусу. Субъект также заполнял анкету Tinnitus-Beeinträchtigungs-Fragebogen (TBF-12), т.е., модифицированную и ратифицированную немецкую версию анкеты из 12 пунктов (Greimel KV et al., Tinnitus-Beeinträchtigungs-Fragebogen (TBF-12). Manual. Frankfurt am Main: Swets & Zeitlinger B.V.; 2000) of the 25-item Tinnitus Handicap Inventory or THI (Newman CW, et al. Development of the Tinnitus Handicap Inventory. Arch Otolaryngol Head Neck Surg 1996; 122(2): 143-148; Newman CW, et al. Psychometric adequacy of the Tinnitus Handicap Inventory (THI) for evaluating treatment outcome. J Am Acad Audiol 1998; 9(2): 153-160.)), a Hospital Anxiety and Depression Scale - Depression Subscale (HADS-D) Questionnaire and a Hyperacusis (Geräuschüberempfindlichkeit-Fragenbogen (GÜF)) Questionnaire (если это было применимо).
Посещение 2 (начальная оценка): Больного опрашивали о неблагоприятных явлениях и изменениях в сопутствующем лечении/заболевании, причем эти явления/изменения были документированы. Субъекта оценивали на пригодность к исследованию, основываясь на обзорном анализе критериев включения/исключения. Вместе с субъектом обсуждали процедуры исследования, а также разрешенное и запрещенное сопутствующее медикаментозное лечение. Проводили первоначальное собеседование по тиннитусу. Субъект также заполнял анкету TBF-12, вопросник HADS-D и вопросник GÜF (если это было применимо). Субъекта включали в исследование и распределяли в группу лечения испытуемым препаратом (плацебо или нерамексаном), как это описано ниже.
Посещение 3 (4-я неделя): Это посещение проводилось в конце 4-недельного периода повышения дозы. Больного опрашивали о неблагоприятных явлениях и изменениях в сопутствующем лечении/заболевании, причем эти явления/изменения были документированы. Проводили контрольное собеседование по тиннитусу. Субъект также заполнял анкету TBF-12, вопросник HADS-D и вопросник GÜF (если это было применимо). Оценивали согласованность больного с медикаментозным лечением и распределяли лекарство на следующие 4 недели, как это описано ниже.
Посещение 4 (8-я неделя): Это посещение проводилось в конце первого 4-недельного периода двойного слепого лечения фиксированной дозой. Больного опрашивали о неблагоприятных явлениях и изменениях в сопутствующем лечении/заболевании, причем эти явления/изменения были документированы. У субъектов брали образцы крови для определения концентрации нерамексана перед введением дозы. Проводили контрольное собеседование по тиннитусу. Субъект также заполнял анкету TBF-12, вопросник HADS-D и вопросник GÜF (если это было применимо). Оценивали согласованность больного с медикаментозным лечением и распределяли лекарство на следующие 4 недели, как это описано ниже.
Посещение 5 (12-я неделя): Это посещение проводилось в конце второго 4-недельного периода двойного слепого лечения фиксированной дозой. Больного опрашивали о неблагоприятных явлениях и изменениях в сопутствующем лечении/заболевании, причем эти явления/изменения были документированы. Проводили контрольное собеседование по тиннитусу. Субъект также заполнял анкету TBF-12, вопросник HADS-D и вопросник GÜF (если это было применимо). Оценивали согласованность больного с медикаментозным лечением и распределяли лекарство на следующие 4 недели, как это описано ниже.
Посещение 6 (16-я неделя, конец лечения). Это посещение проводилось в конце 12-недельного периода двойного слепого лечения фиксированной дозой. Больного опрашивали о неблагоприятных явлениях и изменениях в сопутствующем лечении/заболевании, причем эти явления/изменения были документированы. Проводили оценку результатов анализов в клинической лаборатории. Проводили контрольное собеседование по тиннитусу, и субъект заполнял анкету TBF-12, вопросник HADS-D и вопросник GÜF (если это было применимо). Также проводили тональную аудиометрию (исследование воздушной проводимости).
Посещение 7 (20-я неделя): Это посещение проводилось в конце 4-недельного периода контрольного наблюдения после приема последней дозы испытуемого лекарства. С субъектом проводили обзорный анализ сопутствующего лечения, а также наличия неблагоприятных явлений со времени последнего посещения. Проводили контрольное собеседование по тиннитусу, и субъект заполнял анкету TBF-12, вопросник HADS-D и вопросник GÜF (если это было применимо).
Введение нерамексана
Таблетки нерамексана мезилата с немедленным высвобождением (12,5 мг и 25 мг), а также соответствующие таблетки плацебо применяли в виде таблеток, покрытых пленкой.
Лекарство поставляли в блистерных коробках, которые раздавали больным от 2-го посещения до 5-го посещения. В каждой блистерной коробке содержалось 4 блистерных карты на 4 недели лечения и 1 запасная блистерная карта. Блистерные карты были идентифицированы по неделям лечения. Ежедневное лекарство в блистерных картах было идентифицировано по дням. Испытуемое лекарство на каждый день исследования было представлено 4 отдельными таблетками. Одна блистерная карта состояла из 32 таблеток (7×4 таблетки: 4 таблетки на день и один запасной день: 4 таблетки на день). Один комплект лекарства для больного состоял из 5 коробок. Коробку 2 добавляли в качестве резервного лекарства к коробке 1 (период повышения дозы) и выдавали только в том случае, если субъект терял блистерную карту из коробки 1 или всю коробку.
Испытуемое лекарство выдавали при 2-м посещении (исходная оценка, день 0). Каждый больной получал одну блистерную коробку, содержащую 5 блистерных карт (включая один запасной блистер) лекарства для двойного слепого лечения (т.е. 32 таблетки). Субъектов инструктировали принимать по 2 таблетки два раза в день (4 таблетки в день), начиная со дня после выдачи испытуемого лекарства и до дня следующего планового посещения (посещение 3). Для тех субъектов, которые были распределены в группы, получающие активное лекарство, в режим принятия доз были включены несколько таблеток плацебо, чтобы обеспечить слепой характер лечения в период повышения дозы. Целевую фиксированную поддерживающую дозу 25, 50 или 75 мг в день вводили, начиная с пятой недели двойного слепого лечения, и продолжали до конца периода лечения в исследовании. При каждом из последующих посещений (посещения 3, 4 и 5, соответствующие концу 4-й, 8-й и 12-й недели) больные с 4-недельным интервалом получали еще по одной блистерной коробке, содержащей 5 блистерных карт с лекарством для двойного слепого лечения на промежуточный период до следующего планового посещения. График лечения расписан в таблице 5.
На протяжении всего периода двойного слепого лечения больные продолжали ежедневно принимать лекарство по схеме 2×2 таблетки с постоянным интервалом 12 часов. В том случае, если больной уже принимал утреннюю дозу испытуемого лекарства в день посещения 4 и 6 (8-я и 16-я неделя), запланированное взятие образцов крови не проводилось. Исследователь должен был заново выдать больному достаточное количество испытуемого лекарства. Больной был должен продолжать прием лекарства по 2 таблетки 2 раза в день с постоянным интервалом 12 часов и должен был вернуться в центр исследования для взятия образца крови на анализ уровня нерамексана перед приемом очередной дозы в промежутке времени между посещениями 4 и 6.
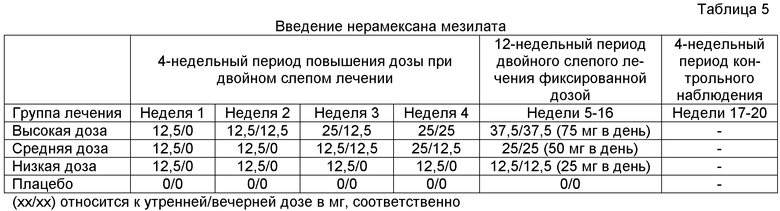
В случае плохой переносимости лекарства исследователь мог принять решение о снижении дозы на 25 мг в день, избегая большей дозы утром, что соответствовало эффективному снижению дозы только в группах, получавших 75 мг в день и 50 мг в день нерамексана мезилата. После пропуска большей утренней таблетки (25 мг или плацебо, соответственно) такие больные должны были продолжать участие в исследовании по плану, хотя и получали утром меньшую таблетку (12,5 мг или плацебо, соответственно) и 2 таблетки разного размера (12,5 мг, 25 мг или плацебо, соответственно) в качестве вечерней дозы. Далее доза должна была оставаться стабильной до конца исследования.
Субъектов инструктировали всегда принимать испытуемое лекарство с учетом индивидуального удобства, но в одно и то же время по ходу всего исследования, по возможности, соблюдая постоянный 12-часовой интервал между дозами (например, в 6:00 и 18:00 или в 8:00 и 20:00). При каждом плановом посещении исследователь спрашивал больного о точках времени приема испытуемого лекарства в предыдущий день. В конце 4-й, 8-й, 12-й и 16-й недели (или при преждевременном окончании своего участия в исследовании) больные возвращались в исследовательский центр, принося с собой выданные им ранее блистерные коробки, содержащие по 5 блистерных карт для оценки согласованности в приеме лекарства.
Эффективность
Основной результат
- Основным критерием эффективности в этом исследовании было изменение суммарной балльной оценки TBF-12 по сравнению с начальной (посещение 2) при заключительном посещении (посещение 6, т.е. 16-я неделя).
Вторичные результаты
- Суммарная балльная оценка TBF-12 (величины и абсолютное изменение по сравнению с начальным уровнем) при всех последующих плановых посещениях, за исключением конечного посещения.
- Изменение суммарной балльной оценки TBF-12 с 16-й недели до 20-й недели (величины и абсолютные изменения).
- Факториальные балльные оценки TBF-12 (величины и абсолютное изменение по сравнению с начальным уровнем, включая изменение с 16-й недели до 20-й недели) при всех последующих посещениях после начальной оценки.
- Величины и абсолютное изменение балльных оценок вопросника о гиперакузии GÜF ("Geräuschüberempfindlichkeits-Fragebogen") по сравнению с начальным уровнем, включая изменение с 16-й недели до 20-й недели, суммарные и факториальные балльные оценки при всех последующих посещениях после начальной оценки, если к больного была представлена гиперакузия.
- Общее клиническое впечатление об изменениях: пункт 27 контрольного собеседования по тиннитусу был подытожен после дихотомизации ответов о любом улучшении (значения 1, 2, 3) в отличие от отсутствия улучшений (значения 4, 5, 6, 7) и о явном улучшении (величины 1, 2) в отличие от отсутствия улучшений (значения 3, 4, 5, 6, 7).
- Общая балльная оценка HADS-D, а также балльные оценки по подшкалам депрессии и страха (величины и абсолютное изменение по сравнению с начальным уровнем, включая изменение с 16-й недели до 20-й недели) при всех посещениях после начальной оценки.
- Значения по результатам собеседования по тиннитусу (начального и последующих) при всех посещениях после начальной оценки; абсолютное изменение по сравнению с начальным уровнем и изменение с 16-й недели до 20-й недели по пунктам 8, 9, 10, 19, 20, 21, 24, 25 и 26 последующих контрольных собеседований.
Анализ данных
Все анализы эффективности были проведены в выборке ITT с применением подхода по переносу данных последнего наблюдения вперед (LOCF). Для определения чувствительности дополнительно был проведен анализ выборки "по протоколу" и всех наблюденных случаев. Все статистические критерии, использованные при оценке основного показателя эффективности (подтверждающее тестирование) и критерии вторичных показателей эффективности (пробные), а также другие статистические критерии, использованные для разведочного анализа, представляли собой критерии двухсторонней гипотезы, реализованные на 5% уровне значимости. Для всех переменных была рассчитана описательная статистика.
Изменение общей балльной оценки TBF-12 по сравнению с начальным уровнем (посещение 2) было проанализировано в двухсторонней модели ANCOVA с использованием группы лечения и исследовательского центра в качестве факторов, а общей балльной оценки TBF-12 в качестве ковариаты.
Для статистической оценки вторичных параметров эффективности было проведено сравнение между нерамексаном и плацебо по посещениям в двухсторонней модели ANCOVA с использованием группы лечения и исследовательского центра в качестве факторов, а соответствующей начальной величины параметра эффективности в качестве ковариаты.
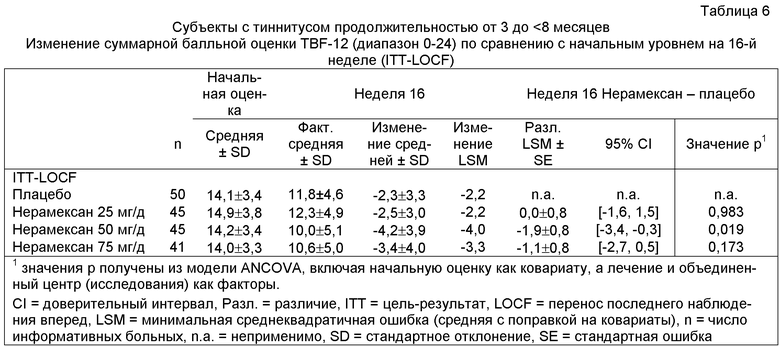
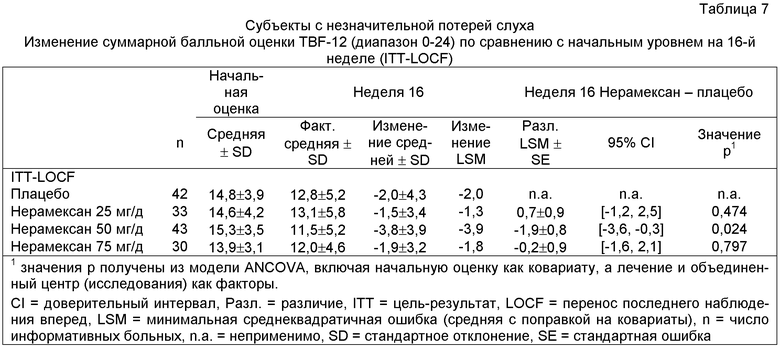
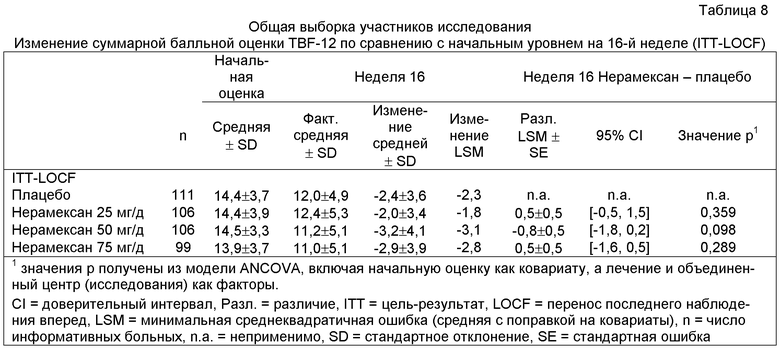
Это клиническое исследование показало многообещающие результаты при оценке показателей эффективности и безопасности. Кроме того, анализ в подгруппах показал, что субъекты, классифицированные соответствующими исследователями как страдающие кохлеарным тиннитусом (т.е. тиннитусом в полосе частот нейросенсорной потери слуха у больного при ощущении тиннитуса на уровне громкости от 3 до 12 дБ), хорошо реагировали на лечение нерамексаном. На чертеже показано изменение балльной оценки TBF-12 в конце лечения в дозовой группе 50 мг по сравнению с группой плацебо. В том же клиническом испытании больные, получавшие лечение в промежутке от трех (3) до восьми (8) месяцев со времени начального проявления тиннитуса (таблица 6), и больные с незначительной потерей слуха (таблица 7) продемонстрировали лучшую реакцию (лечебный эффект в отношении тиннитуса) на нерамексан по сравнению с общей выборкой участников исследования (таблица 8). Улучшение, главным образом, в дозовой группе 50 мг (по сравнению с группой плацебо) было явно более выраженным у больных с тиннитусом, проявившимся от трех до восьми месяцев перед началом лечения, или у больных с незначительной потерей слуха (различие -1,9 балла в каждой группе) и достигало уровня статистической значимости в анализах post-hoc (p=0,019 и 0,024), тогда как различие с плацебо в общей выборке участников исследования составляло только 0,8 балла и не достигало уровня статистической значимости (p=0,098).
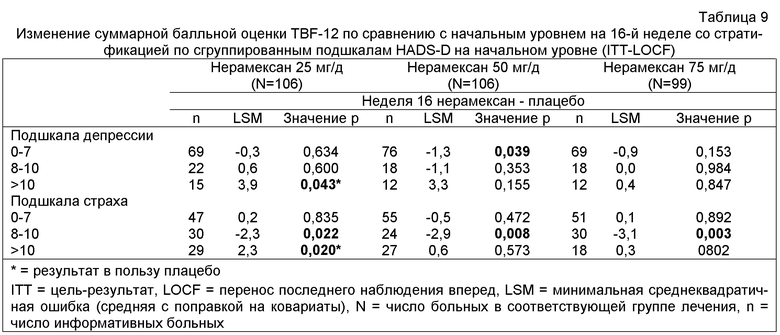
У больных, проявлявших при начальной оценке симптомы страха или депрессии, о чем свидетельствовала суммарная балльная оценка 10 или более по больничной шкале страха и депрессии (HADS), монотерапевтическое лечение нерамексаном в ежедневной дозе 50 или 75 мг давало менее выраженный полезный эффект по сравнению с таким же лечением у больных, имевших при начальном обследовании балльную оценку менее 10 (таблица 9). Поскольку страх и депрессия часто представляют собой медицинскую проблему у больных с тиннитусом (Reynolds et al., Clin. Otolaryngol., 2004, 29, 628-634), комбинирование антидепрессантов и средств против тревожности с нерамексаном может принести дополнительную пользу при лечении этой подгруппы больных тиннитусом.
Эти данные демонстрируют, что нерамексан эффективен при лечении субъектов с тиннитусом, происходящим из улитки, и перед стадией централизации заболевания, а из этого следует, что нерамексан может быть полезен при лечении больных, страдающих кохлеарным тиннитусом.
Сфера настоящего изобретения не ограничивается описанными здесь специфическими вариантами его осуществления. Действительно, специалисту, компетентному в данной области техники, из предшествующего описания будут очевидны различные модификации изобретения в дополнение к тем, которые описаны здесь. Такие модификации должны попадать в сферу прилагаемой формулы изобретения.
Все патенты, патентные заявки, публикации, аналитические методы, литература и другие процитированные здесь материалы включены в качестве ссылок.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТИТРАЦИОННЫЙ КОМПЛЕКТ НЕРАМЕКСАНА И ЕГО ПРИМЕНЕНИЕ В ЛЕЧЕНИИ РАССТРОЙСТВ ВНУТРЕННЕГО УХА | 2008 |
|
RU2459618C2 |
| ТЕРАПИЯ С ИНТЕРВАЛАМИ ДЛЯ ЛЕЧЕНИЯ ТИННИТУСА | 2008 |
|
RU2446794C2 |
| ПРОИЗВОДНЫЕ 1-АМИНОАЛКИЛЦИКЛОГЕКСАНА ДЛЯ ЛЕЧЕНИЯ И ПРЕДУПРЕЖДЕНИЯ ПОТЕРИ СЛУХА | 2008 |
|
RU2452476C2 |
| ПРОИЗВОДНЫЕ 1-АМИНОАЛКИЛЦИКЛОГЕКСАНА ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КОЖИ | 2009 |
|
RU2481828C2 |
| НОВЫЕ КОМБИНАЦИИ НЕРАМЕКСАНА ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ РАССТРОЙСТВ | 2008 |
|
RU2432161C1 |
| ПРОИЗВОДНЫЕ 1-АМИНО-АЛКИЛЦИКЛОГЕКСАНА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ ТУЧНЫМИ КЛЕТКАМИ | 2009 |
|
RU2484813C2 |
| МАТРИЧНАЯ ТАБЛЕТКА С МОДИФИЦИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ НЕРАМЕКСАНА | 2006 |
|
RU2422135C2 |
| СИНТЕЗ МЕЗИЛАТА 1-АМИНО-1,3,3,5,5-ПЕНТАМЕТИЛЦИКЛОГЕКСАНА | 2010 |
|
RU2513090C2 |
| Способы лечения кохлеарной синаптопатии | 2017 |
|
RU2757276C2 |
| СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВА ТЕРМОРЕГУЛЯЦИИ | 2007 |
|
RU2478379C2 |

Предложено применение производного 1-аминоалкилциклогексана нерамексана или его солей для лечения или предупреждения тиннитуса, где лечение проводят в течение от трех до двенадцати месяцев со времени проявления тиннитуса (подострого тиннитуса) (варианты), соответствующий способ лечения и фармацевтическая композиция того же назначения, содержащая нерамексан или его соли в комбинации с дополнительным фармацевтическим средством, выбранным из антидепрессантов или средств против тревожности, антагонистов допамина, альфа-2-дельта-лигандов и антагонистов NK1. Показана эффективность и безопасность лечения перед стадией централизации заболевания, больные хорошо реагировали на лечение нерамексаном. 4 н. и 17 з.п. ф-лы, 1 ил., 9 табл.
1. Применение производного 1-аминоалкилциклогексана, выбранного из нерамексана и его фармацевтически приемлемых солей, для лечения или предупреждения тиннитуса, где лечение проводят в течение от трех до двенадцати месяцев со времени проявления тиннитуса (подострого тиннитуса).
2. Применение производного 1-аминоалкилциклогексана, выбранного из нерамексана и его фармацевтически приемлемых солей, для изготовления лекарственного средства для лечения или предупреждения тиннитуса, где лечение проводят в течение от трех до двенадцати месяцев со времени проявления тиннитуса (подострого тиннитуса).
3. Применение по п.1, где лечение проводят в течение от трех до восьми месяцев со времени проявления тиннитуса.
4. Применение по п.1 или 3, где тиннитус связан с потерей слуха или где тиннитус связан с незначительной потерей слуха.
5. Применение по п.1 или 3, где производное 1-аминоалкилциклогексана представляет собой нерамексана мезилат.
6. Применение по п.5, где нерамексана мезилат вводят в диапазоне от примерно 5 до примерно 150 мг/день, или нерамексана мезилат вводят в диапазоне от примерно 5 до примерно 100 мг/день, или нерамексана мезилат вводят в диапазоне от примерно 5 мг до примерно 75 мг/день, или нерамексана мезилат вводят в дозе 50 мг в день, или нерамексана мезилат вводят в дозе примерно 75 мг/день.
7. Применение по п.1 или 3, где нерамексан или его фармацевтически приемлемую соль вводят один раз в день, два раза в день (b.i.d.) или три раза в день.
8. Применение по п.7, где нерамексан или его фармацевтически приемлемую соль вводят два раза в день.
9. Применение по п.1 или 3, где нерамексан или его фармацевтически приемлемую соль вводят в лекарственной форме с немедленным высвобождением или в лекарственной форме с модифицированным высвобождением.
10. Применение по п.1 или 3, где вводят дополнительное фармацевтическое средство, эффективное для лечения или предупреждения тиннитуса, и необязательно по меньшей мере один фармацевтически приемлемый носитель или наполнитель.
11. Применение по любому из пп.1 или 3, где вводят дополнительное фармацевтическое средство, выбранное из антидепрессантов или средств против тревожности, антагонистов допамина, альфа-2-дельта-лигандов и антагонистов NK1, и необязательно по меньшей мере один фармацевтически приемлемый носитель или наполнитель.
12. Применение по п.11, где антидепрессант или средство против тревожности представляет собой селективный ингибитор обратного захвата серотонина (SSRI), ингибитор обратного захвата серотонина-норэпинефрина (SNRI), норадренергический и специфический серотонинергический антидепрессант (NASSA), ингибитор обратного захвата норэпинефрина (норадреналина) (NRI), ингибитор обратного захвата норэпинефрина-допамина или агонист серотонина 1А.
13. Применение по п.10, где нерамексан или его фармацевтически приемлемую соль и дополнительное фармацевтическое средство вводят совместно.
14. Применение по п.10, где нерамексан или его фармацевтически приемлемую соль и дополнительное фармацевтическое средство вводят в одной препаративной форме.
15. Фармацевтическая композиция, содержащая производное 1-аминоалкилциклогексана, выбранное из нерамексана и его фармацевтически приемлемых солей в комбинации с дополнительным фармацевтическим средством, выбранным из антидепрессантов или средств против тревожности, антагонистов допамина, альфа-2-дельта-лигандов и антагонистов NK1, для лечения или предупреждения тиннитуса, где лечение проводят в течение от трех до двенадцати месяцев со времени проявления тиннитуса (подострого тиннитуса).
16. Фармацевтическая композиция по п.15, в которой антидепрессант или средство против тревожности представляет собой селективный ингибитор обратного захвата серотонина (SSRI), ингибитор обратного захвата серотонина-норэпинефрина (SNRI), норадренергический и специфический серотонинергический антидепрессант (NASSA), ингибитор обратного захвата норэпинефрина (норадреналина) (NRI), ингибитор обратного захвата норэпинефрина-допамина или агонист серотонина 1А.
17. Применение по п.11, где нерамексан или его фармацевтически приемлемую соль и дополнительное фармацевтическое средство вводят совместно.
18. Применение по п.11, где нерамексан или его фармацевтически приемлемую соль и дополнительное фармацевтическое средство вводят в одной лекарственной форме.
19. Способ лечения или предупреждения тиннитуса у субъекта, нуждающегося в этом, включающий введение эффективного количества производного 1-аминоалкилциклогексана, выбранного из нерамексана и его фармацевтически приемлемых солей, где лечение проводят в течение от трех до двенадцати месяцев со времени проявления тиннитуса (подострого тиннитуса).
20. Способ по п.19, где тиннитус связан с потерей слуха или незначительной потерей слуха.
21. Способ по п.19, где лечения проводят в течение от трех до двенадцати месяцев со времени проявления тиннитуса или где лечение проводят в течение от трех до восьми месяцев со времени проявления тиннитуса.
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Новая волна, 2005, с.141 | |||
| Plazas PV et al | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Eur J Pharmacol | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2012-01-10—Публикация
2008-09-10—Подача