Область техники, к которой относится изобретение
Настоящее изобретение относится к терапии с интервалами и/или поддерживающей терапии с использованием 1-аминоалкилциклогексановых производных (например, нерамексана или его фармацевтически приемлемой соли) для лечения субъекта, страдающего тиннитусом.
Уровень техники, к которому относится изобретение
Тиннитус обычно обозначается как «звон в ушах» - ощущение звуков в отсутствие внешнего источника акустических сигналов. Тиннитус определен как «ощущение звука, которое возникает исключительно из-за активности нервной системы без какой-либо соответствующей механической, вибрационной активности улитки, что определяет тиннитус как фантомное слуховое ощущение» (Jastreboff et al., J. Am.Acad.Audiol.2000; 11(3): 162-177).Тиннитус часто связан с пониженной переносимостью звуков (т.е. гиперакузией).
Патофизиология субъективного тиннитуса недостаточно выяснена и определенный патогенез тиннитуса неизвестен. Причиной тиннитуса могут быть многие факторы окружающей среды и индуцируемые веществами факторы. Среди наиболее часто упоминаемых факторов находятся острая акустическая травма, промышленные шумы и развлекательная музыка. В целом тиннитус, очевидно, является результатом нейрональной дисфункции слухового пути. Эта дисфункция обманчиво воспринимается как звук более высокими слуховыми центрами и может вести к функциональным изменениям в слуховом отделе нервной системы. Не поддающиеся адаптации функциональные изменения в корковых структурах могут вести к измененному балансу между возбуждающей и ингибиторной нейротрансмиссией и могут приводить к более тяжелому тиннитусу. Во всех случаях потенциальное нарушение функций слуховых путей и слуховой коры относится к активности префронтальной коры и лимбической системы.
В большинстве случаев (95%) воспринимаемый шум в ушах является исключительно субъективным по природе, например, не может быть идентифицировано никакого физического источника звуковых сигналов и, следовательно, не могут быть услышаны внешние звуки. Осуществляется физическое тестирование для исключения объективного тиннитуса, например, когда ощущение звука пациентом вызывается реальным источником звуковых волн, например, звуком турбулентного потока в кровеносных сосудах, достигающим улитки. Тиннитус может быть классифицирован в соответствии с продолжительностью шума в ушах и степенью проявления шума в ушах (например, тяжестью или раздражающим воздействием шума в ушах) (McCombe et al., Clin. Otolaryngol 2001; 26(5): 388-393 и Davis et al., Epidemiology of Tinnitus.In: Tyler R, editor. Tinnitus Handbook. San Diego: Singular Publishing Group; 2000. p.1-23). В отношении влияния тиннитуса, тиннитус может мучительно беспокоить пациента и может сопровождаться социальными и психологическими осложнениями.
В настоящее время не существует хорошо обоснованного медикаментозного лечения тиннитуса, которое обеспечивает воспроизводимое снижение тиннитуса и беспокойства, обусловленного шумом в ушах, превышающего эффекты плацебо (Dobie, Laryngoscope 1999; 109(8): 1202-1211; Eggermont et al., Trends Neurosci 2004; 27(11): 676-682; и Patterson et al., Int Tinnitus J.2006; 12(2): 149-159).Таким образом, существует потребность в фармацевтических продуктах и методах лечения, которые эффективны при лечении или профилактике тиннитуса. Huynh, et al. (Ann. Pharmacother 1995; 29(3): 311-312) также раскрыли, что существует потребность в исследовании необходимости поддерживающей терапии, а также роли периодов с отсутствием лечения («выходных от лекарства») при разработке новых лекарственных средств для тиннитуса.
1-Аминоалкилциклогексаны, такие как нерамексан (также известный как 1-амино-1,3,3,5,5-пентаметилциклогексан), как обнаружено, являются пригодными для лечения различных заболеваний, особенно при определенных неврологических расстройствах, включая болезнь Альцгеймера и невропатическую боль. 1-Аминоалкилциклогексаны, такие как нерамексан, подробно раскрыты в патентах США № 6034134 и 6071966, содержание этих патентов включено в настоящее описание в качестве ссылки. Считается, что терапевтический эффект 1-аминоалкилциклогексанов, таких как нерамексан, связан с ингибированием эффектов избытка глутамата на рецепторы N-метил-D-аспартата (NMDA) нервных клеток, по этой причине эти соединения относят также к категории антагонистов NMDA или антагонистов рецепторов NMDA. Нерамексан, как также раскрыто, проявляет активность антагониста α9/α10 никотинового рецептора (Plazas, et al., Eur. J. Pharmacol., 2007 Jul. 2; 566 (1-3):11-19).
В патенте США No.6034134 раскрыто, что 1-аминоалкилциклогексаны могут быть пригодны для лечения тиннитуса, благодаря их активности в качестве антагонистов рецепторов NMDA.
Авторы настоящего изобретения обнаружили, что терапия с интервалами или поддерживающая терапия с применением 1-аминоалкилциклогексанов, таких как нерамексан или его фармацевтически приемлемая соль, может быть эффективным подходом к лечению тиннитуса.
Поддерживающая терапия может предотвратить рецидив тиннитуса у больных с достаточными или стабильными эффектами лечения введением пониженной дозы производного 1-аминоалкилциклогексана (например, нерамексана или его фармацевтически приемлемой соли, такой как нерамексана мезилат).
Преимущество, связанное с таким лечением, заключается в существенно сниженной экспозиции лекарства при все еще достаточном эффекте против тиннитуса.
Если тиннитус возник повторно, шанс достаточного эффекта лечения производным 1-аминоалкилциклогексана (например, нерамексаном или его фармацевтически приемлемой солью, такой как нерамексана мезилат) может быть более низким, чем при первом его возникновении, так как необратимые изменения в слуховой системе могут обладать временем для прогрессирования и становиться хроническими.
Однако если симптомы тиннитуса возникают повторно у больных, получающих поддерживающую терапию (например, 20-75% терапевтически эффективной дозы), рецидив может быть более мягким и может с большей чувствительностью отвечать на немедленное увеличение дозы производного 1-аминоалкилциклогексана (например, нерамексана или его фармацевтически приемлемой соли, такой как нерамексана мезилат) до терапевтически эффективной дозы (например, 25 мг нерамексана мезилата два раза в день или 37,5 мг два раза в день для субъектов массой тела более 90 кг, чем у больных без поддерживающей терапии.
Краткое изложение сущности изобретения
Настоящее изобретение относится к производному 1-аминоалкилциклогексана для лечения тиннитуса, где терапевтически эффективное количество производного 1-аминоалкилциклогексана вводят ежедневно в течение первоначального периода, по меньшей мере, три (3) месяца, с последующим вторым периодом, по меньшей мере, в один (1) месяц, где производное 1-аминоалкилциклогексана вводят в дозе, которая составляет 0-75% терапевтически эффективной дозы.
В другом аспекте изобретение относится к применению производного 1-аминоалкилциклогексана для получения лекарственного средства для лечения тиннитуса у нуждающегося в этом субъекта, где терапевтически эффективное количество производного 1-аминоалкилциклогексана вводят ежедневно в течение первоначального периода, по меньшей мере, три (3) месяца, с последующим вторым периодом, по меньшей мере, в один (1) месяц, где производное 1-аминоалкилциклогексана вводят в дозе, которая составляет 0-75% терапевтически эффективной дозы.
В другом аспекте изобретение относится к производному 1-аминоалкилциклогексана для лечения состояния, отвечающего на производное 1-аминоалкилциклогексана, у нуждающегося в этом субъекта, где терапевтически эффективное количество производного 1-аминоалкилциклогексана вводят указанному субъекту ежедневно в течение первоначального периода, по меньшей мере, три (3) месяца, с последующим вторым периодом, по меньшей мере, в один (1) месяц, где производное 1-аминоалкилциклогексана вводят в дозе, которая составляет 0-75% терапевтически эффективной дозы.
В другом аспекте изобретение относится к применению производного 1-аминоалкилциклогексана для получения лекарственного средства для лечения состояния, отвечающего на производное 1-аминоалкилциклогексана, у нуждающегося в этом субъекта, где терапевтически эффективное количество производного 1-аминоалкилциклогексана вводят указанному субъекту ежедневно в течение первоначального периода, по меньшей мере, три (3) месяца, с последующим вторым периодом, по меньшей мере, в один (1) месяц, где производное 1-аминоалкилциклогексана вводят в дозе, которая составляет 0-75% терапевтически эффективной дозы.
Производное 1-аминоалкилциклогексана, а также описанное в настоящем документе лекарственное средство предназначены для введения по указанной выше схеме введения. В одном варианте осуществления производное/лекарственное средство специально адаптируют для предоставления больному соответствующей информации в отношении схемы введения. Соответствующая информация в отношении конкретной схемы введения может быть предоставлена, например, в виде соответствующей информации внутри упаковки или на ней о лекарственной форме, такой как ее внешний вид, например, цвет таблетки или форма таблетки, и/или в виде вкладыша в упаковку, и/или информации для пациента.
В другом аспекте изобретения терапевтически эффективное количество производного 1-аминоалкилциклогексана вводят ежедневно в течение периода, по меньшей мере, три (3) месяца, с последующим периодом, по меньшей мере, в один месяц, где производное 1-аминоалкилциклогексана вводят в дозе, которая составляет выше 0-75%, такой как 20-75% (например, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65% или 70%) или такой как 25-50% терапевтически эффективной дозы.
Снижение дозы производного 1-аминоалкилциклогексана (например, нерамексана или его фармацевтически приемлемой соли, такой как мезилат нерамексана) между введением терапевтически эффективной дозы и введением 0-75%, такой как выше 0-75% или 20-75%, такой как 25-50%, терапевтически эффективной дозы может быть осуществлено ступенчато. Доза 50 мг нерамексана мезилата ежедневно может быть, например, снижена до дозы 25 мг по этапам в 12,5 мг, где дозу 37,5 мг вводят, например, в течение, по меньшей мере, одной недели. Доза 75 мг нерамексана мезилата ежедневно может быть, например, снижена до дозы 25 мг/день. Это может быть осуществлено по этапам в 12,5 мг, где дозы 62,5 мг/день, 50 мг/день и 37,5 мг/день могут вводиться, например, в течение, по меньшей мере, одной недели, соответственно. Альтернативно, доза 75 мг нерамексана мезилата ежедневно может быть, например, снижена до дозы 50 мг/день. Это может быть осуществлено по этапам в 12,5 мг, где доза в 62,5 мг/день может вводиться, например, в течение, по меньшей мере, одной недели. В дополнительном варианте осуществления доза 75 мг нерамексана мезилата ежедневно может быть, например, снижена до дозы 12,5 мг/день. Это может быть осуществлено по этапам в 12,5 мг, где доза 62,5 мг/день, доза 50 мг/день, доза 37,5 мг/день и доза 25 мг/день может вводиться, соответственно, например, в течение, по меньшей мере, одной недели.
Дополнительный аспект изобретения относится к схеме лечения субъекта, страдающего тиннитусом, включающей введение субъекту терапевтически эффективного количества производного 1-аминоалкилциклогексана (например, нерамексана или его фармацевтически приемлемой соли, такой как мезилат нерамексана), где терапевтически эффективное количество производного 1-аминоалкилциклогексана вводят ежедневно в течение периода, по меньшей мере, три (3) месяца, с последующим периодом, по меньшей мере, в один (1) месяц, где производное 1-аминоалкилциклогексана вводят в дозе, которая составляет 0-75%, такой как выше 0-75% или 20-75%, или 25-50%, терапевтически эффективной дозы, с повторением схемы лечения после рецидива тиннитуса.
Согласно изобретению пациенты с рецидивом тиннитуса продолжают принимать терапевтически эффективную дозу, по меньшей мере, в течение трех месяцев, например, по меньшей мере, в течение одного года, перед тем как дозу снижают до поддерживающей дозы.
Альтернативно, схему лечения можно повторить после конкретного периода, такого как после введения в дозе, которая составляет 0-75%, или выше 0-75%, или 20-75%, или 25-50%, терапевтически эффективной дозы, в течение периода от трех (3) до шести (6) месяцев (например, 3, 4, 5 или 6 месяцев).
В дополнительном аспекте изобретения терапевтически эффективное количество производного 1-аминоалкилциклогексана вводят ежедневно в течение первого периода, по меньшей мере, три (3) месяца, с последующим вторым периодом, по меньшей мере, в один месяц, например, по меньшей мере, в три (3) месяца, когда производное 1-аминоалкилциклогексана не вводят, причем схему лечения повторяют после указанного (второго) периода, т.е. в третий период осуществляют то же самое лечение, что и в первый период, в то время как в четвертый период (как и во второй период) производное 1-аминоалкилциклогексана не вводят. Указанное чередование периодов с и без лечения может быть повторено несколько раз, обычно в зависимости от прогрессирования состояния субъекта, подвергаемого лечению.
Схема лечения может быть повторена после конкретного периода, такого как период от трех (3) до шести (6) месяцев (например, 3, 4, 5 или 6 месяцев).
Согласно изобретению снижение дозы, а также увеличение дозы может быть осуществлено ступенчато.
По изобретению перед первым периодом введения может быть осуществлено первоначальное введение дозы или доз, для того, чтобы повысить достижение дозой(ами) терапевтически эффективной дозы первого периода. Если осуществляется такое первоначальное введение, оно обычно выполняется поэтапным способом (т.е. с поэтапным повышением).
В дополнительном аспекте изобретения терапевтически эффективное количество нерамексана или его фармацевтически приемлемой соли, такой как мезилат нерамексана, вводят субъекту, где терапевтически эффективное количество указанного соединения вводят ежедневно в течение периода, по меньшей мере, три (3) месяца, с последующим периодом, по меньшей мере, в один (1) месяц, где указанное соединение вводят в дозе, которая составляет 0-75% или выше 0-75% терапевтически эффективной дозы, с повторением лечения при необходимости.
В дополнительном аспекте изобретения терапевтически эффективное количество нерамексана или его фармацевтически приемлемой соли, такой как мезилат нерамексана, вводят субъекту, где терапевтически эффективное количество указанного соединения вводят ежедневно в течение периода, по меньшей мере, три (3) месяца, с последующим периодом, по меньшей мере, в один (1) месяц, где указанное соединение вводят в дозе, которая составляет 20-75% терапевтически эффективной дозы, с повторением схемы лечения при необходимости.
В дополнительном аспекте изобретения терапевтически эффективное количество нерамексана или его фармацевтически приемлемой соли, такой как мезилат нерамексана, вводят ежедневно в течение периода, по меньшей мере, три (3) месяца, с последующим (вторым) периодом, по меньшей мере, в один (1) месяц, где указанное соединение не вводят, с повторением схемы лечения после указанного (второго) периода. Указанное чередование периодов с и без лечения может быть повторено несколько раз, обычно в зависимости от прогрессирования состояния у субъекта, подвергаемого лечению.
В дополнительном аспекте изобретение относится к способу лечения тиннитуса у нуждающегося в этом субъекта, включающему введение субъекту терапевтически эффективного количества производного 1-аминоалкилциклогексана, где терапевтически эффективное количество производного 1-аминоалкилциклогексана вводят ежедневно в течение первого периода, по меньшей мере, три (3) месяца, с последующим вторым периодом, по меньшей мере, в один (1) месяц, где производное 1-аминоалкилциклогексана вводят в дозе, которая составляет 0-75% терапевтически эффективной дозы.
В дополнительном аспекте изобретение относится к такому способу, где в течение второго периода производное 1-аминоалкилциклогексана вводят в дозе, которая превышает 0-75% терапевтически эффективной дозы.
В дополнительном аспекте изобретение относится к такому способу, где в течение второго периода производное 1-аминоалкилциклогексана вводят в дозе, которая составляет 20-75% терапевтически эффективной дозы.
В дополнительном аспекте изобретение относится к такому способу, где в течение второго периода производное 1-аминоалкилциклогексана вводят в дозе, которая составляет 25-50% терапевтически эффективной дозы.
В дополнительном аспекте изобретение относится к такому способу, где в течение второго периода производное 1-аминоалкилциклогексана не вводят, причем лечение повторяют после второго периода.
В дополнительном аспекте изобретение относится к такому способу, где увеличение дозы до достижения терапевтически эффективной дозы после второго периода осуществляют ступенчато.
В дополнительном аспекте изобретение относится к такому способу, где за вторым периодом следует введение субъекту терапевтически эффективного количества производного 1-аминоалкилциклогексана после рецидива тиннитуса.
В дополнительном аспекте изобретение относится к такому способу, где введение терапевтически эффективного количества производного 1-аминоалкилциклогексана после рецидива тиннитуса продолжается в течение, по меньшей мере, одного года.
В дополнительном аспекте изобретение относится к такому способу, где второй период составляет от трех (3) до шести (6) месяцев.
В дополнительном аспекте изобретение относится к такому способу, где между первым и вторым периодами существует переходный период, в течение которого ступенчато снижают дозу.
В дополнительном аспекте изобретение относится к такому способу, где производное 1-аминоалкилциклогексана представляет собой нерамексан или его фармацевтически приемлемую соль.
В дополнительном аспекте изобретение относится к такому способу, где производное 1-аминоалкилциклогексана представляет собой нерамексана мезилат.
В дополнительном аспекте изобретение относится к такому способу, где нерамексана мезилат вводят в течение первого периода в диапазоне от приблизительно 5 мг/день до приблизительно 150 мг/день.
В дополнительном аспекте изобретение относится к такому способу, где нерамексана мезилат вводят в диапазоне от приблизительно 5 мг/день до приблизительно 100 мг/день.
В дополнительном аспекте изобретение относится к такому способу, где нерамексана мезилат вводят от приблизительно 5 мг до приблизительно 75 мг/день.
В дополнительном аспекте изобретение относится к такому способу, где нерамексана мезилат вводят при приблизительно 50 мг/день.
В дополнительном аспекте изобретение относится к такому способу, где нерамексана мезилат вводят при приблизительно 75 мг/день.
В дополнительном аспекте изобретение относится к такому способу, где нерамексан или его фармацевтически приемлемую соль вводят один раз в день, два раза в день (b.i.d.) или три раза в день.
В дополнительном аспекте изобретение относится к такому способу, где нерамексан или его фармацевтически приемлемую соль вводят два раза в день.
В дополнительном аспекте изобретение относится к такому способу, где нерамексан или его фармацевтически приемлемую соль вводят в препаративной форме с немедленным высвобождением.
В дополнительном аспекте изобретение относится к такому способу, где нерамексан или его фармацевтически приемлемую соль вводят в препаративную форму с модифицированным высвобождением.
В дополнительном аспекте изобретение относится к способу лечения состояния, отвечающего на производное 1-аминоалкилциклогексана, у нуждающегося в этом субъекта, включающему введение субъекту терапевтически эффективного количества производного 1-аминоалкилциклогексана, где терапевтически эффективное количество производного 1-аминоалкилциклогексана вводят ежедневно в течение первоначального периода, по меньшей мере, три (3) месяца, с последующим вторым периодом, по меньшей мере, в один (1) месяц, где производное 1-аминоалкилциклогексана вводят в дозе, которая составляет 0-75% терапевтически эффективной дозы.
Краткое описание фигур
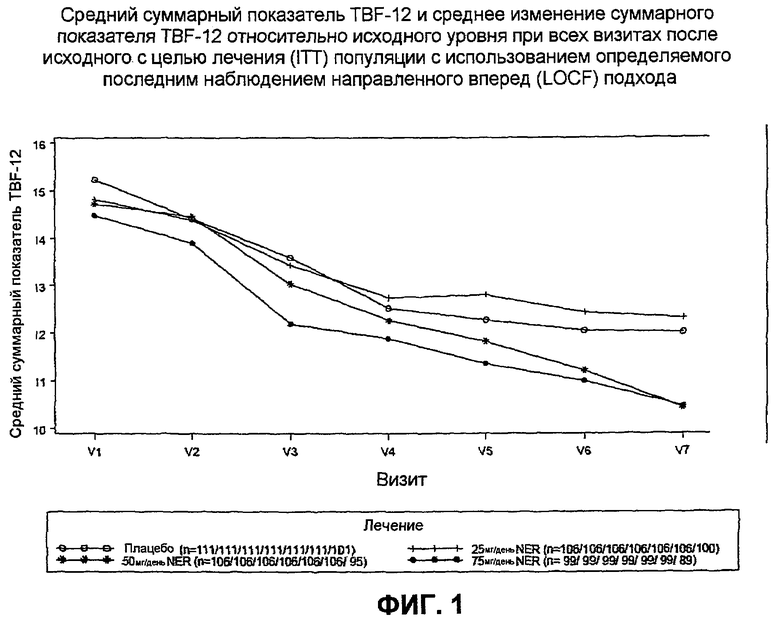
На фиг.1 представлены данные пилотного исследования лечения тиннитуса нерамексаном, демонстрирующие изменение показателя в Tinnitus-Beeintrachtigungs-Fragebogen (TBF-12) (т.е.12-параграфной германской модифицированной и утвержденной версии описи нарушений тиннитуса или THI) от исходного уровня для всех визитов после исходного уровня.
Подробное описание изобретения
Применяемый в настоящем описании термин «тиннитус» включает все проявления субъективного и объективного тиннитуса, а также острые, подострые и хронические формы. Он также включает улитковый тиннитус, а также тиннитус, связанный с потерей слуха или со слабой потерей слуха.
Применяемый в настоящем описании термин "потеря слуха" является синонимом ухудшения слуха и включает несколько стадий потери слуха (таких как слабая потеря слуха, умеренная потеря слуха, тяжелая потеря слуха, глубокая потеря слуха и глухота), а также несколько конкретных форм, таких как акустическая травма, индуцируемая шумом потеря слуха, нейросенсорная потеря слуха, смешанная потеря слуха, неустановленная потеря слуха, ототоксичная потеря слуха, индуцированная лекарственными средствами потеря слуха, внезапная (идиопатическая) потеря слуха, нарушение слухового процесса, старческая тугоухость, индуцированная химическими загрязнителями окружающей среды потеря слуха, индуцированная хирургическим вмешательством потеря слуха, индуцированная раком потеря слуха, индуцированная облучением потеря слуха и индуцированная инфекцией потеря слуха.
Применяемый в настоящем описании термин "субъект" включает млекопитающих, т.е. животных и человека.
Термин "производное 1-аминоалкилциклогексана" используется в настоящем документе для описания 1-аминоалкилциклогексана или соединения, происходящего от 1-аминоалкилциклогексана, например, фармацевтически приемлемых солей 1-аминоалкилциклогексанов. Представленные производные 1-аминоалкилциклогексана могут быть также описаны как «производные 1-аминоциклогексана».
Производные 1-аминоалкилциклогексана по настоящему изобретению могут быть представлены общей формулой (I):
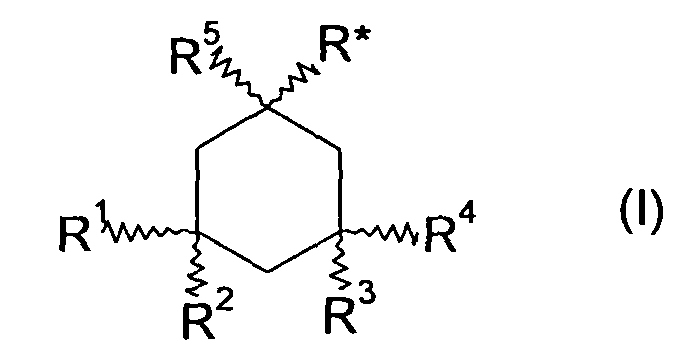
где R* представляет собой -(CH2)n-(CR6R7)m-NR8R9,
где n+m = 0, 1 или 2,
где R1-R7 независимо выбраны из группы, состоящей из водорода и C1-6алкила, где R8 и R9 независимо выбраны из группы, состоящей из водорода и C1-6алкила, или совместно представляют собой низший алкилен-(CH2)x-, где x равен от 2 до 5, включительно, и их оптические изомеры, энантиомеры, гидраты и фармацевтически приемлемые соли.
Не ограничивающие примеры 1-аминоалкилциклогексанов, используемых по настоящему изобретению, включают:
1-амино-1,3,5-триметилциклогексан,
1-амино-1(транс),3(транс),5-триметилциклогексан,
1-амино-1(цис),3(цис),5-триметилциклогексан,
1-амино-1,3,3,5-тетраметилциклогексан,
1-амино-1,3,3,5,5-пентаметилциклогексан (нерамексан),
1-амино-1,3,5,5-тетраметил-3-этилциклогексан,
1-амино-1,5,5-триметил-3,3-диэтилциклогексан,
1-амино-1,5,5-триметил-цис-3-этилциклогексан,
1-амино-(1S,5S)цис-3-этил-1,5,5-триметилциклогексан,
1-амино-1,5,5-триметил-транс-3-этилциклогексан,
1-амино-(1R,5S)транс-3-этил-1,5,5-триметилциклогексан,
1-амино-1-этил-3,3,5,5-тетраметилциклогексан,
1-амино-1-пропил-3,3,5,5-тетраметилциклогексан,
N-метил-1-амино-1,3,3,5,5-пентаметилциклогексан,
N-этил-1-амино-1,3,3,5,5-пентаметилциклогексан,
N-(1,3,3,5,5-пентаметилциклогексил)пирролидин,
3,3,5,5-тетраметилциклогексилметиламин,
1-амино-1,3,3,5(транс)тетраметилциклогексан (аксиальная аминогруппа),
3-пропил-1,3,5,5-тетраметилциклогексиламина полугидрат,
1-амино-1,3,5,5-тетраметил-3-этилциклогексан,
1-амино-1,3,5-триметилциклогексан,
1-амино-1,3-диметил-3-пропилциклогексан,
1-амино-1,3(транс),5(транс)триметил-3(цис)пропилциклогексан,
1-амино-1,3-диметил-3-этилциклогексан,
1-амино-1,3,3-триметилциклогексан,
цис-3-этил-1(транс)-3(транс)-5-триметилциклогексамин,
1-амино-1,3(транс)диметилциклогексан,
1,3,3-триметил-5,5-дипропилциклогексиламин,
1-амино-1-метил-3(транс)пропилциклогексан,
1-метил-3(цис)пропилциклогексиламин,
1-амино-1-метил-3(транс)этилциклогексан,
1-амино-1,3,3-триметил-5(цис)этилциклогексан,
1-амино-1,3,3-триметил-5(транс)этилциклогексан,
цис-3-пропил-1,5,5-триметилциклогексиламин,
транс-3-пропил-1,5,5-триметилциклогексиламин,
N-этил-1,3,3,5,5-пентаметилциклогексиламин,
N-метил-1-амино-1,3,3,5,5-пентаметилциклогексан,
1-амино-1-метилциклогексан,
N,N-диметил-1-амино-1,3,3,5,5-пентаметилциклогексан,
2-(3,3,5,5-тетраметилциклогексил)этиламин,
2-метил-1-(3,3,5,5-тетраметилциклогексил)пропил-2-амин,
2-(1,3,3,5,5-пентаметилциклогексил)этиламин полугидрат,
N-(1,3,3,5,5-пентаметилциклогексил)пирролидин,
1-амино-1,3(транс),5(транс)триметилциклогексан,
1-амино-1,3(цис),5(цис)триметилциклогексан,
1-амино-(1R,5S)транс-5-этил-1,3,3-триметилциклогексан,
1-амино-(1S,5S)цис-5-этил-1,3,3-триметилциклогексан,
1-амино-1,5,5-триметил-3(цис)изопропилциклогексан,
1-амино-1,5,5-триметил-3(транс)изопропилциклогексан,
1-амино-1-метил-3(цис)этилциклогексан,
1-амино-1-метил-3(цис)метилциклогексан,
1-амино-5,5-диэтил-1,3,3-триметилциклогексан,
1-амино-1,3,3,5,5-пентаметилциклогексан,
1-амино-1,5,5-триметил-3,3-диэтилциклогексан,
1-амино-1-этил-3,3,5,5-тетраметилциклогексан,
N-этил-1-амино-1,3,3,5,5-пентаметилциклогексан,
N-(1,3,5-триметилциклогексил)пирролидин или пиперидин,
N-[1,3(транс),5(транс)триметилциклогексил]пирролидин или пиперидин,
N-[1,3(цис),5(цис)триметилциклогексил]пирролидин или пиперидин,
N-(1,3,3,5-тетраметилциклогексил)пирролидин или пиперидин,
N-(1,3,3,5,5-пентаметилциклогексил)пирролидин или пиперидин,
N-(1,3,5,5-тетраметил-3-этилциклогексил)пирролидин или пиперидин,
N-(1,5,5-триметил-3,3-диэтилциклогексил)пирролидин или пиперидин,
N-(1,3,3-триметил-цис-5-этилциклогексил)пирролидин или пиперидин,
N-[(1S,5S)цис-5-этил-1,3,3-триметилциклогексил]пирролидин или пиперидин,
N-(1,3,3-триметил-транс-5-этилциклогексил)пирролидин или пиперидин,
N-[(1R,5S)транс-5-этил-3,3-триметилциклогексил]пирролидин или пиперидин,
N-(1-этил-3,3,5,5-тетраметилциклогексил)пирролидин или пиперидин,
N-(1-пропил-3,3,5,5-тетраметилциклогексил)пирролидин или пиперидин,
N-(1,3,3,5,5-пентаметилциклогексил)пирролидин,
и оптические изомеры, диастереомеры, энантиомеры, гидраты, их фармацевтически приемлемые соли и их смеси.
Производные 1-аминоалкилциклогексана (например, нерамексан, 1-амино-1,3,3,5,5-пентаметилциклогексан) раскрыты в патентах США № 6034134 и 6071966. Производные 1-аминоалкилциклогексана (например, нерамексан) могут быть использованы по изобретению в форме любых их фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов и пролекарств, любые ссылки на производные 1-аминоалкилциклогексана (например, нерамексан) в этом описании должны рассматриваться как относящиеся также к таким солям, сольватам, изомерам, конъюгатам и пролекарствам.
Фармацевтически приемлемые соли включают, но не ограничиваются этим, аддитивные соли кислоты, такие как полученные с хлористоводородной, метилсульфоновой, бромистоводородной, иодистоводородной, перхлорной, серной, азотной, фосфорной, уксусной, пропионовой, гликолевой, молочной, пировиноградной, малоновой, янтарной, фумаровой, винной, лимонной, бензойной, карбоновой, коричной, миндальной, метансульфоновой, этансульфоновой, гидроксиэтансульфоновой, бензолсульфоновой, п-толуолсульфоновой, циклогексансульфоновой, салициловой, п-аминосалициловой, 2-феноксибензойной и 2-ацетоксибензойной кислотами. Все эти соли (или другие сходные соли) могут быть получены общепринятыми способами. Природа соли не является решающей, и предусматривается, чтобы она не была токсичной и существенно не препятствовала желаемой фармакологической активности.
Термин «аналог» или «производное» используется в настоящем описании в традиционном фармацевтическом смысле для обозначения молекулы, которая структурно похожа на эталонную молекулу (такую как нерамексан), но модифицирована целенаправленным и контролируемым способом для замены одного или более конкретных заместителей эталонной молекулы на альтернативный заместитель с созданием в результате этого молекулы, которая структурно сходна с эталонной молекулой. Синтез и скрининг аналогов (например, с использованием структурного и/или биохимического анализа) для идентификации слегка модифицированных вариантов известного соединения, которые могут иметь улучшенные или отклоняющиеся свойства (такие как более высокая эффективность и/или селективность в отношении конкретного типа рецептора-мишени, более высокая способность проникать через гематоэнцефалические барьеры млекопитающих, меньшие побочные эффекты и т.д.), являются подходом к разработке лекарственного средства, который хорошо известен в фармацевтической химии.
Термин «лечить» используется в настоящем описании для обозначения ослабления или облегчения, по меньшей мере, одного симптома заболевания у субъекта. В контексте настоящего изобретения термин «лечить» обозначает также приостановку или задержку возникновения (т.е. периода перед клинической манифестацией заболевания) и/или снижение риска развития или ухудшения заболевания.
Термин «терапевтически эффективный» в применении к дозе или количеству обозначает то количество соединения или фармацевтической композиции, которое подходит для индукции ослабления существующих симптомов тиннитуса или родственных тиннитусу симптомов при введении нуждающемуся в этом млекопитающему.
Выражение «фармацевтически приемлемый» при использовании в связи с композициями по изобретению обозначает молекулярные объекты и другие ингредиенты таких композиций, которые физиологически приемлемы и обычно не вызывают неблагоприятных реакций при введении млекопитающему (например, человеку).Обычно термин «фармацевтически приемлемый» обозначает одобренный регулирующим ведомством федерального или государственного правительства или перечисленный в Фармакопее США или в другой общепризнанной фармакопее для применения у млекопитающих и, более конкретно, у человека.
Термин «носитель» в применении к фармацевтическим композициям по изобретению обозначает разбавитель, наполнитель или носитель, с которым вводят активное соединение (например, нерамексан). Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода, солевые растворы, водные растворы декстрозы, водные растворы глицерина и масла, включая таковые нефти, масла животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Подходящие фармацевтические носители описаны в "Remington's Pharmaceutical Sciences" by A.R.Gennaro, 20th Edition.
Термин «примерно» или «приблизительно» обычно означает в пределах 20%, альтернативно в пределах 10%, включая в пределах 5% данной величины или диапазона. Альтернативно, особенно в биологических системах, термин «приблизительно» означает в пределах приблизительно log (т.е.порядка величины), включая в двукратных пределах данной величины.
В связи со способами настоящего изобретения предлагаются также фармацевтические композиции, включающие терапевтически эффективное количество производного 1-аминоалкилциклогексана (например, нерамексана). Композиции по изобретению могут дополнительно включать носитель или наполнитель (все фармацевтически приемлемые). Композиции могут быть составлены для введения один раз в день, введения два раза в день или введения три раза в день.
Производное 1-аминоалкилциклогексана (например, нерамексан, такой как нерамексана мезилат) или фармацевтическая композиция, включающая его, могут применяться для лечения тиннитуса в соответствии со схемой лечения по изобретению. В одном варианте осуществления производное и/или фармацевтическая композиция (лекарственное средство) адаптируют или подходящим образом получают для конкретного введения, как раскрыто в настоящем документе (например, введения с интервалами, поддерживающего лечения, введения один раз в день, два раза в день или введения три раза в день). Для этой цели упаковка и/или вкладыш упаковки, и/или информация для пациента, и/или сама лекарственная форма может содержать соответствующую информацию.
Активный ингредиент (например, нерамексан или нерамексана мезилат) или композиция по изобретению могут быть использованы для получения лекарственного средства для лечения тиннитуса, где лекарственное средство адаптируют или подходящим образом получают для конкретного введения, как раскрыто в настоящем документе (например, введения с интервалами, поддерживающего лечения, введения один раз в день, введения два раза в день или введения три раза в день). Для этой цели вкладыш упаковки и/или информация для пациента содержит соответствующую информацию.
По настоящему изобретению лекарственная форма производного 1-аминоалкилциклогексана (например, нерамексана) может быть в твердой, полутвердой или жидкой препаративной форме в соответствии со следующим.
Производные 1-аминоалкилциклогексана согласно настоящему изобретению (например, нерамексан) можно вводить перорально, местно, парентерально или в слизистую (например, защечно, с помощью ингаляции или ректально) в единицах дозирования, содержащих общепринятые нетоксичные фармацевтически приемлемые носители. В другом варианте осуществления для введения педиатрическим больным производное 1-аминоалкилциклогексана может быть составлено в виде жидкости с отдушкой (например, с отдушкой мяты перечной). Производные 1-аминоалкилциклогексана по настоящему изобретению можно вводить перорально в форме капсулы, таблетки или тому подобного, или в виде полужидких или жидких препаративных форм (смотрите Remington's Pharmaceutical Sciences, 20th Edition, by A.R.Gennaro).
Для перорального введения в форме таблетки или капсулы производные 1-аминоалкилциклогексана по настоящему изобретению (например, нерамексан) могут быть объединены с нетоксичными фармацевтически приемлемыми наполнителями, такими как связывающие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, сахароза, глюкоза, маннит, сорбит и другие восстанавливающие и невосстанавливающие сахара, микрокристаллическая целлюлоза, сульфат кальция или гидрофосфат кальция); смазывающие агенты (например, стеарат магния, тальк или диоксид кремния, стеариновая кислота, стеарилфумарат натрия, глицерилбегенат, стеарат кальция и тому подобное); разрыхляющие агенты (например, картофельный крахмал или гликолят крахмала натрия); или увлажняющие агенты (например, лаурилсульфат натрия), окрашивающие агенты и отдушки, желатин, подсластители, природные и синтетические камеди (такие как гуммиарабик, трагакант или альгинаты), буферирующие соли, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и тому подобное.
Таблетки могут быть покрыты концентрированным раствором сахара, который может содержать, например, гуммиарабик, желатин, тальк, диоксид титана и тому подобное. Альтернативно таблетки могут быть покрыты полимером, который растворен в легкоиспаряющемся органическом растворителе или смеси органических растворителей. В конкретных вариантах осуществления нерамексан составляют в таблетки с немедленным высвобождением (IR) или с модифицированным высвобождением (MR). Твердые лекарственные формы с немедленным высвобождением позволяют высвобождать большую часть или весь активный ингредиент в течение короткого периода времени, такого как 60 минут или менее, и делают возможным быстрое всасывание лекарственного средства (препаративные формы с немедленным высвобождением 1-аминоалкилциклогексанов, таких как нерамексан, раскрыты в опубликованных патентных заявках США № 2006/0002999 и 2006/0198884, содержание которых включено в настоящее описание в качестве ссылки). Твердые пероральные лекарственные формы с модифицированным высвобождением позволяют поддерживать высвобождение активного ингредиента в течение продолжительного периода времени с целью поддержания терапевтически эффективных уровней в плазме в течение сходных продолжительных интервалов времени и/или модифицировать другие фармакокинетические свойства активного ингредиента (препаративные формы нерамексана с модифицированным высвобождением раскрыты в опубликованной заявке США №2007/0141148, содержание которой включено в настоящее описание в качестве ссылки). Например, нерамексана мезилат может быть составлен в препаративную форму с модифицированным высвобождением (включая таблетки с модифицированным высвобождением) с предоставлением дозы 50 мг нерамексана мезилата.
Для составления мягких желатиновых капсул производные 1-аминоалкилциклогексана согласно настоящему изобретению (например, нерамексан) могут быть смешаны, например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы активных веществ с использованием либо указанных выше наполнителей для таблеток, например, лактозы, сахарозы, сорбита, маннита, крахмалов (например, картофельного крахмала, кукурузного крахмала или амилопектина), производных целлюлозы, либо желатина. Твердые желатиновые капсулы могут быть также заполнены лекарством в жидкой или полужидкой форме.
Производные 1-аминоалкилциклогексана по настоящему изобретению (например, нерамексан) могут быть также введены в микросферы или микрокапсулы, например, изготовленные из полигликолевой кислоты/молочной кислоты (PGLA) (смотрите, например, патенты США №5814344; 5100669 и 4849222; публикации PCT № WO 95/11010 и WO 93/07861). Для достижения контролируемого высвобождения лекарства могут быть использованы биосовместимые полимеры, включая, например, полимолочную кислоту, полигликолевую кислоту, сополимеры полимолочной и полигликолевой кислоты, полиэпсилон-капролактон, полигидроксимасляную кислоту, полиортоэфиры, полиацетали, полигидропираны, полицианоакрилаты и поперечно сшитые или амфипатические блок-сополимеры гидрогелей.
Может использоваться также составление производных 1-аминоалкилциклогексана по настоящему изобретению в полутвердой или жидкой форме. Производное 1-аминоалкилциклогексана (например, нерамексан) может составлять между 0,1 и 99% по массе препаративной формы, более конкретно, между 0,5 и 20% по массе препаративных форм, предназначенных для введения, и между 0,2 и 50% по массе массы препаративных форм, подходящих для перорального введения.
В одном варианте осуществления изобретения производное 1-аминоалкилциклогексана (например, нерамексан) вводят в препаративной форме с модифицированным высвобождением. Лекарственные формы с модифицированным высвобождением обеспечивают средствами для улучшения переносимости больными и для обеспечения эффективного и безопасного лечения путем снижения случаев побочного действия лекарства. По сравнению с лекарственными формами с немедленным высвобождением лекарственные формы с модифицированным высвобождением могут быть использованы для пролонгированного фармакологического действия после введения и для снижения вариабельности концентрации лекарства в плазме на протяжении интервала дозирования, устраняя или снижая тем самым острые пики.
Лекарственная форма с модифицированным высвобождением может включать сердцевину либо покрытую лекарством, либо содержащую его. Сердцевину затем покрывают полимером, модифицирующим высвобождение, в котором диспергируется лекарство. Модифицирующий высвобождение полимер постепенно распадается, высвобождая со временем лекарство. Таким образом, внешний слой композиции эффективно сокращается и тем самым регулирует диффузию лекарства через покрывающий слой, когда композиция контактирует с водной средой, т.е. желудочно-кишечным трактом. Чистая скорость диффузии лекарства зависит главным образом от способности жидкости желудка проникать в покрывающий слой или матрикс и от растворимости самого лекарства.
В другом варианте осуществления изобретения производное 1-аминоалкилциклогексана (например, нерамексан) составляют в виде пероральной жидкой формы. Жидкие препараты для перорального введения могут иметь вид, например, растворов, сиропов, эмульсий или суспензий, или они могут быть представлены в виде сухого продукта для разбавления водой или другим подходящим носителем перед употреблением. Препараты для перорального введения могут быть составлены подходящим образом с получением активного соединения с контролируемым или отложенным высвобождением. Пероральные жидкие препаративные формы 1-аминоалкилциклогексанов, таких как нерамексан, описаны в международной заявке PCT № PCT/US2004/037026, содержание которой включено в настоящее описание в качестве ссылки.
Для перорального введения в жидкой форме производные 1-аминоалкилциклогексана по настоящему изобретению (например, нерамексан) могут быть объединены с нетоксичными фармацевтически приемлемыми инертными носителями (например, этанолом, глицерином, водой), суспендирующими агентами (например, сиропом сорбита, производными целлюлозы или гидрогенированными съедобными жирами), эмульгирующими агентами (например, лецитином или гуммиарабиком), неводными носителями (например, миндальным маслом, эфирами жиров, этиловым спиртом или фракционированными растительными маслами), консервантами (например, метил- или пропил-п-гидроксибензоатами или сорбиновой кислотой) и тому подобным. Для стабилизации лекарственных форм могут быть также добавлены стабилизирующие агенты, такие как антиоксиданты (BHA, BHT, пропилгаллат, аскорбат натрия, лимонная кислота). Например, растворы могут содержать от приблизительно 0,2% до приблизительно 20% массы нерамексана, сбалансированного сахара и смеси этанола, воды, глицерина и пропиленгликоля. Необязательно такие жидкие препаративные формы могут содержать окрашивающие агенты, отдушки, сахарин и карбоксиметилцеллюлозу в качестве загущающего агента или другие наполнители.
В другом варианте осуществления терапевтически эффективное количество производного 1-аминоалкилциклогексана (например, нерамексана) вводят в виде перорального раствора, содержащего консервант, подсластитель, солюбилизатор и растворитель. Пероральный раствор может включать один или более буферов, отдушек или дополнительных наполнителей. В дополнительном варианте осуществления к пероральной жидкой препаративной форме производного нерамексана добавляют мяту перечную или другую отдушку.
Для введения с помощью ингаляции производные 1-аминоалкилциклогексана (например, нерамексан) по настоящему изобретению могут быть удобно доставлены в форме предоставления распыляемого аэрозоля из упаковки под давлением или небулайзера с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением единица дозирования может быть определена с помощью предоставления клапана для доставки контролируемого количества. Капсулы и баллончики, например, из желатина для использования в ингаляторе или инсуффляторе могут быть составлены как содержащие смесь порошка соединения и подходящей основы порошка, такой как лактоза или крахмал.
Растворы для парентерального применения с помощью инъекции могут быть получены в водном растворе водорастворимой фармацевтически приемлемой соли активных веществ, например, в концентрации от приблизительно 0,5% до приблизительно 10% по массе. Эти растворы могут также содержать стабилизирующие агенты и/или буферирующие агенты и могут быть легко предоставлены в ампулах с различными единицами дозирования.
Лекарственные средства по изобретению могут быть доставлены парентерально, т.е. путем внутривенного (i.v.) введения, введения в желудочки мозга (i.c.v.), подкожного (s.c.), внутрибрюшинного (i.p.), внутримышечного (i.m.), субдермального (s.d.) или внутридермального (i.d.) введения, путем прямой инъекции, например, болюсной инъекции или длительной инфузии. Препараты для инъекции могут быть представлены в виде стандартной лекарственной формы, например, в ампулах или в упаковках для многократного введения с добавленным консервантом. Альтернативно, активный ингредиент может быть в форме порошка для разбавления подходящим носителем, например, стерильной водой, свободной от пирогенов, перед употреблением.
В изобретении предлагается также фармацевтическая упаковка или набор, включающий один или более контейнеров, содержащих производное 1-аминоалкилциклогексана (например, нерамексан) и, необязательно, больше ингредиентов препаративной формы. В конкретном варианте осуществления нерамексан предлагается в виде перорального раствора (2 мг/мл) для введения с использованием шприца на 2 чайные ложки (дозировка KORC®).Каждый пероральный шприц имеет синие маркировочные насечки для измерения с линиями на правой стороне шприца (концом вниз), представляющими единицы в tsp (чайных ложках), и с линиями на левой стороне, представляющими единицы в мл.
Оптимальное терапевтически эффективное количество может быть определено экспериментально, принимая во внимание конкретный способ введения, с помощью которого доставляют лекарство, симптом, на который направлено введение, субъекта, страдающего заболеванием (например, массу тела, состояние здоровья, возраст, пол и так далее), и предпочтение и опыт дежурного врача или ветеринара.
Единицы дозирования для ректального применения могут представлять собой растворы или суспензии или могут быть получены в форме суппозиториев или ректальных удерживающих клизм, включающих нерамексан в смеси с нейтральной жировой основой, или желатиновых ректальных капсул, включающих активные вещества в смеси с растительным маслом или парафиновым маслом.
Токсичность и терапевтическая эффективность композиций по изобретению может быть определена с помощью стандартных фармацевтических методов у экспериментальных животных, например, путем определения LD50 (дозы летальности для 50% популяции) и ED50 (терапевтически эффективной дозы для 50% популяции). Соотношение доз терапевтического и токсического эффектов представляет собой терапевтический индекс и может быть выражено как отношение LD50/ED50. Композиции, которые проявляют высокие терапевтические индексы, являются предпочтительными.
Подходящие суточные дозы активных соединений по изобретению при терапевтическом лечении человека составляют приблизительно 0,01-10 мг/кг массы тела для перорального введения и 0,001-10 мг/кг массы тела для парентерального введения. Например, для взрослых подходящие суточные дозы нерамексана мезилата находятся в диапазоне от приблизительно 5 мг до приблизительно 150 мг в день, таком как от приблизительно 5 мг до приблизительно 120 мг, от приблизительно 5 мг до приблизительно 100 мг или от приблизительно 5 мг до приблизительно 75 мг, или от приблизительно 5 мг до приблизительно 50 мг, такие как 25 мг или 50 мг в день. В виде терапевтически эффективного количества по настоящему изобретению суточная доза нерамексана мезилата может быть введена в диапазоне от приблизительно 20 мг до приблизительно 150 мг, таком как от 25 мг до 100 мг (например, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг или 95 мг), таком как от 50 мг до 75 мг. Подходит также эквимолярное количество других фармацевтически приемлемых соли, сольвата, изомера, конъюгата, пролекарства или его производного, такого как нерамексан гидрохлорид. Детям в возрасте 4-14 лет нерамексан (например, нерамексан мезилат) может быть введен в виде пероральной жидкой формы дозирования в дозе приблизительно 0,5 мг/день до максимальной дозы 10 мг/день.
Суточные дозы, указанные в настоящем описании, могут быть введены, например, в виде одной или двух единиц дозирования один, два или три раза в день. Подходящие дозы на единицу дозирования, следовательно, могут представлять собой суточную дозу, разделенную (например, в равных частях) на количество единиц дозирования, вводимых за сутки, и, таким образом, обычно должны быть приблизительно равными суточной дозе или ее половине, одной трети, одной четвертой или одной шестой. Дозировки на единицу дозирования могут быть, следовательно, рассчитаны из каждой указанной в настоящем описании суточной дозы. Суточная доза в 5 мг, например, может рассматриваться как предоставление дозы на единицу дозирования, например, приблизительно 5 мг, 2,5 мг, 1,67 мг, 1,25 мг и 0,83 мг, в зависимости от выбранной схемы дозирования. Соответственно, дозировка в 150 мг в день соответствует дозам на единицу дозирования, например, приблизительно 150 мг, 75 мг, 50 мг, 37,5 мг и 25 мг для соответствующих схем дозирования.
Производные 1-аминоалкилциклогексана по настоящему изобретению (например, нерамексан) могут быть введены в виде монотерапии или в сочетании с другим агентом, прописанным для лечения тиннитуса.
Термин «комбинация», применяемый к активным ингредиентам, используется в настоящем описании для определения одной фармацевтической композиции (препаративной формы), включающей два активных агента (например, фармацевтической композиции, включающей производное 1-аминоалкилциклогексана, такое как нерамексан, и другой агент, прописанный для лечения тиннитуса), или двух отдельных фармацевтических композиций, каждая из которых включает активный агент (например, фармацевтической композиции, включающей производное 1-аминоалкилциклогексана, такое как нерамексан, или другой агент, прописанный для лечения тиннитуса), вводимых совместно.
В контексте настоящего изобретения термин «совместное введение» используется для обозначения введения производного 1-аминоалкилциклогексана, такого как нерамексан, и второго активного агента (например, другого агента, прописанного для лечения тиннитуса улитки) одновременно в одной композиции или одновременно в различных композициях или последовательно. Для последовательного введения, рассматриваемого как «совместное», однако, производное 1-аминоалкилциклогексана, такое как нерамексан, и второй активный агент должны вводиться разделенные временным интервалом, который все еще позволяет привести к благоприятному эффекту лечения тиннитуса у млекопитающего.
Примеры типичных лекарственных форм
С помощью обычно используемых растворителей, вспомогательных агентов и носителей активные ингредиенты можно составлять в таблетки, таблетки с покрытием, капсулы, капельные растворы, суппозитории, препараты для инъекции и инфузии и тому подобное и можно терапевтически вводить пероральным, ректальным, парентеральным и дополнительными путями. Таблетки, пригодные для перорального введения, могут быть получены традиционными методами таблетирования. Следующий пример представлен лишь с целью иллюстрации, и его не следует рассматривать как ограничивающий.
Пример составления 1: Таблетки с немедленным высвобождением нерамексана мезилата
В следующих таблицах представлено изготовление таблеток с немедленным высвобождением нерамексана в дозах 12,5, 25,0, 37,5 и 50,0 мг, включающих активные компоненты, агенты покрытия и другие наполнители.
Примеры
Следующие примеры иллюстрируют изобретения без ограничения его объема.
Пример 1: Дважды слепое, контролируемое плацебо, пилотное испытание нерамексана для лечения тиннитуса
Целью этого пилотного проекта являлось проведение клинического испытания для оценки эффективности нерамексана в качестве терапии тиннитуса. Главная цель этого исследования заключалась в сравнении эффективности, переносимости и безопасности нерамексана мезилата в трех разных дозах (25, 50 или 75 мг/день) против плацебо у субъектов с субъективным тиннитусом, по меньшей мере, умеренной тяжести.
План исследования
Эффективность нерамексана у субъектов, страдающих тиннитусом, по меньшей мере, умеренной тяжести, оценивали в дважды слепом, многоцентровом, рандомизированном, контролируемом плацебо, исследовании с параллельными группами. Приблизительно 100 пациентов, соответствующих конкретным критериям включения и не соответствующих конкретным критериям исключения, рандомизировали в каждую из четырех дважды слепых групп лечения (нерамексана мезилатом 25, 50, 75 мг/день или плацебо), что в общей сложности составило приблизительно 400 пациентов.
Дважды слепой 16-недельный период лечения состоял из 4-недельного титрования повышающейся дозой и 12-недельного периода лечения фиксированной дозой при сохранении неизменной лекарственной формы b.i.d.(дважды в день).В случае плохой переносимости, однако, исследователь мог принять решение о снижении дозы до 25 мг/день (или плацебо, соответственно). После фазы лечения имелся 4-недельный период последующего наблюдения без ограничений активного лечения и сопутствующей терапии. В общей сложности это исследование включало семь исследовательских посещений: скрининг, исходное состояние и в конце 4-й, 8-й, 12-й, 16-й и 20-й недель (Участники получали либо нерамексана мезилат (например, 50 мг, в виде 25-мг таблеток с немедленным высвобождением, принимаемых дважды в день), либо плацебо дважды в день в течение 16 недель. Нерамексана мезилат титровали повышающейся дозой с еженедельными шагами 12,5 или 25 мг в течение 4-недельного периода титрования повышающейся дозой, предшествующего 12-недельному периоду лечения фиксированной дозой. Лечение сопровождалось четырехнедельным периодом последующего наблюдения).
Назначаемые визиты для оценки каждого пациента были следующими:
Визит 1 (скрининг): После подписания согласия субъекта подвергали физическому обследованию и клиническому лабораторному тестированию. Пригодность пациента для исследования оценивали с помощью критериев включения/исключения. Проводили первичный опрос по поводу тиннитуса. Субъект также заполнял Tinnitus-Beeintrachtigungs-Fragebogen (TBF-12) (т.е. 12-пунктную германскую, модифицированную и утвержденную версию (Greimel KV et al., Tinnitus-Beeintrachtigungs-Fragebogen (TBF-12). Manual. Frankfurt am Main: Swets & Zeitlinger B.V.; 2000) 25-пунктной описи нарушений тиннитуса, или THI (Newman CW, et al., Development of the Tinnitus Handicap Inventory. Arch Otolaryngol Head Neck Surg 1996; 122(2): 143-148; Newman CW, et al. Psychometric adequacy of the Tinnitus Handicap Inventory (THI) for evaluating treatment outcome. J. Am. Acad. Audiol. 1998; 9(2): 153-160)), анкету госпитальной тревожности и шкалу депрессии - подшкалу депрессии (HADS-D) и анкету гиперакузии (Beeintrachtigungs -Fragenbogen (GUF)) (в случае применимости).
Визит 2 (исходное состояние): Субъекта опрашивали по поводу неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти события/изменения документировали. Субъекта оценивали на предмет пригодности для исследования на основе рассмотрения критериев включения/исключения. Вместе с субъектом рассматривали процедуры испытания и допустимые и недопустимые сопутствующие лекарственные вмешательства. Проводили исходный опрос по поводу тиннитуса. Субъект также заполнял TBF-12, анкету HADS-D и анкету GUF (в случае применимости). Субъекта вводили в исследование, и назначение лекарственного средства (плацебо или нерамексана) проводилось, как описано ниже.
Визит 3 (4 неделя): Визит проводили в конце 4-недельного последовательного титрования повышающейся дозой. Субъекта опрашивали относительно неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти события/изменения документировали. Проводили опрос для отслеживания тиннитуса. Субъект также заполнял TBF-12, анкету HADS-D и анкету GUF (в случае применимости). Проводили оценку податливости лечению и назначение лекарственного лечения на следующие 4 недели, как описано ниже.
Визит 4 (8 неделя): Этот визит проводили в конце первого 4-недельного периода дважды слепого лечения фиксированной дозой. Субъекта опрашивали относительно неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти изменения документировали. Отбирали образцы крови для определения концентрации нерамексана перед введением дозы. Проводили опрос для отслеживания тиннитуса. Субъект также заполнял TBF-12, анкету HADS-D и анкету GUF (в случае применимости). Проводили оценку податливости лечению и назначение лекарственного лечения на следующие 4 недели, как описано ниже.
Визит 5 (12 неделя): Этот визит проводили в конце второго 4-недельного периода дважды слепого лечения фиксированной дозой. Субъекта опрашивали относительно неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти изменения документировали. Проводили опрос для отслеживания тиннитуса. Субъект также заполнял TBF-12, анкету HADS-D и анкету GUF (в случае применимости). Производили оценку податливости лечению и назначение лекарственного лечения на следующие 4 недели, как описано ниже.
Визит 6 (16 неделя, окончание лечения): Этот визит проводили в конце 12-недельного периода дважды слепого лечения фиксированной дозой. Субъекта опрашивали относительно неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти изменения документировали. Производили клиническую лабораторную оценку. Проводили опрос для отслеживания тиннитуса, и субъект заполнял TBF-12, анкету HADS-D и анкету GUF (в случае применимости). Производили также аудиометрию простого тона (проведение в воздухе).
Визит 7 (20 неделя): Этот визит проводили в конце 4-недельного периода отслеживания после последнего исследования введения дозы лекарства. Проводили опрос субъекта относительно приема сопутствующих лекарств и наличия неблагоприятных событий после последнего визита. Проводили опрос для отслеживания тиннитуса, и субъект заполнял TBF-12, анкету HADS-D и анкету GUF (в случае применимости).
Введение нерамексана
Таблетки нерамексана мезилата с немедленным высвобождением (12,5 мг и 25 мг) и соответствующие таблетки плацебо вводили в виде таблеток, покрытых пленкой.
Лекарственное средство предоставлялось в блистерных коробках, которые раздавались со 2-го по 5-й визиты. Каждая блистерная коробка содержала 4 блистерные карты на 4 недели лечения и 1 запасную блистерную карту. Блистерные карты маркировали по неделям лечения. Распределение лекарственного средства по дням было указано в блистерных картах для каждого дня. Ежедневное введение исследуемого лекарственного средства состояло из 4 отдельных таблеток. Одна блистерная карта содержала 32 таблетки (7×4 таблеток, 4 таблетки в день, и запас из 4 таблеток на один день). Одна упаковка лекарственного средства для пациента состояла из 5 коробок. Коробку 2 добавляли в качестве запасного лекарственного средства к коробке 1 (периода титрования повышающейся дозой), и она предназначалась для выдачи лишь в случае утери пациентом блистерной карты из коробки 1 или всей коробки.
Исследуемое лекарственное средство выдавали при визите 2 (исходный уровень, день 0). Каждый пациент получал блистерную коробку, содержащую 5 блистерных карт (включая 1 запасной блистер) лекарственного средства дважды слепого исследования (т.е.32 таблетки). Субъектов инструктировали принимать по 2 таблетки дважды в день (4 таблетки/день), начиная со следующего дня после выдачи исследуемого лекарственного средства до их следующего визита исследования (визита 3). Для субъектов, получающих активное лекарственное средство, в режим введения дозы включали несколько таблеток плацебо для обеспечения эффекта "слепоты" во время периода титрования возрастающей дозой. Назначенную фиксированную поддерживаемую дозу 25, 50 или 75 мг нерамексана мезилата/день вводили, начиная с пятой недели двойного слепого лечения, и продолжали на протяжении всего исследования. В каждый из последующих визитов (визиты 3, 4 и 5, соответствующие концу 4, 8 и 12 недели) пациенты получали следующую блистерную коробку, содержащую 5 блистерных карт для 4-недельных периодов с дважды слепым лекарственным средством на период лекарственного вмешательства до следующего визита исследования. Схема дозирования показана в таблице 5.
На протяжении периода двойного слепого лечения пациенты продолжали принимать 2×2 таблетки лекарства ежедневно с постоянным интервалом 12 часов. В случае если пациент уже принял утреннюю дозу исследуемого лекарства в день визитов 4 и 6 (8 неделя и 16 неделя), запланированный отбор образца крови не проводили. Исследователь должен был повторно выдать достаточное количество исследуемого лекарственного средства. Больному следовало продолжать прием 2 раза по 2 таблетки с постоянным интервалом 12 часов и вернуться для отбора образца крови до введения дозы во временных границах визитов 4 и 6.
В случае плохой переносимости исследователь мог принять решение о снижении дозы на 25 мг/день путем исключения более крупной таблетки утром, что представляло снижение эффективной дозы только в группах с 75 мг/день и 50 мг/день нерамексана мезилата. После исключения более крупной таблетки (25 мг или плацебо, соответственно) утренней дозы эти пациенты могли затем продолжить участие в исследовании в соответствии с графиком, но получая лишь одну меньшую таблетку в качестве утренней дозы (12,5 мг или плацебо, соответственно) и 2 таблетки разного размера (12,5 мг, 25 мг или плацебо, соответственно) в качестве вечерней дозы. Дозу оставляли постоянной до окончания исследования.
Субъектов инструктировали принимать исследуемое лекарственное средство всегда в удобное для субъекта, но фиксированное время на протяжении всего периода исследования и при постоянном интервале между дозами 12 часов, когда это возможно (например, 6:00 час и 18:00 час или 8:00 час и 20:00 час). При каждом визите исследования исследователь осведомлялся о моментах приема исследуемого лекарственного средства накануне.В конце 4, 8, 12 и 16 недели (или после преждевременного прекращения) пациенты, возвращающиеся в место исследования, приносили с собой свои блистерные коробки, содержащие 5 блистерных карт для оценки податливости лечению.
Эффективность
Первичный результат
Первичной конечной точкой эффективности в этом исследовании было изменение суммарного показателя TBF-12 от исходного уровня (визит 2) до последнего визита (визит 6, т.е.16 неделя).
Вторичные результаты
Суммарный показатель TBF-12 (величины и абсолютное изменение относительно исходного уровня) при всех визитах после исходного, за исключением последнего визита.
Изменение суммарного показателя TBF-12 с 16 недели по 20 неделю (величины и абсолютные изменения).
Факторные показатели TBF-12 (величины и абсолютное изменение по сравнению с исходным уровнем, включая изменение с 16 недели по 20 неделю) при всех визитах после исходного.
Анкета гиперакузии GUF ("Gerauschüberempfindlichkeits- Fragebogen"), величины и абсолютное изменение по сравнению с исходным уровнем, включая изменение с 16 недели по 20 неделю, суммарный и факторные показатели при всех визитах после исходного при наличии гиперакузии.
Общая клиническая оценка изменения: пункт 27 отслеживающего опроса по поводу тиннитуса суммировали после разделения на две части ответов о любом улучшении (величины 1, 2, 3) против отсутствия улучшения (величины 4, 5, 6, 7) и о значительном улучшении (величины 1, 2) против отсутствия выраженного улучшения (величины 3, 4, 5, 6, 7).
Суммарный показатель HADS-D, а также показатели подшкалы депрессии и тревожности (величины и абсолютное изменение по сравнению с исходным уровнем, а также изменение с 16 недели по 20 неделю) при всех визитах после исходного.
Величины опроса по поводу тиннитуса (исходного и отслеживающего) при всех визитах после исходного; абсолютное изменение по сравнению с исходным уровнем и изменение с 16 недели по 20 неделю для пунктов 8, 9, 10, 19, 20, 21, 24, 25 и 26 отслеживающего опроса.
Анализ данных
Все анализы эффективности проводили на популяции ITT с использованием определяемого последним наблюдением направленного вперед (LOCF) подхода. С целью чувствительности дополнительно проводили анализ ряда для каждого протокола и наблюдаемых случаев. Все статистические тесты, использованные для тестирования первичной эффективности (подтверждающего тестирования), и вторичные критерии эффективности (исследовательские) и все другие статистические тесты, использованные для исследовательских анализов, представляли собой тесты двусторонней гипотезы, проведенные при уровне значимости 5%. Для всех переменных рассчитывали стандартные описательные статистические величины.
Изменение с исходного уровня (визит 2) по 16 неделю суммарного показателя TBF-2 анализировали с помощью модели двусторонней ANCOVA с группой лечения и центрами исследования в качестве факторов и исходного суммарного показателя TBF-12 в качестве ковариата.
Для вторичных параметров эффективности проводили сравнение между нерамексаном и плацебо, когда это возможно, по визитам с помощью двустороннего ANCOVA с группой лечения и центрами исследования в качестве факторов и соответствующей исходной величиной параметра эффективности в качестве ковариата.
Обсуждение
Это клиническое исследование дало многообещающие результаты в плане эффективности и безопасности. Через 16 недель дважды слепого лечения (визит 6) при конечных ежедневных дозах 50 или 75 мг нерамексана мезилата пациенты сообщали о выраженном улучшении их тиннитуса, измеряемом с помощью TBF-12, что отличалось от групп, принимавших плацебо или низкую дозу (25 мг) нерамексана мезилата. Период лечения сопровождался 4-недельным периодом выведения без какого-либо лекарственного вмешательства. Примечательно, что субъекты, лечившиеся ранее либо 50, либо 75 мг нерамексана мезилата, сообщали о дополнительном связанном с этим улучшении их тиннитуса, о чем не сообщали субъекты, принимавшие плацебо или низкую дозу нерамексана. Это представляло собой совершенно неожиданное клиническое наблюдение. В конце 4-недельного выведения (20 неделя, визит 7) различие в улучшении TBF-12 между группами 50 мг и плацебо достигало статистической значимости. Эти результаты показаны в таблице 6 ниже и на фиг.1.
ческое среднее ± ст.откл.
-0,2]
Эти данные показывают, что нерамексан обладает способностью продолжительно улучшать тиннитус даже после отмены лекарства. Таким образом, нерамексан может быть пригоден в качестве терапии с интервалами в лечении тиннитуса, которая обеспечивает интервалы без лекарственного вмешательства, во время которых пациенты не испытывают ухудшения их тиннитуса, или в качестве поддерживающей терапии в лечении тиннитуса для предотвращения рецидива тиннитуса у пациентов посредством введения сниженной дозы нерамексана.
Пример 2: Дважды слепое, контролируемое плацебо, испытание нерамексана для лечения тиннитуса
Целью этого проекта являлось проведение клинического испытания для дополнительной оценки продолжительных эффектов нерамексана в качестве терапии тиннитуса. Главная цель этого исследования заключалась в сравнении эффективности, переносимости и безопасности нерамексана против плацебо у субъектов с впервые наступившим, продолжающимся, односторонним или двусторонним субъективным тиннитусом.
План исследования
Эффективность нерамексана у субъектов, страдающих тиннитусом, оценивали в дважды слепом, многоцентровом, рандомизированном, контролируемом плацебо исследовании с параллельными группами. Пациентов, соответствующих конкретным критериям включения и не соответствующих конкретным критериям исключения, рандомизируют в дважды слепые группы лечения.
Субъектов лечат в течение 17 недель нерамексаном или плацебо, включая пятинедельный период титрования повышающейся дозой, зависимой от исследуемых четырех доз, с последующим 12-недельным периодом наблюдения без лечения для исследования продолжительных эффектов лекарства после прекращения лечения.
У субъектов с назначенной суточной дозой нерамексана мезилата 50 мг (с массой тела <90 кг) стационарное состояние обычно достигается через четыре недели, у пациентов с назначенной суточной дозой нерамексана мезилата 75 мг (с массой тела ≥90 кг) стационарное состояние обычно достигается через пять недель лечения. Для пациентов, испытывающих ограничивающие дозу неблагоприятные последствия при дозе 75 мг, доза может быть снижена переводом пациента на дозу 50 мг/день. Пациентом, не переносящим минимальную дозу 50 мг/день, обычно прекращали введение.
Для оценки каждого пациента назначают следующие визиты:
Визит 1 (скрининг): После подписания формы согласия субъекта подвергают физическому обследованию и клиническому лабораторному тестированию. Пригодность пациента для исследования оценивали с помощью критериев включения/исключения.
Визит 2 (исходное состояние): Субъекта опрашивают по поводу неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти события/изменения документируют. Субъекта оценивают на предмет пригодности для исследования на основе рассмотрения критериев включения/исключения. Вместе с субъектом рассматривают процедуры испытания и допустимые и недопустимые сопутствующие лекарственные вмешательства. Оценивают параметры безопасности и эффективности. Субъекта вводят в исследование, и назначение лекарственного средства (плацебо или нерамексана) производится, как описано ниже.
Визит 3 (5 неделя): Этот визит проводится в конце последовательного титрования повышающейся дозой. Субъекта опрашивают относительно неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти события/изменения документируют. Оценивают параметры безопасности и эффективности. Проводят назначение лекарственного лечения, как описано ниже.
Визит 4 (9 неделя): Этот визит проводится в конце первого 4-недельного периода дважды слепого лечения фиксированной дозой. Субъекта опрашивают относительно неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти изменения документируют. Оценивают параметры безопасности и эффективности. Проводят назначение лекарственного лечения, как описано ниже.
Визит 5 (13 неделя): Этот визит проводится в конце второго 4-недельного периода дважды слепого лечения фиксированной дозой. Субъекта опрашивают относительно неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти изменения документируют. Оценивают параметры безопасности и эффективности. Проводят назначение лекарственного лечения, как описано ниже.
Визит 6 (17 неделя, окончание лечения): Этот визит проводится в конце 12-недельного периода дважды слепого лечения фиксированной дозой. Субъекта опрашивают относительно неблагоприятных событий и изменений в сопутствующем лечении/заболевании, и эти изменения документируют. Производят клиническую лабораторную оценку. Оценивают параметры безопасности и эффективности.
Визит 7 (21 неделя): Этот визит проводится через 4 недели после введения последней дозы исследуемого лекарственного средства. Производится опрос субъекта относительно сопутствующих лекарственных вмешательств, а также наличия неблагоприятных событий после последнего визита. Оценивают параметры безопасности и эффективности.
Визит 8 (25 неделя): Этот визит проводится через 8 недель после введения последней дозы исследуемого лекарственного средства. Проводится опрос субъекта относительно сопутствующих лекарственных вмешательств, а также наличия неблагоприятных событий после последнего визита. Оценивают параметры безопасности и эффективности.
Визит 9 (29 неделя): Этот визит проводится в конце 12-недельного периода отслеживания после введения последней дозы исследуемого лекарственного средства. Проводится опрос субъекта относительно сопутствующих лекарственных вмешательств, а также наличия неблагоприятных событий после последнего визита. Оценивают параметры безопасности и эффективности.
Введение нерамексана
Таблетки нерамексана мезилата с немедленным высвобождением (12,5 мг и 25 мг) и соответствующие таблетки плацебо вводят в виде таблеток, покрытых пленкой.
Лекарственный препарат выдают со 2-го визита по 5-й визит. Лекарственный препарат для каждого дня исследования состоит из 4 отдельных таблеток. Схема дозирования показана в таблице 7.
В течение периода дважды слепого лечения пациенты продолжают принимать 2×2 таблетки лекарственного препарата ежедневно с постоянным интервалом 12 часов.
(75 мг/день)
В случае ограничивающих дозу неблагоприятных событий исследователь мог принять решение о снижении дозы на 25 мг/день только в группе 75 мг/день. Субъектам, неспособным переносить минимальную дозу 50 мг/день, прекращали введение.
Субъектов инструктировали принимать исследуемое лекарственное всегда в удобное для субъекта, но фиксированное время на протяжении всего периода исследования и при постоянном интервале между дозами 12 часов, когда это возможно (например, 6:00 час и 18:00 час или 8:00 час и 20:00 час).
Эффективность
Первичный результат
Первичной конечной точкой эффективности в этом исследовании было изменение суммарного показателя TBF-12 от исходного уровня (визит 2) до окончания лечения.
Вторичные результаты
Суммарный показатель TBF-12 и факторные показатели TBF-12 (величины и абсолютное изменение относительно исходного уровня) при всех визитах после исходного.
Громкость тиннитуса (11-бальная шкала Ликерта)
Раздражение от тиннитуса (11-бальная шкала Ликерта)
Влияние тиннитуса на жизнь (11-бальная шкала Ликерта)
Суммарный показатель громкости тиннитуса, раздражения от тиннитуса и влияния тиннитуса на жизнь (T-показатель).
Анализ данных
Все анализы эффективности проводят на популяции ITT с использованием определяемого последним наблюдением направленного вперед (LOCF) подхода. Все статистические тесты, использованные для тестирования первичной эффективности (подтверждающего тестирования), и вторичные критерии эффективности (исследовательские) и все другие статистические тесты, использованные для исследовательских анализов, представляют собой тесты двусторонней гипотезы, проведенные при уровне значимости 5%.
Обсуждение
Ожидается, что это клиническое исследование дополнительно покажет, что нерамексан обладает способностью продолжительно улучшать тиннитус даже после отмены лекарства и что, следовательно, нерамексан может быть пригоден в качестве терапии с интервалами для лечения тиннитуса, которая обеспечивает интервалы без лекарственного препарата, в течение которых пациенты не испытывают ухудшения их тиннитуса, или в качестве поддерживающей терапии для лечения тиннитуса для профилактики рецидива тиннитуса у пациентов посредством введения сниженной дозы нерамексана.
Пример 3: Контролируемое плацебо испытание нерамексана для лечения потери слуха
План исследования
Главной целью этого исследования является изучение безопасности и эффективности нерамексана мезилата в суточных дозах до 75 мг для лечения потери слуха по сравнению с плацебо.
Введение нерамексана
Таблетки нерамексана мезилата 25 мг с модифицированным высвобождением и соответствующие таблетки плацебо вводят в виде покрытых пленкой таблеток.
Нерамексана мезилат (или плацебо) титруют возрастающей дозой до максимальной суточной дозы 75 мг, начиная с суточной дозы 25 мг в течение одной недели со ступенчатым повышением дозы на 25 мг с недельными интервалами.
Лечение начинается с вечера 1 дня исследования. Суточная исходная доза нерамексана мезилата составляет 25 мг на прием, осуществляемый в течение 7 дней при приготовлении ко сну. На 8 день суточная доза нерамексана мезилата увеличивается до 50 мг на протяжении последующих 7 дней (две таблетки вечером в течение одной недели). На 15 день пациентов титруют повышением дозы до 75 мг нерамексана мезилата. Пациенты продолжают принимать в течение 13 недель (три таблетки в сутки вечером в течение 13). Пациентом, которые не переносят дозу 75 мг в день, доза нерамексана мезилата может быть снижена на 25 мг до 50 мг для того, чтобы они оставались в рамках общей схемы продолжительности лечения. Например, пациентом, которые не переносят дозу 75 мг, позволяли вернуться к дозе 50 мг. Пациентов затем просят оставаться на дозе 50 мг на остающееся время общей схемы продолжительности лечения из 7 недель. Этот режим введения дозы показан в таблице 8.
Объем настоящего изобретения не ограничивается конкретными вариантами осуществления, описанными в настоящем документе. Действительно, различные модификации изобретения в дополнение к описанным в настоящем документе должны стать очевидными для специалистов в данной области техники из предшествующего описания. Такие модификации рассматриваются как попадающие в объем прилагаемой формулы изобретения.
Все патенты, заявки, публикации, методы тестирования, литература и другие материалы, цитированные в настоящем описании, включены в настоящее описание в качестве ссылки.
Группа изобретений относится к медицине, а именно к отоларингологии, и может быть использовано для лечения тиннитуса у нуждающегося в этом субъекта. Для этого вводят терапевтически эффективную дозу производного 1-аминоалкилциклогексана, выбранного из нерамексана или его фармацевтически приемлемых солей. Терапевтически эффективную дозу нерамексана вводят ежедневно в течение первого периода, составляющего, по меньшей мере, три месяца, с последующим вторым периодом, составляющим, по меньшей мере, один месяц. Во время второго периода нерамексан вводят в дозе, составляющей 0-75% от терапевтически эффективной дозы, при условии, что когда во время второго периода нерамексан не вводят, лечение первого периода повторяют после второго периода. Группа изобретений обеспечивает эффективность при лечении или профилактике тиннитуса, а также необходимость поддерживающей терапии. 2 н. и 22 з.п.ф-лы, 1 ил., 8 табл., 3 пр.
1. Применение производного 1-аминоалкилциклогексана, выбранного из нерамексана и его фармацевтически приемлемых солей для лечения тиннитуса, где терапевтически эффективную дозу производного 1-аминоалкилциклогексана вводят ежедневно в течение первого периода, составляющего, по меньшей мере, три (3) месяца, с последующим вторым периодом, составляющим, по меньшей мере, один (1) месяц, во время которого производное 1-аминоалкилциклогексана вводят в дозе, составляющей 0-75% от терапевтически эффективной дозы, при условии, что когда во время второго периода производное 1-аминоалкилциклогексана не вводят, лечение первого периода повторяют после второго периода.
2. Применение по п.1, где во время второго периода производное 1-аминоалкилциклогексана вводят в дозе от более 0 до 75% от терапевтически эффективной дозы, или которое вводят в дозе, составляющей 20-75% от терапевтически эффективной дозы, или которое вводят в дозе, составляющей 25-50% от терапевтически эффективной дозы.
3. Применение по п.1, где повышение дозы для достижения терапевтически эффективной дозы после второго периода производится ступенчато.
4. Применение по п.1, где за вторым периодом следует введение субъекту терапевтически эффективной дозы производного 1-аминоалкилциклогексана после рецидива тиннитуса.
5. Применение по п.4, где введение терапевтически эффективной дозы производного 1-аминоалкилциклогексана после рецидива тиннитуса продолжается в течение, по меньшей мере, одного года.
6. Применение по п.1, где второй период составляет от трех (3) до шести (6) месяцев.
7. Применение по п.1, где между первым и вторым периодом имеется переходный период, во время которого доза ступенчато снижается.
8. Применение по п.1, где производное 1-аминоалкилциклогексана представляет собой нерамексана мезилат.
9. Применение по п.8, где нерамексана мезилат вводят в диапазоне от приблизительно 5 мг до приблизительно 150 мг/день во время первого периода, или в диапазоне от приблизительно 5 мг до приблизительно 100 мг/день во время первого периода, или в диапазоне от приблизительно 5 мг до приблизительно 75 мг/день во время первого периода, или приблизительно 50 мг/день во время первого периода, или приблизительно 75 мг/день во время первого периода.
10. Применение по п.1, где нерамексан или его фармацевтически приемлемую соль вводят один раз в день, дважды в день (b.i.d.) или три раза в день.
11. Применение по п.9, где нерамексан или его фармацевтически приемлемую соль вводят дважды в день.
12. Применение по п.1, где нерамексан или его фармацевтически приемлемую соль вводят в препаративной форме с немедленным высвобождением или вводят в препаративной форме с модифицированным высвобождением.
13. Способ лечения тиннитуса у нуждающегося в этом субъекта, включающий введение терапевтически эффективной дозы производного 1-аминоалкилциклогексана, выбранного из нерамексана и его фармацевтически приемлемой соли, где терапевтически эффективную дозу производного 1-аминоалкилциклогексана вводят ежедневно в течение первого периода, составляющего, по меньшей мере, три (3) месяца, с последующим вторым периодом, составляющим, по меньшей мере, один (1) месяц, во время которого производное 1-аминоалкилциклогексана вводят в дозе, составляющей 0-75% от терапевтически эффективной дозы, при условии, что когда во время второго периода производное 1-аминоалкилциклогексана не вводят, лечение первого периода повторяют после второго периода.
14. Способ по п.13, где во время второго периода производное 1-аминоалкилциклогексана вводят в дозе, составляющей от более 0 до 75% от терапевтически эффективной дозы, или которое вводят в дозе, составляющей 20-75% от терапевтически эффективной дозы, или которое вводят в дозе, составляющей 25-50% от терапевтически эффективной дозы.
15. Способ по п.13, где повышение дозы для достижения терапевтически эффективной дозы после второго периода производится ступенчато.
16. Способ по п.13, где за вторым периодом следует введение субъекту терапевтически эффективной дозы производного 1-аминоалкилциклогексана после рецидива тиннитуса.
17. Способ по п.16, где введение терапевтически эффективной дозы производного 1-аминоалкилциклогексана после рецидива тиннитуса продолжается в течение, по меньшей мере, одного года.
18. Способ по п.13, где второй период составляет от трех (3) до шести (6) месяцев.
19. Способ по п.13, где между первым и вторым периодом имеется переходный период, во время которого доза ступенчато снижается.
20. Способ по п.13, где производное 1-аминоалкилциклогексана представляет собой нерамексана мезилат.
21. Способ по п.20, где нерамексана мезилат вводят в диапазоне от приблизительно 5 мг до приблизительно 150 мг/день во время первого периода, или в диапазоне от приблизительно 5 мг до приблизительно 100 мг/день во время первого периода, или в диапазоне от приблизительно 5 мг до приблизительно 75 мг/день во время первого периода, или приблизительно 50 мг/день во время первого периода, или приблизительно 75 мг/день во время первого периода.
22. Способ по п.13, где нерамексан или его фармацевтически приемлемую соль вводят один раз в день, дважды в день (b.i.d.) или три раза в день.
23. Способ по п.22, где нерамексан или его фармацевтически приемлемую соль вводят дважды в день.
24. Способ по п.13, где нерамексан или его фармацевтически приемлемую соль вводят в препаративной форме с немедленным высвобождением или вводят в препаративной форме с модифицированным высвобождением.
| US 6071966 А, 06.06.2000 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| БЕСПАЛОВ А.Ю | |||
| и др | |||
| Нейропсихофармакология антагонистов NMDA-рецепторов | |||
| - СПб., 2000, с.28. | |||
Авторы
Даты
2012-04-10—Публикация
2008-09-10—Подача