Область техники
Изобретение относится к области медицинских исследований и нанотехнологий на основе двухцепочечных нуклеиновых кислот, а именно к способам диагностики патологических состояний, сопровождающихся тромбообразованием, в частности, для обеспечения контроля состояния больных, терапия которых связана с применением гепарина.
Предшествующий уровень техники
Гепарин - кислый мукополисахарид, вырабатываемый тучными клетками и осуществляющий медиаторные функции во всех органах человека и животных и многих биологических жидкостях. В его состав входят несколько линейных полисахаридных цепей с молекулярной массой 5000-30000 Да, состоящих из остатков глюкуроновой кислоты и глюкозамина, этерифицированных серной кислотой.
Молекула гепарина содержит в своем составе значительное количество отрицательно заряженных сульфатных и карбоксильных групп, поэтому она представляет собой сильный полианион, способный к образованию комплексов со многими природными и синтетическими катионами.
Особенности строения и высокая степень химической гетерогенности гепарина определяют его биологическое значение и функциональную роль в организме человека и животных. Являясь природным противосвертывающим фактором, гепарин наиболее широко известен как антикоагулянт прямого типа действия, применяемый для профилактики и терапии тромбоэмболических заболеваний и их осложнений, при операциях на сердце и кровеносных сосудах, для поддержания жидкого состояния крови в аппаратах искусственного кровообращения и гемодиализа, а также для предотвращения свертывания крови при лабораторных исследованиях. Антикоагулянтная активность гепарина обусловлена его способностью повышать спектр угнетаемых антитромбином III сериновых протеаз, участвующих в свертывании крови.
В клинической практике применяют два вида гепарина - стандартный (нефракционный) и низкомолекулярный.
Нефракционный гепарин применяется шире, однако имеет ряд существенных недостатков:
- высокая степень связывания гепарина с белками плазмы и его быстрая инактивация эндотелиальными клетками и макрофагами;
- относительная кратковременность действия гепарина, вследствие чего требуется постоянная внутривенная инфузия в течение суток (или многократные подкожные инъекции препарата);
- гепарин не обладает последействием, и после окончания его применения условия для образования тромба восстанавливаются. Возможна активация тромботического процесса, что выражается в увеличении числа эпизодов ишемии миокарда и развитии инфаркта миокарда.
Для устранения указанных нежелательных свойств используют низкомолекулярный гепарин - препараты, у которых молекулярная масса фрагментов колеблется от 2500 до 6500 Да, синтезированные из нефракционного гепарина.
Низкомолекулярные гепарины тормозят каскад свертывания крови на более высокой ступени - на уровне фактора Ха, имеют высокую биодоступность - более 90% после глубокой подкожной инъекции. Однако они тормозят и образование некоторого количества тромбина, что может привести к развитию тромбоцитопении.
Безопасность клинического применения гепарина может быть гарантирована только при рациональном введении его антагонистов, которые способны быстро и без токсических проявлений устранять избыточный антикоагулянтный эффект гепарина. Трудности восстановления свертываемости крови при использовании антагонистов гепарина во многом зависят от характера распределения гепарина в организме пациента. Поэтому для расчета нейтрализующих доз антагонистов гепарина требуется определять концентрацию гепарина в крови в каждом конкретном случае. Рациональность использования антигепаринатов, главным образом, зависит от точности и скорости получения информации о количестве циркулирующего в кровотоке гепарина, что является основной проблемой безопасного использования гепарина как антикоагулянта.
Эффективность методов определения гепарина зависит от принципа, на котором они основаны.
Известны коагуляционные методы, основанные на определении ингибирующего эффекта гепарина по отношению к тромбину или фактору Ха, например, так называемые интегральные методы, основанные на способности гепарина удлинять время свертывания крови в результате ингибирования образования фибринового сгустка.
Однако, несмотря на простоту, интегральные методы определения концентрации гепарина характеризуются целым рядом недостатков, к которым можно отнести:
- отсутствие специфичности (на результаты интегральных методов, помимо действия гепарина, оказывают влияние различные изменения коагуляции in vivo);
- низкую чувствительность (интегральные методы практически не чувствительны к низким (<0,1 международной единицы активности гепарина в 1 мл (Ед./мл)) концентрациям гепарина;
- низкую воспроизводимость (относительная ошибка определений концентрации гепарина, проводимых при помощи интегральных методов, составляет ~20-25%).
Для определения концентрации гепарина в плазме крови применяют также методы, основанные на использовании хромогенных пептидных субстратов, специфичных по отношению к тромбину или фактору Ха. В этих тестах хромогенные пептидные субстраты выступают в качестве «репортерных» молекул, по изменению оптических свойств которых (колориметрических или флюорометрических) можно следить за скоростью катализируемой гепарином ферментативной реакции инактивации антитромбина или фактора Ха антитромбином III. Условия проведения теста подбирают таким образом, чтобы скорость ферментативной реакции была связана линейной зависимостью с уровнем гепарина в образце. Однако на результаты анализов, проводимых с использованием хромогенных пептидных субстратов, оказывает влияние связывание гепарина с белковыми компонентами плазмы, имеющими антигепариновую природу.
Колориметрический и флюорометрический методы определения гепарина характеризуются более высокой точностью и стабильной чувствительностью к гепарину (до 0,01 Ед./мл) по сравнению с методами, основанными на процессе образовании сгустка, являются более удобными для клинического обследования и контроля, но вследствие их сложности и достаточно высокой стоимости их постановка возможна только в хорошо оснащенных специализированных лабораториях, располагающих дорогостоящим оборудованием и высококвалифицированным персоналом.
Известны химические методы, с помощью которых измеряют в основном количество гепарина как вещества, а не его антикоагулянтную активность, и основаны на детекции гепарина как мукополисахарида.
Для этого, например, используют карбазольную реакцию гексуроновой кислоты или ацетилацетоновую конденсацию гексозаминов с количественным определением последующих пиррольных производных (дериватов) при помощи п-диметиламинобензальдегида (реагент Эрлиха). Эти методы непригодны для определения гепарина в плазме крови, характеризуются длительностью проведения анализа - ~1 час и более, и отличаются невысокой чувствительностью: с их помощью можно обнаружить концентрации гепарина более 12 мкг/мл или 1,6 Ед./мл.
Еще одна группа химических методов основана на способности гепарина как мукополисахарида вызывать метахроматический эффект при его взаимодействии с некоторыми основными красителями - азуром А, толуидиновым синим, карбоцианиновым красителем. Интенсивность метахромазии при образовании комплекса «гепарин - краситель» при оптимальной концентрации и объеме раствора добавленного красителя пропорциональна концентрации гепарина, и эта величина может быть определена спектрофотометрически. Минимальная концентрация гепарина, определяемая при помощи метахроматических методов, составляет ~10 мкг/мл или 1,0 Ед./мл его активности. Относительная ошибка определения концентрации гепарина при помощи этой группы методов составляет 10-15%.
Однако метахроматические методы, как и методы, основанные на использовании специфических в отношении гепарина химических реакций, также непригодны для определения гепарина в плазме крови, достаточно дороги, обладают плохой воспроизводимостью и недостаточно точны. Последние два недостатка обусловлены преципитацией образующегося комплекса «гепарин - краситель» и чувствительностью показаний абсорбции этого комплекса к температуре.
Известно, что практика клинической медицины, как правило, включает проведение анализов физиологических жидкостей (кровь, моча, ликвор и т.д.) пациента с целью определения уровня биологически активных веществ (далее БАВ), определяющих состояние его организма.
Известны биотехнологические приемы для определения содержания БАВ в физиологических жидкостях, в частности портативные универсальные биосенсорные тест-системы (Биосенсоры: основы и приложения. / Под ред. Тернера Э., Карубе И., Уилсона Дж. М.: Мир, 1992, 614 с.), которые состоят из двух принципиальных компонентов: «чувствительного» элемента - «биодатчика», создаваемого на основе биологических молекул, обладающего способностью изменять свои оптические свойства при взаимодействии с БАВ, и системы детектирования и преобразования оптического сигнала, генерируемого биодатчиком при взаимодействии с определяемым БАВ-аналитом (Скуридин С.Г., Дубинская В.А., Лагутина М.А., Ребров Л.Б., Быков В.А., Евдокимов Ю.М. Биодатчики на основе жидкокристаллических структур ДНК: создание и приложения в биотехнологии и медицине. // Технологии живых систем, 2006, т.3, №4, с.3-27).
Биотехнологические методы с использованием биосенсоров обладают целым рядом преимуществ перед традиционными u1084 методами аналитической химии, а именно высокой чувствительностью, селективностью определения БАВ, отсутствием необходимости в специальной пробоподготовке, отсутствием особых требований, предъявляемых к рабочим площадям и квалификации персонала, проводящего анализ, возможностью получения результата анализа в режиме реального времени (Евдокимов Ю.М., Бундин B.C., Островский М.А. Биосенсоры и сенсорная биология. // Сенсорные системы, 1997, т.11, №4, с.373-387).
Известны принципы функционирования биосенсоров на основе молекул ДНК (Yevdokimov Yu.M., Skuridin S.G., Chernukha B.A. The Background for creating biosensors based on nucleic acid molecules. // Advances in Biosensors (Eds. A.P.F.Turner and Yu.M.Yevdokimov); JAI Press Inc., London, 1995, v.3, p.143-164; Skuridin S.G., Yevdokimov Yu.M., Efimov V.S., Hall J.M., Turner A.P.F. A new approach for creating double-stranded DNA biosensors. // Biosens. Bioelectron., 1996, v.11, No 9, p.903-911).
Известны исследования возможностей конструирования биосенсоров биодатчиков для определения БАВ на основе двухцепочечных нуклеиновых кислот (Евдокимов Ю.М., Салянов В.И., Мчедлишвили Б.В., Быков В.А., Спенер Ф., Палумбо М. Молекулярное конструирование на основе двухцепочечных нуклеиновых кислот и синтетических полинуклеотидов для создания интегрального биодатчика. // Сенсорные системы, 1999, т.13, №1, с.82-91).
Было замечено, что жидкие кристаллы ДНК имеют ряд отличительных особенностей, в частности:
- высокую плотность упаковки и упорядоченный характер укладки молекул ДНК в жидких кристаллах, практически совпадающие с аналогичными параметрами, характерными для ДНК в составе биологических объектов;
- высокую лабильность пространственной структуры жидких кристаллов в ответ на изменение внешних условий и, наконец,
- аномальную оптическую активность, наблюдаемую при образовании жидких кристаллов ДНК холестерического типа, которая проявляется, в частности, в наличии интенсивной полосы, расположенной в области поглощения азотистых оснований ДНК (λ≈260 нм) в спектре кругового дихроизма (далее КД) при облучении этих кристаллов потоком циркулярно-поляризованного излучения в ультрафиолетовой области спектра.
Амплитуда этой полосы может в десятки и сотни раз превышать амплитуду полосы в спектре кругового дихроизма (КД), обусловленную молекулярной оптической активностью, характерной для исходных линейных молекул ДНК.
Такие биодатчики получили название «интегральных микрочипов на основе наноконструкций ДНК» (Yevdokimov Yu.M., Salyanov V.I., Zakharov M.A. A novel type of microscopic size chips based on double-stranded nucleic acids. // Lab on a Chip, 2001, v.1, No 1, p.35-41).
В качестве перспективного биоматериала, используемого для создания полифункциональных биодатчиков биосенсорных устройств, известны частицы лиотропных жидкокристаллических дисперсий линейных двухцепочечных молекул ДНК (далее ХЖКД) и их комплексов с БАВ (Скуридин С.Г., Евдокимов Ю.М. Частицы жидкокристаллических дисперсий ДНК как основа для создания чувствительных элементов биосенсоров. // Биофизика, 2004, т.49, №3, с.468-485).
При этом молекулы ДНК, фиксированные в пространственной структуре частиц ХЖКД, используют в качестве «строительных блоков», между которыми возможно «встраивать» искусственные наноразмерные «наномостики», содержащие «чувствительные» элементы, способные легко «откликаться» на присутствие в среде БАВ разной химической природы (Yevdokimov Yu.M., Skuridin S.G., Nechipurenko D.Yu., Zakharov M.A., Salyanov V.I., Kurnosov A.A., Kuznetsov V.D., Nikiforov V.N. Nanoconstructions based on double-stranded nucleic acids. // Int. J. Biol. Macromol., 2005, v.36, No 1-2, p.103-115).
Известны жидкокристаллические биодатчики для определения БАВ (US, 6246470, B1; RU, 2032895, С1), представляющие собой дисперсную фазу из линейных двухцепочных молекул ДНК, сшитых молекулами субстрата для определяемого БАВ, распределенную в водно-полимерном матриксе, при этом используют субстрат, подвергающийся гидролизу под воздействием БАВ.
Принцип формирования и действия датчика состоит в том, что сначала из молекул ДНК и природного соединения формируют комплекс «ДНК - природное соединение», затем из этого комплекса формируют дисперсную жидкокристаллическую фазу и расщепляют молекулы природного соединения в составе комплексов «ДНК - природное соединение», образующих жидкие кристаллы, при помощи определяемого БАВ, являющегося протеолитическим ферментом, например стеллином В. В результате действия фермента сшивки между молекулами ДНК, образованные молекулами природного соединения, разрушаются, и сами жидкие кристаллы переходят из оптически неактивного в оптически активное состояние. Изменение аномальной оптической активности, в частности, спектров ДНК, наблюдаемое при перестроении структуры жидкого кристалла, позволяет не только детектировать наличие фермента в исследуемом растворе, но и открывает возможность для определения его типа, класса или группы по характеру наблюдаемых изменений.
Было установлено, что основным фактором стабилизации интегральных микрочипов ДНК является не осмотическое давление водно-полимерного раствора, а число и «прочность» наномостиков (Скуридин С.Г., Дубинская В.А., Захаров М.А., Лагутина М.А., Минеева М.Ф., Ребров Л.Б., Быков В.А., Евдокимов Ю.М. Выявление фармацевтических субстанций с комплексообразующими свойствами при помощи биоаналитической тест-системы на основе интегральных жидкокристаллических микрочипов ДНК. // Жидкие кристаллы и их практическое использование, 2005, №3-4, с.64-74; Yevdokimov Yu.M., Salyanov V.I., Lortkipanidze G.B., Gedig E., Spener F., Palumbo M. Sensing biological effectors through the response of bridged nucleic acids and polynucleotides fixed in liquid-crystalline dispersions. // Biosens. Bioelectron., 1998, v.13, p.279-291).
Поэтому возможно получение микрочипов ДНК, стабильных в широком интервале условий и способных существовать за пределами образования частиц лиотропной ХЖКД ДНК (Евдокимов Ю.М., Салянов В.И., Скуридин С.Г. От жидких кристаллов к наноконструкциям ДНК. // Молекуляр. биология, 2009, т.43, №2, с.309-326).
Известен способ определения гепарина в лабораторных растворах, основанный на различиях в пространственной организации ХЖКД комплекса «ДНК - антагонист гепарина» и комплекса «ХЖКД ДНК», а также на способности гепарина взаимодействовать с его синтетическим антагонистом - поликонидином, включенным в состав ХЖКД комплекса «ДНК - антагонист гепарина» (RU, 2123008, С1). Этот способ включает:
- формирование ХЖКД комплекса «ДНК - антагонист гепарина» в водно-солевом растворе умеренной (физиологической) ионной силы;
- смешивание полученной дисперсии с нейтральным по отношению к ДНК, антагонисту гепарина и гепарину водно-солевым раствором полимера;
- смешивание полученной смеси с анализируемой жидкостью, содержащей гепарин, в условиях, при которых оптические свойства ХЖКД комплекса «ДНК - антагонист гепарина» не нарушаются;
- регистрацию спектра кругового дихроизма (аномальной оптической активности) в области поглощения азотистых оснований ДНК при пропускании через пробу, полученную в результате указанного смешивания, потока циркулярно-поляризованного излучения в ультрафиолетовой области спектра;
- определение концентрации гепарина в пробе при помощи заранее полученной калибровочной прямой;
- корректировку концентрации гепарина в анализируемой жидкости с учетом разбавления, использованного при приготовлении пробы.
Несмотря на высокую точность и чувствительность этого способа определения гепарина его практические возможности ограничены следующими факторами:
- необходимостью концентрирования гепарина в процессе пробоподготовки физиологической жидкости для анализа, чтобы ее смешивание с водно-солевым раствором полимера, содержащим ХЖКД комплекса «ДНК - антагонист гепарина», не приводило к уменьшению концентрации полимера до значений ниже «критической» концентрации, при которой ХЖКД ДНК не образуется (Yevdokimov Yu.M., Skuridin S.G., Lortkipanidze G.B. Liquid-crystalline dispersions of nucleic acids. // Liq. Crystals, 1992, v.12, No 1, p.1-16);
- применением дорогостоящих стационарных коммерческих дихрографов, обеспечивающих получение потока циркулярно-поляризованного излучения в ультрафиолетовой области спектра и регистрацию аномального оптического сигнала, например, «Jobin-Yvon» Mark III или Mark V; «Jasco», Model-710/720, имеющихся, как правило, только в специализированных научных лабораториях. Недостатком этих приборов является не только их высокая стоимость, но и невысокая скорость регистрации оптического сигнала.
Таким образом, перечисленные выше недостатки существенно затрудняют быстрое получение точной информации о концентрации гепарина в анализируемых пробах и ограничивают широкое применение перечисленных выше групп методов для проведения такого рода анализов в лабораторных условиях.
Поэтому разработка современных высокоточных, простых в исполнении и недорогих экспресс-методов определения уровня гепарина - актуальная проблема клинической биохимии и медицинского приборостроения.
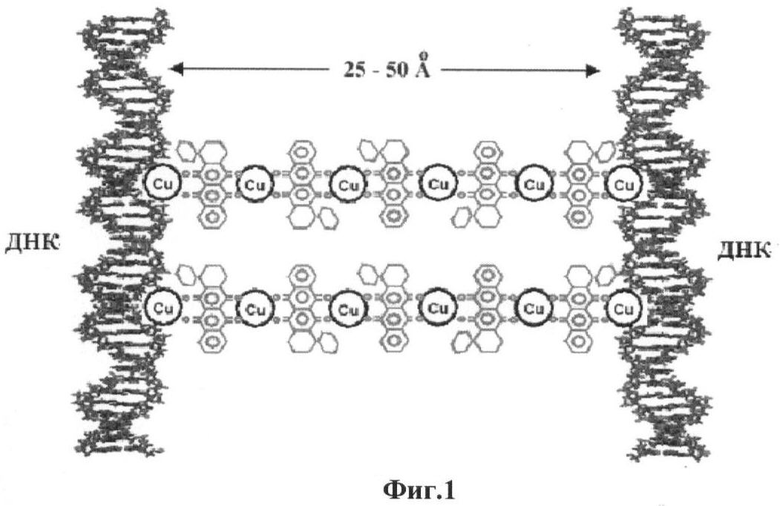
Известен интегральный микрочип, представляющий собой частицу ХЖКД ДНК, в которой соседние молекулы нуклеиновой кислоты «сшиты» наномостиками (Фиг.1), состоящими из чередующихся ионов Cu2+ и молекул соединения антрациклинового ряда - антибиотиков, образующих между собой полимерные хелатные сшивки (RU, 2139933, С1), в которых ионы меди обладают магнитными свойствами и способствуют формированию пространственно-ориентированной структуры частиц ХЖКД ДНК и наномостиков (Никифоров В.Н., Кузнецов В.Д., Нечипуренко Ю.Д., Салянов В.И., Евдокимов Ю.М. Магнитные свойства меди в составе наномостиков, образованных между фиксированными в пространстве молекулами ДНК. // Письма в ЖЭТФ, 2005, т.81, с.327-329). При этом в состав наномостика входят 6 атомов Cu2+ и 5 молекул ДАУ (фиг.2). Применение указанных частиц ХЖКД ДНК в качестве интегрального биодатчика обусловлено тем, что молекулы многих химических и биологически активных соединений образуют комплексные соединения с ионами Cu2+, «вытаскивая» эти ионы из структуры хелатного комплекса с 4-мя атомами кислорода в составе двух последующих молекул антрациклинового соединения. Такой процесс сопровождается не только нарушением целостности всей полимерной «сшивки», но и соответствующим уменьшением аномальной оптической активности молекул указанной ХЖКД ДНК. Величина уменьшения аномальной оптической активности связана с величиной концентрации химического или биологически активного соединения, присутствующего в анализируемой жидкости и разрушающего полимерную хелатную «сшивку». Формирование интегрального микрочипа сопровождается появлением аномального оптического сигнала в спектре кругового дихроизма (КД) в области поглощения антибиотика (λmax ~515 нм) при облучении микрочипа потоком циркулярно-поляризованного излучения в видимой области спектра. Наличие этого сигнала позволяет не только контролировать состояние вторичной структуры молекул ДНК, образующих микрочип, но и целостность самих наномостиков. Поэтому аномальный оптический сигнал можно использовать в качестве аналитического критерия, позволяющего определять аналиты, «мишенью» которых являются «строительные блоки» микрочипа, в частности структурные элементы наномостиков, в частности ионы Cu2+ и молекулы антибиотика.
Однако избирательная способность описанных выше интегральных биодатчиков (RU, 2139933 С1) детектировать в физиологических растворах наличие гепарина по изменению амплитуды аномального оптического сигнала, генерируемого биодатчиком при облучении его потоком циркулярно-поляризованного излучения в ультрафиолетовой области спектра, не была выявлена.
Раскрытие изобретения
Целью настоящего изобретения было создание способа определения физиологических концентраций гепарина в анализируемых жидких пробах с помощью биоаналитической тест-системы с такими условиями его проведения, которые позволили бы быстро, просто, точно и надежно определять его концентрацию, в том числе и очень низкую ~0,5-5,0 мкг/мл, в физиологических растворах.
При создании изобретения была поставлена задача создания способа, обеспечивающего высокочувствительное детектирование гепарина за счет выявления и регистрации изменений оптической активности контактирующего с гепарином биодатчика при облучении его в видимом спектре, вызванных взаимодействием гепарина только со специфическим чувствительным элементом биодатчика, и при этом исключающего одновременное взаимодействие гепарина с другими биологически активными соединениями в исследуемом физиологическом растворе и исключающего необходимость предварительной подготовки анализируемой пробы, связанной с повышением концентрации в ней гепарина.
Поставленная задача была решена созданием способа определения физиологических концентраций гепарина в анализируемых жидких пробах согласно изобретению, включающего регистрацию оптического сигнала помещенного в указанную пробу биодатчика, представляющего собой размещенные в водно-солевом растворе полимера частицы лиотропной холестерической жидкокристаллической дисперсии жестких молекул двухцепочечных нуклеиновых кислот, в которых соседние молекулы нуклеиновых кислот соединены наномостиками, содержащими чувствительный к гепарину элемент, и обладающего аномальными оптическими свойствами при облучении потоком циркулярно-поляризованного излучения, отличающегося тем, что при этом используют интегральный биодатчик, содержащий в качестве чувствительного к гепарину элемента соединение антрациклинового ряда, имеющее не менее одной реакционноспособной аминогруппы, связанной с сахарным остатком, и обладающий хромофорными свойствами при облучении в видимой области спектра, и при этом способ включает:
а) формирование интегрального биодатчика, обладающего хромофорными свойствами при облучении в видимой области спектра, содержащего в наномостиках конструктивный элемент, не чувствительный к гепарину, и чувствительный к гепарину элемент, при этом производят:
a1) формирование частиц холестерической жидкокристаллической дисперсии из молекул нуклеиновых кислот, имеющих молекулярную массу менее 1×106 Да, в водно-солевом полимерном растворе, обладающем способностью исключать указанные молекулы из своего состава;
а2) добавление к водно-солевому раствору полимера жидкокристаллической дисперсии нуклеиновых кислот, полученной в операции a1), раствора соединения, выбранного в качестве чувствительного к гепарину элемента, до получения дисперсии комплекса «нуклеиновая кислота - чувствительный элемент», в котором u1088 реакционноспособные группы чувствительного элемента чувствительны к гепарину;
а3) обработку дисперсии, полученной в операции а2), раствором соединения, выбранного в качестве конструктивного элемента, не чувствительного к гепарину, до получения дисперсии, в которой соседние молекулы нуклеиновых кислот соединены наномостиками, представляющими собой плоские хелатные комплексы «конструктивный элемент - чувствительный элемент - конструктивный элемент … конструктивный элемент - чувствительный элемент - конструктивный элемент»;
а4) последующее размещение дисперсии, полученной в операции а3), в водно-солевом растворе полимера, оптически изотропного и химически нейтрального по отношению к нуклеиновой кислоте, к конструктивному элементу, не чувствительному к гепарину, и к чувствительному элементу;
а5) измерение аномальной оптической активности полученного интегрального биодатчика на двух длинах волн в видимой области спектра, при этом первую длину волны выбирают в области поглощения азотистых оснований нуклеиновых кислот и используют как внутренний стандарт, а вторую длину волны выбирают в полосе поглощения чувствительного элемента, и по многократному увеличению оптического сигнала в полосе поглощения чувствительного элемента определяют исходные характеристики полученного интегрального биодатчика;
б) определение калибровочных характеристик аномальной оптической активности полученного интегрального биодатчика в видимой области спектра при облучении калибровочных проб, содержащих смесь указанного полимерного раствора интегрального биодатчика, полученного в операции а4), и раствора гепарина известной концентрации, потоком циркулярно-поляризованного излучения на указанной длине волны в области поглощения чувствительного элемента;
в) смешивание полученного в операции а4) указанного полимерного раствора интегрального биодатчика с анализируемой жидкой пробой;
г) при облучении полученной в операции в) смеси потоком циркулярно-поляризованного излучения на указанной длине волны в области поглощения чувствительного элемента в видимой области спектра регистрируют оптический сигнал и определяют на основе калибровочных характеристик присутствие и концентрацию гепарина в анализируемой жидкой пробе.
При этом согласно изобретению возможно в качестве молекул нуклеиновых кислот использовать молекулы двухцепочечных синтетических или природных полинуклеотидов, способных к образованию холестерической жидкокристаллической дисперсии при фазовом исключении с сохранением своей химической реакционной способности и аномальных оптических свойств.
При этом согласно изобретению желательно в качестве молекул нуклеиновых кислот использовать молекулы жесткоцепных полимеров.
При этом согласно изобретению целесообразно в качестве конструктивных элементов наномостиков использовать ионы металлов, способных к образованию протяженных плоских хелатных комплексов.
При этом согласно изобретению возможно в качестве конструктивного элемента наномостиков использовать ион меди.
При этом согласно изобретению возможно в качестве чувствительного к гепарину элемента наномостиков использовать соединение антрациклинового ряда, выбранное из группы, включающей рубомицин, виоломицин, адриамицин, карминомицин, премицин, доксорубицин, дауномицин.
При этом согласно изобретению целесообразно в качестве чувствительного к гепарину элемента использовать дауномицин (ДАУ).
При этом согласно изобретению разумно в качестве водно-солевого раствора водорастворимого, оптически изотропного и химически нейтрального по отношению к нуклеиновой кислоте, к конструктивному элементу и чувствительному элементу полимера использовать раствор полиэтиленгликоля.
Краткое описание чертежей
В дальнейшем изобретение поясняется примерами его осуществления и прилагаемыми чертежами, на которых:
Фиг.1 - интегральный биодатчик согласно изобретению схематическое изображение структуры наномостика между двумя соседними молекулами ДНК, фиксированными в пространственной структуре частицы ХЖКД;
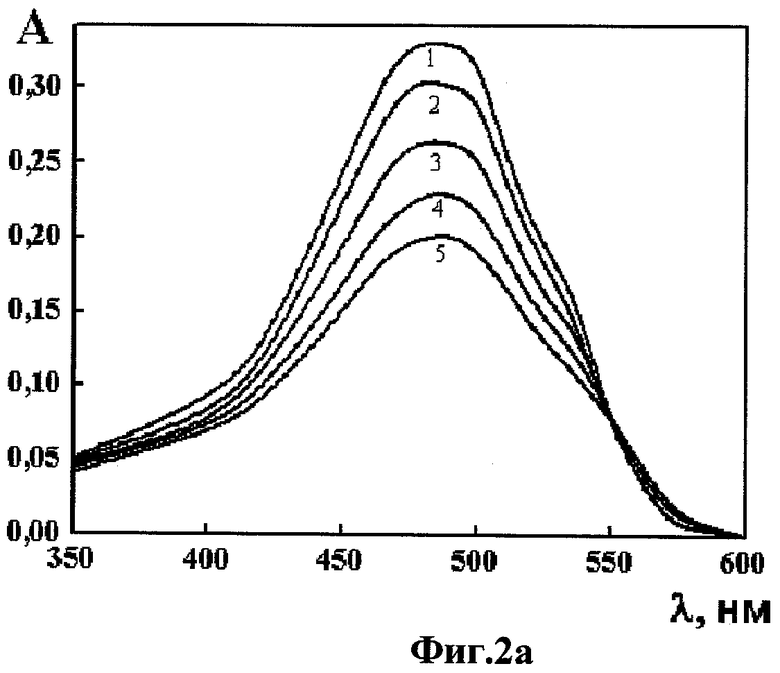
Фиг.2а - спектр поглощения ДАУ при отсутствии гепарина (кривая 1) и спектры поглощения комплекса «ДАУ-гепарин» (кривые 2-5), полученные при обработке ДАУ растворами гепарина разной концентрации, в координатах «оптическая плотность А - длина волны λ»;
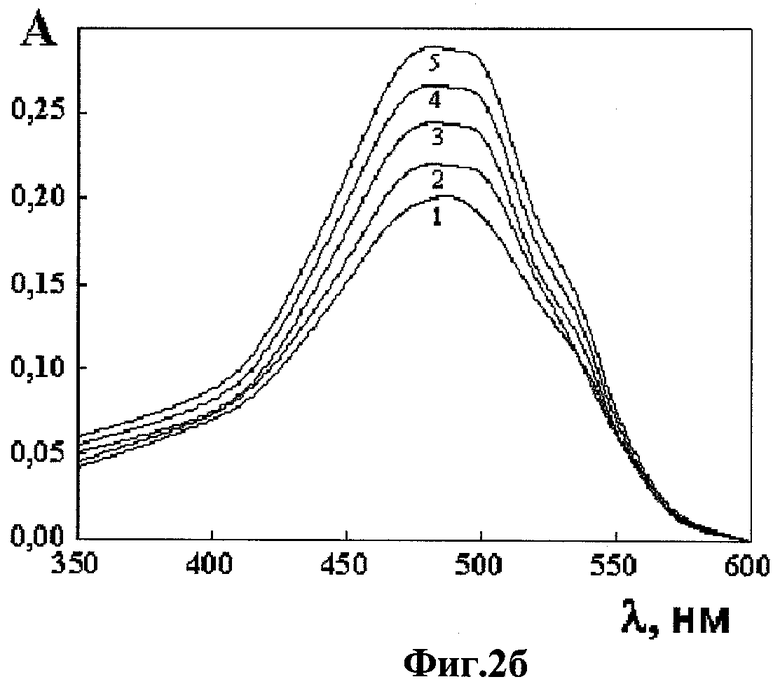
Фиг.2б - спектры поглощения комплекса «ДАУ-гепарин» (кривая 1) и спектры поглощения комплекса «ДАУ-гепарин» после обработки их растворами антагониста гепарина - поликонидина (кривые 2-5) разной концентрации, в координатах «оптическая плотность A - длина волны λ»;
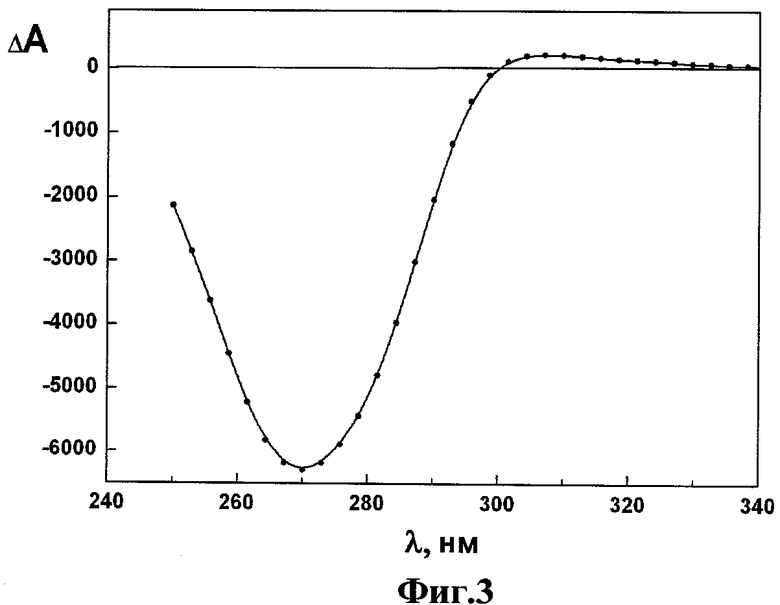
Фиг.3 - спектр КД лиотропной ХЖКД, сформированной в результате фазового исключения молекул ДНК из водно-солевого раствора полимера ПЭГ, в координатах «изменение оптической плотности ΔА=(AL-AR) - длина волны λ»;
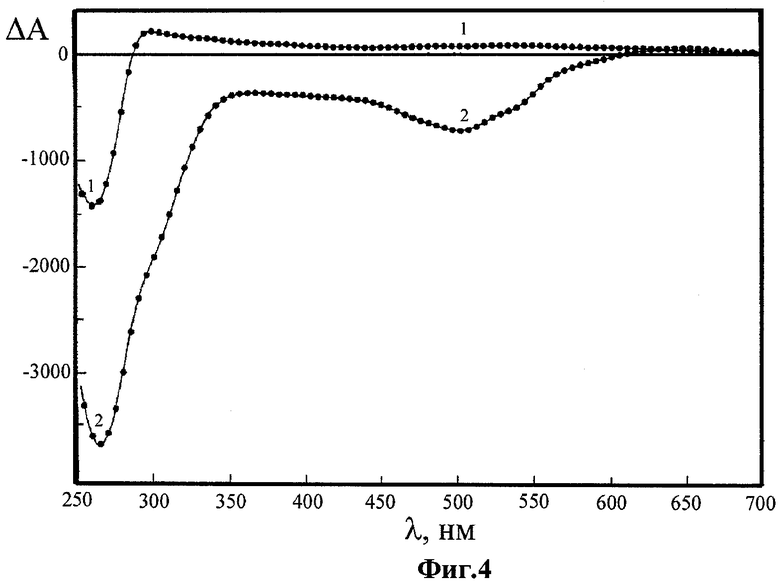
Фиг.4 - спектры КД лиотропной ХЖКД ДНК до обработки (кривая 1) и этой же дисперсии после ее последовательной обработки ДАУ и CuCl2 (кривая 2) в координатах «изменение оптической плотности ΔА=(AL-AR) - λ - длина волны»;
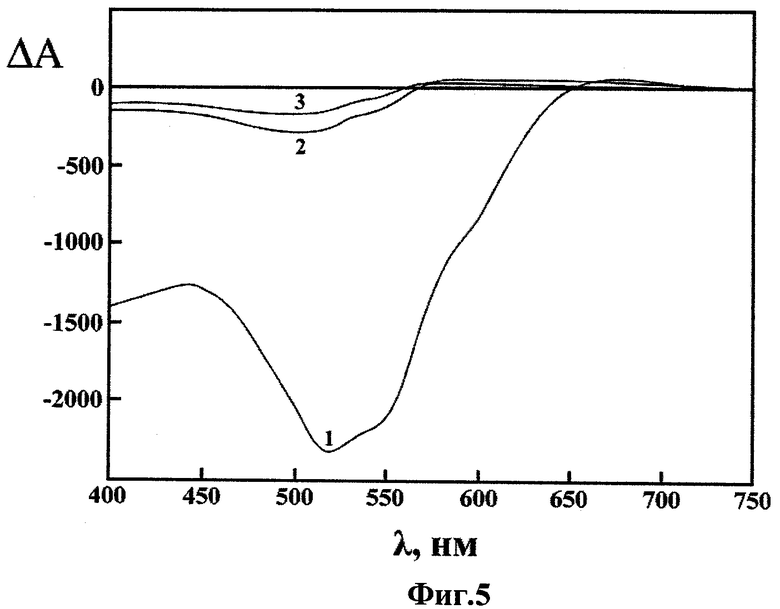
Фиг.5 - спектры КД интегрального биодатчика согласно изобретению до (кривая 1) и после (кривая 2) взаимодействия с гепарином, и спектр КД лиотропной ХЖКД комплекса ДНК-ДАУ (кривая 3), в координатах «изменение оптической плотности ΔА=(AL-AR) - длина волны λ»;
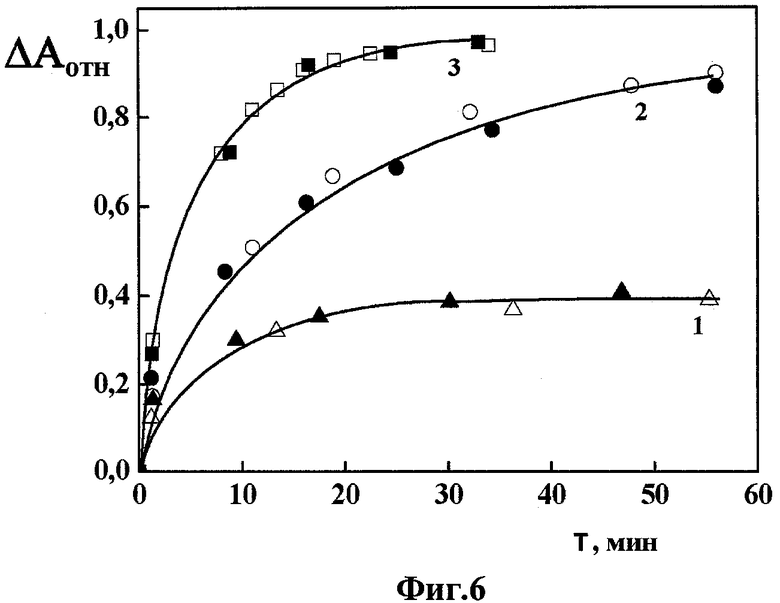
Фиг.6 - динамика разрушения интегральных биодатчиков согласно изобретению под действием разных концентраций гепарина, в координатах «изменение оптической плотности ΔАотн. - время Т»;
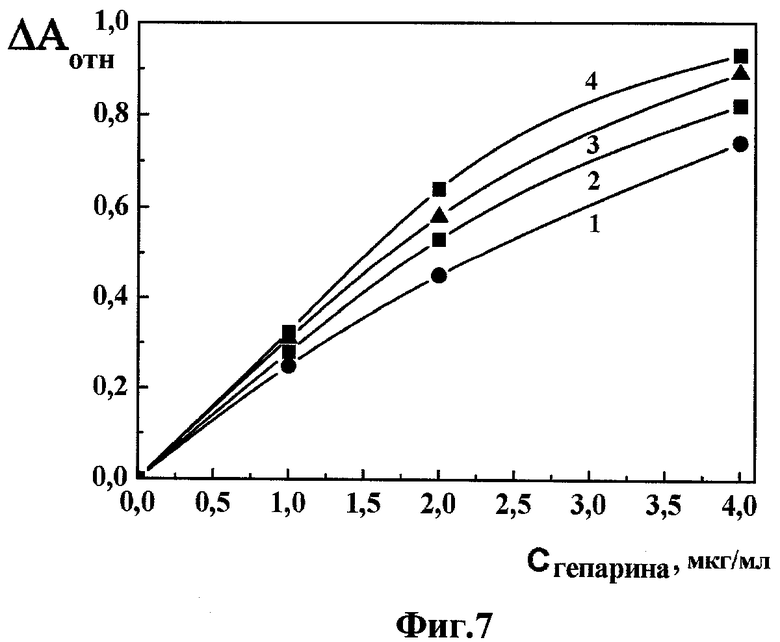
Фиг.7 - калибровочные кривые для определения концентрации гепарина в анализируемой пробе, при обработке интегральных биодатчиков растворами гепарина известной концентрации в течение 9 (кривая 1), 12 (кривая 2), 15 (кривая 3) и 18 мин (кривая 4), в координатах «изменение оптической плотности ΔАотн. - концентрация гепарина СГепарин».
При этом представленные примеры осуществления изобретения не ограничивают его и не выходят за рамки формулы изобретения.
Наилучший вариант осуществления изобретения
Авторами были проведены исследования по созданию интегрального биодатчика, который может содержать в составе наномостиков чувствительный к гепарину элемент, обладающий аномальной оптической активностью при образовании его комплекса с гепарином. В качестве такого элемента были исследованы соединения антрациклинового ряда на примере антибиотика дауномицина (далее ДАУ). При этом была исследована способность дауномицина образовывать комплекс ДАУ-гепарин. В исследованиях были использованы:
1. Раствор дауномицина: приготовление и концентрации.
Коммерческий препарат антрациклинового антибиотика ДАУ (C27H29NO10×HCl; мол. масса = 564 Да; «Sigma», США) использовали без дополнительной очистки.
Навеску ДАУ (~0,4 мг) помещали в пробирку (V=1,5 мл) и растворяли при интенсивном перемешивании на миксере в 200 мкл дистиллированной воды.
Таким способом готовили 200 мкл раствора ДАУ с концентрацией ДАУ СДАУ ~2 мг/мл.
Для окончательного растворения ДАУ пробирку, содержащую указанный раствор ДАУ, помещали в светонепроницаемый контейнер, устанавливали его на 12 часов в прохладное место (~4°C), после чего приступали к определению точной концентрации антибиотика.
Точную концентрацию ДАУ в растворе определяли спектрофотометрически в диапазоне длин волн 350-650 нм, пользуясь значением его молярного коэффициента поглощения (λmax=475 нм; εmax=12000 М-1·см-1).
Согласно полученным данным молярная концентрация ДАУ в указанном растворе составляла 3,15×10-3 М.
Раствор ДАУ хранили в светонепроницаемом контейнере при 4°C.
2. Раствор гепарина приготовление и концентрации
Коммерческий препарат Na-соли гепарина (мол. масса = 4000 Да; «Serva», Германия) с удельной активностью 186000 Ед./г использовали без дополнительной очистки.
Навеску Na-соли гепарина (4,0 мг) помещали в мерную пробирку (V=5,0 мл) и растворяли при интенсивном перемешивании на миксере в 1,5 мл дистиллированной воды; доводили объем раствора до 2,0 мл.
Таким способом готовили 2,0 мл раствора гепарина с фиксированной концентрацией СГепарин = 2 мг/мл.
3. Раствор поликонидина: приготовление и концентрации
Препарат антагониста гепарина - четвертичной аммонийной соли монодисперсного олигомера конидина со степенью полимеризации 25 - поликонидина (мол. масса = 4042 Да), синтезированного к.х.н. А.В.Некрасовым (Институт иммунологии МЗ РФ), использовали без дополнительной очистки.
Навеску поликонидина (4,0 мг) помещали в мерную пробирку (V=5,0 мл) и растворяли при интенсивном перемешивании на миксере в 1,5 мл дистиллированной воды; доводили объем раствора до 2,0 мл.
Таким способом готовили 2,0 мл раствора поликонидина с фиксированной концентрацией СПоликонидин = 2,0 мг/мл.
4. Дихрометр для регистрации аномальной оптической активности биологически активного вещества в анализируемой жидкости
В качестве дихрометра может быть использован дихрометр, обладающий способностью формировать поток циркулярно-поляризованного излучения и воздействовать им на анализируемую жидкость. Например, портативный дихрометр, имеющий следующие характеристики, показанные в Табл.1.
Для исследований был использован известный дихрометр (RU, 92960, U1), содержащий размещенные последовательно: источник широкополосного светового излучения; селектор, приспособленный для формирования световых потоков с заданными длинами волн, соответствующих области оптической активности определяемого вещества, проявляемой в спектре кругового дихроизма; поляризатор, приспособленный для формирования линейно поляризованного светового потока; спектральную щель, приспособленную для выделения линейно поляризованного светового потока с определенным направлением вектора поляризации; модулятор поляризации, приспособленный для преобразования указанного линейно-поляризованного светового потока в циркулярно-поляризованный световой поток с периодически изменяющимся направлением вращения вектора поляризации; устройство для размещения анализируемой пробы в оптически проницаемой кювете, содержащее блок термостатирования указанной кюветы; фотоэлектронный умножитель, приспособленный для регистрации оптических сигналов кругового дихроизма анализируемой жидкости и преобразования их в пропорциональный электрический сигнал; цифровую систему регистрации, приспособленную для выделения и усиления указанного электрического сигнала и преобразования его в цифровую форму; средство обработки полученного электрического сигнала и вычисления концентрации биологически активного вещества.
Управление работой такого дихрометра осуществляется при помощи пакета программ, позволяющего реализовывать различные режимы его работы. Преимуществами описанного дихрометра являются его низкая стоимость по сравнению со стационарными коммерческими аналогами, компактность, мобильность, отсутствие необходимости в охлаждении водой или газообразным азотом, возможность работы персонала, не имеющего высокой квалификации.
Пример 1. Исследование химической активности гепарина в отношении ДАУ.
А) Образование комплекса «ДАУ-Гепарин»
В прямоугольной оптической кювете (длина оптического пути 1 см; V=4,0 мл) смешивали 2,0 мл дистиллированной H2O и 18,0 мкл раствора ДАУ, приготовленного, как описано выше в п.1, при этом: ДАУ («Sigma», США) в концентрации СДАУ=2,81×10-5 М; гепарин («Serva», Германия) - мол. масса гепарина = 4000 Да; удельная активность препарата гепарина составляет 186000 Ед/г.
Регистрировали спектр поглощения полученной смеси в интервале длин волн 350-650 нм, спектр поглощения ДАУ при отсутствии гепарина в координатах «оптическая плотность А - длина волны λ» показан на Фиг.2а (кривая 1).
После регистрации спектра поглощения ДАУ в оптическую кювету, содержащую 2,018 мл раствора ДАУ, последовательно добавляли 1, 3, 5, 9 и 11 мкл (всего 11 мкл) исходного раствора гепарина, приготовленного, как описано выше в п.2; после каждой добавки раствора гепарина полученную в кювете смесь тщательно перемешивали и регистрировали ее спектр поглощения в области длин волн 350-650 нм. Спектры поглощения комплекса «ДАУ-гепарин», полученные при обработке ДАУ растворами гепарина разной концентрации, показаны на Фиг.2а (кривые 2-5):
- кривая 2 при СГепарин = 0,99 мкг/мл;
- кривая 3 при СГепарин = 2,97 мкг/мл;
- кривая 4 при СГепарин = 8,88 мкг/мл;
- кривая 5 при СГепарин = 10,84 мкг/мл.
Добавление гепарина сопровождалось уменьшением оптической плотности в максимуме поглощения ДАУ (гипохромный эффект) и появлением изобестической точки при λ ~550 нм. Эти результаты свидетельствовали об образовании комплекса «ДАУ-гепарин».
Б) Разрушение комплекса «ДАУ-Гепарин»
В оптическую кювету, содержащую 2,029 мл комплекса «ДАУ-гепарин», полученного в п.А примера 1, последовательно добавляли 9, 11, 14 и 24 мкл исходного раствора поликонидина, полученного, как описано выше в п.3, всего 24 мкл. После каждой добавки раствора поликонидина полученную в кювете смесь тщательно перемешивали и регистрировали ее спектр поглощения в области длин волн 350-650 нм.
На Фиг.2б приведены спектры поглощения комплекса «ДАУ-гепарин» до (кривая 1) добавления антагониста гепарина - поликонидина в виде аммонийной соли олигомера конидина со степенью полимеризации 25, и после добавления поликонидина в разных концентрациях (кривые 2-5):
- кривая 2 при СПоликонидин = 8,83 мкг/мл;
- кривая 3 при СПоликонидин = 10,78 мкг/мл;
- кривая 4 при СПоликонидин = 13,71 мкг/мл;
- кривая 5 при СПоликонидин = 23,38 мкг/мл.
При концентрации поликонидина ~23,38 мкг/мл наблюдается практически полное восстановление спектра поглощения, характерного для свободных (не связанных в комплекс) молекул ДАУ, что видно из сравнения кривой 5 на Фиг.2б с кривой 1 на Фиг.2а. Восстановление исходного спектра поглощения ДАУ обусловлено диссоциацией комплекса «ДАУ-гепарин» под действием поликонидина и образованием более прочного комплекса «гепарин-поликонидин».
Таким образом, данные, приведенные на Фиг.2а и 2б, свидетельствуют о том, что гепарин образует прочный комплекс с молекулами ДАУ.
Следовательно, гепарин способен «экстрагировать» молекулы ДАУ из состава наномостиков «-Cu2+-ДАУ-Cu2+- … Cu2+-ДАУ-Cu2+» интегрального биодатчика, что должно приводить к его разрушению, которое будет сопровождаться уменьшением (вплоть до полного исчезновения) генерируемого им оптического сигнала. Это означает, что аномальный оптический сигнал, генерируемый интегральным микрочипом ДНК, можно использовать в качестве критерия, позволяющего судить о наличии гепарина в анализируемой жидкости.
Пример 2. Определение физиологических концентраций гепарина в анализируемых жидких пробах.
Способ определения физиологических концентраций гепарина в анализируемых жидких пробах гепарина согласно изобретению показан на примере определения гепарина с использованием интегрального биодатчика, представляющего собой размещенные в водно-солевом растворе полимера частицы лиотропной холестерической жидкокристаллической дисперсии жестких молекул двухцепочечных нуклеиновых кислот, в которых соседние молекулы нуклеиновых кислот соединены наномостиками, содержащими последовательно соединенные в плоские хелатные комплексы, инертные к гепарину конструктивные элементы и чувствительные к гепарину элементы, при этом интегральный биодатчик в качестве чувствительного к гепарину элемента содержит соединение антрациклинового ряда, имеющее не менее одной реакционноспособной аминогруппы, связанной с сахарным остатком, и обладающего аномальными оптическими и хромофорными свойствами при облучении потоком циркулярно-поляризованного излучения в видимой области спектра.
При этом согласно изобретению возможно в качестве чувствительного к гепарину элемента наномостиков использовать соединение антрациклинового ряда, выбранное из группы, включающей рубомицин, виоломицин, адриамицин, карминомицин, премицин, доксорубицин, дауномицин.
Исследования были проведены с использованием интегрального биодатчика, содержащего в качестве чувствительного к гепарину элемента дауномицин, как наиболее коммерчески приемлемый в настоящее время.
В способе определения гепарина согласно изобретению был создан интегральный биодатчик, имеющий в своей структуре в составе наномостиков чувствительный к гепарину ДАУ и инертный к гепарину конструктивный элемент, в качестве которого использован ион меди.
Схематически на Фиг.1 показана структура наномостиков между двумя соседними молекулами ДНК, фиксированными в пространственной структуре частицы u1061 ХЖКД.
Способ определения гепарина согласно изобретению осуществляли, как описано ниже.
2А. Создание интегрального микрочипа на основе молекул ДНК, фиксированных в структуре частиц лиотропной ХЖКД
2А.1) Формирование частиц лиотропной холестерической жидкокристаллической дисперсии из молекул нуклеиновых кислот, имеющих молекулярную массу менее 1×106 Да, в водно-солевом полимерном растворе, обладающем способностью исключать указанные молекулы из своего состава.
Лиотропную ХЖКД готовили из молекул двухцепочечной ДНК из тимуса крупного рогатого скота («Sigma», США; мол. масса ДНК ~(0,3-0,6)×106 Да, СДНК=5,5 мкг/мл) путем их фазового исключения из водно-солевого (0,3 М NaCl+0,002 М Na+-фосфатный буфер) раствора ПЭГ («Serva», Германия; мол. масса ПЭГ=4000 Да; СПЭГ=170 мг/мл).
Аномальные оптические свойства лиотропной ХЖКД ДНК контролировали, измеряя спектр КД при помощи описанного выше портативного дихрометра (RU, 92960, U1) в интервале длин волн 250-350 нм.
Появление интенсивной отрицательной полосы в спектре КД (λmax ~270 нм) свидетельствовало об упорядоченном расположении молекул ДНК в структуре жидкокристаллической дисперсии, что подтверждается регистрацией, как показано на Фиг.3, спектра КД лиотропной ХЖКД, сформированной в результате фазового исключения молекул ДНК из водно-солевого раствора полимера ПЭГ, в координатах «изменение оптической плотности ΔА=(AL-AR) - длина волны λ» (ΔА×10-6 - круговой дихроизм, оптич. ед.; СДНК ~20 мкг/мл; рН ~7,0; L=1 см; температура - 22°C).
2А.2) Получение лиотропной ХЖКД комплекса «ДНК-ДАУ»
К 3 мл лиотропной ХЖКД, полученной по п.2А.1), добавляли 28,6 мкл раствора ДАУ, полученного аналогично описанному выше в А.1), при концентрации ДАУ СДАУ=3,15×10-3 М при интенсивном перемешивании.
Таким способом получали комплекс между молекулами ДНК и ДАУ в составе лиотропной ХЖКД; измеряли спектр КД полученной смеси.
Появление дополнительной отрицательной полосы в спектре КД в области поглощения ДАУ свидетельствовало об образовании комплекса «ДНК-ДАУ» в случае лиотропной ХЖКД ДНК.
2А.3) Создание интегрального микрочипа ДНК
Готовят 0,001 М раствор CuCl2×2H2O («Aldrich», США).
К 3,0 мл лиотропной ХЖКД комплекса «ДНК-ДАУ», полученного по п.2А.2), добавляли 12,0 мкл полученного раствора CuCl2 при перемешивании. Через 40 мин регистрируют спектр КД полученной смеси в интервале длин волн 400-650 нм (фиг.7, кривая 2).
На Фиг.4 показаны спектры КД лиотропной ХЖКД ДНК по завершении изменения амплитуды сигналов до обработки ДАУ и CuCl2 (кривая 1) и этой же дисперсии после ее последовательной обработки ДАУ и CuCl2 (кривая 2) в координатах «изменение оптической плотности ΔА=(AL-AR) - λ - длина волны» (ΔА×10-6 - круговой дихроизм (оптич. ед.); ДНК из тимуса крупного рогатого скота («Sigma», США); мол. масса ДНК ~(0,3-0,7)·106 Да; СДНК ~5 мкг/мл; СПЭГ=170 мг/мл; мол. масса ПЭГ=4000 Да («Serva», Германия); 0,3 М NaCl+10-2 М Na+-фосфатный буфер, рН ~7,0; ДАУ («Sigma», США); СДАУ=30,08×10-6 М; CuCl2×·2H2O («Aldrich», США); CCu2+=9,91×10-6 М; L=1 см; температура - 22°C).
Многократное увеличение аномальной оптической активности в области поглощения ДАУ (кривая 2 Фиг.4) свидетельствовало о значительном увеличении концентрации анизотропно расположенных молекул ДАУ в составе наномостиков лиотропной ХЖКД в результате образования интегрального микрочипа, в котором между молекулами ДНК образовались наномостики «-Cu2+-ДАУ-Cu2+- … -Cu2+-ДАУ-Cu2+».
Таким образом, был получен интегральный микрочип ДНК, содержащий в составе наномостиков чувствительный к гепарину элемент ДАУ.
2Б.1). Получение калибровочных кривых содержания гепарина в анализируемой пробе
Готовили 1,0 мл раствора интегральных микрочипов ДНК, полученного по п.2А.3), помещали его в оптическую кювету, добавляли 1,0 мл дистиллированной H2O, полученную в кювете смесь тщательно перемешивали и регистрировали ее спектр КД в области длин волн 400-650 нм. Величину оптического сигнала, генерируемого интегральным микрочипом ДНК в области длины волны поглощения ДАУ далее использовали в качестве величины ΔAmax.
В оптическую кювету, содержащую 2,0 мл раствора интегральных микрочипов ДНК, полученного как описано выше, добавляли 5,0 мкл раствора гепарина, приготовленного по п.2; полученную в кювете смесь интенсивно перемешивали. Таким образом готовили образец, концентрация гепарина в котором составляет 4,99 мкг/мл. Через 15 мин регистрировали спектр КД полученной смеси в интервале длин волн 400-650 нм.
На Фиг.5 показаны спектры КД интегрального биодатчика согласно изобретению по завершении изменения амплитуды сигналов до (кривая 1) и после (кривая 2) взаимодействия с гепарином, и, для сравнения, спектр КД лиотропной ХЖКД комплекса ДНК-ДАУ (кривая 3), в координатах «изменение оптической плотности ΔA=(AL-AR) - длина волны λ» (ΔA×10-6 - круговой дихроизм (оптич. ед.); ДНК из тимуса крупного рогатого скота («Sigma», США); мол. масса ДНК ~(0,3-0,7)·106 Да; СДНК ~5 мкг/мл; СПЭГ=170 мг/мл; мол. масса ПЭГ=4000 Да («Serva», Германия); 0,3 М NaCl+10-2 М Na+-фосфатный буфер, рН ~7,0; ДАУ («Sigma», США); СДАУ=30,08×10-6 М; CuCl2×2Н2О («Aldrich», США); CCu2+=9,91×10-6 М; гепарин («Serva», Германия); мол. масса гепарина=4000 Да; удельная активность препарата гепарина составляла 186000 Ед./г; СГепарин ~10 мкг/мл; L=1 см; температура -22°С).
При добавлении гепарина амплитуда отрицательной полосы в спектре КД (кривая 3 на Фиг.5), отражающая наличие наномостиков между соседними молекулами ДНК в составе интегрального микрочипа, резко уменьшалась. Это означало, что обработка интегрального микрочипа ДНК гепарином приводила к разрушению наномостиков. Такое разрушение было обусловлено образованием более прочного комплекса между молекулами ДАУ и молекулами гепарина и, как следствие этого, «экстракцией» ДАУ из состава наномостика.
Как видно из полученных результатов, амплитуда аномального сигнала чистого ДАУ (Фиг.2а, кривая 1), сигнала комплекса ДНК-ДАУ (Фиг.5, кривая 3) и интегрального микрочипа ДНК, полученного в способе согласно изобретению (Фиг.4), отличаются.
Аналогичные данные были получены в случае определения клексана и фраксипарина, представляющих собой препараты низкомолекулярного гепарина со средней молекулярной массой 4000-5000 Да, применяемые в медицинской практике для профилактики тромбоэмболических осложнений, для лечения (рассасывания) глубоких венозных тромбозов, при тромбоэмболии легочных артерий, остром коронарном синдроме и при других патологических состояниях, сопровождающихся тромбообразованием.
2Б.2). Получение калибровочных кривых концентрации гепарина в анализируемой пробе
Из исходного раствора гепарина, полученного как описано выше в п.2, готовили серию проб гепарина для анализа в H2O с концентрацией 1,0, 2,0 и 4,0 мкг/мл.
К 1,0 мл раствора, содержащего интегральные микрочипы ДНК, полученные в п.2А.3), добавляли 1,0 мл соответствующего раствора гепарина указанной выше концентрации при перемешивании и регистрировали спектры КД в области поглощения ДАУ с интервалом 5-10 мин.
На основании полученных данных строили зависимость изменения относительной амплитуды полосы в спектре КД интегрального микрочипа ДНК от времени его обработки гепарином для разных концентраций гепарина в анализируемой пробе.
На Фиг.6 показана динамика разрушения интегральных микрочипов ДНК согласно изобретению под действием разных концентраций гепарина, в координатах «относительное изменение оптической плотности ΔАотн. - время Т» (ΔАотн.=(ΔAmax-ΔАТ)/ΔAmax - отношение разности амплитуд аномальной полосы в спектре КД интегрального микрочипа ДНК в полосе поглощения ДАУ в момент времени Т0 и Т, соответственно, к исходной амплитуде этой полосы в момент времени Т0; ДНК из тимуса крупного рогатого скота («Sigma», США); мол. масса ДНК ~(0,3-0,7)×106 Да; СДНК ~2,75 мкг/мл; СПЭГ=85 мг/мл; мол. масса ПЭГ=4000 Да («Serva», Германия); 0,15 М NaCl+0,001 М Na+-фосфатный буфер, рН ~7,0; ДАУ («Sigma», США); СДАУ=15,04×10-6 М; CuCl2×2H2O («Aldrich», США); CCu2+=2,0×10-6 М; Гепарин («Serva», Германия), мол. масса гепарина=4000 Да; удельная активность препарата гепарина составляла 186000 Ед./г; L=1 см; температура -22°С). При этом на Фиг.6 кривая 1 соответствует концентрации гепарина СГепарин = 1 мкг/мл; кривая 2 - СГепарин = 2 мкг/мл; кривая 3 - СГепарин = 4 мкг/мл.
Данные, приведенные на Фиг.6, показывают, что уменьшение амплитуды полосы в спектре КД интегрального микрочипа ДНК в присутствии гепарина зависит от его концентрации.
На основании полученных данных (Фиг.6), выбрав фиксированные промежутки времени, например, 9, 12, 15 или 18 мин, строили зависимость изменения относительной амплитуды полосы в спектре КД интегрального микрочипа ДНК от концентрации гепарина в анализируемой пробе.
На Фиг.7 показаны калибровочные кривые для определения концентрации гепарина в анализируемой пробе при обработке интегральных микрочипов ДНК согласно изобретению растворами гепарина известной концентрации в течение 9 (кривая 1), 12 (кривая 2), 15 (кривая 3) и 18 мин (кривая 4), в координатах «относительное изменение оптической плотности ΔАотн. - концентрация гепарина СГепарин» ((ΔАотн.=(ΔAmax-ΔАТ)/ΔAmax - отношение разности амплитуд аномальной полосы в спектре КД интегрального микрочипа ДНК в полосе поглощения ДАУ в момент времени Т0 (перед анализом) и Т (после анализа), соответственно, к исходной амплитуде этой полосы в момент времени Т0 (перед анализом); ДНК из тимуса крупного рогатого скота («Sigma», США); мол. масса ДНК ~(0,3-0,7)×106 Да; СДНК~2,75 мкг/мл; СПЭГ=85 мг/мл; мол. масса ПЭГ=4000 Да («Serva», Германия); 0,15 М NaCl+0,001 М Na+-фосфатный буфер, рН ~7,0; ДАУ («Sigma», США); СДАУ=15,04×10-6 М; CuCl2×2H2O («Aldrich», США); CCu2+=2,0×10-6 М; гепарин («Serva», Германия), мол. масса гепарина=4000 Да; удельная активность препарата гепарина составляла 186000 Ед./г; L=1 см; температура -22°С).
Наличие пропорциональной зависимости между изменением относительной амплитуды полосы в спектре КД интегрального микрочипа ДНК и концентрацией гепарина в пробе для анализа, в интервале концентраций гепарина от 0 до 4 мкг/мл, позволяет использовать эту зависимость в качестве калибровочной при определении концентрации гепарина в пробе для анализа.
Таким образом, используя оптический биосенсор, состоящий из портативного дихрометра и интегрального микрочипа ДНК, содержащего чувствительный к гепарину элемент, можно не только судить о наличии гепарина в анализируемой жидкости, но и определять его достаточно низкую (~0,5 мкг/мл) концентрацию.
| название | год | авторы | номер документа |
|---|---|---|---|
| МНОГОФУНКЦИОНАЛЬНАЯ АНАЛИТИЧЕСКАЯ СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ ХАРАКТЕРИСТИК ОПТИЧЕСКОГО СИГНАЛА КРУГОВОГО ДИХРОИЗМА БИОЛОГИЧЕСКИ АКТИВНОГО МАТЕРИАЛА | 2013 |
|
RU2569752C2 |
| ЖИДКОКРИСТАЛЛИЧЕСКАЯ ДИСПЕРСИЯ НА ОСНОВЕ КОМПЛЕКСА (НУКЛЕИНОВАЯ КИСЛОТА - ХИТОЗАН) КАК ИНТЕГРАЛЬНЫЙ БИОДАТЧИК И СПОСОБ ЕЕ СОЗДАНИЯ | 2000 |
|
RU2169770C1 |
| ОПТИЧЕСКИЙ ДИФФУЗОМЕТР ДЛЯ АНАЛИЗА ТРАНСПОРТА БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА, АНАЛИТИЧЕСКАЯ СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА В ЖИДКОСТИ И СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА В ЖИДКОСТИ | 2010 |
|
RU2429465C1 |
| МОЛЕКУЛЯРНАЯ КОНСТРУКЦИЯ НА ОСНОВЕ ЖИДКОКРИСТАЛЛИЧЕСКОЙ ДИСПЕРСИИ НУКЛЕИНОВОЙ КИСЛОТЫ КАК ИНТЕГРАЛЬНЫЙ БИОДАТЧИК И СПОСОБ ЕЕ СОЗДАНИЯ | 1998 |
|
RU2139933C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЕПАРИНА | 1997 |
|
RU2123008C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ В АНАЛИЗИРУЕМОЙ ЖИДКОСТИ БИОЛОГИЧЕСКИ АКТИВНОГО ВЕЩЕСТВА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1996 |
|
RU2107280C1 |
| ЖИДКОКРИСТАЛЛИЧЕСКИЙ БИОДАТЧИК ДЛЯ ОПРЕДЕЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ | 1989 |
|
RU2032895C1 |
| БИОДАТЧИК ДЛЯ ОПРЕДЕЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ, ВЗАИМОДЕЙСТВУЮЩИХ С ДВУХЦЕПОЧЕЧНЫМИ МОЛЕКУЛАМИ НУКЛЕИНОВЫХ КИСЛОТ | 1991 |
|
RU2016888C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОБНАРУЖЕНИЯ БИОЛОГИЧЕСКИХ ТОКСИНОВ | 2004 |
|
RU2320994C1 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ АНАЛИЗА ВЗАИМОДЕЙСТВИЙ БИОЛОГИЧЕСКИХ МОЛЕКУЛ НА БИОЛОГИЧЕСКОМ МИКРОЧИПЕ НА ОСНОВЕ ФЛУОРЕСЦЕНЦИИ АМИНОКИСЛОТНЫХ ОСТАТКОВ ТРИПТОФАНА | 2014 |
|
RU2588816C2 |
Изобретение относится к области медицинских исследований и нанотехнологий на основе двухцепочечных нуклеиновых кислот применительно к диагностике патологических состояний с тромбообразованием. Способ включает создание интегрального микрочипа ДНК, обладающего аномальными оптическими свойствами при облучении потоком циркулярно-поляризованного излучения и хромофорными свойствами при облучении в видимой области спектра и представляющего собой размещенные в водно-солевом растворе полимера частицы лиотропной холестерической жидкокристаллической дисперсии жестких молекул двухцепочечных нуклеиновых кислот, в которых соседние молекулы нуклеиновых кислот соединены наномостиками, содержащими чередующиеся инертный к гепарину конструктивный элемент и чувствительный к гепарину элемент, при этом интегральный микрочип ДНК в качестве чувствительного к гепарину элемента содержит соединение антрациклинового ряда, имеющее не менее одной реакционноспособной аминогруппы, связанной с сахарным остатком. Смешивают раствор, содержащий интегральные микрочипы ДНК, с пробой, в которой присутствует гепарин. Через образец, полученный в результате указанного смешивания, при помощи оптического дихрометра пропускают поток циркулярно-поляризованного излучения на длине волны в области поглощения чувствительного к гепарину элемента, регистрируют оптический сигнал. Использование изобретения позволяет упростить и ускорить процесс диагностики. 7 з.п. ф-лы, 1 табл., 8 ил.
1. Способ определения физиологических концентраций гепарина в анализируемых жидких пробах, включающий регистрацию оптического сигнала помещенного в указанную пробу биодатчика, представляющего собой размещенные в водно-солевом растворе полимера частицы лиотропной холестерической жидкокристаллической дисперсии жестких молекул двухцепочечных нуклеиновых кислот, в которых соседние молекулы нуклеиновых кислот соединены наномостиками, содержащими чувствительный к гепарину элемент, и обладающего аномальными оптическими свойствами при облучении потоком циркулярно-поляризованного излучения, отличающийся тем, что при этом используют интегральный биодатчик, содержащий в наномостиках чередующиеся инертный к гепарину конструктивный элемент и чувствительный к гепарину элемент, в качестве чувствительного к гепарину элемента содержащий соединение антрациклинового ряда, имеющее не менее одной реакционноспособной аминогруппы, связанной с сахарным остатком, и обладающий хромофорными свойствами при облучении в видимой области спектра, и при этом способ включает:
а) создание интегрального биодатчика, обладающего хромофорными свойствами при облучении в видимой области спектра, содержащего в наномостиках конструктивный элемент, не чувствительный к гепарину, и чувствительный к гепарину элемент, при этом производят:
a1) формирование частиц холестерической жидкокристаллической дисперсии из молекул нуклеиновых кислот, имеющих молекулярную массу менее 1·106 Да, в водно-солевом полимерном растворе, обладающем способностью исключать указанные молекулы из своего состава;
а2) добавление к водно-солевому раствору полимера жидкокристаллической дисперсии нуклеиновых кислот, полученной в операции a1), раствора соединения, выбранного в качестве чувствительного к гепарину элемента, до получения дисперсии комплекса «нуклеиновая кислота - чувствительный элемент», в котором реакционноспособные группы чувствительного элемента чувствительны к гепарину;
а3) обработку дисперсии, полученной в операции а2), раствором соединения, выбранного в качестве конструктивного элемента, не чувствительного к гепарину, до получения дисперсии, в которой соседние молекулы нуклеиновых кислот соединены наномостиками, представляющими собой плоские хелатные комплексы «конструктивный элемент - чувствительный элемент - конструктивный элемент … конструктивный элемент - чувствительный элемент - конструктивный элемент»;
а4) последующее размещение дисперсии, полученной в операции а3), в водно-солевом растворе полимера, оптически изотропного и химически нейтрального по отношению к нуклеиновой кислоте, к конструктивному элементу, не чувствительному к гепарину, и к чувствительному элементу; а5) измерение аномальной оптической активности полученного интегрального биодатчика на двух длинах волн в видимой области спектра, при этом первую длину волны выбирают в области поглощения азотистых оснований нуклеиновых кислот и используют как внутренний стандарт, а вторую длину волны выбирают в полосе поглощения чувствительного элемента, и по многократному увеличению оптического сигнала в полосе поглощения чувствительного элемента определяют исходные характеристики полученного интегрального биодатчика;
б) определение калибровочных характеристик аномальной оптической активности полученного интегрального биодатчика в видимой области спектра при облучении калибровочных проб, содержащих смесь указанного полимерного раствора интегрального биодатчика, полученного в операции а4), и раствора гепарина известной концентрации, потоком циркулярно-поляризованного излучения на указанной длине волны в области поглощения чувствительного элемента;
в) смешивание полученного в операции а4) указанного полимерного раствора интегрального биодатчика с анализируемой жидкой пробой;
г) при облучении полученной в операции в) смеси потоком циркулярно-поляризованного излучения на указанной длине волны в области поглощения чувствительного элемента в видимой области спектра регистрируют оптический сигнал и определяют на основе калибровочных характеристик присутствие и концентрацию гепарина в анализируемой жидкой пробе.
2. Способ по п.1, отличающийся тем, что в качестве молекул нуклеиновых кислот используют молекулы двухцепочечных синтетических или природных полинуклеотидов, способных к образованию холестерической жидкокристаллической дисперсии при фазовом исключении с сохранением своей химической реакционной способности и аномальных оптических свойств.
3. Способ по п.2, отличающийся тем, что в качестве молекул нуклеиновых кислот используют молекулы жесткоцепных полимеров.
4. Способ по п.1, отличающийся тем, что в качестве конструктивных элементов наномостиков используют ионы металлов, способных к образованию протяженных плоских хелатных комплексов.
5. Способ по п.4, отличающийся тем, что в качестве конструктивного элемента наномостиков используют ион меди.
6. Способ по п.1, отличающийся тем, что в качестве чувствительного к гепарину элемента наномостиков используют соединение антрациклинового ряда, выбранное из группы, включающей рубомицин, виоломицин, адриамицин, карминомицин, премицин, доксорубицин, дауномицин.
7. Способ по п.6, отличающийся тем, что в качестве чувствительного к гепарину элемента используют дауномицин.
8. Способ по п.1, отличающийся тем, что в качестве водно-солевого раствора водорастворимого, оптически изотропного и химически нейтрального по отношению к нуклеиновой кислоте, к конструктивному элементу и чувствительному элементу полимера используют раствор полиэтиленгликоля.
| СПОСОБ ЗАРЯЖАНИЯ НИСХОДЯЩИХ ОБВОДНЕННЫХ СКВАЖИН | 1994 |
|
RU2133008C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОЛИЧЕСТВА СВОБОДНОГО ГЕПАРИНА В КРОВИ КРУПНОГО РОГАТОГО СКОТА | 1995 |
|
RU2127433C1 |
| SU 1448890 А1, 20.11.1999 | |||
| ЖИДКОКРИСТАЛЛИЧЕСКАЯ ДИСПЕРСИЯ НА ОСНОВЕ КОМПЛЕКСА (НУКЛЕИНОВАЯ КИСЛОТА - ХИТОЗАН) КАК ИНТЕГРАЛЬНЫЙ БИОДАТЧИК И СПОСОБ ЕЕ СОЗДАНИЯ | 2000 |
|
RU2169770C1 |
| МОЛЕКУЛЯРНАЯ КОНСТРУКЦИЯ НА ОСНОВЕ ЖИДКОКРИСТАЛЛИЧЕСКОЙ ДИСПЕРСИИ НУКЛЕИНОВОЙ КИСЛОТЫ КАК ИНТЕГРАЛЬНЫЙ БИОДАТЧИК И СПОСОБ ЕЕ СОЗДАНИЯ | 1998 |
|
RU2139933C1 |
| ЖИДКОКРИСТАЛЛИЧЕСКИЙ БИОДАТЧИК ДЛЯ ОПРЕДЕЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ | 1989 |
|
RU2032895C1 |
| US 2007212786 A1, 13.09.2007 | |||
| US 6246470 B1, 12.06.2001. | |||
Авторы
Даты
2012-01-20—Публикация
2010-08-23—Подача