Изобретение относится к области медицинских исследований, фармацевтической промышленности и биотехнологии, а более конкретно - к способу определения низких концентраций гепарина.
Предлагаемое изобретение может быть использовано в фундаментальной и клинической медицинской биохимии. Наиболее целесообразно использовать его в практическом здравоохранении в тех случаях, когда изменения физиологических (очень низких) значений уровня гепарина в крови пациента свидетельствуют о доклинической фазе развивающихся патологических состояний, что имеет исключительно важное значение для организации профилактических мероприятий и прогноза клинического течения патологического процесса под влиянием начатой терапии. К таким состояниям относятся, в основном, заболевания иммунного генеза (вся акушерская патология, хроническое течение инфекционных заболеваний, антифосфолипидный синдром (АФЛ-синдром) при тотальных или органных атеросклеротических поражениях сосудов, синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и др.).
В организме человека и животных гепарин синтезируется тучными клетками. Он представляет собой кислый мукополисахарид, который осуществляет медиаторные функции во всех органах и многих биологических жидкостях. В его состав входит несколько линейных полисахаридных цепей с молекулярной массой 5000-30000 Да, состоящих из остатков глюкуроновой кислоты и глюкозамина, этерифицированных серной кислотой (фиг.1).
Молекула гепарина содержит в своем составе значительное количество отрицательно заряженных сульфатных и карбоксильных групп, поэтому она представляет собой наиболее сильный природный полианион, способный к образованию комплексов со многими белковыми и синтетическими соединениями поликатионной природы, несущими суммарный положительный заряд.
Особенности строения и высокая степень химической гетерогенности гепарина определяют его биологическое значение и функциональную роль в организме человека и животных. Являясь природным противосвертывающим фактором, гепарин наиболее широко известен как антикоагулянт прямого типа действия, применяемый для профилактики и терапии тромбоэмболических заболеваний и их осложнений, при операциях на сердце и кровеносных сосудах, для поддержания жидкого состояния крови в аппаратах искусственного кровообращения и гемодиализа, а также для предотвращения свертывания крови при лабораторных исследованиях. Антикоагулянтная активность гепарина обусловлена его способностью повышать спектр угнетаемых антитромбином III сериновых протеаз, участвующих в свертывании крови.
Безопасность клинического применения гепарина может быть гарантирована только при рациональном использовании антагонистов гепарина, которые способны быстро и без токсических проявлений устранять антикоагулянтный эффект гепарина. Рациональность использования антигепаринатов, главным образом, зависит от точности и скорости получения информации о количестве циркулирующего в кровотоке гепарина, что является основной проблемой безопасного использования гепарина как антикоагулянта.
В современной фармакологии для этих целей используют как природные, так и синтетические препараты. Трудности восстановления свертываемости крови при использовании антагонистов гепарина во многом зависят от характера распределения гепарина в организме пациента. Поэтому для расчета нейтрализующих доз антагонистов гепарина требуется определять концентрацию гепарина в крови в каждом конкретном случае.
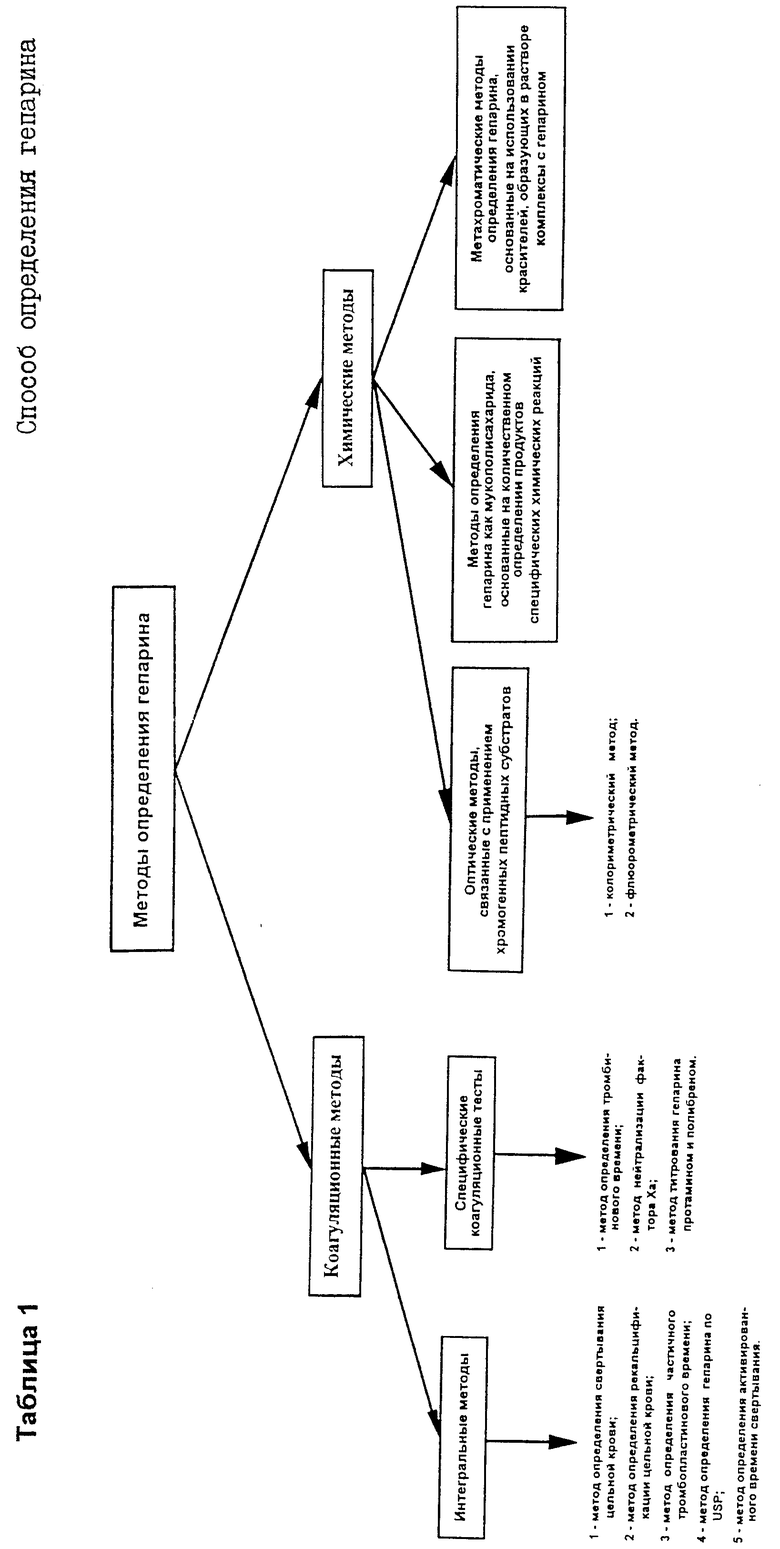
Эффективность методов определения гепарина зависит от принципа, на котором они основаны. Поэтому все известные в настоящее время методы определения гепарина, используемые в клинических или биохимических лабораториях, можно разделить на две группы (таблица) [В кн.: Нарушения реакций образования тромбина./ Под ред. Р.У.Колмена. М.: Медицина, 1988 , с. 175 - 208].
К первой группе относится большая часть описанных в литературе методов. Эти методы (коагуляционные методы) основаны на определении ингибирующего эффекта гепарина по отношению к тромбину или фактору Ха.
Ко второй группе относятся химические методы, которые измеряют в основном количество гепарина как вещества, а не его антикоагулянтную активность.
В арсенале клинических лабораторий необходимо иметь обе группы методов. Это обусловлено тем, что методы первой группы предназначены для определения антикоагулянтной активности гепарина, имеющей индивидуальную реакцию в клинических образцах, тогда как методы второй группы могут быть полезны, например, для сравнения разных препаратов гепарина или количественной характеристики присутствующего в анализируемом образце антикоагулянта безотносительно его фармакологического эффекта.
Среди методов, относящихся к первой группе, наиболее широкую известность получили так называемые интегральные методы, основанные на способности гепарина удлинять время свертывания крови в результате ингибирования образования фибринового сгустка.
Несмотря на простоту и известность, интегральные методы определения концентрации гепарина характеризуются целым рядом недостатков, к которым можно отнести:
- отсутствие специфичности (на результаты интегральных методов, помимо действия гепарина, оказывают влияние различные изменения коагуляции in vivo);
- низкую чувствительность (интегральные методы практически не чувствительны к низким (< 0,1 Ед./мл) концентрациям гепарина);
- низкую воспроизводимость (относительная ошибка определений концентрации гепарина, проводимых при помощи интегральных методов, составляет ≈ 20 - 25%).
Во избежание недостатков, характерных интегральным методам, были разработаны методики (коагуляционные тесты), основанные на более специфическом действии гепарина.
Несмотря на более высокую по сравнению с интегральными методами специфичность и достаточно высокую чувствительность (от 0,1 до ≈ 0,01 Ед./мл гепарина), коагуляционные тесты тем не менее не получили достаточно широкого распространения. Это связано прежде всего с их громоздкостью и трудностью в исполнении. Поэтому применение специфических коагуляционных тестов возможно только в специализированных клинических лабораториях.
Кроме описанных выше интегральных и специфических коагуляционных тестов для определения концентрации гепарина в плазме крови применяют также методы, основанные на использовании хромогенных пептидных субстратов, специфичных по отношению к тромбину или фактору Ха. В этих тестах хромогенные пептидные субстраты выступают в качестве "репортерных" молекул, по изменению оптических свойств которых (колориметрических или флюорометрических) можно следить за скоростью катализируемой гепарином ферментативной реакции инактивации антитромбина или фактора Ха антитромбином III. Условия проведения теста подбирают таким образом, чтобы скорость ферментативной реакции была связана линейной зависимостью с уровнем гепарина в образце.
Преимущества колориметрического и флюорометрического методов заключаются в высокой и стабильной чувствительности к гепарину (до 0,01 Ед./мл) и точности по сравнению с методами, основанными на образовании сгустка.
Следует отметить, что на результаты анализов, проводимых с использованием хромогенных пептидных субстратов, оказывает влияние связывание гепарина с белковыми компонентами плазмы, имеющими антигепариновую природу. Тем не менее методы, использующие хромогенные пептидные субстраты, наиболее удобны для клинического обследования и контроля, но их постановка, вследствие сложности и достаточно высокой стоимости, возможна только в хорошо оснащенных специализированных лабораториях, располагающих дорогостоящим оборудованием и высококвалифицированным персоналом.
Вторая группа методов (таблица, химические методы) определения концентрации гепарина основана на определении гепарина как мукополисахарида.
Для этого используют карбазольную реакцию гексуроновой кислоты или ацетилацетоновую конденсацию гексозаминов с количественным определением последующих пиррольных дериватов при помощи п-диметиламинобензальдегида (реагент Эрлиха).
Эти методы непригодны для определения гепарина в плазме крови, характеризуются длительностью проведения анализа (≈ 1 час и более) и отличаются невысокой чувствительностью (с их помощью можно обнаружить 12 мкг/мл гепарина или 1,6 Ед./мл его активности).
Еще одна группа химических методов основана на способности гепарина как мукополисахарида вызывать метахроматический эффект при его взаимодействии с некоторыми основными красителями (азур А, толуидиновый синий, карбоцианиновый краситель). Интенсивность метахромазии при образовании комплекса (гепарин-краситель) при оптимальной концентрации и объеме раствора добавленного красителя пропорциональна концентрации гепарина: эта величина может быть определена спектрофотометрически. Однако метахроматические методы, как и методы, основанные на использовании специфических в отношении гепарина химических реакций, также непригодны для определения гепарина в плазме крови, достаточно дороги, обладают плохой воспроизводимостью и недостаточно точны. Последние два недостатка обусловлены преципитацией образующегося комплекса (гепарин-краситель) и чувствительностью показаний абсорбции этого комплекса к температуре.
Минимальная концентрация гепарина, определяемая при помощи метахроматических методов, составляет ≈ 10 мкг/мл или 1 Ед./мл его активности. Относительная ошибка определений концентрации гепарина при помощи этой группы методов составляет 10 - 15%.
Таким образом, перечисленные выше недостатки существенно затрудняют быстрое получение точной информации о концентрации гепарина в анализируемых пробах и ограничивают широкое применение перечисленных выше групп методов (табл.1) для проведения такого рода анализов в условиях клинических и экспериментальных лабораторий.
В основу предлагаемого изобретения положена задача создать способ определения концентрации гепарина с такими условиями его проведения, которые позволили бы быстро, просто, точно и надежно определять его концентрацию (в том числе и очень низкую (< 1 мкг/мл)).
Эта задача решена в результате создания способа определения концентрации гепарина, взаимодействующего с его антагонистом, находящимся в составе лиотропной жидкокристаллической дисперсии комплекса (ДНК-антагонист), заключающегося в том, что в водно-солевом растворе умеренной (физиологической) ионной силы из комплекса линейных двухцепочечных молекул ДНК низкой молекулярной массы и молекул антагониста гепарина формируют лиотропную жидкокристаллическую дисперсию, смешивают полученную дисперсию сначала с нейтральным по отношению к ДНК, антагонисту и гепарину водно-солевым раствором полимера, а потом с анализируемой жидкостью, содержащей гепарин, в условиях, при которых оптические свойства лиотропной жидкокристаллической дисперсии комплекса (ДНК-антагонист) не нарушаются, затем через пробу, полученную в результате указанного смешения, пропускают поток циркулярно поляризованного излучения, на длине волны в области поглощения ДНК регистрируют оптический сигнал, определяют концентрацию гепарина в пробе по калибровочной прямой и корректируют его концентрацию в анализируемой жидкости с учетом разбавления, использованного при приготовлении пробы.
Использование предлагаемого способа позволяет быстро, просто, с высокой точностью и чувствительностью определять концентрацию гепарина в анализируемой пробе. Анализы можно проводить в любых лабораториях, поскольку их проведение не требует специально организованного рабочего места и высокой квалификации технического персонала.
Целесообразно в качестве нейтрального полимера использовать полиэтиленгликоль (ПЭГ), поскольку этот полимер является безвредным для персонала, осуществляющего анализ, химически нейтральным по отношению к ДНК, поликатиону и гепарину, обладает высокой растворимостью в водно-солевых растворах умеренной ионной силы, необходимой для создания условий фазового исключения ДНК, обладает оптической изотропией и высокой прозрачностью, необходимой для измерения спектров КД; кроме того, препараты этого полимера разной молекулярной массы доступны по разумной цене.
Целесообразно, чтобы поликатион представлял собой соединение, относящееся к классу полиаминов, характеризовался узким молекулярно-весовым распределением, не поглощал в ультрафиолетовой области спектра, образовывал комплекс не только с гепарином, но и с двухцепочечными линейными молекулами ДНК и обладал низкой токсичностью, сочетаемой с антигепариновой активностью.
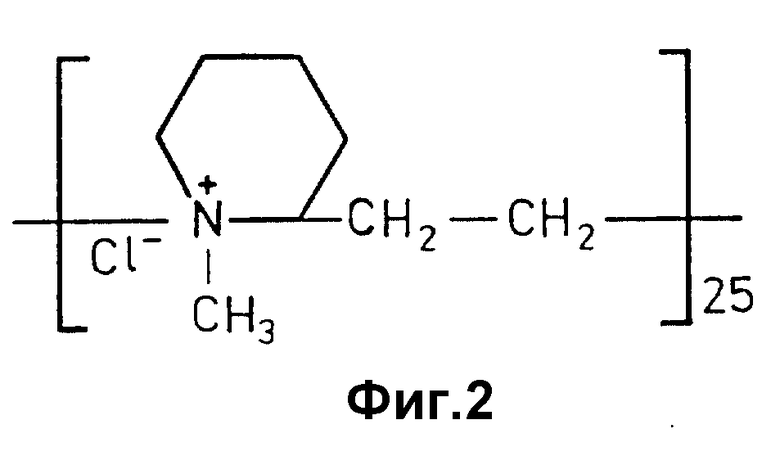
Желательно, что поликатион представлял собой четвертичную аммонийную соль (ЧАС) олигомера конидина (поликонидин) со степенью полимеризации 25 (фиг. 2), поскольку соединения этой группы являются в настоящее время наиболее перспективными высокоселективными и малотоксичными антигепаринатами [Чернова О. В. Исследование антигепариновой активности и влияния на свертывание крови четвертичных аммонийных солей монодисперсных олигомеров конидина. Автореферат канд. диссертации. М.: 1983].
Таким образом, предлагаемый способ может быть использован для быстрого, высокоточного и высокочувствительного определения концентрации гепарина в тех случаях, когда другие лабораторные способы не применимы или не дают надлежащего эффекта.
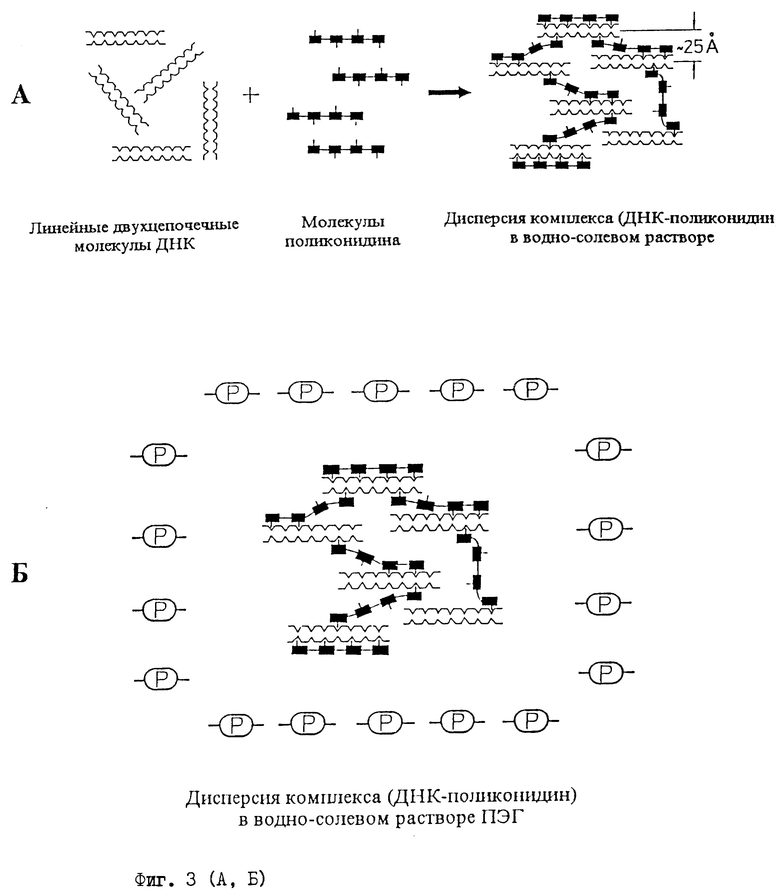
Предлагаемый способ определения концентрации гепарина в анализируемой жидкости (растворе) иллюстрируется схемами, приведенными на фиг.3 (А-Г), и осуществляют следующим образом:
- непосредственно перед определением концентрации гепарина в анализируемой жидкости (растворе) в водно-солевом растворе умеренной ионной силы формируют лиотропную жидкокристаллическую дисперсию комплекса (ДНК-поликонидин) (фиг.3А);
- смешивают водно-солевой раствор жидкокристаллической дисперсии комплекса (ДНК-поликонидин) с водно-солевым раствором полимера, что приводит к получению смеси, в которой молекулы гепарина практически мгновенно реагируют с молекулами поликонидина, образующими комплекс с молекулами ДНК (фиг.3Б);
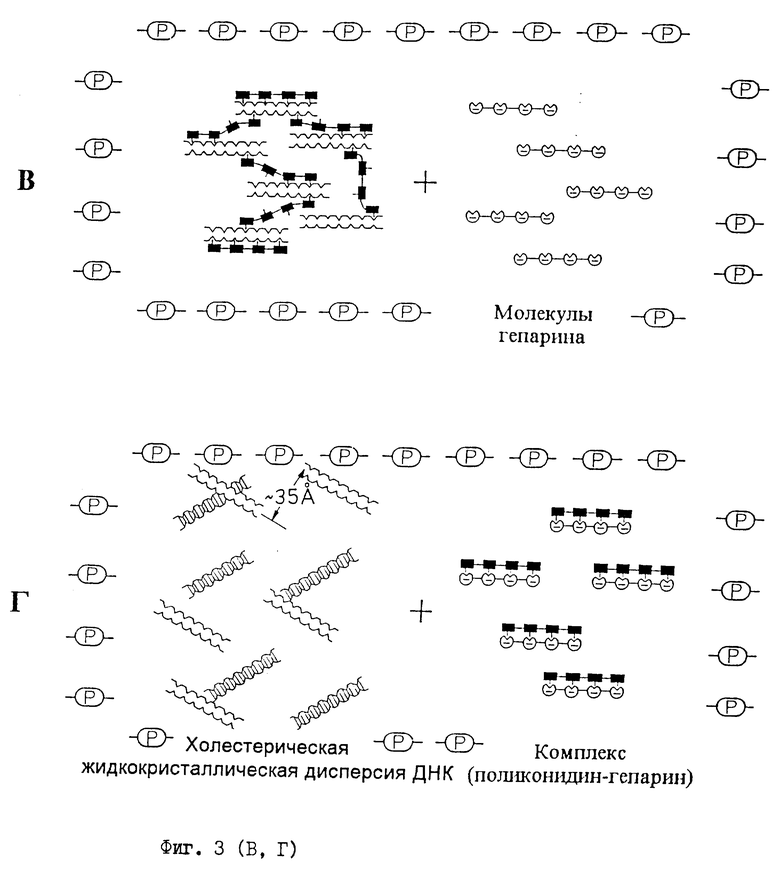
- смешивают полимерсодержащий водно-солевой раствор жидкокристаллический дисперсии комплекса (ДНК-поликонидин) с равным объемом жидкости (раствора), в которой присутствует гепарин; это приводит к получению пробы, готовой для проведения анализа (фиг.3В);
- удаление молекул поликонидина из состава комплекса (ДНК-поликонидин) в результате образования в пробе комплекса (гепарин-поликонидин) приводит к перестроению пространственной организации исходной лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) и сопровождается формированием холестерической жидкокристаллической дисперсии ДНК (фиг. 3Г);
- облучают пробу циркулярно поляризованным светом;
- измеряют величину оптического сигнала, генерируемого пробой, при λ 280 нм;
- определяют концентрацию гепарина в пробе при помощи предварительно построенной по описанному выше способу калибровочной прямой, представляющей собой зависимость величины оптического сигнала, генерируемого жидкокристаллической дисперсией комплекса (ДНК-поликонидин) при добавлении гепарина, от концентрации гепарина;
- корректируют концентрацию гепарина в анализируемой жидкости (растворе) с учетом ее разбавления, использованного при приготовлении пробы.
Для лучшего понимания настоящего изобретения ниже приведены примеры, характеризующие различные стадии заявляемого способа со ссылками на прилагаемые фигуры, на которых:
фиг. 1 характеризует химическую формулу мономерного звена полисахаридной цепи молекулы гепарина;
фиг. 2 характеризует химическую формулу аммонийной соли монодисперсного олигомера конидина со степенью полимеризации 25;
фиг.3 характеризует:
а) схему формирования в водно-солевом растворе умеренной ионной силы лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин);
б) схематическое изображение лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) в водно-солевом растворе ПЭГ;
в) схематическое изображение водно-солевого раствора ПЭГ, содержащего лиотропную жидкокристаллическую дисперсию комплекса (ДНК-поликонидин), в который добавлен гепарин;
г) схематическое изображение пространственной перестройки молекул ДНК в частицах лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) под действием гепарина, приводящей к образованию в водно-солевом растворе ПЭГ холестерической жидкокристаллической дисперсии ДНК;
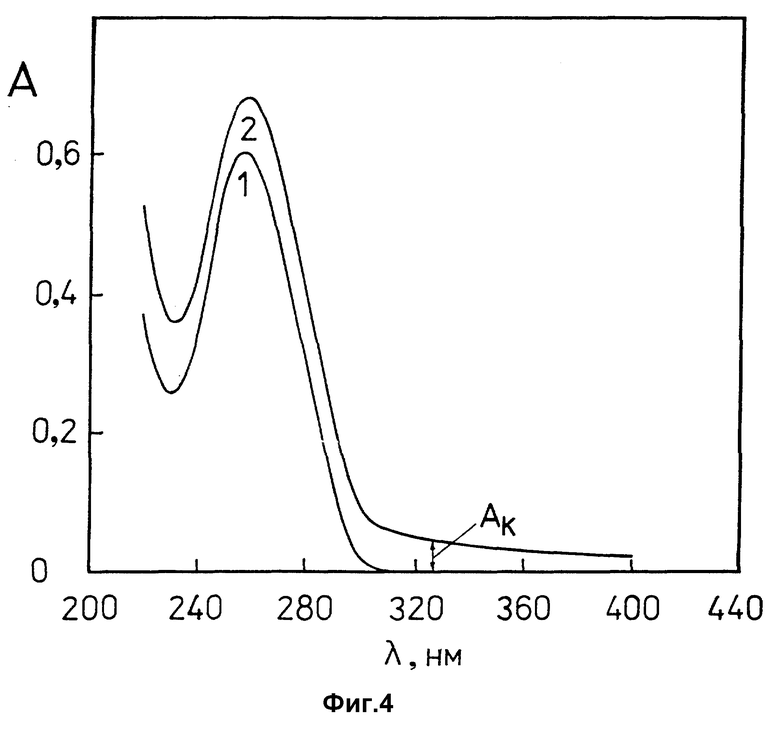
фиг. 4 характеризует спектры поглощения водно-солевых растворов линейной двухцепочечной ДНК (кривая 1) и лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) (кривая 2) в координатах "оптическая плотность, A" - "длина волны, λ (нм)".
ДНК эритроцитов цыплят ("Reanal", Венгрия);
молекулярная масса ДНК ≈(0,3-0,5)•106 Да;
CДНК = 30 мкг/мл;
0,3 M NaCl + 10-2 M фосфатный буфер; pH ≈ 7,0.
кривая 1- Cполи конидин= 0;
кривая 2- Cполик онидин= 13,9•10-3 мг/мл;
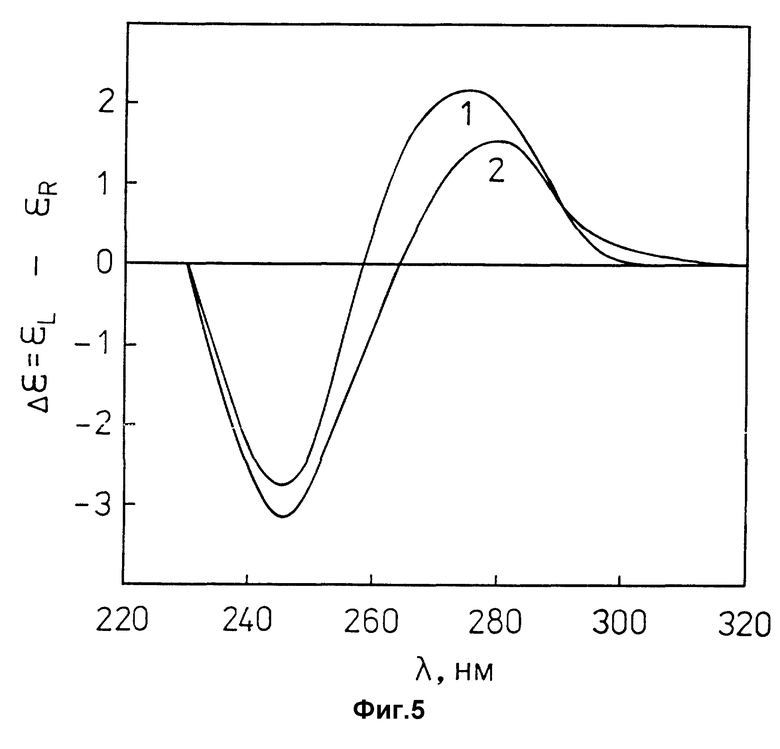
фиг. 5 характеризует спектры КД водно-солевых растворов линейной двухцепочечной ДНК (кривая 1) и лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) (кривая 2) в координатах "Δε = εL-εR" - "длина волны, λ (нм)":
где Δε - молярный круговой дихроизм (Δε = ΔA/Cднк);
ΔA - экспериментально измеренный круговой дихроизм;
CДНК - концентрация ДНК;
εL - молярный дихроизм для левоциркулярно поляризованного света;
εR - молярный дихроизм для правоциркулярно поляризованного света;
ДНК эритроцитов цыплят ("Reanal", Венгрия);
молекулярная масса ДНК ≈(0,3-0,5)•106 Да;
CДНК = 30 мкг/мл;
0,3 M NaCl + 10-2 M фосфатный буфер; pH ≈ 7,0.
кривая 1 - Cполи конидин = 0;
кривая 2 - Cполик онидин = 13,9•10-3 мг/мл;
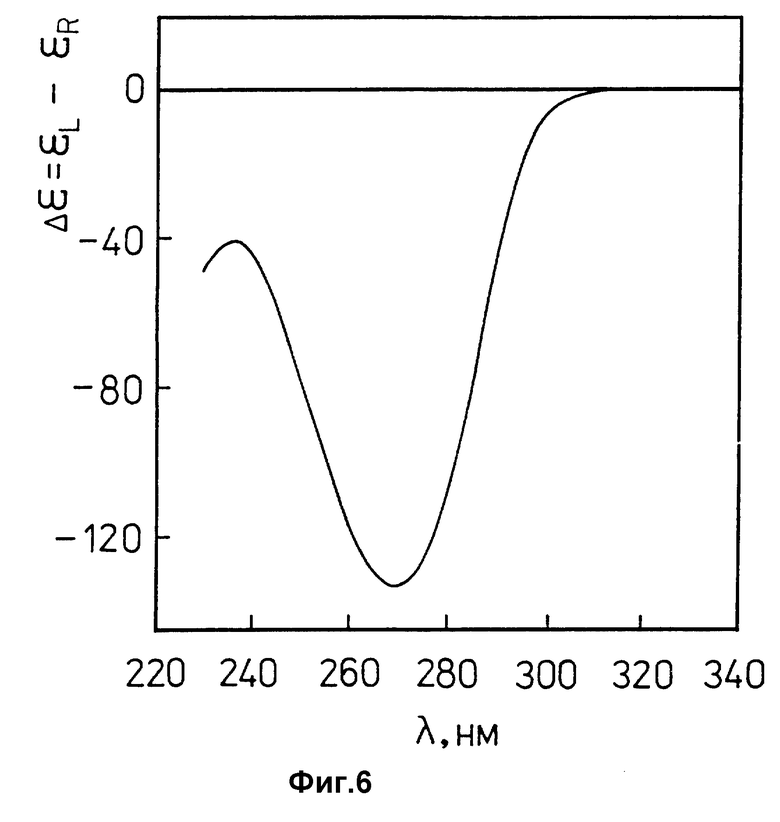
фиг. 6 характеризует спектр КД холестерической жидкокристаллической дисперсии ДНК, сформированной в ПЭГ-содержащем водно-солевом растворе, в координатах "Δε = εL-εR" - "длина волны, λ (нм)":
ДНК эритроцитов цыплят ("Reanal", Венгрия);
молекулярная масса ДНК ≈(0,3-0,5)•106 Да;
CДНК = 15 мкг/мл;
0,3 M NaCl + 10-2 M фосфатный буфер; pH ≈ 7,0.
CПЭГ = 170 мг/мл;
молекулярная масса ПЭГ = 4000 ("Ferak", Германия);
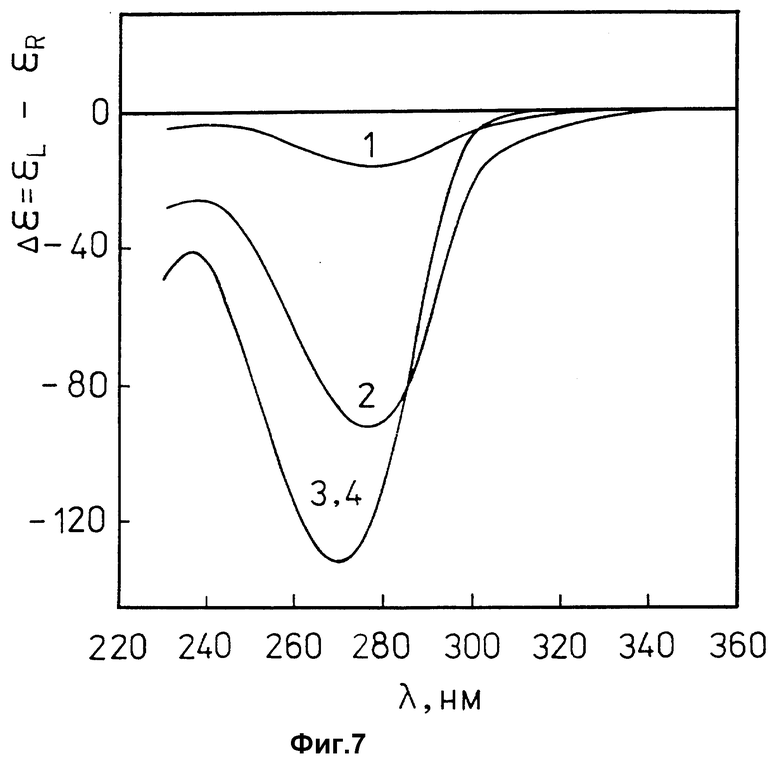
фиг. 7 характеризует спектры КД ПЭГ-содержащих водно-солевых растворов лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) и холестерической жидкокристаллической дисперсии ДНК до (соответственно кривые 1 и 3) и после (соответственно кривые 2 и 4) добавления гепарина в координатах "Δε = εL-εR" - "длина волны, λ (нм)",
ДНК эритроцитов цыплят ("Reanal", Венгрия);
молекулярная масса ДНК ≈(0,3-0,5)•106 Да;
CДНК = 15 мкг/мл;
0,3 M NaCl + 10-2 M фосфатный буфер; pH ≈ 7,0.
CПЭГ = 170 мг/мл;
молекулярная масса ПЭГ = 4000 ("Ferak", Германия);
кривая 1 - Cполи конидин = 6,95•10-3 мг/мл;
Cгепарин = 0;
кривая 2 - Cполи конидин = 6,95•10-3 мг/мл;
Cгепарин = 2,5•10-3 мг/мл;
гепарин из мукозы свиньи (Na-соль, "Serva", Германия) с удельной активностью 186000 Ед./г.
кривая 3 - Cгепарин = 0;
кривая 4 - Cгепарин = 2,5•10-3 мг/мл;
гепарин из мукозы свиньи (Na-соль, "Serva", Германия) с удельной активностью 186000 Ед./г;
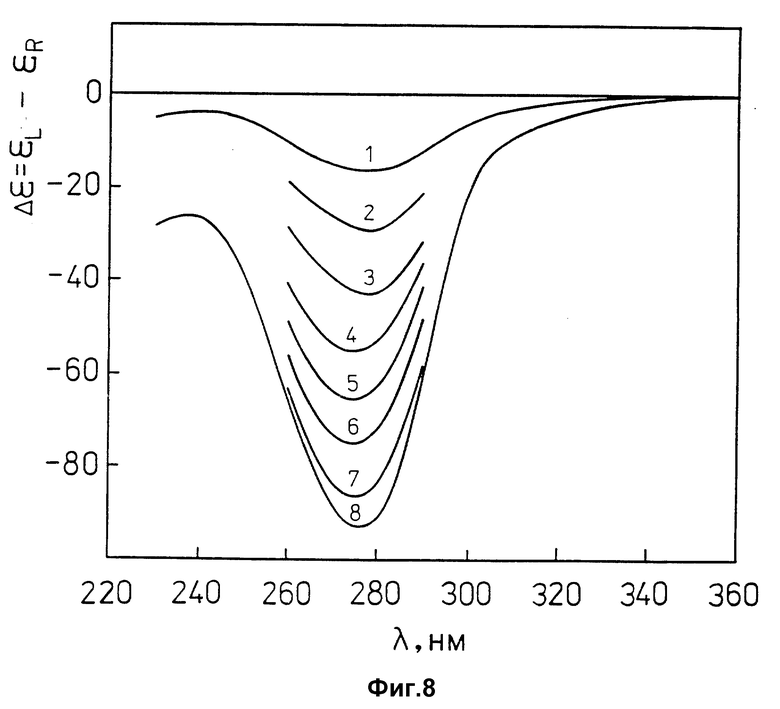
фиг. 8 характеризует спектры КД ПЭГ-содержащего водно-солевого раствора лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) при разных концентрациях гепарина в координатах "Δε = εL-εR" - "длина волны, λ (нм)".
ДНК эритроцитов цыплят ("Reanal", Венгрия);
молекулярная масса ДНК ≈(0,3-0,5)•106 Да;
CДНК = 15 мкг/мл;
0,3 M NaCl + 10-2 M фосфатный буфер; pH ≈ 7,0.
CПЭГ = 170 мг/мл;
молекулярная масса ПЭГ = 4000 ("Ferak", Германия);
Cполик онидин = 6,95•10-3 мг/мл.
1 - Cгепарин = 0; 2 - Cгепарин = 0,2•10-3 мг/мл;
3 - Cгепарин = 0,4•10-3 мг/мл; 4 - Cгепарин = 0,6•10-3 мг/мл;
5 - Cгепарин = 0,8•10-3 мг/мл; 6 - Cгепарин = 1,0•10-3 мг/мл;
7 - Cгепарин = 1,4•10-3 мг/мл; 8 - Cгепарин = 2,5•10-3 мг/мл.
Гепарин из мукозы свиньи (Na-соль, "Serva", Германия) с удельной активностью 186000 Ед./г;
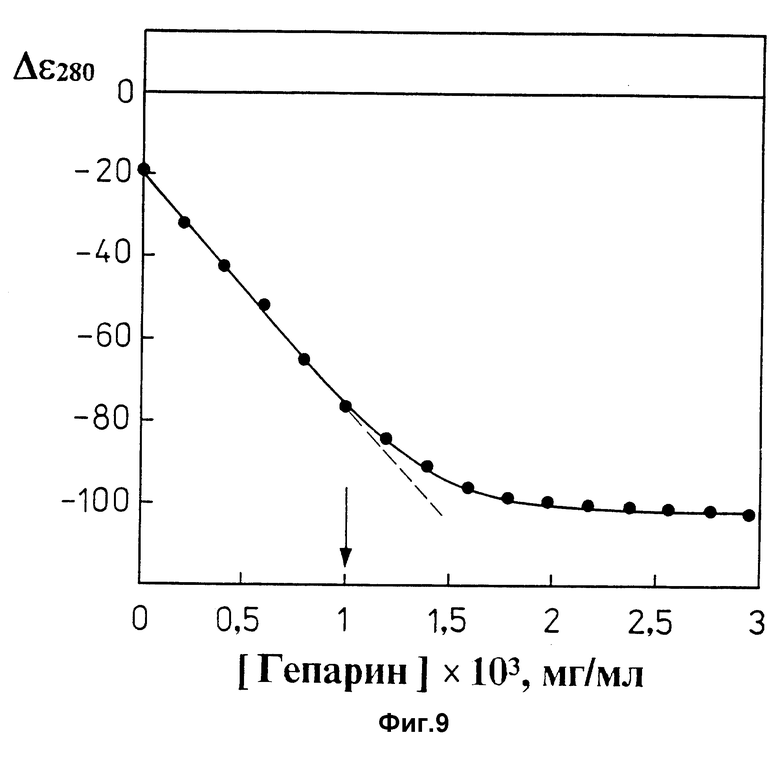
фиг. 9 характеризует зависимость амплитуды отрицательной полосы в спектрах КД ПЭГ-содержащего водно-солевого раствора лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) от концентрации гепарина в координатах "Δε280" - "концентрация гепарина, Cгепарин•103, (мг/мл)".
Стрелкой на фиг. 9 указана концентрация гепарина, вплоть до которой между величиной Δε280 и концентрацией гепарина наблюдается прямо пропорциональная зависимость;
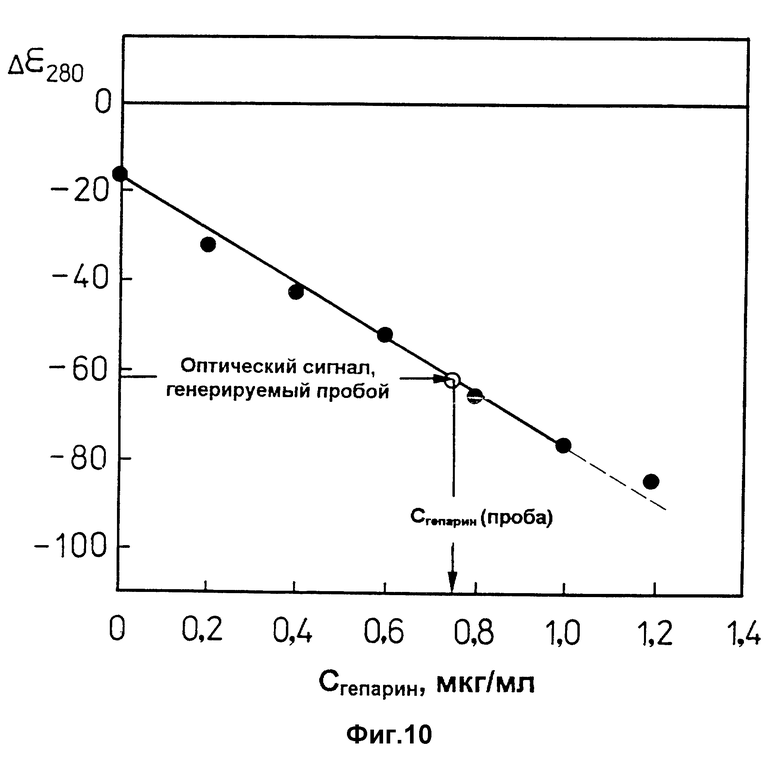
фиг. 10 характеризует калибровочную прямую, предназначенную для определения концентрации гепарина в пробе, в координатах "Δε280" - "концентрация гепарина, Cгепарин, (мкг/мл)".
Стрелками на фиг. 10, в качестве примера, показан способ определения концентрации гепарина в пробе.
Пример 1. Формирование лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) в водно-солевом растворе умеренной ионной силы.
1.1 Навески NaCl (17,532 г), NaH2PO4•2H2O (0,78 г) и Na2HPO4•12H2O (1,79 г) помещают в мерную колбу (V = 1000 мл) и растворяют в дистиллированной воде; доводят объем раствора до метки.
Таким способом готовят 1 л 0,3 М раствора NaCl, содержащего 10-2 М фосфатный буфер (pH ≈ 7,0).
1.2 10 мг препарата линейной двухцепочечной ДНК ("Reanal", Венгрия; молекулярная масса (0,3-0,5)•106 Да) помещают в мерную пробирку (V = 10 мл) и растворяют в 5 мл раствора, приготовленного по п. 1.1; доводят объем раствора до 10 мл. Концентрацию ДНК определяют спектрофотометрически, исходя из соотношения 1 мг ДНК соответствует ≈20 оптическим единицам в 1 мл (λmax= 258,4 нм, εmax= 6600 M-1 см-1; pH ≈7,0).
Таким способом готовят 10 мл водно-солевого раствора ДНК с фиксированной концентрацией (CДНК = 1 мг/мл; 0,3 М NaCl + 10-2 М фосфатный буфер; pH ≈7,0).
1.3 Навеску четвертичной аммонийной соли олигомера конидина со степенью полимеризации 25 (4 мг) помещают в мерную пробирку (V = 5 мл) и растворяют в 1,5 мл раствора, приготовленного по п. 1.1; доводят объем раствора до 2 мл.
Таким способом готовят 2 мл водно-солевого раствора поликонидина с фиксированной концентрацией (Cполик онидин = 2 мг/мл; 0,3 М NaCl + 10-2 М фосфатный буфер; pH ≈ 7,0).
1.4 Навески NaH2PO4•2H2O (0,078 г) и Na2HPO4•12H2O (0,179 г), NaCl (1,753 г) и ПЭГ (34 г; молекулярная масса ПЭГ = 4000, "Ferak", Германия) помещают в мерную колбу (V = 100 мл) и растворяют в дистиллированной воде; доводят объем раствора до метки.
Таким способом готовят 100 мл водно-солевого раствора ПЭГ (CПЭГ = 340 мг/мл; 0,3 М NaCl + 10-2 М фосфатный буфер; pH ≈ 7,0).
Все растворы, приготовленные по п.п. 1.1-1.4, фильтруют для удаления механических примесей через нитроцеллюлозные фильтры с диаметром пор 1,5 мкм ("Chemapol", Чехия).
1.5 В стеклянной пробирке (V = 10 мл) смешивают 4,85 мл раствора 1.1 с 0,15 мл раствора 1.2.
Таким способом готовят 5 мл водно-солевого раствора линейной двухцепочечной ДНК заданной концентрации (CДНК = 30 мкг/мл; 0,3 М NaCl + 10-2 М фосфатный буфер; pH ≈ 7,0).
После смешения растворов 1.1 и 1.2 регистрируют спектры поглощения и КД водно-солевого раствора линейной двухцепочечной ДНК заданной концентрации, приготовленного по п. 1.5 (см. фиг. 4 (кривая 1) и фиг. 5 (кривая 1), где изображены спектр поглощения и спектр КД водно-солевого раствора линейной двухцепочечной ДНК соответственно).
1.6 В стеклянную пробирку (V = 10 мл), содержащую 3 мл водно-солевого раствора линейной двухцепочечной ДНК, приготовленного по п. 1.5, добавляют при постоянном перемешивании по 7 мкл раствора, приготовленного по п. 1.3 (суммарный объем добавленного раствора 1.3 составляет 21 мкл).
Таким способом формируют лиотропную жидкокристаллическую дисперсию комплекса (ДНК-поликонидин) в водно-солевом растворе умеренной ионной силы (CДНК = 30 мкг/мл; 0,3 М NaCl + 10-2 М фосфатный буфер; pH ≈ 7,0);
Cполи конидин ≈ 13,9•10-3 мг/мл).
1.7 В стеклянной пробирке (V = 10 мл) смешивают 1,5 мл раствора (1.4) с 1,5 мл раствора (1.5); полученную смесь интенсивно перемешивают в течение 3 мин.
Таким способом формируют в ПЭГ-содержащем водно-солевом растворе холестерическую жидкокристаллическую дисперсию ДНК (CДНК = 15 мкг/мл; CПЭГ = 170 мг/мл; 0,3 М NaCl + 10-2 М фосфатный буфер; pH ≈ 7,0).
После приготовления полученных по пп. 1.6 и 1.7 жидкокристаллических дисперсий комплекса (ДНК-поликонидин) и ДНК их свойства контролируют при помощи оптических методов (спектрофотометрия и КД-спектроскопия). Появление "кажущейся" оптической плотности (Aк) в области длин волн, превышающих 320 нм (фиг. 4, кривая 2), в которой ни ДНК, ни поликонидин не обладают заметным собственным поглощением, свидетельствует о том, что в результате смешения растворов, приготовленных по п.п. 1.3 и 1.5, образуется лиотропная жидкокристаллическая дисперсия комплекса (ДНК-поликонидин). Данные КД-спектроскопии (фиг. 5, кривая 2) свидетельствуют о том, что лиотропная жидкокристаллическая дисперсия комплекса (ДНК-поликонидин), сформированная в водно-солевом растворе умеренной ионной силы в соответствии со схемой, приведенной на фиг. 3A, не обладает аномальной оптической активностью, которая должна проявляться как интенсивная отрицательная полоса с максимумом при λ ~ 270 нм (фиг. 6) и характерна для холестерической жидкокристаллической дисперсии ДНК.
Пример 2. Оптические свойства лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) в ПЭГ-содержащем водно-солевом растворе до и после добавления гепарина.
2.1 Навеску Na-соли гепарина (4 мг; "Serva", Германия; удельная активность 186000 Ед./г) помещают в мерную стеклянную пробирку (V = 5 мл) и растворяют в 1,5 мл раствора, приготовленного по п. 1.1; доводят объем раствора до 2 мл.
Таким способом готовят 2 мл водно-солевого раствора гепарина с фиксированной концентрацией (Cгепарин = 2 мг/мл; 0,3 М NaCl + 10-2 М фосфатный буфер (pH ≈ 7,0).
2.2 В стеклянной пробирке (V = 10 мл) смешивают 1,5 мл водно-солевого раствора лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин), приготовленного по п. 1.6, и 1,5 мл ПЭГ-содержащего водно-солевого раствора, приготовленного по п. 1.4; полученную смесь интенсивно перемешивают в течение 3 мин.
Таким способом готовят ПЭГ-содержащий водно-солевой раствор лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин), физико-химические свойства которого обеспечивают условия, необходимые для фазового исключения линейных двухцепочечных молекул ДНК и образования холестерической жидкокристаллической дисперсии ДНК (CДНК = 15 мкг/мл; Cполи конидин = 6,95•10-3 мг/мл; CПЭГ = 170 мг/мл; 0,3 М NaCl + 10-2 М фосфатный буфер; pH ≈ 7,0).
2.3 В прямоугольную оптическую кварцевую кювету (V = 4 мл; длина оптического пути 1 см) помещают 2 мл раствора, приготовленного по п. 2.2, и записывают его спектр КД в области длин волн 220-350 нм при помощи дихрографа "Jobin-Yvon, Mark III" (Франция).
2.4 После регистрации спектра КД в оптическую кювету, содержащую 2 мл раствора, приготовленного по п. 2.2, добавляют 2,5 мкл водно-солевого раствора гепарина, приготовленного по п. 2.1; полученную в оптической кювете смесь перемешивают и регистрируют ее спектр КД в области длин волн 220-350 нм.
2.5 Аналогично пп. 2.3-2.4, в качестве контроля, регистрируют спектры КД 2 мл ПЭГ-содержащего водно-солевого раствора холестерической жидкокристаллической дисперсии ДНК, приготовленного по п. 1.7, до и после добавления 2,5 мкл раствора гепарина, приготовленного по п. 2.1.
На фиг. 7 приведены спектры КД ПЭГ-содержащих водно-солевых растворов лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) и холестерической жидкокристаллической дисперсии ДНК до (соответственно кривые 1 и 3) и после (соответственно кривые 2 и 4) добавления гепарина. Сопоставление кривой 1 с кривой 3 показывает, что лиотропная жидкокристаллическая дисперсия комплекса (ДНК-поликонидин), помещенная в ПЭГ-содержащий водно-солевой раствор, не обладает аномальной оптической активностью, характерной для холестерической жидкокристаллической дисперсии ДНК.
Добавление гепарина в раствор, содержащий лиотропную жидкокристаллическую дисперсию комплекса (ДНК-поликонидин), сопровождается появлением в спектре КД интенсивной отрицательной полосы, расположенной в области поглощения азотистых оснований ДНК (кривая 3). Амплитуда полосы в спектре КД, возникшая после добавления гепарина, практически не отличается от амплитуды отрицательной полосы, наблюдаемой в спектре КД холестерической жидкокристаллической дисперсии ДНК (кривая 2). Как показывает контроль, добавление гепарина в раствор, содержащий холестерическую жидкокристаллическую дисперсию ДНК, не влияет на ее аномальные оптические свойства (ср. кривые 2 и 4).
Многократное увеличение амплитуды полосы в спектре КД ПЭГ-содержащего водно-солевого раствора лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) после добавления гепарина свидетельствует об изменении пространственной организации образующих ее молекул ДНК. Такое изменение обусловлено диссоциацией комплекса (ДНК-поликонидин) под действием гепарина и образованием более прочного комплекса (гепарин-поликонидин). В результате удаления молекул поликонидина из состава комплекса (ДНК-поликонидин) молекулы ДНК перестраиваются, образуя холестерическую жидкокристаллическую дисперсию ДНК, обладающую аномальными оптическими свойствами (фиг. 3Г).
Таким образом, индуцированное гепарином появление интенсивной отрицательной полосы в спектре КД ПЭГ-содержащего водно-солевого раствора лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) можно использовать в качестве критерия, позволяющего судить о наличии гепарина в анализируемом растворе (жидкости).
Пример 3. Аналитические возможности лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) в ПЭГ-содержащем водно-солевом растворе.
3.1 В пробирке (V = 0,5 мл) смешивают 20 мкл раствора гепарина, приготовленного по п. 2.1, с 180 мкл раствора, приготовленного по п. 1.1.
Таким способом готовят 200 мкл водно-солевого раствора гепарина с фиксированной концентрацией (Cгепарин = 0,2 мг/мл; 0,3 М NaCl + 10-2 М фосфатный буфер; pH ≈ 7,0).
3.2 В прямоугольную кварцевую кювету (V = 4 мл; длина оптического пути 1 см) помещают 2 мл ПЭГ-содержащего водно-солевого раствора лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин), приготовленного по п. 2.2, и регистрируют его спектр КД в области длин волн 220-350 нм.
3.3 После регистрации спектра КД исходного ПЭГ-содержащего водно-солевого раствора лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) в кювету добавляют по 2 мкл раствора 3.1 (суммарный объем добавленного раствора 3.1 составляет 30 мкл); после каждой добавки раствора 3.1 полученную в оптической кювете смесь перемешивают и регистрируют спектр КД в области длин волн 220-350 нм.
На фиг. 8 спектр КД исходной лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) (кривая 1) сопоставлен со спектрами КД этой же дисперсии, в которую добавлены разные концентрации гепарина (кривые 2-8). Добавление гепарина сопровождается появлением в спектре КД лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) отрицательной полосы с максимумом при λ ~ 280 нм, амплитуда которой возрастает по мере увеличения концентрации гепарина в растворе.
Зависимость амплитуды полосы при λ = 280 нм в спектре КД лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин) от концентрации гепарина (фиг. 9) показывает, что между величиной Δε280 и концентрацией гепарина наблюдается прямо пропорциональная зависимость в области концентраций гепарина от 0 до (1,2-1,3)•10-3 мг/мл.
Наличие прямо пропорциональной зависимости между величиной оптического сигнала, генерируемого лиотропной жидкокристаллической дисперсией комплекса (ДНК-поликонидин) в ПЭГ-содержащем водно-солевом растворе после добавления гепарина, и концентрацией гепарина позволяет использовать прямолинейный участок кривой, приведенной на фиг. 9, в качестве калибровочной прямой.
Зависимость, приведенная на фиг. 10, представляет собой калибровочную прямую, пользуясь которой можно с высокой точностью определять низкие (< 1 мкг/мл) концентрации гепарина в анализируемой пробе.
Таким образом, интенсивная отрицательная полоса в области поглощения азотистых оснований ДНК в спектре КД в сочетании с наличием прямо пропорциональной зависимости между амплитудой этой полосы и концентрацией добавленного гепарина может быть использована для определения наличия и низких концентраций гепарина в анализируемом растворе (жидкости).
Пример 4. Регламент определения концентрации гепарина в анализируемом растворе.
4.1 В пробирке (V = 5 мл) смешивают 1 мл анализируемого раствора гепарина и 1 мл ПЭГ-содержащего водно-солевого раствора, приготовленного по п. 1.4.
Таким способом готовят 2 мл анализируемого раствора гепарина, содержащего ПЭГ (CПЭГ = 170 мг/мл).
4.2 В пробирке (V = 5 мл) смешивают 1 мл анализируемого раствора гепарина, содержащего ПЭГ, приготовленного по п. 4.1, и 1 мл ПЭГ-содержащего водно-солевого раствора лиотропной жидкокристаллической дисперсии комплекса (ДНК-поликонидин), приготовленного по п. 2.2.
Таким способом получают пробу, готовую для проведения анализа.
4.3 Регистрируют спектр КД пробы, приготовленной в соответствии с п. 4.2, в области длин волн 220-350 нм.
4.4 Определяют значение величины Δε280, характерное для спектра КД пробы.
4.5 Наносят экспериментально полученное значение величины Δε280 на калибровочную прямую (фиг. 10).
Если экспериментально полученное значение величины Δε280 находится в пределах -20 ед. < Δε280< -100 ед., то при помощи калибровочной прямой определяют концентрацию гепарина в пробе, соответствующее экспериментально полученному значению Δε280 (способ определения концентрации гепарина в пробе схематически показан стрелками на фиг. 10).
4.6 Пользуясь полученным при помощи калибровочной прямой значением концентрации гепарина в пробе, определяют концентрацию гепарина в анализируемом растворе с учетом его разбавления, связанного с приготовлением пробы:
Cгепарин (анализируемый раствор) = 4•Cгепарин (проба)
4.7 Если же экспериментально измеренное значение величины Δε280> -100 ед., в этом случае возможно только ориентировочное определение концентрации гепарина в анализируемом растворе (в этом случае можно лишь утверждать, что концентрация гепарина в анализируемом растворе превышает 4 мкг/мл).
4.8 Для уточнения концентрации гепарина анализируемый раствор разбавляют водно-солевым раствором, приготовленным по п. 1.1, в 2, 4, и т.д. в 2n раз. После каждого разведения с полученным раствором гепарина повторяют операции, перечисленные в пп. 4.1-4.6. Эти операции повторяют до тех пор, пока экспериментально зарегистрированное значение величины Δε280 не окажется в области значений -20 ед.< Δε280< -100 ед.
4.9 В том случае, когда после 2n- ого разведения анализируемого раствора гепарина экспериментально измеренное значение величины Δε280 оказывается в пределах -20 ед.< Δε280< -100 ед., при помощи калибровочной прямой определяют соответствующую ей концентрацию гепарина в пробе.
4.10 Пользуясь полученным значением концентрации гепарина в пробе (п. 4.9), определяют концентрацию гепарина в анализируемом растворе с учетом всех стадий разбавления, связанных с приготовлением пробы:
Cгепарин (мкг/мл, анализируемый раствор) = 2n+2•Cгепарин (мкг/мл, проба)
Минимальная концентрация гепарина, определяемая в анализируемой жидкости (растворе) при помощи предлагаемого регламента, основанного на измерении оптического сигнала, генерируемого лиотропной жидкокристаллической дисперсией комплекса (ДНК-поликонидин) под действием гепарина, при помощи дихрографа "Jobin-Yvon, Mark III" (Франция), составляет ≈ 0,4-0,5 мкг/мл.
Изобретение относится к области медицинских исследований, фармацевтической промышленности и биотехнологии. Для определения гепарина в водно-солевом растворе из комплекса линейных двухцепочечных молекул ДНК низкой молекулярной массы и молекул антагониста гепарина формируют лиотропную жидкокристаллическую дисперсию. Смешивают полученную дисперсию сначала с нейтральным по отношению к ДНК антагонисту и гепарину водно-солевым раствором полимера, а потом с анализируемой жидкостью, содержащей гепарин. Смешение проводят в условиях, при которых оптические свойства лиотропной жидкокристаллической дисперсии комплекса (ДНК-антагонист) не нарушаются. Через пробу, полученную в результате указанного смешения, пропускают поток циркулярно поляризованного излучения. На длине волны в области поглощения ДНК регистрируют оптический сигнал. Использование изобретения позволяет упростить и ускорить процесс диагностики доклинической фазы развивающихся патологических состояний. 3 з.п.ф-лы, 10 ил., 1 табл.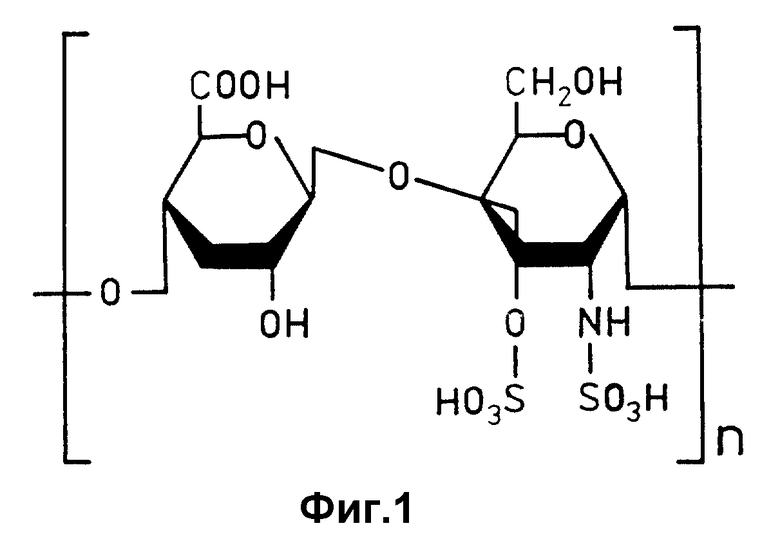
| Нарушения реакций образования тромбина (под ред | |||
| Р.У.Колмена) | |||
| - М.: Медицина, 1988, с.175 - 208. |
Авторы
Даты
1998-12-10—Публикация
1997-10-28—Подача