Изобретение относится к исследованию биологического материала, в частности к определению длины теломер.
Теломерные районы ДНК (теломеры) представляют собой концевые участки хромосом, не несущие смысловой нагрузки, которые состоят из повторяемых гексаповторов TTAGGG, имеющих тандемное расположение и идентичных для всех позвоночных [1, 8]. При делении клетки в результате концевой недорепликации ДНК вновь синтезированная сестринская хроматида становится короче, и происходит это за счет потери теломерных повторов [9]. Укорочение теломер является ограничением к безостановочному делению клеток, поэтому длина теломер определяет репликативный потенциал клетки, а также является косвенным маркером ее репликативной истории. Короткие теломеры являются признаком «стареющих» клеток.
Длина теломер является одной из основных динамических функций жизнедеятельности клетки, и изучение таких изменений имеет важное фундаментальное и клиническое значение. Изменение длины теломер с возрастом и возможность ее регуляции имеют большое значение в изучении биологии старения и геронтологии [2, 6]. Достаточно широко используется измерение длины теломер в диагностике, оценке эффективности лечения и прогноза онкологических заболеваний, а также состояний, связанных с патологией иммунной системы [4, 13, 15]. Изучение теломер на клеточном уровне, изменения, связанные с делением клетки, имеют особое значение для понимания биологии старения, поскольку затрагивает процессы, определяющие продолжительность жизни клетки.
Измерение длины теломер стало рутинным методом благодаря разработке методики Flow-FISH-гибридизация in situ с анализом на проточном цитофлуориметре. Эта методика позволяет определять длину теломер в единичных клетках целевой популяции [11]. Измерение теломер в пролиферирующих клетках возможно несколькими способами. Наиболее простой - это выделение пролиферирующих клеток с помощью ДНК красителей, когда клетки в фазе S-G2-M имеют большее количество ДНК, что позволяет их дифференцировать по более высокому уровню флуоресценции по каналу светимости ДНК красителя [3]. Эта методика включена в метод Flow-FISH для измерения теломер, поэтому нет необходимости для отдельного сортинга пролиферирующих клеток. Однако этот метод позволяет определять длину теломер только в клетках, которые делились в момент исследования, и не учитывает клетки, которые поделились ранее.
Другой метод - это инкубирование живых клеток в растворе, содержащем бромдеоксиуридин (BrdU), который встраивается во вновь синтезируемые цепи ДНК. Затем добавляют анти-BrdU моноклональные антитела, меченные флуорохромом и анализируют на проточном цитофлуориметре. Это позволяет точно выделить все поделившиеся клетки, поскольку они содержат встроенный меченый нуклеотид независимо от времени исследования.
Еще одна методика, взятая авторами за прототип, позволяет выделить пролиферирующие клетки, используя витальный флуоресцентный краситель. Принцип метода заключается в окрашивании клеток витальным красителем, который прочно связывается с белками клетки, и после деления распределяется между дочерними клетками [14]. Неподелившиеся клетки имеют максимальную светимость по каналу флуоресценции витального красителя, а клетки, совершившие хотя бы одно деление, будут иметь уровень флуоресценции значительно ниже. Чтобы определить длину теломер в пролиферирующих клетках, нужно их сперва выделить из общей популяции, т.е. провести сортировку, например, на клеточном сортере, поскольку флуорохромы не выдерживают нагрева до 80°С, необходимого для проведения метода гибридизации in situ [3, 5, 14]. Этот метод, как и предыдущий, очень затратный и трудоемкий, требующий значительного количества времени и, помимо специального клеточного сортера, необходима подготовка большого количества клеток.
Окраска клеток витальным красителем позволяет также определить точное количество совершенных клетками делений в культуре. После деления материнской клетки краситель равномерно распределяется между дочерними клетками, которые имеют уровень флуоресценции в два раза ниже, что повторяется с каждым новым делением. По количеству пиков флуоресценции витального красителя можно определить количество клеточных делений [7].
Авторами был проведен ряд опытов, в которых было показано, что витальный краситель CFSE не выдерживает нагрева до 80°С в формамиде, и после гибридизации in situ невозможно определить количество делений по количеству раздельных пиков по каналу флуоресценции CFSE. Существуют способы для сохранения флуорохрома на клетке при нагревании до 80°С, один из которых - это использование специального химического вещества BS3 (Bis(sulfosuccinimidyl)suberat), который используется в методе Flow-FISH для дифференцировании клеток по поверхностным антигенам [12]. Основываясь на этом методе, было предположено, что использование BS3 будет способствовать сохранению витального красителя на клетке после нагрева до 80°С, что позволит одномоментно определять длину теломер и количество совершенных делений в культурах пролиферирующих клеток.
Целью изобретения является создание способа одномоментного определения длины теломер в клетках с известным количеством совершенных делений.
Способ заключается в том, что клетки дифференцируют по количеству совершенных делений с помощью витального красителя по градуальному снижению уровня его флуоресценции. Одномоментно с этим, без процедуры предварительного выделения целевой пролиферирующей популяции клеток из общей популяции, применяют метод flow-FISH (гибридизация in situ) для определения длины теломер в клетках, дифференцированных по количеству совершенных делений и поверхностному маркеру. Процедуры производят с участием кросслинкера аминогрупп Bis(sulfosuccinimidyl)suberat(BS3).
Способ позволяет определить длину теломер на уровне единичной клетки с помощью гибридизации in situ, а также определить количество делений, совершенных этой клеткой in vitro с последующим анализом на проточном цитофлуориметре.
Это делает метод более доступным, значительно увеличивает информативность и производительность, сокращает время исследования и финансовые затраты.
Описание способа с примерами конкретной реализации
Исследуемые клетки окрашивают витальным красителем CFSE (Molecular probes, USA) с конечной концентрацией 2µМ в RPMI 1640 15 минут, затем отмывают в RPMI с 10% FCS (HyClone, UK). После этого клетки культивируют in vitro.
После культивирования клетки отмывают в ЗФР с 0,1% БСА (Sigma, США) (ЗФР-БСА) и метят биотинилированными антителами против целевого антигена. Инкубируют 20 минут, отмывают ЗФР-БСА и добавляют стрептавидин, меченный флуорохромом, и инкубируют 20 минут. После отмывки добавляют раствор BS3 4 мМ (Bis(sulfosuccnimidyl)suberat, Pierce, USA) 30 минут при 37°С [12]. Затем добавляют Tris (Sigma, США) в конечной концентрации 20 мМ, инкубируют 15 минут и отмывают ЗФР-БСА. Осадок ресуспендируют в 300 мкл гибридизационного раствора, состоящего из 70% формамида (Sigma, США), 20 мМ Tris и 1% БСА. Зонд PNA комплиментарный теломерной последовательности ДНК и меченный флуорохромом (Bio-Synthesis, Inc., USA), добавляют в концентрации 0,3 мкг/мл [10]. Параллельно ставят пробу с контрольными клетками, которые используют как стандарт гибридизации. Пробы нагревают 10 минут при 80°С и гибридизуют 3 часа при +20°С. Затем клетки переносят в пробирки для цитометрии, дважды отмывают раствором 70% формамида и однократно ЗФР-БСА + 0,1% Tween. Осадок ресуспендируют в 0,5 мл ЗФР-БСА. Анализ проб проводят на проточном цитофлуориметре. По параметрам прямого и бокового светорассеивания выделяют регион лимфоцитов, в котором определяют позитивные клетки по CD4 антигену по каналу флуоресценции используемого флуорохрома. Из позитивного региона строят гистограмму по сигналу флуоресценции витального красителя CFSE, на которой будут видны пики распределения клеток по количеству прошедших делений. На данной гистограмме пик с наиболее высокой флуоресценцией определяет неподелившееся клетки, а с минимальной флуоресценцией клетки, совершившие максимальное количество делений. После выделения популяции клеток с нужным количеством делений строят гистограмму по флуоресценции флуорохрома Су3, которым мечен PNA зонд, комплиментарный теломерной ДНК.
Длину теломер в клетках определяют как средний уровень флуоресценции клеток по каналу флурохрома Су3 после гибридизации в присутствии PNA зонда за вычетом фоновой (аутофлуоресценции) клеток, прошедших те же условия в отсутствие PNA зонда. Отношение показателя средней длины теломер в клетках к показателю контрольных клеток отражает среднюю длину теломер относительно контрольных клеток.
Ниже приведен пример, поясняющие данный способ определения относительной средней длины теломер в пролиферирующих клетках.
Пример. Определение изменения длины теломер с каждым новым делением в субпопуляциях CD4+ и CD8+ лимфоцитов человека в культуре in vitro за 7 суток в ответ на активацию анти-СD3 моноклональными антителами.
От 6 доноров 5 мл периферической крови, стабилизированной гепарином, стерильно центрифугируют в градиенте фиколл-верографина в течение 20 минут при 3 тыс. об/мин, после чего кольцо мононуклеарных клеток собирают и отмывают дважды с 5 мл стерильного забуференного физиологического раствора (ЗФР) по 5 минут при 1 тыс.об/мин. Осадок ресуспендируют в 1 мл ЗФР и подсчитывают количество клеток в камере Горяева.
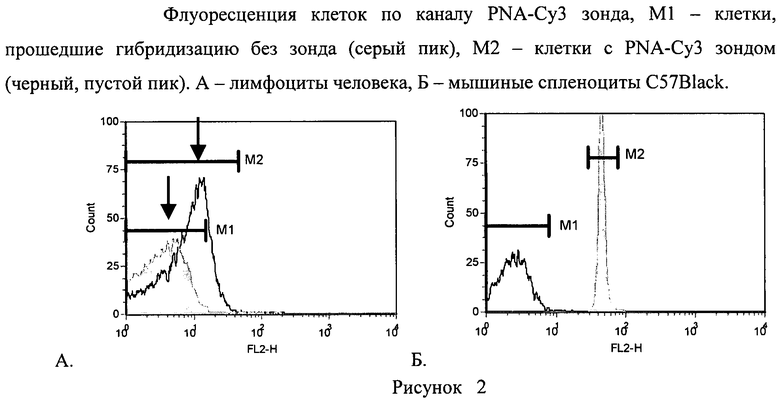
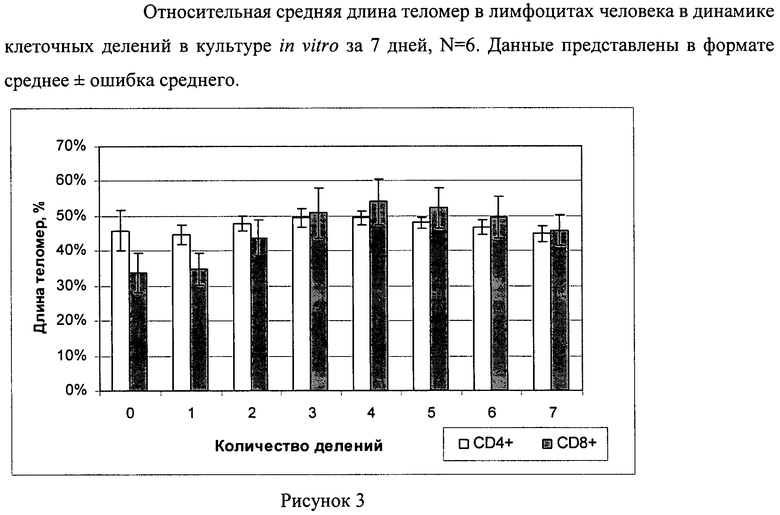
Лимфоциты окрашивают витальным красителем CFSE и культивируют в 24 луночных планшетах в CO2 инкубаторе 5% СО2 7 суток в количестве 2 млн на 1 мл полной среды (RPMI, FCS 10%, глютамин 0,3 мг/мл, гентамицин 50 мкг/мл, тиенам 25 мкг/мл) с добавлением анти-СD3 антител 1 мкг/мл (МедБиоСпектр, Россия) и ИЛ-2 100 ед/мл (Биотех, Россия). После 7 суток клетки собирают и проводят гибридизацию in situ используя мышиные анти-СD4 и анти-CD8 биотинилированные антитела (Becton Dickinson, США). Гибридизацию in situ проводят с PNA зондом, комплиментарным теломерной последовательности ДНК (СССТАА)3, меченным флуорохромом Су3 (Bio-Synthesis, Inc., USA) с конечной концентрацией 0,3 мкг/мл [10]. За контрольные клетки были взяты мышиные спленоциты линии C57B L/6 (Питомник «Рассвет», г.Томск). Анализ проводили на проточном цитофлуориметре FACS Calibur (Becton Dickinson, США) с помощью программного обеспечения Cell QuestPRO (Becton Dickinson, США). После выделения гейта лимфоцитов по прямому и боковому светорассеиванию выделяли клетки, позитивные по CD4+ (или CD8+) антигену, из которых определяли количество пиков по каналу флуоресценции витального красителя CFSE (Рисунок 1). Было определено, что за 7 суток клетки совершили максимально 7 делений. Из каждого гейта, соответствующего определенному количеству совершенных лимфоцитами делений, была определена средняя длина теломер путем определения уровня флуоресценции по каналу светимости зонда PNA-Су3; дополнительно была измерена средняя длина теломер в спленоцитах, как контрольных клетках, с использованием аналогичного зонда (Рисунок 2). Были определены относительные длины теломер в неподелившихся клетках и клетках, прошедших от 1 до 7 делений по субпопуляциям CD4+ (CD8+) лимфоцитов. Из Рисунка 3 видно, что неподелившиеся клетки имеют самые короткие теломеры, а при делении происходит постепенное удлинение теломер с пиком на 3 делении для CD4+ лимфоцитов и на 4-5 делений для CD8+ лимфоцитов. Было определено, что при культивировании in vitro после активации лимфоцитов aнти-CD3 антителами происходит удлинение теломер, с большим значением для CD8+ клеток. Полученные данные свидетельствуют о значительном влиянии активации и культивирования in vitro на молекулярные изменения в лимфоцитах.
Таким образом, полученные результаты свидетельствуют о возможности применения метода для измерения средней длины теломер в клетках в зависимости от количества пройденных ими делений. Значительным преимуществом этого метода является одномоментное разделение клеток по количеству совершенных делений, поверхностному маркеру и определение в них средней длины теломер.
Источники информации


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ мРНК КАТАЛИТИЧЕСКОЙ СУБЪЕДИНИЦЫ ТЕЛОМЕРАЗЫ (hTERT) | 2007 |
|
RU2346279C2 |
| Способ определения абсолютной длины теломер лейкоцитов с помощью метода проточной цитометрии | 2021 |
|
RU2763935C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МАРКЕРА РАЗВИТИЯ РЕВМАТОИДНОГО АРТРИТА НА ОСНОВЕ ВЫЯВЛЕНИЯ УКОРОЧЕНИЯ ОТНОСИТЕЛЬНОЙ ДЛИНЫ ТЕЛОМЕР НА ОТДЕЛЬНЫХ ХРОМОСОМАХ В Т-ЛИМФОЦИТАХ ПЕРИФЕРИЧЕСКОЙ КРОВИ | 2012 |
|
RU2522961C1 |
| СПОСОБ ИЗМЕРЕНИЯ ДЛИНЫ ТЕЛОМЕР КЛЕТОК ЛЕЙКОКОНЦЕНТРАТА ПУПОВИННОЙ КРОВИ | 2010 |
|
RU2434940C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФРАГМЕНТАЦИИ ДНК В БАКТЕРИЯХ | 2007 |
|
RU2420596C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ СТРОЕНИЯ ХРОМОСОМ | 2005 |
|
RU2471871C2 |
| СПОСОБ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ ТЕРМИНАЛЬНЫХ НУКЛЕОТИДОВ G-ЦЕПИ ТЕЛОМЕРНОЙ ДНК ЧЕЛОВЕКА С ПОМОЩЬЮ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ И ДУПЛЕКС-СПЕЦИФИЧЕСКОГО АНАЛИЗА, НАБОРЫ СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ЗОНДОВ ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА | 2012 |
|
RU2508407C9 |
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ, СПОСОБЫ И НАБОРЫ, СВЯЗАННЫЕ С УДЛИНЕНИЕМ ТЕЛОМЕР | 2014 |
|
RU2766120C2 |
| Тест-система для определения уровня хромосомной нестабильности, способ скрининга противоопухолевых лекарственных кандидатов, вызывающих хромосомную нестабильность, и способ поиска генов, контролирующих трансмиссию хромосом | 2020 |
|
RU2744383C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИТОХОНДРИАЛЬНОЙ ДИСФУНКЦИИ У БОЛЬНЫХ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНЬЮ ПЕЧЕНИ | 2018 |
|
RU2691108C1 |
Изобретение относится к области биотехнологии, а именно к способу измерения длины теломер в клетках. Способ включает измерение длины теломер методом flow-FISH в клетках, дифференцированных по количеству совершенных делений с помощью витального красителя без предварительного выделения пролиферирующих клеток, с использованием кросслинкера аминогрупп Bis(sulfosuccinimidyl)suberat (BS3). Предложенное изобретение позволяет одномоментно определять длину теломер в клетках с известным количеством совершенных делений. 3 ил.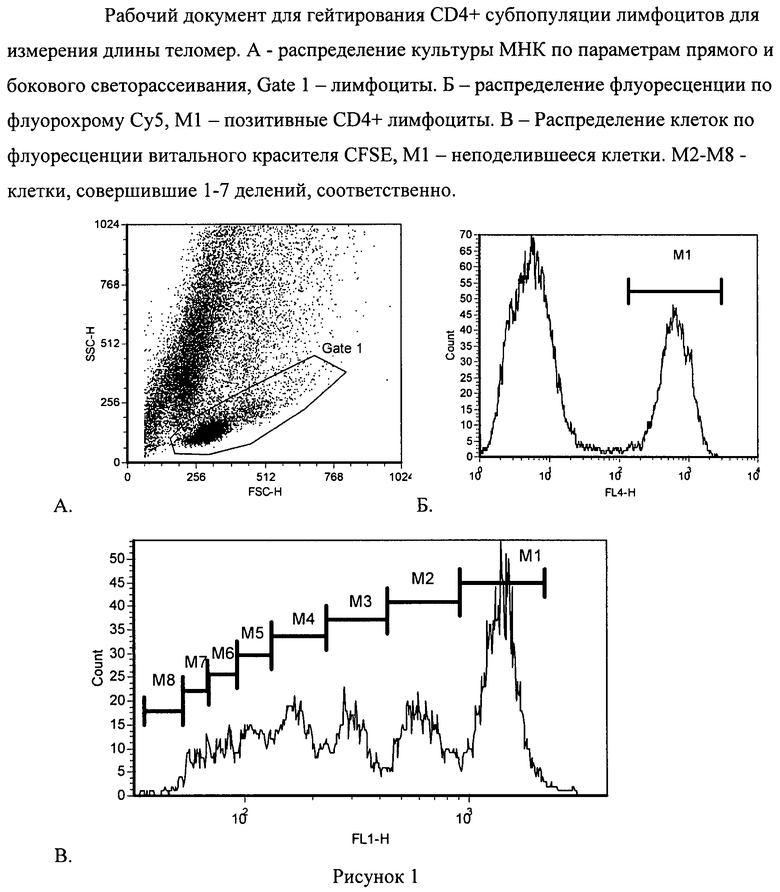
Способ измерения длины теломер в клетках, дифференцированных по количеству совершенных делений с помощью витального красителя по градуальному снижению уровня его флуоресценции, с применением метода flow-FISH (гибридизация in situ) и последующим анализом на проточном цитофлуориметре, отличающийся тем, что длину теломер измеряют в пролиферирующих клетках общей популяции одномоментно с их дифференциацией по количеству делений и дифференциацией по поверхностному маркеру, для чего используют кросслинкер аминогрупп Bis(sulfosuccinimidyl)suberat(BS3).
| WOLF D | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| SCHMID I | |||
| et al «Simultaneous Flow Cytometric Analysis of Two Cell Surface Markers, Telomere Length, and DNA Content», Cytometry, 2002, vol | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| RUFER | |||
Авторы
Даты
2012-02-27—Публикация
2010-03-24—Подача