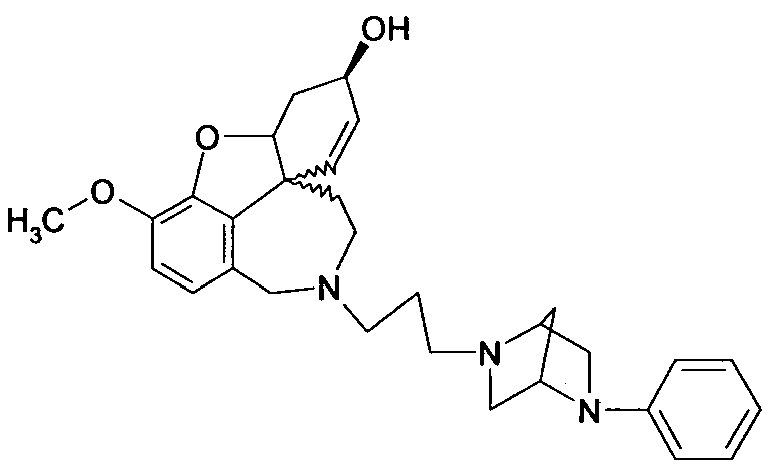
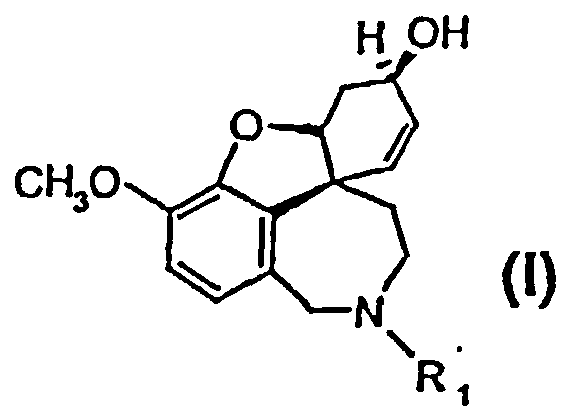
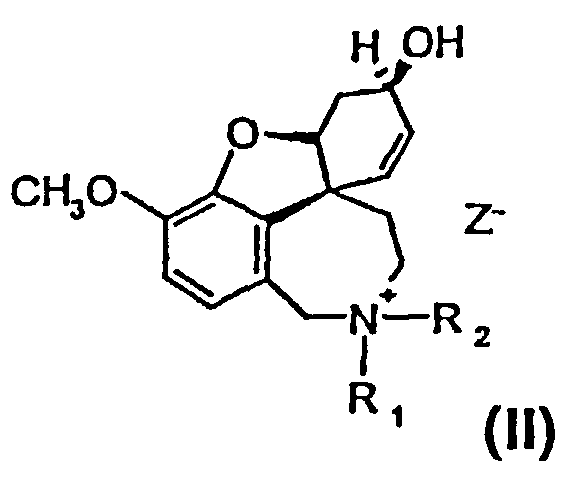
Изобретение относится к способу получения высокочистого 4а,5,9,10,11,12-гексагидро-6H-бензофуро[3a,3,2-ен][2]бензазепина, а также его производных общей формулы I и II
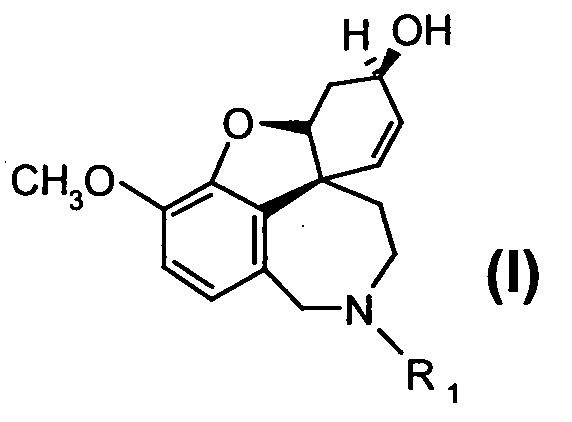
и
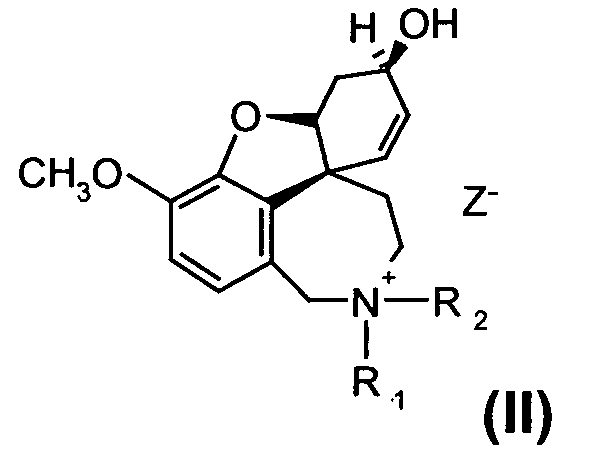
или их солей, где R1 выбран из группы, состоящей из водорода, гидрокси, алкокси, низшего алкила, который в случае необходимости замещен, по меньшей мере, одним галогеном, низшего алкенила, низшего алкинила, арила, аралкила, арилоксиалкила, формила, алкилкарбонила, арилкарбонила, аралкилкарбонила, алкилоксикарбонила, арилоксикарбонила, аралкилоксикарбонила, алкилсульфонила, аралкилсульфонила, арилсульфонила, и где R2 выбран из группы, состоящей из водорода, формила, алкила, алкенила, арила, аралкила, алкилкарбонила, арилкарбонила, аралкилкарбонила, алкилоксикарбонила, арилоксикарбонила, аралкилоксикарбонила, алкилсульфонила, арилсульфонила и аралкилсульфонила, причем Z- является анионом фармацевтически приемлемой органической кислоты или неорганическим анионом.
Галантамин является алкалоидом с высокой фармакологической активностью, встречающимся преимущественно в растениях типа амариллисовых. Особенно следует подчеркнуть его действие в качестве селективного ингибитора ацетилхолинэстеразы и связанное с этим применение для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Однако количеств, выделяемых из встречающихся в природе кавказских подснежников Galanthus Woronoyi, недостаточно, чтобы удовлетворить потребность в фармацевтическом сырье. Поэтому с конца шестидесятых годов известен синтез галантамина, который, однако, характеризуется длительными и неэкономичными путями реакции с плохими общими выходами.
Согласно международной заявке WO-A-97/110777 путем целенаправленного выбора бромнарведина в качестве исходного продукта должен быть создан экономичный путь для синтеза галантамина, если бромнарведин дебромируют ацетатом палладия(II) с добавкой трифенилфосфина. Однако полученный рацемический нарведин содержит примерно 700-800 частей/млн. палладия, который также после многократной обработки активированным углем не может быть отделен. Также при других стадиях реакции, таких как восстановление рацемического нарведина, которые описаны в международной заявке WO-A-96/12692 фирмой-заявителем, далее в конечном продукте реакции выявлено присутствие палладия несмотря на многократную обработку.
Галантамин или производные галантамина, которые содержат палладий в количестве 700-800 частей/млн., однако не пригодны для получения лекарственных средств, таких как средства для лечения болезни Альцгеймера, так как в организме, из-за остатков палладия, могут возникнуть нежелательные побочные эффекты. Согласно этому нормировано предельное значение <5 частей/млн. для орального приема лекарств, см. “Note for Guidance on specification limits for residues of metal catalysts” CPMP/SWP/QWP/4446/00.
Поэтому в основе изобретения лежит задача разработать способ, как указано выше, с помощью которого могут быть соблюдены вышеназванные нормированные предельные значения.
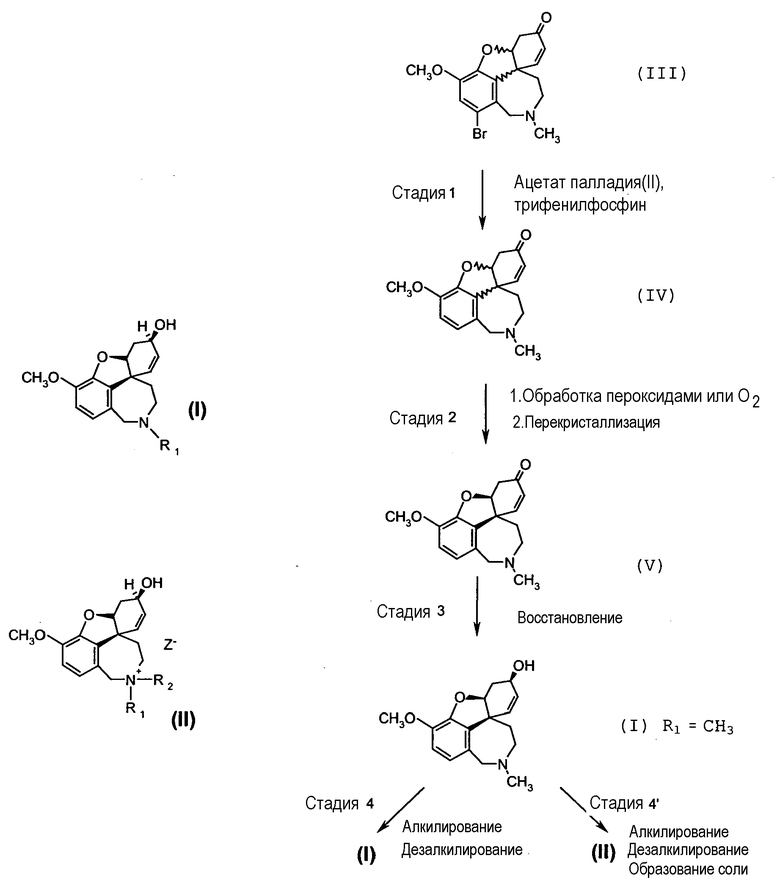
Согласно изобретению предложен способ получения вышеназванных соединений общих формул (I) или (II), причем на стадии реакции 1 дебромируют рацемический бромнарведин (III) ацетатом палладия(II) и трифенилфосфином, на стадии реакции 2 обрабатывают реакционную смесь, содержащую рацемический нарведин (IV), при контакте с кислородом и подвергают преобразованию до энантиомерно чистого нарведина (V), и причем на стадии реакции 3 путем восстановления получают энантиомерно чистый галантамин общей формулы (I) с R1, равным CH3, и на стадии реакции 4 путем алкилирования или дезалкилирования получают соединения общей формулы (I), или на стадии реакции 4' путем алкилирования и дезалкилирования, а также последующего образования соли получают соединения общей формулы (II).
Альтернативно предложен способ получения вышеназванных соединений общих формул (I) или (II), причем на стадии реакции 1 дебромируют рацемический бромнарведин (III) ацетатом палладия (II) и трифенилфосфином, на стадии реакции 2 обрабатывают реакционную смесь, содержащую рацемический нарведин (IV), с использованием пероксидов и подвергают преобразованию до энантиомерно чистого нарведина (V), и причем на стадии реакции 3 путем восстановления получают энантиомерно чистый галантамин общей формулы (I), где R1 означает CH3, и на стадии реакции 4 путем алкилирования или дезалкилирования получают соединения общей формулы (I), или на стадии реакции 4' путем алкилирования и дезалкилирования, а также последующего образования соли получают соединения общей формулы (II).
Предпочтительные варианты осуществления способа согласно изобретению описаны в зависимых пунктах формулы изобретения.
Далее изобретение относится к энантиомерно чистому нарведину общей формулы (V), который получают путем проведения стадии реакции 1, а также стадии реакции 2, и остаточная доля палладия составляет менее 26 частей/млн., предпочтительно менее 24 частей/млн., особенно предпочтительно менее 14 частей/млн.
Далее изобретение относится к энантиомерно чистому галантамину общей формулы (I), где R1 означает CH3, который получают путем проведения стадий синтеза 1-3 с последующим проведением одной или нескольких соответствующих стадий очистки, предпочтительно перекристаллизации, и остаточная доля палладия составляет менее 5 частей/млн.
Далее изобретение относится к производным галантамина общих формул (I) и (II), которые получают способом со стадиями синтеза 1-4 или 4', а также соответствующими последующими стадиями очистки, предпочтительно перекристаллизации, и остаточная доля палладия составляет менее 5 частей/млн.
Далее изобретение относится к применению энантиомерно чистого галантамина для получения лекарственных средств для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера.
Также изобретение относится к применению высокочистых производных галантамина общих формул (I) и (II) для получения лекарственных средств для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера.
Изобретение подробно поясняется далее с помощью примеров выполнения для осуществления изобретения, причем стадии способа рассматривают согласно схеме реакций:
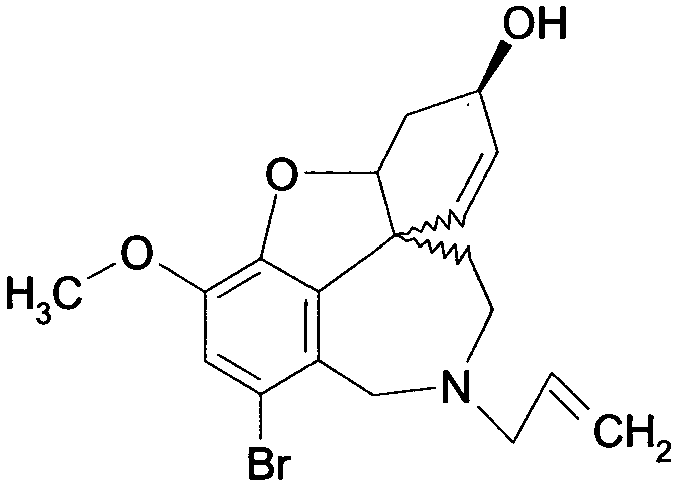
Стадия 1: Рацемический бромнарведин общей формулы (III) растворяют в ДМФА, смешивают с NaCO2H, PPH3, ацетатом палладия(II), а также гидроксидом натрия. Эту реакционную смесь нагревают до 94°C и шесть часов выдерживают при этой температуре, причем за ходом реакции следят с помощью хроматографии. Затем реакционную смесь обрабатывают, причем ДМФА отгоняют, рацемический нарведин (IV) осаждают путем добавления воды и отделяют.
Стадия 2.1: Полученный рацемический нарведин (IV) растворяют в смеси этанол/триэтиламин и смешивают с активированным углем и фильтровальным вспомогательным средством. Смесь при интенсивном перемешивании от одного до четырех часов нагревают с обратным холодильником, причем пропускают через реактор воздушно-азотную смесь, например с 5 об.% кислорода. Неожиданно было найдено, что путем обработки активированным углем, с одной стороны, и контакте с кислородом, с другой стороны, может быть достигнуто сокращение доли палладия существенно выше 95% по сравнению с известной долей палладия, которая может быть выявлена. Это должно быть пояснено с помощью следующей таблицы:
нарведин
Из приведенных в таблице данных видно, что в рацемической смеси нарведина выявлен остаток палладия 748-813 частей/млн. Конечный продукт реакции с этой долей палладия непригоден для дальнейшего применения для получения лекарственных средств. Путем обработки реакционной смеси согласно изобретению активированным углем при одновременном контакте с кислородом палладиевый катализатор переводят в нерастворимую, окисленную форму, так что возможно отделение в области менее 26 частей/млн., предпочтительно менее 24 частей/млн., особенно предпочтительно менее 14 частей/млн.
В альтернативном варианте способа полученный рацемический нарведин (IV) также растворяют в смеси этанол/триэтиламин и смешивают с активированным углем и фильтровальным вспомогательным средством; однако к этой смеси затем при интенсивном перемешивании медленно добавляют 0,1-1 вес.% пероксида водорода и от одного до четырех часов нагревают с обратным холодильником. Неожиданно также в этом варианте способа было найдено, что путем обработки активированным углем, с одной стороны, и с использованием пероксида водорода, с другой стороны, после фильтрации доля палладия может быть существенно уменьшена по сравнению с известной долей палладия, которая может быть выявлена. Измеренные значения приведены в следующей таблице:
нарведин
В следующем варианте способа к смеси, состоящей из рацемического нарведина (IV), этанола, триэтиламина, активированного угля и фильтровального вспомогательного средства, при интенсивном перемешивании медленно добавляют 0,1-1 вес.% метахлорпербензойной кислоты (MCPBA) и от одного до четырех часов нагревают с обратным холодильником. В этом варианте способа также неожиданно оказалось, что путем обработки активированным углем, с одной стороны, и с использованием метахлорпербензойной кислоты, с другой стороны, после фильтрации доля палладия существенно уменьшена по сравнению с известной долей палладия, которая может быть выявлена. Измеренные значения приведены в следующей таблице:
нарведин
(обработан MCPBA)
Стадия 2.2: Реакционную смесь, полученную на стадии 2.1, охлаждают и затравливают кристаллами (-)нарведина, так что получают энантиомерно чистый (-)нарведин общей формулы (V). Стадия 3: Полученный после перекристаллизации энантиомерно чистый (-)нарведин общей формулы (V) смешивают, как описано в международной заявке WO-A-96/12692, с одномолярным раствором L-селектрида в ТГФ, дают перемешиваться один час, смешивают с этанолом и выпаривают. Путем энантиомерно селективного восстановления получают энантиомерно чистый галантамин общей формулы (I), где R1=CH3. Одно- или многократной перекристаллизацией добиваются остаточной доли палладия менее 5 частей/млн. Это возможно, так как путем обработки кислородом или пероксидом согласно стадии синтеза 2.1 палладиевый катализатор переводят в нерастворимую, окисленную форму, которую можно легко отделить путем очистки перекристаллизацией.
Стадия 4: Соединение общей формулы (I), где R1 означает CH3, может быть подвергнуто дезалкилированию или дальнейшему алкилированию, чтобы таким образом остатки R1 или R2 ввести в атом азота.
Стадия 4': Стадию 4' проводят аналогично стадии 4 с тем отличием, что следующее преобразование происходит с кислотой, как, например, гидробромид, с образованием фармацевтически приемлемых солей с противоионом Z-, как, например, бромид. Также соединения общей формулы (I) или (II) могут быть, если необходимо, затем очищены перекристаллизацией, так что достигают остаточной доли палладия менее 5 частей/млн.
Вышеприведенные примеры выполнения проводят так, что R1 или R2 представляют образцы заместителей, в которых алифатические углеродные заместители характеризуются числом атомов углерода в диапазоне от 1 до 6, и ароматический остаток арил выбирают из группы, включающей фурил, фенил, пиридинил, пиридазил, пиразинил, пиразолил, имидазил и пиразил. Этот примерный выбор однако не оценивается как ограничение объема правовой охраны.
Фармакологическое действие соединений общих формул (I) и (II) может быть подтверждено с помощью измеренных значений IC50, так как это та концентрация, при которой достигается 50%-ное ингибирование ацетилхолинэстеразы (AChEI) или бутирилхолинэстеразы (BuChEI). Удовлетворительные значения ингибирования (см. следующий обзор (таблицу)) являются следующим признаком того, что соединения общих формул (I) или (II) пригодны для получения лекарственных средств для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера.
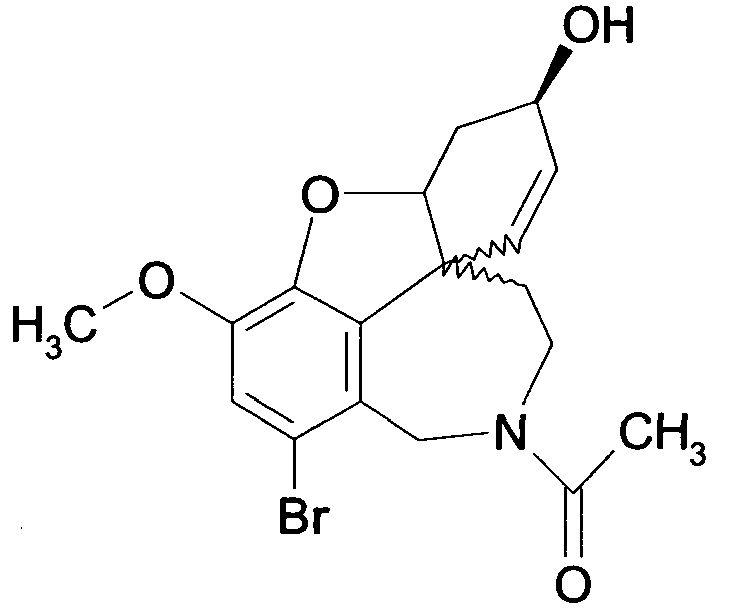
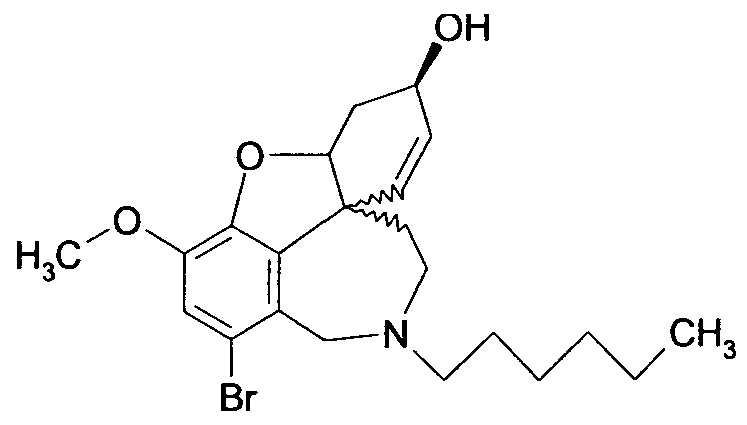
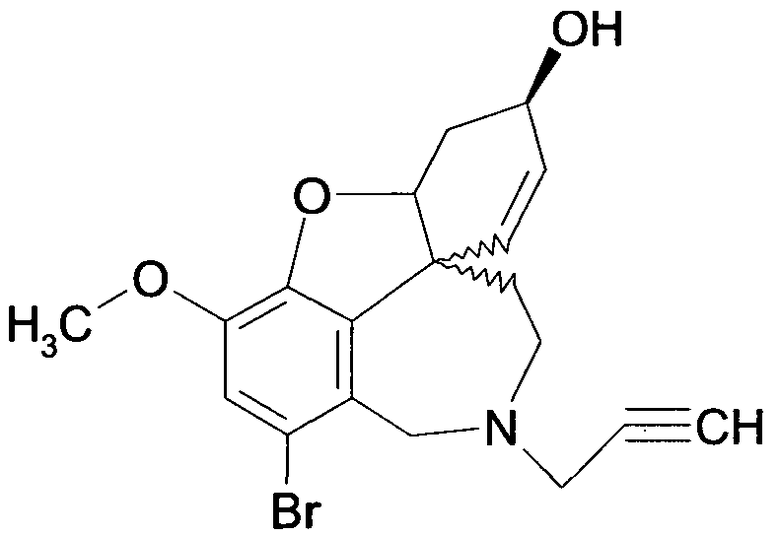
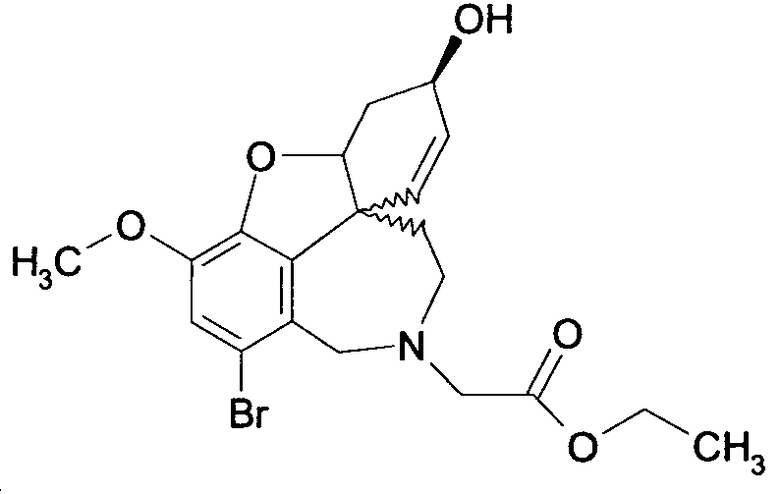
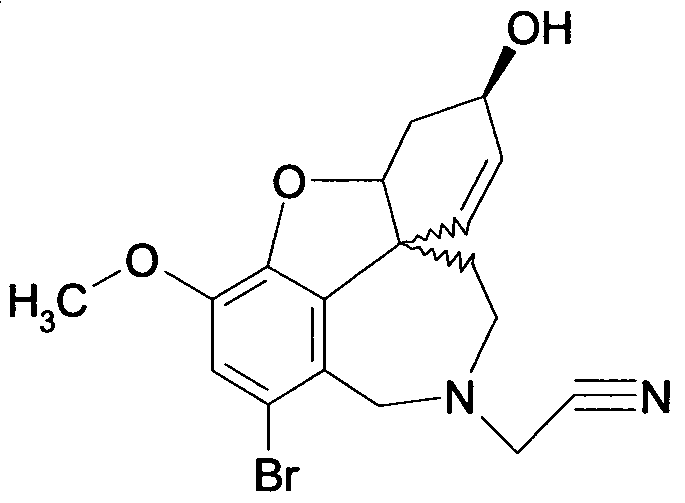
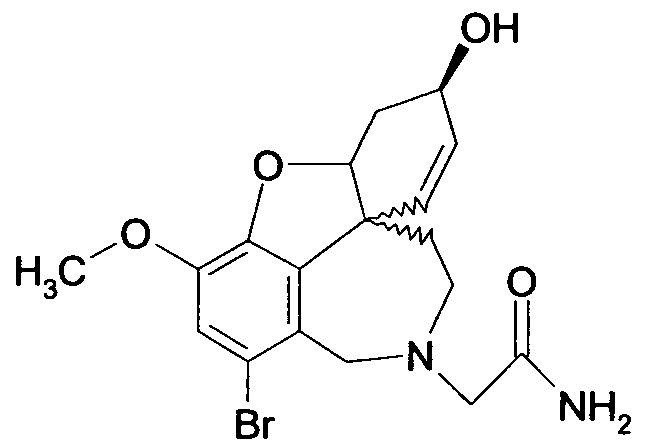
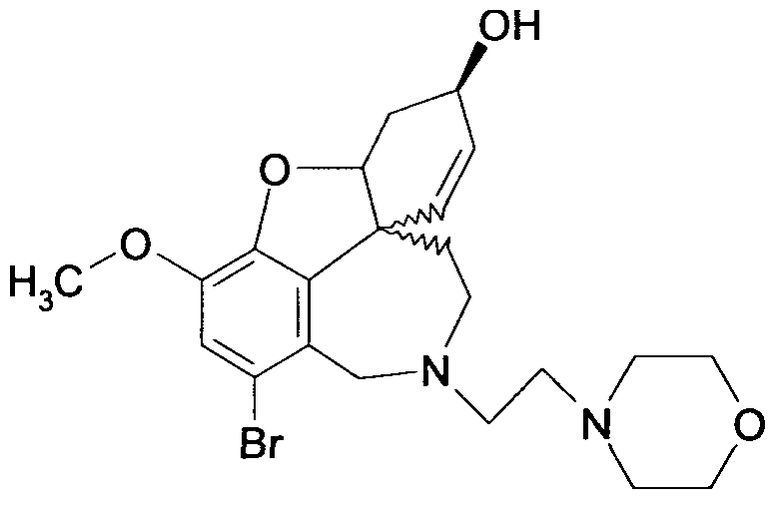
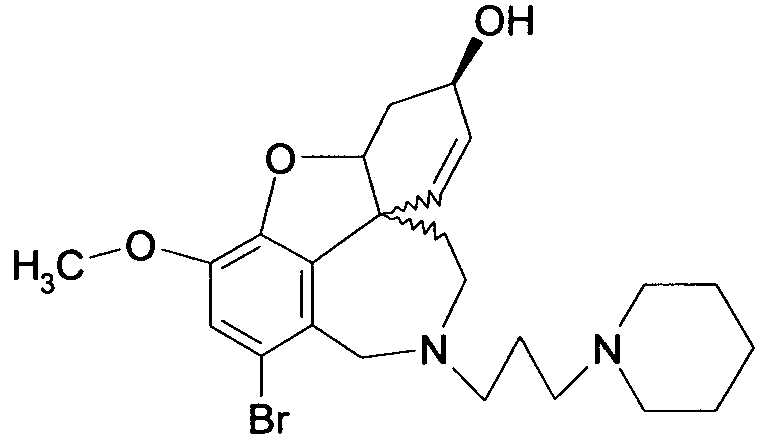
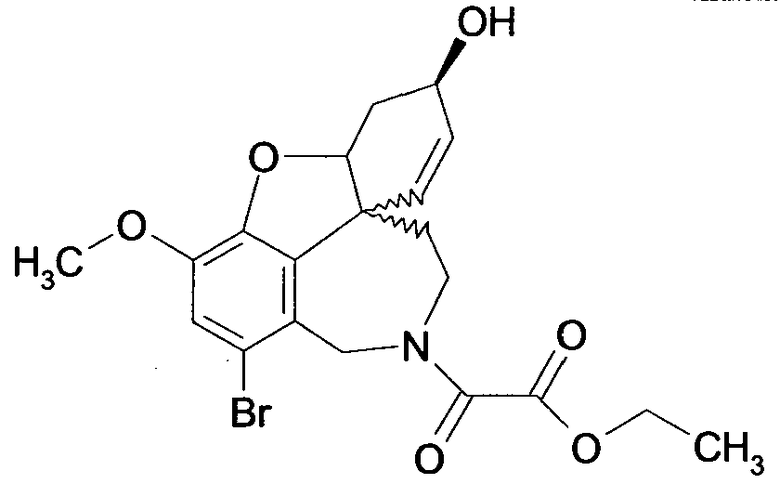
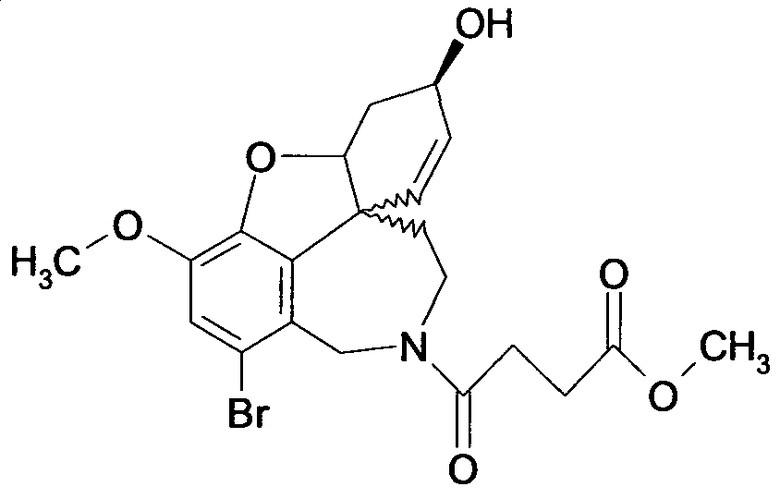
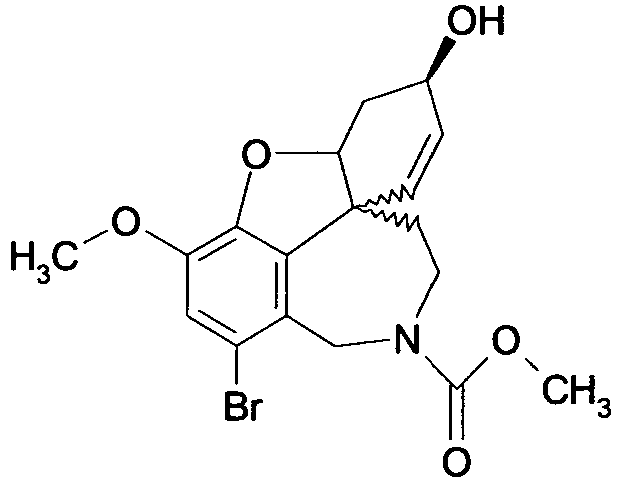
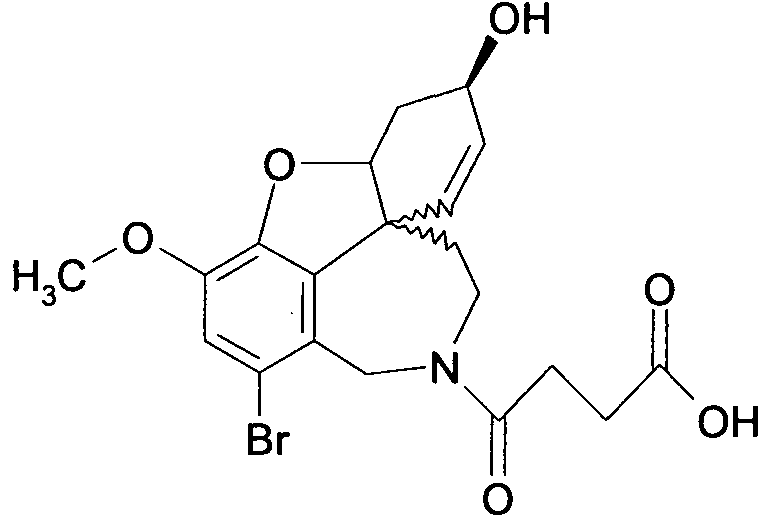
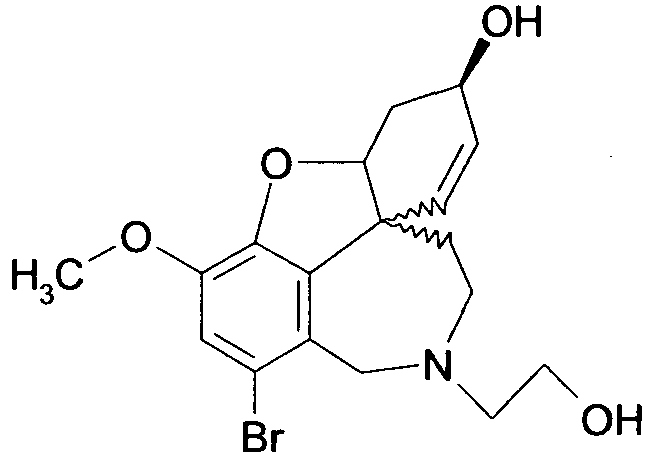
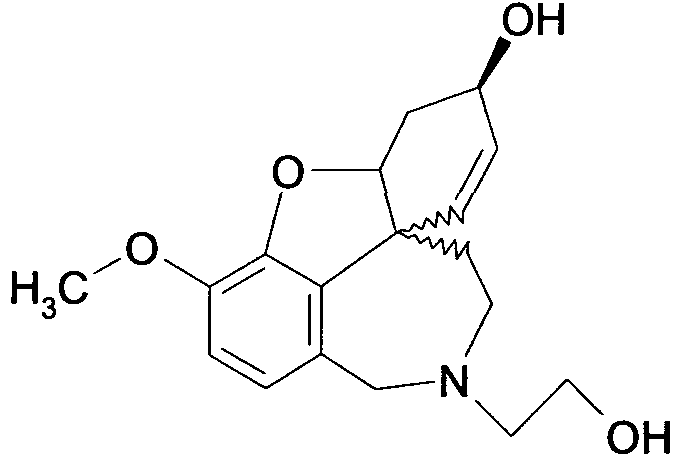
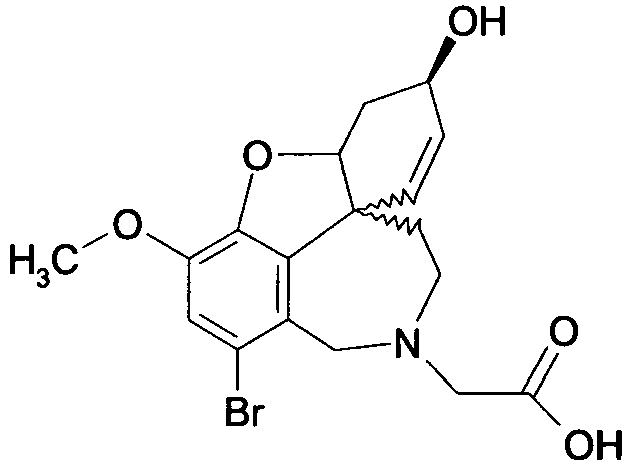
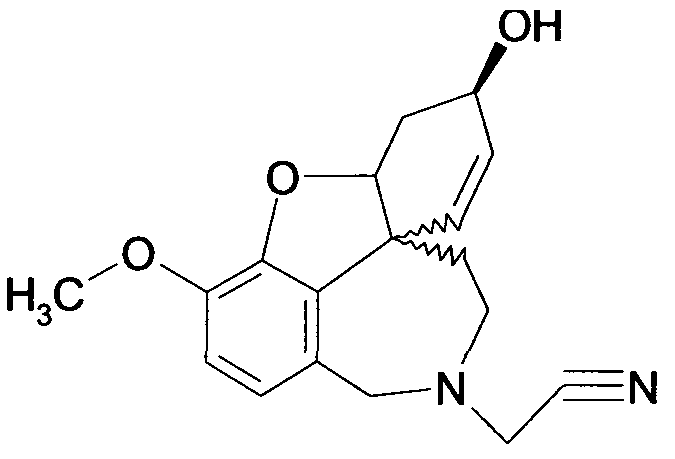
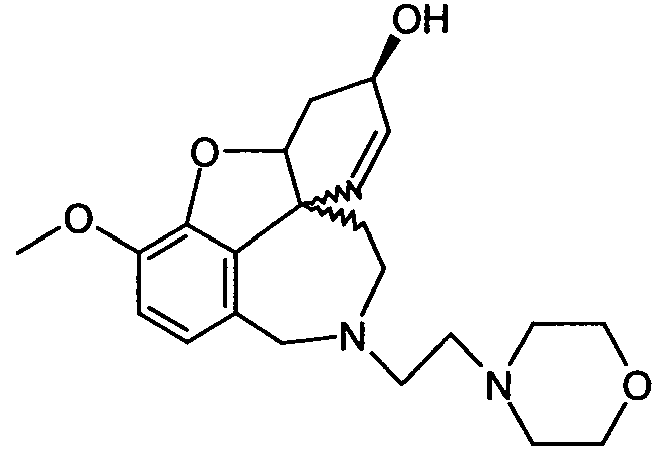
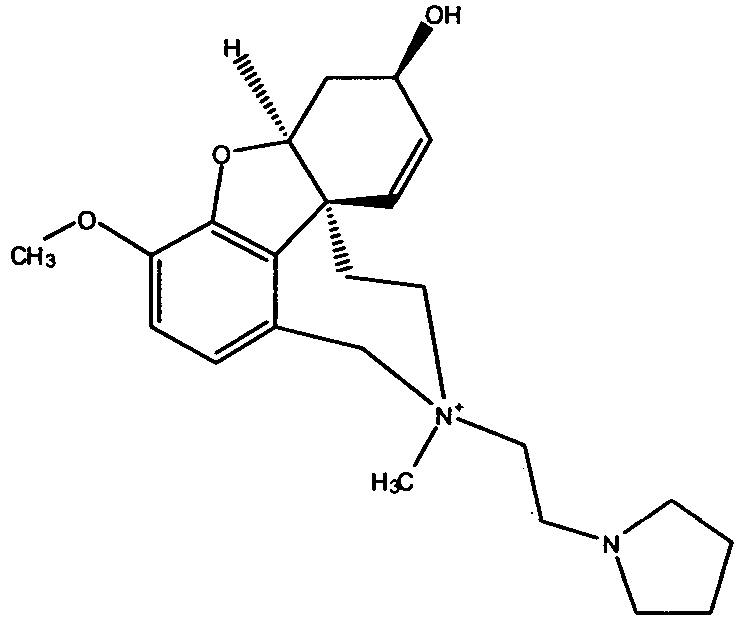
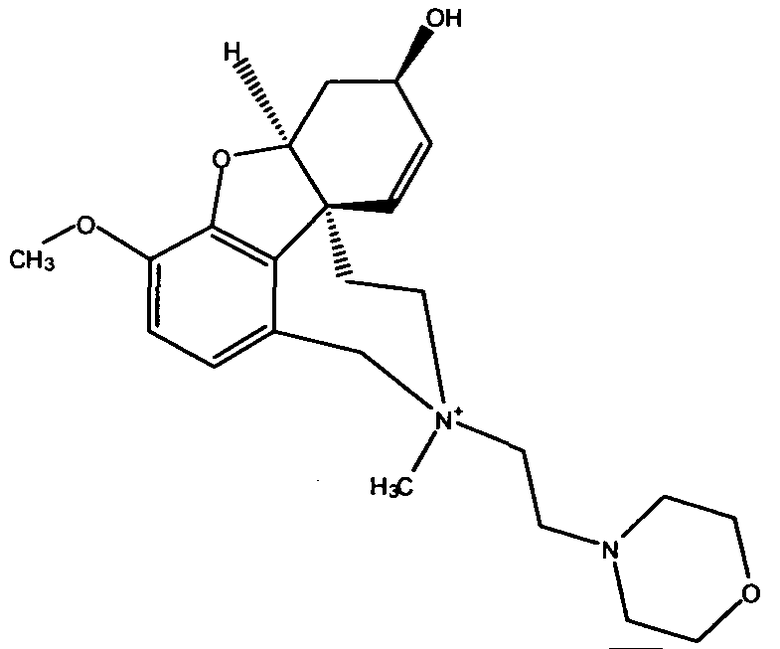
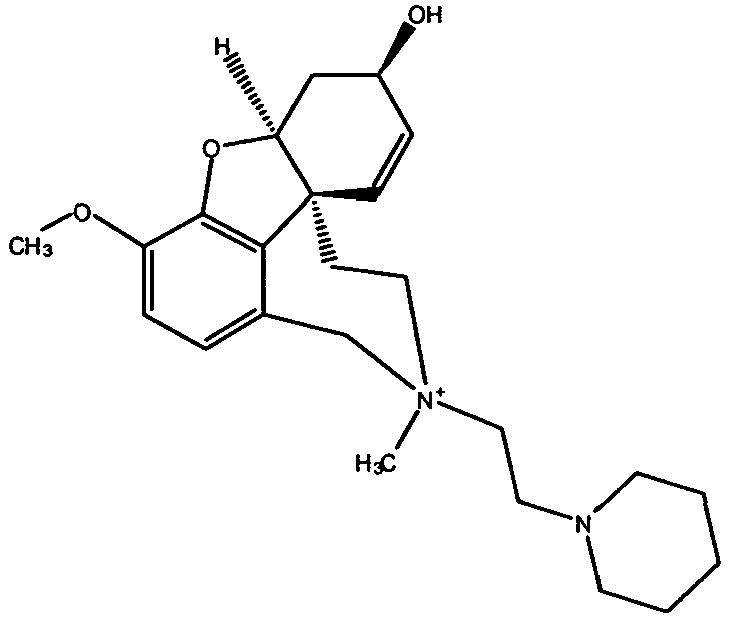
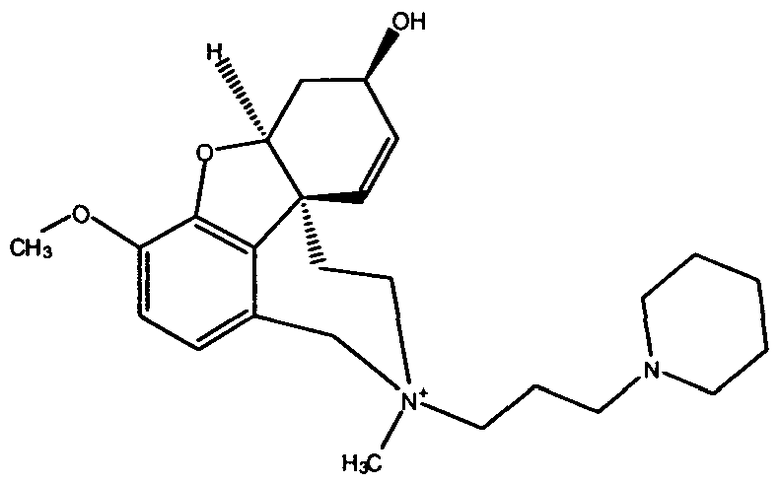
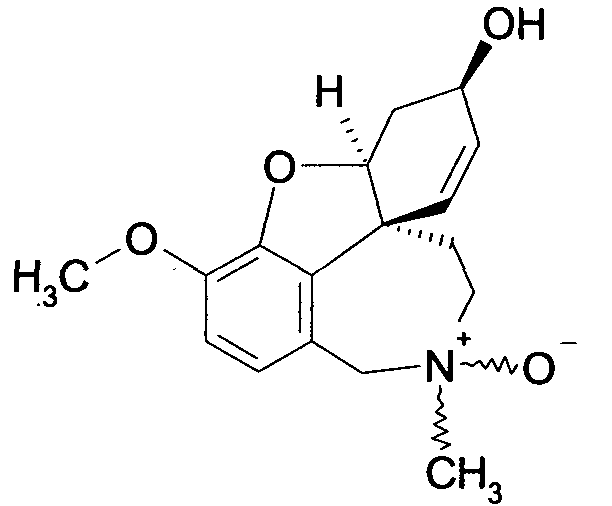
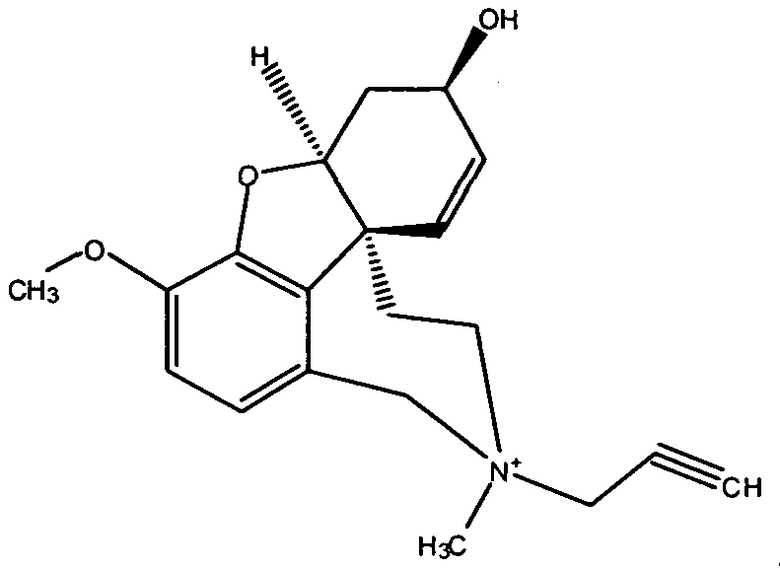
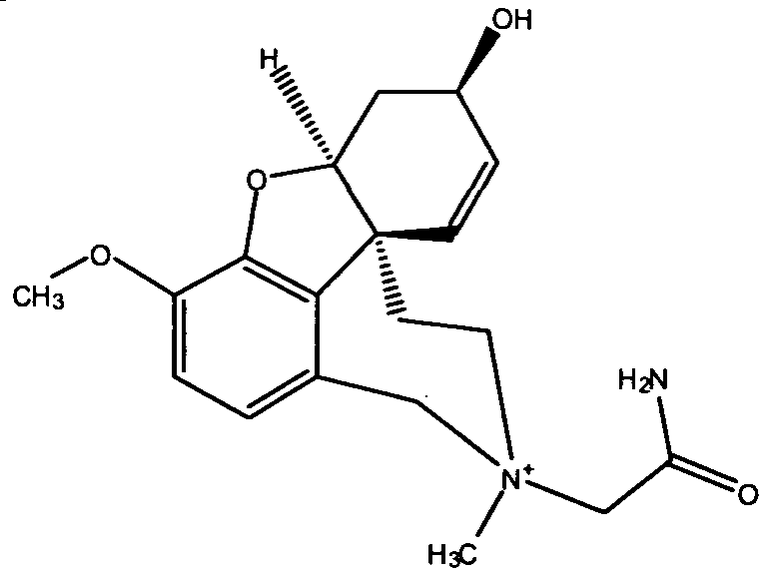
Обобщая, можно сказать, что обработкой согласно изобретению дебромированного нарведина, полученного путем катализа палладием, а именно путем контакта с кислородом или пероксидами, используемый палладиевый катализатор переводится в нерастворимую оксидную форму и может быть отделен простым способом. Путем этой обработки реакционной смеси, абсолютно правильно проведенной безопасными техническими нормами, неожиданным образом удалось сократить остаток палладия ниже 5 частей/млн., так что смогли получить высокочистый галантамин или высокочистые производные галантамина, которые непосредственно могут быть использованы для получения лекарственных средств, например лекарственных средств для лечения болезни Альцгеймера.
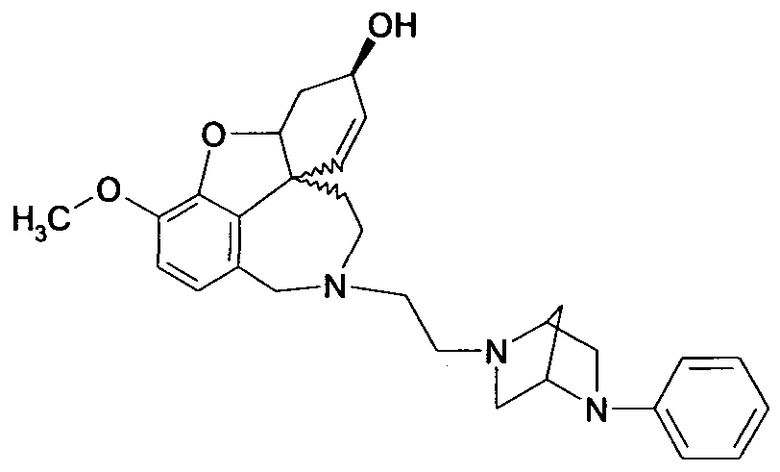
Изобретение относится к способу получения высокочистого 4а,5,9,10,11,12-гексагидро-6Н-бензофуро[3а,3,2-ен][2]бензазепина, а также его производных общей формулы I и II
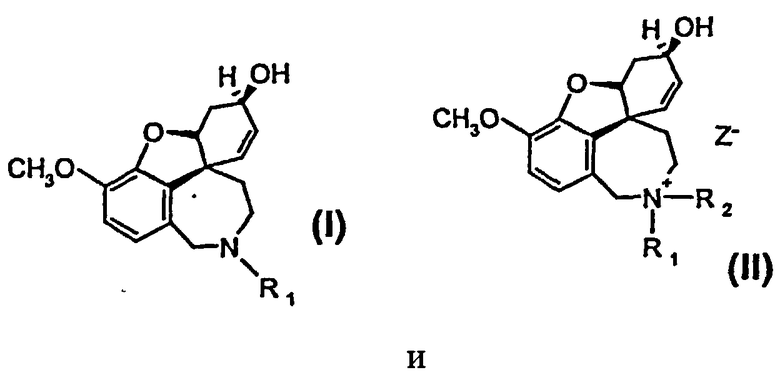
исходят из рацемического бромнарведина, который дебромируют при катализе палладием. При этом изобретение предусматривает обработку реакционной смеси, происходящую в присутствии кислорода или пероксидов, так что палладиевый катализатор переводят в нерастворимую, легко отделяемую форму. Следующие реакции происходят путем восстановления энантиомерно чистого нарведина до энантиомерно чистого галантамина, причем затем его алкилируют или дезалкилируют, так что достигают соответствующего замещения в атоме азота кольца. Путем последующей очистки, такой как перекристаллизация, достигают остаточной доли палладия ниже 5 частей/млн., так что возможно непосредственное применение в качестве фармацевтического сырья. 2 н. и 4 з.п.ф-лы, 4 табл.
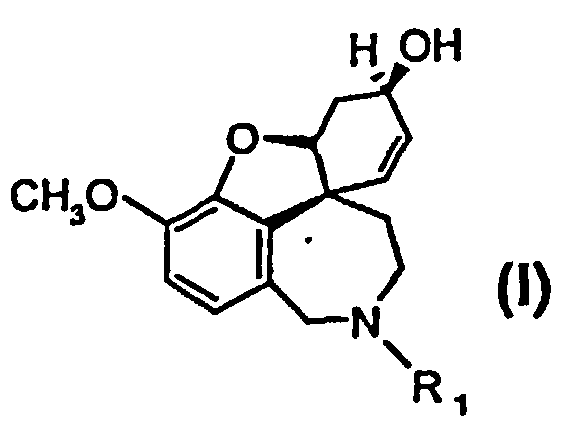
1. Способ получения высокочистого 4а,5,9,10,11,12-гексагидро-6Н-бензофуро[3а,3,2-ен][2]бензазепина, а также его производных общей формулы I и II
и
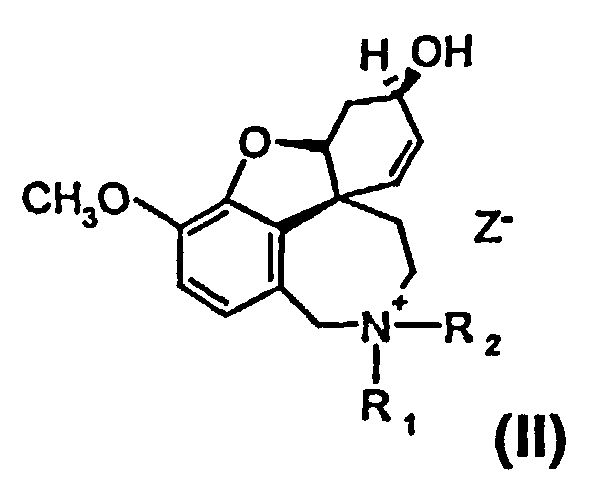
или их солей, где R1 выбран из группы, состоящей из водорода, гидрокси, алкокси, низшего (C1-С6) алкила, который в случае необходимости замещен, по меньшей мере, одним галогеном, (С1-С6)низшего алкенила, (С1-С6)низшего алкинила, арила, аралкила, арилоксиалкила, формила, алкилкарбонила, арилкарбонила, аралкилкарбонила, алкилоксикарбонила, арилоксикарбонила, аралкилоксикарбонила, алкилсульфонила, аралкилсульфонила, арилсульфонила, и где R2 выбран из группы, состоящей из водорода, формила, алкила, алкенила, арила, аралкила, алкилкарбонила, арилкарбонила, аралкилкарбонила, алкилоксикарбонила, арилоксикарбонила, аралкилоксикарбонила, алкилсульфонила, арилсульфонила и аралкилсульфонила, и где Z- является анионом фармацевтически приемлемой органической кислоты или неорганическим анионом, отличающийся тем, что на стадии реакции 1 дебромируют рацемический бромнарведин (III)
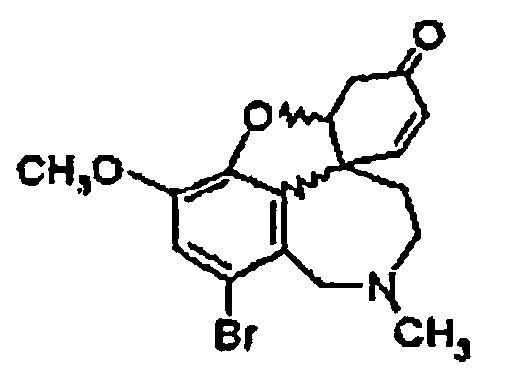
ацетатом палладия(II) и трифенилфосфином, на стадии реакции 2 обрабатывают реакционную смесь, содержащую рацемический нарведин (IV),
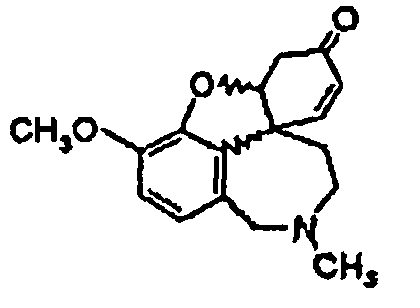
при контакте с кислородом и подвергают преобразованию до энантиомерно чистого нарведина (V),
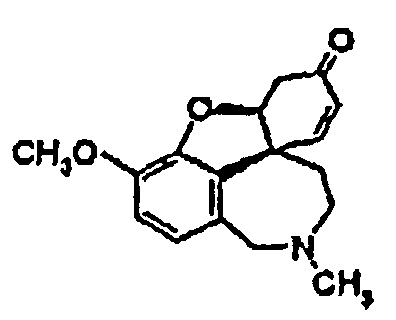
где используют воздушно-азотную смесь в присутствии активированного угля, и где на стадии реакции 3 путем восстановления получают энантиомерно чистый галантамин общей формулы (I), где R1 означает СН3, и на стадии реакции 4 путем алкилирования или дезалкилирования получают соединения общей формулы (I), или на стадии реакции 41 путем алкилирования и дезалкилирования, а также последующего образования соли получают соединения общей формулы (II).
2. Способ по п.1, отличающийся тем, что после стадии реакции 3 и/или стадии реакции 4 проводят одну или несколько последующих стадий очистки, предпочтительно перекристаллизации.
3. Способ получения высокочистого 4а,5,9,10,11,12-гексагидро-6Н-бензофуро[3а,3,2-ен][2]бензазепина, а также его производных общей формулы I и II
и
или их солей, где R1 выбран из группы, состоящей из водорода, гидрокси, алкокси, низшего (C1-С6) алкила, который в случае необходимости замещен, по меньшей мере, одним галогеном, низшего (С1-С6) алкенила, низшего (C1-С6) алкинила, арила, аралкила, арилоксиалкила, формила, алкилкарбонила, арилкарбонила, аралкилкарбонила, алкилоксикарбонила, арилоксикарбонила, аралкилоксикарбонила, алкилсульфонила, аралкилсульфонила, арилсульфонила, и где R выбран из группы, состоящей из водорода, формила, алкила, алкенила, арила, аралкила, алкилкарбонила, арилкарбонила, аралкилкарбонила, алкилоксикарбонила, арилоксикарбонила, аралкилоксикарбонила, алкилсульфонила, арилсульфонила и аралкилсульфонила, и где Z- является анионом фармацевтически приемлемой органической кислоты или неорганическим анионом, отличающийся тем, что на стадии реакции 1 дебромируют рацемический бромнарведин (III)
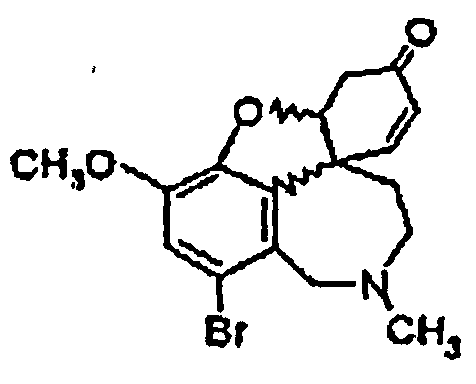
ацетатом палладия(II) и трифенилфосфином, на стадии реакции 2 обрабатывают реакционную смесь, содержащую рацемический нарведин (IV),
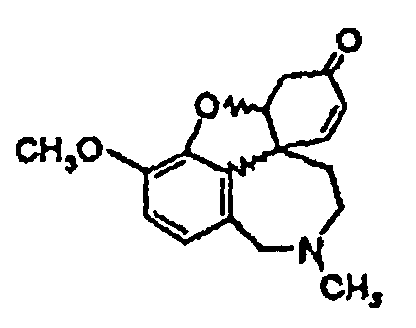
в присутствии пероксидов и активированного угля и подвергают преобразованию до энантиомерно чистого нарведина (V),
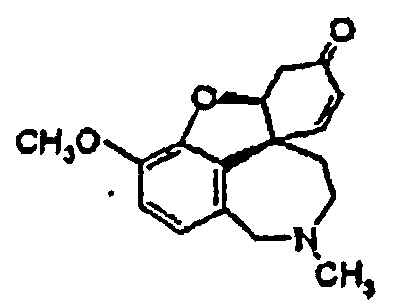
причем на стадии реакции 3 путем восстановления получают энантиомерно чистый галантамин общей формулы (I), где R1 означает СН3, и на стадии реакции 4 путем алкилирования или дезалкилирования получают соединения общей формулы (I), или на стадии реакции 4' путем алкилирования и дезалкилирования, а также последующего образования соли получают соединения общей формулы (II).
4. Способ по п.3, отличающийся тем, что на стадии реакции 2 в качестве пероксидов используют неорганические пероксиды, предпочтительно пероксид водорода.
5. Способ по п.3, отличающийся тем, что на стадии реакции 2 в качестве пероксидов используют органические пероксиды, предпочтительно метахлорпербензойную кислоту.
6. Способ по п.3, отличающийся тем, что после стадии реакции 3 и/или стадии реакции 4 проводят одну или несколько последующих стадий очистки, предпочтительно перекристаллизации.
| WO 9612692 А, 02.05.1996 WO 9711077 А, 27.03.1997 | |||
| Czollner L | |||
| et al | |||
| Tetrahedron Letters, 1998, v.39, no.15, p.2087-2088 | |||
| Shien W-C, et al | |||
| J | |||
| jf Organic Chemistry, 1994, v.59, no.18, p.5463-5465 | |||
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4А,5,9,10,11,12-ГЕКСАГИДРО-6Н-БЕНЗОФУРО(3А,3,2-EF)(2)БЕНЗАЗЕПИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1995 |
|
RU2146258C1 |
| RU 98102930 A, 10.11.1999. | |||
Авторы
Даты
2012-03-10—Публикация
2008-02-14—Подача