ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка является международной заявкой и по ней испрашивается приоритет и преимущество приоритет по предварительной заявке U.S. № 62/780688, поданной 17 декабря 2018 г., содержание которой во всей полноте включено в настоящее изобретение посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к способу получения конкретных замещенных конденсированных с гетероциклом гамма-карболинов, описанных в настоящем изобретении, которые применимы для лечения заболеваний, включающих 5-HT2A рецептор, переносчик серотонина (SERT), пути, включающие сигнальные системы дофаминового рецептора D1 и/или D2 и/или μ-опиоидный рецептор.
УРОВЕНЬ ТЕХНИКИ
[0002] Известно, что замещенные конденсированные с гетероциклом гамма-карболины являются агонистами или антагонистами 5-HT2 рецепторов, в частности, 5-HT2A рецепторов, для лечения нарушений центральной нервной системы. Эти соединения раскрыты в патентах U.S. 6548493; 7238690; 6552017; 6713471; 7183282; U.S. RE39680 и U.S. RE39679 в качестве новых соединений применимых для лечения нарушений, связанных с модулированием рецептора 5-HT2A, таких как ожирение, состояние тревоги, депрессия, психоз, шизофрения, нарушения сна, сексуальные нарушения мигрень, патологические состояния, связанные с головной болью, социофобиями, желудочно-кишечные нарушения, такие как дисфункция перистальтики желудочно-кишечного тракта и ожирение. В патенте U.S. 8309722 и в патенте U.S. 7081455 также раскрыты способы получения замещенных конденсированных с гетероциклом гамма-карболинов и применение этих гамма-карболинов в качестве агонистов и антагонистов серотонина, применимых для лечения и предупреждения нарушений центральной нервной системы, таких как поведение, обнаруживающее склонность к потреблению наркотиков, и нарушения сна.
[0003] Кроме того, в патенте U.S. 8598119 раскрыто применение конкретных замещенных конденсированных с гетероциклом гамма-карболинов для лечения комбинации психоза и депрессивных нарушений, а также сна, депрессивных расстройств и/или расстройств настроения у пациентов с психозом или болезнью Паркинсона. В дополнение к нарушениям, связанным с психозом и/или депрессией в этом патенте раскрыто и заявлено применение этих соединений в низкой дозе для селективного антагонистического воздействия на эти 5-HT2A рецепторы без влияния или с минимальным влиянием на дофаминовый D2 рецепторы и поэтому они применимы для лечения нарушений сна без побочных эффектов, связанных с высокой занятостью путей допамина D2, или побочных эффектов других путей (например, GABAA рецепторов), связанных с обычными седативно-снотворными средствами (например, бензодиазепинами) включая, но не ограничиваясь только ими, развитие наркотической зависимости, мышечную гипотонию, слабость, головную боль, затуманенное зрение, вертиго, тошноту, рвоту, желудочный дискомфорт, диарею, боль в суставах и боль в груди. В патенте U.S. 8648077 также раскрыты способы получения кристаллов солей присоединения этих замещенных конденсированных с гетероциклом гамма-карболинов с толуолсульфоновой кислотой.
[0004] Кроме того, предшествующие данные показывают, что указанные выше замещенные конденсированные с гетероциклом гамма-карболины частично могут действовать посредством антагонизма к рецептору NMDA путем передачи сигналов через mTOR1 образом, сходным с образом для кетамина. Кетамин является селективным антагонистом рецептора NMDA. Кетамин действует через систему, которая не связана с обычными психогенными моноаминами (серотонин, норэпинефрин и дофамин), и поэтому является основной причиной для их намного более быстрых эффектов. Кетамин прямо оказывают антагонистическое воздействие на экстрасинаптические глутаматергические рецепторы NMDA, что также косвенно приводит к активации глутаматных рецепторов типа AMPA. Последующие эффекты включают мозговой нейротрофический фактор (BDNF) и пути киназы mTORC1. Аналогично кетамину последние данными показывают, что соединения, относящиеся к предлагаемым в настоящем изобретении, усиливают индуцированные NMDA и AMPA токи в пирамидальных нейронах медиальной префронтальной коры головного мозга крысы путем активации рецепторов D1, и что это связано с усилением передачи сигналов mTORC1. В международной заявке PCT/US2018/043100 раскрыты такие эффекты для некоторых замещенных конденсированных с гетероциклом гамма-карболинов и связанные с ними терапевтические показания.
[0005] В публикации US 2017/319580 раскрыты дополнительные замещенные конденсированные гамма-карболины. Эти новые соединения сохраняет значительную часть уникальной фармакологической активности раскрытых ранее соединений, включая ингибирование серотонинового рецептора, ингибирование SERT и модулирование дофаминового рецептора. Однако неожиданно установлено, что эти соединения также обладают значительной активностью по отношению к мю-опиатным рецепторам. Аналоги этих новых соединений также раскрыты, например, в публикациях WO 2018/126140 и WO 2018/126143.
[0006] Например, соединение формулы A, указанное ниже является активным антагонистом серотонинового 5-HT2A рецептора частичным агонистом мю-опиатного рецептора или смещенным агонистом. Это соединение также взаимодействует с дофаминовыми рецепторами, в частности, с дофаминовыми D1 рецепторами.
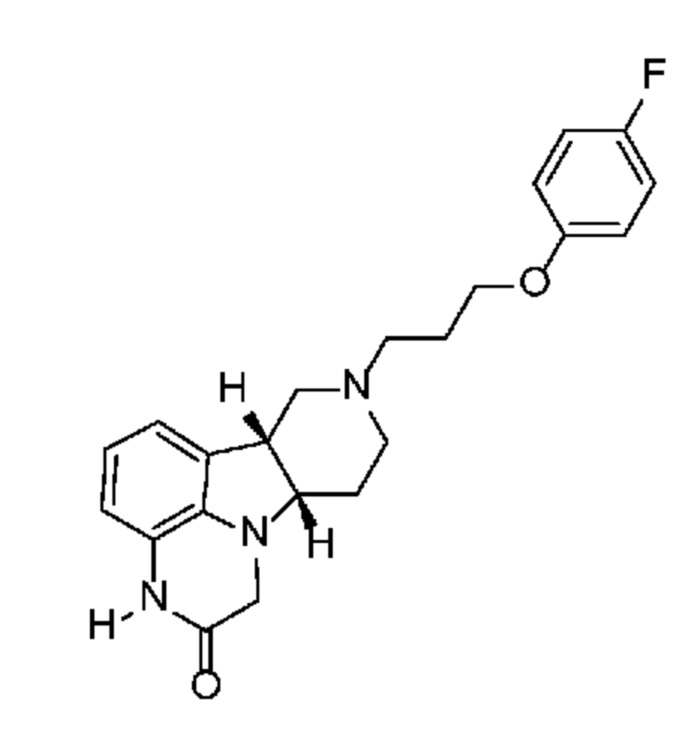
Формула A
Также предполагается, что соединение формулы A благодаря своей активности по отношению к D1 рецептору также может усиливать опосредуемую с помощью NMDA и AMPA передачу сигналов по пути mTOR. Таким образом, соединение формулы A также применимо для лечения или профилактики нарушений центральной нервной системы, но в данной области техники требуются дополнительные соединения, обладающие этим уникальным биохимическим и фармакологическим профилем, в особенности такие, которые обладают немного измененными фармакологическими и фармакокинетическими профилями по сравнению с соединением формулы A.
[0007] Получение замещенных конденсированных с гетероциклом гамма-карболинов в свободных или фармацевтически приемлемых солевых формах, промежуточных продуктов, использующихся для их получения, например, энантиомерно чистых промежуточных продуктов типа 2,3,4,4a,5,9b-гексагидро-1H-пиридо[4,3-b]индола, способы получения указанных промежуточных продуктов и указанных замещенных конденсированных с гетероциклом гамма-карболинов раскрыты в патентах U.S. 7183282, 8309722, 8779139, 9315504 и 9751883, полные содержания которых включены в настоящее изобретение в качестве ссылки.
[0008] Настоящее изобретение относится к способам получения конкретных конденсированных гамма-карболинов с высокими чистотой, выходом и экономической эффективностью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0009] Настоящее изобретение относится к улучшенным способам получения замещенных конденсированных с гетероциклом гамма-карболинов в свободных или фармацевтически приемлемых солевых формах, промежуточных продуктов, использующихся для их получения, например, энантиомерно чистых промежуточных продуктов типа 2,3,4,4a,5,9b-гексагидро-1H-пиридо[4,3-b]индола, и способам получения указанных промежуточных продуктов и указанных замещенных конденсированных с гетероциклом гамма-карболинов раскрыты в настоящем изобретении.
[00010] Замещенные конденсированные с гетероциклом гамма-карболины и их фармацевтически приемлемые соли, полученные в настоящем изобретении, описываются остовными структурами, приведенными в формуле 1J и 2J:
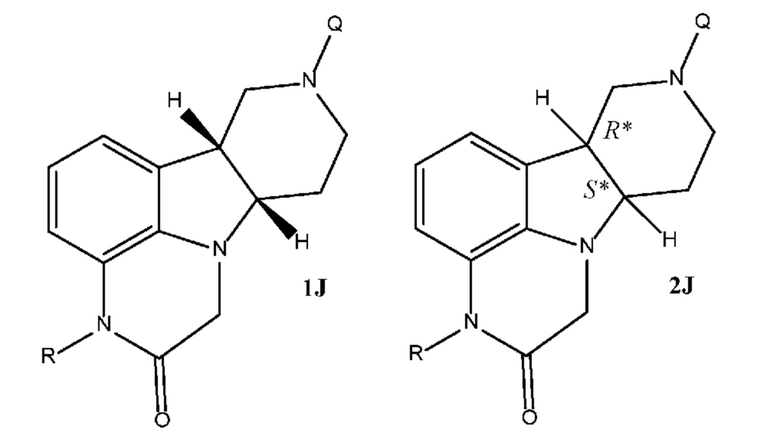
где R выбран из H и C1-4 алкила, и Q выбран из 4-(4-фторфенил)-4-оксобутила и 3-(4-фторфенокси)пропила. Следует понимать, что для соединения формулы 2J (и аналогично формулы 2 везде в настоящем изобретении) приведенная стереохимическая конфигурация является абсолютной стереохимической конфигурацией, которая, например, соответствует 4aS, 9bR конфигурации для соединения формулы 2I и 6bR, 10aS конфигурации для соединения формулы 2J. В отличие от этого следует понимать, что для соединения формулы 1J (и аналогично формулы 1’s везде в настоящем изобретении) приведенная стереохимическая конфигурация является относительной стереохимической конфигурацией для двух соседних стереоцентров. Так, например, для соединения формулы 1J, приведенного выше, формула описывает соединения, обладающие 6bR, 4aS конфигурацией, и соединения, обладающие 6bS, 4aR конфигурацией, или их комбинации.
[00011] В некоторых вариантах осуществления настоящее изобретение относится к соединениям формулы 1I, приведенным ниже в свободной форме или в форме соли, которые применимы, например, в качестве промежуточных продуктов для получения соединений формулы 1J:
Соединения формулы 1I:
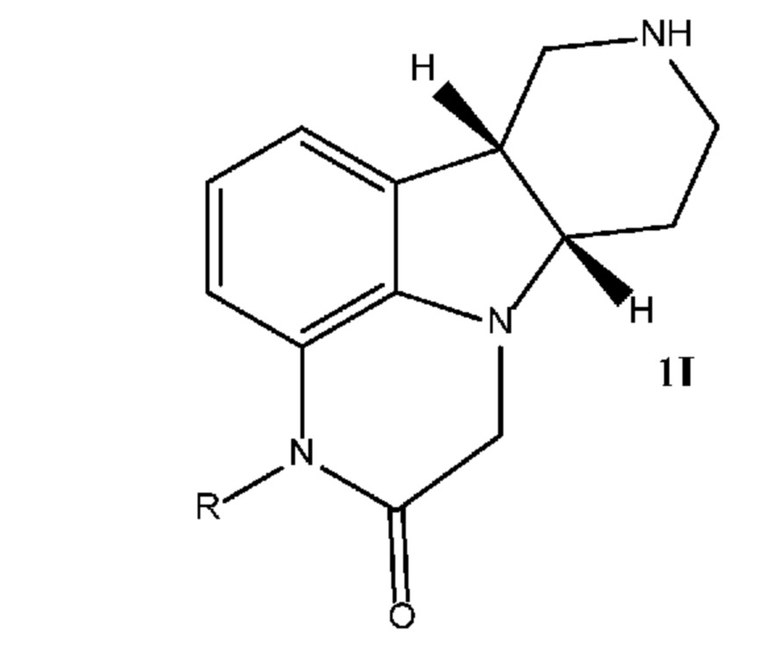
где:
R означает H или C1-4 алкил (например, метил);
в свободной форме или в форме соли, например, в форме соли присоединения с кислотой, необязательно в твердой форме.
[00012] В некоторых вариантах осуществления настоящее изобретение также относится к соединениям следующих формул:
1.1.Формула 1I, где R означает C1-C4 алкил (например, метил).
1.2.Формула 1I, где R означает H.
1.3.Формула 1I, 1.1 или 1.2, где соединение находится в форме свободного основания.
1.4.Формула 1I, 1.1 или 1.2, где соединение находится в форме соли присоединения с кислотой.
1.5.Формула 1.4, где форма соли присоединения с кислотой является гидрогалогенидом (например, гидрохлоридом, гидробромидом, гидройодидом или гидрофторидом, например, при отношении количества молей основания к количеству молей кислоты, составляющем от 1:1 до 3:1).
1.6.Формула 1.5, где солью присоединения с кислотой является гидрохлорид.
1.7. Любая из предыдущих формул, где указанное соединение находится в твердой форме, например, твердой аморфной форме или твердой кристаллической форме.
1.8. Любая из предыдущих формул, где указанные соединения содержат не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95% и до 100% цис-стереоизомера в пересчете на все остальные стереоизомеры и/или где указанные соединения обладают энантиомерным избытком (e.e.), составляющим не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95% или более 97% или более 99%, или более 99,5%, или более 99,9% и до 100% (т. е. для приведенного выше энантиомера 4aS, 9bR).
[00013] В некоторых вариантах осуществления настоящее изобретение относится к соединениям формулы 2I, приведенным ниже в свободной форме или в форме соли, которые применимы, например, в качестве промежуточных продуктов для получения соединений формулы 2J:
Соединения формулы 2I:
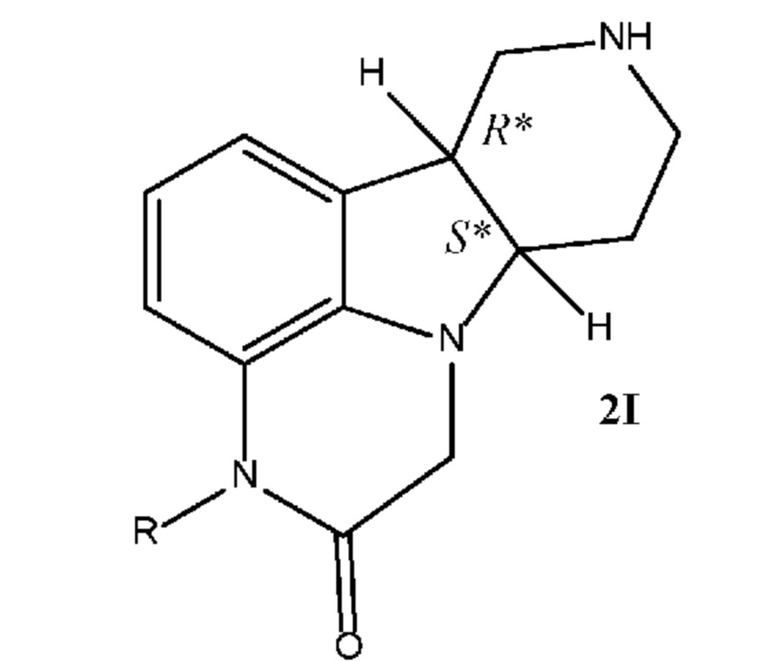
где:
R означает H или C1-4 алкил (например, метил);
в свободной форме или в форме соли, например, в форме соли присоединения с кислотой, необязательно в твердой форме.
[00014] Настоящее изобретение также относится к соединениям следующих формул:
2.1.Формула 2I, где R означает C1-C4 алкил (например, метил).
2.2.Формула 2I, где R означает H.
2.3.Формула 2I, 2.1 или 2.2, где соединение находится в форме свободного основания.
2.4.Формула 2I, 2.1 или 2.2, где соединение находится в форме соли присоединения с кислотой.
2.5.Формула 2.4, где форма соли присоединения с кислотой является гидрогалогенидом (например, гидрохлоридом, гидробромидом, гидройодидом или гидрофторидом, например, при отношении количества молей основания к количеству молей кислоты, составляющем от 1:1 до 3:1).
2.6.Формула 2.5, где солью присоединения с кислотой является гидрохлорид.
2.7. Любая из предыдущих формул, где указанное соединение находится в твердой форме, например, твердой аморфной форме или твердой кристаллической форме.
2.8. Любая из предыдущих формул, где указанные соединения содержат не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95% и до 100% цис-стереоизомера в пересчете на все остальные стереоизомеры.
[00015] Настоящее изобретение также относится к следующим соединениям, которые могут образоваться в качестве примесей в способах получения соединений формулы 1J:
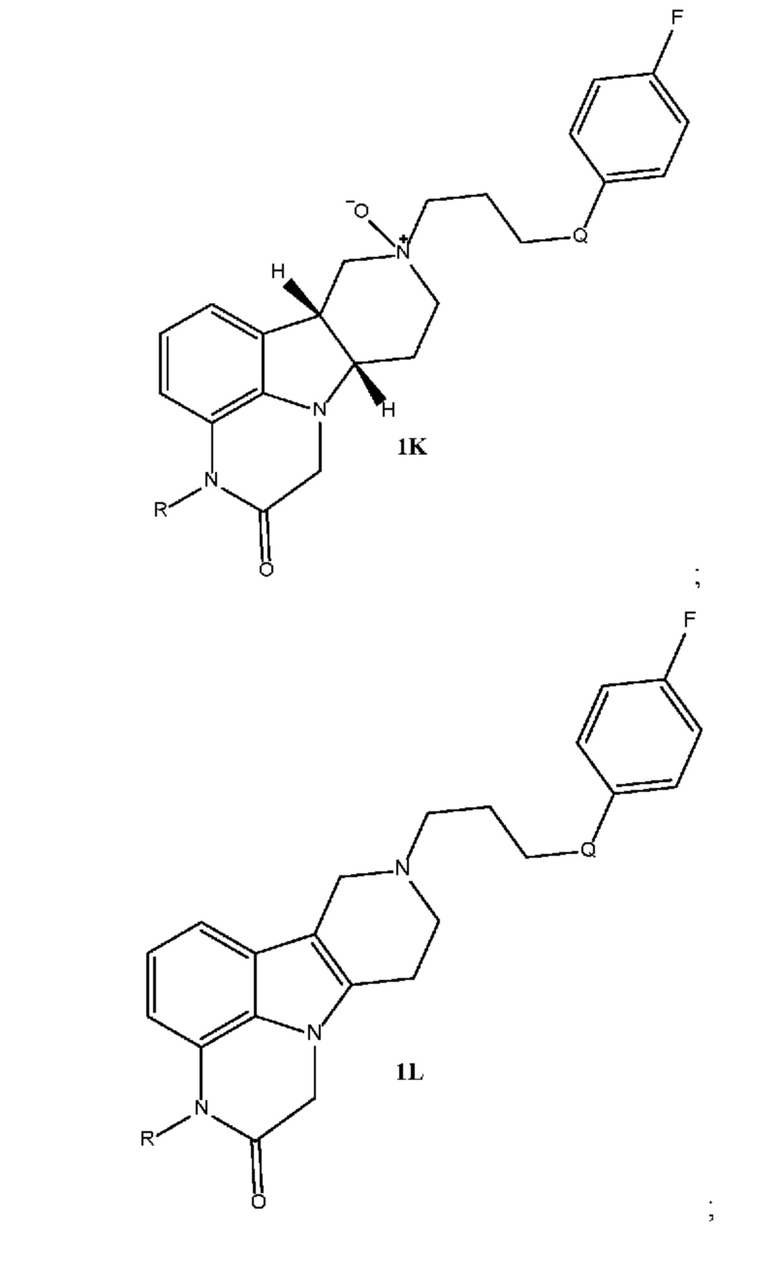 ;
;
где в каждом из указанных соединений 1K и 1L группа R выбрана из H и C1-4 алкила (например, метила), и группа Q выбрана из -O- и -(C=O)-.
[00016] Настоящее изобретение также относится к следующим соединениям, которые могут образоваться в качестве примесей в способах получения соединений формулы 2J:
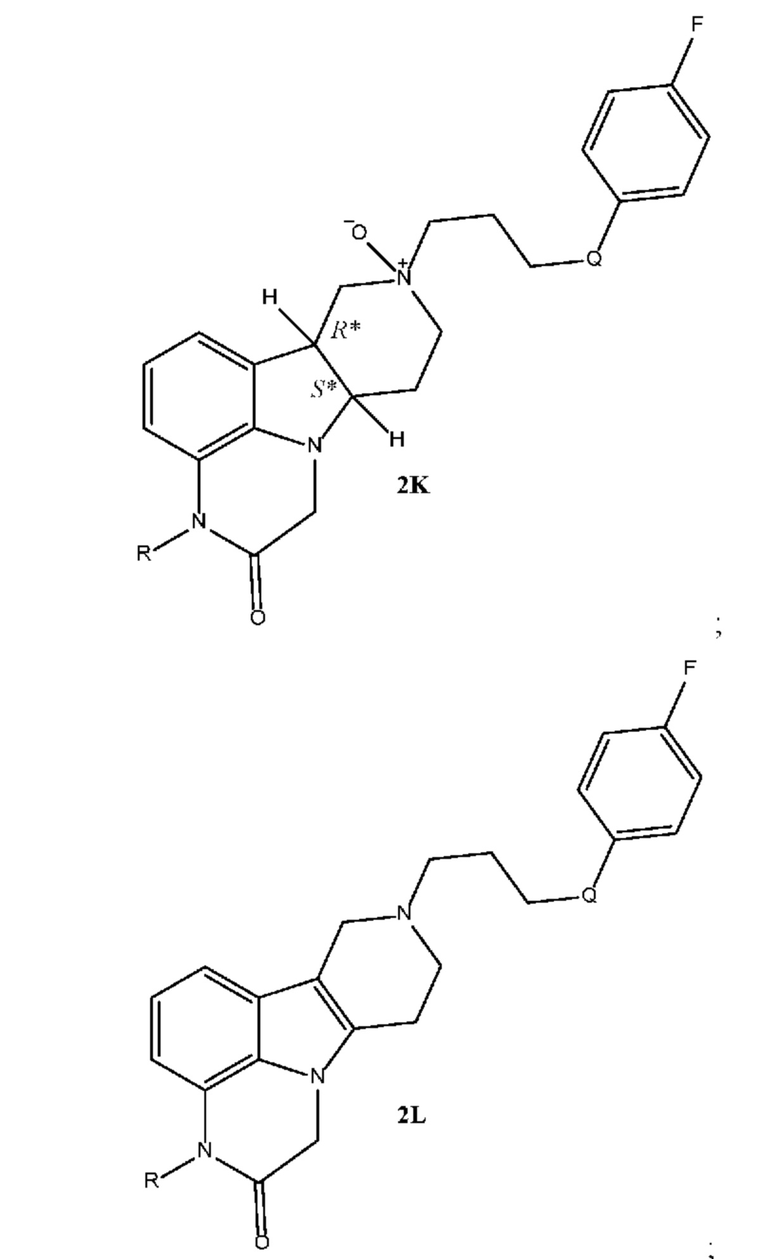
где в каждом из указанных соединений 2K и 2L группа R выбрана из H и C1-4 алкила (например, метила), и группа Q выбрана из -O- и -(C=O)-.
[00017] В некоторых вариантах осуществления настоящее изобретение относится к способу получения соединения формулы 1J, представленному на следующей схеме:
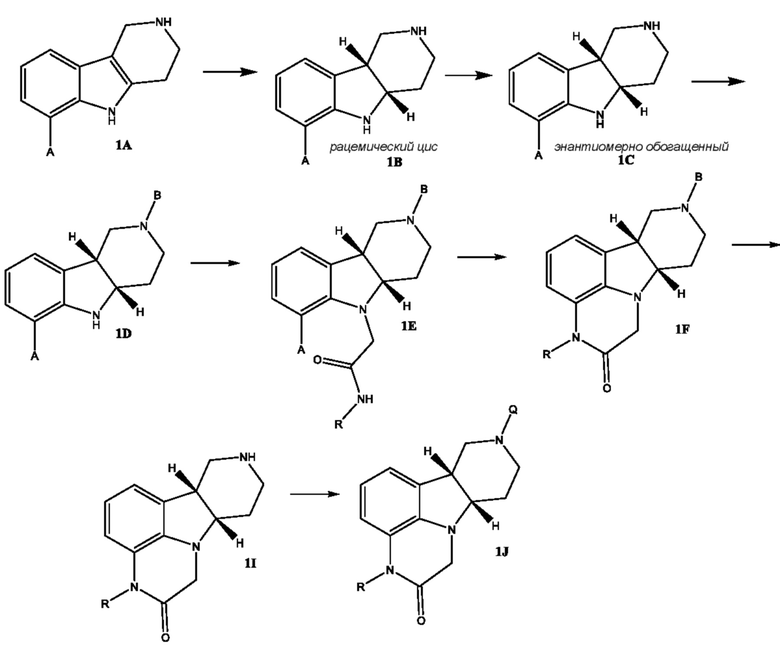
где для каждого из соединений 1A - 1J независимо:
(i) A выбран из Br, Cl и I;
(ii) R выбран из H и C1-4 алкила (например, метила);
(iii) B означает защитную группу, определенную в настоящем изобретении; и
(iv) Q выбран из 4-(4-фторфенил)-4-оксобутила и 3-(4-фторфенокси)пропила;
где каждое из соединений 1A, 1B, 1C, 1D, 1E, 1F, 1I и 1J независимо находится в форме свободного основания или в форме соли (например, в форме соли присоединения с кислотой). Следует понимать, что соединение 1B в значительной степени, в основном или полностью представляет собой рацемические цис-изомеры, т.е. содержит примерно одинаковые количества двух цис-энантиомеров с преимущественным или полным исключением любых транс-изомеров. Также следует понимать, что соединение 1C в значительной степени, в основном или полностью представляет собой один цис-энантиомер, точнее, 4aS, 9bR энантиомер (приведенный выше) с преимущественным или полным исключением противоположного цис-энантиомера или любого транс-стереоизомера.
[00018] В некоторых вариантах осуществления настоящее изобретение относится к способу получения соединения формулы 2J, представленному на следующей схеме:
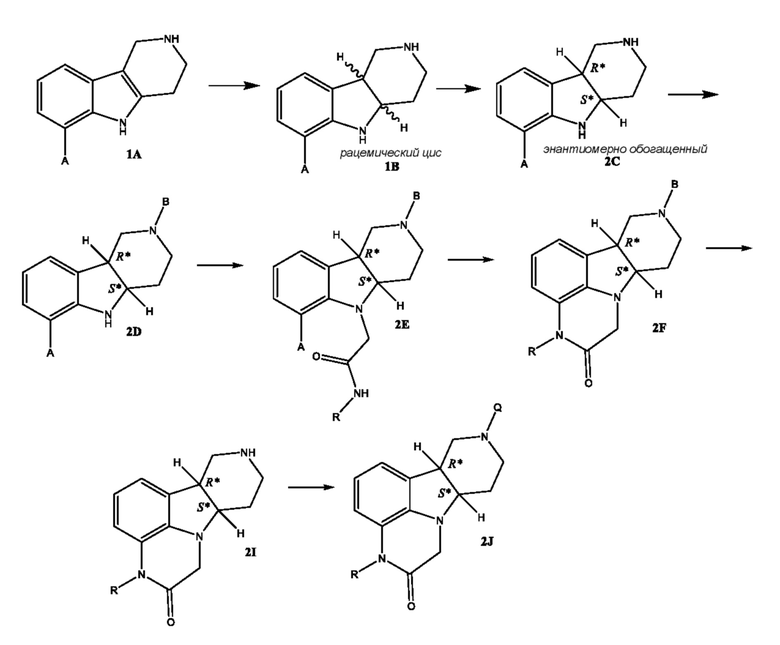
где для каждого из соединений 2A - 2J, независимо:
(i) A выбран из Br, Cl и I;
(ii) R выбран из H и C1-4 алкила (например, метила);
(iii) B означает защитную группу, определенную в настоящем изобретении; и
(iv) Q выбран из 4-(4-фторфенил)-4-оксобутила и 3-(4-фторфенокси)пропила;
где каждое из соединений 1A, 1B, 2C, 2D, 2E, 2F, 2I и 2J независимо находится в форме свободного основания или в форме соли (например, в форме соли присоединения с кислотой). Следует понимать, что соединение 1B в значительной степени, в основном или полностью представляет собой рацемические цис-изомеры, т.е. содержит примерно одинаковые количества двух цис-энантиомеров с преимущественным или полным исключением любых транс-изомеров. Также следует понимать, что соединение 2C в значительной степени, в основном или полностью представляет собой один цис-энантиомер с преимущественным или полным исключением противоположного цис-энантиомера или любого транс-стереоизомера.
[0019] В некоторых вариантах осуществления настоящее изобретение относится к способам получения соединения формулы 1J, приведенного выше в свободной форме или в форме соли, указанного ниже:
3.1.Формула 1J, где R означает H.
3.2.Формула 1J, где R означает C1-4 алкил.
3.3.Формула 1J, где R означает метил.
3.4.Формула 1J или любая из 3.1-3.3, где Q означает 4-(4-фторфенил)-4-оксобутил.
3.5.Формула 1J или любая из 3.1-3.3, где Q означает 3-(4-фторфенокси)пропил.
3.6.Формула 1J, где R означает H и Q означает 3-(4-фторфенокси)пропил.
3.7.Формула 1J или любая из 3.1-3.6, где соединение формулы 1J находится в форме свободного основания, например, в форме твердого свободного основания.
3.8.Формула 1J или любая из 3.1-3.6, где соединение формулы 1J находится в форме соли.
3.9.Формула 1J или любая из 3.1-3.6, где соединение формулы 1J находится в форме соли присоединения с кислотой.
3.10.Формула 1J или любая из 3.1-3.6, где соединение формулы 1J находится в форме тозилата или гидрохлорида, например, при отношении количества свободного основания к количеству кислоты, составляющем от 1:1 до 1:3.
3.11.Формула 1J или любая из 3.1-3.10, где соединение формулы 1J содержит не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95%, до 100% цис-стереоизомера в пересчете на все остальные стереоизомеры.
3.12.Формула 1J или любая из 3.1-3.11, где соединение формулы 1J находится в основном в энантиомерно чистой форме, например, характеризуется составляющим не менее 90% e.e., предпочтительно не менее 95% e.e., или не менее 97% e.e, или не менее 99% e.e., или не менее 99.5% e.e., или не менее 99,9% e.e., до 100% e.e.
[0020] В некоторых вариантах осуществления настоящее изобретение относится к способам получения соединения формулы 2J, приведенного выше в свободной форме или в форме соли, указанного ниже:
4.1.Формула 2J, где R означает H.
4.2.Формула 2J, где R означает C1-4 алкил.
4.3.Формула 2J, где R означает метил.
4.4.Формула 2J или любая из 4.1-4.3, где Q означает 4-(4-фторфенил)-4-оксобутил.
4.5.Формула 2J или любая из 4.1-4.3, где Q означает 3-(4-фторфенокси)пропил.
4.6.Формула 2J, где R означает H и Q означает 3-(4-фторфенокси)пропил.
4.7.Формула 2J или любая из 4.1-4.6, где соединение формулы 2J находится в форме свободного основания, например, в форме твердого свободного основания.
4.8.Формула 2J или любая из 4.1-4.6, где соединение формулы 2J находится в форме соли.
4.9.Формула 2J или любая из 4.1-4.6, где соединение формулы 2J находится в форме соли присоединения с кислотой.
4.10.Формула 2J или любая из 4.1-4.6, где соединение формулы 2J находится в форме тозилата или гидрохлорида, например, при отношении количества свободного основания к количеству кислоты, составляющем от 1:1 до 1:3.
4.11.Формула 2J или любая из 4.1-4.10, где соединение формулы 2J содержит не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95%, до 100% цис-стереоизомера в пересчете на все остальные стереоизомеры.
4.12.Формула 2J или любая из 4.1-4.11, где соединение формулы 2J находится в основном в энантиомерно чистой форме, например, характеризуется составляющим не менее 90% e.e., предпочтительно не менее 95% e.e., или не менее 97% e.e, или не менее 99% e.e., или не менее 99,5%, или не менее 99,9% e.e., до 100% e.e.
[0021] Первым объектом настоящего изобретения является способ (способ 1J) получения соединения формулы 1J или любой из 3.1-3.12 в свободной форме или в форме соли, включающий стадии (a) реакцию соединения формулы 1E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно с йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 1F в свободной форме или в форме соли; (b) удаление защитной группы пиперидинового атома азота соединения формулы 1F с получением соединения формулы 1I (или любой из 1.1-1.8) в свободной форме или в форме соли; и (c) алкилирование пиперидинового атома азота соединения формулы 1I подходящим алкилирующим реагентом с получением соединения формулы 1J (или любой из 3.1-3.12) в свободной форме или в форме соли; и необязательно (d) превращение соединения формулы 1J в свободной форме в соединение формулы 1J (или любой из 3.1-3.12) в форме соли, например, в форме соли присоединения с кислотой (например, в форме тозилата). В некоторых вариантах осуществления способ дополнительно включает стадию алкилирования соединения формулы 1D с получением соединения формулы 1E.
[0022] В другом варианте осуществления первого объекта настоящее изобретение относится к способу (способ 2J) получения соединения формулы 2J или любой из 4.1-4.12 в свободной форме или в форме соли, включающему стадии (a) реакцию соединения формулы 2E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно с йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 2F в свободной форме или в форме соли; (b) удаление защитной группы пиперидинового атома азота соединения формулы 2F с получением соединения формулы 2I (или любой из 2.1-2.8) в свободной форме или в форме соли; и (b) алкилирование пиперидинового атома азота соединения формулы 1I подходящим алкилирующим реагентом с получением соединения формулы 2J (или любой из 4.1-4.12) в свободной форме или в форме соли; и необязательно (d) превращение соединения формулы 2J в свободной форме в соединение формулы 2J (или любой из 4.1-4.12) в форме соли, например, в форме соли присоединения с кислотой (например, в форме тозилата). В некоторых вариантах осуществления способ дополнительно включает стадию алкилирования соединения формулы 2D с получением соединения формулы 2E.
[0023] Вторым объектом настоящего изобретения является способ (способ 1I) получения соединения формулы 1I или любой из 1.1-1.8 в свободной форме или в форме соли, включающий стадии (a) реакцию соединения формулы 1E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно с йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 1F в свободной форме или в форме соли; и (b) удаление защитной группы пиперидинового атома азота соединения формулы 1F с получением соединения формулы 1I (или любой из 1.1-1.8) в свободной форме или в форме соли. В некоторых вариантах осуществления способ дополнительно включает стадию алкилирования соединения формулы 1D с получением соединения формулы 1E.
[0024] В другом варианте осуществления второго объекта, настоящее изобретение относится к способу (способ 2I) получения соединения формулы 2I или любой из 2.1-2.8 в свободной форме или в форме соли, включающему стадии (a) реакцию соединения формулы 2E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно с йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 2F в свободной форме или в форме соли; и (b) удаление защитной группы пиперидинового атома азота соединения формулы 2F с получением соединения формулы 2I (или любой из 2.1-2.8) в свободной форме или в форме соли. В некоторых вариантах осуществления способ дополнительно включает стадию алкилирования соединения формулы 2D с получением соединения формулы 2E.
[0025] Третьим объектом настоящего изобретения является способ (способ 1F) получения соединения формулы 1F в свободной форме или в форме соли, включающий стадии (a) реакцию соединения формулы 1E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно с йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 1F в свободной форме или в форме соли. В некоторых вариантах осуществления способ дополнительно включает стадию алкилирования соединения формулы 1D с получением соединения формулы 1E.
[0026] В другом варианте осуществления третьего объекта настоящее изобретение относится к способу (способ 2F) получения соединения формулы 2F в свободной форме или в форме соли, включающему стадии (a) реакцию соединения формулы 2E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно с йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 2F в свободной форме или в форме соли. В некоторых вариантах осуществления способ дополнительно включает стадию алкилирования соединения формулы 2D с получением соединения формулы 2E.
[0027] Другим объектом настоящего изобретения является применение соединения формулы 1I или любой из 1.1 и следующих, и/или соединения формулы 1F в способе получения соединения формулы 1J или любой из 3.1-3.12.
[0028] Другим объектом настоящего изобретения является применение соединения формулы 2I или любой из 2.1 и следующих, и/или соединения формулы 1F в способе получения соединения формулы 2J или любой из 4.1-4.12.
[0029] Другим объектом настоящего изобретения является активная фармацевтическая композиция, содержащая соединение формулы 1J или 2J в основном в чистой форме.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0030] Одним объектом настоящего изобретения является способ (способ 1I) получения соединения формулы 1I или любой из 1.1-1.8 в свободной форме или в форме соли, включающий стадии (a) реакцию соединения формулы 1E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно с йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 1F в свободной форме или в форме соли; и (b) удаление защитной группы пиперидинового атома азота соединения формулы 1F с получением соединения формулы 1I (или любой из 1.1-1.8) в свободной форме или в форме соли. В некоторых вариантах осуществления способ дополнительно включает стадию алкилирования соединения формулы 1D с получением соединения формулы 1E.
[0031] Предпочтительно, если стадии (a) и (b) проводят без выделения или без очистки промежуточного продукта формул 1F. В некоторых вариантах осуществления стадии (a) и (b) проводят последовательно в одном реакционном сосуде или в наборе соединенных реакционных сосудов.
[0032] В другом варианте осуществления этого объекта настоящее изобретение относится к способу (способ 2I) получения соединения формулы 2I или любой из 2.1-2.8 в свободной форме или в форме соли, включающий стадии (a) реакцию соединения формулы 2E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно с йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 2F в свободной форме или в форме соли; и (b) удаление защитной группы пиперидинового атома азота соединения формулы 2F с получением соединения формулы 2I (или любой из 2.1-2.8) в свободной форме или в форме соли.
[0033] Предпочтительно, если стадии (a) и (b) проводят без выделения или без очистки промежуточного продукта формул 2F. В некоторых вариантах осуществления стадии (a) и (b) проводят последовательно в одном реакционном сосуде или в наборе соединенных реакционных сосудов.
[0034] Катализатором на основе переходного металла на стадии (a) способа 1I или 2I может быть атом, ион, соль или комплекс переходных металлов, выбранных из групп 8-11 Периодической системы (например, палладия, меди, никеля, платины, рутения или родия). Примеры такого катализатора на основе переходного металла включают, но не ограничиваются только ими медные катализаторы, такие как CuI, CuCl, CuBr, CuBr2, Cu(II) ацетат, Cu2Cl2, Cu2O, Cu, CuSO4, Cu2SO4, или палладиевые или никелевые катализаторы, такие как Pd/C, PdCl2, Pd(OAc)2, (CH3CN)2PdCl2, Pd[P(C6H5)3]4, бис(дибензилиденацетон)палладий [Pd(dba)2], трис(дибензилиденацетон)дипалладий [Pd2(dba)3], Ni(ацетилацетонат)2, NiCl2[P(C6H5)]2 и Ni(1,5-циклооктадиен)2, описанные в патентах U.S. 6759554 B2, 6395916 B1 и 6307087 B1, каждый из которых во всей своей полноте включен в настоящее изобретение в качестве ссылки. В предпочтительном варианте осуществления катализатором на основе переходного металла является медный катализатор. В особенно предпочтительном варианте осуществления указанным катализатором является CuI.
[0035] Основание применимое на стадии (a) способа 1I или 2I может представлять собой основание Бренстеда или основание Льюиса, включающее только в качестве примера, основания-амины (например, триэтиламин, триметиламин, N,N’-диизопропилэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) или 1,4-диазабицикло[2.2.2]октан (DABCO)), гидриды (например, гидрид натрия, лития или калия), алкоксиды (например, трет-бутоксид натрия или калия), карбонаты (например, карбонат или бикарбонат натрия, калия или карбонат цезия) или фосфаты (например, фосфат калия). В предпочтительном варианте осуществления указанным основанием является карбонат щелочного или щелочноземельного металла (например, натрия, калия, цезия, бария и т.п.). В особенно предпочтительном варианте осуществления указанным основанием является карбонат калия.
[0036] В некоторых вариантах осуществления основание на стадии (a) можно исключить путем использования лиганда на стадии (a), который сам является основным, такого как аминный лиганд (например, DBU, DBN или 1,2-диамин), описанный ниже. В таких вариантах осуществления стадия (a) может включать лиганд (iv) без основания (ii). В других вариантах осуществления основание (ii) и основный лиганд (iv) используют вместе, например, неорганическое основание (ii) (такое как карбонат калия или карбонат натрия) и основный аминный лиганд (iv) (такой как DBU, DBN или 1,2-диамин).
[0037] Необязательные моно- или бидентатные лиганды, применимые на стадии (a) способа 1I или 2I, представляют собой лиганды, для которых известно, что они связываются с катализаторами на основе переходного металла. Примеры таких лигандов включают, но не ограничиваются только ими фенольный или аминный лиганды, такие как необязательно замещенный ариловый спирт, 1,2-диамин, 1,2-аминоспирт, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO), имидазолийкарбен, 4-(диметиламино)пиридин, 2-(аминометил)пиридин, 4,7-дифенил-1,10-фенантролин, 4,7-диметил-1,10-фенантролин, 5-метил-1,10-фенантролин, 5-хлор-1,10-фенантролин и 5-нитро-1,10-фенантролин. Примеры фенольных или аминных лигандов включают, но не ограничиваются только ими, 2-фенилфенол, 2,6-диметилфенол, 2-изопропилфенол, 1-нафтол, 8-гидроксихинолин, 8-аминохинолин, DBU, DBN, DABCO, 2-(диметиламино)этанол, N,N-диэтилсалициламид, 2-(диметиламино)глицин, N,N,N',N'-тетраметил-1,2-диаминоэтан, 4,7-дифенил-1,10-фенантролин, 4,7-диметил-1,10-фенантролин, 5-метил-1,10-фенантролин, 5-хлор-1,10-фенантролин, 5-нитро-1,10-фенантролин, 4-(диметиламино)пиридин, 2-(аминометил)пиридин, (метилимино)диуксусная кислота, цис-1,2-диаминоциклогексан, транс-1,2-диаминоциклогексан, смесь цис- и транс-1,2-диаминоциклогексанов, цис-N,N'-диметил-1,2-диаминоциклогексан, транс-N,N'-диметил-1,2-диаминоциклогексан, смесь цис- и транс-N,N'-диметил-1,2-диаминоциклогексанов, цис-N-толил-1,2-диаминоциклогексан, транс-N-толил-1,2-диаминоциклогексан, смесь цис- и транс-N-толил-1,2-диаминоциклогексанов, этаноламин, 1,2-диаминоэтан, N,N'-диметил-1,2-диаминоэтан, N,N-диметил-2-гидроксибензамид, N,N-диэтил-2-гидроксибензамид, фтор-N,N-диэтил-2-гидроксибензамид, хлор-N,N’-диэтил-2-гидроксибензамид, (2-гидроксифенил)(пирролидин-1-ил)метанон, бифенил-2-ол, 2-пиридилфенол, 1,2-бензолдиамин, аммиак, N,N-диметилформамид, диметилсульфоксид и 1-метил-2-пирролидинон, описанный в патентах U.S. 6759554B2; 6395916B1; 6307087B1, Klapars, A. et al., J. Am. Chem. Soc. (2002) 124, 7421-7428; Kang, S., et al., Synlett, 3, 427-430 (2002); Sugahara, M. and Ukita, T., Chem. Pharm. Bull. (1997) 45, 719-721, каждый из которых включен в настоящее изобретение в качестве ссылки. В особенно предпочтительном варианте осуществления указанным лигандом является DBU, DBN, N,N’-диметил-1,2-диаминоэтан, транс-N,N'-диметил-1,2-диаминоциклогексан, или н-бутилэтилендиамин. Если не ограничиваться какой-либо теорией, предполагается, что лиганды облегчают протекание реакции путем стабилизации и солюбилизации катализатора на основе металла.
[0038] В одном варианте осуществления неочищенное соединение формулы 1F или 2F обрабатывают реагентом для удаления меди. Например, неочищенное соединение можно суспендировать и/или растворить в органическом растворителе и промыть щелочным водным раствором (например, водным раствором аммиака). Альтернативно, неочищенное твердое вещество можно прямо промыть щелочным водным раствором (например, водным раствором аммиака).
[0039] Условия для удаления защитной группы на стадии (b) способа 1I или 2I с необходимостью меняются в зависимости от выбора защитной группы B и могут включать, например, кислотный или основной катализ или каталитическое гидрирование. Так, например, если защитной группой является ацильная группа, такая как алканоильная или алкоксикарбонильная группа (например, этоксикарбонил) или ароильная группа, удаление защитной группы можно провести, например, путем гидролиза основанием, таким как гидроксид щелочного металла, например, гидроксид лития, калия или натрия. Альтернативно, ацильную защитную группу, такую как трет-бутоксикарбонильную группу можно удалить, например, путем обработки подходящей кислотой, такой как хлористоводородная, серная или фосфорная кислота или трифторуксусная кислота. Арилметоксикарбонильную защитную группу, такую как бензилоксикарбонильную группу, можно удалить, например, гидрированием над катализатором, таким как платина или палладий на угле, или путем обработки кислотой Льюиса, такой как трис(трифторацетат) бора. Примеры реагентов, применимых для указанной стадии удаления защитной группы приведены в "Protective Groups in Organic Synthesis" by Theodora Green (publisher: John Wiley & Sons).
[0040] В предпочтительном варианте осуществления защитной группой B является карбаматная защитная группа, например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил или трет-бутоксикарбонил. В указанном варианте осуществления стадию (b) способа 1I или 2I предпочтительно можно провести с использованием кислого водного раствора, такого как водный раствор хлористоводородной кислоты или водный раствор бромистоводородной кислоты, или с использованием неводной кислой среды, такой как хлорид водорода или бромид водорода в органическом растворителе (например, метаноле, THF, диоксане, диэтиловом эфире, уксусной кислоте или их смесь) или с использованием сильной органической кислоты (например, неразбавленной трифторуксусной кислоты (TFA), или TFA в подходящем органическом растворителе, например, диоксане). В предпочтительном варианте осуществления неводной кислой средой является бромистоводородная кислота, растворенная в органическом растворителе (например, в уксусной кислоте).
[0041] В некоторых вариантах осуществления стадию (b) способа 1I или 2I проводят в кислой среде и соединение формулы 1I или 2I получают в форме соли присоединения с кислотой. Например, реакцию можно провести с использованием хлористоводородной кислоты или бромистоводородной кислоты и получить соединения формулы 1I или 2I в виде гидрохлорида или гидробромида. В других вариантах осуществления стадию (b) способа 1I или 2I проводят в кислой среде и реакционную смесь нейтрализуют или подщелачивают подходящим основанием для получения соединения формулы 1I или 2I в форме свободного основания. Подходящие основания для проведения указанной нейтрализации или подщелачивания включают неорганические основания, такие как гидроксиды, оксиды, карбонаты и бикарбонаты (например, аммония, щелочного металла или щелочноземельного металла основания, включая NaOH, KOH, LiOH, NH4OH, Ca(OH)2, CaO, MgO, Na2CO3, K2CO3, Li2CO3, NaHCO3, KHCO3, LiHCO3, CaCO3, MgCO3, (NH4)2CO3 и т.п.), необязательно в водном растворе (таком как водный раствор гидроксида натрия, водный раствор карбоната натрия или водный раствор аммиака).
[0042] В некоторых вариантах осуществления способ 1I или 2I даем соединения формулы 1I или 2I соответственно в виде кристаллического свободного основания или в виде кристаллической соли присоединения с кислотой, например, в виде гидрохлорида или гидробромида. Авторы настоящего изобретения неожиданно установили, что применение способа 1I или 2I, или одного или большего количества способов 5.1-5.52 дает соединения формулы 1I или 2I с намного меньшим загрязнением примесями переходного металла (например, меди) по сравнению со способами получения этих соединений предшествующего уровня техники. Например, применение способов, предлагаемых в настоящем изобретении, может дать соединения формулы 1I или 2I, содержащие менее примерно 50 част./млн меди или менее примерно 10 част./млн меди, или менее примерно 5 част./млн меди.
[0043] В предпочтительных вариантах осуществления первого объекта настоящее изобретение относится к следующим:
5.1. Способ 1I или 2I, где соединение формулы 1I или 2I представляет собой соответственно соединение любой формулы 1.1-1.8 или 2.1-2.8.
5.2. Способ 1I или 2I, где заместитель A соединения формулы 1E или 2E выбран из Br, Cl и I.
5.3. Способ 5.2, где A означает Br.
5.4. Способ 1I или 2I, или любой из 5.1 и следующих, где заместитель R соединений формул 1E, 1F и 1I, или 2E, 2F и 2I, означает C1-4 алкил (например, метил).
5.5. Способ 1I или 2I, или любой из 5.1 и следующих, где заместитель R соединений формул 1E, 1F и 1I, или 2E, 2F и 2I, означает H.
5.6. Способ 1I или 2I, или любой из 5.1 и следующих, где защитной группой B соединений формул 1E и 1F, или 2E и 2F, является группа формулы P-Z, где P выбран из CH2, C(O), C(O)O и S(O)2, и где Z означает необязательно замещенный алкил, арил, алкиларил или -OR’ где R’ означает алкил, арил, арилалкил или гетероарилалкил.
5.7. Способ 5.6, где защитной группой B является ацильная группа (например, алканоильная или алкоксикарбонильная группа), например, трет-бутоксикарбонил, феноксикарбонил, этоксикарбонил или метоксикарбонил, или необязательно замещенный бензилоксикарбонил.
5.8. Способ 5.7, где защитной группой B является этоксикарбонил.
5.9. Способ 5.6, где защитной группой B является необязательно замещенная бензильная группа, например, бензил, 4-метоксибензил или 2,4-диметоксибензил.
5.10. Способ 1I или 2I, или любой из 5.1 и следующих, где катализатором на основе переходного металла на стадии (a) является медный катализатор.
5.11. Способ 5.10, где катализатор на основе переходного металла на стадии (a) выбран из CuI, CuBr, CuCl, Cu(OAc)2, Cu2Cl2, CuBr2, CuSO4, Cu2SO4 и Cu2O.
5.12. Способ 5.11, где катализатор на основе переходного металла на стадии (a) выбран из CuI, CuBr и CuCl.
5.13. Способ 5.12 где катализатором на основе переходного металла является CuI.
5.14. Способ 1I или 2I, или любой из 5.1 и следующих, где катализатор на основе переходного металла на стадии (a) содержится в количестве от 0,01 до 0,50 экв., например, от 0,05 до 0,40 экв. или от 0,10 до 0,30 экв., или от 0,15 до 0,25 экв., или примерно 0,20 экв.
5.15. Способ 1I или 2I, или любой из 5.1 и следующих, где основанием на стадии (a) является основание Бренстеда, например, выбранное из аминов, алкоксидов, карбонатов и фосфатов и их смесей.
5.16. Способ 5.15, где основанием на стадии (a) является карбонатное основание, например, карбонат или бикарбонат щелочного или щелочноземельного металла, или их смеси.
5.17. Способ 5.16, где основание на стадии (a) выбрано из карбоната натрия, карбоната калия, бикарбоната натрия или бикарбоната калия, или их смеси.
5.18. Способ 5.17, где основание на стадии (a) включает карбонат калия, необязательно в количестве, равном от 1,5 до 3 экв., например, от 2 до 2,5 экв., или примерно 2,2 экв.
5.19. Способ 1I или 2I, или любой из 5.1 и следующих, где стадия (a) не включает основание (ii), например, не включает алкоксид, карбонат, фосфат или другое неорганическое основание.
5.20. Способ 1I или 2I, или любой из 5.1 и следующих, где стадия (a) включает йодид или бромид щелочного металла или аммония, например, выбранный из йодида натрия, йодида калия, йодида лития, бромида натрия, бромида калия, бромида лития, или тетраалкиламмонийбромида или йодида (например, тетрабутиламмонийбромида или йодида).
5.21. Способ 5.20, где стадия (a) включает йодид калия.
5.22. Способ 1I или 2I, или любой из 5.1 и следующих, где стадия (a) включает монодентатный или бидентатный лиганд, например, лиганд, выбранный из фенольных или аминных лигандов.
5.23. Способ 5.22, где лиганд выбран из необязательно замещенного 1,2-диамина, необязательно замещенного 1,2-аминоспирта, DBU, DBN или DABCO.
5.24. Способ 5.23, где лиганд представляет собой DBU.
5.25. Способ 1I или 2I, или любой из 5.1 и следующих, где лиганд на стадии (a) содержится в количестве от 0,01 до 0,50 экв., например, от 0,05 до 0,45 экв., или от 0,10 до 0,40 экв., или от 0,20 до 0,30 экв., или примерно 0,25 экв.
5.26. Способ 1I или 2I, или любой из 5.1 и следующих, где растворитель на стадии (a) представляет собой диоксан или толуол.
5.27. Способ 5.26, где растворитель на стадии (a) представляет собой толуол.
5.28. Способ 5.27, где соединение формулы 1E или 2E объединяют с основанием (ii) в растворителе толуоле и смесь азеотропно перегоняют для удаления воды до прибавления катализатора (i) и необязательного йодида (iii) и/или необязательного лиганда (iv).
5.29. Способ 1I или 2I, или любой из 5.1 и следующих, где соединение формулы 1F или 2F выделяют путем охлаждения реакционной смеси до комнатной температуры и последующего разбавления смеси неполярным растворителем (например, пентанами, н-пентаном, гексанами, н-гексаном, гептанами, н-гептаном, циклопентаном, циклогексаном или их комбинацией) для осаждения продукта, последующего фильтрования и выделения осадка.
5.30. Способ 5.29, где реакционным растворителем является толуол и добавленным неполярным растворителем является гептан (например, гептаны или н-гептан).
5.31. Способ 5.29 или 5.30, где осадившееся твердое вещество (например, осадок на фильтре) диспергируют водным раствором неорганического основания (например, водным раствором NaOH, KOH или NH4OH) с последующим фильтрованием и промывкой водой.
5.32. Способ 1I или 2I, или любой из 5.1 и следующих, где стадией удаления защитной группы (b) является опосредуемая кислотой или основанием реакция расщепления, реакция гидролиза (например, катализируемая кислотой или основанием) или реакция гидрирования.
5.33. Способ 5.32, где стадией удаления защитной группы (b) является кислотный гидролиз, например, водный или неводный кислотный гидролиз.
5.34. Способ 5.33, где кислотный гидролиз включает кислоту, например, выбранную из хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты и азотной кислоты, необязательно избыток кислоты (например, 10-30 мол. экв. кислоты).
5.35. Способ 5.33, где кислотный гидролиз включает кислоту в неводном растворителе, например, уксусной кислоте, эфире или THF.
5.36. Способ 5.33, где кислотный гидролиз включает кислоту в водном растворителе, например, в воде или смеси вода-спирт (например, вода-метанол или вода-этанол).
5.37. Способ 5.35, где стадией удаления защитной группы (b) включает применение бромистоводородной кислоты в уксусной кислоте (например, 33% мас./мас. HBr в AcOH).
5.38. Любой из способов 5.32-5.37, где стадией удаления защитной группы включает применение бромистоводородной кислоты или бромида водорода и стадия дополнительно включает промывку начального или конечного продукта полярным растворителем (например, этилацетатом, метил-трет-бутиловым эфиром, ацетонитрилом, тетрагидрофураном, 1,4-диоксан или их комбинацией, или одним или большим количеством из них последовательно) для удаления брома из продукта.
5.39. Любой из способов 5.32-5.38, где стадия (b) сначала дает форму соли присоединения с кислотой соединения формулы 1I или 2I (например, соль с HCl или HBr) и где стадия (b) дополнительно включает стадию нейтрализации для превращения формы соли присоединения с кислотой соединения формулы 1I или 2I в соответствующую форму свободного основания.
5.40. Способ 5.39, где стадия нейтрализации включает объединение формы соли присоединения с кислотой соединения формулы 1I или 2I с неорганическим основанием (например, гидроксидом, алкоксидом, карбонатом или бикарбонатом аммония, щелочного металла или щелочноземельного металла).
5.41. Способ 5.40, где неорганическим основанием является гидроксид аммония, необязательно в форме водного раствора аммиака (например, 25% мас./об. водного раствора аммиака).
5.42. Способ 5.32, где стадией удаления защитной группы (b) является опосредуемое основанием расщепление, например, включающее органическое основание (например, пиперидин) в органическом растворителе.
5.43. Способ 5.32, где стадией удаления защитной группы (b) является реакция гидрирования, например, каталитическое гидрирование, включающее катализатор на основе переходного металла (например, платины или палладия) и водород.
5.44. Способ 1I или 2I, или любой из 5.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в виде твердого вещества, например, в виде аморфного или кристаллического твердого вещества (в форме свободного основания или соли присоединения с кислотой).
5.45. Способ 1I или 2I, или любой из 5.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в основном в чистой форме, например, чистотой более 90 мас.% или, например, чистотой более 95 мас.%, чистотой до 100 мас.%.
5.46. Способ 1I или 2I, или любой из 5.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в свободной форме (т. е. в форме свободного основания), необязательно в виде кристаллического твердого вещества.
5.47. Способ 1I или 2I, или любой из 5.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в форме соли, например, в форме соли присоединения с кислотой.
5.48. Способ 5.47, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в виде соли присоединения, выбранной из гидрохлорида, гидробромида, гидройодида, формиата, ацетата, трифторацетата или метансульфоната, например, при отношении количества молей основания к количеству молей кислоты, составляющем от 1:1 до 2:1.
5.49. Способ 5.48, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в виде гидрохлорида или гидробромида, например, в виде твердого гидрохлорида или гидробромида или кристаллического твердого гидрохлорида или гидробромида.
5.50. Способ 1I или 2I, или любой из 5.1 и следующих, где способ проводят без выделения или без очистки промежуточного продукта формулы 1F или 2F.
5.51. Способ 1I или 2I, или любой из 5.1 и следующих, где стадии (a) и (b) проводят последовательно в одном реакционном сосуде или в наборе соединенных реакционных сосудов.
5.52. Способ 1I или 2I, или любой из 5.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в форме, содержащей менее примерно 50 част./млн меди, или менее примерно 10 част./млн меди, или менее примерно 5 част./млн меди.
5.53. Способ 1I или 2I, или любой из 5.1 и следующих, где способ дополнительно включает стадию (c) алкилирования пиперидинового атома азота соединения формулы 1I или 2I подходящим алкилирующим реагентом, описанным в настоящем изобретении, с получением соединения формулы 1J или 2J в свободной форме или в форме соли.
5.54. Способ 5.53, где соединение формулы 1J или 2J получают в форме свободного основания на стадии (c), и где способ дополнительно включает стадию (d) превращения указанного соединения формулы 1J или 2J в форме свободного основания в соединение формулы 1J или 2J в форме соли, например, в форме соли присоединения с кислотой (например, в форме тозилата).
5.55. Способ 5.53 или 5.54, где способ дает соединение формулы 1J или 2J, описанные формулами 3.1-3.12 или 4.1-4.12 соответственно.
5.56. Способ 1I или 2I, или любой из 5.1-5.55, дополнительно включающий любую или все следующие стадии, описанные в любых его вариантах осуществления везде в настоящем изобретении:
a. Получение соединения формулы 1A по реакции 2-бромфенилгидразина в свободной форме или в форме соли, с 4-пиперидиноном в свободной форме или в форме соли, необязательно в форме гидрата, необязательно в растворителе уксусной кислоте;
b. Получение соединения формулы 1C или 2C в свободной форме или в форме соли путем (a) восстановления соединения формулы 1A в соединение формулы 1B, где восстановление необязательно включает реакцию соединения формулы 1A с триэтилсиланом и метансульфоновой кислотой, и (b) разделение стереоизомеров формулы 1B с помощью разделения хиральной соли хиральной хроматографией с получением соединения формулы 1C или 2C, необязательно где разделение хиральной соли проводят в одну стадию разделения с использованием S-миндальной кислоты;
c. Получение соединения формулы 1D или 2D в свободной форме или в форме соли путем защиты пиперидинамина формулы 1C или 2C защитным реагентом в присутствии основания;
d. Получение соединения формулы 1E или 2E в свободной форме или в форме соли путем N-алкилирования соединения формулы 1D или 2D (a) нуклеофильным алкилгалогенидом и (b) основанием.
[0044] Другим объектом настоящего изобретения является способ (способ 1J) получения соединения формулы 1J или любой из 3.1-3.12 в свободной форме или в форме соли, включающий стадии (a) реакцию соединения формулы 1E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 1F в свободной форме или в форме соли; (c) удаление защитной группы пиперидинового атома азота соединения формулы 1F с получением соединения формулы 1I (или любой из 1.1-1.8) в свободной форме или в форме соли; и (c) алкилирование пиперидинового атома азота соединения формулы 1I подходящим алкилирующим реагентом с получением соединения формулы 1J (или любой из 3.1-3.12) в свободной форме или в форме соли; и необязательно (d) превращение соединения формулы 1J в свободной форме в соединение формулы 1J (или любой из 3.1-3.12) в форму соли, например, в форму фармацевтически приемлемой соли, такую как форма соли присоединения с кислотой (например, в форму тозилата). В некоторых вариантах осуществления способ дополнительно включает стадию алкилирования соединения формулы 1D с получением соединения формулы 1E.
[0045] В другом варианте осуществления второго объекта, настоящее изобретение относится к способу (способ 2J) получения соединения формулы 2J или любой из 4.1-4.15 в свободной форме или в форме соли, включающему стадии (a) реакцию соединения формулы 2E в свободной форме или в форме соли с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом) и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 2F в свободной форме или в форме соли; (b) удаление защитной группы пиперидинового атома азота соединения формулы 2F с получением соединения формулы 2I (или любой из 2.1-2.8) в свободной форме или в форме соли; и (c) алкилирование пиперидинового атома азота соединения формулы 1I подходящим алкилирующим реагентом с получением соединения формулы 2J (или любой из 4.1-4.12) в свободной форме или в форме соли; и необязательно (d) превращение соединения формулы 2J в свободной форме в соединение формулы 2J (или любой из 4.1-4.12) в форму соли, например, в форму фармацевтически приемлемой соли, такую как форма соли присоединения с кислотой (например, в форму тозилата). В некоторых вариантах осуществления способ дополнительно включает стадию алкилирования соединения формулы 2D с получением соединения формулы 2E.
[0046] Во всех случаях стадии (a) и (b) способа 1J и 2J можно провести в соответствии с приведенным выше описанием способа 1I и 2I соответственно, включая любой из способов 5.1-5.56.
[0047] Алкилирующие средства, подходящие для стадии (c) способа 1J или 2J, включают соединения общей формулы Q-X, где Q выбран из 4-(4-фторфенил)-4-оксобутила и 3-(4-фторфенокси)пропила, и где X означает любую подходящую отщепляющуюся группу. Отщепляющиеся группы являются фрагментами, известными в данной области техники, как способные участвовать в реакции нуклеофильного замещения. В некоторых вариантах осуществления X выбран из хлора, брома, йода, C1-4 алкилсульфонилокси (например, метансульфонилокси) и необязательно замещенной арилсульфонилокси (например, бензолсульфонилокси, 4-нитробензолсульфонилокси, 4-галогенсульфонилокси и т.п.).
[0048] В некоторых вариантах осуществления стадия (c) способа 1J или 2J может дополнительно включать подходящее основание. Подходящие основания включают, но не ограничиваются только ими, органические основания, такие как основания-амины (например, аммиак, триэтиламин, N,N’-диизопропилэтиламин или 4-(диметиламино)пиридин (DMAP), 1,5-диазабицикло[4.3.0]-нон-5-ен (DBN), 1,5-диазабицикло[5.4.0]ундец-5-ен (DBU)); или неорганические основания, такие как гидриды (например, гидрид натрия, лития или калия), алкоксиды (например, трет-бутоксид натрия, калия или лития), арилоксиды (например, феноксид лития, натрия или калия) или карбонаты, бикарбонаты, фосфаты или гидроксиды щелочного или щелочноземельного металла (например, натрия, магния, кальция, калия, цезия или карбонат, бикарбонат, гидроксид или фосфат бария). Необязательно, стадия (c) может дополнительно включать неорганический йодид, такой как йодид калия или йодид натрия, предпочтительно йодид калия. Подходящие растворители включают полярные протонные и/или полярные апротонные растворители, такие как, ацетонитрил, диоксан, диметилформамид, диметилацетамид, диметилсульфоксид, метанол, этанол, изопропанол и их смеси. В предпочтительном варианте осуществления стадия (c) включает реакцию соединения формулы 1I или 2I с алкилирующим реагентом 1-хлор-3-(4-фторфенокси)пропаном и основанием, выбранным из триэтиламина, диизопропилэтиламина, карбоната калия и карбоната натрия. Если используют основание, количество основания может быть любым количеством от каталитического количества (например, 0,01 экв.) до избыточного количества (например, 10 или более экв.). В некоторых вариантах осуществления реакцию проводят с использованием от 1,0 до 10,0 экв. основания, например, от 3,0 до 10,0 или от 4,0 до 6,0 экв. основания.
[0049] Соединение формулы 1J или 2J, которое получают на стадии (c) способа 1J или 2J, можно получить в виде свободного основания или в виде соли. Подходящие формы соли включают соли присоединения с кислотой, такие как фосфаты, сульфаты, гидрогалогениды (например, гидрохлорид) и карбоксилаты (например, ацетат или формиат). Форму свободного основания или форму соли соединения формулы 1J или 2J можно получить, например, с выделением или очисткой по любой подходящей методике. В некоторых вариантах осуществления реакцию на стадии (c) проводят в присутствии избытка основания и это может обеспечить выделение свободного основания соединения формулы 1J или 2J из реакционной смеси (например, путем водной/органической экстракции и/или с помощью хроматографии, и/или путем осаждения из подходящего растворителя, и/или путем выпаривания реакционного растворителя). В некоторых вариантах осуществления реакцию на стадии (c) проводят при отсутствии основания или в присутствии менее 1 экв. основания (например, 0,5 экв. или менее, или каталитического количества). В частности, при проведении при отсутствии основания стадия (c) может дать соль присоединения с кислотой соединения формулы 1J или 2J, где кислотный компонент соли образован из алкилирующего реагента. Например, если соединение формулы 1I или 2I обрабатывают алкилирующим реагентом Q-X, определенным выше, и при отсутствии добавленного основания, полученное соединение формулы 1J или 2J можно получить в виде соли присоединения с кислотой, соответствующей группе X (например, если X означает хлор, то соединение формулы 1J или 2J можно получить в форме соли присоединения с хлористоводородной кислотой). В некоторых вариантах осуществления эквимолярное количество или лишь умеренный избыток основания используют во время реакции на стадии (c), но до или во время очистки добавляют избыток кислоты (например, хлористоводородной кислоты), что приводит к получению соединения формулы 1J или 2J в виде соли присоединения с кислотой (например, гидрохлорида).
[0050] В некоторых вариантах осуществления стадия (c) способа 1J или 2J дает соединение формулы 1J или 2J в свободной форме (т. е. в форме свободного основания) и эту форму выделяют и/или очищают и затем необязательно проводят стадию (d) превращения формы свободного основания указанного соединения формулы 1J или 2J в форму соли указанного соединения формулы 1J или 2J, например, в форму фармацевтически приемлемой соли (например, соли присоединения с кислотой). В некоторых вариантах осуществления эту форму соли присоединения с кислотой указанного соединения формулы 1J или 2J дополнительно выделяют и/или очищают. Если не ограничиваться теорией, предполагается, что начальное выделение соединения формулы 1J или 2J в свободной форме, затем последующее превращение этого соединения в форму соли (например, в форму соли присоединения с кислотой) дает конечный продукт (соединение формулы 1J или 2J) более высокой чистоты и/или лучшей перерабатываемости.
[0051] Стадию (d) способа 1J или 2J можно провести по реакции формы свободного основания соединения формулы 1J или 2J с подходящей кислотой, в воде или в органическом растворителе, или в их смеси с получением, например, фармацевтически приемлемой соли присоединения с кислотой формулы 1J или 2J, предлагаемой в настоящем изобретении. Подходящие кислоты обычно известны в данной области техники и могут включать, например, хлористоводородную кислоту или толуолсульфоновую кислоту. Если используют одновалентную кислоту (например, хлористоводородную кислоту или толуолсульфоновую кислоту), стадия (d) может дать моно-соль присоединения или ди-соль присоединения в зависимости от отношения количества молярных эквивалентов кислоты к количеству молярных эквивалентов использующегося свободного основания (например, от 1:1 количества свободного основания к количеству кислоты до 1:2 количества свободного основания к количеству кислоты).
[0052] В предпочтительных вариантах осуществления этого объекта настоящее изобретение относится к следующим:
6.1. Способ 1J или 2J, где соединение формулы 1I или 2I представляет собой соответственно соединение любой формулы 1.1-1.8 или 2.1-2.8.
6.2. Способ 1J или 2J, где заместитель A соединения формулы 1E или 2E выбран из Br, Cl и I.
6.3. Способ 6.2, где A означает Br.
6.4. Способ 1J или 2J или любой из 6.1 и следующих, где заместитель R соединений формул 1E, 1F и 1I или 2E, 2F и 2I, означает C1-4 алкил (например, метил).
6.5. Способ 1J или 2J или любой из 6.1 и следующих, где заместитель R соединений формул 1E, 1F и 1I или 2E, 2F и 2I, означает H.
6.6. Способ 1J или 2J или любой из 6.1 и следующих, где защитной группой B соединений формул 1E и 1F, или 2E и 2F, является группа формулы P-Z, где P выбран из CH2, C(O), C(O)O и S(O)2, и где Z означает необязательно замещенный алкил, арил, алкиларил или -OR’ где R’ означает алкил, арил, арилалкил или гетероарилалкил.
6.7. Способ 6.6, где защитной группой B является ацильная группа (например, алканоильная или алкоксикарбонильная группа), например, трет-бутоксикарбонил, феноксикарбонил, этоксикарбонил или метоксикарбонил, или необязательно замещенный бензилоксикарбонил.
6.8. Способ 6.7, где защитной группой B является этоксикарбонил.
6.9. Способ 6.6, где защитной группой B является необязательно замещенная бензильная группа, например, бензил, 4-метоксибензил или 2,4-диметоксибензил.
6.10. Способ 1J или 2J или любой из 6.1 и следующих, где катализатором на основе переходного металла на стадии (a) является медный катализатор.
6.11. Способ 6.10, где катализатор на основе переходного металла на стадии (a) выбран из CuI, CuBr, CuCl, Cu(OAc)2, Cu2Cl2, CuBr2, CuSO4, Cu2SO4 и Cu2O.
6.12. Способ 6.11, где катализатор на основе переходного металла на стадии (a) выбран из CuI, CuBr и CuCl.
6.13. Способ 6.12 где катализатором на основе переходного металла является CuI.
6.14. Способ 1J или 2J или любой из 6.1 и следующих, где катализатор на основе переходного металла на стадии (a) содержится в количестве от 0,01 до 0,50 экв., например, от 0,05 до 0,40 экв. или от 0,10 до 0,30 экв., или от 0,15 до 0,25 экв., или примерно 0,20 экв.
6.15. Способ 1J или 2J или любой из 6.1 и следующих, где основанием на стадии (a) является основание Бренстеда, например, выбранное из аминных оснований, алкоксидов, карбонатов и фосфатов и их смесей.
6.16. Способ 6.15, где основанием на стадии (a) является карбонатное основание, например, карбонат или бикарбонат щелочного или щелочноземельного металла, или их смеси.
6.17. Способ 6.16, где основание на стадии (a) выбрано из карбоната натрия, карбоната калия, бикарбоната натрия или бикарбоната калия, или их смеси.
6.18. Способ 6.17, где основание на стадии (a) включает карбонат калия, необязательно в количестве, равном от 1,5 до 3 экв., например, от 2 до 2,5 экв. или примерно 2,2 экв.
6.19. Способ 1J или 2J или любой из 6.1 и следующих, где стадия (a) не включает основание (ii), например, не включает алкоксид, карбонат, фосфат или другое неорганическое основание.
6.20. Способ 1J или 2J или любой из 6.1 и следующих, где стадия (a) включает йодид или бромид щелочного металла или аммония, например, выбранный из йодида натрия, йодида калия, йодида лития, бромида натрия, бромида калия или бромида лития, или тетраалкиламмонийбромида или -йодида (например, тетрабутиламмонийбромида или -йодида).
6.21. Способ 6.20, где стадия (a) включает йодид калия.
6.22. Способ 1J или 2J или любой из 6.1 и следующих, где стадия (a) включает монодентатный или бидентатный лиганд, например, лиганд, выбранный из фенольных или аминных лигандов.
6.23. Способ 6.22, где лиганд выбран из необязательно замещенного 1,2-диамина, необязательно замещенного 1,2-аминоспирта, DBU, DBN или DABCO.
6.24. Способ 6.23, где лигандом является DBU.
6.25. Способ 1J или 2J или любой из 6.1 и следующих, где лиганд на стадии (a) содержится в количестве от 0,01 до 0,50 экв., например, от 0,05 до 0,45 экв. или от 0,10 до 0,40 экв., или от 0,20 до 0,30 экв., или примерно 0,25 экв.
6.26. Способ 1J или 2J или любой из 6.1 и следующих, где растворителем на стадии (a) является диоксан или толуол.
6.27. Способ 6.26, где растворителем на стадии (a) является толуол.
6.28. Способ 6.27, где соединение формулы 1E или 2E объединяют с основанием (ii) в растворителе толуоле и смесь азеотропно перегоняют для удаления воды до прибавления катализатора (i) и необязательного йодида (iii) и/или необязательного лиганда (iv).
6.29. Способ 1J или 2J или любой из 6.1 и следующих, где соединение формулы 1F или 2F выделяют путем охлаждения реакционной смеси до комнатной температуры и последующего разбавления смеси неполярным растворителем (например, пентанами, н-пентаном, гексанами, н-гексаном, гептанами, н-гептаном, циклопентаном, циклогексаном или их комбинацией) для осаждения продукта, последующего фильтрования и выделения осадка.
6.30. Способ 6.29, где реакционным растворителем является толуол и добавленным неполярным растворителем является гептан (например, гептаны или н-гептан).
6.31. Способ 6.29 или 6.30, где осадившееся твердое вещество (например, осадок на фильтре) диспергируют водным раствором неорганического основания (например, водным раствором NaOH, KOH или NH4OH) с последующим фильтрованием и промывкой водой.
6.32. Способ 1J или 2J или любой из 6.1 и следующих, где стадией удаления защитной группы (b) является опосредуемая кислотой или основанием реакция расщепления, реакция гидролиза (например, катализируемая кислотой или основанием) или реакция гидрирования.
6.33. Способ 6.32, где стадией удаления защитной группы (b) является кислотный гидролиз, например, водный или неводный кислотный гидролиз.
6.34. Способ 6.33, где кислотный гидролиз включает кислотный катализатор, например, выбранный из хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты и азотной кислоты, необязательно избыток кислоты (например, 10-30 мол. экв. кислоты).
6.35. Способ 6.33, где кислотный гидролиз включает кислоту в неводном растворителе, например, уксусной кислоте, эфире или THF.
6.36. Способ 6.33, где кислотный гидролиз включает кислоту в водном растворителе, например, в воде или смеси вода-спирт (например, вода-метанол или вода-этанол).
6.37. Способ 6.35, где стадия удаления защитной группы (b) включает применение бромистоводородной кислоты в уксусной кислоте (например, 33% мас./мас. HBr в AcOH).
6.38. Любой из способов 6.32-6.37, где стадия удаления защитной группы включает применение бромистоводородной кислоты или бромида водорода и стадия дополнительно включает промывку начального или конечного продукта полярным растворителем (например, этилацетатом, метил-трет-бутиловым эфиром, ацетонитрилом, тетрагидрофураном, 1,4-диоксан или их комбинацией, или одним или большим количеством из них последовательно) для удаления брома из продукта.
6.39. Любой из способов 6.32-6.38, где стадия (b) сначала дает форму соли присоединения с кислотой соединения формулы 1I или 2I (например, соль с HCl или HBr) и где стадия (b) дополнительно включает стадию нейтрализации для превращения формы соли присоединения с кислотой соединения формулы 1I или 2I в соответствующую форму свободного основания.
6.40. Способ 6.39, где стадия нейтрализации включает объединение формы соли присоединения с кислотой соединения формулы 1I или 2I с неорганическим основанием (например, гидроксидом, алкоксидом, карбонатом или бикарбонатом аммония, щелочного металла или щелочноземельного металла).
6.41. Способ 6.40, где неорганическим основанием является гидроксид аммония, необязательно в форме водного раствора аммиака (например, 25% мас./об. водного раствора аммиака).
6.42. Способ 6.32, где стадией удаления защитной группы (b) является опосредуемое основанием расщепление, например, включающее органическое основание (например, пиперидин) в органическом растворителе.
6.43. Способ 6.32, где стадией удаления защитной группы (b) является реакция гидрирования, например, каталитическое гидрирование, включающее катализатор на основе переходного металла (например, платины или палладия) и водород.
6.44. Способ 1J или 2J или любой из 6.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в виде твердого вещества, например, в виде аморфного или кристаллического твердого вещества (в форме свободного основания или соли присоединения с кислотой).
6.45. Способ 1J или 2J или любой из 6.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в основном в чистой форме, например, чистотой более 90 мас.% или, например, чистотой более 95 мас.%, чистотой более 98,5%, чистотой до 100 мас.%.
6.46. Способ 1J или 2J или любой из 6.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в свободной форме (т. е. в форме свободного основания), необязательно в виде кристаллического твердого вещества.
6.47. Способ 1J или 2J или любой из 6.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в форме соли, например, в форме соли присоединения с кислотой.
6.48. Способ 6.48, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в виде соли присоединения, выбранной из гидрохлорида, гидробромида, гидройодида, формиата, ацетата, трифторацетата или метансульфоната, например, при отношении количества молей основания к количеству молей кислоты, составляющем от 1:1 до 2:1.
6.49. Способ 6.44, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в виде гидрохлорида или гидробромида, например, в виде твердого гидрохлорида или гидробромида или кристаллического твердого гидрохлорида или гидробромида.
6.50. Способ 1J или 2J или любой из 6.1 и следующих, где способ проводят без выделения или без очистки промежуточного продукта формулы 1F или 2F.
6.51. Способ 1J или 2J или любой из 6.1 и следующих, где стадии (a) и (b) проводят последовательно в одном реакционном сосуде или в наборе соединенных реакционных сосудов.
6.52. Способ 1J или 2J или любой из 6.1 и следующих, где соединение формулы 1I или 2I (например, соединение любого из 1.1-1.8 или 2.1-2.8) получают в форме, содержащей менее примерно 50 част./млн меди, или менее примерно 10 част./млн меди, или менее примерно 5 част./млн меди.
6.53. Способ 1J или 2J или любой из 6.1 и следующих, где соединение формулы 1J или 2J представляет собой, соответственно соединение формулы 3.1-3.12 или 4.1-4.12.
6.54. Способ 1J или 2J или любой из 6.1 и следующих, где подходящим алкилирующим реагентом на стадии (c) является соединение общей формулы Q-X, где Q выбран из 4-(4-фторфенил)-4-оксобутила и 3-(4-фторфенокси)пропила, и где X означает любую подходящую отщепляющуюся группу (например, функциональную группу, известную в данной области техники в качестве подходящей для реакции нуклеофильного замещения).
6.55. Способ 6.50, где группа X выбрана из хлора, брома, йода, C1-4 алкилсульфонилокси (например, метансульфонилокси) и необязательно замещенной арилсульфонилокси (например, бензолсульфонилокси, 4-нитробензолсульфонилокси, 4-галогенсульфонилокси и т. п.).
6.56. Способ 1J или 2J или любой из 6.1 и следующих, где группой Q соединения формулы 1J или 2J является 4-(4-фторфенил)-4-оксобутил.
6.57. Способ 1J или 2J или любой из 6.1 и следующих, где группой Q соединения формулы 1J или 2J является 3-(4-фторфенокси)пропил.
6.58. Способ 1J или 2J или любой из 6.1 и следующих, где алкилирующим реагентом является 4-хлор-4’-фторбутирофенон или 1-хлор-3-(4-фторфенокси)пропан.
6.59. Способ 1J или 2J или любой из 6.1 и следующих, где стадия (c) включает алкилирующий реагент (например, 1-хлор-3-(4-фторфенокси)пропан) в количестве, равном от 1 до 3 экв., например, от 1 до 2 экв. или от 1,25 до 1,75 экв. или примерно 1,5 экв., например, от 1,35 до 1,65 экв.
6.60. Способ 1J или 2J или любой из 6.1 и следующих, где стадия (c) дополнительно включает подходящее основание, например, органическое основание (например, основание-амин) или неорганическое основание (например, гидрид, алкоксид, арилоксид, карбонат, бикарбонат, фосфат или гидроксид).
6.61. Способ 6.56, где основание на стадии (c) выбрано из триэтиламина, диизопропилэтиламина, карбоната натрия и карбоната калия.
6.62. Способ 6.57, где основанием на стадии (c) является триэтиламин или диизопропилэтиламин.
6.63. Способ 6.58, где триэтиламин или диизопропилэтиламин содержится в количестве от 1 до 10 экв., например, от 2 до 10 экв. или от 4 до 6 экв., или примерно 5 экв., например, 4,5-5,5 экв.
6.64. Способ 1J или 2J или любой из 6.1 и следующих, где стадия (c) дополнительно включает неорганический йодид (например, йодид калия или йодид натрия), необязательно в количестве, равном от 0,75 до 1,5 экв. или от 1 до 1,25 экв., или примерно 1 экв., например, 0,9-1,1 экв.
6.65. Способ 1J или 2J или любой из 6.1 и следующих, где растворителем на стадии (d) является диметилсульфоксид.
6.66. Способ 1J или 2J или любой из 6.1 и следующих, где соединение формулы 1J или 2J получают в форме свободного основания на стадии (c).
6.67. Способ 6.66, где соединение формулы 1J или 2J в форме свободного основания выделяют из реакционной смеси способом, включающим стадии (i) разбавление реакционной смеси органическим растворителем (например, этилацетатом) и водой, (ii) отделение органического слоя и его концентрирование в вакууме до малого объема и (iii) совместное выпаривание остатка с неполярным растворителем (например, пентанами, н-пентаном, гексанами, н-гексаном, гептанами, н-гептаном, циклопентаном, циклогексаном или их комбинацией) от1 до 5 раз (например, трижды) с последующим сбором твердых веществ фильтрованием.
6.68. Способ 6.67, где способ выделения соединения формулы 1J или 2J включает стадию осаждения неочищенного продукта из подходящего растворителя (например, ацетонитрила, ацетона и/или метанола) с получением твердого свободного основания (например, диспергирования неочищенного продукта указанным растворителем и фильтрования для извлечения твердого продукта и/или перекристаллизации продукта из указанного растворителя).
6.69. Способ 6.68, где неочищенный продукт перекристаллизовывают из бинарной смеси растворителей, например, ацетон-метанол или ацетон-этилацетат, при соотношении растворителей, составляющем от 5:1 до 1:5.
6.70. Способ 6.69, где растворителем для перекристаллизации является ацетон-метанол при составляющем от 2:1 до 4:1 отношении количества ацетона к количеству метанола, например, составляющем 3:1 отношении количества ацетона к количеству метанола.
6.71. Любой из способов 6.68-6.70, где способ включает диспергирования неочищенного продукта ацетонитрилом с последующей перекристаллизацией из бинарного растворителя (например, ацетон-метанол).
6.72. Способ 1J или 2J или любой из 6.1 и следующих, где соединение формулы 1J или 2J получают в форме соли на стадии (c), например, соли присоединения с кислотой (например, гидрохлорида).
6.73. Любой из способов 6.66-6.71, где соединение формулы 1J или 2J получают в форме свободного основания на стадии (c) и где способ дополнительно включает стадию (d) превращения указанного соединения формулы 1J или 2J в форме свободного основания в соединение формулы 1J или 2J в форме соли, например, в форме соли присоединения с кислотой (например, в форме тозилата).
6.74. Способ 6.73, где стадия (d) включает обработку соединения формулы 1J или 2J в форме свободного основания кислотой (например, толуолсульфоновой кислотой) в количестве, равном от 1,25 до 2,00 мол. экв. кислоты в пересчете на свободное основание (например, от 1,3 до 1,6 экв., или примерно 1,5 экв.), в подходящем растворителе (например, метаноле, этаноле, пропаноле, изопропаноле, ацетонитриле, метилизобутилкетоне, метилэтилкетоне).
6.75. Способ 6.73 или 6.74, где температура на стадии (d) равна от 25°C до 100°C, например, от 30°C до 60°C или от 45°C до 55°C, или 50°C.
6.76. Способ 6.74 или 6.75, где кислотой является толуолсульфоновая кислота и растворителем является метилэтилкетон.
6.77. Любой из способов 6.73-6.76, где стадия (d) приводит к самопроизвольному осаждению соединения формулы 1J или 2J в твердой форме, необязательно в кристаллическом виде, необязательно с последующей промывкой растворителем (например, солеобразующим растворителем).
6.78. Способ 1J или 2J или любой из 6.1 и следующих, где способ дает соединение формулы 1J или 2J в форме свободного основания, необязательно в форме твердого кристаллического свободного основания.
6.79. Способ 1J или 2J или любой из 6.1 и следующих, где способ дает соединение формулы 1J или 2J в форме соли присоединения с кислотой, необязательно в форме твердой кристаллической соли.
6.80. Способ 6.79, где формой соли присоединения с кислотой является форма тозилата.
6.81. Способ 1J или 2J или любой из 6.1 и следующих, где способ дает соединение формулы 1J или 2J, содержащее не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95%, до 100% цис-стереоизомера в пересчете на все остальные стереоизомеры.
6.82. Способ 1J или 2J или любой из 6.1 и следующих, где способ дает соединение формулы 1J или 2J в основном в энантиомерно чистой форме, например, составляющим не менее 90% e.e., предпочтительно не менее 95% e.e., или не менее 97% e.e, или не менее 99% e.e., или не менее 99,5% e.e., или не менее 99,9% e.e., до 100% e.e.
6.83. Способ 1J или 2J или любой из 6.1 и следующих, где способ дает соединение формулы 1J или 2J в основном в чистой форме, например, по данным исследования с помощью HPLC, например, в форме чистотой более 95% или более 97%, более 98%, более 98,5%, более 99%, более 99,5% или в форме чистотой более 99,9%, в форме чистотой до 100%.
6.84. Способ 1J или 2J или любой из 6.1 и следующих, где способ дает соединение формулы 1J или 2J в форме, содержащей менее примерно 50 част./млн меди, или менее примерно 10 част./млн меди, или менее примерно 5 част./млн меди.
6.85. Способ 1J или 2J или любой из 6.1-6.84, где способ дает соединение формулы 1J или 2J в смеси с не менее 0,001 мас.% и менее 2 мас.% по меньшей мере одного соединения, выбранного из соединения формулы 1K или 2K, или 1L, или 2L.
6.86. Способ 6.85, где способ дает соединение формулы 1J или 2J в смеси с не менее 0,10 мас.% и менее 2 мас.% по меньшей мере одного соединения, выбранного из соединения формулы 1K или 2K, или 1L, или 2L.
6.87. Способ 6.86, где способ дает соединение формулы 1J или 2J в смеси с не менее 1,0 мас.% и менее 2,0 мас.% соединения формулы 1K или 2K.
6.88. Способ 6.86 или 6.87, где способ дает соединение формулы 1J или 2J в смеси с не менее 1,0 мас.% и менее 2,0 мас.% соединения формулы 1L или 2L.
6.89. Способ 1J или 2J или любой из 6.1 и следующих, где способ дает соединение формулы 1J или 2J в смеси с менее 1,0 мас.% 1-хлор-3-(4-фторфенокси)пропана), например, менее 0,5% или менее 0,25%, или менее 0,15% или менее 0,10%, или менее 0,08 мас.% 1-хлор-3-(4-фторфенокси)пропана).
6.90. Способ 1J или 2J или любой из 6.1 и следующих, где способ дает соединение формулы 1J или 2J в смеси с менее 5000 част./млн любого органического растворителя (например, ацетона, ацетонитрила или метанола), например, менее 4000 част./млн или менее 3000 част./млн, или менее 1500 част./млн, или менее 1000 част./млн, или менее 500 част./млн, или менее 410 част./млн, любого такого органического растворителя.
6.91. Любой из способов 6.85-6.90, где в соединении формулы 1K или 2K, или 1L, или 2L группа R означает H и группа Q означает -O-.
6.92. Способ 1J или 2J или любой из 6.1-6.91, дополнительно включающий любую или все следующие стадии, описанные в любых его вариантах осуществления везде в настоящем изобретении:
a. Получение соединения формулы 1A по реакции 2-бромфенилгидразина в свободной форме или в форме соли, с 4-пиперидиноном в свободной форме или в форме соли, необязательно в форме гидрата, необязательно в растворителе уксусной кислоте ;
b. Получение соединения формулы 1C или 2C в свободной форме или в форме соли путем (a) восстановления соединения формулы 1A в соединение формулы 1B, где восстановление необязательно включает реакцию соединения формулы 1A с триэтилсиланом и метансульфоновой кислотой, и (b) разделение стереоизомеров формулы 1B с помощью разделения хиральной соли хиральной хроматографией с получением соединения формулы 1C или 2C, необязательно где разделение хиральной соли проводят в одну стадию разделения с использованием S-миндальной кислоты;
c. Получение соединения формулы 1D или 2D в свободной форме или в форме соли путем защиты пиперидинамина формулы 1C или 2C защитным реагентом в присутствии основания;
d. Получение соединения формулы 1E или 2E в свободной форме или в форме соли путем N-алкилирования соединения формулы 1D или 2D (a) нуклеофильным алкилгалогенидом и (b) основанием.
[0053] Другим объектом настоящего изобретения является способ (способ 1F) получения соединения формулы 1F в свободной форме или в форме соли, включающий стадии (a) реакцию соединения формулы 1E в свободной форме или в форме соли, в растворителе, включающем толуол, с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) основанием, (iii) необязательно йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом), и (iv) одним или большим количеством моно- или бидентатных лигандов, включающих DBU, с получением соединения формулы 1F в свободной форме или в форме соли с последующим (b) выделением соединения формулы 1F в свободной форме или в форме соли путем осаждения из смеси гидрофобных растворителей.
[0054] В другом варианте осуществления этого объекта настоящее изобретение относится к способу (способ 2F) получения соединения формулы 2F в свободной форме или в форме соли, включающему стадии (a) реакцию соединения формулы 2E в свободной форме или в форме соли, в растворителе, включающем толуол, с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) основанием, (iii) необязательно йодидом или бромидом щелочного металла или аммония (например, йодидом калия или тетрабутиламмонийбромидом), и (iv) одним или большим количеством моно- или бидентатных лигандов, включающих DBU, с получением соединения формулы 2F в свободной форме или в форме соли с последующим (b) выделением соединения формулы 2F в свободной форме или в форме соли путем осаждения из смеси гидрофобных растворителей.
[0055] Способы предшествующего уровня техники синтеза соединений, таких как соединения формулы 1F или 2F, включают применение йодида меди в растворителе диоксане с лигандом N,N,N’,N’-тетраметилэтилендиамином или применение йодида меди в растворителе толуоле с основанием карбонатом калия и лигандом DBU. Однако эти способы предшествующего уровня техники страдают от одного или большего количества следующих недостатков: (1) длительные времена реакции, (2) образование нежелательных примесей, и/или (3) потери продукта вследствие разложения во время выпаривания реакционного растворителя. Заявитель неожиданно установил, что выбор реакции и условий очистки критически важен для улучшения выхода. В частности, неожиданно было установлено, что вода стимулирует образование примесей и разложение. Применение толуола в качестве растворителя, в особенности азеотропно перегнанного толуола, приводит к увеличению выхода и чистоты продукта. Кроме того, неожиданно было установлено, что осаждение продукта из реакционной смеси, индуцированное путем добавления гидрофобного углеводородного растворителя дает более чистый продукт и с более высоким выходом, чем способы предшествующего уровня техники.
[0056] В предпочтительных вариантах осуществления способов 1F и 2F настоящее изобретение также относится к следующим:
7.1. Способ 1F или 2F, где катализатором на основе переходного металла на стадии (a) является медный катализатор.
7.2. Способ 7.1, где катализатор на основе переходного металла на стадии (a) выбран из CuI, CuBr, CuCl, Cu(OAc)2, Cu2Cl2, CuBr2, CuSO4, Cu2SO4 и Cu2O.
7.3. Способ 7.2, где катализатор на основе переходного металла на стадии (a) выбран из CuI, CuBr и CuCl.
7.4. Способ 7.3, где катализатором на основе переходного металла является CuI.
7.5. Способ 1F или 2F, или любой из 7.1 и следующих, где катализатор на основе переходного металла на стадии (a) содержится в количестве от 0,01 до 0,50 экв., например, от 0,05 до 0,40 экв. или от 0,10 до 0,30 экв., или от 0,15 до 0,25 экв., или примерно 0,20 экв.
7.6. Способ 1F или 2F, или любой из 7.1 и следующих, где основанием на стадии (a) является основание Бренстеда, например, выбранное из аминных оснований, алкоксидов, карбонатов и фосфатов и их смесей.
7.7. Способ 7.6, где основанием на стадии (a) является карбонатное основание, например, карбонат или бикарбонат щелочного или щелочноземельного металла, или их смеси.
7.8. Способ 7.7, где основание на стадии (a) выбрано из карбоната натрия, карбоната калия, бикарбоната натрия, или бикарбоната калия, или их смеси.
7.9. Способ 7.8, где основание на стадии (a) включает карбонат калия, необязательно в количестве, равном от 1,5 до 3 экв., например, от 2 до 2,5 экв., или примерно 2,2 экв.
7.10. Способ 1F или 2F, или любой из 7.1 и следующих, где стадия (a) включает йодид или бромид щелочного металла или аммония, например, выбранный из йодида натрия, йодида калия, йодида лития, бромида натрия, бромида калия, бромида лития, или тетраалкиламмониййодида или -бромида (например, тетрабутиламмонийбромида).
7.11. Способ 7.10, где стадия (a) включает йодид калия.
7.12. Способ 1F или 2F, или любой из 7.1 и следующих, где DBU лиганд на стадии (a) содержится в количестве от 0,01 до 0,50 экв., например, от 0,05 до 0,45 экв. или от 0,10 до 0,40 экв., или от 0,20 до 0,30 экв., или примерно 0,25 экв.
7.13. Способ 1F или 2F, или любой из 7.1 и следующих, где соединение формулы 1E или 2E объединяют с основанием (ii) в растворителе толуоле и смесь азеотропно перегоняют для удаления воды до прибавления катализатора (i) и необязательного йодида (iii) и лиганда (iv).
7.14. Способ 1F или 2F, или любой из 7.1 и следующих, где соединение формулы 1F или 2F выделяют путем охлаждения реакционной смеси до комнатной температуры и последующего разбавления смеси неполярным растворителем (например, пентанами, н-пентаном, гексанами, н-гексаном, гептанами, н-гептаном, циклопентаном, циклогексаном или их комбинацией) для осаждения продукта, последующего фильтрования и выделения осадка.
7.15. Способ 7.14, где реакционным растворителем является толуол и добавленным неполярным растворителем является гептан (например, гептаны или н-гептан).
7.16. Способ 7.14 или 7.15, где осадившееся твердое вещество (например, осадок на фильтре) диспергируют водным раствором неорганического основания (например, водным раствором NaOH, KOH или NH4OH) с последующим фильтрованием и промывкой водой.
7.17. Способ 7.16, где осадившееся твердое вещество диспергируют водным раствором гидроксида аммония с последующим фильтрованием и промывкой водой.
7.18. Способ 1F или 2F, или любой из 7.1 и следующих, где соединение формулы 1F или 2F получают в виде твердого вещества, например, в виде аморфного или кристаллического твердого вещества.
7.19. Способ 1F или 2F, или любой из 7.1 и следующих, где соединение формулы 1F или 2F получают в основном в чистой форме, например, чистотой более 90 мас.% или, например, чистотой более 95 мас.%, чистотой до 100 мас.%.
7.20. Способ 1F или 2F, или любой из 7.1 и следующих, где соединение формулы 1F или 2F получают в свободной форме (т.е. в форме свободного основания), необязательно в виде кристаллического твердого вещества.
7.21. Способ 1F или 2F, или любой из 7.1 и следующих, где соединение формулы 1F или 2F получают в форме, содержащей менее примерно 50 част./млн меди, или менее примерно 10 част./млн меди, или менее примерно 5 част./млн меди.
[0057] В некоторых вариантах осуществления любой из способов 1F, 2F, 1I, 2I, 1J, 2J, или 5.1-5.56 или 6.1-6.92, или 7.1-7.21, может дополнительно включать стадию получения соединения формулы 1C или 2C:
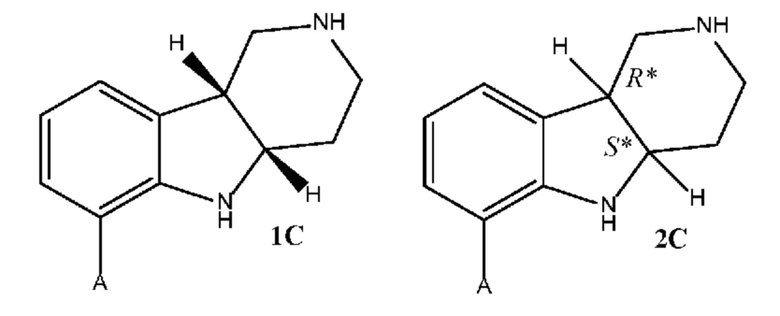
в свободной форме или в форме соли, включающую подстадии:
a) восстановление соединения формулы 1A:
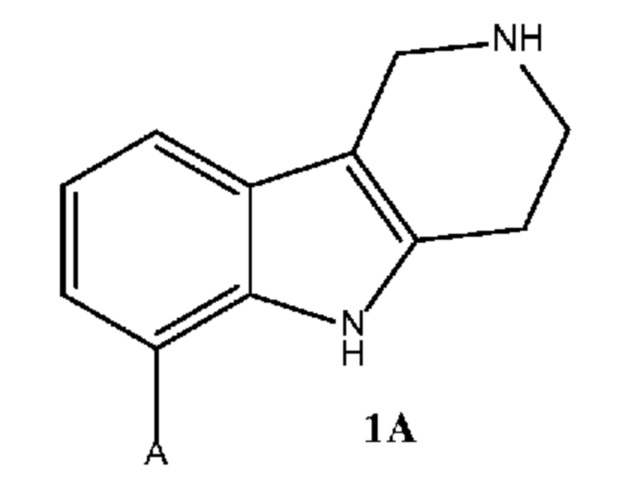
в соединение формулы 1B:
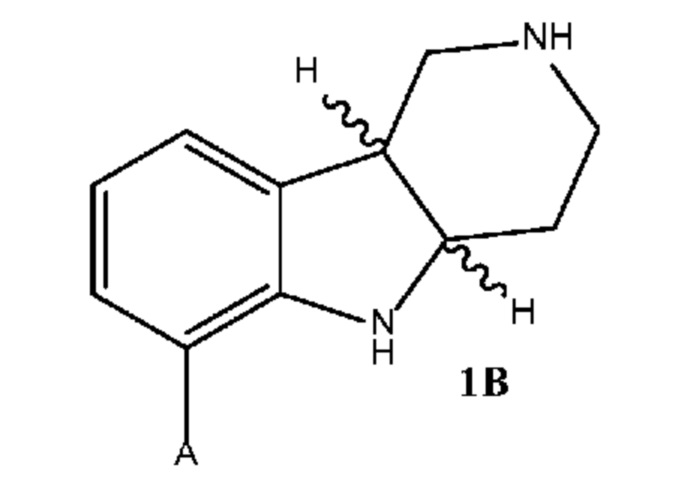
где заместитель A соединений формул 1A, 1B, 1C и/или 2C выбран из Br, Cl и I; и
b) разделение стереоизомеров (например, энантиомеров) соединений формулы 1B с помощью разделения хиральной кислоты или хиральной хроматографии с получением соединения формулы 1C или 2C; необязательно где соединение формулы 1C или 2C содержит не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95% и до 100% цис-стереоизомера в пересчете на все остальные стереоизомеры; и/или где соединение формулы 1C или 2C обладает энантиомерным избытком (e.e.) (например, энантиомера 4aS, 9bR или энантиомера 4aR, 9bS), составляющим не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95% или более 97% или более 99% или более 99,9% и до 100%.
[0058] Восстановление соединений формулы 1A в соединения формулы 1B можно провести путем применения восстановительного реагента, включая, но не ограничиваясь только ими: силаны в присутствии кислоты (например, уксусной, метансульфоновой кислоты или трифторуксусной кислоты); металл (например, цинк) и неорганические кислоты (например, хлористоводородная кислоты); натрий и жидкий аммиак; натрий в этаноле; или путем применения комплексов боран-амин (например, боран-триэтиламин в тетрагидрофуране); триацетоксиборогидрид натрия; или цианоборогидрид натрия. Превращение соединения формулы 1A в соединение формулы 1B также можно провести путем каталитического гидрирования, при котором соединение формулы 1A обрабатывают водородом в присутствии катализатора, такого как оксид палладия, палладий на угле или оксид платины (см. Hudlicky, M., "Reductions in Organic Chemistry", Ellis Horwood, Ltd., Chichester, UK, 1984). Восстановление соединения формулы 2A в соединение формулы 2B можно провести путем применения аналогичных реагентов, описанных для восстановления соединений формулы 1A - 1B, таких как силаны (например, триэтилсилан) в присутствии кислоты (например, уксусной, метансульфоновой или трифторуксусной кислоты); металл (например, цинк) и неорганическая кислота (например, хлористоводородная кислота); натрий и жидкий аммиак; натрий в этаноле; или путем применения комплексов боран-амин (например, боран-триэтиламин в тетрагидрофуране); триацетоксиборогидрид натрия; или цианоборогидрид натрия. Превращение соединения формулы 2A в соединение формулы 2B также можно провести путем каталитического гидрирования, при котором соединение формулы 2A обрабатывают водородом в присутствии катализатора, такого как оксид палладия, палладий на угле или оксид платины. В особенно предпочтительном варианте осуществления восстановления соединений формулы 1A или 2A восстановление проводят путем применения триэтилсилана в присутствии трифторуксусной кислоты или триэтилсилана в присутствии метансульфоновой кислоты. В частности, неожиданно было установлено, что замена трифторуксусной кислоты метансульфоновой кислотой значительно увеличивает выход, уменьшает время реакции и увеличивает экономическую эффективность. Например, использование 4 объемов метансульфоновой кислоты вместо 10 объемов трифторуксусной кислоты значительно сокращает потребность в дорогостоящем триэтилсилане (от 7 объемов до 1,3 объемов) и уменьшает время реакции от 45 ч до 2-5 ч при увеличении выхода стадии.
[0059] В некоторых вариантах осуществления энантиомерное обогащение (или разделение) изомеров соединений формулы 1B с получением соединений формулы 1C или 2C можно провести с помощью разделения хиральной соли, в котором используют хиральные кислоты, такие как хиральные сульфоновые кислоты или моно- или дикарбоновые кислоты или их производные. Примеры таких кислот включают, но не ограничиваются только ими, (+/-)/(R/S) винную кислоту, (+/-)/ (R/S) (моно- или диацетил)винную кислоту, (+/-)/(R/S) (моно- или дибензоил)винную кислоту, (+/-)/(R/S) (моно- или дипивалоил)винную кислоту, (+/-)/(R/S) миндальную кислоту, (+/-)/ (R/S) ацетоксифенилуксусную кислоту, (+/-)/(R/S) метоксифенилуксусную кислоту, (+/-)/(R/S) гидроксиминдальную кислоту, (+/-)/(R/S) галогеноминдальную кислоту (например, 4-фторминдальную кислоту), (+/-)/(R/S) молочную кислоту и (+/-)/(R/S) камфорсульфоновую кислоту. Аналогичным образом, разделение энантиомеров соединений формулы 2B можно провести с помощью разделения хиральной соли, где используют хиральные кислоты, такие как хиральные сульфоновые кислоты или моно- или дикарбоновые кислоты или их производные. Примеры таких кислот включают, но не ограничиваются только ими, (+/-)/(R/S) винную кислоту, (+/-)/ (R/S) (моно- или диацетил)винную кислоту, (+/-)/(R/S) (моно- или дибензоил)винную кислоту, (+/-)/(R/S) (моно- или дипивалоил)винную кислоту, (+/-)/(R/S) миндальную кислоту, (+/-)/ (R/S) ацетоксифенилуксусную кислоту, (+/-)/(R/S) метоксифенилуксусную кислоту, (+/-)/(R/S) гидроксиминдальную кислоту, (+/-)/(R/S) галогеноминдальную кислоту (например, 4-фторминдальную кислоту), (+/-)/(R/S) молочную кислоту и (+/-)/(R/S) камфорсульфоновую кислоту. Предпочтительно, если разделение соединений формулы 1B или 2B проводят с использованием миндальной кислоты. В особенно предпочтительном варианте осуществления, указанной кислотой является (S)-(+)-миндальная кислота. Разделение можно оптимизировать, когда нежелательный энантиомер удаляют первым. Поэтому в другом предпочтительном варианте осуществления разделение проводят путем добавления (R)-(-)-миндальной кислоты для удаления нежелательного энантиомера первым, затем добавляют (S)-(+)-миндальную кислоту и получают искомый продукт. В некоторых вариантах осуществления проводят только одно разделение с использованием только (S)-(+)-миндальной кислоты. Предпочтительные для разделения растворители включают метанол, этанол, метил-трет-бутиловый эфир (MTBE) и их комбинации.
[0060] В другом варианте осуществления энантиомерное обогащение (или разделение) стереоизомеров соединений формулы 1B можно провести путем использования хиральной хроматографии, например, с использованием колонки с трис(3,5-диметилфенилкарбаматом) амилозы, продающейся под торговым названием "CHIRALPAK® AD®". Изомеры формулы 1B можно разделить и элюировать подвижной фазой, такой как этанол, при скорости потока, равной 100-450 мл/мин. В еще одном варианте осуществления изомеры формулы 1B можно разделить и элюировать подвижной фазой, такой как метанол или изопропиловый спирт. Фракции, содержащие искомые соединения, предпочтительно, соединения формулы 1C или 2C, можно собрать и отделить. В одном варианте осуществления хиральная хроматография включает применение колонки CHIRALPAK® AD®, 20 мкм, 5 см ID×50 см L и 100% этанола в качестве подвижной фазы при скорости потока, равной 150 мл/мин. В другом варианте осуществления хиральная хроматография включает применение колонки CHIRALPAK® AD®, 20 мкм, 11 см ID×25 см L и 100% этанола в качестве подвижной фазы при скорости потока, равной 400 мл/мин.
[0061] Следует понимать, что при разделении изомеров соединений формулы 1B и получении соединений формулы 1C или 2C диастереоизомерный или энантиомерный состав соединений становится фиксированным или в основном фиксированным, поскольку все последующие реакции в последовательности, дающей соединение формулы 1J или 2J, в основном не меняют диастереоизомерный или энантиомерный состав соединений. Таким образом, во всех объектах и вариантах осуществления настоящего изобретения все промежуточные продукты формул 1D, 1E, 1F, 1H и 1I могут в существенной степени, в основном или полностью представлять собой один цис-энантиомер при существенном или полном исключении противоположного цис-изомера или любого транс-изомера. Аналогичным образом, во всех объектах и вариантах осуществления настоящего изобретения все промежуточные продукты формул 2D, 2E, 2F, 2H и 2I могут в существенной степени, в основном или полностью представлять собой один цис-энантиомер, точнее, 4aS, 9bR энантиомер при существенном или полном исключении противоположного цис-изомера или любого транс-изомера. Таким образом, при использовании в настоящем изобретении все промежуточные продукты формул 1D, 2D, 1E, 2E, 1F, 2F, 1H, 2H, 1I и 2I могут содержать не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95% и до 100% цис-стереоизомера в пересчете на все остальные стереоизомеры; и/или обладать энантиомерным избытком (e.e.), составляющим не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно более 95%, или более 97%, или более 98,5%, или более 99%, или более 99,9% и до 100%.
[0062] В некоторых вариантах осуществления любой из способов 1F, 2F, 1I, 2I, 1J, 2J, или 5.1-5.56 или 6.1-6.92, или 7.1-7.21 может дополнительно включать стадию получения соединения формулы 1A в свободной форме или в форме соли, по реакции 2-бромфенилгидразина с 4-пиперидиноном в кислотном растворителе (индольная реакция Фишера). В некоторых вариантах осуществления 2-бромфенилгидразин и/или 4-пиперидинон используют в виде соли присоединения с кислотой, например, гидрохлорида, гидробромида, ацетата или трифторацетата. В некоторых вариантах осуществления 4-пиперидинон содержится, как гидрат, например, моногидрат. В некоторых вариантах осуществления получают продукт в виде соли присоединения с кислотой, например, гидрохлорида, гидробромида, трифторацетата, сульфата, или ацетата. Реакцию можно провести в любом подходящем растворителе, например, в водном или спиртовом растворителе (например, воде, метаноле, этаноле или изопропаноле или любой их смеси), содержащем растворенную кислоту (например, HCl, HBr, H2SO4, уксусную кислоту), или в неразбавленном кислотном растворителе (например, уксусной кислоте, трифторуксусной кислоте). В некоторых вариантах осуществления выход можно увеличить путем использования растворителя, в котором продукт плохо растворим. В некоторых вариантах осуществления выход увеличивают путем использования неразбавленной уксусной кислоты в качестве растворителя.
[0063] В некоторых вариантах осуществления любой из способов 1F, 2F, 1I, 2I, 1J, 2J, или 5.1-5.56 или 6.1-6.92, или 7.1-7.21 может дополнительно включать стадию получения соединения формулы 1D или 2D:
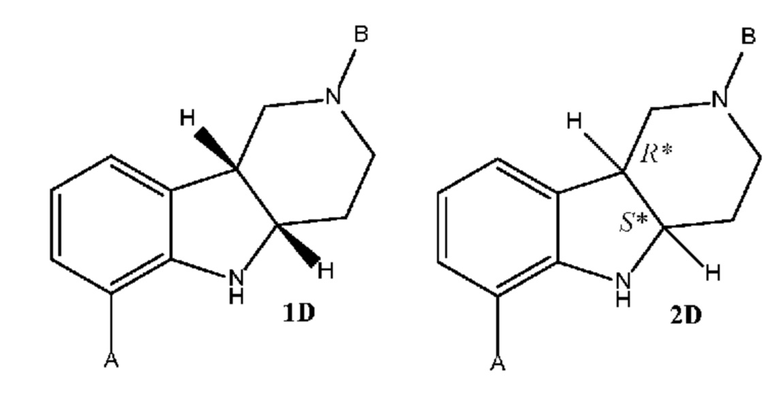
где:
(i) A выбран из Br, Cl и I; и
(ii) B означает защитную группу, определенную в настоящем изобретении;
в свободной форме или в форме соли,
включать стадию защиты пиперидинамина формулы 1C или 2C защитным реагентом в присутствии основания;
где указанным защитным реагентом является соединение общей формулы:
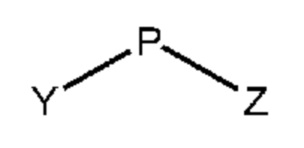
где:
(i) Y означает галоген, имидазолил, бензотриазол, N-(окси)сукцинимид, алкоксигруппу, -O-алкиларил или -O-арил;
(ii) Z означает необязательно замещенный алкил, арил, алкиларил или -OR где R означает алкил, арил, арилалкил или гетероарилалкил;
(iii) P означает -CH2-, -C(O)-, -C(O)O- или S(O)2.
[0064] Примеры подходящего защитного реагента для реакции с соединениями формулы 1C или 2C включают, но не ограничиваются только ими, бензилоксикарбонилхлорид (Cbz-Cl), трифенилметилхлорид, этилхлорформиат, трет-бутоксикарбонильный ангидрид (Boc2O), бензил N-сукцинимидилкарбонат или бензоилгалогенид (например, бензоилхлорид или -бромид), (бензилоксикарбонил)-бензотриазол, бензилгалогенид (например, бензилхлорид или -бромид), 1-аренсульфонилхлорид или толуолсульфонилхлорид. Другим примером защитного реагента соединений формулы 1C или 2C является п-метоксибензил, который можно получить с использованием п-метоксибензилхлорида, п-метоксибензилбромида или п-метоксибензальдегида. Защитные реагенты, раскрытые в настоящем изобретении не являются исчерпывающими. Другие примеры защитного реагента для амина приведены в одном из многих общих руководств по этому вопросу, например, в "Protective Groups in Organic Synthesis" by Theodora Green (publisher: John Wiley & Sons), раскрытие которого включено в настоящее изобретение в качестве ссылки. Поэтому после добавления защитного реагента к соединениям формулы 1C или 2C заместитель B полученного соединения 1D или 2D описывается общей формулой:
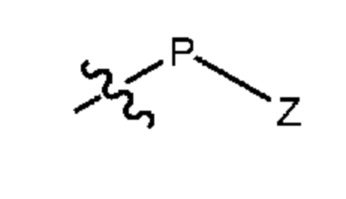
где:
(i) Z означает необязательно замещенный алкил, арил, алкиларил или -OR где R означает алкил, арил, арилалкил или гетероарилалкил;
(ii) P означает -CH2-, -C(O)-, -C(O)O- или S(O)2.
[0065] Для стадии защиты этого варианта осуществления обычно необходимо добавление основания, такого как: бутиллитий или гидриды металлов (например, гидрид калия); бикарбонаты, карбонаты или гидроксиды щелочных или щелочноземельных металлов (например, карбонат калия или натрия, бикарбонат натрия или гидроксид натрия), или органические амины (например, триэтиламин). Предпочтительным защитным реагентом для соединений формулы 1D или 2D является этилхлорформиат или BOC ангидрид. В особенно предпочтительном варианте осуществления указанным защитным реагентом является этилхлорформиат и указанным основанием является триэтиламин или гидроксид натрия.
[0066] В некоторых вариантах осуществления превращение соединения формулы 1C или 2C в соединение формулы 1D или 2D включает обработку этилхлорформиатом и гидроксидом натрия в смеси воды и THF.
[0067] В некоторых вариантах осуществления методика защиты пиперидинового атома азота соединения формулы 1C или 2C включает проводимую сначала нейтрализацию соли соединения формулы 1C или 2C, например, соли с миндальной кислотой, подходящим основанием, затем выделение, отделение или очистка свободного основания соединения формулы 1C или 2C. Затем добавляют соответствующие реагенты для защиты пиперидинового атома азота соединения формулы 1C или 2C вместе с подходящим основанием с получением соединения формулы 1D или 2D. Основание, использующееся для нейтрализации, может быть или может не быть основанием, использующимся для реакции защиты. В других вариантах осуществления соль соединения формулы 1C или 2C (например, манделат) вводят в реакцию с соответствующими реагентами для защиты в присутствии избытка основания для того, чтобы получить соединения формулы 1D или 2D в одну стадию. Таким образом, реакции образования и ацилирования свободного основания в этих вариантах осуществления проводят одновременно. Предпочтительным основанием является гидроксид натрия.
[0068] В некоторых вариантах осуществления любой из способов 1F, 2F, 1I, 2I, 1J, 2J, или 5.1-5.52 или 6.1-6.92, или 7.1-7.21, может дополнительно включать стадию получения соединения формулы 1E или 2E:
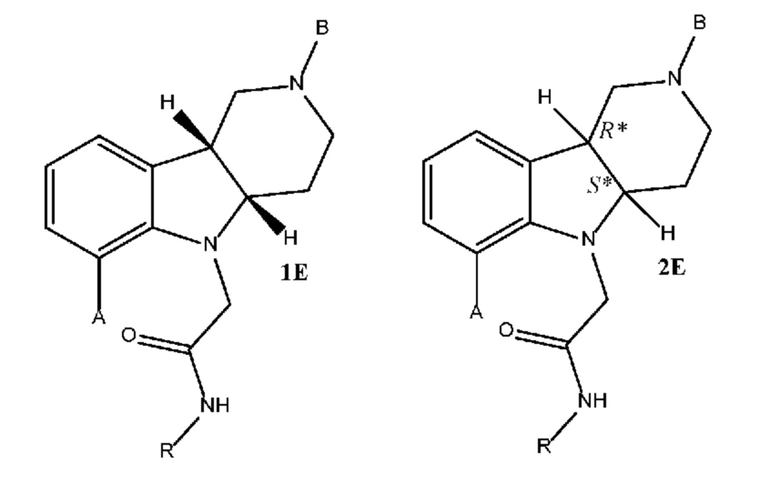
где:
(i) A выбран из Br, Cl и I;
(ii) R выбран из H и C1-4 алкила (например, метила); и
(iii) B означает защитную группу, определенную в настоящем изобретении;
в свободной форме или в форме соли,
включая стадию N-алкилирования соединения формулы 1D или 2D, описанного выше в настоящем изобретении, (a) нуклеофильным алкилгалогенидом общей формулы:
где:
(i) A=Cl, F, Br или I; и
(ii) R означает H или C1-4 алкил;
и (b) основанием и необязательно (c) катализатором (например, источником йодида или бромида).
[0069] Другим объектом настоящего изобретения является способ получения соединения формулы 1D или 2D, определенного выше, включающий стадию N-алкилирования соединения формулы 1D или 2D (a) нуклеофильным алкилгалогенидом (b) основанием, и (c) катализатором, в подходящем растворителе, описанном ниже в настоящем изобретении.
[0070] Примеры нуклеофильных алкилгалогенидов, подходящих для алкилирования соединений формулы 1D и 2D, включают, но не ограничиваются только ими, 2-хлорацетамид, 2-бромацетамид, N-C1-4 алкил-2-хлорацетамиды (например, N-метил-2-хлорацетамид) и N-C1-4 алкил-2-бромацетамиды (например, N-метил-2-бромацетамид). Примеры оснований применимых для указанного алкилирования включают, но не ограничиваются только ими, органические основания, такие как основания-амины (например, аммиак, триэтиламин, N,N’-диизопропилэтиламин или 4-(диметиламино)пиридин (DMAP), 1,5- диазабицикло[4.3.0]-нон-5-ен (DBN), 1,5-диазабицикло[5.4.0]ундец-5-ен (DBU)); или неорганические основания, такие как гидриды (например, гидрид натрия, лития или калия), алкоксиды (например, трет-бутоксид натрия, калия или лития и K(OAr), Na(OAr)) или карбонаты, бикарбонаты, фосфаты или гидроксиды щелочных или щелочноземельных металлов (например, бикарбонат, гидроксид или фосфат натрия, магния, кальция, калия, цезия или карбонат бария). Необязательно указанную реакцию N-алкилирования можно провести в присутствии источника йодида или бромида, такого как йодид или бромид щелочного металла или аммония. Например, йодида калия или йодида натрия, или бромида калия или бромида натрия, тетраалкилйодида аммония (например, тетрабутиламмониййодида), или тетраалкилбромида аммония (например, тетрабутиламмонийбромида). В предпочтительных вариантах осуществления алкилирование можно провести с использованием 2-хлорацетамида или N-метил-2-хлорацетамида в присутствии N,N’-диизопропилэтиламина и йодида калия в растворителе диметилацетамиде. Подходящие растворители также включают ацетонитрил, диоксан, диметилформамид и диметилацетамид.
[0071] В предпочтительном варианте осуществления алкилирование соединения формулы 1D или 2D проводят с использованием 2-хлорацетамида, N,N-диизопропилэтиламина и тетрабутиламмониййодида или -бромида в подходящем растворителе, таком как диметилацетамид, при температуре, равной от 90 до 110°C. Авторы настоящего изобретения неожиданно установили, что при масштабировании способов предшествующего уровня техники для получения соединения формулы 1E или 2E возникает затруднение, связанное с экзотермическим автокаталитическим разложением при температурах, близких к температуре предшествующей реакции (т. е. примерно при 120°C или выше). Поэтому авторы изобретения провели повторное исследование для поиска альтернативного набора условий проведения реакции. Исследованные факторы включают концентрацию, температуру, дозирование реагентов, молярные отношения, выбранный растворитель (например, диметилацетамид, N-метилпирролидон, DMSO, ацетон и ацетонитрил), выбранный катализатор (например, галогениды щелочного металла, такие как KI и KBr; соли аммония, такие как тетрабутиламмониййодид или -бромид; отщепляющаяся группа нуклеофильного алкилгалогенида (например, Cl или Br) и источник основания (например, основания-амины, такие как DIPEA, основания-гидриды, такие как NaH, неорганические основания, такие как карбонат натрия или калия). Неожиданно было установлено, что улучшенные результаты получают с использованием катализатора тетраалкилгалогенида аммония (например, тетрабутилйодида или -бромида аммония) в количестве, равном примерно от 0,5 до 1,5 экв., например, от 0,75 до 1,25 экв., или от 0,9 до 1,10 экв. (например, примерно 1,0 экв.), с основанием-третичным амином (например, DIPEA в количестве 1,5-1,9 экв., например, примерно 1,7 экв.) и 2-хлорацетамида в растворителе диметилацетамиде. Предпочтительно, если температура равна от 90 до 110°C, такая как от 95 до 100°C. Поскольку этот способ дает немного меньшие выходы, чем способы предшествующего уровня техники, дополнительно неожиданно было установлено, что можно использовать преимущество разностей растворимостей соединений формулы 1D/2D и 1E/2E в этилацетате. Поэтому в предпочтительном варианте осуществления стадия получения соединения формулы 1E или 2E, включает стадию повторного суспендирования неочищенного продукта в растворителе этилацетате, необязательно в виде смеси с растворителем н-гексаном, и выделение продукта путем кристаллизации при температуре, равной от 5 до 70°C.
[0072] Другим объектом настоящего изобретения является активная фармацевтическая композиция (активный фармацевтический ингредиент), содержащая соединение формулы 1J или 2J в основном в чистой форме. В других вариантах осуществления этого объекта настоящее изобретение относится к следующим:
8.1. Активная фармацевтическая композиция (активный фармацевтический ингредиент), содержащая соединение формулы 1J или 2J в форме фармацевтически приемлемой соли, где композиция содержит не менее 97 мас.% указанного соединения (в пересчете на форму соли), необязательно в форме твердой кристаллической соли (например, в форме тозилата).
8.2. Композиция 8.1, где соединением является соединение формулы 1J, где R означает H и Q означает 3-(4-фторфенокси)пропил.
8.3. Композиция 8.2, где указанное соединение находится в основном в энантиомерно чистой форме, например, характеризующееся составляющим не менее 97% e.e., или не менее 98% e.e, или не менее 98,5% e.e., или не менее 99% e.e., до 100% e.e.
8.4. Композиция 8.2 или 8.3, где композиция содержит соединение в количестве, равном не менее 98%, не менее 98,5% или не менее 99,0 мас.% (в пересчете на форму соли).
8.5. Любая из композиций 8.2-8.4, где соединение находится в форме свободного основания, необязательно в форме твердого кристаллического свободного основания.
8.6. Любая из композиций 8.1-8.5, где композиция содержит не более 2,0 мас.% каждого любого из соединений 1A, 1B, 1C, 1D, 2D, 1E, 2E, 1F, 2F, 1I или 2I, например, не более 1,0 мас.% каждого или не более 0,50 мас.% каждого.
8.7. Любая из композиций 8.1-8.6, где композиция содержит не более 2,0 мас.% соединения формулы 1I или 2I (например, где R означает H), например, не более 1,5% или не более 1,0% или не более 0,5 мас.%.
8.8. Любая из композиций 8.1-8.7, где композиция содержит не более 50 част./млн меди, например, не более 40 част./млн, или не более 25 част./млн, или не более 10 част./млн меди, или не более 5 част./млн меди.
8.9. Любая из композиций 8.1-8.8, где композиция содержит не менее 0,001 мас.% и менее 2 мас.% по меньшей мере одного соединения, выбранного из соединения формулы 1K или 2K, или 1L, или 2L.
8.10. Любая из композиций 8.1-8.8, где композиция содержит соединение формулы 1J или 2J в смеси с не менее 0,10 мас.% и менее 2 мас.% по меньшей мере одного соединения, выбранного из соединения формулы 1K или 2K, или 1L, или 2L.
8.11. Любая из композиций 8.1-8.8, где композиция содержит соединение формулы 1J или 2J в смеси с не менее 1,0 мас.% и менее 2,0 мас.% соединения формулы 1K или 2K.
8.12. Любая из композиций 8.1-8.8, где композиция содержит соединение формулы 1J или 2J в смеси с не менее 1,0 мас.% и менее 2,0 мас.% соединения формулы 1L или 2L.
8.13. Любая из композиций 8.1-8.12, где композиция содержит соединение формулы 1J или 2J в смеси с менее 1,0 мас.% 1-хлор-3-(4-фторфенокси)пропана), например, менее 0,5% или менее 0,25%, или менее 0,15% или менее 0,10%, или менее 0,08 мас.% 1-хлор-3-(4-фторфенокси)пропана).
8.14. Любая из композиций 8.1-8.12, где композиция содержит соединение формулы 1J или 2J в смеси с менее 5000 част./млн любого органического растворителя (например, ацетона, ацетонитрила или метанола), например, менее 4000 част./млн или менее 3000 част./млн, или менее 1500 част./млн, или менее 1000 част./млн, или менее 500 част./млн, или менее 410 част./млн, любого такого органического растворителя.
8.15. Любая из композиций 8.9-8.14, где в соединении формулы 1K или 2K, или 1L, или 2L группа R означает H и группа Q означает -O-.
8.16. Любая из композиций 8.1-8.15, где соединение формулы 1J или 2J представляет собой соединение, полученное любым из способов 1J, 2J или 6.1-6.92.
[0073] Другим объектом настоящего изобретения является активная фармацевтическая композиция (активный фармацевтический ингредиент), соответствующая любой из композиций 8.1-8.16 в смеси с одним или большим количеством фармацевтически приемлемых инертных наполнителей, разбавителей или растворителей. В некоторых вариантах осуществления фармацевтическая композиция выбрана из таблетки, капсулы, каплеты, порошка, облатки, геля или стерильного раствора для инъекции. В некоторых вариантах осуществления фармацевтическая композиция представляет собой перорально разрыхляющуюся таблетку. В некоторых вариантах осуществления фармацевтическая композиция представляет собой композицию пролонгированного действия, например, для внутримышечного или подкожного введения. В некоторых вариантах осуществления фармацевтическая композиция содержит от 1 до 60 мг соединения формулы 1J или 2J в пересчете на массу свободного основания (например, 20-60 мг или 20-40 мг, или 40-60 мг для перорально принимаемой дозированной формы; например, 1-30 мг или 5-20 мг, или 5-15 мг, или 1-10 мг, для перорально быстрорастворяющейся дозированной формы).
[0074] При использовании в настоящем изобретении "активная фармацевтическая композиция" означает активный фармацевтический ингредиент (API), предназначенный для включения в фармацевтическую композицию дл введения в организм человека или животного. Сам по себе API состоит только из активного медицинского соединения (например, соединения формулы 1J или 2J) и любых случайных примесей, обусловленных его синтезом. В отличие от этого, "фармацевтическая композиция" содержит API в смеси по меньшей мере с одним инертным наполнителем, разбавителем или растворителем. Подходящие инертные наполнители, разбавители и растворители известны в данной области техники и включают, но не ограничиваются только ими, связующие, разрыхлители, полимеры, сахара, наполнители, подсластители, адгезивы, буферы, модулирующие высвобождение агенты, защитные покрытия (например, желудочные покрытия), окрашивающие вещества, вкусовые добавки и жидкие носители (включая воду, этанол, глицерин, сорбит, пропиленгликоль и т.п.).
[0075] Соединения, описанные в настоящем изобретении, и их фармацевтически приемлемые соли можно получить способами, описанными и приведенными в качестве примера в настоящем изобретении, и аналогичными им способами, и способами известными в области химии. При описании способов синтеза, описанных в настоящем изобретении, следует понимать, что все предложенные условия проведения реакции, включая выбор растворителя, атмосферу для реакции, температуру реакции, длительность эксперимента и процедуры обработки выбраны стандартными для этой реакции, которые должен легко понимать специалист в данной области техники. Поэтому иногда может потребоваться проведение любой реакции при повышенной температуре или большего или меньшего периода времени, чем указано в настоящем изобретении. Специалисту в области органического синтеза известно, что функциональные группы, содержащиеся в разных частях молекулы, должны быть совместимы с предложенными реагентами и реакциями. Если они не имеются в продаже, исходные вещества для этих методик можно получить по процедурам, которые выбраны из числа сходных или аналогичных использующихся в химии для синтеза известных соединений. Все публикации, цитированные в настоящем изобретении, во всей своей полноте включены в настоящее изобретение в качестве ссылки.
[0076] Если термины специально не определены в варианте осуществления, то термины, использующиеся в настоящем изобретении, обычно определены следующим образом.
[0077] Выражение "фармацевтически приемлемые соли" означает производные раскрытых соединений, когда исходное соединение модифицировано путем получения его солей присоединения с кислотой или с основанием. Примеры фармацевтически приемлемых солей включают, но не ограничиваются только ими, соли неорганических или органических кислот основных остатков, таких как амины; щелочей или органические соли кислотных остатков, таких как карбоновые кислоты; и т.п. Фармацевтически приемлемые соли включают обычные нетоксичные соли или четвертичные аммониевые соли исходных соединений, полученные, например, из нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают полученные из неорганических кислот, таких как хлористоводородная кислота; и соли, полученные из органических кислот, таких как толуолсульфоновая кислота.
[0078] Фармацевтически приемлемые соли, предлагаемые в настоящем изобретении, можно синтезировать из исходных соединений, которые содержат основный или кислотный фрагмент, по обычным химическим методикам. Обычно такие соли можно получить по реакции форм свободной кислоты или свободного основания этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе, или в их смеси; обычно предпочтительны неводные среды. Соединения, предлагаемые в настоящем изобретении, содержат более чем один основный атом азота. Например, соединения формулы 1J и 2J оба содержат два основных атома азота (один N-арилпиперазиновый азот и один алифатический пиперидиновый азот). Следует понимать, что пиперидиновый азот является более основным, чем пиперазиновый азот. Также следует понимать, что любой один или оба эти атома азота могут образовать соль присоединения с кислотой с кислотным водородом одноосновной, двухосновной или трехосновной кислоты Бренстеда в зависимости от отношения количества молей свободного основания к количеству молей кислоты, использованной в реакции. Поэтому, если термины, такие как "соль присоединения с кислотой" используют в настоящем изобретении, такой термин означает любые такие соли, которые возможны, а также их комбинации.
[0079] Термин "алкил" включает обладающие разветвленной и линейной цепью насыщенные алифатические углеводородные группы, содержащие указанное количество атомов углерода; например, "C1-C4 алкил" означает алкил, содержащий от 1 до 4 включительно атомов углерода. Примеры алкила включают, но не ограничиваются только ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил.
[0080] "Галоген" или "галогенид" при использовании в настоящем изобретении означает фтор, хлор, бром и йод. Поэтому "алкилгалогенид" означает галогенидную группу, присоединенную к алкильной группе, определенной выше, такую как метилйодид или йодбутан.
[0081] "Щелочной металл" означает литий, натрий и калий. "Аммоний" означает аммониевый ион (NH4+) и тетраалкиламмониевые ионы (NR4+), где R означает C1-6 алкильный радикал. Например, тетраалкиламмоний включает тетраметиламмоний, тетраэтиламмоний, тетрапропиламмоний и тетрабутиламмоний. Таким образом, термин "йодид или бромид щелочного металла или аммония" включает, но не ограничивается только ими, йодиды и бромиды натрия, калия, лития, аммония и тетраалкиламмония.
[0082] "Циклоалкил" включает моноциклические или полициклические кольцевые системы, содержащие по меньшей мере одно алифатическое кольцо. Поэтому, "циклоалкил" включает циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил и т.п. Если циклоалкил является полициклической системой, такая система может содержать алифатическое кольцо, конденсированное с ароматическими, неароматическими, гетероароматическими или гетеронеароматическими кольцами. Их примеры включают октагидро-1H-инден, 2,3-дигидро-1H-инден и 5,6,7,8-тетрагидрохинолин.
[0083] Термин "гетероциклоалкил" в настоящем изобретении означает моноциклическую или полициклическую систему, содержащую по меньшей мере одно алифатическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из группы, включающей O, N и S. Поэтому гетероциклоалкил может означать пиперидинил, пиперазинил, 2-пирролидонил, 1,2,3,4-тетрагидрохинолинил, 2H,6H-1,5,2-дитиазинил, 2H-пирролил или 1,2,3,4-тетрагидро-1,8-нафтиридин.
[0084] При использовании в настоящем изобретении термин "арил" означает стабильную 5-7-членную моноциклическую или полициклическую или 7-14-членную полициклическую кольцевую систему, которая включает по меньшей мере одно ароматическое кольцо (т.е. плоское кольцо, которое содержит 4n+2 пи-электрона, где n является целым числом). Поэтому термин "арил" включает фенил, нафтил и их производные. Термин "арил" также включает полициклические кольцевые системы, которые содержат по меньшей мере одно ароматическое кольцо. Конденсированное с одним или большим количеством ароматических, неароматических или гетероароматических колец (например, 2,3-дигидро-1H-инден).
[0085] При использовании в настоящем изобретении термин "гетероцикл", "гетероциклическое кольцо" или "гетероарил" означает стабильное 5-7-членное моноциклическое или полициклическое или 7-14-членное полициклическое кольцо, которое включает по меньшей мере одно ароматическое кольцо, содержащее по меньшей мере один гетероатом, независимо выбранный из группы, включающей O, N и S. Поэтому, "гетероцикл" или "гетероциклическое кольцо", или "гетероарил" могут включать одно гетероароматическое кольцо или гетероароматическое кольцо, конденсированное с другим гетероароматическим кольцом или с негетероароматическим или неароматическим кольцом. Гетероциклическое кольцо может присоединить боковую группу по любому гетероатому или атому углерода, что приводит к стабильной структуре. Гетероциклические кольца, описанные в настоящем изобретении, могут быть замещенными по атому углерода или по атому азота, если полученное соединение стабильно. Примеры гетероциклических или гетероарильных групп включают, но не ограничиваются только ими 1H-индазолил, тиазолил, фурил, пиридил, хинолинил, пирролил, индолил и 5,6,7,8-тетрагидрохинолинил.
[0086] Термин "замещенный" при использовании в настоящем изобретении означает, что любой один или большее количество водородов у указанного атома заменены с выбором из указанной группы при условии, что не превышена валентность указанного атома и что замещение приводит к стабильному соединению. Поэтому необязательно замещенный алкил может означать алкильную группу, определенную выше, в которой один или большее количество водородов, включая, но не ограничиваясь только ими, галоген, гидрокси, амино, сульфгидрил, алкил, алкенил, алкинил, галогеналкил (например, CH2Cl, CF3, CH3CH2Br и т.п.), амидную группу, арил, арилалкил, гетероарил, гетероарилалкил, циклоалкил, гетероциклоалкил, алкокси, карбокси, карбонил, силил, алкиламино, алкиламидную группу, нитро, циано, галоген, -S(O)-алкил, -S(O)2-алкил, R-циклоалкил, R-гетероциклоалкил, R-C(O)-, R-C(O)-OR’, R-O-, -N(R)(R’) где R и R’ независимо означают H, алкил, арил, гетероарил, циклоалкил, гетероциклоалкил, арилалкил, гетероарилалкил, гетероарилалкил или гетероциклоалкил.
[0087] Термин "разделение" является термином, использующимся, в данном уровне техники и означает разделение рацемической смеси на ее энантиомеры с помощью любых средств, включая взаимодействие хиральной органической кислоты или основания с компонентами рацемической смеси с образованием диастереоизомерных солей и разделение указанных солей, например, по методике кристаллизации. Термин "разделение хиральной соли" означает разделение рацемической смеси на ее энантиомеры путем применения хиральной кислоты.
[0088] Термин "хроматография" хорошо известен в данной области техники и означает методику разделения компонентов смеси путем ее взаимодействия со стационарной фазой и элюирования компонентов смеси подвижной фазой, такой как этанол, метанол, ацетонитрил, вода или их смеси. Термин "хиральная хроматография" означает хроматографию, в которой стационарная фаза является хиральной.
[0089] Термин "хиральная кислота" означает любую оптически активную кислоту, способную к образованию диастереоизомерных солей с соединениями формулы 1B или 2B. Термины "моно- или дикарбоновая кислота" или "сульфоновая кислота" в настоящем изобретении означают любое соединение, которое содержит одну или две функциональные карбоксигруппы и сульфоновые группы соответственно. Примеры таких кислот включают, но не ограничиваются только ими, (+/-)/(R/S) винную кислоту, (+/-)/ (R/S) (моно- или диацетил)винную кислоту, (+/-)/(R/S) (моно- или дибензоил)винную кислоту, (+/-)/(R/S) (моно- или дипивалоил)винную кислоту, (+/-)/(R/S) миндальную кислоту, (+/-)/(R/S) ацетоксифенилуксусную кислоту, (+/-)/(R/S) метоксифенилуксусную кислоту, (+/-)/(R/S) гидроксиминдальную кислоту, (+/-)/(R/S) галогеноминдальную кислоту (например, 4-фторминдальную кислоту), (+/-) /(R/S) молочную кислоту и (+/-)/(R/S) камфорсульфоновую кислоту.
[0090] Термин "защитный реагент" означает любое соединение, которое взаимодействует с атомом, защита которого желательна так, чтобы блокировать или замаскировать его функциональность. Его обычно используют для временной модификации потенциально реакционноспособной функциональной группы, чтобы защитить ее от нежелательного химического превращения. Желательный защитный реагент является таким, который совместим с реакционной смесью или стабилен к ее воздействию и легко отщепляется позже, когда защита больше не требуется.
[0091] Термины "защитная группа" и "защищающая группа" означают удаляемые химические группы, которые используют для защиты или маскировки реакционноспособных функциональных фрагментов во время синтетических превращений. Термин "защитный реагент" означает реагент, который используют для присоединения группы к защищаемому функциональному фрагменту. Например, защитный реагент этилхлорформиат используют для присоединения защитной группы этоксикарбонила и защитный реагент BOC-ангидрид используют присоединения защитной группы трет-бутоксикарбонила. Защитные группы, определенные в настоящем изобретении, включают группы общей формулы -P-Z, где Z означает необязательно замещенный алкил, арил, алкиларил, алкоксикарбонил или -OR, где R означает алкил, арил, арилалкил или гетероарилалкил и где P означает -CH2-, -C(O)-, -C(O)O- или S(O)2. Примеры защитных групп включают бензилоксикарбонил (Cbz), трифенилметил, алкилокси- и арилоксикарбонил (например, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, феноксикарбонил), бензил-N-сукцинимидилкарбонил, бензоил, замещенный бензоил, замещенный бензилоксикарбонил, бензил, замещенный бензил и алкил и арилсульфонил (например, метансульфонил, бензолсульфонил, толуолсульфонил). Другие подходящие защитные реагенты и защитные группы описаны, например, в публикации "Protective Groups in Organic Synthesis" by Theodora Green (publisher: John Wiley & Sons, Fourth Edition, 2007), раскрытие которой во всей своей полноте включено в настоящее изобретение в качестве ссылки.
[0092] Термин "удаление защитной группы" означает акт удаления или отщепления защитной группы. Условия для удаления защитной группы для указанных выше защитных групп с необходимостью меняются в зависимости от выбора защитной группы и могут включать кислоту (например, хлористоводородную, серную, фосфорную или трифторуксусную кислоту или кислоту Льюиса, такую как трис(трифторацетат) бора) или основание (гидроксид щелочного металла, например, гидроксид лития, калия или натрия), катализ или условия каталитического гидрирования (например, водород и палладий на угле).
[0093] Термин "катализатор" в настоящем изобретении означает любое вещество или реагент, способный повлиять, индуцировать, усилить, воздействовать или стимулировать реакционную способность соединения или реакцию без его израсходования. Выражение "катализатор на основе переходного металла" включает любой металл, обладающий валентными электронами на d-орбиталях, например, металлы, выбранные из числа групп 3-12 Периодической системы. Катализаторы, применимые в способах, предлагаемых в настоящем изобретении, включают атомы, ионы, соли или комплексы переходных металлов групп 8-11 Периодической системы. "Группа 3-12 Периодической системы" означает группы Периодической системы, пронумерованные в соответствии с системой IUPAC. Поэтому используются переходные металлы групп 8-11, которые включают железо, рутений, осмий, кобальт, родий, иридий, никель, палладий, платину, медь, серебро и золото. Примеры таких катализаторов включают, но не ограничиваются только ими CuI, CuCl, CuBr, CuBr2, Cu(II) ацетат, Cu2Cl2, Cu2O, CuSO4, Cu2SO4, Cu, Pd/C, PdCl2, Pd(OAc)2, (CH3CN)2PdCl2, Pd[P(C6H5)3]4, бис(дибензилиденацетон)палладий [Pd(dba)2], трис(дибензилиденацетон)дипалладий [Pd2(dba)3], Ni(ацетилацетонат)2, NiCl2[P(C6H5)]2 и Ni(1,5-циклооктадиен)2. Катализаторы обычно, но не обязательно используют в субстехиометрических количествах в пересчете на реагенты. Предпочтительно используют 0,5-20 мол.%, наиболее предпочтительно 10 мол.% катализатора на основе переходного металла в пересчете на реагенты.
[0094] Термин "основание" в настоящем изобретении означает органические или неорганические основания, такие как основания-амины (например, аммиак, триэтиламин, N,N’-диизопропилэтиламин или 4-(диметиламино)пиридин (DMAP); 1,5-диазабицикло[4.3.0]-нон-5-ен (DBN), 1,5-диазабицикло[5.4.0]ундец-5-ен (DBU)); гидриды (например, гидрид натрия, лития или калия); алкоксиды, (например, трет-бутоксид натрия, калия или лития и K(OAr), Na(OAr)); или карбонаты, бикарбонаты, фосфаты или гидроксиды щелочного или щелочноземельного металла (например, карбонат, бикарбонат, гидроксид натрия, магния, кальция, калия, цезия или фосфат бария).
[0095] Термин "основание Бренстеда" является известным в данной области техники термином и означает незаряженный или заряженный атом или молекулу, например, оксид, амин, алкоксид или карбонат, который является акцептором протона. Примеры основания Бренстеда включают, но не ограничиваются только ими K3PO4, K2CO3, Na2CO3, Tl2CO3, Cs2CO3, K(OtBu), Li(OtBu), Na(OtBu), K(OPh) и Na(OPh), или их смеси.
[0096] Термин "основание Льюиса" известен в данной области техники и означает химический фрагмент, при некоторых условиях проведения реакции способный быть донором пары электронов. Примеры оснований Льюиса включают, но не ограничиваются только ими, незаряженные соединения, такие как спирты, тиолы, олефины, и амины (например, аммиак, триэтиламин), и заряженные фрагменты, такие как алкоксиды, тиоляты, карбанионы и множество других органических анионов.
[0097] Термин "кислота" в настоящем изобретении означает кислоту Льюиса или Бренстеда. Кислота Льюиса является известным в данной области техники термином и означает химический фрагмент, способный быть акцептором пары электронов (например, трифторид бора). Кислота Бренстеда означает любой химический фрагмент способный быть донором протона (например, уксусную кислоту, хлористоводородную кислоту, фосфорную кислоту, а также другие органические кислоты, известные в данной области техники).
[0098] Термин "лиганд" означает любой атом, молекулу или ион, способный отдавать или обобщать один или большее количество электронов с помощью координационной и/или ковалентной связи с другим центральным атомом, обычно металлом. "Монодентатный лиганд" означает лиганды, которые обладают одним центром связывания с центральным атомом (например, пиридин или аммиак). "Бидентатный лиганд" означает лиганды, которые обладают двумя центрами связывания (например, N,N’-диметилэтилендиамин, N,N,N’,N’-тетраметилэтилендиамин или 1,10-фенантролин). Примеры применимых лигандов для групп 8-11 переходных металлов включают, но не ограничиваются только ими, 2-фенилфенол, 2,6-диметилфенол, 2-изопропилфенол, 1-нафтол, 8-гидроксихинолин, 8-аминохинолин, DBU, DBN, DABCO, 2-(диметиламино)этанол, N,N-диэтилсалициламид, 2-(диметиламино)глицин, N,N,N',N'-тетраметил-1,2-диаминоэтан, 4,7-дифенил-1,10-фенантролин, 4,7-диметил-1,10-фенантролин, 5-метил-1,10-фенантролин, 5-хлор-1,10-фенантролин, 5-нитро-1,10-фенантролин, 4-(диметиламино)пиридин, 2-(аминометил)пиридин, (метилимино)диуксусную кислоту, цис-1,2-диаминоциклогексан, транс-1,2-диаминоциклогексан, смесь цис- и транс-1,2-диаминоциклогексанов, цис-N,N'-диметил-1,2-диаминоциклогексан, транс-N,N'-диметил-1,2-диаминоциклогексан, смесь цис- и транс-N,N'-диметил-1,2-диаминоциклогексанов, цис-N-толил-1,2-диаминоциклогексан, транс-N-толил-1,2-диаминоциклогексан, смесь цис- и транс-N-толил-1,2-диаминоциклогексанов, этаноламин, 1,2-диаминоэтан, N,N'-диметил-1,2-диаминоэтан, N,N-диметил-2-гидроксибензамид, N,N-диэтил-2-гидроксибензамид, фтор-N,N-диэтил-2-гидроксибензамид, хлор-N,N’-диэтил-2-гидроксибензамид, (2-гидроксифенил)(пирролидин-1-ил)метанон, бифенил-2-ол, 2-пиридилфенол, 1,2-бензолдиамин, аммиак, N,N-диметилформамид, диметилсульфоксид, 1-метил-2-пирролидинон или их смеси, а также бифенильные и бинафтильные лиганды, описанные выше в настоящем изобретении. В некоторых вариантах осуществления количество использующегося лиганда может быть стехиометрическим или избыточным. В других вариантах осуществления лиганд можно использовать в качестве растворителя для реакции. Поэтому такие реагенты, как N,N-диметилформамид, диметилсульфоксид, 1-метил-2-пирролидинон или другие жидкие амины могут выступать в качестве растворителя, а также лиганда для реакции.
[0099] Термин "N,N’-диметилэтилендиамин" используют взаимозаменяемым образом с термином "N,N’-диметил-1,2-диаминоэтан".
[00100] Выражение "нуклеофильный алкилгалогенид" означает любое соединение, содержащее и алкилгалогенидную функциональную группу (электрофильную) и нуклеофильную функциональную группу. Термин "нуклеофильный" или "нуклеофил" хорошо известен в данной области техники и означает химический фрагмент, содержащий реакционноспособную пару электронов.
[00101] Термин "восстановление" или "восстанавливать" означает превращение функциональной группы в молекуле с переходом от более высокой степени окисления к более низкой степени окисления. Термин "восстановительный реагент" или "восстанавливающий реагент" означает любое соединение или комплекс, известный в этой области вследствие его способности превращать функциональную группу в молекуле с переходом от более высокой степени окисления к более низкой степени окисления. Примеры восстановления включают восстановление двойной углерод-углеродной связи в ординарную углерод-углеродную связь и восстановление карбонильной группы (C=O) в метилен (CH2). Восстановление можно обеспечить путем прямого переноса электрона, гидрида или атома водорода. Типичные восстановительные реагенты применимые для способов 1C и 2C, включают гидриды металлов (например, алюмогидрид лития, борогидрид натрия, цианоборогидрид натрия) и водород в присутствии катализатора (например, никель Ренея, палладий на древесном угле, борид никеля, металлическую платину или ее оксид, оксид родия, рутения и цинка, пентацианокобальтат(II) Co(CN)53-). Каталитическое гидрирование обычно проводят при комнатной температуре и при атмосферном давлении, но для более стойких двойных связей может потребоваться более высокая температура и/или более высокое давление. Другие восстановительные реагенты, применимые для превращения двойных связей в ординарные связи, включают силан и кислоту; цианоборогидрид натрия и кислоту; цинк и кислоту; натрий и жидкий аммиак; натрий в этаноле; и боран-триэтиламин.
[00102] Термин "алкилирование" означает введение алкильного радикала в органическое соединение путем замещения или присоединения. Поэтому термин "N-алкилирование" означает присоединение алкильного радикала к атому азота органического соединения.
[00103] Методики получения соединений, описанные в настоящем изобретении, и методики проведения некоторых из стадий способов, описанные в настоящем изобретении, известны специалистам в данной области техники и приведены, например, в патентах U.S. 8309722; 8779139; 9315504; 9751883; 8648077; 9199995; и 9586960; содержания которых во всей своей полноте включены в настоящее изобретение в качестве ссылки.
ПРИМЕРЫ
Пример 1: Гидрохлорид 6-бром-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола.
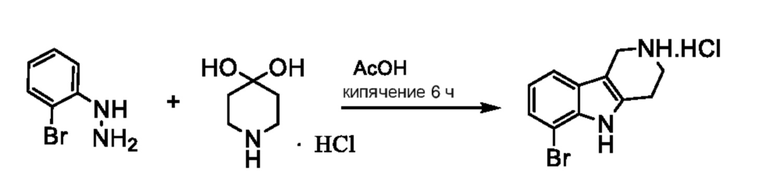
[00104] Гидрохлорид 1-(2-бромфенил)гидразина и моногидрат гидрохлорида 4-пиперидинона объединяют в молярном отношении примерно 1:1,1 в уксусной кислоте и полученную дисперсию кипятят с обратным холодильником, пока по данным анализа с помощью HPLC не останется менее 1% исходного гидразина (например, в течение 6 ч). Затем реакционную смесь охлаждают до комнатной температуры, фильтруют и осадок на фильтре промывают ацетоном и сушат и получают твердое вещество, которое используют на следующей стадии.
Пример 2: [4aS, 9bR]-6-Бром-2,3,4,4a,5,9b-гексагидро-1H-пиридо[4,3-b]индол
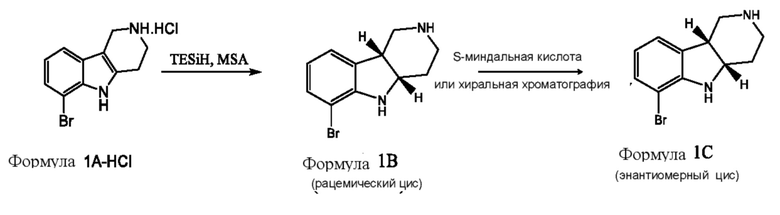
[00105] Восстановление: В 3-горлую круглодонную колбу (RBF) объемом 3 л с магнитной мешалкой, патрубком для подачи N2 и осушающей трубкой помещают метансульфоновую кислоту (400 мл). Порциями добавляют гидрохлорид 6-бром-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индола (100 г). Реакционную смесь нагревают до температуры от 40°C до 45°C и затем триэтилсилан (TES) (55,5 мл, 1 экв.) прибавляют по каплям в течение 1 ч для регулирования выделения тепла. Температуру поддерживают равной от 40°C до 45°C. После завершения добавления смесь перемешивают при температуре от 40°C до 45°C в течение 1,5 ч. Можно добавить в течение примерно 10 мин дополнительное количество TES (13,9 мл, 0,25 экв.), после чего смесь перемешивают при температуре от 40°C до 45°C в течение 30 мин. Можно добавить в течение примерно 10 мин дополнительное количество TES (13,9 мл, 0,25 экв.), после чего смесь перемешивают при комнатной температуре в течение ночи. Можно добавить дополнительное количество TES (5,5 мл, 0,1 экв.) и смесь перемешивают при комнатной температуре в течение 90 мин. После охлаждения до <10°C реакцию останавливают водой (600 мл) путем добавления воды по каплям при скорости, обеспечивающей поддержание температуры <40°C (наблюдается сильное выделение тепла). Добавляют дихлорметан (1000 мл) и значение pH смеси устанавливают равным примерно 12 с помощью 50% мас./об. водного раствора NaOH. Смесь фильтруют через слой целита. Слои разделяют и водный слой экстрагируют дихлорметаном (100 мл). Объединенный органический слой промывают водой (100 мл), сушат над сульфатом магния (120 г), фильтруют и концентрируют в вакууме. Остаток обрабатывают гептанами. После фильтрования полученное твердое вещество сушат в вакууме при 30°C и получают 73,1 г продукта (выход: 83%, чистота по данным HPLC: 97,1%).
[00106] Разделение: [4aS, 9bR]-6-Бром-2,3,4,4a,5,9b-гексагидро-1H-пиридо[4,3-b]индол можно выделить путем растворения рацемического цис-6-бром-2,3,4,4a,5,9b-гексагидро-1H-пиридо[4,3-b]индола (9,61 г, 38,0 ммоля) в метаноле (190 мл) при 50°C и проводимого порциями добавления (S)-(+)-миндальной кислоты (5,78 г, 38,0 ммоля). Полученный прозрачный раствор перемешивают при 50°C в течение нескольких минут и по каплям добавляют эфир (95 мл). Полученный раствор охлаждают до комнатной температуры. Белый осадок (S-манделат, 4,1 г) отфильтровывают. Анализ с помощью HPLC показывает >99% e.e.
Пример 3: (4aS,9bR)-Этил-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилат
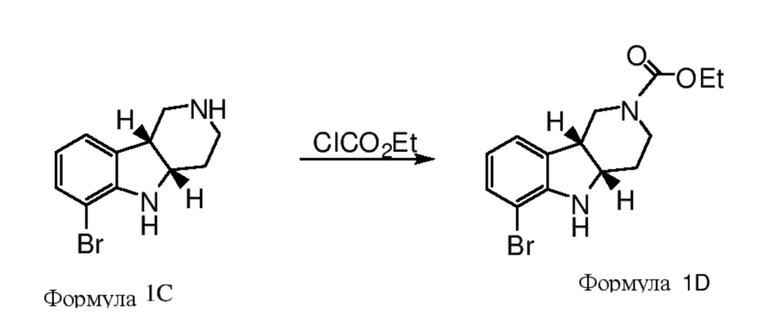
[00107] (4aS,9bR)-этил-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилат можно получить путем проводимого сначала получения [4aS, 9bR]-6-бром-2,3,4,4a,5,9b-гексагидро-1H-пиридо[4,3-b]индола (36,0 г, 0,142 моля)) в виде свободного основания путем использования 50% водного раствора гидроксида натрия и экстракции продукта посредством MTBE. Превращение в (4aS,9bR)-этил-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилат после этого можно провести путем охлаждения суспензии [4aS, 9bR]-6-бром-2,3,4,4a,5,9b-гексагидро-1H-пиридо[4,3-b]индола (36,0 г, 0,142 моля)) в THF (300 мл) и триэтиламине (24 мл) в бане из воды со льдом. Этилхлорформиат по каплям добавляют (13,5 мл, 0,142 моля) шприцевым насосом в течение 1 ч. Баню из воды со льдом удаляют и реакционную смесь перемешивают при комнатной температуре в течение еще ч. Реакционную смесь пропускают через слой целита и растворитель выпаривают и получают (4aS,9bR)-этил-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилат). 1H ЯМР (CDCl3, 300 МГц): 1,20-1,35 (м,3H), 1,73-1,85 (м, 1H), 1,85-1,99 (м, 1H), 3,22-3,52 (м, 3H), 3,52-3,66 (м, 1H), 3,66-3,95 (уш, 1H), 3,95-4,21 (м, 4H), 6,60 (т, J=7,7 Гц, 1H), 7,04 (д, J=7,2 Гц, 1H), 7,20 (д, J=8,1 Гц, 1H).
[00108] Альтернативную применению свободного основания [4aS, 9bR]-6-бром-2,3,4,4a,5,9b-гексагидро-1H-пиридо[4,3-b]индол (соединение формулы 1C) реакцию также можно провести с использованием в качестве исходного вещества (S)-манделата [4aS, 9bR]-6-бром-2,3,4,4a,5,9b-гексагидро-1H-пиридо[4,3-b]индола. Круглодонную колбу объемом 100 мл снабжают стержнем для магнитной мешалки, капельной воронкой с выравниванием давления и патрубком для подачи N2 в верхней части капельной воронки. В колбу помещают исходный S-манделат (5 г, 12,35 ммоля), Na2CO3 (2,88 г, 27,17 ммоля) и 25 мл THF. К желтой реакционной смеси при 25°C (температура нагревательного блока) по каплям в течение примерно 70 мин добавляют раствор этилхлорформиата (1,64 г, 15,11 ммоля) в 5 мл THF. Смесь перемешивают при 25°C в течение еще 10 мин и затем исследуют с помощью HPLC. С помощью HPLC устанавливают наличие менее 2% исходного вещества и устанавливают выход искомого продукта, равный примерно 98%. К смеси добавляют 12,5 мл EtOH и смесь концентрируют при пониженном давлении для удаления примерно 30 мл растворителя (в основном THF). Затем к смеси добавляют 37,5 мл H2O и полученная смесь по данным использования индикаторной бумаги обладает pH >9. Затем желтую смесь перемешивают при комнатной температуре в течение примерно 1 ч и затем фильтруют. Твердое вещество промывают с помощью 25 мл H2O. После сушки в вакуумном сушильном шкафу при 58°C в течение примерно 16 ч получают 3,9442 г желтого твердого вещества (выход 98%). 1H ЯМР твердого вещества подтверждает и показывает отсутствие (s)-миндальной кислоты. Анализ продукта с помощью HPLC показывает, что искомый продукт обладает чистотой >99%. LC-MS обнаруживает пик с M/e=326 (M+1).
Пример 4: [4aS,9bR]-Этил-5-(2-амино-2-оксоэтил)-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилат
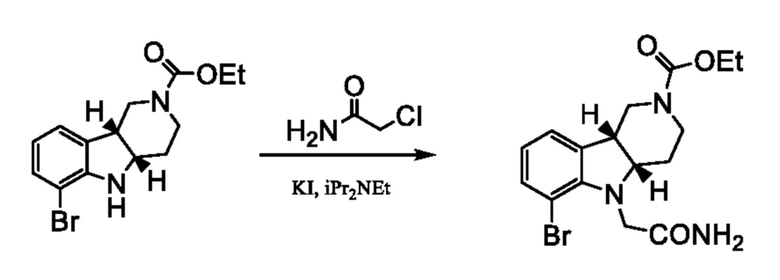
[00109] (4aS,9bR)-Этил-5-(2-амино-2-оксоэтил)-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилат можно получить путем кипячения с обратным холодильником суспензии (4aS,9bR)-этил-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилата (5,648 г, 17,4 ммоля), 2-хлорацетамида (7,32 г, 78,2 ммоля), йодида калия (19,2 г, 77,7 моля) и диизопропилэтиламина (19 мл, 115 ммоля) в ацетонитриле (80 мл) в течение 27 ч. Растворитель удаляют в вакууме и к остатку добавляют воду (200 мл) и перемешивают в течение 1 ч. Полученное белое твердое вещество отфильтровывают, промывают этанолом и сушат.
[00110] В последующих экспериментах установлено, что выход увеличивается и время реакции уменьшается при использовании в основном таких же но с заменой растворителя на диметилацетамид (например, при температуре, равной от 80 до 110°C, например, при 110°C). В сравнительных экспериментах установлено, что при использовании в качестве растворителя диметилацетамида получают более высокие выходы, чем при использовании ацетонитрила или диоксана. Последующие эксперименты также проводили с использованием растворителя 2-бромацетамида в диметилацетамиде, ацетонитриле или диоксане, необязательно также содержащем йодид калия или тетрабутилбромид аммония.
[00111] Дополнительные эксперименты показали, что при операции в большем масштабе продукт может образовывать масло, что приводит к затруднениям при использовании и очистке. Неожиданно было установлено, что на этот результат значительно влияет регулирование степени охлаждения и скорости добавления воды. Поэтому в улучшенном способе получают продукт из содержащей диметилацетамид реакционной смеси путем осадительной кристаллизации с использованием вод в качестве антирастворителя, необязательно с индуцированием путем добавления затравочных кристаллов. Например, реакционную смесь можно охладить примерно до 50-70°C, затем добавить часть воды, затем добавить больше воды. Смесь перемешивают или перемешивают при постепенном охлаждении до конечной температуры, равной примерно 0-15°C (например, 5°C) с последующим фильтрованием и промывкой водой. Во время охлаждения вносят затравочные кристаллы для осаждения продукта.
Пример 4b: 4aS,9bR]-Этил-5-(2-амино-2-оксоэтил)-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилат
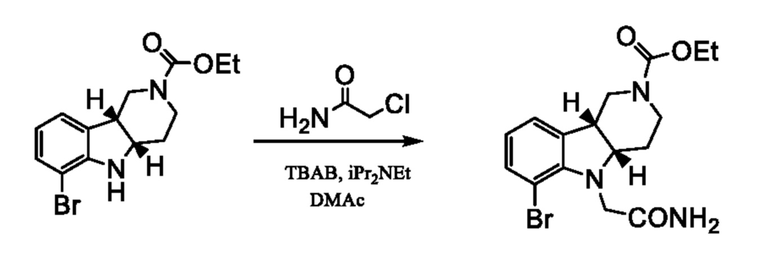
[00112] (4aS,9bR)-Этил-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилат (175 г, 538 ммоля), 2-хлорацетамид (75,48 г, 807 ммоля), тетрабутиламмонийбромид (173,5 г, 538 ммоля) и диизопропилэтиламин (151 мл, 917 ммоля) суспендируют в диметилацетамид (158 мл) при 107-110°C в течение 24-27 ч. HPLC показывает завершение реакции более чем на 85%. Реакционную смесь охлаждают до 50-55°C и медленно добавляют воду (350-400 мл), смесь перемешивают в течение 2 ч примерно при 50°C и затем в смесь вносят затравочные кристаллы продукта (примерно 50 мг). Дополнительно добавляют воду (450-500 мл) в течение от 1 до 3 ч, затем повторно вносят затравочные кристаллы и затем смесь медленно охлаждают до 5°C. Суспензию фильтруют и осадок на фильтре промывают водой, сушат в вакууме и получают 187 г неочищенного продукта (86% чистота по данным HPLC). Неочищенный продукт повторно суспендируют в этилацетате при 70°C и перемешивают в течение 2 ч. Суспензию охлаждают до 50°C и медленно добавляют н-гептан для индуцирования осаждения. После перемешивания в течение 2 ч при 50°C, смесь медленно охлаждают до 5°C, затем фильтруют и промывают смесью этилацетат/гексан (1:1). После сушки получают 149 г чистого продукта (98% чистота по данным HPLC).
Пример 5: (6bR,10aS)-Этил-2,3,6b,9,10,10a-гексагидро-2-оксо-1H-пиридо[3’,4’:4,5]-пирроло[1,2,3-de]хиноксалин-8-карбоксилат
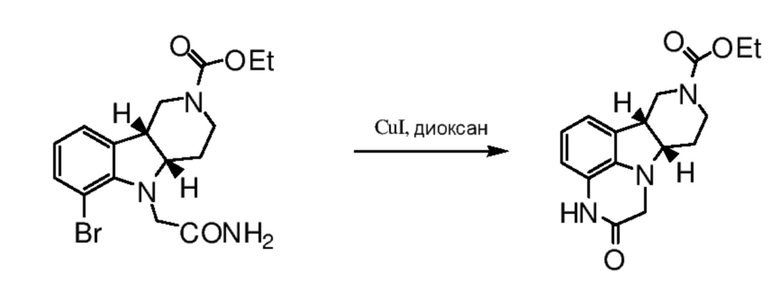
[00113] Суспензию [4aS,9bR]-этил-5-(2-амино-2-оксоэтил)-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилата (254 мг, 1,34 ммоля), йодида меди(I) (254 мг, 1,34 моля), карбоната калия (3,96 г, 28,7 ммоля) и N,N’-диметилэтилендиамина (0,31 мл, 2,87 ммоля) в диоксане (20 мл) кипятят с обратным холодильником в течение 4,5 ч. Добавляют еще порцию йодида меди(I) (250 мг, 1,32 ммоля) и N,N’-диметилэтилендиамина (0,33 мл, 3,05 ммоля). Полученную смесь кипятят с обратным холодильником в течение еще 3 ч и затем нагревают при 73°C в течение примерно 66 ч. Реакционную смесь концентрируют и пропускают через короткую колонку с оксидом алюминия с использованием смеси 100:3:3 дихлорметан : триэтиламин : метанол. Поступивший из колонки растворитель выпаривают и полученное твердое вещество и повторно растворяют в дихлорметане. Раствор в дихлорметане промывают рассолом, сушат над сульфатом натрия и концентрируют и получают твердое вещество (3,7 г, 95%, 83% чистота по данным HPLC).
[00114] При переводе этой лабораторной методики в более крупный масштаб (~ 1 кг) установлено, что выход снижается до 26% преимущественно вследствие потерь при фильтровании. Даже после повторного диспергирования осадка на фильтре в метаноле для извлечения дополнительного количества продукта суммарный выход приближается лишь к 86% с чистотой по данным HPLC, равной примерно 70-75%. Если не ограничиваться теорией, предполагается, что потери обусловлены потерей материала при переносе между трубопроводами, реакторами и другими сосудами.
[00115] Проведены дополнительные эксперименты для оптимизации условий проведения реакции и очистки. Начальные эксперименты с использованием N,N,N’,N’-тетраметилэтилендиамина в качестве лиганда (0,25 экв.) с йодидом калия (1,9 экв.), йодидом меди (0,2 экв.) и растворителем диоксаном привели к временам реакции, равным не менее 48 ч и получению приемлемого выхода. Кроме того, неожиданно было установлено, что продукт чувствителен к кислороду и во время экстракции и концентрирования реакционного растворителя до проведения хроматографии может происходить разложение. Также установлено, что реакция чувствительна к содержанию воды в реакционном растворителе (диоксан смешивается с водой, что приводит к наличию значительно большей концентрации воды, чем в случае других растворителей). Также установлено, что использование DBU в качестве лиганда, толуола в качестве растворителя и азеотропной перегонки до реакции приводит к значительному повышению выхода и степени превращения. Выход дополнительно повышается при использовании углеводородного растворителя для осаждения продукта в виде свободного основания, а не проведения экстракции и/или выпаривания реакционной смеси.
[00116] [4aS,9bR]-Этил-5-(2-амино-2-оксоэтил)-6-бром-3,4,4a,5-тетрагидро-1H-пиридо[4,3-b]индол-2(9bH)-карбоксилат (1400 г, 1,00 экв.) и карбонат калия (2,2 экв.) суспендируют в растворителе толуоле (4 мл/г реагента) и смесь нагревают с ловушкой Дина-Штарка при 110°C в течение примерно 2 ч. Азеотропную перегонку продолжают до прекращения отделения воды. После охлаждения до 70°C добавляют йодид меди (0,2 экв.) и DBU (0,25 экв.). После перемешивания в течение 7 ч при 120°C обнаруживают, что реакция в основном завершена (остается <3% исходного вещества по данным HPLC). Реакционную смесь охлаждают до комнатной температуры и при перемешивании разбавляют с помощью 10 объемов дегазированного н-гептана. После перемешивания в течение 2 ч получают густую суспензию. Смесь фильтруют и собранные твердые вещества диспергируют в 7% водном растворе гидроксида аммония в течение 1 ч. Дисперсию фильтруют и твердое вещество дважды промывают водой. Процедуру диспергирование/промывка повторяют дважды с использованием 12,5% водного раствора гидроксида аммония (в каждом случае диспергирование в течение 1 ч). Твердое вещество сушат и получают искомый продукт с выходом 95% (95% чистота по данным HPLC).
Пример 6: (6bR,10aS)-2,3,6b,7,8,9,10,10a-Октагидро-1H-пиридо-[3’,4’:4,5]-пирроло[1,2,3-de]хиноксалин
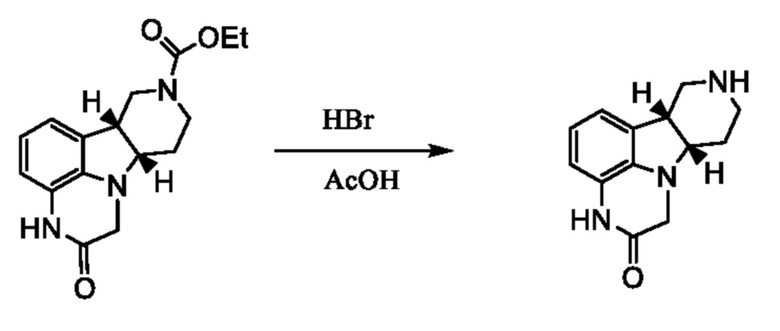
[00117] Этиловый эфир (6bR, 10aS)-2-оксо-2,3,6b,9,10,10a-гексагидро-1H,7H-пиридо[3',4':4,5] пирроло[1,2,3-de]хиноксалин-8-карбоновой кислоты (6,4 г, 21,2 ммоля) суспендируют в растворе HBr/уксусная кислота (64 мл, 33% мас./мас.) при комнатной температуре. Смесь нагревают при 50°C в течение 16 ч. После охлаждения и обработки этилацетатом (300 мл) смесь фильтруют. Осадок на фильтре промывают этилацетатом (300 мл) и затем сушат в вакууме. Затем полученную соль с HBr суспендируют в метаноле (200 мл), и охлаждают сухим диоксидом углерода в изопропаноле. При энергичном перемешивании к суспензии медленно добавляют раствор аммиака (10 мл, 7 н. в метаноле) для установления pH смеси равного 10. Полученную смесь сушат в вакууме без дополнительной очистки и получают неочищенный (6bR, 10aS)-2-оксо-2,3,6b,9,10,10a-гексагидро-1H,7H-пиридо[3',4':4,5]пирроло[1,2,3-de]хиноксалин (8,0 г), который используют на следующей стадии без обработки. MS (ESI) m/z 230,2 [M+H]+.
Пример 7: (6bR,10aS)-8-(3-(4-Фторфенокси)пропил)-6b,7,8,9,10,10a-гексагидро-1H-пиридо[3',4':4,5]пирроло[1,2,3-de]хиноксалин-2(3H)-он
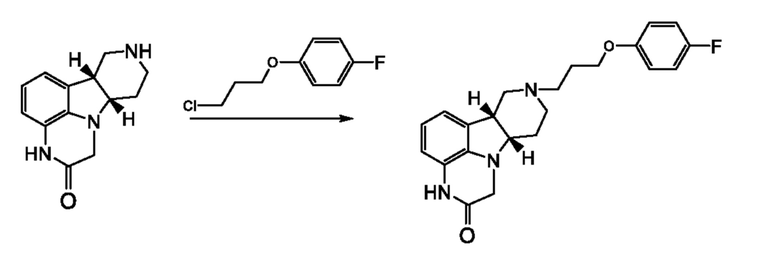
[00118] Смесь (6bR,10aS)-6b,7,8,9,10,10a-гексагидро-1H-пиридо[3',4':4,5]пирроло[1,2,3-de]хиноксалин-2(3H)-она (100 мг, 0,436 ммоля), 1-(3-хлоропрокси)-4-фторбензола (100 мкл, 0,65 ммоля) и KI (144 мг, 0,87 ммоля) в ДМФА (2 мл) дегазируют аргоном в течение 3 мин и добавляют DIPEA (150 мкл, 0,87 ммоля). Полученную смесь нагревают при 78°C и перемешивают при этой температуре в течение 2 ч. Смесь охлаждают до комнатной температуры и затем фильтруют. Осадок на фильтре очищают с помощью колоночной хроматографии на силикагеле с использованием градиентного режима 0-100% этилацетата в смеси метанол/7 н. NH3 в метаноле (1 : 0,1 об./об.) в качестве элюента и получают частично очищенный продукт, который дополнительно очищают с помощью полупрепаративной системы HPLC с использованием градиентного режима 0-60% ацетонитрила в воде, содержащего 0,1% муравьиной кислоты, в течение 16 мин и получают искомый продукт в виде твердого вещества (50 мг, выход 30%). MS (ESI) m/z 406,2 [M+1] +. 1H ЯМР (500 МГц, DMSO-d6) δ 10,3 (с, 1H), 7,2-7,1 (м, 2H), 7,0-6,9 (м, 2H), 6,8 (дд, J=1,03, 7,25 Гц, 1H), 6,6 (т, J=7,55 Гц, 1H), 6,6 (дд, J=1,07, 7,79 Гц, 1H), 4,0 (т, J=6,35 Гц, 2H), 3,8 (д, J=14,74 Гц, 1H), 3,3-3,2 (м, 3H), 2,9 (дд, J=6,35, 11,13 Гц, 1H), 2,7-2,6 (м, 1H), 2,5-2,3 (м, 2H), 2,1 (т, J=11,66 Гц, 1H), 2,0 (д, J=14,50 Гц, 1H), 1,9-1,8 (м, 3H), 1,7 (т, J=11,04 Гц, 1H).
[00119] В дополнительных экспериментах установлено, что выход и чистота повышаются при проведении реакции в растворителе ДМСО при 70-75°C в течение 3-5 ч (степень превращения 97% в масштабе 100 г - 1 кг)). Продукт можно выделить путем остановки реакции смесью этилацетат-вода, с последующей заменой растворителя на н-гептан после разделения фаз. Неочищенный продукт можно выделить путем кристаллизации из н-гептана с последующим фильтрованием, промывкой и сушкой в вакууме. Неочищенный продукт можно дополнительно очистить диспергированием в ацетонитриле и фильтрованием. Полученный продукт соответствует ожидаемым данным анализа с помощью 1H ЯМР и HPLC-MS. Получают следующий профиль загрязнений (органические примеси определены с помощью HPLC за исключением примесей растворителя, которые определены с помощью HS-GC):
Пример 8: Очистка (6bR,10aS)-8-(3-(4-фторфенокси)пропил)-6b,7,8,9,10,10a-гексагидро-1H-пиридо[3',4':4,5]пирроло[1,2,3-de]хиноксалин-2(3H)-она
[00120] В экспериментах с увеличением масштаба неожиданно было установлено, что повторное диспергирование неочищенного (6bR,10aS)-8-(3-(4-фторфенокси)пропил)-6b,7,8,9,10,10a-гексагидро-1H-пиридо[3',4':4,5]пирроло[1,2,3-de]хиноксалин-2(3H)-она в ацетонитриле или ацетоне приводит к в целом приемлемой чистоте по данным HPLC очищенного продукта (93-97%), но он содержит избыточные количества некоторых конкретных примесей, например, 1-(3-хлоропрокси)-4-фторбензол, который содержится в количестве от 0,10 до 0,30% мас./мас. Содержание этой примеси в конечном продукте должно ограничиваться составляющим не более 0,08% мас./мас.
[00121] Поэтому проведено исследование кристаллизации для определения оптимальных условий очистки свободного основания продукта. Исследованные в начале растворители включают метанол, этанол, изопропанол, ацетонитрил, ацетон, метилэтилкетон, 2-метилтетрагидрофуран, этилацетат и изопропилацетат. На основании результатов начального исследования в последующих исследованиях использовали только метанол, ацетон и ацетонитрил.
[00122] Начальные результаты приведены ниже в таблице:
[00123] Когда указанные выше перекристаллизованные продукты сушат при 50°C и в вакууме 100 мбар, все же содержания остаточного растворителя превышают предельное значение ICH, как показано ниже в таблице (24 ч сушки для ацетонитрила, 60 ч сушки для метанола и ацетона):
[00124] Эти данные показывают, что продукт неожиданно склонен удерживать растворители таким образом, что их очень трудно удалить даже после увеличенных периодов сушки в вакууме. В сочетании с дополнительными исследованиями установлено, что свободное основание (6bR,10aS)-8-(3-(4-фторфенокси)пропил)-6b,7,8,9,10,10a-гексагидро-1H-пиридо[3',4':4,5]пирроло[1,2,3-de]хиноксалин-2(3H)-она склонно удерживать растворители в своей кристаллической структуре в количестве, равном примерно 10 мол.%.
[00125] Дополнительные исследования показали, что скорость охлаждения во время кристаллизации влияет на содержание остаточного растворителя. Установлено, что более быстрое охлаждение (например, 20°C/ч вместо 10°C/ч) способствует образованию более мелких кристаллов, которые удерживают меньшее количество растворителя. В отличие от этого, сушка кристаллов при более высоких температурах или более низком давлении (в более высоком вакууме) не оказывает значительное влияние на содержание остаточного растворителя.
[00126] Дополнительные исследования проведены для определения роли антирастворителей (например, н-гептана или MTBE) во время кристаллизации. Если не ограничиваться теорией, предполагается, что путем использования смеси растворителей содержание каждого растворителя можно снизить до находящегося ниже предельных значений ICH. Однако следует исследовать каждый набор бинарных смесей растворителей, чтобы показать, что перекристаллизация из смесей растворителей обеспечивает достаточную общую чистоту по данным HPLC и удовлетворительный профиль примесей.
[00127] Исследованы разные комбинации смесей растворителей для перекристаллизации, включая ацетон-этилацетат и ацетон-метанол, при разных соотношениях растворителей. Установлено, что использование для перекристаллизации смеси ацетон-метанол в соотношении 2:1 или 3:1 приводит к удовлетворительным результатам, как показано ниже в таблице:
[00128] Все условия сушки полученных выше кристаллов представляют собой 16 ч, 40°C при 100 мбар.
Пример 9: Очистка тозилата (6bR,10aS)-8-(3-(4-фторфенокси)пропил)-6b,7,8,9,10,10a-гексагидро-1H-пиридо[3',4':4,5]пирроло[1,2,3-de]хиноксалин-2(3H)-она
[00129] (6bR,10aS)-8-(3-(4-Фторфенокси)пропил)-6b,7,8,9,10,10a-гексагидро-1H-пиридо[3',4':4,5]пирроло[1,2,3-de]хиноксалин-2(3H)-он в форме свободного основания (1,88 г) помещают в сосуд объемом 20 мл. Добавляют 11 мл метилэтилкетона и реакционную смесь нагревают при 50°C и образуется коричневая суспензия. Добавляют твердую толуолсульфоновую кислоту (1,5 экв.) и смесь быстро становится гомогенным коричневым раствором. При перемешивании при 50°C медленно начинается кристаллизация продукта. После перемешивания в течение примерно 1 ч нагревание прекращают и реакционной смеси дают охладиться до комнатной температуры при перемешивании (перемешивание в течение ночи). Получают коричневую суспензию. Смесь фильтруют и промывают с помощью метилэтилкетона в вакууме и получают 1,7 г почти белого коричневатого порошка. Порошок медленно становится пурпурным при комнатной температуре. Анализ с помощью XRPD дает острые пики, характерные для хорошо закристаллизованного вещества, но содержится немного аморфной примеси. 1H ЯМР согласуется с данными для монотозилата (отношение количества молей тозильных протонов к количеству протонов свободного основания составляет 1:1). Дополнительные исследования показывают, что соль является гигроскопичной.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФУНКЦИОНАЛЬНЫЕ ПЛГ СОПОЛИМЕРЫ, ИХ НАНОЧАСТИЦЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ДЛЯ АДРЕСНОЙ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА И ПОЛУЧЕНИЯ ИЗОБРАЖЕНИЯ | 2013 |
|
RU2631653C2 |
| СИНТЕЗ 3-МЕТИЛ-1,2,4-ТИАДИАЗОЛ-5-КАРБОГИДРАЗИДА ИЛИ ЕГО МЕТИЛ-d ДЕЙТЕРИРОВАННОЙ ФОРМЫ | 2019 |
|
RU2804686C2 |
| {3-[(7H-ПИРРОЛО[2,3-d]ПИРИМИДИН-4-ИЛ)АЗОЛИЛ]АЗЕТИДИН-3-ИЛ}АЦЕТОНИТРИЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ЯНУС КИНАЗ | 2015 |
|
RU2601410C1 |
| СУЛЬФАТИРОВАННЫЕ ПРОИЗВОДНЫЕ ОЛИГОСАХАРИДОВ | 2005 |
|
RU2392281C2 |
| ИНГИБИТОР СЕРИНОВЫХ ПРОТЕАЗ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 1999 |
|
RU2232760C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ФТОР-4-БОРОНО-L-ФЕНИЛАЛАНИНА И ВЕЩЕСТВА-ПРЕДШЕСТВЕННИКА 2-ФТОР-4-БОРОНО-L-ФЕНИЛАЛАНИНА | 2014 |
|
RU2668166C1 |
| ПИРИДОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ, ВЫПОЛНЯЮЩИЕ ФУНКЦИЮ ДВОЙНЫХ ИНГИБИТОРОВ mTORC 1/2 | 2018 |
|
RU2771201C2 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ УПРАВЛЕНИЯ ДУБЛИРОВАНИЕМ ПАКЕТОВ С УЧЕТОМ ДВУХСИСТЕМНОЙ СВЯЗИ В СИСТЕМЕ МОБИЛЬНОЙ СВЯЗИ НОВОГО ПОКОЛЕНИЯ | 2019 |
|
RU2771835C1 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЦИТОТОКСИЧЕСКИХ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 2016 |
|
RU2746322C2 |
| ЭНАНТИОСЕЛЕКТИВНЫЙ СИНТЕЗ 6-АМИНО-7-ГИДРОКСИ-4,5,6,7-ТЕТРАГИДРОИМИДАЗО[4,5,1-jk][1]БЕНЗАЗЕПИН-2[1H]-ОНА И ЗИЛПАТЕРОЛА | 2008 |
|
RU2433131C2 |
Группа изобретений относится к фармацевтической химии и включает способы получения соединений формул 1J, 1I, 1F. В формуле 1J R выбран из H и C1-4 алкила, Q выбран из 4-(4-фторфенил)-4-оксобутила и 3-(4-фторфенокси)пропила. Замещенные конденсированные с гетероциклом гамма-карболины формулы 1J применимы для лечения заболеваний, включающих 5-HT2A рецептор, переносчик серотонина (SERT), пути, включающие сигнальные системы дофаминового рецептора D1 и/или D2 и/или µ-опиоидный рецептор. Способ получения соединения формулы 1J осуществляют путем взаимодействия в толуоле соединения формулы 1Е с катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, и необязательно основанием и необязательно йодидом или бромидом щелочного металла или аммония, и необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 1F. Затем удаляют защитную группу пиперидинового атома азота соединения формулы 1F с получением соединения формулы 1I, которое подвергают алкилированию подходящим реагентом алкилирования с получением соединения формулы 1J в свободной форме или в форме соли. Способ также необязательно включает превращение соединения формулы 1J в свободной форме в соединение формулы 1J в форме соли. Заместители в формулах 1Е, 1F, 1I являются такими, как указано в формуле изобретения. Технический результат: повышение выхода и чистоты получаемого замещенного конденсированного с гетероциклом гамма-карболина формулы 1J за счет использования в качестве растворителя толуола. 3 н. и 36 з.п. ф-лы, 9 пр., 4 табл.
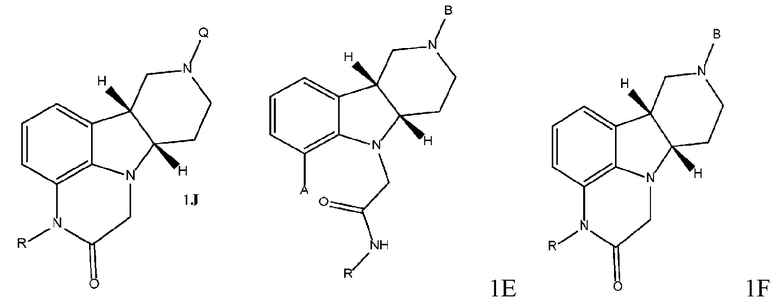
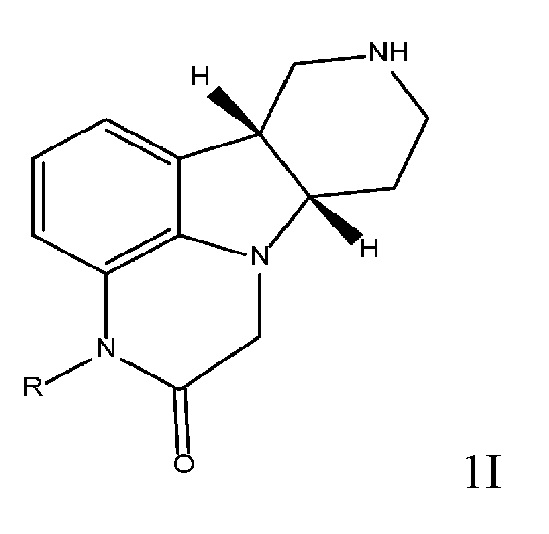
1. Способ получения соединения формулы 1J,
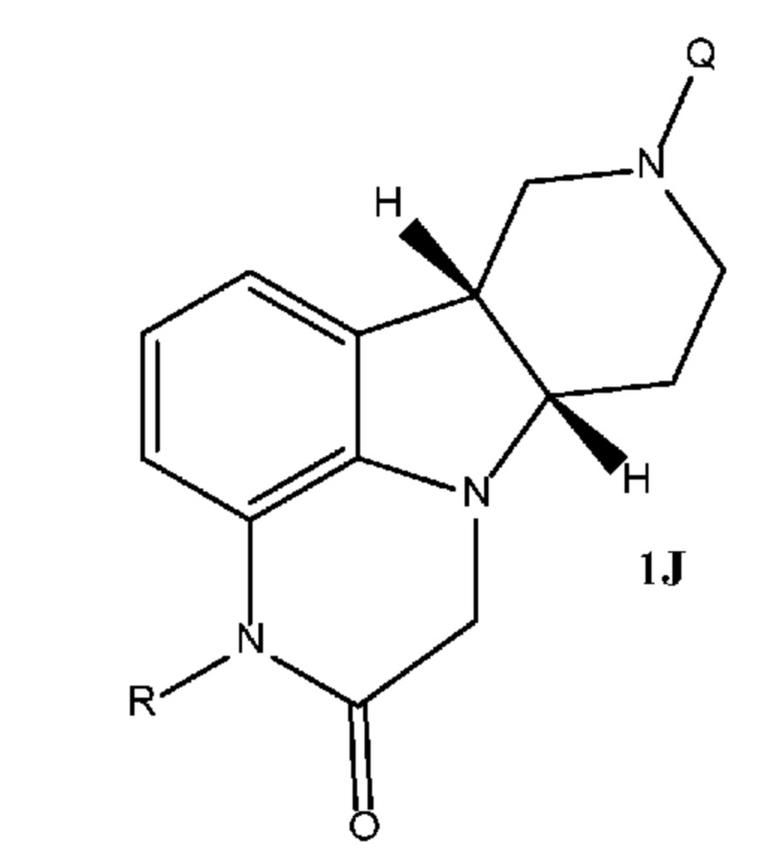
в свободной форме или в форме соли, где R выбран из H и C1-4 алкила, и Q выбран из 4-(4-фторфенил)-4-оксобутила и 3-(4-фторфенокси)пропила;
включающий стадии (a) реакцию соединения формулы 1E,
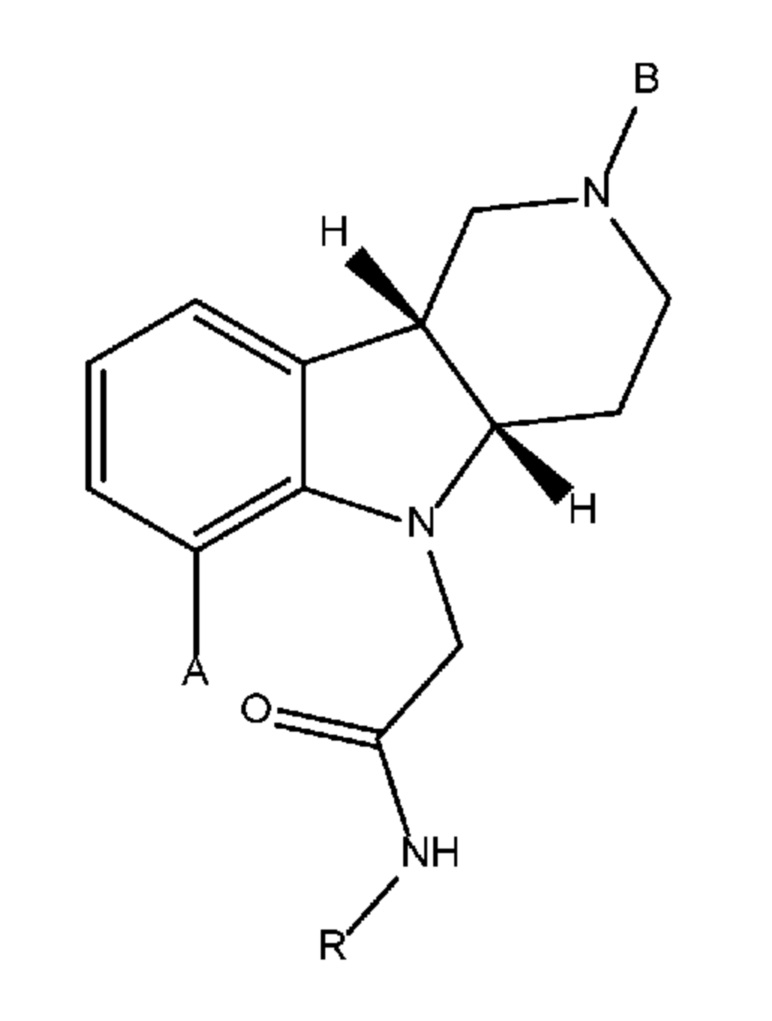
в свободной форме или в форме соли в растворителе, представляющем собой толуол, где
(i) A выбран из Br, Cl и I;
(ii) R выбран из H и C1-4 алкила;
(iii) B означает защитную группу;
с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно йодидом или бромидом щелочного металла или аммония и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 1F,
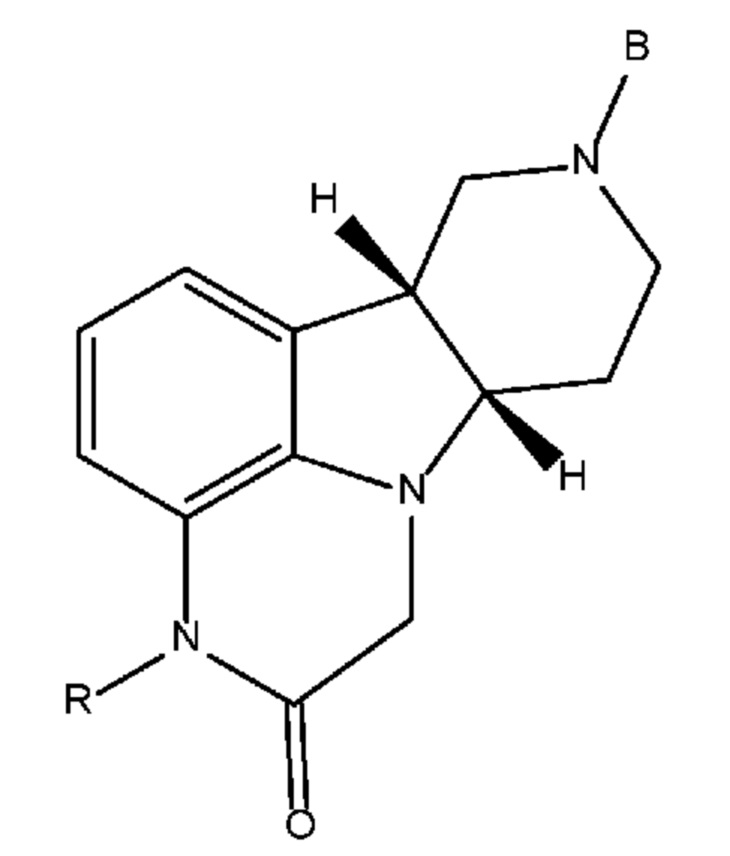
в свободной форме или в форме соли, где B и R являются такими, как определено для соединения формулы 1E;
(b) удаление защитной группы пиперидинового атома азота соединения формулы 1F с получением соединения формулы 1I,
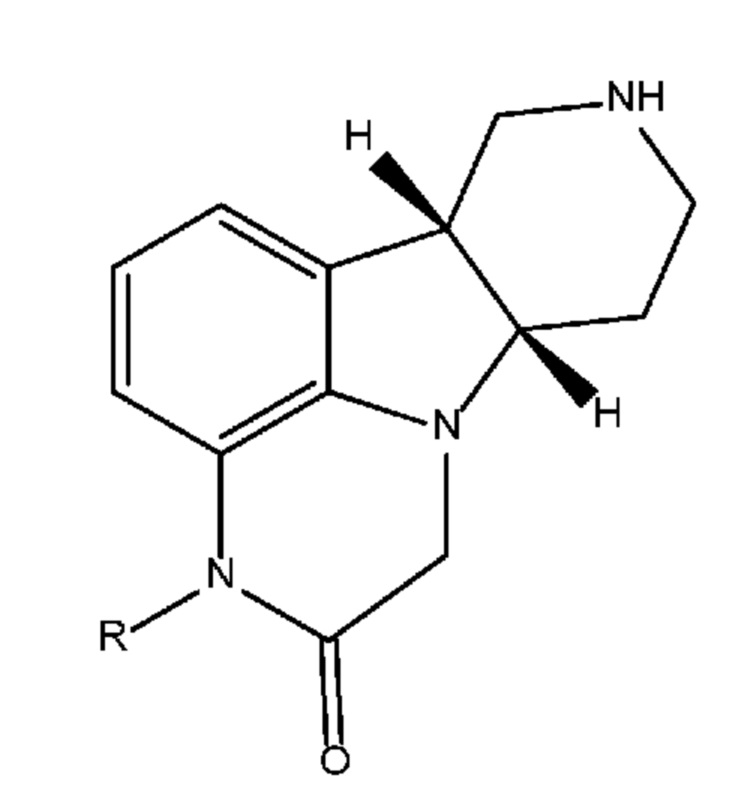
в свободной форме или в форме соли, где R является таким, как определено для соединения формулы 1F; и (c) алкилирование пиперидинового атома азота соединения формулы 1I подходящим реагентом алкилирования с получением соединения формулы 1J в свободной форме или в форме соли; и необязательно (d) превращение соединения формулы 1J в свободной форме в соединение формулы 1J в форме соли.
2. Способ по п.1, где R означает H.
3. Способ по п.1 или 2, где Q означает 3-(4-фторфенокси)пропил.
4. Способ по любому из пп.1-3, где B представляет собой группу формулы P-Z, где P выбран из CH2, C(O), C(O)O и S(O)2, и где Z представляет собой необязательно замещенный алкил, арил, алкиларил или -OR’, где R’ представляет собой алкил, арил, арилалкил или гетероарилалкил.
5. Способ по п.4, где B представляет собой ацильную группу.
6. Способ по п.5, где защитная группа B представляет собой трет-бутоксикарбонил, феноксикарбонил, этоксикарбонил, метоксикарбонил или необязательно замещенный бензилоксикарбонил.
7. Способ по п.6, где защитная группа B представляет собой этоксикарбонил.
8. Способ по любому из пп.1-7, где катализатор на основе переходного металла на стадии (a) представляет собой медный катализатор.
9. Способ по п.8, где катализатор на основе переходного металла на стадии (a) выбран из CuI, CuBr, CuCl, Cu(OAc)2, Cu2Cl2, CuBr2, CuSO4, Cu2SO4 и Cu2O.
10. Способ по п.9, где катализатор на основе переходного металла представляет собой CuI.
11. Способ по любому из пп.1-10, где основание на стадии (a) представляет собой карбонатное основание.
12. Способ по п.11, где основание на стадии (a) выбрано из карбоната натрия, карбоната калия, бикарбоната натрия или бикарбоната калия, или их смеси.
13. Способ по любому из пп.1-12, где стадия (a) включает йодид или бромид щелочного металла или аммония.
14. Способ по любому из пп.1-13, где стадия (a) включает монодентатный или бидентатный лиганд.
15. Способ по п.14, где лиганд выбран из необязательно замещенного 1,2-диамина, необязательно замещенного 1,2-аминоспирта, DBU, DBN или DABCO.
16. Способ по п.15, где лиганд представляет собой DBU.
17. Способ по любому из пп.1-16, где соединение формулы 1E объединяют с основанием (ii) в растворителе, представляющем собой толуол, и смесь азеотропно перегоняют для удаления воды до прибавления катализатора (i) и необязательного йодида (iii) и/или необязательного лиганда (iv).
18. Способ по п.17, где соединение формулы 1F выделяют путем охлаждения реакционной смеси до комнатной температуры и последующего разбавления смеси неполярным растворителем для осаждения продукта, последующего фильтрования с выделением осадка.
19. Способ по п.18, где неполярный растворитель представляет собой пентаны, н-пентан, гексаны, н-гексан, гептаны, н-гептан, циклопентан, циклогексан или их комбинацию.
20. Способ по любому из пп.1-19, где стадией удаления защитной группы (b) является кислотный гидролиз.
21. Способ по п.20, где стадия удаления защитной группы (b) включает применение бромистоводородной кислоты в уксусной кислоте.
22. Способ по любому из пп.20 или 21, где стадия (b) сначала дает форму соли присоединения с кислотой соединения формулы 1I и где стадия (b) дополнительно включает стадию нейтрализации для превращения формы соли присоединения с кислотой соединения формулы 1I в соответствующую форму свободного основания, где необязательно стадия нейтрализации включает водный раствор аммиака.
23. Способ по п.22, где соединение формулы 1I первоначально представляет собой соль присоединения с кислотой HCl или HBr.
24. Способ по любому из пп.1-23, где подходящим алкилирующим реагентом на стадии (c) является соединение общей формулы Q-X, где Q выбран из 4-(4-фторфенил)-4-оксобутила и 3-(4-фторфенокси)пропила, и где X выбран из хлора, брома, йода, C1-4 алкилсульфонилокси и необязательно замещенной арилсульфонилокси.
25. Способ по п.24, где стадия (c) дополнительно включает подходящее органическое основание или неорганическое основание.
26. Способ по любому из пп.1-25, где соединение формулы 1J получают в форме свободного основания на стадии (c).
27. Способ по п.26, где соединение формулы 1J в форме свободного основания выделяют из реакционной смеси способом, включающим стадии (i) разбавление реакционной смеси органическим растворителем и водой, (ii) отделение органического слоя и его концентрирование в вакууме до малого объема и (iii) совместное выпаривание остатка с неполярным растворителем от 1 до 5 раз с последующим сбором твердых веществ фильтрованием.
28. Способ по п.27, где полученный неочищенный продукт дополнительно очищают путем осаждения из подходящего растворителя.
29. Способ по п.27 или 28, где неочищенный продукт диспергируют и фильтруют с ацетонитрилом с последующей перекристаллизацией из бинарной смеси растворителей.
30. Способ по любому из пп.27-29, где соединение формулы 1J получают в виде кристаллического твердого вещества путем перекристаллизации из растворителя, выбранного из ацетонитрила, ацетона, метанола или их смеси.
31. Способ по п.30, где перекристаллизацию осуществляют из смеси ацетон-метанол.
32. Способ по любому из пп.1-31, дополнительно включающий стадию превращения соединения формулы 1J в свободной форме в соединение формулы 1J в форме соли.
33. Способ по п.32, где форма соли представляет собой форму тозилатной соли.
34. Способ получения соединения формулы 1I, определенного в п.1 в свободной форме или в форме соли, включающий стадии (a) реакцию соединения формулы 1E, определенного в п.1 в свободной форме или в форме соли в растворителе, представляющем собой толуол, с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) необязательно основанием, (iii) необязательно йодидом или бромидом щелочного металла или аммония и (iv) необязательно монодентатным или бидентатным лигандом с получением промежуточного продукта формулы 1F в свободной форме или в форме соли; и (b) удаление защитной группы пиперидинового атома азота соединения формулы 1F с получением соединения формулы 1I в свободной форме или в форме соли.
35. Способ по п.34, где катализатор на основе переходного металла представляет собой CuI, основание выбрано из карбоната натрия, карбоната калия, бикарбоната натрия или бикарбоната калия, или их смеси, реакция содержит йодид или бромид щелочного металла или аммония, и где реакция содержит моно- или бидентатный лиганд, и где указанный лиганд представляет собой DBU.
36. Способ по п.34 или 35, где защитная группа B представляет собой трет-бутоксикарбонил, феноксикарбонил, этоксикарбонил, метоксикарбонил или необязательно замещенный бензилоксикарбонил.
37. Способ получения соединения формулы 1F, определенного в п.1 в свободной форме или в форме соли, включающий стадии (a) реакцию соединения формулы 1E, определенного в п.1 в свободной форме или в форме соли, в растворителе, представляющем собой толуол, с (i) катализатором на основе переходного металла, выбранным из группы, состоящей из групп 8-11 Периодической системы, (ii) основанием, (iii) необязательно йодидом или бромидом щелочного металла или аммония, и (iv) одним или большим количеством моно- или бидентатных лигандов, включающих DBU, с получением соединения формулы 1F в свободной форме или в форме соли с последующим (b) выделением соединения формулы 1F в свободной форме или в форме соли, путем осаждения из смеси гидрофобных растворителей.
38. Способ по п.37, где катализатор на основе переходного металла представляет собой CuI, основание выбрано из карбоната натрия, карбоната калия, бикарбоната натрия или бикарбоната калия, или их смеси, и реакция содержит йодид или бромид щелочного металла или аммония.
39. Способ по любому из пп.1-38, где способ дополнительно включает стадию получения соединения формулы 1E:
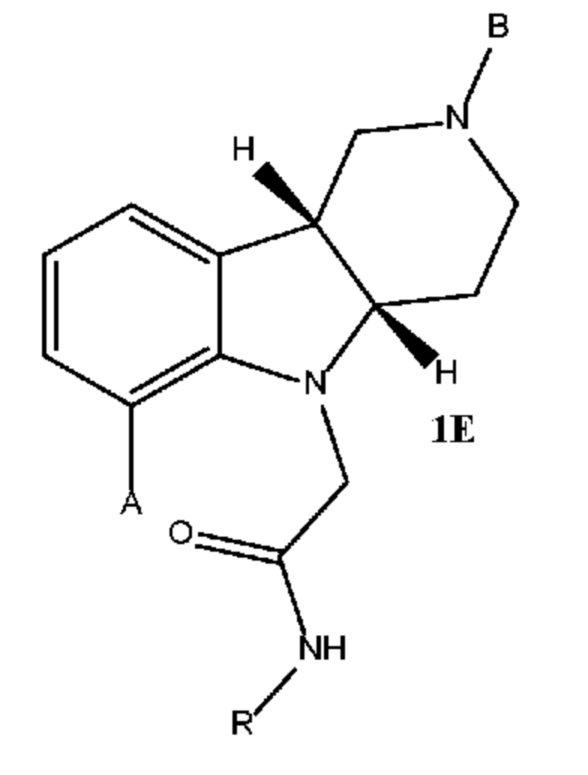
где:
(i) A выбран из Br, Cl и I;
(ii) R выбран из H и C1-4 алкила; и
(iii) B представляет собой защитную группу;
в свободной форме или в форме соли,
включает стадию N-алкилирования соединения формулы 1D
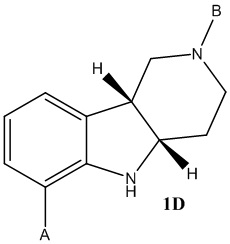
(a) нуклеофильным алкилгалогенидом общей формулы:
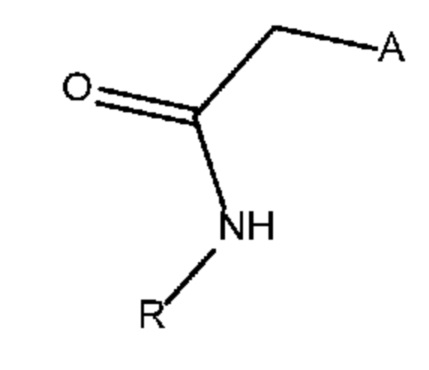
где:
(i) A=Cl, F, Br или I; и
(ii) R представляет собой H или C1-4 алкил;
(b) основанием, и (c) катализатором;
где указанным основанием является основание-третичный амин и катализатором является тетраалкилгалогенид аммония.
| US 8309722 B2, 13.11.2012 | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| US 6548493 A, 15.04.2003 | |||
| US 9708322 В2, 18.07.2017 | |||
| US 6713471 В1, 30.03.2004 | |||
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2011 |
|
RU2591194C2 |
Авторы
Даты
2023-05-05—Публикация
2019-12-17—Подача