Область техники, к которой относится изобретение
Настоящее изобретение относится к новой ацетил-CoA-карбоксилазе.
Предпосылки создания изобретения
Жирные кислоты являются важными составляющими липидов, таких как фосфолипиды и триацилглицериды. Известно, что жирные кислоты, содержащие две или более ненасыщенных связей, которые обобщенно называются полиненасыщенными жирными кислотами (PUFA), включают арахидоновую кислоту, дигомо-γ-линоленовую кислоту, эйкозапентаеновую кислоту и докозагексаеновую кислоту. В литературе опубликованы данные о различных видах физиологической активности таких жирных кислот (непатентный документ 1).
Среди них привлекает внимание арахидоновая кислота в качестве промежуточного метаболита при синтезе простагландинов, лейкотриенов и т.п., и было предпринято множество попыток использовать ее в качестве материала для функциональных продуктов питания и лекарственных средств. Кроме того, арахидоновая кислота содержится в грудном молоке, так что она важна для роста младенцев, особенно, для роста и развития мозга эмбриона, и поэтому она привлекает внимание также как и DHA (докозагексаеновая кислота) в пищевом аспекте как необходимый компонент для роста младенцев.
Предполагается, что такие полиненасыщенные жирные кислоты найдут применение в различных областях, но некоторые из них не могут быть синтезированы in vivo у животных. Это привело к разработке способов получения полиненасыщенных жирных кислот путем культивирования различных микроорганизмов. Также предпринимались попытки продукции полиненасыщенных жирных кислот в растениях. В этом случае известно, что полиненасыщенные жирные кислоты накапливаются в виде компонентов запасных липидов, таких как триацилглицериды, например, в микробных клетках или семенах растений.
Хотя молекулярные структуры ферментов, вовлеченных в de novo синтез жирных кислот и удлинение цепей жирных кислот, отличаются у прокариотов и эукариотов, механизмы ферментативных реакций похожи для любых типов клеток. Биосинтез жирных кислот начинается с ацетил-CoA, и из ацетил-CoA образуется малонил-CoA в результате катализа ацетил-CoA-карбоксилазой (E.C.6.4.1.2). Различные насыщенные жирные кислоты синтезируют путем добавления двух атомов углерода посредством декарбоксилирующего сочетания ацетил-CoA с малонил-CoA в серии реакций конденсации-восстановления-дегидратации-восстановления, катализируемых синтетазами жирных кислот (FAS). Аналогичным образом, реакции удлинения цепи жирной кислоты включают добавление двух атомов углерода посредством декарбоксилирующего сочетания ацетил-CoA с малонил-CoA в серии реакций конденсации-восстановления-дегидратации-восстановления.
В настоящее время ацетил-CoA-карбоксилазы (далее также называемые «АСС») известны для нескольких организмов. АСС млекопитающих представляют собой конкретные аллостерические ферменты, активируемые лимонной кислотой, ингибируемые сложными эфирами CoA и длинноцепочечных жирных кислот и инактивируемые фосфорилированием. У грибов интенсивно исследуется АСС из дрожжей (Saccharomyces cerevisiae).
АСС из S. cerevisiae локализована в цитоплазме и митохондриях и кодируется генами ACC1 и HFA1, соответственно. Известно, что ген АСС1 является необходимым геном, делеция которого приводит к гибели клетки (непатентный документ 2). Анализ различных штаммов выявил, что ген АСС1 также вовлечен в транспорт (полиА+)мРНК из ядра, а также имеет другие функции (непатентный документ 3).
Предпринимались попытки увеличить содержание жиров в семенах растений с использованием генов АСС (непатентный документ 4). Например, опубликовано, что содержание жирных кислот в расчете на сухую массу увеличивается, а также изменяется соотношение состава жирных кислот в семенах трансгенной Brassica napus L., экспрессирующей ACC из Arabidopsis thaliana (непатентный документ 5). Однако картина изменения соотношения состава жирных кислот зависит от соотношения состава жирных кислот, присущих организму-хозяину, и трансдуцированного гена АСС. С другой стороны, активность АСС регулируется различным образом не только на уровне экспрессии, но также и на уровне белка (непатентные документы 3 и 4), а также на нее влияют взаимодействия с другими ферментами, функционирующими в ряде систем синтеза жирных кислот. Поэтому, для получения желаемой композиции жирных кислот в зависимости от трансформируемого организма-хозяина может потребоваться соответствующий ген АСС.
Для продуцирующего липиды гриба Mortierella alpina (далее также называемого «M. alpina») в качестве гена АСС ранее был известен фрагмент гена гомолога АСС из штамма CBS 528.72, предположительно обладающего АСС-активностью (ацетил-CoA-карбоксилазной активностью) (непатентный документ 6). Однако до настоящего времени не было подтверждено, что белок, содержащий такой фрагмент, обладает АСС-активностью. Была проведена оценка штамма M. alpina CBS696.70 по накоплению жира и ацетил-CoA-карбоксилазной активности (непатентный документ 7).
Ссылки
Непатентные документы
Непатентный документ 1: Lipids, 39, 1147 (2004)
Непатентный документ 2: Giaever G. et al. Nature 418, 387-91 (2002)
Непатентный документ 3: O. Tehlivets et al., Biochimica et Biophysica Acta, 1771, 255-270 (2007)
Непатентный документ 4: Biosci. Biotechnol. Biochem., 68 (6), 1175-1184, (2004)
Непатентный документ 5: Plant Physiol. 113, 75-81 (1997)
Непатентный документ 6: The International Nucleotide Sequence Database accession number AJ586915
Непатентный документ 7: Microbiology, 145, 1911-1917 (1999)
Краткое описание сущности изобретения
Технические проблемы
Однако известно, что гены АСС, о которых сообщалось до настоящего времени, не обладают достаточным влиянием на метаболизм липидов при их переносе и экспрессии в организмах-хозяевах. Их недостатком также является то, что они недостаточно эффективно увеличивают или уменьшают накопление жиров или жирных кислот в некоторых хозяевах. Поэтому необходим новый белок, который при переносе и экспрессии в клетке-хозяине будет влиять на метаболизм липидов хозяина. Также необходим новый белок, способный продуцировать жиры с высоким содержанием промышленно значимых жирных кислот.
Способ решения проблем
Задачей настоящего изобретения является предоставление белков и нуклеиновых кислот, способных продуцировать ценные жиры путем экспрессии в клетке-хозяине для влияния на метаболизм липидов хозяина или для увеличения содержания желаемой жирной кислоты.
Для достижения поставленной задачи авторы изобретения провели тщательные исследования. Во-первых, с помощью EST-анализа продуцирующего липиды гриба M. alpina были выявлены последовательности, имеющие высокую гомологию с известными генами АСС. Для получения полноразмерной открытой рамки считывания (ORF), кодирующей АСС, при помощи скрининга кДНК-библиотеки или ПЦР была клонирована полноразмерная кДНК. Путем ее трансформации в высокопролиферирующую клетку-хозяина, такую как дрожжевая клетка, авторы изобретения предприняли попытку продуцировать композицию жирных кислот и успешно клонировали ген новой АСС, способной продуцировать композицию жирных кислот, отличающуюся от композиции, продуцируемой хозяевами, экспрессирующими обычные АСС, и в итоге осуществили настоящее изобретение. Соответственно, настоящее изобретение обеспечивает следующие аспекты:
(1) Нуклеиновую кислоту по любому из (а)-(e) ниже:
(а) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий ацетил-CoA-карбоксилазной активностью;
(b) нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий ацетил-CoA-карбоксилазной активностью;
(c) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, имеющую 80% или большую идентичность с нуклеотидной последовательностью, состоящей из SEQ ID NO:1, и кодирующую белок, обладающий ацетил-CoA-карбоксилазной активностью;
(d) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, идентичной на 80% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий ацетил-CoA-карбоксилазной активностью; и
(e) нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий ацетил-CoA-карбоксилазной активностью.
(2) Нуклеиновую кислоту по пункту (1), которой является любая из (а)-(e) ниже:
(а) нуклеиновой кислоты, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий ацетил-CoA-карбоксилазной активностью;
(b) нуклеиновой кислоты, которая гибридизуется в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий ацетил-CoA-карбоксилазной активностью; и
(c) нуклеиновой кислоты, которая содержит нуклеотидную последовательность, имеющую 90% или большую идентичность с нуклеотидной последовательностью, состоящей из SEQ ID NO:1, и кодирующую белок, обладающий ацетил-CoA-карбоксилазной активностью;
(d) нуклеиновой кислоты, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, идентичной на 90% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий ацетил-CoA-карбоксилазной активностью; и
(e) нуклеиновой кислоты, которая гибридизуется в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий ацетил-CoA-карбоксилазной активностью.
(3) Нуклеиновую кислоту по любому из (а)-(c) ниже:
(а) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, приведенную в SEQ ID NO:1, или ее фрагмент;
(b) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, или ее фрагмент;
(c) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, приведенную в SEQ ID NO:4, или ее фрагмент.
(4) Нуклеиновую кислоту по любому из (а)-(e) ниже:
(а) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах;
(b) нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах;
(c) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, имеющую 80% или большую идентичность с нуклеотидной последовательностью, состоящей из SEQ ID NO:1, и кодирующую белок, обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах;
(d) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, идентичной на 80% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах; и
(e) нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах.
(5) Нуклеиновую кислоту по пункту (4), которой является любая из (а)-(e) ниже:
(а) нуклеиновой кислоты, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах;
(b) нуклеиновой кислоты, которая гибридизуется в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах;
(c) нуклеиновой кислоты, которая содержит нуклеотидную последовательность, имеющую 90% или большую идентичность с нуклеотидной последовательностью, состоящей из SEQ ID NO:1, и кодирующую белок, обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах;
(d) нуклеиновой кислоты, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, идентичной на 90% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах; и
(e) нуклеиновой кислоты, которая гибридизуется в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах.
(6) Белок по (а) или (b) ниже:
(а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:2, и обладающий ацетил-CoA-карбоксилазной активностью; или
(b) белок, состоящий из аминокислотной последовательности, идентичной на 80% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий ацетил-CoA-карбоксилазной активностью.
(7) Белок по (а) или (b) ниже:
(а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности SEQ ID NO:2, и обладающий ацетил-CoA-карбоксилазной активностью; или
(b) белок, состоящий из аминокислотной последовательности, идентичной на 90% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий ацетил-CoA-карбоксилазной активность
(8) Белок по (а) или (b) ниже:
(а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:2, и обладающий активностью, восполняющей отсутствие ацетил-CoA-карбоксилазы у дрожжей; или
(b) белок, состоящий из аминокислотной последовательности, идентичной на 80% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий активностью, восполняющей отсутствие ацетил-CoA-карбоксилазы у дрожжей.
(9) Белок по (а) или (b) ниже:
(а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности SEQ ID NO:2, и обладающий активностью, восполняющей отсутствие ацетил-CoA-карбоксилазы у дрожжей; или
(b) белок, состоящий из аминокислотной последовательности, идентичной на 90% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий активностью, восполняющей отсутствие ацетил-CoA-карбоксилазы у дрожжей.
(10) Белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2.
(11) Рекомбинантный вектор, содержащий нуклеиновую кислоту по любому из пунктов (1)-(5).
(12) Клетку, трансформированную рекомбинантным вектором по пункту (11).
(13) Композицию жирных кислот, полученную культивированием трансформированной клетки по пункту (12).
(14) Способ получения композиции жирных кислот по пункту (13), включающий сбор композиции жирных кислот из культуры трансформированных клеток по пункту (12).
(15) Продукт питания, содержащий композицию жирных кислот по пункту (13).
(16) Нуклеиновую кислоту по любому из (а)-(e) ниже:
(а) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий активностью, повышающей содержание арахидоновой кислоты, характерное для хозяина;
(b) нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий активностью, повышающей содержание арахидоновой кислоты, характерное для хозяина;
(c) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, имеющую 80% или большую идентичность с нуклеотидной последовательностью, состоящей из SEQ ID NO:1, и кодирующую белок, обладающий активностью, повышающей содержание арахидоновой кислоты, характерное для хозяина;
(d) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, идентичной на 80% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий активностью, повышающей содержание арахидоновой кислоты, характерное для хозяина; и
(e) нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий активностью, повышающей содержание арахидоновой кислоты, характерное для хозяина.
(17) Белок по (а) или (b) ниже:
(а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:2, и обладающий активностью, повышающей содержание арахидоновой кислоты, характерное для хозяина; или
(b) белок, состоящий из аминокислотной последовательности, идентичной на 80% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий активностью, повышающей содержание арахидоновой кислоты, характерное для хозяина.
Дополнительно, настоящее изобретение также охватывает следующие аспекты:
(А) Нуклеиновую кислоту по любому из (а)-(e) ниже:
(а) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий активностью, изменяющей содержание жирных кислот или соотношение состава жирных кислот, характерное для хозяина;
(b) нуклеиновую кислоту, которая гибридизуется в жестких условиях, предпочтительно, в условиях 2×SSC при 50°C, с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий активностью, изменяющей содержание жирных кислот или соотношение состава жирных кислот, характерное для хозяина;
(c) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, имеющую 80% или большую идентичность, предпочтительно, 90% или большую с нуклеотидной последовательностью SEQ ID NO:1, и кодирующую белок, обладающий активностью, изменяющей содержание жирных кислот или соотношение состава жирных кислот, характерное для хозяина;
(d) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, имеющей 80% идентичность или большую, предпочтительно, 90% идентичность или большую с аминокислотной последовательностью SEQ ID NO:2, и обладающий активностью, изменяющей содержание жирных кислот или соотношение состава жирных кислот, характерное для хозяина; и
(e) нуклеиновую кислоту, которая гибридизуется в жестких условиях, предпочтительно, в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий активностью, изменяющей содержание жирных кислот или соотношение состава жирных кислот, характерное для хозяина.
(B) Белок по (а) или (b) ниже:
(а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности SEQ ID NO:2, и обладающий активностью, изменяющей содержание жирных кислот или соотношение состава жирных кислот, характерное для хозяина; или
(b) белок, состоящий из аминокислотной последовательности, имеющей 80% идентичность или большую, предпочтительно, 90% или большую с аминокислотной последовательностью, состоящей из SEQ ID NO:2, и обладающий активностью, изменяющей содержание жирных кислот или соотношение состава жирных кислот, характерное для хозяина.
Дополнительно, настоящее изобретение также охватывает: (C) рекомбинантный вектор, содержащий любую из нуклеиновых кислот, представленных в пункте (А); (D) клетку, трансформированную рекомбинантным вектором; (E) композицию жирных кислот, полученную культивированием трансформированной клетки, имеющей измененное содержание жирных кислот или соотношение состава жирных кислот по сравнению с параметрами, характерными для культур хозяина, не трансформированных рекомбинантным вектором по пункту (C); (F) способ получения композиции жирных кислот по пункту (E), включающий сбор композиции жирных кислот по пункту (E) из культур трансформированных клеток по пункту (D); и (G) продукт питания, содержащий композицию жирных кислот по пункту (E).
Предпочтительные эффекты изобретения
АСС настоящего изобретения улучшает способность продуцировать жирные кислоты и/или запасные липиды и, поэтому, предпочтительна в качестве средства улучшения продукции полиненасыщенных жирных кислот у микроорганизмов и растений. Таким образом, из них можно получить липиды с желаемыми характеристиками или эффектами, которые пригодны для использования в продуктах питания, косметических продуктах, фармацевтических продуктах, мылах и т.д.
Краткое описание фигур
На фиг.1А показана полноразмерная последовательность кДНК (SEQ ID NO:4) ACC из штамма M. alpina 1S-4 и выведенная из нее аминокислотная последовательность (SEQ ID NO:2).
На фиг.1В показана полноразмерная последовательность кДНК (SEQ ID NO:4) ACC из штамма M. alpina 1S-4 и выведенная из нее аминокислотная последовательность (SEQ ID NO:2).
На фиг.1С показана полноразмерная последовательность кДНК (SEQ ID NO:4) ACC из штамма M. alpina 1S-4 и выведенная из нее аминокислотная последовательность (SEQ ID NO:2).
На фиг.1D показана полноразмерная последовательность кДНК (SEQ ID NO:4) ACC из штамма M. alpina 1S-4 и выведенная из нее аминокислотная последовательность (SEQ ID NO:2).
На фиг.2А показано сравнение между полноразмерной последовательностью кДНК ACC из штамма M. alpina 1S-4 и нуклеотидной последовательностью фрагмента гомолога АСС из известного штамма M. alpina CBS528.72.
На фиг.2В показано сравнение между полноразмерной последовательностью кДНК ACC из штамма M. alpina 1S-4 и нуклеотидной последовательностью фрагмента гомолога АСС из известного штамма M. alpina CBS528.72.
На фиг.2С показано сравнение между полноразмерной последовательностью кДНК ACC из штамма M. alpina 1S-4 и нуклеотидной последовательностью фрагмента гомолога АСС из известного штамма M. alpina CBS528.72.
На фиг.2D показано сравнение между полноразмерной последовательностью кДНК ACC из штамма M. alpina 1S-4 и нуклеотидной последовательностью фрагмента гомолога АСС из известного штамма M. alpina CBS528.72.
На фиг.3А показано сравнение между аминокислотной последовательностью (SEQ ID NO:2), образованной из полноразмерной последовательности кДНК ACC из штамма M. alpina 1S-4, и аминокислотной последовательностью (SEQ ID NO:25), образованной из фрагмента кДНК АСС из штамма M. alpina CBS528.72.
На фиг.3В показано сравнение между аминокислотной последовательностью (SEQ ID NO:2), образованной из полноразмерной последовательности кДНК ACC из штамма M. alpina 1S-4, и аминокислотной последовательностью (SEQ ID NO:25), образованной из фрагмента кДНК АСС из штамма M. alpina CBS528.72.
На фиг.3С показано сравнение между аминокислотной последовательностью (SEQ ID NO:2), образованной из полноразмерной последовательности кДНК ACC из штамма M. alpina 1S-4, и аминокислотной последовательностью (SEQ ID NO:25), образованной из фрагмента кДНК АСС из штамма M. alpina CBS528.72.
На фиг.4А показано сравнение аминокислотной последовательности (SEQ ID NO:2), образованной из полноразмерной последовательности кДНК ACC из штамма M. alpina 1S-4, с аминокислотной последовательностью (SEQ ID NO:34) цитоплазматической АСС, Асс1р, и аминокислотной последовательностью (SEQ ID NO:35) митохондриальной ACC, Hfa1p, из дрожжей Saccharomyces cerevisiae.
На фиг.4В показано сравнение аминокислотной последовательности (SEQ ID NO:2), образованной из полноразмерной последовательности кДНК ACC из штамма M. alpina 1S-4, с аминокислотной последовательностью (SEQ ID NO:34) цитоплазматической АСС, Асс1р, и аминокислотной последовательностью (SEQ ID NO:35) митохондриальной ACC, Hfa1p, из дрожжей Saccharomyces cerevisiae.
На фиг.4С показано сравнение аминокислотной последовательности (SEQ ID NO:2), образованной из полноразмерной последовательности кДНК ACC из штамма M. alpina 1S-4, с аминокислотной последовательностью (SEQ ID NO:34) цитоплазматической АСС, Асс1р, и аминокислотной последовательностью (SEQ ID NO:35) митохондриальной ACC, Hfa1p, из дрожжей Saccharomyces cerevisiae.
На фиг.4D показано сравнение аминокислотной последовательности (SEQ ID NO:2), образованной из полноразмерной последовательности кДНК ACC из штамма M. alpina 1S-4, с аминокислотной последовательностью (SEQ ID NO:34) цитоплазматической АСС, Асс1р, и аминокислотной последовательностью (SEQ ID NO:35) митохондриальной ACC, Hfa1p, из дрожжей Saccharomyces cerevisiae.
На фиг.4Е показано сравнение аминокислотной последовательности (SEQ ID NO:2), образованной из полноразмерной последовательности кДНК ACC из штамма M. alpina 1S-4, с аминокислотной последовательностью (SEQ ID NO:34) цитоплазматической АСС, Асс1р, и аминокислотной последовательностью (SEQ ID NO:35) митохондриальной ACC, Hfa1p, из дрожжей Saccharomyces cerevisiae.
Фиг.5 является схематической диаграммой, на которой показана плазмида pSDY-ACC. На данной фигуре hisH4.1p представляет промотор гена гистона H4.1 из M. alpina, trpCt представляет терминатор гена trpC из Aspergillus nidulans, ura5 представляет ген ura5 из M. alpina, и рДНК представляет часть 18S рДНК (рибосомной ДНК) из M. alpina. Стрелки (→) на схеме указывают положения праймеров ACC-F7 и trpCt-R, используемых для идентификации трансформированных штаммов.
Фиг.6 является графиком, показывающим изменение во времени сухой массы клеток трансформированных штаммов M. alpina. Ось ординат: сухая масса клеток (г/пробирка); ось абсцисс: время инкубации (дни).
Фиг.7 является графиком, показывающим изменение во времени количества жирных кислот, продуцируемых трансформированными штаммами M. alpina. Ось ординат: количество продуцируемых жирных кислот (мг/л среды); ось абсцисс: время инкубации (дни).
Фиг.8 является графиком, показывающим соотношение состава жирных кислот трансформированных штаммов M. alpina на 8-й день инкубации. Ось ординат: соотношение состава жирных кислот; ось абсцисс: клетка-хозяин и трансформированные штаммы. Условные обозначения на графике: EPA: эйкозапентаеновая кислота; ARA: арахидоновая кислота; DGLA: дигомо-γ-линоленовая кислота; GLA: γ-линоленовая кислота; LA: линолевая кислота; OA: олеиновая кислота; SA: стеариновая кислота; PA: пальмитиновая кислота.
Описание вариантов осуществления изобретения
Настоящее изобретение относится к новой ацетил-CoA-карбоксилазе из рода Mortierella, характеризуемой катализируемой реакцией получения малонил-CoA посредством АТФ-зависимого карбоксилирования ацетил-CoA.
Реакция получения малонил-CoA из ацетил-CoA, опосредуемая ацетил-CoA-карбоксилазой настоящего изобретения (далее также называемой «АСС»), является ключевой, лимитирующей стадией в биосинтезе жирных кислот. Это означает, что АСС представляет собой ключевой фермент, отвечающий за поставку малонил-CoA, который является важным промежуточным соединением в синтезе жирных кислот. Более конкретно, АСС представляет собой фермент, катализирующий следующую реакцию:
[Формула 1]
АТФ+ацетил-CoA+HCO3 -<=>АДФ+Pi+малонил-CoA
Таким образом, такие ферменты катализируют реакцию получения малонил-CoA посредством АТФ-зависимого карбоксилирования ацетил-CoA. Эта реакция проходит в две стадии, показанные ниже:
[Формула 2]
(1) BCCP*+HCO3 -+Mg2 +-АТФ→BCCP-CO2 -+Mg2 +-АДФ+Pi (биотин-карбоксилтранфераза)
(2) BCCP-CO2 -+ацетил-CoA→BCCP+малонил-CoA (карбоксилтрансфераза)
BCCP*: белок-носитель биотинкарбоксила
Малонил-CoA, продуцируемый по данной реакции, служит в качестве субстрата для de novo реакции синтеза жирных кислот или реакции удлинения цепи жирной кислоты при синтезе различных жирных кислот. Таким образом, известно, что АСС настоящего изобретения играет важную роль в регуляции биосинтеза жирных кислот или метаболизма липидов.
Малонил-CoA, продуцируемый АСС настоящего изобретения, является субстратом в синтезе жирных кислот, описанном выше, и скорость продукции малонил-CoA определяет скорость in vivo биосинтеза жирных кислот. Более конкретно, de novo синтез жирных кислот начинается с ацетил-CoA, к которому для синтеза новых жирных кислот добавляют два атома углерода путем декарбоксилирующего присоединения малонил-CoA в серии реакций конденсации-восстановления-дегидратации-восстановления. Например, пальмитиновую кислоту, содержащую 16 атомов углерода, синтезируют семью циклами серий реакций конденсации-восстановления-дегидратации-восстановления, при этом два атома углерода на метильном конце данной пальмитиновой кислоты являются производными ацетил-CoA, и другие являются производными малонил-CoA. Малонил-CoA не только является промежуточным соединением в биосинтезе жирных кислот, но также является промежуточным соединением в биосинтезе поликетидов.
Кроме того, ацетил-CoA-карбоксилаза настоящего изобретения обладает активностью, компенсирующей недостаток ацетил-CoA-карбоксилазы в дрожжах, которая подробно описана ниже.
Нуклеиновые кислоты, кодирующие ацетил-CoA-карбоксилазу настоящего изобретения
Последовательности, относящиеся к ацетил-CoA-карбоксилазе настоящего изобретения (АСС), включают SEQ ID NO:1, представляющую собой область открытой рамки считывания (ORF-область) ACC из M. alpina 1S-4; SEQ ID NO:2, представляющую собой ее аминокислотную последовательность; SEQ ID NO:3, представляющую собой область кодирующей последовательности (CDS-область); SEQ ID NO:4, представляющую собой нуклеотидную последовательность кДНК; и SEQ ID NO:5, представляющую собой геномную нуклеотидную последовательность. Более конкретно, SEQ ID NO:3 соответствует нуклеотидам 45-6734 из SEQ ID NO:4, и SEQ ID NO:1 соответствует нуклеотидам 45-6731 из SEQ ID NO:4 и нуклеотидам 1-6684 из SEQ ID NO:3. Геномная последовательность SEQ ID NO:5 содержит пять интронных и экзонных областей, соответствующих нуклеотидам 1-27, 315-665, 1271-2828, 2917-3463, 3590-6239 и 6339-7889 из SEQ ID NO:5.
Нуклеиновые кислоты настоящего изобретения включают одноцепочечные и двухцепочечные ДНК, а также комплементарную им РНК, и могут быть либо природными, либо полученными искусственно. Например, ДНК включает, но не ограничивается ими, геномную ДНК, кДНК, соответствующую геномной ДНК, химически синтезированную ДНК, ПЦР-амплифицированную ДНК и их комбинации, а также ДНК/РНК-гибриды.
Предпочтительные варианты нуклеиновых кислот настоящего изобретения включают (а) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, приведенную в SEQ ID NO:1; (b) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO:2; (c) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, приведенную в SEQ ID NO:4; или (d) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, приведенную в SEQ ID NO:5, и т.д.
Для получения вышеперечисленных нуклеотидных последовательностей можно провести поиск нуклеотидных последовательностей, кодирующих белки, имеющие высокий процент идентичности с известным белком с АСС-активностью, по базе данных нуклеотидных последовательностей EST или геномной ДНК из организма, обладающего АСС-активностью. Организмом, обладающим АСС-активностью, предпочтительно, является продуцирующие липиды грибки, такие как, но без ограничения, M. alpina.
Для проведения EST-анализа сначала конструируют кДНК-библиотеку. Методики создания кДНК-библиотеки можно найти в «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)). Также можно использовать коммерчески доступные наборы для создания кДНК-библиотеки. Например, методика создания кДНК-библиотеки, подходящей для настоящего изобретения, является следующей. А именно, соответствующую среду инокулируют соответствующим штаммом продуцирующих липиды грибков M. alpina, и предварительно культивируют в течение соответствующего периода времени. Например, условия культивирования, подходящие для данного предварительного культивирования, включают среду, состоящую из 1,8% глюкозы, 1% дрожжевого экстракта, рН 6,0, и культивирование в течение 3 дней при температуре инкубации 28°C. Затем из продукта предварительного культивирования получают основную культуру в соответствующих условиях. Например, композиция культуральной среды, подходящей для основной культуры, может содержать 1,8% глюкозы, 1% порошка соевых бобов, 0,1% оливкового масла, 0,01% адеканола, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O, pH 6,0. Условия инкубации, подходящие для основной культуры, включают инкубацию при аэрации и встряхивании при 300 об/мин, 1 vvm, 26°C, в течение 8 дней. В ходе инкубации можно добавлять соответствующее количество глюкозы. Культуры собирают в соответствующих временных точках в ходе основного культивирования, и клетки собирают для получения тотальной РНК. Тотальную РНК можно выделить с помощью известной методики, такой как способ с использованием гуанидинхлорида/CsCl. Поли(А)+РНК можно очистить из полученной тотальной РНК с помощью коммерчески доступного набора. Кроме того, кДНК-библиотеку можно создать, используя коммерчески доступный набор. Затем можно получить данные о EST путем определения нуклеотидных последовательностей любых клонов из созданной кДНК-библиотеки, используя праймеры, подобранные для секвенирования вставки в векторе. Например, можно провести направленное клонирование, когда кДНК-библиотеку создают с использованием набора для клонирования ZAP-cDNA GigapackIII Gold (STRATAGENE).
В результате поиска гомологии с использованием BLASTX среди аминокислотных последовательностей, помещенных в базу данных GenBank, было показано, что последовательность кДНК АСС настоящего изобретения имеет гомологию с АСС-гомологами из эукариотических микроорганизмов. Среди известных аминокислотных последовательностей гипотетический белок RO3G_04977 из Rhizopus oryzae имел наиболее высокий процент идентичности, и идентичность нуклеотидной последовательности и аминокислотной последовательности между кодирующей этот белок CDS и CDS белка ACC настоящего изобретения, определенные с помощью clustalW, составляли 65,5% и 66,3%, соответственно. Идентичность возможным аминокислотным последовательностям гомологов АСС из других грибов составляла 58,8% для гомолога из Neurospora crassa (номер доступа EAA33781), 58,3% для гомолога из Aspergillus fumigatus (номер доступа EAL93163) и 55,1% для цитоплазматической ACC, Acc1p (SEQ ID NO:34), и 44,7% для митохондриальной ACC, Hfa1p (SEQ ID NO:35), из дрожжей Saccharomyces cerevisiae.
Что касается гена АСС из M. alpina, то фрагмент гомолога АСС из штамма CBS528.72 был уже известен и ранее помещен в базу данных Genbank (нуклеотидная последовательность: номер доступа AJ586915 (непатентный документ 6); аминокислотная последовательность: номер доступа CAE52914). CDS-область из штамма CBS528.72 соответствует нуклеотидам 342-1439 из SEQ ID NO:1, и ее аминокислотная последовательность соответствует аминокислотам 100-465 из SEQ ID NO:4. По сравнению с этими последовательностями CDS-область из штамма CBS528.72 в недавно полученной кДНК из M. alpina 1S-4 имела 91,3% идентичность нуклеотидной последовательности и 97,8% идентичность аминокислотной последовательности. Для кДНК из M. alpina 1S-4 настоящего изобретения последовательности нераскрытых областей в известном штамме CBS528.72 еще не были опубликованы, и, поэтому, полная последовательность гена ACC из M. alpina впервые была описана настоящим изобретением. Было показано, что недавно описанные последовательности областей содержат ряд областей или других элементов, критичных для функционирования АСС, и более конкретно, домен белка-носителя биотинкарбоксила, карбоксилтрансферазный домен, консервативный домен белка-акцептора биотина и аминокислотные остатки, входящие в состав акцептора биотина, все из которых необходимы для активности АСС.
Настоящее изобретение также охватывает нуклеиновые кислоты, функционально эквивалентные нуклеиновой кислоте, которая содержит нуклеотидную последовательность, приведенную в приведенной выше SEQ ID NO:1 (далее также называемую как «нуклеотидная последовательность настоящего изобретения»), или нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2 (далее также называемую как «аминокислотная последовательность настоящего изобретения»). Выражение «функционально эквивалентная» означает, что белок, кодируемый нуклеотидной последовательностью настоящего изобретения, и белок, состоящий из аминокислотной последовательности настоящего изобретения, обладает АСС-активностью. АСС-активность можно оценить с помощью известных способов, включая, например, способ, описанный в J.B.C., 279, 21779-21786, 2004.
В дополнение к указанной выше АСС-активности белок, кодируемый нуклеотидной последовательностью настоящего изобретения, или белок, состоящий из аминокислотной последовательности настоящего изобретения, могут также представлять собой белок, обладающий активностью, компенсирующей недостаток АСС в дрожжах (далее также называемый «белок, обладающий активностью, компенсирующей недостаток АСС в дрожжах настоящего изобретения»). АСС дрожжей (S. cerevisiae) локализована в цитоплазме и митохондриях, причем известно, что ген АСС1, кодирующий цитоплазматическую АСС, является необходимым геном, чья делеция приводит к гибели клетки (Biochim. Biophys. Acta, 1771, 255-270, 2007). Другими словами, дрожжи, у которых отсутствует ген АСС1, не могут нормально расти, но его функция компенсируется, и они могут расти при экспрессии гена, функционально эквивалентного гену АСС1.
В связи с этим, способом подтверждения компенсации недостатка АСС в дрожжах с помощью АСС настоящего изобретения может быть любой способ, подтверждающий восстановление АСС-активности в штамме дрожжей с отсутствием АСС при экспрессии гена АСС настоящего изобретения. В качестве конкретного примера, для гена АСС1, кодирующего цитоплазматическую АСС, может быть использован следующий способ.
В данном способе получают гетерозиготный штамм, у которого отсутствует один аллель гена АСС1, кодирующего цитоплазматическую АСС в диплоидных дрожжах, и затем получают штамм, несущий экспрессионную кассету с геном АСС настоящего изобретения на хромосоме, отличной от хромосомы, несущей АСС1, как подробно описано в примере 4 ниже. Эти штаммы высевают на чашки для споруляции для образования аскоспор. Полученные клетки могут быть подвергнуты анализу случайной выборки спор или тетрадному анализу для отбора полученных из спор гаплоидных штаммов. Полученные таким образом гаплоидные дрожжи генотипируют для того, чтобы оценить могут ли нежизнеспособные в других случаях штаммы, дефицитные по АСС1, расти только в присутствии экспрессионной кассеты гена АСС настоящего изобретения, указывая на то, что АСС настоящего изобретения может компенсировать АСС-активность в S. cerevisiae.
В дополнение к указанной выше АСС-активности белок, кодируемый нуклеотидной последовательностью настоящего изобретения, или белок, состоящий из аминокислотной последовательности настоящего изобретения, может также представлять собой белок, обладающий активностью, изменяющей содержание арахидоновой кислоты или композицию жирных кислот, характерные для хозяина. Таким образом, при трансформации клетки-хозяина нуклеиновой кислотой, кодирующей белок настоящего изобретения, и экспрессии белка количество или соотношение состава жирных кислот, продуцируемых трансформированной клеткой, могут измениться по сравнению с этими показателями для нетрансформированных клеток-хозяев. Клеткой-хозяином может быть любая клетка из списка, приведенного в разделе «Конструирование векторов для экспрессии АСС настоящего изобретения и получение трансформированных клеток» ниже. Жирными кислотами, продуцируемыми хозяином, могут быть жирные кислоты, приведенные в разделе «Композиции жирных кислот настоящего изобретения» ниже.
Такие нуклеиновые кислоты, функционально эквивалентные нуклеиновым кислотам настоящего изобретения, включают нуклеиновую кислоту по любому из (а)-(e) ниже. Используемое ниже выражение «указанная выше активность настоящего изобретения» относится к «АСС-активности; активности, компенсирующей недостаток АСС в дрожжах настоящего изобретения; и/или активности, изменяющей содержание арахидоновой кислоты или композицию жирных кислот, характерные для хозяина», определение которых дано выше.
(а) Нуклеиновая кислота, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий указанной выше активностью настоящего изобретения.
Нуклеиновая кислота настоящего изобретения содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий указанной выше активностью настоящего изобретения.
Более конкретно, она содержит нуклеотидную последовательность, кодирующую белок, состоящий из:
(i) аминокислотной последовательности с делецией одной или более (предпочтительно, одной или нескольких (например, 1-400, 1-200, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, более предпочтительно, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2;
(ii) аминокислотной последовательности с замещенными другими аминокислотами одной или более (предпочтительно, одной или нескольких (например, 1-400, 1-200, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, более предпочтительно, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2;
(iii) аминокислотной последовательности с добавлением одной или более (предпочтительно, одной или нескольких (например, 1-400, 1-200, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, более предпочтительно, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2; или
(iv) аминокислотной последовательности с любой комбинацией (i)-(iii) выше;
и обладающий указанной выше активностью настоящего изобретения.
В приведенных выше модификациях предпочтительны консервативные замены. Консервативная замена относится к замене конкретного аминокислотного остатка другим аминокислотным остатком, имеющим аналогичные физико-химические характеристики, и может представлять собой любую замену, которая по существу не изменяет структурные характеристики исходной последовательности, например, она может представлять собой любую замену, при условии, что замещенные аминокислоты не разрушают спираль, присутствующую в исходной последовательности, или не разрушают любой другой тип вторичной структуры, присущий исходной последовательности.
Консервативную замену обычно вводят путем синтеза в биологических системах или путем химического пептидного синтеза, предпочтительно, химическим пептидным синтезом. В этом случае заместители могут включать неприродные аминокислотные остатки, а также пептидомиметики, и обратные или инвертированные формы аминокислотных последовательностей, в которых аминокислоты в незамещенных областях расположены в обратном порядке или инвертированы.
Ниже приведен не ограничивающий объем изобретения перечень групп аминокислотных остатков, которые могут быть замещены друг другом.
Группа А: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминомасляная кислота, метионин, О-метилсерин, трет-бутилглицин, трет-бутилаланин и циклогексилаланин;
группа В: аспарагиновая кислота, глутаминовая кислота, изоаспарагиновая кислота, изоглутаминовая кислота, 2-аминоадипиновая кислота и 2-аминосубериновая кислота;
группа С: аспарагин и глутамин;
группа D: лизин, аргинин, орнитин, 2,4-диаминомасляная кислота и 2,3-диаминопропионовая кислота;
группа Е: пролин, 3-гидроксипролин и 4-гидроксипролин;
группа F: серин, треонин и гомосерин; и
группа G: фенилаланин и тирозин.
Неконсервативные замены могут включать любую замену члена одной из вышеперечисленных групп членом другой группы, причем в этом случае для сохранения биологических функций белков настоящего изобретения предпочтительно учитывать индексы гидрофобности аминокислот (Kyte et al., J. Mol. Biol., 157:105-131(1982)).
Неконсервативная замена может также включать аминокислотную замену на основе гидрофобности.
В описании и чертежах настоящего изобретения обозначения и сокращения для нуклеотидов и аминокислот основаны на биологической номенклатуре, предложенной комиссией IUPAC и IUB, или протоколах, обычно используемых в данной области, описанных, например, в Immunology-A Synthesis (second edition, edited by E.S. Golub and D.R. Gren, Sinauer Associates, Sunderland, Massachusetts (1991)). Любые оптические изомеры аминокислот (если они возможны) относятся к L-изомерам, если не указано иное.
Стереоизомеры приведенных выше аминокислот, такие как D-аминокислоты, неприродные аминокислоты, такие как α,α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие неканонические аминокислоты, могут также входить в состав белков настоящего изобретения.
В настоящем описании последовательности белков приведены с аминоконцом с левой стороны, и карбоксиконцом с правой стороны, в соответствии со стандартным написанием и как общепринято в данной области.
Аналогичным образом и как принято в данной области, одноцепочечные полинуклеотидные последовательности приведены с 5'-концом с левой стороны, и двухцепочечные полинуклеотидные последовательности приведены с 5'-концом одной цепи с левой стороны, если не указано иное.
Специалист в данной области сможет подобрать и создать различные варианты белков, описанных в настоящем описании, используя методики, известные в данной области. Например, специалист сможет идентифицировать подходящие области белковой молекулы, структуру которых можно изменить, не разрушая, при этом, биологическую активность белка настоящего изобретения направленным воздействием на области, которые не считаются важными для биологической активности белка настоящего изобретения. Также, специалист сможет идентифицировать аминокислотные остатки и области, консервативные между гомологичными белками. Кроме того, специалист сможет ввести консервативные аминокислотные замены в области, которые могут быть важны для биологической активности или структуры белка настоящего изобретения без разрушения биологической активности и без отрицательного влияния на полипептидную структуру белка.
В частности, аминокислотная последовательность АСС настоящего изобретения содержит консервативный мотив биотин-содержащих ферментов, называемый «МКМ-мотив». Этот мотив необходим для АСС и является консервативным в аминокислотных последовательностях биотин-содержащих ферментов, и соответствует аминокислотным остаткам 736-738 на фиг.4. На фиг.4 приведено сравнение аминокислотных последовательностей АСС из M. alpina и ACC1 из дрожжей. На фиг.4 одной чертой подчеркнуты биотинкарбоксилазные (ВС) домены, двойной чертой подчеркнуты домены белка-носителя биотинкарбоксила (ВССР), и прерывистой линией подчеркнуты карбоксил-трансферазные (СТ) домены. Остатки лизина (K, Lys), указанные стрелкой, представляют собой акцепторные остатки биотина, и области, соответствующие МКМ-мотиву, заключены в рамки. Соответственно, вариантом настоящего изобретения может быть любой вариант, при условии, что сохраняется указанный выше консервативный мотив, и не нарушается указанная выше активность настоящего изобретения.
Специалист в данной области сможет провести так называемые структурно-функциональные исследования для идентификации аминокислотных остатков в пептиде, аналогичном пептиду или белку настоящего изобретения, которые важны для биологической активности или структуры указанного белка, и провести сравнение аминокислотных остатков у двух пептидов для того, чтобы предсказать, какие остатки в белке, аналогичном белку настоящего изобретения, являются аминокислотными остатками, соответствующими аминокислотным остаткам, важным для биологической активности или структуры. Кроме того, специалист сможет выбрать варианты, которые сохраняют биологическую активность белка настоящего изобретения, выбирая химически аналогичные аминокислотные замены для таких предсказанных аминокислотных остатков. Специалист в данной области также сможет провести анализ трехмерной структуры и аминокислотной последовательности вариантов белка. С учетом аналитических результатов специалист сможет дополнительно предсказать выравнивание аминокислотных остатков в отношении трехмерной структуры белка. Исходя из аналитических результатов, описанных выше, специалист в данной области сможет также создать варианты, не содержащие замен аминокислотных остатков, по предсказанию расположенных на поверхности белка, поскольку такие остатки могут быть вовлечены в важное взаимодействие с другими молекулами. Более того, специалист в данной области сможет создать варианты, содержащие единственную аминокислотную замену среди аминокислотных остатков, составляющих белок настоящего изобретения. Можно провести скрининг вариантов с помощью известных методов анализа для сбора информации об индивидуальных вариантах. В результате, специалист сможет оценить важность индивидуальных аминокислотных остатков, составляющих белок настоящего изобретения, сравнивая варианты, содержащие замену отдельного аминокислотного остатка, для оценки того, имеют ли они пониженную биологическую активность по сравнению с биологической активностью белка настоящего изобретения, или они не имеют такой биологической активности, или они имеют неподходящую активность, ингибируя биологическую активность белка настоящего изобретения. Более того, исходя из информации, собранной из таких рутинных экспериментов, специалист в данной области сможет легко проанализировать нежелательные аминокислотные замены для вариантов белка настоящего изобретения, либо для индивидуальных замен, либо в комбинации с другими мутациями.
Как описано выше, белки, состоящие из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, могут быть получены с помощью таких методик, как сайт-направленный мутагенез, описанный в «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)); «Current Protocols in Molecular Biology» (John Wiley & Sons (1987-1997); Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488-92; Kunkel (1988) Method. Enzymol. 85: 2763-6, и т.д. Получение такие вариантов, содержащих аминокислотные делеции, замены или добавления и т.п., может быть осуществлено с помощью известных методик, таких как, например, способ Кункеля или способ дуплексов с разрывом, используя набор для введения мутаций на основе сайт-направленного мутагенеза, такой как, например, QuikChange™ Site-Directed Mutagenesis Kit (Stratagene), GeneTailor™ Site-Directed Mutagenesis System (Invitrogen) или TaKaRa Site-Directed Mutagenesis System (Mutan-K, Mutan-Super Express Km, etc.; Takara Bio Inc.).
В дополнение к сайт-направленному мутагенезу, приведенному выше, методики введения делеции, замены или добаления одной или нескольких аминокислот в аминокислотные последовательности белков с сохранением их активности могут включать способ обработки гена мутагеном, и способ, включающий селективное расщепление гена для удаления, замены или добавления отдельного нуклеотида с последующим лигированием.
Нуклеотидная последовательность, которую содержит нуклеиновая кислота настоящего изобретения, предпочтительно является нуклеотидной последовательностью, кодирующей белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий АСС-активностью.
Нуклеотидная последовательность, из которой состоит нуклеиновая кислота настоящего изобретения, также содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, и обладающий указанной выше активностью настоящего изобретения. Не существует ограничений по числу или сайтам изменений аминокислот, или модификациям аминокислот в белке настоящего изобретения, при условии сохранения указанной выше активности настоящего изобретения. Способ оценки указанной выше активности настоящего изобретения описаны выше.
(b) Нуклеиновая кислота, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий указанной выше активностью настоящего изобретения.
Нуклеиновая кислота настоящего изобретения гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1, и содержит нуклеотидную последовательность, кодирующую белок, обладающий указанной выше активностью настоящего изобретения. SEQ ID NO:1 и ACC-активность описаны выше.
Приведенную выше нуклеотидную последовательность можно получить из кДНК-библиотеки, геномной библиотеки и т.п. с помощью известной методики гибридизации, такой как гибридизация колоний, гибридизация бляшек (фаговых) или Саузерн-блоттинг, с использованием зонда, полученной на основе соответствующего фрагмента способом, известным опытным специалистам в данной области.
Подробное описание методов гибридизации можно найти в «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001); в частности, в разделах 6-7); «Current Protocols in Molecular Biology» (John Wiley & Sons (1987-1997); в частности, в разделах 6.3-6.4); «DNA Cloning 1: Core Techniques, A Practical Approach 2nd ed.» (Oxford University (1995); в частности, в разделе 2.10, посвященном условиям проведения гибридизации) и т.д.
Жесткость условий гибридизации в основном определяются условиями гибридизации, более предпочтительно, условиями проведения гибридизации и отмывки. Используемый в настоящем описании термин «жесткие условия» включает средние или очень жесткие условия гибридизации.
В частности, средние условия гибридизации включают, например, проведение гибридизации в условиях 1×SSC-6×SSC при 42°C-55°C, более предпочтительно, в условиях 1×SSC-3×SSC при 45°C-50°C, наиболее предпочтительно, в условиях 2×SSC при 50°C. Если гибридизационный раствор содержит, например, около 50% формамида, то используют температуру на 5-15°C ниже указанных температур. Условия проведения отмывки включают отмывку в условиях 0,5×SSC-6×SSC при 40°C-60°C. При проведении гибридизации и отмывки обычно можно добавить 0,05%-0,2%, предпочтительно, около 0,1% ДСН.
Очень жесткие условия гибридизации включают гибридизацию и/или отмывку при более высоких температурах и/или более низких концентрациях соли, чем при средних условиях гибридизации. Например, условия гибридизации включают гибридизацию в условиях 0,1×SSC-2×SSC при 55°C-65°C, более предпочтительно, в условиях 0,1×SSC-1×SSC при 60°C-65°C, наиболее предпочтительно, в условиях 0,2×SSC при 63°C. Условия отмывки включают отмывку в условиях 0,2×SSC при 50°C-68°C, более предпочтительно, в условиях 0,2×SSC при 60°C-65°C.
Например, условия гибридизации, используемые в настоящем изобретении, включают, но не ограничены ими, предварительную гибридизацию в условиях 5×SSC, 1% SDS, 50 мМ Tris-HCl (pH 7,5) и 50% формамида при 42°C с последующей гибридизацией с зондом в течение ночи при 42°C, и последующей трехкратной отмывкой по 20 минут в условиях 0,2×SSC, 0,1% SDS при 65°C.
Также можно использовать коммерчески доступные наборы для гибридизации, в которых не используется радиоактивный зонд. Более конкретно, гибридизацию можно проводить с использованием набора для детекции нуклеиновой кислоты DIG (Roche Diagnostics) или системы для направленного мечения и детекции ECL (Amersham) и т.п.
Нуклеиновые кислоты, входящие в объем настоящего изобретения, предпочтительно, включают нуклеиновую кислоту, которая гибридизуется в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1, и содержит нуклеотидную последовательность, кодирующую белок с АСС-активностью.
(c) Нуклеиновая кислота, которая содержит нуклеотидную последовательность, имеющую 80% или большую идентичность с нуклеотидной последовательностью, состоящей из SEQ ID NO:1, и кодирующую белок, обладающий указанной выше активностью настоящего изобретения.
Нуклеотидная последовательность, которую содержат нуклеиновые кислоты настоящего изобретения, имеет по меньшей мере 80% идентичность с нуклеотидной последовательностью, приведенной в SEQ ID NO:1, и кодирует белок, обладающий указанной выше активностью настоящего изобретения.
Предпочтительно, нуклеиновая кислота содержит нуклеотидную последовательность, имеющую по меньшей мере 80% идентичность, более предпочтительно, 85% идентичность, еще более предпочтительно, 90% (например, 92% или большую, еще более предпочтительно, 95% или большую, даже 97%, 98% или 99%) идентичность с нуклеотидной последовательностью, приведенной в SEQ ID NO:1, и кодирующую белок с указанной выше активностью настоящего изобретения.
Процент идентичности между двумя последовательностями нуклеиновых кислот можно определить визуально и математически, или, предпочтительно, сравнивая информацию о последовательностях двух нуклеиновых кислот с использованием компьютерной программы. Компьютерные программы для сравнения последовательностей включают, например, программу BLASTN (Altschul et al. (1990) J. Mol. Biol. 215: 403-10), версия 2.2.7 которой доступна на веб-сайте Национальной медицинской библиотеки США: http://www.ncbi.nlm.nih.gov/blast/bl2seq/bls.html, или алгоритм WU-BLAST 2.0 и т.д. Стандартные параметры по умолчанию для WU-BLAST 2.0 доступны на интернет-сайте: http://blast.wustl.edu/.
(d) Нуклеиновая кислота, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, имеющей 80% идентичность или большую с аминокислотной последовательностью, состоящей из SEQ ID NO:2, и обладающий указанной выше активностью настоящего изобретения.
Нуклеиновая кислота настоящего изобретения содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, имеющей 80% идентичность или большую с аминокислотной последовательностью, состоящей из SEQ ID NO:2, и обладающий указанной выше активностью настоящего изобретения. Белок, кодируемый нуклеиновой кислотой настоящего изобретения, может быть АСС или белком, имеющим идентичность с аминокислотной последовательностью АСС, при условии, что он функционально эквивалентен белку, обладающему указанной выше активностью настоящего изобретения.
Более конкретно, аминокислотная последовательность имеет 80% идентичность или большую, предпочтительно, 85% или большую, более предпочтительно, 90% или большую, еще более предпочтительно, 95% или большую, даже более предпочтительно, 97% (например, 98%, даже 99%) или большую с аминокислотной последовательностью SEQ ID NO:2 или аналогичной последовательностью.
Нуклеиновая кислота настоящего изобретения предпочтительно содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, имеющей 95% идентичность или большую с аминокислотной последовательностью SEQ ID NO:2, и обладающий указанной выше активностью настоящего изобретения. Более предпочтительно, нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, имеющей 98% идентичность или большую с аминокислотной последовательностью SEQ ID NO:2, и обладающий указанной выше активностью настоящего изобретения.
Процент идентичности между двумя аминокислотными последовательностями можно определить визуально и математически. Или альтернативно, процент идентичности можно определить с использованием компьютерной программы. Такие компьютерные программы включают, например, BLAST, FASTA (Altschul et al., J. Mol. Biol., 215:403-410 (1990)) и ClustalW, и т.д. В частности, различные условия (параметры) для определения идентичности с помощью программы BLAST описаны в статье Altschul et al. (Nucl. Acids. Res., 25, p.3389-3402, 1997) и находятся в общем доступе на сайте Национального центра биотехнологической информации (NCBI) или на сайте базы данных ДНК Японии (DDBJ) (BLAST Manual, Altschul et al., NCB/NLM/NIH Bethesda, MD 20894; Altschul et al.). Процент идентичности можно также определить с использованием программ для обработки генетической информации, таких как GENETYX Ver.7 (Genetyx), DNASIS Pro (Hitachisoft), Vector NTI (Infomax) и т.п.
Некоторые схемы для выравнивания аминокислотных последовательностей могут определять наличие совпадений даже на определенной короткой области в последовательностях, и, таким образом, можно детектировать области с очень высокой идентичностью по последовательности в такой короткой выровненной области, даже если между используемыми полноразмерными последовательностями не наблюдается значительного сходства. Кроме того, в алгоритме BLAST можно использовать матрицу стоимости аминокислотных замен BLOSUM62 и необязательные параметры: (А) включение фильтра для демаскирования сегментов с низкой композиционной сложностью (определяемых с помощью программы SEG авторов Wootton and Federhen (Computers and Chemistry, 1993); см. также Wootton and Federhen, 1996, «Analysis of compositionally biased regions in sequence databases», Methods Enzymol., 266: 554-71) или сегментов, состоящих из внутренних повторов с короткой периодичностью (определяемых с помощью программы XNU авторов Claverie and States (Computers and Chemistry, 1993)); и (B) порог статистической значимости для выражения совпадений с последовательностями базы данных или Е-оценка (ожидаемая вероятность совпадений, находимых случайно, по стохастической модели Karlin and Altschul, 1990; если статистическая значимость, приписываемая совпадению выше порога Е-оценки, то совпадение не засчитывается).
(e) Нуклеиновая кислота, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий указанной выше активностью настоящего изобретения.
Нуклеиновая кислота настоящего изобретения гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и содержит нуклеотидную последовательность, кодирующую белок, обладающий указанной выше активностью настоящего изобретения.
Белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и условия гибридизации описаны выше. Нуклеиновая кислота настоящего изобретения включает нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и которая содержит нуклеотидную последовательность, кодирующую белок, обладающий указанной выше активностью настоящего изобретения.
Нуклеиновая кислота настоящего изобретения также включает нуклеиновую кислоту, которая содержит нуклеотидную последовательность с делецией, заменой или добавлением одного или нескольких нуклеотидов в нуклеотидной последовательности, состоящей из SEQ ID NO:1, и кодирующую белок, обладающий указанной выше активностью настоящего изобретения. Более конкретно, также можно использовать нуклеиновую кислоту, которая содержит нуклеотидные последовательности, выбранные из:
(i) нуклеотидной последовательности с делецией одного или более (предпочтительно, одного или нескольких (например, 1-1500, 1-1000, 1-500, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, более предпочтительно, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) нуклеотидов в нуклеотидной последовательности, приведенной в SEQ ID NO:1;
(ii) нуклеотидной последовательности с заменой другими нуклеотидами одного или более (предпочтительно, одного или нескольких (например, 1-1500, 1-1000, 1-500, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, более предпочтительно, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) нуклеотидов в нуклеотидной последовательности, приведенной в SEQ ID NO:1;
(iii) нуклеотидной последовательности с добавлением одного или более (предпочтительно, одного или нескольких (например, 1-1500, 1-1000, 1-500, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, более предпочтительно, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1)) нуклеотидов в нуклеотидной последовательности, приведенной в SEQ ID NO:1; или
(iv) нуклеотидной последовательности с любой комбинацией (i)-(iii) выше;
и кодирующие белок, обладающий указанной выше активностью настоящего изобретения.
Предпочтительные варианты нуклеиновых кислот настоящего изобретения также включают нуклеиновую кислоту по любому из (а)-(c) ниже:
(а) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, приведенную в SEQ ID NO:1, или ее фрагмент;
(b) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность, приведенную в SEQ ID NO:2, или ее фрагмент;
(c) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, приведенную в SEQ ID NO:4, или ее фрагмент.
(а) Нуклеиновая кислота, которая содержит нуклеотидную последовательность, приведенную в SEQ ID NO:1, или ее фрагмент; (b) нуклеиновая кислота, которая содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность, приведенную в SEQ ID NO:2, или ее фрагмент; и (c) нуклеиновая кислота, которая содержит нуклеотидную последовательность, приведенную в SEQ ID NO:4, или ее фрагмент, описаны выше. Фрагменты приведенных выше последовательностей представляют собой области, содержащиеся в приведенных выше нуклеотидных последовательностях, включая ORF, CDS, биологически активные области, области, используемые в качестве описанных ниже праймеров, и области, способные служить в качестве зондов, и могут быть природными или полученными искусственно.
Нуклеиновые кислоты настоящего изобретения также включают:
(1) (а) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2;
(b) нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1;
(c) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, имеющую 80% или большую идентичность с нуклеотидной последовательностью, состоящей из SEQ ID NO:1, и кодирующую белок;
(d) нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, идентичной на 80% или более аминокислотной последовательности, состоящей из SEQ ID NO:2;
(e) нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2; и
(2) нуклеиновую кислоту по пункту (1), которой является одна из (а)-(e):
(а) нуклеиновой кислоты, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2;
(b) нуклеиновой кислоты, которая гибридизуется в условиях 2×SC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1;
(c) нуклеиновой кислоты, которая содержит нуклеотидную последовательность, имеющую 90% или большую идентичность с нуклеотидной последовательностью, состоящей из SEQ ID NO:1;
(d) нуклеиновой кислоты, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, идентичной на 90% или больше с аминокислотной последовательностью, состоящей из SEQ ID NO:2;
(e) нуклеиновой кислоты, которая гибридизуется в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2.
Белки ацетил-CoA-карбоксилазы настоящего изобретения
Белки настоящего изобретения включают белок, состоящий из аминокислотной последовательности, приведенной в SEQ ID NO:2, и белки, функционально эквивалентные этому белку, и могут быть природными или полученными искусственно. Белок, состоящий из приведенной в SEQ ID NO:2 аминокислотной последовательности, описан выше. «Функционально эквивалентные белки» относятся к белкам, обладающим «указанной выше активностью настоящего изобретения», определение которой дано выше в разделе «Нуклеиновые кислоты, кодирующие ацетил-CoA-карбоксилазу настоящего изобретения».
В настоящем изобретении белки, функционально эквивалентные белку, состоящему из аминокислотной последовательности, приведенной в SEQ ID NO:2, включают белок описанный в (а) или (b) ниже:
(а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:2, и обладающий указанной выше активностью настоящего изобретения; или
(b) белок, состоящий из аминокислотной последовательности, идентичной на 80% или более аминокислотной последовательности, состоящей из SEQ ID NO:2, и обладающий указанной выше активностью настоящего изобретения.
В настоящем описании аминокислотная последовательность с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:2 или аминокислотная последовательность, идентичная на 80% или более аминокислотной последовательности SEQ ID NO:2, описаны в разделе «Нуклеиновые кислоты, кодирующие ацетил-CoA-карбоксилазу настоящего изобретения». Термин «белок, обладающий указанной выше активностью настоящего изобретения», также включает вариант белка, кодируемый нуклеиновой кислотой, содержащей нуклеотидную последовательность SEQ ID NO:1, или вариант белка, содержащий различные типы модификаций, такие как замена, делеция или добавление одной или нескольких аминокислот в аминокислотной последовательности, приведенной в SEQ ID NO:2, или модифицированный белок, имеющий модифицированную боковую цепь аминокислоты, или белок, слитый с другим белком и обладающий АСС-активностью и/или активностью, компенсирующей недостаток АСС в дрожжах, и/или активностью, регулирующей соотношение состава жирных кислот настоящего изобретения.
Белки настоящего изобретения могут быть получены искусственно с помощью методик химического синтеза, таких как Fmoc-метод (флуоренилметилоксикарбонильный метод) и tBoc-метод (трет-бутилоксикарбонильный метод). Их также можно синтезировать химически с использованием пептидного синтезатора, поставляемого компаниями Advanced ChemTech, Perkin Elmer, Pharmacia, Protein Technology Instrument, Synthecell-Vega, PerSeptive, Shimadzu Corporation и т.п.
Белки настоящего изобретения также включают:
(1) (а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:2;
(b) белок, состоящий из аминокислотной последовательности, имеющей 80% идентичность или большую с аминокислотной последовательностью, состоящей из SEQ ID NO:2;
(2) белок по (а) или (b) ниже:
(а) белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-200 аминокислот в аминокислотной последовательности SEQ ID NO:2;
(b) белок, состоящий из аминокислотной последовательности, имеющей 90% идентичность или большую с аминокислотной последовательностью SEQ ID NO:2.
Клонирование нуклеиновых кислот настоящего изобретения
Нуклеиновые кислоты для АСС настоящего изобретения можно клонировать, например, скринируя кДНК-библиотеку с использованием соответствующего зонда. Их также можно клонировать ПЦР-амплификацией с соответствующими праймерами с последующим лигированием в подходящий вектор. Клон можно дополнительно субклонировать в другой вектор.
Например, можно использовать коммерчески доступные плазмидные векторы, такие как pBlue-Script™ SK (+) (Stratagene), pGEM-T (Promega), pAmp (TM: Gibco-BRL), p-Direct (Clontech) и pCR2.1-TOPO (Invitrogen). Для амплификации с помощью ПЦР в качестве праймеров можно использовать любые области нуклеотидных последовательностей, приведенных в SEQ ID NO:1, и т.п. выше, например, такие как:
прямой праймер: 5'-GCCAACTGGCGTGGATTCTC-3' (SEQ ID NO:6) и
обратный праймер: 5'-GTCCTCGTTGATAGTAGGGTC-3' (SEQ ID NO:7).
ПЦР проводят, добавляя указанные выше праймеры и термостабильную ДНК-полимеразу (или аналогичный фермент) к кДНК, полученной из клеток M. alpina. Хотя специалисты в данной области смогут легко осуществить данную методику, следуя, например, «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)), условия проведения ПЦР в настоящем изобретении могут включать следующее:
температуру денатурации: 90-95°C;
температуру отжига: 40-60°C;
температуру элонгации: 60-75°C;
число циклов: 10 или больше.
Полученный продукт ПЦР можно очистить с использованием известных способов. Например, в таких способах используются наборы, такие как GENECLEAN (Funakoshi Co., Ltd.), QIAquick PCR для очистки (QIAGEN), ExoSAP-IT (GE Healthcare Bio-Sciences); или DEAE-целлюлозные фильтры, или диализные мешки и т.д. При использовании агарозного геля ПЦР продукты разделяют электрофорезом в агарозном геле, и фрагменты нуклеиновых кислот вырезают из агарозного геля с последующей очисткой с помощью GENECLEAN (Funakoshi Co., Ltd.), экстракционных наборов QIAquick Gel (QIAGEN), способом «заморозки-оттаивания» и т.д.
Нуклеотидные последовательности клонированных нуклеиновых кислот можно определить с использованием нуклеотидного секвенатора.
Конструирование векторов для экспрессии АСС настоящего изобретения и получение трансформированных клеток
Настоящее изобретение также относится к рекомбинантным векторам, содержащим нуклеиновую кислоту, кодирующую АСС настоящего изобретения. Настоящее изобретение дополнительно относится к клеткам, трансформированным рекомбинантными векторами.
Такие рекомбинантные векторы и трансформированные клетки могут быть получены следующим образом. А именно, плазмиду, несущую нуклеиновую кислоту, кодирующую АСС настоящего изобретения, расщепляют рестрикционными эндонуклеазами. Используемые рестрикционные эндонуклеазы, например, включают, но не ограничиваются ими, EcoRI, KpnI, BamHI и SalI и т.д. Концы плазмиды после рестрикции можно «затупить» обработкой ДНК-полимеразой фага Т4. Расщепленный нуклеотидный фрагмент очищают электрофорезом в агарозном геле. Этот фрагмент можно встроить в экспрессионный вектор известным способом, таким образом, получая вектор для экспрессии АСС. Этот экспрессионный вектор трансформируют в хозяина для создания трансформированной клетки, которую используют для экспрессии целевого белка.
В настоящем изобретении экспрессионный вектор и хозяин конкретно не ограничены, при условии возможности экспрессии целевого белка; и хозяева, например, включают грибы, бактерии, растения и животных, или их клетки. Грибы включают филаментные грибы, такие как продуцирующие липиды грибы M. alpina, дрожжи, такие как Saccharomyces cerevisiae и т.д. Бактерии включают Escherichia coli, Bacillus subtilis и т.д. Кроме того, растения включают продуцирующие масло растения, такие как рапс, соя, хлопчатник, сафлор и лен.
Продуцирующие липиды грибы, которые можно использовать, включают, например, штаммы, описанные в MYCOTAXON, Vol. XLIV, NO. 2, pp. 257-265 (1992), в частности, микроорганизмы, относящиеся к роду Mortierella, включая микроорганизмы, относящиеся к подроду Mortierella, такие как Mortierella elongata (M. elongata) IFO8570, Mortierella exigua (M. exigua) IFO8571, Mortierella hygrophila (M. hygrophila) IFO5941, Mortierella alpina IFO8568, ATCC16266, ATCC32221, ATCC42430, CBS 219.35, CBS224.37, CBS250.53, CBS343.66, CBS527.72, CBS528.72, CBS529.72, CBS608.70, CBS754.68, или микроорганизмы, относящиеся к подроду Micromucor, такие как Mortierella isabellina (M. isabellina) CBS194.28, IFO6336, IFO7824, IFO7873, IFO7874, IFO8286, IFO8308, IFO7884, Mortierella nana (M. nana) IFO8190, Mortierella ramanniana (M. ramanniana) IFO5426, IFO8186, CBS112.08, CBS212.72, IFO7825, IFO8184, IFO8185, IFO8287, Mortierella vinacea (M. vinacea) CBS236.82. Из них предпочтительным видом является M. alpina.
При использовании грибов в качестве хозяина предпочтительно, чтобы структура вектора позволяла самостоятельную репликацию нуклеиновой кислоты настоящего изобретения в хозяине или ее встраивание в хромосому гриба. Также предпочтительно, чтобы вектор содержал промотор и терминатор. При использовании M. alpina в качестве хозяина экспрессионным вектором может быть, например, pD4, pDuraSC, pDura5 и т.п. Можно использовать любой промотор, который экспрессируется в хозяине, включая промоторы генов M. alpina, такие как промотор гена гистона Н4.1, промотор гена GAPDH (глицеральдегид-3-фосфат дегидрогеназы) и промотор гена TEF (фактора элонгации трансляции).
Методики трансформации рекомбинантным вектором филаментных грибов, таких как M. alpina, включают электропорацию, использование сферопластов, доставку генетического материала с помощью частиц и прямые микроинъекции ДНК в ядро. При использовании ауксотрофного штамма-хозяина трансформированные штаммы можно получить путем селекции штаммов, растущих на селективной среде, в которой отсутствуют необходимые для штамма питательные вещества. При использовании для трансформации маркерного гена лекарственной резистентности с помощью культивирования в селективной среде, содержащей лекарственное соединение, можно получить клеточные колонии, демонстрирующие устойчивость к лекарственным соединениям.
При использовании в качестве хозяина дрожжей экспрессионным вектором может быть, например, pYE22m или аналогичный вектор. Также можно использовать коммерчески доступные векторы для экспрессии дрожжей, такие как pYES (Invitrogen) и pESC (STRATAGENE). Дрожжи, подходящие для использования в качестве хозяев в настоящем изобретении, включают, но не ограничиваются ими, штамм S. cerevisiae EH13-15 (trp1, MATα) и т.д. Используемые промоторы включают, например, промоторы генов дрожжей или родственных организмов, такие как промотор GAPDH, промотор GAL1 и промотор GAL10.
Методики трансформации рекомбинантного вектора в дрожжи включают, например, литий-ацетатный способ, электропорацию, использование сферопластов, декстран-опосредованную трансфекцию, осаждение фосфатом кальция, полибрин-опосредованную трансфекцию, слияние протопластов, заключение (одного или нескольких) полинуклеотидов в липосомы и прямую микроинъекцию ДНК в ядра, и т.д.
При использовании в качестве хозяев бактерий, таких как E. coli, экспрессионным вектором может быть, например, pGEX, pUC18 или аналогичный вектор, доступный от компании Pharmacia. Промоторы, которые можно использовать, включают промоторы генов E. coli, фагов и т.п., такие как, например, trp-промотор, lac-промотор, PL-промотор и PR-промотор. Методики трансформации рекомбинантного вектора в бактерии включают, например, электропорацию и кальций-хлоридный способ.
Способы получения композиций жирных кислот настоящего изобретения
Настоящее изобретение относится к способам получения композиции жирных кислот из трансформированной клетки, описанной выше. А именно, к способам получения композиции жирных кислот из продукта культивирования, полученного культивированием указанной выше трансформированной клетки. Более конкретно, ее можно получить по методике, описанной ниже. Однако способы настоящего изобретения не ограничены нижеследующими методиками, и их также можно осуществлять с использованием других стандартных общеизвестных методик.
Для культивирования организма, экспрессирующего АСС, можно использовать любую культуральную среду, при условии, что она имеет соответствующий рН и осмотическое давление, а также содержит питательные вещества, необходимые для роста каждого хозяина, микроэлементы и биологические материалы, такие как сыворотка или антибиотики. Например, среды, которые можно использовать для дрожжевых клеток, трансформированных для экспрессии АСС, включают, но не ограничиваются ими, среду SC-Trp, среду YPD, среду YPD5 и т.п. В качестве композиции конкретной среды приведен состав среды SC-Trp, которая содержит в расчете на объем 1 литр: 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г глюкозы и 1,3 г сухого порошка аминокислот (смеси 1,25 г сульфата аденина, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 0,6 г урацила).
Можно использовать любые культуральные условия, подходящие для роста хозяина и поддерживающие стабильность получаемого фермента, и, в частности, можно подбирать различные условия, включая анаэробность, время инкубации, температуру, влажность, статичную или качаемую культуру, и т.д. Культивирование можно проводить в одинаковых условиях (одностадийная культура) или можно проводить так называемое двухстадийное или трехстадийное культивирование с использованием двух или нескольких различных типов культуральных условий, но в случае крупномасштабных культур предпочтительно использовать двухстадийную культуру вследствие ее высокой эффективности.
В качестве конкретного способа получения композиции жирных кислот настоящего изобретения ниже приведено и проиллюстрировано использование дрожжей в качестве хозяина в двухстадийной культуре. А именно, в качестве предварительной культуры колонии, полученные, как описано выше, инокулируют в указанную выше среду SC-Trp или аналогичную среду, и предварительно культивируют в течение 2 дней при встряхивании при 30°C. Затем, в качестве основной культуры 500 мкл предварительной культуры добавляют в 10 мл среды YPD5 (2%-й дрожжевой экстракт, 1%-й полипептон, 5%-я глюкоза) и культивируют при встряхивании при 30°C в течение 2 дней.
Композиция жирных кислот настоящего изобретения
Настоящее изобретение также относится к композиции жирных кислот, которая представляет собой совокупность одной или нескольких жирных кислот в клетке, экспрессирующей АСС настоящего изобретения. Предпочтительно, изобретение относится к композиции жирных кислот, полученной культивированием трансформированной клетки, экспрессирующей АСС настоящего изобретения. Жирными кислотами могут быть свободные жирные кислоты или триглицериды, фосфолипиды и т.д.
Жирными кислотами, содержащимися в композиции жирных кислот настоящего изобретения, являются линейные или разветвленные монокарбоновые кислоты длинноцепочечных углеводов, включая, например, но, не ограничиваясь ими, миристиновую кислоту (тетрадекановую кислоту) (14:0), миристолеиновую кислоту (тетрадеценовую кислоту) (14:1), пальмитиновую кислоту (гексадекановую кислоту) (16:0), пальмитолеиновую кислоту (9-гексадеценовую кислоту) (16:1), стеариновую кислоту (октадекановую кислоту) (18:0), олеиновую кислоту (цис-9-октадеценовую кислоту) (18:1 (9)), вакценовую кислоту (11-октадеценовую кислоту (18:1 (11)), линолевую кислоту (цис,цис-9,12-октадекадиеновую кислоту) (18:2 (9,12)), α-линоленовую кислоту (9,12,15-октадекатриеновую кислоту) (18:3 (9,12,15)), γ-линоленовую кислоту (6,9,12-октадекатриеновую кислоту) (18:3 (6,9,12)), стеаридоновую кислоту (6,9,12,15-октадекатетраеновую кислоту) (18:4 (6,9,12,15)), арахиновую кислоту (эйкозановую кислоту) (20:0), (8,11-эйкозадиеновую кислоту) (20:2 (8,11)), кислоту Мида (5,8,11-эйкозатриеновую кислоту) (20:3 (5,8,11)), дигомо-γ-линоленовую кислоту (8,11,14-эйкозатриеновую кислоту) (20:3 (8,11,14)), арахидоновую кислоту (5,8,11,14-эйкозатетраеновую кислоту) (20:4 (5,8,11,14)), эйкозатетраеновую кислоту (8,11,14,17-эйкозатетраеновую кислоту) (20:4 (8,11,14,17)), эйкозапентаеновую кислоту (5,8,11,14,17-эйкозапентаеновую кислоту) (20:5 (5,8,11,14,17)), бегеновую кислоту (докозановую кислоту) (22:0), (7,10,13,16-докозатетраеновую кислоту) (22:4 (7,10,13,16)), (7,10,13,16,19-докозапентаеновую кислоту) (22:5 (7,10,13,16,19)), (4,7,10,13,16-докозапентаеновую кислоту) (22:5 (4,7,10,13,16)), (4,7,10,13,16,19-докозагексаеновую кислоту) (22:6 (4,7,10,13,16,19)), лигноцериновую кислоту (тетрадокозановую кислоту) (24:0), нервоновую кислоту (цис-15-тетракозеновую кислоту) (24:1), церотиновую кислоту (гексадокозановую кислоту) (26:0) и т.д. Приведенные выше химические названия являются общепринятыми названиями, которые приведены в биохимической номенклатуре IUPAC, при этом после каждого названия приведено систематическое название, и в круглых скобках указано число атомов углерода, а также число и положения двойных связей.
Композиция жирных кислот настоящего изобретения может состоять из любого числа и любого типа жирных кислот, при условии, что они содержат комбинацию одной или нескольких из перечисленных выше жирных кислот.
Лиофилизированные клетки, полученные с помощью способов получения композиций жирных кислот настоящего изобретения, описанных выше, перемешивают со смесью хлороформа и метанола в соответствующем соотношении, и затем нагревают в течение соответствующего времени. Кроме того, клетки отделяют от растворителя несколько раз центрифугированием. Затем липиды сушат подходящим способом и затем растворяют в растворителе, таком как хлороформ. Аликвоту полученного образца собирают, и жирные кислоты в клетках преобразуют в метиловые эфиры с использованием метанольной HCl, затем экстрагируют гексаном и выпаривают гексан, и осадок анализирую газовой хроматографией. Например, при экспрессии АСС настоящего изобретения в дрожжах можно получить композицию жирных кислот, которая отличается (в отношении соотношения состава жирных кислот) более высоким содержанием пальмитолеиновой кислоты и/или докозановой кислоты или более низким содержанием пальмитиновой кислоты, стеариновой кислоты и/или гексадокозановой кислоты относительно их содержания в культурах хозяев, которые не были трансформированы рекомбинантным вектором настоящего изобретения.
АСС настоящего изобретения иногда приводит к соотношению состава жирных кислот, которое отличается от соотношений составов жирных кислот, полученных с известными АСС, демонстрируя, что влияние АСС настоящего изобретения на липидный метаболизм в клетках-хозяевах отличается от влияния известных АСС.
Продукты питания или другие продукты, содержащие композиции жирных кислот настоящего изобретения
Настоящее изобретение также относится к продуктам питания, содержащим указанные выше композиции жирных кислот. Композиции жирных кислот настоящего изобретения можно стандартно использовать для получения продуктов питания и промышленных сырьевых материалов, содержащих жиры и масла (сырьевые материалы для косметической промышленности, фармацевтической промышленности (например, местных лекарственных средств для кожи), мыл и т.д.) или для других целей. Косметические средства (композиции) или фармацевтические средства (композиции) могут представлять собой любую форму, включая, но, не ограничиваясь ими, раствор, пасту, гель, твердое вещество, порошок и т.д. Продукты питания могут также представлять собой фармацевтический состав, такой как капсула, или процессированное питание, такое как натуральная жидкая диета, безшлаковая диета, элементная диета, питательные напитки или формула для питания через зонд, содержащие композицию жирных кислот настоящего изобретения в комбинации с белками, сахарами, жирами, микроэлементами, витаминами, эмульгаторами, вкусоароматическими добавками и т.д.
Другие примеры продуктов питания настоящего изобретения включают, но не ограничиваются ими, пищевые добавки, продукты здорового питания, продукты функционального питания, продукты питания для детей, модифицированное молоко для детей, модифицированное молоко для недоношенных детей, продукты питания для пожилых и т.д. Используемый в настоящем описании термин «продукт питания» собирательно относится к пищевым продуктам в твердой, текучей, жидкой форме или к пищевым продуктам в виде смеси указанных форм.
Пищевые добавки относятся к продуктам питания, усиленным определенными питательными ингредиентами. Продукты здорового питания относятся к продуктам питания, которые считаются «здоровыми» или полезными для здоровья, и включают пищевые добавки, натуральные продукты питания, диетические продукты питания и т.д. Продукты функционального питания относятся к продуктам питания для введения питательных ингредиентов, имеющих физиологические регуляторные функции, и их можно также называть продуктами для специального оздоровительного питания. Продукты питания для детей относятся к продуктам питания, предназначенным для детей примерно до 6-летного возраста. Продукты питания для пожилых относятся к продуктам питания, обработанным для более легкого пищеварения и всасывания по сравнению с необработанными продуктами питания. Модифицированное молоко для детей относится к модифицированному молоку, предназначенному для детей до одного года. Модифицированное молоко для недоношенных детей относится к модифицированному молоку, предназначенному для недоношенных детей примерно до 6-месячного возраста.
Эти продукты питания включают натуральные продукты, такие как мясо, рыбу, орехи (обработанные жирами и маслами); продукты питания, приготовленные на жирах и маслах, такие как китайские продукты питания, китайская лапша, супы; продукты, в которых жиры и масла используются для жарки, такие как темпура (жареные во фритюре рыба и овощи), жареные во фритюре продукты питания, панированные в сухарях, жареный соевый творог, китайский жареный рис, пончики, каринто (японское печенье из жареного теста); продукты на жировой и масляной основе или продукты питания, приготовляемые с жирами и маслами, такие как сливочное масло, маргарин, майонез, салатная заправка, шоколад, лапша быстрого приготовления, карамель, сухое печенье, печенье, торты, мороженное; и продукты питания, на которые распыляют, или которые покрывают жирами и маслами в конце приготовления, такие как рисовые крекеры, галеты, сладкий хлеб с бобовой пастой. Однако продукты питания настоящего изобретения не ограничены продуктами, содержащими жиры и масла, но также включают процессированные сельскохозяйственные продукты, такие как хлеб, макароны, готовый к употреблению рис, сладости (леденцы, жевательная резинка, жевательный мармелад, таблетки, японские сладости), соевый творог и процессированные продукты из них; ферментированные продукты питания, такие как саке (японское рисовое вино), медицинский ликер, мирин (сладкое рисовое вино), уксус, соевый соус и мисо (паста из соевых бобов); животные продукты питания, такие как йогурт, ветчина, бекон и сосиски; процессированные морепродукты, такие как камабоко (блюдо из сурими), агетен (жареное во фритюре сурими) и ханпен (воздушное сурими); и фруктовые напитки, безалкогольные напитки, спортивные напитки, алкогольные напитки, чай и т.п.
Способ оценки или отбора штаммов с использованием нуклеиновой кислоты, кодирующей АСС, или белка АСС настоящего изобретения
Настоящее изобретение также относится к способам оценки или отбора продуцирующих липиды штаммов с использованием нуклеиновой кислоты, кодирующей АСС, или белка АСС настоящего изобретения. Способы более подробно описаны ниже.
(1) Способы оценки
Одним из вариантов осуществления настоящего изобретения является способ оценки продуцирующего липиды штамма с использованием нуклеиновой кислоты, кодирующей АСС, или белка АСС настоящего изобретения. Способ оценки настоящего изобретения может включать оценку продуцирующего липиды тестируемого штамма на указанную выше активность настоящего изобретения с использованием праймера или зонда, подобранных на основе нуклеотидной последовательности настоящего изобретения. Общие методики для такого способа оценки известны и описаны, например, в WO01/040514 или JP HEI 8-205900 A. Краткое описание способа оценки приведено ниже.
Сначала получают геном тестируемого штамма. Можно использовать любой способ выделения, такой как способ Херефорда или калий-ацетатный способ (см., например, Methods in Yeast Genetics, Cold Spring Harbor Laboratory Press, p130 (1990)).
Праймер или зонд подбирают на основе нуклеотидной последовательности настоящего изобретения, предпочтительно, SEQ ID NO:1. С помощью известных методик праймер или зонд можно подобрать из любой области нуклеотидной последовательности настоящего изобретения. Число нуклеотидов в полинуклеотиде, используемом в качестве праймера, обычно составляет 10 или больше, предпочтительно, от 15 до 25. Обычно число нуклеотидов, подходящих для расположенной между праймерами области, как правило, составляет от 300 до 2000 нуклеотидов.
Полученный выше праймер или зонд используют для оценки того, содержит ли геном указанного выше тестируемого штамма последовательность, специфичную для нуклеотидной последовательности настоящего изобретения. Последовательность, специфичную для нуклеотидной последовательности настоящего изобретения, можно детектировать с помощью известных методик. Например, для амплификации нуклеиновой кислоты тестируемого штамма с помощью ПЦР или аналогичного метода в качестве одного праймера используют полинуклеотид, содержащий часть или всю последовательность, специфичную для нуклеотидной последовательности настоящего изобретения, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную приведенной выше нуклеотидной последовательности, и в качестве другого праймера используют полинуклеотид, содержащий часть или всю последовательность выше или ниже от этой последовательности, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную приведенной выше нуклеотидной последовательности, определяя, таким образом, присутствие или отсутствие продукта амплификации, молекулярную массу продукта амплификации и т.д.
Условия проведения ПЦР, подходящие для способа настоящего изобретения, конкретно не ограничены, но включают, например:
температуру денатурации: 90-95°C;
температуру отжига: 40-60°C;
температуру элонгации: 60-75°C;
число циклов: 10 или больше.
Полученный в результате продукт реакции, то есть амплифицированный продукт, можно разделить электрофорезом в агарозном геле или аналогичным способом для определения молекулярной массы амплифицированного продукта. Таким образом, указанную выше активность настоящего изобретения тестируемого штамма можно предсказать или установить по соответствию молекулярной массы амплифицированного продута массе молекулы нуклеиновой кислоты, соответствующей области, специфичной для нуклеотидной последовательности настоящего изобретения. Более того, указанную выше активность настоящего изобретения можно более точно предсказать или оценить с помощью анализа нуклеотидной последовательности амплифицированного продукта способом, описанным выше, или аналогичным способом. Способ оценки указанной выше активности настоящего изобретения описан выше.
Альтернативно, способ оценки настоящего изобретения может включать культивирование тестируемого штамма и определение уровня экспрессии АСС, кодируемой нуклеотидной последовательностью настоящего изобретения, такой как SEQ ID NO:1, в результате чего тестируемый штамм оценивается на указанную выше активность настоящего изобретения. Уровень экспрессии АСС можно определить, культивируя тестируемый штамм в соответствующих условиях и количественно оценивая мРНК АСС или белок. Количественную оценку мРНК или белка можно провести с помощью известных методик. Количественную оценку мРНК можно провести, например, с помощью нозерн-гибридизации или количественной ОТ-ПЦР, в то время как количественную оценку белка можно выполнить, например, с помощью Вестерн-блоттинга (Current Protocols in Molecular Biology, John Wiley & Sons 1994-2003).
(2) Способы отбора
Другим вариантом осуществления настоящего изобретения является способ отбора продуцирующего липиды штамма с использованием нуклеиновой кислоты, кодирующей АСС, или белка АСС настоящего изобретения. Способ отбора настоящего изобретения может включать культивирование тестируемых штаммов и определение уровня экспрессии АСС, кодируемой нуклеотидной последовательностью настоящего изобретения, такой как SEQ ID NO:1, для отбора штамма, имеющего желаемый уровень экспрессии, в результате чего можно отобрать штамм, обладающий желаемой активностью. Альтернативно, способ может включать предварительное определение типового штамма, отдельное культивирование типового штамма и тестируемых штаммов, определение указанного выше уровня экспрессии в каждом штамме и сравнение уровня экспрессии между типовым штаммом и каждым тестируемым штаммом, в результате чего можно отобрать желаемый штамм. Более конкретно, штамм с желаемой активностью можно отобрать, культивируя типовой штамм и тестируемые штаммы в соответствующих условиях, определяя уровень экспрессии в каждом штамме и отбирая тестируемый штамм, например, имеющий более высокий или более низкий уровень экспрессии относительно типового штамма. Желаемую активность можно оценить, определяя уровень экспрессии АСС, как описано выше.
Альтернативно, способ отбора настоящего изобретения может включать культивирование тестируемых штаммов и отбор штамма, имеющего более высокую или более низкую указанную выше активность настоящего изобретения, в результате чего можно отобрать штамм, обладающий желаемой активностью. Желаемую активность можно оценить, определяя уровень экспрессии АСС, как описано выше.
Примеры тестируемых штаммов или типовых штаммов, которые можно использовать, включают, например, но не ограничиваются ими, штамм, трансформированный указанным выше вектором настоящего изобретения, штамм с подавленной экспрессией указанной выше нуклеиновой кислоты настоящего изобретения, штамм с введенными мутациями, штамм с природными мутациями и т.д. Следует отметить, что АСС-активность настоящего изобретения и/или активность, компенсирующую недостаток АСС в дрожжах настоящего изобретения, можно оценить, например, способом, описанным в разделе «Нуклеиновые кислоты, кодирующие ацетил-CoA-карбоксилазу настоящего изобретения». Методики введения мутаций включают, но не ограничиваются ими, физические способы, такие как УФ или радиоактивное излучение, и химические способы, такие как обработка химическими соединениями EMS (этилметансульфонат), N-метил-N-нитрозогуанидином или аналогичными соединениями (см., например, Yasuji Oshima ed., Biochemistry Experiments vol. 39, Experimental Protocols for Yeast Molecular Genetics, pp. 67-75, Japan Scientific Societies Press).
Штаммы, используемые в качестве типовых и тестируемых штаммов настоящего изобретения, включают, но не ограничиваются ими, продуцирующие липиды грибы или дрожжи, перечисленные выше. Более конкретно, типовые и тестируемые штаммы могут представлять собой комбинацию любых штаммов, принадлежащих к различным родам или видам, и одновременно можно использовать один или несколько тестируемых штаммов.
Настоящее изобретение дополнительно проиллюстрировано следующими примерами. Однако следует понимать, что настоящее изобретение не ограничено приведенными ниже примерами.
ПРИМЕРЫ
[Пример 1]
(1) Конструирование кДНК-библиотеки и EST-анализ
Штамм M. alpina 1S-4 инокулировали в 100 мл среды (1,8% глюкозы, 1% дрожжевого экстракта, рН 6,0) и инкубировали при встряхивании в течение 4 дней при 28°C. Клетки собирали для выделения тотальной РНК с использованием гидрохлорида гуанидина/CsCl. Поли(А)+мРНК выделяли из тотальной РНК с использованием набора для очистки мРНК Oligotex-dT30 <Super> mRNA. Ее использовали для конструирования кДНК-библиотеки, используя набор для клонирования ZAP-cDNA GigapackIII Gold (STRATAGENE). Проводили однократный анализ нуклеотидной последовательности с 5'-конца кДНК (примерно 2000 клонов).
(2) Поиск гомологов АСС
Отыскивали последовательности, полученные с помощью приведенного выше EST-анализа, по аминокислотным последовательностям, помещенным в базу данных GENEBANK, используя программу поиска гомологии BLASTX для выявления гомологов ацетил-CoA-карбоксилазы. В результате была найдена последовательность, имеющая наиболее высокий процент идентичности с гомологом ацетил-CoA-карбоксилазы из Schizosaccharomyces pombe (номер доступа P78820), а именно, последовательность, соответствующая нуклеотидам 5833-6026 в SEQ ID NO:1.
[Пример 2]
(1) Клонирование МаАСС
кДНК-библиотеку скринировали для поиска последовательности, соответствующей нуклеотидам 5833-6026 в SEQ ID NO:1, обнаруженной в примере 1,, поскольку эта последовательность, по-видимому, кодирует фрагмент гомолога ацетил-CoA-карбоксилазы из M. alpina (MaACC). Для получения зонда с помощью ПЦР сначала конструировали праймеры 931-F и 931-R.
931-F: 5'-GCCAACTGGCGTGGATTCTC-3' (SEQ ID NO:6)
931-R: 5'-GTCCTCGTTGATAGTAGGGTC-3' (SEQ ID NO:7)
ПЦР проводили, используя кДНК-библиотеку (2,6×106 БОЕ/мкл) в качестве матрицы с ExTaq (Takara Bio Inc.) и праймерами 931-F и 931-R. Условия проведения ПЦР включали 2 мин. при 94°C с последующими 30 циклами по 1 мин. при 94°C, 1 мин. при 55°C и 3 мин. при 72°C.
Амплифицированные фрагменты ТА-клонировали (клонированы в ТА-вектор) с использованием набора для клонирования TOPO-TA (INVITROGEN CORPORATION). Определяли нуклеотидные последовательности некоторых клонов, и клон, содержащий нуклеотиды 5835-6014 в SEQ ID NO:4, обозначали как pCR-MaACC-P1. Затем проводили ПЦР с использованием этой плазмиды в качестве матрицы вместе с указанными выше праймерами. В реакции использовали ExTaq (Takara Bio Inc.), но амплифицируемую ДНК метили диоксигенином (DIG), используя смесь для ПЦР-мечения (Roche Diagnostics), вместо включенной в набор для ПЦР смеси dNTP, таким образом, получая зонд для скрининга кДНК-библиотеки. Полученный зонд использовали для скрининга кДНК-библиотеки.
Условия проведения гибридизации были следующими.
Гибридизационный буфер: 5×SSC, 1% SDS, 50 мМ Tris-HCl (pH 7,5), 50% формамид;
Температура гибридизации: 42°C (в течение ночи);
Условия проведения отмывки: 3 раза по 20 минут в растворе 0,2×SSC, 0,1% SDS (65°C).
Детекцию осуществляли, используя набор для детекции нуклеиновой кислоты DIG (Roche Diagnostics). Плазмиды вырезали отщеплением in vivo из фаговых клонов, полученных в результате скрининга. Была определена нуклеотидная последовательность плазмиды pBMaACC-p38, содержащая фрагмент, соответствующий нуклеотидам 5833-6026 в SEQ ID NO:1, и имеющая максимально длинную вставку среди этих плазмид. Плазмида pBMaACC-P38 содержала нуклеотиды 1892-6865 в SEQ ID NO:4. Этот клон, по-видимому, не содержал всю последовательность МаАСС, принимая во внимание сравнение с известными гомологами ацетил-CoA-карбоксилазы, присутствие или отсутствие старт-кодона и т.д.
Для получения полноразмерной последовательности МаАСС проводили три раунда 5'-RACE с использованием набора 5'-Full RACE Core Set (Takara Bio Inc.), следуя протоколу изготовителя, указанному ниже. Тотальная РНК была такой же, как использовали для конструирования кДНК-библиотеки.
Для проведения 5'-RACE (первый раунд) конструировали следующие праймеры на основе нуклеотидной последовательности вставки из pBMaACC-P38:
праймер ACC-RT-1: pTGGTGCCGGGTTGCT (SEQ ID NO:8)
праймер ACC-S1-1: GCAAACTTGTTCGCTACCTTG (SEQ ID NO:9)
праймер ACC-A1-1: TCGTTCTCCTTCTCCAACAA (SEQ ID NO:10)
праймер ACC-S2-1: CAGGCCTATGCTGAGATTGAG (SEQ ID NO:11)
праймер ACC-A2-1: TGGACCTCTTCCAACGAGTAA (SEQ ID NO:12).
В 5'-RACE (первый раунд) фрагменты кДНК, амплифицированные с праймером ACC-S2-1 и праймером ACC-A2-1, клонировали в ТА-вектор, и клон с максимальной длиной вставки из полученных клонов, содержащий частичную последовательность MaACC, был обозначен как pCRMaACC-P2-5. Этот клон содержал нуклеотиды 1183-2011 в SEQ ID NO:4.
Для проведения дополнительной 5'-RACE (второй раунд) на основе этой последовательности конструировали следующие праймеры:
5'-RACE (второй раунд)
праймер ACC-RT-2: pCAGGGCGTTCAGCAGTG (SEQ ID NO:13)
праймер ACC-S1-2: CGAGTACTTGATCCGCCTTT (SEQ ID NO:14)
праймер ACC-A1-2: GGAAATCACCACGAATGGAG (SEQ ID NO:15)
праймер ACC-S2-2: GGAGTTCGAGGAAAACACCA (SEQ ID NO:16)
праймер ACC-A2-2: TGACCACGATCCTGTCCATA (SEQ ID NO:17).
В 5'-RACE (второй раунд) фрагменты кДНК, амплифицированные с праймером ACC-S2-2 и праймером ACC-A2-2, клонировали в ТА-вектор, и клон, содержащий частичную последовательность MaACC, с максимальной длиной вставки из полученных клонов обозначали как pCRMaACC-P7-15. Этот клон содержал нуклеотиды 738-1522 в SEQ ID NO:4.
Для проведения дополнительной 5'-RACE (третий раунд) на основе этой последовательности конструировали следующие праймеры:
5'-RACE (третий раунд)
праймер ACC-RT-3: pTCGGGCTTGGCAATG (SEQ ID NO:18)
праймер ACC-S1-3: ATCTGGAGGTCCAGCTTTTG (SEQ ID NO:19)
праймер ACC-A1-3: GCGTTACCAGCCAACTTCAT (SEQ ID NO:20)
праймер ACC-S2-3: GCGTCGCCATCAGAAGATTA (SEQ ID NO:21)
праймер ACC-A2-3: AGGCCTGAGCGAACTTTTCT (SEQ ID NO:22).
В 5'-RACE (третий раунд) фрагменты кДНК, амплифицированные с праймером ACC-S2-3 и праймером ACC-A2-3, клонировали в ТА-вектор, и клон, содержащий частичную последовательность MaACC, с максимальной длиной вставки из полученных клонов, обозначали как pCRMaACC-P9-2. Этот клон содержал нуклеотиды 1-792 в SEQ ID NO:4 и, по-видимому, содержал старт-кодон MaACC, исходя из сравнения с известными гомологами ацетил-CoA-карбоксилазы или аналогичными белками. Полученные таким образом последовательности лигировали, с получением последовательности SEQ ID NO:4, представляющей последовательность кДНК, содержащую полную кодирующую последовательность MaACC.
Затем содержащую SEQ ID NO:4 плазмиду конструировали, как описано ниже. Сначала лигировали фрагмент ДНК примерно 8 т.п.о., полученный расщеплением плазмиды pBMaACC-P38 рестрикционными эндонуклеазами NotI и BamHI, и фрагмент ДНК примерно 0,8 т.п.о., полученный расщеплением плазмиды pCRMaACC-P2-5 рестрикционными эндонуклеазами NotI (полилинкер вектора pCR2.1, расположенный в 5'-области от МаАСС) и BamHI, с производством плазмиды pBMaACC-P4. С другой стороны, синтезировали кДНК с помощью системы для ОТ-ПЦР SuperScript First-Strand (Invitrogen) с использованием такой же тотальной РНК, которую использовали для конструирования кДНК-библиотеки с праймерами со случайной последовательностью.
Ее использовали в качестве матрицы для проведения дополнительной ПЦР с использованием ExTaq (Takara Bio) с праймером ACC-NotI: GCGGCGGCCGCTCCCACTGACTCAAGCGG (SEQ ID NO:23) и праймером ACC-A1-2, и полученные ДНК-фрагменты клонировали в ТА-вектор. Фрагмент ДНК примерно 1,5 т.п.о., полученный расщеплением клона, содержащего корректный фрагмент нуклеотидов 1-1578 в SEQ ID NO:4, рестрикционными эндонуклеазами NotI и XbaI, лигировали с фрагментом ДНК примерно 8,4 т.п.о., полученным расщеплением плазмиды pBMaACC-P4 рестрикционными эндонуклеазами NotI и XbaI, с получением плазмиды pB-MaACC.
(2) Анализ последовательности
Последовательность кДНК (SEQ ID NO:4) ACC из M. alpina (MaACC), полученную как описано выше, подвергали анализу ORF (открытой рамки считывания). В результате было предсказано, что кодирующая область АСС настоящего изобретения соответствует нуклеотидам 45-6734 в SEQ ID NO:4 (SEQ ID NO:3), и область ORF соответствует нуклеотидам 45-6731 в SEQ ID NO:4 (SEQ ID NO:1). Последовательность кДНК (SEQ ID NO:4) ACC из M. alpina (также называемая в данном описании «МаАСС») и ее предполагаемая аминокислотная последовательность (SEQ ID NO:2) показаны на фиг.1.
Кроме того, SEQ ID NO:4 подвергали гомологическому анализу с использованием BLASTX по аминокислотным последовательностям, зарегистрированным в базе данных GenBank. В результате было показано, что МаАСС имеет гомологию с гомологами АСС из эукариотических микроорганизмов, в частности, среди известных аминокислотных последовательностей максимальную идентичность МаАСС имеет с предполагаемым белком RO3G_04977 из Rhizopus oryzae. Идентичность по нуклеотидной последовательности между CDS данного белка и кодирующей областью MaACC и идентичность его аминокислотной последовательности и предполагаемой аминокислотной последовательностью МаАСС, определенные с помощью clustalW, составляли 65,5% и 66,3%, соответственно. Процент идентичности с предполагаемыми аминокислотными последовательностями гомологов АСС из других грибов составлял: 58,8% с гомологом из Neurospora crassa (номер доступа EAA33781), 58,3% с гомологом из Aspergillus fumigatus (номер доступа EAL93163) и 55,1% с цитоплазматической ACC Acc1p и 44,7% с митохондриальной ACC Hfa1p из дрожжей S. cerevisiae.
С другой стороны, фрагмент гомолога АСС из штамма M. alpina CBS528.72 был уже зарегистрирован в базе данных Genbank (нуклеотидная последовательность: номер доступа AJ586915 (непатентный документ 6) (SEQ ID NO:24); аминокислотная последовательность: номер доступа CAE52914 (SEQ ID NO:25)). Полученную новую полноразмерную кДНК-последовательность из M. alpina 1S-4 и ее предполагаемую аминокислотную последовательность сравнивали с этими последовательностями. Сравнение нуклеотидных последовательностей показано на фиг.2, и сравнение аминокислотных последовательностей показано на фиг.3. CDS-область нуклеотидной последовательности с номером доступа AJ586915 соответствует нуклеотидам 342-1439 в SEQ ID NO:4 и показала 91,3% идентичность до тех пор, пока это касается указанной области. Аминокислотная последовательность с номером доступа CAE52914 соответствует аминокислотам 100-465 в SEQ ID NO:2 и показала 97,8% идентичность до тех пор, пока это касается указанной области.
[Пример 3]
Конструирование экспрессионного вектора
Вектор для экспрессии в дрожжах, pYE22m, расщепляли рестрикционной эндонуклеазой EcoRI и выступающие концы достраивали с образованием «тупых» концов, используя набор для затупления (Takara Bio). В этот фрагмент встраивали NotI-линкер (p-GCGGCCGC: SEQ ID NO:26) с конструированием вектора pYE22mN. Лигировали фрагмент, полученный расщеплением вектора pYE22mN рестрикционными эндонуклеазами NotI и SalI, и фрагмент примерно 6,9 т.п.о., полученный расщеплением плазмиды pB-MaACC рестрикционными эндонуклеазми NotI и XhoI, с использованием набора для высокого лигирования (TOYOBO), получая плазмиду pYE-MaACC. Затем расщепляли плазмиду pYE-MaACC рестрикционной эндонуклеазой HindIII, и выступающие концы достраивали с образованием «тупых» концов, используя набор для затупления (Takara Bio), и встраивали по сайту SmaI в плазмиду pUC-URA3 с получением плазмиды pUC-URA3-MaACC. Полученную плазмиду расщепляли рестрикционной эндонуклеазой HindIII и трансформировали в дрожжевой штамм Δura3, таким образом, чтобы экспрессионная кассета АСС из M. alpina была встроена ниже URA3 на дрожжевой хромосоме.
[Пример 4]
Получение штаммов дрожжей, трансформированных кассетой для экспрессии АСС из штамма M. alpina 1S-4, и анализ случайной выборки спор
Нокаутированный штамм дрожжей YSC1021-673427 (Δacc1:KanMX/ACC1, his3Δ1/his3Δ1, leu2Δ0/leu2Δ0, ura3Δ0/ura3Δ0, LYS2/lys2Δ0, MET15/met15Δ0, Open Biosystems), который является гетерозиготным диплоидным штаммом, у которого отсутствует ген цитоплазматической АСС, трансформировали с ДНК-фрагментом, полученным расщеплением рестрикционной эндонуклеазой HindIII плазмиды pUC-URA3-MaACC, сконструированной в примере 3. Трансформированные штаммы отбирали, исходя из роста на чашках с агаром SD-Ura. Штаммы, случайно отобранные таким образом, обозначали как штамм MaACC-HD-#1 и штамм MaACC-HD-#2 (Δacc1: KanMX/ACC1, his3Δ1/his3Δ1, leu2Δ0/leu2Δ0, MaACC-URA3/ura3Δ0, LYS2/lys2Δ0, MET15/met15Δ0).
Для индукции споруляции штаммы MaACC-HD-#1 и MaACC-HD-#2 высевали на чашки с агаром YPD и инкубировали при 30°C в течение 2 дней. Растущие клетки высевали на чашки с агаром для споруляции (1% ацетата калия, 0,1% дрожжевого экстракта, 0,05% глюкозы, 2% агара) и инкубировали при 25°C в течение 4 дней. Одну полную микробиологическую петлю инокулировали в 1 мл раствора зимолазы (1,2 М сорбит, 50 мМ калий-фосфатного буфера (рН 7,5), 14 мМ 2-меркаптоэтанола, 0,2 мг/мл зимолазы 100Т (Seikagaku Corporation)) и инкубировали при встряхивании при 30°C в течение 24 часов. Затем клетки собирали центрифугированием и удаляли супернатант. Клетки энергично перемешивали с 1 мл стерильной воды, затем собирали центрифугированием и удаляли супернатант. Эту операцию дополнительно повторяли дважды.
Полученные клетки соответственно разводили стерильной водой и высевали на чашки с агаром YPD для образования одиночных колоний. Для ста случайно выбранных штаммов из полученных колоний (из всего 200 штаммов) делали реплики на чашках с агаром YPD, YPD+G418 (200 мг/л), SD-Ura, SD-Met и SD-Lys и оценивали рост на каждой чашке. Результаты показаны в таблице 1.
Таблица 1
Рост трансформированных штаммов гетерозиготного диплоидного штамма, у которого отсутствует ген дрожжевой цитоплазматической АСС
Ген АСС1 из S. cerevisiae и MaACC могут быть расщеплены на четыре генотипа:
(1) Δacc1: KanMX, MaACC-URA3;
(2) ACC1, ura3Δ0;
(3) ACC1, MaACC-URA3; и
(4) Δacc1: KanMX, ura3Δ0.
Фенотипы штаммов, имеющих такие генотипы, соответствуют номерам (I-IV), показанным в первой колонке в таблице 1, но некоторые штаммы, растущие на всех тестируемых чашках с агаром, являются диплоидными.
Из восьми штаммов выделяли геномную ДНК, используя набор Dr. GenTLE (для дрожжей) (Takara Bio), и подвергали ПЦР с использованием ExTaq (Takara Bio) с комбинациями праймеров ScACC1-19/ScACC1+658, праймеров ScACC1-19/KanB и праймеров ACC1-scf5/ACC1-scr5. В результате, в трех из восьми штаммов наблюдалась амплификация фрагмента ДНК соответствующего размера с комбинацией праймеров, указывая на то, что они являются диплоидными. Последовательности приведенных выше праймеров приведены ниже:
ScACC1-19: CCCGAAACAGCGCAGAAAATTAG (SEQ ID NO:27)
ScACC1+658: CCAGACCGGTTTTCTCGTCCACGTG (SEQ ID NO:28)
KanB: CTGCAGCGAGGAGCCGTAAT (SEQ ID NO:29)
ACC1-scf5: CGCATTGGTCTTGCTAGTGA (SEQ ID NO:30)
ACC1-scr5: AAGTGCGACACTCCGTTCTT (SEQ ID NO:31).
Таким образом, 74 штамма с фенотипом I в таблице 1 включают примерно 60 гаплоидных штаммов, то есть штаммы с указанными выше генотипами (1):(2):(3):(4), по-видимому, появляются в соотношении расщепления примерно 1:1:1:0.
Следует отметить, что штаммы Δacc1 известны как являющиеся летальными в S. cerevisiae. Не было получено ни одного штамма с генотипом (4), поскольку они были Δacc1 и летальными. Однако штаммы с генотипом (1) были получены, несмотря на то, что они были Δacc1, демонстрируя, что МаАСС может компенсировать Δacc1. Другими словами, было показано, что МаАСС обладает АСС-активностью в цитоплазме.
[Пример 5]
Саузерн-анализ
Случайным образом выбирали два штамма из каждой из групп I-a (штаммы, гаплоидные по результатам ПЦР), II-a и III-a в таблице 1, полученные в примере 4. Геномную ДНК выделяли, как описано выше. Ее расщепляли рестрикционными эндонуклеазами BamHI или HindIII и разделяли электрофорезом в 0,8%-ом агарозном геле, и переносили и фиксировали ДНК на Hybond N+. Используемыми зондами являлись: (1) фрагмент ДНК от -500-го до -157-го нуклеотида выше гена АСС1 из S. cerevisiae, (2) фрагмент ДНК от 101-го до 658-го нуклеотида в гене АСС1 из S. cerevisiae, и (3) фрагмент ДНК МаАСС (SEQ ID NO:4). Для мечения и детектирования зондов использовали AlkPhos Direct (GE Healthcare). Саузерн-анализ проводили с использованием зонда (1) или зонда (2) для ДНК, расщепленной рестрикционной эндонуклеазой BamHI, и с использованием зонда (3) для ДНК, расщепленной рестрикционной эндонуклеазой HindIII. В результате, в группе I-a, штамм, гаплоидный по результатам ПЦР, зонд (1) детектировал сигнал на уровне 3,2 т.п.о., зонд (2) не давал сигнала, и зонд (3) детектировал сигнал на уровне 8,2 т.п.о. С другой стороны, в группе II-a зонд (1) и зонд (2) детектировал сигнал на уровне 7,6 т.п.о., и зонд (3) не давал сигнала, при этом в группе III-a зонд (1) и зонд (2) детектировали сигнал 7,6 т.п.о, и зонд (3) детектировал сигнал 8,2 т.п.о.
Приведенные результаты показали, то эти штаммы содержат следующие гены цитоплазматической АСС: штамм группы I-a содержит только MaACC из штамма M. alpina 1S-4, штамм группы II-a содержит только ACC1 из S. cerevisiae, а штамм группы III-a содержит как MaACC, так и ACC1.
[Пример 6]
Анализ дрожжей, экспрессирующих МаАСС
Для четырех случайных образом выбранных штаммов из каждой из групп I-a (штаммы, гаплоидные по результатам ПЦР), II-a и III-a в таблице 1, полученных в примере 4, инокулировали по одной полной микробиологической петле в 10 мл жидкой среды YPD5+Ura (2% дрожжевого экстракта, 1% полипептона, 5% глюкозы, 0,002% урацила) и инкубировали при встряхивании при 30°C в течение 24 часов или 72 часов. В конце инкубации измеряли оптическую плотность культур при 600 нм для оценки роста клеток (таблица 2).
Рост клеток (OD
600 нм
)
Клетки собирали центрифугированием и лиофилизировали, затем жирные кислоты в клетках переводили в метиловые эфиры с использованием метанольной HCl, затем экстрагировали гексаном, гексан выпаривали, и осадок анализировали с помощью газовой хроматографии для определения композиций жирных кислот при различных временах инкубации (таблицы 3 и 4).
Соотношение состава жирных кислот штаммов дрожжей (после 24-часовой инкубации)
Соотношение состава жирных кислот штаммов дрожжей (после 72-часовой инкубации)
В результате, штамм группы I-a, содержащий только МаАСС из M. alpina, рос быстрее штамма группы II-a, содержащего только ген АСС из S. cerevisiae. Штамм группы III-a, содержащий оба гена АСС, рос еще быстрее штамма группы I-a.
Более того, штаммы с разными генотипами имели разное соотношение состава жирных кислот, то есть, у штамма группы I-a, содержащего только МаАСС из M. alpina, наблюдалось заметное снижение содержания пальмитиновой кислоты, стеариновой кислоты и гексадокозановой кислоты среди насыщенных жирных кислот, а также снижение содержания олеиновой кислоты среди мононенасыщенных жирных кислот по сравнению со штаммом группы II-a, содержащим только ген АСС из S. cerevisiae. С другой стороны, у этого штамма наблюдалось повышение содержание тетрадокозановой кислоты среди насыщенных жирных кислот и содержание пальмитолеиновой кислоты среди мононенасыщенных жирных кислот. У штамма группы III-a, содержащего как MaACC из M. alpina, так и ACC1 из S. cerevisiae, наблюдалось промежуточное соотношение состава жирных кислот между соотношениями, характерными для группы I-a и II-a.
[Пример 7]
Установление геномной последовательности гена АСС
Штаммом M. alpina 1S-4 инокулировали 100 мл жидкой среды (1% глюкозы, 0,5% дрожжевого экстракта, рН 6,0) и инкубировали при встряхивании и 28°C в течение 4 дней. Клетки собирали фильтрованием, и выделяли геномную ДНК с использованием набора DNeasy Plant (Quiagen).
Для определения последовательности геномной ДНК АСС из штамма M. alpina 1S-4 использовали следующие праймеры:
ACC-G1: atgactaccaacgtacagtccttcattg (SEQ ID NO:32)
ACC-G2: ttaaacggtcatcgtggcgaacttggc (SEQ ID NO:33).
Геномную ДНК из штамма M. alpina 1S-4 использовали в качестве матрицы для проведения 30 циклов ПЦР (98°C-10 сек. и 68°C-15 мин.) с использованием LATaq (Takara Bio). Полученные фрагменты ДНК примерно 8 т.п.о. клонировали в ТА-вектор. Последовательность геномной ДНК (SEQ ID NO:5) АСС из штамма M. alpina 1S-4 определяли нуклеотидным секвенированием вставок в многочисленных клонах.
Сравнение последовательности геномной ДНК гена АСС из штамма M. alpina 1S-4 с последовательностью кДНК выявило, что ген содержит пять интронных и экзонных областей, соответствующих нуклеотидам 1-27, 315-665, 1271-2828, 2917-3463, 3590-6239 и 6339-7889 в SEQ ID NO:5.
[Пример 8]
Повышенная экспрессия АСС в Mortierella alpina
(1) Конструирование экспрессионного вектора
Проводили ПЦР, используя плазмиду pB-MaACC (см. пример 2) в качестве матрицы, вместе со следующими праймерами ACCExF-SpeI и ACCExR-SpeI, что давало продукт ПЦР примерно 6,7 т.п.о.
праймер ACCExF-SpeI: 5'-ATACTAGTATGACTACCAACGTACAGTCC-3' (SEQ ID NO:36)
праймер ACCExR-SpeI: 5'-GGACTAGTCTTAAACGGTCATCGTGGCG-3' (SEQ ID NO:37).
Его расщепляли рестрикционной эндонуклеазой SpeI и лигировали с фрагментом, полученным расщеплением плазмиды pSDY рестрикционной эндонуклеазой SpeI с получением плазмиды pSDY-ACC (фиг.5).
(2) Трансформация Mortierella alpina
Ауксотрофный по урацилу штамм Dura-3, который получали из M. alpina способом, согласно международной публикации № WO2005/019437 (озаглавленной «Способ разведения продуцирующих липиды грибов»), использовали в качестве хозяина и трансформировали методом доставки генетического материала с помощью частиц. Для отбора трансформированных штаммов использовали среду SC на агаре (0,5% дрожжевой азотной основы без аминокислот и сульфата аммония (DIFCO), 0,17% сульфата аммония, 2% глюкозы, 0,002% аденина, 0,003% тирозина, 0,0001% метионина, 0,0002% аргинина, 0,0002% гистидина, 0,0004% лизина, 0,0004% триптофана, 0,0005% треонина, 0,0006% изолейцина, 0,0006% лейцина, 0,0006% фенилаланина и 2% агара).
(3) Отбор трансформированных штаммов
Примерно 50 трансформированных штаммов выделяли, инокулировали в 15 мл жидкой среды GY (2% глюкозы, 1% дрожжевого экстракта, рН 6,0) и инкубировали при встряхивании при 28°C в течение 8 дней. Клетки собирали и сушили при 120°C в течение 2 часов, жирные кислоты в клетках преобразовывали в метиловые эфиры с использованием метанольной HCl и проводили анализ жирных кислот. Для дальнейших экспериментов отбирали четыре штамма, A4, H9, H11 и H20, имеющие высокий уровень продукции жирных кислот и высокое содержание арахидоновой кислоты,
(4) Подтверждение трансформации МаАСС-экспрессионной кассеты
Четыре трансформированных штамма, отобранных, как описано выше, инкубировали в жидкой среде GY и выделяли геномную ДНК. Для того чтобы оценить была ли или нет экспрессионная кассета МаАСС трансформирована в трансформированные штаммы, проводили ПЦР с использованием геномной ДНК в качестве матрицы вместе с праймерами ACC-F7 и trpCt-R, указанными ниже. При использовании в указанной реакции pSDY-ACC в качестве матрицы амплифицировался ПЦР-продукт примерно 1,6 т.п.о. В случае каждого трансформированного штамма обнаруживали ПЦР-продукт этого размера, что указывало на то, что МаАСС-экспрессионная кассета была трансформирована в указанные штаммы. Однако ПЦР-продукт не мог быть детектирован в штамме-хозяине Δura-3 в таких же условиях.
ACC-F7: 5'-GCTTGGTCGCGATGTCTACACCTCG-3' (SEQ ID NO:38)
trpCt-R: 5'-ACGTATCTTATCGAGATCCTGAACACCA-3' (SEQ ID NO:39)
(5) Оценка трансформированных штаммов
Для четырех трансформированных штаммов оценивали изменение роста и продукции жирных кислот во времени. А именно, каждый штамм инокулировали в 15 мл жидкой среды GY и инкубировали при встряхивании при 28°C. На 2-й, 4-й, 6-й, 8-й и 10-й день все клетки собирали и оценивали сухую массу клеток и уровень продукции жирных кислот (фиг.6 и 7). В результате, все трансформированные штаммы и штамм-хозяина Δura-3 имели максимальный уровень продукции жирных кислот на 8-й день.
Таким образом, проводили сравнение композиций жирных кислот, сухой массы клеток, общего уровня продукции жирных кислот и продукции арахидоновой кислоты на 8-й день (фиг.8, таблица 5). В результате, штамм-хозяина Δura-3 и трансформированные штаммы имели примерно одинаковую сухую массу клеток, но количество жирных кислот, продуцируемых на объем, увеличилось в 1,1-1,2 раза, и количество арахидоновой кислоты, продуцируемой на объем, увеличилось в 1,2-1,6 раза.
Сравнение роста штаммов и их продуктивности в отношении жирных кислот и арахидоновой кислоты
Таким образом, повышение экспрессии АСС в Mortierella alpine увеличивало уровень продукции жирных кислот, в частности, увеличивало уровень продукции арахидоновой кислоты относительно других жирных кислот.
Перечень последовательностей:
SEQ ID NO:6: праймер
SEQ ID NO:7: праймер
SEQ ID NO:8: праймер
SEQ ID NO:9: праймер
SEQ ID NO:10: праймер
SEQ ID NO:11: праймер
SEQ ID NO:12: праймер
SEQ ID NO:13: праймер
SEQ ID NO:14: праймер
SEQ ID NO:15: праймер
SEQ ID NO:16: праймер
SEQ ID NO:17: праймер
SEQ ID NO:18: праймер
SEQ ID NO:19: праймер
SEQ ID NO:20: праймер
SEQ ID NO:21: праймер
SEQ ID NO:22: праймер
SEQ ID NO:23: праймер
SEQ ID NO:26: праймер
SEQ ID NO:27: праймер
SEQ ID NO:28: праймер
SEQ ID NO:29: праймер
SEQ ID NO:30: праймер
SEQ ID NO:31: праймер
SEQ ID NO:32: праймер
SEQ ID NO:33: праймер
SEQ ID NO:36: праймер
SEQ ID NO:37: праймер
SEQ ID NO:38: праймер
SEQ ID NO:39: праймер
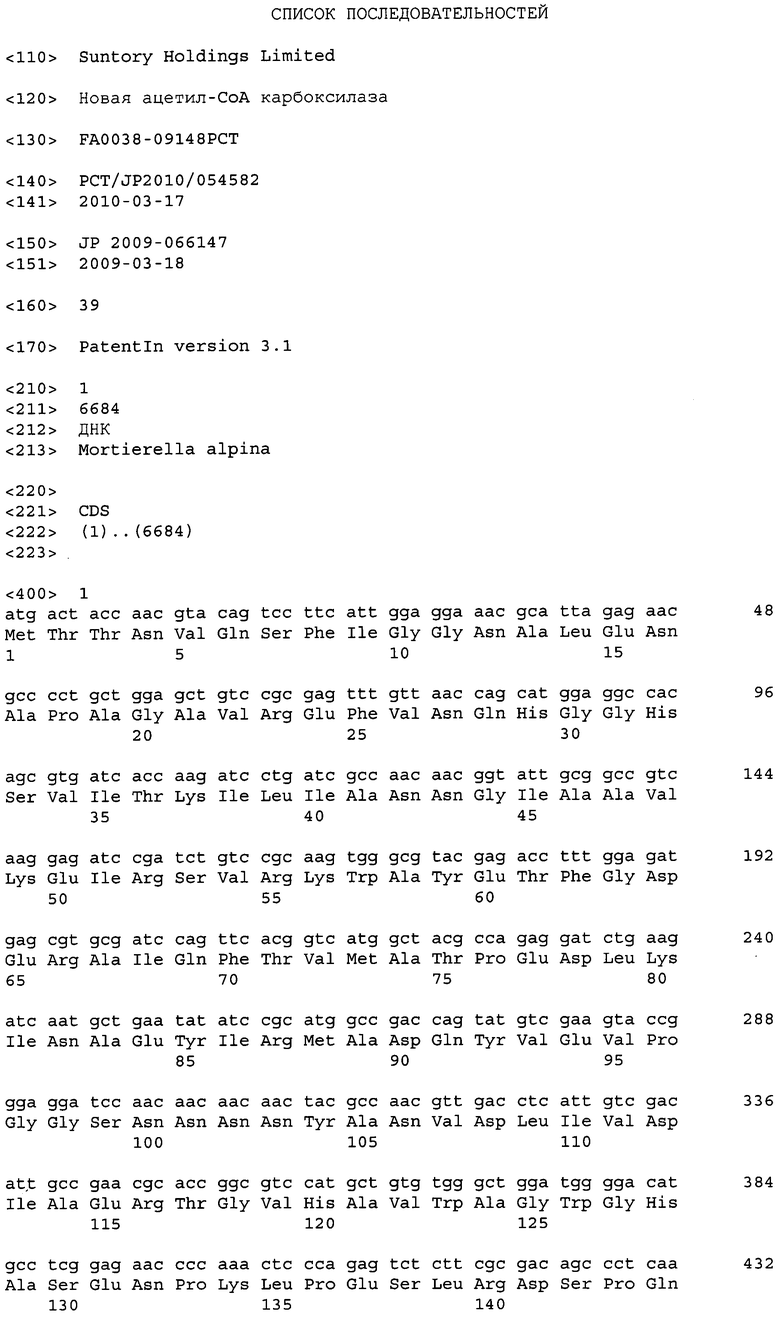






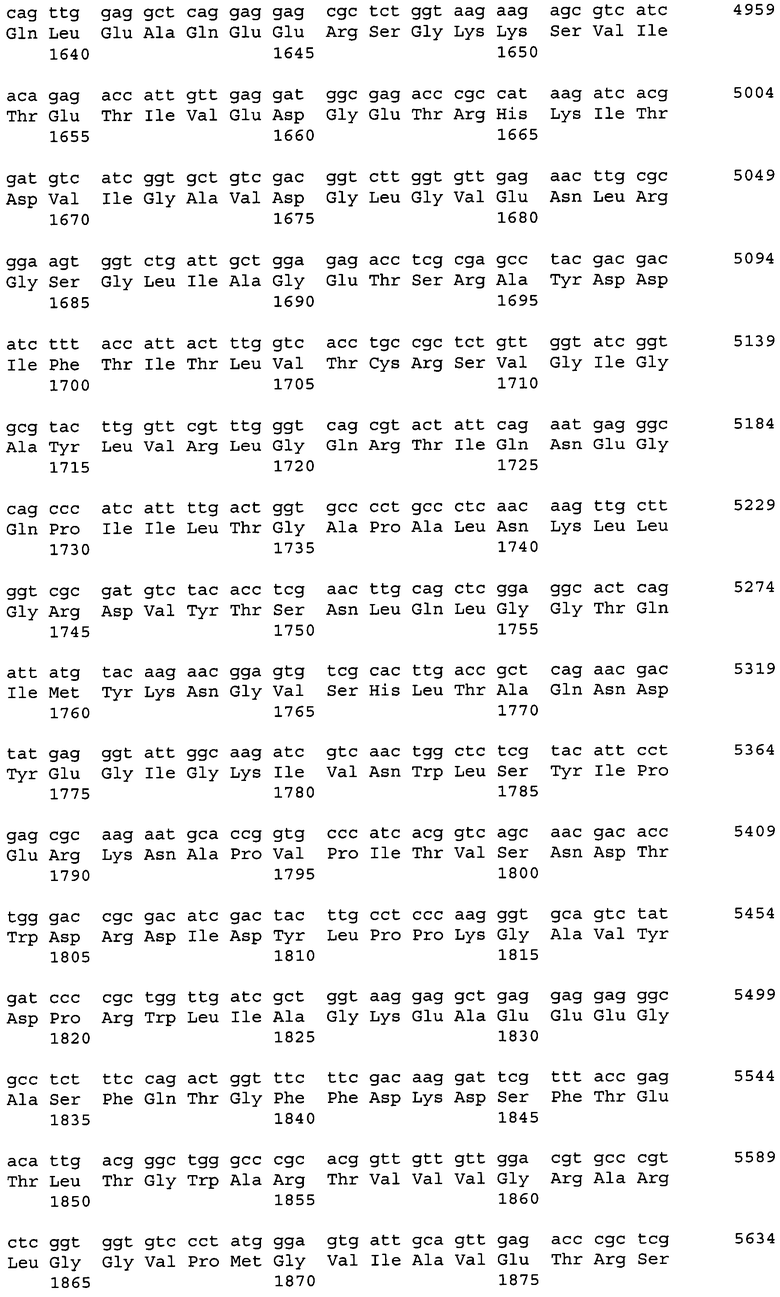
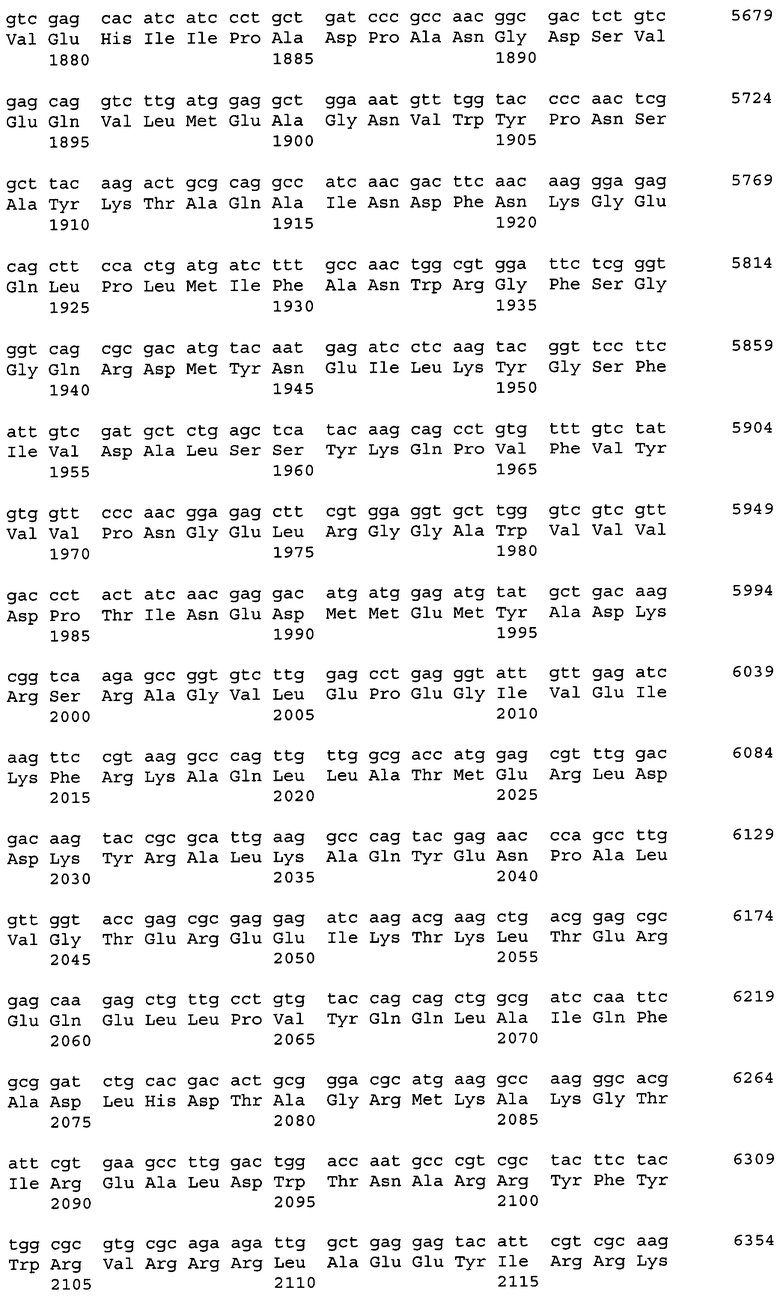

































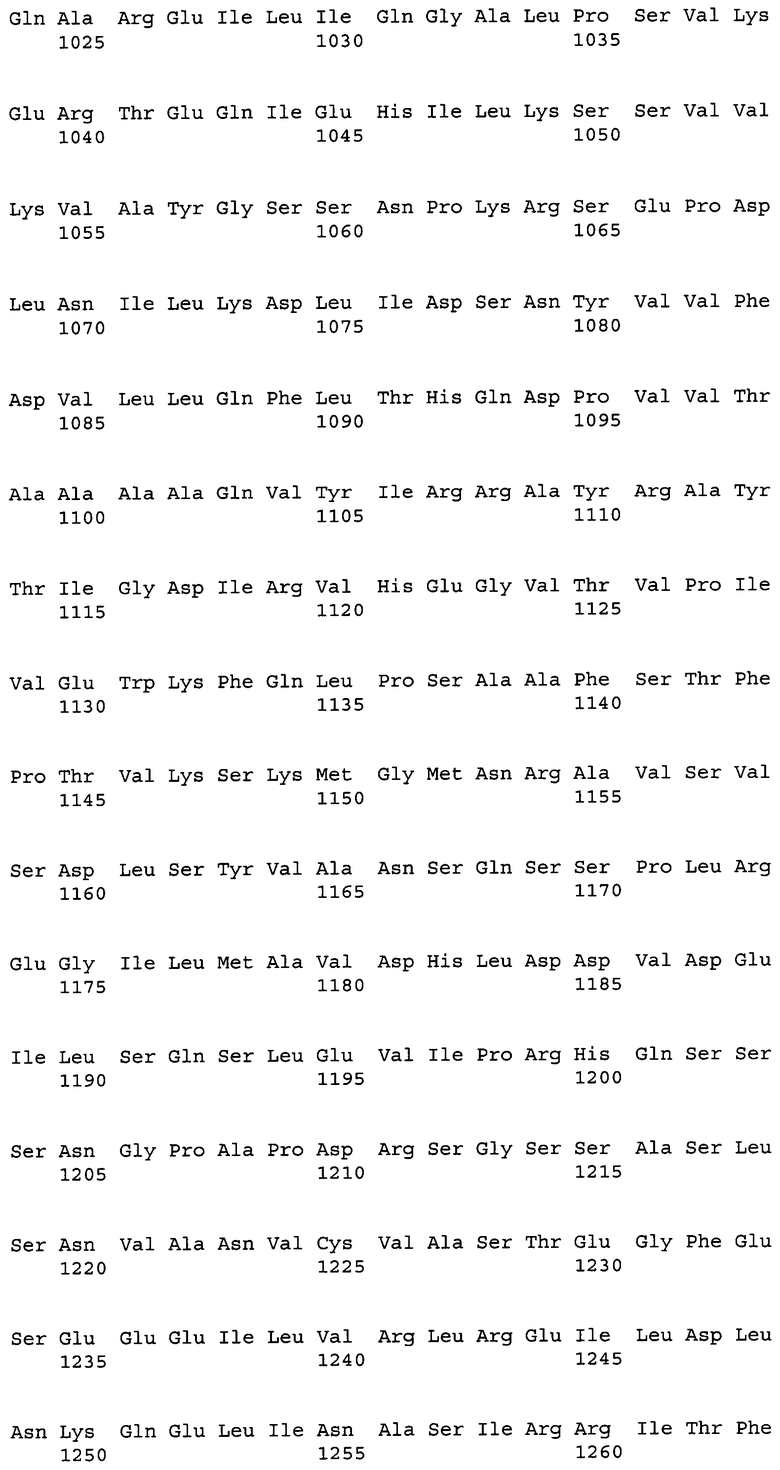
























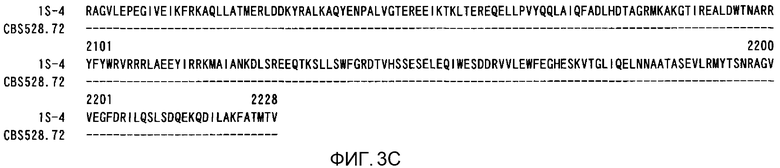


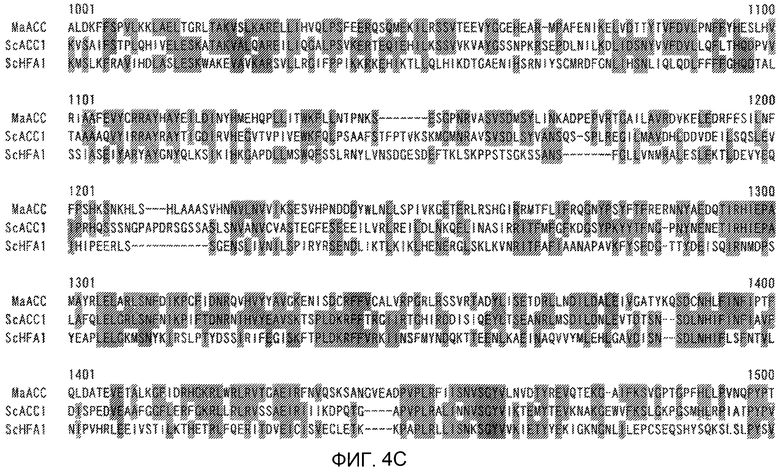


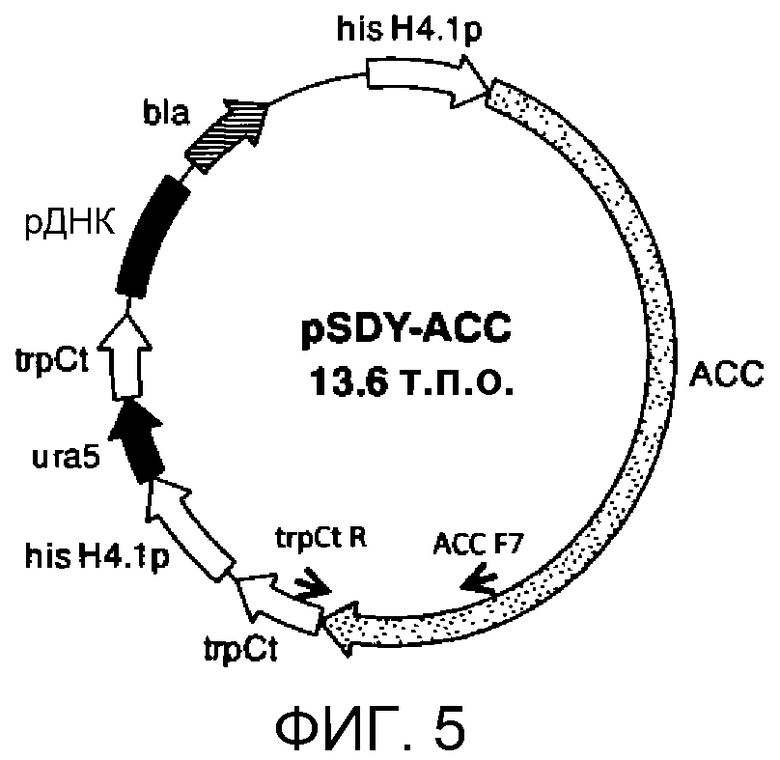
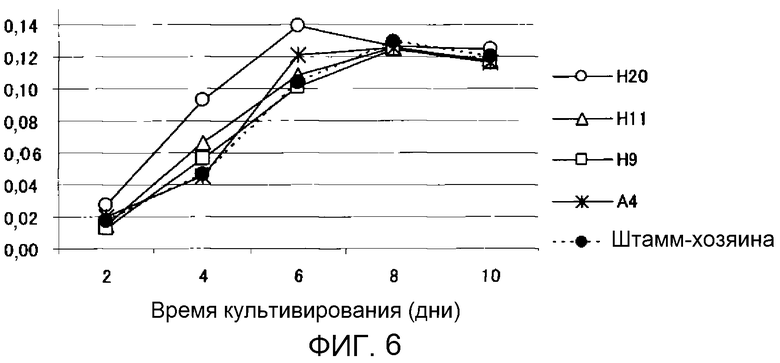
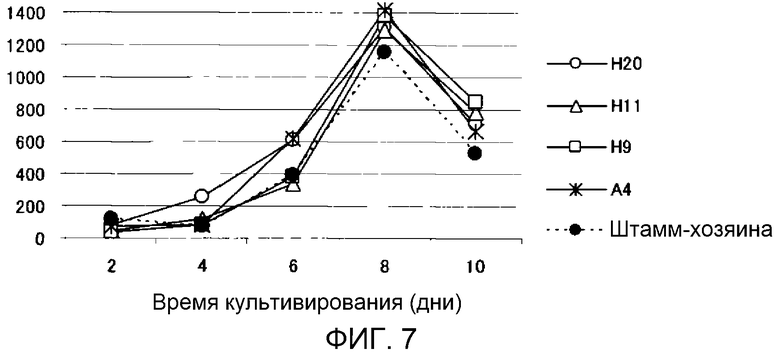
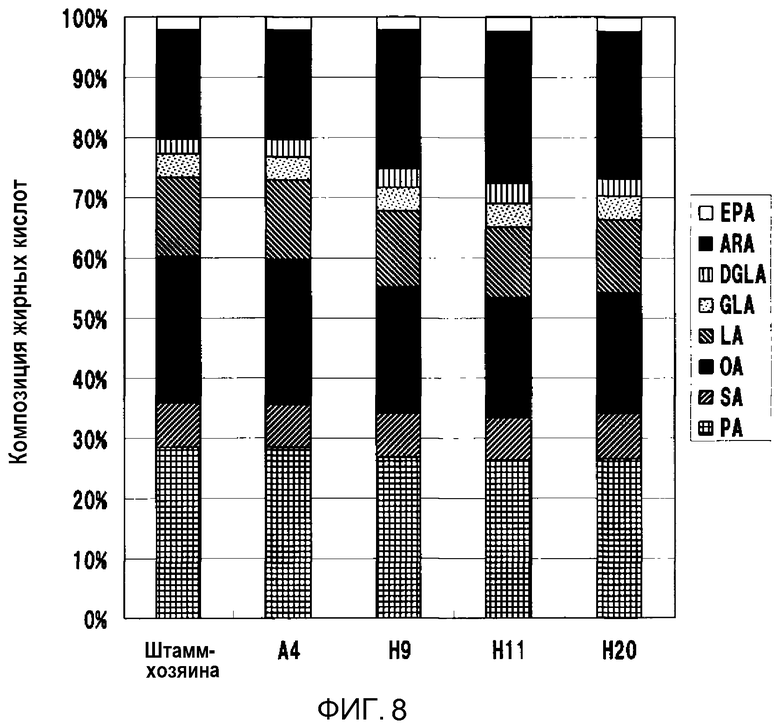
Изобретение относится к области биотехнологии. Представлена нуклеиновая кислота, кодирующая белок, обладающий ацетил-СоА- карбоксилазной активностью, компенсирующей недостаток ацетил-СоА-карбоксилазной активности в дрожжах, где нуклеотидная последовательность выбрана из группы, состоящей из нуклеиновой кислоты, которая содержит нуклеотидную последовательность: (a) кодирующую белок, состоящий из аминокислотной последовательности SEQ ID NO:2; (b) которая гибридизуется в жестких условиях с нуклеиновой кислотой, комплементарной SEQ ID NO:1; (c) SEQ ID NO:1; и (d) которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из комплементарной нуклеотидной последовательности, кодирующей белок SEQ ID NO:2; где SEQ ID NO:1 и 2 раскрыты в описании. Также описаны: ацетил-СоА-карбоксилаза (SEQ ID NO:2), повышающая содержание арахидоновой кислоты, характерное для хозяина; рекомбинантный вектор, содержащий указанную нуклеиновую кислоту; и клетка, которая трансформирована указанным вектором, предназначенные для получения композиции жирных кислот, содержащей повышенный уровень арахидоновой кислоты. Предложен способ получения композиции жирных кислот, включающий культивирование указанной клетки и сбор композиции жирных кислот из культуры трансформированных клеток. Изобретение позволяет получить композицию жирных кислот в клетке-хозяине с повышенным содержанием арахидоновой кислоты. 9 н. и 2 з.п. ф-лы, 8 ил., 5 табл., 8 пр.
1. Молекула нуклеиновой кислоты, состоящая из нуклеотидной последовательности, кодирующей белок, обладающий ацетил-СоА- карбоксилазной активностью, где нуклеотидная последовательность выбрана из группы, состоящей из:
(a) нуклеотидной последовательности, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности SEQ ID NO:2;
(b) нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1;
(c) нуклеотидной последовательности, которая содержит нуклеотидную последовательность, состоящую из SEQ ID NO:1; и
(d) нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности SEQ ID NO:2.
2. Молекула нуклеиновой кислоты по п.1, состоящая из нуклеотидной последовательности, кодирующей белок, обладающий ацетил-СоА-карбоксилазной активностью, где нуклеотидная последовательность выбрана из группы, состоящей из:
(a) нуклеотидной последовательности, которая гибридизуется в условиях 2xSSC при 50°С с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1; и
(b) нуклеотидной последовательности, которая гибридизуется в условиях 2xSSC при 50°С с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности SEQ ID NO:2.
3. Молекула нуклеиновой кислоты, состоящая из нуклеотидной последовательности, кодирующей белок, обладающий ацетил-СоА- карбоксилазной активностью, где нуклеотидная последовательность содержит нуклеотидную последовательность SEQ ID NO:4.
4. Молекула нуклеиновой кислоты, состоящая из нуклеотидной последовательности, кодирующей белок, обладающий активностью, компенсирующей недостаток ацетил-СоА-карбоксилазной активности в дрожжах, где нуклеотидная последовательность выбрана из группы, состоящей из:
(a) нуклеотидной последовательности, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности SEQ ID NO:2;
(b) нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1;
(c) нуклеотидной последовательности, которая содержит нуклеотидную последовательность, состоящую из SEQ ID NO:1; и
(d) нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности SEQ ID NO:2.
5. Молекула нуклеиновой кислоты по п.4, состоящая из нуклеотидной последовательности, кодирующей белок, обладающий активностью, компенсирующей недостаток ацетил-СоА-карбоксилазной активности в дрожжах, где нуклеотидная последовательность выбрана из группы, состоящей из:
(a) нуклеотидной последовательности, которая гибридизуется в условиях 2xSSC при 50°С с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1; и
(b) нуклеотидной последовательности, которая гибридизуется в условиях 2xSSC при 50°С с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности SEQ ID NO:2.
6. Белок, обладающий ацетил-СоА-карбоксилазной активностью, где белок состоит из аминокислотной последовательности SEQ ID NO:2.
7. Рекомбинантный вектор, содержащий нуклеиновую кислоту по любому из пп.1-5, для получения композиции жирных кислот, содержащей повышенный уровень арахидоновой кислоты.
8. Клетка, которая трансформирована рекомбинантным вектором по п.7, для получения композиции жирных кислот, содержащей повышенный уровень арахидоновой кислоты.
9. Способ получения композиции жирных кислот, включающий культивирование трансформированных клеток по п.8 и сбор композиции жирных кислот из культур трансформированных клеток по п.8.
10. Молекула нуклеиновой кислоты, состоящая из нуклеотидной последовательности, кодирующей белок, обладающий активностью, повышающей содержание арахидоновой кислоты, характерное для хозяина, где нуклеотидная последовательность выбрана из группы, состоящей из:
(a) нуклеотидной последовательности, которая содержит нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности SEQ ID NO:2;
(b) нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:1;
(c) нуклеотидной последовательности, которая содержит нуклеотидную последовательность, состоящую из SEQ ID NO:1; и
(d) нуклеотидной последовательности, которая гибридизуется в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности SEQ ID NO:2.
11. Белок, обладающий активностью, повышающей содержание арахидоновой кислоты, характерное для хозяина, где белок состоит из аминокислотной последовательности SEQ ID NO:2.
| DATABASE: UniProtKB/TrEMBL, Q70BT2 (Q70BT2_MORAP), 05.07.2004 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| US 2006051847 A1, 09.03.2006 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ | 1991 |
|
RU2038377C1 |
Авторы
Даты
2015-05-27—Публикация
2010-03-17—Подача