Изобретение относится к новым соединениям формулы (I), обладающим антитромботической активностью, которые, в частности, ингибируют фактор свертывания крови IXa, к способам их получения и к их применению в качестве лекарственных средств.
Свертывание крови представляет собой процесс контроля потока крови, являющийся существенно важным для выживания млекопитающих. Процесс свертывания крови и последующее растворение сгустка крови после заживления раны имеют место сразу после сосудистого повреждения, и его можно разделить на четыре фазы:
1. Фаза вазоконстрикции или сужения сосудов: посредством этого потеря крови в пораженной области снижается.
2. Следующая фаза представляет собой активацию тромбоцитов тромбином. Тромбоциты прикрепляются к месту повреждения стенки сосуда и образуют агрегат тромбоцитов. Белок фибриноген является здесь ответственным за связывание тромбоцитов посредством соответствующих поверхностных рецепторов. Тромбоциты также связываются с доступным коллагеном внеклеточного матрикса поврежденной стенки сосуда, и за счет этого происходит их активация. После активации тромбоцитов секретируются различные вещества-мессенджеры, которые индуцируют активацию других тромбоцитов. В то же время мембранный липид, фосфатидилсерин, транспортируется из внутренней стороны мембраны тромбоцитов на внешнюю сторону, на которой могут аккумулироваться комплексы факторов свертывания крови. Тромбоциты ускоряют свертывание крови посредством такого механизма.
3. Образование таких комплексов факторов свертывания приводит к массивному образованию тромбина, который преобразовывает растворимый фибриноген в фибрин путем отщепления двух небольших пептидов. Фибриновые мономеры спонтанно образуют нитеподобные цепочки, из которых, после поперечного связывания фактором свертывания крови XIII, образуется стабильная белковая структура. Изначально даже более свободный агрегат тромбоцитов стабилизируется такой структурой фибрина; агрегаты тромбоцитов и структура фибрина являются двумя существенными составляющими тромба.
4. После заживления раны тромб растворяется под действием ключевого фермента эндогенной системы фибринолиза - плазмина.
Два альтернативных пути могут приводить к образованию фибринового сгустка: внутренний и внешний путь. Эти пути инициируются разными механизмами, но в более поздней фазе они сливаются с образованием общего конечного пути каскада свертывания крови. На этом конечном пути свертывания крови происходит активация фактора свертывания крови X. Активированный фактор X является ответственным за образование тромбина из неактивного предшественника - протромбина, циркулирующего в крови. Образование тромба в основании аномальности стенки сосуда в отсутствие повреждения сосуда является результатом внутреннего пути. Образование фибринового сгустка в ответ на повреждение ткани или рану является результатом внешнего пути. Оба пути включают относительно большое количество белков, которые известны как факторы свертывания крови.
Для внутреннего пути необходимы факторы свертывания крови V, VIII, IX, X, XI и XII, а также прекалликреин, высокомолекулярный кининоген, ионы кальция и фосфолипиды из тромбоцитов.
Инициация внутреннего пути происходит, когда прекалликреин, высокомолекулярный кининоген, фактор XI и XII связываются с отрицательно заряженной поверхностью. Этот момент времени обозначен как контактная фаза. Доступность для воздействия коллагена стенки сосудов является основным стимулом контактной фазы. Результатом процессов контактной фазы является преобразование прекалликреина в калликреин, который, в свою очередь, активирует фактор XII. Под воздействием фактора XIIa происходит дальнейший гидролиз прекалликреина до калликреина, результатом чего является активация. С повышением активации фактора XII происходит активация фактора XI, которая приводит к высвобождению брадикинина, вазодилататора. В результате происходит завершение начальной фазы вазоконстрикции. Брадикинин образуется из высокомолекулярного кининогена. В присутствии ионов Ca2+ фактор XIa активирует фактор IX. Фактор IX представляет собой профермент, который содержит витамин K-зависимые остатки γ-карбоксиглутаминовой кислоты (GLA). Активность сериновой протеазы становится заметной после связывания Ca2+ с этими GLA остатками. Различные сериновые протеазы каскада свертывания крови (факторы II, VII, IX и X) содержат такие витамин K-зависимые GLA остатки. Фактор IXa расщепляет фактор X и приводит к активации фактора Xa. Необходимым условием для образования фактора IXa является образование комплекса теназы из Ca2+ и факторов VIIIa, IXa и X на поверхности активированных тромбоцитов. Одной из реакций активированных тромбоцитов является презентация фосфатидилсерина и фосфатидилинозитола на поверхностях. Экспонирование этих фосфолипидов, прежде всего, делает возможным образование комплекса теназы. Фактор VIII в этом способе имеет функцию рецептора для факторов IXa и X. Фактор VIII поэтому представляет собой кофактор в каскаде свертывания крови. Для активации фактора VIII с образованием фактора VIIIa, действительного рецептора, необходимо лишь минимальное количество тромбина. С увеличением концентрации тромбина фактор VIIIa в конце концов далее расщепляется и инактивируется тромбином. Такое двойственное действие тромбина в отношении фактора VIII приводит к самоограничению образования комплекса теназы и, таким образом, к ограничению свертывания крови.
Для внешнего пути необходимы тканевый фактор (TF) и факторы свертывания крови V, VII, VIII, IX и X. В случае повреждения сосуда тканевый фактор (TF) аккумулируется с фактором свертывания крови VII, и происходит активация последнего. Комплекс TF и фактор свертывания крови VII имеют два субстрата, факторы свертывания крови X и IX.
Фактор свертывания крови IX может активироваться посредством внутреннего пути и внешнего пути. Активация фактора IXa, таким образом, представляет собой центральную точку пересечения между двумя путями активации свертывания крови.
Фактор IXa играет важную роль в свертывании крови. недостаток фактора IXa приводит к гемофилии B, тогда как повышенные концентрации фактора IXa в крови приводят к существенно повышенному риску образования тромбоза (Weltermann A, et al., J Thromb Haemost. 2003; 1: 28-32). Регуляция активности фактора IXa может снизить тромбообразование в животных моделях (Feuerstein GZ, et al., Thromb Haemost. 1999; 82: 1443-1445).
Соединения формулы (I) по настоящему изобретению являются подходящими для профилактического и для терапевтического введения человеку, страдающему от заболеваний, сопровождающих тромбозы, эмболии, способность к гиперкоагуляции или фиброзные изменения. Их можно использовать для вторичной профилактики, и они являются подходящими как для неотложной, так и для долговременной терапии.
Настоящее изобретение, поэтому, относится к соединению формулы (I)
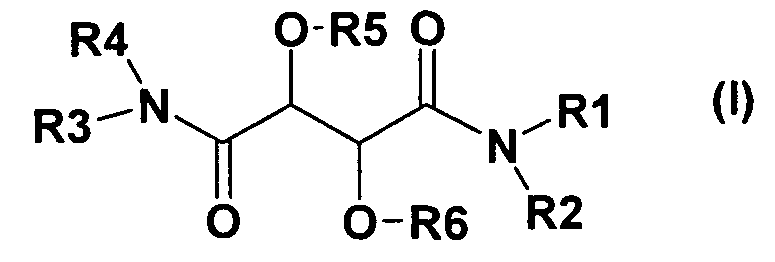
и/или ко всем стереоизомерным формам соединения формулы (I) и/или смесям этих форм в любом соотношении, и/или к физиологически приемлемой соли соединения формулы (I), где
R1 представляет собой
1) -(C6-C14)-арил-Z, где Z представляет собой основную азот-содержащую группу, и где арил является незамещенным или моно-, ди- или тризамещенным группой T,
2) -(C3-C12)-циклоалкил-Z, где Z представляет собой основную азот-содержащую группу, и где циклоалкил является незамещенным или моно-, ди- или тризамещенным группой T,
3) четырех-пятнадцатичленный Het-Z, где Z представляет собой основную азотсодержащую группу, и где Het является незамещенным или дополнительно моно-, ди- или тризамещенным группой T,
R2 и R4 являются одинаковыми или отличными друг от друга и независимо друг от друга представляют собой атом водорода или -(C1-C4)-алкил,
R3 представляет собой
1) -(C0-C4)-алкилен-(C6-C14)-арил, где арил является незамещенным или моно-, ди- или тризамещенным группой T,
2) -(C0-C4)-алкилен-Het, где Het является незамещенным или моно-, ди- или тризамещенным группой T,
3) -(C0-C4)-алкилен-(C6-C14)-арил-Q-(C6-C14)-арил, где два арила в каждом случае независимо друг от друга являются незамещенными или моно-, ди- или тризамещенными группой T,
4) -(C0-C4)-алкилен-(C6-C14)-арил-Q-(C3-C12)-циклоалкил, где арил и циклоалкил в каждом случае независимо друг от друга являются незамещенными или моно-, ди- или тризамещенными группой T,
5) -(C0-C4)-алкилен-(C6-C14)-арил-Q-Het, где арил и Het в каждом случае независимо друг от друга являются незамещенными или моно-, ди- или тризамещенными группой T,
6) -(C0-C4)-алкилен-Het-Q-(C6-C14)-арил, где арил и Het в каждом случае независимо друг от друга являются незамещенными или моно-, ди- или тризамещенными группой T, или
7) -(C0-C4)-алкилен-Het-Q-Het, где два радикала Het в каждом случае независимо друг от друга являются незамещенными или моно-, ди- или тризамещенными группой T,
Q представляет собой ковалентную связь, -(C1-C4)-алкилен, -NH-, -N((C1-C4)-алкил)-, -O-, -SO2- или -S-,
T представляет собой
1) галоген,
2) -(C1-C6)-алкил, где алкил является незамещенным или, независимо, моно-, ди- или тризамещенным группой -(C1-C3)-фторалкил, -N-C(O)-OH или -N-C(O)-(C1-C4)-алкил,
3) -(C1-C3)-фторалкил,
4) -(C3-C8)-циклоалкил,
5) -OH,
6) -O-(C1-C4)-алкил,
7) -O-(C1-C3)-фторалкил,
8) -NO2,
9) -CN,
10) -N(R10)(R11), где R10 и R11 независимо друг от друга представляют собой атом водорода, -(C3-C8)-циклоалкил, галоген или -(C1-C6)-алкил,
11) -C(O)-NH-R10,
12) -NH-C(O)-R10,
13) -NH-SO2-R10,
14) -SO2-(C1-C4)-алкил,
15) -SO2-NH-R10,
16) -SO2-(C1-C3)-фторалкил,
17) -S-(C1-C4)-алкил или
18) -S-(C1-C3)-фторалкил,
R5 и R6 являются одинаковыми или отличными друг от друга и независимо друг от друга представляют собой атом водорода, -C(O)-R12, -C(O)-O-R12, -C(O)-NH-R12 или -(C1-C4)-алкил, где
R12 представляет собой -(C1-C6)-алкил, -(C3-C8)-циклоалкил, -(C6-C14)-арил или Het.
Настоящее изобретение, кроме того, относится к соединению формулы (I) и/или ко всем стереоизомерным формам соединения формулы (I) и/или смесям этих форм в любом соотношении, и/или к физиологически приемлемой соли соединения формулы (I), где
R1 представляет собой
1) -(C6-C14)-арил-Z, где арил выбран из группы, состоящей из фенила и нафтила, и где арил является незамещенным или моно-, ди- или тризамещенным группой T, и Z представляет собой амино, аминометилен, амидино, гуанидино, азетидинил, пирролидинил, пиперидинил, пиридинил или аминопиридинил, или
2) четырех-пятнадцатичленный Het-Z, где Het выбран из группы, состоящей из акридинила, азепинила, азетидинила, бензимидазолинила, бензимидазолила, бензофуранила, бензотиофуранила, бензотиофенила, бензоксазолила, бензотиазолила, бензотриазолила, бензотетразолила, бензизоксазолила, бензизотиазолила, карбазолила, 4aH-карбазолила, карболинила, бета-карболинила, хиназолинила, хинолинила, хинолизинила, 4H-хинолизинила, хиноксалинила, хинуклидинила, хроманила, хроменила, циннолинила, дека-гидрохинолинила, дибензофуранила, дибензотиофенила, дигидрофуран[2,3-b]-тетрагидрофуранила, дигидрофуранила, диоксолила, диоксанила, диоксоленила, 2H, 6H-1,5,2-дитиазинила, фуранила, фуразанила, имидазолидинила, имидазолинила, имидазолила, 1H-индазолила, индолинила, индолизинила, индолила, 3H-индолила, изобензофуранила, изохинолинила, изохроманила, изоиндазолила, изоиндолинила, изоиндолила, изотиазолидинила, 2-изотиазолинила, изотиазолила, изоксазолила, изоксазолидинила, 2-изоксазолинила, морфолинила, нафтиридинила, октагидроизохинолинила, оксадиазолила, 1,2,3-оксадиазолила, 1,2,4-оксадиазолила, 1,2,5-оксадиазолила, 1,3,4-оксадиазолила, оксазолидинила, оксазолила, оксазолидинила, оксотиоланила, фенантридинила, фенантренила, фенантролинила, феназинила, фенотиазинила, феноксатиинила, феноксазинила, фталазинила, пиперазинила, пиперидинила, птеридинила, пуринила, пиранила, пиразинила, пиразолидинила, пиразолинила, пиразолила, пиридазинила, пиридооксазолила, пиридоимидазолила, пиридотиазолила, пиридотиофенила, пиридила, пиримидинила, пирролидинила, пирролинила, 2H-пирролила, пирролила, тетрагидрофуранила, тетрагидроизохинолинила, тетрагидрохинолинила, тетрагидропиридинила, 6H-1,2,5-тиадазинила, 1,2,3-тиадиазолила, 1,2,4-тиадиазолила, 1,2,5-тиадиазолила, 1,3,4-тиадиазолила, тиантренила, тиазинила, тиазолила, тиенила, тиеноимидазолила, тиенооксазолила, тиенопиридинила, тиенопирролила, тиенотиазолила, тиенотиофенила, тиоморфолинила, тиопиранила, триазинила, 1,2,3-триазолила, 1,2,4-триазолила, 1,2,5-триазолила, 1,3,4-триазолила или ксантенила, и где Het является незамещенным или моно-, ди- или тризамещенным группой T, и где Z имеет значения, определенные выше,
R2 и R4 являются одинаковыми или отличными друг от друга и независимо друг от друга представляют собой атом водорода или -(C1-C4)-алкил,
R3 представляет собой
1) -(C0-C4)-алкилен-(C6-C14)-арил, где арил имеет значение, определенное выше, и является незамещенным или моно-, ди- или тризамещенным группой T,
2) -(C0-C4)-алкилен-(C6-C14)-арил-Q-(C6-C14)-арил, где два арила в каждом случае независимо друг от друга имеют значения, определенные выше, и в каждом случае независимо друг от друга являются незамещенными или моно-, ди- или тризамещенными группой T,
3) -(C0-C4)-алкилен-(C6-C14)-арил-Q-(C3-C12)-циклоалкил, где арил имеет значение, определенное выше, и циклоалкил является незамещенным или моно-, ди- или тризамещенным группой T, или
4) -(C0-C4)-алкилен-(C6-C14)-арил-Q-Het, где арил и Het имеют значения, определенные выше, и в каждом случае независимо друг от друга являются незамещенными или моно-, ди- или тризамещенными группой T,
Q представляет собой ковалентную связь, -(C1-C4)-алкилен, -NH-, -N((C1-C4)-алкил)- или -O-,
T представляет собой
1) галоген,
2) -(C1-C6)-алкил, где алкил является незамещенным или, независимо, моно-, ди- или тризамещенным группой -(C1-C3)-фторалкил, -N-C(O)-OH или -N-C(O)-(C1-C4)-алкил,
3) -(C1-C3)-фторалкил,
4) -(C3-C6)-циклоалкил,
5) -OH,
6) -O-(C1-C4)-алкил,
7) -O-(C1-C3)-фторалкил,
8) -NO2,
9) -CN,
10) -N(R10)(R11), где R10 и R11 независимо друг от друга представляют собой атом водорода, -(C3-C6)-циклоалкил, галоген или -(C1-C6)-алкил,
11) -C(O)-NH-R10,
12) -NH-C(O)-R10,
13) -NH-SO2-R10,
14) -SO2-(C1-C4)-алкил,
15) -SO2-NH-R10,
16) -SO2-(C1-C3)-фторалкил,
17) -S-(C1-C4)-алкил или
18) -S-(C1-C3)-фторалкил,
R5 и R6 являются одинаковыми или отличными друг от друга и независимо друг от друга представляют собой атом водорода, -C(O)-R12, -C(O)-O-R12, -C(O)-NH-R12 или -(C1-C4)-алкил, где
R12 представляет собой -(C1-C6)-алкил, -(C3-C8)-циклоалкил, -(C6-C14)-арил или Het, и где арил и Het имеют значения, определенные выше.
Настоящее изобретение, кроме того, относится к соединению формулы (I) и/или ко всем стереоизомерным формам соединения формулы (I) и/или смесям этих форм в любом соотношении, и/или к физиологически приемлемой соли соединения формулы (I), где
R1 представляет собой карбамимидоилфенил (бензамидино), аминометилфенил или Het-Z, где Het выбран из группы, состоящей из бензимидазолила и изохинолинила, и где Z представляет собой амино или амидино,
R2 и R4 в каждом случае представляют собой атом водорода,
R3 представляет собой
1) фенил, где фенил является незамещенными или моно- или дизамещенным группой T,
2) -фенил-Q-фенил, где два фенильных радикала в каждом случае независимо друг от друга являются незамещенными или моно- или дизамещенными группой T,
3) фенил-Q-(C3-C6)-циклоалкил, где фенил и циклоалкил в каждом случае независимо друг от друга являются незамещенными или моно- или дизамещенными группой T, или
4) фенил-Q-Het-2, где Het-2 выбран из группы, состоящей из хинолинила, хиноксалинила, фуранила, индолила, изохинолинила, изотиазолила, изоксазолила, оксадиазолила, пиперидинила, пиразолила, пиридазинила, пиримидинила, пиридила, пиримидинила, пирролила, тиадиазолила, тиазолила, тиенила, тиенопирролила или тиенотиофенила, и где фенил и Het-2 в каждом случае независимо друг от друга являются незамещенными или моно- или дизамещенными группой T,
Q представляет собой ковалентную связь, -CH2-, -N(CH3)- или -O-,
T представляет собой
1) F, Cl или Br,
2) -(C1-C4)-алкил, где алкил является незамещенным или, независимо, моно- или дизамещенным группой -CF3 или -N-C(O)-CH3,
3) -CF3,
4) -O-(C1-C4)-алкил,
5) -O-CF3,
6) -NO2,
7) -N(R10)(R11), где R10 и R11 независимо друг от друга представляют собой атом водорода или -(C1-C4)-алкил, или
8) -SO2-CH3,
R5 и R6 в каждом случае представляют собой атом водорода.
Следующим объектом изобретения являются соединения формулы (I) из группы, включающей
(2R,3R)-N-(1-аминоизохинолин-6-ил)-2,3-дигидрокси-N'-п-толилтартарамид,
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-2,3-дигидрокси-N'-п-толилтартарамид,
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-N'-(4-циклогексилфенил)-2,3-дигидрокситартарамид,
(2R,3R)-N-(4-аминометилфенил)-2,3-дигидрокси-N'-п-толилсукцинамид;
(2R,3R)-N-(4-карбамимидоилфенил)-2,3-дигидрокси-N'-п-толилсукцинамид,
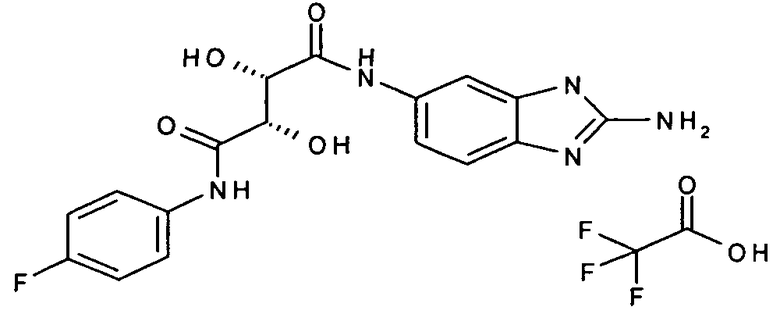
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-N'-(4-фторфенил)-2,3-дигидрокситартарамид,
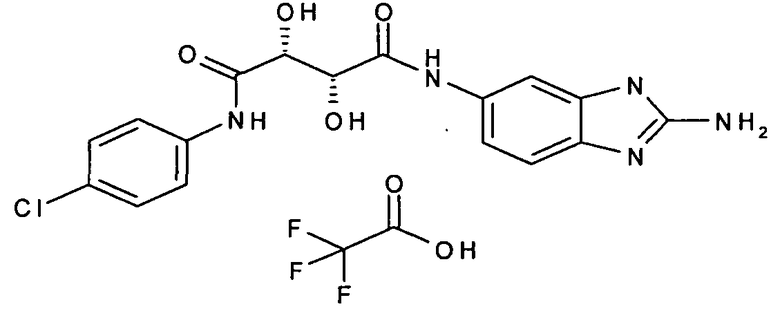
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-N'-(4-хлорфенил)-2,3-дигидрокситартарамид,
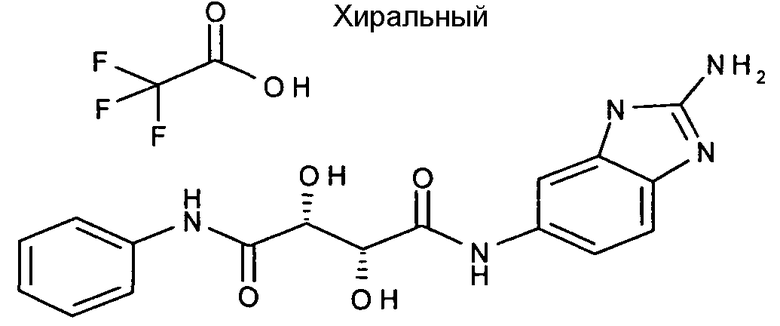
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-2,3-дигидрокси-N'-фенилтартарамид,
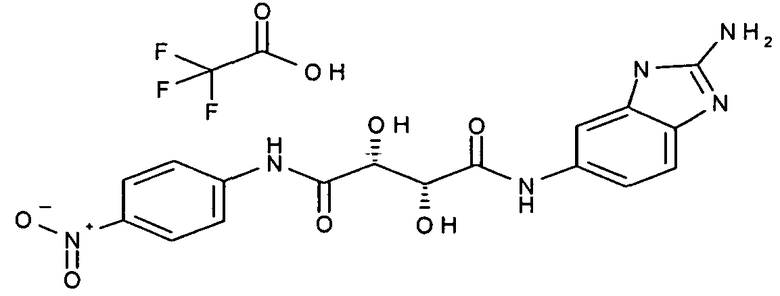
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-2,3-дигидрокси-N'-(4-нитрофенил)-тартарамид,
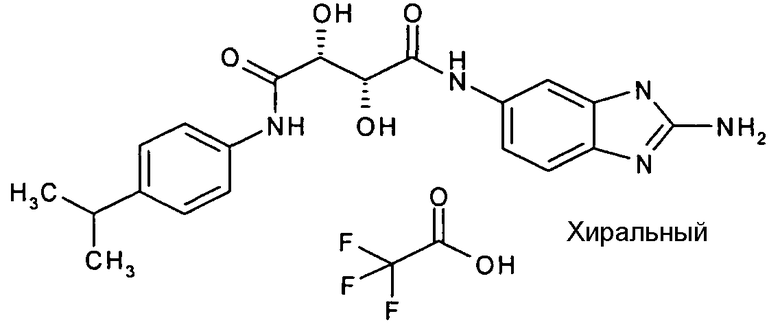
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-2,3-дигидрокси-N'-(4-изопропилфенил)-тартарамид,
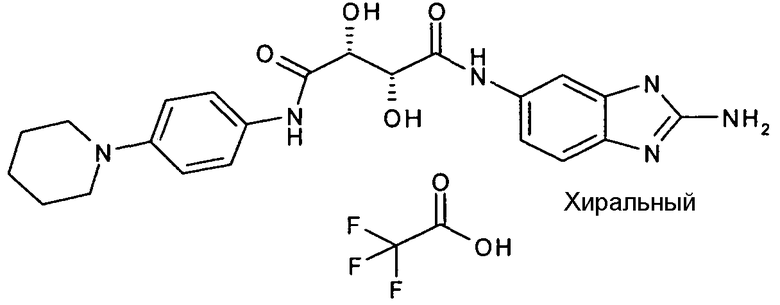
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-2,3-дигидрокси-N'-(4-пиперидин-1-ил-фенил)тартарамид или
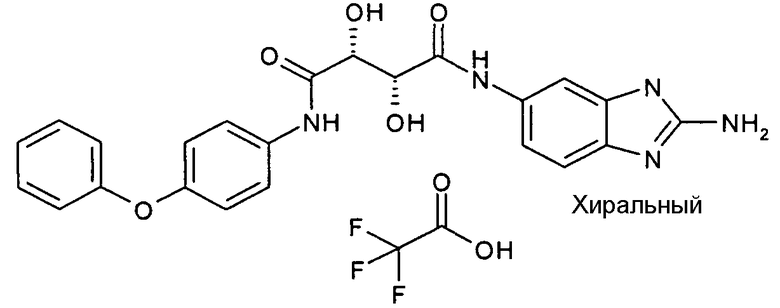
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-2,3-дигидрокси-N'-(4-феноксифенил)-тартарамид.
Термин “(C1-C4)-алкил” или “(C1-C6)-алкил” следует рассматривать как означающий углеводородные радикалы, углеродная цепь которых является линейной или разветвленной и содержит от 1 до 4 или от 1 до 6 атомов углерода, например метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил, гексил, 2,3-диметилбутан или неогексил. Термин “-(C0-C4)-алкилен” следует рассматривать как означающий углеводородные радикалы, углеродная цепь которых является линейной или разветвленной и содержит от 1 до 4 атомов углерода, например метилен, этилен, пропилен, изопропилен, изобутилен, бутилен или трет-бутилен. “-C0-Алкилен” представляет собой ковалентную связь. Термин “-(C1-C4)-алкилен” следует рассматривать как означающий углеводородные радикалы, углеродная цепь которых является линейной или разветвленной и содержит от 1 до 4 атомов углерода, например метилен (-CH2-), этилен (-CH2-CH2-), пропилен (-CH2-CH2-CH2-), изопропилен, изобутилен, бутилен или трет-бутилен.
Термин “-(C3-C12)-циклоалкил” следует рассматривать как означающий кольца, состоящие из 3-12 атомов углерода, такие как соединения, которые образованы из моноциклов, содержащих от 3 до 8 атомов углерода в кольце, такие как циклопропан, циклобутан, циклопентан, циклогексан, циклогептан или циклооктан, которые образованы из бициклов, такие как бицикло[4,2,0]октан, октагидроинден, декагидронафталин, декагидроазулен, декагидробензоциклогептен или додекагидрогептален, или из связанных мостиковой связью циклов, такие как спиро[2,5]октан, спиро[3,4]октан, спиро[3,5]нонан, бицикло[3,1,1]гептан, бицикло[2,2,1]гептан или бицикло[2,2,2]октан.
Термин “-(C3-C6)-циклоалкил” или “-(C3-C8)-циклоалкил” следует рассматривать как означающий радикалы, которые образованы из моноциклов, содержащих от 3 до 6 или от 3 до 8 атомов углерода в кольце, такие как циклопропан, циклобутан, циклопентан, циклогексан, циклогептан или циклооктан.
Термин “-(C6-C14)-арил” следует рассматривать как означающий ароматические углеводородные радикалы, содержащие от 6 до 14 атомов углерода в кольце. -(C6-C14)-Арильные радикалы представляют собой, например, фенил, нафтил, например 1-нафтил, 2-нафтил, антрил или флуоренил. Нафтильные радикалы и, в частности, фенильные радикалы являются предпочтительными арильными радикалами.
Термин “четырех-пятнадцатичленный Het” или “Het” следует рассматривать как означающий кольцевые системы, содержащие от 4 до 15 атомов углерода, которые присутствуют в одной, в двух или в трех кольцевых системах, связанных друг с другом, и в которых один, два, три или четыре одинаковых или отличных друг от друга гетероатомов, выбранных из группы, включающей кислород, азот или серу, могут замещать соответствующие атомы углерода. Примерами таких кольцевых систем являются радикалы акридинил, азепинил, азетидинил, бензимидазолинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензотиазолил, бензотриазолил, бензотетразолил, бензизоксазолил, бензизотиазолил, карбазолил, 4aH-карбазолил, карболинил, бета-карболинил, хиназолинил, хинолинил, хинолизинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, хроманил, хроменил, циннолинил, декагидрохинолинил, дибензофуранил, дибензотиофенил, дигидрофуран[2,3-b]-тетрагидрофуранил, дигидрофуранил, диоксолил, диоксанил, диоксоленил, 2H, 6H-1,5,2-дитиазинил, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индолинил, индолизинил, индолил, 3H-индолил, изобензофуранил, изохинолинил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изотиазолидинил, 2-изотиазолинил, изотиазолил, изоксазолил, изоксазолидинил, 2-изоксазолинил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, оксотиоланил, фенантридинил, фенантренил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазолил, пиридоимидазолил, пиридотиазолил, пиридотиофенил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетрагидропиридинил, 6H-1,2,5-тиадазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазинил, тиазолил, тиенил, тиеноимидазолил, тиенооксазолил, тиенопиридинил, тиенопирролил, тиенотиазолил, тиенотиофенил, тиоморфолинил, тиопиранил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил или ксантенил.
Термин “-(C1-C3)-фторалкил” следует рассматривать как означающий частично или полностью фторированный алкильный радикал, который образован, например, из следующих радикалов: -CF3, -CHF2, -CH2F, -CHF-CF3, -CHF-CHF2, -CHF-CH2F, -CH2-CF3, -CH2-CHF2, -CH2-CH2F, -CF2-CF3, -CF2-CHF2, -CF2-CH2F, -CH2-CHF-CF3, -CH2-CHF-CHF2, -CH2-CHF-CH2F, -CH2-CH2-CF3, -CH2-CH2-CHF2, -CH2-CH2-CH2F, -CH2-CF2-CF3, -CH2-CF2-CHF2, -CH2-CF2-CH2F, -CHF-CHF-CF3, -CHF-CHF-CHF2, -CHF-CHF-CH2F, -CHF-CH2-CF3, -CHF-CH2-CHF2, -CHF-CH2-CH2F, -CHF-CF2-CF3, -CHF-CF2-CHF2, -CHF-CF2-CH2F, -CF2-CHF-CF3, -CF2-CHF-CHF2, -CF2-CHF-CH2F, -CF2-CH2-CF3, -CF2-CH2-CHF2, -CF2-CH2-CH2F, -CF2-CF2-CF3, -CF2-CF2-CHF2 или -CF2-CF2-CH2F.
Термин “галоген” следует рассматривать как означающий фтор, хлор, бром или иод; фтор, хлор или бром являются предпочтительными, особенно хлор или бром.
Термин “основная азотсодержащая группа” следует рассматривать как означающий радикалы, где соответствующая этой группе кислота имеет pKa приблизительно от 5 до 15. Примеры такой основной азотсодержащей группы включают амино, аминометилен, амидино (карбамимидоил), гуанидино, азетидинил, пирролидинил, пиперидинил, пиридинил или аминопиридинил.
Функциональные группы используемых промежуточных соединений, например, амино или карбоксильные группы, могут быть защищены подходящими защитными группами. Подходящие защитные группы для функциональных аминогрупп представляют собой, например, трет-бутоксикарбонил, бензилоксикарбонил, фталоил, или тритильные или тозильные защитные группы. Подходящие защитные группы карбоксильной функциональной группы представляют собой, например, алкиловые, ариловые или арилалкиловые сложные эфиры. Защитные группы можно вводить и удалять способами, которые хорошо известны или описаны в настоящей заявке (см. Green, T.W., Wutz, P.G.M., Protective Groups in Organic Synthesis (1991), 2nd Ed., Wiley-Interscience, или Kocienski, P., Protecting Groups (1994), Thieme). Термин защитная группа также может включать связанные с полимером защитные группы. Такие защищенные соединения формулы (I), где, например, функциональные группы радикалов U, V, X или W необязательно могут быть также защищены, хотя сами могут и не быть фармакологически активными, необязательно могут быть преобразованы, после введения млекопитающим, путем метаболизма в фармакологически активные соединения по настоящему изобретению.
Соединения по настоящему изобретению можно получить хорошо известными способами или в соответствии со способами, описанными в настоящей заявке.
Настоящее изобретение, кроме того, относится к способу получения соединения формулы (I) и/или стереоизомерной формы соединения формулы (I) и/или физиологически приемлемой соли соединения формулы (I), который включает получение соединения формулы (I) в соответствии со схемой (1).
Схема 1:
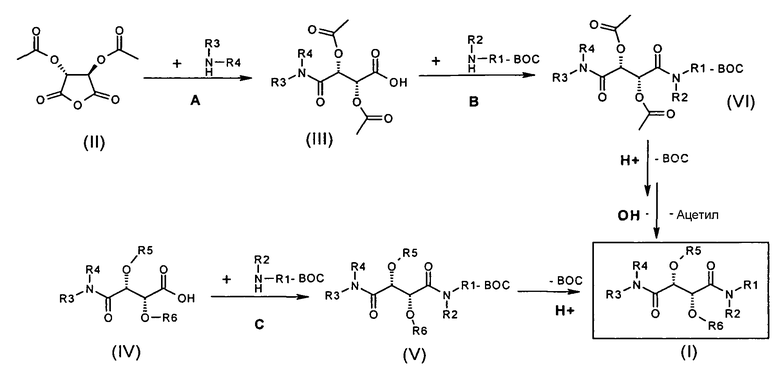
Радикалы R1, R2, R3 и R4, используемые в схеме 1, имеют такие же значения, как в соединении формулы (I); BOC представляет собой защитную группу бутоксикарбонил.
В способе на стадии А, диацетил-L-винный ангидрид (соединение формулы (II)) растворяют в растворителе, таком как диметилформамид (ДМФА), тетрагидрофуран (ТГФ), N-метилпирролидинон (NMP), диоксан или дихлорметан и подвергают взаимодействию с подходящим амином формулы NH(R3)-R4 с получением соответствующего амида (III). Для этого добавляют подходящее основание, такое как N-метилморфолин или, альтернативно, другое аминовое основание, такое как основание Hünig, триэтиламин (NEt3) или 4-диметиламинопиридин (4-DMAP). На следующей стадии B, моноамид III растворяют в растворителе, таком как диметилформамид (ДМФА), тетрагидрофуран (ТГФ), NMP, диоксан или дихлорметан, и подвергают сочетанию с подходящим амином формулы NH(R1-BOC)-R2 с получением соответствующего диамида (VI). Для этого, как описано выше, используют традиционный конденсирующий реагент, такой как TOTU, PyBrop, PyBop, HATU или EDC, и подходящее основание, такое как аминовые основания, такие как основания Хенига, NEt3 или DMAP.
После удаления защитных групп, таких как защитная группа Boc по N(R1)-R2, с использованием стандартных способов, таких как использование TFA-CH2Cl2 и удаление ацетильных групп путем щелочного гидролиза, например, с использованием NaOH при комнатной температуре (КТ), получают целевые соединения (I). (Для альтернативных способов удаления защитных групп, см., например, Kocienski, P.J., Protecting Groups, Thieme Verlag 1994, pp. 1-16). Этот путь дает соединения типа I, где R6=H. Соединения, где R6 является отличным от H, в принципе, могут быть получены из этих соединений, в соответствии с известными стандартными способами (например, образование сложного эфира или карбамоилирования).
В альтернативном способе (C) моноамид винной кислоты (IV) растворяют непосредственно в растворителе, таком как диметилформамид (ДМФА), тетрагидрофуран (ТГФ), NMP, диоксан или CH2Cl2, и подвергают сочетанию с подходящим амином формулы NH(R1-BOC)-R2 с получением соответствующего диамида (V). Для этого используют традиционный конденсирующий реагент, такой как TOTU, PyBrop, PyBop, Hatu или EDC, и подходящее основание, такое как аминовые основания, такие как основания Hünig, NEt3 или DMAP. После удаления защитных групп, таких как защитные группы BOC по N(R1)-R2, с использованием стандартных способов, например, TFA-CH2Cl2 при комнатной температуре, получают целевые соединения (I). Соединения, где R6 является отличным от H, в принципе, также могут быть получены в соответствии с этим способом.
Настоящее изобретение, кроме того, относится к способу получения соединения формулы (I) и/или стереоизомерной формы соединения формулы (I) и/или физиологически приемлемой соли соединения формулы (I), который включает:
a) взаимодействие соединения формулы (II)
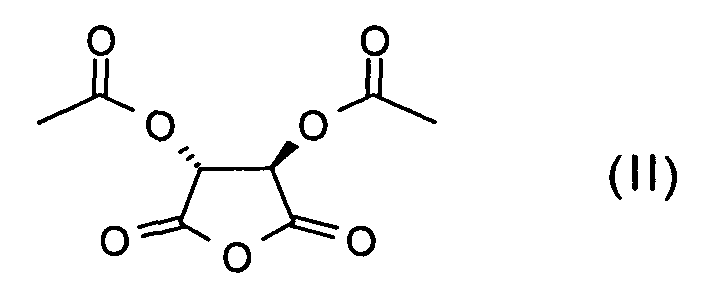
с соединением NH(R3)(R4) с получением соединения формулы (III)
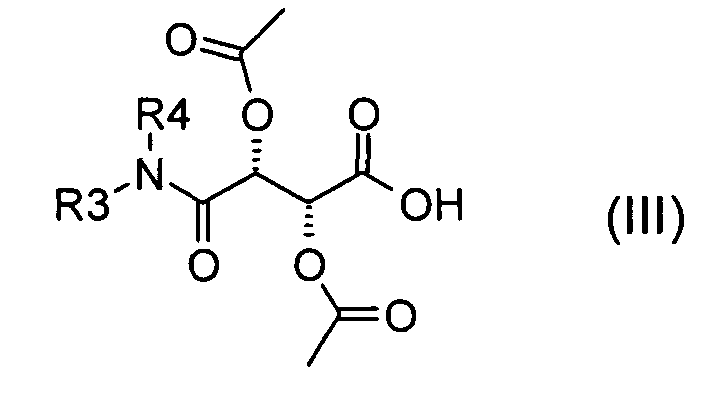
где радикалы R3 и R4 имеют значения, определенные для формулы (I), и взаимодействие соединения формулы (III) с соединением NH(R2)(R1)-Boc с получением соединения формулы (VI)
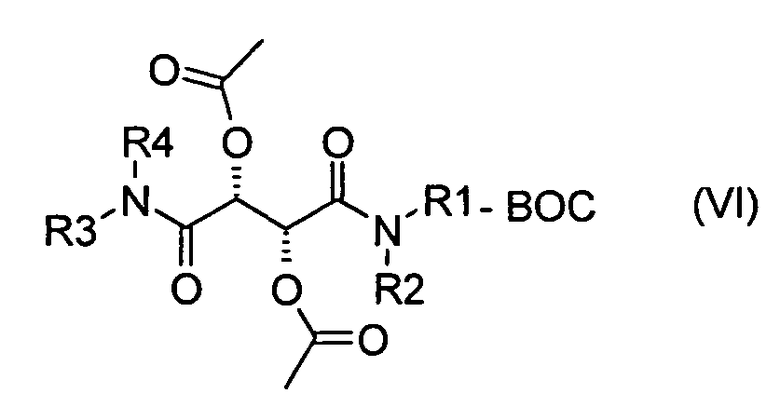
где радикалы R1, R2, R3 и R4 имеют значения, определенные для формулы (I), и Boc представляет собой защитную группу бутоксикарбонил, с последующим взаимодействием с получением соединения формулы (I), или
b) взаимодействие соединения формулы (IV)
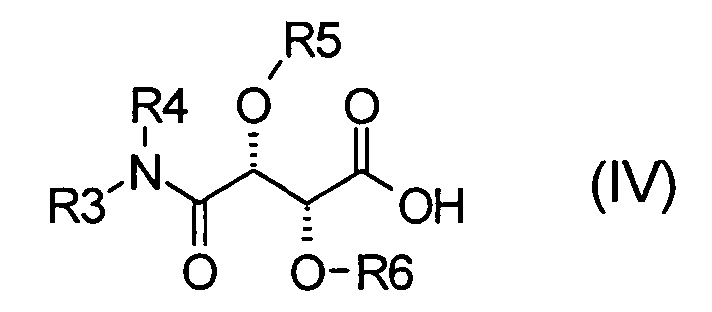
где радикалы R3, R4, R5 и R6 имеют значения, определенные для формулы (I), с соединением NH(R2)(R1)-Boc с получением соединения формулы (V)
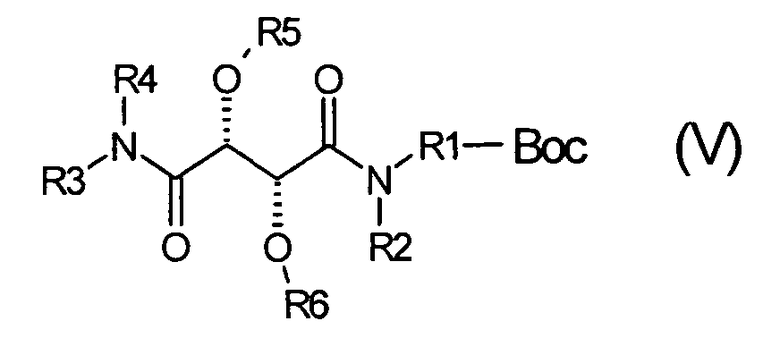
где радикалы R1, R2, R3, R4, R5 и R6 имеют значения, определенные для формулы (I), и Boc представляет собой защитную группу бутоксикарбонил, с последующим взаимодействием с получением соединения формулы (I), или
c) либо выделение соединения формулы (I), полученного в соответствии со способом a) или b) в свободной форме, либо выделение его из физиологически неприемлемых солей, либо, в случае присутствия кислотных или основных групп, преобразование его в физиологически приемлемые соли, или
d) разделение соединения формулы (I), полученного в соответствии со способом a) или b), или подходящего предшественника формулы (I), которые в силу своей химической структуры существуют в энантиомерной или диастереомерной формах, на чистые энантиомеры или диастереомеры путем солеобразования с энантиомерно чистыми кислотами или основаниями, хроматографии с хиральными стационарными фазами или дериватизации посредством хиральных энантиомерно чистых соединений, таких как аминокислоты, разделения, полученных таким образом диастереомеров, и удаления хиральных вспомогательных групп.
Соединение формулы (I), полученное в соответствии со Схемой 1, или подходящий предшественник формулы (I), которые в силу своей химической структуры существуют в энантиомерных формах, можно разделить на чистые энантиомеры (способ d) путем солеобразования с энантиомерно чистыми кислотами или основаниями, хроматографии с хиральными стационарными фазами или дериватизации при помощи хиральных энантиомерно чистых соединений, таких как аминокислоты, разделения полученных таким образом диастереомеров, и удаления хиральных вспомогательных групп, или
соединение формулы (I), полученное в соответствии со Схемой 1, либо может быть выделено в свободной форме, либо, в случае присутствия кислотных или основных групп, преобразовано в физиологически приемлемые соли (способ c).
В способе d) соединение формулы (I), если оно существует в виде смеси диастереомеров или энантиомеров, или если оно получено избранным путем синтеза в виде их смеси, разделяют на чистые стереоизомеры, либо путем хроматографии на необязательно хиральном материале-носителе, либо, если рацемическое соединение формулы (I) способно к образованию соли, путем фракционированной кристаллизации образованных диастереомерных солей с использованием оптически активного основания или кислоты в качестве вспомогательного вещества. Подходящие хиральные стационарные фазы для разделения энантиомеров методом тонкослойной или колоночной хроматографии представляют собой, например, носители на основе модифицированного силикагеля ("Pirkle phases") и высокомолекулярные углеводы, такие как триацетилцеллюлоза. Для аналитических целей методы газовой хроматографии с хиральными стационарными фазами также можно использовать после соответствующей дериватизации, как это известно специалистам в данной области. Для разделения энантиомеров рацемических карбоновых кислот осуществляют образование диастереомерных солей с разной растворимостью с использованием оптически активного, обычно коммерчески доступного основания, такого как (-)-никотиновое, (+)- и (-)-фенилэтиламиновое, хининовое основания, L-лизин или L- и D-аргинин, более плохо растворимый компонент выделяют в виде твердого вещества, более легко растворимый диастереомер осаждают из маточного раствора и чистые энантиомеры получают из полученных таким образом диастереомерных солей. Способом, являющимся в принципе идентичным, рацемические соединения формулы (I), которые содержат основную группу, такую как аминогруппа, могут быть преобразованы в чистые энантиомеры с использованием оптически активных кислот, таких как (+)-камфор-10-сульфоновая кислота, D- и L-винная кислота, D- и L-молочная кислота и (+) и (-)-миндальная кислота. Хиральные соединения, которые содержат функциональные группы спирта или амина, также могут быть преобразованы с использованием подходяще активированных или необязательно N-защищенных энантиомерно чистых аминокислот в соответствующие сложные эфиры или амиды, или, наоборот, хиральные карбоновые кислоты могут быть преобразованы с использованием карбокси-защищенных энантиомерно чистых аминокислот в амиды, или, используя энантиомерно чистые гидроксикарбоновые кислоты, такие как молочная кислота, в соответствующие хиральные сложные эфиры. Затем хиральность аминокислотного или спиртового радикала, введенного в энантиомерно чистой форме, можно использовать для разделения изомеров путем осуществления разделения присутствующих диастереомеров при помощи кристаллизации или хроматографии с подходящими стационарными фазами и затем удаления захваченной хиральной группы также с использованием подходящих способов.
Кроме того, в случае некоторых соединений по настоящему изобретению возникает возможность использования диастереомерно или энантиомерно чистых исходных продуктов для получения кольцевых структур. Таким путем, можно использовать другие или упрощенные способы для очистки конечных продуктов. Такие исходные продукты получали заранее в энантиомерно или диастереомерно чистой форме, в соответствии со способами, известными из литературы. Это означает, в частности, что в синтезе структур, составляющих скелет соединения, используют либо энантиоселективные способы, либо также энантиомерное (или диастереомерное) разделение осуществляют на более ранней стадии синтеза, а не только на стадии конечных продуктов. Подобным образом, достигается упрощение разделения с осуществлением процедуры в две или более стадий.
Кислотные или основные продукты соединения формулы (I) могут присутствовать в форме их солей или в свободной форме. Фармакологически приемлемые соли являются предпочтительными, например, соли щелочных или щелочно-земельных металлов, такие как гидрохлориды, гидробромиды, сульфаты, гемисульфаты, все возможные фосфаты и соли аминокислот, природных оснований или карбоновых кислот.
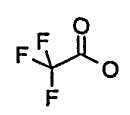
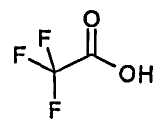
Получение физиологически приемлемых солей из соединений формулы (I), способных к образованию соли, включая их стереоизомерные формы, в соответствии со способом стадии c) осуществляют способом, известным per se. С основными реагентами, такими как гидроксиды, карбонаты, гидрокарбонаты, алкоксиды и аммиак или органические основания, например триметил- или триэтиламин, этаноламин, диэтаноламин или триэтаноламин, трометамол, или, альтернативно, основными аминокислотами, например лизином, орнитином или аргинином, соединения формулы (I) образуют стабильные соли щелочных металлов, щелочно-земельных металлов или необязательно замещенные аммониевые соли. Если соединения формулы (I) содержат основные группы, стабильные кислотно-аддитивные соли также могут быть получены с использованием сильных кислот. Для этого подходящими являются неорганические и органические кислоты, такие как хлористоводородная, бромистоводородная, серная, гемисерная, фосфорная, метансульфоновая, бензолсульфоновая, п-толуолсульфоновая, 4-бромбензолсульфоновая, циклогексиламидосульфоновая, трифторметилсульфоновая, 2-гидроксиэтансульфоновая, уксусная, щавелевая, винная, янтарная, глицерофосфорная, молочная, яблочная, адипиновая, лимонная, фумаровая, малеиновая, глюконовая, глюкуроновая, пальмитиновая или трифторуксусная кислота.
Изобретение также относится к лекарственным средствам, которые включают эффективное количество, по меньшей мере, одного соединения формулы (I) и/или физиологически приемлемой соли соединения формулы (I) и/или, необязательно, стереоизомерной формы соединения формулы (I), вместе с фармацевтически подходящим и физиологически приемлемым носителем, добавкой и/или другими активными и вспомогательными веществами.
Принимая во внимание их фармакологические свойства, соединения по настоящему изобретению являются подходящими, например, для профилактики, вторичной профилактики и терапии всех тех заболеваний, которые можно лечить путем ингибирования фактора свертывания крови IXa. Таким образом, соединения по настоящему изобретению являются подходящими в качестве ингибиторов как для профилактического, так и для терапевтического введения человеку. Они являются подходящими как для неотложного лечения, так и для долговременной терапии. Соединения формулы (I) можно использовать для пациентов, страдающих от расстройств здоровья или заболеваний, которые сопровождают тромбозы, эмболии, способность к гиперкоагуляции или фиброзные изменения.
Они включают инфаркт миокарда, стенокардию и все другие формы острого коронарного синдрома, удар, заболевания периферических сосудов, тромбоз глубоких вен, эмболию сосудов легких, эмболические или тромботические явления, вызванные сердечной аритмией, сердечно-сосудистые явления, такие как рестеноз после реваскуляризации, ангиопластики и подобных вмешательств, таких как имплантации стента и операции, связанные с шунтированием. Кроме того, соединения формулы (I) можно использовать при всех вмешательствах, которые приводят к контактированию крови с посторонними веществами, как у пациентов с диализом и у пациентов с постоянными катетерами. Соединения формулы (I) также можно использовать для снижения риска тромбоза после хирургического вмешательства, такого как операции на коленных и бедренных суставах.
Соединения формулы (I) являются подходящими для лечения пациентов с диссеминированным внутрисосудистым свертыванием, сепсисом и другими внутрисосудистыми явлениями, которые сопровождают воспаление. Кроме того, соединения формулы (I) являются подходящими для профилактики и лечения пациентов с атеросклерозом, диабетом и метаболическим синдромом и их осложнений. Расстройства гемостатической системы (например фибриновые отложения) вовлечены в механизмы, которые приводят к росту опухоли и метастазам опухоли, и в воспалительные и дегенеративные заболевания суставов, такие как ревматоидный артрит и артроз. Соединения формулы (I) являются подходящими для замедления или профилактики таких процессов.
Другие показания для применения соединений формулы (I) включают фиброзные изменения легких, такие как хроническое обструктивное легочное заболевание, респираторный дистресс-синдром взрослых (ARDS), и глаз, такие как фибриновые отложения после глазных операций. Соединения формулы (I) также являются подходящими для профилактики и/или лечения образования рубцов.
Лекарственные средства по настоящему изобретению можно вводить путем перорального введения, путем ингаляции, ректального или чрескожного введения или путем подкожной, внутрисосудистой, интраперитонеальной или внутривенной инъекции. Пероральное введение является предпочтительным. Возможно покрытие стентов соединениями формулы (I), а также других поверхностей, которые контактируют с кровью в организме.
Настоящее изобретение также относится к способу получения лекарственного средства, который включает приведение, по меньшей мере, одного соединения формулы (I) в подходящую для введения форму с использованием фармацевтически подходящего и физиологически приемлемого носителя и, необязательно, других подходящих активных веществ, добавок или вспомогательных веществ.
Подходящие формы твердых или галеновых препаратов представляют собой, например, гранулы, порошки, таблетки с покрытием, таблетки, (микро)капсулы, суппозитории, сиропы, соки, суспензии, эмульсии, капли или растворы для инъекций и препараты с пролонгированным высвобождением активного вещества, для получения которых используют традиционные эксципиенты, такие как носители, разрыхлители, связующие, агенты покрытия, вещества для создания объема, агенты скольжения или смазывающие вещества, отдушки, подсластители и солюбилизаторы. Можно указать такие часто используемые вспомогательные вещества, как карбонат магния, диоксид титана, лактоза, маннит и другие сахара, тальк, лактоза, желатин, крахмал, целлюлоза и ее производные, животные и растительные масла, такие как масло из печени трески, подсолнечное, арахисовое или кунжутное масло, полиэтиленгликоль и растворители, такие как, например, стерильная вода и одно- или многоатомные спирты, такие как глицерин.
Предпочтительно фармацевтические препараты получают и вводят в дозируемых единицах, где каждая единица содержит в качестве активного составляющего определенную дозу соединения формулы (I) по настоящему изобретению. В случае твердых дозируемых единиц, таких как таблетки, капсулы, таблетки с покрытием или суппозитории, эта доза может составлять приблизительно 1000 мг, но предпочтительно приблизительно от 50 до 300 мг, а в случае растворов для инъекций в ампулах приблизительно 300 мг, но предпочтительно приблизительно от 10 до 100 мг.
Для лечения взрослого пациента с массой тела приблизительно 70 кг, в зависимости от эффективности соединения формулы (I), можно указать суточную дозу приблизительно от 2 до 1000 мг активного вещества, предпочтительно приблизительно от 50 до 500 мг. Однако в некоторых обстоятельствах, более высокая или более низкая доза также может быть подходящей. Суточную дозу можно вводить как путем разового введения в виде единой дозы, либо в виде нескольких более мелких дозируемых единиц и путем нескольких введений подразделенных доз с определенными интервалами.
Соединения формулы (I) можно вводить как в виде монотерапии, так и в сочетании или вместе со всеми антитромботическими (антикоагулянтами и ингибиторами агрегации тромбоцитов), тромболитическими (активаторы плазминогена любого типа), другими профибринолитически активными веществами, гипотензивными средствами, регуляторами сахара в крови, средствами, снижающими уровень липидов, и средствами против аритмии.
Примеры
Конечные продукты обычно определяют масс-спектроскопическими методами (FAB, ESI-MS) и методом 1H-ЯМР, в каждом случае указывается основной пик или два основных пика. Температура указана в градусах Цельсия, Yld. означает выход. Используемые аббревиатуры либо расшифровываются, либо представляют собой традиционные обозначения.
Если не указано иное, хроматографические разделения осуществляли на силикагеле с использованием смесей этилацетат/гептан в качестве элюентов. Препаративные разделения на силикагеле (ВЭЖХ) с обращенной фазой (ОФ) осуществляли, если не указано иное, в следующих условиях: колонка Merck Hibar RT 250-25 Lichrospher 100 RP-18e 5мкм, Merck KGaA, Germany, Life Science & Analytics, 64293 Darmstadt; подвижная фаза A: H2O + 0,1% TFA, фаза B: 80% ацетонитрила + 0,1% TFA, скорость потока 25 мл/мин, от 0 до 7 мин 100% A, 7 мин до 22 мин до 100% B, 22 мин до 30 мин 100% B, 30 мин до 33 мин до 100% A, 33 мин до 35 мин 100% A.
Выпаривание растворителей обычно осуществляли при пониженном давлении при 35°C-45°C на роторном испарителе. Если не указано иное, анализы ЖХ/МС осуществляли в следующих условиях:
Способ A:
Колонка: YMC J´shere H80 33×2,1 мм; Waters GmbH, Helfmann-Park 10, 65760 Eschborn, Germany; наполнитель 4 мкм,
Растворитель: ACN+0,05% TFA:H2O+0,05% TFA (скорость потока 1,3 мл/мин)
Градиент: 5:95 (0 мин) до 95:5 (2,5 мин) до 95:5 (3,0 мин)
Ионизация: ESI+
Способ B:
Колонка: YMC J´shere H80 33×2,1 мм; наполнитель 4 мкм,
Растворитель: ACN+0,05% TFA:H2O+0,05% TFA (скорость потока 1 мл/мин)
Градиент: 5:95 (0 мин) до 95:5 (3,4 мин) до 95:5 (4,4 мин)
Ионизация: ESI+
Способ D:
Колонка: YMC J´shere ODS H80 20×2,1 мм наполнитель 4 мкм,
Растворитель: ACN:H2O+0,05% TFA (скорость потока 1 мл/мин)
Градиент: 4:96 (0 мин) до 95:5 (2 мин) до 95:5 (2,4 мин) до 96:4 (2,45 мин)
Ионизация: ESI+
Препаративную ВЭЖХ осуществляли с использованием следующего способа:
Колонка: Waters Atlantis dC18 OBD 30x100 мм 5 мкм; Waters GmbH, Helfmann-Park 10, 65760 Eschborn, Germany
Растворитель: ACN:H2O+0,1%TFA (скорость потока 60 мл/мин)
Градиент: 10:90 (0 мин) до 90:10 (10 мин)
Используемые аббревиатуры:
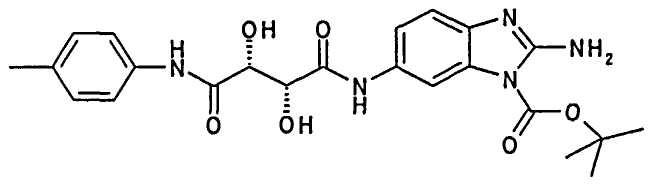
Пример 1
(2R,3R)-N-(1-Аминоизохинолин-6-ил)-2,3-дигидрокси-N′-п-толилсукцинамид; соединение с трифторуксусной кислотой
Стадия 1 способа:
[6-((2R,3R)-2,3-Дигидрокси-3-п-толилкарбамоилпропиониламино)изохинолин-1-ил]-N-дикарбоксиамино трет-бутиловый эфир
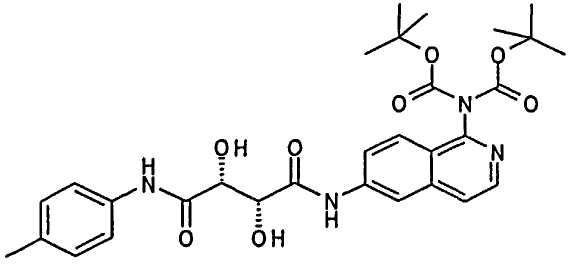
0,037 мл NMM (0,334 ммоль) добавляли к раствору 26,6 мг (2R,3R)-2,3-дигидрокси-N-п-толилянтарной кислоты (0,111 ммоль), 40,0 мг 6-аминоизохинолин-1-ил)-N-дикарбоксиамино трет-бутилового эфира (0,111 ммоль) (6-аминоизохинолин-1-ил)-N-дикарбоксиамино трет-бутиловый эфир получали, как в способе, описанном в WO 2004/072101, стр.108) и 15,1 мг HOAt (0,111 ммоль) в 1,5 мл ДМФА и смесь перемешивали в течение 10 мин. После добавления 52 мг PyBrop (0,111 ммоль), реакционную смесь перемешивали при комнатной температуре в течение 42 часов. Реакционную смесь фильтровали и очищали при помощи препаративной ВЭЖХ. Очищенные фракции продукта лиофилизировали. Получали 4 мг белого твердого вещества.
Выход: 6% ЖХ/МС (Способ D) (М+Н)+ 581
Стадия 2 способа:
(2R,3R)-N-(1-Аминоизохинолин-6-ил)-2,3-дигидрокси-N′-п-толилсукцинамид; соединение с трифторуксусной кислотой
1 мл TFA добавляли к раствору соединения, полученного на стадии 1 способа (4 мг, 6,9 мкмоль), в 3 мл DCM и смесь перемешивали при комнатной температуре в течение 2 часов. Растворители отгоняли при пониженном давлении, остаток растворяли в МеОН и воде, раствор затем лиофилизировали в течение ночи и получали 4 мг указанного в заголовке соединения в виде белого твердого вещества. Чистота 85%.
ЖХ/МС (Способ В) 380,15 (Rt=1,05 мин, 97%)
1Н ЯМР (500 МГц, DMSO-d6) δ (м.д.): 1,73 (примесь), 2,26 (с, 3Н), 3,01 (примесь), 4,51 (дд, 1Н), 4,57 (дд, 1Н), 6,05 (д, 1Н), 6,22 (д, 1Н), 7,13 (д, 2Н), 7,18 (д, 1Н), 7,62 (м, ЗН), 8,04 (дд, 1Н), 8,48 (кв., 2Н), 8,76 (с, 2Н), 9,55 (с, 1Н), 10,29 (с, 1Н), 12,71 (с, 1Н)
Пример 2:
(2R,3R)-N-(2-Амино-3Н-бензимидазол-5-ил)-2,3-дигидрокси-N′-п-толилсукцинамид; соединение с трифторуксусной кислотой
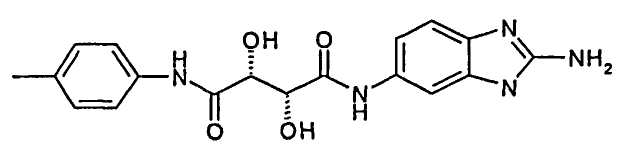
Стадия 1 способа:
(2R,3R)-2-Амино-6-(2,3-дигидрокси-3-п-толилкарбамоилпропиониламино)-бензимидазол-1-карбоксиамино трет-бутиловый эфир
119 мг (2R,3R)-2,3-дигидрокси-N-п-толилянтарной кислоты (0,5 ммоль) и 124 мг трет-бутил 2,5-диаминобензимидазол-1-карбоксилата (0,5 ммоль) (трет-бутил 2,5-диамино-N-Вос-бензимидазол-1-карбоксилат был получен в соответствии с Международной заявкой WO 2002/042273) растворяли в 5 мл ДМФА. 74 мг HOAt (0,55 ммоль), 180 мг PyBrop (0,55 ммоль) и 193 мг DIPEA (1,5 ммоль) растворяли в смеси 1,5 мл DCM и 1,5 мл ДМФА и добавляли к реакционной смеси. После перемешивания в течение ночи смесь разбавляли этилацетатом. Органическую фазу промывали водным раствором гидрокарбоната натрия и обычным солевым раствором, сушили над сульфатом натрия, фильтровали и растворители удаляли при пониженном давлении. Указанное в заголовке соединение получали в виде масла.
ЖХ/МС (Способ D) (M+H-tBu)+ 414
Стадия 2 способа:
(2R,3R)-N-(2-Амино-3Н-бензимидазол-5-ил)-2,3-дигидрокси-N′-п-толилсукцинамид; соединение с трифторуксусной кислотой
Остаток со стадии 1 способа растворяли в смеси 2 мл DCM и 2 мл TFA. После перемешивания при комнатной температуре в течение 2 часов растворители удаляли при пониженном давлении и осуществляли очистку с использованием ВЭЖХ. 90 мг (Выход: 37%) указанного в заголовке соединения получали в виде белого твердого вещества.
ЖХ/МС (Способ А) 370,15 (Rt=1,0 мин, 100%)
1Н ЯМР (400 МГц, DMSO-d6) δ (м.д.): 2,23 (с, 3Н), 4,47 (т, 2Н), 6,00 (дд, 2Н), 7,12 (д, 2Н), 7,28 (с, 1Н), 7,48 (д, 1Н), 7,62 (д, 2Н), 8,03 (с, 1Н), 8,39 (ушир.с, 2Н), 9,51 (с, 1Н), 9,78 (с, 1Н)
Пример 3:
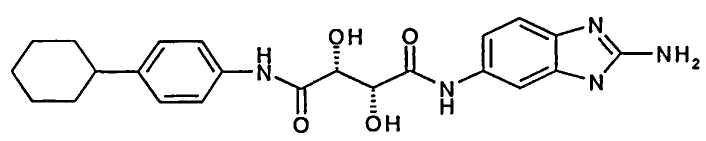
(2R,3R)-N-(2-Амино-3Н-бензимидазол-5-ил)-N′-(4-циклогексилфенил)-2,3-дигидроксисукцинамид; соединение с трифторуксусной кислотой
Стадия 1 способа:
(2R,3R)-2,3-Диацетокси-N-(4-циклогексилфенил)янтарная кислота
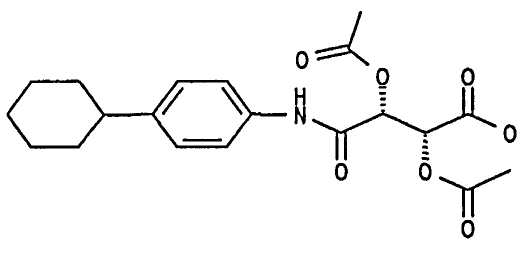
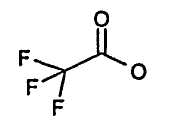
216 мг (+)-диацетил-L-винного ангидрида (1 ммоль) и 263 мг 4-циклогексилфениламина (1,5 ммоль) и 200 мкл N-метилморфолина растворяли в 5 мл ДМФА и смесь перемешивали в течение 3 часов при комнатной температуре. Смесь разбавляли этилацетатом. Органическую фазу промывали 1 н. раствором HCl и обычным солевым раствором, сушили над сульфатом натрия, фильтровали и растворители удаляли при пониженном давлении. 430 мг указанного в заголовке соединения получали в виде масла (Выход приблизительно 100%). ЖХ/МС (Способ D) (М+Н)+ 392
Стадия 2 способа:
трет-Бутил (2R,3R)-2-амино-6-[2,3-диацетокси-3-(4-циклогексилфенилкарбамоил)пропиониламино]бензимидазол-1-карбоксилат
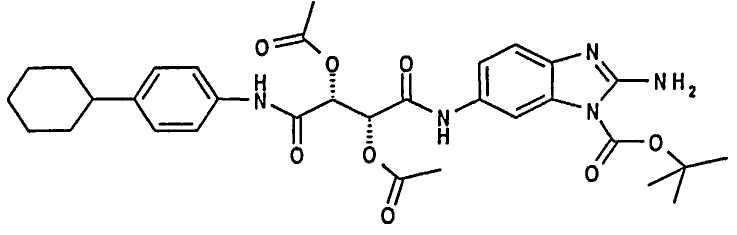
118 мг соединения, полученного на Стадии 1 способа (0,3 ммоль), и 110 мкл N-метилморфолина растворяли в 2 мл ДМФА при 0°С. Добавляли 115 мг TDBTU (0,33 ммоль) и смесь перемешивали еще в течение 30 мин. Добавляли 82 мг трет-бутил 2,5-диаминобензимидазол-1-карбоксилата (0,33 ммоль) и смесь перемешивали при 0°С в течение 4 часов. Смесь разбавляли этилацетатом. Органическую фазу промывали водным раствором гидрокарбоната натрия и обычным солевым раствором, сушили над сульфатом натрия, фильтровали и растворители удаляли при пониженном давлении. Указанное в заголовке соединение получали в виде масла. ЖХ/МС (Способ D) (М+Н)+ 622
Стадия 3 способа:
(2R,3R)-2-Ацетокси-2-(2-амино-3Н-бензимидазол-5-илкарбамоил)-1-(4-циклогексилфенилкарбамоил)этилацетат; соединение с трифторуксусной кислотой
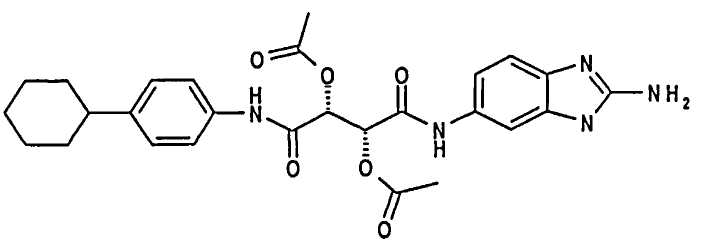
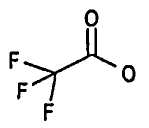
Соединение со стадии 2 способа растворяли в 3 мл DCM и 1,5 мл TFA и смесь перемешивали при комнатной температуре в течение 2 часов. Указанное в заголовке соединение получали в виде масла.
Стадия 4 способа:
(2R,3R)-N-(2-Амино-3Н-бензимидазол-5-ил)-N′-(4-циклогексилфенил)-2,3-дигидроксисукцинамид; соединение с трифторуксусной кислотой
Масло со стадии 3 способа растворяли в 3 мл метанола и обрабатывали при помощи 500 мкл 5 н раствора NaOH в течение ночи. Растворители отгоняли при пониженном давлении, остаток растворяли в 2 мл TFA и упаривали. Остаток очищали при помощи ВЭЖХ и получали 7 мг указанного в заголовке соединения в виде белого твердого вещества. ЖХ/МС (Способ А) 437,21 (Rt=1,39 мин, 100%)
1Н ЯМР (400 МГц, DMSO-d6) δ (м.д.): 1,16-1,42 (м, 5Н), 1,68-1,83 (м, 5Н), 4,49 (дд, 2Н), 5,99 (дд, 2Н), 7,17 (д, 2Н), 7,25 (ушир.д, 1Н), 7,45 (д, 1Н), 7,62 (д, 2Н), 8,02 (ушир.с, 1Н), 8,36 (ушир.с, 2Н), 9,53 (с, 1Н), 9,78 (с, 1Н)
Пример 4:
(2R,3R)-N-(4-Аминометилфенил)-2,3-дигидрокси-N'-п-толилсукцинамид; соединение с трифторуксусной кислотой
Стадия 1 способа:
трет-Бутил [4-((2R,3R)-2,3-дигидрокси-3-п-толилкарбамоилпропиониламино)бензил]карбамат
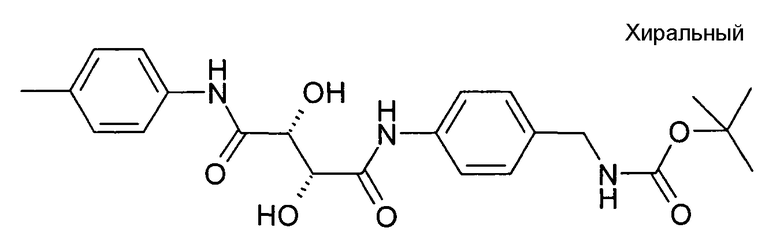
По аналогии с Примером 1, стадия 1 способа, 33 мг (0,15 ммоль) трет-бутил (4-аминобензил)карбамата и 36 мг (0,15 ммоль) (2R,3R)-2,3-дигидрокси-N-п-толилянтарной кислоты растворяли в 1 мл DCM и 1 мл ДМФА и последовательно обрабатывали при помощи 78 мкл DIPEA (0,45 ммоль), 22,5 мг HOAt (0,165 ммоль) и 76,9 мг (0,165 ммоль) PyBrop. Без какой-либо дальнейшей обработки полученную партию продукта фильтровали и очищали при помощи ВЭЖХ. Содержащие продукт фракции лиофилизировали.
Стадия 2 способа:
(2R,3R)-N-(4-Аминометилфенил)-2,3-дигидрокси-N'-п-толилсукцинамид; соединение с трифторуксусной кислотой
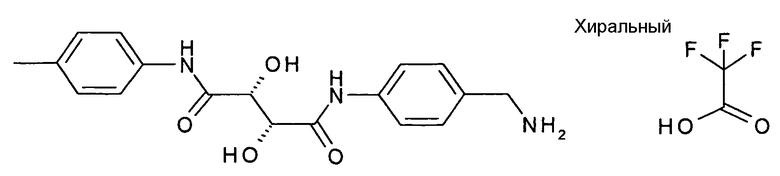
Продукт, полученный на стадии 1, подвергали взаимодействию способом, аналогичным описанному в примере 1; стадия 2 способа, затем смесь концентрировали, обрабатывали водой и лиофилизировали.
Выход: 15,5 мг (23% от 2 стадий).
ЖХ/МС (Способ A) M-NH2=327,36 (Rt=0,88 мин, 93%)
1H ЯМР (500 МГц, DMSO-d6) δ (м.д.): 2,25 (с, 3H), 3,98 (ушир.с, 2H), 4,49 (м, 2H), 5,99 (д, 1H), 6,09 (д, 1H), 7,12 (д, 2H), 7,39 (д, 2H), 7,62 (д, 2H), 7,79 (д, 2H), 8,12 (ушир.с, 3H), 9,51 (с, 1H), 9,72 (с, 1H).
Пример 5:
(2R,3R)-N-(4-Карбамимидоилфенил)-2,3-дигидрокси-N'-п-толилсукцинамид; соединение с трифторуксусной кислотой
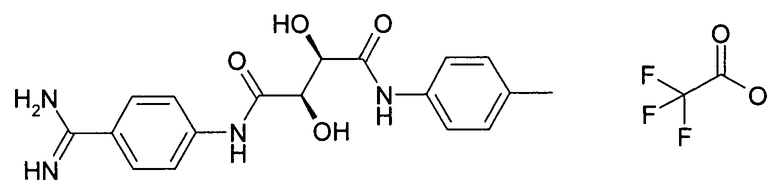
Стадия 1 способа:
(2R,3R)-2,3-Диацетокси-N-(4-карбамимидоилфенил)янтарная кислота; соединение с трифторуксусной кислотой
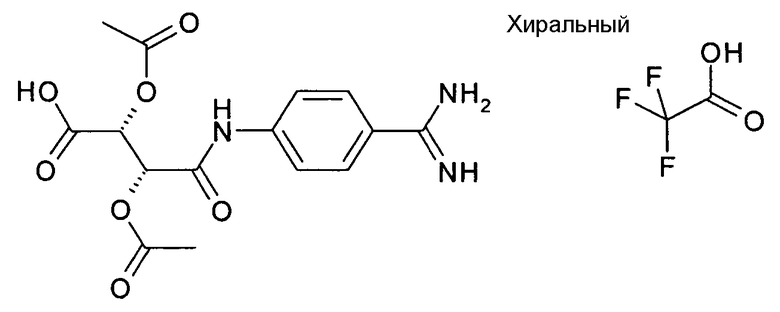
500 мг (2,39 ммоль) дигидрохлорида 4-аминобензамидина и 519 мг (2,40 ммоль) (3R,4R)-4-ацетокси-2,5-диоксотетрагидрофуран-3-илацетата растворяли в 2 мл пиридина и 2 мл ДМФА и обрабатывали при помощи 25 мг 4-DMAP. Смесь затем нагревали в течение 1 часа при 100°C. Смесь фильтровали и очищали с использованием ВЭЖХ. Содержащие продукт фракции объединяли и лиофилизировали.
Выход: 130 мг (12%).
Стадия 2 способа:
(2R,3R)-N-(4-Карбамимидоилфенил)-2,3-дигидрокси-N'-п-толилсукцинамид; соединение с трифторуксусной кислотой
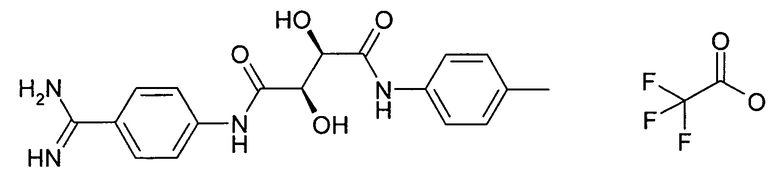
52 мг (0,11 ммоль) производного, полученного на стадии 1 способа, растворяли в 1 мл ДМФА и затем обрабатывали при помощи 15 мг (0,13 ммоль) толуидина, 62 мг (0,13 ммоль) PyBrop, 18 мг (0,13 ммоль) HOAt и 65 мкл (0,58 ммоль) NMM. После перемешивания при комнатной температуре в течение 1 часа добавляли 2 мл MeOH и 90 мг метоксида натрия. После того как преобразование завершалось, смесь фильтровали и очищали при помощи ВЭЖХ.
Выход: 19 мг (36% от 2 стадий).
ЖХ/МС (Способ A) 357,43 (Rt=0,88 мин, 100%)
1H ЯМР (500 МГц, DMSO-d6) δ (м.д.): 2,26 (с, 3H), 4,48 (м, 1H), 4,53 (м, 1H), 6,01 (м, 1H), 6,16 (м, 1H), 7,13 (д, 2H), 7,63 (д, 2H), 7,81 (д, 2H), 8,01 (д, 2H), 8,86 (ушир.с, 2H), 9,20 (ушир.с, 2H), 9,53 (с, 1H), 10,13 (с, 1H).
Соединения в таблице 1 ниже были получены таким же путем, как описано в представленных выше примерах.
Фармакологические примеры
Метод определения фактора IXa
Полученные в примерах вещества испытывали на ингибирование ферментативной активности FIXa с использованием субстрата PEFA 3107 (Pentapharm/Loxo; via S. Black GmbH, Baumstrasse 41, 47198 Duisburg, Germany; Pr. No. 095-20) и фактора IXa (Calbiochem, фирма Merck KGaA поставляет Calbiochem на рынок в Германии, Life Science & Analytics, 64293 Darmstadt; Pr. No. 233290). В этом способе 28 мкл испытываемого буфера (50 мМ α,α,α-трис(гидроксиметил)метиламина (TRIS), 100 мМ NaCl, 5 мМ CaCl2, 0,1% бычьего сывороточного альбумина, pH 7,4) и 10 мкл фактора IXa (конечная концентрация в испытываемой партии 277 нМ) добавляли к 2 мкл 10 мМ раствора соответствующих испытываемых веществ в диметилсульфоксиде и смесь инкубировали в течение 15 минут при комнатной температуре в 96-полулуночном микротитровальном планшете. Ферментную реакцию начинали путем добавления 10 мкл субстрата (1 мМ исходного раствора в воде). Прохождение реакции отслеживали при 405 нм в считывающем устройстве для микротитровальных планшетов (SpectraMax plus 384; Molecular Devices) в течение 15 минут.
ИК50 рассчитывали из усредненных значений (определение в двух повторах) серии разведений испытываемого вещества с использованием программы Grafit 4 (Erithacus Software, UK). Константы ингибирования (Ki) рассчитывали в соответствии с уравнением Cheng Prusoff Ki=ИК50/(1+(S/Km), где S=концентрация испытываемого субстрата в испытании и Km=константа Michaelis-Menten.
Таблица 2 представляет результаты.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИЗОСЕРИНОВЫЕ ПРОИЗВОДНЫЕ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ IXA | 2007 |
|
RU2446157C2 |
| АЗАИНДОЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Xa | 2004 |
|
RU2330853C2 |
| СОЛИ ТРИАЗОЛИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PAR1, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2009 |
|
RU2494100C2 |
| МОЧЕВИНА И СУЛЬФАМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ TAFIA | 2007 |
|
RU2459619C2 |
| ИНГИБИТОРЫ ФАКТОРА VIIA | 2000 |
|
RU2248359C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРА Ха | 2004 |
|
RU2346944C2 |
| ПРОИЗВОДНЫЕ (ТИО)МОЧЕВИНЫ, ИНГИБИРУЮЩИЕ ФАКТОР VIIa, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2286337C2 |
| N-ГУАНИДИНОАЛКИЛАМИДЫ, ИХ ПОЛУЧЕНИЕ, ИХ ПРИМЕНЕНИЕ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ | 2000 |
|
RU2253651C2 |
| ПРОИЗВОДНЫЕ КАЛИХЕАМИЦИНА И ИХ КОНЪЮГАТЫ "АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО" | 2018 |
|
RU2732568C1 |
| АГОНИСТЫ 5-НТ4-РЕЦЕПТОРОВ ДЛЯ ЛЕЧЕНИЯ ДЕМЕНЦИИ | 2011 |
|
RU2569733C2 |
Настоящее изобретение относится к соединениям формулы I и/или ко всем изомерным формам соединения формулы I, и/или к смесям этих форм в любом соотношении, и/или к физиологически приемлемым солям соединения формулы I, где R1 представляет собой: 1) -(C6-C14)-арил-Z, где Z представляет собой аминогруппу, аминометилен или амидиногруппу, и где арил является незамещенным, 2) Het-Z, где Z представляет собой аминогруппу, аминометилен или амидиногруппу, и где Het выбран из бензимидазолила и изохинолинила, и Het является незамещенным или монозамещенным группой Т, R2 и R4 являются одинаковыми, и каждый представляет собой атом водорода, R3 представляет собой: 1) -(С0)-алкилен-(С6-С14)-арил, где арил является незамещенным или мономещенным группой Т, 2) -(С0)-алкилен-(С6-С14)-арил-Q-(С6-С14)-арил, где оба арила являются незамещенными, 3) -(С0-С4)-алкилен-(С6-С14)-арил-Q-Het, где арил и Het в каждом случае являются незамещенными, и Het представляет собой пиперидинил, Q представляет собой ковалентную связь или -О-, Т представляет собой: 1) галоген, 2) -(C1-С6)-алкил, где алкил является незамещенным, 3) -(С3-С8)-циклоалкил или 4) -NO2, R5 и R6 являются одинаковыми, и каждый представляет собой атом водорода. Также изобретение относится к применению соединения формулы I для получения лекарственного средства. Технический результат: получены новые соединения, полезные в качестве ингибиторов фактора свертывания IXA. 2 н. и 4 з.п. ф-лы, 2 табл., 5 пр.
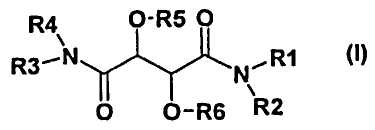
1. Соединение формулы I
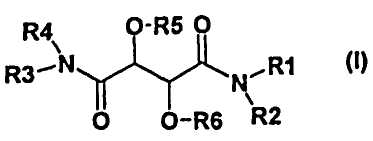
и/или все изомерные формы соединения формулы I, и/или смеси этих форм в любом соотношении, и/или физиологически приемлемая соль соединения формулы I, где
R1 представляет собой
1) -(C6-C14)-арил-Z, где Z представляет собой аминогруппу, аминометилен или амидиногруппу и где арил является незамещенным,
2) Het-Z, где Z представляет собой аминогруппу, аминометилен или амидиногруппу и где Het выбран из бензимидазолила и изохинолинила и Het является незамещенным или монозамещенным группой Т,
R2 и R4 являются одинаковыми и каждый представляет собой атом водорода,
R3 представляет собой
1) -(С0)-алкилен-(С6-С14)-арил, где арил является незамещенным или мономещенным группой Т,
2) -(С0)-алкилен-(С6-С14)-арил-Q-(С6-С14)-арил, где оба арила являются незамещенными,
3) -(С0-С4)-алкилен-(С6-С14)-арил-Q-Het, где арил и Het в каждом случае являются незамещенными и Het представляет собой пиперидинил,
Q представляет собой ковалентную связь или -О-, Т представляет собой
1) галоген,
2) -(С1-С6)-алкил, где алкил является незамещенным,
3) -(С3-С8)-циклоалкил или
4) -NO2,
R5 и R6 являются одинаковыми и каждый представляет собой атом водорода.
2. Соединение формулы I по п.1, где R1 представляет собой
1) -(C6-C14)-арил-Z, где арил выбран из группы, состоящей из фенила и нафтила, и где арил является незамещенным и Z представляет собой аминогруппу, аминометилен или амидиногруппу, или
2) Het-Z, где Het выбран из бензимидазолила и изохинолинила и где Het является незамещенным или монозамещенным группой Т, и где Z имеет значения, определенные выше,
R2 и R4 являются одинаковыми и каждый представляет собой атом водорода,
R3 представляет собой
1) -(С0)-алкилен-(С6-С14)-арил, где арил имеет значение, определенное выше, и является незамещенным или монозамещенным группой Т,
2) -(С0)-алкилен-(С6-С14)-арил-Q-(С6-С14)-арил, где два арила в каждом случае независимо друг от друга имеют значения, определенные выше, и оба являются незамещенными,
3) -(С0-С4)-алкилен-(С6-С14)-арил-Q-Het, где арил имеет значение, определенное выше, и Het представляет собой пиперидинил, и арил и Het оба являются незамещенными,
Q представляет собой ковалентную связь или -О-,
Т представляет собой
1) галоген,
2) -(С1-С6)-алкил, где алкил является незамещенным,
3) -(С3-С6)-циклоалкил или
4) -NO2,
R5 и R6 являются одинаковыми и каждый представляет собой атом водорода.
3. Соединение формулы I по п.1, где
R1 представляет собой карбамимидоилфенил, аминометилфенил или Het-Z, где Het выбран из группы, состоящей из бензимидазолила и изохинолинила и где Z представляет собой аминогруппу или амидиногруппу,
R2 и R4 в каждом случае представляют собой атом водорода,
R3 представляет собой
1) фенил, где фенил является незамещенным или монозамещенным группой Т,
2) -фенил-Q-фенил, где оба фенильных радикала являются незамещенными,
3) фенил-Q-Het-2, где Het-2 представляет собой пиперидинил и где фенил и Het-2 являются незамещенными,
Q представляет собой ковалентную связь или -О-,
Т представляет собой
1) F, Cl или Br,
2) -(С1-С4)-алкил, где алкил являются незамещенным, или
3) -NO2, и
R5 и R6 в каждом случае представляют собой атом водорода.
4. Соединение формулы I по одному или более пп.1-3, которое представляет собой следующее соединение
(2R,3R)-N-(1-аминоизохинолин-6-ил)-2,3-дигидрокси-N′-п-толилсукцинамид,
(2R,3R)-N-(2-амино-3H-бензимидазол-5-ил)-2,3-дигидрокси-N′-п-толилсукцинамид,
(2R,3R)-N-(2-амино-3Н-бензимидазол-5-ил)-N′-(4-циклогексилфенил)-2,3-дигидроксисукцинамид,
(2R,3R)-N-(4-аминометилфенил)-2,3-дигидрокси-N′-п-толилсукцинамид,
(2R,3R)-N-(4-карбамимидоилфенил)-2,3-дигидрокси-N′-п-толилсукцин амид,
(2R,3R)-N-(2-амино-3Н-бензимидазол-5-ил)-N′-(4-фторфенил)-2,3-дигидроксисукцинамид,
(2R,3R)-N-(2-амино-3Н-бензимидазол-5-ил)-N′-(4-хлорфенил)-2,3-дигидроксисукцинамид,
(2R,3R)-N-(2-амино-3Н-бензимидазол-5-ил)-2,3-дигидрокси-N′-фенилсукцинамид,
(2R,3R)-N-(2-амино-3Н-бензимидазол-5-ил)-2,3-дигидрокси-N′-(4-нитрофенил)сукцинамид,
(2R,3R)-N-(2-амино-3Н-бензимидазол-5-ил)-2,3-дигидрокси-N′-(4-изопропилфенил)сукцинамид,
(2R,3R)-N-(2-амино-3Н-бензимидазол-5-ил)-2,3-дигидрокси-N′-(4-пиперидин-1-ил-фенил)сукцинамид или
(2R,3R)-N-(2-амино-3Н-бензимидазол-5-ил)-2,3-дигидрокси-N′-(4-феноксифенил)сукцинамид.
5. Применение соединения формулы I по одному или более пп.1-4 для получения лекарственного средства для профилактики, вторичной профилактики и терапии всех тех заболеваний, которые сопровождают тромбозы, эмболии, способность к гиперкоагуляции или фиброзные изменения.
6. Применение по п.5, где заболевание представляет собой инфаркт миокарда, стенокардию и все другие формы острого коронарного синдрома, удар, заболевания периферических сосудов, тромбоз глубоких вен, эмболию сосудов легких, эмболические или тромботические явления, вызванные сердечной аритмией, сердечнососудистые явления, такие как рестеноз после реваскуляризации и ангиопластики и подобных вмешательств, таких как имплантации стента и операции, связанные с шунтированием, или снижение риска тромбоза после хирургического вмешательства, такого как операции на коленных и бедренных суставах, или диссеминированное внутрисосудистое свертывание, сепсис и другие внутрисосудистые явления, которые сопровождают воспаление, атеросклероз, диабет и метаболический синдром и их осложнения, рост опухоли и метастазы опухоли, воспалительные и дегенеративные заболевания суставов, такие как ревматоидный артрит и артроз, расстройства гемостатической системы, такие как фибриновые отложения, фиброзные изменения легких, такие как хроническое обструктивное легочное заболевание, респираторный дистресс-синдром взрослых, или фибриновые отложения в глазу после глазных операций, или для профилактики и/или лечения образования рубцов.
| В С ЕС О Ю.-^,' !ПДИ'НГСБИВ.": | 0 |
|
SU308364A1 |
| DE 10104598 А1, 08.08.2002 | |||
| Экономайзер | 0 |
|
SU94A1 |
| N-2-(1- R-5-R-6-R- БЕНЗИМИДАЗОЛИЛ)СУКЦИНАМИНОВЫЕ КИСЛОТЫ, ПРОЯВЛЯЮЩИЕ НЕЙРОЛЕПТИЧЕСКУЮ, АНТИГИПОКСИЧЕСКУЮ И АНТИАРИТМИЧЕСКУЮ АКТИВНОСТЬ | 1991 |
|
RU2043344C1 |
Авторы
Даты
2012-03-27—Публикация
2007-08-31—Подача