Изобретение относится к синтезу новых биологически активных химических соединений, конкретно к N-2-(I-R1-5-R2-6-R3-бензимидазолил)-сукцинаминовым кислотам общей формулы I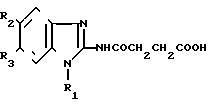 где а) R1=н-C4H9, R2=R3=H;
где а) R1=н-C4H9, R2=R3=H;
б) R1= CH3, R2= R3=Br, которые обладают нейролептической, антигипоксической и антиаритмической активностью, и могут найти применение в медицине.
Аналогами по действию являются аминазин, натрия оксибутират, новокаинамид препараты, широко применяющиеся в медицинской практике.
Целью изобретения является создание более эффективных и менее токсичных по сравнению с приведенными аналогами нейролептических, антигипоксических и антиаритмических препаратов.
Поставленная цель достигается новой химической структурой N-2-(1-R1-5-R2-6-R3-бензимидазолил)-сукцинаминовых кислот формулы I, получаемых при взаимодействии 2-амино-1-R1-5-R2-6-R3-бензимидазолов с янтарным ангидридом в среде сухого диоксана по схеме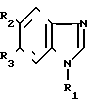 +
+ 

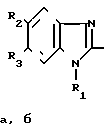 NHCOCH2CH2COOH
NHCOCH2CH2COOH
Выход целевых продуктов составил 65-70% Соединения Ia,б кристаллические бесцветные вещества, растворимые в ДМФА, ДМСО, не растворимые в ацетоне и воде.
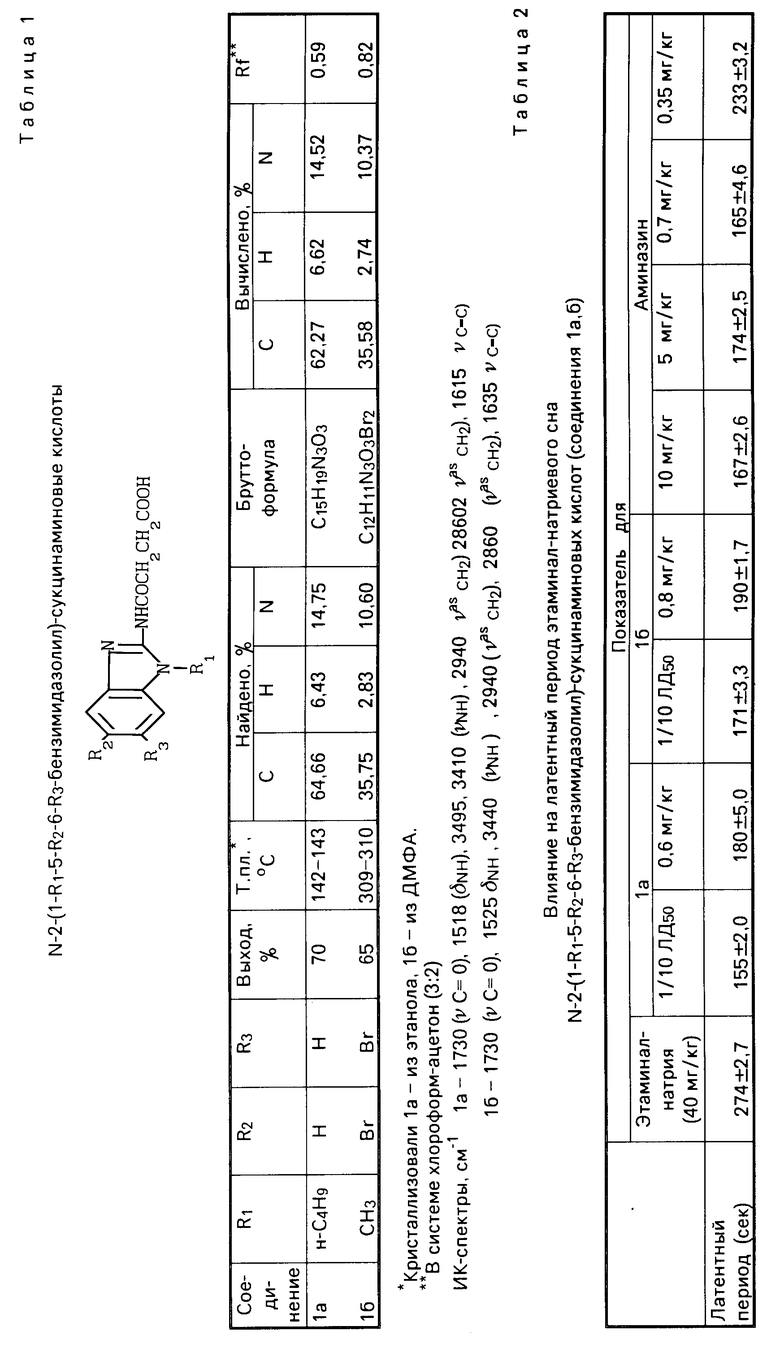
Строение синтезированных соединений подтверждено данными элементного анализа и ИК-спектроскопии, а индивидуальность контролировалась методом тонкослойной хроматографии (см.табл.1).
П р и м е р. N-2-(1-бутилбензимидазолил)-сукцинаминовая кислота Ia (см. табл.1). К раствору 1,89 г (0,01 моль) 2-амино-1-бутилбензимидазола в 100 мл сухого диоксана прибавляли раствор 1,2 г (0,012 моль) янтарного ангидрида в диоксане. Реакционную смесь кипятили 2 ч, избыток растворителя отгоняли в вакууме. Выпавший осадок отфильтровывали, промывали водой и высушивали. Выход 2,0г (70%).
Аналогично получали соединение 1б.
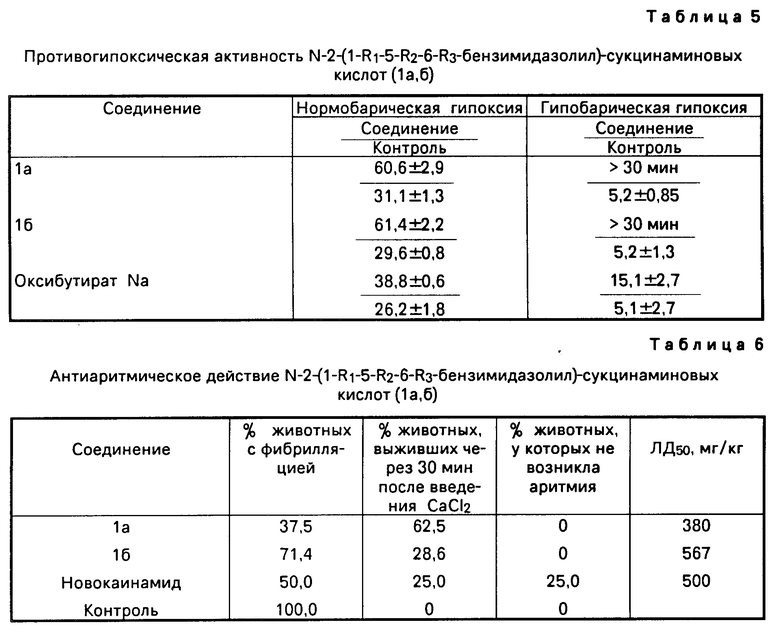
Острую токсичность исследуемых соединений и препаратов сравнения определяли в опытах на белых мышах массой 18-22 г по методике [1] Соединения вводили внутрибрюшинно в виде суспензии, стабилизированной твином-80 ЛД50 соединений 1а и 1б составляет 380 и 567 мг/кг соответственно.
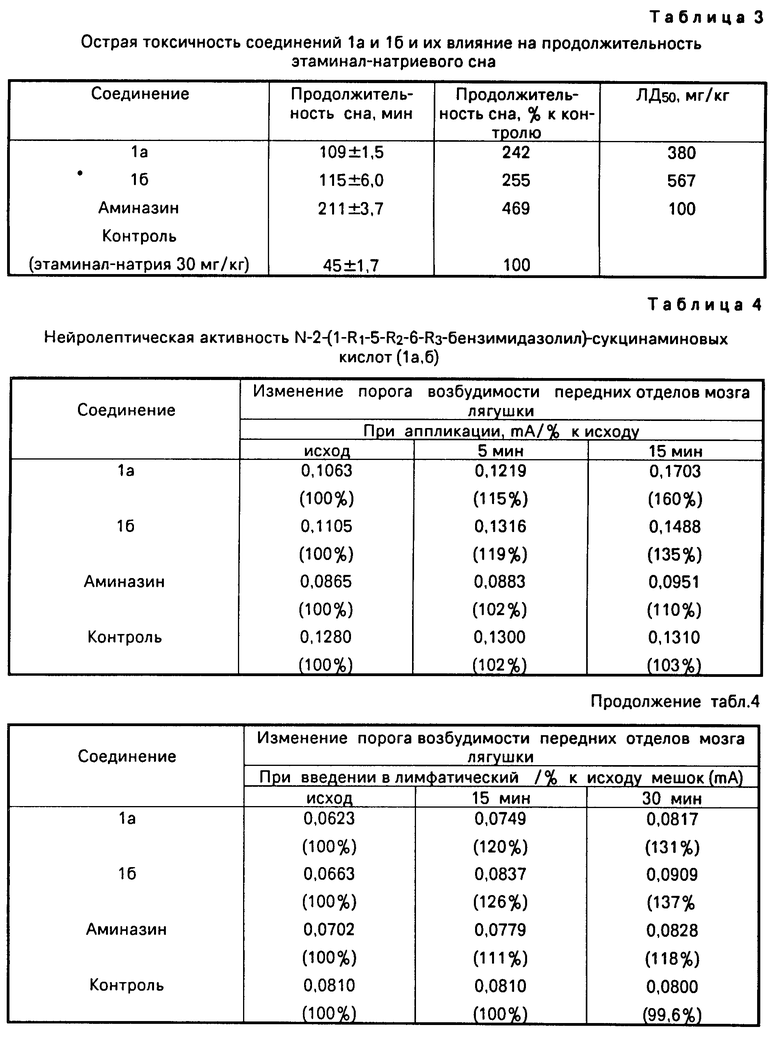
Изучено влияние соединений 1а,б и аминазина на латентный период этаминалового сна (см.табл.2) и продолжительность этаминал-натриевого сна (см.табл.3).
Как показали исследования, влияние аминазина на латентный период сна при введении в дозах от 10 мг/кг (1/10 ЛД50) до 0,7 мг/кг (среднетерапевтическая доза) практически не изменяется (167±2,6 и 165 ±4,6 с). То же можно сказать и о влиянии соединений 1а и 1б в дозах, равных 1/10 ЛД50 и эквимолекулярных 0,7 мг/кг аминазина (различия статистически не достоверны, см.табл.2. Поэтому в дальнейшем проводилось изучение заявляемых соединений в дозе, эквимолекулярной 0,7 мг/кг аминазина.
Влияние соединений на продолжительность латентного периода этаминал-натриевого сна проводилось по методике [2] на крысах линии Вистар. Исследуемые соединения вводились в дозе, эквимолекулярной 0,7 мг/кг аминазина, этаминал-натрий в дозе 40 мг/кг. Препарат сравнения аминазин в дозе 0,7 мг/кг. Об эффекте судили по уменьшению латентного периода до засыпания.
Из табл. 2 видно, что соединения 1а и 1б по их действию близки к аминазину (180 ±5, 190±1,7 и 165±4,6 с соответственно). При этом острая токсичность соединения 1а в 3,8 раза, а соединения 1б в 5,7 раза ниже, чем у аминазина.
Влияние соединений 1а и 1б на продолжительность этаминал-натриевого сна изучалось по методике [3] на крысах линии Вистар (см.табл.3).
Крысам первой и второй групп вводили соединения 1а и 1б соответственно в дозах, эквимолекулярных 0,7 мг/кг аминазина, а через 30 мин этаминал-натрий в дозе 30 мг/кг. Крысам третьей группы вводили аминазин в дозе 0,7 мг/кг и через 30 мин этаминал-натрий (30 мг/кг). Контрольная группа крыс получала только этаминал-натрия в дозе 30 мг/кг. О продолжительности этаминал-натриевого сна судили по времени, в течение которого животные находились в боковом положении.
Опыты показали, что соединение Ia увеличивает продолжительность сна по сравнению с контролем в 2,4 раза, а соединение 1б в 2,6 раза (аминазин в 4,7 раза). Но при этом токсичность исследуемых соединений в 3,8 и 5,7 раза соответственно ниже, чем у аминазина.
Нейролептический эффект исследуемых соединений оценивался также путем определения порогов возбудимости моторных центров передних отделов мозга лягушки. В остром опыте на необездвиженной лягушке обнажали передние доли мозга и наносили раздражение с помощью электростимулятора УЭС-1 биполярно, прямоугольными импульсами тока, длительностью 0,5 мc и частотой следования 50 импульсов в секунду. Электрическое раздражение моторных центров, передних долей мозга, вызывало движение туловища и головы лягушки.
Минимальная сила тока, вызывавшая при прямом раздражении указанных структур мозга двигательную реакцию, оценивалась как порог раздражения [4]
В опыте сопоставлялись средние значения порогов возбудимости в исходном состоянии и через 15 мин при аппликации 2% взвеси исследуемых соединений. В качестве препарата сравнения использовался аминазин [5]
Результаты опытов представлены в табл. 4. Из данных табл. 4 видно, что введение соединения 1а приводит к увеличению порога раздражения на 60% а соединение 1б на 35% Препарат сравнения аминазин достоверного увеличения порога раздражения при аппликации не дает.
Определены также значения порога возбудимости в исходном состоянии и через 30 мин после введения исследуемых веществ в лимфатический мешок лягушки (см. табл. 4). Соединения 1а и 1б вводили в дозе 1/10 ЛД50, аминазин 0,7 мг/кг. Соединения 1а и 1б увеличивают порог возбудимости на 31 и 37% соответственно, а аминазин на 18%
В контрольных группах животных ни при аппликации, ни при введении физиологического раствора в лимфатический мешок достоверного изменения порога возбудимости не наблюдалось.
Таким образом, соединения 1а и 1б оказывают выраженное угнетающее действие на возбудимость моторных центров передних отделов мозга лягушки.
Большинство соединений, обладающих нейролептическим действием, за счет торможения процессов клеточного дыхания обладают способностью повышать устойчивость организма к гипоксии, а также оказывают антиаритмическое действие, влияя на нервную регуляцию сердечного ритма [6,7]
Поэтому была изучена также антигипоксическая и антиаритмическая активность заявляемых N-2-(1-R1-5-R2-6-R3-бензимидазолил)-сукцинаминовых кислот. Антигипоксическую активность исследуемых соединений и препарата сравнения оксибутирата натрия изучали на моделях нормобарической и гипобарической гипоксии [6] в дозе 1/10 ЛД50. Нормобарическую гипоксию воспроизводили путем помещения животных в гермокамеру объемом 500 мл, при стандартных значениях температуры (18-22оС). В опытах регистрировалось время жизни животных. В гермокамеру одновременно помещали опытное и контрольное животное. Гипобарическую гипоксию воспроизводили путем разряжения атмосферы в барокамере. Парциальное давление кислорода составляло 37,5 мм рт.ст. Скорость "подъема" животных на высоту 1500 м равнялась 30 м/с. В барокамеру одновременно помещали опытное и контрольное животное. Время экспозиции животных в барокамере 30 мин. Результаты опытов представлены в табл.5.
Соединения 1а и 1б на модели нормобарической гипоксии проявляли примерно равную активность. Они увеличивали продолжительность жизни животных в гермокамере в 2,0 и 2,1 раза соответственно (оксибутират натрия в 1,5 раза).
В условиях гипобарической гипоксии при введении соединений 1а и 1б животные не погибали в течение 30 мин (время экспозиции в барокамере, т.е. продолжительность их жизни увеличивалась более, чем в 5 раз. Оксибутират натрия в этих условиях увеличивает продолжительность жизни животных в 3 раза.
Антиаритмическую активность заявляемых соединений изучали на модели хлоридкальциевой аритмии на белых беспородных крысах. Аритмию моделировали по методу [8] одномоментным введением 10%-ного раствора СаCl2 (200 мг/кг) в бедренную вену. Исследуемые вещества и препарат сравнения вводили в дозе 1/10 ЛД50. Полученные данные приведены в табл.6.
Исследования показали, что введение соединения 1а приводит к повышению процента выживаемости животных в 2,5 раза, по сравнению с новокаинамидом. Это соединение сильнее новокаинамида и по антифибриллярной активности. Соединение 1б увеличивает процент выживания животных на уровне препарата сравнения.
Таким образом, заявляемые соединения 1а,б по нейролептическому действию на показатели латентного периода этаминал-натриевого сна равны аминазину, а по влиянию на величину порога возбудимости передних отделов мозга лягушки превосходят аминазин на 50 и 25% соответственно. При этом острая токсичность заявляемых соединений в 3,8 и 5,7 раза соответственно ниже, чем у аминазина. Описанные соединения 1а и 1б обладают также выраженной противогипоксической активностью, увеличивая продолжительность жизни животных в гермокамере в 2,0 и 2,1 раза соответственно (оксибутират натрия в 1,5 раза). В условиях гипобарической гипоксии продолжительность жизни животных увеличивалась более чем в 5 раз (оксибутират натрия в 3 раза).
По антиаритмическому действию (показатель выживших животных) соединение 1б равно новокаинамиду, а соединение 1а превышает его в 2,5 раза.
| название | год | авторы | номер документа |
|---|---|---|---|
| 10-БЕНЗИЛ-2- ГИДРОКСИ -4-ОКСО-4Н- ПИРИМИДО/1,2-А/-БЕНЗИМИДАЗОЛ, ПРОЯВЛЯЮЩИЙ НЕЙРОЛЕПТИЧЕСКУЮ, ПРОТИВОСУДОРОЖНУЮ, ПРОТИВОГИПОКСИЧЕСКУЮ, АНАЛЬГЕТИЧЕСКУЮ И АНТИНОЦИЦЕПТИВНУЮ АКТИВНОСТИ | 1993 |
|
RU2042679C1 |
| СОЛИ N-2-(ТЕТРАГИДРОБЕНЗТИАЗОЛИЛ)-МАЛОНИЛАМИНОВОЙ КИСЛОТЫ | 1993 |
|
RU2072355C1 |
| 2-СТИРИЛ-5,5-ДИМЕТИЛ-4(5Н)-ОКСАЗОЛОНЫ, ОБЛАДАЮЩИЕ АНТИГИПОКСИЧЕСКИМ ДЕЙСТВИЕМ | 1978 |
|
SU738331A1 |
| ПРОИЗВОДНЫЕ БЕНЗИЛАМИДА 4-ОКСИМАСЛЯНОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЕ МЕСТНО-АНЕСТЕЗИРУЮЩУЮ, АНТИАРИТМИЧЕСКУЮ, АНТИАНГИАЛЬНУЮ И АНТИНЕКРОТИЧЕСКУЮ АКТИВНОСТЬ | 1988 |
|
SU1601984A1 |
| 2-СТИРИЛ-3-(О-МЕТОКСИФЕНИЛ)-6-МЕТИЛ-4(3Н)-ПИРИМИДОНЫ, ОБЛАДАЮЩИЕ АНТИГИПОКСИЧЕСКИМ ДЕЙСТВИЕМ | 1978 |
|
SU731727A1 |
| 1-ФЕНИЛ-3-АЛКИЛ-5-(O-ОКСИФЕНИЛ)-1,2,4-ТРИАЗОЛЫ, ОБЛАДАЮЩИЕ ТРАНКВИЛИЗИРУЮЩИМ И АНТИГИПОКСИЧЕСКИМ ДЕЙСТВИЕМ, И 1-ФЕНИЛ-3-Н-БУТИЛ-5-(О-ОКСИФЕНИЛ)-1,2,4-ТРИАЗОЛ, ОБЛАДАЮЩИЙ ТРАНКВИЛИЗИРУЮЩИМ, АНТИГИПОКСИЧЕСКИМ И АНАЛЬГЕТИЧЕСКИМ ДЕЙСТВИЕМ | 1983 |
|
SU1280851A1 |
| Пиперидиламид 3,5-дибром-4-аминобензолсульфонилсукцинаминовой кислоты, проявляющий нейролептическое и мочегонное действие | 1991 |
|
SU1824396A1 |
| ПРОИЗВОДНЫЕ 2-СТИРИЛ-5,5-ДИМЕТИЛ-4(5Н)-ОКСАЗОЛОНА, ОБЛАДАЮЩИЕ ТРАНКВИЛИЗИРУЮЩИМ ДЕЙСТВИЕМ | 1978 |
|
SU725419A1 |
| N-АЦИЛЬНЫЕ ПРОИЗВОДНЫЕ 4-ФЕНИЛ-ПИРРОЛИДИН-2-ОНОВ, ОБЛАДАЮЩИЕ ЦЕРЕБРОПРОТЕКТИВНЫМ (НООТРОПНЫМ) ДЕЙСТВИЕМ | 1990 |
|
SU1746665A1 |
| ЭФИРЫ ФОСФИНОВЫХ КИСЛОТ ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ КОРРЕКЦИИ НАРУШЕНИЙ ОБМЕННЫХ ПРОЦЕССОВ МОЗГА | 1994 |
|
RU2141961C1 |
Использование: в качестве препарата, обладающего нейролептической, антигипоксической и антиаритмической активностью. Сущность изобретения: продукт общей формулы  где а) R1=CH3; R2=R3=Br б) R1= H-C4H9; R2=R3=H а) т.пл. 142-143°С БФ C15H19N3O3 выход 70% б/ т.пл. 309 310°С, БФ C12H11N3O3, выход 65% Реагент 1: 2-амино- 1-R1-5-R2-6-R3 -бензимидазол Реагент 2: янтарный ангидрид. Среда: сухой диоксан. 6 табл.
где а) R1=CH3; R2=R3=Br б) R1= H-C4H9; R2=R3=H а) т.пл. 142-143°С БФ C15H19N3O3 выход 70% б/ т.пл. 309 310°С, БФ C12H11N3O3, выход 65% Реагент 1: 2-амино- 1-R1-5-R2-6-R3 -бензимидазол Реагент 2: янтарный ангидрид. Среда: сухой диоксан. 6 табл.
N-2-(1-R1-5-R2-6-R3-Бензимидазолил)сукцинаминовые кислоты общей формулы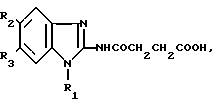
где а) R1 CH3, R2 R3 Br;
б) R1 H C4H9, R2 R3 водород,
проявляющие нейролептическую, антигипоксическую и антиаритмическую активность.
| Машковский М.Д | |||
| Лекарственные средства, ч.1 М.: Медицина, 1986, стр.41. |
Авторы
Даты
1995-09-10—Публикация
1991-05-20—Подача