Изобретение относится к прикладной биохимии, медицине, ветеринарии и клинической лабораторной диагностике для определения активности тканевых, бактериальных, вирусных и грибковых протеиназ, расщепляющих иммуноглобулины различных классов. Изобретение предназначено для одновременного определения активности протеолитических ферментов с различными типами активных центров в различных биологических жидкостях, культуральных средах при культивировании бактерий, грибов, вирусов и простейших.
Известно несколько способов выявления активности протеиназ, расщепляющих иммуноглобулины, которые основаны на регистрации фрагментов иммуноглобулинов после инкубации с ферментами с применением методов гельфильтрации [1], электрофореза с иммуноблотингом [2] и по расщеплению хромогенных субстратов [3].
Недостатком методов является сложность и трудоемкость исполнения, полуколичественное выражение активности иммуноглобулин-расщепляющих ферментов в исследуемых образцах, невозможность определения протеиназ с различными типами активных центров.
Наиболее близким к нашему изобретению является способ определения IgG-протеиназной активности на основе иммуноферментного анализа [4], включающий физическую сорбцию иммуноглобулина на поверхности лунок пластикового планшета для иммуноферментных реакций, обработка сорбированного иммуноглобулина раствором, содержащим протеолитические ферменты, сорбцией на оставшийся иммуноглобулин антител против IgG человека, конъюгированного с пероксидазой хрена, и выявлением сорбированного конъюгата в хромогенной реакции.
Существенным недостатком этого метода является выявление протеиназ, расщепляющих только иммуноглобулины класса IgG, тогда как в последние годы описаны бактериальные и тканевые протеиназы, специфичные по отношению и к другим классам иммуноглобулинов - IgM, IgA.
Существенным недостатком метода является также отсутствие этапа, позволяющего выявлять протеиназы по типу активных центров. Еще одним недостатком метода является использование сорбции иммуноглобулинов прямо на полистироловый планшет, что приводит к экранированию части Fc-областей, поскольку иммуноглобулины сорбируются не направленно. Кроме того, существование свободных Fab-фрагментов иммуноглобулинов создает возможность их взаимодействия с антигенными сайтами протеаз, а также с другими антигенами, что приводит к стерическим препятствиям для конъюгатов, реагирующих с Fc-областями.
Для расчета активности фермента используется оптическая плотность окисленного раствора хромогена, которая отличается от планшета к планшету и от активности пероксидазы хрена, конъюгированной с белком А золотистого стафилококка в различных сериях препарата и у разных производителей препарата. Это, в свою очередь, делает метод плохо воспроизводимым и не позволяет сравнивать результаты, полученные в разное время и разными лабораториями.
Задачей изобретения является создание специфичного, чувствительного, воспроизводимого, стандартизуемого способа определения активности протеиназ различного происхождения со всеми типами активных центров, способных расщеплять иммуноглобулины различных классов.
Проведенными исследованиями по патентной и научно-технической литературе установлено, что в известных методических и технических решениях отсутствуют: единый контроль, определение активности протеаз с различными типами активных центров, проведение всех реакций на одном планшете, выражение результата в весовых метрических единицах, что может считаться соответствием заявляемого технического решения критериям "Новизна" и "Существенные отличия". Кроме того, данный способ позволяет определять активность протеаз, способных расщеплять антитела классов IgM, IgG, IgA, что достигается использованием соответствующих конъюгатов.
Задача достигается тем, что реакцию протеолиза проводят в иммунологических планшетах, сенсибилизированных одним из микробных антигенов условно патогенной микрофлоры млекопитающих, к которым организм содержит антитела в высоких титрах, на которые специфически сорбируют антитела через Fab-область иммуноглобулины классов IgM, IgA, IgG, являющиеся субстратом для изучаемых ферментов. В среду инкубации вводят вместе с источником ферментов ингибиторы их активных центров и, после проведения реакции и промывки планшета, учитывают количество конъюгата, специфичного к Fc-области соответствующих классов иммуноглобулинов с помощью хромогенной реакции.
Это достигается тем, что в качестве субстрата в реакции протеолиза используют различные классы иммуноглобулинов, сорбированные из пуллированной сыворотки от 10 (не менее) доноров на полистироловом планшете через микробные антигены, внесением в среду инкубации ферментов, а также ингибиторов их активных центров. Учет количества оставшихся антител в контрольных лунках и в лунках с пробами, содержащими источник протеолитических ферментов и их ингибиторов, проводят по калибровочной кривой. Количество антител, подвергнутых протеолизу, определяют по разнице между количеством антител в контрольных лунках и опытных путем внесения коньюгатов пероксидазы с антителами, специфичными к Fc-областям соответствующих классов антител - IgA, IgM, IgG.
Способ осуществляется следующим образом.
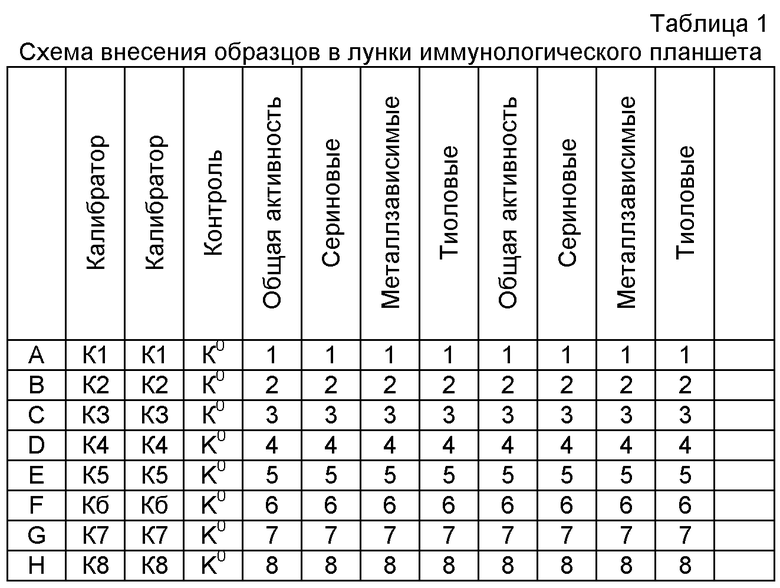
Используют планшет для иммуноферментного анализа, сенсибилизированный любым антигеном условно патогенной микрофлоры человека или животных, к которым в сыворотке крови содержатся антитела в высоких титрах. Во все лунки планшета вносят сыворотку, разведенную фосфатно-солевым буферным раствором, содержащим неионогенный детергент в концентрации 0,1-0,05% (ФСБ-Т) и инкубируют в течение 1-2 часов, после чего планшет промывают. В лунки планшета вносят источник ферментов по схеме, приведенной в табл.1. Это могут быть очищенные ферменты или любая биологическая жидкость, содержащая ферменты - моча, копрофильтраты, среды культированных микроорганизмов, экстракты или гомогенаты тканей ферменты различных микроорганизмов, гомогенаты тканей и др. В первую лунку вносят фермент без ингибиторов. Во вторую приливают ингибитор металлоферментов, в третью - один из ингибиторов сериновых протеиназ, в четвертую - один из ингибиторов цистеиновых протеиназ. На каждом планшете ставят калибровочную кривую в двух повторах, делая серию двукратных разведений сыворотки с известным количеством антител, специфичных к сорбированному антигену.
Планшет инкубируют в течение 1-2 часов при 37°С на планшеточном встряхивателе. После инкубации лунки планшета промывают 3-кратно раствором ФСБ-Т и дистиллированной водой. Затем во все лунки вносят раствор одного из конъюгатов антител против Fc-областей, соответствующих иммуноглобулинов человека (IgG, IgA, IgM) с ферментом индикатором и инкубируют 45-60 минут при 20-28°С на встряхивателе. От несвязавшегося конъюгата лунки планшета промывают 3-кратно раствором ФСБ-Т, дистиллированной водой, вносят по 100 мкл раствора хромогена (орто-фенилендиамин или тетраметилбензидин) и инкубируют в темноте 15-30 минут. Реакцию останавливают внесением в каждую лунку 50 мкл стоп-раствора (2М раствор серной кислоты). Результаты иммуноферментного анализа регистрируют фотометрически. Измерение оптической плотности (ОП) проводят не позднее, чем через 30 минут после остановки хромогенной реакции.
Для расчета результатов данного теста необходимо построение кривой зависимости оптической плотности контрольных точек и соответствующих им концентраций в линейно-логарифмических координатах. По построенной таким образом кривой определяют концентрацию антител в исследуемой пробе. Для этого необходимо отложить на оси Y оптическую плотность исследуемого образца и найти на оси Х соответствующую этому значению концентрацию антител. Возможно также использование программируемого планшеточного фотоколориметра, куда вводятся данные соответствующих концентраций калибраторов.
Расчет активности ферментов.
По калибровочной кривой определяют количество нерасщепленных антител в каждой из лунок планшета. Затем, по формулам (1, 2, 3, 4) определяют активность общих ферментов и ферментов, имеющих разные типы активных центров.
1. Ао=(K0-a)×L
2. Ac=(K0-х)×L
3. Ам=(K0-м)×L
4. Ац=(K0-ц)×L
Ао - общая протеолитическая активность; Ас - активность сериновых протеиназ; Ам - активность металлзависимых протеиназ; Ац - активность цистеиновых протеиназ;
К0 - количество антител в контрольной лунке без добавления фермента;
а - количество антител в лунке после инкубации ферментов без добавления ингибиторов;
х - количество антител в лунке после инкубации ферментов с добавлением ингибиторов сериновых протеиназ;
м - количество антител в лунке после инкубации ферментов с добавлением ингибиторов металлопротеиназ;
ц - количество антител в лунке после инкубации ферментов с добавлением ингибиторов цистеиновых протеиназ;
L - разведение исходного образца фермента.
Метод пригоден для выявления активности протеолитических ферментов с различным типом активных центров в любых биологических жидкостях.
Преимущества и особенности использования способа представлены на конкретных примерах его использования и проведения испытаний.
Пример 1. Определение активности протеолитических ферментов с различным типом активных центров, специфичных к иммуноглобулинам классов IgM, IgA, IgG, в экстракте кала.
Берут навеску кала ≈1 г в центрифужную пробирку, добавляют 10 мл буферного раствора с рН 8,0 и инкубируют на встряхивателе при температуре +4°С в течение 15-30 мин. Затем центрифугируют при 5000 об/мин в течение 15 минут. Супернатант используют для анализа. Перед использованием супернатант разводят тем же буфером 1:10.
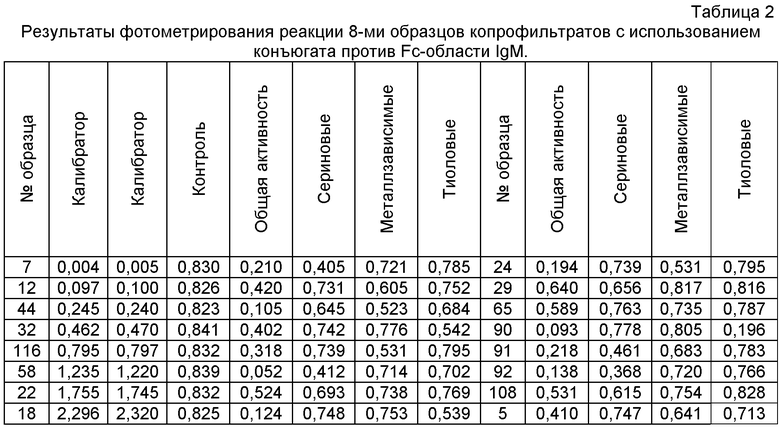
Собирают планшет, стрипы которого сенсибилизированы иммуноглобулинами классов IgM, IgA, IgG. В лунки планшета по схеме (табл.1) вносят ингибиторы, затем по 0,1 мл экстракта кала. В отдельные лунки в трех повторах вносят буферный раствор. На отдельном стрипе делают серию двукратных разведении соответствующего иммуноглобулина, или пуллированной сыворотки (с известным содержанием антител всех классов), в качестве калибровочной кривой. Планшет инкубируют в течение 2 часов при температуре 37°С, затем промывают трехкратно ФСБ-Т и трехкратно дистиллированной водой. Во все лунки планшета вносят конъюгат пероксидазы с антителами, направленными против Fc-областей соответствующих иммуноглобулинов, инкубируют 40-45 минут на встряхивателе, затем снова промывают трехкратно ФСБ-Т и трехкратно дистиллированной водой. Добавляют в каждую лунку 0,1 мл хромогенного буфера, содержащего перекись водорода и хромоген. После проведения хромогенной реакции ее останавливают добавлением стопреагента и замеряют оптическую плотность на фотоэлектроколориметре при длине волны, соответствующей используемому хромогену. Результаты фотометрии планшета с образцами копрофильтратов приведены в табл.2.
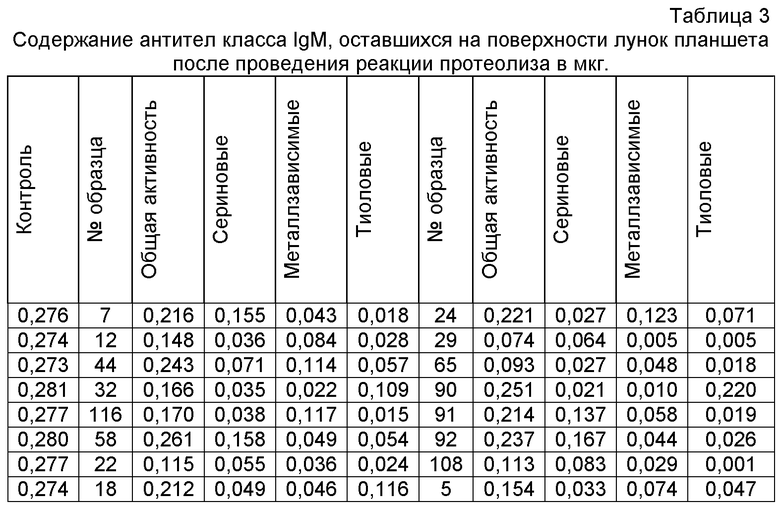
По калибровочной кривой находят количество антител, сорбированных в каждой лунке после проведения реакции протеолиза (табл.3).
Среднее содержание антител в 8-ми контрольных лунках равно 0,276 мкг.
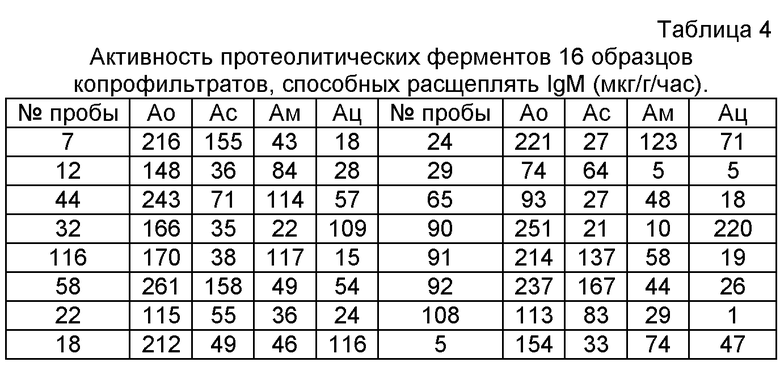
По формулам №1, 2, 3, 4 рассчитывают активность протеолитических ферментов. Результаты приведены на табл.4.
Пример 2. Определение активности протеолитических ферментов с различным типом активных центров, специфичных к иммуноглобулинам классов IgM, IgA, IgG, в моче.
Реакцию и подсчет проводят также, но для исследования используют цельную мочу после центрифугирования.
Пример 3. Определение активности протеолитических ферментов с различным типом активных центров, специфичных к иммуноглобулинам классов IgM, IgA, IgG, секретируемых микроорганизмами.
Различные микроорганизмы, включая бактерии, грибы, вирусы, простейшие, обладают большим потенциалом протеолитических ферментов, секретируемых во внешнюю среду. Эти ферменты способствуют их инвазии в ткани хозяина и считаются весомым фактором их патогенности. Метод позволяет изучать ферментный состав микроорганизмов, активных по отношению к иммуноглобулинам.
Для выявления активности секретируемых протеолитических ферментов микроорганизмы выращивают в жидкой среде, затем среду центрифугируют или проводят стерилизующую фильтрацию для удаления микроорганизмов, а супернатант используют для анализа. Анализ и подсчет производят как в примере 1. Окончательный результат выражают, учитывая количество взятых для анализа микроорганизмов в Ig/час/на 1 млрд микробных тел.
Пример 4. Определение активности очищенных протеолитических ферментов с различным типом активных центров, специфичных к иммуноглобулинам классов IgM, IgA, IgG.
Анализ проводят как в примере 1, но используют очищенные ферменты.

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ И НАБОР ДЛЯ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ С1 ИНГИБИТОРА ПО СПОСОБНОСТИ СВЯЗЫВАТЬСЯ С IgAl-ПРОТЕАЗОЙ | 2011 |
|
RU2475756C1 |
| СПОСОБ И НАБОР ДЛЯ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ И ИНГИБИРОВАНИЯ IGA1-ПРОТЕАЗЫ | 2006 |
|
RU2310853C1 |
| ВЫСОКОЧУВСТВИТЕЛЬНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ ИММУНОГЛОБУЛИН-ПРОТЕИНАЗНОЙ АКТИВНОСТИ С ИСПОЛЬЗОВАНИЕМ ПОЛИМЕРНЫХ МАТРИЦ | 2013 |
|
RU2519071C1 |
| СПОСОБ И НАБОР ДЛЯ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ С1-ИНГИБИТОРА ПО АЛЬТЕРНАТИВНОМУ ПУТИ | 2010 |
|
RU2458346C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ПРОДУКТОВ ПРОТЕОЛИЗА В ПЛАЗМЕ КРОВИ И ДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2015 |
|
RU2597782C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ IgG-ПРОТЕИНАЗНОЙ АКТИВНОСТИ | 2008 |
|
RU2373538C1 |
| СПОСОБ И НАБОР ДЛЯ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ПРОТЕИНАЗ | 2006 |
|
RU2312352C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ IgA-ПРОТЕИНАЗНОЙ АКТИВНОСТИ | 2010 |
|
RU2426126C1 |
| ПРЕПАРАТЫ АНТИТЕЛ | 2011 |
|
RU2617532C2 |
| СПОСОБ И НАБОР ДЛЯ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ С1 ИНГИБИТОРА ПО СПОСОБНОСТИ СВЯЗЫВАТЬСЯ С ТРОМБИНОМ | 2011 |
|
RU2477859C1 |
Изобретение относится к прикладной биохимии, медицине, ветеринарии и клинической лабораторной диагностике и касается способа определения активности тканевых, бактериальных, вирусных и грибковых протеиназ, расщепляющих иммуноглобулины различных классов. Способ включает сенсибилизацию планшета бактериальным антигеном любого представителя условно патогенной микрофлоры, нанесение на сорбированный антиген антител классов IgG, IgM и IgA, проведение реакции протеолиза путем инкубации в лунках планшета исследуемой биологической жидкости вместе с ингибиторами активных центров ферментов (сериновых, цистеиновых, металлзависимых), отмывку продуктов реакции и расчет активности фермента с соответствующим типом активного центра. Представленное изобретение позволяет одновременно определить активность протеиназ различного происхождения с различными типами активных центров. 1 з.п. ф-лы, 4 табл.
1. Способ количественного определения активности протеолитических ферментов различного происхождения, способных расщеплять антитела различных классов, включающий стандартный иммуноферментный анализ с использованием планшета для иммуноферментного анализа, характеризующийся тем, что вначале планшет сенсибилизируют бактериальным антигеном любого представителя условно патогенной микрофлоры млекопитающих, на сорбированный антиген дополнительно сорбируют направленные к этим антигенам антитела классов IgG, IgA, IgM - вместе или одного из них, реакцию протеолиза проводят путем инкубации в лунках планшета исследуемой биологической жидкости вместе с ингибиторами активных центров ферментов (сериновых, цистеиновых, металлзависимых), отмывают от продуктов реакции, затем осуществляют детекцию оставшихся нерасщепленных антител проведением стандартного иммуноферментного анализа с использованием конъюгатов антител к сорбированным на планшет антителам классов IgG, или IgM, или IgA, активность фермента с соответствующим типом активного центра рассчитывают по разнице количества антител в лунке планшета без добавления фермента и оставшихся антител в лунке после инкубации с жидкостью, содержащей фермент.
2. Способ по п.1, отличающийся тем, что активность протеолитических ферментов определяют по формулам:
Ао=(K0-a)·L
Ас=(К0-х)·L
Aм=(K0-м)·L
Ац=(К0-ц)·L,
где Ао - общая протеолитическая активность;
Ас - активность сериновых протеиназ;
Ам - активность металлзависимых протеиназ;
Ац - активность цистеиновых протеиназ;
К0 - количество антител в контрольной лунке без добавления фермента;
а - количество антител в лунке после инкубации ферментов без добавления ингибиторов;
х - количество антител в лунке после инкубации ферментов с добавлением ингибиторов сериновых протеиназ;
м - количество антител в лунке после инкубации ферментов с добавлением ингибиторов металлопротеиназ;
ц - количество антител в лунке после инкубации ферментов с добавлением ингибиторов цистеиновых протеиназ;
L - разделение исходного образца фермента.
| СПОСОБ ОПРЕДЕЛЕНИЯ IgG-ПРОТЕИНАЗНОЙ АКТИВНОСТИ | 2008 |
|
RU2373538C1 |
| СПОСОБ И НАБОР ДЛЯ ИММУНОФЕРМЕНТНОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ПРОТЕИНАЗ | 2006 |
|
RU2312352C1 |
| О.Д.ЗИНКЕВИЧ и др | |||
| Клинико-диагностическое значение оценки активности ig-протеаз у детей с дисбактериозом кишечника, Журн | |||
| Микробиол., 2004, №3, с.73-77. | |||
Авторы
Даты
2012-04-10—Публикация
2010-07-01—Подача