Изобретение относится к медицинской биохимии, а именно к способам определения функциональной активности протеиназ. Протеиназы являются физиологически важными ферментами, участвующими во многих процессах живого организма. Многие из них - относительно малоспецифичные эндопептидазы, осуществляющие расщепление белковых субстратов. Такие ферменты, в частности, осуществляют процесс переваривания белковой пищи в желудочно-кишечном тракте. В желудке протеолиз катализируется пепсинами желудочного сока при кислых рН, а в двенадцатиперстной кишке - тремя типами эндопептидаз - трипсином, химотрипсином и эластазами и двумя типами экзопептидаз - карбоксипептидазой А и карбоксипептидазой В - ферментами сока поджелудочной железы при нейтральных или слабощелочных рН. Определение наличия и активности этих протеиназ в желудке или двенадцатиперстной кишке может быть использовано для характеристики состояния системы пищеварения в норме и патологии. Кроме того, небольшие количества этих ферментов в их активной или зимогенной форме могут находиться в кровотоке и характеризовать функциональное состояние желудка и поджелудочной железы.
В качестве лечебных препаратов (в частности, для заместительной терапии) используются протеиназы животного, растительного и бактериального происхождения. Определение их функциональной активности полезно для характеристики потенциальной эффективности этих препаратов и их сохранности. Для всех этих целей может быть использовано данное изобретение.
Функциональную активность протеиназ определяют по скорости гидролиза различных белковых субстратов (разных для разных ферментов) в условиях оптимума рН для действия данной протеиназы. Процесс часто характеризуется многостадийностью, поскольку необходимо после проведения инкубации фермента с субстратом проводить отделение продуктов реакции от исходного субстрата и фермента и определять количество этих продуктов. Так, в качестве белковых субстратов пепсина, химотрипсина и трипсина до сих пор используются денатурированный гемоглобин, казеин молока (иногда окрашенный азокрасителем), яичный альбумин. В большинстве случаев проводится осаждение всех белков трихлоруксусной кислотой, а затем спектрофотометрическое определение количества растворимых белковых фрагментов. Этими методами затруднительно обнаружить протеолитическую активность в сыворотке крови или моче.
Известно использование иммуноферментного метода для определения ферментативной активности нейтральных протеиназ условно патогенных бактерий, выделенных из фекалий, с использованием в качестве субстрата фармакопейного препарата иммуноглобулина G человека [1]. Реакцию протеолиза IgG проводили при рН 7,85 в течение 1 ч при 37°С в растворе в полистироловом планшете, а затем методом иммуноферментного анализа определяли концентрацию нерасщепленных антител в реакционной смеси. Недостатками описанного метода являются: 1) использование двух планшетов - для проведения гидролиза, а затем переноса реакционной смеси во второй планшет тест-системы для определения IgG, 2) необходимость предварительного подбора разведения тестируемого фермента, чтобы попасть в диапазон концентраций, благоприятных для определения активности. Кроме того, возможности определения таким методом активности кислых протеиназ не были испытаны и описаны. Возможно, здесь возникли бы определенные трудности в связи с необходимостью изменения рН раствора при иммуноферментном определении остаточной концентрации IgG.
Задачей заявленного изобретения является разработка способа определения функциональной активности протеиназ и набора для иммуноферментного определения активности протеиназ с применением единообразного метода для кислых и щелочных ферментов без предварительного подбора оптимальных разведении и пригодного для определения активности в биологических жидкостях, чистых препаратах или сложных смесях.
Поставленная задача достигается путем разработки способа определения и набора. Известные методы определения активности ферментов по гидролизу IgG (см., например, [1]) касались лишь нейтральных протеиназ в гомогенной среде. Неизвестно было, будут ли кислые протеиназы столь же существенно расщеплять IgG, чтобы можно было обнаружить драматические изменения в структуре иммуноглобулина, влияющие на его иммунохимические свойства. Исследование активности ферментов в гетерогенной среде (т.е. по действию на твердофазный - иммобилизованный субстрат) по обнаружению иммунохимических изменений в субстрате также не известно. Проведенные исследования показали, что протеиназы способны гидролизовать сорбированный IgG в количественном соответствии с их функциональной активности, причем столь эффективно, что продукты гидролиза, остающиеся иммобилизованным в ячейках микропанели, утрачивают эпитопы, узнаваемые антителами против IgG. Кроме того, было показано, что оценить активность тестируемого фермента можно при любой глубине гидролиза по калибровочной кривой, т.е. нет необходимости в предварительном подборе разведения тестируемого фермента. Таким образом, способ предусматривает сорбцию на микропанели IgG, инкубацию в ячейках микропанели растворов, содержащих протеиназу, при рН, оптимальных для действия данного фермента, и определение активности фермента по снижению количества сорбированного IgG, определяемого конъюгатом с пероксидазой поликлональных антител к IgG.
Набор содержит микропанель с сорбированным препаратом IgG, конъюгат пероксидазы с антителами против IgG, субстратный буфер и стандартный образец протеиназы.
Техническим результатом заявленного изобретения является разработка простого способа определения активности протеиназ и набора для иммуноферментного определения функциональной активности протеиназ с применением единообразного метода для кислых и щелочных ферментов без предварительного подбора оптимальных разведений и пригодного для определения активности в биологических жидкостях, чистых препаратах или сложных смесях.
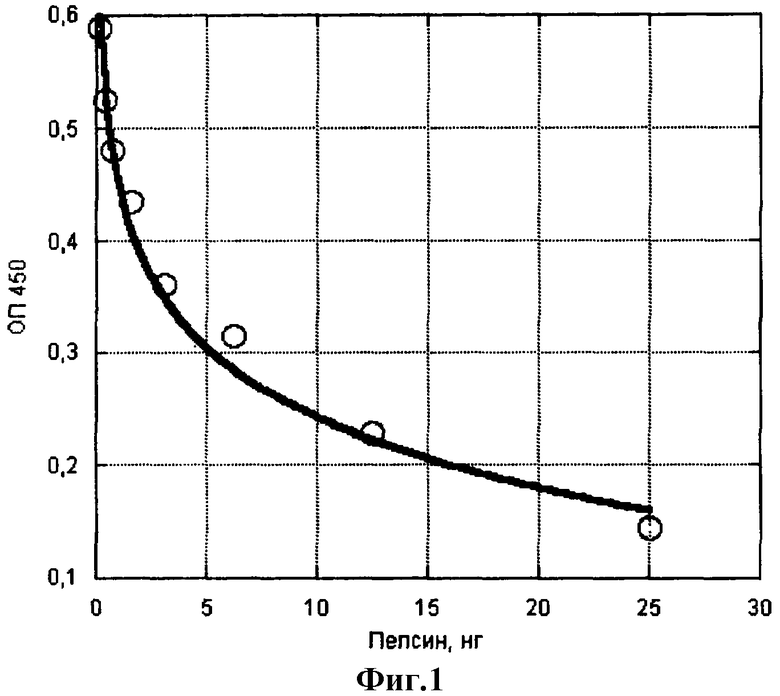
Пример 1. Определение ферментативной активности пепсина. В основу метода положено определение остаточного количества IgG методом иммуноферментного анализа. Для этого проводят сорбцию препарата IgG человека на поверхности лунок микропанели в 0,05 М натрийкарбонатном буфере, рН 9,5. В лунки вносят растворы пепсина в нитратном буфере, рН 3, путем раститровки в виде двойных разведений с образованием большого диапазона концентраций в ряду из 8-12 лунок. После инкубации в течение выбранного в зависимости от активности фермента времени и температуре, удаления растворов из лунок и отмывки лунок фосфатно-солевым буфером, рН 6,5, с твином в последние вносят раствор конъюгата анти-IgG с пероксидазой хрена. После инкубации в течение 1 ч и аналогичной промывки в лунки вносят субстратный буфер с тетраметилбензидином. Через 20 мин процесс останавливают подкислением серной кислотой и измеряют светопоглощение при 450 нм на спектрофотометре с вертикальным лучом. По разности оптических плотностей растворов в опыте и контроле (без фермента) рассчитывают количество гидролизованного за 1 ч IgG, которое характеризует активность пепсина. На фиг.1 показано соответствие количества активного пепсина разнице оптических плотностей.
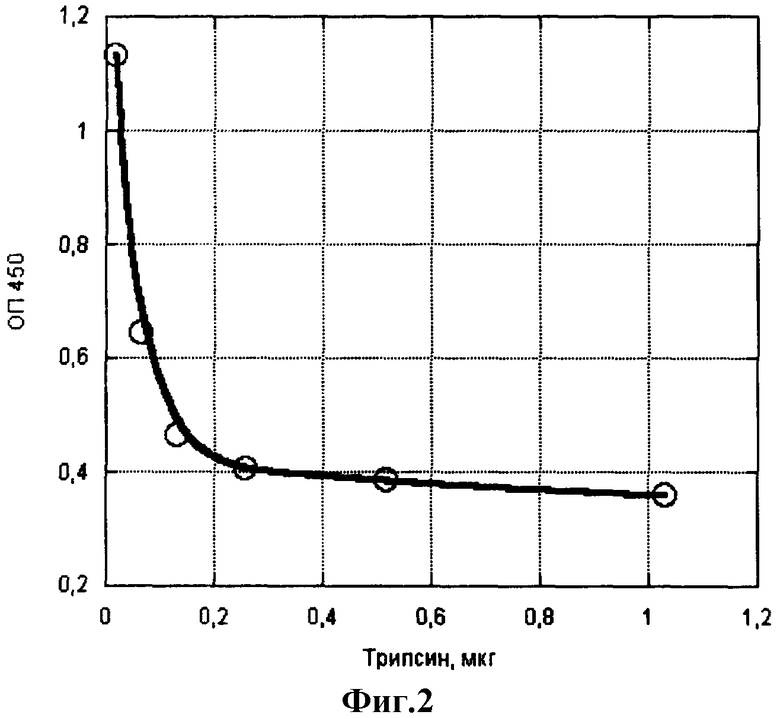
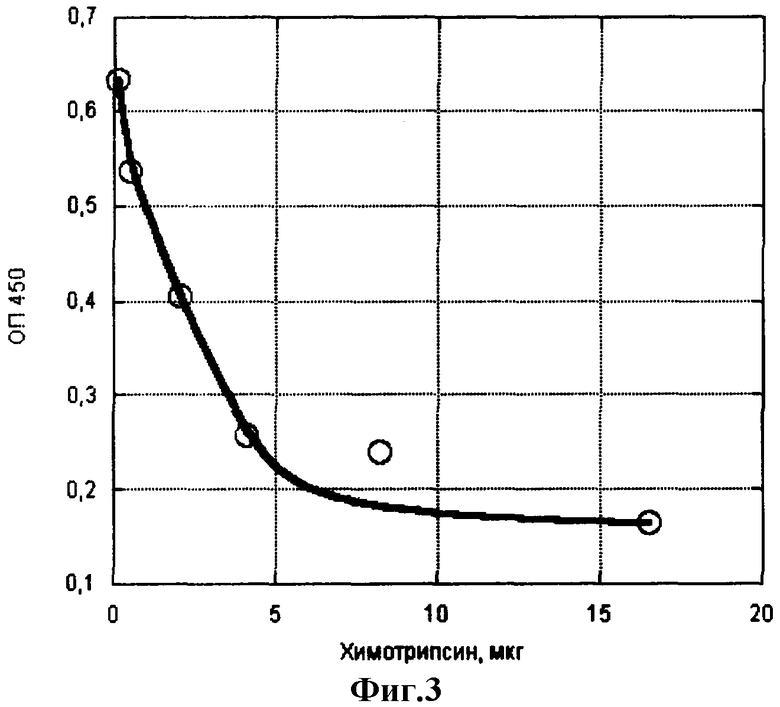
Пример 2. Определение ферментативной активности нейтральных протеиназ (трипсина и химотрипсина). Определение проводят аналогично примеру 1, внося в лунки с сорбированным IgG растворы протеиназ в фосфатном буфере, рН 7,4, путем раститровки в виде двойных разведений с образованием большого диапазона концентраций в ряду из 8-12 лунок. Далее все, как в примере 1. На фиг.2 и 3 показаны соответствия количества активного трипсина и химотрипсина разнице оптических плотностей.
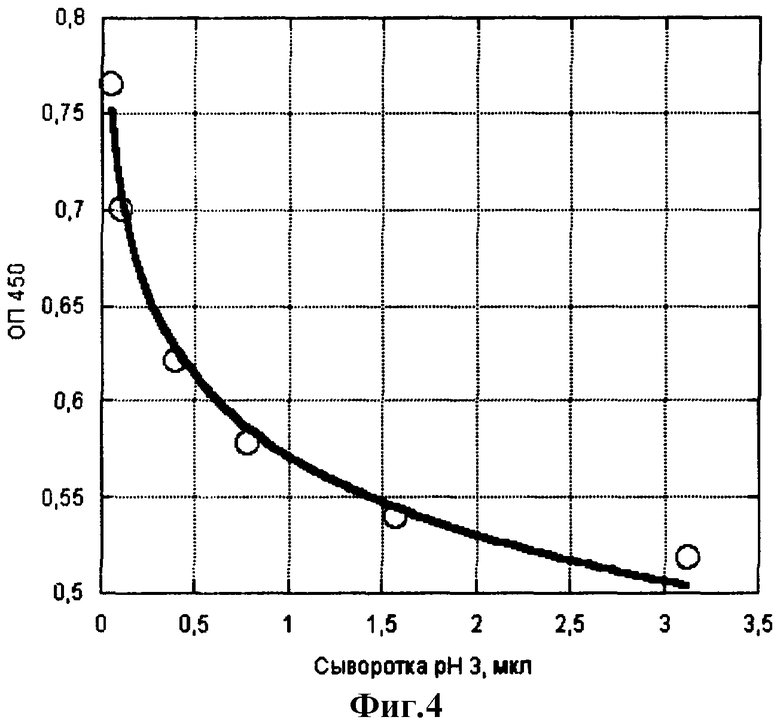
Пример 3. Определение ферментативной активности кислых протеиназ в сыворотке крови. В сыворотке крови кислые протеиназы содержатся в виде своих предшественников - пепсиногенов I и II. После подкисления до рН 3 зимогены переходят в активную форму и проявляют протеолитическую активность. Определение проводят аналогично примеру 1, внося в лунки с сорбированным IgG сыворотку крови человека в виде двойных разведений в нитратном буфере, рН 3. Далее все, как в примере 1. На фиг.4 показано соответствие количества сыворотки крови разнице оптических плотностей, характеризующей активность кислых протеиназ. Сравнение фиг.4 и 1 позволяет оценить содержание активного пепсина в сыворотке крови около 130 нг/мл. По литературным данным [2], в сыворотке взрослых людей содержится 133±9 нг/мл пепсиногена I (содержание пепсиногена II в 10 раз ниже). Таким образом, метод позволяет определить содержание в сыворотке крови человека пепсиногена I.
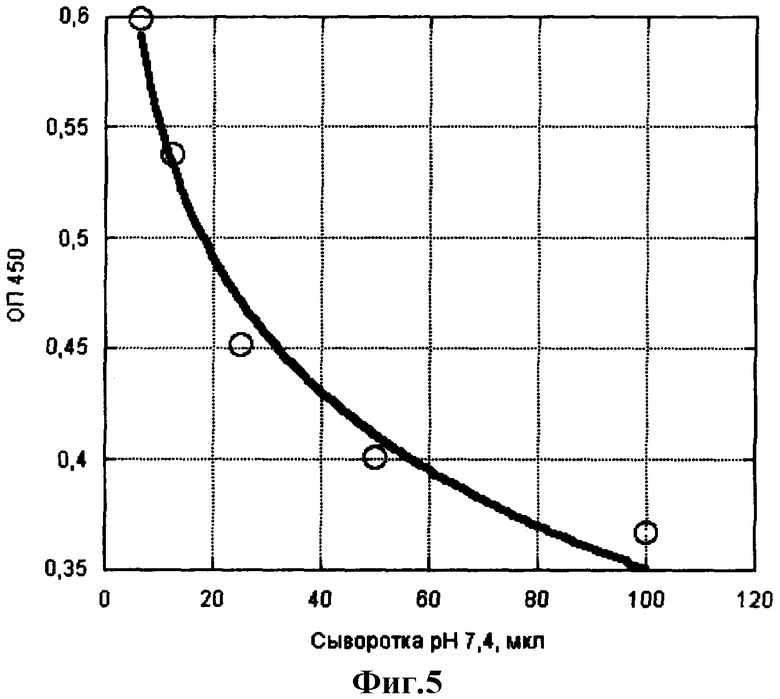
Пример 4. Определение ферментативной активности нейтральных протеиназ в сыворотке крови. Определение проводят аналогично примеру 2, внося в лунки с сорбированным IgG сыворотку крови человека в виде двойных разведений в фосфатном буфере, рН 7,4. Далее все, как в примере 1. На фиг.5 показано соответствие количества сыворотки крови разнице оптических плотностей, характеризующей активность нейтральных протеиназ. Сравнение фиг.5, 2 и 3 позволяет оценить содержание активной нейтральной протеиназы в сыворотке крови как 5 мкг/мл активного трипсина или 50 мкг/мл активного химотрипсина. В плазме крови присутствуют предшественники нейтральных протеиназ в количествах до 300 мкг/мл суммарно [3], которые могут переходить в активную форму при превращении плазмы в сыворотку.
Пример 5. Набор для определения ферментативной активности протеиназ. Набор содержит микропанель с сорбированным препаратом IgG, конъюгат пероксидазы с антителами против IgG человека, субстратный буфер и стандартные образцы протеиназ. Данный набор используется в соответствии с примерами 1-4.
ЛИТЕРАТУРА
1. Зинкевич О.Д., Бондаренко В.М., Тюрин Ю.А., Сафина Н.А., Анохин В.А. Клинико-диагностическое значение оценки активности IgG-протеаз у детей с дисбактериозом кишечника // Журн. микробиол. 2004. №3. С.73-77.
2. Waldum H.L., Straume B.K., Burhol P.O., Dahl L.B. Serum group I pepsinogens in children // Acta Paediatr. Scand. 1980. V.69. P.215-218.
3. Баскова И.П. Белки системы гемостаза // Белки и пептиды. М. Наука. 1995. Т.1. С.397-433.
Изобретение относится к медицинской биохимии. Разработаны способ и набор для определения функциональной активности кислых и щелочных протеиназ. Способ предусматривает сорбцию на микропанели IgG, инкубацию в ячейках микропанели растворов, содержащих протеиназу при рН, необходимых для действия данного фермента, и определение активности фермента по снижению количества сорбированного IgG, определяемого конъюгатом антител к IgG с пероксидазой. Набор содержит микропанель с сорбированным препаратом IgG, конъюгат пероксидазы с антителами против IgG, субстратный буфер и стандартные образцы протеиназ. Техническим результатом заявленного изобретения является упрощение способа определения активности протеиназ и создание набора для иммуноферментного определения функциональной активности протеиназ, без предварительного подбора оптимальных разведений и пригодного для определения активности протеиназ в биологических жидкостях, чистых препаратах или сложных смесях. 2 н.п. ф-лы, 5 ил.
| ЗИНКЕВИЧ О.В | |||
| и др | |||
| Клинико-диагностическое значение оценки активности lgG-протеаз у детей с дисбактериозом кишечника | |||
| - Журн | |||
| Микробиол., 2004, №3, с.73-77 | |||
| MAVROPOULOS J.C | |||
| et al | |||
| Парный автоматический сцепной прибор для железнодорожных вагонов | 0 |
|
SU78A1 |
Авторы
Даты
2007-12-10—Публикация
2006-07-13—Подача