Предлагаемое изобретение относится к химии производных 2,4-диамино-симм-триазинов, в частности к способу получения 6-(3-феноксифенилзамещенных) 2,4-диамино-симм-триазинов общей формулы
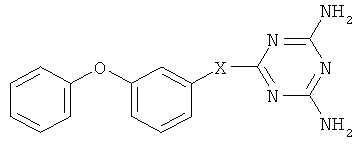
где Х = одинарная связь, -СН=СН-; 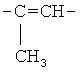 ;
; ; -СН2-СН2-; -СН2-; -CH2-NH-СН2-СН2-; -СН2-О-СН2-СН2-,
; -СН2-СН2-; -СН2-; -CH2-NH-СН2-СН2-; -СН2-О-СН2-СН2-,
которые являются новыми по структуре 3-феноксифенилсодержащими соединениями и могут представлять интерес в качестве полупродуктов в синтезе биологически активных веществ. Анализ литературных источников и работа с патентными базами показали, что гетероциклические соединения, молекулы которых содержат дифенилоксидный фрагмент, являются перспективными биологически активными веществами и проявляют ряд фармакологических свойств.
Так, перметрин [(3-феноксифенил)метиловый эфир 3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоновой кислоты; смесь цис- и транс-изомеров (3:1)] и фенотрин [2,2-диметил-3-(2-метил-1-пропенил)циклопропанкарбоновой кислоты (3-феноксифенил)метиловый эфир] используются как лекарственные препараты, обладающие противопаразитарным, противопедикулезным, инсектицидным, овоцидным фармакологическим действием. Имеются примеры использования феноксифенилацетиленов, полученных на основе 1-(2-метил-4-феноксифенил)этанона и 1-(3-феноксифенил)этанона, в качестве противотромботических, противовоспалительных, жаропонижающих агентов и анальгетиков [Химическая энциклопедия: В 5 т.: Т.5. / Ред. кол.: Кнунянц И.Л. и др. - М.: Большая Российская Энциклопедия, 1992. - 639 с.].
Гуанамины (6-арилзамещенные 2,4-диамино-симм-триазины) представляют интерес как сырье для производства полимеров (гуанаформальдегидных смол) [Химическая энциклопедия. М.: Сов. энцикл., 1988. Т.1. С.1209; Энциклопедия полимеров. М.: Сов. энцикл., 1972. Т.1. С.654], как компоненты антипиренов (замедлителей горения) [Кодолов В.И. Замедлители горения полимерных материалов. М.: Химия, 1980]. Многие гуанамины обладают выраженной биологической активностью, способствуют заживлению пептических язв [Ogino A., Matsumura S., Fujita T. // J. Med. Chem. 1980. №23. P.23], обладают противовоспалительной активностью [Пат. США №3966728, 1976], антиаллергической [Пат. США №4333933, 1982] и диуретической активностью [Lipschitz W., Stokey E.// J. Pharmacol. 1948. №92. P.131].
На базе семейства триазинов разработан препарат широкого спектра действия - «триазаварин». Препарат защищает на 60-90% от инфекций, вызываемых вирусами крымской геморрагической лихорадки, лихорадки долины Рифт, вирусами клещевого энцефалита, вирусами гриппа (в том числе вирусами гриппа птиц H5N1), респираторно-синцитиальной инфекции [Институт органического синтеза им. И.Я. Постовского УрО РАН. В.Н.Чарушин, О.Н.Чупахин // Номер контракта: 02.435.11.3017].
Известен способ получения арилвинил- и гетарилвинилзамещенных цианамино-симм-триазинов рециклизацией перхлоратов 4-оксо-1,3-бензоксазиния действием цианогуанидина с выходами 65-81% [Е.Ю.Шашева. Автореф. дис. канд. хим. наук, Ростов-на-Дону, 2008].
Данный метод не приводит к получению веществ заявляемой структурной формулы.
Возможно получение 6-арил-3,5-диамино-1,2,4-триазинов, используя соли 5-тетразолилдиазония и производные арилацетонитрилов с трифенилфосфином или медью в присутствии кислоты [Заявка на изобретение: RU 2001130299/04, МПК C07D 253/075, 08.11.2001].
Недостатком данного способа является многостадийность процесса, синтез протекает в три стадии, через тетразолилгидразоны нитрилов.
Данный метод не приводит к получению веществ заявляемой структурной формулы.
Известен также способ получения 2,4-диамино-симм-триазинов взаимодействием нитрилов и мочевины при 250-500°С в жидком аммиаке [Пат. США №2527314, МПК C07D 253/075, 1950].
Недостатками данного способа являются сложное аппаратурное оформление (для создания высокого давления аммиака), высокая температура реакции и низкое качество образующихся продуктов.
Данный метод также не приводит к получению веществ заявляемой структурной формулы.
1,3,5-Триазины были получены реакцией нитрилов с дициандиамидом в присутствии гидроокиси калия в растворе метилцеллозольва при температуре кипения [В.В.Соснина, Е.Р.Кофанов // Известия высших учебных заведений. Химия и химическая технология. 2006, №4. Т.49. С.3-7].
Данный метод не приводит к получению веществ заявляемой структурной формулы.
Так же 1,3,5-триазины были получены взаимодействием карбонитрилов с цианогуанидинами в присутствии гидроокиси калия в растворе 2-метоксиэтанола при температуре кипения [WO 99/31088 А1, 24.06.1999].
Недостатками данного способа является то, что 2-метоксиэтанол (метилцеллозольв) имеет недостаточно высокую температуру кипения (125°С) и в качестве растворителя в синтезе 1,3,5-триазинов дает невысокие выходы продуктов (15-60%) в случае алифатических нитрилов.
Данный метод также не приводит к получению веществ заявляемой структурной формулы, однако с его помощью был синтезирован феноксифенилзамещенный 2,4-диамино-1,3,5-триазин на основе 4-феноксибензонитрила, а именно 6-(4-феноксифенил)-1,3,5-триазин-2,4-диамин, феноксигруппа в этой структуре находится в положении 4.
Наиболее близким к предлагаемому является способ получения 2,4-диамино-1,3,5-триазинов на основе нитрилов и дициандиамида [JP 4300832 А, 23.10.1992; JP 4300874 А, 23.10.1992].
В данном патенте описан способ получения только одного соединения из заявленного ряда 6-(3-феноксифенилакрило)-2,4-диамино-симм-триазина. Однако этим способом не были получены другие соединения из синтезированного нами ряда 6-(3-феноксифенилзамещенных)-2,4-диамино-симм-триазинов.
Недостатками данного способа являются невысокие выходы целевых продуктов, которые составляют 16,6-66,7%, выход для 6-(3-феноксифенилакрило)-2,4-диамино-симм-триазина в описании изобретения отсутствует.
Задачей предлагаемого изобретения является разработка технологичного малостадийного метода синтеза 6-(3-феноксифенилзамещенных)-2,4-диамино-симм-триазинов с хорошим выходом и высокой степенью чистоты.
Техническим результатом является расширение ассортимента химических соединений, в частности получение новых 6-(3-феноксифенилзамещенных) 2,4-диамино-симм-триазинов с хорошими выходами 80-92%, высокой степенью чистоты 99-100%.
Поставленный технический результат достигается в способе получения 6-(3-феноксифенилзамещенных) 2,4-диамино-симм-триазинов общей формулы

где Х = одинарная связь, -СН=СН-; 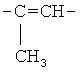 ;
; ; -СН2-СН2-; -СН2-; -CH2-NH-СН2-СН2-; -СН2-О-СН2-СН2-,
; -СН2-СН2-; -СН2-; -CH2-NH-СН2-СН2-; -СН2-О-СН2-СН2-,
заключающийся во взаимодействии карбонитрилов с дициандиамидом в присутствии гидроокиси калия, отличающийся тем, что в качестве карбонитрилов используют 3-феноксибензонитрил, 3-феноксифенилацетонитрил, 3-(3-феноксифенил)акрилонитрил, 3-(3-феноксифенил)-2-бутенонитрил, 3-(3-феноксифенил)пропионитрил, 3-(3-феноксибензиламино)пропионитрил, 2-метил-2-(3-феноксибензоат) пропионитрил или 3-феноксифенилметоксипропионитрил, при этом процесс проводят при мольном соотношении соответствующего карбонитрила и дициандиамида, равном 1:1,2, при температуре 130-135°С в присутствии диметилформамида.
Сущностью метода является реакция взаимодействия дициандиамида с карбонитрилами, выбранными из ряда: 3-феноксибензонитрила, 3-феноксифенилацетонитрила, 3-феноксифенилакрилонитрила, 3-(3-феноксифенил)-2-бутенонитрила, 3-(3-феноксифенил)пропионитрила, 3-(3-феноксибензиламино)пропионитрила, 2-метил-2-(3-феноксибензоат)пропионитрила, 3-феноксифенилметоксипропионитрила.
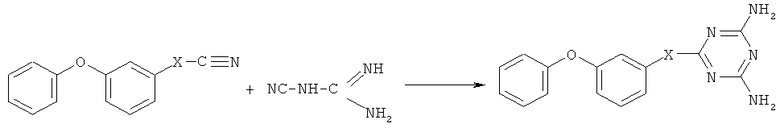
где Х = одинарная связь, -СН=СН-; 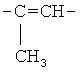 ;
; ; -СН2-СН2-; -СН2-; -CH2-NH-СН2-СН2-; -СН2-О-СН2-СН2-.
; -СН2-СН2-; -СН2-; -CH2-NH-СН2-СН2-; -СН2-О-СН2-СН2-.
Способ осуществляется следующим образом.
В реактор, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, помещают дициандиамид, гидроокись калия и диметилфорамид, затем добавляют нитрил, содержащий 3-феноксифенильный фрагмент в диметилфорамиде. Реакционную массу энергично перемешивают в течение 15 часов при температуре 130-135°С.
Реакционную массу охлаждают и осаждают 2,4-диамино-симм-триазин холодной водой, при этом образуются белые хлопья. Далее смесь фильтруют на фильтре Шотта, промывают теплой водой и сушат. Конечный продукт перекристаллизовывают из хлороформа.
Выход данных продуктов после выделения 80-92%.
Как показали проведенные исследования, оптимальным и технологичным условием проведения реакции является ее осуществление в среде диметилформамида при мольном соотношении нитрил : дициандиамид 1:1,2. Меньший избыток дициандиамида приводил к некоторому снижению выхода целевого продукта за счет неполной конверсии нитрильного соединения. Дальнейшее увеличение избытка дициандиамида не влияло на выход 6-(3-феноксифенилзамещенных) 2,4-диамино-симм-триазинов и являлось нецелесообразным.
Оптимальной температурой реакции является 130-135°С. Снижение температуры до комнатной приводит к сильному увеличению продолжительности данного взаимодействия и снижению выхода целевого продукта.
Пример 1. 6-(3-Феноксифенил)-2,4-диамино-симм-триазин.
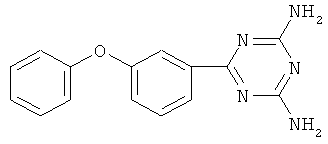
В реактор, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, помещают 5,17 г (0,061 моль) дициандиамида, 3,41 г (0,061 моль) гидроокиси калия и 30 мл диметилфорамида, затем добавляют 10 г (0,051 моль) 3-феноксибензонитрила в 10 мл диметилфорамида. Реакционную массу энергично перемешивают в течение 15 часов при температуре 130-135°С.
Реакционную массу охлаждают и осаждают 6-(3-феноксифенил)2,4-диамино-симм-триазин холодной водой, при этом образуются белые хлопья. Далее смесь фильтруют на фильтре Шотта, промывают теплой водой и сушат.Конечный продукт перекристаллизовывают из хлороформа.
Выход 11,38 г (0,0408 моль, 80%). Т.пл. 125-127°С. Спектр ЯМР 1H, δ, м.д.: 6,74-7,35 м (9Н, С6Н5ОС6Н4); 6,57 с (4Н, NH2). Масс-спектр, m/z (Iотн, %): 287 [М+] (100), 194 (11), 85 (8), 43 (18). Найдено, %: С 64.52; Н 4.53; N 25.10. C15H13N5O. Вычислено, %: С 64.50; Н 4.50; N 25.09.
Пример 2. 6-(3-Феноксифенилацето)-2,4-диамино-симм-триазин.
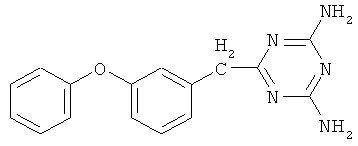
В реактор, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, помещают 4,82 г (0,057 моль) дициандиамида, 3,19 г (0,057 моль) гидроокиси калия и 30 мл диметилфорамида, затем добавляют 10 г (0,048 моль) 3-феноксифенилацетонитрила в 10 мл диметилфорамида. Реакционную массу энергично перемешивают в течение 15 часов при температуре 130-135°С.
Реакционную массу охлаждают и осаждают 6-(3-феноксифенилацето)-2,4-диамино-симм-триазин холодной водой, при этом образуются белые хлопья. Далее смесь фильтруют на фильтре Шотта, промывают теплой водой и сушат. Конечный продукт перекристаллизовывают из хлороформа.
Выход 12,94 г (0,044 моль, 92%). Т.пл. 160-163°С. Спектр ЯМР 1Н, δ, м.д.: 6,54-7,27 м (9Н, С6Н5ОС6Н4); 6,35 с (4Н, NH2); 3,56 с (2Н, СН2). Масс-спектр, m/z (Iотн, %): 292 [М+] (100), 43 (10). Найдено, %: С 65.52; Н 5.10; N 23.87. C16H15N5O. Вычислено, %: С 65.53; Н 5.01; N 23.89.
Пример 3. 6-(3-Феноксифенилакрило)2,4-диамино-симм-триазин.

В реактор, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, помещают 4,56 г (0,054 моль) дициандиамида, 3 г (0,054 моль) гидроокиси калия, 0,1-0,2 г гидрохинона и 30 мл диметилфорамида, затем добавляют 10 г (0,045 моль) 3-феноксифенилакрилонитрила в 10 мл диметилфорамида. Реакционную массу энергично перемешивают в течение 15 часов при температуре 130-135°С.
Реакционную массу охлаждают и осаждают 6-(3-феноксифенилакрило)-2,4-диамино-симм-триазин холодной водой, при этом образуются белые хлопья. Далее смесь фильтруют на фильтре Шотта, промывают теплой водой и сушат. Конечный продукт перекристаллизовывают из хлороформа.
Выход 11,25 г (0,0369 моль, 82%). Т.пл. 170-172°С. Спектр ЯМР 1Н, δ, м.д.: 6,71-7,15 м (9Н, С6Н5ОС6Н4); 6,35 с (4Н, NH2); 6,96-7,00 д (1H, Ar-СН); 5,62-5,67 д (1Н, CH-CN). Масс-спектр, m/z (Iотн, %): 304 [М+] (100), 262 (18), 43 (12). Найдено, %: С 66.85; Н 4.93; N 22.89. C17H15N5O. Вычислено, %: С 66.89; Н 4.92; N 22.95.
Пример 4. 6-(3-(3-Феноксифенил)-2-бутенил)-2,4-диамино-симм-триазин.

В реактор, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, помещают 4,29 г (0,051 моль) дициандиамида, 2,86 г (0,051 моль) гидроокиси калия, 0,1-0,2 г гидрохинона и 30 мл диметилфорамида, затем добавляют 10 г (0,043 моль) 3-(3-феноксифенил)-2-бутенонитрила в 10 мл диметилфорамида. Реакционную массу энергично перемешивают в течение 15 часов при температуре 130-135°С.
Реакционную массу охлаждают и осаждают 6-(3-(3-феноксифенил)-2-бутенил)-2,4-диамино-симм-триазин холодной водой, при этом образуются белые хлопья. Далее смесь фильтруют на фильтре Шотта, промывают теплой водой и сушат. Конечный продукт перекристаллизовывают из хлороформа.
Выход 11 г (0,0344 моль, 80%). Т. пл. 179-182°С.Спектр ЯМР 1Н, δ, м.д.: 6,74-7,35 м (9Н, С6Н5ОС6Н4); 6,57 с (4Н, NH2); 6,62 с (1Н, CH-CN); 2,42 с (3Н, СН3). Масс-спектр, m/z (Iотн, %): 318 [М+] (100), 194 (17), 43 (9). Найдено, %: С 67.72; Н 5.33; N 21.91. C18H17N5O. Вычислено, %: С 67.71; Н 5.33; N 21.94.
Пример 5. 6-(3-(3-Феноксифенил)пропио)-2,4-диамино-симм-триазин.
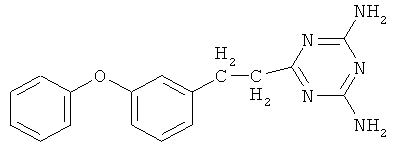
В реактор, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, помещают 4,56 г (0,054 моль) дициандиамида, 2,4 г (0,054 моль) гидроокиси калия и 30 мл диметилфорамида, затем добавляют 10 г (0,045 моль) 3-(3-феноксифенил)пропионитрила в 10 мл диметилфорамида. Реакционную массу энергично перемешивают в течение 15 часов при температуре 130-135°С.
Реакционную массу охлаждают и осаждают 6-(3-(3-феноксифенил)пропио)-2,4-диамино-симм-триазин холодной водой, при этом образуются белые хлопья. Далее смесь фильтруют на фильтре Шотта, промывают теплой водой и сушат. Конечный продукт перекристаллизовывают из хлороформа.
Выход 12,43 г (0,0405 моль, 90%). Т.пл. 173-174°С. Спектр ЯМР 1Н, δ, м.д.: 6,89-7,47 м (9Н, С6Н5ОС6Н4); 6,53 с (4Н, NH2); 2,81-2,86 т (2Н, Ar-СН2); 3,42-3,49 т (2Н, CH2-CN). Масс-спектр, m/z (Iотн, %): 306 [М+] (100). Найдено, %: С 67.69; Н 5.31; N 21.95. C18H17N5O. Вычислено, %: С 67.71; Н 5.33; N 21.94.
Пример 6. 6-[2-(3-Феноксибензиламино)этил]-2,4-диамино-симм-триазин.
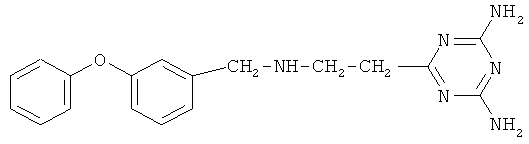
В реактор, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, помещают 4 г (0,048 моль) дициандиамида, 2,7 г (0,048 моль) гидроокиси калия и 30 мл диметилфорамида, затем добавляют 10 г (0,04 моль) 3-(3-феноксибензиламино)пропионитрила в 10 мл диметилфорамида. Реакционную массу энергично перемешивают в течение 15 часов при температуре 130-135°С.
Реакционную массу охлаждают и осаждают 6-(3-(3-феноксибензиламино)пропио)-2,4-диамино-симм-триазин холодной водой, при этом образуются белые хлопья. Далее смесь фильтруют на фильтре Шотта, промывают теплой водой и сушат. Конечный продукт перекристаллизовывают из хлороформа.
Выход 11,29 г (0,0336 моль, 84%). Т.пл. 190-193°С. Спектр ЯМР 1Н, δ, м.д.: 6,92-7,86 м (9Н, С6Н5ОС6Н4), 6,48 с (4Н, NH2), 8,2 с (N-H), 3,6 д (2Н, Ar-СН 2-N) 2,2 т (2Н, СН2), 2,7 т (2Н, СН2). Масс-спектр, m/z (Iотн, %): 336 [М+] (100). Найдено, %: С 64.32; Н 6.03; N 24.99. C18H20N6O. Вычислено, %: С 64.30; Н 6.00; N 25.00.
Пример 7. 6-{2-[(3-Феноксибензил)окси]этил}-2,4-диамино-симм-триазин.
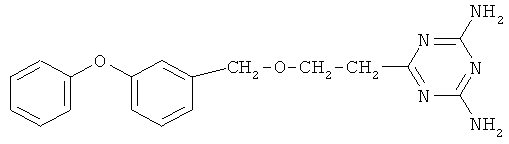
В реактор, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, помещают 4 г (0,048 моль) дициандиамида, 2,7 г (0,048 моль) гидроокиси калия и 30 мл диметилфорамида, затем добавляют 10 г (0,04 моль) 3-феноксифенилметоксипропионитрила в 10 мл диметилфорамида. Реакционную массу энергично перемешивают в течение 15 часов при температуре 130-135°С.
Реакционную массу охлаждают и осаждают 6-(3-феноксифенилметоксипропио)-2,4-диамино-симм-триазин холодной водой, при этом образуются белые хлопья. Далее смесь фильтруют на фильтре Шотта, промывают теплой водой и сушат. Конечный продукт перекристаллизовывают из хлороформа.
Выход 11,72 г (0,0348 моль, 87%). Т.пл. 187-190°С. Спектр ЯМР 1Н, δ, м.д.: 7,04-7,72 м (9Н, С6Н5ОС6Н4), 6,17 с (4Н, NH2), 4,2 с (2Н, Ar-СН2-О), 3,32-3,36 (т, 2Н, СН2), 2,13-2,27 (т, 2Н, CH2-CN). Масс-спектр, m/z (Iотн, %): 337 [М+] (100), 43 (18).Найдено, %: С 64.08; Н 5.63; N 20.81. C18H19N5O2. Вычислено, %: С 64.10; Н 5.60; N 20.80.
Пример 8. 6-[1-Метилэтил-1-(3-феноксибензоат)]-2,4-диамино-симм-триазин.
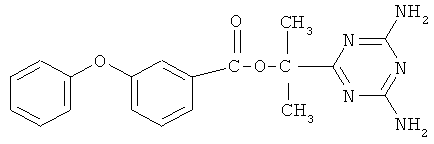
В реактор, оборудованный механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, помещают 3,59 г (0,043 моль) дициандиамида, 2,41 г (0,043 моль) гидроокиси калия и 30 мл диметилфорамида, затем добавляют 10 г (0,036 моль) 2-метил-2-(3-феноксибензоат)пропионитрила в 10 мл диметилфорамида. Реакционную массу перемешивают в течение 15 часов при температуре 130-135°С.
Реакционную массу охлаждают и осаждают 6-(2-метил-2-(3-феноксибензоат)пропио)-2,4-диамино-симм-триазин холодной водой, при этом образуются белые хлопья. Далее смесь фильтруют на фильтре Шотта, промывают теплой водой и сушат. Конечный продукт перекристаллизовывают из хлороформа.
Выход 11,83 г (0,0324 моль, 90%). Т.пл. 200-201°С. Спектр ЯМР 1Н, δ, м.д.: 7,24-7,86 м (9Н, С6Н5ОС6Н4), 6,75 с (4Н, NH2), 1,8 с (6Н, СН3). Масс-спектр, m/z (Iотн, %): 365 [М+] (100), 194 (17), 85 (18), 43 (14). Найдено, %: С 62.49; Н 5.24; N 19.19. C19H19N5O3. Вычислено, %: С 62.47; Н 5.21; N 19.18.
Выводы
Предлагаемый способ позволяет получить 6-(3-феноксифенилзамещенные)-2,4-диамино-симм-триазины, в одну стадию с хорошими выходами. К его достоинствам можно отнести препаративную простоту синтеза и легкость выделения целевых продуктов с высокой степенью чистоты. Структура синтезированных соединений подтверждена масс-, ЯМР 1Н-спектроскопией и элементным анализом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2-(3-ФЕНОКСИФЕНИЛЗАМЕЩЕННЫХ)БЕНЗИМИДАЗОЛОВ | 2011 |
|
RU2453539C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(3-ФЕНОКСИФЕНИЛЗАМЕЩЕННЫХ)БЕНЗОКСАЗОЛОВ | 2011 |
|
RU2473546C2 |
| 3-ФЕНОКСИФЕНИЛСОДЕРЖАЩИЕ 1,3-ДИКЕТОНЫ В КАЧЕСТВЕ ИСХОДНЫХ СОЕДИНЕНИЙ ДЛЯ ПОЛУЧЕНИЯ ИХ ХЕЛАТНЫХ КОМПЛЕКСОВ С ИОНАМИ МЕДИ (II) И СПОСОБ ПОЛУЧЕНИЯ 3-ФЕНОКСИФЕНИЛСОДЕРЖАЩИХ 1,3-ДИКЕТОНОВ | 2012 |
|
RU2475473C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(3-ФЕНОКСИФЕНИЛ)БУТАН-1,3-ДИОНА | 2013 |
|
RU2529029C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-МЕТИЛ-2-(3-ФЕНОКСИБЕНЗОАТ)ПРОПИОНИТРИЛА | 2009 |
|
RU2398762C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ФЕНОКСИФЕНИЛАЦЕТОНИТРИЛА | 2011 |
|
RU2451669C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ЗАМЕЩЕННЫХ-3-(3-ФЕНОКСИФЕНИЛ)-2-ПРОПЕНЕНИТРИЛОВ | 2008 |
|
RU2366647C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3- И 4-(1,5,3-ДИТИАЗАЦИКЛОАЛКАН-3-ИЛ)БЕНЗАМИДОВ | 2014 |
|
RU2574073C2 |
| Способ получения производных бензиламина | 1979 |
|
SU786885A3 |
| Способ получения смеси 2,4-диамино-6-алкилтио-S-триазинов с 2,4-диамино-6-хлор-S-триазинами | 1984 |
|
SU1599370A1 |
Описывается способ получения 6-(3-феноксифенилзамещенных) 2,4-диамино-симм-триазинов формулы

где Х = одинарная связь, -СН=СН-; 
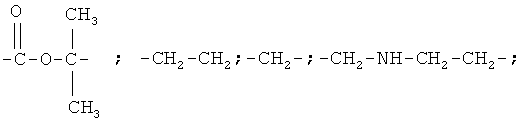 -СН2-О-СН2-СН2-, заключающийся во взаимодействии соответствующих нитрилов с дициандиамидом в присутствии гидроокиси калия в диметилформамиде при температуре 130-135°С и при мольном соотношении нитрила и дициандиамида, равном 1:1,2. Способ обеспечивает высокий выход и высокую степень чистоты целевого продукта, который может найти применение в качестве полупродуктов в синтезе биологически активных веществ. 8 пр.
-СН2-О-СН2-СН2-, заключающийся во взаимодействии соответствующих нитрилов с дициандиамидом в присутствии гидроокиси калия в диметилформамиде при температуре 130-135°С и при мольном соотношении нитрила и дициандиамида, равном 1:1,2. Способ обеспечивает высокий выход и высокую степень чистоты целевого продукта, который может найти применение в качестве полупродуктов в синтезе биологически активных веществ. 8 пр.
Способ получения 6-(3-феноксифенилзамещенных)2,4-диамино-симм-триазинов формулы

Х = одинарная связь, -СН=СН-; 
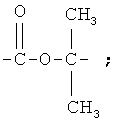 -СН2-СН2-; -СН2-; -CH2-NH-СН2-СН2-; -СН2-О-СН2-СН2-, заключающийся во взаимодействии карбонитрилов с дициандиамидом в присутствии гидроокиси калия, отличающийся тем, что в качестве карбонитрилов используют 3-феноксибензонитрил, 3-феноксифенилацетонитрил, 3-(3-феноксифенил)акрилонитрил, 3-(3-феноксифенил)-2-бутенонитрил, 3-(3-феноксифенил)пропионитрил, 3-(3-феноксибензиламино)пропионитрил, 2-метил-2-(3-феноксибензоат)пропионитрил или 3-феноксифенилметоксипропионитрил, при этом процесс проводят при мольном соотношении соответствующего карбонитрила и дициандиамида, равном 1:1,2, при температуре 130-135°С в присутствии диметилформамида.
-СН2-СН2-; -СН2-; -CH2-NH-СН2-СН2-; -СН2-О-СН2-СН2-, заключающийся во взаимодействии карбонитрилов с дициандиамидом в присутствии гидроокиси калия, отличающийся тем, что в качестве карбонитрилов используют 3-феноксибензонитрил, 3-феноксифенилацетонитрил, 3-(3-феноксифенил)акрилонитрил, 3-(3-феноксифенил)-2-бутенонитрил, 3-(3-феноксифенил)пропионитрил, 3-(3-феноксибензиламино)пропионитрил, 2-метил-2-(3-феноксибензоат)пропионитрил или 3-феноксифенилметоксипропионитрил, при этом процесс проводят при мольном соотношении соответствующего карбонитрила и дициандиамида, равном 1:1,2, при температуре 130-135°С в присутствии диметилформамида.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| JP 4300874 А, 23.10.1992 | |||
| JP 4300832 А, 23.10.1992 | |||
| Устройство для фотографической записи звуков или меняющихся токов | 1927 |
|
SU5770A1 |
| Способ получения производных 1-(4-феноксифенил)-1,3,5-триазина | 1973 |
|
SU489333A3 |
Авторы
Даты
2012-05-27—Публикация
2011-04-01—Подача