ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка притязает на приоритет на основании предварительной заявки с регистрационным № 60/878028, поданной 29 декабря 2006.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение отчасти относится к области размножения линий растительных клеток, включая способы размножения растительных клеток в суспензиях в виде отдельных клеток.
УРОВЕНЬ ТЕХНИКИ
На протяжении последних двух десятилетий появилась методика генной инженерии растений наряду с крупными усовершенствованиями в разработке способов крупномасштабного культивирования растительных клеток для получения полезных вторичных метаболитов. С 1995 года (Moffat, 1995; Ma et al., 2003) такие суспензионные культуры растительных клеток все больше и больше использовали в качестве полезной системы клеток-хозяев для экспрессии рекомбинантных белков.
Индуцируемая ауксином каллюсная ткань или суспензии несмотря на происхождение из одной ткани обычно содержат клетки с разными фенотипами. Таким образом, трансгенные линии, создаваемые на основе таких типов клеток, обычно являются высоко гетерогенными с неустойчивыми уровнями экспрессии. Поэтому клоны, продуцирующие многие полезные вторичные метаболиты, получали из отдельных протопластов, например клон клеток с высокой продукцией шиконина, полученный из протопластов Lithospermum erythrorhizon (Maeda et al., 1983).
До настоящего времени было необходимо образование протопластов для того, чтобы дезагрегировать клетки не только в случае селекции клеток, но также в случае электропорации/ПЭГ-опосредованной трансформации культивируемых растительных клеток. Получение протопластов требовалось для выделения отдельных клонов клеток из растительных тканей. Однако обычно в случае протопластов бывает сложно регенерировать их нормальные стенки, поскольку изолированные протопласты обычно задерживают в клеточном цикле, и они плохо делятся (Hahne and Hoffmann, 1984). Во многих исследованиях, проводимых на культивируемых протопластах, показано, что первым и основным образуемым полисахаридом является каллоза, которая состоит из 1, 3-, 8-глюкопираноз (Klein el al., 1981).
Имеющие раны или подвергнутые стрессу растения часто секретируют массу такого глюкана в периплазматические пространства (Currier, 1957). Во время ранних стадий регенерации стенок связывание между целлюлозой и ксилоглюканом является не таким прочным, как связывание в интактных растениях (Hayashi et al., 1986). Так как макромолекулярная организация ксилоглюкана и целлюлозы в первичных клеточных стенках, по-видимому, ответственна за прочность и растяжимость (Hayashi and Maclachlan, 1984), отложение ксилоглюкана, а также целлюлозы вокруг протопластов, по-видимому, является крайне необходимым для их деления и способности к росту. Такое необходимое условие тормозит деление протопласта, таким образом увеличивая время для регенерации в нормальные клетки с клеточными характеристиками, свойственными родительским линиям.
Следовательно, имеющейся в настоящее время технической проблемой в области культивирования растительных клеток является выделение отдельных жизнеспособных клеток, которые можно клонировать, из растительной ткани в культуре (Bourgin, 1983; Tabata et al., 1976). В суспензионной культуре всегда образуются неоднородные агрегаты клеток, и каждый такой агрегат содержит до сотни клеток. Ничего не известно о связи между такими клетками в агрегате, и не было сообщений, в которых бы идентифицировали отдельный фермент, который может диссоциировать агрегаты клеток и поддерживать их в виде отдельных клеток in vitro с интактными клеточными стенками.
В нескольких сообщениях выдвигали предположение о роли пектина в адгезионных свойствах клеток, но такая связь установлена относительно недавно (Bouton et al., 2002). Кроме того, сообщалось о сильном ослаблении адгезионных свойств в клетках (Sterling et al., 2006).
У мутантов qua1-1 наблюдали отдельные обособленные клетки корня (Bouton et al., 2002). Пониженное содержание пектина дополнительно подтверждено в экспериментах по иммунофлуоресценции с использованием антител, вырабатываемых против специфичных эпитопов пектина. Такие наблюдения свидетельствуют о том, что кодируемый фермент может быть вовлечен в синтез пектиновых полисахаридов, и ясно показывают, что пектин вовлечен в адегезионные свойства растительных клеток.
Таким образом, нарушение синтеза пектинов для устранения адгезионных свойств клеток может облегчить разделение клеток. Сообщалось, что изоляция отдельных клеток с использованием однократных обработок ферментами, разрушающими пектин (Naill, 2005), способствовало изоляции отдельных клеток в суспензионных культурах клеток Taxus. Такие отдельные клетки Taxus использовали для скрининга элитных клональных линий с более высоким уровнем продукции таксола. Однако такой способ не применим для поддержания суспензии отдельных клеток в условиях постоянного присутствия фермента в среде. Также самый высокий выход отдельных клеток при такой короткой импульсной обработке ферментом или сочетанием ферментов составлял только от 17,1% до 34,4% (Naill, 2005). Длительная обработка пектиназой в суспензиях клеток риса приводила только к получению суспензии мелких агрегатов при концентрации 0,005%, но не помогала поддерживать суспензию в виде отдельных клеток (Lee et al., 2004). Продолжительные обработки сочетанием ферментов, пектиназой и целлюлазой в течение более чем 8 часов приводили к лизису клеток (Naill, 2005).
Сообщалось об улучшении разделения клеток в суспензионных культурах клеток сои в присутствии колхицина (Umetsu et al., 1975). Для разделения клеток алкалоид добавляли в культуральную среду в более низких концентрациях (0,1-1,0 мМ), чем концентрации (5-20 мМ) для получения хромосомной полиплоидии. Однако колхицин ингибирует митоз в клетках растений и животных (Lewin, 1980). Колхицин связывается с тубулином и препятствует сборке микротрубочек. Поэтому для получения разделения клеток концентрация колхицина и время обработки должны быть как можно более низкими.
Колхициновые алкалоиды использовали для синхронизации роста культивируемых клеток животных, в случае которых алкалоиды обычно добавляют в концентрации 0,5 мМ, когда клетки должны быть задержаны в пределах нескольких часов перед митозом. Хотя морфогенное действие довольно сходно с действием на клетки животных, растительные клетки могут делиться во время роста в присутствии колхицина в концентрации 0,1 мМ (Umetsu et al., 1975). Жизнеспособность клеток снижалась после 4 дней культивирования клеток сои в суспензии в присутствии 1 мМ колхицина. Кроме того, при таких обработках только 44,8% клеток были жизнеспособны, но их можно было поддерживать делящимися, в отличие от клеток животных.
Было исследовано применение ингибиторов деполимеризации тубулина или олигосахаридов для поддержания отдельных клеток в суспензии в культурах растений in vitro. В литературе имеется некоторая информация еще с 1975 года, относящаяся к применению колхицинов для разделения клеток; см. раздел «Ссылки» ниже. Также исследовали ингибиторы тубулина в качестве гербицидов.
Осуществление особых событий трансгеноза и извлечение продуктов в большей степени основано на разработке методик, обеспечивающих такую возможность. Современными способами, используемыми для трансформации агрегатов клеток в суспензии, являются способы, опосредованные Agrobacterium и микроиглами. Способ с использованием Agrobacterium дает степень интеграции остова до 67-90%, что делает такой способ очень неэффективным, при этом опосредованная WHISKERSTM трансформация не может служить в качестве высокопроизводительного способа (HTP). Опосредованный ПЭГ способ всегда используют для протопластов, и показано, что, хотя протопласт табака легко можно трансформировать, сложно осуществить процесс HTP-трансформации вследствие проблем, связанных с регенерацией клеточных стенок.
В данной области, по-видимому, нет информации относительно протоколов трансформации, основанной на суспензионной культуре отдельных клеток. Имеется несколько сообщений о протоколах, основанных на использовании протопластов, но протопласты лишены клеточных стенок в отличие от растительных клеток в суспензиях отдельных клеток, которые обсуждаются ниже.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к простым и совместимым способам разрушения агрегатов клеток в суспензии до отдельных клеток с интактными первичными клеточными стенками. В следующем далее описании обсуждается разделение клеток в суспензии агрегатов клеток, культивируемых в среде, содержащей разрушающие пектины ферменты или соединения, деполимеризующие тубулин, включая колхицин.
Настоящее изобретение также относится к новым применениям соединений для таких целей. Один аспект настоящего изобретения относится к трансформации таких изолированных клеток. Такие способы упрощают и интегрируют способы трансформации, основанной на отдельных клетках, и селекции в технологические процессы осуществления трансгенных и транспластомных событий. Настоящее изобретение также устраняет технические ограничения и с высокой эффективностью создает не содержащие маркеров и однородно экспрессирующие трансгенные линии для удовлетворения различных потребностей при осуществлении программ, связанных со здравоохранением животных, биофармацией и сохранением свойств и защитой сельскохозяйственных растений.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1: Изоляция отдельных клеток в суспензии клеток JTNT1 с интактной клеточной стенкой при постоянных обработках пектолиазой, субкультивируемых в среде в течение 7 суток.
A - нормальная суспензия BY2; B - то же, что и A, но клетки окрашены I2KI, чтобы показать агрегацию клеток; C и D - разделенные клетки после 6 суток непрерывной обработки ферментом; E и F - разделенные отдельные клетки, окрашенные I2KI или без окраски. Обратите внимание на нормальное клеточное деление (F).
Фигура 2: Жизнеспособность клеток BY2 через 6 суток после непрерывной обработки пектолиазой (клетки обработаны FDA и PI) и выход отдельных клеток.
A: агрегаты клеток BY2; B: BY2 в 1 мл инокулята с пектолиазой в среде в течение 5 суток; C: 6 мл инокулята в среде с ферментом на 5 день; D, E и F: фотографии полей микроскопа в случае C; G: контрольные скопления в случае варианта клеток BY2, обработанных BAP и 12% сахарозой; H и I: отдельные клетки в результате 5-дневной непрерывной обработки ферментом клеток из варианта G. Клетки окрашены FDA и PI. Обратите внимание, что мертвые клетки в PI окрашены красным цветом.
Фигура 3: Индукция суспензий, содержащих отдельные клетки, в результате 7-дневных обработок колхицином в среде из суспензий, содержащих агрегаты клеток табака BY2 и Xanthi.
A: Нормальные агрегаты BY2 в суспензии (окрашены Calcafluor). B: Суспензия, содержащая отдельные клетки BY2, в 1 мМ колхицине в течение 7 суток. C: То же, что и B, но увеличено, чтобы показать отдельные клетки с интактными стенками. D: Агрегаты Xanthi в суспензии. E: Агрегаты Xanthi в суспензии, обработанные в течение 7 суток в 0,5 мМ колхицине. Отмечается частичное высвобождение отдельных клеток в 0,5 мМ; и F: Разделенные отдельные клетки Xanthi в 1 мМ колхицине.
Фигура 4: Высвобождение отдельных клеток с интактными клеточными стенками при обработках колхицином суспензий, содержащих агрегаты клеток табака BY2 и Xanthi.
A: Нормальные агрегаты BY2 в суспензии. B: суспензия, содержащая отдельные клетки BY2, в 1 мМ колхицине в течение 7 суток. C и D: Восстановление агрегатов клеток после удаления колхицина (через 4 дня после субкультивирования с использованием 1 цикла культивирования при обработке колхицином). E: Агрегаты Xanthi в суспензии; F: Агрегаты Xanthi в суспензии, обработанные в течение 7 суток 1 мМ колхицином. Обратите внимание на высвобождаемые отдельные клетки в культурах BY2 и Xanthi и наличие интактной клеточной стенки, которая видна в присутствии оптического осветлителя Calcafluor. (Все примеры обрабатывали 0,1% Calcafluor и исследовали в флуоресцентном микроскопе Leica.)
Фигура 5: Высвобождение отдельных жизнеспособных клеток с интактными клеточными стенками при обработках колхицином из агрегатов клеток табака варианта BY2 (адаптированных в среде EP с 12% сахарозой) и агрегатов клеток дурмана в суспензиях.
A: Нормальные агрегаты BY2-V в суспензии. B: Укрупненный вид необработанных агрегатов. C, D и E: Индукция суспензии, содержащей отдельные клетки BY2, в 1 мМ колхицине в течение 7 суток (Клетки при увеличении 10×, 20× и 40×). F: Индукция отдельных клеток в суспензии дурмана при обработке 1 мМ колхицином в течение 7 суток. Все образцы обрабатывали FDA и PI и исследовали в флуоресцентном микроскопе Leica. Отмечается высокая жизнеспособность клеток, наблюдаемая в данном случае при окраске FDA, и очень мало окрашенных красным цветом клеток в PI.
Фигура 6: Влияние DAS-PMTI-1, производного метилиндола, запатентованного Dow AgroSciences (DAS), и эффективного гербицида, ингибирующего микротрубочки, на рост клеток табака NT1. Клетки выращивали в отсутствие или в присутствии 25 или 50 нМ DAS-PMTI-1 в среде NT1B с 3% глицерином в качестве единственного источника углерода. Все значения сырой массы представлены в виде средних ±0,18, полученных для повторов образцов.
Фигура 7: Получение отдельных клеток и колоний из суспензионных линий DAS GAD1762-034.
Фигуры 8A, 8B и 8C: 2-6-недельный рост колоний из отдельных клеток DAS GAD1762-034.
Фигура 9: Образцы собирали на 7 и 13 день на протяжении более чем 4 циклов субкультивирования и осуществляли анализ экспрессии. Полученные данные об экспрессии представлены на графике.
Фигура 10: Отдельные клетки среди клеток BY2, которые выделяли, используя DAS-PMTI-1. Концентрацию 20-50 нМ использовали для получения отдельных клеток после 5 дней субкультивирования. Обратите внимание, что клетки представляют собой отдельные клетки (пара имеет перекрывающиеся края), и изображение получено в дифференциальном интерференционном контрастном микроскопе, соединенном с конфокальной системой визуализации.
Фигура 11: Экспрессия YFP (плазмида Ubi10-YFP) после 72 часов обработки ПЭГ. В одной из небольших дочерних (делящихся) клеток в плоскости фокусировки видна экспрессия GFP, показывающая, что экспрессия может быть стабильной.
Фигура 12: Слева: необработанная контрольная ткань ингибирована 100 мг/л канамицина. Справа: полученный из отдельной клетки предполагаемый транспластомный изолят, растущий на среде для селекции.
Фигура 13: Получение клональных линий из суспензий, содержащих отдельные клетки моркови. Газонный рост на M-среде, засеянной суспензией, содержащей необработанные агрегаты (панель A). Рост дискретных колоний на среде, засеянной отдельными клетками (панель B).
Фигура 14: Обработка 0,5-1 мМ колхицином в жидкой среде, и культуры, которые анализировали на 14 день после закладки субкультуры (конец второго цикла субкультивирования). A: Отдельные клетки высвобождаются из кластеров. B: Агрегаты с плотно упакованными клетками, окрашенные прижизненным красителем FDA. C и D: Окрашенные FDA отдельные клетки, высвобождаемые при обработке 1 и 0,5 мМ соответственно, после фильтрования суспензии (с использованием фильтров с диаметром пор 100 мкм). E и F: Более крупный вид отдельных клеток, показанных на фигуре D.
Фигура 15: Кривая роста отдельных клеток JTNT1 в ответ на MTI.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Возможность выделять и выращивать отдельные клетки имеет многочисленные возможные применения. Например, способы, описанные в настоящей публикации, применимы для усовершенствования способов, связанных с продуктивностью культур растительных клеток, используемых в области здравоохранения животных.
Таким образом, способы согласно настоящему изобретению применимы для повышения эффективности способов, используемых в области здравоохранения животных и получения биофармацевтических продуктов на основе растительных клеток. Варианты осуществления настоящего изобретения могут помогать проводить скрининг элитных клонов трансгенных клеток, например осуществлять закладку суспензионных мини-культур клеток для минимизации разбросов между партиями, чтобы разработать стандартный рабочий протокол (SOP) для систем трансформации, основанной на отдельных клетках, чтобы минимизировать или исключить наличие нетрансгенных клеток в агрегатах. Итак, аспекты настоящего изобретения применимы в HTP (высокоэффективном способе) скрининга в области здравоохранения животных и программах по улучшению линий клеток-хозяев.
Настоящее изобретение также иллюстрирует и обеспечивает возможность для дальнейшей разработки основанных на одиночных клетках анализов и способов сортировки клеток для идентификации стабильно экспрессирующих клеток, на основании экспрессии РНК, связанной с клеточными зондами, используемыми для исследования гашения флуоресценции.
Такие отдельные клетки также применимы для быстрого скрининга сайт-специфичной гомологичной рекомбинации вместо современной основанной на протопластах временной системы. Например, суспензии клеток кукурузы сорта Black Mexican Sweet (BMS) и суспензии клеток канолы могут обеспечивать отдельные системы для таких применений. Таким образом, целенаправленную гомологичную рекомбинацию, например, можно использовать в вариантах осуществления настоящего изобретения. Такой тип методики является, например, предметом заявки WO 03/080809 A2 и соответствующей опубликованной заявки на выдачу патента США (USPA 20030232410), относящейся к применению цинковых пальцев для целенаправленной рекомбинации. В данной области также известно применение рекомбиназ (например, cre-lox и flp-frt).
Растительные системы экспрессии in vitro можно использовать для получения полезных фармацевтических продуктов и рекомбинантных белков для здравоохранения животных. Ключевое преимущество таких растительных систем экспрессии заключается в том, что они являются эукариотическими по природе - обладающими эндомембранными системами и секреторными путями, сходными с системами и путями в клетках млекопитающих. Поэтому сложные белки в основном эффективно подвергаются фолдингу и сборке с соответствующими посттрансляционными модификациями.
Другим преимуществом продуцирующих растительных систем является возможность увеличения масштаба. Фактически неограниченные количества рекомбинантного белка могут быть выращены либо в ограниченной зеленой ткани, либо в увеличенном масштабе на промышленном оборудовании с использованием систем ферментации или биореакторов после скрининга элитных экспрессирующих клонов и увеличения объема таких гомогенно экспрессирующих клеточных линий.
В данном описании приведены примеры двух методик получения отдельных клеток. Обе методики успешно работали для разделения жизнеспособных отдельных клеток. Однако способ с использованием колхицина является более предпочтительным по сравнению со способом расщепления ферментами при получении большого объема суспензии отдельных клеток с интактной клеточной стенкой, по меньшей мере, в двух типах клеток в суспензиях. В случае ферментного способа наблюдали не только ингибирование клеточного роста, но и более высокую степень смертности. Также в том случае, когда жизнеспособные клетки помещали на гелевую среду без удаления или промывки использованной среды, клетки погибали и колонии не были видны. Применение таких суспензий отдельных клеток, полученных с использованием способа расщепления ферментами, может быть рекомендовано, но потребуется дополнительная оптимизация.
Напротив, добавление ингибиторов тубулина, подобных колхицину, тестированных в настоящем исследовании, по-видимому, очень полезно для разделения растительных клеток и отбора отдельных клеток. Такой способ является простым, так как он заключается только в добавлении подходящего объема колхицина в жидкую среду во время стадии субкультивирования. Способ может быть основным инструментом, который будет иметь огромное значение для получения заданной суспензии в таком процессе, как закладка суспензионных мини-культур с использованием в качестве исходных клеток однородного инокулята, состоящего из клеток с высокой жизнеспособностью. Способ может повысить эффективность электропорации, опосредованной WhiskersTM и опосредованной Agrobacterium трансформации. Такой способ получения отдельных клеток также можно использовать для выделения элитных клонов линий, продуцирующих рекомбинантные белки, из трансгенных агрегатов в суспензии.
Хотя для выделения отдельных клеток применяли основанный на протопластах способ, настоящий способ с использованием колхицина является более простым и более эффективным. Отдельные клетки, полученные колхициновым способом, более стабильны, чем протопласты, в результате наличия стенок и не требуют регенерации клеточных стенок. Клетки имеют стенки с каркасом из ксилоглюкана/целлюлозы нормального состава (Hayashi and Maclachlan, 1984). Они не продуцируют каллозу во время размножения и разделения клеток, как видно в исследованиях, в которых клетки сеянцев сосны, растущих в присутствии колхицина, не имеют аномального утолщения стенки, а разрастаются радиально (Itoh, 1976). Рост клеток является нормальным после субкультивирования в среде, не содержащей колхицина, тогда как большинство протопластов подвергаются задержке и плохо делятся (4). Культивируемые с колхицином клетки могут иметь такую же степень полиплоидии, однако концентрации колхицина, используемые в настоящем исследовании (0,1-1,0 мМ), были в 10-100 раз ниже, чем концентрация, требуемая для индукции полиплоидии (5-20 мМ). Извлечение отдельных клеток было намного лучше при использовании колхицинового способа, чем в случае протопластов (Hyashi and Yoshida, 1988). Такие клетки могут быть дополнительно тестированы с использованием проточной цитометрии, чтобы оценить уровень полиплоидии и стабильность генома. Кроме того, повышенные уровни плоидности могут обеспечивать дополнительное преимущество, состоящее в повышении уровня рекомбинантного белка в результате увеличенного количества копий в трансформированных клетках.
Активность галактуронана проявлялась в виде биологических функций в разделении клеток в суспензии клеток сои, и о нем сообщалось как об олигосахариде, который проявлял биологические функции в разделении клеток (Albersheim and Darvill, 1985). Поэтому галактуроновую кислоту также тестировали в таких суспензиях клеток, чтобы добиться разделения клеток без какого-либо изменения плоидности, на тот случай, если имеет место какое-либо индуцированное колхицином изменение плоидности в суспензиях отдельных клеток, о которых сообщается в настоящем описании. Итак, дополнительно оценивается прямое применение галактуронана и других сходных олигосахаридов для сравнения эффективности в разделении клеток посредством нарушения адгезионных свойств клеток. Таким образом, настоящее изобретение относится к простым способам, которые являются воспроизводимыми и совместимыми с несколькими прохождениями клеточного цикла в суспензии при одновременном поддержании стабильности генома клеток.
Одним предпочтительным соединением, приведенным в качестве примера в настоящем описании, является DAS-PMTI-I. Указанное соединение, по-видимому, является очень эффективным (в ~100-1000 раз более эффективным, чем колхицин, по своему влиянию на рост культур). После 7 дней обработки происходит значительная гибель клеток при концентрации 0,5 мМ, но когда такие культуры субкультивировали в отсутствие DAS-PMTI-I, клетки PH в суспензии восстанавливались в виде отдельных клеток с низкой частотой через 2 недели. Может быть осуществлена дополнительная оптимизация, чтобы определить предпочтительные концентрации такого соединения в зависимости от предпочтительных применений (например, от типа клетки и тому подобного) для разделения отдельных клеток. Можно использовать другие ингибиторы MT1, имеющие сходные функции, при разделении данных клеток посредством нарушения синтеза пектина. В свете настоящего описания дополнительные ингибиторы MT1 и их аналоги можно тестировать и подвергать скринингу в отношении их эффективности в получении и поддержании отдельных клеток.
Химическая структура DAS-PMTI-1, также известного как этиловый эфир(4-хлор-1,5-дифенил-1H-пиразол-3-илокси)уксусной кислоты, показана ниже:

Предпочтительный род соединений для применения согласно настоящему изобретению представлен соединениями типа DAS-PMTI-1. Такие соединения могут соответствовать общей структуре, показанной выше, и включают их функциональные (для применения согласно настоящему изобретению) производные и аналоги.
Далее приведена общая химическая формула некоторых известных ингибиторов микротубулина для применения согласно настоящему изобретению. Хотя DAS-PMTI-1 является предпочтительным вариантом, практически любое ингибирующее микротубулин средство можно использовать согласно настоящему изобретению. В некоторых предпочтительных вариантах один или несколько представителей следующего рода диарилпиразола используют в сочетании с колхицином:
где
X = CO2R, CH2CO2R, CH2CH2CO2R, (CH2)3CO2R, OCH2CO2R, OCH(CH3)CO2R, OC(CH3)2CO2R, CH2OCH2CO2R, CH2CH(CO2CH2CH3)CO2R, OCH(CO2CH2CH3)CO2R;
Y = CN, Cl, Br, F, NO2;
Ar1 = незамещенный фенил, незамещенный пиридин, 1-3-замещенный фенил, 1-3-замещенный пиридин, замещенный галогеном или CN;
Ar2 = незамещенный фенил, незамещенный пиридин, 1-3-замещенный фенил, 1-3-замещенный пиридин, замещенный галогеном или CN;
R = H или 1-5-углеродный неразветвленный или разветвленный сложный эфир.
Таким образом, суспензионные культуры из отдельных растительных клеток получали, используя ингибиторы микротрубочек, и их можно было поддерживать в культуре в течение, по меньшей мере, 2 циклов субкультивирования. Такие суспензии из отдельных клеток являются уникальными в том, что они имеют интактную клеточную стенку и, кроме того, они существуют отдельно друг от друга.
«Трансгенное» растение, растительная клетка и тому подобное (если не оговорено особо) представляют собой целое растение, растительную клетку, культуру растительных клеток, линию растительных клеток, культуру ткани растений, низшее растение, культуру клеток однодольного растения, культуру клеток двудольного растения или потомство, полученное из трансформированной растительной клетки (или протопласта или тому подобного), которые содержат чужеродную ДНК, введенную лабораторным способом, исходно не присутствующую в нативной нетрансгенной растительной клетке того же вида. Термины «трансгенное растение» и «трансформированное растение» иногда использовали в данной области как синонимы для определения растения, ДНК которого содержит экзогенную молекулу ДНК. Трансгенное растение может быть стабильно трансформировано так, чтобы оно содержало чужеродную ДНК, которая функционирует и включена в геномную ДНК растения, или является трансгенным растением, которое было трансформировано основанными на вирусах векторами и временно экспрессировало чужеродную ДНК.
Термин «изолированный» и «очищенный» означает «подвергнутой обработке человеком» и может быть применим к полинуклеотидам и белкам. Клонированный полинуклеотид представляет собой, например, изолированный полинуклеотид.
Способы трансформации. Указанные отдельные клетки тестировали в отношении трансформации ядер и пластид с использованием Agrobacterium и полиэтиленгликоля (ПЭГ) в случае ядерной трансформации и баллистическую бомбардировку в случае трансформации пластид. При попытках трансформации ядер показана доставка плазмидной ДНК и временная экспрессия желтого флуоресцирующего белка. Клетки подвергали восстановлению при трансформации пластид, и стабильная трансформация показана с помощью ПЦР-анализа. Наращивали массу изолятов транспластомных каллюсов и анализировали в отношении селектируемого маркера, экспрессии гена nptII, с помощью ELISA.
Методика трансформации, описанная в настоящей публикации, может быть применена в способах, используемых в здравоохранении животных. Однако трансформация, основанная на отдельных клетках, с помощью новых способов доставки, включая доставку наночастиц, также может обеспечивать уникальные подходы к трансформации сельскохозяйственных растений в дополнение к использованию типов клеток-хозяев, применяемых для продуцирования рекомбинантных белков.
Разработка трансформации отдельных клеток с использованием способов, основанных на ПЭГ и/или электропорации, позволяет получать отдельные клетки с интактной стенкой, применимые так же, как и системы клеток бактерий/млекопитающих, а также применимые в высокопроизводительных системах трансформации для таких типов клеток.
Возможность трансформации отдельных клеток имеет многочисленные возможные применения. Например, способы, раскрытые в данном описании, применимы для усовершенствования методик, связанных с продуктивностью культур растительных клеток для применений в области здравоохранения животных. Кроме того, способы согласно настоящему изобретению применимы для повышения эффективности методик, используемых в области здравоохранения животных и для получения биофармацевтических продуктов на основе растительных клеток. Способы согласно настоящему изобретению также могут помогать в проведении скрининга элитных клонов трансгенных клеточных линий. Такие возможности можно использовать для закладки суспензионных клеточных мини-культур, чтобы минимизировать изменчивость экспрессии в разных партиях, и для разработки SOP, чтобы минимизировать или исключить нетрансгенные клетки или наличие множественных событий в агрегатах.
Как обсуждалось в разделе «Уровень техники», основанные на Agrobacterium способы очень неэффективны, а основанная на WHISKERSTM трансформация не может служить в качестве высокопроизводительного способа. ПЭГ-опосредованный способ используют в случае протопластов. Хотя протопласты табака легко подвергаются трансформации, их трудно подвергнуть процессу HTP-трансформации вследствие проблем, связанных с регенерацией клеточных стенок.
В отличие от этого настоящее изобретение обеспечивает интактную клеточную стенку. Опосредованный ПЭГ способ является первым способом, в котором сообщается об отдельной клетке с интактной клеточной стенкой. Способы согласно настоящему изобретению также являются высокоэффективными. Также способ исключает интеграцию остова благодаря использованию для трансфекции очищенных фрагментов плазмид. Протокол для быстрой трансформации с использованием отдельных растительных клеток при осуществлении таких способов, как активируемая флуоресценцией сортировка клеток (FACS), может быть идеальным для миниатюризации и автоматизации способов скрининга подходящих событий при пониженной стоимости ресурсных и временных затрат. Такой протокол может значительно улучшить современный способ селекции каллусов или агрегатов в суспензии посредством скрининга трансформированных клеток с помощью сортировщиков клеток и позволяет определять гомогенно экспрессирующие элитные события для дальнейшего совершенствования при промышленном исследовании или получении на конвейере.
Таким образом, способы согласно настоящему изобретению обеспечивают фундаментальные основы, например, для исследования и разработки новых биологических технологий, для HTP-скрининга для нужд здравоохранения животных и улучшения линий клеток-хозяев.
Настоящее изобретение обеспечивает возможность дальнейшей разработки анализов, основанных на отдельных клетках, и способов сортировки клеток для идентификации стабильно экспрессирующих клеток на основе экспрессии РНК, связанной с клеточными зондами, используемыми для исследования гашения флуоресценции.
Такие отдельные клетки также применимы для временного и/или стабильного скрининга представляющего интерес гена (GOI) при осуществлении программ по сохранению свойств и защите сельскохозяйственных растений.
Если специально не указано или не предполагается иное, термины, используемые в настоящем описании в единственном числе, означают «по меньшей мере, один».
Все патенты, заявки на выдачу патентов, предварительные заявки и публикации, указанные или цитированные в настоящем описании, включены в виде ссылки в полном объеме в той степени, в которой они не противоречат конкретным идеям настоящего описания.
ПРИМЕР 1 - Материалы и способы.
Культивируемые в суспензии клетки BY2 получали из японского табака и поддерживали в среде LSBY2 в 7-дневном цикле. Суспензию дурмана обыкновенного и суспензии гаванского табака Pettite инициировали из каллусов, полученных в DAS, и суспензии Xanthi получали от профессора Jack Widholm из UIUC, IL. Суспензионные клетки JT-NT1, полученные из Вашингтонского университета, которые поддерживали в среде NT1B в 7-дневном цикле, использовали только для исследования фермента расщепления пектина, чтобы разделить клетки на отдельные клетки. Клетки культивировали во встряхиваемых колбах при 25-28ºC в темноте на орбитальном встраивающем устройство при 150 об/мин. Колхицин получали из Fluka, DAS-PMTI-1 (Martin et al., 2001; Smith et al., 2001), получали из DAS CRS, и расщепляющие пектин ферменты (пектолиазу Y и пектиназу) получали из Sigma. Концентрации исходного раствора в случае обоих ингибиторов полимеризации тубулина, используемых в данном исследовании, растворяли в ДМСО, чтобы получить 0,5 М маточный раствор. Тестируемые концентрации ферментов пектиназы и пектолиазы были в диапазоне от 0,0005% до 0,005%. Суспензионные линии клеток табака NT-I и BY-2, например, являются подходящими для практического осуществления настоящего изобретения. Клетки BY-2 являются коммерчески доступными и применимы, например, согласно Nagata et al. (Nagata, T., Nemoto, Y. and Hasezawa. S. [1992], Tobacco BY-2 cell line as the "HeLa" cell in the cell biology of higher plants. Int. Rev. Cytol. 132: 1-30). Клетки NT-I исходно получали из Nicotiana tabacum L. cv. ярко-желтого (bright yellow) 2. Линия клеток NT-I широко используется и легко доступна; хотя любую суспензионную линию табака можно использовать при практическом осуществлении настоящего изобретения. Следует отметить, что происхождение линии клеток NT-I неясно. Кроме того, линия клеток, по-видимому, вариабельна и склонна изменяться в ответ на условия культивирования. Клетки NT-I, подходящие для применения в приведенных ниже примерах, доступны из Американской коллекции типов культур с номером доступа ATCC 74840. См. также патент США № 6140075.
ПРИМЕР 2 - Микроскопические исследования.
Размножение и разделение клеток наблюдали в световом микроскопе (используя оптическую микроскопию по Номарскому и темнопольную оптическую микроскопию). Сферические клетки и отдельные клетки подсчитывали, используя гемацитометр, чтобы определить степень размножения и разделения клеток соответственно. Количество клеток в агрегатах определяли, используя обработку 5% (масс./об.) триоксидом хрома в течение 16 часов и подсчитывая клетки (Henshaw et al., 1966). Жизнеспособность клеток определяли посредством окрашивания клеток (Yokoyama et al., 1997) диацетатом флуоресцеина (FDA) и йодидом пропидия (PI), используя флуоресцентный микроскоп (Zeiss Photomicroscope). Чтобы определить наличие клеточной стенки в таких культурах отдельных клеток, использовали оптический осветлитель. В данном исследовании использовали Calcafluor, полученный из Sigma, который является специфичным флуоресцентным красителем целлюлозы, и образование комплекса целлюлозы-Calcafluor наблюдали с помощью флуоресцентной микроскопии (Zeiss Photomicroscope). Calcofluor (Sigma Chemical Co., St. Louis, Mo.) готовили в виде 0,1% (масс./об.) раствора в буфере PBS и хранили в темноте при комнатной температуре (Kwok et al., 2003). Перед использованием краску Calcafluor центрифугировали при 15000 g в течение 2 мин, чтобы удалить осадок. К разделенным клеткам добавляли одну или две капли раствора Calcafluor. После выдерживания в течение 2 или 3 минут при комнатной температуре суспензию клеток промывали водой и контрастно красили 0,1% голубым Эванса (Sigma; E-2129) в TBS (pH 7,2) в течение 1 минуты при комнатной температуре и исследовали в УФ-микроскопе при длине волны 395-415 нм (наблюдаемый свет 455 нм). Клеточные стенки выглядели в виде голубовато-белых или бирюзовых овальных ореолов.
ПРИМЕР 3 - Результаты непрерывных обработок пектиназой и пектолиазой в среде.
Суспензии клеток табака сорта Petite Havana BY2 и NT1 использовали для исследования влияния расщепляющих пектин ферментов, пектиназой и пектолиазой, в разных концентрациях. Суспензии JT-NT1 лучше отвечали на обработки пектиназой, а суспензия BY2 лучше отвечала на обработки ферментом пектолиазой, чем другой фермент. Однако имела место гибель клеток, которую визуализировали, используя прижизненные красители, и ингибирование роста клеток. Объем инокулята клеток на стадии субкультивирования увеличивали до 12 раз, чтобы получить приемлемый выход отдельных клеток. Клетки PH и BY2 можно было культивировать в течение, по меньшей мере, 7 суток в культуре с пектолиазой. Длительное культивирование таких клеток при низкой концентрации фермента пектолиазы (3 единицы активности), по-видимому, было вредным. Клетки на 6-й день культивирования давали высокий выход отдельных клеток в том случае, когда объем инокулята составлял 6 мл (исходный отъем инокулята в стационарной фазе), и их культивировали в 50 мл свежей среды вместе с ферментом. Среди таких клеток при тестировании с использованием FDA и PI через 6 дней культивирования наблюдали высокий уровень отдельных жизнеспособных клеток (фигура 1 и 2). На рост суспензионной культуры сильно влияли ферментные обработки, и субкультивирование клеток в среде, содержащей такой же фермент, по-видимому, было губительным. Рекомендуется обработка свежих клеток максимально в течение до 7 суток в культуре, и затем такие клетки следует перенести в среду без фермента, чтобы восстановить рост. В лучшем случае такой способ можно применять для скрининга элитных трансгенных клонов в гетерогенных агрегатах или для закладки высокопроизводительных суспензионных культур с однородным объемом клеток.
Фигура 1: Изоляция отдельных клеток в суспензии клеток JTNT1 с интактной клеточной стенкой при непрерывных обработках пектолиазой и субкультивировании в среде в течение 7 суток.
A - нормальная суспензия BY2; B - то же, что и A, но клетки, окрашены I2KI, чтобы показать агрегацию клеток; C и D - разделенные клетки после 6 суток непрерывной обработки ферментом; E и F - разделенные отдельные клетки, окрашенные I2KI или без окраски. Обратите внимание на нормальное клеточное деление (F).
Фигура 2: Жизнеспособность клеток BY2 через 6 суток после непрерывной обработки пектолиазой (клетки обработаны FDA и PI) и выход отдельных клеток.
A: агрегаты клеток BY2; B: BY2 в 1 мл инокулята в среде с пектолиазой в течение 5 суток; C: 6 мл инокулята с ферментом в среде на 5 день; D, E и F: фотографии полей микроскопа в случае C; G: контрольные скопления в случае варианта клеток BY2, обработанных BAP и 12% сахарозой; H и I: отдельные клетки в результате 5-дневной непрерывной обработки ферментом для G. Клетки окрашены FDA и PI. Обратите внимание, что мертвые клетки в PI окрашены красным цветом.
ПРИМЕР 4 - Влияние колхицина на рост клеток BY2, NT1, Petite Havana (PH) и Xanthi (Xan) и Jimson Weed (JM) в суспензии.
После 7-дневного культивирования количество клеток BY2, Xan и клеток JM реагировало на 0,5 мМ и 1 мМ концентрацию колхицинов (фигура 3, 4 и 5). Однако суспензии клеток с высоким уровнем отдельных клеток наблюдали в случае концентрации 1 мМ в суспензии клеток BY2 и клеток JM. Важно отметить, что на рост клеток JM сильно влияла даже 0,5 мМ концентрация колхицина, и рост невозможно было восстановить даже после дополнительной недели роста в такой же среде. Это свидетельствует о том, что деление клеток ингибируется колхицином в клетках JM, и далее необходимо тестировать более низкие концентрации, чтобы оптимизировать разделение клеток без снижения плотности или роста культуры. Интересно, что такое ингибирование роста не наблюдали в суспензиях клеток BY2, которые могли расти в течение, по меньшей мере, 14 суток в условиях постоянного присутствия 1 мМ колхицина. Набухание клеток впервые наблюдали на 3-й день, и клетки принимали сферическую форму по мере продолжения культивирования клеток BY2 в суспензии. После того как сферические клетки постепенно высвобождались из агрегатов, разделение клеток предположительно сопровождалось размножением клеток. Примерно такое же количество клеток BY2 присутствовало в среде, содержащей 1 мМ колхицина, через 7 суток, как и в контрольных культурах. Когда клетки, культивируемые в течение 7 суток в 1 мМ колхицине, субкультивировали в среде, не содержащей колхицина, способность расти в виде агрегатов восстанавливалась не полностью, вместо этого ~90% клеток в суспензии были видны в виде отдельных интактных клеток. Размножение и разделение клеток также частично имело место в агрегатах суспензионных клеток во всех других клеточных суспензиях, тестированных в среде, содержащей 0,5 мМ колхицин. В суспензиях клеток JT-NT1 и JM имел место ингибирующий рост ответ. В суспензиях клеток NT1 регистрировали почти 50% снижение роста в 1 мМ колхицине.
Среди таких клеток наблюдали крупные сегрегированные клетки, сходные с клетками среди разделенных эпидермальных клеток корня, о наличии которых сообщалось в случае мутантов по пектину qual-1 (Bouton, 2002). Сходную частичную сегрегацию клеток с общей сферической формой наблюдали во всех типах клеток в суспензии, тестированных с DAS-PMTI-1. Однако наблюдали очень значительное влияние на рост клеток в суспензиях, обработанных DAS-PMTI-1 в концентрации 0,5 мМ. Могут быть осуществлены дополнительные эксперименты, чтобы оптимизировать условия разделения клеток с использованием такого соединения и чтобы минимизировать ингибирование роста клеток. Как показано в тестах с окрашиванием FDA и PI, имеет место высокая степень жизнеспособности клеток в тестированных суспензиях клеток BY2 и JM. Клетки были сильно закругленными, и во многих клетках наблюдали клювовидный вырост, свидетельствующий о растяжении клеточной стенки активных клеток, возможно, перед делением клеток. Разделенные клетки были крупными, увеличенными в объеме и имели сферическую форму, которая типична для протопласта. Краситель Calcafluor использовали для определения наличия или отсутствия интактных клеточных стенок. Фигура 4. Ясно показано наличие клеточной стенки вокруг таких округлых клеток. Исследование таких клеток с использованием конденсора доля темнопольной микроскопии показало наличие толстой клеточной стенки вокруг клетки (фигура 3: панель C). Такие отдельные клетки были жизнеспособными во встряхиваемых культурах, так как не было мертвых клеток вследствие отсутствия пектина и наличия крупных клеток, которые видны в тесте с прижизненным окрашиванием (фигура 5). Как показано на данной панели, наблюдали очень высокий процент живых здоровых клеток. Следовательно, можно применять такие клетки во встряхиваемых культурах или в планшетах с микролунками в качестве инокулята, содержащего точное количество клеток.
Фигура 3: Индукция суспензий, содержащих отдельные клетки, в результате 7-дневных обработок колхицином в среде, из суспензий, содержащих агрегаты клеток табака BY2 и Xanthi. A: Нормальные агрегаты BY2 в суспензии (окрашены Calcafluor). B: Суспензия, содержащая отдельные клетки BY2, в 1 мМ колхицине в течение 7 суток. C: То же, что и B, но увеличено, чтобы показать отдельные клетки с интактными стенками. D: Агрегаты Xanthi в суспензии. E: Агрегаты Xanthi в суспензии, обработанные в течение 7 суток в 0,5 мМ колхицине. Отмечается частичное высвобождение отдельных клеток в 0,5 мМ; и F: Разделенные отдельные клетки Xanthi в 1 мМ колхицине.
Фигура 4: Высвобождение отдельных клеток с интактными клеточными стенками при обработках колхицином суспензий, содержащих агрегаты клеток табака BY2 и Xanthi.
A: Нормальные агрегаты BY2 в суспензии. B: суспензия, содержащая отдельные клетки BY2, в 1 мМ колхицине в течение 7 суток. C и D: Восстановление агрегатов клеток после удаления колхицина (через 4 дня после субкультивирования с использованием 1 цикла культивирования при обработке колхицином). E: Агрегаты Xanthi в суспензии; F: Агрегаты Xanthi в суспензии, обработанные в течение 7 суток 1 мМ колхицином. Обратите внимание на высвобождаемые отдельные клетки в культурах BY2 и Xanthi и наличие интактной клеточной стенки, которая видна в присутствии оптического осветлителя Calcafluor. (Все примеры обрабатывали 0,1% Calcafluor и исследовали в флуоресцентном микроскопе Leica.)
Фигура 5: Высвобождение отдельных жизнеспособных клеток с интактными клеточными стенками при обработках колхицином из агрегатов клеток табака варианта BY2 (адаптированных в среде EP с 12% сахарозой) и агрегатов клеток дурмана в суспензиях.
A: Нормальные агрегаты BY2-V в суспензии. B: Укрупненный вид необработанных агрегатов. C, D и E: Индукция суспензии, содержащей отдельные клетки BY2, в 1 мМ колхицине в течение 7 суток (Клетки при увеличении 10×, 20× и 40×). F: Индукция отдельных клеток в суспензии дурмана при обработке 1 мМ колхицином в течение 7 суток. Все образцы обрабатывали FDA и PI и исследовали в флуоресцентном микроскопе Leica. Отмечается высокая жизнеспособность клеток, наблюдаемая в данном случае при окраске FDA, и очень мало окрашенных красным цветом клеток в PI.
ПРИМЕР 5 - Получение отдельных клеток и влияние DAS-PMTI-1 в среде, содержащей глицерин в качестве единственного источника углерода.
В настоящем примере приведено другое обсуждение, касающееся новой содержащей глицерин ростовой среды, влияния низких концентраций DAS-PMTI-1 и параметров роста. Полученные результаты имеют важное значение, так как предыдущие сообщения в литературе свидетельствовали о том, что глицерин подавляет эффекты колхицина, проявляемые в разрушении микротрубочек у сои; таким образом, имеющиеся в данной области сведения были направлены против использования глицерина в среде для таких применений. См., например, Hayashi and Yoshida, 85 PNAS 2618-22 (1988). Кроме того, данные, полученные согласно настоящему изобретению, относительно глицерина являются новыми для растительных клеток, и такие результаты не сообщались ранее. Быстрорастущие культуры табака трех разных генотипов успешно выращивали в течение нескольких месяцев, используя 3% глицерин в качестве единственного источника углерода.
В данном примере также получен график кривой роста, изображающий поведение культуры при двух разных концентрациях DAS-PMTI-1, и проведено сравнение с нулевой обработкой.
Несколько классов соединений, которые разрушают микротрубочки, позволяют получать отдельные клетки. Соединения включают средства, разрушающие или ингибирующие микротрубочки (соединения, связывающие α- и β-тубулин), которые классифицируют на следующие группы: (i) динитроанилины (колхицины, оризалин, трифлуаралин, хлоралин) и (ii) N-фенилкарбамат, такой как бензамид, пронамид, амид фосфорной кислоты, амипрофосметил (Morejohn and Foskett, 1986; Akashi et al., 1988), а также противогрибковое средство, зариламил бензамида (Young, 1991), (iii) противоопухолевые средства, паклитаксел (Morejohn and Foskett, 1986), винкристин, винбластин, и (iv) другие соединения, которые разрушают микротрубочки и/или нарушают свойства стенки, такие как ингибиторы синтеза целлюлозы и ингибиторы образований цитоскелета, такие как алюминий и кумарин, также тестировали в отношении их способности давать отдельные клетки без образования или с образованием небольшого количества микроядер. Кортикальные микротрубочки и митотические микротрубочки имеют разную чувствительность и сочетание соединений из разных классов, перечисленных выше, или из одного класса, но избирательно разрушающие трубочки в такой степени, когда деление клеток не затрагивается, но адгезионные свойства клеток могут быть существенно нарушены, чтобы добиться и поддерживать клетки в стадии отдельных клеток при небольшой или при отсутствии нестабильности генома.
Исследовали эффекты ингибиторов микротрубочек (MTI) на рост клеток табака в суспензионной культуре. Семидневные клетки в стационарной фазе (1 мл) переносили в среду (50 мл) во встряхиваемые колбы объемом 250 мл (Bokros et al., 1993), содержащие разные концентрации (25-1000 нМ) MTI, и выращивали в культурах в течение 7 суток в темноте при 25ºC. И контрольные, и MTI-содержащие колбы содержали ДМСО в конечной концентрации 0,5-0,1% (об./об.). Рост в присутствии таких химических средств оценивали в среде EP12 в случае клеток BY2 и в среде NT1B в случае клеток BTI-NT1, в которых источник углерода заменен 3% глицерином. Ответ таких клеток сравнивали с ответом в среде такого же состава, но с 3% сахарозой в качестве источника углерода. Среду с глицерином использовали потому, что известно, что глицерин является стабилизатором микротрубочек, и в клетках табака, адаптированных в 3% глицерине, не наблюдали фенольных соединений при стрессе.
Образцы клеток в трех повторах, взятые с интервалом в 1 сутки (0,5 мл), осаждали кратковременным центрифугированием во взвешенных микроцентрифужных пробирках и определяли сырую массу. Результаты, представленные на фигуре 6, показывают, что после 2-дневной lag-фазы контрольные клетки быстро росли в течение 4 суток и вступали в стационарную фазу на 6 день. Клетки табака, выращиваемые с 25 нМ DAS-PMTI-1, имели кинетику роста, сходную с кинетикой роста контрольной культуры. Однако сырая масса таких культур была немного выше, чем в контролях во время стационарной фазы, что свидетельствует о стимуляции роста в 50 нМ DAS-PMTI-1. В клетках, выращиваемых в присутствии 0,5-1,0 мМ DAS-PMTI-1, наблюдали полное ингибирование и гибель клеток в течение 3 суток после закладки культуры при исследовании клеток, обработанных FDA и йодидом пропидия, в флуоресцентном микроскопе. Данные показывают, что рост клеток табака ингибируется при концентрации, близкой к пороговому значению 50 нМ, и концентрации выше 100 нМ вызывают ингибирование митоза и гибель клеток.
В отличие от колхицина, динитроанилина, который обладает низкой эффективностью в отношении получения отдельных клеток, в случае которого эффективной является концентрация 0,25-0,5 мМ, DAS-PMTI-1 является очень эффективным при таких низких концентрациях как 5-25 нМ, даже в присутствии глицерина в качестве основного источника углерода как в случае клеток NT1, так и в случае клеток BY2. Диапазон концентраций до 25 нМ является эффективным не только для высвобождения отдельных клеток, но также очень эффективен в том, чтобы не снижать скорость роста клеток в течение периода времени, составляющего 10 суток (фигура 6). Действительно, наблюдается небольшое увеличение биомассы в стационарной фазе роста вследствие того факта, что такие отдельные клетки размножаются. Однако микроскопические исследования не выявили наличия микроядер в таких отдельных клетках.
Фигура 6: Влияние DAS-PMTI-1 на рост клеток табака NT1. Клетки выращивали в отсутствие или в присутствии 25 или 50 нМ DAS-PMTI-1 в среде NT1B с 3% глицерином в качестве единственного источника углерода. Все значения сырой массы представлены в виде средних ±0,18, полученных для повторов образцов.
Состояние отдельных клеток в случае клеток, полученных с использованием DAS-PMTI-1, анализировали в конфокальном микроскопе, и было ясно подтверждено, что они представляли собой отдельные клетки, так как не обнаружены соединенные клетки.
ПРИМЕР 6 - Деконволюция трансгенных суспензионных линий и получение клональных линий
Суспензии табака обычно содержат клетки в агрегатах или небольших кластерах, и они являются высоко гетерогенными. Клетки в культуре могут быть генетически идентичными (гомогенная популяция) или могут проявлять некоторую генетическую изменчивость (гетерогенная популяция). Гомогенную популяцию клеток, полученную из одной родительской клетки, называют клоном. Следовательно, все клетки в клональной популяции являются генетически идентичными и высоко гомогенными в отношении свойств клеток. Суспензии клеток табака BY2 и NT1 часто используют в качестве модельных систем во многих лабораториях.
Указанные клетки легко трансформируются после удаления клеточной стенки (Mathur and Koncz, 1998), непосредственно путем бомбардировки частицами или в результате совместного культивирования с Agrobacterium tumefaciens (An, 1985; Klein et al., 1988; Rempel and Nelson, 1995). Хотя опосредованную A. tumefaciens трансформацию BY-2 рутинно осуществляют во многих лабораториях, авторы обнаружили, что эффективность получения трансгенных каллусов варьирует в разных экспериментах и, главным образом, зависит от качества культуры клеток BY-2. При синхронизации клетки BY-2 в M и ранней G1-фазе в 10 раз более чувствительны к стабильной опосредованной A. tumefaciens трансформации, чем клетки, находящиеся в G2. Кроме того, штамм Agrobacterium LBA4404, который конститутивно экспрессирует ген virG (van der Fits et al., 2000), в 2-5 раз более эффективен в отношении образования трансгенных каллусов. Обычно примерно 500 трансгенных каллусов можно получить из 4 мл клеток BY-2, культивируемых совместно со штаммом Agrobacterium, что позволяет осуществлять программы скрининга по фенотипу. Однако кластеры или агрегаты в суспензиях трансформированных линий, по-видимому, имеют гетерогенные множественные события трансгеноза. В результате происходит изменение уровней экспрессии от одной партии культуры к другой. Способ, основанный на отдельных клетках, применяют для того, чтобы подвергнуть деконволюции химерную смесь клеток в кластере и разделить их на отдельные клетки, чтобы идентифицировать клональные события. Отдельные клетки получали из химерных трансгенных суспензионных линий табака NT1 (GAD1762-034), трансформированных геном селектируемого маркера PAT (фигуры 7 и 8).
Фигура 7: Получение отдельных клеток и колоний из суспензионных линий DAS GAD1762-034. Фигуры 8A, 8B и 8C: 2-6-недельный рост колоний из отдельных клеток DAS GAD1762-034.
Примерно 20 дискретных колоний собирали случайным образом и затем выращивали на свежей среде для селекции. Из таких колоний получали суспензионные линии, и быстро растущие линии получали посредством 6 циклов субкультивирования по 7 суток каждый. Продукция биомассы таких колоний была довольна однородной в разных линиях, и 19 линий затем подвергали анализу в отношении белка.
Образцы собирали на 7 и 13 день на протяжении более чем 4 циклов субкультивирования и осуществляли анализ экспрессии. Полученные данные об экспрессии изображали графически (фигура 9).
На основании анализа данных ясно, что получено несколько клональных линий с близкими значениями экспрессии на протяжении нескольких циклов субкультивирования по сравнению с контрольной линией №34, содержащей агрегаты в суспензии. Кроме того, подлиния 17 превосходила контрольную линию по уровням экспрессии, что свидетельствует о том, что указанный способ может выявлять элитную клональную линию в популяции, и дополнительно улучшенная деконволюция может способствовать получению однородно экспрессирующих элитных линий.
ПРИМЕР 7 - Трансформации суспензионных культур, содержащих отдельные клетки
Материалы и способы
Получение материала растительных клеток: За 3-4 дня до трансформации 1-недельную суспензионную культуру субкультивировали в свежей среде, перенося 2 мл культуры NT1 или BY2 в 40 мл среды NT1B или LSBY2 в колбу объемом 250 мл. Использовали концентрации ингибиторов микротрубочек (MTI), которые описаны выше для получения отдельных клеток. Отдельные клетки собирали либо на 4 день, либо на 7 день после обработки MTI.
Фигура 10: Отдельные клетки среди клеток BY2, которые выделяли, используя DAS-PMTI-1, производное метилиндола, запатентованной DAS, и эффективный гербицид, ингибирующий микротрубочки. Концентрацию 20-50 нМ использовали для получения отдельных клеток после 5 дней субкультивирования. Обратите внимание, что клетки представляют собой отдельные клетки (пара имеет перекрывающиеся края), и изображение получено в дифференциальном интерференционном контрастном микроскопе, соединенном с конфокальной системой визуализации.
Когда отдельные клетки BY2 пропускали через проточный цитометр Beckman, обнаружили 658250 жизнеспособных клеток/мл среды, при этом жизнеспособные клетки имели диаметр 10,43 мкм и объем 593,8 мкм3.
Подготовка Agrobacterium: Штамм Agrobacterium tumefaciens LBA4404, содержащий конструкцию гена YFP (pDAB4613), хранили в 50% глицерине при -80ºC. Аликвоту объемом 20-500 мкл исходной культуры, содержащей экспрессирующий вектор, использовали для закладки жидкой культуры, непосредственно добавляя 20-500 мкл к 30 мл жидкой среды YEP, содержащей 10 г/л дрожжевого экстракта, 10 г/л пептона, 5 г/л NaCl, 10 г/л сахарозы и 50 мг/л спектиномицина. После инкубации в течение 18-20 часов в темноте при 28ºC и 150-200 об/мин вплоть до достижения культурой плотности при OD600 примерно 1,5.
Совместное культивирование отдельных клеток для трансформации ядер: Во время трансформации 1,0 мл суспензии Agrobacterium добавляли в колбу, содержащую 40 мл 4- или 7-дневной суспензии отдельных клеток табака (предварительно промытых в среде, чтобы удалить MTI) и перемешивали пипетированием вверх и вниз 5 раз, используя пипетку с широким отверстием на 10 мл. Затем однородную суспензию переносили аликвотами по 250 мкл в 24-луночные планшеты, обернутые парафильмом, и культивировали в темноте при 25ºC без встряхивания в течение 3 суток. Аликвоту суспензии объемом примерно 50 мкл тестировали, помещая ее на предметное стекло для микроскопа и выявляя временную экспрессию желтого флуоресцирующего белка (YFP).
Обработка ПЭГ/ДНК отдельных клеток для трансформации ядер: Суспензии, содержащие агрегаты клеток JT-NT1, обрабатывали колхицином (Fluka) в конечной концентрации 1 мМ в среде NT1B в момент закладки субкультуры и культивировали в течение 7 суток при 125 об/мин на орбитальном встряхивателе. Суспензии культивировали при 25ºC. В конце седьмого дня 1 мл (0,6 OD600) отдельных клеток собирали из колбы и переносили в стерильную пробирку объемом 14 мл. Добавляли 10 мл среды MaMg (состав среды см. в таблице 1 ниже) и центрифугировали 5 минут при ~1000 об/мин.

Жидкость сливали и клетки ресуспендировали в 300 мкл MaMg и добавляли ~50 мкл плазмидной ДНК. К полученной смеси отдельных клеток и ДНК медленно добавляли 300 мкл ПЭГ 3350 (40% ПЭГ 3350 масс./об., 0,4 М маннит, 0,1 М Ca(NO3)2, конечное значение pH 5-6) и осторожно перемешивали. Смесь отдельных клеток, ДНК и ПЭГ инкубировали при комнатной температуре в течение 20 минут и затем добавляли 10 мл W5 (среда для промывки) и центрифугировали 5 минут при ~1000 об/мин. Жидкость сливали и добавляли 2 мл основной жидкой среды (NT1B) и суспензию клеток переносили в многолуночный планшет. Таким образом, несколько повторов могут быть перенесены в лунки 24-луночного планшета. Временную экспрессию YFP анализировали в точке 20-24 часа, перенося 50 мкл суспензии клеток на предметное стекло для микроскопа, и затем исследовали в флуоресцентном микроскопе, используя подходящий фильтр (возбуждение 500/20 нм, диахром, эмиссия 535/30 нм).
Баллистическая бомбардировка отдельных клеток для трансформации пластид: Клетки BY2 обрабатывали 20-50 нМ DAS-PMTI-1 в среде EP12%, чтобы увеличить количество пластид, и либо без 2,4-D, либо с добавлением BAP, чтобы увеличить размер пластид, в течение 7 дней. В конце седьмого дня отдельные клетки собирали и 2 мл суспензии переносили на фильтровальную бумагу. Клетки выдерживали на гелевой среде LS BY2 в течение 2 часов для подсушивания. Загружали по пять чашек для линий отдельных клеток с дефицитом 2,4-D и для линий клеток, обработанных BAP. Такие клетки обрабатывали 50 нМ DAS-PMTI-1 в течение 2 недель, и на 3-й неделе они находились в 20 нМ DAS-PMTI-1. Клетки чувствовали себя хорошо и были относительно здоровыми.
Клетки подвергали бомбардировке pDAB3969 на частицах золота размером 0,6 мкм, следуя стандартному протоколу и используя баллистический пистолет (BioRad). Их переносили в среду для селекции LS-B Y2 с 12% сахарозой + 100 мг/л канамицина после 2 дней восстановления на среде без средства для селекции.
Результаты и обсуждение
Попытки трансформации ядер: Попытки опосредованной ПЭГ (фигура 11) и опосредованной Agrobacterium трансформации (фигура 3) ясно показали, что частота экспрессии была сходной в обоих случаях, в аликвоте объемом 50 мкл анализируемых клеток было 2-3 экспрессирующих YFP клетки. Таким образом, имелась одна трансформированная клетка в партии из 10970 отдельных клеток, что свидетельствует о том, что способ может быть не очень эффективным. Вероятно, что остаточный колхицин не был удален из клеток, и в параллельном эксперименте клетки восстанавливались до образования колоний быстрее и были более здоровыми, образуя колонии с большей частотой. Это свидетельствует о том, что стадия промывки увеличивала частоту трансформации в экспериментах по оптимизации. Если будет отобрано только одно событие из отдельной клетки, то будет, по меньшей мере, 50-60 трансформированных клеток в мл отдельных клеток в планшете с микролунками в случае обоих способов трансформации. Однако условия трансформации могут быть оптимизированы дополнительно и могут быть выделены дополнительные, стабильно трансформированные колонии.
Фигура 11: Экспрессия YFP (плазмида Ubi10-YFP) после 72 часов обработки ПЭГ. В одной из небольших дочерних (делящихся) клеток в плоскости фокусировки видна экспрессия GFP, показывающая, что экспрессия может быть стабильной.
Трансформация пластид: После 6 недель культивирования идентифицировали 5 активно растущих колоний на среде для селекции. Однако контрольные необработанные клетки погибали при селекции в присутствии 100 мг/л канамицина (фигура 12). Отбирали образцы активно делящихся колоний и анализировали в ПЦР, чтобы определить интеграцию плазмид. В двух из 5 колоний ясно показан ПЦР-продукт, свидетельствующий о том, что трансген интегрирован в пластиды.
Фигура 12: Слева: необработанная контрольная ткань ингибирована 100 мг/л канамицина. Справа: полученный из отдельной клетки предполагаемый транспластомный изолят, растущий на среде для селекции.
Проводятся дополнительные эксперименты, чтобы разработать протоколы высокопроизводительной трансформации ядер и пластид.
Дополнительные эксперименты по трансформации осуществляют для того, чтобы оптимизировать протокол для дальнейшей разработки HTP и протокол трансформации без остова (используя очищенный фрагмент плазмиды) для исследования и разработки новых биологических технологий.
ПРИМЕР 8 - Адаптация суспензионных культур в среде с глицерином
Материалы и способы.
Кондиционирование культур для синхронизации. Чтобы улучшить синхронизацию, все культуры выдерживали в течение 2 недель без субкультивирования с последующим разбавлением 1 мл старой культуры в 50 мл свежей среды. Недифференцированные и делящиеся клетки подсчитывали через 2 дня после такого субкультивирования (наблюдали амитотический индекс до 40%), тогда как дифференцированные не делящиеся клетки наблюдали после 10 дней культивирования. Использовали образцы суспензии объемом 0,5 мл для способов приготовления тотальных препаратов.
Культуры клеток.
Длительную культуру клеток Bright Yellow-2 (BY-2) культивировали в среде LSGS-BY2 (приложение 1), а клетки NT1 и кратковременно культивируемые суспензионные клетки табака сорта Petite Havana (PHL) культивировали в среде LSG-BY-2 (приложение II) или в среде G-NT1 (приложение III). Все среды содержали глицерин в качестве источника углерода вместо сахарозы в среде роста за исключением случая постоянных культур BY2, когда среда кроме глицерина содержала 1% сахарозу. Суспензионные культуры разбавляли еженедельно (1 мл старой культуры в 50 мл свежей среды) в колбах Эрленмейера объемом 250 мл. Суспензию клеток встряхивали на ротационном встряхивателе при 100 об/мин и поддерживали при 25ºC в темноте. (Vos et al. Microtubules become more dynamic but not shorter during preprophase band formation: a possible 'Search-and-Capture' mechanism for microtubule translocation, Cell Motil. Cytoskeleton 57: 246-258, 2004).
Характеристики культур клеток, выращиваемых в среде с глицерином.
Общий рост всех культур снижался по сравнению с контрольными культурами, выращиваемыми на сахаре. Однако в том случае, когда исходный уровень инокулятов культур увеличивали, получали нормальные скорости роста. Клетки были здоровыми, и их можно было продолжать выращивать до 2 недель в культурах без обычного потемнения клеток, наблюдаемого в контрольных культурах в присутствии сахара. Клетки, выращиваемые в культурах с глицерином, имели более высокую степень агрегации клеток в суспензионные единицы по сравнению с культивируемыми в присутствии сахара аналогами. Такие клетки использовали в экспериментах для тестирования соединений MTI в отношении нарушения адгезионных свойств клеток в агрегированных субъединицах, так как глицерин ослабляет стабильность мембран.
Приложение I.
Среда LSGS-BY2 состоит из макро- и микросолей Мурашига и Скуга (Murashige and Skoog 1962) с добавлением 30 мл глицерина (об./об.) и 10 г сахарозы (масс./об.), 100 мг/л миоинозитола, 200 мг/л KH2PO4, 1 мг/л тиамина и 0,2 мкг/л 2,4-дихлорфеноксиуксусной кислоты. Перед автоклавированием среду доводили до pH 5,8.
Приложение II.
Среда LSG-BY2 состоит из макро- и микросолей Мурашиге и Скуга (Murashige and Skoog 1962) с добавлением 30 мл глицерина (об./об.), 100 мг/л миоинозитола, 200 мг/л KH2PO4, 1 мг/л тиамина и 0,2 мкг/л 2,4-дихлорфеноксиуксусной кислоты. Перед автоклавированием среду доводили до pH 5,8.
Приложение III.
Среда G-NT1 состоит из макро- и микросолей Мурашиге и Скуга (Murashige and Skoog 1962) с добавлением 30 мл глицерина (об./об.), 100 мг/л миоинозитола, 180 мг/л KH2PO4, 1 мг/л тиамина и 2 мг/л 2,4-дихлорфеноксиуксусной кислоты. Перед автоклавированием среду доводили до pH 5,8.
ПРИМЕР 9 - Получение отдельных клеток на основе суспензионных культур двудольных растений (табака (BY2, NT1, Petite Havana, Xanthi)), моркови (Daucus carota L. ssp. sativus cv Sativa)
Суспензионные культуры моркови.
Закладку культур каллусов моркови осуществляли из поддерживаемых in vitro растений Daucus carota L. ssp. sativus cv Sativa. Изолированные эксплантаты листовых черешков культивировали на полутвердой среде (Mashayekhi-Nezamabadi, 2000). Закладку суспензионных культур осуществляли из каллусов посредством переноса 50 мг рыхлых каллусов в 1,5 мл среды LSBY2 (приложение I) в 24-луночных планшетах для микротитрования. Наиболее быстро растущие суспензии затем переносили в колбы, при этом 1 мл суспензии добавляли к 35 мл жидкой среды LSBY2. Культуры поддерживали при рассеянном освещении с 7-дневным циклом субкультивирования. Такие культуры могли быть регенерированы, и суспензионные единицы были объемными с плотно расположенными в них клетками. При обработке 0,5 мМ-1 мМ колхицином или 25 нМ-0,5 мМ DAS-PMTI-1 (этиловый эфир(4-хлор-1,5-дифенил-1H-пиразол-3-илокси)уксусной кислоты) на стадии получения суспензии при субкультивировании клетки отделялись от единиц и высвобождались в среду в течение 3 дней после закладки культуры. В культурах клеток наблюдали гомогенное образование отдельных клеток при обработках колхицином, но при обработке DAS-PMTI-1 наблюдали образование отдельных клеток с неоднородной формой клеток, не с округлыми клетками. Клетки имели интактные клеточные стенки, которые анализировали при окрашивании красителем Calacafluor в флуоресцентном микроскопе.
Получение клональных линий из суспензий отдельных клеток моркови.
Суспензию отдельных клеток в стационарной фазе роста через 7 дней после закладки культуры с обработками 0,5 М колхицином разбавляли, используя свежую среду LSBY2 до 0,6 OD660. Разбавленные культуры отдельных клеток объемом 1,5 мл помещали на среду M (приложение II) в чашки Петри 15×100 и распределяли, используя петлю. Необработанные суспензии, содержащие агрегаты клеток моркови, также разбавляли до такой же плотности и высевали сходным образом, чтобы сравнить влияние рост таких культур. После 4-недельного роста в темноте чашки с отдельными клетками давали несколько дискретных колоний, что свидетельствует о том, что из таких клеток могут быть получены клональные клетки. Однако в необработанной суспензии наблюдали газонный рост каллуса на поверхности чашки (фигура 13). Таким образом, можно показать, что изолированные клетки моркови могут образовывать колонии, которые получены из отдельной клетки, с получением при этом клональных линий.
Фигура 13: Получение клональных линий из суспензий, содержащих отдельные клетки моркови. Газонный рост на M-среде, засеянной суспензией, содержащей необработанные агрегаты (панель A). Рост дискретных колоний на среде, засеянной отдельными клетками (панель B).
ПРИМЕР 10 - Получение отдельных клеток из суспензионных культур однодольных растений (кукуруза, рис (T309), ежа сборная, пшеница (Anza))
Культуры тотипотентных содержащих хлорофилл клеток кукурузы.
Фотоавтотрофные культуры кукурузы закладывали и поддерживали в условиях 7-дневных циклов культивирования (Jayakumar et al. 2005). Культуры обрабатывали в момент субкультивирования либо 25-0,5 мМ DAS-PMTI-1 (этиловый эфир(4-хлор-1,5 дифенил-1H-пиразол-3-илокси)уксусной кислоты), либо 10-0,5 мМ трифлуралина, чтобы отделить отдельные клетки от агрегатов. Колхицин был активным только при концентрации выше 0,5 мМ и до 1 мМ и высвобождал отдельные клетки (фигура 14). Суспензионные единицы кукурузы плотно упакованы в твердые клеточные агрегаты по сравнению с анализируемыми клетками двудольных растений. Однако суспензия зеленых клеток кукурузы имеет наиболее плотные суспензионные единицы, и показано, что обработки дают высвобождение до 50% жизнеспособных отдельных клеток за 7 дней, которые могут быть отделены либо кратковременным центрифугированием при 100 об/мин, либо фильтрованием через сита с порами диаметром в диапазоне 75-100 мкм.
Фигура 14: Обработка 0,5-1 мМ колхицином в жидкой среде и культуры, которые анализировали на 14 день после закладки субкультуры (конец второго цикла субкультивирования). A: Отдельные клетки высвобождаются из кластеров. B: Агрегаты с плотно упакованными клетками, окрашенные прижизненным красителем FDA. C и D: Окрашенные FDA отдельные клетки, высвобождаемые при обработке 1 и 0,5 мМ соответственно, после фильтрования суспензии (с использованием фильтров с диаметром пор 100 мкм). E и F: Более крупный вид отдельных клеток, показанных на фигуре D.
Суспензионная культура ежи сборной и риса (T309).
Закладку каллусов ежи сборной и T309 осуществляли из зрелых семян (коллекция семян DAS) на полутвердой среде. Суспензионные культуры закладывали из таких полученных семян каллусов, используя протокол, описанный в Fauquet et al., 1996. Культуры суспензионных клеток поддерживали в условиях 7-дневного цикла субкультивирования в колбах, встряхиваемых при 150 об/мин в темноте. Соединения MTI, подобные соединениям, описанным для кукурузы (выше), использовали в таком же диапазоне концентраций. Отдельные клетки ежи сборной и риса высвобождались через 3-5 дней после закладки культуры.
Суспензионная культура пшеницы (cv. Anza).
Закладку каллусов пшеницы Anza осуществляли на полутвердой среде для пшеницы MS2-D (приложение III) из ткани щитка. Ткани щитков выделяли из стерилизованных и вымоченных тканей и каллусы, индуцированные из разных тканей, переносили в жидкую среду для пшеницы MS-2D (приложение III). Выделяли линии быстро делящихся клеток и затем субкультивировали в течение 7 лет в режиме 7-дневного цикла субкультивирования в жидкой среде MS2D и поддерживали длительное время (7 лет). Для получения отдельных клеток культуры сначала адаптировали в жидкой среде NB с дикамбой (приложение IV). Культуры пшеницы Anza можно кондиционировать, чтобы получить высокодисперсные суспензии в такой среде с однородным размером единиц агрегированных клеток. Колхицин, трифтуаралин или DAS-PMTI-1 добавляли к инокулятам на стадии закладки субкультуры в среду в диапазоне концентраций 25-1 мМ. В суспензии происходило высвобождение отдельных клеток в среду, начиная с 3 дня после закладки субкультуры. Отдельные клетки были мелкими и единообразными.
Приложение I.
Среда LSBY2 состоит из макро- и микросолей Мурашиге и Скуга (Murashige and Skoog 1962) с добавлением 30 г сахарозы (масс./об.), 100 мг/л миоинозитола, 200 мг/л KH2PO4, 1 мг/л тиамина и 0,2 мкг/л 2,4-дихлорфеноксиуксусной кислоты. Перед автоклавированием при 120ºC среду доводили до pH 5,8. Объем суспензии, полученный на 7-й день культивирования, в стационарной фазе использовали для закладки культур. Инокуляты суспензии моркови объемом 1 мл переносили в 50 мл среды LSBY2 и затем культуры помещали на встряхиватель при 150 об/мин в темноте при 28ºC. Используемые соединения MTI добавляли вместе со свежей средой в цикле закладки культур.
Приложение II.
M-среда состоит из основных солей LS и витамина B5, 30 г глюкозы, 2,4-D и кинетина по 1 мкМ каждого, и среду доводили до pH 5,8 перед добавлением к среде 8 г/л очищенного агара. Затем среду автоклавировали и выливали в чашки Петри 15×100.
Приложение III.
Среда MS2D состоит из солей MS ((Murashige and Skoog 1962) и витаминов Eriksson с добавлением 2 мг 2,4-D, 0,5 мг тиамина, 30 г сахарозы, 400 мг миоинозитола, 400 мг гидролизата казеина (ECH). Культуры автоклавировали после доведения значения pH среды до 5,8. Суспензионные культуры субкультивировали обычным образом с интервалами в 7 дней (6 мл исходных инокулятов используемой суспензии в 54 мл свежей среды) и выращивали, встряхивая при 150 об/мин в темноте при 28ºC. В указанных условиях популяции клеток всегда были в фазе экспоненциального роста со 2 по 6 день после посева. В случае гелевой среды для индукции каллусов из щитков зрелых семян среда MS2D содержала дополнительный компонент гельрит в концентрации 2,5 г/л, который добавляли после корректировки pH.
Приложение IV.
Среда NB с дикамбой состоит из основных солей NB, сахарозы 30 г/л, миоинозитола 100 мг/л, гидролизата казеина ECH (ECH) 300 мг/л, L-пролина (2,5 М) 1,7 мл/л, L-глутамина 500 мг/л и 6,6 мг/л дикамбы. Значение pH среды доводили до pH 5,8 перед стерилизацией фильтрованием.
ПРИМЕР 11 - Получение отдельных клеток моркови и опосредованная нитевидными кристаллами Si-C генетическая трансформация суспензионных культур отдельных клеток моркови
Закладка суспензий, содержащих отдельные клетки моркови.
Регенерируемую криоконсервированную линию моркови (D2-40-018) размораживали и культивировали в среде Линсмейера-Скуга (LS) (Nagata T., Nemoto Y. и Hasezawa S. (1992) Int. Rev. Cyto 132, 1-30). Соли для среды приобретали из Phyto Technology Laboratories, № в каталоге L689. Активно растущую в суспензии линию получали в течение недели и поддерживаемую линию субкультивировали, перенося 2 мл PCV в 58 мл среды для суспензии LSBY2 при 28ºC на орбитальном встряхивателе (Innova-3300) при 125 об/мин в условиях рассеянного освещения в режиме 7-дневного цикла культивирования. Для получения отдельных клеток 1 мл PCV суспензии моркови в стационарной фазе добавляли к 30 мл среды для суспензии LS с 1 мМ колхицина (Sigma, № в каталоге C3915) и культивировали в течение 7 дней. Отдельные клетки получали 3-7-дневных культур и использовали в экспериментах по трансформации. Отдельные клетки моркови можно поддерживать в стационарной фазе до 28 дней, разбавляя культуры на 14 день добавлением 60 мл свежей жидкой среды LSBY2.
Опосредованная нитевидными кристаллами WHISKERS TM генетическая трансформация отдельных клеток моркови.
Отдельные клетки, полученные в среде LSBY2 с 1 мМ колхицина, исследовали на 4 день и на 11 день после закладки культуры. Отдельные клетки были очень активными и жизнеспособными, что определяли по окрашиванию диацетатом флуоресцеина. Каллусы, экспрессирующие желтый флуоресцирующий белок, полученные из отдельных клеток колоний, исследовали на 10 день и на 25 день после селекции на чашках с глюфосинатом аммония.
Генетическая трансформация отдельных клеток моркови.
В экспериментах по трансформации использовали модифицированный протокол трансформации на основе WHISKERSTM [Petolino, Welter and Cai (2003) Molecular Methods of Plant Analysis, Vol. 23, 147-158, Chater 9, Genetic Transformation of Plants, ISBN 3540002928]. Эксперименты начинали, перенося 25 мл суспензии, содержащей отдельные клетки моркови, на 4 день и на 11 день после обработки отдельных клеток и осуществляя закладку культуры в стерильных центрифужных флаконах IEC объемом 250 мл (Fisher Scientific, № в каталоге 05-433B). Трансформацию осуществляли добавлением 8,1 мл свежеприготовленной 5% суспензии нитевидных кристаллов (Silar SC-9, Advanced Composit Materilas Corp, Greer, SC) и 170 мкг pDAB3831, содержащей промотор AtUbi10, управляющий геном PAT, и промотор CSVMS, управляющий геном YFP. Для каждой трансформации использовали один флакон, который помещали в модифицированный смеситель для краски (Red Devil Equipment Co, Minneapolis, MN) и встряхивали при высокой скорости в течение 10 секунд, затем клетки возвращали в колбу объемом 500 мл для восстановления и добавляли 100 мл свежей жидкой среды LSBY2. Клеткам давали возможность восстановиться в течение 1 часа на роторном встряхивателе при 125 об/мин и 28ºC.
После восстановления аликвоты суспензии клеток объемом 3 мл равномерно распределяли на стерильные диски из фильтровальной бумаги номер 4 диаметром 55 мм (Whatman International Ltd.), на воронке Бюхнера и отсасывали жидкую среду. Затем бумажные фильтры с клетками помещали в чашки Петри 60×20 мм, содержащие полутвердую среду LSBY2-B15 с 15 мг/л глюфосината аммония и 0,8% агара TC в качестве гелеобразующего агента. Чашки инкубировали при 28ºC в темноте. Через 10 дней клетки, экспрессирующие GFP, снимали с фильтровальной бумаги и помещали в отдельные чашки с полутвердой средой LSBY2-B15. Оставшийся фильтр и клетки переносили на свежую полутвердую среду LSBY2-B15 и инкубировали в темноте при 28ºC.
Анализ событий образования колоний из отдельных клеток.
Предполагаемые трансгенные клетки, которые однородно флуоресцировали в инвертированном микроскопе Leica через 25 дней после начала экспериментов по трансформации, анализировали в отношении функционального селектируемого маркерного белка PAT посредством чувствительного анализа ELISA, используя набор «EnviroLogix LibertyLink® PAT/pat Plate Kit». Набор «EnviroLogix LibertyLink® PAT/pat Plate Kit» представляет собой набор для твердофазного иммуноферментного анализа (ELISA) типа «сэндвич». Ткань каллуса помещали в микроцентрифужную пробирку и добавляли 250 мкл буфера для экстракции. Буфер для экстракции представлял собой PBS (Fisher, № в каталоге BP665-1), содержащий 0,05% твин-20 (Sigma-Aldrich, № в каталоге P1379). Ткань размалывали небольшим ручным пестиком в микроцентрифужной пробирке. Экстракт образца центрифугировали при относительной силе центрифугирования 11000 в течение одной минуты, и надосадок использовали в ELISA в следующих разведениях 1:1, 1:2, 1:4, 1:8, 1:16, 1:32 и 1:64. Способы ELISA осуществляли, как указано в наборе Envirologix, номер в катлоге APO 14. В тесте экстракты образца добавляли в тестируемые лунки, покрытые антителами против PAT, продукта гена pat. Любые остатки, присутствующие в экстракте образца, связываются с антителами, и затем их выявляли добавлением фермента (пероксидазы хрена), меченного антителом PAT/pat. После простой стадии промывки результаты анализа визуализировали на стадии проявления окраски; проявление окраски пропорционально концентрации PAT/pat в экстракте образца.
Результаты показали, что негативная контрольная ткань при соотношении 143 мг образца/250 мкл буфера для экстракции не давала значения, оцениваемого в ELISA PAT. Событие 001B при соотношении 63 мг образца/250 мкл давало значения в ELISA 83 нг/мл, что равно 330 пг PAT на мг каллуса, что, таким образом, свидетельствует о том, что ярко флуоресцирующие клетки действительно трансформированы как PhiYFP, флуоресцирующим в ожидаемом диапазоне, так и селектируемым маркерным геном PAT.
ПРИМЕР 12 - Химический класс ингибиторов микротрубочек и получение отдельных растительных клеток.
Параллелизм между микротрубочками и микрофибриллами представляет собой коррелированный ответ на неизвестный поляризующий источник, а не причинную связь (Emons et al., 1992). Это подтверждается несколькими примерами, например большинство клеток в зоне созревания корня кукурузы (Zea mays) при водном дефиците имеют группы микротрубочек в форме закрученных вправо спиралей, а микрофибриллы в форме спиралей, закрученных влево (Baskin et al., 1999). Подобным образом, мутант Arabidopsis (Arabidopsis thaliana) с организацией микротрубочек 1 (mor1) имеет аномальное расположение микротрубочек, но вероятно неизмененную группировку микрофибрилл (Himmelspach et al., 2003; Sugimoto et al., 2003). В суспензиях, содержащих отдельные клетки, в проведенных авторами экспериментах наблюдали ростовую реакцию, сходную с реакцией в контроле, при этом сухая масса возрастала на протяжении цикла субкультивирования клеток, что свидетельствует о том, что клетки делятся при более низкой концентрации ингибиторов микротубулина (MTI), несмотря на тот факт, что в суспензиях имеются клетки, имеющие изотропический рост с радиальным разрастанием. Кроме того, при изменении состава среды на сфотографированной чашке с клетками можно увидеть такие отдельные клетки с изотропическим ростом, что дополнительно подтверждает тот факт, что такие клетки действительно делятся при низких уровнях концентраций MTI. Таким образом, растительные клетки, обработанные низкими концентрациями ингибитора микротрубочек и поддерживаемые в оптимальных уровнях в среде, могут иметь значительную популяцию кортикальных микротрубочек, которые остаются не измененными. Это может позволять отдельным клеткам продолжать процесс нормального построения клеточных стенок, включая построение фрагмопласта, который является важной предпосылкой для деления клеток.
Чтобы частично ингибировать функцию микротрубочек и выбрать соединения, которые являются избирательными в их разрушении в случае низких уровней, проводили скрининг разных классов соединений. Взаимодействие MTI с тубулином растений хорошо охарактеризовано (Hugdahl and Morejohn, 1993). Тем не менее, при использовании любого ингибитора имеют место неспецифичные эффекты (Vaughn and Lehnen, 1991). Поэтому в настоящем примере проводили сравнение соединений класса ингибиторов микротубулина с разной химической структурой, чтобы идентифицировать соединения, которые могут поддерживать рост отдельных клеток без неспецифичных эффектов. Известно, что такие соединения, как хлорпрофам, в низких концентрациях ингибируют удлинение, которое необходимо для стимуляции радиального разрастания, так как они влияют на митотические микротрубочки более активно, чем на кортикальные микротрубочки (Hoffman и Vaughn, 1994). Таким образом, целью настоящей работы был выбор соединений, которые в низкой оптимальной концентрации могут в достаточной степени сохранять осуществление кортикальными микротрубочками нормальной клеточной функции, поддерживая при этом изотопический рост, но в то же время обладая низким неспецифичным ингибирующим действием или не обладая таким действием.
Колхицин является производным трополона, стереохимическая структура и способ действия которого хорошо изучен (Keats and Mason, 1981; Margolis and Wilson, 1977; Raugh and Wilson, 1980), Murgulis, 1974), и он предотвращает образование микротрубочек из димеров тубулина. Пропизамид и другие безамиды действуют на ядерное веретено в растительных клетках (Akashi et al., 1988; Bartels PG and Hilton JL., 1973; Carlson et al., 1975) и были разработаны в качестве довсходовых гербицидов, которые являются эффективными на однолетних травах и широколистных злаках (Aya et al., 1975). Применения амидов фосфорной кислоты сходны с применениями динитроанилиновых гербицидов, включая оризалин (сурфлан) и трифлуралин (трефлан) (Ashton and Crafts, 1981). Трифлуралин является одним из наиболее известных представителей семейства динитроанилиновых гербицидов; он разрушает микротрубочки растений, но неэффективен в клетках животных (Hess and Bayer, 1974; Hess and Bayer, 1977). Пиридины имеют бензольное кольцо, в котором один из атомов углерода заменен азотом. Существует несколько замещенных пиридинов, используемых в качестве гербицидов. К такой группе относятся дитиопир (Dimension®) и тиазопир (Visor®). Дитиопир является избирательным довсходовым и послевсходовым средством, используемым только на газонах для борьбы с широким многообразием травянистых сорняков. Часто его готовят в составах вместе с другими гербицидами и удобрениями. Триазопир является избирательным довсходовым соединением, которое хорошо работает в борьбе практически со всеми травянистыми сорняками и применяется на многих сельскохозяйственных культурах, включая цитрусовые, хлопок, кукурузу, арахис, сою и картофель. Таким образом, пиридины по своей функции, по-видимому, являются ингибиторами сборки микротрубочек.
Материалы и способы
Суспензионные культуры табака JTNT1. Суспензионные культуры табака JTNT1 поддерживали субкультивированием объема осажденных клеток (PCV) 1 мл в 20 мл среды для табака (соли MS, миоинозитол, тиамин HCl (1 мг/мл), двухосновный фосфат калия (безводный), MES, 2,4-D (10 мг/мл) и 3% глицерин (среда NT1B). Линию клеток субкультивировали каждые 7 дней и собирали при необходимости для тестирования. 1 М сахароза ингибировала как скорость, так и степень индуцированной таксолом полимеризации тубулина растений (Bokros et al., 1993). Исследование полимеризации тубулина растений в присутствии 1 М сахарозы (APM, амипрофосметил и оризалин) показало зависимое от концентрации уменьшение длины микротрубочек растений (Morejohn and Fosket, 1984; Morejohn et al., 1987). Кроме того, сахароза стабилизирует предварительно образованные микротрубочки, делая невозможным исследование влияния MTI на предварительно образованные микротрубочки. Кроме того, сахароза существенно повышает вязкость, и полимеризация тубулина изменяется, по меньшей мере, частично в результате уменьшения скорости диффузии димера и полимера. Таким образом, важно, чтобы среда для получения отдельных клеток содержала мало сахарозы или не содержала сахарозы. Соответственно для данного исследования была создана новая линия JTNT1, адаптированная в среде с глицерином.
Для обработок суспензионные линии получали, добавляя 1 мл PCV в 20 мл среды, при это часто вращая, чтобы обеспечить хорошее распределение клеток (так как агрегаты в суспензии имеют склонность оседать), и затем переносили в лунки 24-луночных планшетов для микротитрования. Каждая из 24 лунок содержала 1 мл суспензии JTNT1. 24-луночные планшеты оставляли на встряхивающем устройстве Innova 4900 Multi Environmental, используя специальные зажимы и жгуты, чтобы обеспечить укладку планшетов в стопки до 6 планшетов в высоту. Планшеты вращали со скоростью 130 об/мин и при 25ºC в темноте.
Получение отдельных клеток. Каждое соединение растворяли в диметилсульфоксиде (ДМСО), получая 0,5-молярные исходные растворы. Один мл суспензии JTNT1 (1 мл PCV/20 мл среды для табака) добавляли в каждую лунку 24-луночных планшетов. В каждую лунку добавляли отдельное химическое вещество так, чтобы получить требуемые концентрации (1 мкМ, 3 мкМ и 10 мкМ). Культурам давали возможность расти в течение 7 суток на встряхивающем устройстве Innova. Каждый день получали измерения мутности для каждой лунки, используя SpectraMax M2e, производства Molecular devices (установленный при поглощении 600, каждую лунку регистрировали 5 раз). На 7 день клетки исследовали, используя инвертированный конфокальный микроскоп Leica 5000, в отношении образования отдельных клеток и жизнеспособности клеток.

Получение клональных каллусов с использованием отдельных клеток BY2 в среде LSBY2 с глицерином. Клетки табака BY-2 (Nagata et al., 1992) трансформировали pDAB1590, используя модифицированный протокол, описанный Shaul et al., 1996, и отбирали на LSBY15 через 4 дня совместного культивирования. Извлекали каллус, экспрессирующий зеленый флуоресцирующий белок, и каллус поддерживали в среде LSBY2 B15. В течение месяца каллус выращивали до нескольких сантиметров в диаметре и небольшой, но ярко флуоресцирующий кусочек (комочек ~2-5 мм2) переносили на свежую отвержденную среду с добавлением питательных веществ и свежего селектирующего агента, чтобы поддерживать клетки и чтобы отобрать каллус, гомогенно экспрессирующий GFP. Кусочек каллуса массой 500 мг переносили в 50 мл LSBY2-Gly-B15, модифицированной жидкой среды LSBY2 с 3% глицерином и 1% сахарозой в качестве источника углерода, во встряхиваемой колбе объемом 250 мл (130 об/мин при 25ºC в темноте). Каждую неделю 0,5 мл объема осажденных клеток (PCV) использовали для закладки суспензионной культуры. Таким образом, каллус, экспрессирующий зеленый флуоресцирующий белок (GFP), и агрегаты в суспензии поддерживали в условиях месячного и 7-дневного циклов соответственно.
Получение отдельных клеток, экспрессирующих GFP. Отдельные клетки получали добавлением соединения DDP (дифенилпиразола) в концентрации 1 мкМ в начале 7-дневного цикла культивирования в среду LSBY2-Gly-B15 вместе с добавлением 0,5 мл объема осажденных клеток (PCV) в виде экспрессирующих GFP агрегатов в суспензии в стационарной фазе. Альтернативно 25 мл суспензии, содержащей агрегаты, переносили в 25 мл свежей среды для суспензии LSBY2-Gly-B15, добавляя 50 мкл 1 М исходного раствора дифенилпиразола, растворенного в ДМСО, получая конечную концентрацию в суспензии 1 мкМ. Таким образом, отдельные клетки могут быть получены в течение намного более короткого цикла, только в течение 3,5 суток. Среда LSBY215 всегда содержит 15 мг/л глюфосината аммония для селекции.
GFP экспрессировался в виде химерного белка в отдельных клетках на протяжении 3,5- или 7-дневных циклов культивирования и находился в субклеточных структурах, при этом экспрессию GFP с химерных конструкций наблюдали в живых клетках с помощью стандартной эпифлуоресценции, используя микроскоп Leica, а также используя конфокальные лазерные сканирующие микроскопы. Экспрессию наблюдали во многих субклеточных компартментах, включая ядро и цитоплазматические тяжи.
Результаты и обсуждение.
Клетки были здоровыми в среде для культуры табака, содержащей глицерин, и кластеры клеток были явно видны. Клетки давали хорошее увеличение биомассы в течение периода времени, составляющего 7 суток, хотя имело место ~50% снижение биомассы по сравнению с контролем на сахаре. Контрольные культуры также содержали 0,1% ДМСО, чтобы гарантировать, что эффект не был индуцирован ДМСО. Добавление 1 мкМ этилового эфира(4-хлор-1,5-дифенил-1H-пиразол-3-илокси)уксусной кислоты (дифенилпиразола) в среду либо с сахарозой, либо с глицерином существенно не снижало биомассу клеток по сравнению с соответствующими контролями, что свидетельствует о наличии активного роста отдельных клеток, сходного с контролем, в присутствии дифенилпиразола. Кривые роста были сходными для культур на протяжении 2 подцикла или 3,5 дней. При получении отдельных клеток в среде с глицерином также показана очень высокая жизнеспособность клеток по сравнению с контролем.
Было исследовано несколько других соединений, включая трифлуралин, оризалин и соединения класса стабилизаторов микротубулина, такие как таксол, в отношении их эффективности в образовании отдельных клеток в суспензионной культуре клеток табака JTNT1, культивируемых в среде NT1B с 3% глицерином в качестве единственного источника углерода. Использовали колхицин, N-(1,1-диметилпропинил)3-хлорбензамид, пропизамид и трифлуралин. В указанных исследованиях соединения отличались по своей эффективности в образовании отдельных клеток и по наклону кривой зависимости доза-ответ. Оризалин, подобно другим тестированным соединениям, увеличивал диаметр отдельных клеток, по меньшей мере, в 4 раза и имел насыщающую концентрацию примерно в 10 раз выше порога. Колхицин увеличивал диметр в 5 раз и давал более крутую кривую зависимости доза-ответ, которая показывает, что указанные два соединения могут быть предпочтительными для работы с высокими дозами.
Концентрации, необходимые для получения отдельных клеток, были в диапазоне от 50 мкМ до 2 мМ в случае колхицина и от 10 нМ и до 100 мкМ в случае пропизамида, N-(1,1-диметилпропинил)3-хлорбензамида. Однако концентрации оризалина и трифлуралина для оптимального получения отдельных клеток были в диапазоне от 100 нМ до 1 мМ. Однако при высоких концентрация таких соединений увеличивался синтез белка, в обработанных клетках происходило деление пластид и митохондрий, приводя к образованию гигантских клеток до 300 мкм в диаметре с полиплоидией ядер, которую наблюдали в клетках моркови, культивируемых в течение 21 дня. Полученные результаты свидетельствуют о том, что ингибирование митоза является основным эффектом таких соединений при исследованных высоких концентрациях. Таким образом, по-видимому, важно поддерживать не только оптимальную концентрацию MTI, но также химические характеристики соединения (которому будет свойственна очень избирательная функция по отношению к трубочкам и не будет свойственна неизбирательная функция, сходная с функционированием при делении клеток). В соответствии с целью изобретения ниже описаны другие соединения, помимо дифенилпиразола, описанного ранее.
Исследовали агрегаты BY2 в суспензии: в среде LSBY2 с сахаром; делящиеся отдельные клетки BY2, полученные в 1 мкМ дифенилпиразоле, исследуя чашку с клетками в модифицированной среде LSBY2; трансгенные клетки BY2 GFP, подверженные деконволюции, и одиночную клональную колонию на гелевой среде LSBY2-15.
Выводы о получении отдельных клеток табака BY2 в среде LSBY2 с глицерином.
Отдельные клетки, полученные в 1 мкМ дифенилпиразоле из агрегатов в суспензии, имеют одно ядро с одним или двумя ядрышками в 90% клеток к 3,5 дням культивирования. Такие клетки могут быть посеяны на чашке с гелем LSBY2 с 0,8% агаром TC и 15 мг/л глюфосината аммония в качестве селектирующего средства, так как плазмида pDAB1590, используемая для трансформации агрегатов в суспензии, имела PAT в качестве селектируемого маркера. Клетки разбавляли в жидкой среде в разведении 1:4 и высевали на гелевую среду и проводили селекцию клонов на 21 день после посева.
Что касается добавления амипрофосметила (APM) к суспензиям JTNT1, то отдельные клетки образовывались при концентрации 1-10 мкМ; при более высокой концентрации имеет место заметное снижение роста и ингибирование клеточного деления. Отдельные округлые клетки можно видеть на снимках, сделанных в присутствии 1 мкМ и 3 мкМ APM, по сравнению с контролем, в котором присутствовал только ДМСО. Клетки табака JTNT1 были здоровыми, имели желтую окраску и хорошо росли в присутствии 1 мкМ и 3 мкМ APM. Жизнеспособность клеток, которую измеряли с использованием красителей диацетата флуоресцеина и йодида пропидия, составляла до 70%.
Кроме того, исследовали индуцированное APM получение отдельных клеток табака JTNT1 в среде с глицерином. Контрольные суспензии, содержащие агрегаты JTNT1, наблюдали в среде с глицерином и 0,1% ДМСО; отдельные клетки JTNT1 наблюдали в среде NT1B с глицерином с добавлением 1, 3 и 10 мкМ APM.
Дитиопир относится к классу замещенных пиридиновых гербицидов, которые разрушают микротрубочки. При добавлении к суспензиям JTNT1 в концентрациях 1 мкМ, 3 мкМ and 10 мкМ отдельные клетки образовывались при использовании концентраций 1 мкМ и 3 мкМ (изображения E и F), а концентрация 10 мкМ давала отдельные клетки (и концентрация клеток была низкой). Клетки табака были здоровыми, росли и имели желтую окраску при использовании всех тестированных концентраций дитиопира. Жизнеспособность клеток после обработки 1 мкМ и 3 мкМ дитиопира составляла 70-80%, что свидетельствует о более высокой жизнеспособности.
Миметик колхицина (Evans et al., 2003), (±)-4S,5R-4-нитро-5-(2,3,4-триметоксифенил)циклогексен (триметоксифенилциклогексен), тестировали в культурах табака JTNT1 в отношении эффективности в образовании отдельных клеток. Хотя было небольшое осветление клеток (они были немного более светлого желтого цвета), клетки росли на чашках очень хорошо. Указанное химическое соединение стимулировало образование отдельных клеток в концентрации 1 мкМ, 3 мкМ и 10 мкМ. Клетки были округлыми, и жизнеспособность клеток при всех уровнях концентраций составляла 80-90%. Ингибирование роста клеток было довольно сходным при тестированных концентрациях, и клетки были здоровыми с высокой жизнеспособностью, и наблюдали меньшую цитотоксичность.
Таким образом, индуцированное образование отдельных клеток в клетках табака JTNT1 наблюдали в среде с глицерином при индукции триметоксифенилциклогексеном в концентрации 10 мкМ.
Превосходные отдельные клетки. Агрегаты клеток моркови в суспензии можно культивировать в 1 мМ колхицине в 60 мл жидкой среды LSBY2 и поддерживать в такой же среде до 28 суток. Рост после второго субкультивирования снижается через 14 суток, но клетки продолжали расти, образуя превосходные отдельные клетки, которые были живыми здоровыми (но в которых наблюдали сильно разделенные на доли ядра, что свидетельствовало о появлении полиплоидии ядер). Превосходные отдельные клетки моркови с несколькими ядрами наблюдали в 21-дневных клетках в случае постоянного присутствия 1 мМ колхицина в среде LSBY2.
Заключение. Рост клеток при указанных тестированных уровнях наблюдали посредством визуального исследования и регистрируя сухую массу (только на 7 день) и мутность. На фигуре 15 изображены результаты измерения мутности, полученные за 7-дневный период. Значения мутности получали относительно чашек, содержащих только среду (с 3% глицерина), и для концентраций ингибитора микротрубочек 1 мкМ, 3 мкМ и 10 мкМ. Хотя в контролях наблюдали наилучшую картину роста, как и ожидалось, ни одно из химических соединений не вызывало гибель линий клеток в концентрациях 1 мкМ и 3 мкМ. Клетки при всех обработках претерпевали повышение скорости роста примерно в одной и той же временной точке (3-й день), и объем клеток еще увеличивался к 7 дню. Полученные данные показывают, что химически обработанные клетки оставались жизнеспособными в течение, по меньшей мере, 7 суток.
Пример 12. Ссылки:


ПРИМЕР 13 - Сравнительное исследование вызываемой MTI субклеточной структуры отдельных клеток, цитогенеза и оценка молекулярной геномной нестабильности.
Макроскопическую стабильность генома в полученных из культуры ткани растениях исследовали на цитогенетическом уровне для нескольких видов растений (Shoyama et al. 1995; Zoriniants et al. 2003). Что касается полученных в результате соматического эмбриогенеза растений, то цитогенетические исследования показали противоречивые результаты. Odake el al. (1993) сообщали об удвоении числа хромосом (от диплоидного к тетраплоидному) в 66,7% и 100% полученных в результате соматического эмбриогенеза растений Asparagus officinalis L., полученных на отвержденной гелановой камедью среде и в жидкой среде соответственно. Напротив, Mamiya et al. (2001) сообщили об отсутствии изменений плоидности во время соматического эмбриогенеза A. officinalis. Сообщалось, что синтетические ауксины, такие как 2,4-D (2,4-дихлорфеноксиуксусная кислота) и NAA (нафталинуксусная кислота), используемые в культуральных средах, ассоциированы с сомаклональной вариабельностью (Karp 1989; Phillips et al. 1994). Действительно, сообщалось об уменьшении плоидности в системах соматического эмбриогенеза моркови (Ronchi et al. 1992) и тополя (Rugh et al. 1993), в которых использовали 2,4-D. Ингибиторы микротубулина (MTI) также увеличивали плоидность в растительных клетках. Однако концентрация и класс соединений MTI определяют природу плоидности или отсутствие плоидности. Например, оризалин индуцирует полиплоидию ядер в клетках TBY2, а пропазамид в сходных концентрациях не индуцирует полиплоидии ядер (Ehsan et al., 1999). Подобным образом, длительная экспозиция суспензионных клеток моркови индуцирует полиплоидию ядер при более высокой концентрации колхицина. В суспензионных клетках моркови наблюдали полиплоидию ядер в присутствии 1 мМ колхицина при культивировании отдельных клеток с 14 по 21 день при непрерывной обработке. Однако частота появления таких уровней плоидности намного меньше в культурах вплоть до 14 дней и составляет менее <1%, такое значение сходно со значением в контроле, указанным для культивируемых с ауксином контрольных суспензий (Karp 1989; Phillips et al. 1994). Однако среди тестированных в данном исследовании соединений этиловый эфир(4-хлор-1,5-дифенил-1H-пиразол-3-илокси)уксусной кислоты и 4S,5R-4-нитро-5-(2,3,4-триметоксифенил)циклогексен обеспечивали эффективное получение отдельных клеток при низком проценте или отсутствии плоидности ядер в течение 14 суток при непрерывных обработках.
В любом случае способ индукции образования отдельных клеток из клеточных агрегатов с использованием обладающих низкой цитотоксичностью MTI все же могут изменять существующие картины экспрессии генов в отдельных клетках с разным профилем экспрессии. Хорошо известно, что метилирование ДНК запускает нежелательные последствия, приводящие к сомаклональной вариабельности in vitro. Кроме того, MTI индуцируют изменения, которые могут приводить к молекулярной вариабельности или нестабильности. Сообщалось о процентном содержании полиморфов, составляющем 1,09%, при индуцированном колхицином удвоении числа хромосом до тетраплоидов у Eragrostis curvula (Mecchia et al. 2007). Уровень концентрации колхицина, используемый для обработки семян E. curvula, составляет 0,05%. Целью настоящего исследования была оценка стабильности генома отдельных клеток JTNT1, полученных в присутствии 1 мкМ этилового эфира(4-хлор-1,5-дифенил-1H-пиразол-3-илокси)уксусной кислоты.
Используя различные молекулярные способы, такие как AFLP, RAPD (быстро амплифицированная полиморфная ДНК), RFLP (полиморфизм длины рестрикционных фрагментов), пытались идентифицировать измерить уровень сомаклональной вариабельности в полученных из культуры ткани растениях (Devarumath et al. 2002; Martins et al. 2004; Sanchez-Teyer et al. 2003; Hale and Miller 2005). Однако независимо от применяемой методики только очень небольшой процент (намного меньше 1%) генома можно оценить несмотря на производительную методику (в смысле количества отбираемых образцов локусов). Из множества доступных методик AFLP является наиболее высокопроизводительным, обычно при этом анализируют 50-100 локусов на пару праймеров. Предполагается, что такие локусы рассеяны по геному более или менее случайно, и, следовательно, AFLP обеспечивает наилучшую возможность выявления индуцированных в культуре ткани изменений. Кроме того, AFLP также является одним из наиболее надежных молекулярных методик для идентификации сортов культурных растений и анализа вариабельности (Hale and Miller, 2005). Таким образом, указанный способ оценки был выбран для применения в настоящем исследовании.
Материалы и способы.
Инициация образования отдельных клеток табака JTNT1 и сбор образцов. Образование отдельных клеток табака JTNT1 инициировали в двух разных средах, NT1B с 3% сахарозой (NT1B-Suc) и NT1B с 3% глицерином (NT1B-Gly), используя 3,5-дневный цикл культивирования. Закладку культур осуществляли, добавляя 12,5 мл суспензии, содержащей агрегаты культур в стационарной фазе, поддерживаемых в соответствующей культуральной среде, и к 12,5 мл свежей культуральной среды во встряхиваемых колбах объемом 125 мл, содержащих 1 мкМ этилового эфира(4-хлор-1,5-дифенил-1H-пиразол-3-илокси)уксусной кислоты (дифенилпиразола). Колбы закрывали пористой пробкой и культивировали на орбитальном встряхивающем устройстве при 130 об/мин в темноте при 25-28ºC. Культуры субкультивировали через каждые 3,5 дня вплоть до 14 суток. Четыре образца (клеток, выращенных на Suc/Gly, и контрольных культур в Suc/Gly-среде с 0,2% ДМСО) культур собирали каждый раз по достижении 3,5 дней центрифугированием суспензии при 3000 об/мин в течение 5 минут. Образцы немедленно лиофилизировали, чтобы предотвратить окисление клеток с целью минимизации какого-либо повреждающего действия на образцы после сбора. Отдельные клетки красили красителем ядер Hoechst в течение одного часа и исследовали под микроскопом в отношении аномалий ядер вплоть до двух циклов культивирования.
Цитологическая характеристика отдельных клеток.
Жизнеспособность клеток и клеточная стенка. Полученные отдельные клетки JTNT1 использовали для окраски клеточным красителем FUN1 (F-7030, Molecular Probes, Invitrogen Inc), который используют в тестах на жизнеспособность дрожжей и который включает в себя два цветных флуоресцентных зонда. Третий краситель, Calcofluor White M2R, который красит клеточную стенку, также использовали для окраски клеток. В случае отдельных клеток JTNT1 добавляли 20 мкМ красителя FUN1 и культуру инкубировали при комнатной температуре в течение 20 минут. Добавляли 1 мл свежей культуральной среды, чтобы отмыть избыток красителя, и центрифугировали при 3000 об/мин; надосадок отбрасывали. Клетки исследовали и визуализировали, используя микроскоп Zeiss ApoTome.
Плазматическая мембрана. Клетки JTNT1 инкубировали с 5мкМ FM4-64 (стириловый краситель) в течение 5 минут и промывали свежей средой. Культуру центрифугировали при 3000 об/мин и добавляли свежую среду. Клетки визуализировали, используя микроскоп Zeiss ApoTome.
Ядро. Отдельные клетки красили ядерным красителем Hoechst в течение одного часа и исследовали в Zeiss Apo Tome в отношении какой-либо аномалии ядер вплоть до прохождения двух циклов культивирования. Также использовали краситель кристаллический фиолетовый в качестве красителя живых ядер для исследования структуры ядер с целью характеристики плоидности.
Цитоскелет. Фаллотоксины связываются с филаментами актина. Использовали фаллоидин Alex Fluor 488 (A 12379 Invitrogen Inc) для окраски отдельных клеток. К отдельным клеткам добавляли 6,6 мкМ Alex fluor и инкубировали в течение 30 минут и визуализировали под микроскопом.
Молекулярная оценка нестабильности генома.
Экстракция ДНК. Геномную ДНК из типичных образцов собирали на 3,5, 7, 10,5 и 14 день. Культуры в Suc и Gly наряду с контролями (10 образцов) экстрагировали, используя протокол CTAB (см. приложение к примеру 12). ДНК оценивали количественно, используя краситель PicoGreen® из Molecular Probes, Inc. (Eugene, Oregon). Каждая лунка планшета для микротитрования содержала 90 мкл 200-кратного количества красителя Picogreen вместе с 10 мкл образца ДНК в 40x-разведении или стандарты ДНК лямбда (0, 2,5, 5 и 10 нг/мкл). Планшеты недолго встряхивали, используя стандартное встряхивающее устройство для планшетов, и регистрировали флуоресценцию (возбуждение ~480 нм, испускание ~520 нм), используя флуориметр Spectra Max GeminiXS из Molecular Devices (Sunnyvale, California). Каждый образец количественно оценивали в трех повторах и среднее значение из трех полученных результатов использовали для последующих разведений. Концентрации в образцах ДНК доводили до рабочей концентрации 91 нг/мкл стерильной водой.
Анализ AFLP. Анализы полиморфизма длин амплифицированных фрагментов (AFLP) осуществляли, используя модификацию протокола Vos et al. (1995), который описан в Bryan et al. (2002). Фермент рестрикции EcoRI, разрезающий 6 п.н., использовали в сочетании с ферментом рестрикции MseI, разрезающим 4 п.н. Флуоресцентно меченные EcoRI-праймеры и немеченые MseI-праймеры для AFLP заказывали в Applied Biosystems (Foster City, CA). Анализ AFLP осуществляли, используя протокол картирования AFLP растений Applied Biosystems посредством избирательной реакции амплификации с одной модификацией. Модификация заключалась в том, что реакционные смеси для расщепления/лигирования инкубировали при 37ºC в течение ночи. Избирательно амплифицированные продукты разбавляли в 2 раза в стерильной деионизованной воде. 0,5 мкл разбавленного продукта объединяли с 5 мкл буфера для загрузки (5 мкл стандарта для оценки размера LIZ 500 п.н. GeneScan, смешанных с 500 мкл формамида ABI HiDi). Образцы анализировали на анализаторе ДНК AB3730XL со спектральной матрицей G5-RCT, используя стандартные условия. Затем данные импортировали в GeneMapper®, версию 4.0 (Applied Biosystems, 2005). Аллелям присваивали числовые значения в соответствии с размером фрагментов ПЦР.
Результаты и обсуждение.
Цитология и другие субклеточные оценки отдельных клеток.
Клеточная стенка и деление клеток. Во время культивирования клеток происходит их рост и дифференцировка, и форма и структура клеток зависит от клеточной стенки. Наблюдали изотропический рост отдельных клеток с 3-10-кратным увеличением размера с образованием типичной округлой клетки. Чтобы выяснить структуру клеточной стенки, использовали Calcofluor (отбеливающее средство, которое обладает аффинностью связывания с целлюлозами). В отдельных клетках наблюдали четкую кольцевую стенку. Клеточная стенка является динамической структурой, которая играет важную роль в определении формы клеток и взаимодействует с факторами окружающей среды. Хотя большинство отдельных исследуемых клеток представляли собой сферические клетки, можно было видеть делящиеся клетки с клеточной пластинкой. Возрастание сухой массы является другим признаком того, что в указанных отдельных клетках происходит клеточное деление. После 14 дней культивирования в MTI, если отдельные клетки переносили в среду, не содержащую MTI, клетки восстанавливали агрегаты в суспензии, что свидетельствует об обратимости анизотропного роста.
Плазматическая мембрана. Плазматическая мембрана является одним из важных компонентов клетки, который заключает в себе все клеточное содержимое. Плазматическая мембрана ограничивает клеточную стенку и обеспечивает конечный фильтр между внутренним содержимым клетки и окружающей средой. Амфифильный стириловый краситель FM применим для исследования организации органелл и перемещения везикул в живых эукариотических клетках (Bolte et al., 2004). Сначала краситель FM локализуется в плазматической мембране (PM), затем в результате эндоцитоза переходит в вакуоли и везикулы, затем в эндосомы. FM4-64 (избирательный по отношению к мембране флуоресцентный краситель) окрашивает плазматическую мембрану и затем интернализуется в другие органеллы в клетках (Ueda et al., 2001). После 5-минутного окрашивания исследовали флуоресценцию плазматических мембран отдельных клеток и не выявили структурных дефектов. В отдельных образцах, в которых использовали 100 нМ изоксебена, чтобы удалить целлюлозную сеть, FM4-64 показывал большие везикулы на поверхности. В мембранах наблюдали активный эндоцитоз в течение 5 минут.
Ядро. Сообщается, что организация ядра в MTI-обработанной растительной клетке является сложной, и показано, что полиплоидия ядер является обычной при более высоких концентрациях. Образцы исследовали вплоть до 7 дней при 1 мкМ концентрациях дифенилпиразола и триметоксифенилциклогексена. Структуру ядер анализировали, используя различные красители (Hoechst3325). В случае JTNT1 отдельные клетки содержат одно ядро с одним или двумя ядрышками при концентрациях дифенилпиразола и триметоксифенилциклогексена 1 мкМ в 3,5-дневных культурах. Однако высокие концентрации таких соединений приводят к образованию гигантских клеток с диаметром до 150-300 мкМ с полиплоидией ядер, которую наблюдали в клетках моркови, культивируемых в течение 21 дня. Полученные результаты свидетельствуют о том, что ингибирование митоза является основным действием таких соединений при исследованных высоких концентрациях. Таким образом, важно поддерживать не только оптимальную концентрацию MTI, но также химические характеристики соединения, которому будет свойственна очень избирательная функция по отношению к трубочкам и не будет свойственна неизбирательная функция, сходная с функционированием при делении клеток.
Цитоскелет. Цитоскелет состоит из нескольких структурных белков, таких как F-актины и тубулины, которые вовлечены в поддержание структурной целостности клеточной структуры. Исследовали динамику цитоскелета in vivo, используя конъюгат актина с зеленым флуоресцирующим красителем Alexa flour 488 (A12373), который ярче и меньше зависит от pH. Микротрубочки и актиновые филаменты являются структурами, необходимыми для поддержания структуры цитоскелета в растительных клетках, важной для их роста и дифференцировки и для жизнеспособности растительных клеток (Kost et al., 2002). В отдельных клетках, окрашенных фаллоидином, наблюдали цитоскелет из актиновых филаментов, и не выявили дефектных положений филаментов, таким образом структура клеток была нормальной.
Молекулярный анализ. В анализе AFLP использовали 10 комбинаций праймеров, основанных на использовании EcoRI (фермент рестрикции, нечувствительный к метилированию). Две пары праймеров не приводили к амплификации (p6 и p10), и две пары праймеров не давали различия по фрагментам (3p и 8p). Количество различимых отдельных фрагментов в случае использования пар праймеров 1p, 2p, 3p, 4p, 5p, 7p, 8p, 9p составляло 47, 39, 31, 42, 47, 32, 7 и 46 соответственно. Не выявлено полиморфизма AFLP среди всех образцов, обработанных нечувствительными к метилированию (т.е. EcoRI-MseI) комбинациями праймеров, за исключением образцов JTNT1, культивируемых 14 дней с глицерином (4-й цикл субкультивирования). Напротив, не идентифицировано полиморфных фрагментов во всех других образцах в случае образцов, культивируемых с глицерином. В обработанных сахарозой образцах не выявлено полиморфизма по каким-либо фрагментам в случае тестированных комбинаций праймеров. Как предполагалось, не было различий в образцах отдельных клеток на протяжении, по меньшей мере, 3 циклов субкультивирования. Однако полиморфизм в культурах с глицерином в 4 цикле субкультивирования может быть следствием постоянного присутствия соединения в дополнение к стрессу, обусловленному отсутствием сахарозы (который, по-видимому, вызывает нестабильность). Различие, выявляемое в культурах отдельных клеток JTNT1, не проявляющих полиморфизма, свидетельствует о том, что глицерин как простой источник углерода, хотя и стабилизирует, как известно, микротрубочки, но не способен поддерживать многие клеточные функции, особенно в условиях длительного присутствия ингибитора микротубулина (MTI). В любом случае обработки отдельных клеток могут быть успешно проведены в тестированном диапазоне концентраций дифенилпиразола на протяжении, по меньшей мере, 4 циклов субкультивирования без проблем с нестабильностью генома.
Сделаны фотографии 2 полиморфных форм, выявленных в случае праймера 5p. Субкультура 4 имела инсерцию фрагмента длиной 130 п.н. и делецию фрагмента длиной 131 п.н.
Определяли профили AFLP, полученные с использованием нечувствительных к метилированию ферментов EcoRI и MseI с использованием комбинаций пары праймеров. Все образцы для 4 циклов субкультивирования были мономорфными, тогда как профиль для культуры с глицерином в 4-м цикле субкультивирования был полиморфным по различными локусам.
Таблица 2: Представлены подробности используемых комбинаций праймеров для AFLP и соответствующие количества наблюдаемых полос. Сахароза-X, отдельные клетки в среде NT1B-сахароза; глицерин-X, отдельные клетки среде NT1B-глицерин; контроль-сахароза, контрольная суспензия, содержащая агрегаты JTNT1, в сахарозе; контроль-глицерин, контрольная суспензия, содержащая агрегаты JTNT1, в глицерине.

Молекулярно-генетическая оценка единообразия. В данном исследовании наблюдали AFLP-полиморфизм (в 4-м цикле субкультивирования суспензии отдельных клеток, растущих на глицерине, в случае 9 комбинаций праймеров из 10 используемых комбинаций праймеров). Во всех случаях наблюдаемая вариабельность имеет отношение к фрагментам, образуемым с использованием EcoRI/MseI. Увеличение состояния метилирования во время культивирования ткани сообщалось ранее для каллусов томата, которые сравнивали с листьями (Smulders et al. 1995) и регенерированных из культуры ткани растений гороха (Cecchini et al. 1992). Таким образом, чтобы дополнительно оценить основанную на метилировании вариабельность, можно провести дальнейшую оценку чувствительной к метилированию комбинации PStI/MseI.
Приложение - пример 13.
Экстракция ДНК с использованием CTAB из суспензии клеток табака/каллусных тканей.
1. Отвешивают ~25 мг лиофилизованной ткани в пробирку Эппендорф объемом 2 мл.
2. Помещают стальной шарик в пробирку с тканью и встряхивают на Geno-гомогенизаторе или смесителе для красок в течение примерно 1 минуты (Geno-гомогенизатор устанавливают на 500 ударов/мин). Шарик вынимают и осторожно постукивают по пробирке, чтобы уменьшить образование комочков ткани.
3. Добавляют 1 мл буфера для экстракции и осторожно постукивают пробирку, чтобы уменьшить образование комочков ткани и поместить ткань в буфер, инкубируют при осторожном помешивании по краям в течение 2 часов при 65ºC. Охлаждают до комнатной температуры (~10 минут).
Буфер для экстракции (250 мл)
Трис-HCl 25 мл
NaCl 29,2 г
Na-EDTA 12,5 мл
CTAB 6,25 г
PVP 3,75 г
Вода (добавляют до конечного объема 250 мл)
4. Добавляют 0,75 мл смеси 25:24:1 фенол/хлороформ/изоамиловый спирт pH 8 к буферу для экстракции и осторожно покачивают вручную в течение 5 мин. Центрифугируют в течение 5 минут при 10000 об/мин чтобы разделить фазы. Осторожно переносят водную фазу в новую пробирку.
5. Повторяют стадию 4, используя смесь 24:1 хлороформ/октанол вместо смеси фенол/хлороформ/изоамиловый спирт.
6. К надосадку добавляют равный объем изопропанола и оставляют на 1 час при комнатной температуре.
7. Центрифугируют пробирки в течение 10 минут при 10000 об/мин и надосадок сливают с осторожностью, чтобы сохранить осадок на дне пробирки.
8. Добавляют 0,5 мл смеси 70% этанола и РНКазы, чтобы промыть осадок ДНК, и центрифугируют в течение 1 мин при 10000 об/мин (1:1000 РНКаза/этанол).
9. Осторожно сливают надосадок и повторяют промывку только 70% этанолом. Полностью высушивают осадок, оставляя при комнатной температуре на 3 часа или высушивая образцы на роторном испарителе в течение ~5 минут.
10. После того как капелек спирта не остается, осадок растворяют в 0,2 мл 1X буфера трис-EDTA, который был предварительно нагрет до 65ºC. Образцы оставляют стоять в течение ночи при комнатной температуре, чтобы полностью ресуспендировать.
11. На следующее утро осторожно встряхивают пробирки для перемешивания. Образцы разгоняют в агарозном геле, чтобы проверить расщепление и присутствие РНК и определить количество.
Пример 13. Ссылки.



ПРИМЕР 14 - Трансформация отдельных клеток табака BY2 плазмидами.
Получение отдельных клеток в препаратах для трансформации плазмидой.
Четыре миллилитра суспензии клеток табака BY2 (в стационарной фазе роста, поддерживаемые в 7-дневном цикле) добавляли к 26 мл свежей среды, которая состояла либо из среды A [соли LS (PhiytoTechnology Laboratories, L689), 120 г/л сахарозы, 1 мг/л никотиновой кислоты, 1 мг/л пиридоксина-HCl, 10 мг/л тиамина-HCl и 20 нМ дифенилпиразола (DPP)], либо из среды B [соли LS, 120 г/л сахарозы, 1 мг/л никотиновой кислоты, 1 мг/л пиридоксина-HCl, 10 мг/л тиамина-HCl, 2,5 мг/л бензиламинопурина (BAP) и 20 нМ DPP], находящейся во встряхиваемой колбе объемом 125 мл с пористой пробкой. Колбы помещали на роторное встряхивающее устройство при скорости 125 об/мин в темноте при температуре 28ºC на 7 суток.
Эксперимент по трансформации.
Эксперименты по трансформации начинали с разбавления суспензионной культуры BY2 (выращенной, как описано выше) свежей средой до OD650 1,0. Для приготовления каждой мишени для трансформации 1,5 мл разбавленной суспензии пипеткой переносили на стерильную фильтровальную бумагу, которая была помещена сверху устройства для вакуумной фильтрации. Клетки из суспензии равномерно осаждались на поверхности фильтровальной бумаги. Фильтровальную бумагу с клетками переносили в среду для бомбардировки [основные соли MS, витамин B5, 18,2 г/л маннита, 18,2 г/л сорбита, 30 г/л сахарозы, 1 мг/л BAP, 0,1 мг/л 1-нафталинуксусной кислоты (NAA), 8 г/л агара TC (PhytoTechnology Laboratories, A175).
Конструкция плазмиды для трансформации пластид отдельных клеток.
Конструкция ДНК, используемая в настоящем примере, названа pDAB3969. Элементы конструкции были фланкированы последовательностями 16S trnI и trnA из генома хлоропласта табака. Два гена, aphA-6 и nptII, использовали в качестве селектируемых маркеров под контролем промоторов Prrn плюс ген 10 T7 и PpsbA соответственно. Ген 10 T7 также управляет представляющим интерес геном, TurboGFP.
Баллистическая бомбардировка отдельных клеток BY2.
Клетки оставляли в среде для бомбардировки в течение 4 часов перед бомбардировкой. Приготовленные мишени бомбардировали, используя систему доставки Bio-Rad PDS-1000/He. Готовили частицы золота (0,4 мкм, Inbio Gold Melbourne, Australia) и осаждали ДНК на их поверхности, используя стандартные способы.
Чашки с мишенями бомбардировали при давлении 1100 фунтов на кв. дюйм (7,6848 МПа) наряду с 28 дюймами (71,12 мм) ртутного столба и на расстоянии 9 см от задерживающего экрана. Чашки затем отставляли, давая период восстановления одни сутки. Фильтровальные бумаги с тканью затем переносили в среду C [соли LS, 120 г/л сахарозы, 170 мг/л фосфата калия, однозамещенного, безводного, 0,6 мг/л тиамина-HCl, 0,2 мг/л 2,4-D, 8 г/л агара TC и 100 мг/л канамицина] и оставляли на исходной чашке для селекции вплоть до появления резистентных колоний. Когда резистентные колонии вырастали до диаметра 4-5 мм, их изолировали в отдельные чашки с гелевой средой C и наращивали массу вплоть до того момента, когда они становились достаточно большими, чтобы можно было взять образец для ПЦР-анализа.
Результаты и обсуждение.
Суспензионные линии BY2 культивировали в среде A и среде B в течение 7 суток. Пять чашек с мишенями готовили из клеток, выращенных в среде A, и пять других чашек готовили из клеток, выращенных в среде B. Указанные две среды были составлены для получения увеличенных амилопластов в результате увеличения содержания сахарозы, удаления ауксина 2,4-дихлорфеноксиуксусной кислоты (2,4-D) и в среде B в результате добавления цитокинина BAP (1,2). Увеличенные амилопласты служили в качестве более крупных мишеней для баллистической трансформации. В обеих средах, которые содержали 20 нМ DPP, получали отдельные клетки. В чашках после бомбардировки получали 3 резистентные к канамицину колонии из клеток, обработанных в среде, и 2 резистентные колонии из клеток, обработанных в среде B.
Из каждой колонии брали образцы для молекулярного анализа. ДНК экстрагировали, используя протокол DNasey, и аликвоты анализировали в ПЦР, используя следующие наборы праймеров.

Праймеры амплифицировали участки конструкции для трансформации. Праймер MAS401 садится на нативную пластидную ДНК табака на расстоянии 83 пары оснований от конца фланкирующей последовательности trnA и демонстрирует интеграцию в пластидный геном.
Реакции ПЦР при использовании наборов праймеров 2, 3, 4 и 5 давали позитивные реакции в случае всех пяти образцов. ДНК из суспензионных клеток BY2 дикого типа (нетрансформированных) или контрольных растений табака не давала каких-либо полос. Таким образом, результаты ПЦР свидетельствуют о присутствии всех трех трансгенов и интеграции в пластидный геном.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПЕРЕНОСА МОЛЕКУЛЯРНЫХ ВЕЩЕСТВ В КЛЕТКИ РАСТЕНИЙ | 2008 |
|
RU2495935C2 |
| СПОСОБ РЕГЕНЕРАЦИИ ХЛОПЧАТНИКА ИЗ СОМАТИЧЕСКИХ КЛЕТОК (ВАРИАНТЫ) | 1988 |
|
RU2128428C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОЙ СУСПЕНЗИОННОЙ КУЛЬТУРЫ ТРАНСГЕННОГО ТАБАКА Nicotiana tabacum L., СОДЕРЖАЩЕГО ГЕН UIDA | 2012 |
|
RU2519652C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2556376C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2017 |
|
RU2664865C2 |
| ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ ДОСТАВКА СИКВЕНС-СПЕЦИФИЧНЫХ НУКЛЕАЗ | 2010 |
|
RU2612156C2 |
| РАСТИТЕЛЬНЫЕ КЛЕТКИ И ОРГАНИЗМЫ РАСТЕНИЙ С МОДИФИЦИРОВАННЫМ КЛЕТОЧНЫМ РОСТОМ, РАЗВИТИЕМ И ДИФФЕРЕНЦИРОВКОЙ | 2004 |
|
RU2349642C2 |
| ДОСТАВКА ЛИНЕЙНОЙ МОЛЕКУЛЫ ДНК В РАСТЕНИЯ ДЛЯ СТАБИЛЬНОЙ ТРАНСФОРМАЦИИ С ПОМОЩЬЮ ПЕГИЛИРОВАННЫХ КВАНТОВЫХ ТОЧЕК | 2011 |
|
RU2575097C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЙ ZEA MAYS L., УСТОЙЧИВЫХ К ПОВРЕЖДЕНИЯМ, ВЫЗЫВАЕМЫМ НАСЕКОМЫМИ | 1988 |
|
RU2126047C1 |
| РЕКОМБИНАНТНЫЕ КЛЕТКИ РАСТЕНИЙ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ БЕЛКА-МИШЕНИ С ИХ ИСПОЛЬЗОВАНИЕМ | 2014 |
|
RU2636462C2 |

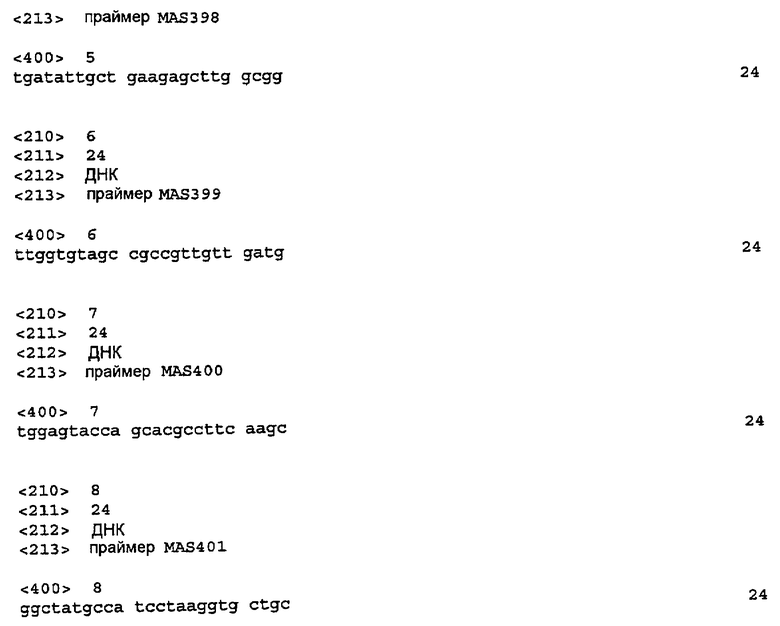
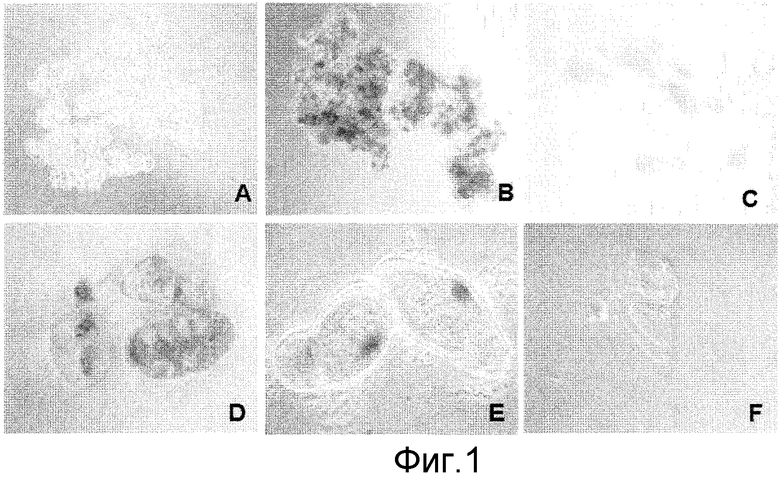


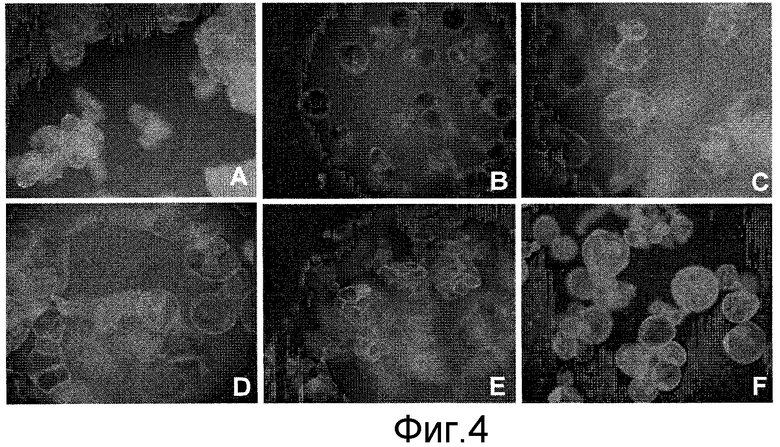
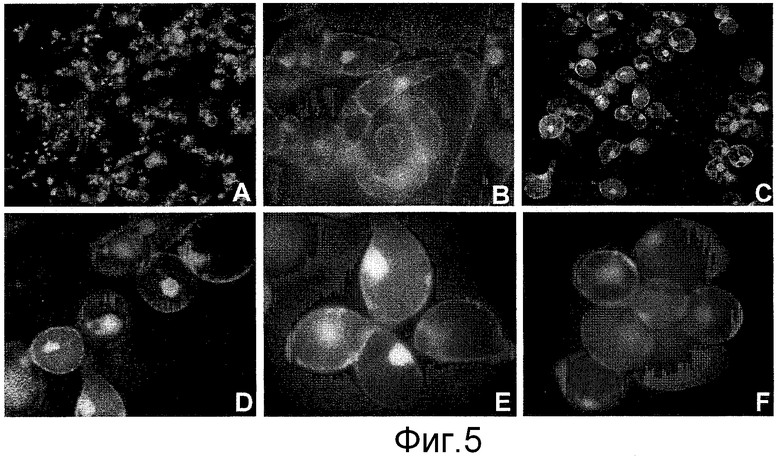







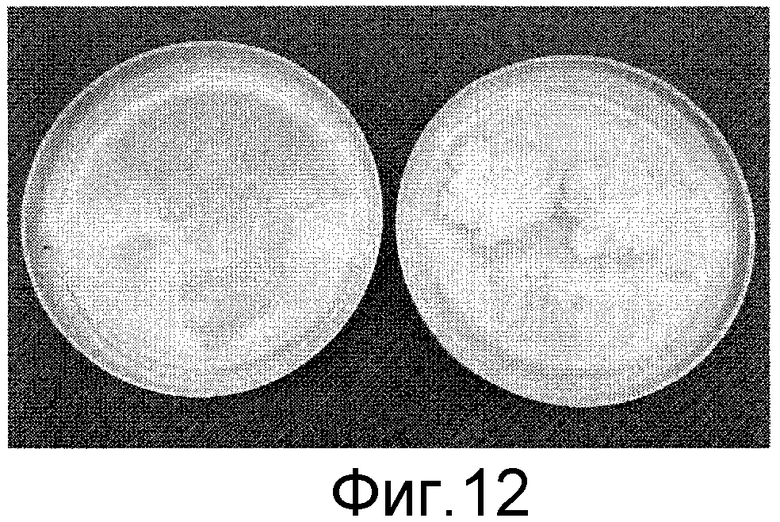



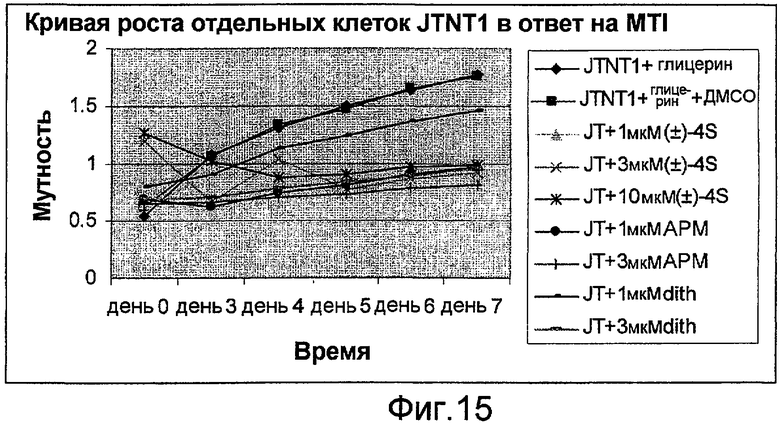
Изобретение относится к биотехнологии. Описан способ получения отдельной растительной клетки, где способ включает: помещение агрегированных растительных клеток, содержащих интактные клеточные стенки, в среду, содержащую глицерин и разделяющее средство, выбранное из группы, состоящей из фермента, расщепляющего пектин, и соединения, деполимеризующего тубулин; встряхивание агрегированных растительных клеток со стадии (а) при температуре 25-28°С в темноте на орбитальном шейкере при 150 об/мин и перенос одной или нескольких растительных клеток, содержащих интактные клетки, в среду культивирования растения, которая не содержит глицерин и разделяющее средство, выбранное из группы, состоящей из фермента, расщепляющего пектин, и соединения, деполимеризующего тубулин. Раскрыт способ трансформации клетки, полученной описанным способом, при этом указанный способ включает получение изолированной клетки согласно описанному способу, трансформацию указанной клетки гетерологичным полинуклеотидом и отбор трансформированной клетки. Изобретение упрощает и интегрирует способы трансформации, основанные на отдельных клетках. Настоящее изобретение с высокой эффективностью создает не содержащие маркеров и однородные трансгенные линии для удовлетворения различных потребностей при осуществлении программ, связанных со здравоохранением животных, биофармацией и защитой сельскохозяйственных растений. 2 н. и 11 з.п. ф-лы, 15 ил., 2 табл.
1. Способ получения отдельной растительной клетки, где способ включает:
a) помещение агрегированных растительных клеток, содержащих интактные клеточные стенки в среду, содержащую глицерин и разделяющее средство, выбранное из группы, состоящей из фермента, расщепляющего пектин, и соединения, деполимеризующего тубулин;
b) встряхивание агрегированных растительных клеток со стадии (а) при температуре 25-28°С в темноте на орбитальном шейкере при 150 об/мин; и
c) перенос одной или нескольких растительных клеток, содержащих интактные клетки в среду культивирования растения, которая не содержит глицерин и разделяющее средство, выбранное из группы, состоящей из фермента, расщепляющего пектин, и соединения, деполимеризующего тубулин.
2. Способ по п.1, в котором указанная среда является жидкой средой, и указанные клетки находятся в суспензии.
3. Способ по п.1, в котором указанное разделяющее средство представляет собой соединение, деполимеризующее тубулин.
4. Способ по п.3, в котором указанное соединение, деполимеризующее тубулин, выбрано из группы, состоящей из колхицина и динитроанилина.
5. Способ по п.3, в котором указанное соединение, деполимеризующее тубулин, соответствует следующей формуле:
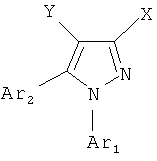
где X=OCH2CO2R;
Y=1;
Аr1=незамещенный фенил;
Аr2=незамещенный фенил; и
R=этил.
6. Способ по п.5, в котором указанное соединение, деполимеризующее тубулин, представляет собой этиловый эфир(4-хлор-1,5-дифенил-1Н-пиразол-3-илокси)уксусной кислоты.
7. Способ по п.3, в котором указанное соединение, деполимеризующее тубулин, представляет собой

8. Способ по п.1, в котором указанным разделяющим средством является фермент, выбранный из группы, состоящей из пектиназы и пектолиазы.
9. Способ трансформации клетки, полученной способом по п.1, при этом указанный способ включает получение изолированной клетки согласно способу по п.1, трансформацию указанной клетки гетерологичным полинуклеотидом и отбор трансформированной клетки.
10. Способ по п.9, в котором на указанной стадии отбора используют селекцию без маркеров.
11. Способ по п.1, в котором указанный способ является высокопроизводительным способом.
12. Способ по п.9, в котором указанную стадию трансформации осуществляют, применяя способ, выбранный из группы, состоящей из способов, основанных на использовании полиэтиленгликоля, электропорации, бомбардировок и наночастиц.
13. Способ по п.1, в котором указанная среда выбрана из группы, состоящей из гелевой и полутвердой среды.
| HAYASHI Т., YOSHIDA К | |||
| «Cell expansion and single-cell separation induced by colchicine in suspension-cultured soybean cells», Proc Natl Acad Sci USA | |||
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
| Способ получения трасформированных клеток двудольных растений | 1984 |
|
SU1582990A3 |
Авторы
Даты
2012-05-27—Публикация
2007-12-27—Подача