ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам регуляции клеточного роста и/или регуляции развития и дифференцировки у растений и к применимым для этого молекулам. Кроме того, настоящее изобретение относится к продуцируемым и/или созданным растениям с генетически контролируемыми генами, вовлеченными в рост их клеток и/или развитие и дифференцировку, и способам их применения.
УРОВЕНЬ ТЕХНИКИ
Растения обладают особыми эмбриологическими свойствами, отличными от свойств других эукариот. Так как растительные клетки не мигрируют, считается, что клеточное деление, растяжение и запрограммированная гибель клеток определяют морфогенез. Клетки пролиферируют в меристемных тканях, существующих на обоих полюсах, верхушке побега и кончике корня. Пролиферирующие клетки дифференцируются и накапливаются, развиваясь в растение. Размер растения определяется количеством и размером входящих в его состав клеток, формирующих растение. Растения контролируют клеточный рост (пролиферацию клеток) посредством регуляции клеточного цикла, так что размеры растений адаптированы к изменяемым условиям окружающей среды. Регуляция клеточного цикла имеет важное значение для дифференцировки растений. Например, перициклические клетки корней пребывают в особом периоде (фазе G2) клеточного цикла, и дифференцировка боковых корней определяется тем, начали ли клетки делиться или нет. Количество клеток гипокотиля регулируется у растений, но клеточный цикл изменяется в темноте и размер клеток изменяется при эндоредупликации.
Предполагается, что способ регуляции деления клеток растений, в частности способ регуляции клеточного цикла, имеет большое значение в качестве нового способа селекции растений, при котором одновременно воздействуют на такие параметры, как рост, форма и реакция на стресс.
Клетка делится на две дочерние клетки в результате целого ряда процессов, называемых клеточным циклом, который состоит из четырех фаз, а именно: промежуточная фаза 1 (фаза G1), фаза синтеза ДНК (S-фаза), промежуточная фаза 2 (фаза G2) и фаза митоза (фаза M). Были указаны и исследованы механизмы, связанные с регуляцией фаз S и M клеточного цикла. Среди этих двух фаз фаза M, называемая фазой митотического деления, является фазой для равномерного распределения хромосом, удвоенных в фазе S, между дочерними клетками. Для вступления в фазу M циклины (одним из типичных представителей является циклин B) связываются с циклин-зависимой киназой (CDK) с образованием активированного комплекса для усиления агрегации хромосом и разрушения ядерных мембран. Фаза M заканчивается после процесса, называемого цитокинезом (деление цитоплазмы) для разделения цитоплазмы после распределения хромосом на две части. В растительных клетках образуется фрагмопласт, который является структурой, специфичной для растений, и протекает деление цитоплазмы. Образование фрагмопласта регулируется кинезин-подобными белками NACK1 и NACK2.
Циклин B, NACK1 и NACK2, выполняющие важные функции в процессе - от вступления в фазу M до окончания фазы M в растительных клетках, показывают картины экспрессии генов, специфичные для фаз G2/M. Сообщается, что специфичная регуляторная последовательность, называемая M-специфичным активатором (MSA), существующая в области промотора, контролирует специфичную для фаз экспрессию указанных генов (непатентный документ 1). Кроме специфичных для растений CDK, CDKB и генов, имеющих высокое сходство с циклин-специфичными ферментами E2 среди ферментов E2, связанных с протеолизом, сообщалось о ряде функционально неизвестных генов, имеющих картины экспрессии, специфичные для фазы M. При анализе показано, что многие из указанных генов содержат последовательности MSA в промоторных областях. Поэтому считается, что механизмы регуляции специфичной для фаз G2/M экспрессии генов последовательностями MSA консервативны у всех растений.
NtmybA1, NtmybA2 и NtmybB (в дальнейшем называемые «Ntmyb») идентифицированы в табаке в качестве MSA-связывающих факторов. Аминокислотные последовательности белков Ntmyb обычно имеют высокое сходство с областью связывания ДНК myb, имеющей последовательность, состоящую из неполных трех повторов, существующих в c-myb у животных и других организмов (такие белки, содержащие указанную ДНК-связывающую область, в дальнейшем называют «3Rmyb»). Многие растения имеют гены, несущие myb-подобные ДНК-связывающие области, но большинство из них состоит из двух повторяющихся областей myb или областей myb неповторяющегося типа. Например, Arabidopsis thaliana, секвенирование генома которого завершено, имеет более ста генов, содержащих myb-подобные ДНК-связывающие области, но только пять генов содержат указанную выше myb-подобную ДНК-связывающую область, состоящую из трех неполных повторов myb (3Rmyb). Таким образом, такие гены известны как конкретные представители суперсемейств, составляющих группу myb-подобных белков растений (непатентный документ 2).
Эксперименты по регуляции транскрипции с репортерными генами проводили для исследований функций Ntmyb, используя системы временной экспрессии в растительных клетках. Сообщалось, что NtmybA1 и NtmybA2 активировали транскрипцию с промотора циклина B мадагаскарского барвинка (Catharanthus roseus) (CYM) и промотора NACK 1, и наоборот, NtmybB супрессировал указанную транскрипцию, таким образом показывая, что Ntmyb способны связываться с MSA и действовать в качестве регулирующих транскрипцию факторов для генов, имеющих специфичную для фаз G2/M экспрессию (непатентный документ 3). Однако указанные сообщения основаны только на результатах транскрипции репортерных генов, активированных Ntmyb, временно экспрессированными в одной точке клеточного цикла, регулируемого циклической экспрессией многочисленных генов. Таким образом, еще не было сообщений, раскрывающих функции Ntmyb в клеточном цикле и делении клеток.
Сообщались примеры, описывающие, что рост и развитие растений модифицировали трансформацией специфично экспрессирующимися в фазах G2/M генами. Например, удлинение корней усиливается в трансформированных растениях, которые эктопически экспрессировали циклин B (непатентный документ 4); и цитоплазматическое деление было неполным, уменьшая высоту растений, имеющих супрессированную экспрессию NACK1, важного для окончания фазы M, или в трансформированных растениях, имеющих доминантные негативные по NACK1 конструкции (непатентный документ 5). Однако указанные примеры представляют собой способы регулирования клеточного роста с использованием отдельных генов, связанным с прохождением фазы M. Таким образом, не было сообщений, описывающих трансформированные растения, в которых экспрессия специфичных для фаз G2/M генов, включая функционально неизвестные гены, регулируемых последовательностями MSA, регулировалась совместно.
Ntmyb содержит ДНК-связывающую область myb, имеющую гомологию с c-myb. Считается, что транскрипционная функция c-myb неактивна, когда мотив EVES, существующий в указанном белке, связывается с ДНК-связывающим доменом myb, и активируется, когда фосфорилирование мотива EVES протеинкиназой приводит к изменению конформации белка, тем самым обеспечивая возможность для связывания коактиватора P100 с ДНК-связывающей областью myb (непатентный документ 6). Так как обнаружено, что другие области, отличные от ДНК-связывающих областей myb, не имеют сходства при сравнении Ntmyb и c-myb, и регуляторные последовательности, такие как мотивы EVES, не являются консервативными, то предполагают, что механизм регуляции способности Ntmyb активировать транскрипцию отличается от механизма в случае белка c-myb. Не было сообщений, описывающих наличие области для регулирования активирующей транскрипцию способности Ntmyb.
Сообщалось только о ДНК, кодирующих полноразмерный 3Rmyb, в табаке и Arabidopsis thaliana, которые являются двудольными растениями, но не было сообщений о полноразмерном 3Rmyb из однодольных растений. Это значит, что нет сообщений, показывающих, являются ли механизмы регуляции специфичной для фаз G2/M экспрессии генов, опосредованной последовательностью MSA и 3Rmyb, консервативными или неконсервативными у однодольных растений и двудольных растений.
Большинство животных являются диплоидными, но у растений известны различные уровни плоидности. Triticum является гексаплоидным, а Asterales является декаплоидным. Большое количество указанных полиплоидных растений обычно имеют качества или свойства, полезные в сельском хозяйстве, и создание растений разной плоидности применяют в качестве средства для селекции. Обработку колхицином широко используют в качестве методики для создания полиплоидов. А именно, обработку колхицином осуществляют на семенах растений, зародышах растений или клетках органов в культуре ткани и затем проводят отбор растений из регенерированных растений. Колхицин ингибирует образование веретена деления плоидных клеток после удвоения ДНК, и плоидные клетки образуются в результате «перескакивания» фазы митоза. Однако необходимы исследования органов, которые необходимо обрабатывать колхицином, и времени для обработки лекарственным средством; таким образом, это нелегко осуществить у всех растений.
[Непатентный документ 1] Ito et al., Plant Cell, 10: 331 (1998)
[Непатентный документ 2] Stracke et al., Curr. Opin. Plant Biol. 4: 447 (2001)
[Непатентный документ 3] Ito et al., Plant Cell, 13: 1891 (2001)
[Непатентный документ 4] Doerner et al., Nature, 380: 520 (1996)
[Непатентный документ 5] Nishihama et al., Cell, 109: 87 (2002)
[Непатентный документ 6] Dash et al., Genes Dev., 10: 1858 (1996)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Как указано выше, так как регуляция клеточного цикла имеет важное значение для селекции растений, целью настоящего изобретения является новый способ модифицирования роста или пролиферации растительных клеток. А именно, целью настоящего изобретения является способ модифицирования развития/дифференцировки растений в комбинации с модифицированием роста или пролиферации растительных клеток и применимые в данном способе гены растений.
Другой целью настоящего изобретения являются способы существенной модификации функции генов растений 3Rmyb и новые варианты молекул белка 3Rmyb, функция которых модифицирована.
Авторы изобретения провели всестороннее исследование, обнаружив, что ген растений 3Rmyb является фактором, необходимым для роста (или пролиферации) растительных клеток, и осуществили способ модифицирования роста растительных клеток целенаправленным воздействием на ген 3Rmyb и способ модифицирования развития/дифференцировки растений. Кроме того, авторы изобретения обнаружили, что указанные способы могут быть применимы для множества растений.
А именно, созданы растительные клетки и растения, проявляющие модифицированные активности растительного белка 3Rmyb. В указанных растительных клетках и растениях клеточный рост (или пролиферация клеток) и/или развитие/дифференцировка клеток несомненно могут быть модифицированы.
Кроме того, впервые при использовании растительных клеток и растений, у которых наблюдаются модифицированные активности растительного белка 3Rmyb, обнаружено, что представитель 3Rmyb растений, содержащий специфичную аминокислотную последовательность, является положительно регулирующим фактором в отношении клеточного цикла и деления клеток (одним из типичных представителей растительного 3Rmyb является «NtmybA2») и что другой представитель 3Rmyb растений, содержащий аминокислотную последовательность, отличную от вышеуказанной последовательности, является отрицательно регулирующим фактором в отношении клеточного цикла и деления клеток (одним из типичных примеров растительного 3Rmyb является «NtmybB»).
Авторы изобретения также успешно создали варианты транскрипционных факторов, растительных белков 3Rmyb и обнаружили, что их функции модифицированы. Авторы изобретения успешно обнаружили, что указанные варианты можно использовать для того, чтобы модифицировать активности, присущие растительным белкам 3Rmyb в растительных клетках или в растениях. А именно, авторы изобретения обнаружили регуляторные области для регуляции активностей транскрибирующихся ниже генов среди аминокислотных последовательностей растительных белков 3Rmyb и успешно создали молекулы, обладающие модифицированной способностью активировать транскрипцию генов. Авторы изобретения успешно создали варианты растительных белков 3Rmyb, обладающие существенно повышенной способностью активировать транскрипцию (обладающие существенно повышенными свойствами активации транскрипции), и молекулы, действующие доминантно-негативно на транскрипты генов растений 3Rmyb.
Авторы изобретения также успешно выделили новый ген растений 3Rmyb, полученный из однодольного растения риса, т.е. ДНК, кодирующую белок Os3RmybA1; и обнаружили, что белок Os3RmybA1 является функциональным эквивалентом белка табака 3Rmyb, белка NtmybA2.
На основании указанных выше полученных данных авторы осуществили настоящее изобретение.
Настоящее изобретение относится к способу регуляции роста клеток растений и/или регуляции развития и дифференцировки организма растения, при этом ген-мишень выбран из генов 3Rmyb растений, гена Os3RmybA1, вовлеченного в деление клеток растений, а также их генных аналогов, и белков, кодируемых указанными генами.
В используемом в данном описании смысле счет, «счет при выравнивании», свидетельствующий о сходстве между определенной аминокислотой или аминокислотной последовательностью и конкретной представляющей интерес аминокислотой или аминокислотной последовательностью, относится к проценту идентичных или сходных аминокислот, который получен в результате анализа множественного выравнивания аминокислотных последовательностей с использованием программы ClustalW (http://www.ddbj.nig.ac.jp/E-mail/clustalw-j.html). Кроме того, указанное выше сравнение аминокислотных последовательностей проводят при оптимальном выравнивании аминокислотных последовательностей, являющихся мишенями. Две аминокислотные последовательности являются оптимальными в данном описании, если конкретно не описано иное. Программа работает при следующих условиях: параметры устанавливают по умолчанию (def), OUTPUT=clustal, OUTORDER=aliged, MATRIX=blosum, GAPDIST=8, MAXDIV=40, ENDGAPS=OFF, NOPGAPS=OFF и NOHGAPS=OFF.
В более конкретном аспекте в настоящем изобретении предлагается следующее:
(1) Растительная клетка, имеющая (генетически) модифицированную активность растительного белка 3Rmyb по сравнению с соответствующей растительной клеткой дикого типа.
(2) Растительная клетка по п.(1), в которой указанная растительная клетка несет или была трансформирована ДНК, выбранной из следующих ДНК (a)-(f), или конструкцией рекомбинантной ДНК или вектором, которые указаны в следующем п.(g):
(a) ДНК, кодирующая любую аминокислотную последовательность растительных белков 3Rmyb,
(b) ДНК, не только гибридизующаяся с ДНК, кодирующей любую аминокислотную последовательность растительных белков 3Rmyb, в жестких условиях, но также кодирующая функционально эквивалентный белок любому из растительных белков 3Rmyb;
(c) ДНК, кодирующая рибозимную каталитическую РНК, которая специфично расщепляет транскрипт ДНК, кодирующей любой из растительных белков 3Rmyb;
(d) ДНК, не только кодирующая РНК, которая супрессирует экспрессию ДНК, кодирующей любой из растительных белков 3Rmyb, посредством механизмов косупрессии при экспрессии в растительной клетке, но также являющаяся по меньшей мере на 90% гомологичной ДНК 3Rmyb;
(e) ДНК, кодирующая РНК, которая супрессирует экспрессию ДНК, кодирующей любой из растительных белков 3Rmyb, посредством механизмов интерференции РНК при экспрессии в растительной клетке;
(f) ДНК, кодирующая антисмысловую РНК, которая комплементарна транскрипту ДНК, кодирующей любой из растительных белков 3Rmyb;
(g) рекомбинантная конструкция ДНК или вектор, содержащий по меньшей мере один представитель, выбранный из группы, состоящей из следующих представителей (i)-(iii):
(i) промотор, способный к транскрипции в растительной клетке,
(ii) ДНК, в которой ДНК по любому из указанных выше пп.(a)-(f) связана с указанной последовательностью промотора в смысловом или антисмысловом направлении, и
(iii) сигнал терминации транскрипции и полиаденилирования молекулы РНК.
(3) Растительная клетка по п.(1) или (2), в которой растительный белок 3Rmyb является транскрипционным фактором для активации специфичной для фаз G2/M транскрипции, опосредованной последовательностью MSA.
(4) Растительная клетка по п.(1) или (2), в которой растительный белок 3Rmyb, который является транскрипционным фактором для активации специфичной для фаз G2/M транскрипции, опосредованной последовательностью MSA, представляет собой белок, содержащий по меньшей мере аминокислотную последовательность
SILX1KRXRXLX3X4PX2XX5X1RXX5KK (SEQ ID NO: 94),
где X означает любую аминокислоту, X1 означает K или R, X2 означает L, I или V, X3 означает L или V, X4 означает S или T и X5 означает D или E.
(5) Растительная клетка по любому из пп.(1)-(4), в которой растительный белок 3Rmyb представляет собой аминокислотную последовательность, выбранную из SEQ ID NO: 32, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 75 и SEQ ID NO: 76.
(6) Растительная клетка по п.(1) или (2), в которой растительный белок 3Rmyb является транскрипционным фактором для супрессии или ингибирования специфичной для фаз G2/M транскрипции, опосредованной последовательностью MSA.
(7) Растительная клетка по п.(1) или (2), в которой растительный белок 3Rmyb, который является транскрипционным фактором для супрессии или ингибирования специфичной для фаз G2/M транскрипции, опосредованной последовательностью MSA, представляет собой белок, содержащий по меньшей мере аминокислотную последовательность
SCSSXSX6 (SEQ ID NO: 95),
где X означает любую аминокислоту и X6 означает K, R, D, E или H.
(8) Растительная клетка по п.(1), (2), (6) или (7), в которой растительный белок 3Rmyb представляет собой аминокислотную последовательность, выбранную из SEQ ID NO: 55, SEQ ID NO: 77 и SEQ ID NO: 78.
(9) Растительная клетка по любому из пп.(1)-(8), в которой количество экспрессированных растительных белков 3Rmyb модифицировано по сравнению с соответствующей растительной клеткой дикого типа.
(10) Растительная клетка по любому из пп.(1)-(8), в которой рост указанной клетки модифицирован по сравнению с соответствующей растительной клеткой дикого типа.
(11) Растение, содержащее или имеющее растительную клетку по любому из пп.(1)-(10).
(12) Растение, которое является потомством, потомком или клоном трансгенного растения по п.(11).
(13) Растение по п.(11) или (12), в котором клеточный рост и/или развитие/дифференцировка модифицированы по сравнению с соответствующим растением дикого типа.
(14) Растение по п.(11) или (12), которое используют для модифицирования роста его клеток и/или развития/дифференцировки.
(15) ДНК, кодирующая белок 3Rmyb с повышенной способностью активировать транскрипцию по сравнению с соответствующим белком дикого типа.
(16) ДНК по п.(15), в которой белок 3Rmyb с повышенной способностью активировать транскрипцию несет потерю функции, вызванную регуляторной областью для регуляции способности активировать транскрипцию.
(17) ДНК по п.(16), в которой указанная регуляторная область потери функции расположена в положении ближе к C-концевой стороне, чем аминокислотная последовательность TPSILKKRHR, которая показана в SEQ ID NO: 89.
(18) ДНК по п.(16), в которой указанная регуляторная область потери функции расположена в положении ближе к C-концевой стороне, чем аминокислотный остаток W в аминокислотной последовательности NXXTPXRLWX, где X означает любую аминокислоту, которая показана в SEQ ID NO: 90.
(19) ДНК по п.(16), в которой указанная регуляторная область потери функции находится в пределах от аминокислотной последовательности PPRFPSXDXPF, где X означает любую аминокислоту, которая показана в SEQ ID NO: 91, до C-конца.
(20) ДНК по любому из пп.(15)-(19), которая кодирует растительный белок 3Rmyb, в котором мутация потери функции вызвана заменой, делецией (или нарушением) и/или добавлением (или инсерцией) по меньшей мере одной или нескольких аминокислот.
(21) ДНК по любому из пп.(15)-(19), которая кодирует растительный белок 3Rmyb, в котором мутация потери функции вызвана делецией или нарушением по меньшей мере одной или нескольких аминокислот.
(22) ДНК, кодирующая доминантный негативный белок против эндогенного растительного белка 3Rmyb.
(23) ДНК по п.(22), которая кодирует белок, содержащий аминокислотную последовательность ДНК-связывающей области 3Rmyb растений.
(24) Рекомбинантная конструкция ДНК или вектор, содержащий представитель, выбранный из группы, состоящей из следующих представителей (i)-(iii):
(i) промотора, способного к транскрипции в растительной клетке,
(ii) ДНК, в которой ДНК по любому из пп.(15)-(23) связана с указанной последовательностью промотора в смысловом или антисмысловом направлении, и
(iii) сигнала терминации транскрипции и полиаденилирования молекулы РНК.
(25) Растительная клетка, которая несет или была трансформирована ДНК, рекомбинантной конструкцией ДНК или вектором по любому из пп.(15)-(24).
(26) Растительная клетка по п.(25), в которой рост клетки модифицирован по сравнению с соответствующей растительной клеткой дикого типа.
(27) Трансгенное растение, содержащее или несущее растительную клетку по п.(25).
(28) Растение, которое является потомством, потомком или клоном трансгенного растения по п.(27).
(29) Растение по п.(27) или (28), в котором клеточный рост и/или развитие/дифференцировка модифицированы по сравнению с соответствующим растением дикого типа.
(30) ДНК, выбранная из следующих ДНК (a)-(i):
(a) ДНК, кодирующая белок, содержащий аминокислотную последовательность SEQ ID NO: 32,
(b) ДНК, содержащая нуклеотидную последовательность SEQ ID NO: 31,
(c) ДНК, кодирующая белок, не только содержащий аминокислотную последовательность с аминокислотной заменой, делецией (или нарушением) или добавлением (или инсерцией) одной или множества аминокислот в аминокислотной последовательности SEQ ID NO: 32, но также являющийся функционально эквивалентным белку с аминокислотной последовательностью SEQ ID NO: 32,
(d) ДНК, не только гибридизующаяся с ДНК с нуклеотидной последовательностью SEQ ID NO: 31 в жестких условиях, но также кодирующая белок, функционально эквивалентный белку с аминокислотной последовательностью SEQ ID NO: 32,
(e) ДНК, кодирующая белок, не только содержащий аминокислотную последовательность со счетом при выравнивании 60 или более по сравнению с аминокислотной последовательностью SEQ ID NO: 32, но также являющийся функционально эквивалентным белку с аминокислотной последовательностью SEQ ID NO: 32,
(f) ДНК, кодирующая антисмысловую РНК, которая комплементарна транскрипту ДНК, выбранной из указанных выше ДНК по п.(a)-(e),
(g) ДНК, кодирующая рибозимную каталитическую РНК, которая специфично расщепляет транскрипт ДНК, выбранной из указанных выше ДНК по п.(a)-(e),
(h) ДНК, не только кодирующая РНК, которая супрессирует экспрессию ДНК, выбранной из указанных выше ДНК по п.(a)-(e), на основе механизмов косупрессии при экспрессии в растительной клетке, но также являющаяся по меньшей мере на 90% гомологичной указанной ДНК, выбранной из (a)-(e), и
(i) ДНК, не только кодирующая РНК, которая супрессирует экспрессию ДНК, выбранной из указанных выше ДНК по п.(a)-(e), на основе механизмов интерференции РНК при экспрессии в растительной клетке, но также являющаяся идентичной на протяжении 20 или более следующих друг за другом нуклеотидов указанной ДНК, выбранной из (a)-(e).
В настоящем изобретении растительный белок 3Rmyb представлен группой белков, отличающихся тем, что c-Myb-подобный домен Myb содержит аминокислотную последовательность, включающую в себя 3 неполных повтора ДНК-связывающего домена. Желательными являются такие растительные белки 3Rmyb, которые содержат аминокислотную последовательность со счетом при выравнивании по меньшей мере 60 (т.е. 60 или выше) при сравнении с аминокислотной последовательностью ДНК-связывающего домена myb белка c-myb человека (т.е. с аминокислотной последовательностью с остатками аминокислот 43-192 SEQ ID NO: 88), где счет при выравнивании указывает сходство при сравнении выровненных аминокислотных последовательностей. Кроме того, требуемые типы включают белки, содержащие аминокислотную последовательность с тремя повторами консервативной аминокислотной последовательности SEQ ID NO: 92 c-Myb-подобного ДНК-связывающего домена Myb, т.е.,
W[S,T]XXE[D,E]XX[L,I,V],
где X означает любую аминокислоту, и [] означает одну конкретную аминокислоту, выбранную из аминокислот, перечисленных в квадратных скобках,
с дополнительными промежуточными 42 произвольными аминокислотными остатками, расположенными между указанными повторами. Более предпочтительно такие типы включают белки, содержащие последовательность из 150 аминокислот следующей формулы:
WTXEEDXXLXXXVXXUXGX7XWKXIAXXXXXROX5JQCLHRWQKVLXPXLJKGXWOXEEDXXJXXXJXX7XGXXKWSXJOXXXXGRIGKQCRERWUNHLXPXIXX7XXWTXXEX5XXLXXXHXXXGNX7WAEJXX7XLXGX7ODNOIKNXWXSOXKKX7
где X означает любую аминокислоту, J означает одну аминокислоту, выбранную из I, V, и L, O означает одну аминокислоту, выбранную из G, S, T, C и A, X7 означает одну аминокислоту, выбранную из K, R и H, U означает одну аминокислоту, выбранную из H, W, Y и F и X5 означает одну аминокислоту, выбранную из D и E, как показано в SEQ ID NO: 93.
Более желательно типы растительных белков 3Rmyb включают белки, в которых указанная последовательность из 150 аминокислот является последовательностью следующей формулы:
WTXEEDXXLXX[A,V]VXX[F,Y]XG[K,R][N,S,R]WK[K,R,N]IAXXXXXR[S,T][D,E][V,L]QCLHRWQKVL[N,D,H]P[D,E,N]L[V,I]KG[P,S,A]W[S,T]XEED[D,E,N]X[I,L]X[E,D,Q][L,M][V,I]X[K,R][Y,N,L]G[P,A,C]XKWSX[I,V][A,S]XX[L,M][P,A]GRIGKQCRERW[H,Y]NHL[D,N]PXI[K,N,R][K,R][D,E,N][A,P]WTX[E,Q]E[E,D]XXL[I,M,C]X[A,S,Y]H[Q,R]X[N,Y,H]GN[K,R]WAE[I,L]X[K,R]XL[P,H]G[R,K][S,T]DN[S,A,G]IKN[H,L]W[H,N]S[S,T][L,V,M]KK[K,R]
где Х является любой аминокислотой, и [] означает одну конкретную аминокислоту, выбранную из аминокислот, перечисленных в квадратных скобках, например, в [K,R] это означает K или R.
Кроме того, более желательным растительным белком 3Rmyb является белок, представленный аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 32, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78. Еще более желательный растительный белок 3Rmyb включает белок, представленный аминокислотной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 32, SEQ ID NO: 51, SEQ ID NO: 53 и SEQ ID NO: 55.
Таким образом, в объем настоящего изобретения также входит следующее:
(1) Трансформированная клетка, содержащая или несущая ДНК, выбранную из следующих ДНК (a)-(f):
(a) ДНК, выбранная из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 50, SEQ ID NO: 52 и SEQ ID NO: 54,
(b) ДНК, кодирующая антисмысловую РНК, которая комплементарна транскрипту ДНК, выбранной из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 50, SEQ ID NO: 52 и SEQ ID NO: 54,
(c) ДНК, кодирующая рибозимную каталитическую РНК, которая специфично расщепляет транскрипт ДНК, выбранной из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54,
(d) ДНК, не только кодирующая РНК, которая супрессирует экспрессию ДНК, выбранной из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, посредством механизмов косупрессии при экспрессии в растительной клетке, но также являющаяся на 90% или более гомологичной ДНК, выбранной из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54,
(e) ДНК, не только кодирующая РНК, которая супрессирует экспрессию ДНК, выбранной из группы, состоящей из SEQ ID NO:31, SEQ ID NO:50, SEQ ID NO:52 и SEQ ID NO: 54 посредством механизмов интерференции РНК при экспрессии в растительной клетке, но также являющаяся идентичной на протяжении 20 или более следующих друг за другом нуклеотидов ДНК, выбранной из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54,
(f) ДНК, кодирующая доминантный негативный белок против белка, кодируемого эндогенной ДНК, выбранной из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 50, SEQ ID NO: 52 и SEQ ID NO: 54,
или рекомбинантную конструкцию ДНК или вектор, которые указаны в следующем пункте (g):
(g) рекомбинантная конструкция ДНК или вектор, выбранные из группы, состоящей из:
(i) промотора, способного к транскрипции в растительной клетке,
(ii) ДНК, в которой ДНК по любому из указанных выше по пп.(a)-(f) связана с указанной последовательностью промотора в смысловом или антисмысловом направлении, и
(iii) сигнала терминации транскрипции и полиаденилирования молекулы РНК.
(2) Трансформированная растительная клетка, содержащая или несущая ДНК, выбранную из ДНК по пп.(1) (a)-(f), или рекомбинантную конструкцию ДНК или вектор по п.(1)(g).
(3) Трансформированная растительная клетка по п.(2), которую используют для модифицирования ее клеточного роста.
(4) Трансформированная растительная клетка по п.(2), в которой клеточный рост модифицирован или изменен.
(5) Трансгенное растение, содержащее или несущее трансформированную растительную клетку по любому из пп.(2)-(4).
(6) Трансгенное растение, которое является потомством, потомком или клоном трансгенного растения по п.(5).
(7) Трансгенное растение по п.(5) или (6), в котором рост растительной клетки модифицирован или изменен.
(8) Трансгенное растение по п.(5) или (6), которое используют для модифицирования развития и дифференцировки особей растений.
(9) Трансгенное растение по п.(5) или (6), в котором развитие и/или дифференцировка особей растений модифицирована или изменена.
(10) Пищевая и/или кормовая композиция, которая произведена или получена из растительной клетки по любому из пп.(2)-(4) или растения по любому из пп.(5)-(8).
(11) Химический продукт, который произведен или получен из растительной клетки по п.(2)-(4) или растения по любому из пп.(5)-(8).
(12) Белок, который выделен или получен из растительной клетки по п.(2)-(4) или растения по любому из пп.(5)-(8).
(13) Нуклеиновая кислота, которая выделена или получена из растительной клетки по п.(2)-(4) или растения по любому из пп.(5)-(8).
Кроме того, в настоящем изобретении предлагается следующее:
(14) ДНК, выбранная из группы, состоящей из следующих ДНК по п.(a)-(e):
(a) ДНК, кодирующая белок с аминокислотной последовательностью SEQ ID NO: 32,
(b) ДНК с нуклеотидной последовательностью SEQ ID NO: 31,
(c) ДНК, кодирующая белок с последовательностью, имеющей аминокислотную замену, делецию (или нарушение) или добавление (или инсерцию) одной или множества аминокислот в аминокислотной последовательности SEQ ID NO: 32, при этом указанный белок является функционально эквивалентным аминокислотной последовательности SEQ ID NO: 32,
(d) ДНК, не только гибридизующаяся с ДНК, имеющей нуклеотидную последовательность SEQ ID NO: 31, в жестких условиях, но также кодирующая белок, функционально эквивалентный аминокислотной последовательности SEQ ID NO: 32, и
(e) ДНК, кодирующая белок, имеющий аминокислотную последовательность со счетом при выравнивании 60 или более по сравнению с аминокислотной последовательностью SEQ ID NO: 32, при этом указанный белок является функционально эквивалентным белку с аминокислотной последовательностью SEQ ID NO: 32.
(15) ДНК, кодирующая антисмысловую РНК, которая комплементарна транскрипту ДНК, выбранной из ДНК по п.(14) (a)-(e).
(16) ДНК, кодирующая рибозимную каталитическую РНК, которая специфично расщепляет транскрипт ДНК, выбранной из ДНК по п.(14) (a)-(e),
(17) ДНК, не только кодирующая РНК, которая супрессирует экспрессию ДНК, выбранной из ДНК по п.(14) (a)-(e), посредством механизмов косупрессии при экспрессии в растительной клетке, но также являющаяся на 90% или более гомологичной ДНК, выбранной из ДНК по п.(14) (a)-(e).
(18) ДНК (i) кодирующая РНК, которая супрессирует экспрессию ДНК, выбранной из ДНК по п.(14) (a)-(e), посредством механизмов интерференции РНК при экспрессии в растительной клетке, и (ii) являющаяся идентичной на протяжении 20 или более следующих друг за другом нуклеотидов ДНК, выбранной из ДНК по п.(14) (a)-(e).
(19) ДНК, кодирующая доминантный негативный белок против белка, кодируемого эндогенной ДНК растительной клетки, выбранной из ДНК по п.(14) (a)-(e).
(20) ДНК по любому из пп.(14)-(19), которую используют для того, чтобы модифицировать клеточный рост и/или развитие/дифференцировку растений.
(21) Рекомбинантная конструкция ДНК или вектор, содержащий элемент, выбранный из следующих элементов (i)-(iii):
(i) промотора, способного к транскрипции в растительной клетке,
(ii) ДНК, в которой ДНК, выбранная из ДНК по п.(14)-(19), связана с указанной последовательностью промотора в смысловом или антисмысловом направлении, и
(iii) сигнала терминации транскрипции и полиаденилирования молекулы РНК.
(22) Трансформированная клетка, которая несет ДНК, выбранную из ДНК по пп.(14)-(19), или рекомбинантную конструкцию ДНК или вектор, который указан в (21).
(23) Пептид, кодируемый ДНК, которая указана в п.(14), или его пептид; или доминантный негативный белок, направленный к белку, кодируемому эндогенной ДНК растительной клетки, выбранной из ДНК по п.(14) (a)-(e), или его пептиду.
(24) Способ получения белка по п.(23), который включает в себя стадии
культивирования трансформированной клетки, несущей ДНК по п.(14) или вектор, несущий указанную ДНК, и
извлечения полученного в результате экспрессированного белкового продукта из указанной трансформированной клетки или надосадков культуры указанных клеток.
(25) Трансформированная растительная клетка, которая несет ДНК по любому из пп.(14)-(19) или рекомбинантную конструкцию ДНК или вектор, который указан в п.(21).
(26) Трансформированная растительная клетка по п.(25), которую используют для модифицирования роста растительных клеток.
(27) Трансформированная растительная клетка по п.(25), в которой рост растительных клеток модифицирован.
(28) Трансгенное растение, содержащее или несущее трансформированную растительную клетку по любому из пп.(25)-(27).
(29) Трансгенное растение, которое является потомством. потомком или клоном трансгенного растения по п.(28).
(30) Трансгенное растение по п.(28) или (29), в котором рост растительной клетки модифицирован.
(31) Трансгенное растение по п.(28) или (29), которое используют для модифицирования развития и/или дифференцировки особей растений.
(32) Трансгенное растение по п.(28) или (29), в котором развитие и/или дифференцировка особей растений модифицированы.
(33) Пищевая и/или кормовая композиция, которая произведена или получена из растительной клетки по любому из пп.(25)-(27) или растения по любому из пп.(28)-(32).
(34) Химический продукт, который произведен или получен из растительной клетки по п.(25)-(27) или растения по любому из пп.(28)-(32).
(35) Белок, который выделен или получен из растительной клетки по п.(25)-(27) или растения по любому из пп.(28)-(32).
(36) Нуклеиновая кислота, которая выделена или получена из растительной клетки по п.(25)-(27) или растения по любому из пп.(28)-(32).
(37) Транскрипт ДНК, выбранной из ДНК по п.(14) (a)-(e).
(38) Способ количественного анализа транскрипта по п.(37).
(39) Способ осуществления относительного сравнения множества образцов в отношении количеств транскрипта по п.(37).
(40) Способ количественного анализа белка, кодируемого ДНК по п.(14).
(41) Способ осуществления относительного сравнения множества образцов в отношении количеств белка, кодируемого ДНК по п.(14).
Автор настоящего изобретения с соавторами обнаружил, что C-концевая область белка NtmybA2 является частью, ответственной за негативную регуляцию свойств активатора транскрипции, и имеется домен активатора транскрипции, расположенный в середине белка NtmybA2. На основании указанных данных автор настоящего изобретения с соавторами успешно модифицировал функции белка NtmybA2, таким образом обеспечив возможность конструирования и получения мутантов NtmybA2, обладающих повышенной способностью активировать транскрипцию, других мутантов NtmybA2, обладающих пониженной способностью активировать транскрипцию. Таким образом, они достигли успеха в производстве мутантов NtmybA2, которые функционируют доминантно-негативно.
В настоящем изобретении также предлагается следующее:
(42) ДНК, кодирующая аминокислотную последовательность, принадлежащую молекуле, имеющей потерю функции, вызванную регуляторной областью NtmybA2, для регуляции способности активировать транскрипцию, связанной с белком NtmybA2 SEQ ID NO: 53.
(43) ДНК по п.(42), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 705-1042 SEQ ID NO: 53.
(44) ДНК по п.(42), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 631-1042 SEQ ID NO: 53.
(45) ДНК по п.(42), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 569-1042 SEQ ID NO: 53.
(46) ДНК по п.(42), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 413-1042 SEQ ID NO: 53.
(47) ДНК по п.(42), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 243-1042 SEQ ID NO: 53.
(48) ДНК по п.(42), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 188-1042 SEQ ID NO: 53.
(49) ДНК по любому из пп.(42)-(48), в которой регуляторная область потери функции получена заменой, делецией (или нарушением) и/или добавлением (или инсерцией) одной или нескольких аминокислот в последовательности.
(50) ДНК по любому из пп.(42)-(48), в которой регуляторная область потери функции получена делецией (или нарушением) одной или нескольких аминокислот в последовательности.
(51) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-704 SEQ ID NO: 53, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA2, который показан в SEQ ID NO: 53, модифицирована (или изменена).
(52) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-603 SEQ ID NO: 53, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA2, который показан в SEQ ID NO: 53, модифицирована (или изменена).
(53) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-568 SEQ ID NO: 53, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA2, который показан в SEQ ID NO: 53, модифицирована (или изменена).
(54) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-412 SEQ ID NO: 53, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA2, который показан в SEQ ID NO: 53, модифицирована (или изменена).
(55) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-242 SEQ ID NO: 53, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA2, который показан в SEQ ID NO: 53, модифицирована (или изменена).
(56) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-187 SEQ ID NO: 53, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA2, который показан в SEQ ID NO: 53, модифицирована (или изменена).
(57) ДНК, кодирующая аминокислотную последовательность, принадлежащую молекуле, имеющей потерю функции, вызванную регуляторной областью NtmybA1 для регуляции способности активировать транскрипцию, связанной с белком NtmybA2 SEQ ID NO: 51.
(58) ДНК по п.(57), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 715-1003 SEQ ID NO: 51.
(59) ДНК по п.(57), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 641-1003 SEQ ID NO: 51.
(60) ДНК по п.(57), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 579-1003 SEQ ID NO: 51.
(61) ДНК по п.(57), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 459-1003 SEQ ID NO: 51.
(62) ДНК по п.(57), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 299-1003 SEQ ID NO: 51.
(63) ДНК по п.(57), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 186-1003 SEQ ID NO: 51.
(64) ДНК по любому из пп.(57)-(63), в которой регуляторная область потери функции получена заменой, делецией (или нарушением) и/или добавлением (или инсерцией) одной или нескольких аминокислот в последовательности.
(65) ДНК по любому из пп.(57)-(63), в которой регуляторная область потери функции получена делецией (или нарушением) одной или нескольких аминокислот в последовательности.
(66) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-714 SEQ ID NO: 51, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA1, который показан в SEQ ID NO: 51, модифицирована (или изменена).
(67) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-640 SEQ ID NO: 51, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA1, который показан в SEQ ID NO: 51, модифицирована (или изменена).
(68) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-578 SEQ ID NO: 51, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA1, который показан в SEQ ID NO: 51, модифицирована (или изменена).
(69) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-458 SEQ ID NO: 51, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA1, который показан в SEQ ID NO: 51, модифицирована (или изменена).
(70) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-298 SEQ ID NO: 51, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA1, который показан в SEQ ID NO: 51, модифицирована (или изменена).
(71) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-185 SEQ ID NO: 51, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка NtmybA1, который показан в SEQ ID NO: 51, модифицирована (или изменена).
(72) ДНК, кодирующая аминокислотную последовательность, принадлежащую молекуле, имеющей потерю функции, вызванную регуляторной областью Os3RmybA1, для регуляции способности активировать транскрипцию, связанной с белком Os3RmybA1 SEQ ID NO: 32.
(73) ДНК по п.(72), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 709-993 SEQ ID NO: 32.
(74) ДНК по п.(72), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 635-993 SEQ ID NO: 32.
(75) ДНК по п.(72), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 575-993 SEQ ID NO: 32.
(76) ДНК по п.(72), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 426-993 SEQ ID NO: 32.
(77) ДНК по п.(72), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 257-993 SEQ ID NO: 32.
(78) ДНК по п.(72), которая кодирует аминокислотную последовательность молекулы с регуляторной областью потери функции, которая представляет собой часть аминокислот с остатками аминокислот в положениях 203-993 SEQ ID NO: 32.
(79) ДНК по любому из пп.(72)-(78), в которой регуляторная область потери функции получена заменой, делецией (или нарушением) и/или добавлением (или инсерцией) одной или нескольких аминокислот в последовательности.
(80) ДНК по любому из пп.(72)-(78), в которой регуляторная область потери функции получена делецией (или нарушением) одной или нескольких аминокислот в последовательности.
(81) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-708 SEQ ID NO: 32, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка Os3RmybA1, который показан в SEQ ID NO: 32, модифицирована (или изменена).
(82) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-634 SEQ ID NO: 32, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка Os3RmybA1, который показан в SEQ ID NO: 32, модифицирована (или изменена).
(83) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-574 SEQ ID NO: 32, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка Os3RmybA1, который показан в SEQ ID NO: 32, модифицирована (или изменена).
(84) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-425 SEQ ID NO: 32, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка Os3RmybA1, который показан в SEQ ID NO: 32, модифицирована (или изменена).
(85) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-256 SEQ ID NO: 32, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка Os3RmybA1, который показан в SEQ ID NO: 32, модифицирована (или изменена).
(86) ДНК, кодирующая аминокислотную последовательность из остатков аминокислот в положениях 1-202 SEQ ID NO: 32, при этом указанная аминокислотная последовательность служит в качестве молекулы, в которой функция белка Os3RmybA1, который показан в SEQ ID NO: 32, модифицирована (или изменена).
(87) Рекомбинантная ДНК (или рекомбинантная конструкция ДНК) или вектор, выбранные из группы, состоящей из следующих элементов (i)-(iii):
(i) промотора, способного к транскрипции в растительной клетке,
(ii) ДНК, в которой ДНК по любому из по пп.(42)-(86) связана с указанной последовательностью промотора в смысловом или антисмысловом направлении, и
(iii) сигнала терминации транскрипции и полиаденилирования молекулы РНК.
(88) Трансформированная растительная клетка, которая несет ДНК по любому из пп.(42)-(86) или рекомбинантную конструкцию ДНК или вектор, которые указаны в п.(87).
(89) Трансформированная растительная клетка по п.(88), которую используют для модифицирования роста растительных клеток.
(90) Трансформированная растительная клетка по п.(88), в которой рост растительной клетки модифицирован.
(91) Трансгенное растение, содержащее или несущее трансформированную растительную клетку по любому из пп.(88)-(90).
(92) Трансгенное растение, которое является потомством, потомком или клоном трансгенного растения по п.(91).
(93) Трансгенное растение по п.(91) или (92), в котором рост растительной клетки модифицирован.
(94) Трансгенное растение по п.(91) или (92), которое используют для модифицирования развития и дифференцировки особей растений.
(95) Трансгенное растение по п.(91) или (92), в котором этом развитие и/или дифференцировка особей растений модифицирована.
(96) Пищевая и/или кормовая композиция, которая произведена или получена из растительной клетки по любому из пп.(88)-(90) или растения по любому из пп.(91)-(95).
(97) Химический продукт, который произведен или получен из растительной клетки по п.(88)-(90) или растения по любому из пп.(91)-(95).
(98) Белок, который выделен или получен из растительной клетки по п.(88)-(90) или растения по любому из пп.(91)-(95).
(99) Нуклеиновая кислота, которая выделена или получена из растительной клетки по п.(88)-(90) или растения по любому из пп.(91)-(95).
Кроме того, в объем настоящего изобретения также входит следующее:
(100) Трансформированная клетка, которая несет ДНК, выбранную из ДНК согласно следующим пп.(a)-(f), или рекомбинантную конструкцию ДНК или вектор, которые указаны в следующем п.(g):
(a) ДНК, кодирующая растительный белок 3Rmyb,
(b) ДНК, кодирующая антисмысловую РНК, которая комплементарна транскрипту ДНК, кодирующей растительный белок 3Rmyb,
(c) ДНК, кодирующая рибозимную каталитическую РНК, которая специфично расщепляет транскрипт ДНК, кодирующей растительный белок 3Rmyb,
(d) ДНК, не только кодирующая РНК, которая супрессирует экспрессию ДНК, кодирующей растительный белок 3Rmyb посредством механизмов косупрессии при экспрессии в растительной клетке, но также являющаяся по меньшей мере на 90% гомологичной ДНК, кодирующей белок 3Rmyb;
(e) ДНК, не только кодирующая РНК, которая супрессирует экспрессию ДНК, кодирующей растительный белок 3Rmyb, посредством механизмов интерференции РНК при экспрессии в растительной клетке, но также являющаяся идентичной на протяжении 20 или более следующих друг за другом нуклеотидов указанной ДНК, кодирующей растительный белок 3Rmyb;
(f) ДНК, кодирующая доминантный негативный белок против белка, кодируемого эндогенной ДНК растительной клетки, кодирующей растительный белок 3Rmyb;
(g) рекомбинантная ДНК (или рекомбинантная конструкция ДНК) или вектор, выбранный из группы, состоящей из следующих элементов (i)-(iii):
(i) промотора, способного к транскрипции в растительной клетке,
(ii) ДНК, в которой ДНК по любому из пп.(a)-(f) связана с указанной последовательностью промотора в смысловом или антисмысловом направлении, и
(iii) сигнала терминации транскрипции и полиаденилирования молекулы РНК.
(101) Трансформированная растительная клетка, которая несет ДНК по любому из пп.(100) (a)-(f) или рекомбинантную конструкцию ДНК или вектор, которые указаны в п.(100)(g).
(102) Трансформированная растительная клетка по п.(101), которую используют для модифицирования роста растительных клеток.
(103) Трансформированная растительная клетка по п.(101), в которой рост растительной клетки модифицирован.
(104) Трансгенное растение, содержащее или несущее трансформированную растительную клетку по любому из пп.(101)-(103).
(105) Трансгенное растение, которое является потомством, потомком или клоном трансгенного растения по п.(104).
(106) Трансгенное растение по п.(104) или (105), в котором рост растительной клетки модифицирован.
(107) Трансгенное растение по п.(104) или (105), которое используют для модифицирования развития и дифференцировки особей растений.
(108) Трансгенное растение по п.(104) или (105), в котором развитие и/или дифференцировка особей растений модифицирована.
(109) Пищевая и/или кормовая композиция, которая произведена или получена из растительной клетки по любому из пп.(101)-(103) или растения по любому из пп.(104)-(108).
(110) Химический продукт, который произведен или получен из растительной клетки по п.(101)-(103) или растения по любому из пп.(104)-(108).
(111) Белок, который выделен или получен из растительной клетки по п.(101)-(103) или растения по любому из пп.(104)-(108).
(112) Нуклеиновая кислота, которая выделена или получена из растительной клетки по п.(101)-(103) или растения по любому из пп.(104)-(108).
В объем настоящего изобретения также входят растительные белки 3Rmyb с повышенной способностью активировать транскрипцию (или растительные белки 3Rmyb с повышенной функцией). Варианты таких белков перечислены в данном описании ниже. Также в объем настоящего изобретения входят ДНК, кодирующие растительные белки 3Rmyb с повышенной функцией.
(113) Растительный белок 3Rmyb с потерей функции, в котором регуляторная область для регуляции способности активировать транскрипцию утратила свою функцию.
(114) Растительный белок 3Rmyb с потерей функции по п.(113), в котором область потери функции находится в пределах 600 аминокислотных остатков от C-конца.
(115) Растительный белок 3Rmyb с потерей функции по п.(113), в котором область потери функции находится в пределах 500 аминокислотных остатков от C-конца.
(116) Растительный белок 3Rmyb с потерей функции по п.(113), в котором область потери функции находится в пределах 420 аминокислотных остатков от C-конца.
(117) Растительный белок 3Rmyb с потерей функции по п.(113), в котором область потери функции находится в пределах 350 аминокислотных остатков от C-конца.
(118) Растительный белок 3Rmyb с потерей функции по п.(113), в котором область потери функции находится в пределах 280 аминокислотных остатков от C-конца.
Желательно перечисленные белки являются следующими белками:
(119) Растительный белок 3Rmyb с потерей функции по п.(113), в котором потеря функции обусловлена делецией или нарушением одной или нескольких аминокислот в последовательности.
(120) Растительный белок 3Rmyb по п.(113), в котором делеция аминокислот имеет место в пределах 280-600 аминокислот от C-конца в последовательности.
(121) Растительный белок 3Rmyb по п.(113), в котором делеция аминокислот имеет место в пределах 280-500 аминокислот от C-конца в последовательности.
Более желательно:
(122) Растительный белок 3Rmyb по п.(113), в котором делеция аминокислот имеет место в пределах 350-420 аминокислот от C-конца в последовательности.
(123) Белок по любому из пп.(113)-(122), в котором растительный белок 3Rmyb представляет собой аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 32, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 75 и SEQ ID NO: 76.
(124) Белок по любому из пп.(113)-(122), в котором растительный белок 3Rmyb представляет собой аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 32, SEQ ID NO: 51 и SEQ ID NO: 53.
ПРЕИМУЩЕСТВА ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к растительным клеткам, обладающим модифицированным клеточным ростом (или модифицированной пролиферацией клеток). Указанные растительные клетки позволяют получать растения, имеющие модифицированное развитие/дифференцировку. Таким образом, предлагаются новые способы создания растений, обладающих требуемыми свойствами, такими как специфичное разрастание органа, мужская стерильность и повышенная резистентность к стрессу.
Указанные выше цели и другие цели, характерные признаки, преимущества и аспекты настоящего изобретения будут легко понятны специалистам в данной области на основании следующего описания. Однако следует понимать, что подробное описание, включая следующие наилучшие способы осуществления изобретения, примеры и т.д., является иллюстрацией предпочтительных вариантов осуществления настоящего изобретения и приведено только для его объяснения. Специалистам в данной области будет понятно, что может быть осуществлено большое количество вариаций и/или изменений (или модификаций) данного изобретения на основании сведений, представленных в описании в следующих разделах и других разделах спецификации, не отходя от сути и не выходя за рамки объема изобретения, указанного в данном описании. Все патентные публикации и справочные документы, цитированные в данном описании в целях иллюстрации, таким образом, включены в настоящее описание в виде ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей в случае, когда предполагаемая аминокислотная последовательность белка риса, зарегистрированная с No. доступа: BAB78687 в DDBJ (банк данных о ДНК Японии), и аминокислотная последовательность белка Os3RmybA1 оптимально выровнены. Продолжение на фиг.2 и 3.
На фиг.2 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей в случае, когда предполагаемая аминокислотная последовательность белка риса, зарегистрированная с No. доступа: BAB78687 в DDBJ, и аминокислотная последовательность белка Os3RmybA1 оптимально выровнены. Начало на фиг.1 и продолжение на фиг.3.
На фиг.3 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей в случае, когда предполагаемая аминокислотная последовательность белка риса, зарегистрированная с No. доступа: BAB78687 в DDBJ, и аминокислотная последовательность белка Os3RmybA1 оптимально выровнены. Начало на фиг.1 и 2.
Фиг.4 является диаграммой, показывающей степени увеличения удельной активности LUC, когда способности Os3RmybA1 и NtmybA2 активировать транскрипцию слитого гена промотор CYM-LUC исследовали с использованием экспрессирующих плазмид для Os3RmybA1 и NtmybA2 в комбинации с репортерной плазмидой промотор CYM-LUC. Все активности LUC выражены относительно контроля (принятого за 1,0). Данные представляют собой среднее из пяти экспериментов. Отрезки ошибок указывают S.D.
Фиг.5 является диаграммой, показывающей степени увеличения удельной активности LUC, когда исследовали способности укороченных на C-конце вариантов NtmybA2 и мутанта NtmybA2 активировать транскрипцию слитого гена промотор NACK1-LUC, используя различные экспрессирующие плазмиды для укороченных на C-конце мутантных вариантов NtmybA2 и NtmybA2 в комбинации с репортерной плазмидой промотор NACK1-LUC. Все активности LUC выражены относительно контроля (принятого за 1,0). Данные представляют собой среднее из пяти экспериментов. Отрезки ошибок указывают S.D.
Фиг.6 является диаграммой, показывающей степени увеличения удельной активности LUC, когда исследовали способности экспрессируемых совместно (NtmybA2+NtmybA2T5) или (NtmybB+NtmybA2T5) активировать транскрипцию слитого гена промотор CYM-LUC, используя репортерную плазмиду промотор CYM-LUC. Все активности LUC выражены относительно контроля (принятого за 1,0). Данные представляют собой среднее из пяти экспериментов. Отрезки ошибок указывают S.D.
Фиг.7 представляет собой набор фотографий, демонстрирующих размер каллусов BY2, трансформированных pPZP211-35S:A2RNAi, в которых уровни эндогенно экспрессированного NtmybA2 снижались посредством механизмов интерференции РНК, и каллусов BY2, трансформированных pPZP211. Вектор: каллусы BY2, трансформированные pPZP211; и A2 RNAi: каллусы, трансформированные pPZP211-35S:A2RNAi.
На фиг.8 показаны результаты анализа содержания ядерной ДНК для каллусов BY2, трансформированных pPZP211-35S:A2RNAi, в которых уровни эндогенно экспрессированного NtmybA2 снижались посредством механизмов интерференции РНК, и каллусов BY2, трансформированных pPZP211. Вектор и векторный контроль: каллусы BY2, трансформированные pPZP211; и A2 RNAi: каллусы, трансформированные pPZP211-35S:A2RNAi.
Фиг.9 представляет собой набор фотографий, демонстрирующих размер каллусов BY2, трансформированных pPZP211-35S:BRNAi, в которых уровни эндогенно экспрессированного NtmybB снижались посредством механизмов интерференции РНК, и каллусов BY2, трансформированных pPZP211. Вектор и векторный контроль: каллусы BY2, трансформированные pPZP211; и B RNAi: каллусы, трансформированные pPZP211-35S:BRNAi.
На фиг.10 показаны результаты анализа содержания ядерной ДНК для каллусов BY2, трансформированных pPZP211 и pPZP211-35S:BRNAi, в которых уровни эндогенно экспрессированного NtmybB снижались посредством механизмов интерференции РНК, и каллусов BY2, трансформированных pPZP211. Вектор и векторный контроль: каллусы BY2, трансформированные pPZP211; и B RNAi: каллусы, трансформированные pPZP211-35S:BRNAi.
Фиг.11 представляет собой набор фотографий, демонстрирующих размер каллусов BY2, трансформированных pPZP211-35S:A2, в которых NtmybA2 стабильно экспрессировался, каллусов BY2, трансформированных pPZP211-35S:A2T2, в которых NtmybA2T2 стабильно экспрессировался, и каллусов BY2, трансформированных pPZP211. Вектор: каллусы, трансформированные pPZP211; 35S:A2: каллусы, трансформированные pPZP211-35S:A2; и 35S:A2T2: каллусы, трансформированные pPZP211-35S:A2T2.
На фиг.12 показано количество клеток в случае клеток, составляющих каллусы BY2, трансформированные pPZP211-35S:A2, в которых NtmybA2 стабильно экспрессировался, каллусы BY2, трансформированные pPZP211-35S:A2T2, в которых NtmybA2T2 стабильно экспрессировался, и каллусы BY2, трансформированные pPZP211. Вектор: каллусы, трансформированные pPZP211; 35S:A2: каллусы, трансформированные pPZP211-35S:A2; и 35S:A2T2: каллусы, трансформированные pPZP211-35S:A2T2.
На фиг.13 показаны результаты анализа уровня ядерной ДНК для каллусов BY2, трансформированных pPZP211-35S:A2, в которых NtmybA2 стабильно экспрессировался, каллусов BY2, трансформированные pPZP211-35S:A2T2, в которых NtmybA2T2 стабильно экспрессировался, и каллусов BY2, трансформированные pPZP211. Контроль: каллусы, трансформированные pPZP211; 35S:A2: каллусы, трансформированные pPZP211-35S:A2; и 35S:A2T2: каллусы, трансформированные pPZP211-35S:A2T2.
Фиг.14 представляет собой набор фотографий, демонстрирующих рост табака, трансформированного pPZP211-35S:B, в котором NtmybB стабильно экспрессировался, табака, трансформированного pPZP211-35S:B.RNAi, в котором экспрессия эндогенного NtmybB была супрессирована механизмами РНКi, и табака, трансформированного pPZP211. Вектор: каллусы, трансформированные pPZP211; 35S:B: каллусы, трансформированные pPZP211-35S:B; и B RNAi: каллусы, трансформированные pPZP211-35S:B.RNAi.
На фиг.15 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2 и Os3RmybA1 оптимально выровнены.
На фиг.15-17 стрелки указывают области для соответствующих мутантных конструкций NtmybA2 с C-концевой делецией и соответствующие аминокислотные области, относящиеся к NtmybA1 и Os3RmybA1. На чертежах «*» означает, что аминокислотные остатки в данной колонке идентичны во всех последовательностях при выравнивании (полностью консервативный аминокислотный сайт), «:» означает, что наблюдались консервативные замены (высоко консервативный аминокислотный сайт), и «.» означает, что наблюдаются полуконсервативные замены (умеренно консервативный аминокислотный сайт) в связи с итоговыми результатами относительно сходства аминокислот, полученными на основе анализа множественного выравнивания последовательностей с помощью программы ClustalW. Продолжение на фиг.16-18.
На фиг.16 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2 и Os3RmybA1 оптимально выровнены. Начало на фиг.15. продолжение на фиг 17 и 18.
На фиг.17 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2 и Os3RmybA1 оптимально выровнены. На чертежах участки последовательностей, заключенные в прямоугольник, указывают положения консенсусных аминокислот при сравнении с NtmybA1 и Os3RmybA1, обнаруживаемых в области делеции или вблизи области делеции NtmybA2. Аминокислотные последовательности, показанные в прямоугольниках, означают консервативные последовательности, где X означает любую аминокислоту. Начало на фиг.15 и 16, продолжение на фиг.18.
На фиг.18 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2 и Os3RmybA1 оптимально выровнены. Продолжение, начало на фиг.15-17.
На фиг.19 показаны результаты на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R1 (на фиг.19-25 обозначен «AtMYB3R-1») и AtMYB3R4 (на фиг.19-25 обозначен «AtMYB3R-4») оптимально выровнены. На чертежах «*» означает, что аминокислотные остатки в данной колонке идентичны во всех последовательностях при выравнивании (полностью консервативный аминокислотный сайт), «:» означает, что наблюдались консервативные замены (высоко консервативный аминокислотный сайт), и «.» означает, что наблюдаются полуконсервативные замены (умеренно консервативный аминокислотный сайт) в связи с итоговыми результатами относительно сходства аминокислот, полученными на основе анализа множественного выравнивания последовательностей с помощью программы ClustalW. Продолжение на фиг.20-25.
На фиг.20 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R-1 и AtMYB3R-4 оптимально выровнены. Начало на фиг.19, продолжение на фиг.21-25.
На фиг.21 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R-1 и AtMYB3R-4 оптимально выровнены. Начало на фиг.19 и 20, продолжение на фиг.22-25.
На фиг.22 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R-1 и AtMYB3R-4 оптимально выровнены. Начало на фиг.19-21, продолжение на фиг.23-25.
На фиг.23 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R-1 и AtMYB3R-4 оптимально выровнены. На чертеже черная горизонтальная полоса указывает особую область последовательности, в которой аминокислоты являются высоко консервативными, за исключением ДНК-связывающего домена myb. Консенсусная последовательность, обнаруженная в области, обозначенной черной горизонтальной полосой, записана жирными буквами, где X означает любую аминокислоту; J означает аминокислоту, выбранную из I, V и L; O означает аминокислоту, выбранную из S и T; X1 означает аминокислоту, выбранную из K и R; U означает аминокислоту, выбранную из V и L; и X5 означает аминокислоту, выбранную из D и E. Начало на фиг.19-22, продолжение на фиг.24 и 25.
На фиг.24 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R-1 и AtMYB3R-4 оптимально выровнены. Начало на фиг.19-23, продолжение на фиг.25.
На фиг.25 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R-1 и AtMYB3R-4 оптимально выровнены. Продолжение, начало на фиг.19-24.
На фиг.26 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybB, AtMYB3R3 (на фиг.26-28 обозначен «AtMYB3R-3») и AtMYB3R5 (на фиг.26-28 обозначен «AtMYB3R-5») оптимально выровнены. На чертежах «*» означает, что аминокислотные остатки в данной колонке идентичны во всех последовательностях при выравнивании (полностью консервативный аминокислотный сайт), «:» означает, что наблюдались консервативные замены (высоко консервативный аминокислотный сайт), и «.» означает, что наблюдаются полуконсервативные замены (умеренно консервативный аминокислотный сайт) в связи с итоговыми результатами относительно сходства аминокислот, полученными на основе анализа множественного выравнивания последовательностей с помощью программы ClustalW program. На чертеже черная горизонтальная полоса указывает особую область последовательности, в которой аминокислоты являются высоко консервативными, за исключением ДНК-связывающего домена myb. Консенсусная последовательность, обнаруженная в области, обозначенной черной горизонтальной полосой, записана жирными буквами, где X означает любую аминокислоту; и X6 означает аминокислоту, выбранную из K, R, D, E и H. Продолжение на фиг.27 и 28.
На фиг.27 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybB, AtMYB3R-3 и AtMYB3R-5 оптимально выровнены. Начало на фиг.26, продолжение на фиг.28.
На фиг.28 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда аминокислотные последовательности белков NtmybB, AtMYB3R-3 и AtMYB3R-5 оптимально выровнены. Продолжение, начало на фиг.26 и 27.
На фиг.29 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда составляющие аминокислотные последовательности соответствующих myb-подобных ДНК-связывающих доменов с 3 повторами оптимально выровнены между белками MYB3R-1 (выделен из Physcomitrella patens; на фиг.29-31 обозначен «PhpMYB3R-1»), MYB3R-1 (выделен из Adiantum raddianum; на фиг.29-31, обозначен «AdrMYB3R-1»), MYB3R-1 (выделен из Hordeum vulgare; на фиг.29-31 обозначен «HvMYB3R-1»), MYB3R-1 (выделен из Secale cereale; на фиг.29-31 обозначен «ScMYB3R-1»), предполагаемым Myb-родственным доменом (выделен из Papaver rhoeas; на фиг.29-31 обозначен «ParMYB3R-1»), AtMYB3R1 (на фиг.29-31 обозначен «AtMYB3R-1»), AtMYB3R3 (на фиг.29-31 обозначен «AtMYB3R-3»), AtMYB3R4 (на фиг.29-31 обозначен «AtMYB3R-4»), AtMYB3R5 (на фиг.29-31 обозначен «AtMYB3R-5»), NtmybA1, NtmybA2, NtmybB и Os3RmybA1. Консервативные среди 13 аминокислотных последовательностей аминокислотые сайты изображены на чертежах в консенсусной последовательности, где X означает любую аминокислоту; J означает аминокислоту, выбранную из I, V и L; O означает аминокислоту, выбранную из G, S, T, C и A; X7 означает аминокислоту, выбранную из K, R и H; U означает аминокислоту, выбранную из H, W, Y и F; и X5 означает аминокислоту, выбранную из D и E. На чертежах черные горизонтальные полосы указывают консенсусные участки, обнаруженные в ДНК-связывающих доменах myb с 3 повторами c-myb, которые обозначены «MYB#1 (указатель повтора ДНК-связывающего домена Myb 1.)» на основании результатов поиска, полученных с помощью программы MOTIF (http://motif.genome.ad.jp/). Стрелки между черными горизонтальными полосами означают количество аминокислот, существующих между указанными выше консенсусными последовательностями. Продолжение на фиг.30 и 31.
На фиг.30 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда составляющие аминокислотные последовательности соответствующих myb-подобных ДНК-связывающих доменов с 3 повторами оптимально выровнены между белками PhpMYB3R-1, AdrMYB3R-1, HvMYB3R-1, ScMYB3R-1, ParMYB3R-1, AtMYB3R1, AtMYB3R3, AtMYB3R4, AtMYB3R5, NtmybA1, NtmybA2, NtmybB и Os3RmybA1. Начало на фиг.29, продолжение на фиг.31.
На фиг.31 показаны результаты сравнения на основе анализа множественного выравнивания аминокислотных последовательностей, когда составляющие аминокислотные последовательности соответствующих myb-подобных ДНК-связывающих доменов с 3 повторами оптимально выровнены между белками PhpMYB3R-1, AdrMYB3R-1, HvMYB3R-1, ScMYB3R-1, ParMYB3R-1, AtMYB3R1, AtMYB3R3, AtMYB3R4, AtMYB3R5, NtmybA1, NtmybA2, NtmybB и Os3RmybA1. Продолжение, начало на фиг.29 и 30.
На фиг.32 показаны результаты сравнения состояний роста и развития (высота побегов) культивируемых растений с перенесенным геном NtmybA2 (табак с высокой экспрессией NtmybA2) и нетрансфицированных геном NtmybA2 растений.
На фиг.33 показаны результаты сравнения состояний роста и развития (количество настоящих листьев) культивируемых растений с перенесенным геном NtmybA2 (табак с высокой экспрессией NtmybA2) и нетрансфицированных геном NtmybA2 растений.
НАИЛУЧШИЕ СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем изобретении применение «методики рекомбинации генов» делает возможным не только получение, выделение и секвенирование выбранных в качестве мишени нуклеиновых кислот, пептидов и их фрагментов, но также конструированием и продуцирование их рекомбинантов. Методика рекомбинации генов (включая методику рекомбинантной ДНК), которую можно использовать в данном изобретении, включает методики, известные в данной области, и может быть осуществлена способами, описанными, например, в J. Sambrook, E. F. Fritsch & T. Maniatis, "Molecular Cloning: A Laboratory Manual (2nd edition)", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (1989); D. M. Glover et al. ed., "DNA Cloning", 2nd ed., Vol. 1 to 4, (The Practical Approach Series), IRL Press, Oxford University Press (1995); The Japanese Biochemical Society (JBS) ed., "Zoku-Seikagaku Jikken Koza 1, Idenshi Kenkyu-Hou II", Tokyo Kagaku Dozin Co. Ltd., Japan, (1986); JBS ed., "Shin-Seikagaku Jikken Koza 2, Kakusan III (Recombinant DNA technique)", Tokyo Kagaku Dozin Co. Ltd., Japan, (1992); "Methods in Enzymology" series, Academic Press, New York, including, for example, R. Wu ed., "Methods in Enzymology", Vol. 68 (Recombinant DNA), Academic Press, New York (1980); R. Wu et al. ed., "Methods in Enzymology", Vol. 100 (Recombinant DNA, Part B) & 101 (Recombinant DNA, Part C), Academic Press, New York (1983); R. Wu et al. ed., "Methods in Enzymology", Vol. 153 (Recombinant DNA, Part D), 154 (Recombinant DNA, Part E) & 155 (Recombinant DNA, Part F), Academic Press, New York (1987); J. H. Miller ed., "Methods in Enzymology", Vol. 204, Academic Press, New York (1991); R. Wu ed., "Methods in Enzymology", Vol. 216 (Recombinant DNA, Part G), Academic Press, New York (1992); R. Wu ed., "Methods in Enzymology", Vol. 217 (Recombinant DNA, Part H) & 218 (Recombinant DNA, Part I), Academic Press, New York (1993); G. M. Attardi et al. ed., "Methods in Enzymology", Vol. 260 (Mitochondrial Biogenesis and Genetics, Part A), Academic Press, New York (1995); J. L. Campbell ed., "Methods in Enzymology", Vol. 262 (DNA Replication), Academic Press, New York (1995); G. M. Attardi et al. ed., "Methods in Enzymology", Vol. 264 (Mitochondrial Biogenesis and Genetics, Part B), Academic Press, New York (1996); P. M. Conn ed., "Methods in Enzymology", Vol. 302 (Green Fluorescent Protein), Academic Press, New York (1999); S. Weissman ed., "Methods in Enzymology", Vol. 303 (cDNA Preparation and Characterization), Academic Press, New York (1999); J. C. Glorioso et al. ed., "Methods in Enzymology", Vol. 306 (Expression of Recombinant Genes in Eukaryotic Systems), Academic Press, New York (1999); M. lan Phillips ed., "Methods in Enzymology", Vol. 313 (Antisense Technology, Part A: General Methods, Methods of Delivery and RNA Studies) & 314 (Antisense Technology, Part B: Applications), Academic Press, New York (1999); J. Thorner et al. ed., "Methods in Enzymology", Vol. 326 (Applications of Chimeric Genes and Hybrid Proteins, Part A: Gene Expression and Protein Purification), 327 (Applications of Chimeric Genes and Hybrid Proteins, Part B: Cell Biology and Physiology) & 328 (Applications of Chimeric Genes and Hybrid Proteins, Part C: Protein-Protein Interactions and Genomics), Academic Press, New York (2000) и т.д., или способами, описанными в ссылках, цитированных в указанных публикациях, или способами, по существу им эквивалентными, или модифицированными способами, описания которых включены в данное описание в виде ссылки.
Настоящее изобретение относится к растительным клеткам и растениям, содержащим указанную растительную клетку, которые имеют модифицированные активности растительных белков 3Rmyb. Модификация активностей растительных белков 3Rmyb согласно настоящему изобретению включает модификацию экспрессии растительного гена 3Rmyb и модификацию функций растительных белков 3Rmyb.
Вышеуказанная модификация экспрессии растительного гена 3Rmyb включает стабильную экспрессию, сверхэкспрессию, эктопическую экспрессию и индуцированную экспрессию указанных генов и включает супрессию указанной экспрессии. Предпочтительно модификация представляет собой стабильную экспрессию, сверхэкспрессию или супрессию указанной экспрессии.
Настоящее изобретение также относится к молекулам, способным к ингибированию или супрессии экспрессии (в частности включая экспрессию in vivo) растительного гена(нов) 3Rmyb в растениях. Термин «супрессия экспрессии» растительного гена(нов) 3Rmyb или растительного гена 3Rmyb или «супрессированная экспрессия» или «репрессированная экспрессия» растительного гена(нов) 3Rmyb включает супрессию транскрипции генов и супрессию трансляции белка, а также не только полностью молчание экспрессии ДНК, но также уменьшение экспрессии ДНК.
Способы с использованием методики на основе антисмысловых последовательностей больше всего применяются специалистами в данной области при супрессии специфичной эндогенной экспрессии генов в растениях. Антисмысловое действие в растительных клетках впервые было показано экспериментально Ecker et al. с использованием анализа временной экспрессии, при котором растения трансформировали антисмысловой РНК посредством электропорации, и антисмысловое действие, вызываемое указанной антисмысловой РНК, наблюдали в трансгенных растениях (J.R.Ecker и R.W.Davis, Proc. Natl. Acad. USA. 83: 5372 (1986)). Впоследствии сообщали о вариантах табака и петунии, в которых экспрессия антисмысловой РНК приводила к уменьшению экспрессии гена-мишени (A.R.van der Krol et al., Nature 333: 866 (1988)). Таким образом, в настоящее время разработаны способы для ингибирования или супрессии экспрессии генов в растениях.
Ингибирование или супрессия экспрессии генов, опосредованная антисмысловой нуклеиновой кислотой, включает множество следующих действий: а именно ингибирование инициации транскрипции, индуцированное образованием триплекса; супрессию транскрипции, индуцированную гибридизацией с сайтами, в которых РНК-полимераза локально создает структуру открытой петли; ингибирование транскрипции, индуцированное гибридизацией с РНК в ходе протекания ее синтеза; супрессию сплайсинга, индуцированную гибридизацией в месте соединения интрона-экзона; супрессию сплайсинга, индуцированную гибридизацией с сайтами, образующими сплайсеосому; супрессию переноса из ядер в цитоплазму, индуцированную гибридизацией с мРНК; супрессию сплайсинга, индуцированную гибридизацией с сайтами кэпирования и сайтами полиаденилирования; супрессию инициации трансляции, индуцированную гибридизацией с сайтами связывания инициатора трансляции; супрессию трансляции, индуцированную гибридизацией с сайтами связывания рибосом вблизи кодонов инициации; ингибирование элонгации пептидной цепи, индуцированное гибридизацией с областями трансляции мРНК или сайтами связывания полисом; и молчание генной экспрессии, индуцированное гибридизацией с сайтами взаимодействия нуклеиновая кислота-белок; и тому подобное. Указанные действия ингибируют процессы транскрипции, сплайсинга или трансляции, супрессируя экспрессию генов-мишеней.
Антисмысловые последовательности, которые используются в данном изобретении, могут супрессировать или ингибировать экспрессию генов-мишеней на основе любого из указанных выше действий или активностей. В варианте, когда конструируют антисмысловые последовательности, комплементарные нетранслируемой области (UTR) вблизи 5'-конца мРНК гена-мишени, указанные последовательности будут эффективными в ингибировании трансляции гена. Однако также применимы последовательности, комплементарные кодирующей области или нетранслируемой 3'-области (3'-UTR). Таким образом, ДНК, содержащая антисмысловую последовательность, по последовательности не ограниченная областями для трансляции, а включающая нетранслируемые области, также относится к антисмысловой ДНК, используемой в настоящем изобретении. Антисмысловая ДНК, которую используют в данном изобретении, лигируют с расположенным ниже сайтом подходящего промотора, предпочтительно с последующим лигированием с последовательностью, содержащей сигнал терминации транскрипции с 3'-стороны. Полученной таким образом ДНК можно трансфицировать или трансформировать требуемые растения известными способами. Предпочтительно, чтобы последовательность антисмысловой ДНК была комплементарна эндогенному гену, принадлежащему трансформируемому растению, или его части. Однако не обязательно, чтобы она была полностью комплементарной, при условии, что она может эффективно ингибировать экспрессию гена. РНК-транскрипт предпочтительно по меньшей мере на 90%, наиболее предпочтительно по меньшей мере на 95% комплементарен продукту транскрипции гена-мишени. Гомологию последовательностей можно определить с помощью вышеуказанного поиска.
Для эффективного ингибирования экспрессии гена-мишени с использованием антисмысловых последовательностей длина антисмысловой ДНК составляет по меньшей мере 15 нуклеотидов, предпочтительно по меньшей мере 100 нуклеотидов или более и более предпочтительно по меньшей мере 500 нуклеотидов или более. Обычно длина антисмысловой ДНК, используемой в изобретении, короче 5 т.п.н., предпочтительно менее 2,5 т.п.н.
Супрессию экспрессии эндогенного гена можно осуществить, используя ДНК, кодирующую рибозим. Рибозим относится к молекуле каталитической РНК. Имеются рибозимы с разнообразными активностями. Среди них исследования на рибозимах, служащих в качестве ферментов, которые расщепляют РНК, делают возможным конструирование рибозимов, которые обеспечивают сайт-специфичное расщепление РНК. Рибозимы представляют собой не только молекулы размером примерно 400 или более нуклеотидов, такие как интрон группы I и РНКаза P, включая РНК M1, но также молекулы, имеющие активный домен примерно из 40 нуклеотидов, называемые рибозимами типа головки молотка и рибозимами типа шпильки.
Например, саморасщепляющий домен рибозимов типа головки молотка расщепляет G13U14C15 с 3'-стороны C15; однако считается, что образование пар оснований между U14 и A9 является ключевым для катализа, и показано, что кроме C может быть отщеплен нуклеотид в положении 15 A или U (M. Koizumi et al. (1988), FEBS Lett. 228: 225). Если сайт рибозима, связывающий субстрат, сконструировать комплементарным последовательности РНК вблизи сайта-мишени, то можно будет получить рибозимы, которые расщепляют РНК таким образом, как фермент рестрикции, и узнают последовательность UC, UU или UA в РНК-мишени (M. Koizumi et al. (1988), FEBS Lett. 239: 285, M. Koizumi et al. (1989), Nucleic Acids Res. 17: 7059). Например, существует множество возможных сайтов-мишеней в кодирующей области гена NtmybA2 (SEQ ID NO: 2).
Также в целях практического осуществления настоящего изобретения применимы рибозимы типа шпильки. Рибозим типа шпильки обнаружен например в минус-цепи сателлитной РНК вируса кольцевой пятнистости табака (J.M. Buzayan, Nature, 323: 349, 1986). Также показано, что можно сконструировать указанный рибозим так, чтобы он позволял расщеплять специфичную для мишени РНК (Y. Kikuchi and N. Sasaki, Nucleic Acids Res., 19: 6751 (1992)).
Рибозим, предназначенный для обеспечения расщепления мишеней, может быть лигирован с таким промотором, как промотор 35S вируса мозаики цветной капусты (CaMV), и последовательностью терминации транскрипции, чтобы обеспечить транскрипцию в растительных клетках. Однако в таких случаях, когда добавляют дополнительные последовательности к 5'- или 3'-концу РНК-транскрипта, активность рибозима может исчезать или не исчезать. В указанных случаях для точного вырезания рибозимной части из РНК, содержащей транскрипт рибозима, другой цис-действующий отрезающий рибозим может быть помещен с 5'- или 3'-стороны рибозимной части, чтобы обеспечить отрезание (K.Taira et al., Protein Eng., 3: 733 (1990); A.M.Dzianott and J.J.Bujarski, Proc. Natl. Acad. Sci. USA., 86: 4823 (1989); C.A.Grosshans and R.T.Cech, Nucleic Acids Res., 19: 3875 (1991); K.Taira et al., Nucleic Acids Res., 19: 5125 (1991)). Также можно поместить такие составляющие единицы в виде тандема, чтобы обеспечить разрезание множества сайтов в генах-мишенях, таким образом, еще более усиливая действие (N. Yuyama et al., Biochem. Biophys. Res. Commun., 186: 1271, 1992). Продукты транскрипции генов, являющиеся мишенями согласно настоящему изобретению, могут быть специфично расщеплены такими рибозимами, таким образом, приводя к супрессии экспрессии указанных генов.
Супрессия экспрессии эндогенных генов может быть достигнута косупрессией, индуцированной трансформацией с использованием ДНК, имеющей последовательность, идентичную или аналогичную последовательностям генов-мишеней. Термин «косупрессия» относится к явлению, когда введение гена, содержащего последовательность, идентичную или сходную с последовательностью эндогенного гена-мишени, в растения супрессирует экспрессию и внедренного чужеродного гена и эндогенного гена-мишени. Подробности механизма косупрессии еще не выяснены, но косупрессия часто наблюдается в растениях (Curr. Biol., 7: R793, 1997; Curr. Biol., 6: 810, 1996). Например, растения, в которых косупрессирован ген NtmybA2, могут быть получены трансформацией или трансфекцией растений-мишеней векторной ДНК, сконструированной так, чтобы она обеспечивала возможность экспрессии ДНК, содержащей ген NtmybA2 или аналогичную ему последовательность, с последующим отбором растений с более подавленным клеточным ростом из полученных в результате растений. Гены, используемые при косупрессии, не обязательно полностью идентичны гену-мишени, но они по меньшей мере на 70% (70% или более), предпочтительно на 80% или более и еще более предпочтительно по меньшей мере на 90% (например на 95% или более) идентичны по последовательности. Идентичность последовательностей можно определить, используя указанный выше поиск.
Супрессия экспрессии эндогенного гена может быть достигнута посредством интерференции РНК (RNAi), индуцированной трансформацией ДНК, в которой последовательность, идентичная или аналогичная последовательности генов-мишеней, расположена в виде инвертированного повтора. «Интерференция РНК» или «RNAi» означает явление, при котором введение ДНК, в которой последовательность, идентичная или аналогичная эндогенному гену-мишени, расположена в виде инвертированного повтора, индуцированного трансформацией растений, вызывает экспрессию двунитевой РНК (днРНК), полученной из чужеродной ДНК, таким образом супрессируя экспрессию гена-мишени. Предполагается, что механизм интерференции РНК включает в себя начальную стадию образования комплекса мРНК гена-мишени и двунитевой РНК, полученной из введенной последовательности, с последующим синтезом комплементарной РНК с использованием связанных последовательностей в качестве праймеров, вторую стадию фрагментации комплекса эндогенной РНКазой и третью стадию действия фрагментированных двунитевых РНК длиной от 20 до 30 пар оснований в качестве сигналом для вторичной интерференции РНК, обеспечивающей повторную деградацию мРНК эндогенного гена-мишени (Curr. Biol., 7: R793, 1997; Curr. Biol., 6: 810, 1996). Например, способ получения растений, в которых ген NtmybB супрессирован интерференцией РНК, может заключаться в трансформации растений-мишеней векторной ДНК, сконструированной так, чтобы она обеспечивала возможность экспрессии ДНК, в которой последовательность ДНК, содержащая ген NtmybB или аналогичную ему последовательность, расположена в виде инвертированного повтора, с последующим отбором трансформированных растений с повышенным или ускоренным клеточным ростом из полученных в результате трансформированных растений. Не обязательно, чтобы гены, применяемые для интерференции РНК, были полностью идентичны генам-мишеням, но они являются генами, имеющими по меньшей мере 10 следующих друг за другом нуклеотидов, предпочтительно от 20 до 100 следующих друг за другом нуклеотидов и более предпочтительно 50 или более следующих друг за другом нуклеотидов, идентичных по последовательности гену-мишени. Гены, применяемые для интерференции РНК, могут представлять собой гены, имеющие последовательность по меньшей мере на 70%, предпочтительно по меньшей мере на 80% и более предпочтительно по меньшей мере на 90% (например на 95% или более) идентичную по последовательности представляющему интерес гену-мишени. Кроме того, более предпочтительные гены, применимые для интерференции РНК, включают гены, имеющие последовательность, которая не только по меньшей мере на 70%, предпочтительно по меньшей мере на 80% и более предпочтительно по меньшей мере на 90% (например на 95% или более) идентичны по последовательности представляющему интерес гену-мишени, но также расположена в виде инвертированного повтора. Среди них желательными генами, применимыми для интерференции РНК, являются гены, имеющие последовательность, которая имеет идентичность по последовательности гену-мишени и расположена посредством спейсерной последовательности в виде инвертированного повтора. Идентичность последовательностей можно определить, используя вышеуказанный поиск. Что касается длины гена, применяемого для интерференции РНК, то они могут представлять собой полноразмерную форму генов-мишеней. Однако достаточно, чтобы они имели по меньшей мере 25 нуклеотидов, предпочтительно 50 нуклеотидов, более предпочтительно 100 нуклеотидов, еще более предпочтительно 500 нуклеотидов.
Кроме того, RNAi осуществима посредством вирусной инфекции растения. Вирус растения, имеющий однонитевую РНК в качестве генома, принимает двунитевую форму в процессе репликации. Таким образом, когда последовательность гена-мишени встраивают вместе с подходящим промотором в геном вируса растений с последующей трансфекцией растений полученным в результате рекомбинантным вирусом, будет образовываться двунитевая РНК последовательности гена-мишени в связи с репликацией указанного вируса. В результате будет достигаться эффект RNAi (Angell et al., Plant J. 20, 357-362 (1999)).
Кроме того, супрессия экспрессии эндогенного гена согласно настоящему изобретению может быть достигнута трансформацией растений генами, обладающими доминантными негативными свойствами против генов-мишеней. «ДНК, кодирующая белок, обладающий доминантными негативными свойствами», относится к ДНК, кодирующей белки, которые функционируют как сайленсеры или понижающие факторы против активности белков, кодируемых эндогенными генами согласно изобретению, имеющимися внутри растений, в которых экспрессируются указанные ДНК. О том, функционирует ли или не функционирует представляющая интерес ДНК в качестве сайленсера или понижающего фактора против активности эндогенного гена согласно настоящему изобретению, можно судить, как указано выше, в зависимости от того, ингибирует или супрессирует представляющая интерес ДНК количество генных транскриптов с растительных генов циклина B, генов NACK1 или ортологичных им генов.
Индуцированное доминантными негативными молекулами снижение функций эндогенных белков 3Rmyb можно осуществить трансформацией видов растений, отличных от видов, из которых выделяют белки NtmybA1, белки NtmybA2 или белки Os3RmybA1.
Растения, имеющие модифицированные активности растительных белков 3Rmyb, в данном случае являются представителями, имеющими измененную экспрессию растительных генов 3Rmyb или измененные функции белков 3Rmyb. Предпочтительно растения имеют количественные изменения экспрессии указанных генов или функций экспрессированных белков на уровне, заметно отличающемся от уровней в растениях дикого типа. Примеры количественного изменения экспрессии включают стабильную экспрессию, индуцированную экспрессию, сверхэкспрессию, эктопическую экспрессию и супрессию указанной экспрессии. Такие растения, имеющие измененную экспрессию или функции, кроме способов генетической инженерии посредством трансформации, можно создать традиционными способами мутагенеза и отбора.
Настоящее изобретение, кроме того, относится к рекомбинантным ДНК и векторам (векторным конструкциям), содержащим инсерцию ДНК, которая супрессирует или ингибирует указанную выше ДНК согласно настоящему изобретению, экспрессию ДНК согласно настоящему изобретению и экспрессию белков, кодируемых ДНК согласно настоящему изобретению. Рекомбинантные ДНК и векторы (векторные конструкции) включают кроме указанных выше векторов (векторных конструкций), используемых при получении рекомбинантных белков, векторы или векторные конструкции, обеспечивающие возможность экспрессии ДНК в растительных клетках для получения трансгенных растений, указанных ДНК, которые супрессируют или ингибируют ДНК согласно настоящему изобретению, экспрессию ДНК согласно настоящему изобретению и экспрессию белков, кодируемых ДНК согласно настоящему изобретению. Такие рекомбинантные ДНК или векторы (векторные конструкции) без ограничения являются любыми, при условии что они содержат последовательность промотора, способную к транскрипции в растительных клетках, и последовательность терминатора, содержащую сайт полиаденилирования, необходимый для стабилизации транскрибируемых продуктов. Примерами рекомбинантных ДНК или векторов (векторных конструкций) являются плазмиды «pBI121», «pBI221», «pBI101» (все Clontech), «pTA7001», «pTA7002» (Aoyama et al. (1997) Plant J. 11: 605), «pPZP211» (Hajdukiewicz et al., Plant Mol. Biol. 25: 989 (1994), и т.д.
Указанная выше рекомбинантная ДНК или вектор (векторная конструкция) согласно настоящему изобретению может содержать любые промоторы, предназначенные для обеспечения стабильной или индуцируемой экспрессии белков согласно настоящему изобретению. Промоторами, экспрессируемыми in vivo согласно настоящему изобретению, желательно являются промоторы, которые перечислены в данном описании ниже. Примерами промоторов, предназначенных для обеспечения возможности стабильной экспрессии, являются промотор 35S вируса мозаики цветной капусты (CaMV) (Odell et al., Nature, 313: 810 (1985)), промотор актина риса (Zhang et al., Plant Cell, 3: 1155 (1991)), промотор убиквитина кукурузы (Cornejo et al., Plant Mol. Biol., 23: 567 (1993)) и т.д.
К промоторам, предназначенным для обеспечения индуцируемой экспрессии, относятся, например, промоторы, известные как элементы, которые экспрессируются под действием экзогенных факторов, включая грибковую, бактериальную или вирусную инфекцию или инвазию, низкие температуры, повышенные температуры, условия засухи, облучение УФ-светом и применения специфичных соединений. Примерами таких промоторов являются промоторы для экспрессии, индуцируемой инфекцией или инвазией нитчатых грибов, бактерий или вирусов, такие как промотор гена хитиназы риса (Xu et al., Plant Mol. Biol., 30: 387 (1996)) и промотор гена PR табака (Ohshima et al., Plant Cell 2: 95 (1990)); промотор гена «lip19» риса, индуцируемый низкими температурами (Aguan et al., Mol. Genet., 240: 1 (1993)); промотор гена «hsp80» или гена «hsp72» риса, индуцируемый высокими температурами (Van Breusegem et al., Planta, 193: 57 (1994)); промотор гена «rab16» Arabidopsis thaliana, индуцируемый обезвоживанием (Nundy et al., Proc. Natl. Acad. Sci. USA, 87: 1406 (1990)); промотор гена синтазы халкона петрушки, индуцируемый облучением УФ-светом (Schulze-Lefert et al., EMBO J., 8: 651 (1989)); промотор гена алкогольдегидрогеназы кукурузы, индуцируемый анаэробными условиями (Walker et al., Proc. Natl. Acad. Sci. USA, 84: 6624 (1987)); и т.д. Промотор гена хитиназы риса и промотор гена белка PR табака также могут быть индуцированы специфичными соединениями, такими как салициловая кислота. «rab16» также может быть индуцирован при использовании фитогормона абсцизиновой кислоты. В объем изобретения включено применение векторных систем, содержащих системы ответа на глюкокортикоиды или эстроген, чтобы обеспечить индуцируемую экспрессию генов в растениях. К векторам, отвечающим на глюкокортикоиды для обеспечения индуцируемой экспрессии, относятся pTA7001, pTA7002 (Aoyama et al., Plant J., 11: 605 (1997)). К векторам, отвечающим на эстроген для обеспечения индуцируемой экспрессии, относится pER10 (Zuo et al., Plant J., 24: 265 (2000)). Примерами промоторов, обеспечивающих возрастание специфичной для клеток экспрессии генов в растениях, также является промотор гена NPK1 табака, экспрессируемый во время фаз с S по M (Nishihama et al., Genes Dev., 15: 352 (2000)), промотор гена NACK1 табака в качестве промотора, экспрессируемого в фазе M (Nishihama et al., Cell, 109: 87 (2002)), промотор гена CYM Catharanthus roseus CYM (Ito et al., Plant J., 11: 983 (1997)), промотор гена CYS Catharanthus roseus, экспрессируемый в фазе S (Ito et al., Plant J., 11: 983 (1997)), промотор гена cdc2a Arabidopsis thaliana, который, как обнаружено, является активным в растущих клетках на протяжении клеточного цикла (Chung et al., FEBS Lett., 362: 215 (1995)), etc. Примеры тканеспецифичных промоторов можно найти в следующих документах: патенте США 5459252 и патенте США 5633363 (специфичные для корня), патенте США 5097025 ((i) семена, (ii) зрелое растение), патенте США 5391725 ((i) хлоропласт, (ii) цитозоль), патенте США 4886753 (корневые клубеньки), патенте США 5646333 (эпидермис), патенте США 5110732 ((i) корень, (ii) корнеплод), патенте США 5618988 (запасающий орган), патенте США 5401836 и патенте США 5792925 (корень), патенте США 4943674 (фрукты или орехи), патенте США 5495007 (флоэма), патенте США 5824857 (сосудистая ткань), описания которых включены в данную публикацию в виде ссылки. Кроме указанных промоторов к применимым промоторам относятся промотор AtHB8 Arabidopsis thaliana, который действует как промотор, специфичный для прокамбия сосудисто-волокнистых пучков (Baima et al. Development 121: 4171 (1995)), специфичный для стебля и корня промотор ACL5 Arabidopsis thaliana (Hanzawa et al. The EMBO Journal, 19: 4248 (2000)), специфичный для наземной части промотор RBCS3A томата (Meier et al. Plant Physiol. 107: 1105 (1995)), и т.д.
К промоторам, которые являются активными при высоких уровнях экспрессии генов в мужских репродуктивных органах или клетках, относятся промотор гена AtNACK2 Arabidopsis thaliana (PCT/JP02/12268), промотор гена AVP1 Arabidopsis thaliana (Mitsuda et al., Plant Mol. Biol, 46: 185 (2001)), промотор гена DAD1 Arabidopsis thaliana (Ishiguro et al., Plant Cell, 13: 2191 (2001)), промоторы генов TA20 и TA29 табака (Goldberg et al., Science, 240: 1460 (1988)), промотор гена Osg6B риса (Tuchiya et al., Plant Mol. Biol, 26: 1737 (1994)), промотор гена Lat52 томата (Twellr et al., Development, 109: 705 (1990)), промотор гена g10 табака (Rogers et al., Plant Mol. Biol., 45: 577 (2001)), и искусственные промоторы, полученные путем инсерции специфичных для пыльника регуляторных последовательностей для экспрессии генов в промотор вируса 35S вируса мозаики цветной капусты (Ingrid et al., Plant Cell, 4: 253 (1992)), и т.д.
Также настоящее изобретение относится к трансформированным растительным клеткам, в которые внедрена указанная выше рекомбинантная ДНК или вектор (или векторная конструкция) согласно настоящему изобретению. Растительные клетки, в которые внедрен вектор (или векторная конструкция) согласно настоящему изобретению, включают такие растительные клетки для получения трансформированных организмов растений (трансформантов растений). Растительная клетка, в которую перенесен вектор или векторная конструкция согласно настоящему изобретению, включает растительные клетки для получения или конструирования трансгенных растений или организмов растений. Применимая растительная клетка без ограничения выбрана из известных растений, включая, например, культивируемые растения, полезные или ценные растения и другие растения. К таким растениям относятся растения, известные как зерновые культуры, бобовые, корнеплоды или клубнеплоды, орехи, семена, овощи, ягоды, фрукты или плодовые деревья, кроме того, растения, происходящие из огородных культур, садовых деревьев или трав, плодоовощных видов, цветущих деревьев и декоративных видов. Примерами растительных клеток являются клетки, выбранные из группы, состоящей из видов Solanaceous, видов Cruciferous (Brassicaceous), видов Graminaceous, видов Leguminous, видов Liliaceous, видов Umbelliferous, видов Cucurbitaceous и других видов, предпочтительно табака (Nicotiana tabacum), Arabidopsis thaliana, сои (Glycine max), бобов Aduki (небольшие красные бобы), зеленых бобов (Phaseolus vulgaris), гороха (Lathyrus spp., включая снежный горошек (Pisum sativum)), кормовых бобов (Vicia faba), арахиса (Arachis hypogaea), кунжута (Sesamum indicum LINNE), риса (Oryza sativa), пшеницы (Triticum aestivum), ячменя, ржи (Secale cereale), овса (Avena sativa), кукурузы (Zea mays), сорго (Sorghum bicolor, Sorghum vulgare), картофеля (Solanum tuberosum), томата, зеленого перца, капусты, брокколи, петрушки, шпината, батата (Ipomoea batatus), таро (Colocasia spp., включая C. esculenta), конджака (Amorphophallus rivieri var. konjac), кассавы (Manihot spp., включая M. esculenta), винограда, яблонь, персиков, груш (Pyrus spp., включая Pyrus pyrifolia var. culta и Pyrus communis), хурмы (Diospyros kaki), клубники, голубики, сливы, дыни, огурца, сахарного тростника (Saccharum officinarum L.), мандарина, лимона, апельсина, маслины (Olea europaea), хлопка (Gossypium arboretum), и другие растительные клетки. Растительные клетки согласно настоящему изобретению включают не только культивируемые клетки (линии клеток), но также отдельные клетки, присутствующие в организме растений. Они также включают протопласты, зачатки побегов, множественные побеги и опушенные корни. Применимые способы внедрения вектора или векторной конструкции в растительную клетку включают, например, трансформацию, опосредованную Agrobacterium (Hood et al., Transgenic Res., 2: 218 (1993); Hiei et al., Plant J., 6: 271 (1994)), электропорацию (Tada et al., Theor. Appl. Genet., 80: 475 (1990)), способ на основе полиэтиленгликоля (Lazzeri et al., Theor. Appl. Genet, 81: 437 (1991)), бомбардировку частицами (Sanford et al., J. Part. Sci. tech., 5: 27 (1987)). Способ внедрения (введения) соответственно выбирают из способов, известных в данной области и хорошо описанных в научной и патентной литературе.
Трансформированные растительные клетки могут быть подвергнуты повторной дифференцировке, чтобы регенерировать организм растения. Повторная дифференцировка варьирует в зависимости от вида клеток растений, но включает, например, способ Fujimura et al. (Plant Tissue Culture Lett., 2: 74 (1995)) для риса; способ Shillito et al. (Bio/Technology, 7: 581 (1989)) и способ Gorden-Kamm et al. (Plant Cell, 2: 603 (1990)) для кукурузы; способ Visser et al. (Theor. Appl. Genet, 78: 594 (1989)) для картофеля; способ Nagata и Takebe (Planta, 99: 12 (1971)) для табака; и способ Akama et al. (Plant Cell Reports, 12: 7-11 (1992)) для Arabidopsis thaliana.
После получения трансгенных растений, в которые внедрена ингибирующая или супрессирующая ДНК против ДНК согласно настоящему изобретению или экспрессии ДНК согласно изобретению, можно получить потомство растений посредством полового или бесполого (вегетативного) размножения. Можно массово размножать растения на основе материалов для размножения (например, семян, орехов, плодов, черенков, клубней, корневищ, луковиц, побегов, корней, отводков, каллусов растений, протопластов и т.д., полученных из представляющего интерес растения и его потомства или клонов. Настоящее изобретение охватывает растительные клетки, в которые была внедрена супрессирующая ДНК против ДНК согласно настоящему изобретению или экспрессии ДНК согласно изобретению, растения, несущие такую растительную клетку, потомство и клоны, полученные из такого растения, указанные растения или организмы растений, их материалы (источники) для размножения, такие как потомство и клоны.
Растения согласно настоящему изобретению могут изменять рост своих клеток и развитие/дифференцировку посредством регулирования экспрессии ДНК согласно изобретению по сравнению с нормальными особями растений.
Термин «модификация клеточного роста», «модификация пролиферации клеток» или «модифицированный клеточный рост» относится, например, к событиям, включающим уменьшение или продление времени, необходимого для клеточного цикла; уменьшение или продление времени, необходимого для каждой из составляющих фаз клеточного цикла, G1, S, G2 и M; ингибирование или задержку вхождения в каждую из составляющих фаз G1, S, G2 и M клеточного цикла; супрессию терминации каждой из составляющих фаз G1, S, G2 и M клеточного цикла; супрессию прохождения каждой из составляющих фаз клеточного цикла, G1, S, G2 и M; изменение размера клеток; изменение в расширение фрагмопласта; изменение в образовании фрагмопласта; изменение в расширении клеточной пластинки; изменение в образовании клеточной пластинки; изменение частоты деления клеток; изменение в количестве ядер, находящихся в клетке; и изменение уровня содержания ДНК в ядре. Предпочтительными примерами являются события, включающие уменьшение или продление времени, необходимого для клеточного цикла, изменение размера клеток; изменение в образовании фрагмопласта; изменение в образовании клеточной пластинки; изменение частоты деления клеток; и изменение уровня содержания ядерной ДНК. Изменение уровня содержания ядерной ДНК в используемом в данном описании смысле охватывает изменение полиплоидии, предпочтительно увеличение полиплоидии.
Термин «модификация развития/дифференцировки» или «модифицированное развитие/дифференцировка» в используемом в данном описании смысле относится, например, к событиям, включающим увеличение количества клеток, составляющих растение, вследствие усиленного роста клеток, снижение количества клеток, составляющих растение, вследствие подавленного клеточного роста, увеличение скорости роста и развития растения вследствие усиленного роста клеток, уменьшение скорости роста и развития растения вследствие подавленного клеточного роста, увеличение скорости роста и развития растения с укорочением периода, необходимого для цветения, уменьшение скорости роста и развития растения с удлинением периода, необходимого для цветения, увеличение скорости роста и развития растения без изменения регуляторного аппарата цветения с образованием цветочных бутонов у растения большого размера, снижение скорости роста и развития растения без изменения регуляторного аппарата цветения с образованием цветочных бутонов у растений небольшого размера, увеличение скорости роста и развития растения с укорочением периода, необходимого для достижения старости, уменьшение скорости роста и развития растения с удлинением периода, необходимого для достижения старости, увеличение скорости роста и развития растения без изменения регуляторного аппарата до инициации старения, при этом растение растет, так что становится большого размера до инициации старения, уменьшение скорости роста и развития растения без изменения регуляторного аппарата до инициации старения с началом старения после вырастания растения до небольшого размера, изменение морфологической формы ткани вследствие усиленного или подавленного клеточного роста, изменение размера ткани вследствие усиленного или подавленного клеточного роста, изменение морфологической формы органов вследствие усиленного или подавленного клеточного роста, изменение размера органов вследствие усиленного или подавленного клеточного роста, изменение морфологической формы растения вследствие усиленного или подавленного клеточного роста и изменение размера растения вследствие усиленного или подавленного клеточного роста. Предпочтительными примерами указанного являются события, включающие увеличение скорости роста и развития растения без изменения регуляторного аппарата цветения с образованием цветочных бутонов у растений большого размера, уменьшение количества клеток, составляющих растение, вследствие подавленного клеточного роста, уменьшение скорости роста и развития растения без изменения аппарата, регулирующего образование цветочных бутонов, с образованием цветочных бутонов у растений небольшого размера, изменение размера органа вследствие усиленного или подавленного клеточного роста, и изменение размера растения вследствие усиленного или подавленного клеточного роста. Более предпочтительным примером является изменение размера растения вследствие усиленного или подавленного клеточного роста. В настоящем изобретении изменение размера растения вследствие усиленного или подавленного клеточного роста представляет собой увеличение размера растения из-за усиленного клеточного роста или уменьшение размера растения вследствие подавленного клеточного роста.
Создание растений, которые обеспечивают возможность уменьшения уровней генной экспрессии эндогенных NtmybA1 и NtmybA2, согласно данному изобретению приводит к получению растений, имеющих подавленный рост и развитие или пролиферацию, сопровождаемую наличием клеток, имеющих подавленное или ингибированное клеточное деление или цитокинез, и создание культивируемых клеток, имеющих пониженные уровни генной экспрессии эндогенного NtmybA2, приводит к их модифицированному клеточному циклу. Это показывает, что NtmybA1 и NtmybA2 являются позитивно регулирующими факторами в отношении клеточного цикла и деления клеток и что можно создавать растения, имеющие подавленные характеристики роста и развития.
В настоящем изобретении создание трансгенных растений и трансформированных клеток, которые обеспечивают возможность стабильной экспрессии NtmybA2, приводит к получению растений или культивируемых клеток, которые являются медленно растущими. Это показывает, что эктопическая экспрессия NtmybA2 позволяет создавать растения, имеющие замедленный клеточный цикл и подавленный рост и развитие.
В трансгенных растениях и трансформированных клетках, имеющих пониженные уровни экспрессии гена эндогенного NtmybB, их рост и развитие согласно изобретению подавлены или ингибированы. Это показывает, что NtmybB является негативно регулирующим фактором в отношении клеточного цикла и деления клеток и что можно создавать растения, имеющие повышенные характеристики роста и развития.
В растениях, которые обеспечивают возможность стабильной экспрессии NtmybB, их рост и развитие согласно изобретению подавлены или ингибированы. Это показывает, что NtmybB является негативно регулирующим фактором в отношении клеточного цикла и деления клеток и что можно получать растения, имеющие подавленные характеристики роста и развития.
Настоящее изобретение относится к генам Os3RmybA1 риса, которые служат в качестве активаторов транскрипции генов циклина B и NACK-родственных генов. Из риса (Oryza sativa) выделена кДНК Os3RmybA1, которая представляет собой растительный ген 3Rmyb, и ее нуклеотидная последовательность успешно раскрыта в данном изобретении. Нуклеотидная последовательность кДНК Os3RmybA1 показана в SEQ ID NO: 31, и аминокислотная последовательность белка Os3RmybA1, кодируемого данным геном, также показана в SEQ ID NO: 32.
Настоящее изобретение относится к белкам 3Rmyb однодольных растений, которые функционально эквивалентны белку Os3RmybA1. В используемом в данном описании смысле термин «эквивалентно функциональный» или «функционально эквивалентный» указывает, что белок действует или функционирует в качестве активатора транскрипции генов циклина B и NACK-родственных генов. Можно оценить, служат ли белки в качестве факторов регулирования транскрипции генов циклина B и NACK-родственных генов, посредством анализа функциональной комплементации на основе экспрессии таких белков в мутантных линиях и активации транскрипции генов циклина B и NACK-родственных генов такими белками, которые временно экспрессируются в растительных клетках.
Подходящие растения для выделения или отделения белков, функционально эквивалентных растительным белкам 3Rmyb, охарактеризованным в настоящем изобретении, могут быть выбраны из однодольных растений. Такие растения также могут быть использованы в качестве источников генов.
В варианте способов получения или выделения указанного выше функционально эквивалентного белка способы введения в белок аминокислотной мутации хорошо известны специалистам в данной области. Специалист в данной области может ввести аминокислотную замену, делецию (нарушение) и/или инсерцию (добавление) в аминокислотную последовательность встречающегося в природе белка «Os3RmybA1» (например, белка, показанного в SEQ ID NO: 32) согласно обычному способу получения мутантного белка (мутеина), функционально эквивалентного такому встречающемуся в природе белку. Мутации аминокислот также могут встречаться в природе. К белкам согласно настоящему изобретению относятся белки, имеющие аминокислотную последовательность, содержащую по меньшей мере одну замену, делецию (нарушение) или инсерцию (добавление) одной или множества аминокислотных остатков в аминокислотной последовательности такого встречающегося в природе белка «Os3RmybA1». Количество измененных аминокислотных остатков в последовательности обычно составляет 50 или меньше из всех аминокислотных остатков, присутствующих в белке, предпочтительно 30 или меньше, более предпочтительно 10 или меньше и еще более предпочтительно 3 или меньше. Модификации аминокислот можно осуществить, используя, например, «набор для сайт-направленного мутагенеза Transformer» и «набор для сайт-направленного мутагенеза на основе ПЦР ExSite» (Clontech) в случае мутаций и замен, и «набор для гнездовых делеций Quantum leap» (Clontech) в случае делеций.
К таким мутациям, превращениям и модификациям относятся такие, которые описаны в JBS (Ed.), "Zoku-Seikagaku Jikken Koza 1, Idenshi Kenkyuhou II", p105 (Susumu Hirose), Tokyo Kagaku Dozin Co. Ltd., Japan (1986); JBS (Ed.), "Shin-Seikagaku Jikken Koza 2, Kakusan III (Recombinant DNA technique)", p233 (Susumu Hirose), Tokyo Kagaku Dozin Co. Ltd., Japan (1992); R. Wu, L. Grossman, ed., "Methods in Enzymology", Vol. 154, p. 350 & p. 367, Academic Press, New York (1987); R. Wu, L. Grossman, ed., "Methods in Enzymology", Vol. 100, p. 457 & p. 468, Academic Press, New York (1983); J. A. Wells et al., Gene, 34: 315, 1985; T. Grundstroem et al., Nucleic Acids Res., 13: 3305, 1985; J. Taylor et al., Nucleic Acids Res., 13: 8765, 1985; R. Wu ed., "Methods in Enzymology", Vol. 155, p. 568, Academic Press, New York, 1987); A. R. Oliphant et al., Gene, 44: 177, 1986 и т.д. Например, к ним относятся такие способы, как сайт-направленный мутагенез (сайт-специфичный мутагенез) с использованием синтетических олигонуклеотидов (Zoller et al., Nucl. Acids Res., 10: 6487, 1987; Carter et al., Nucl. Acids Res., 13: 4331, 1986), кассетный мутагенез (Wells et al., Gene, 34: 315, 1985), мутагенез на основе рестрикционной селекции (Wells et al., Philos. Trans. R. Soc. London Ser A, 317: 415, 1986), аланиновое сканированием (Cunningham and Wells, Science, 244: 1081-1085, 1989), ПЦР-мутагенез, способ Кункеля, способ на основе dNTP[αS] (Eckstein), мутагенез, направленный на определенную область с использованием сернистой кислоты и азотистой кислоты и тому подобные.
Замена, делеция (нарушение) или инсерция (добавление) аминокислот могут давать требуемую модификацию и могут вызывать изменение физиологических или химических свойств полипептида, который составляет представляющий интерес белок. Часто имеют место случаи, когда полипептид с заменой, делецией или инсерцией будет считаться по существу идентичным полипептиду без такой замены, делеции или инсерции. По существу идентичные заменители аминокислот в аминокислотной последовательности могут быть выбраны из других аминокислот в классе, к которому относится аминокислота. Например, неполярные (гидрофобные) аминокислоты включают аланин, фенилаланин, лейцин, изолейцин, валин, пролин, триптофан, метионин и тому подобные, полярные (нейтральные) аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин и тому подобные, аминокислоты, имеющие положительный заряд (основные аминокислоты), включают аргинин, лизин, гистидин и тому подобные, и аминокислоты, имеющие отрицательный заряд (кислые аминокислоты), включают аспарагиновую кислоту, глутаминовую кислоту и тому подобные. В некоторых случаях цистеин может быть заменен серином; глицин аланином или лейцином; и лейцин аланином, изолейцином, валином или другими. В белках согласно настоящему изобретению находящиеся в них аминокислотные остатки могут быть модифицированы химическими способами. Также они могут быть модифицированы и частично разрушены ферментами, такими как пептидазы (например, пепсин, химотрипсин, папаин, бромелаин, эндопептидаза, экзопептидаза и т.д.), чтобы получить их производные или мутанты.
Белки могут быть экспрессированы в виде слитых белков при получении способом на основе рекомбинации генов, и могут быть in vivo или in vitro превращены или процессированы в такие продукты, которые обладают по существу эквивалентной биологической активностью по сравнению с продуктами, которые встречаются в природе. Можно применить систему экспрессии слитых белков, обычно используемую в генной инженерии. Такие слитые белки могут быть очищены аффинной хроматографией и подобными способами, воспользовавшись их слитыми остатками. К таким слитым белкам относятся белки, слитые с гистидиновой меткой, и белки, слитые с аминокислотной последовательностью β-галактозидазы (β-gal), белка, связывающего мальтозу (MBP), глутатион-S-трансферазы (GST), тиоредоксина (TRX) или рекомбиназы Cre. Подобным образом полипептид может быть соединен с меткой в виде гетерогенного эпитопа и может быть выделен/очищен иммуноаффинной хроматографией с использованием антитела, специфично связывающегося с эпитопом. В более подходящих вариантах типичные примеры включают, например, AU5, c-Myc, CruzTag 09, CruzTag 22, CruzTag 41, Glu-Glu, HA, Ha.11, KT3, FLAG (зарегистрированная торговая марка Sigma-Aldrich), Omni-зонд, S-зонд, T7, Lex A, V5, VP16, GAL4, VSV-G и другие (Field et al., Molecular and Cellular Biology, 8: pp.2159-2165 (1988); Evan et al., Molecular and Cellular Biology, 5: pp.3610-3616 (1985); Paborsky et al., Protein Engineering, 3(6): pp.547-553 (1990); Hopp et al., BioTechnology, 6: pp.1204-1210 (1988); Martin et al., Science, 255: pp.192-194 (1992); Skinner et al., J. Biol. Chem., 266: pp.15163-15166 (1991); Lutz-Freyermuth et al., Proc. Natl. Acad. Sci. USA, 87: pp.6393-6397 (1990); и т.д.). Также применимы дрожжевые двугибридные системы.
Кроме того, слитыми белками могут быть белки, меченные маркером, так что они становятся регистрируемыми белками. В более подходящих вариантах регистрируемыми маркерами могут быть метка Biotin-Avi, которая является биотин/стрептавидиновой системой, и флуоресцирующие вещества. К флуоресцирующим веществам относятся зеленые флуоресцирующие белки (GFP), полученные из люминесцирующих медуз, таких как Aequorea victorea и тому подобные, их модифицированные варианты (варианты GFP), такие как EGFP (усиленный гуманизированный GFP) и rsGFP (GFP со сдвигом в красную область), желтые флуоресцирующие белки (YFP), зеленые флуоресцирующие белки (GFP), голубые флуоресцирующие белки (CFP), синие флуоресцирующие белки (BFP), GFP, полученный из Renilla reniformis, и тому подобные (Atsushi Miyawaki ed., Jikken Igaku, suppl., Postgenome Jidai no Jikken Kouza 3. GFP and Bioimaging, Youdosha, Japan, 2000). Также регистрация может быть осуществлена с использованием антител (включая моноклональные антитела и их фрагменты), которые специфично узнают указанную выше слитую метку.
Способы, известные в области пептидного синтеза, например способы химического синтеза, такие как способы синтеза в жидкой фазе и способы твердофазного синтеза, можно использовать для синтеза белков и их пептидных фрагментов согласно настоящему изобретению. В таких способах, используя смолу для синтеза белков или пептидов, соответствующим образом защищенные аминокислоты последовательно связывают с требуемой аминокислотной последовательностью на смоле согласно различным способам конденсации, которые известны в данной области. Для реакций конденсации предпочтительно используют различные активирующие реагенты, которые известны в данной области. Например, в качестве таких реагентов предпочтительно можно использовать карбодиимиды, такие как дициклогексилкарбодиимид. Целевой реагент может быть получен при удалении соответствующим образом защитной группы в том случае, когда продукт имеет защитную группу.
Белки согласно настоящему изобретению могут быть получены в виде белков, встречающихся в природе (нативные белки), способами, известными специалисту в данной области, или альтернативно в виде рекомбинантных белков, которые получают с использованием методики рекомбинации генов. Такие нативные белки могут быть получены, например, посредством следующих стадий: небольшое животное, такое как кролик, иммунизируют рекомбинантными белками способом, раскрытом в данном описании ниже, чтобы вызвать образование антител, которые затем связывают с подходящими адсорбентами (CNBr-активированной агарозой или тозил-активированной агарозой), и экстракт белков из листьев риса подвергают очистке, используя колонку, содержащую полученный в результате иммуноадсорбент, чтобы получить нативный белок. Рекомбинантные белки могут быть получены стандартными способами, например, инсерцией кодирующей белок ДНК согласно изобретению в подходящий экспрессирующий вектор, введением указанной векторной конструкции в подходящую клетку и очисткой из полученной в результате трансформированной клетки.
Клетки-хозяева, используемые для получения рекомбинантных белков, включают, например, растительные клетки, клетки микроорганизмов, таких как Escherichia coli и дрожжи, клетки животных, клетки насекомых и другие. К векторам (или векторным конструкциям) для экспрессии in vivo рекомбинантных белков относятся, например, плазмиды «pBI121» и «pBI101» (Clontech) для растительных или дрожжевых клеток; плазмиды «система экспрессии pET» (Stratagene) и «векторы для слияний генов с GST» (Pharmacia) для E. coli; плазмида «pMAM» (Clontech) для клеток млекопитающих; плазмида «pBacPAK8.9» (Clontech) и т.д.
Инсерцию ДНК в вектор можно осуществить, используя обычные способы, такие как способы, описанные в Molecular Cloning (Maniatis et al., Cold Spring harbor Laboratory Press). Вектор или векторная конструкция могут быть введены в клетку-хозяина с использованием обычных способов, таких как электропорация, микроинъекция и бомбардировка частицами. Введение векторных конструкций можно проводить подходящими способами в зависимости от конкретной используемой клетки-хозяина.
Очистку рекомбинантных белков из полученных в результате трансформированных клеток можно осуществить, используя высаливание или осаждение органическими растворителями, ионообменную хроматографию, аффинную хроматографию, хроматографию на колонке, используя иммуноадсорбирующую колонку, гель-фильтрацию, SDS-электрофорез, изоэлектрический электрофорез и другие способы очистки и разделения отдельно или необязательно в комбинации с любым другим способом в зависимости от свойств белков-мишеней. Когда рекомбинантный белок согласно настоящему изобретению экспрессируется в виде белка, слитого с меткой, такой как глутатион-S-трансфераза (GST), он может быть очищен аффинной хроматографией, направленной к указанной метке.
Настоящее изобретение также относится к ДНК, кодирующей каждый из вышеуказанных белков согласно настоящему изобретению. ДНК согласно настоящему изобретению без ограничения включает геномную ДНК, кДНК, химически синтезированную ДНК и другую ДНК, при условии что она способна кодировать белок согласно настоящему изобретению. Геномную ДНК можно, например, получить посредством проведения полимеразной цепной реакции (ПЦР), в которой используют матричную геномную ДНК, полученную согласно способу, описанному в документе (Rogers and Bendich, Plant Mol. Biol. 5: 69 (1985)), используют в комбинации с праймерами, сконструированными на основе последовательностей ДНК (например, нуклеотидной последовательности SEQ ID NO: 31) согласно настоящему изобретению. Для кДНК мРНК, полученную из растений согласно обычным способам (Maniatis et al. Molecular Cloning Cold Spring harbor Laboratory Press), подвергают обратной транскрипции с последующей ПЦР с использованием указанных выше праймеры, чтобы получить кДНК. Геномная ДНК и кДНК также могут быть получены посредством приготовления библиотек геномной ДНК или библиотек кДНК согласно обычным способам и скрининга полученных в результате библиотек геномной ДНК или библиотек кДНК с помощью зондов, синтезированных на основе нуклеотидной последовательности согласно настоящему изобретению (например, на основе нуклеотидной последовательности SEQ ID NO: 31).
Другие варианты выделения функционально эквивалентных белков включают способы гибридизации (Southern, J. Mol. Biol. 98: 503 (1975); Maniatis et al., «Molecular Cloning», Cold Spring harbor Laboratory Press) и способы ПЦР (H. A. Erlich (ed.), «PCR technology», Stockton Press, New York (1989)). Другими словами, специалист в данной области может получить белки, функционально эквивалентные белку «Os3RmybA1», посредством использования изолированной ДНК, высоко гомологичной нуклеотидной последовательности гена «Os3RmybA1» (SEQ ID NO: 31), при это указанную изолированную ДНК получают, используя нуклеотидную последовательность гена «Os3RmybA1» (SEQ ID NO: 31) или ее часть в качестве зонда, а также используя олигонуклеотиды, гибридизуемые с частью нуклеотидной последовательности гена «Os3RmybA1» (SEQ ID NO: 31), в качестве праймеров. Следовательно, белок согласно настоящему изобретению также охватывает белки, которые кодируются ДНК, выделенной согласно способам гибридизации или ПЦР, и являются функционально эквивалентными белку «Os3RmybA1».
Термин «полимеразная цепная реакция» или «ПЦР», используемый в данном описании, обычно относится к способу, описанному в Saiki et al., Science, 239: 487 (1988); патенте США No. 4683195 и других документах. Например, ПЦР представляет собой способ in vitro ферментативной амплификации требуемых конкретных нуклеотидных последовательностей. В общем, ПЦР включает в себя повторяющуюся серию циклов, при которых синтез в ходе элонгации праймера осуществляют, используя два олигонуклеотидных праймера, способных предпочтительно гибридизоваться с матрицей нуклеиновой кислоты. Обычно праймеры, используемые в ПЦР, могут включать праймеры, которые являются комплементарными представляющей интерес внутренней нуклеотидной последовательности в матрице. Например, предпочтительные пары праймеров, которые используют в данном изобретении, могут представлять собой пары праймеров, которые являются комплементарными обоим концам указанной амплифицируемой нуклеотидной последовательности, или фланкирующим областям, смежным с указанной нуклеотидной последовательностью. Предпочтительно выбирают 5'-концевой праймер так, чтобы он содержал по меньшей мере кодон инициации или можно было осуществлять амплификацию, включая кодон инициации, и выбирают 3'-концевой праймер, так чтобы он содержал по меньшей мере стоп-кодон, или осуществляют амплификацию, включая стоп-кодон. Праймеры включают олигонуклеотиды, состоящие предпочтительно из 5 или более оснований нуклеотидов, более предпочтительно из 10 или более оснований нуклеотидов и еще более предпочтительно от 18 до 25 оснований нуклеотидов.
Реакции ПЦР могут быть осуществлены способами, известными в данной области, или способами по существу им эквивалентными и модифицированными способами. Например, ПЦР могут быть осуществлены согласно способам, описанным в указанных выше документах, а также R. Saiki, et al., Science, 230: 1350, 1985; H. A. Erlich ed., PCR Technology, Stockton Press, 1989; D. M. Glover et al. ed., "DNA Cloning", 2nd ed., Vol. 1, (The Practical Approach Series), IRL Press, Oxford University Press (1995); M. A. Innis et al. ed., "PCR Protocols: a guide to methods and applications", Academic Press, New York (1990)); M. J. McPherson, P. Quirke and G. R. Taylor (Ed.), PCR: a practical approach, IRL Press, Oxford (1991); M. A. Frohman et al., Proc. Natl. Acad. Sci. USA, 85, 8998-9002 (1988), и модифицированными способами или их вариантами. Способы ПЦР также могут быть осуществлены с использованием коммерчески доступных наборов, подходящих для этого, и также могут быть осуществлены согласно протоколам, описанным производителями или дистрибьюторами наборов.
Для ПЦР в типичном случае матрицу (например, ДНК, синтезированную с использованием мРНК в качестве матрицы; 1-ю нить ДНК) и праймеры, синтезированные согласно плану на указанном гене, например, смешивают с 10× буфером для реакции (прилагаемом в наборе ДНК-полимеразы Taq), dNTP (дезоксирибонуклеозидтрифосфатами; смесь dATP, dGTP, dCTP и dTTP), ДНК-полимеразой Taq и деионизованной дистиллированной водой. Смесь подвергают 25-60 циклам амплификации, используя автоматизированный термоциклер, такой как система для ПЦР GeneAmp 2400 (Perkin-Elmer/Cetus) при использовании общепринятых условий цикла ПЦР. Количество циклов амплификации соответственно может быть установлено при подходящем значении в зависимости от целей. Цикл ПЦР включает в себя, например, денатурацию при 90-95°C в течение от 5 до 100 сек, отжиг при 40-60°C в течение от 5 до 150 сек и удлинение при 65-75°C в течение 30-300 сек и предпочтительно денатурацию при 94°C в течение 15 сек, отжиг при 58°C в течение 15 сек и удлинение при 72°C в течение 45 сек. Соответствующее значение для температуры отжига и времени реакции может быть соответственно выбрано в эксперименте. Подходящее значение времени денатурации и удлинения соответственно варьирует в соответствии с длиной нити ожидаемых продуктов ПЦР. В общем, время отжига предпочтительно варьирует в зависимости от значения Т.пл. гибридов праймер-матрица ДНК. Период времени удлинения обычно устанавливают с целью получения примерно 1 мин на 1000 п.н. длины нити, но в некоторых случаях можно выбрать более короткий период времени.
Полученная таким образом нуклеотидная последовательность ДНК может быть легко секвенирована, например, с использованием секвенатора модели 310 (ABI). ДНК согласно настоящему изобретению можно использовать, например, для получения рекомбинантных белков, которые указаны выше. Также можно экспрессировать ДНК согласно настоящему изобретению in vivo в растениях с получением трансгенных растений, в которых клеточный рост изменен, и трансгенных растений с модифицированным развитием и дифференцировкой.
Для выделения или разделения генов, кодирующих белки, функционально эквивалентные Os3RmybA1, можно осуществить гибридизацию в условиях гибридизации при 55°C с последующими промывками, всего 3 раза, в течение 10 мин при 55°C в 0,1% SDS-содержащем 2×SSC (3 М NaCl, 0,3 М цитрат натрия) или 2×SSPE (3,6 М NaCl, 0,2 М раствор фосфата натрия (pH 7,7), 0,02 М Na2-EDTA). Более жесткая гибридизация может заключаться предпочтительно в гибридизации при 65°C с последующими промывками, всего 3 раза, в течение 10 мин при 65°C в 0,1% SDS-содержащем 2×SSC или 2×SSPE. Еще более жесткая гибридизация заключается предпочтительно в гибридизации при 65°C, затем промывке в течение 10 мин при 65°C в 0,1% SDS-содержащем 2×SSC или 2×SSPE с последующими промывками всего 2 раза в течение 10 мин при 65°C в 0,1% SDS-содержащем 1×SSC или 1×SSPE. Применимыми для гибридизации буферами могут быть буферы, описанные в «Molecular cloning (Maniatis T. et al., Cold Spring Harbor Laboratory Press)», и другие.
Родственные белки, их фрагменты и нуклеиновые кислоты (включая мРНК и олигонуклеотиды), которые приведены в данном описании, могут быть применимы отдельно или в виде смеси с множеством других элементов для способов геномики и протеомики, необязательно в комбинации со способом на основе антисмысловых последовательностей, антителами, включая моноклональные антитела, способами на основе трансгенных растений и другими способами или материалами. Также они могут быть применимы для методики интерференции РНК (RNAi) с использованием двунитевой РНК (днРНК). Таким образом, могут быть доступны следующие анализы: анализ полиморфизма генов, включая основной анализ «полиморфизма единичных нуклеотидов (SNP)»; анализ экспрессии генов, анализ функции генов, анализ белок-белковых взаимодействий, анализ родственных генов и анализ агрохимических средств с использованием матриц нуклеиновых кислот и матриц белков. Например, в способе на основе матрицы нуклеиновой кислоты образцы анализируют, используя библиотеки кДНК, распределяя ДНК, полученную в ПЦР, на пластине носителя с высокой плотностью с помощью устройства для нанесения пятен и используя гибридизацию.
Распределение в виде матрицы можно осуществить иммобилизацией ДНК в каждом определенном месте на пластине носителя, такой как предметное стекло, кремниевая пластина и пластмассовая пластина, с помощью игл или булавок или используя способ струйной печати и другие. Данные получают посредством наблюдения сигналов, которые возникли в результате гибридизации на матрицах нуклеиновых кислот. Сигналы могут представлять собой сигналы, полученные в результате меток, таких как флуоресцирующие красители (например, Cy3, Cy5, BODIPY, ФИТЦ, красители Alexa Fluor (торговая марка), и техасский красный (торговая марка). Регистрацию можно осуществлять с помощью лазерного сканнера и тому подобного. Полученные в результате данные можно обрабатывать с помощью компьютерной системы с установленными программами согласно соответствующему алгоритму. Также в методике белковых матриц можно использовать меченые продукты экспрессии рекомбинантных белков. Оборудование и способы, используемые в методике белковых матриц, включают двумерный электрофорез (2-DE); масс-спектроскопический анализ (МС), включая такие методики, как ионизация в электроспрее (ESI), и лазерная десорбция/ионизация из матрицы (MALDI), в которых можно использовать анализаторы MALDI-TOF, тройные квадрупольные анализаторы ESI, анализаторы ESI типа «ионная ловушка» и другие для белковых веществ, включая фрагменты, расщепленные ферментами; способы окрашивания; изотопное мечение и анализ; способы обработки изображения; и тому подобные. Следовательно, настоящее изобретение может охватывать компьютерные программы, базы данных и другие продукты, получаемые или используемые в вышеприведенных способах не только в связи с NACK1 и NACK2, но также в связи антителами против NACK2 и родственными им веществами.
При использовании в данном описании термин «антитело» может быть использован в самом широком смысле и может охватывать требуемые моноклональные антитела против любого из белков Os3RmybA1, составляющих Os3RmybA1 полипептидов и Os3RmybA1-родственных пептидных фрагментов; композиции антител (или смеси), обладающие специфичностью к их различным эпитопам; кроме того, моновалентные или поливалентные антитела и поликлональные и моноклональные антитела, а также антитела, которые являются интактными молекулами или их фрагментами и производными, включая фрагменты F(ab')2, Fab' и Fab; а также химерные антитела, гибридные антитела, каждое из которых имеет по меньшей мере два сайта, связывающих антиген или эпитоп, или биспецифичные рекомбинантные антитела (например, квадромы, триомы и т.д.), межвидовые гибридные антитела, антиидиотипические антитела и антитела, которые были химически модифицированы или обработаны и должны рассматриваться как производные указанных антител, и кроме того, которые могут быть получены либо слиянием адоптивных клеток, либо способом на основе гибридом, или конструированием антител или с использованием синтетических или полусинтетических способов известным образом, которые могут быть получены либо известными стандартными способами с точки зрения продукции антител или способом на основе рекомбинантной ДНК и которые обладают нейтрализующими или связывающими свойствами в отношении антигенных веществ-мищеней или эпитопов-мишеней, описанных и определенных в данном описании. В частности, предпочтительное антитело согласно настоящему изобретению включает антитела, способные специфично узнавать полипептид, выбранный из группы, состоящей из доменов в пределах аминокислотных остатков 53-202 в SEQ ID NO: 32.
Моноклональные антитела, полученные против антигенных веществ, получают любым способом, способным обеспечивать продукцию молекул антител рядом клеточных линий в культуре. Определение «моноклональное» указывает на характер антитела как полученного по существу из гомогенной популяции антител и не должно быть истолковано как требование получения антитела каким-либо конкретным способом. Индивидуальными антителами являются антитела, включающие популяцию идентичных антител за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела являются высоко специфичными и при этом направленными против одного антигенного сайта. В отличие от препаратов обычных (поликлональных) антител, которые, как правило, содержат разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Кроме своей специфичности моноклональные антитела имеют преимущества, состоящее в том, что они синтезируются в культуре гибридом, не загрязненной другими иммуноглобулинами. Моноклональные антитела включают гибридные и рекомбинантные антитела. Их можно получать заменой вариабельного домена константным доменом антитела, или легкой цепи тяжелой цепью, заменой цепи от одного вида цепью от другого вида или слиянием гетерогенных белков независимо от происхождения или названия класса или подкласса иммуноглобулина, при условии что они проявляют требуемую биологическую активность (например, патент США No. 4816567; Monoclonal Antibody Production Techniques and Applications, pp.79-97, Marcel Dekker, Inc., New York, 1987; и т.д.).
Предпочтительные способы получения моноклональных антител включают, например, способы с использованием гибридомных клеток (G. Kohler and C. Milstein, Nature, 256, pp.495-497 (1975)); способы с использованием гибридом B-клеток человека (Kozbor et al., Immunology Today, 4, pp.72-79 (1983); Kozbor, J. Immunol., 133, pp.3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63, Marcel Dekker, Inc., New York (1987); способы на основе триом; способы на основе EBV-гибридом (Cole et al., Monoclonal Antibody and Cancer Therapy, Alan R. Liss, Inc., pp.77-96 (1985)) (способы получения моноклональных антител человека; патент США No. 4946778 (способы получения одноцепочечных антител), а также следующие документы, связанные с антителами: S. Biocca et al., EMBO J, 9, pp.101-108 (1990); R.E. Bird et al., Science, 242, pp.423-426 (1988); M.A. Boss et al., Nucl. Acids Res., 12, pp.3791-3806 (1984); J. Bukovsky et al., Hybridoma, 6, pp.219-228 (1987); M. DAINO et al., Anal. Biochem., 166, pp.223-229 (1987); J.S. Huston et al., Proc. Natl. Acad. Sci. USA, 85, pp.5879-5883 (1988); P.T. Jones et al., Nature, 321, pp.522-525 (1986); J.J. Langone et al. (ed.), "Methods in Enzymology", Vol. 121 (Immunochemical Techniques, Part I: Hybridoma Technology and Monoclonal Antibodies), Academic Press, New York (1986); S. Morrison et al., Proc. Natl. Acad. Sci. USA, 81, pp.6851-6855 (1984); V.T. Oi et al., BioTechniques, 4, pp.214-221 (1986); L. Riechmann et al., Nature, 332, pp.323-327 (1988); A. Tramontano et al., Proc. Natl. Acad. Sci. USA, 83, pp.6736-6740 (1986); C. Wood et al., Nature, 314, pp.446-449 (1985); Nature, 314, pp.452-454 (1985) или цитированные в них документы (описания которых включены в виде ссылки в данное описание). Антитела согласно настоящему изобретению применимы не только при анализе и выявлении продуктов экспрессии генов, рассматриваемых в данном описании, но также в случае множества применений.
Подходящим является выделение ДНК, кодирующих растительные белки 3Rmyb согласно настоящему изобретению указанными выше способами, основанными на гибридизации, и способами, основанными на ПЦР. В тех случаях, когда выделение осуществляют посредством ПЦР, можно выделить ДНК, кодирующую ДНК-связывающую область myb, имеющую рамку из 3 повторов, посредством, например, ПЦР с использованием вырожденных праймеров, которые описаны в примере 1. Чтобы повысить специфичность ПЦР, также применимо конструирование второй пары праймеров ПЦР, которые имеют сайты отжига в более внутреннем положении последовательности-мишени, чем сайты отжига первых праймеров ПЦР. Может быть применима гнездовая ПЦР со второй парой праймеров. После определения нуклеотидной последовательности полученных в результате ДНК-продуктов применение быстрой амплификации концов кДНК (RACE, Dorit et al., Current protocols in molecular biology. Unit 15.6 (1992)) позволяет выделить и определить 5'- и 3'-концевые последовательности кДНК.
Подходящие растения, из которых выделяют или отделяют растительный белок 3Rmyb, охарактеризованный в настоящем изобретении, могут быть выбраны из двудольных растений. Указанные растения также можно использовать в качестве источников генов.
Применимые двудольные и однодольные растения, охарактеризованные в настоящем изобретении, без ограничения выбраны из любых видов, включая виды, широко известные как культивируемые растения или полезные растения. Растения включают зерновые культуры, бобовые, корнеплоды или клубнеплоды, орехи, семена, овощи, ягоды, фрукты или плодовые деревья, а также огородные культуры, садовые деревья или травы, плодоовощные виды, цветущие деревья и декоративные виды. Примеры растений включают виды Solanaceous, виды Cruciferous (Brassicaceous), виды Graminaceous, виды Leguminous, виды Liliaceous, виды Umbelliferous, виды Cucurbitaceous и другие виды, предпочтительно табак (Nicotiana tabacum), Arabidopsis thaliana, сою (Glycine max), бобы Aduki (небольшие красные бобы), зеленые бобы (Phaseolus vulgaris), горох (Lathyrus spp., включая снежный горошек (Pisum sativum)), кормовые бобы (Vicia faba), арахис (Arachis hypogaea), рис (Oryza sativa), пшеницу (Triticum aestivum), ячмень, рожь (Secale cereale), овес (Avena sativa), полевицу (Agrostis spp.), кукурузу (Zea mays), сорго (Sorghum bicolor, Sorghum vulgare), канолу (Brassica napus, Brassica rapa ssp.), рапс (Brassica napus), картофель (Solanum tuberosum), батат (Ipomoea batatus), таро (Colocasia spp., включая C. esculenta), конджак (Amorphophallus rivieri var. konjac), кассаву (Manihot spp., включая M. esculenta) и другие.
Настоящее изобретение относится к способам конструирования или получения молекул по меньшей мере с повышенной способностью активировать транскрипцию по сравнению со способностью, присущей представителю, выбранному из группы, состоящей из белков NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R1 и AtMYB3R4, которые включают в себя модификацию функции указанного белка, выбранного из NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R1 и AtMYB3R4, и отбор указанной требуемой молекулы по меньшей мере с такой повышенной активирующей способностью в отношении функции активатора транскрипции указанного белка.
В настоящем изобретении белок NtmybA1 (включая модифицированный белок NtmybA1 и NtmybA1-родственный белок), который служит в качестве молекулы с повышенной способностью активировать транскрипцию по сравнению со способностью, присущей белку NtmybA1, представляет собой по меньшей мере один представитель, выбранный из группы, состоящей из:
(a) молекулы, в которой последовательность из остатков аминокислот 459-1003 SEQ ID NO: 51 делетирована из белка NtmybA1, показанного в SEQ ID NO: 51,
(b) более желательно молекулы, в которой последовательность из остатков аминокислот 579-1003 SEQ ID NO: 51 делетирована из белка NtmybA1, показанного в SEQ ID NO: 51, или молекулы, в которой последовательность из остатков аминокислот 715-1003 SEQ ID NO: 51 делетирована из белка NtmybA1, показанного в SEQ ID NO: 51, и
(c) наиболее желательно молекулы, в которой последовательность из остатков аминокислот 641-1003 SEQ ID NO: 51 делетирована из белка NtmybA1, показанного в SEQ ID NO: 51.
В настоящем изобретении белок NtmybA2 (включая модифицированный белок NtmybA2 и NtmybA2-родственный белок), который служит в качестве молекулы с повышенной способностью активировать транскрипцию по сравнению со способностью, присущей белку NtmybA2, является по меньшей мере одним представителем, выбранным из группы, состоящей из:
(a) молекулы, в которой последовательность из остатков аминокислот 413-1042 SEQ ID NO: 53 делетирована из белка NtmybA2, показанного в SEQ ID NO: 53,
(b) более желательно молекулы, в которой последовательность из остатков аминокислот 569-1042 SEQ ID NO: 53 делетирована из белка NtmybA2, показанного в SEQ ID NO: 53, или молекулы, в которой последовательность из остатков аминокислот 705-1042 SEQ ID NO: 53 делетирована из белка NtmybA2, показанного в SEQ ID NO: 53, и
(c) наиболее желательно молекулы, в которой последовательность из остатков аминокислот 631-1042 SEQ ID NO: 53 делетирована из белка NtmybA2, показанного в SEQ ID NO: 53.
В настоящем изобретении белок Os3RmybA1 (включая модифицированный белок Os3RmybA1 и Os3RmybA1-родственный белок), который служит в качестве молекулы с повышенной способностью активировать транскрипцию по сравнению со способностью, присущей белку Os3RmybA1, является по меньшей мере одним представителем, выбранным из группы, состоящей из:
(a) молекулы, в которой последовательность из остатков аминокислот 426-993 SEQ ID NO: 32 делетирована из белка Os3RmybA1, показанного в SEQ ID NO: 32,
(b) более желательно молекулы, в которой последовательность из остатков аминокислот 575-993 SEQ ID NO: 32 делетирована из белка Os3RmybA1, показанного в SEQ ID NO: 32, или молекулы, в которой последовательность из остатков аминокислот 709-993 SEQ ID NO: 32 делетирована из белка Os3RmybA1, показанного в SEQ ID NO: 32,
(c) наиболее желательно молекулы, в которой последовательность из остатков аминокислот 635-993 SEQ ID NO: 32 делетирована из белка Os3RmybA1, показанного в SEQ ID NO: 32.
В настоящем изобретении белок AtMYB3R1 (включая модифицированный белок AtMYB3R1 и AtMYB3R1-родственный белок), который служит в качестве молекулы с повышенной способностью активировать транскрипцию по сравнению со способностью, присущей белку AtMYB3R1, является по меньшей мере одним представителем, выбранным из группы, состоящей из:
(a) молекулы, в которой последовательность из остатков аминокислот 583-776 SEQ ID NO: 75 делетирована из белка AtMYB3R1, показанного в SEQ ID NO: 75, или молекулы, в которой последовательность из остатков аминокислот 691-776 SEQ ID NO: 75 делетирована из белка AtMYB3R1, показанного в SEQ ID NO: 75, и
(b) желательно молекулы, в которой последовательность из остатков аминокислот 621-776 SEQ ID NO: 75 делетирована из белка AtMYB3R1, показанного в SEQ ID NO: 75.
В настоящем изобретении белок AtMYB3R4 (включая модифицированный белок AtMYB3R4 и AtMYB3R4-родственный белок), который служит в качестве молекулы с повышенной способностью активировать транскрипцию по сравнению со способностью, присущей белку AtMYB3R4, является по меньшей мере одним представителем, выбранным из группы, состоящей из:
(a) молекулы, в которой последовательность из остатков аминокислот 570-961 SEQ ID NO: 76 делетирована из белка AtMYB3R4, показанного в SEQ ID NO: 76, или молекулы, в которой последовательность из остатков аминокислот 667-961 SEQ ID NO: 76 делетирована из белка AtMYB3R4, показанного в SEQ ID NO: 76, и
(b) желательно молекулы, в которой последовательность из остатков аминокислот 608-961 SEQ ID NO: 76 делетирована из белка AtMYB3R4, показанного в SEQ ID NO: 76.
Настоящее изобретение относится к способам конструирования или получения молекул, которые служат в качестве доминантных негативных агентов против эндогенных молекул 3Rmyb растений, которые включают в себя
модифицирование функции представителя, выбранного из группы, состоящей из белков NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R1 и AtMYB3R4, и
отбор указанной желательной молекулы по меньшей мере с доминантной негативной активностью по отношению к указанной эндогенной молекуле 3Rmyb растений, при этом указанная доминантная негативная молекула включает молекулы по меньшей мере с пониженной способностью активировать транскрипцию или лишенные такой способности по сравнению со способностью, присущей указанному белку дикого типа, выбранному из группы, состоящей из NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R1 и AtMYB3R4.
В настоящем изобретении белок NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R1 или AtMYB3R4 (включая модифицированный белок NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R1 или AtMYB3R4, а также белок, родственный NtmybA1, NtmybA2, Os3RmybA1, AtMYB3R1 или AtMYB3R4), который служит в качестве доминантной негативной молекулы против по меньшей мере одного из эндогенных генов 3Rmyb, является по меньшей мере одним представителем, выбранным из группы, состоящей из:
(a) молекулы, в которой последовательность из остатков аминокислот 299-1003 SEQ ID NO: 51 делетирована из белка NtmybA1, показанного в SEQ ID NO: 51,
(b) более желательно молекулы, в которой последовательность из остатков аминокислот 186-1003 SEQ ID NO: 51 делетирована из белка NtmybA1, показанного в SEQ ID NO: 51,
(c) молекулы, в которой последовательность из остатков аминокислот 243-1042 SEQ ID NO: 53 делетирована из белка NtmybA2, показанного в SEQ ID NO: 53,
(d) более желательно молекулы, в которой последовательность из остатков аминокислот 188-1042 SEQ ID NO: 53 делетирована из белка NtmybA2, показанного в SEQ ID NO: 53,
(e) молекулы, в которой последовательность из остатков аминокислот 257-993 SEQ ID NO: 32 делетирована из белка Os3RmybA1, показанного в SEQ ID NO: 32,
(f) более желательно молекулы, в которой последовательность из остатков аминокислот 203-993 SEQ ID NO: 32 делетирована из белка Os3RmybA1, показанного в SEQ ID NO: 32,
(g) молекулы, в которой последовательность из остатков аминокислот 241-776 SEQ ID NO: 75 делетирована из белка AtMYB3R1, показанного в SEQ ID NO: 75,
(h) более желательно молекулы, в которой последовательность из остатков аминокислот 187-776 SEQ ID NO: 75 делетирована из белка AtMYB3R1, показанного в SEQ ID NO: 75,
(i) молекулы, в которой последовательность из остатков аминокислот 235-961 SEQ ID NO: 76 делетирована из белка AtMYB3R4, показанного в SEQ ID NO: 76, и
(j) более желательно молекулы, в которой последовательность из остатков аминокислот 181-961 SEQ ID NO: 76 делетирована из белка AtMYB3R4, показанного в SEQ ID NO: 76.
Свойства активатора транскрипции, проявляемые NtmybA2-родственной молекулой, имеющей делецию аминокислотной последовательности из остатков аминокислот 242-1042 или 188-1042 белка NtmybA2, были снижены по сравнению со свойствами белка NtmybA2 дикого типа; кроме того, в том случае, когда полноразмерную форму белка NtmybA2 экспрессировали совместно с NtmybA2-родственной молекулой, имеющей делецию аминокислотной последовательности из остатков аминокислот 188-1042 белка NtmybA2, свойство активатора транскрипции, проявляемое белком NtmybA2 отдельно, было подавлено, и кроме того, когда полноразмерную форму NtmybB экспрессировали совместно с молекулой, имеющей делецию аминокислотной последовательности из остатков аминокислот 188-1042 белка NtmybA2, свойство супрессора транскрипции, проявляемое белком NtmybB отдельно, было подавлено. Указанные факты свидетельствуют, что NtmybA2-родственная молекула, имеющая делецию аминокислотной последовательности из остатков аминокислот 243-1042 или 188-1042 белка NtmybA2, функционирует доминантно негативно против эндогенного растительного белка 3Rmyb.
Что касается терминов (слов), символов и/или сокращений, используемых в описании и на чертежах, то они должны соответствовать «биохимической номенклатуре комиссии ИЮПАК-ИЮБ» или являться основанными на значениях определений или стандартах, которые общеприняты и обычно используются в данной области. Типичные сокращения имеют следующие значения:
В отношении символов для аминокислот:
X: любая аминокислота из вышеуказанных аминокислот или любая конкретная аминокислота (когда указано специально) (Xaa)
В отношении символов для нуклеотидов:
неизвестный, любой другой нуклеотид или любой конкретный нуклеотид (когда указано специально).
ПРИМЕРЫ
Подробности настоящего изобретения описаны с помощью следующих примеров, но такие примеры представлены только в иллюстративных целях и для ссылочных вариантов настоящего изобретения. Указанные примеры описаны в данной публикации в целях иллюстрации конкретных вариантов осуществления настоящего изобретения и никоим образом не должны рассматриваться как ограничительные и ограничивающие объем описанного в данной публикации изобретения. В настоящем изобретении должно быть понятно, что могут быть осуществлены или реализованы различные варианты не отходя от сути и в рамках объема и концепции, раскрытой в данном описании.
Следует отметить, что общие способы, необходимые для рекомбинации генов, включая разрывы и лигирование ДНК, для трансформации или трансфекции E. coli, нуклеотидного секвенирования генов, гибридизации и другие, в принципе соответствуют способам в справочниках и руководствах для пользователей, прилагаемых к коммерчески доступным реагентам, устройствам, приборам или механизмам, применимым в каждой операции, и в руководствах по проведению экспериментов (например, «Molecular cloning (Maniatis T. et al., Cold Spring Harbor Laboratory Press)», включая J. Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (2nd Edition, 1989 and 3rd Edition, 2001)). Все примеры осуществляли или могут быть осуществлены, если не оговорено особо в данном описании, стандартными способами, которые хорошо известны и являются обычными для специалистов в данной области.
Пример 1
Выделение и секвенирование гена Os3RmybA1 риса
Осуществляли выделение кДНК, кодирующей 3Rmyb риса из риса с последующим секвенированием.
Чтобы выделить кДНК, конструировали вырожденные праймеры на основе аминокислотных последовательностей в каждом ДНК-связывающем домене myb белков 3Rmyb табака, NtmybA1, NtmybA2 и NtmybB. ПЦР осуществляли с вырожденными праймерами в комбинации с используемой в качестве матрицы кДНК, полученной из каллусов риса. Чтобы повысить специфичность ПЦР с вырожденными праймерами, проводили гнездовую ПЦР. В результате успешно осуществили выделение фрагментов кДНК, имеющих 3 повтора ДНК-связывающего домена myb.
Полученные в результате фрагменты подвергали 5'-RACE и 3'-RACE и каждую концевую последовательность полноразмерной кДНК секвенировали.
Выделение кДНК, содержащей полноразмерный структурный ген, было успешным в случае праймеров, сконструированных на основе 5'-концевой последовательности и 3'-концевой последовательности. Подробное описание приведено ниже.
(1) Очистка мРНК и синтез кДНК
С зерен культивируемого риса var. Nipponbare (japonica) удаляли шелуху, стерилизовали антиформином, затем помещали в среду N6CI (неорганические соли N6 и витамины N6 (Chu et al. (1975), Sientia Sinica 18: 659) с добавлением 30 г/л сахарозы, 2 мг/л 2,4-D и 2 г/л (GelriteTM, pH 5,8), и инкубировали для того, чтобы индуцировать эмбриогенные каллусы, происходящие из щитка.
Суммарную РНК экстрагировали из каллусов (130 мг), используя мини-набор для растений RNeasyTM (QIAGEN). Полученную в результате суммарную РНК (50 мкг) подвергали очистке, используя системы выделения мРНК PolyATtractTM (Promega), чтобы получить мРНК. Очищенную мРНК концентрировали посредством осаждения этанолом и затем использовали для синтеза кДНК с помощью системы для синтеза первой нити для ОТ-ПЦР SuperscriptTM (Invitrogen).
(2) Клонирование посредством ПЦР с вырожденными праймерами, основанными на доменах Myb
ПЦР осуществляли с аликвотой (2 мкл) синтезированной кДНК (50 мкл).
В ПЦР использовали праймеры:
и
Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan), буфер для реакции, прилагаемый к TaKaRa Ex TaqTM, 200 мкМ каждого из dATP, dTTP, dCTP и dGTP и 10 мкМ каждого из DEGmybF и DEGmybR. Амплификацию осуществляли, используя систему для ПЦР GeneAmpTM 9700 (PE Applied Biosystems) с установкой повторяющихся стадий при 94°C в течение 30 сек, при 42°C в течение 30 сек и при 72°C в течение 30 сек, всего 35 циклов. После окончания реакции продукты подвергали очистке с помощью набора для очистки продуктов ПЦР QIAquickTM (QIAGEN).
Гнездовую ПЦР осуществляли с аликвотой (1 мкл) очищенного реакционного раствора ПЦР в качестве матрицы.
Праймеры, используемые во второй ПЦР, представляли собой вырожденные праймеры (сконструированные к областям внутри DEGmybF и DEGmybR),
и
Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan), буфер для реакции, прилагаемый к TaKaRa Ex TaqTM, 200 мкМ каждого из dATP, dTTP, dCTP и dGTP и 10 мкМ каждого из DEGmybF2 и DEGmybR2. Амплификацию осуществляли, используя систему для ПЦР GeneAmpTM 9700 (PE Applied Biosystems) с установкой повторяющихся стадий при 94°C в течение 30 сек, при 58°C в течение 30 сек и при 72°C в течение 30 сек, всего 35 циклов. После окончания реакции раствор для реакции ПЦР подвергали очистке с помощью набора для очистки продуктов ПЦР QIAquickTM (QIAGEN).
Затем гнездовую ПЦР осуществляли с аликвотой (1 мкл) очищенного реакционного раствора второй ПЦР в качестве матрицы.
Праймеры, используемые в третьей ПЦР, представляли собой вырожденные праймеры (сконструированные к областям внутри DEGmybF2 и DEGmybR2),
и
Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan), буфер для реакции, прилагаемый к TaKaRa Ex TaqTM, 200 мкМ каждого из dATP, dTTP, dCTP и dGTP и 10 мкМ каждого из DEGmybF3 и DEGmybR3. Амплификацию осуществляли, используя систему для ПЦР GeneAmpTM 9700 (PE Applied Biosystems) с установкой повторяющихся стадий при 94°C в течение 30 сек, при 56°C в течение 30 сек и при 72°C в течение 30 сек, всего 30 циклов. После окончания реакции раствор для реакции ПЦР подвергали очистке с помощью набора для очистки продуктов ПЦР QIAquickTM (QIAGEN). Полученный в результате раствор для реакции ПЦР анализировали, используя агарозные гели. В результате подтвердили, что амплифицированный продукт представлял собой ДНК длиной примерно 300 п.н. Затем полученный фрагмент ДНК подвергали TA-клонированию в pCR4-TOPOTM (Invitrogen). Вставки ДНК из 3 клонов секвенировали на уровне нуклеотидов с использованием праймера T7, 5'- TAATACGACTCACTATAGGG -3' (SEQ ID NO: 7), получая SEQ ID NO: 8, SEQ ID NO: 9, и SEQ ID NO: 10.
(3) Секвенирование 5'-концевой последовательности кДНК 3Rmyb риса
Чтобы получить полноразмерную кДНК гена 3Rmyb риса, включая фрагмент ДНК-связывающего домена 3Rmyb, который выделяли, как описано выше в (1), проводили амплификацию 5'-концов для указанной кДНК. Выделение 5'-концов ДНК осуществляли посредством 5'-RACE, используя набор GeneRacerTM (Invitrogen). Коротко, суммарную РНК экстрагировали из эмбриогенных каллусов, происходящих из щитков (130 мг) (полученных согласно указанному выше способу (1)), с использованием мини-набора для растений RNeasyTM (QIAGEN). Синтез кДНК осуществляли, используя набор GeneRacerTM (Invitrogen), с аликвотой (3 мкг) экстрагированной суммарной РНК в качестве матрицы. ПЦР осуществляли с указанной кДНК в качестве матрицы в комбинации с праймерами (сконструированными к SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10),
и
Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan). Амплификацию осуществляли, используя систему для ПЦР GeneAmpTM 9700 (PE Applied Biosystems) с установкой для осуществления начальной стадии при 94°C в течение 2 мин, затем для повторения стадий при 94°C в течение 30 сек и при 72°C в течение 3 мин, всего 5 циклов, следующих стадий при 94°C в течение 30 сек и при 70°C в течение 3 мин, всего 5 циклов, и стадий при 94°C в течение 30 сек, при 68°C в течение 30 сек и при 72°C в течение 3 мин, всего 25 циклов, и для осуществления конечной стадии при 72°C в течение 10 мин. ПЦР осуществляли с аликвотой (1 мкл) полученного в результате раствора для реакции ПЦР в качестве матрицы в комбинации с праймерами
и
Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan). Амплификацию осуществляли, используя систему для ПЦР GeneAmpTM 9700 (PE Applied Biosystems) с установкой для осуществления начальной стадии при 94°C в течение 2 мин, затем для повторения стадий при 94°C в течение 30 сек и при 72°C в течение 3 мин, всего 5 циклов, следующих стадий при 94°C в течение 30 сек и при 70°C в течение 3 мин, всего 5 циклов, и стадий при 94°C в течение 30 сек, при 68°C в течение 30 сек и при 72°C в течение 3 мин, всего 25 циклов, и для осуществления конечной стадии при 72°C в течение 10 мин. После окончания реакции раствор для реакции ПЦР подвергали очистке с использованием набора для очистки продуктов ПЦР QIAquickTM (QIAGEN). Амплифицированную ДНК подвергали TA-клонированию в pCR4-TOPOTM (Invitrogen). Полученную в результате вставку ДНК из плазмиды секвенировали на уровне нуклеотидов, используя праймер
и
Нуклеотидная последовательность клона №26 показана в SEQ ID NO: 16. SEQ ID NO: 17 представляет собой нуклеотидную последовательность клона №27.
(4) Секвенирование 3'-концевой последовательности кДНК 3Rmyb риса
Чтобы получить полноразмерную кДНК гена 3Rmyb риса, включая фрагмент ДНК-связывающего домена 3Rmyb, который выделяли как описано выше в (1), проводили амплификация 3'-концов для указанной кДНК. 3'-конец секвенировали посредством 3'-RACE, используя набор GeneRacerTM (Invitrogen). Коротко, суммарную РНК, экстрагировали из эмбриогенных каллусов, происходящих из щитков (130 мг) (полученных согласно указанному выше способу (1)), с использованием мини-набора для растений RNeasyTM (QIAGEN). Синтез кДНК осуществляли, используя набор GeneRacerTM (Invitrogen), с аликвотой (5 мкг) экстрагированной суммарной РНК в качестве матрицы. ПЦР осуществляли с указанной кДНК в качестве матрицы в комбинации с праймерами (сконструированными к SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10),
и
Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan). Амплификацию осуществляли, используя систему для ПЦР GeneAmpTM 9700 (PE Applied Biosystems) с установкой для осуществления начальной стадии при 94°C в течение 2 мин, затем для повторения стадий при 94°C в течение 30 сек и при 72°C в течение 3 мин, всего 5 циклов, следующих стадий при 94°C в течение 30 сек и при 70°C в течение 3 мин, всего 5 циклов, и стадий при 94°C в течение 30 сек, при 68°C в течение 30 сек и при 72°C в течение 3 мин, всего 25 циклов, и для осуществления конечной стадии при 72°C в течение 10 мин. ПЦР осуществляли с аликвотой (1 мкл) полученного в результате раствора для реакции ПЦР в качестве матрицы в комбинации с праймерами
и
Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan). Амплификацию осуществляли, используя систему для ПЦР GeneAmpTM 9700 (PE Applied Biosystems) с установкой для осуществления начальной стадии при 94°C в течение 2 мин, затем для повторения стадий при 94°C в течение 30 сек и при 72°C в течение 3 мин, всего 5 циклов, следующих стадий при 94°C в течение 30 сек и при 70°C в течение 3 мин, всего 5 циклов, и стадий при 94°C в течение 30 сек, при 68°C в течение 30 сек и при 72°C в течение 3 мин, всего 25 циклов, и для осуществления конечной стадии при 72°C в течение 10 мин. После окончания реакции раствор для реакции ПЦР подвергали очистке с использованием набора для очистки продуктов ПЦР QIAquickTM (QIAGEN). Амплифицированную ДНК подвергали TA-клонированию в pCR4-TOPOTM (Invitrogen). Полученную в результате вставку ДНК из плазмиды секвенировали на уровне нуклеотидов, используя праймер
и
В результате определяли каждую нуклеотидную последовательность обоих 5'- и 3'-концов фрагмента вставки ДНК. Нуклеотидная последовательность 5'-стороны клона № 31 показана в SEQ ID NO: 22. SEQ ID NO: 23 представляет собой нуклеотидную последовательность 3'-стороны клона №23.
(5) Выделение кДНК, содержащей полноразмерный структурный ген 3Rmyb риса, и нуклеотидное секвенирование
Суммарную РНК экстрагировали из эмбриогенных каллусов, происходящих из щитков (130 мг) (полученных согласно указанному выше способу (1)), используя мини-набор для растений RNeasyTM (QIAGEN). Синтез кДНК осуществляли, используя систему для синтеза первой нити для ОТ-ПЦР SuperscriptTM (Invitrogen) с аликвотой (5 мкг) экстрагированной суммарной РНК в качестве матрицы.
ПЦР осуществляли с аликвотой (1 мкг) синтезированной кДНК (50 мкл). В ПЦР использовали праймеры:
и
Реакцию осуществляли в общем объеме 50 мкл, используя ДНК-полимеразу PfuTurboTM для «горячего старта» (Stratagene), буфер для реакции, прилагаемый к ДНК-полимеразе PfuTurboTM для «горячего старта», 200 мкМ каждого из dATP, dTTP, dCTP и dGTP и 1 мкМ каждого из OsA1-1F и OsA1-2R. Амплификацию осуществляли, используя систему для ПЦР GeneAmpTM 9700 (PE Applied Biosystems) с установкой для осуществления начальной стадии при 95°C в течение 2 мин, затем для повторения стадий при 95°C в течение 30 сек, при 60°C в течение 30 сек и при 72°C в течение 4 мин, всего 40 циклов, и для осуществления конечной стадии при 72°C в течение 10 мин. После окончания реакции раствор для реакции ПЦР подвергали очистке с использованием набора для очистки продуктов ПЦР QIAquickTM (QIAGEN).
Когда раствор для реакции ПЦР анализировали в агарозных гелях, было подтверждено, что амплифицированная ДНК представляла собой один фрагмент длиной примерно 3 т.п.н. Поэтому данный фрагмент ДНК подвергали TA-клонированию в pCR4-TOPOTM (Invitrogen). Полученную в результате плазмиду pCR4-Os3RmybA1 с данной вставкой ДНК секвенировали с использованием следующих праймеров:
Полученная в результате нуклеотидная последовательность показана в SEQ ID NO: 31.
Пример 2
Аминокислотная последовательность, кодируемая ДНК SEQ ID NO: 31, показана в SEQ ID NO: 32. Аминокислотная последовательность SEQ ID NO: 32 содержит три повтора ДНК-связывающего домена myb, и ген в случае указанной кодирующей последовательности обозначен «Os3RmybA1». Когда обе последовательности, аминокислотная последовательность белка Os3RmybA1 и предполагаемая аминокислотная последовательность (SEQ ID NO: 49), рассчитанная на основе информационных данных о геноме, зарегистрированных с номером доступа NO: BAB78687 в DDBJ (банк данных о ДНК Японии), оптимально выровнены, очевидно выявляется, что N-концевые области являются высоко гомологичными между аминокислотной последовательностью, кодируемой кДНК Os3RmybA1 и аминокислотной последовательностью BAB78687, тогда как C-концевые области отличаются друг от друга. Область, расположенная ниже положения аминокислоты 783 в BAB78687, отличается от Os3RmybA1, и BAB78687 является белком, состоящим из 787 аминокислот, тогда как Os3RmybA1 состоит из 993 аминокислот. Следовательно предполагается, что сайты сплайсинга BAB78687 были ошибочно рассчитаны, когда структурную область BAB78687 определяли на основе геномной последовательности (фиг.1-3).
Пример 3
Свойство Os3RmybA1 как активатора транскрипции
Функцию выделенного Os3RmybA1 подтверждали на основании служить активатором транскрипции, проявляемой геном CYM, несущим последовательность MSA в области промотора. Коротко, протопласты линии клеток табака BY2 котрансфицировали плазмидами, оптимизированными для экспрессии Os3RmybA1, управляемой промотором 35S вируса мозаики цветной капусты (CaMV), и плазмидами, несущими репортерный ген, в котором промотор CYM слит с геном люциферазы. Осуществляли анализ временной экспрессии, наблюдая активности люциферазы, для количественного определения способности Os3RmybA1 служить в качестве активатора транскрипции.
(1) Конструирование плазмид
Конструирование экспрессирующих плазмид
Конструирование pEXP-Os3RmybA1
Фрагмент ДНК (содержащий Os3RmybA1), вырезанный из pCR4-Os3RmybA1 расщеплением EcoRI, встраивали в смысловом направлении в сайт, полученный расщеплением EcoRI в pEXP35S, чтобы создать pEXP-Os3RmybA1. Указанная плазмида pEXP-Os3RmybA1 является плазмидой, оптимизированной для экспрессии полноразмерной ОРС Os3RmybA1, управляемой промотором 35S вируса мозаики цветной капусты (CaMV).
Плазмиды, которые по существу функционально эквивалентны pEXP-Os3RmybA1, также могут быть сконструированы следующим образом:
Выступающий конец ДНК, вырезанной из pBI221 (Clontech) расщеплением EcoRI и SacI, затупляют фрагментом Кленова и затем встраивают в сайт, полученный расщеплением XhoI с последующим затуплением фрагментом Кленова конца, отрезанного XhoI от pBluescript (SK-), чтобы создать плазмиду pTN. Фрагмент ДНК, который вырезают из pBI221 расщеплением PstI и затупляют полученный в результате выступающий конец фрагментом Кленова с последующим расщеплением XbaI, встраивают в сайт, полученный расщеплением NotI и затуплением фрагментом Кленова выступающего конца, с последующим отщеплением с помощью XbaI из pTN, чтобы создать плазмиду pP35S. То есть плазмида pP35S является плазмидой с множественными сайтами рестрикции между промотором 35S CaMV и терминатором синтетазы нопалина (NOS). Фрагмент ДНК (содержащий Os3RmybA1), вырезанный из pCRР4-Os3RmybA1 расщеплением EcoRI, встраивают в смысловом направлении в сайт, полученный расщеплением EcoRI в pP35S, чтобы создать pP35S-Os3RmybA1. pP35S-Os3RmybA1 является плазмидой, оптимизированной для экспрессии полноразмерной ОРС Os3RmybA1, управляемой промотором 35S CaMV.
Конструирование плазмиды pEXP-GUS
Фрагмент ДНК, полученный расщеплением SacI и затуплением полученного в результате выступающего конца фрагментом Кленова с последующим отщеплением посредством HindIII от pBI-121 (Clontech), встраивали в сайт, полученный расщеплением EcoRI и затуплением полученного в результате выступающего конца фрагментом Кленова с последующим отщеплением HindIII от pEXP35S, чтобы создать pEXP-GUS. pEXP-GUS является плазмидой, оптимизированной для экспрессии GUS, управляемой промотором 35S CaMV. К применимым плазмидам, которые по существу являются функционально эквивалентными pEXP-GUS, относится pBI221 (Clontech).
Конструирование плазмиды R-LUC
Фрагмент ДНК фрагмент, полученный расщеплением BamHI и NheI плазмидного вектора pRL-null (Promega), встраивали в сайт, полученный расщеплением XbaI и BamHI в pBI-221 (Clontech). Полученную в результате плазмиду расщепляли XbaI и SacI, фрагментом Кленова затупляли полученный в результате выступающий конец с последующим удалением фрагментов ДНК. Полученный в результате продукт подвергали самолигированию, чтобы создать плазмиду R-LUC. Плазмида R-LUC является плазмидой, оптимизированной для экспрессии люциферазы, полученной из Renilla (R-LUC), управляемой промотором 35S CaMV 35S.
Конструирование плазмиды промотор CYM-LUC
Фрагмент ДНК, полученный путем расщепления HindIII и SacI из плазмиды pDO432 (Nishiuchi et al., Plant Mol. Biol., 29: 599 (1995)), встраивали в сайт, полученный расщеплением HindIII и SacI, с последующим удалением фрагментов ДНК, содержащих область промотора 35S CaMV, из pBI221 (Clontech), чтобы создать pUC-LUC. Области промотора CYM амплифицировали в ПЦР, используя геномную ДНК (полученную из Catharanthus roseus согласно обычному способу) в качестве матрицы. В ПЦР использовали праймеры
и
Амплифицированную область промотора CYM расщепляли BamHI и HindIII и встраивали в сайт, полученный расщеплением BamHI и HindIII, в pUC-LUC, чтобы создать плазмиду промотор CYM-LUC. То есть плазмида промотор CYM-LUC является плазмидой, оптимизированной для экспрессии люциферазы (LUC), управляемой промотором CYM, содержащим последовательность MSA в качестве регуляторной последовательности в трех положениях.
(2) Получение протопластов BY-2, перенос генов с помощью плазмид и анализ активности LUC
Протопласты получали из линии культивируемых клеток табака BY2 (3-дневного возраста; после пересева культуры в свежую жидкую среду LSD (100 мл, Nagata et al. (1981), Mol. Gen. Genet. 184: 161)) согласно способу Evans et al. (Evans et al. (1983), Int. Rev. Cytol. 33: 53).
Коротко, клетки BY2 собирали из жидкой среды LSD центрифугированием при 2000 об/мин при комнатной температуре, затем смешивали с 100 мл среды N2 (1% целлюлазы «ONOZUKA» RS (Yakult Honsha Co., Ltd., Japan), 0,5% гемицеллюлазы (SIGMA), 0,1% пектолиазы Y-23 (Kikkoman Co., Japan), 7,4 г/л CaCl2·2H2O, 1,6 г/л ацетата натрия, 45 г/л маннита, pH 5,7), и подвергали культивированию с осторожным вращением при 27°C в темноте, чтобы переварить клеточные стенки. Через три часа клетки собирали центрифугированием при 500 об/мин при комнатной температуре. Собранные клетки смешивали с 50 мл среды N3 (7,4 г/л CaCl2·2H2O, 1,6 г/л ацетата натрия, 45 г/л маннита, pH 5,7) и промывали. Клетки собирали центрифугированием при 500 об/мин при комнатной температуре и суспендировали в 40 мл среды N4 (4,6 г/л смеси солей для растений Murashige и Skoog (Wako Pure Chemical Industries, Ltd, Japan), 100 мг/л казаминовых кислот, 100 мг/л миоинозитола, 2,8 г/л L-пролина, 97,6 мг/л MES, 1 мг/л тиамин-HCl, 357 мг/л KH2PO4, 102,6 г/л сахарозы, pH 5,7). Суспензию клеток центрифугировали при 700 об/мин при комнатной температуре в течение 10 мин, чтобы отделить протопласты от верхнего слоя среды.
Трансфекцию плазмидной ДНК в протопласты осуществляли прямым переносом генов, опосредованным ПЭГ (Bilang et al. (1994), In Plant Molecular Biology Manual, pp. A1, 1-16).
Коротко, полученные в результате протопласты промывали 40 мл W5 (154 мМ NaCl, 124 мМ CaCl2, 5 мМ KCl, 5 мМ глюкоза, pH 5,8), подвергали центрифугированию при 500 об/мин в течение 3 мин при комнатной температуре, чтобы отделить протопласты. Указанную стадию промывки повторяли 3 раза. После промывки суспензию протопластов с использованием MMM (15 мМ MgCl2, 0,1% MES, 0,5 М маннита, pH 5,8) доводили до концентрации клеток 2×105 клеток/мл. Аликвоты (250 мкл) суспензии протопластов в MMM разносили в каждую из пробирок и смешивали с 20 мкл раствора плазмидной ДНК. После осторожного перемешивания добавляли раствор ПЭГ (250 мкл; ПЭГ4000 добавляли к 0,4 М раствору маннита-0,1 М Ca(NO3)2, образуя 40% мас./об. раствор ПЭГ, который доводили до pH 8 и затем автоклавировали) к обработанной плазмидной ДНК суспензии протопластов и затем осторожно перемешивали. Наконец к суспензии протопластов добавляли 5 мл среды LSD с добавлением 0,4 М маннита и инкубировали в течение 20 час в темноте. После культивирования клетки собирали центрифугированием при 500 об/мин в течение 3 мин и подвергали анализу активности LUC и R-LUC. Субстрат, используемый в указанных анализах, представлял собой двойную люциферазную репортерную систему для анализа (Promega). Наблюдение осуществляли с помощью люминометра LB955 (BERTHOLD).
(3) Активация промотора CYM посредством Os3RmybA1
Осуществляли котрансфекцию плазмидой R-LUC для управляемой промотором 35S CaMV экспрессии люциферазы Renilla, чтобы обеспечить внутренний контроль эффективности трансфекции в образцах с переносом генов. Активность LUC в каждом случае калибровали относительно контрольной активности люциферазы Renilla. Плазмиды, используемые в данном случае, представляют собой pEXP-Os3RmybA1 для управляемой промотором 35S CaMV экспрессии полноразмерного Os3RmybA1, pEXP-GUS для управляемой промотором 35S CaMV экспрессии GUS, вышеуказанную плазмиду промотор CYM-LUC и плазмиду R-LUC. Трансфекцию осуществляли в пяти повторах. Использовали следующие комбинации плазмид:
(i) комбинация, не содержащая эффекторной плазмиды:
плазмида промотор CYM-LUC (10 мкг/1 образец) + плазмида pEXP-GUS (10 мкг/1 образец) + плазмида R-LUC (1 мкг/1 образец),
(ii) комбинация с pEXP-Os3RmybA1 в качестве эффекторной плазмиды:
плазмида промотор CYM-LUC (10 мкг/1 образец) + плазмида pEXP-Os3RmybA1 (10 мкг/1 образец) + плазмида R-LUC (1 мкг/1 образе),
(iii) комбинация с pEXP-NtmybA2 в качестве эффекторной плазмиды:
плазмида промотор CYM-LUC (10 мкг/1 образец) + плазмида pEXP-NtmybA2 (10 мкг/1 образец) + плазмида R-LUC (1 мкг/1 образец).
Если удельную ферментативную активность LUC принять за «1» в случае трансфекции комбинацией (i) (уровни люциферазной активности стандартизуют в соответствии с уровнями активности люциферазы Renilla), то удельная активность LUC в комбинации (ii) увеличивается примерно в 2,5 раза. Подобным образом удельная активность LUC в комбинации (iii) также увеличивается примерно в 2,5 раза (фиг.4). Описано, что Os3RmybA1 активирует транскрипцию промотора CYM. Неожиданно несмотря на то что Os3RmybA1 является кДНК, клонированной из риса, она проявляет способность активировать транскрипцию в клетках табака в такой же степени, как NtmybA2 табака. Тот факт, что Os3RmybA1, выделенный из риса, функционирует в клетках табака так же, как NtmybA2 табака, ясно свидетельствует о том, что механизмы регуляции специфичной для фаз G2/M экспрессии генов являются консервативными у двудольных и однодольных растений.
Пример 4
Выделение ДНК, кодирующей каждый из NtmybA1, NtmybA2 и NtmybB
Нуклеотидная последовательность ДНК, кодирующая NtmybA1, которую использовали в данном изобретении, показана в SEQ ID NO: 50, а аминокислотная последовательность NtmybA1 в SEQ ID NO: 51. Нуклеотидная последовательность ДНК, кодирующая NtmybA2, также показана в SEQ ID NO: 52, а аминокислотная последовательность NtmybA2 в SEQ ID NO: 53. Кроме того, нуклеотидная последовательность ДНК, кодирующая NtmybB, которую использовали в данном изобретении, показана в SEQ ID NO: 54, а аминокислотная последовательность NtmybB в SEQ ID NO: 55.
Каждую ДНК, кодирующую NtmybA1, NtmybA2 и NtmybB, выделяли с помощью дрожжевой одногибридной системы (Clontech) (Ito et al., Plant Cell, 13:1891 (2001)). Растительную кДНК, полученную из культивируемых клеток BY2 2-дневного возраста, встраивали в плазмиду pGAD10, чтобы сконструировать библиотеки кДНК. Создали дефицитный по HIS штамм дрожжей, который содержит хромосомы, несущие инсерцию репортерных генов, в которых MSA-содержащий промотор, промотор NACK1, был функционально слит с геном, отвечающим за биосинтез гистидина (HIS3), и трансфицировали указанными выше библиотеками кДНК. Трансформированные дрожжевые клетки подвергали селекции на среде, не содержащей гистидина, и из выращенных колоний извлекали три клона (плазмиды OH53, OH60 и OH88). Секвенировали каждую нуклеотидную последовательность вставки кДНК в трех плазмидах (OH53, OH60 и OH88) и получили ДНК, кодирующие NtmybA1, NtmybA2 и NtmybB. Вставка в плазмиде OH53 является фрагментом ДНК, кодирующим NtmybA1. ДНК-вставка в плазмиде OH60 является ДНК, кодирующей полноразмерный NtmybA2. ДНК, кодирующая полноразмерных NtmybB, находилась в плазмиде OH88 в качестве вставки. Так как OH53 не содержала полноразмерной кодирующей области, то определение 3'-концов осуществляли посредством 3'-RACE. В результате получили плазмиду pGEMe-OH53i6, имеющую вставку полноразмерной кДНК NtmybA1.
Подходящим может быть простое выделение указанных ДНК с использованием ПЦР или методики гибридизации. Когда используют гибридизацию, кДНК может быть получена из клеток BY2 в период экспоненциального роста и затем клонирована в плазмидах или фагах для конструирования библиотек, которые могут быть соответствующим образом подвержены стадиям скрининга. Применимые зонды могут быть получены на основе информации о ДНК SEQ ID NO: 50 для NtmybA1, ДНК SEQ ID NO: 52 для NtmybA2 и ДНК SEQ ID NO: 54 для NtmybB.
В том случае, когда выделение осуществляют с использованием ПЦР, кДНК, полученная из клеток BY2 в период экспоненциального роста, может быть использована в качестве матрицы. Праймеры могут быть сконструированы на основе информации о ДНК SEQ ID NO: 50 для NtmybA1, ДНК SEQ ID NO: 52 для NtmybA2 и ДНК SEQ ID NO: 54 для NtmybB. В примерах после тех, в которых описано конструирование плазмид согласно изобретению, NtmybA2 и NtmybB могут быть вырезаны из OH60, OH88 и других, и фрагменты ДНК, кодирующие NtmybA2 и NtmybB, могут быть соответствующим образом получены с использованием ПЦР-праймеров с включением подходящих сайтов рестрикции.
Пример 5
Конструирование плазмид pEXP-NtmybA2 и pEXP-NtmybB
Конструировали плазмиды pEXP-NtmybA2 и pEXP-NtmybB для управляемой промотором 35S CaMV экспрессии NtmybA2 и NtmybB соответственно. Коротко фрагменты ДНК, вырезанные при расщеплении SalI из OH60 и OH88, встраивали в смысловом направлении в сайт, полученный расщеплением SalI, в pEXP35S, чтобы сконструировать плазмиды pEXP-NtmybA2 и pEXP-NtmybB для управляемой промотором 35S CaMV экспрессии NtmybA2 и NtmybB, соответственно.
Плазмиды, которые по существу функционально эквивалентны указанным плазмидам, также могут быть сконструированы следующим образом:
Фрагмент ДНК, вырезанный при расщеплении SalI из OH60 или OH88, встраивают в сайт, полученный расщеплением SalI плазмиды pP35S, чтобы создать pP35S-NtmybA2 или pP35S-NtmybB. То есть pP35S-NtmybA2 и pP35S-NtmybB являются плазмидами для управляемой промотором 35S CaMV экспрессии NtmybA2 и NtmybB соответственно.
Пример 6
Функциональная область NtmybA2 модулирует способность активировать транскрипцию
NtmybA2 является активатором транскрипции гена NACK1 и гена CYM. Однако было неизвестно, какая область является функциональной областью, вовлеченной в способность белка NtmybA2 активировать транскрипцию. Для осуществления поиска такой функциональной области конструировали серию укороченных на C-конце мутантных вариантов NtmybA2. Анализировали способность указанных мутантов активировать транскрипцию гена NACK1 и определяли функциональную область NtmybA2, которая модулирует способность активировать транскрипцию.
(1) Конструирование плазмид
Конструирование соответствующих плазмид для каждого укороченного на C-конце мутанта белка NtmybA2
Для исследования области NtmybA2, которая функционирует в активации транскрипции гена, создавали следующие мутантные белки NtmybA2 с C-концевой делецией, в которых аминокислотная последовательность NtmybA2 была укорочена на C-конце:
(i) pEXP-NtmybA2T1 (отсутствует область от аминокислоты 705 до C-конца),
(ii) pEXP-NtmybA2T2 (отсутствует область от аминокислоты 631 до C-конца),
(iii) pEXP-NtmybA2T3 (отсутствует область от аминокислоты 569 до C-конца),
(iv) pEXP-NtmybA2ΔEcoRI (отсутствует область от аминокислоты 413 до C-конца),
(v) pEXP-NtmybA2T4 (отсутствует область от аминокислоты 243 до C-конца),
(vi) pEXP-NtmybA2T5 (отсутствует область от аминокислоты 188 до C-конца).
Для плазмид (i), (ii), (iii), (v) и (vi) каждый делеционный фрагмент ДНК получали в ПЦР, используя pEXP-NtmybA2 в качестве матрицы. В ПЦР использовали следующие праймеры:
для (i) с праймером A2-T1-TAG:
ПЦР-амплифицированные фрагменты ДНК, кодирующие соответствующие мутанты NtmybA2 с C-концевой делецией, расщепляли SalI и затем встраивали в смысловом направлении в сайт, полученный расщеплением SalI плазмиды pEXP35S, чтобы создать плазмиды (i), (ii), (iii), (v) и (vi), соответственно.
Плазмиду (iv) создавали расщеплением pEXP-NtmybA2 с использованием EcoRI с последующим самолигированием после удаления полученной в результате вырезанной ДНК.
Плазмиды, которые являются по существу функционально эквивалентными любой из плазмид (i)-(vi), также могут быть сконструированы следующим образом:
(vii) pP35S-NtmybA2T1 (отсутствует область от аминокислоты 705 до C-конца),
(viii) pP35S-NtmybA2T2 (отсутствует область от аминокислоты 631 до C-конца),
(ix) pP35S-NtmybA2T3 (отсутствует область от аминокислоты 569 до C-конца),
(x) pP35S-NtmybA2ΔEcoRI (отсутствует область от аминокислоты 413 до C-конца),
(xi) pP35S-NtmybA2T4 (отсутствует область от аминокислоты 243 до C-конца),
(xii) pP35S-NtmybA2T5 (отсутствует область от аминокислоты 188 до C-конца).
Для плазмид (vii), (viii), (ix), (xi) и (xii) делеционные фрагменты ДНК амплифицировали в ПЦР, используя pP35S-NtmybA2 в качестве матрицы.
В ПЦР использовали праймеры:
для (vii) с праймером A2-T1-TAG:
ПЦР-амплифицированные фрагменты ДНК, кодирующие соответствующие мутанты NtmybA2 с C-концевой делецией, расщепляли SalI и затем встраивали в смысловом направлении в сайт, полученный расщеплением SalI плазмиды pP35S, чтобы создать плазмиды (vii), (viii), (ix), (xi) и (xii) соответственно. Плазмиду (x) создавали частичным расщеплением pP35S-NtmybA2 с использованием EcoRI с последующим самолигированием после затупления выступающего конца фрагментом Кленова.
Конструирование плазмиды для промотора NACK1-LUC
Фрагмент ДНК, полученный при расщеплении HindIII и SacI из плазмиды pDO432 (Nishiuchi et al., Plant Mol. Biol., 29: 599(1995)), встраивали в сайт, полученный HindIII-SacI-расщеплением pBI221 (Clontech) с последующим удалением фрагментов ДНК, содержащих область промотора 35S CaMV, чтобы создать pUC-LUC. Область промотора NACK1 амплифицировали в ПЦР, используя геномную ДНК (полученную из культивируемых клеток табака BY2 согласно обычным способам) в качестве матрицы.
В ПЦР используют праймеры:
Амплифицированную область промотора NACK1 расщепляли BamHI и HindIII и затем встраивали в сайт, полученный расщеплением BamHI и HindIII плазмиды pUC-LUC, чтобы создать плазмиду промотор NACK1-LUC. То есть плазмида промотор NACK1-LUC является плазмидой для экспрессии LUC, управляемой промотором NACK1, содержащим в качестве регуляторных последовательностей мотивы MSA в двух положениях.
(2) Изменение способности активировать транскрипцию мутантных белков NtmybA2 с C-концевыми делециями
Трансфекцию плазмид в протопласты BY-2 осуществляли согласно способу примера 3 (2). Эффекторными плазмидами, используемыми в данном случае, были указанные выше плазмиды, (1) (i)-(vi), для экспрессии делеционных мутантов NtmybA2, pEXP-NtmybA2 для экспрессии полноразмерного NtmybA2 и pEXP-GUS для экспрессии GUS. Репортером, используемым в данном случае, была плазмида промотор NACK1-LUC. Активацию транскрипции репортерного гена оценивали посредством измерения уровней активности LUC. Активности LUC и R-LUC анализировали таким же образом, как в примере 3. Каждая удельная активность LUC выражена относительно стандартизованного значения активности LUC в соответствии с уровнем активности R-LUC.
Когда удельную активность LUC принимали за «1» в случае эффекторной плазмиды pEXP-GUS, то наблюдали, что удельная активность LUC для pEXP-NtmybA2 была примерно в 4 раза выше. Когда использовали плазмиды (i)-(iii), то наблюдали, что удельная активность LUC повышалась относительно случая с pEXP-NtmybA2; в частности она была примерно в 45 раз выше в случае плазмиды (ii). В случае трансфекции плазмидой (iv) удельная активность LUC уменьшалась до уровня pEXP-NtmybA2, по сравнению со случаем использования (iii). В случае (v) и (vi) активность LUC уменьшалась, становясь ниже уровня pEXP-NtmybA2.
Исходя из указанных выше результатов очевидно, что C-концевая область NtmybA2 в пределах от аминокислоты 631 до C-конца является областью, которая негативно регулирует способность активировать транскрипцию, присущую белку NtmybA2. Очевидно, что аминокислотная последовательность в пределах остатков 413-630 будет действовать как область энхансера, активируя транскрипцию. Показано, что аминокислотная делеция остатков в пределах от аминокислоты 569 до C-конца, особенно от аминокислоты 631 до C-конца, обеспечивает заметное увеличение способности NtmybA2 активировать транскрипцию, тогда как аминокислотная делеция остатков в пределах от аминокислоты 188 до C-конца или от аминокислоты 243 до C-конца обеспечивает уменьшение способности NtmybA2 активировать транскрипцию (фиг.5).
Пример 7
Доминантные негативные действия NtmybA2T5 на NtmybA2 или NtmybB
В примере 6 уровни способности активировать транскрипцию в случае NtmybA2T4 при использовании полипептида с остатками в пределах аминокислот 1-242 белка NtmybA2 и в случае NtmybA2T5 при использовании полипептида с остатками в пределах от аминокислоты 1 до 187 белка NtmybA2 снижались больше, чем в случае полноразмерного NtmybA2. Указанные факты свидетельствуют, что NtmybA2T4 и NtmybA2T5, в которых способность активировать транскрипцию снижена или утрачена, связываются с последовательностью MSA промоторов-мишеней, таким образом ингибируя связывание эндогенных NtmybA1, NtmybA2 и NtmybB с последовательностью MSA, в силу чего NtmybA2T4 и NtmybA2T5 действуют доминантно негативно. Чтобы показать доминантную негативную функцию NtmybA2T5, количественно оценивали активацию транскрипции, управляемой промотором CYM, в случаях совместно экспрессии NtmybA2 в комбинации с NtmybA2T5 и совместной экспрессия NtmybB в комбинации с NtmybA2T5.
Протопласты BY-2, полученные согласно способу, описанному в примере 3 (2), трансформировали набором плазмид NACK1-промотор:LUC (10 мкг/образец), R-LUC (1 мкг/образец), pEXP-NtmybA2 (10 мкг/образец) и pEXP-NtmybA2T5 (10 мкг/образец) или другим набором плазмид NACK1-промотор:LUC (10 мкг/образец), R-LUC (1 мкг/образец), pEXP-NtmybA2 (10 мкг/образец) и pEXP-GUS (10 мкг/образец). Полученные в результате трансформированные клетки BY2 анализировали в отношении активности LUC и активности R-LUC согласно способу, описанному в примере 3 (4). Трансфекцию плазмидами осуществляли в пяти повторах. Уровень удельной активности LUC (которая выражена относительно уровня активности LUC, стандартизованного в соответствии с уровнем активности R-LUC) снижался в комбинации pEXP-NtmybA2+pEXP-NtmybA2T5 больше, чем в комбинации pEXP-NtmybA2+pEXP-GUS. Полученные результаты подтверждают, что NtmybA2T5 действует на NtmybA2 доминантно негативно.
Также к протопластам BY-2 добавляли плазмиду NACK1-промотор:LUC (10 мкг/образец), R-LUC (1 мкг/образец) с последующим переносом генов с помощью pEXP-NtmybB (10 мкг/образец)+pEXP-NtmybA2T5 (10 мкг/образец) или pEXP-NtmybB (10 мкг/образец)+pEXP-GUS (10 мкг/образец). Полученные в результате трансформированные клетки BY2 анализировали в отношении активности LUC и активности R-LUC согласно способу, описанному в примере 3 (4). Уровень удельной активности LUC (которая выражена относительно уровня активности LUC, стандартизованной в соответствии с уровнем активности R-LUC) повышался в комбинации pEXP-NtmybB+pEXP-NtmybA2T5 больше, чем в комбинации pEXP-NtmybB+pEXP-GUS. Полученные результаты подтверждают, что NtmybA2T5 действует на NtmybB доминантно негативно (фиг.6).
Пример 8
Модификация роста и развития растений Arabidopsis thaliana, трансформированных NtmybA2, NtmybA2T2- и NtmybB
Создавали трансгенные растения Arabidopsis thaliana, которые стабильно экспрессируют форму активатора транскрипции NtmybA2 - NtmybA2T2, которая является мутантной конструкцией с повышенной в значительной степени способностью NtmybA2 активировать транскрипцию, и форму репрессора транскрипции NtmybB при действии промотора 35S CaMV, и сравнивали в отношении их роста и развития соответственно.
(1) Конструирование плазмиды для трансформации
Фрагмент ДНК, полученный KpnI-расщеплением pEXP-NtmybA2T2, затем затуплением концов фрагментом Кленова с последующим XhoI-расщеплением, встраивали в сайт, полученный расщеплением SalI и SmaI плазмиды pBI-RHL, которая описана в PCT/JP02/12268 (2002), чтобы создать pBIHm-NtmybA2T2. В сайт, полученный SalI-расщеплением pBIHm-NtmybA2T2 с последующим удалением вырезанного фрагмента ДНК, включающего в себя NtmybA2T2, встраивали фрагменты ДНК, полученные SalI-расщеплением pEXP-NtmybB и pEXP-NtmybA2, чтобы создать pBIHm-NtmybB и pBIHm-NtmybA2 соответственно. sGFP-содержащий фрагмент ДНК, полученный расщеплением NotI плазмиды pTH2 (Chiu et al., Curr. Biol. 1996 Mar 1; 6(3): 325-30) и затуплением концов фрагментом Кленова с последующим расщеплением SalI, встраивали в сайт, полученный расщеплением SalI-SmaI плазмиды pBIHm-NtmybA2T2 с последующим удалением фрагмента ДНК, включающего в себя NtmybA2T2, чтобы создать pBIHm-GFP.
То есть вышеуказанные (i) pBIHm-NtmybA2T2, (ii) pBIHm-NtmybB, (iii) pBIHm-NtmybA2 и (iv) pBIHm-GFP являются бинарными векторами для управляемой промотором 35S CaMV экспрессии соответствующих NtmybA2T2, NtmybB, NtmybA2 и sGFP соответственно, которыми можно трансформировать растения согласно способу трансформации, опосредованной Agrobacterium. Указанные плазмиды могут быть генетически перенесены в растения, которые можно подвергнуть селекции с использованием гигромицина, чтобы получить трансформанты растений.
Плазмиды, которые по существу являются функционально эквивалентными любой из плазмид (i)-(iv), могут быть сконструированы следующим образом:
Фрагмент ДНК, полученный расщеплением SacI-ApaI плазмиды pP35S-NtmybA2T2 с последующим затуплением фрагментом Кленова полученного в результате выступающего конца, встраивают в сайт, полученный расщеплением SalI плазмиды pBI-RHL, которая описана в PCT/JP02/12268 (2002), с последующим затуплением полученного в результате выступающего конца фрагментом Кленова, чтобы создать pBIHm35S-NtmybA2T2. Фрагменты ДНК, полученные SalI-расщеплением pP35S-NtmybB и pP35S-NtmybA2, встраивают в сайт, полученный расщеплением SalI плазмиды pBIHm35S-NtmybA2T2 с последующим удалением полученного в результате вырезанного фрагмента ДНК, включающего в себя NtmybA2T2, чтобы создать pBIHm35S-NtmybB и pBIHm35S-NtmybA2 соответственно. sGFP-содержащий фрагмент ДНК, полученный расщеплением NotI-SalI плазмиды pTH2 (Chiu et al., Curr. Biol. 1996 Mar 1; 6(3): 325-30) и затуплением полученного в результате выступающего конца фрагментом Кленова, встраивают в сайт, полученный SalI-расщеплением pBIHm35S-NtmybA2T2, затуплением фрагментом Кленова выступающего конца с последующим удалением полученного в результате фрагмента ДНК, включающего в себя NtmybA2T2, чтобы создать pBIHm35S-GFP.
То есть указанные выше (v) pBIHm35S-NtmybA2T2, (vi) pBIHm35S-NtmybB, (vii) pBIHm35S-NtmybA2 и (viii) pBIHm35S-GFP являются плазмидными векторами для управляемой промотором 35S CaMV экспрессии NtmybA2T2, NtmybB, NtmybA2 и sGFP соответственно. Они являются бинарными векторами, которые обеспечивают трансформацию растений, опосредованную Agrobacterium. Указанные плазмиды могут быть генетически перенесены в растения, которые могут быть подвергнуты селекции с использованием гигромицина, чтобы получить трансформанты растений.
(2) Трансформация Arabidopsis thaliana
Agrobacterium tumefaciens штамма EHA101 трансформировали бинарным вектором, выбранным из плазмид (1) (i)-(iv), которые создавали, как описано выше (1). Затем Arabidopsis thaliana экотипа Col-0 трансформировали способом погружения цветков для опосредованной Agrobacterium трансформации (Clough et al. (1998), Plant J. 16: 735), используя Agrobacterium, несущие указанную выше плазмиду. Семена, собранные из инфицированных Agrobacterium цветочных бутонов, стерилизовали хлорноватистой кислотой и стерильной водой и высевали в среду MS с добавлением 25 мкг/мл гигромицина и 100 мкг/мл карбенициллина. Отбирали трансгенные растения, способные расти в среде с добавлением гигромицина.
(3) Модификация роста и развития растений Arabidopsis thaliana, трансформированных NtmybA2, NtmybA2T2 и NtmybB
Отобранные трансформанты растений пересаживали на среду MS (неорганические соли MS, 30% сахароза и 0,4% геллановая камедь), отвержденную в чашке Петри (прямоугольный контейнер №2, Eiken Chemical Co., Ltd., Japan), обеспечивали возможность стоять вертикально и культивировали при 21°C в течение 16 час при непрерывном освещении и затем в темноте в течение 8 час. На 25 день после пересадки измеряли длину главных корней. В контрольной группе больше всего преобладали проростки, являющиеся линиями трансформантов с длиной главного корня от 31 мм до 35 мм (трансформация с использованием pBIHm-GFP), тогда как наиболее распространенными проростками были линии трансформантов с длиной главного корня от 21 мм до 25 мм в случаях трансформации pBIHm-NtmybA2, pBIHm-NtmybA2T2 и pBIHm-NtmybB. Таким образом, успешно получили растения с подавленным ростом и развитием. На основании указанных выше результатов очевидно, что трансгенные растения Arabidopsis thaliana, которые стабильно экспрессируют NtmybA2, NtmybB или NtmybA2T2, имеют модифицированные свойства роста и развития.
Пример 9
Модификация роста и развития растений Arabidopsis thaliana, трансформированных NtmybA2T2 и NtmybA2T5
Создавали трансгенные растения Arabidopsis thaliana, которые стабильно экспрессируют доминантную негативную форму NtmybA2T5, при действии промотора 35S CaMV, и сравнивали в отношении их роста и развития.
Создавали трансгенные растения Arabidopsis thaliana, которые экспрессируют мутантные конструкции NtmybA2T2 с повышенной в значительной степени способностью NtmybA2 активировать транскрипцию, при действии промотора циклина B (CYM) и сравнивали в отношении их роста и развития.
(1) Конструирование плазмид для трансформации
Конструирование плазмиды pDBIHm-NtmybA2T5
Фрагмент ДНК для рамки считывания A, коммерчески поставляемый Invitrogen, встраивали в сайт, полученный при расщеплении SmaI плазмиды pUC19 (Takara, Japan), чтобы создать pUC-RFA. Рамку считывания A, вырезанную BamHI-SpeI-расщеплением pUC-RFA, встраивали в сайт, полученный при расщеплении BamHI-SpeI плазмиды pBI-RHL, которая описана в PCT/JP02/12268 (2002), чтобы создать pDESTBI-1.
Фрагмент ДНК фрагмент, вырезанный расщеплением KpnI-XhoI плазмиды pEXP-NtmybA2T5, встраивали в сайт, полученный при расщеплении KpnI-XhoI плазмиды pENTR2B (Invitrogen), чтобы создать pENTR-NtmybA2T5. Смесь pDESTBI-1 и pENTR-NtmybA2T5 подвергали сайт-специфичной рекомбинации, используя смесь GatewayTM LR ClonaseTM (Invitrogen), чтобы сконструировать pDBIHm-NtmybA2T5. Реакцию со смесью GatewayTM LR ClonaseTM осуществляли согласно протоколам, прилагаемым к реагентам. Вектор pDBIHm-NtmybA2T5 является плазмидным вектором для управляемой промотором 35S CaMV экспрессии NtmybA2T5. Он также является бинарным вектором, который позволяет осуществлять опосредованную Agrobacterium трансформацию растений. Указанная плазмида может быть генетически перенесена в растения, которые могут быть подвергнуты селекции с использованием гигромицина, чтобы получить трансформанты растений.
Плазмиды, которые являются по существу функционально эквивалентными pDBIHm-NtmybA2T5, также могут быть сконструированы следующим образом.
Плазмиду pP35S-NtmybA2T5 расщепляют SacII и ApaI с последующим затуплением выступающего конца фрагментом Кленова. Полученный в результате вырезанный фрагмент ДНК фрагмент встраивают в сайт, полученный KpnI-XhoI-расщеплением pENTR2B (Invitrogen) с последующим затуплением фрагментом Кленова полученного в результате выступающего конца, чтобы создать pENTR35S-NtmybA2T5. Смесь pDESTBI-1 и pENTR35S-NtmybA2T5 подвергают сайт-специфичной рекомбинации, используя смесь GatewayTM LR ClonaseTM (Invitrogen), чтобы сконструировать pDBIHm35S-NtmybA2T5. Реакцию со смесью GatewayTM LR ClonaseTM осуществляют согласно протоколам, прилагаемым к реагентам. Вектор pDBIHm35S-NtmybA2T5 является плазмидным вектором для управляемой промотором 35S CaMV экспрессии NtmybA2T5. Он также является бинарным вектором, который позволяет осуществлять опосредованную Agrobacterium трансформацию растений. Указанная плазмида может быть генетически перенесена в растения, которые могут быть подвергнуты селекции с использованием гигромицина, чтобы получить трансформанты растений.
Конструирование плазмиды pPCYM-NtmybA2T2
Область промотора CYM получали посредством ПЦР, используя в качестве матрицы геномную ДНК, полученную из Catharanthus roseus согласно обычному способу.
В ПЦР использовали праймеры
и
Амплифицированная область промотора CYM расщепляли PstI и HindIII и затем встраивали в сайт, полученный PstI-HindIII-расщеплением pPZP211 (Hajdukiewicz et al., Plant Mol. Biol. 25: 989 (1994)), чтобы создать плазмиду pPZP211-CYM. Фрагмент, вырезанный SalI-расщеплением pEXP-NtmybA2T2, встраивали в сайт, полученный SalI-расщеплением pPZP211-CYM, чтобы создать pPCYM-NtmybA2T2. Вектор pPCYM-NtmybA2T2 является плазмидным вектором для управляемой промотором CYM экспрессии NtmybA2T2. Он также является бинарным вектором, который позволяет осуществлять опосредованную Agrobacterium трансформацию растений. Указанная плазмида может быть генетически перенесена в растения, которые могут быть подвергнуты селекции с использованием канамицина, чтобы получить трансформанты растений. Плазмида pPCYM-NtmybA2T2 также может быть сконструирована следующим образом.
Плазмида может быть сконструирована встраиванием фрагмента ДНК, вырезанного SalI-расщеплением pP35SNtmybA2T2, в сайт, полученный SalI-расщеплением pPZP211-CYM.
(2) Трансформация Arabidopsis thaliana
Растения Arabidopsis thaliana экотипа Col-0 трансформировали pDBIHm-NtmybA2T5, pPCYM-NtmybA2T2 (сконструированным, как описано выше в (1)) и pBIHm-GFP (контрольная группа) согласно способу, раскрытому в примере 5, и подвергали селекции, соответственно. Селекцию трансгенных растений, трансформированных pDBIHm-NtmybA2T5 и pBIHm-GFP, осуществляли на среде MS, содержащей гигромицин (25 мкг/мл) и карбенициллин (100 мкг/мл), чтобы получить трансформанты растения, способные соответственно расти на среде. Селекцию трансгенных растений, трансформированных pPCYM-NtmybA2T2, осуществляли на среде MS, содержащей канамицин (50 мкг/мл) и карбенициллин (100 мкг/мл), чтобы получить жизнеспособные трансформанты растений. Полученные в результате трансформированные линии пересевали на смесь грунта вермикулит:торфяной мох (1:1), акклиматизировали и культивировали при 21°C в течение 16 час при непрерывном освещении и затем в темноте в течение 8 час. Указанные линии подвергали самоопылению, чтобы получить первое дочернее поколение семян, которые использовали для анализа.
(3) Модификация скорости роста растений Arabidopsis thaliana при действии мутантов NtmybA2
Семена первого дочернего поколения от самоопыляемых растений, полученных в результате трансформации, стерилизовали хлорноватистой кислотой и стерильной водой, высевали на среду MS (неорганические соли MS, 30% сахароза и 0,4% геллановая камедь), отвержденную в чашке Петри (прямоугольный контейнер №2, Eiken Chemical Co., Ltd., Japan) и подвергали яровизации при 4°C в темноте в течение 4 дней. После яровизации растениям обеспечивали возможность стоять вертикально и культивировали при 21°C в течение 16 час при непрерывном освещении и затем в темноте в течение 8 час. Через три дня после яровизации измеряли длину каждого главного корня.
Наблюдали множественные линии трансформантов с фенотипами подавленного роста среди линий, трансфицированных pDBIHm-NtmybA2T5 и pPCYM-NtmybA2T2, по сравнению с контрольной линией, трансформированной pBIHm-GFP.
Пример 10
Подавление роста и развития растений репрессированной экспрессией NtmybA1 и NtmybA2
Индуцированное вирусом молчание генов (VIGS) использовали в качестве средства для супрессии экспрессии эндогенных генов, чтобы оценить фенотип растений с подавленной экспрессий NtmybA1 и NtmybA2. Плазмиды LgJ и LGFPJ, используемые в VIGS, были любезно предоставлены дистрибьютором Yuichiro Watanabe, Department of Life Sciences (Multi-Disciplinary Sciences), Graduate School of Arts and Sciences, The University of Tokyo, Japan. LgJ является плазмидой, имеющей вставку ДНК, кодирующей вирус, полученный модификацией РНК-вируса растений, вируса мозаики томата (ToMV). Модификация ToMV заключается во введении мутации в виде аминокислотных замен в область, кодирующую фермент репликации, чтобы ослабить индуцированные вирусом симптомы благодаря снижению уровней реплицируемого вируса; во введении новой последовательности промотора, чтобы обеспечить экспрессию чужеродной ДНК; и вставке сайтов рекомбинации системы GatewayTM ниже промотора для экспрессии чужеродной ДНК, чтобы обеспечить инсерцию чужеродной ДНК посредством реакции с LR (доступна из Invitrogen). Плазмида LgJ может быть подвергнута РНК-транскрипции in vitro, чтобы создать рекомбинантную вирусную РНК, которая является инфекционной для растений. В растениях, инфицированных указанным рекомбинантным вирусом, двунитевая ДНК, полученная из чужеродной ДНК, экспрессируется в растениях в виде промежуточного продукта репликации. В том случае, когда чужеродной ДНК, используемой в рекомбинантном вирусе, является ДНК, полученная из растения для вирусной инфекции, экспрессия соответствующего эндогенного гена растений будет супрессирована. LGFPJ получают инсерцией ДНК, кодирующей GFP, в LgJ и она позволяет выявлять вирусную инфекцию посредством наблюдения за экспрессией GFP.
(1) Конструирование плазмид
Конструирование LA1A2J
Фрагмент ДНК, содержащий часть кДНК NtmybA1, амплифицировали в ПЦР, используя в качестве матрицы pGEMe-OH53i6, в комбинации с праймерами,
и
Фрагмент ДНК, содержащий часть кДНК NtmybA2, амплифицировали в ПЦР, используя в качестве матрицы OH60 в комбинации с праймерами,
и
Реакцию ПЦР осуществляли, используя PyrobestTM (Takara, Japan). Полученные в результате фрагменты ДНК встраивали в сайт EcoRV pBluescriptTM (Stratagene), чтобы создать pBS-VA1 и pBS-VA2 соответственно. Фрагмент ДНК, вырезанный SmaI-SalI-расщеплением PBS-VA2, встраивали в сайт, полученный HindIII-расщеплением pBS-VA1, затуплением концов фрагментом Кленова с последующим расщеплением SalI, чтобы создать pBS-VA1A2. ПЦР осуществляли с использованием pBS-VA1A2 в качестве матрицы в комбинации с праймерами
и
чтобы получить фрагмент ДНК, несущий связанный в тандеме участок ДНК, кодирующий часть NtmybA1, и связанный в тандеме участок ДНК, кодирующий часть NtmybA2, в котором последовательность attB1 (система GatewayTM, Invitrogen) добавляли к одному концу, а последовательность attB2 (система GatewayTM, Invitrogen) к другому концу. Смесь указанного фрагмента ДНК и плазмиды pDONR201 (Invitrogen) подвергали реакции BP, используя ClonaseTM BP (Invitrogen), чтобы получить pDONOR-VA1A2. Смесь pDONR-VA1A2 и LgJ подвергали взаимодействию с ClonaseTM LR (Invitrogen), чтобы получить LA1A2J. Реакции с ClonaseTM BP и ClonaseTM осуществляли согласно протоколам, прилагаемым к реагенту.
Аликвоту (5 мкг) LA1A2J расщепляли MluI, чтобы получить линеаризованную плазмиду. После обработки фенолом/хлороформом плазмиду осаждали этанолом и повторно растворяли в стерилизованной воде (10 мкл).
Полученную в результате линеаризованную LA1A2J использовали в качестве матрицы для транскрипции in vitro.
Коротко, смесь 10× буфера T7 (5 мкл, Roche, прилагается к РНК-полимеразе T7), 0,1 М DTT (2,5 мкл), ингибитора РНКазы (1 мкл, Roche, 40 единиц/мкл), смеси A/C/U/G (5 мкл, 20 мМ в случае каждого из ATP, CTP и UTP и 2 мМ GTP), 5 мМ m7G[5']ppp[5']G (2,5 мкл, CAP, Roche), стерилизованной воды (14 мкл) и линеаризованной LA1A2J (10 мкл) инкубировали при 37°C в течение 5 мин. К смеси добавляли 10 мкл РНК-полимеразы T7 (20 единиц/мкл, Roche) и полученную в результате смесь инкубировали при 37°C в течение 25 мин с последующим добавлением 20 мМ GTP (5 мкл). Затем смесь инкубировали при 37°C в течение 35 мин. После окончания реакции аликвоту (2 мкл) реакционного раствора подвергали электрофорезу в агарозных гелях, чтобы подтвердить транскрипцию RNA.
РНК LA1A2J использовали для инокуляции Nicotiana benthamiana. Коротко, растения культивировали при 25°C и 2 верхних листа Nicotiana benthamiana на стадии 4-5 листьев опыляли порошком карборунда и инокулировали РНК LA1A2J (5 мкл/лист). В течение 5 минут после инокуляции инокулированные листья промывали дистиллированной водой. Инокулировали пять отдельных растений и после инокуляции культивировали при 23°C.
Транскрипцию РНК in vitro осуществляли, используя LGFPJ в качестве контрольной группы подобно LA1A2J, и РНК LGFPJ использовали для инокуляции растений.
(2) Подавление роста и развития растений в случае растений с репрессированной экспрессией NtmybA1 и NtmybA2
Уровни экспрессированной мРНК NtmybA1 и мРНК NtmybA2 исследуют с использованием ОТ-ПЦР. Коротко, уровни экспрессированной мРНК NtmybA1 и мРНК NtmybA2 исследуют посредством ОТ-ПЦР в растениях, инфицированных LA1A2J и LGFPJ. Суммарную РНК экстрагируют из верхушки каждого побега растений, в которые инокулировали РНК LA1A2J, с подавленной высотой побегов и растений, в которые инокулировали РНК LGFPJ, используя мининабор для растений RNeasyTM (QIAGEN). Синтез кДНК осуществляют, используя систему для синтеза первой нити SuperscriptTM для ОТ-ПЦР (Invitrogen) с экстрагированной суммарной РНК в качестве матрицы. Синтезированную кДНК используют в качестве матрицы и выявление NtmybA1 и NtmybA2 осуществляют с
и
Уровень кДНК стандартизуют в соответствии с количеством, экспрессированным с мРНК EF1α в комбинации с
и
ПЦР осуществляют, используя аликвоту (1 мкл) синтезированной кДНК (50 мкл), таким образом обеспечивая возможность стандартизации количества используемой кДНК и анализ уровня экспрессии в случае NtmybA1 и NtmybA2.
Рост и развитие растений сильно подавлены у растений Nicotiana benthamoiana, в которые инокулировали РНК LA1A2J, с пониженными уровнями эндогенно экспрессируемых мРНК NtmybA1 и мРНК NtmybA2, по сравнению с контрольной группой, т.е. группой с инокуляцией РНК LGFPJ.
На основании указанных выше наблюдений будет очевидно, что снижение уровней экспрессии эндогенных NtmybA1 и NtmybA2 обеспечивает возможность подавления роста и развития растений.
(3) Подавление цитокинеза и прохождения M-фазы в растениях с подавленной экспрессией NtmybA1 и NtmybA2
Клетки эпидермиса листа и замыкающие клетки устьиц исследовали в листьях отдельных растений с подавленной экспрессией эндогенных NtmybA1 и NtmybA2, которые описаны выше (2).
Клетки эпидермиса снимали с нижней поверхности листьев двумя пинцетами и подвергали окраске ядер с использованием смеси молочная кислота-пропионовая кислота (1:1), содержащей 1% орцеина. Указанные клетки исследовали с помощью дифференциального интерференционного контрастного микроскопа. В результате наблюдали многоядерные клетки, которые имели множество ядер. Также обнаружили крупные и мелкие ядра среди ядер, существующих в многоядерных клетках. Многоядерная клетка показывает, что протекают процессы деления ядер, а цитокинез ингибирован. Тот факт, что имеются ядра, которые отличаются по размеру, свидетельствует о том, что количество хромосомы в ядрах увеличивается вследствие события аберрантного деления ядер и перескакивания через фазу M. То есть затронуты стадии вступления в фазу M, ее прохождения и терминации в клетках с подавленной экспрессией NtmybA1 и NtmybA2. На основании вышесказанного обнаружено, что NtmybA1 и NtmybA2 являются генами, необходимыми для нормального прохождения фазы M.
(4) Изменения клеточного цикла в растениях с подавленной экспрессией NtmybA1 и NtmybA2
Уровни ядерной ДНК анализируют в листьях отдельных растений табака с подавленной экспрессией эндогенных NtmybA1 и NtmybA2, которые описаны выше в (2). Отрезают третий верхний лист над инокулированным листом, смешивают с 1 мл буфера для экстракции ядер, имеющегося в CystainTM UV Precise P (наборе для окрашивания ДНК с высоким разрешением, Partec) в чашке Петри, и измельчают лезвием бритвы в течение 1 мин. После выдерживания при комнатной температуре в течение 10 мин полученный в результате образец фильтруют через одноразовый фильтрующий элемент Partec Cell TricsTM (поры 50 мкм, Partec), получая фильтрат, к которому добавляют 2 мл буфера для окрашивания, имеющегося в CystainTM UV Precise P (набор для окрашивания ДНК с высоким разрешением, Partec). Измерения осуществляют анализатором плоидности PA (Partec).
В образцах ядер, полученных из листьев отдельных растений табака с подавленной экспрессией NtmybA1 и NtmybA2, пики 4C (указывающей фазы S, G2) увеличиваются по сравнению с контрольной группой и, кроме того, также наблюдаются пики 8C (которые не наблюдаются в контрольной группе), свидетельствующие о множественных ядрах. Тот факт, что пики 4C увеличиваются, свидетельствует о замедленном прохождении фаз S, G2 или замедленном вхождении в фазу M. Тот факт, что имеют место пики 8C множественных ядер, свидетельствует об ингибировании вхождения в фазу M или о перескакивании через фазу M. На основании вышесказанного обнаружено, что NtmybA1 и NtmybA2 являются генами, необходимыми для нормального прохождения фазы M, и молчащая экспрессия указанных генов позволяет модулировать клеточный цикл.
Пример 11
Модификация скорости клеточного роста в трансформированных линиях клеток табака BY2 с подавленной экспрессией Ntmyb
(1) Конструирование плазмиды для каждой RNAi против NtmybA1, NtmybA2, и NtmybB
Фрагмент ДНК, вырезанный KpnI-расщеплением pEXP35S, затуплением ДНК-полимеразой T4 выступающего конца с последующим расщеплением EcoRV, встраивали в сайт, полученный EcoRI-HindIII-расщеплением pPZP211 с последующим затуплением фрагментом Кленова выступающего конца, чтобы создать pPZP211-35S.
ПЦР осуществляли, используя pBI121 (Clontech) в качестве матрицы в комбинации с праймерами
и
чтобы амплифицировать фрагмент ДНК, несущий ОРС GUS.
Указанный фрагмент ДНК расщепляли EcoRI и BamHI и затем встраивали в сайт, полученный EcoRI-BamHI-расщеплением pBluescriptTMII (SK+, Stratagene), чтобы создать pGUS1.0.
ПЦР осуществляли с OH60 в качестве матрицы в комбинации с
и
чтобы амплифицировать фрагмент ДНК, кодирующий часть NtmybA2, который затем расщепляли EcoRI и XhoI. Полученный в результате фрагмент ДНК встраивали в сайт, полученный EcoRI-XhoI-расщеплением pGUS1.0, чтобы создать pGUS-A2.RNAi-a.
ПЦР осуществляли с OH60 в качестве матрицы в комбинации с
и
чтобы амплифицировать фрагмент ДНК, кодирующий часть NtmybA2, который затем расщепляли BamHI и XbaI. Полученный в результате фрагмент ДНК встраивали в сайт, полученный BamHI-XbaI-расщеплением pGUS-A2.RNAi-a, чтобы создать pGUS-A2.RNAi.
ПЦР осуществляли с OH88 в качестве матрицы в комбинации с
и
чтобы амплифицировать фрагмент ДНК, кодирующий часть NtmybB, который расщепляли EcoRI и XhoI. Полученный в результате фрагмент ДНК встраивали в сайт, полученный EcoRI-XhoI-расщеплением pGUS1.0, чтобы создать pGUS-B.RNAi-a.
ПЦР осуществляли с OH88 в качестве матрицы в комбинации с
и
чтобы амплифицировать фрагмент ДНК, кодирующий часть NtmybB, который расщепляли BamHI и XbaI. Полученный в результате фрагмент ДНК встраивали в сайт, полученный BamHI-XbaI-расщеплением pGUS-B.RNAi-a, чтобы создать pGUS-B.RNAi.
Фрагмент ДНК, вырезанный HindIII-расщеплением pGUS-A2.RNAi, встраивали в сайт, полученный HindIII-расщеплением pPZP211-35S, чтобы создать pPZP211-35S:A2RNAi.
Фрагмент ДНК, вырезанный HindIII-SalI-расщеплением pGUS-B.RNAi, встраивали в сайт, полученный HindIII-SalI-расщеплением pPZP211-35S, чтобы создать pPZP211-35S:B:RNAi.
Векторы pPZ P211-35S:A2RNAi и pPZP211-35S:B:RNAi являются плазмидными векторами для управляемой промотором 35S CaMV экспрессии неполной последовательности NtmybA2 и неполной последовательности NtmybB в форме инвертированных повторов, в которых неполные последовательности NtmybA2 и неполные последовательности NtmybB будут образовывать двунитевые структуры РНК в растениях соответственно. Они являются бинарными векторами, которые обеспечивают возможность опосредованной Agrobacterium трансформации растений. Плазмиды могут быть генетически перенесены в растения, которые могут быть подвергнуты селекции с использованием канамицина, чтобы получить трансформанты растений.
В растениях табака и клетках культуры табака, трансформированных указанными плазмидами, влияние RNAi на NtmybA2 и NtmybB можно получить под действием экспрессированной двунитевой РНК.
Плазмиды, которые по существу являются функционально эквивалентными pPZP211-35S:A2RNAi и pPZP211-35S:B:RNAi, могут быть сконструированы следующим образом.
Фрагмент ДНК, вырезанный расщеплением SacII и KpnI плазмиды pP35S с последующим затуплением ДНК-полимеразой T4 выступающего конца, встраивают в сайт, полученный EcoRI-HindIII-расщеплением pPZP211 с последующим затуплением фрагментом Кленова выступающего конца, чтобы создать pPZP211-P35S. Фрагмент ДНК, вырезанный HindIII-расщеплением pGUS-A2.RNAi, встраивают в сайт, полученный HindIII-расщеплением pPZP211-P35S, чтобы создать pPZP211-P35S:A2RNAi. Фрагмент ДНК, вырезанный HindIII-SalI-расщеплением pGUS-B.RNAi, встраивают в сайт, полученный HindIII-SalI-расщеплением pPZP211-P35S, чтобы создать pPZP211-P35S:B:RNAi. Векторы pPZP211-P35S:A2RNAi и pPZP211-P35S:B:RNAi являются плазмидными векторами для управляемой промотором 35S CaMV экспрессии неполной последовательности NtmybA2 и неполной последовательности NtmybB в форме инвертированных повторов, в которых неполные последовательности NtmybA2 и неполные последовательности NtmybB будут образовывать двунитевые структуры РНК в растениях соответственно. Они являются бинарными векторами, которые обеспечивают возможность опосредованной Agrobacterium трансформации растений. Плазмиды могут быть генетически перенесены в растения, которые могут быть подвергнуты селекции с использованием канамицина, чтобы получить трансформанты растений.
(2) Трансформация линий клеток BY2 табака
Чтобы определить влияние подавленной экспрессии NtmybA2 и NtmybB на клеточный рост, клетки BY2 табака трансформировали Agrobacterium tumefaciens штамма LBA4404, несущими представитель, выбранный из pPZP211-35S:A2RNAi, pPZP211-35S:B:RNAi и pPZP211 (в качестве контрольного вектора). Коротко, смесь клеток BY-2 табака через 3-дня после пассажа, культивируемых в свежей жидкой среде LSD, и 2-дневные культуры Agrobacterium tumefaciens штамма LBA4404 в среде YEB, несущие представитель, выбранный из pPZP211-35S:A2RNAi, pPZP211-35S:B:RNAi и pPZP211 (в качестве контрольного вектора), культивировали совместно при 25°C в условиях темноты. Через два дня клетки BY-2 промывали средой LSD, высевали в среду LSD-0,2% GelriteTM, содержащую 200 мкг/мл канамицина и 300 мкг/мл карбенициллина, и инкубировали при 25°C в темноте. Через два дня полученные в результате резистентные к канамицину каллусы анализировали в отношении уровней экспрессированных NtmybA2 и NtmybB посредством ОТ-ПЦР. Суммарную РНК экстрагировали из указанных каллусов с использованием реагента TrizolTM Invitrogen (Invitrogen). Синтез кДНК осуществляли, используя систему для синтеза первой нити SuperscriptTM для ОТ-ПЦР (Invitrogen) с экстрагированной суммарной РНК в качестве матрицы. Амплификацию и выявление кДНК NtmybA2 осуществляли, используя полученную в результате кДНК в качестве матрицы в комбинации с праймером OH60DB1:
и праймером OH60DS6:
Амплификацию и выявление кДНК NtmybB осуществляли с праймером OH88Bam5:
и праймером OH88DS2:
ПЦР осуществляли с аликвотой (1 мкл) синтезированной кДНК (50 мкл). Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan), буфер для реакции, прилагаемый к TaKaRa Ex TaqTM, 200 мкМ каждого из dATP, dTTP, dCTP и dGTP, и 1 мкМ каждого из праймеров. Стадию, состоящую из инкубации при 93°C в течение 30 сек, инкубации при 56°C в течение 1 мин и инкубации при 73°C в течение 2 мин, повторяли 27 циклов для выявления NtmybB и 26 циклов для выявления NtmybA2 соответственно. Указанные продукты ПЦР анализировали электрофорезом в агарозном геле. В результате уровни экспрессированного NtmybA2 снижались в pPZP211-35S:A2RNAi-трансформированных каллусах по сравнению с уровнями в трансформированных контрольным вектором pPZP211 каллусах, и уровни экспрессированного NtmybB снижались в pPZP211-35S:B.RNAi-трансформированных каллусах по сравнению с уровнями при использовании контрольного вектора.
(3) Изменение скорости клеточного роста трансгенных клеток BY2 с подавленными уровнями экспрессированного NtmybA2
Когда размер указанных выше pPZP211-35S:A2RNAi-трансформированных каллусов с подавленными уровнями экспрессируемого NtmybA2 сравнивали с уровнями в группе с контрольным вектором, обнаружено, что размер каллусов уменьшался (фиг.7).
Анализировали уровни ядерной ДНК, чтобы оценить клеточный цикл клеток, составляющих указанные каллусы. Анализ проводили следующим образом.
К каждому замороженному и хранившемуся каллусу добавляли 1 мл буфера для экстракции ядер, имеющегося в CyStainTM UV Precise P (наборе для окрашивания ДНК с высоким разрешением, Partec), растворяли и затем смешивали. После выдерживания при комнатной температуре в течение 10 мин полученный в результате образец фильтровали через одноразовые фильтрующие элементы Partec Cell TricsTM (поры 50 мкм, Partec), получая фильтрат, к которому добавляли 2 мл буфера для окрашивания, имеющегося в CystainTM UV Precise P (наборе для окрашивания ДНК с высоким разрешением, Partec). Измерения осуществляли анализатором плоидности PA (Partec).
При сравнении с группой с контрольным вектором пики 4C (свидетельствующие о фазах S, G2) увеличивались и, кроме того, также наблюдались пики 8C (которые не наблюдались в группе с контрольным вектором), свидетельствующие об удвоенных хромосомах, в pPZP211-35S:A2RNAi-трансформированных каллусах с подавленными уровнями экспрессированной мРНК NtmybA2 (фиг.8). Тот факт, что пики 4C увеличиваются, свидетельствует об увеличении продолжительности периодов S-, G2-фаз, из-за того что затруднено вступление в фазу M клеток с подавленной экспрессий NtmybA2. Тот факт, что имеются пики 8C, свидетельствует о том, что имеет место ингибирование вступления в фазу M и клетки перескакивают фазу M, таким образом приводя к удвоению хромосом. В результате указанного обнаружено, что клеточный цикл замедлен и клеточный рост подавлен, таким образом приводя к образованию меньших по размеру каллусов.
(4) Изменение скорости клеточного роста трансгенных клеток BY2 с подавленными уровнями экспрессированного NtmybB
Когда размер указанных выше pPZP211-35S:BRNAi-трансформированных каллусов с подавленными уровнями экспрессируемой мРНК NtmybB сравнивали с уровнями в группе с контрольным вектором, обнаружено, что размер каллусов увеличивался (фиг.9).
Анализировали уровни ядерной ДНК, чтобы оценить клеточный цикл клеток, составляющих указанные каллусы. Анализ проводили таким же образом, как указано выше (4). При сравнении с группой с контрольным вектором пики 4C (свидетельствующие о хромосомах в фазах S, G2) уменьшались в pPZP211-35S:BRNAi-трансформированных каллусах с подавленными уровнями экспрессированного NtmybB (фиг.10). Тот факт, что пики 4C уменьшаются, свидетельствует об укорочении фаз S, M, т.е. ускорении вхождения в фазу M. Ингибирование экспрессии NtmybB приводит к повышенной экспрессии генов или увеличению уровней экспрессируемых генов, которые необходимы для вхождения в фазу M. Обнаружено, что в результате ускорения вступления в фазу M клеточный цикл укорачивается и клеточный рост усиливается, таким образом обеспечивая возможность образования более крупных каллусов.
Пример 12
Модификация скоростей клеточного роста трансгенных клеток BY2 табака со стабильной экспрессией NtmybA2 и NtmybA2T2
(1) Конструирование стабильно экспрессирующих плазмид для NtmybA2 и NtmybA2T2
Фрагмент ДНК, вырезанный SalI-расщеплением OH60, встраивали в сайт, полученный SalI-расщеплением pPZP211-35S, чтобы создать pPZP211-35S:A2.
Фрагмент ДНК, вырезанный SalI-расщеплением pEXP-NtmybA2T2, встраивали в сайт, полученный SalI-расщеплением pPZP211-35S, чтобы создать pPZP211-35S:A2T2.
Коротко, векторы pPZP211-35S:A2 и pPZP211-35S:A2T2 являются плазмидными векторами для управляемой промотором 35S CaMV экспрессии NtmybA2 и NtmybA2T2 соответственно. Они являются бинарными векторами, которые обеспечивают возможность опосредованной Agrobacterium трансформации растений. Плазмиды могут быть генетически перенесены в растения, которые могут быть подвергнуты селекции с использованием канамицина, чтобы получить трансформанты растений.
Плазмиды, которые по существу являются функционально эквивалентными pPZP211-35S:A2T2, могут быть сконструированы следующим образом.
Фрагмент ДНК, вырезанные SalI-расщеплением pP35S-NtmybA2T2 и OH60, встраивают в сайт, полученный SalI-расщеплением pPZP211-35S, чтобы создать pPZP211-P35S:A2T2 и pPZP211-P35S:A2 соответственно.
(2) Трансформация линии клеток табака BY2
Чтобы определить влияние стабильной экспрессии NtmybA2 и NtmybA2T2 на клеточный рост, клетки табака BY2 трансформировали посредством Agrobacterium tumefaciens штамма LBA4404, несущего представитель, выбранный из pPZP211-35S:A2, pPZP211-35S:A2T2 и pZP211 (в качестве контрольного вектора). Трансформацию клеток табака BY-2 осуществляли согласно способу, описанному в примере 11 (2). Через двадцать два дня полученные в результате резистентные к канамицину каллусы анализировали в отношении уровней экспрессированной мРНК NtmybA2 и мРНК NtmybA2T2 с помощью ОТ-ПЦР. Суммарную РНК экстрагировали из указанных каллусов реагентом TrizolTM Invitrogen (Invitrogen). Синтез кДНК осуществляли, используя систему для синтеза первой нити SuperscriptTM для ОТ-ПЦР (Invitrogen) с экстрагированной суммарной РНК в качестве матрицы. Амплификацию и выявление NtmybA2 и NtmybA2T2 осуществляли, используя полученную в результате кДНК в качестве матрицы в комбинации с
и
ПЦР осуществляли с аликвотой (1 мкл) синтезированной кДНК (50 мкл). Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan), буфер для реакции, прилагаемый к TaKaRa Ex TaqTM, 200 мкМ каждого из dATP, dTTP, dCTP и dGTP и 1 мкМ каждого праймера. Стадию, состоящую из инкубации при 93°C в течение 30 сек, инкубации при 56°C в течение 1 мин и инкубации при 73°C в течение 1 мин, повторяли 24 цикла. Указанные продукты ПЦР анализировали электрофорезом в агарозном геле. В результате уровни экспрессированного NtmybA2 увеличивались в pPZP211-35S:A2-трансформированных каллусах по сравнению с группой с контрольным вектором, и экспрессию NtmybA2T2 наблюдали в pPZP211-35S:A2T2-трансформированных каллусах.
(3) Изменение скоростей клеточного роста трансгенных клеток BY2, стабильно экспрессирующих мутанты NtmybA2 и NtmybA2
Размеры указанных выше каллусов, трансформированных pPZP211-35S:A2 или pPZP211-35S:A2T2, с подтвержденной экспрессией мРНК NtmybA2 или мРНК NtmybA2T2 сравнивали с размерами каллусов в группе с контрольным вектором, обнаружено, что размер каллусов уменьшался (фиг.11).
Анализировали уровни ядерной ДНК, чтобы исследовать клеточный цикл клеток, составляющих указанные каллусы. Анализ осуществляли таким же образом, как в указанном выше примере 11 (3).
При сравнении с группой с контрольным вектором пики 4C (указывающие на хромосомы фазы S, G2) уменьшались в каллусах, стабильно экспрессирующих NtmybA2. Указанная тенденция также наблюдалась в каллусах, которые стабильно экспрессируют NtmybA2T2, который представлял собой мутант с повышенной способностью NtmybA2 активировать транскрипцию (фиг.13).
Указанные клеточные трансформанты исследовали с помощью микроскопа. В результате не наблюдали многоядерных клеток, и, таким образом, количество выявленных ядер свидетельствовало о количестве клеток. Полученное в результате количество клеток сравнивали между группой с контрольным вектором, NtmybA2-трансформированными каллусами и NtmybA2T2-трансформированными каллусами. В результате обнаружено, что количество клеток уменьшается в случае NtmybA2, что коррелировало с размером каллусов и, кроме того, уменьшение количества клеток заметно в случае NtmybA2T2 (фиг.12).
Полученные данные свидетельствуют, что клеточный рост подавлен и количество клеток уменьшается, таким образом приводя к образованию более мелких каллусов, хотя вхождение в фазу M продолжается в каллусах со стабильной экспрессией мутантов NtmybA2 и NtmybA2.
Пример 13
Изменение роста и развития трансгенных растений табака с модулированными уровнями экспрессированного NtmybB
(1) Конструирование плазмид
Фрагмент ДНК, полученный SalI-расщеплением OH88, встраивали в сайт, полученный SalI-расщеплением pPZP211, чтобы создать pPZP211-35S:B.
(2) Получение трансгенных растений табака
Плазмиду pPZP211-35S:B.RNAi (которая описана в примере 11 (3)), использовали для получения трансгенных растений табака с подавленной в результате механизма RNAi экспрессией эндогенной РНК NtmybB. Плазмиду pPZP211-35S:B использовали для получения трансгенных растений табака, которые экспрессируют NtmybB стабильно. Agrobacterium tumefaciens штамма LBA4404, несущие представитель, выбранный из pPZP211-35S:B.RNAi, pPZP211-35S:B и pPZP211 (в качестве контрольного вектора), использовали согласно стандартному способу трансформации листовых дисков, чтобы создать трансформанты Nicotiana tabacum ver. SR1.
(3) Изменение роста трансгенных растений табака
Полученные в результате отдельные растений, устойчивые к канамицину, культивировали, чтобы получить семена после самоопыления. Полученные в результате семена стерилизовали этанолом и хлорноватистой кислотой, затем высевали в среду MS-0,2% GelriteTM, содержащую 50 мкг/мл канамицина, и выращивали при 28°C в условиях освещения, чтобы создать растения. После культивирования в течение 12 дней полученные в результате отдельные растения, устойчивые к канамицину, переносили на почву и выращивали при 28°C в условиях непрерывного освещения в течение 25 дней.
Полученные в результате устойчивые к канамицину отдельные растения анализировали в ОТ-ПЦР, чтобы подтвердить изменения уровня экспрессированной мРНК NtmybB. Суммарную РНК экстрагировали реагентом TrizolTM Invitrogen (Invitrogen) из растений (сырая масса 0,5-0,8 г) на 22 день после посева. Синтез кДНК осуществляли, используя систему для синтеза первой нити для ОТ-ПЦР SuperscriptTM (Invitrogen) с экстрагированной суммарной РНК в качестве матрицы. Амплификацию и выявление кДНК NtmybB осуществляли, используя полученную в результате кДНК в качестве матрицы в комбинации с
и
Уровень кДНК стандартизовали в соответствии с уровнем экспрессированной мРНК EF1α в комбинации с
и
ПЦР осуществляли с аликвотой (1 мкл) синтезированной кДНК (50 мкл). Реакцию осуществляли в общем объеме 50 мкл, используя TaKaRa Ex TaqTM (Takara, Japan), буфер для реакции, прилагаемый к TaKaRa Ex TaqTM, 200 мкМ каждого из dATP, dTTP, dCTP и dGTP и 1 мкМ каждого из праймеров. Стадию, состоящую из инкубации при 93°C в течение 30 сек, инкубации при 56°C в течение 1 мин и инкубации при 73°C в течение 1 мин, повторяли 27 циклов. Такую же стадию повторяли 18 циклов для выявления EF1α. Указанные продукты ПЦР анализировали электрофорезом в агарозном геле. В результате высокий уровень амплифицированной кДНК NtmybB наблюдали в линии клеток №6, трансформированной pPZP211-35S:B, по сравнению с группой с контрольным вектором, в то время как EF1α в равной мере выявляли среди всех образцов, и подтвердили повышение уровня экспрессии. Также уровень амплифицированной кДНК NtmybB почти не наблюдали в линии клеток №2, трансформированных pPZP211-35S:B.RNAi, по сравнению с группой с контрольным вектором и подтвердили снижение уровня экспрессии.
Рост и развитие подавлены в стабильно экспрессирующей NtmybB трансгенной линии табака (№6) по сравнению с группой с контрольным вектором, тогда как рост и развитие усиливаются в трансгенной линии табака (№2) с экспрессией эндогенного NtmybB, подавленной RNAi, по сравнению с группой с контрольным вектором (фиг.14). Полагают, что так как NtmybB подавляет экспрессию генов, обязательных для прохождения в фазу M, то вступление в фазу M и/или прохождение фазы M замедляется в трансгенных растениях, сверхэкспресирующих NtmybB, таким образом приводя к ингибированию деления клеток и увеличению периода времени, необходимого для клеточного цикла, с таким результатом, что линии проявляют фенотип подавленного роста и развития. Наоборот, предполагается, что если экспрессию эндогенного NtmybB подавляют, то в связи с этим запускается экспрессия генов, необходимых для прохождения фазы M, или увеличивается уровень экспрессии, с таким результатом, что вступление в фазу M и/или прохождение фазы M ускоряется и период времени, необходимый для клеточного цикла, укорачивается, таким образом, линии проявляют фенотип усиленного роста и развития.
Пример 14
Сходство аминокислотных последовательностей белков NtmybA1, NtmybA2 и Os3RmybA1
Аминокислотные последовательности белков NtmybA1, NtmybA2 и Os3RmybA1 оптимально выравнивают и проводят анализ множественного выравнивания аминокислотных последовательностей. Результаты сравнения показаны на фиг.15-18. Высокое сходство аминокислотных последовательностей обнаружено не только в ДНК-связывающей области myb, состоящей из 3 повторов, но также в области (положения аминокислот 631-1042), негативно регулирующей, и в области (положения аминокислот 413-630), усиливающей способность активировать транскрипцию, присущую белку NtmybA2, как показано в примере 6. Представители, действующие как активаторы транскрипции, NtmybA1, NtmybA2 и Os3RmybA1, в высокой степени сходны на аминокислотном уровне в областях, регулирующих способность активировать транскрипцию, и поэтому показано, что они имеют сходный механизм регуляции. На фиг.15-18 стрелки указывают области для соответствующих конструкций делеционных мутантов NtmybA2, которые описаны в примере 6, и соответствующие области аминокислот, относящиеся к NtmybA1 и Os3RmybA1. Выяснено, что части делеций NtmybA2 для создания мутантов NtmybA2 с высокой способностью активировать транскрипцию, NtmybA2T1, NtmybA2T2 и NtmybA2T3, в высокой степени сходны с NtmybA1 и Os3RmybA1, и обнаружены консервативные аминокислоты среди трех указанных белков. То есть в случае NtmybA2T1 последовательность TPSILKKRHR (SEQ ID NO: 89) обнаружена вблизи области делеции; в случае NtmybA2T2 последовательность NXXTPXRLWX (SEQ ID NO: 90) и в случае NtmybA2T3 последовательность PPRFPSXDXPF (SEQ ID NO: 91), где X означает любую аминокислоту. В случае NtmybA1 и Os3RmybA1 делеция C-концевой части в пределах от любой из указанных консервативных последовательностей до C-конца обеспечит возможность создания мутантов, функционально эквивалентных NtmybA2T1, NtmybA2T2 и NtmybA2T3.
Пример 15
Сходство аминокислотных последовательностей 3Rmyb, NtmybA1, NtmybA2, NtmybB и Os3RmybA1 Arabidopsis thaliana
Несмотря на то что известно 100 или более белков, содержащих myb-подобный ДНК-связывающий мотив, в полном геноме Arabidopsis thaliana, сообщается, что только 5 представителей являются белками 3Rmyb, имеющими структурную конфигурацию, состоящую из неполных 3 повторов myb-последовательности (Stracke et al., Curr. Opin. Plant Biol. 4: 447 (2001)). Однако еще не были обнаружены белки с выявленными функциями среди указанных белков 3Rmyb.
(1) Сходство аминокислотных последовательностей среди растительных 3Rmyb в форме активаторов транскрипции
Аминокислотные последовательности сообщенных представителей 3Rmyb Arabidopsis thaliana, AtMYB3R1 (GenBankTM, No. доступа AAD46772, SEQ ID NO: 75), и AtMYB3R4 (GenBankTM, No. доступа AAK54739, SEQ ID NO: 76) и аминокислотные последовательности NtmybA1, NtmybA2 и Os3RmybA1 оптимально выравнивают и проводят анализ множественного выравнивания аминокислотных последовательностей. Результаты сравнения в отношении сходства показаны на фиг.19-25. Выяснено, что аминокислотные последовательности AtMYB3R1 и AtMYB3R4 в высокой степени сходны с последовательностями NtmybA1, NtmybA2 и Os3RmybA1 не только в myb-подобных ДНК-связывающих доменах но также в областях, важных для NtmybA2 с точки зрения регуляции активации транскрипции. В частности, характерная консенсусная последовательность, состоящая из 22 составляющих аминокислот формулы:
где X является любой аминокислотой; J является аминокислотой, выбранной из группы, состоящей из I, V и L; O является аминокислотой, выбранной из S и T; X1 является аминокислотой, выбранной из K и R; U является аминокислотой, выбранной из V и L; и X5 является аминокислотой, выбранной из D и E, наблюдается среди участков с высоким сходством. Указанная консенсусная последовательность свидетельствует, что AtMYB3R1 и AtMYB3R4 могут функционировать в качестве активаторов транскрипции для гена циклина B и гена NACK1 подобно NtmybA1, NtmybA2 и Os3RmybA1.
(2) Сходство аминокислотных последовательностей среди растительных 3Rmyb в форме репрессоров транскрипции
Так как не обнаружено сходства аминокислотных последовательностей между представителем, выбранным из представителей 3Rmyb Arabidopsis thaliana AtMYB3R3 (GenBankTM No. доступа AAF25950, SEQ ID NO: 77) и AtMYB3R5 (GenBankTM No. доступа AAK54740, SEQ ID NO: 78), и представителем, выбранным из указанных выше растительных 3Rmyb в форме активаторов транскрипции, за исключением ДНК-связывающих доменов myb, предполагается, что AtMYB3R3 и AtMYB3R5 не будут функционировать в качестве активаторов транскрипции. Поэтому аминокислотные последовательности AtMYB3R3 и AtMYB3R5 и аминокислотную последовательность NtmybB оптимально выравнивали. В результате обнаружены сходства аминокислотных последовательностей между аминокислотными последовательностями AtMYB3R3, AtMYB3R5 и NtmybB. Результаты сравнения показаны на фиг.26-28. Очевидно, что аминокислотные последовательности AtMYB3R3 и AtMYB3R5 в высокой степени сходны с аминокислотной последовательностью NtmybB не только в myb-подобном ДНК-связывающем домене, но также большое количество сходных аминокислот присутствуют с других доменах, и, кроме того, характерная консенсусная последовательность, состоящая из 7 составляющих ее аминокислот (включая четыре коровых остатка Ser), формулы:
где X является любой аминокислотой и X6 является аминокислотой, выбранной из группы, состоящей из K, R, D, E и H, расположена в положении, более близком к N-концевой половине, чем ДНК-связывающий домен myb. Указанная консенсусная последовательность не встречается в аминокислотных последовательностях AtMYB3R1, AtMYB3R4, NtmybA1, NtmybA2 и Os3RmybA1. Данный факт свидетельствует о том, что указанная консенсусная последовательность подобно NtmybB является репрессором транскрипции гена циклина B и гена NACK1.
(3) Представители семейства 3Rmyb растений, классифицируемые как подсемейства, имеющие форму активатора и форму репрессора.
Из приведенных выше пунктов (1) и (2) очевидно, что представители 3Rmyb занимают структурно и функционально особые положения в надсемействе myb растений и действуют как факторы регуляции транскрипции гена циклина B и гена NACK1. Также обнаружено, что они могут быть классифицированы на основании их сходства как относящиеся к подсемействам, имеющим форму активатора транскрипции и форму репрессора транскрипции, даже в семействе 3Rmyb.
Оптимальное выравнивание аминокислотных последовательностей осуществляли с помощью программы ClustalW (http://www.ddbj.nig.ac.jp/E-mail/clustalw-j.html) со всеми параметрами, установленными по умолчанию. На чертежах, иллюстрирующих итоговые результаты программы ClustalW, среди символов, обозначающих сходство и идентичность аминокислот, «*» означает, что остатки аминокислот в данной колонке идентичны во всех последовательностях при выравнивании (полностью консервативный аминокислотный сайт); «:» означает, что наблюдались консервативные замены (высоко консервативный аминокислотный сайт), и «.» означает, что наблюдаются консервативные замены (умеренно консервативный аминокислотный сайт).
Пример 16
Консервативность аминокислотных участков, составляющих ДНК-связывающий мотив myb среди отличающихся представителей 3Rmyb растений
До настоящего времени сообщалось, что фрагменты кДНК 3Rmyb со структурной конфигурацией, состоящей из трех повторов мотива myb, выделяют из различных представителей растений (Kranz et al., Plant J. 21: 231 (2000)). Аминокислотные последовательности ДНК-связывающего мотива указанных отличающихся представителей 3Rmyb растений сравнивали с полноразмерной аминокислотной последовательностью c-myb человека.
Представители 3Rmyb из указанных отличающихся растений сравнивали по аминокислотным участкам их ДНК-связывающего мотива myb. 3Rmyb, используемые в сравнении аминокислотных последовательностей, включают MYB3R-1, полученный из Physcomitrella patens (GenBankTM, No. доступа AAF78888, SEQ ID NO: 79, обозначенный «PhpMYB3R-1» на фиг.29-31), MYB3R-1, полученный из Adiantum raddianum (GenBankTM, No. доступа AAF67053, SEQ ID NO: 80, обозначенный «AdrMYB3R-1» на фиг.29-31), MYB3R-1, полученный из Hordeum vulgare (GenBankTM, No. доступа AAF78890, SEQ ID NO: 81, обозначенный «HvMYB3R-1» на фиг.29-31), MYB3R-1, полученный из Secale cereale (GenBankTM, No. доступа AAF67050, SEQ ID NO: 82, обозначенный «ScMYB3R-1» на фиг.29-31), предполагаемый Myb-родственный домен, полученный из Papaver rhoeas (GenBankTM, No. доступа AAF43043, SEQ ID NO: 83, обозначенный «ParMYB3R-1» на фиг.29-31), AtMYB3R1 (обозначенный «AtMYB3R-1» на фиг.29-31), AtMYB3R3 (обозначенный «AtMYB3R-3» на фиг.29-31), AtMYB3R4 (обозначенный «AtMYB3R-4» на фиг.29-31), AtMYB3R5 (обозначенный «AtMYB3R-5» на фиг.29-31), NtmybA1, NtmybA2, NtmybB, Os3RmybA1, c-myb человека (SWISS-PROT No. доступа P10242, SEQ ID NO: 88). Так как кДНК, полученный из Adiantum raddianum, Hordeum vulgare и Secale cereale, являются фрагментами, исходные составляющие повторы ДНК-связывающих мотивов myb не показаны в формах, точных по длине.
Аминокислотную последовательность ДНК-связывающего мотива myb в пределах положений 43-192 белка c-myb человека (SWISS-PROT No. доступа P10242, SEQ ID NO: 88) и аминокислотные последовательности представителей 3Rmyb, выделенных из указанных выше растений, оптимально выравнивали. Уже сообщенные полноразмерные последовательности сравнивали среди других представителей 3Rmyb растений, отличных от 3Rmyb Adiantum raddianum, Hordeum vulgare и Secale cereale, при невозможности охватить полноразмерный ДНК-связывающий мотив myb. Каждая оценка выравнивания, свидетельствующая о сходстве аминокислот относительно c-myb, показана следующим образом.
Оценка выравнивания составляет 62 для NtmybA1; 65 для NtmybA2; 60 для NtmybB; 64 для AtMYB3R1; 64 для AtMYB3R3; 63 для AtMYB3R4; 66 для AtMYB3R5; 66 для PhpMYB3R-1; 66 для ParMYB3R-1 и 60 для Os3RmybA1. Из сказанного выше очевидно, что ДНК-связывающие домены myb представителей 3Rmyb растений являются высоко консервативными при сравнении с c-myb. Также обнаружено, что ДНК-связывающие домены myb представителей 3Rmyb растений имеют оценку выравнивания 60 или выше относительно c-myb.
Посредством анализа оптимального выравнивания аминокислотных последовательностей c-myb-подобных ДНК-связывающих мотивов NtmybA1, NtmybA2, NtmybB, AtMYB3R1, AtMYB3R3, AtMYB3R4, AtMYB3R5, PhpMYB3R-1, ParMYB3R-1, Os3RmybA1, HvMYB3R-1, AdrMYB3R-1 и ScMYB3R-1 авторы настоящего изобретения с соавторами успешно обнаружили консервативные общие последовательности в указанных мотивах среди данных 13 представителей 3Rmyb растений (фиг.29-31).
Общая аминокислотная последовательность (консенсусная аминокислотная последовательность), консервативная в ДНК-связывающем мотиве myb среди различных представителей 3Rmyb растений, содержит три повтора myb-мотива c-myb, вместе с промежуточными 42 случайными аминокислотами (аминокислотами между стрелками на чертежах), расположенными между указанными повторами, где указанный myb-мотив c-myb является последовательностью, состоящей из 9 аминокислотных остатков формулы:
(i) W[S,T]XXE[D,E]XX[L,I,V]
(соответствующая SEQ ID NO: 92),
где X означает любую аминокислоту, и [ ] означают одну аминокислоту, выбранную из аминокислот, указанных в квадратных скобках,
(каждый из консенсусных участков (помеченных черными горизонтальными полосами на чертеже), составляющих 3-повторяющуюся ДНК-связывающую область myb, показан символом MYB№1 (обозначение повтора ДНК-связывающего домена Myb 1.) в результатах поиска, полученных с использованием программы MOTIF (http://motif.genome.ad.jp/)).
Более конкретно, когда сайты, состоящие из консенсусных аминокислот или химически аналогичных аминокислот в 13 аминокислотных последовательностях, называют «консенсусная последовательность», возможной последовательностью является последовательность (обозначенная как «консенсусная последовательность» на чертежах) из 150 аминокислот следующей формулы:
(ii) WTXEEDXXLXXXVXXUXGX7XWKXIAXXXXXROX5JQCLHRWQKVLXPXLJKGXWOXEED
XXJXXXJXX7XGXXKWSXJOXXXXGRIGKQCRERWUNHLXPXIXX7XXWTXXEX5XXLXXXHXXXGNX7WAEJXX7XLXGX7ODNOIKNXWXSOXKKX7
(соответствующей SEQ ID NO: 93),
где X является любой аминокислотой; J является аминокислотой, выбранной из группы, состоящей из I, V и L; O является аминокислотой, выбранной из группы, состоящей из G, S, T, C и A; X7 является аминокислотой, выбранной из группы, состоящей из K, R и H; U является аминокислотой, выбранной из группы, состоящей из H, W, Y и F; и X5 является аминокислотой, выбранной из D и E.
Оптимальное выравнивание аминокислотных последовательностей проводили с использованием программы ClustalW (http://www.ddbj.nig.ac.jp/E-mail/clustalw-j.html), в которой все параметры устанавливали по умолчанию.
Пример 17
Выделение 3Rmyb растений
Чтобы выделить ДНК, кодирующую белки, содержащие аминокислотную последовательность (i), в частности (ii), которая описана в примере 16, осуществляли способ согласно примеру 1.
Коротко, амплификация может быть осуществлена с использованием в качестве матрицы кДНК, полученной из растительных тканей-мишеней или клеток с сильным клеточным ростом, посредством ПЦР с использованием вырожденных праймеров в комбинации с гнездовой ПЦР. Вырожденные праймеры, используемые в первой ПЦР, представляют собой набор праймеров SEQ ID NO: 1 и SEQ ID NO: 2. Полученный в результате первый реакционный раствор используют в качестве матрицы для второй ПЦР. Вторую ПЦР, гнездовую ПЦР, осуществляют с набором праймеров SEQ ID NO: 3 и SEQ ID NO: 4. Второй реакционный раствор используют в качестве матрицы для третьей ПЦР. Третью ПЦР, гнездовую ПЦР, осуществляют с набором праймеров SEQ ID NO: 5 и SEQ ID NO: 6, чтобы обеспечить возможность амплификации ДНК, кодирующей часть ДНК-связывающего домена myb. Можно секвенировать нуклеотидные последовательности 5'- и 3'-концов полноразмерной кДНК, адаптировав 5'RACE и 3'RACE, основанные на нуклеотидных последовательностях, полученных в результате фрагментов ДНК. ПЦР может быть осуществлена с праймерами, сконструированными на концевых последовательностях, охарактеризованных в RACE, чтобы амплифицировать полноразмерную кДНК. Ткани и клетки с сильным клеточным ростом включают каллусы, культуры клеток, проростки или всходы, полученный из растений-мишеней; апикальные побеги, верхушки корней и другие.
Пример 18
Определение функций 3Rmyb растений
Чтобы определить функцию 3Rmyb растений, которые выделяли согласно способу примера 17, конструировали 3Rmyb-плазмиды растений для управляемой промотором 35S CaMV 35S экспрессии кДНК, выбранной в качестве мишени, и затем протопласты, приготовленные из клеток BY2 табака, совместно трансфицировали комбинацией плазмид, выбранной из следующих комбинаций (i) и (ii):
(i) 3Rmyb-плазмида растений (10 мкг/образец), плазмида промотор NACK1-LUC (10 мкг/образец) и плазмида R-LUC (1 мкг/образец),
(ii) плазмида pBI221 (10 мкг/образец), плазмида промотор NACK1-LUC (10 мкг/образец) и плазмида R-LUC (1 мкг/образец).
Полученные в результате протопласты анализировали в отношении активности LUC и активности R-LUC. Уровень активности LUC стандартизовали (удельная активность LUC) в соответствии с уровнем активности R-LUC. В том случае когда удельная активность LUC повышается в комбинации (i) по сравнению с удельной активностью в комбинации (ii), можно определить, что представители 3Rmyb растений являются формами активаторов транскрипции. В том случае когда удельная активность LUC уменьшается в комбинации (i) по сравнению с удельной активностью в комбинации (ii), можно определить, что представители 3Rmyb растений являются формами репрессоров транскрипции. Приготовление протопластов, перенос генов плазмид и анализы активности LUC и R-LUC могут быть осуществлены согласно способам, описанным в примере 3.
Пример 19
Создание растений с мужской стерильностью посредством специфичной для мужских репродуктивных органов экспрессии NtmybB
Растения могут быть трансформированы плазмидами для управляемой промотором, экспрессируемым специфично для мужских репродуктивных органов, экспрессии гена NtmybB, который репрессирует транскрипцию генов, специфично экспрессируемых в фазах G2/M. Модификация клеточного роста в мужском репродуктивном органе приводит к ингибированию или супрессии нормального образования пыльцы, таким образом, создавая возможность получения трансгенных растений с пониженной фертильностью семян.
(1) Конструирование плазмид
Ниже описан вариант конструирования плазмид для трансформации, которая делает возможной специфичную для мужских репродуктивных органов экспрессию NtmybB. Плазмиды, описанные в PCT/JP02/12268 (2002), pENTRAVP1 и pENTR0.6, являются плазмидами, несущими вставку промотора гена AtNACK2 Arabidopsis thaliana и промотора гена AVP1 Arabidopsis thaliana соответственно. ПЦР осуществляли, используя каждую из указанных плазмид в качестве матрицы в комбинации с
и
для pENTRAVP1, или
и
для pENTR0.6.
Амплифицированные фрагменты ДНК расщепляют HindIII и затем встраивают вместе с фрагментом ДНК для NtmybB, вырезанным SalI и EcoRV из pEXP-NtmybB, в SalI-HindIII-сайт pUC18 (Takara, Japan), чтобы создать pUC-AVP1-NtmybB и pUC-0.6-NtmybB соответственно. Фрагменты ДНК, вырезанные SacI-расщеплением pUC-AVP1-NtmybB и pUC-0.6-NtmybB, затем затупленные ДНК-полимеразой T4 на выступающем конце с последующим расщеплением HindIII, встраивали в сайт, полученный SacI-расщеплением pBI121 (Clontech), затем затуплением ДНК-полимеразой T4 выступающего конца с последующим расщеплением HindIII, чтобы создать pBI-PAVP1-NtmybB и pBI-N0.6-NtmybB соответственно. Плазмида pBI-PAVP1-NtmybB является бинарным вектором для управляемой промотором AVP1 экспрессии NtmybB. Указанная плазмида дает возможность для опосредованной Agrobacterium трансформации растений. Плазмида pBI-N0.6-NtmybB является плазмидным вектором для управляемой промотором AtNACK2 экспрессии NtmybB. Указанная плазмида дает возможность для опосредованной Agrobacterium трансформации растений. Растения, трансформированные указанными плазмидами, могут быть подвергнуты селекции с использованием канамицина.
(2) Трансформация Arabidopsis thaliana
Agrobacterium tumefaciens трансформируют бинарным вектором, выбранным из двух плазмид, которые созданы, как описано выше (1). Затем Arabidopsis thaliana экотипа Col-0 трансформируют способом погружения цветков (как описано в примере 8) для опосредованной Agrobacterium трансформации с использованием Agrobacterium, несущей указанную выше плазмиду. Семена, собранные из инфицированных Agrobacterium цветочных бутонов, стерилизуют хлорноватистой кислотой и стерильной водой и высевают в среду MS с добавлением 50 мкг/мл канамицина и 100 мкг/мл карбенициллина. Отбирают трансгенные растения, способные расти в среде с добавлением канамицина.
(3) Снижение фертильности трансгенных растений
Когда растения, полученные в результате использования бинарного вектора, описанного выше в (1) на указанной выше стадии (2), исследовали в отношении семян, образованных в оболочках, обнаружили, что количество семян уменьшается относительно растений дикого типа и созданы трансгенные растения с пониженной фертильностью.
Пример 20
Создание растений с мужской стерильностью посредством специфичной для мужских репродуктивных органов экспрессии NtmybB
Растения могут быть трансформированы плазмидами для управляемой промотором, экспрессируемым специфично для мужских репродуктивных органов, экспрессии гена NtmybB, который репрессирует транскрипцию генов, экспрессируемых в фазах G2/M. Модификация клеточного роста в мужском репродуктивном органе приводит к ингибированию или супрессии нормального образования пыльцы, таким образом, создавая возможность получения трансгенных растений с пониженной фертильностью семян.
(1) Конструирование плазмид
Применимые гены для регистрируемой экспрессии, специфичной для мужских репродуктивных органов, включают ген AVP1 Arabidopsis thaliana и ген AtNACK2 Arabidopsis thaliana. Промоторные области указанных генов используют для конструирования плазмид. Имеющаяся ДНК, кодирующая каждую область промотора указанных генов, включает вставки промоторных областей в плазмидах pENTRAVP1(AVP1) и pENTR0.6(AtNACK2), которые описаны в PCT/JP02/12268 (2002). ДНК, кодирующую NtmybB, можно получить из OH88. Указанные фрагменты ДНК встраивают в сайт, полученный удалением промотора 35S CaMV и гена GUS из pBI121 (Clontech), чтобы создать плазмиды, в которых оперативно слиты промотор AVP1, NtmybB и терминатор Nos, или плазмиды, в которых оперативно слиты промотор AtNACK2, NtmybB и терминатор Nos. Указанные плазмиды являются бинарными векторами для управляемой промотором AVP1 или промотором AtNACK1 экспрессии NtmybB, который создает возможность для опосредованной Agrobacterium трансформации растений. Полученные в результате трансгенные растения можно подвергнуть селекции с использованием канамицина.
(2) Трансформация of Arabidopsis thaliana
Плазмиды, полученные в результате указанной выше стадии (1), используют для трансформации Agrobacterium tumefaciens. Затем Arabidopsis thaliana экотипа Col-0 трансформируют способом погружения цветков (таким же образом, как в примере 8) для опосредованной Agrobacterium трансформации с использованием Agrobacterium, несущей указанную выше плазмиду. Семена, полученные из инфицированных Agrobacterium цветочных бутонов, стерилизуют хлорноватистой кислотой и стерильной водой и высевают в среду MS с добавлением 50 мкг/мл канамицина и 100 мкг/мл карбенициллина. Отбирают трансгенные растения, способные расти в среде с добавлением канамицина.
(3) Снижение фертильности трансгенных растений
Когда растения, полученные в результате использования бинарного вектора, описанного выше в (1), на указанной выше стадии (2), исследовали в отношении их семян, образованных в оболочках, обнаружили, что количество семян уменьшается относительно растений дикого типа и созданы трансгенные растения с пониженной фертильностью.
Пример 21
Модификация роста и развития трансгенных растений табака с подавленной экспрессией NtmybA1 и NtmybA2
RNAi используют для того, чтобы репрессировать экспрессию эндогенных NtmybA1 и tmybA2 в трансгенных растениях табака с подавленным ростом и развитием.
(1) Конструирование плазмид
ДНК конструируют связыванием части ДНК для NtmybA1 или NtmybA2, или ДНК как для NtmybA1, так и для NtmybA2 в виде структуры инвертированного повтора. Когда элементы связаны в виде инвертированного повтора, ДНК, кодирующую GUS, встраивают в виде спейсера между повторами. Полученные в результате ДНК с инвертированными повторами используют в качестве ДНК RNAi. Оперативно слитая ДНК, несущая промотор 35S CaMV, ДНК RNAi и терминатор Nos, встраивают в плазмиду pBI-RHL. Указанные плазмиды являются плазмидами для управляемой промотором 35S CaMV экспрессии двунитевой формы РНК, кодирующей NtmybA1, NtmybA2 или оба белка NtmybA1 и NtmybA2, которые дают возможность для осуществления опосредованной Agrobacterium трансформации растений. Полученные в результате трансгенные растения могут быть подвергнуты селекции с использованием гигромицина. В полученных в результате трансгенных растениях экспрессия эндогенного NtmybA1 или NtmybA2 или обоих эндогенных NtmybA1 и NtmybA2 снижается, что инициируется экспрессированной двунитевой РНК. То есть в растениях можно получить механизм RNAi.
(2) Трансформация растений табака
Сконструированные плазмиды в результате осуществления указанной выше стадии (1) используют для трансформации Agrobacterium tumefaciens. Затем Nicotiana tabacum ver. SR1 трансформируют способом листовых дисков, используя Agrobacterium, несущие каждые плазмиды. Полученные в результате устойчивые к гигромицину каллусы подвергают дифференцировке, чтобы регенерировать отдельные трансгенные растения, которые обеспечивают продукцию семян в результате самоопыления.
(3) Модификация роста и развития трансгенных растений
Полученные при самоопылении семена трансгенных растений, полученных в результате указанной выше стадии (2) с использованием бинарного вектора согласно вышеуказанному пункту (1), высевали и выращивали. Когда исследовали состояние их роста и развития, то обнаружили, что рост и развитие полученных в результате трансгенных растений табака подавлены по сравнению с ростом и развитием растений дикого типа.
Пример 22
Модулирование роста и развития трансформированных Ntmyb растений табака
В трансгенных растениях табака, которые экспрессируют представитель, выбранный из эндогенного NtmybA2, NtmybA2T5, NtmybA2T2 и NtmybB, их рост и развитие ингибированы или подавлены.
В трансгенных растениях табака, в которых экспрессия представителя, имеющего форму активатора транскрипция, выбранного из эндогенного NtmybA1, эндогенного NtmybA2 и обоих эндогенных NtmybA1 и NtmybA2, является молчащей или супрессирована RNAi, их рост и развитие ингибированы или подавлены.
(1) Конструирование плазмид
Плазмиду pRHL (описанную в PCT/JP02/12268 (2002)), расщепляли ApaI, затупляли ДНК-полимеразой T4 на выступающем конце и затем подвергали самолигированию, чтобы создать pRHL2. Плазмиду pRHL2 расщепляли XhoI, затупляли фрагментом Кленова на выступающем конце и затем подвергали самолигированию, чтобы создать pRHL3. Плазмиду pRHL3 расщепляли SpeI, затупляли фрагментом Кленова на выступающем конце и затем подвергали самолигированию, чтобы создать pRHL4.
Фрагмент ДНК, несущий кассету ccdB, вырезанную расщеплением EcoRI из pENTR2B (Invitrogen), затупляли фрагментом Кленова на выступающем конце и встраивали в XmnI-BsaAI-сайт pDONR201 (Invitrogen), чтобы создать pDONR201ΔCm1. Плазмида, несущая вставку фрагмента ДНК в обратном направлении по сравнению с pDONR201ΔCm1, обозначена «pDONR201ΔCm3».
Фрагмент ДНК, вырезанный расщеплением ApaI-SmaI из pDONR201ΔCm1, встраивали в ApaI-SmaI-сайт pBluescriptTMII (Stratagene), чтобы создать pBS-attP.
Фрагмент ДНК, вырезанный расщеплением EcoRI из pDHu1-1 (любезно предоставлена Yoshihisa UENO, Graduate School of Science, Nagoya University, Japan), затупляли на выступающем конце фрагментом Кленова и затем встраивали в SmaI-сайт pRHL4, чтобы создать pRHGUSRiL.
Фрагмент ДНК, вырезанный расщеплением ApaI и NruI из pDONR201ΔCm3, встраивали в сайт, полученный расщеплением ApaI и SmaI плазмиды pRHGUSRiL, чтобы создать pRHGUSRiP1.
Фрагмент ДНК, вырезанный расщеплением ApaI из pBS-attP, затуплением ДНК-полимеразой T4 выступающего конца с последующим расщеплением SpeI, встраивали в сайт, полученный XhoI-расщеплением pRHGUSRiP1, затуплением фрагментом Кленова выступающего конца с последующим расщеплением SpeI, чтобы создать pRHGUSRiP2.
Фрагмент ДНК, вырезанный расщеплением BglII из pRHGUSRiP2, встраивали в сайт, полученный BglII-расщеплением pBI121 с последующим удалением вырезанного фрагмента ДНК, чтобы создать pBI-GUSRiP1.
ПЦР осуществляли с использованием в качестве матрицы pBS-VA1A2, которая описана в примере 10 (1), в комбинации с
и
чтобы получить фрагмент ДНК, несущий тандемно связанный участок ДНК, кодирующий часть NtmybA1, и тандемно связанный участок ДНК, кодирующий часть NtmybA2, в котором последовательность attB1 (система GatewayTM, Invitrogen) добавляли к одному концу, а последовательность attB2 (система GatewayTM, Invitrogen) добавляли к другому концу. Смесь указанного фрагмента ДНК и плазмиды pBI-GUSRiP1 (Invitrogen) подвергали реакции BP, используя ClonaseTM BP (Invitrogen), чтобы создать pBIHm-A1A2RNAi, в которой ДНК, несущая тандемно связанный участок ДНК, кодирующий часть NtmybA1, и тандемно связанный фрагмент ДНК, кодирующий часть NtmybA2, встроены в виде структуры инвертированного повтора в pBI-GUSRiP1.
ПЦР осуществляют с использованием в качестве матрицы pBS-VA1, которая описана в примере 10 (1), в комбинации с
и
чтобы получить фрагмент ДНК, несущий участок ДНК, кодирующий часть NtmybA1, где последовательность attB1 (система GatewayTM, Invitrogen) добавлена к одному концу, а последовательность attB2 (система GatewayTM, Invitrogen) добавлена к другому концу. Смесь указанного фрагмента ДНК и плазмиды pBI-GUSRiP1 (Invitrogen) подвергают реакции BP, используя ClonaseTM BP (Invitrogen), чтобы создать pBIHm-A1RNAi, в которой ДНК, несущая участок ДНК, кодирующий часть NtmybA1, встроена в виде стуркутры инвертированного повтора в pBI-GUSRiP1.
ПЦР осуществляют с использованием в качестве матрицы pBS-VA2, которая описана в примере 10 (1), в комбинации с
и
чтобы получить фрагмент ДНК, несущий участок ДНК, кодирующий часть NtmybA2, где последовательность attB1 (система GatewayTM, Invitrogen) добавлена к одному концу, а последовательность attB2 (система GatewayTM, Invitrogen) добавлена к другому концу. Смесь указанного фрагмента ДНК и плазмиды pBI-GUSRiP1 (Invitrogen) подвергают реакции BP, используя ClonaseTM BP (Invitrogen), чтобы создать pBIHm-A2RNAi, в которой ДНК, несущая участок ДНК, кодирующий часть NtmybA2, встроена в виде структуры инвертированного повтора в pBI-GUSRiP1.
То есть плазмиды (i) pBIHm-A1A2RNAi, (ii) pBIHm-A1RNAi и (iii) pBIHm-A2RNAi являются бинарными векторами для управляемой промотором 35S CaMV экспрессии двунитевой формы (i) РНК, кодирующей оба белка NtmybA1 и NtmybA2, (ii) РНК, кодирующей NtmybA1, и (iii) РНК, кодирующей NtmybA2 соответственно, которые обеспечивают опосредованную Agrobacterium трансформацию растений. Полученные в результате трансгенные растения могут быть подвергнуты селекции с использованием гигромицина. В трансгенных растениях, полученных в результате трансформации представителем, выбранным из бинарных векторов (i)-(iii), уровни in vivo обоих экспрессированных эндогенных NtmybA1 и NtmybA2 в случае вектора (i), экспрессированного эндогенного NtmybA1 в случае вектора (ii) экспрессированного эндогенного NtmybA2 в случае вектора (iii), снижаются, что запускается экспрессированной двунитевой РНК. То есть в растениях может быть получен механизм RNAi.
(2) Трансформация растений табака
Растения табака трансформируют следующими плазмидами:
(i) плазмида pBIHm-A1A2RNAi (вышеуказанный пункт (1)),
(ii) плазмида pBIHm-A1RNAi (вышеуказанный пункт (1)),
(iii) плазмида pBIHm-A2RNAi (вышеуказанный пункт (1)),
(iv) плазмида pBIHm-NtmybA2 (пример 8 (1)),
(v) плазмида pBIHm-NtmybA2T2 (пример 8 (1)),
(vi) плазмида pBIHm-NtmybB (пример 8 (1)),
(vii) плазмида pDBIHm-NtmybA2T5 (пример 9 (1)),
(viii) плазмида pBIHm-GFP (пример 8 (1)),
(ix) плазмида pPZP211 (пример 9 (1)),
(x) плазмида pPCYM-NtmybA2T2 (пример 9 (1)),
(xi) плазмида pPZP211-35S:A2RNAi (пример 11 (1)),
(xii) плазмида pPZP-35S:A2 (пример 12 (1)),
(xiii) плазмида pPZP-35S:A2T2 (пример 12 (1)).
Плазмиды (i)-(xiii) используют для трансформации Agrobacterium tumefaciens. Затем Nicotiana tabacum ver. SR1 трансформируют способом листовых дисков, используя Agrobacterium, несущие каждую из плазмид. Устойчивые к гигромицину трансгенные растения получают при использовании плазмид (i)-(viii), тогда как устойчивые к канамицину трансгенные растения получают при использовании плазмид (ix)-(xiii). Полученные в результаты каллусы подвергаются дифференцировке с регенерацией отдельных трансгенных растений, которые позволяют получать семена, образованные при самоопылении.
(3) Модификация роста и развития трансгенных растений
Полученные при самоопылении семена трансгенных растений, полученных в результате указанной выше стадии (2), высевали и выращивали. Когда исследовали состояние их роста и развития, то обнаружили, что рост и развитие трансгенных растений табака, полученных в результате использования представителя, выбранного из векторов (i)-(vii), указанных выше (2), ингибированы или подавлены по сравнению с ростом и развитием трансгенных растений, получаемых с использованием вектора (viii), указанного выше (2), или растением дикого типа. Также обнаружили, что рост и развитие трансгенных растений табака, полученный в результате использования представителя, выбранного из векторов (x)-(xiii), указанных выше (2), ингибированы или подавлены по сравнению с ростом и развитием трансгенных растений, получаемых при использовании вектора (ix), указанного выше (2), или растений дикого типа.
Пример 23
Создание мутантов NtmybA1, Os3RmybA1, AtMYB3R1 и AtMYB3R4 с измененной способностью активировать транскрипцию
Представители 3Rmyb растений в форме активаторов транскрипции, NtmybA1, Os3RmybA1, AtMYB3R1, и AtMYB3R4, могут быть укорочены на C-конце, чтобы создать молекулы с повышенной способностью активировать транскрипцию или молекулы с пониженной способностью активировать транскрипцию. Сайты или области, которые необходимо делетировать, можно определить на основе примера 14 и фиг.15-18 или на основе примера 15 и фиг.19-25.
То есть в случае NtmybA1 делеция аминокислотных остатков в пределах положений 579-1003, 641-1003 или 715-1003 аминокислотной последовательности NtmybA1 позволит создать мутанты NtmybA1, обладающие повышенной способностью активировать транскрипцию. В случае Os3RmybA1 делеция аминокислотных остатков в пределах положений 575-993, 635-993 или 709-993 аминокислотной последовательности Os3RmybA1 позволит создать мутанты Os3RmybA1, обладающие повышенной способностью активировать транскрипцию. В случае AtMYB3R1 делеция аминокислотных остатков в пределах положений 583-776, 621-776 или 691-776 аминокислотной последовательности AtMYB3R1 позволит создать мутанты AtMYB3R1, обладающие повышенной способностью активировать транскрипцию. В случае AtMYB3R4 делеция аминокислотных остатков в пределах положений 570-961, 608-961 или 667-961 аминокислотной последовательности AtMYB3R4 позволит создать мутанты AtMYB3R4, обладающие повышенной способностью активировать транскрипцию.
Кроме того, в случае NtmybA1 делеция аминокислотных остатков в пределах положений 186-1003 или 299-1003 аминокислотной последовательности NtmybA1 позволит создать мутанты NtmybA1, обладающие пониженной способностью активировать транскрипцию. В случае Os3RmybA1 делеция аминокислотных остатков в пределах положений 203-993 или 257-993 аминокислотной последовательности Os3RmybA1 позволит создать мутанты Os3RmybA1, обладающие пониженной способностью активировать транскрипцию. В случае AtMYB3R1 делеция аминокислотных остатков в пределах положений 187-776 или 241-776 аминокислотной последовательности AtMYB3R1 позволит создать мутанты AtMYB3R1, обладающие пониженной способностью активировать транскрипцию. В случае AtMYB3R4 делеция аминокислотных остатков в пределах положений 181-961 или 235-961 аминокислотной последовательности AtMYB3R4 позволит создать мутанты AtMYB3R4, обладающие пониженной способностью активировать транскрипцию.
Способность активировать транскрипцию, вызываемая указанными выше мутантами, может быть определена согласно способам, которые описаны в примерах 3 и 18, в результате оценки уровней управляемой промотором NACK1 транскрипции в условиях временной экспрессии в протопластах BY2. В каждом случае способность активировать транскрипцию указанных делеционных мутантов повышена или понижена относительно способности активировать транскрипцию образцов дикого типа.
Пример 24
Карликовость трансгенных растений табака, которые сверхэкспрессируют NtmybA2
(1) Трансформация растений табака
Agrobacterium tumefaciens штамма EHA101 трансформировали представителем, выбранным из указанных выше плазмид, pBIHm-NtmybA2 и pBIHm-GFP. Затем растения Nicotiana tabacum ver. SR1 трансформировали способом листовых дисков, используя Agrobacterium, несущие одну из плазмид.
(2) Уровни экспрессии перенесенных генов в трансгенных растениях табака
Полученные в результате отдельные растения, устойчивые к гигромицину, культивировали, чтобы получить семена после самоопыления. Полученные в результате самоопыления семена от трансформированных NtmybA2 линий AW№3 и AW№23, и GFP-трансформированной линии G№3 высевали в пластиковый горшок (13 см), наполненный почвенной смесью (Kureha-Engei-Baido, Kureha Chemical Industry Co., Ltd.), и культивировали при 27°C. Условия освещенности заключались в культивировании в течение 18 час при непрерывном освещении и культивировании в течение 6 час в темноте. Экспрессию перенесенных генов в указанных линиях проверяли в ОТ--ПЦР. Брали образцы случайных верхушечных листов от 5 отдельных растений линии и осуществляли амплификацию NtmybA2 согласно способу указанного выше примера 10 (2). Полученные в результате продукты ПЦР анализировали способом электрофореза в агарозном геле. В результате уровни экспрессированного NtmybA2 возрастали в линиях AW№3 и AW№23 относительно линии G№3, и сверхэкспрессию перенесенных генов подтверждали в линиях AW№3 и AW№23.
(3) Карликовость трансформированных NtmybA2 растений табака
Продолжали культивирование соответствующих отдельных растений со сверхэкспрессией NtmybA2, подтвержденной на указанной выше стадии (2), и успешно исследовали высоту их побегов и количество собственно листьев. В результате отдельные растения с повышенными уровнями экспрессированного NtmybA2, AW№3 и AW№23 имели уменьшенную высоту побегов (фиг.32) и меньший размер листьев по сравнению с G№3. Обнаружено, что в AW№3 и AW№23 количество настоящих листьев имеет тенденцию к небольшому снижению (фиг.33). Их междоузлия также значительно укорочены. Указанные факты свидетельствуют, что трансгенные растений табака с управляемой промотором 35S CaMV экспрессией NtmybA2 являются карликовыми.
(4) Уменьшенное количество клеток и уменьшенные по размеру клетки в трансформированных NtmybA2 растениях табака
Линию трансгенных растений AW№23, культивированную на описанной выше стадии (3), сравнивали с табаком дикого типа в отношении размера их собственно листьев и клеток эпидермиса. Что касается собственно листьев, подвергаемых исследованию, использовали полностью раскрывшиеся листья, которые были расположены в одном и том же положении листа и у табака дикого типа и растений AW№23. Когда указанные листья сравнивали по размеру, то размер листьев AW№23 был примерно на 80% меньше, чем размер листьев табака дикого типа. Чтобы исследовать клетки эпидермиса в данном листе, готовили образцы листовых дисков и обесцвечивали-фиксировали смесью этанол:уксусная кислота (9:1). Полученные в результате образцы листовых дисков фотографировали с использованием дифференциального интерференционного контрастного микроскопа и измеряли область из 50 клеток эпидермиса в каждом образце. В результате область клеток была примерно на 45% меньше в AW№23 по сравнению с областью клеток в растении дикого типа, обнаружено, что размер клеток уменьшался в AW№23. На основании указанных выше результатов размер клеток, составляющих листья, оказывается на 45% меньше в AW№23, кроме того, размер листьев уменьшается до более миниатюрного состояния, т.е. является меньшим на 80%, и поэтому предполагается, что причиной карликовых листьев кроме уменьшения размера клеток является уменьшение количества клеток. Также предполагается, что количество клеток уменьшается вследствие замедления клеточного цикла.
Пример 25
Карликовость трансгенных растений табака для управляемой промотором AtHB8 Arabidopsis thaliana экспрессии NtmybA2
Создавали трансгенные растения табака для управляемой промотором гена AtHB8 Arabidopsis thaliana экспрессии NtmybA2 и сравнивали состояния их роста и развития.
(1) Конструирование плазмид для трансформации
Конструирование плазмиды pDBIHm-PAtHB8-NtmybA2
ПЦР осуществляли, используя геномную ДНК Arabidopsis thaliana в качестве матрицы в комбинации с
и
чтобы получить фрагмент ДНК, несущий область промотора гена AtHB8 Arabidopsis thaliana (SEQ ID NO: 98, промотор AtHB8, GenBank, № доступа AL161582; используемые нуклеотиды 89580-91279)). ПЦР осуществляли, используя OH60 в качестве матрицы в комбинации с
и
чтобы получить фрагмент ДНК, несущий участок для части NtmybA2.
Продукт ПЦР, ДНК промотора AtHB8, расщепляли PstI и BamHI. Фрагмент ДНК, несущий участок для части NtmybA2, расщепляли BamHI и NotI. Указанные два фрагмента ДНК встраивали в сайт, полученный PstI-NotI-расщеплением pBluescript (Stratagene), чтобы создать плазмиду pBS-PAtHB8-NtmybA2T2.
Плазмиду pTH2 (Chiu et al., Curr. Biol. 1996 Mar. 1; 6 (3): 325-30) расщепляли EcoRI, фрагментом Кленова затупляли выступающий конец и затем расщепляли NotI, чтобы вырезать фрагмент ДНК, несущий терминатор NOS. Полученный в результате фрагмент ДНК встраивали в сайт, полученный расщеплением NotI-EcoRV плазмиды pENTR2B (Invitrogen), чтобы создать плазмиду pENTR-NOST1.
Фрагмент ДНК, вырезанный расщеплением SalI-NotI из pBS-PAtHB8-NtmybA2T2, встраивали в сайт, полученный SalI-NotI-расщеплением pENTR-NOST1, чтобы создать плазмиду pENTR-PAtHB8-NtmybA2T2.
OH60 расщепляли SalI, фрагментом Кленова затупляли выступающий конец и затем расщепляли SpeI, чтобы вырезать фрагмент ДНК, несущий C-концевую область NtmybA2. Указанный фрагмент ДНК встраивали в сайт, полученный SpeI-SmaI-расщеплением pENTR-PAtHB8-NtmybA2T2, чтобы создать плазмиду pENTR-PAtHB8-NtmybA2.
Смесь плазмиды pDESTBI-1 (которая сконструирована согласно примеру 9) и pENTR-PAtHB8-NtmybA2 подвергали сайт-специфичной рекомбинации с использованием смеси Gateway LR ClonaseTM (Invitrogen), чтобы создать pDBIHm-HB8-NtmybA2. Реакцию со смесью GatewayTM LR ClonaseTM осуществляли согласно протоколам, прилагаемым к реагенту. Вектор pDBIHm-HB8-NtmybA2 является плазмидным вектором для управляемой промотором AtHB8 экспрессии полноразмерного NtmybA2. Он также является бинарным вектором, позволяющим осуществлять опосредованную Agrobacterium трансформацию растений. Трансгенные растения могут быть отобраны с использованием гигромицина из растений, трансформированных указанными плазмидами.
(2) Трансформация растений табака
Указанную выше плазмиду pDBIHm-HB8-NtmybA2 использовали для трансформации Agrobacterium tumefaciens штамма EHA101. Затем растения Nicotiana tabacum ver. SR1 и Nicotiana bentamiana трансформировали способом листовых дисков, используя Agrobacterium, несущие одну из указанных плазмид.
(3) Карликовость трансгенных растений табака, которые экспрессируют NtmybA2 под управлением промотора AtHB8
Получают семена после самоопыления соответствующих линий трансформантов, полученных на описанной выше стадии (2). Полученные семена высевают в пластиковый горшок (13 см), наполненный почвенной смесью (Kureha-Engei-Baido, Kureha Chemical Industry Co., Ltd.), и культивируют при 27°C. Условия освещенности заключаются в культивировании в течение 18 час при непрерывном освещении и культивировании в течение 6 час в темноте. Указанные трансгенные растения являются карликовыми по сравнению с растениями табака дикого типа и растениями, трансформированными контрольным вектором.
Пример 26
Модификация полиплоидии у трансгенных растений Arabidopsis thaliana с репрессированной экспрессией Atmyb3R1 и Atmyb3R4
(1) Конструирование плазмид для экспрессии Atmyb3R1 и Atmyb3R4 RNAi
Чтобы создать трансгенные растения Arabidopsis thaliana для индукции RNAi в отношении Atmyb3R1 и Atmyb3R4, конструируют подходящие плазмиды. Последовательности ДНК, содержащие 250 или более пар оснований, амплифицируют в ПЦР на основе кДНК Atmyb3R1, которая показана в SEQ ID NO: 75, и кДНК Atmyb3R4, которая показана в SEQ ID NO: 76. Указанные два фрагмента ДНК связывают в виде тандема, чтобы создать конструкцию ДНК. Плазмиду конструируют лигированием полученной в результате конструкции ДНК в виде структуры инвертированного повтора, содержащего GUS, встроенный между повторами, согласно способу, такому же, как способ конструирования плазмиды из примера 11. Указанная плазмида является бинарным вектором, который обеспечивает возможность не только регулируемой промотором 35S CaMV экспрессии встроенной ДНК, но также опосредованной Agrobacterium трансформации растений Arabidopsis thaliana, при этом полученные в результате трансформанты могут быть отобраны с использованием канамицина. Механизм RNAi получают с помощью РНК, экспрессируемой перенесенным геном в растениях Arabidopsis thaliana, трансформированных указанной плазмидой, таким образом, приводя к снижению уровней экспрессируемых Atmyb3R1 и Atmyb3R4.
(2) Трансформация растений Arabidopsis thaliana
Arabidopsis thaliana экотипа Col-0 трансформируют способом погружения цветков (подобно примеру 8), используя Agrobacterium, несущие плазмиду, сконструированную согласно указанной выше стадии (1). Семена, полученные в результате самоопыления из инфицированных Agrobacterium растений, стерилизуют этанолом и хлорноватистой кислотой и хорошо промывают стерильной дистиллированной водой. Указанные семена культивируют в агаризованной среде MS с добавлением канамицина в концентрации 50 мкг/мл. Трансгенные растения можно отобрать в виде устойчивых к канамицину отдельных растений.
(3) Изменение эндополиплоидии трансгенных растений Arabidopsis thaliana
Полученные в результате трансформанты растений, отобранные на указанной выше стадии (2), высаживают в горшок и культивируют. Семена, полученные в результате самоопыления от указанных трансгенных растений, стерилизуют этанолом и хлорноватистой кислотой и промывают стерильной дистиллированной водой. Указанные семена культивируют в агаризованной среде MS с добавлением канамицина в концентрации 50 мкг/мл. Уровни содержания ядерной ДНК измеряют, используя розеточные листья от выращенных отдельных растений, устойчивых к канамицину, таким же образом, как в примере 11. Хотя Arabidopsis thaliana является диплоидным растением, пики 2C и 4C и, кроме того, пики 8C и 16 C, свидетельствующие о повышенном содержании ядерной ДНК вследствие эндоредупликации, наблюдают при измерении уровня содержания ДНК у Arabidopsis thaliana дикого типа. Отдельные растения с увеличенной эндополиплоидией могут быть идентифицированы при анализе уровня содержания ядерной ДНК в трансгенных растениях Arabidopsis thaliana с пониженными уровнями экспрессированного Atmyb3R1 и Atmyb3R4 при действии механизма RNAi. Отдельные растения, в которых пики 2C (регистрируемые у дикого типа) не наблюдаются, могут быть определены как тетраплоидные. Отдельные растения, в которых пики 2C и 4C исчезают и регистрируются пики 8C и 16C, могут быть определены как октаплоидные.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Предлагаются способы регуляции клеточного цикла, которые имеют важное значение для селекции растений и модифицирования пролиферации растительных клеток, и способы модифицирования развития/дифференцировки отдельных растений. Предлагаются растительные гены, применимые для регуляции роста растительных клеток и регуляции развития и дифференцировки отдельных растений, и способы их применения. С использованием данных способов могут быть получены новые линии растений и разработаны способы селекции растений. В частности, предлагаются способы модифицирования и регуляции функций генов 3Rmyb растений, новые мутантные гены 3Rmyb, имеющие модифицированные функции, их генные продукты и молекулы, имеющие к ним отношение. Также предлагаются варианты растительных белков 3Rmyb, у которых в значительной степени повышены функции активаторов транскрипции, и молекулы, которые функционируют доминантно-негативно против транскриптов генов 3Rmyb растений, и могут быть разработаны способы с их применением. Кроме того, на основе целенаправленного воздействия на указанные гены предлагаются способы модифицирования пролиферации растительных клеток и способы модифицирования развития/дифференцировки отдельных растений. Таким образом, могут быть получены растительные клетки и растения, сохраняющие модифицированный клеточный рост и развитие/дифференцировку, и могут быть созданы растения, обладающие требуемыми свойствами, такими как увеличение конкретного органа, мужская стерильность или повышенная устойчивость к стрессу.
Несмотря на то что настоящее изобретение конкретно подробно описано со ссылкой на определенные варианты осуществления изобретения и его примеры, должно быть понятно, что возможно практическое осуществление изобретения в другой форме. В свете данного описания будет понятно, что различные модификации и изменения составляют сущность и входят в объем прилагаемой формулы изобретения.
<Текст списка последовательностей на естественном языке>
SEQ ID NO: 1, олигонуклеотид, который действует в качестве праймера для ПЦР, n означает инозин в положениях 3, 6 и 15 и любое основание в положении 21,
SEQ ID NO: 2, олигонуклеотид, который действует в качестве праймера для ПЦР, n означает инозин,
SEQ ID NO: 3, олигонуклеотид, который действует в качестве праймера для ПЦР, n означает инозин,
SEQ ID NO: 4, олигонуклеотид. который действует в качестве праймера для ПЦР, n означает инозин,
SEQ ID NO: 5, олигонуклеотид. который действует в качестве праймера для ПЦР, n означает инозин,
SEQ ID NO: 6, олигонуклеотид, который действует в качестве праймера для ПЦР, n означает инозин,
SEQ ID NO: 7, олигонуклеотид, который действует в качестве праймера для ПЦР, праймер T7,
SEQ ID NO: 11, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 12, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 13, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 14, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 15, олигонуклеотид, который действует в качестве праймера для ПЦР, праймер T3,
SEQ ID NO: 16, n означает любое основание,
SEQ ID NO: 18, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 19, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 20, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 21, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 24, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 25, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 26, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 27, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 28, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 29, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 30, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 31, ОРС Os3RmybA1,
SEQ ID NO: 33, праймер ОТ-ПЦР для NtmybA1/A2,
SEQ ID NO: 34, праймер ОТ-ПЦР для NtmybA1/A2,
SEQ ID NO: 35, праймер ОТ-ПЦР для EF1α,
SEQ ID NO: 36, праймер ОТ-ПЦР для EF1α,
SEQ ID NO: 37, ПЦР-праймер для ДНК VIGS A1,
SEQ ID NO: 38, ПЦР-праймер для ДНК VIGS A1,
SEQ ID NO: 39, ПЦР-праймер для ДНК VIGS A2,
SEQ ID NO: 40, ПЦР-праймер для ДНК VIGS A2,
SEQ ID NO: 41, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 42, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 43, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 44, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 45, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 46, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 47, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 48, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 50, DDBJ, № доступа AB056122, NtmybA1 (DDBJ № доступа BAB70510),
SEQ ID NO: 52, DDBJ, № доступа AB056123, NtmybA2 (DDBJ, № доступа BAB70511),
SEQ ID NO: 54, DDBJ, № доступа AB056124, NtmybB (DDBJ, № доступа BAB70512),
SEQ ID NO: 56, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 57, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 58, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 59, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 60, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 61, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 62, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 63, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 64, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 65, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 66, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 67, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 68, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 69, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 70, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 71, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 72, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 73, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 74, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 84, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 85, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 86, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 87, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 89, сконструированная аминокислотная последовательность,
SEQ ID NO: 90, сконструированная аминокислотная последовательность, X означает любой аминокислотный остаток,
SEQ ID NO: 91, сконструированная аминокислотная последовательность, X означает любой аминокислотный остаток,
SEQ ID NO: 92, сконструированная аминокислотная последовательность, X означает любой аминокислотный остаток в положениях 3, 4, 7 и 8, означает S или T в положении 2, D или E в положении 6 и L, или I, или V в положении 9,
SEQ ID NO: 93, сконструированная аминокислотная последовательность, X означает H, W, Y или F в 16 и 93, K, H или R в 19, 67, 102, 123, 129, 134 и 150, S, T, G, C или A в 32, 54, 77, 135, 138 и 146, D или E в 33 и 110, L, I или V в 34, 49, 61, 65, 76 и 127, и любой остаток в других положениях,
SEQ ID NO: 94, сконструированная аминокислотная последовательность, X означает K или R в 4 и 17, L или V в 11, S или T в 12, L, I или V в 14, D или E в 16 и 20, и любой аминокислотный остаток в других положениях,
SEQ ID NO: 95, сконструированная аминокислотная последовательность, X означает K, или R, или D, или E, или H в положении 7 и любой аминокислотный остаток в положении 5,
SEQ ID NO: 96, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 97, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 99, олигонуклеотид, который действует в качестве праймера для ПЦР,
SEQ ID NO: 100, олигонуклеотид, который действует в качестве праймера для ПЦР.
















































































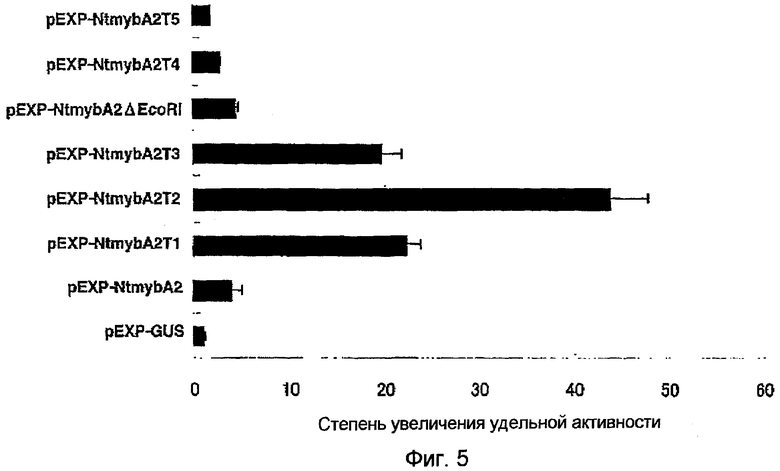
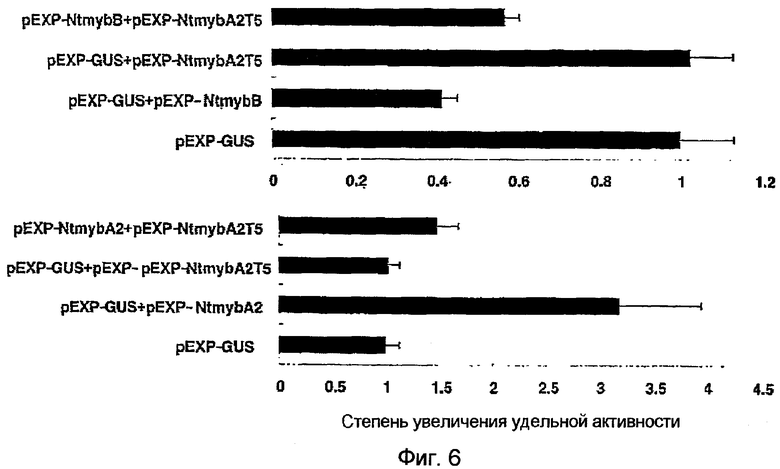
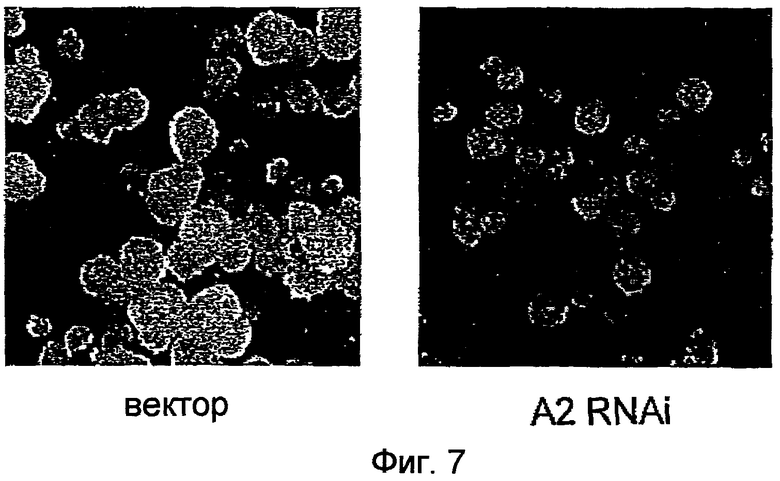
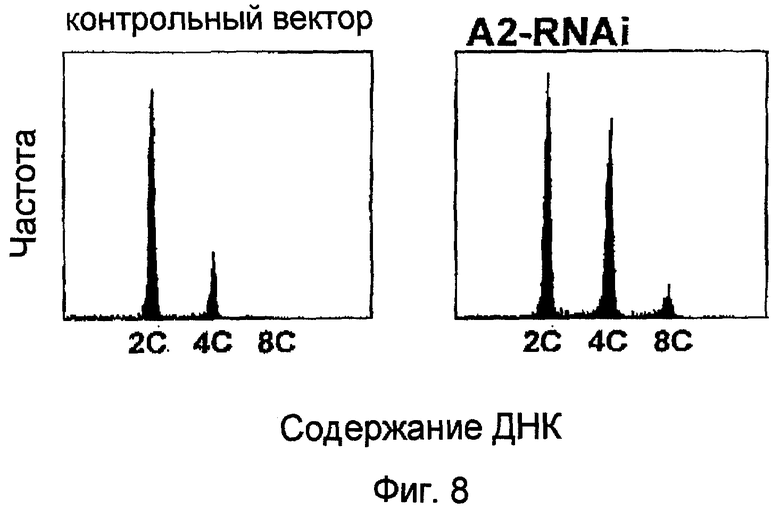
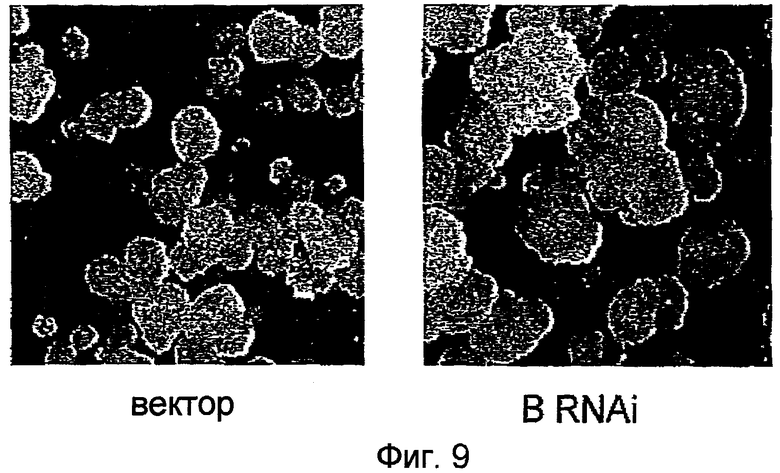
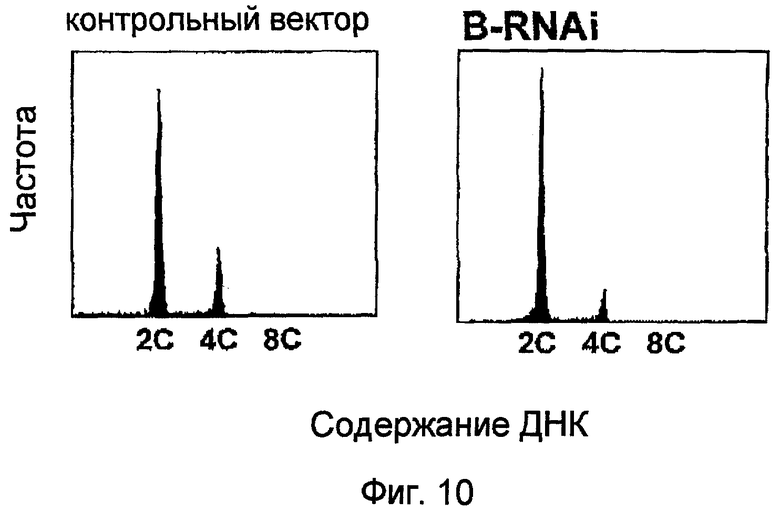
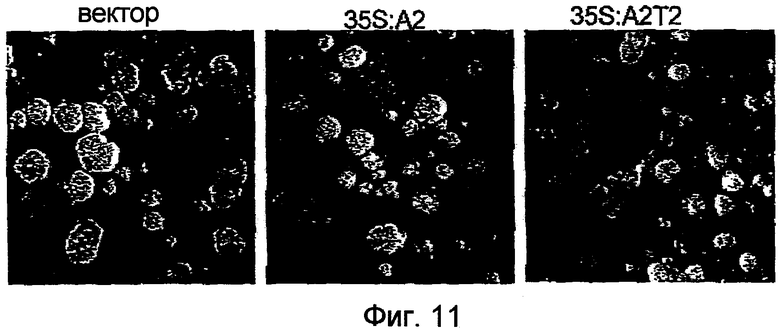
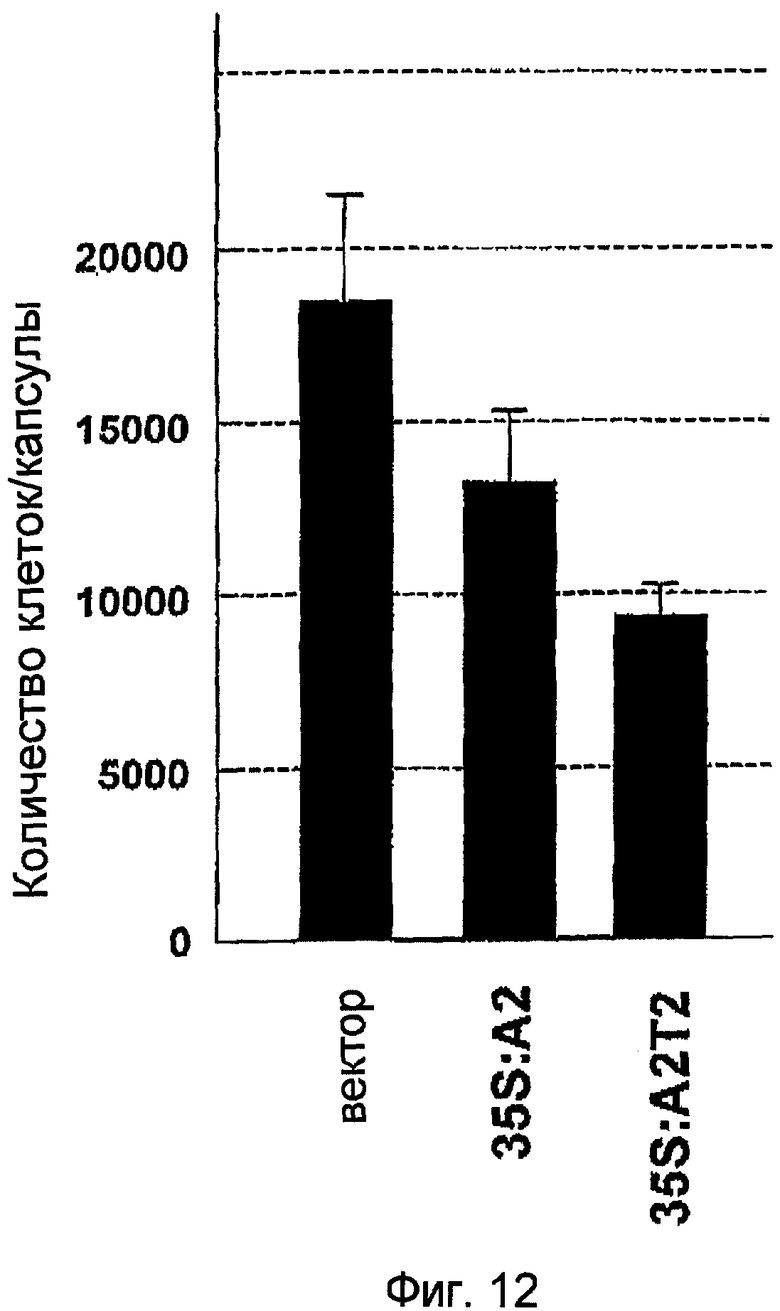
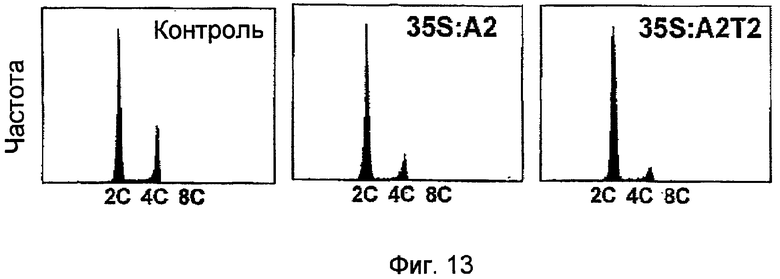



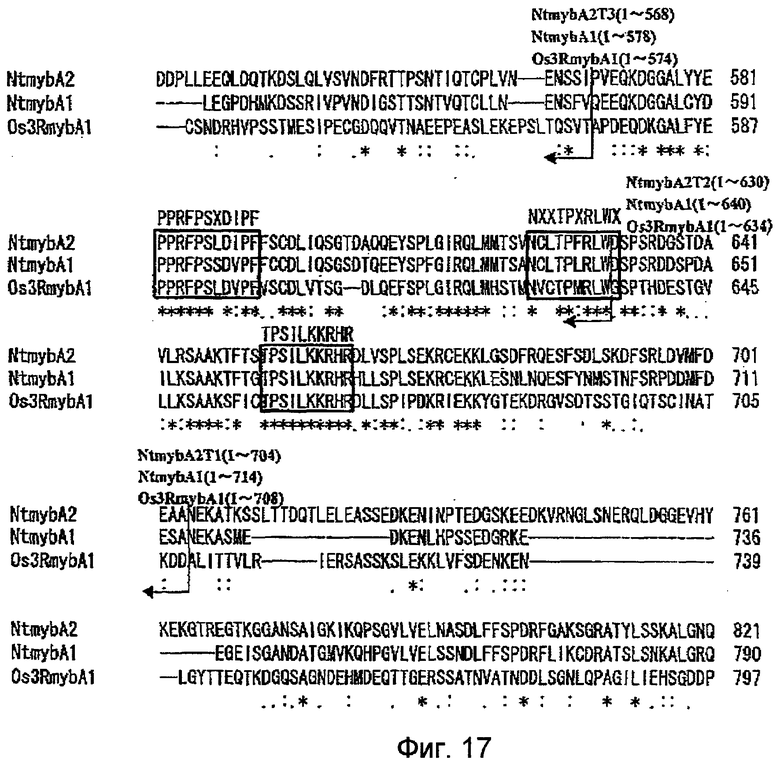



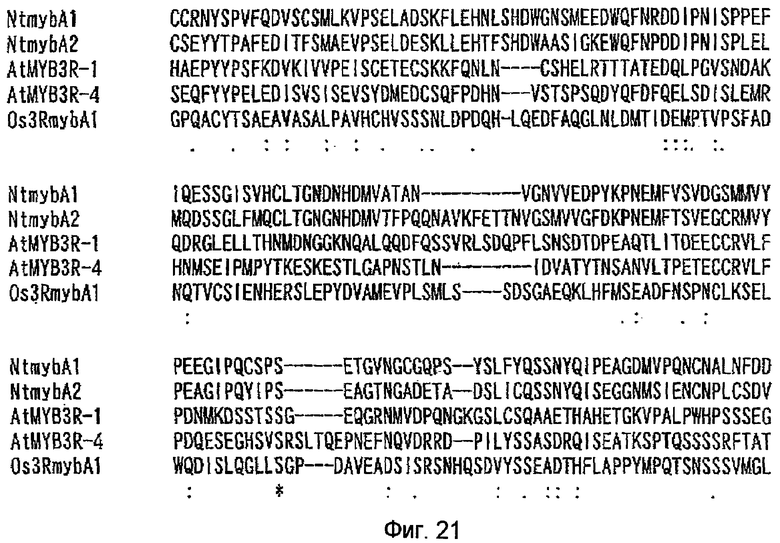


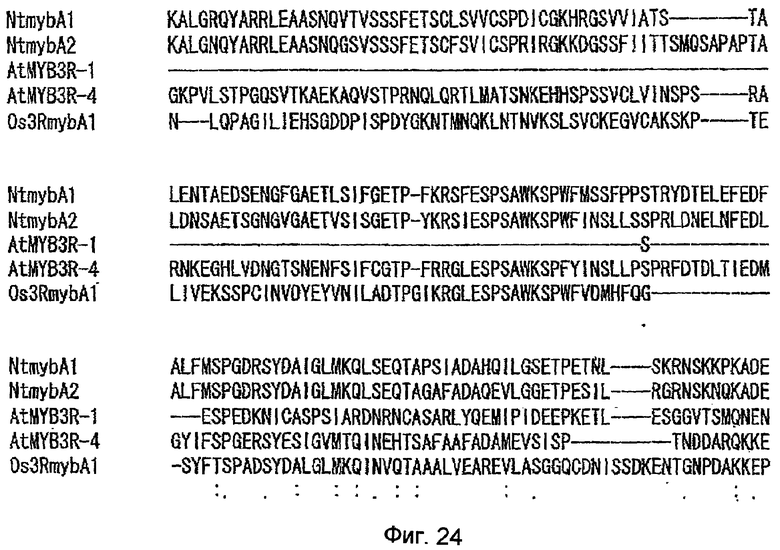





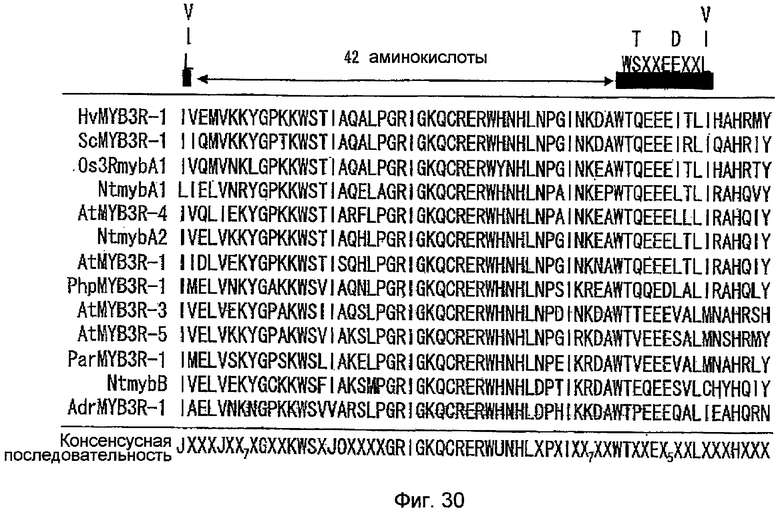

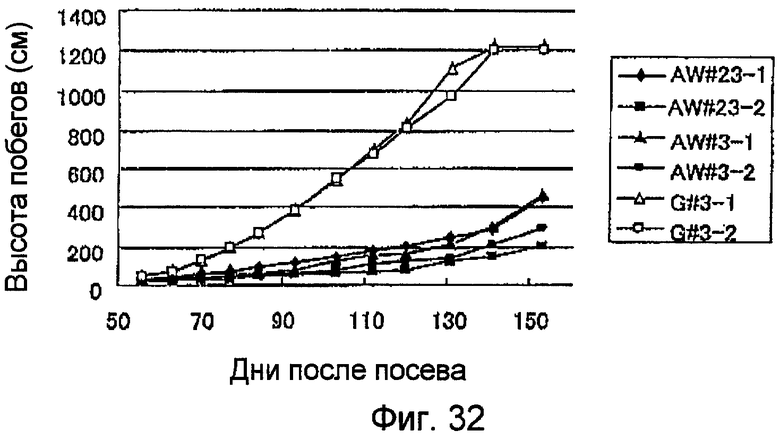
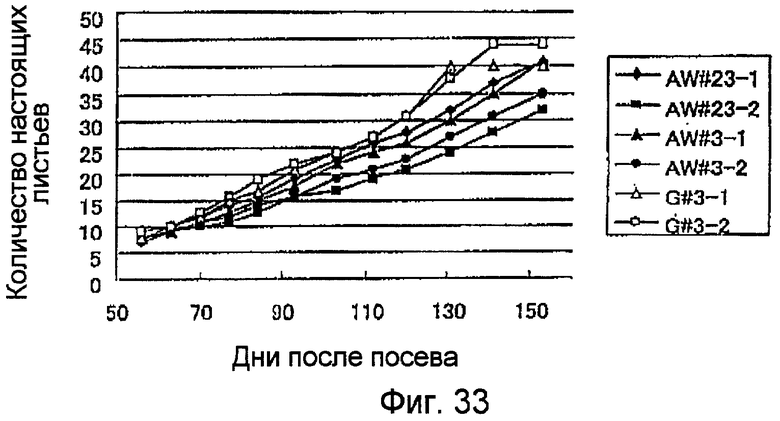
Растительную клетку трансформируют ДНК, кодирующей растительные белки 3Rmyb или РНК, супрессирующую экспрессию белков 3Rmyb. Белок 3Rmyb растений является фактором, активирующим специфичную для фазы G2/M транскрипцию, т.е. фактором, необходимым для роста растительных клеток. Растение, регенерированное из такой клетки, обладает гипертрофией специфичного органа, мужской стерильностью или устойчивостью к стрессу. 2 н. и 10 з.п. ф-лы, 33 ил.
(a) ДНК, кодирующая любую аминокислотную последовательность растительных белков 3Rmyb,
(b) ДНК, которая гибридизуется в жестких условиях с ДНК, кодирующей любую аминокислотную последовательность растительных белков 3Rmyb, и кодирует белок, функционально эквивалентный любому из растительных белков 3Rmyb;
(c) ДНК, кодирующая рибозимную каталитическую РНК, которая специфически расщепляет или разрушает транскрипт ДНК, кодирующей любой из растительных белков 3Rmyb;
(d) ДНК, не только кодирующая РНК, которая супрессирует экспрессию ДНК, кодирующей любой из растительных белков 3Rmyb, посредством механизмов косупрессии при экспрессии в растительной клетке, но также являющаяся по меньшей мере на 90% гомологичной ДНК 3Rmyb;
(e) ДНК, кодирующая РНК, которая супрессирует экспрессию ДНК, кодирующей любой из растительных белков 3Rmyb, посредством механизмов интерференции РНК при экспрессии в растительной клетке;
(f) ДНК, кодирующая антисмысловую РНК, которая комплементарна транскрипту ДНК, кодирующей любой из растительных белков 3Rmyb;
(g) рекомбинантная конструкция ДНК или вектор, состоящие из следующих представителей (i)-(iii):
(i) промотора, способного к транскрипции в растительной клетке,
(ii) ДНК, где ДНК по любому из указанных выше пп.(a)-(f) связана с указанной последовательностью промотора в смысловом или антисмысловом направлении, и
(iii) сигнал терминации транскрипции и полиаденилирования молекулы РНК.
где X означает любую аминокислоту, X1 означает K или R, Х2 означает L, I или V, Х3 означает L или V, Х4 означает S или Т и Х3 означает D или Е.
где X означает любую аминокислоту, а Х6 означает K, R, D, Е или Н.
| THE PLANT CELL, 2001, vol.13, pp.1891-1905 | |||
| CURRENT OPINION IN PLANT BIOLOGY, 2001, vol.4, pp.447-456 | |||
| THE EMBO JOURNAL, 2002, vol.21, pp.675-684 | |||
| NATURE, 2002, vol.420, pp.312-316. |
Авторы
Даты
2009-03-20—Публикация
2004-03-11—Подача