Изобретение относится к генной инженерии и микробиологической промышленности и может быть использовано для микробиологической иммобилизации белков.
Экспонирование белков на поверхности клеток микроорганизмов имеет ряд преимуществ по сравнению с иммобилизацией на синтетических сорбентах. Белок, продуцируемый клеткой, оказывается связанным с ней сразу после транспортировки его наружу, что сводит трудоемкий процесс очистки белка к простому отделению клеток фильтрацией. Более того, отпадает необходимость как в связывании белка с сорбентом, так и в сорбенте как таковом.
Необходимо отметить, что в природе широко распространен микробиологический способ экспозиции биологически активных молекул. В норме на поверхности клеток дрожжей располагаются множество белков, ответственных за флокуляцию (слипание), разнообразные литические ферменты, белки и гликопротеины, участвующие в строении и поддержании клеточной стенки (Biochimica et Biophysica Acta, review, 1999, 1426(2), pp.373-383). В настоящее время проводятся активные исследования, направленные на изучение белков клеточной стенки и их использование для получения клеточно-связанных молекул.
Существует два способа иммобилизации белков на поверхности клеток дрожжей - закрепление с помощью С концевых участков (доменов) белков клеточной стенки или с помощью N концевых участков.
В первом случае для закрепления белка на поверхности клеток в его аминокислотную последовательность добавляют С домен белка клеточной стенки, который содержит сигнал прикрепления гликозилфосфатидилинозитола (GPI-anchor). Гликозидный остаток в полученном комплексе обуславливает ковалентное прикрепление к 1, 6 гликанам клеточной стенки (WO 2009093118, US 2009280560, US 2009163379).
Исследования показали, что С домены разных белков клеточной стенки с разной степенью эффективности иммобилизируют интересующие белки (Applied and Environmental Microbiology, 1997, 63(2), pp.615-620). Так для Saccharomyces cerevisiae изучали использование С доменов белков клеточной стенки Aga1p, Cwp1p, Cwp2p, Tip1p, Tir1p, Sed1p, Ycr89w и Flo1p для получения клеточно-связанной α-галактозидазы. Показано, что С домены белков Sed1p и Cwp2p позволяют получить клеточно-связанную α-галактозидазу с активностью 1,2 и 1,3 единиц галактозидазной активности/мл, тогда как, например, при использовании С доменов белков Ycr89w и Flo1p активность экспонированного фермента составляет только 0,1 и 0,2 единиц галактозидазной активности/мл.
Благодаря данному подходу в S. cerevisiae иммобилизирован целый ряд белков, включая α-галактозидазу, глюкоамилазу, α-амилазу, целлюлазу, липазу, β-глюкозидазу, флюоресцентные белки и пептидные библиотеки (Genetic Biotechnology Advances, review, 2000, 18(2) pp.121-140), но получаемые количества иммобилизированных белков и активность ферментов в большинстве случаев невысоки. Например, активность липазы Rhizopus orizae ROL, иммобилизированной на поверхности клеток S. cerevisiae с помощью С домена Aga1p, составила всего 4,1 единиц липазной активности/г сухого веса (Applied Microbiology Biotechnology, 2001, 56(5-6), pp.681-686).
Лучшие результаты были получены в Pichia pastoris при экспонировании липазы В Candida antarctica CALB с помощью С домена белка Sed1p. Активность клеточно-связанной липазы в этом случае составила 220 единиц липазной активности/г сухого веса (Biotechnology Letters, 2010, 32(8), pp.1131-1136).
Второй способ иммобилизации белка - использование N домена белка клеточной стенки. В зависимости от используемого N домена, возможны разные варианты прикрепления к клеточной стенке. Присоединение может происходить непосредственно за счет ковалентного связывания с гликанами клеточной стенки (Applied and Environmental Microbiology, 2006, 72(11), pp.7003-7012), за счет связывания через дисульфидные мостики с белками клеточной стенки (Applied Microbiology Biotechnology, 2010, 88(4), pp.885-891), либо за счет нековалентного адгезионного присоединения к клеточной стенке (Applied Microbiology Biotechnology, 2010, 88(4), pp.885-891). Например, использование Aga2p (второй малой субъединицы α-агглютинина, которая связана через дисульфидные мостики с первой субъединицей Aga1p) для экспонирования липазы Yarrowia lipolytica Lip7 и Lip8 в S. cerevisiae позволило достичь активности клеточно-связанной липазы 283 и 121 единиц липазной активности/г сухого веса, соответственно (Applied Microbiology Biotechnology, 2010, 88(4), pp.885-891).
В дрожжах Y. lipolytica изучен белок, ковалентно связанный с гликанами клеточной стенки - Ylcwp1p (Microbiology, 2004, 150(1), pp.53-60). Его С домен использован для иммобилизации флуоресцентного белка EGFP, гемолизина Vibrio harveyi (Journal of Microbiological Methods, 2008, 72(2), pp.116-123) и щелочной протеазы (Marine Biotechnology, 2008, 11(1), pp.81-89). Однако полученные клеточно-связанные ферменты не обладали высокой активностью.
Охарактеризован также белок YIPir1, закрепленный на поверхности клетки за счет связи через дисульфидные мостики с белками клеточной стенки (Yeast, 2003, vol.20, pp.417-426).
Технической задачей, на решение которой направлено настоящее изобретение, является создание генетической конструкции, позволяющей экспонировать белки на поверхности клеточной стенки Y. lipolytica.
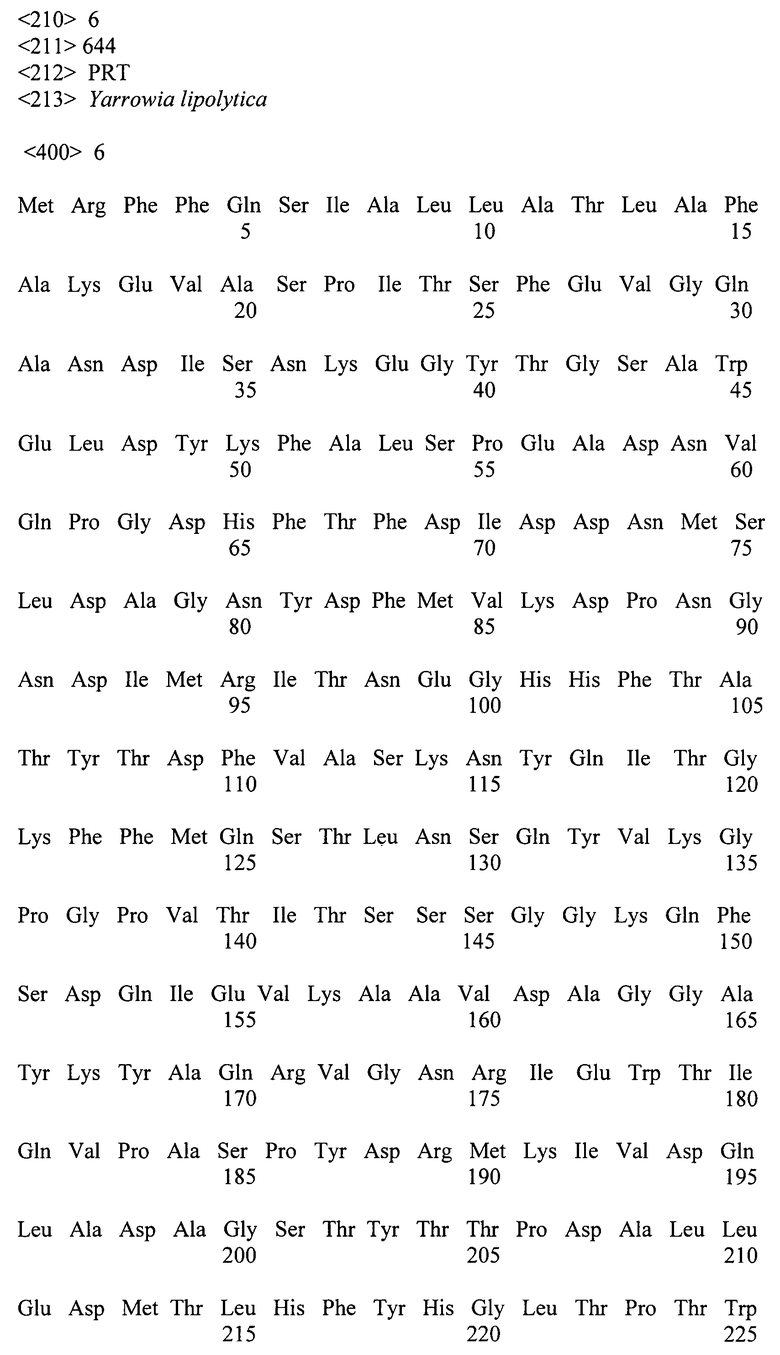
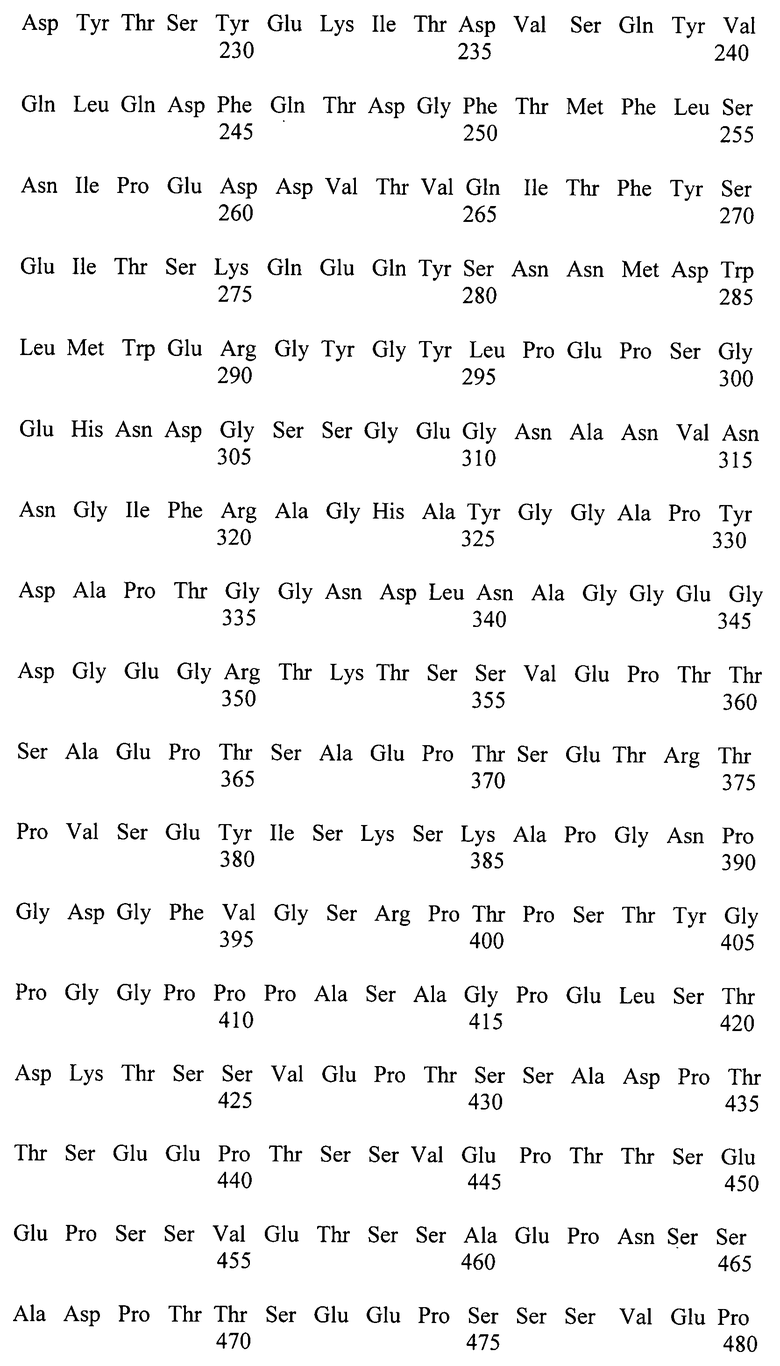
Поставленная задача решена путем создания генетической конструкции для экспозиции белка на поверхности клеточной стенки Y. lipolytica, содержащей промотор, терминатор, сигнальную последовательность, селективный маркер, нуклеотидную последовательность, кодирующую иммобилизируемый белок, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, содержащую аминокислотную последовательность, выбранную из группы последовательностей, приведенных в списке последовательностей под номером SEQ ID NO:1 или SEQ ID NO:2, или SEQ ID NO:3, или SEQ ID NO:4, или SEQ ID NO:5, или SEQ ID NO:6, или аминокислотную последовательность, гомологичную одной из указанных не менее, чем на 80%.
При решении поставленной задачи нами были выявлены аминокислотные последовательности, включающие С или N домены белков клеточной стенки, которые при присоединении их к аминокислотной последовательности экспрессируемого белка, способствуют его закреплению на поверхности клетки Y. lipolytica и позволяют эффективно экспонировать белок.
Изобретение проиллюстрировано следующими фигурами графического изображения:
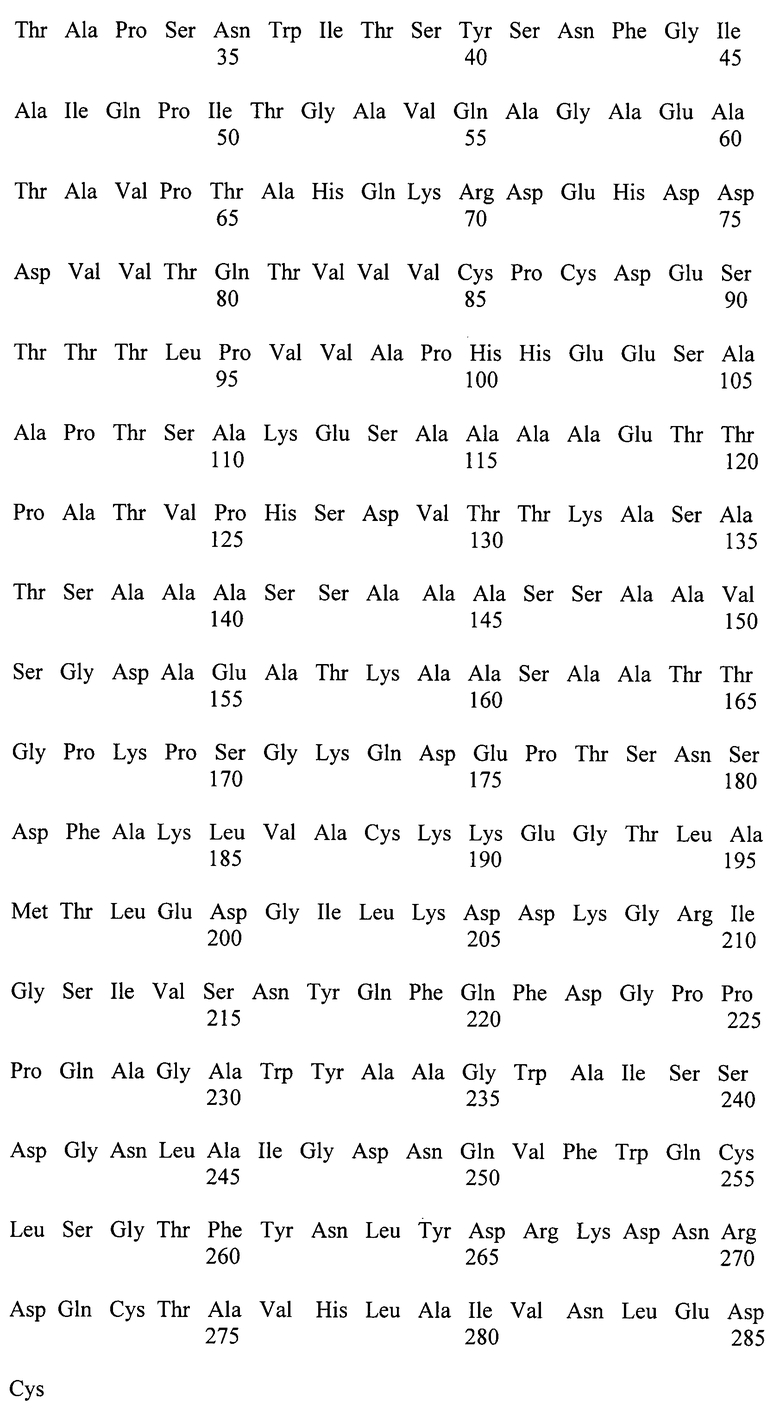
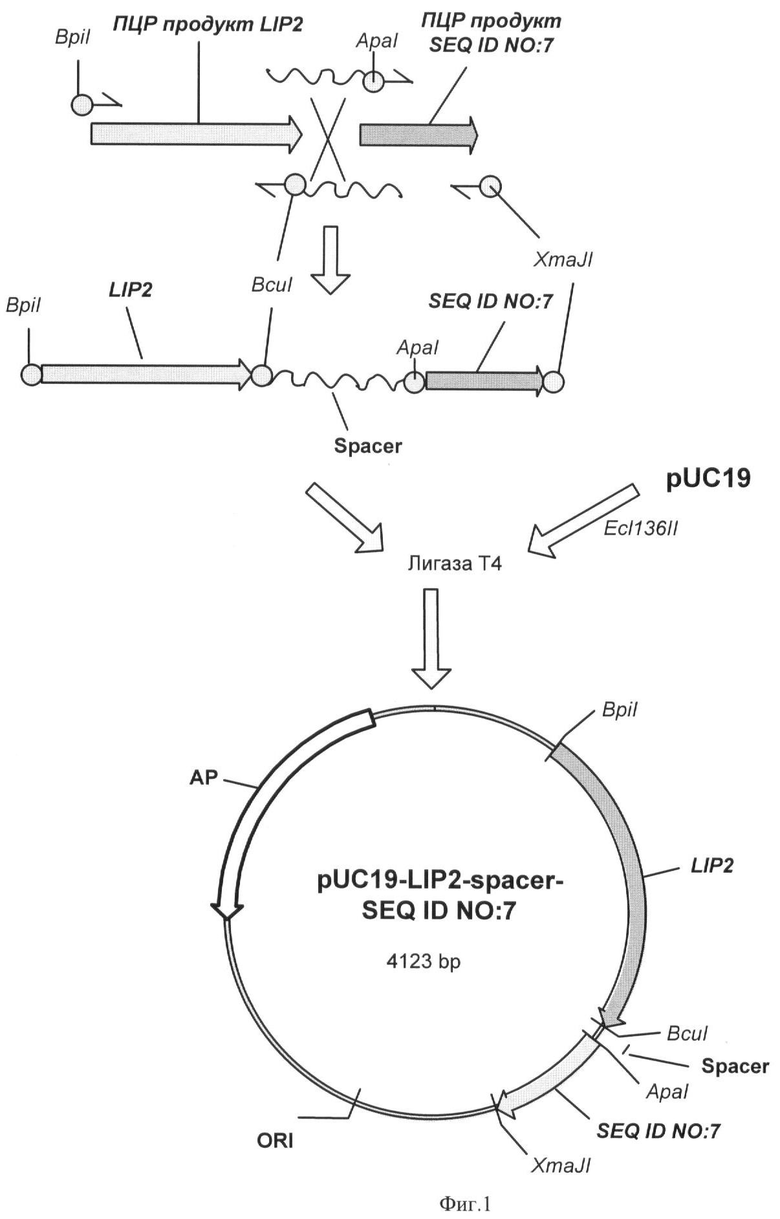
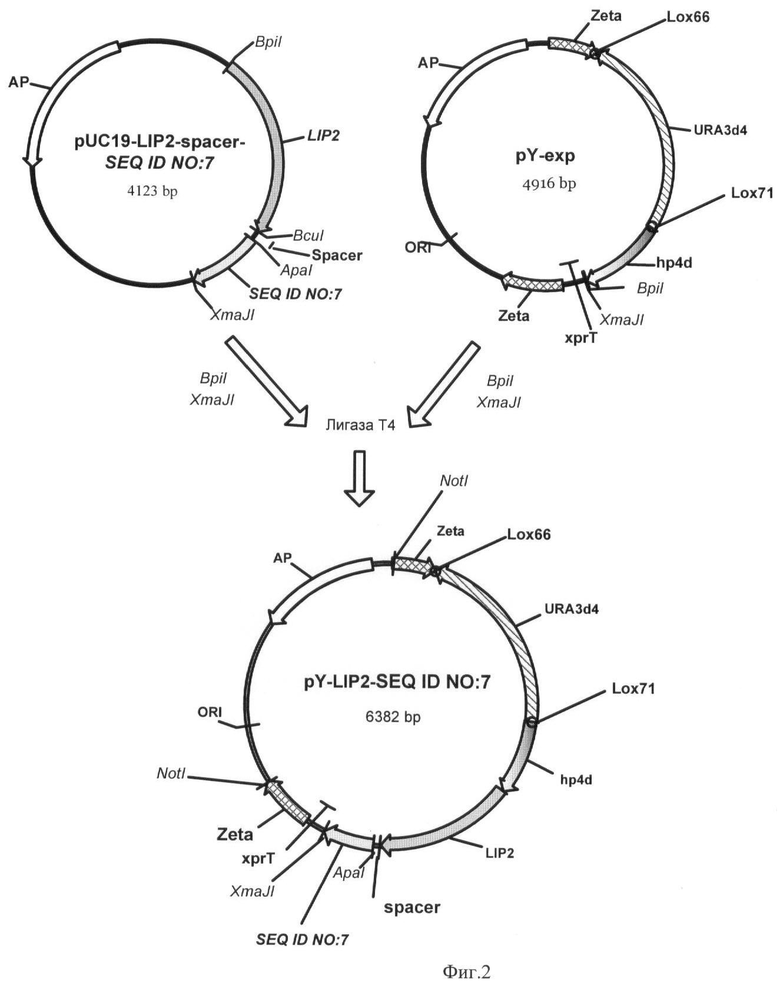
Фиг.1 - Схема получения плазмиды pUC19-LIP2-spacer-SEQ ID NO:7.
Фиг.2 - Схема получения вектора pY-LIP2-SEQ ID NO:7.
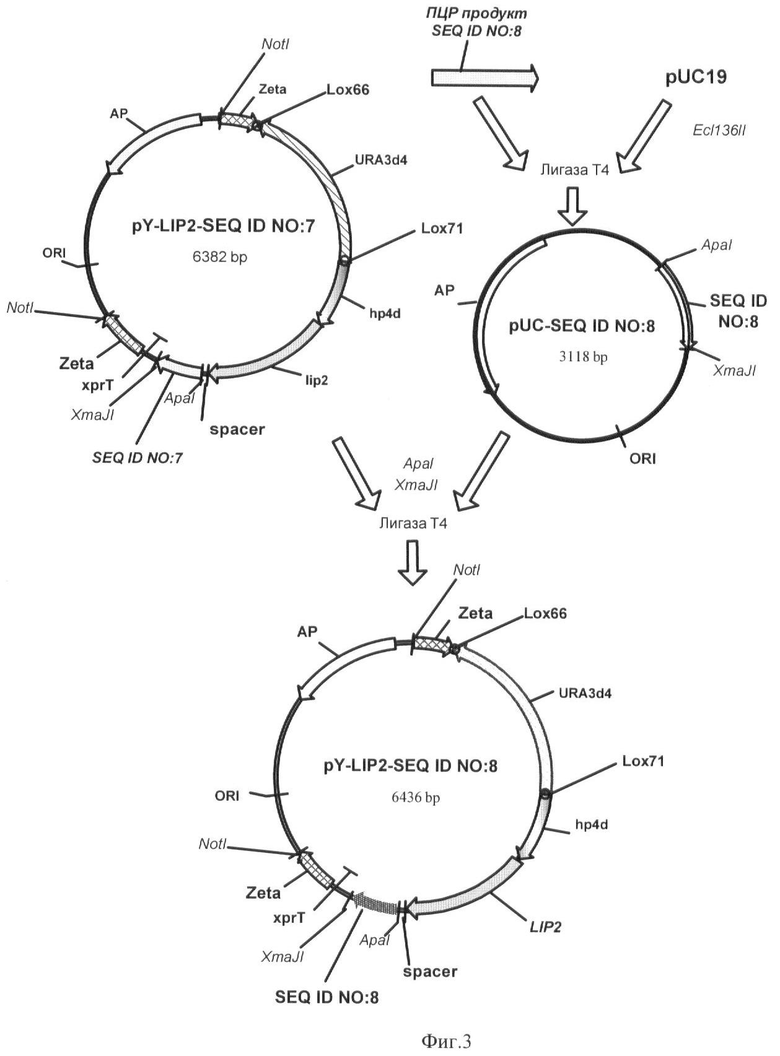
Фиг.3 - Схема получения вектора pY-LIP2-SEQ ID NO 8.
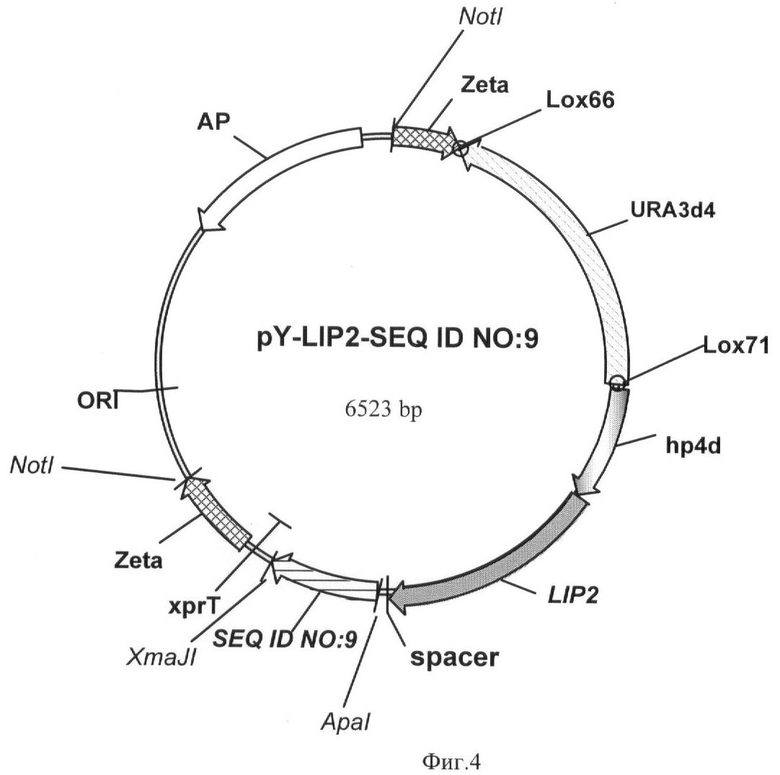
Фиг.4 - Вектор для иммобилизации pY-LIP2-SEQ ID NO 9.
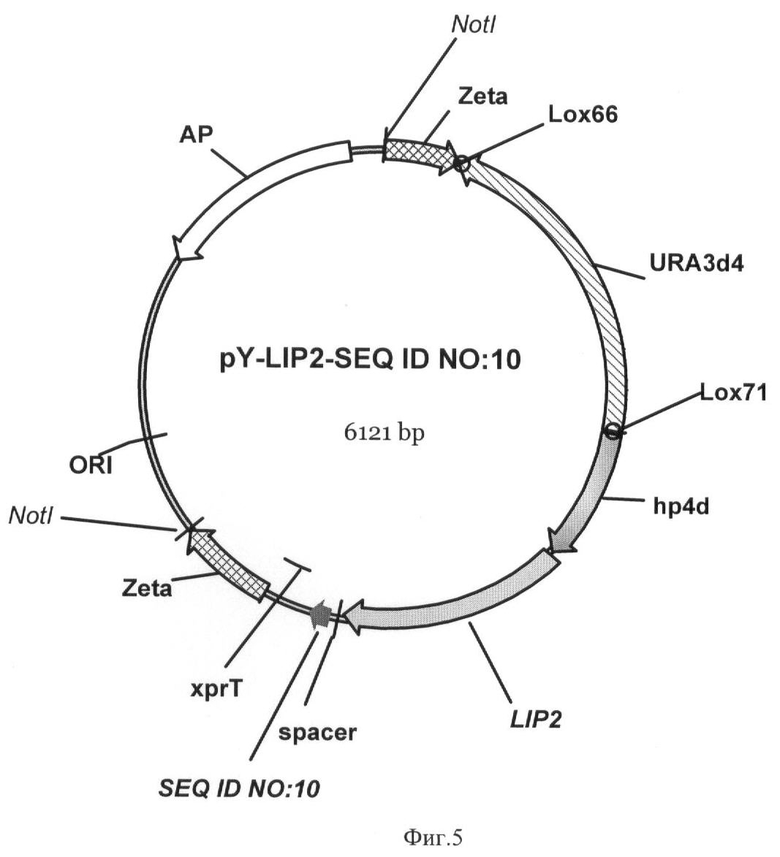
Фиг.5 - Вектор для иммобилизации pY-LIP2-SEQ ID NO 10.
Фиг.6 - Схема получения вектора pY-LIP2-SEQ ID NO 11.
Фиг.7 - Вектор для иммобилизации pY-LIP2-SEQ ID NO 12.
Примеры конкретного исполнения приведены для случая экспонирования белка Lip2 на поверхности клеточной стенки Y. lipolytica, но заявляемая генетическая конструкция может быть использована для микробиологической иммобилизации и других белков.
Пример 1. Получение плазмиды pUC19-LIP2-spacer-SEQ ID NO:7.
Ген липазы размером 1002 п.н. получают при помощи ПЦР с использованием Pfu-полимеразы (Fermentas Inc.) и праймеров:
GAAGACACAATGAAGCTTTCCACCATCCT (LIP2-BpiI-F) и CTCCGCTTCCACCAGATCCGCCAGACGATCCACTAGTGATACCACAGACACCCTCG (Lip-BcuI-spacer-R)
(Все используемые в работе праймеры синтезированы фирмой «Синтол», Москва).
Нуклеотидную последовательность SEQ ID NO:7 размером 366 п.н., кодирующую аминокислотную последовательность SEQ ID NO:1, получают при помощи ПЦР с использованием Pfu-полимеразы и праймеров:
CGGATCTGGTGGAAGCGGAGGCTCGGGATCGGGGCCCCTCGGCTTTGCCGCTCG (spacer-ApaI-D27-F) и CCTAGGTTAGAAAAGCATGGCGACG(D27-XmaJI-R).
В качестве матрицы для ПЦР используют тотальную геномную ДНК штамма Po1f Y. lipolytica (ATCC MYA-2613), полученную по методу, описанному ранее (Kaiser et.al., Methods in Yeast Genetics. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory, 1994).
Два полученных фрагмента амплифицированной ДНК очищают после электрофореза в 1% агарозном геле методом экстракции ДНК (Kit #K0513, Fermentas Inc.) и сшивают методом ПЦР сшивки.
Полученная нуклеотидная кассета LIP2-spacer-SEQ ID NO:7, длинной 1437 п.н., состоит из гена липазы (LIP2), нуклеотидной последовательности SEQ ID NO:7 и синтетического участка (spacer), кодирующего аминокислотную последовательность GSSGGSGGSGGSGS, которая обеспечивает упругое (пластичное) соединение двух разных функциональных пептидов в иммобилизованной липазе (Microbiology, 2001, 56(5-6), pp.681-686) (фиг.1).
0,5 мкг полученного после сшивания фрагмента ДНК LIP2-spacer-SEQ ID NO:7 лигируют с 0,2 мкг ДНК вектора pUC19, обработанного эндонуклеазой рестрикции Ecl136II и трансформируют в Е.coli XL1 (Blue). Клоны, содержащие необходимую вставку амплифицированной ДНК размером 1437 п.н., отбирают на чашках по устойчивости к ампициллину и с использованием стандартного теста на отсутствие активности β-галактозидазы. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом и секвенируют (стандартные праймеры M13/pUC 17-mer, M13/pUC reverse 17-mer).
Полученная плазмида размером 4123 п.н. названа pUC19-LIP2-spacer-SEQ ID NO:7 (фиг.1).
Пример 2. Получение экспрессионного вектора pY-LIP2-SEQ ID NO:7.
Вектор pUC19-LIP2-spacer-SEQ ID NO:7 обрабатывают эндонуклеазами рестрикции BpiI и XmaJI. 0,4 мкг полученного фрагмента лигируют с 0,2 мкг ДНК вектора pY-exp, обработанного эндонуклеазами рестрикции BpiI и XmaJI.
Вектор pY-exp получают из вектора pZ-ura3d4-hp4d-Txpr (RU 2355754) путем добавления сайтов Lox66 и Lox71. Для этого деффектный маркер ura3d4 синтезируют методом ПЦР по праймерам TTTGCTAGCTACCGTTCGTATAGCATACATTATACGAAGTTATGCCCTCCTACGAAGCTC(URA-71-F) и ATCGATACCGTTCGTATAATGTATGCTATACGAAGTTATCGACAAAGGCCTGTTTC (URA-66-R).
Полученный ПЦР-продукт длинной 1391 п.н. обрабатывают эндонуклеазами рестрикции Bsu15I и NheI и лигируют с ДНК вектора pZ-ura3d4-hp4d-Txpr, обработанного эндонуклеазами рестрикции Bsu15I и NheI, заменяя тем самым ura3d4 на lox66-ura3d4-lox71.
Полученный вектор pY-exp размером 4916 п.н. содержит участки транспозонных повторов Zeta для негомологичной рекомбинации, синтетический промотер hp4d, терминатор гена XPR2 и дефектный маркер ura3d4 для отбора трансформантов с многокопийной интеграцией в геном, экранированный сайтами узнавания рекомбиназы Cre фага P1 (Lox66 и Lox71).
Экспрессионный вектор pY-LIP2-SEQ ID NO:7, получаемый в результате встраивания фрагмента ДНК LIP2-spacer-SEQ ID NO:7 в вектор pY-exp, имеет размер 6382 п.н. и содержит помимо экспрессионных элементов расположенные в рамке считывания ген липазы LIP2 и нуклеотидную последовательность SEQ ID NO:7 (фиг.2). Далее его используют для микробиологической иммобилизации липазы.
Пример 3. Микробиологическая иммобилизация липазы с использованием экспрессионного вектора pY-LIP2-SEQ ID NO:7.
Экспрессионный вектор pY-LIP2-SEQ ID NO:7 обрабатывают ферментом рестрикции NotI и кассету используют для трансформации штамма Po1f Leu+ Y.lipolytica, полученного из штамма Po1f (ATCC MYA-2613) путем комплементации ауксотрофности по лейцину вектором pNB268 (US5786212). Трансформацию штамма осуществляют литиевым методом (Current Genetic, 1989, vol.16, pp.253-260), с использованием 5 мкг ДНК кассеты для иммобилизации.
Селекцию трансформантов ведут по комплементации ауксотрофности по урацилу на агаризованной минимальной среде YNB (Himedia G091) с добавлением глюкозы (2 мас.%).
Ферментацию отобранных трансформантов проводят в минимальной среде YNB с добавлением оливкового масла (5 мас.%), глюкозы (5 мас.%) в пробирках (50 мл) с рабочим объемом 10 мл. В качестве контроля используют штамм Po1f Leu+ Ura+ Y. lipolytica, полученный из штамма Po1f Leu+ путем комплементации ауксотрофности по урацилу (Biotechnology and Bioengineering, 2010, 107(4), pp.673-682).
Активность липазы измеряют на 3, 4 и 5 сутки ферментации.
Липазную активность измеряют методом, основанном на гидролизе п-нитрофенилбутирата с образованием бутирата и п-нитрофенола (Applied Microbiology and Biotechnology, 2003, vol. 63, pp.136-142). 200 мкл суспензии клеток осаждают центрифугированием, промывают дважды изотоническим раствором и разводят в 1000 раз. Единица липазной активности соответствует такому количеству фермента, которое высвобождает 1 мкмоль п-нитрофенола за минуту в 1 мл рабочего раствора.
Для определения сухой биомассы клетки осаждают из 1 мл, промывают, лиофилизируют и взвешивают.
Активность клеточно-связанной липазы и количество экспонированного фермента представлены в табл.1.
Пример 4. Получение экспрессионного вектора pY-LIP2-SEQ ID NO 8.
Нуклеотидную последовательность SEQ ID NO:8 размером 420 п.н., кодирующую аминокислотную последовательность SEQ ID NO 2, амплифицируют с помощью метода ПЦР по праймерам GGGCCCCTTTACGTCCCCAACTAC (F182-ApaI-F) и CCTAGGTTAGAAAAGCATGGCAGCGG (F182-XmaJI-R) с геномной ДНК штамма Po1f.
0,3 мкг полученного фрагмента ДНК лигируют с 0,15 мкг ДНК вектора pUC19, обработанного эндонуклеазой рестрикции Ecl136II и трансформируют в Е.coli XL1 (Blue). Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом и секвенируют (стандартные праймеры M13/pUC 17-mer, M13/pUC reverse 17-mer). Полученная плазмида размером 3118 п.н. названа pUC19-SEQ ID NO 8 (фиг.3).
0,4 мкг фрагмента, полученного после обработки вектора pUC19-SEQ ID NO 8 эндонуклеазами рестрикции ApaI и XmaJI, лигируют с 0,2 мкг ДНК вектора pY-LIP2-SEQ ID NO 7, обработанного эндонуклеазами рестрикции ApaI и XmaJI, заменяя тем самым фрагмент SEQ ID NO 7 на фрагмент SEQ ID NO 8. Лигазную смесь трансформируют в Е.coli XL1 (Blue) и получают экспрессионный вектор для иммобилизации с использованием аминокислотной последовательности SEQ ID NO 2. Полученный вектор для иммобилизации липазы размером 6436 п.н. назван pY-LIP2-SEQ ID NO 8 (фиг.3).
Пример 5. Микробиологическая иммобилизация липазы с использованием экспрессионного вектора pY-LIP2-SEQ ID NO:8.
Получение экспрессионной кассеты для иммобилизации липазы с использованием аминокислотной последовательности SEQ ID NO:2, трансформация Y. lipolytica, отбор трансформантов, проведение ферментации и измерение липазной активности осуществляли, как описано в примере 3.
Активности фермента липазы, экспонированного с помощью аминокислотной последовательности SEQ ID NO:2 и количество иммобилизованного фермента представлены в табл.1.
Пример 6. Получение экспрессионных векторов pY-LIP2-SEQ ID NO 9 и pY-LIP2-SEQ ID NO 10.
Нуклеотидную последовательность SEQ ID NO:9 размером 507 п.н., кодирующую аминокислотную последовательность SEQ ID NO 3, амплифицируют методом ПЦР по праймерам
GGGCCCTTTGGTCAGTACGCTTTCATTG (E311-ApaI-F) и
CCTAGGTTAGAAAAGCATGGCGGCAG (Е311-XmaJI-R)
с геномной ДНК штамма Po1f.
Нуклеотидную последовательность SEQ ID NO:10 размером 105 п.н., кодирующую аминокислотную последовательность SEQ ID NO 4, амплифицируют по праймерам
GGGCCCATCCAGGCTCCCCCCTC (C228-ApaI-F) и
CCTAGGTTAGAAGAGAGCAGCGACAAC(C228-XmaJI-R).
Дальнейшие процедуры по получению экспрессионных векторов pY-LIP2-SEQ ID NO 9 длиной 6523 п.н. (фиг.4) и pY-LIP2-SEQ ID NO 10 длиной 6121 п.н. (фиг.5) проводили, как описано в примере 4.
Пример 7. Микробиологическая иммобилизация липазы с использованием экспрессионных векторов pY-LIP2-SEQ ID NO:9 и pY-LIP2-SEQ ID NO:10.
Микробиологическую иммобилизацию фермента липазы Lip2 с использованием аминокислотных последовательностей SEQ ID NO 3 и SEQ ID NO 4 проводили, как описано в примере 3.
Активность клеточно-связанной липазы и количество экспонированного фермента представлены в табл.1.
Пример 8. Получение экспрессионного вектора pY-SEQ ID NO:11-LIP2.
Нуклеотидную последовательность SEQ ID NO:11 размером 858 п.н, кодирующую аминокислотную последовательность SEQ ID NO 5, получают методом ПЦР сшивки двух ПЦР продуктов, синтезированных по праймерам:
ATATGGTCTCTAATGCTCTTCAAGTCCGCTG (P1-Eco31I-F) и
GGTGTTGTCTCGGCAGCAGCAG (Р1-siteless-R),
а также
GCCGAGACAACACCCGCCACCGTCC (P1-siteless-F) и
TACCTAGGTGTACACACAGTCCTCGAGGTTGACAA (P1-Bsp1407-XmaJI-R)
с геномной ДНК штамма Po1f.
Полученный фрагмент обрабатывают эндонуклеазами рестрикции Eco31I и XmaJI и лигируют на вектор pUC-hp4d (RU 2355754), обработанный эндонуклеазами рестрикции BpiI и XmaJI. Полученная плазмида размером 4099 п.н. названа php4d-SEQ ID NO:11 (фиг.6).
Ген липазы LIP2 размером 1032 п.н. получают путем обработки вектора pY-LIP2-SEQ ID NO:7 ферментами рестрикции Bsp1407I и XmaJI, очищают после электрофореза в 1% агарозном геле и лигируют с вектором php4d-SEQ ID NO:11, обработанным эндонуклеазами рестрикции Bsp1407I и XmaJI. Полученная плазмида размером 5125 п.н. названа php4d-SEQ ID NO:11-LIP2 (фиг.6).
Нуклеотидную кассету hp4d-SEQ ID NO:11-LIP2 получают из вектора php4d-SEQ ID NO:11-LIP2 путем обработки эндонуклеазами рестрикции NheI и XmaJI и лигируют с вектором pY-exp, обработанным эндонуклеазами рестрикции NheI и XmaJI. Получают экспрессионный вектор длиной 6855 п.н. для иммобилизации липазы с помощью аминокислотной последовательности SEQ ID NO 5, который называют pY-SEQ ID NO:11-LIP2 (фиг.6).
Пример 9. Микробиологическая иммобилизация липазы с использованием экспрессионного вектора pY-SEQ ID NO:11-LIP2.
Микробиологическую иммобилизацию фермента липазы Lip2 с использованием аминокислотной последовательности SEQ ID NO:5 проводят, как описано в примере 3.
Активность клеточно-связанной липазы и количество экспонированного фермента представлены в табл.1.
Пример 10. Получение экспрессионного вектора pY-SEQ ID NO:12-LIP2.
Нуклеотидную последовательность SEQ ID NO:12 размером 1986 п.н, кодирующую аминокислотную последовательность SEQ ID NO 6, амплифицируют с помощью метода ПЦР по праймерам
ATCGTCTCTAATGCGATTCTTTCAGTCTATTGCCCTACTAGCCA (N--C-Esp3I-F) и
TACCTAGGTGTACACGGTGTTAGCAACAACAGG(N--C-Bsp1407-XmaJI-R).
Полученный фрагмент обрабатывают эндонуклеазами рестрикции Esp3I и XmaJI и лигируют на вектор pUC-hp4d, обработанный эндонуклеазами рестрикции BpiI и XmaJI. Полученная плазмида размером 5227 п.н. названа php4d-SEQ ID NO:12.
Дальнейшие процедуры по получению экспрессионного вектора pY-SEQ ID NO:12-LIP2 длиной 7979 п.н. (фиг.7) проводили, как описано в примере 8.
Пример 11. Микробиологическая иммобилизация липазы с использованием экспрессионного вектора pY-SEQ ID NO:12-LIP2.
Микробиологическую иммобилизацию фермента липазы Lip2 с использованием аминокислотной последовательности SEQ ID NO:6 проводили, как описано в примере 3.
Активность клеточно-связанной липазы и количество экспонированного фермента представлены в табл.1.
Результаты, приведенные в табл.1, свидетельствуют об эффективности использования предложенных конструкций для иммобилизации фермента липазы Lip2 на клетках Y. lipolytica. Активность клеточно-связанного фермента составляет 10010-19200 единиц/г сухой биомассы, что соответствует экспонированию 106 молекул фермента на одну клетку и примерно в 70 раз превышает лучшие результаты, описанные в литературе (Biotechnology Letters, 2010, 32(8), pp.1131-1136; Applied Microbiology Biotechnology, 2010, 88(4), pp.885-891).
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ КЛЕТОЧНО-СВЯЗАННОЙ ЛИПАЗЫ | 2012 |
|
RU2475532C1 |
| ИНТЕГРАТИВНЫЙ ВЕКТОР Random-URA3-RPT ДЛЯ ПОСЛЕДОВАТЕЛЬНОГО ВВЕДЕНИЯ МНОЖЕСТВЕННЫХ КОПИЙ ГЕНЕТИЧЕСКИХ ЭЛЕМЕНТОВ В ДРОЖЖИ Yarrowia lipolytica | 2006 |
|
RU2376376C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ YARROWIA-LIPOLYTICA - ПРОДУЦЕНТ ЛИПАЗЫ | 2011 |
|
RU2451075C1 |
| Модифицированный вариант гена LacZ из E. coli, кодирующий стабилизированный вариант белка, для использования в качестве транскрипционного репортера в Yarrowia lipolytica | 2015 |
|
RU2609646C2 |
| Рекомбинантная плазмида pBU-LipA, обеспечивающая синтез белка липазы А штамма Bacillus natto IAN | 2023 |
|
RU2808501C1 |
| ДРОЖЖИ РОДА YARROWIA, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ ВНУТРИКЛЕТОЧНО НАКАПЛИВАТЬ СЛОЖНЫЕ ЭФИРЫ ЖИРНЫХ КИСЛОТ, И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ТАКИХ ЭФИРОВ | 2013 |
|
RU2539744C1 |
| Трансформант дрожжей Yarrowia lipolytica, продуцирующий линалоол | 2022 |
|
RU2809554C1 |
| ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ ЛИПАЗЫ | 2007 |
|
RU2355754C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ, ПРИНАДЛЕЖАЩИХ К РОДУ Yarrowia | 2009 |
|
RU2422526C2 |
| Плазмидная ДНК-кассета pVAX-C3-PolyA, плазмидная ДНК-матрица pVAX-C3-RBD-PolyA для синтеза мРНК и полинуклеотидная вакцина против SARS-CoV-2, представляющая собой молекулы мРНК-C3-RBD-PolyA, индуцирующие SARS-CoV-2-специфические антитела | 2024 |
|
RU2839841C1 |









Изобретение относится к генной инженерии и микробиологической промышленности и касается генетической конструкции для экспозиции белка на поверхности клеточной стенки Yarrowia lipolytica. Представленная конструкция содержит промотор, терминатор, сигнальную последовательность, селективный маркер, нуклеотидную последовательность, кодирующую иммобилизируемый белок, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, содержащую аминокислотную последовательность, выбранную из группы последовательностей, приведенных в списке последовательностей под номером SEQ ID NO:1 или SEQ ID NO:2, или SEQ ID NO:3, или SEQ ID NO:4, или SEQ ID NO:5, или SEQ ID NO:6. Представленное изобретение позволяет упростить процесс очистки продуцируемого клеткой белка и может быть использовано для микробиологического получения белков. 7 ил., 11 пр., 1 табл.
Генетическая конструкция для экспозиции белка на поверхности клеточной стенки Yarrowia lipolytica, содержащая промотор, терминатор, сигнальную последовательность, селективный маркер, нуклеотидную последовательность, кодирующую иммобилизируемый белок, и нуклеотидную последовательность, кодирующую аминокислотную последовательность, содержащую аминокислотную последовательность, выбранную из группы последовательностей, приведенных в списке последовательностей под номером SEQ ID NO:1 или SEQ ID NO:2, или SEQ ID NO:3, или SEQ ID NO:4, или SEQ ID NO:5, или SEQ ID NO:6, или аминокислотную последовательность, гомологичную одной из указанных не менее чем на 80%.
| LIXI YUE et al., Construction of a new plasmid for surface display on cells of Yarrowia lipolitica, Journal of Microbiological Methods, 2008, Vol.72, p.p.116-123 | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2012-05-27—Публикация
2010-11-13—Подача