Область техники
Настоящее изобретение относится к области метаболической инженерии и биотехнологии и может быть использовано для получения продуцента линалоола с помощью дрожжей Yarrowia lipolytica.
Уровень техники
Yarrowia lipolytica являются одними из наиболее изученных не конвенциональных дрожжей, способных продуцировать важные метаболиты. В литературе (например, [1]) они рассматривают как клеточные фабрики для целого ряда производств, а в США имеют статус GRAS (в целом считаются безопасными) [2]. На данный момент дрожжи Y. lipolytica используются для промышленного производства двух видов пищевых и кормовых добавок: каротиноидов и масел, богатых полиненасыщенными жирными кислотами [3].
Линалоол - монотерпеноид с широким спектром биологической активности. Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (США) линалоол признан безопасным (имеет статус GRAS) в качестве синтетического вкусового вещества и добавки в пищевых продуктах для человека, а также в качестве ингредиента в медицине и пищевых продуктах для животных [4]. Линалоол может находить применение в качестве ароматизатора и консерванта в косметических средствах, и антибактериального, противогрибкового или противовоспалительного средства в медицине.
Наиболее значимый результат в конструировании штамма-продуцента линалоола был получен на бактериях Pantoea ananatis [5]. Авторами во главе с Nitta был сконструирован генетически модифицированный штамм, в котором разрушен эндогенный оперон crtEXYIB-crtZ, отвечающий за синтез каротиноидов, делетирован нативный ген глюкозодегидрогеназы GCD и экспрессированны гены ацетил-КоА ацетилтрансферазы/гидрокси метил-КоА редуктазы mvaE и гидроксиметилглутарил-КоА синтазы mvaS из Enterococcus faecalis; мевалонат киназы MVK M. paludicola; линалоол синтазы LIS Actinidia arguta и линалоол синтазы A. arguta слитой с галофильной β-лактамазой из Chromohalobacter sp.560 с гексагистидином на N-конце, повышающий растворимость фермента в организме хозяина. В этом же исследовании при скрининге линалоол синтаз было выявлено, что LIS A. arguta оказывает наиболее положительное влияние на продукцию линалоола [6]. В периодической «двухфазной» ферментации с подпиткой, сконструированный штамм накапливал 10.9 г/л (S)-линалоола в ферментере. Однако, бактерии Р. ananatis являются патогенными для сельскохозяйственных культур и лесных пород деревьев, а также способны инфицировать человека [7].
Максимальный титр линалоола, полученный на сегодняшний день на рекомбинантных дрожжах Y. lipolytica, при ферментации в колбах составляет 6.96 мг/л [8]. Данный результат достигнут при использовании штамма, полученного путем сверхэкспрессии нативных генов 3-гидрокси-3-метилглютарил-КоА редуктазы HMGR1, изопентенилдифосфат дельта-изомеразы IDI1 и мутантного варианта гена фарнезилпирофосфатсинтазы с двумя аминокислотными заменами ERG20F88W-N119W и гетерологичной экспрессии кодон-оптимизированного для Y. lipolytica гена линалоол синтазы LIS A. arguta.
Технической проблемой, на решение которой направлено представленное изобретение является расширение арсенала микроорганизмов, продуцирующих линалоол.
Раскрытие сущности изобретения
Техническим результатом является получение трансформанта дрожжей Yarrowia lipolytica, продуцирующий линалоол.
Для достижения технического результата предложен Трансформант дрожжей Y. lipolytica, продуцирующий монотерпеноид линалоол, содержащий в составе хромосомы, по крайней мере, по одной копии каждого из следующих генов, ген HMGR1 Y. lipolytica, кодирующий 3-гидрокси-3-метилглютарил-кофермент А редуктазу, ген ERG12 Y. lipolytica, кодирующий мевалонаткиназу, модифицированный ген ERG20F88W-N119W Y. lipolytica, кодирующий фарнезилпирофосфатсинтазу, кодон-оптимизированный ген CrGPPS Catharanthus roseus, кодирующий фермент геранилпирофосфат синтазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1 и кодон-оптимизированный ген LIS Actinidia arguta, кодирующий линалоолсинтазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 2.
Поставленная задача решена также тем, что предложен штамм дрожжей Y. lipolytica ВКПМ Y-5015 - продуцент линалоола.
Конструирование экспрессионных кассет при получении трансформанта дрожжей осуществляют стандартными методами генетической инженерии [9] с использованием генетических элементов, подходящих для работы с дрожжами рода Yarrowia. В качестве промоторов могут быть использованы АСС1, ACL2, DGA1, GAPDH, GAPDHin, GPAT, GPD1, GPM1, ENO2, ЕХР1, EYD1, EYK1, FBA1, FBA1in, FASα, FASβ, HP4D, ICL1, IDH1, IDH2, IDP2, ILV5, LEU2, LEUm, PGK1, POT1, POX2, POX4, RPS7, TDH1, TEF1, TEFin, XPR2, YAT1,ZWF [10, 11, 12, 13, 14, 15, 16].
В качестве терминаторов транскрипции могут быть использованы Асо3, CYC1, Guo, LIP1, LIP2, РЕХ3, РЕХ16, РЕХ20, РНO5, TEF1, ScADH1, ScPGK1, ScENO2, Tsynth2, Tsynth7, Tsynth8, Tsynth10, Tsynth22, Tsynth27, Tsynth30, XPR2 [15, 17, 18, 19, 16].
Введение генов может быть осуществлено как хромосомальной, так и эписомальной интеграцией, в качестве сайтов для гомологичной интеграции могут быть использованы последовательности, гомологичные участкам хромосомы дрожжей рода Yarrowia. В целях повышения эффективности экспрессии мРНК с интегрированных последовательностей при трансляции предпочтительно использовать гетерологичные гены, кодон-оптимизированные для дрожжей Y. lipolytica.
Трансформацию экспрессионной кассеты в клетки дрожжей Y. lipolytica осуществляют любым подходящим способом, в частности, методом электоропорации [20] или методом с использованием ацетата лития [21].
Краткое описание чертежей
фиг. 1 Схема экспрессионной кассеты IntF1-PTEFin-HMGR1
фиг. 2 Схема экспрессионной кассеты IntD4-PTEFin-ERG12
фиг. 3 Схема экспрессионной кассеты IntA2-PTEFin-ERG20F88W-N119W
фиг. 4 Схема экспрессионной кассеты IntB1-PTEFin-ERG20F88W-N119W
фиг. 5 Схема экспрессионной кассеты IntE12-PTEFin-LIS
фиг. 6 Схема экспрессионной кассеты IntE16-PTEFin-LIS
фиг. 7 Схема экспрессионной кассеты IntC14-PTEFin-LIS
фиг. 8 Схема экспрессионной кассеты IntC3-PTEFin-CrGPPS
Осуществление изобретения
Пример 1. Получение нуклеотидной последовательности SEQ ID NO: 1
Здесь и далее все гетерологичные гены кодон-оптимизируют для Y. lipolytica с помощью онлайн программы GenSmart™ [22].
Укороченную (начиная со второго метионина (Met100)) версию гена CrGPPS С.roseus [23] кодон-оптимизируют и синтезируют в виде плазмиды pT-IntC3-CrGPPS (синтез осуществлен компанией «Twist Bioscience Corporation)) (США). С синтезированной плазмиды pT-IntC3-CrGPPS амплифицируют нуклеотидную последовательность по праймерам:
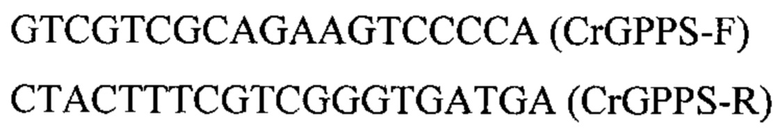
Полученную нуклеотидную последовательность очищают после электрофореза в 1% агарозном геле и секвенируют по праймерам CrGPPS-F/CrGPPS-R. Полученная последовательность приведена в перечне последовательностей под номером SEQ ID NO: 1.
Пример 2. Интеграция гена HMGR1 Y. lipolytica, кодирующего фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, в геном штамма-реципиента.
В качестве штамма-реципиента используют штамм линии W29 Y. lipolytica ВКПМ Y-4620 [25].
Конструируют экспрессионную плазмиду pARS-IntF1-TEFin-HMGR1, содержащую ген HMGR1 для интеграции в локус IntF1 на хромосоме F (положение 3863884-3865837 пн) с помощью CRISPR-Cas9 системы. Плазмиду pARS-IntF1-TEFin-HMGR1 получают на базе вспомогательной плазмиды pARS-IntF1-PromTerm-Cm, которую получают путем сборки 7 фрагментов по методу Гибсона.
Фрагмент 1 с фланком Up к локусу IntF1 (IntF1-Up) амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
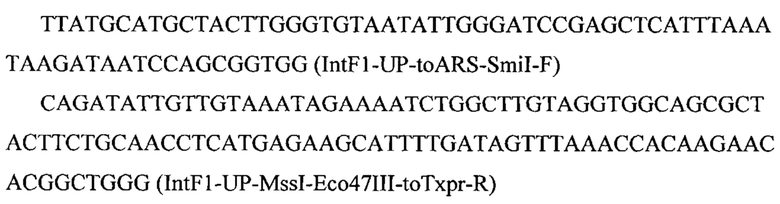
Фрагмент 2 с терминатором хрr2 (Тхрr2) амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
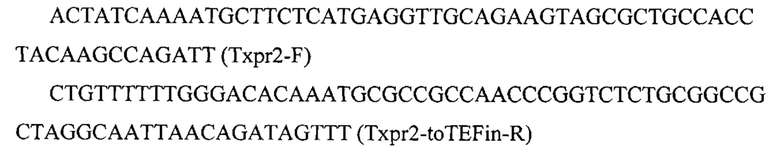
Фрагмент 3 с промотером TEFin (PromTEFin) получают путем обработки вектора pTEFin-uno [24] эндонуклеазами рестрикции NheI и BpiI и очищают после электрофореза в 1% агарозном геле.
Фрагмент 4 с геном устойчивости к хлорамфениколу (Cm) амплифицируют с плазмиды pMW-att-Cm [25, С.39] с помощью праймеров:
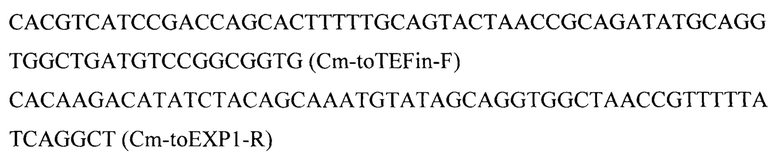
Фрагмент 5 с терминатором teƒ (Ttef) амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
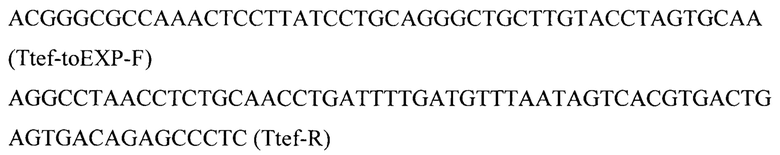
Фрагмент 6 с фланком Down к локусу IntF1 (IntF1-Down) амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
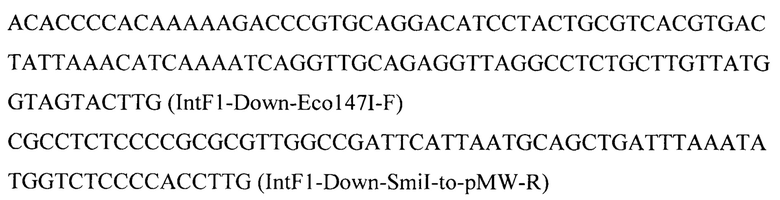
Фрагмент 7 получают обработкой вектора pARS-Cre-reverse (RU 2539744) эндонуклеазами рестрикции SacI и PvuII, очищают после электрофореза в 1% агарозном геле, обрабатывают Pfu-полимеразой для получения тупых концов.
После реакции сборки по Гибсону, смесь фрагментов трансформируют в Е. coli XL 1 (Blue). Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом.
Для получения экспрессионной плазмиды pARS-IntF1-TEFin-HMGR1 фрагмент HMGR1 амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
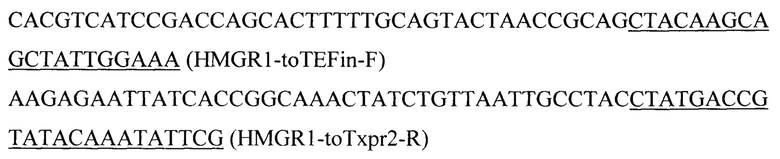
Вспомогательную плазмиду pARS-IntF1-PromTerm обрабатывают эндонуклеазой рестрикции AarI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают методом Гибсона с ПЦР-фрагментом HMGR1 с получением плазмиды pARS-IntF1-TEFin-HMGR1.
Вспомогательную плазмиду pCNR-sgIntF1 для осуществления интеграции гена HMGR1 посредством CRISPR-Cas9 системы редактирования генома конструируют с помощью олигонуклеотида
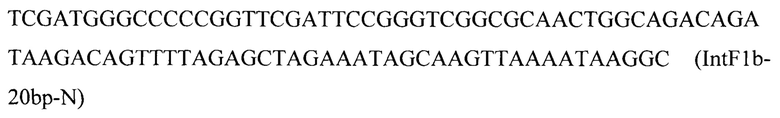
на базе разработанной эписомальной плазмиды pCasNA-RK (Addgene ID: 175708) методом рекомбиниринга [25, С. 33].
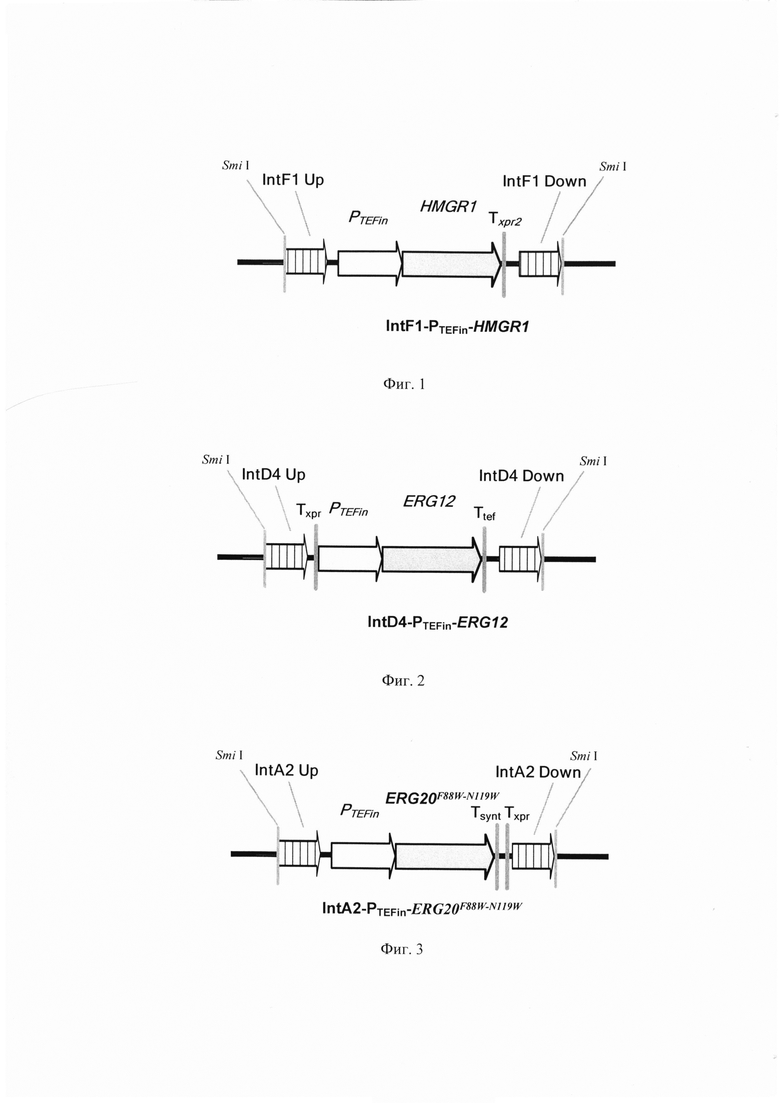
Линеаризованный фрагмент ДНК IntF1-PTEFin-HMGRl (фиг. 1) получают путем обработки плазмиды pARS-IntF1-TEFin-HMGR1 эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntF1 для ко-трансформации штамма-реципиента Y. lipolytica ВКПМ Y-4620.
Трансформанты отбирают на среде YPSuc Nat (мас. %: дрожжевой экстракт - 1, пептон - 2, сахароза - 1, агар - 1, вода - остальное) с добавлением нурсеотрицина (0,025 мас. %) по устойчивости к антибиотику нурсеотрицину.
У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
Получают трансформант 1 с кассетой IntF1-PTEFin-HMGR1, интегрированной в локус IntF1 на хромосоме F.
Пример 3. Интеграция гена ERG12 Y. lipolytica, кодирующего мевалонаткиназу
Интеграцию гена осуществляют в трансформант 1, полученный в примере 2.
Конструируют экспрессионную плазмиду pARS-IntD4-TEFin-ERG72, содержащую ген ERG12 для интеграции в локус IntD4 на хромосоме D (положение 1038596 - 1039926 пн) с помощью CRISPR-Cas9 системы. Плазмиду pARS-IntD4-TEFin-ERG12 получают на базе вспомогательной плазмиды pARS-IntD4-PromTerm-Cm. Плазмиду pARS-IntD4-PromTerm-Cm конструируют путем сборки 7 фрагментов по методу Гибсона. Все фрагменты получают с помощью ПЦР как описано в примере 1, за исключением фрагментов 1 и 6, получение которых описано ниже.
Фрагмент 1 (IntD4-UP) амплифицируют с геномной ДНК штамма W29 Y. lipolytica с использованием праймеров:

Фрагмент 6 (IntD4-Down) амплифицируют с геномной ДНК штамма W29 Y. lipolytica с использованием праймеров:
Ген ERG12 амплифицируют с геномной ДНК штамма W29 Y. lipolytica с помощью праймеров:

Плазмиду pARS-IntD4-PromTerm-Cm обрабатывают эндонуклеазой рестрикции AarI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают по методу Гибсона с ПЦР-фрагментом ERG 12 с получением плазмиды pARS-IntD4-TEFin-ERG12.
Вспомогательную плазмиду pCNR-sgIntD4 для осуществления интеграции гена ERG12 с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга.
Линеаризованный фрагмент ДНК IntD4-PTEFin-ERG12 (фиг. 2) получают путем обработки плазмиды pARS-IntD4-TEFin-ERG12 эндонуклеазой рестрикции SmiI и используют совместно с вспомогательной кольцевой плазмидой pCNR-sgIntD4 для ко-трансформации трансформанта 1 (пример 2). Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
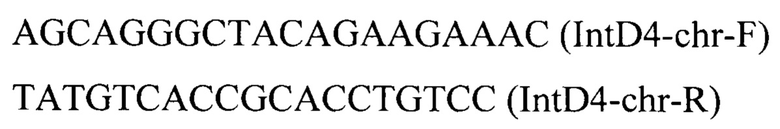
Получают трансформант 2 с кассетой IntD4-PTEFin-ERG12, интегрированной в локус IntD4 на хромосоме D.
Пример 4. Интеграция мутантного гена ERG20F88W-N119W Y. lipolytica, кодирующего фарнезил пирофосфат синтазу
Интеграцию гена осуществляют в трансформант 2, полученный в примере 3. Для этого конструируют экспрессионную плазмиду pARS-IntA2-ERG20F88W-N119W, содержащую мутированный вариант гена ERG20 Y. lipolytica с двумя заменами аминокислот F88W и N119W для интеграции в локус IntA2 на хромосоме А (положения 221472 -222858 п.н.) с помощью CRJSPR-Cas9 системы. Плазмиду pARS-IntA2-ERG20F88W-N119W получают на базе вспомогательной плазмиды pARS-IntA2-Prom-term. Плазмиду pARS-IntA2-Prom-term конструируют путем сборки 7 фрагментов по методу Гибсона. Все фрагменты получают с помощью ПЦР как описано в примере 1, за исключением фрагментов 1 и 6, получение которых описано ниже.
Фрагмент 1 (IntA2-UP) амплифицируют с геномной ДНК штамма W29 Y. lipolytica с использованием праймеров:

фрагмент 6 (IntA2-Down) амплифицируют с геномной ДНК штамма W29 Y. lipolytica с использованием праймеров:
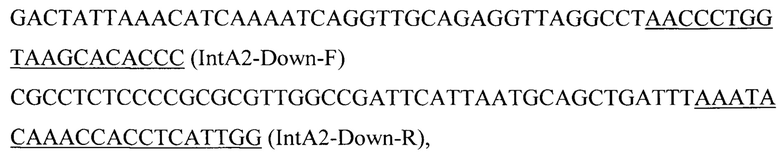
Фрагмент fromTEFin-ERG20F88W-N119W-toTtef получают амплификацией с синтезированного в Twist Bioscience Corporation фрагмента ERG20F88W-N119W с использованием пар праймеров:
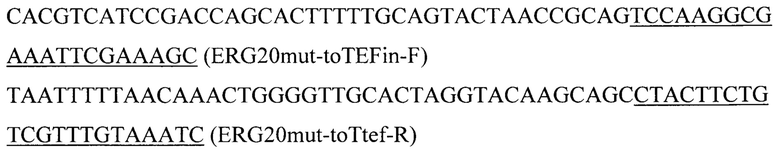
Полученный фрагмент fromTEFin-ERG20F88W-N119W-toTtef и плазмиду pARS-IntA2-Prom-term расщепляют эндонуклеазой рестрикции AarI и собирают методом Гибсона в единую плазмиду pARS-IntA2-ERG20F88W-N119W.
Вспомогательную плазмиду pCNR-sgIntA2 для осуществления интеграции гена ERG20F88W-N119W с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида

на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга.
Линеаризованный фрагмент IntA2-ERG20F88W-N119W (фиг.3) получают путем обработки плазмиды pARS-IntA2-ERG20F88W-N119W эндонуклеазой рестрикции SmiI и ко-трансформируют совместно с вспомогательной плазмидой pCNR-sgIntA2 в трансформант 2 (пример 3).
Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
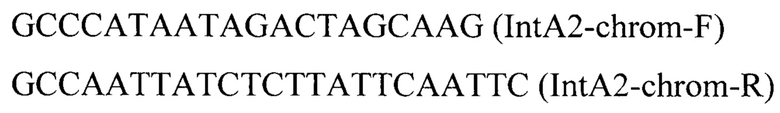
Получают трансформант 3 с кассетой IntA2-ERG20F88W-N119W, интегрированной в локус IntA2 на хромосоме А.
Далее в полученный трансформант 3 осуществляют интеграцию второй копии гена ERQ20F88W-N119W. Для этого конструируют экспрессионную плазмиду pARS-IntB1-ERG20F88W-N119W, содержащую мутированный вариант гена ERG20 Y. lipolytica с двумя заменами аминокислот F88W и N119W для интеграции в локус IntB1 на хромосоме В (положения 118362 - 119703 п.н.) с помощью CRISPR-Cas9 системы. Плазмиду pARS-IntB1-ERG20F88W-N119W получают на базе вспомогательной плазмиды pARS-IntB1-Prom-term. Плазмиду pARS-IntB1-Prom-term конструируют путем сборки 7 фрагментов по методу Гибсона. Все фрагменты получают с помощью ПНР как описано в примере 1, за исключением фрагментов 1 и 6, получение которых описано ниже.
Фрагмент 1 (InB1-UP) амплифицируют с геномной ДНК штамма W29 Y. lipolytica с использованием праймеров:

фрагмент 6 (IntB1-Down) амплифицируют с геномной ДНК штамма W29 Y. lipolytica с использованием праймеров:

Фрагмент fromTEFin-ERG20F88W-N119W-toTtef и плазмиду pARS-IntB1-Prom-term расщепляют AarI, собирают методом Гибсона в единую плазмиду pARS-IntB1-ERG20F88W-N119W.
Вспомогательную плазмиду pCNR-sgIntB1 для осуществления интеграции гена ERG20F88W-N119W с помощью CRJSPR-Cas9 системы конструируют с помощью олигонуклеотида
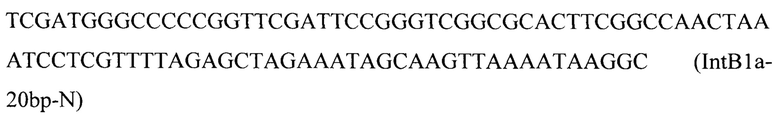
на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга.
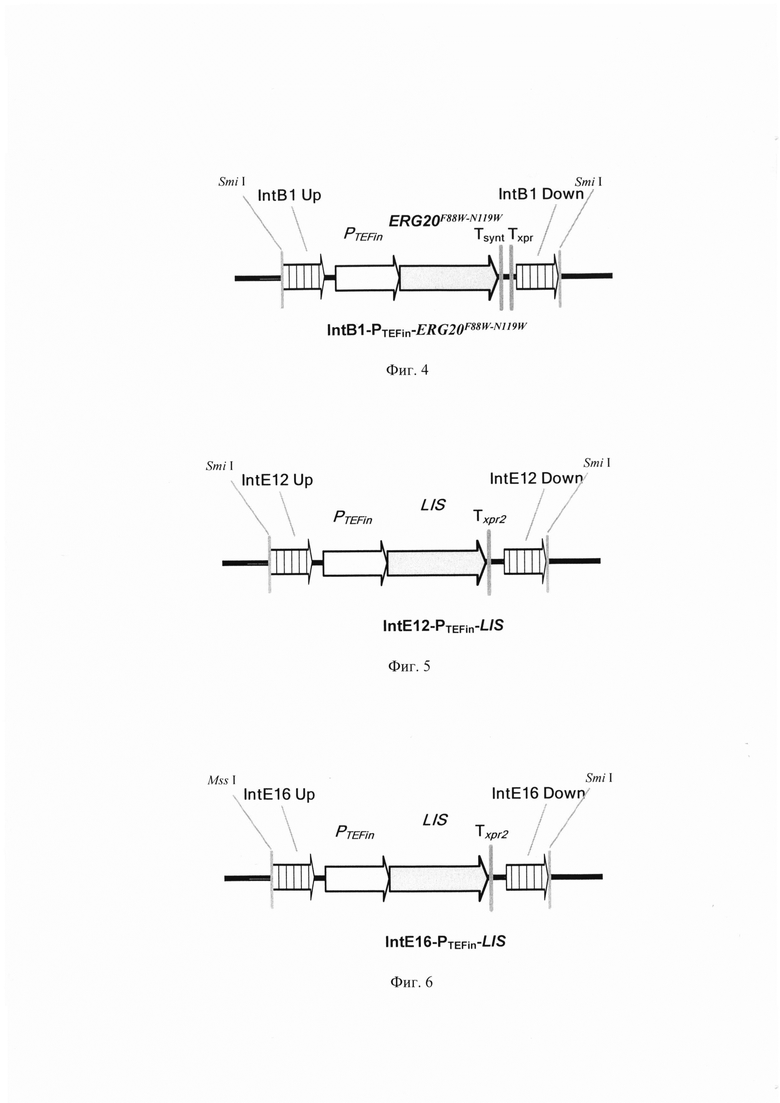
Линеаризованный фрагмент IntB1-PTEFin-ERG20F88W-N119W (фиг. 4) получают путем обработки плазмиды pARS-IntBl-ERG20F88W-N119W эндонуклеазой рестрикции SmiI и ко-трансформируют совместно с вспомогательной плазмидой pCNR-sgIntB1 в трансформант 3 (пример 4). Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:

Получают трансформанты 4 с кассетой IntB1-PTEFin-ERG20F88W-N119W, интегрированной в локус IntB1 на хромосоме В.
Пример 5. Интеграция гена LIS Actinidia arguta, кодирующего линалоол синтазу
Интеграцию гена осуществляют в трансформант 4, полученный в примере 4. Для этого плазмиду pT-flIntE12-LIS, содержащую кодон-оптимизированный ген LIS из A. Argute (LIS, GenBank ID: GQ338153.1) для интеграции в хромосому Е (в положение 2831926 - 2833196 п. н.) с использованием CRISPR-Cas9 системы, синтезируют Twist Bioscience Corporation.
Линеаризованный фрагмент IntE12-PTEFin-LIS (фиг.5) получают обработкой плазмиды pT-flIntE12-LIS эндонуклеазой рестрикции SmiI и ко-трансформируют совместно с вспомогательной плазмидой pCNR-sgIntE12 (Addgene ID: 175636) в трансформант 4 (пример 5). Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
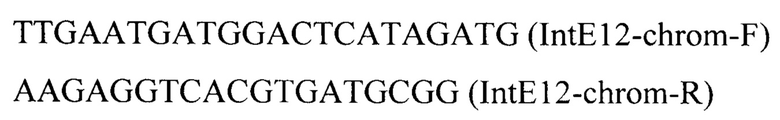
Получают трансформант 5 с кассетой IntE12-PTEFin-LIS, интегрированной в локус IntE12 на хромосоме Е.
Далее в полученный трансформант 5, осуществляют интеграцию второй копии гена LIS. Для этого плазмиду pT-flIntE16-LIS, содержащую кодон-оптимизированный ген LIS из A. argute для интеграции в хромосому Е (в положение 3975493 - 3976833 п. н.) с использованием CPISPR-Cas9 системы, синтезируют Twist Bioscience Corporation.
Линеаризованный фрагмент IntE16-PTEFin-LIS (фиг.6) получают обработкой плазмиды pT-flIntE16-LIS эндонуклеазой рестрикции Smil и ко-трансформируют совместно с вспомогательной плазмидой pCNR-sgIntE16 (Addgene ID: 175637) в трансформант 5 (пример 6). Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
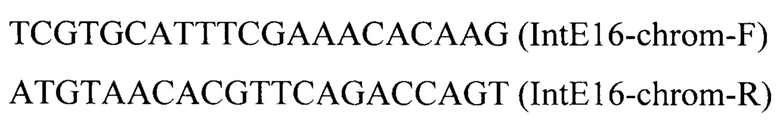
Получают трансформант 6 с кассетой IntE16-PTEFin-LIS, интегрированной в локус IntE16 на хромосоме Е.
Далее в полученный трансформант 6, осуществляют интеграцию третьей копии гена LIS. Для этого плазмиду pT-IntC14-LIS, содержащую кодон-оптимизированный ген LIS из A. argute для интеграции в хромосому С (в положение 3133312 - 3135244 п.н.) с использованием CRISPR-Cas9 системы, синтезируют Twist Bioscience Corporation.
Линеаризованный фрагмент IntC14-PTEFin-LIS (фиг.7) получают обработкой плазмиды pT-flIntC14-LIS эндонуклеазой рестрикции Smil и ко-трансформируют совместно с вспомогательной плазмидой pCNR-sgIntC14 (Addgene ID: 175634) в трансформант 6 (пример 7). Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
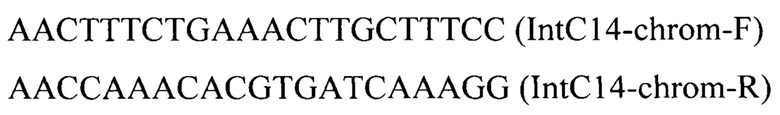
Отбирают трансформант 7 с кассетой IntC14-PTEFin-LIS, интегрированной в локус IntC14 на хромосоме С.
Пример 6. Интеграция гена CrGPPS Catharanthus roseus, кодирующего геранилпирофосфат синтазу
Интеграцию гена осуществляют в трансформант 7, полученный в примере 5. Вспомогательную плазмиду pCNR-sgIntC3 для осуществления интеграции гена CrGPPS с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
TCGATGGGCCCCCGGTTCGATTCCGGGTCGGCGCAACTAACGCAGGAT CAAGAGAGTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGC (IntC3b-20bp-N) на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга.
Линеаризованный фрагмент IntC3-PxEFin-CrGPPS (фиг. 8) получают обработкой плазмиды pT-IntC3-CrGPPS эндонуклеазой рестрикции SmiI и ко-трансформируют совместно с вспомогательной плазмидой pCNR-sgIntC3 в трансформант 7 (пример 8).
Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
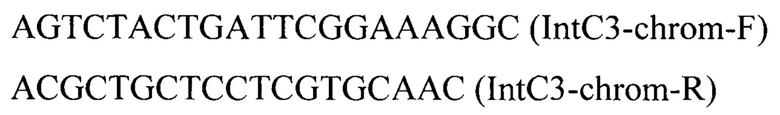
Отбирают трансформант 8 с кассетой IntC3-PTEFin-CrGPPS, интегрированной в локус IntC3 на хромосоме С. Отобранный трансформант депонирован в Биоресурсном Центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» (117545 Москва, 1-ый Дорожный пр-д, д. 1) как штамм дрожжей Y. lipolytica ВКПМ Y-5015.
Признаки штамма дрожжей Y. lipolytica ВКПМ Y-5015
Культурально-морфологические признаки
Суточная культура в жидкой YPD (мас. %: дрожжевой экстракт - 1, пептон - 1, глюкоза - 2, вода - остальное) среде представлена овальными, удлиненно-овальными, округлыми клетками размером 4,6-6,0×4,5-12,5 мкм. Почкование полярное или латеральное, на узком основании. К третьим суткам большинство клеток почкуются и образуют истинный и псевдомицелий.
При росте в жидкой среде YPD при 28°C в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Клетки хорошо растут на простых питательных средах. Колонии на мальтоагаре (возраст 1 неделя) белого цвета, пастообразные, слегка приподнятые в центре, морщинистые, с фестончатым краем. Штрих на мальтоагаре непрерывный, плоский, блестящий, белого цвета, пастообразный, края ровные, со временем становится складчатым. Спор не образует.
Физиолого-биохимические признаки.
Облигатный аэроб. Сахара не сбраживает. Ассимилирует: сахарозу, глюкозу, D-галактозу (медленно), L-сорбозу, D-рибозу, этанол, глицерин, эритрит, адонит, D-маннит, сорбит и молочную, янтарную, лимонную, глюконовую кислоты. Не ассимилирует: мальтозу, лактозу, целлобиозу, трегалозу, мелибиозу, раффинозу, мелицитозу, инулин, крахмал, D-ксилозу, L- и D-арабинозу, раммозу, дульцит, инозит, D-глюкозамин и глюкуроновую, 2-кетоглюконовую, 5-кетоглюконовую кислоты. Не ассимилирует нитраты, жирные кислоты и алканы. Не растет в безвитаминной среде, требует присутствия в среде тиамина, не требует биотина.
Оптимальное значение рН для роста 5,5-7,0. Не растет при 37°С. Максимальная температура роста 35°С. Разжижает желатин. Гидролизует мочевину.
Пример 7. Культивирование штамма Y. lipolytica ВКПМ Y-5015 в колбах.
Культивирование штамма ВКПМ Y-5015 осуществляют в жидкой среде YPSuc9 (мас. %: дрожжевой экстракт - 1, пептон - 1, сахароза - 9, вода - остальное) в колбах (750 мл) с рабочим объемом 50 мл при 28°С и постоянном перемешивании (275 об/мин) в течение 5 суток с добавлением 5 мл изопропилмиристата на 2 сутки культивирования.
В качестве образца сравнения при культивировании используют трансформант 7 - предшественник штамма ВКПМ Y-5015 (отличающийся отсутствием гена CrGPPS).
После культивирования проводят экстракцию линоола, для чего в среду культивирования добавляют 2.5 мл изопропилмиристата. Полученный раствор перемешивают (200 об/мин) в течение 1 часа и центрифугируют. Концентрацию линалоола в органической фазе определяют с помощью системы ГХ/МС на приборе «Маэстро» (Interlab) (ГХ Agilent 7820А и МСД 5977, Agilent Technologies). Условия газохроматографического разделения: температура колонки: начальная 70°С в течение 2 мин и нагрев до 260°С со скоростью 15 град/мин; затем нагрев до 320°С со скоростью 30 град/мин и выдержкой при 320°С в течение 1 минуты. Газ-носитель - гелий. Ввод пробы с разделенным на 1/5 газом-носителем. Регистрация масс-спектров в режиме полного сканирования 35-300 а.е. масс. Температура испарителя - 270°С. Температура интерфейса - 280°С, температура квадруполя - 150°С, источника -230°С. Ионизация электронным ударом, энергия ионизации 70 эВ. Объем вводимого образца: 1 мкл. К 130 мкл гексана добавляли 20 мкл навески изопропилмиристата (разведение в 7.5 раза).
Результаты культивирования трансформанта 7 и штамма ВКПМ Y-5015 приведены в табл. 1.
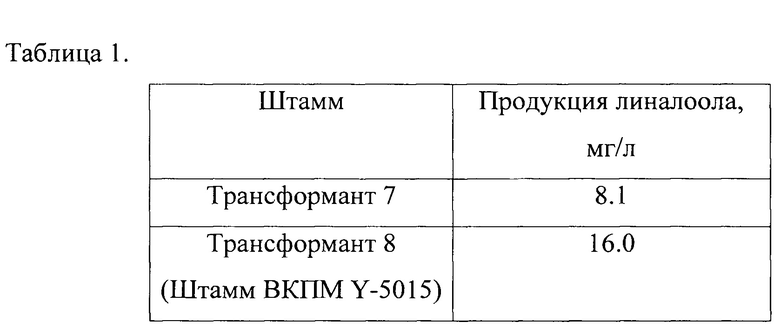
Полученные результаты показывают, что введение гена CrGPPS С. roseus в геном дрожжей Y. lipolytica позволяет получить повышение продукции линалоола в 2 раза.
Таким образом, продукция линалоола, образующаяся при культивировании штамма ВКПМ Y-5015, в 2,3 раза превосходит результат ранее описанных на дрожжах Y. lipolytica (6.96 мг/л) [8].
1. Miller K.K., Alper Н.S. (2019). Appl Microbiol Biotechnol, 103(23-24), 9251-9262. doi: 10.1007/s00253-019-10200-х
2. Groenewald M., Boekhout Т., et al. (2014). Crit Rev Microbiol, 40(3), 187-206. doi: 10.3109/1040841 X.2013.7703 86
3. Madzak C. (2021). J Fungi (Basel), 7(7). doi:10.3390/jof7070548
4. Haque I., Bashar A. Khalipha R., et al. (2021). International Journal of Evergreen Scientific Research. 03 (02), 105-118.
5. Nitta N., Tajima Y., et al. (2021). Microb Cell Fact, 20(1), 54. doi:10.l186/s12934-021-01543-0
6. Hoshino Y., Moriya M., et al. (2020). J Biotechnol, 324, 21-27. doi: 10.1016/j.jbiotec.2020.09.021
7. Coutinho T.A., Venter S. (2009). Molecular Plant Pathology 10(3), 325-335N. doi:10.1111/J.1364-3703.2009.00542.X
8. Cao X., Wei L.J., et al. (2017). Bioresour Technol, 245(Pt B), 1641-1644. doi: 10.1016/j.biortech.2017.06.105
9. Sambrook J., Maniatis Т., Fritsch E. Molecular Cloning: Laboratory Mannual, 2nd edition. New York: Cold Spring Harbor Laboratory Press, 1989
10. Park Y.K., Korpys P., et al. (2019). FEMS Yeast Res, 79(1). doi: 10.1093/femsyr/foy 105
11. Kamineni A., Chen S., et al. (2020). FEMS Yeast Res, 20(5). doi: 10.1093/femsyr/foaa035
12. US 20060115881
13. Madzak C., Treton В., et al. (2000). JMol Microbiol Biotechnol, 2(2), 207-216.
14. Tai M., Stephanopoulos G. (2013). Metab Eng, 15, 1-9. doi:10.1016/j.ymben.2012.08.007
15. Darvishi F., Ariana M., et al. (2018). Appl Microbiol Biotechnol, 7(92(14), 5925-5938. doi: 10.1007/s00253 -018-9099-x
16. https://www.researchsquare.com/article/rs-1570357/v1
17. Curran, K.A., Morse, N.J., Markham, K.A., Wagman, A.M., Gupta, A., & Alper, H.S. (2015). ACS Synth Biol, 4(1), 824-832. doi:10.1021/sb5003357
18. Larroude M., Park Y.K., et al. (2019). Microb Biotechnol, 12(6), 1249-1259. doi:10.1111/1751-7915.13427
19. EP 2 649 887 В1
20. Yeast Metabolic Engineering: Methods and Protocols, Methods in Molecular Biology. 2014, 1152, 43-62. doi: 10.1007/978-1-4939-0563-8_3
21. Berardi E., Thomas D.Y. (1990) Current Genetics 18, 169-170. doi:10.1007/BF00312606
22. https://www.genscript.com/gensmart-free-gene-codon-optimization.html
23. Rai A., Smita S. S. et al. (2013). Mol Plant, 6(5), 1531-1549. doi:10.1093/mp/sst058
24. RU 2713124
25. Taratynova M.O., Kosikhina Y.M. et al. (2021). Biotekhnologiya, 37, 29-41. doi:10.21519/0234-2758-2021-37-3-29-41
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing originalFreeTextLanguageCode="en"
nonEnglishFreeTextLanguageCode="ru" dtdVersion="V1_3"
fileName="Yarrowia lipolytica, linalool_SEQ_ID1_2.xml"
softwareName="WIPO Sequence" softwareVersion="2.1.2"
productionDate="2022-09-27">
<ApplicantFileReference>PCT/IB2022/99999</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>64738</ApplicationNumberText>
<FilingDate></FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">НИЦ «Курчатовский институт»
</ApplicantName>
<ApplicantNameLatin>NRC Kurchatov Institute</ApplicantNameLatin>
<InventionTitle languageCode="ru">Трансформант дрожжей Yarrowia
lipolytica, продуцирующий линалоол.</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>963</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..963</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Yarrowia lipolytica</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gtcgtcgcagaagtccccaaattagccagcgcagcagaatactttttca
agctgggcgttgagggcaagcgattccgacccaccgtccttctgctcatggccactgccatcgacgcccc
catcagtcgaactccccccgacacttcccttgacaccctgtccaccgagctgcgactccgacagcagtcc
attgccgagattactgagatgattcatgtggcttctctgttgcatgacgacgtgttggacgacgctgaga
ctcgacggggcattggctctctcaacttcgttatgggcaacaagctcgctgtcctcgcgggcgacttcct
gctgtctcgggcgtgtgttgcgctggcgtcgctaaagaacaccgaggttgttagcctactagcgaccgtt
gtcgaacatctggtcaccggcgaaaccatgcagatgaccaccactagcgaccagcggtgttccatggagt
actacatgcagaaaacctactacaagacagcgtccctgatttccaactcctgtaaggctattgctctgct
cgctggccagacctccgaggtcgccatgctcgcctacgagtacggcaagaacctcggcctcgccttccag
ctcattgacgacgtcctcgacttcaccggaacttcggcctcgctcggaaagggatccctctccgacattc
ggcatggaattgtcactgctcccattctgttcgctattgaggagttccccgagctgcgagctgtggtgga
cgagggattcgagaacccctacaacgtggacctggccctgcattaccttggaaagtcccgaggaatccag
cgaacacgagagcttgccatcaagcatgccaacctggcctctgacgccatcgactctctgcccgtgaccg
acgatgagcatgtcctccgatctcgacgagccctcgtcgagctcacccagcgagtcatcacccgacgaaa
gtag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>1722</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1722</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Yarrowia lipolytica</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gcctctttcaaccgattctgcgtgtcctccctgctggctcccaacaact
ctccccagatctccaacgctccccgatctaccgctgtgccctccatgcccaccacccagaagtggtctat
taccgaggacctggccttcatctctaacccctccaagcagcacaaccaccagaccggctaccgaattttc
tccgacgagttctacctgaagcacgagaacaagctcaaggacgtccgacgagccctgcgagaggtggagg
agactcccctggagggcctcgtcatgattgacaccctgcagcgactcggtatcgactaccacttccaggg
agagattggagctctgctccagaagcagcagcgaatctctacctgcgactaccccgagcacgacctgttc
gaggtgtccacccgattccgactgctccgacaggagggtcacaacgtccccgccgacgtgttcaacaact
tccgagacaaggagggacgattcaagtctgagctgtcccgagacattcgaggtctgatgtccctctacga
ggcttcccagctgtccattcagggcgaggacatcctcgaccaggccgctgacttctcctctcagctgctc
tctggttgggctaccaacctggaccaccaccaggcccgactggtccgaaacgctctcacccacccctacc
acaagtccctcgccaccttcatggctcgaaacttcaactacgactgtaagggccagaacggttgggtcaa
caacctccaggagctcgccaagatggacctgaccatggtgcagtctatgcaccagaaggaggtcctccag
gtgtcccagtggtggaagggacgaggtctggctaacgagctgaagctcgtgcgaaaccagcccctgaagt
ggtacatgtggcctatggccgctctcaccgaccctcgattctctgaggagcgagtcgagctgaccaagcc
catctccttcatctacatcattgacgacatcttcgacgtgtacggaaccctcgaggagctgaccctcttc
accgacgccgtcaaccgatgggagctgaccgctgtggagcagctccctgactacatgaagatctgcttca
aggccctgtacgacatcaccaacgagattgcttacaagatctacaagaagcacggacgaaaccccattga
ctctctccgacgaacctgggcctccctgtgtaacgctttcctcgaggaggccaagtggttcgcttctggc
aacctgcccaaggccgaggagtacctcaagaacggtatcatttcctctggaatgcacgtcgtgaccgtcc
acatgttcttcctgctcggcggttgtttcaccgaggagtccgtcaacctggtggacgagcacgccggtat
cacctcctctatcgctaccattctgcgactctctgacgacctcggatccgccaaggacgaggaccaggac
ggatacgacggctcttacctggagtgctacctcaaggaccacaagggttcctctgtcgagaacgcccgag
aggaggtcatccgaatgatttccgacgcttggaagcgactgaacgaggagtgcctgtttcccaacccctt
ctctgccaccttccgaaagggatccctgaacatcgctcgaatggtgcccctcatgtactcttacgacgac
aaccacaacctgcccattctcgaggagcacatgaaaaccatgctgtacgactcctcttcctaa</INSDS
eq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм дрожжей Yarrowia lipolytica - продуцент линалоола | 2023 |
|
RU2819537C1 |
| Модифицированная нуклеотидная последовательность, кодирующая полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы (варианты), ее использование при конструировании трансформантов дрожжей Yarrowia lipolytica, продуцирующих каротиноиды | 2021 |
|
RU2794980C1 |
| Трансформант дрожжей Yarrowia lipolytica, продуцирующий кантаксантин | 2023 |
|
RU2827562C1 |
| Способ повышения продукции изолимонной кислоты у дрожжей Yarrowia lipolytica, дрожжи вида Yarrowia lipolytica, обладающие способностью к продукции изолимонной кислоты | 2018 |
|
RU2713124C2 |
| ДРОЖЖИ РОДА YARROWIA, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ ВНУТРИКЛЕТОЧНО НАКАПЛИВАТЬ СЛОЖНЫЕ ЭФИРЫ ЖИРНЫХ КИСЛОТ, И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ТАКИХ ЭФИРОВ | 2013 |
|
RU2539744C1 |
| Промотор для экспрессии генов и его использование при конструировании трансформанта дрожжей Yarrowia lipolytica, продуцирующего β-каротин | 2022 |
|
RU2819535C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ YARROWIA-LIPOLYTICA - ПРОДУЦЕНТ ЛИПАЗЫ | 2011 |
|
RU2451075C1 |
| ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ ЛИПАЗЫ | 2007 |
|
RU2355754C1 |
| Штамм дрожжей Yarrowia lipolytica, продуцирующий изолимонную кислоту | 2021 |
|
RU2757603C1 |
| ИНТЕГРАТИВНЫЙ ВЕКТОР Random-URA3-RPT ДЛЯ ПОСЛЕДОВАТЕЛЬНОГО ВВЕДЕНИЯ МНОЖЕСТВЕННЫХ КОПИЙ ГЕНЕТИЧЕСКИХ ЭЛЕМЕНТОВ В ДРОЖЖИ Yarrowia lipolytica | 2006 |
|
RU2376376C2 |

Изобретение относится к биотехнологии. Предложен трансформант дрожжей Y. lipolytica, продуцирующий монотерпеноид линалоол, содержащий в составе хромосомы, по крайней мере, по одной копии каждого из следующих генов, ген HMGR1 Y. lipolytica, кодирующий 3-гидрокси-3-метилглютарил-кофермент А редуктазу, ген ERG12 Y. lipolytica, кодирующий мевалонаткиназу, модифицированный ген ERG2F88W-N119W Y. lipolytica, кодирующий фарнезилпирофосфатсинтазу, кодон-оптимизированный ген CrGPPS Catharanthus roseus, кодирующий фермент геранилпирофосфат синтазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1, и кодон-оптимизированный ген LIS Actinidia arguta, кодирующий линалоолсинтазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 2. Также предложен штамм дрожжей Y. lipolytica ВКПМ Y-5015, продуцирующий линалоол. Изобретение обеспечивает повышение продукции линалоола. 2 н.п. ф-лы, 8 ил., 1 табл., 7 пр.
1. Трансформант дрожжей Y. lipolytica, продуцирующий монотерпеноид линалоол, содержащий в составе хромосомы, по крайней мере, по одной копии каждого из следующих генов, ген HMGR1 Y. lipolytica, кодирующий 3-гидрокси-3-метилглютарил-кофермент А редуктазу, ген ERG12 Y. lipolytica, кодирующий мевалонаткиназу, модифицированный ген ERG2F88W-N119W Y. lipolytica, кодирующий фарнезилпирофосфатсинтазу, кодон-оптимизированный ген CrGPPS Catharanthus roseus, кодирующий фермент геранилпирофосфат синтазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1, и кодон-оптимизированный ген LIS Actinidia arguta, кодирующий линалоолсинтазу, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 2.
2. Штамм дрожжей Y. lipolytica ВКПМ Y-5015 - продуцент линалоола.
| CAO X | |||
| ET AL | |||
| Enhancing linalool production by engineering oleaginous yeast Yarrowia lipolytica | |||
| Bioresour Technol | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| US 20220213513 A1, 07.07.2022 | |||
| HOSHINO Y | |||
| ET AL | |||
| Stereospecific linalool production utilizing two-phase cultivation system in Pantoea ananatis | |||
| J Biotechnol | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
Авторы
Даты
2023-12-12—Публикация
2022-11-25—Подача