Изобретение относится к фармакологии, а именно к биологически активным веществам, обладающим антиагрегантной и антитромбогенной активностью, которые могут быть использованы в качестве действующего начала лекарственных препаратов для терапии тромбозов.
Известно, что проблема артериальных тромбозов является одним из важных факторов, определяющих исход заболеваний сердечно-сосудистой системы. Именно тромбозы служат причиной внезапной смерти, инфаркта миокарда, ишемического мозгового инсульта, сосудистых осложнений сахарного диабета, других нарушений кровоснабжения органов и тканей (R.J.Vestrick, M.E.Winn, D.T.Eitzman. Murine Models of Vascular Thrombosis. Arteriosclerosis, Thrombosis, and Vascular Biology, 2007, vol. 27, p.2079-2093). Важная роль в процессе тромбообразования отводится тромбоцитам, что обусловлено их способностью к адгезии, агрегации, освобождению содержимого гранул хранения, адсорбированию, депонированию и транспорту биологически активных веществ, способностью осуществлять эндотелиально-поддерживающую функцию (А.С.Духанин, Ф.Р.Губаева. Экспериментальная и клиническая фармакология, 1998, №4, с.66-71; R.C.Jin, B.Voetsch, J.Loscalzo. Endogenous mechanisms of ingibition of platelet function. Microcirculation, 2003, vol.3, №12, p.247-258.). Используя антитромбоцитарные вмешательства при различных проявлениях активации тромбоцитарного звена гемостаза, можно существенно уменьшить риск развития таких осложнений.
Однако, несмотря на то, что за последнее время достигнут значительный прогресс в изучении механизмов нарушения агрегации тромбоцитов, арсенал средств фармакологической коррекции нарушений тромбоцитарно-сосудистого гемостаза весьма ограничен.
В настоящее время выделяют три группы антитромбоцитарных препаратов.
Известны тиенопиридины (клопидогрель, тиклопидин, плавикс), которые селективно блокируют АДФ-рецептор P2Yi2 в тромбоцитах (S.P.Kunapuli. Multiple P2 receptor subtypes on platelets: A new interpretation of their function. Trends Pharmacol. Sci.,1998, vol. 19, p.391-394). Препараты обладают рядом недостатков. Так, при применении клопидогреля достоверно чаще отмечаются диарея и кожная сыпь, требующие отмены препарата (А.В.Добровольский. Клопидогрель в лечении заболеваний сердечно-сосудистой системы. Русский мед. журнал, 2009, №8, с.558-570). Чаще всего клопидогрель используют для усиления антитромботического эффекта, а именно в дополнение к аспирину, а также при возникновении резистентности к последнему. Кроме того, необходимо отметить высокую стоимость данного препарата, что ограничивает его применение и экономически не оправдано.
Известны блокаторы ГП-рецепторов IIb/IIIa для внутривенного применения - абциксимаб, эптифибатид, тирофибан, фрамон (Е.П.Панченко. Концепция атеротромбоза - основа патогенеза сердечно-сосудистых заболеваний. Основные направления антитромботической терапии. Русский мед. журнал, 2005, т.13, №7, с.433-440). Препараты могут использоваться только в условиях стационара по строгим показаниям. Кроме того, данные препараты дорогостоящи. Тем более, что к настоящему времени убедительно доказано значение этих препаратов лишь для предотвращения осложнений при внутрикоронарных вмешательствах в дополнении к аспирину.
Известны ингибиторы циклооксигеназы (ЦОГ), в частности ацетилсалициловая кислота, составляющая основу современной антитромбоцитарной терапии и которая признана стандартом антитромботической терапии [Guidelines on the management of stable angina pectoris: executive summary: The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Eur. Heart J., 2006, vol.27, p.1341-1381 (Рекомендации Европейского кардиологического сообщества, 2006)].
Однако хорошо известны свойственные аспирину желудочно-кишечные побочные эффекты, прежде всего увеличение риска кровотечений. Другим "слабым" местом аспирина считается наличие так называемой "резистентности" к аспирину у 15-45% лиц. Появившееся в последние годы отрицательное отношение к длительному использованию аспирина у больных с перенесенным ранее инфарктом миокарда и имеющих сердечную недостаточность или предрасположенных к ее развитию, основано на косвенных указаниях о способности аспирина ослаблять положительное влияние ингибиторов ангиотензинпревращающего фермента. Кроме того, описан так называемый "аспириновый парадокс" - относительно высокая частота ишемических событий на фоне использования аспирина.
Одним из важных факторов, определяющих исход заболеваний сердечно-сосудистой системы, является проблема артериальных и венозных тромбозов, которая неразрывно связана с состоянием системы гемостаза. В связи с вышесказанным создание новых соединений с антитромбогенной и одновременно антиагрегантной активностями является одним из перспективных направлений современной фармакологии.
Техническим результатом изобретения является повышение антитромбогенной активности препаратов и одновременное проявление антиагрегантной активности.
Технический результат достигается гидробромидом 9-(3,4-дигидроксифенацил)-2,3-дигидроимидазо[1,2-а]бензимидазола формулы I:
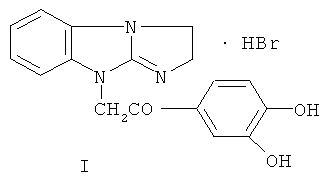
Соединение I описано ранее как проявляющее антиоксидантную активность и влияющее на агрегацию эритроцитов, тем самым уменьшая вязкость крови (В.А.Анисимова, И.Е.Толпыгин, А.А.Спасов и др. Хим.-фарм. журнал, 2007, т.41, №3, с.9-13). Для гидробромида I найдены новые свойства: выраженная антиагрегантная и антитромбогенная активности.
Способ получения соединения I заключается в конденсации 1H-2,3-дигидроимидазо[1,2-а]бензимидазола с 3,4-дигидроксифенацилбромидом. Другой способ, который описан в вышеуказанной работе, отличается тем, что в качестве алкилирующего компонента берут 3,4-диметокси-фенацилбромид, а затем в полученном гидробромиде 9-(3,4-диметоксифенацил)-2,3-дигидроимидазо[1,2-а]бензимидазола омыляют метоксигруппы при кипячении в конц. HBr:
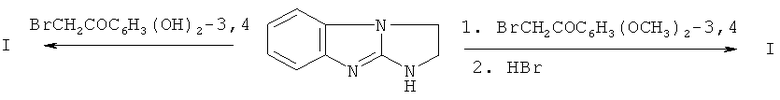
Ниже приведены примеры синтеза и исследования соединения I.
Пример 1. Гидробромид 9-(3,4-дигидроксифенацил)-2,3-дигидро-имидазо[1,2-а]бензимидазола (I). В теплый раствор 1,59 г (10 ммоль) 1Н-2,3-дигидроимидазо[1,2-а]бензимидазола (А.Ф.Пожарский, В.А.Анисимова, Е.Б.Цупак. Практические работы по химии гетероциклов. Изд-во Ростовского ун-та, 1988, с.124-125) в 35-40 мл ацетонитрила вносят 2,77 г (12 ммоль) 3,4-дигидроксифенацилбромида, полученного бромированием 3,4-дигидрокси-ацетофенона с помощью CuBr2 в смеси CHCl3 -EtOAc (L.C.King, G.K.Ostrum. J. Org. Chem., 1964, vol.29 p.3459; С.J.Sharpe, R.S.Shadbolt. J. Med. Chem, 1971, vol.14, №10, p.977-982). Смесь кипятят при перемешивании до полного протекания реакции (контроль - ТСХ), охлаждают, осадок отфильтровывают, промывают ацетонитрилом и ацетоном, получая 3,35 г (86%) искомой соли. Очищают перекристаллизацией из воды с активированным углем. Т.пл. 267-268°C.
Найдено, %: C 52,40; H 4,08; Br 20,35; N 12,43. C17H15N3O3·HBr.
Вычислено, %: C 52,32; H 4,13; Br 20,48; N 12,30. ИК-спектр, λ, см-1: 1705 (C=O).
ЯМР 1Н спектр (ДМСО-d6), δ, м.д.: 4.37 (2Н, т, CH2), 4.50 (2Н, т, CH2), 6.17 (2Н, с, СН2СО), 7.32 (2Н, дт, Н6,7), 7.57 (2Н, дд, Н5,8), 7.71 (1Н, д, Н5'), 7.80 (1Н, с, Н6'), 8.02 (1Н, д, Н2'), 9.33 (1Н, с, ОН), 9.47(ГН, с, ОН), 10.18 (1Н, с, N+H).
Пример 2. Изучение антиагрегантной активности in vitro.
Для изучения антиагрегантного действия была выбрана модель АДФ индуцированной агрегации тромбоцитов (G.V.Born, V.J.Cross. The aggregation of platelet. J. Physiol., 1963, vol.16, p.178-195), в модификации Габбасова В.А. (В.А.Габбасов, Е.Г.Попов, И.Ю.Гаврилов и др. Лабораторное дело, 1989, №10, с.15-18). Метод основан на регистрации степени изменений светопропускания плазмы, богатой тромбоцитами, при добавлении к последней веществ, индуцирующих агрегацию (в условиях постоянного перемешивания), а также на анализе флюктуации светопропускания образца суспензии, вызванных случайным изменением числа частиц в оптическом канале прибора. Эксперименты были выполнены на 4 кроликах, массой 2,5-3 кг. Исследования проводили на богатой тромбоцитами плазме, полученной по способу, описанному в 1971 году (В.А.Люсов, Ю.Б.Белоусов. Метод графической регистрации агрегации тромбоцитов и изменения ее при ишемической болезни сердца. Кардиология, 1971, №8, с.459-461). Для этого венозную кровь, взятую из ушной краевой вены кролика, стабилизировали 3,8% раствором цитрата натрия в соотношении 9:1 и центрифугировали в течение 10 минут на центрифуге ОПН-3 при мощности 1500 об/мин. Для получения бедной тромбоцитами плазмы, необходимой для калибровки, обогащенную тромбоцитами плазму центрифугировали при 3000 об/мин в течение 15 минут. Предварительно прибор калибровали по двум точкам. При этом светопропускание бедной тромбоцитами плазмы принималось за 0%, а светопропускание богатой тромбоцитами плазмы - за 100%. В ходе эксперимента в кювету агрегометра последовательно вносили 300 мкл богатой тромбоцитами плазмы и раствор исследуемого соединения в концентрации 1×10-4 М. Пробы инкубировали в термостатируемых ячейках агрегометра при 37°C в течение 5 минут. После включения записи агреготограммы, на 10 секунде регистрации процесса, в кювету добавляли индуктор агрегации - аденозин-5-дифосфорную кислоту (АДФ) («Sigma» США), в конечной концентрации 5 мкМ. В качестве препаратов сравнения взяты ацетилсалициловая кислота, широко используемая в клинике как антиагрегантное средство, а также дигидрохлорид 9-диэтиламиноэтил-2,3-дигидроимидазо[1,2-а]бензимидазола (диабенол), который также обладает антиагрегантной активностью (Г.В.Ковалев, А.А.Спасов, В.А.Анисимова и др. Патент РФ №2061481, Бюл., 1996, №16).
При регистрации процесса агрегации тромбоцитов в течение 5 мин получали кривые, отражающие падение оптической плотности богатой тромбоцитами плазмы. Степень агрегации оценивали по величине максимальной амплитуды, агреготограммы. Расчет ингибирующего влияния на агрегацию тромбоцитов (ИнАТ) изучаемых соединений проводили по формуле
ИнАТ=100-(В/А)×100%,
где А - степень агрегации тромбоцитов крови кроликов без изучаемых соединений,
В - степень агрегации тромбоцитов после инкубации плазмы богатой тромбоцитами с изучаемыми соединениями.
Величину антиагрегационного эффекта оценивали по показателю ЭК50 (эффективная концентрация, подавляющая процесс агрегации тромбоцитов на 50%). Расчет ЭК50 производился с использованием метода регрессионного анализа в программе Microsoft Excell 2003.
Острую токсичность вещества (ЛД50) определяли в опытах на беспородных белых мышах массой 16-20 г при внутрибрюшинном введении. Гибель животных отмечали в течение 24 ч. При подсчете величины ЛД50 использовали метод Личфилда-Вилкоксона.
Широту терапевтического действия веществ оценивали по условному терапевтическому индексу - отношению величины ЛД50 к ЭК50.
В результате эксперимента была определена величина антиагрегантного эффекта. ЭК50 бромида I «in vitro» составила 1,3×10-4 M (табл.1), ацетилсалициловой кислоты - 1,2×10-3 M, диабенола - 2,6×10-4 М.
По способности ингибировать функциональную активность тромбоцитов соединение I превосходит ацетилсалициловую кислоту в 9,2 раза, а диабенол - в 2 раза. ЛД50 вещества I составила 1260 мг/кг и, следовательно, терапевтический индекс соединения I в 17 раз превосходит таковой ацетилсалициловой кислоты и в 8 раз превосходит терапевтический индекс диабенола (табл.1).
Пример 3. Изучение антиагрегантного действия на модели внутрисосудистой агрегации тромбоцитов.
Эксперименты были выполнены на 55 белых нелинейных крысах обоего пола массой 250-300 г. Моделирование внутрисосудистой агрегации тромбоцитов проводили по методу, основанному на способности натриевой соли аденозин-дифосфорной кислоты (АДФ) при внутривенном введении лабораторным животным вызывать образование тромбоцитарных агрегатов в сосудистом русле (J.F.Pinon. In vivo stady platelet aggregation in rats. J. Pharmacol. Meth., 1984, vol. 12, p.79-84). В ходе эксперимента в бедренную вену крысы вводили раствор индуктора агрегации тромбоцитов АДФ в дозе 1 мг/кг (0,1 мл на 100 г веса животного). Через 30 сек после введения АДФ из брюшной аорты забирали две порции крови по 0,5 мл. В одной порции содержалось 1,5 мл ЭДТА-буферного раствора с формалином (pH 7,6), фиксирующим образовавшиеся тромбоцитарные агрегаты (проба А) (в мМ-ЭДТА - 24,0; KH2PO4 - 3,3; Na2HPO4×2H2O - 5,4; формалин - 2,5%), а в другой 1,5 мл ЭДТА-буферного раствора без формалина (проба Б), в которой происходила дезагрегация (в мМ-ЭДТА - 24,0; KH2PO4 - 3,3; Na2HPO4×2H2O - 13,4). Обе пробы осторожно перемешивали и отстаивали в пластиковых пробирках 10-15 мин. После этого пробы центрифугировали при 1500 об/мин в течение 10 мин. В надосадочной жидкости подсчитывали число отдельных тромбоцитов фазовоконтрастным методом.
Расчет величины внутрисосудистой агрегации тромбоцитов проводили по формуле
(В-А × 100%): В,
где А - число тромбоцитов в пробе А,
В - число тромбоцитов в пробе В.
Соединение I в дозе 50 мг/кг вводили перорально за 30 мин до нембуталового наркоза животных (50 мг/кг внутрибрюшинно). В качестве препарата сравнения использовали ацетилсалициловую кислоту в дозе 125 мг /кг и диабенол в дозе 50 мг/кг. Для определения ЭК 50 вещества I и диабенол были изучены в концентрациях 25 и 10 мг/кг, а ацетилсалициловая кислота - в дозах 250 и 350 мг/кг.
Статистическая обработка результатов проводили в электронной таблице Excell 5.0 с использованием t-критерия Стьюдента и парного критерия Вилкоксона при помощи пакета статистических программ программного обеспечения Microsoft Excell 2006.
В результате проведенных опытов было показано, что соединение I, проявившее высокую антиагрегантную активность in vitro, показало также высокую способность ингибировать агрегацию тромбоцитов in vivo в дозе 50 мг/кг (табл.2). Как видно из данной таблицы, уровень агрегации тромбоцитов контрольной группы животных в абсолютных величинах составил 20,3. Тогда, как уровень агрегации кровяных пластинок при введении бромида I был равен 5,15, что соответствовало 74,6% ингибирования агрегации тромбоцитов по сравнению с контрольными крысами. Затем был исследован дозозависимый антиагрегантный эффект исследуемого соединения, в связи с чем его действие было изучено дополнительно в дозах 25 и 10 мг/кг. В дозе 25 мг/кг оно снижало уровень агрегации тромбоцитов с 20,3 до 10,4. Антиагрегационный эффект при этом был равен 48,8%. Уменьшение дозы до 10 мг/кг приводило к потере ингибирующей активности, которая составила 15,57%. ЭК50 соединения I при этом была равна 24,01 мг/кг (табл.2).
Уровень агрегации кровяных пластинок при введении диабенола в дозе 50 мг/кг равен 6,03, что соответствовало 70,2% ингибирования агрегации тромбоцитов по сравнению с контрольными животными. В дозе 25 и 10 мг/кг антиагрегантная активность диабенола составила 55,2 и 14,4% соответственно. ЭК50 данного вещества была равна 25,4 мг/кг.
Ацетилсалициловая кислота была также изучена в трех дозах 125 мг/кг, 250 мг/кг и 350 мг/кг. Препарат в дозе 125 мг/кг предупреждал внутрисосудистую агрегацию тромбоцитов на 28,6%, в дозе 250 мг/кг блокировал ее на 57,8%, а в дозе 350 мг/кг на 89,2%. ЭК50 ацетилсалициловой кислоты - 192 мг/кг (табл.3). Также нами был рассчитан условный терапевтический индекс изученных веществ (табл.3). По терапевтическому индексу соединение I превосходило ацетилсалициловую кислоту в 38,1 раза, а диабенол - в 5,7 раза.
Пример 4. Изучение антитромботической активности соединения I на моделях экспериментальных тромбозов
А. Влияние на выживаемость мышей на модели системного адреналин-коллагенового тромбоза
В работе использовали 40 белых беспородных мышей обоего пола массой около 20-25 г, содержащихся в условиях вивария (температура 22-24°C, относительная влажность воздуха 40-50%) с естественным световым режимом на стандартной диете (ГОСТ Р 50258-92), соблюдая правила лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.3-96 и 1000.4-96), а также правила и Международные рекомендации Европейской конвенции по защите позвоночных животных, используемые при экспериментальных исследованиях (1997).
Модель клеточного тромбоза для тестирования потенциальных антитромботических агентов, первично действующих на агрегацию тромбоцитов, была поставлена в соответствии с методикой DiMinno G. (G.DiMinno, M.J.Silver. Mouse Antithrombotic Assay: A Simple Method for the Evaluation of Antithrombotic Agents in vivo. Potentiation of Antithrombotic Activity be Ethyl Alcohol. J. Pharmacol. Exp. Ther., 1983, vol. 225, №1, p.57-60).
В качестве тромботического агента использовали смесь растворов коллагена и адреналина в дозе 0,5 мг/кг и 0,06 мг/кг соответственно. Данную смесь в объеме 0,1 мл вводили в хвостовую вену животного в течение 10 сек. Исследуемое вещество и препараты сравнения, в качестве которых использовали ацетилсалициловую кислоту в дозе 20 мг/кг и диабенол в дозе 36 мг/кг, вводили перорально за 2 ч до моделирования тромбоза. Соединение I вводили в дозе 43 мг/кг, которая была эквимолярна дозе аспирина, так же как и дозе диабенола.
Животным контрольной группы вводили растворитель в эквивалентном объеме. В качестве критерия эффективности исследуемых соединений фиксировалось количество выживших животных по сравнению с контрольной группой.
Статистический анализ достоверности действия противотромботических препаратов (оценку разности между долями животных, выживших в контроле и в опыте) выполняли по F критерию Фишера.
В группе контрольных животных наблюдалась гибель примерно 95% мышей. При этом были отмечены характерные признаки нарушения дыхательной функции легких: наблюдалось увеличение частоты и поверхностный характер дыхания, выраженный экзофтальм, и изменение цвета радужной оболочки. Также наблюдался парез задних конечностей: мыши не двигались даже в ответ на толчки, не были способны отдергивать задние лапы при сильном нажатии. Визуально наблюдались тетанические судороги, животные принимали характерную позу, при которой задние лапы были выпрямлены и отведены назад. В течение 1-3 мин после введения тромботических агентов животные погибали от удушья.
Данные проведенных исследований представлены в табл.4. Так, соединение I в изученной дозе предотвращало гибель 90% животных, двигательная активность которых полностью восстанавливалась через 1,0-1,5 мин. Остальные 10% животных, которые погибли в результате эксперимента при визуальном наблюдении, были более активны, наблюдалось уменьшение выраженности двигательных нарушений, при этом внешние проявления генерализованного тромбоза развивались постепенно (в течение 3-5 мин) в отличие от контрольной группы.
Диабенол в изученной дозе предотвращал гибель 70% животных, остальные 30% животных погибли в результате эксперимента.
Ацетилсалициловая кислота оказала маловыраженное защитное действие. В группе мышей, получивших ацетилсалициловую кислоту, выжившие животные составили всего 30%.
Дополнительно были сопоставлены данные об острой токсичности данных соединений. Летальные дозы при которых погибает 50% мышей, составляют для соединения I - 1260 мг/кг, для диабенола - 275 мг/кг, а для ацетилсалициловой кислоты - 310 мг/кг. Таким образом, соединение I обладает выраженной противотромботической активностью, превосходящей ацетилсалициловую кислоту и диабенол, и эта активность проявляется в дозе, которая ниже его токсической дозы.
Б. Изучение антитромботической активности на модели артериального тромбоза, индуцированного раствором хлорида железа Эксперименты выполнены на 55 белых нелинейных крысах-самцах, массой 450-500 г, содержащихся в условиях вивария (температура 22-24°C, относительная влажность воздуха 40-50%) с естественным световым режимом на стандартной диете (ГОСТ Р 50258-92), соблюдая правила лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3-96 и 1000.4-96), а также правила и Международные рекомендации Европейской конвенции по защите позвоночных животных, используемые при экспериментальных исследованиях (1997).
Изучение антитромботической активности соединений проводили на модели артериального тромбоза у крыс, вызванного поверхностной аппликацией 50% раствора хлорида железа (III) (K.D.Kurz, B.W.Main, G.E.Sandusky. Rat model of arterial thrombosis induced by ferric chloride. Thromb. Res., 1990, vol. 15, p.269-280). Соединение I вводили перорально в дозе, эквимолярной дозе ацетилсалициловой кислоте (20 мг/кг), которая составила 43 мг/кг. Диабенол вводили в дозе 36 мг/кг. Группе контрольных животных вводили растворитель в эквивалентном количестве. Моделирование артериального тромбоза осуществляли спустя 2 ч после перорального введения соединений, что соответствует времени достижения максимальной концентрации ацетилсалициловой кислоты в крови. Крыс интраперитониально наркотизировали нембуталом (50 мг/кг), затем послойно вскрывали кожу и ткани, отпрепаровывали сонную артерию на 4 см в длину, на участок длиной около 1 см укладывали ватный диск размером 2 мм × 8 мм, смоченный 50% раствором хлорида железа (0,025 мл), и пленку Parafilm для изоляции окружающих тканей. На расстоянии 1 см от данного участка устанавливался ультразвуковой датчик аппарата Доплера. Доплерографические исследования проводили на ультразвуковом компьютеризированном приборе для исследования кровотока как в крупных кровеносных сосудах (артериальных и венозных диаметром 1-7 мм), так и в микрососудах (диаметром менее 1 мм) неинвазивным способом «Минимакс-Доплер-К» (Санкт-Петербург). Регистрацию кровотока вели до полной окклюзии сосуда (характеризуется отсутствием пульсации сонной артерии выше участка наложения тромбообразующего агента и характерного артериального звукового сигнала).
В качестве критериев оценки эффективности препаратов использовали удлинение интервала времени, необходимого для развития полной окклюзии сонной артерии.
Для определения ЭК50 изученные вещества исследовали в различных концентрациях.
Статистическую обработку результатов проводили в электронной таблице Excell 5.0 с использованием t-критерия Стьюдента и парного критерия Вилкоксона при помощи пакета статистических программ программного обеспечения Microsoft Excell 2006.
В контрольной группе животных, которым вводили дистиллированную воду, среднее время окклюзии сонной артерии составило 17,4 мин (табл.5), что совпадает с данными, полученными другими авторами (G.DiMinno, M.J.Silver. Mouse Antithrombotic Assay: A Simple Method for the Evaluation of Antithrombotic Agents in vivo. Potentiation of Antithrombotic Activity be Ethyl Alcohol. J. Pharmacol. Exp. Ther., 1983, vol. 225, №1, p.57-60). Предварительное введение соединения I предупреждало время развития окклюзии сонной артерии крыс. Время образования тромба при действии данного вещества составило 30,48 мин, что соответствовало увеличению времени окклюзии сосуда по отношению к контролю на 74,7%.
Диабенол уступал соединению I. Полную окклюзию сонной артерии при введении данного вещества наблюдали на 28 мин, что составило увеличение времени образования тромба на 62,34% по отношению к контролю.
Ацетилсалициловая кислота в дозе 20 мг/кг оказалась практически неэффективна, так как увеличивала время полной окклюзии сосуда по сравнению с контрольной группой животных всего на 16,7%.
Далее нами была определена ЭК50 соединений I и диабенола, а также ацетилсалициловой кислоты (табл.5). Для этого с учетом эффекта, который вещества I и диабенол проявили в эквимолярных дозах ацетилсалициловой кислоты, их концентрация была снижена, а доза препарата сравнения увеличена. ЭК50 для вещества I составила 23,4 мг/кг, для диабенола - 31,12 мг/кг, а для аспирина этот показатель оказался в несколько раз выше и был равен 114,7 мг/кг. По терапевтическому индексу соединение I превосходило аспирин в 20 раз, а диабенол в 6 раз (табл.6).
Таким образом, в результате исследований установлено, что трициклическое конденсированное производное бензимидазола I проявило выраженную антиагрегантную и антитромбогенную активности.
По способности ингибировать функциональную активность тромбоцитов in vitro соединение I превосходит ацетилсалициловую кислоту в 9,2 раза, а диабенол, являющийся также конденсированным производным бензимидазола, в 2 раза. Терапевтический индекс соединения I in vitro в 17 раз превосходит таковой ацетилсалициловой кислоты и в 8 раз превосходит терапевтический индекс диабенола (табл.1).
Соединение I при изучении на интактных животных также показало высокую антиагрегантную активность и по терапевтическому индексу превосходило ацетилсалициловую кислоту и диабенол в 38,1 и 5,7 раз соответственно.
На экспериментальной модели адреналин-коллагенового тромбоза соединение I предотвращало гибель 90% животных, в то время как выживаемость животных при введении диабенола составила 70%, а ацетилсалициловой кислоты всего 30%.
В результате проведенных исследований также установлено, что соединение I проявило выраженную антитромботическую активность на модели артериального тромбоза, индуцированного раствором хлорида железа. По терапевтическому индексу данное соединение превосходило ацетилсалициловую кислоту в 20 раз, а диабенол в 6 раз.
Таким образом, изучение антиагрегантной и антитромбогенной активности конденсированного производного бензимидазола I имеет важное значение для разработки новых антиагрегантных и антитромбогенных лекарственных средств, применяющихся в терапии состояний, сопровождающихся повышенным тромбогенным состоянием крови.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИТРОМБОГЕННОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2440814C1 |
| ДИГИДРОХЛОРИД 1-(3-МОРФОЛИНОПРОПИЛ)-2-ФЕНИЛИМИДАЗО[1,2-a]-БЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТАГОНИСТА ПУРИНОВЫХ P2Y-РЕЦЕПТОРОВ, АНТИАГРЕГАНТНУЮ И АНТИТРОМБОТИЧЕСКУЮ АКТИВНОСТЬ | 2008 |
|
RU2391345C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНТИТРОМБОТИЧЕСКОГО ДЕЙСТВИЯ В ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЕ В ВИДЕ ТАБЛЕТОК | 2019 |
|
RU2696869C1 |
| ГИДРОГАЛОГЕНИДЫ 11-ФЕНОКСИЭТИЛ- И 11-БЕНЗИЛЗАМЕЩЁННЫХ 2,3,4,5-ТЕТРАГИДРО[1,3]ДИАЗЕПИНО[1,2-а]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2582618C1 |
| АНТИТРОМБОТИЧЕСКОЕ СРЕДСТВО, ВЛИЯЮЩЕЕ НА РЕГУЛЯЦИЮ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ТРОМБОЦИТОВ | 2008 |
|
RU2377990C1 |
| ДИГИДРОБРОМИД 2-(3,4-ДИГИДРОКСИФЕНИЛ)-9-ДИЭТИЛАМИНОЭТИЛИМИДАЗО[1,2-a] БЕНЗИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2008 |
|
RU2391979C2 |
| Дикалиевая соль N-(3-гидроксибензоил)таурина, обладающая антиагрегантной и антитромботической активностью в сочетании с церебропротективным действием | 2019 |
|
RU2730835C1 |
| Бромиды 1-замещенных-3-{ [2-(3,5-ди-трет-4-гидроксифенил)-2-оксоэтил]} -2-аминобензимидазолия, обладающие антиагрегантными и антиоксидантными свойствами | 2016 |
|
RU2623439C1 |
| Дикалиевая соль N-(4-гидроксибензоил)таурина, обладающая антиагрегантной и антитромботической активностью | 2019 |
|
RU2731106C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАГРЕГАНТНОЙ И АНТИКОАГУЛЯНТНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2573379C1 |
Предложено применение гидробромида 9-(3,4-дигидроксифенацил)-2,3-дигидроимидазо[1,2-а]бензимидазола формулы I в качестве соединения, обладающего антитромбогенной активностью. Соединение может быть использовано в качестве действующего начала лекарственных препаратов для терапии тромбозов. Техническим результатом изобретения является повышение антитромбогенной активности в условиях артериального тромбоза. Активность соединения превосходит ацетилсалициловую кислоту и диабенол. 1 з.п. ф-лы, 6 табл., 4 пр.
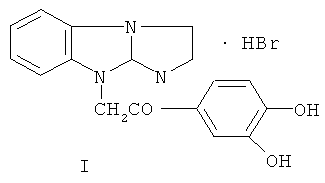
1. Применение гидробромида 9-(3,4-дигидроксифенацил)-2,3-дигидроимидазо[1,2-а]бензимидазола формулы I:
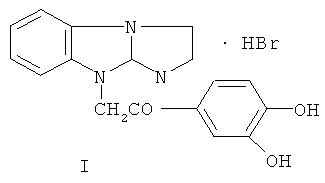
в качестве соединения, проявляющего антитромбогенную активность.
2. Применение гидробромида 9-(3,4-дигидроксифенацил)-2,3-дигидроимидазо[1,2-а]бензимидазола по п.1 как действующего начала в фармацевтических композициях.
| АНИСИМОВА В.А | |||
| и др | |||
| Синтез и фармакологическая активность ароил-метилзамещенных бензимидазольных систем, содержащих гидроксигруппы в ароильном радикале | |||
| - Химико-фармацевтический журнал, 2007, т.41, №3, с.9-13 | |||
| АНТИТРОМБОТИЧЕСКОЕ СРЕДСТВО, ВЛИЯЮЩЕЕ НА РЕГУЛЯЦИЮ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ТРОМБОЦИТОВ | 2008 |
|
RU2377990C1 |
| КОНКОЛЬ К.И | |||
| Функциональная активность форменных элементов крови и антитромбогенный потенциал сосудистой | |||
Авторы
Даты
2012-06-20—Публикация
2010-11-10—Подача