Предлагаемое изобретение относится к медицине, а именно к фармацевтической химии, фармакологии и технологии лекарственных форм, и направлено на создание лекарственного препарата с противоишемическими, гемореологическими и антирадикальными свойствами.
Известно, что при ишемии ограничивается поступление кислорода и запускается каскад метаболических процессов, в которые вовлечена генерация свободных радикалов кислорода и азота (S.Love. Oxidative stress in brain ischemia. // Brain Pathology. - 1999. - Vol.9. - P.119-131), играющих ключевую роль при ишемических и, в особенности, реперфузионных поражениях (M.Fujimura, T.Tominaga, P.H.Chan. Neuroprotective effect of antioxidant in ischemic brain injury. // Neurocritical Care. - 2005. - Vol.2, №1. - P.59-66).
Одним из наиболее перспективных направлений фармакологической коррекции поражений мозга является применение нейропротекторов с разными механизмами действия, таких как «ловушки» свободных радикалов (СР), ингибиторы NO-синтазы и селенорганичекие соединения (Е.И.Гусев, В.И.Скворцова. Ишемия головного мозга. // - М.: Медицина, 2001). При этом, помимо использования для монотерапии, препараты, элиминирующие свободные радикалы, могут быть полезны в комбинации с другими терапевтическими подходами, в особенности, со средствами, восстанавливающими нарушенный кровоток, когда реперфузия вызывает массированное увеличение продукции СР (I.Margaill, M.Plotkine, D.Lerrouet. Antioxidant strategies in the treatment of stroke. // Free Rad. Biol. Med. - 2005. - Vol.39, №4. - 429-443).
Как правило, в лечении ишемических поражений используется сочетание нескольких препаратов, влияющих на основные патогенетические звенья ишемии. Поэтому в качестве препаратов сравнения при изучении противоишемических свойств был выбран кавинтон, нейропротективное действие которого опосредовано его сосудистыми и гемореологическими эффектами (Г.Н.Авакян, А.А.Никонов, Е.И.Чуканова. Кавинтон в эксперименте и клинической практике: Методические рекомендации. - М.: Медицина, 1998. - 55 с.), при исследовании антирадикальных и мембранопротекторных свойств - препарат мексидол (соль эмоксипина и янтарной кислоты), для которого характерно антирадикальное и противогипоксическое действие и который эффективен при острых и хронических нарушениях мозгового кровообращения (Т.А.Воронина. Отечественный препарат нового поколения мексидол, основные эффекты, механизм действия, применение. Изд-во НИИ Фармакологии PAMH. - M. - 2003. - 20 c.), а при исследовании гемореологических свойств - препарат пентоксифиллин, оказывающий влияние на вязкостные характеристики крови (H.Flint, M.A.Cotter, N.E.Cameron. Pentoxifylline effects on nerve conduction velocity and blood flow in diabetic rats. // Int. J. Exp. Diabetes. Res. - 2000. - Vol., №1. - P.49-58) и эталонный антиагрегант - ацетилсалициловая кислота, широко используемая в клинической практике (В.А.Алмазов, B.C.Гуревич, Л.В.Шатилина и др. Роль гиперпероксидации липидов в нарушении структурой организации тромбоцитарных мембран. // Бюллетень эксперим. биологии и медицины. - 1992. - №9. - С.265-267).
Техническим результатом изобретения является создание средства, обладающего более высокой противоишемической, гемореологической и антирадикальной активностью.
Технический результат достигается дигидробромидом 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола формулы I

Известно, что дигидробромид 2-(3,4-диоксифенил)-9-диэтил-аминоэтилимидазо[1,2-а]бензимидазола оказывает церебропротекторное действие при радиационных поражениях (Патент РФ №2238938, C07D 235/04, 2004 г.).
Способ получения дигидробромида 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола заключается в конденсации 1-диэтиламиноэтил-2-аминобензимидазола с 3,4-диметоксифенацилбромидом, последующей циклизации образующегося в результате конденсации бромида 1-диэтиламиноэтил-3-(3,4-диметоксифенацил)-2-аминобензимидазолия в 48%-ной бромистоводородной кислоте (т.кип. 127°С), сопровождающейся деметилированием метоксигрупп и образованием искомого дигидробромида 2-(3,4-дигидроксифенил)замещенного имидазо[1,2-а]бензимидазола (аналогию см. Хим.-фарм. журнал, 2006 г., т.40, №10, с.3-10).
Ниже приведен пример получения соединения I.
Пример. Дигидробромид 2-(3,4-диоксифенил)-9-этиламиноэтилимидазо[1,2-а]бензимидазола (I).
В раствор 2,32 г (10 ммоль) 2-амино-1-диэтиламиноэтилбензимидазола в 25 мл ацетона вносят 2,6 г (10 ммоль) 3,4-диметоксифенацилбромида. Выпавший осадок бромида 2-амино-1-(2-диэтиламиноэтил)-3-(3,4-диметоксифенацил)бензимидазолия отфильтровывают, промывают ацетоном. Выход 4,6 г (93,5%). Т.пл. 182°С (разложение, из спирта). Найдено, %: C 56,2; H 6,4; Br 16,4; N 11,3. C23H30N4O3·HBr. Вычислено, %: C 56,2; H 6,4; Br 16,3; N 11,4. ИК-спектр (вазелиновое масло): 1685 см-1 (C=O).
Кипятят 4 г (~8 ммоль) полученного бромида в 160 мл конц. HBr (т.кип.127°С) до полного протекания реакции (контроль - ТСХ: исчезновение пятна исходного имина и промежуточно образующегося 2-(3,4-диметоксифенил)замещенного имидазо[1,2-а]бензимидазола). По охлаждении осадок искомого дигидробромида отфильтровывают, промывают ацетоном. Выход 4,1 г (96%). Кристаллизуется соль из 80%-ного водного спирта в виде белоснежных волокнистых кристаллов, которые после высушивания при 110-120°С имеют т.пл. 289-290°С (разложение). Кристаллогидрат с 1 молекулой воды плавится при 180°С. В ИК-спектре полученного дигидробромида отсутствует полоса поглощения карбонильной группы, присутствующая в ИК-спектре четвертичной соли. Найдено, %: C 47,6; H 5,3; Br 30,0; N 10,7. C21H24N4O2·2HBr. Вычислено, %: C 47,9; H 5,0; Br 30,4; N 10,7.
Фармакологические свойства заявленного соединения I.
Данное соединение (I) проявляет противоишемические и гемореологические свойства, обладает широким спектром антирадикальной активности.
Исследование противоишемической активности соединения I in vivo (модель 4-сосудистой перевязки артерий мозга с реперфузией у крыс)
Материалы и методы
Опыты выполнены на 40 неинбредных крысах обоего пола массой 180-230 г, которых содержали в условиях вивария с естественным световым режимом на стандартной диете лабораторных животных (ГОСТ Р50258-92) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997), а также правил лабораторной практики при проведении доклинических исследований в РФ. Забой животных проводили согласно требованиям, изложенным в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1989).
Соединение I (5 мг/кг) и препарат сравнения кавинтон (5 мг/кг) вводили однократно внутрибрюшинно за 10 мин перед окклюзией каротидных артерий. Для исследования было сформировано 3 группы: 1) контроль - ложнооперированные крысы; 2) ишемия; 3) животные с ишемией, которым за 10 мин до окклюзии вводили исследуемое вещество.
Тотальную ишемию головного мозга с последующей реперфузией моделировали по методу (C.Bromont, C.Marie, J.Bralet. Increased lipid peroxidation in vulnerable brain regions after transient forebrain ischaemia in rats. // Stroke. - 1989. - Vol.20, №7. - P.918-924). Первоначально производили термокоагуляцию вертебробазилярных артерий. Через 4 сут после восстановления животных на каротидные артерии накладывали окклюзоры без пережатия. Все этапы операции проводили под наркозом (калипсол 80-100 мг/кг, в/бр). На следующие сутки после второй операции моделировали тотальную ишемию головного мозга пережатием каротидных артерий окклюзорами в течение 30 мин. Реперфузия достигалась снятием окллюзоров, восстановление кровотока контролировали визуально.
В восстановительном периоде оценивали показатели двигательной активности (актометр Ugo Basile, Италия) в 1-е и 2-е сут реперфузии. В течение первых 7 сут оценивали неврологический статус животных и динамометрию передних лап, которую определяли по усилию удержания кольца динамометра при рефлексе хватания передними лапами, как описано (В.В.Дрозд, В.А.Косолапов, О.В.Островский, А.А.Спасов. Динамика восстановительного периода у крыс, перенесших тотальную ишемию головного мозга. // Бюлл. эксперим. биол. мед. - 2000. - Т.130, №10. - С.475-477.). Неврологический статус оценивали по 3-х балльной шкале с учетом нормальных (2 балла), сниженных (1 балл) или отсутствующих (0 баллов) рефлексов (роговичного, отдергивания хвоста, задней лапы, переворачивания, хватания передними лапами и вздрагивания на звуковой раздражитель). На 7-е сут реперфузии исследовали запоминание аверсивного стимула в тесте условной реакции пассивного избегания (УРПИ), обучение проводили предварительно за 1 час до начала ишемии. При наблюдении за животными позже 7 сут динамики отмечено не было.
Смертность в ходе эксперимента колебалась между 25 и 35%. Гибель после термокоагуляции вертебробазилярных артерий составляла не более 10%. После 2-го этапа - наложения окклюзора на каротидные артерии гибели животных не наблюдали.
Статистическую обработку данных проводили в пакете Statistica 6.0. па (StatSoft, США) с использованием дисперсионного анализа множественных сравнений и критерия Шеффе (p≤0,05 или p≤0,01).
Результаты.
При изучении влияния соединения I на восстановление крыс в реперфузионном периоде после ишемии было установлено, что соединение I превосходило препарат сравнения кавинтон по активности, более выражено восстанавливая нарушенную двигательную активность в 1-е и 2-е сут реперфузии (Таблица 1). Соединение I достоверно улучшало неврологический статус и вызывало его полную нормализацию на 7-е сут наблюдений (Таблица 2), а также практически полное восстановление мышечной силы (Таблица 3). Кавинтон не приводил к полной нормализации неврологического статуса и динамометрии - на 7-е сут дефицит составлял 34% и 23,5% соответственно. Соединение I нормализовало запоминание обучающего задания в тесте УРПИ у животных, перенесших тотальную ишемию мозга, сокращая дефицит памяти до 15,3% (p<0,01) (Таблица 4). Препарат сравнения также оказывал некоторое корректирующее влияние на памятный след, однако дефицит памяти под влиянием кавинтона составлял 50,3%.
Таким образом, соединение I превосходит препараты сравнения дибунол и кавинтон по противоишемической активности.
Исследование антирадикальной активности соединения I in vitro
Материалы и методы
В качестве препарата сравнения использовали мексидол (НИИ фармакологии РАМН, Россия). Исследование процессов хемилюминесценции проводили на хемилюминометре «Хемилюминомер-03» (Уфа, Россия), связанном интерфейсом с компьютером.
Способность веществ взаимодействовать с липидными радикалами LOO• исследовали на модели Fe2+-индуцированной хемилюминесценции липидов (P.P.Фархутдинов, В.А.Лиховских. Хемилюминесцентные методы исследования свободно-радикального окисления в биологии и медицине. // - Уфа, 1995. - 110 с.). Реакционная смесь объемом 20 мл содержала липиды куриного желтка, содержащего липопротеиновые комплексы. Содержание белка определяли с помощью кумасси синего и доводили до 1 мг на мл дальнейшим разведением. Инициирование ПОЛ осуществляли FeSO4 (чда, Украина) в конечной концентрации 2,5 мМ при интенсивном перемешивании и t 37°C, после чего в течение 10 мин измеряли кинетику хемилюминесценции.
Для измерения ХЛ, сопровождающей аутоокисление люминола с генерацией активных форм кислорода (АФК) (С.Г.Семешко, P.P.Фархутдинов. Общая антиоксидантная активность слезной жидкости. // Клин. лаб. диаг. - 2002. - №24. - С.33-34), в кювету хемилюминометра добавляли фосфатный буфер pH 7,45, содержащий 1 мкМ люминола (Serva, Германия) и 5 мМ цитрата натрия (ЧД, Россия) в конечном объеме 20 мл. Инициирование ХЛ осуществляли FeSO4 в конечной концентрации 2,5 мМ при интенсивном перемешивании и в течение 5 мин измеряли кинетику ХЛ.
Для оценки способности веществ инактивировать супероксидный анион-радикал использовали непрямой метод (В.А.Костюк, А.И.Потапович, Ж.В.Ковалева. Простой и чувствительный метод определения активности супероксиддисмутазы, основанный на реакции окисления кверцитина. // Вопр. мед. химии. - 1990. - Т.36, №2. - С.88-91) с применением кверцетина (Sigma, США). Ингибиторную активность соединений регистрировал по торможению падения оптической плотности на спектрофотометре СФ-46 (Ломо, Россия) при λ 406 нм в кювете с длиной оптического пути 10 мм. Степень ингибирования реакции рассчитавали: % инг=100-(ΔDвещ/ΔDкверц×100), где ΔDвещ - изменение оптической плотности за 10 мин в опытной пробе, содержащей вещество; ΔDкверц - изменение оптической плотности за 10 мин в контрольной пробе, не содержащей вещества. Также применяли прямой хемилюминесцентный метод ксантин-ксантиноксидаза индуцированной люцигенин-зависимой ХЛ (B.Gunaydin, A.T.Demiryurek. Interaction of lidocaine with reactive oxygen and nitrogen species. // Eur. J. Anaesthesiol. - 2001. - Vol.18, №12 - P.816-822). Генерацию супероксидного радикала вызывали внесением 0,25 мл ксантиноксидазы (Sigma, США) (0,25 U/ml) в пробу, содержащую 10 мл фосфатного буфера pH 7,45, содержащего 5 мкМ люцигенина (Fluka, Швейцария) и 0,5 мл 1 мМ ксантина (Sigma, США). Кинетику хемилюминисценции оценивали в течение 5 мин при интенсивном перемешивании и t 37°C.
Способность веществ к перехвату и инактивации пероксильного радикала (ROO•) оценивали по методу (Г.И.Клебанов, О.Б.Любицкий, О.В.Васильева и др. // Антиоксидантные свойства производных 3-оксипиридина: мексидола, эмоксипина и проксипина. // Вопр. мед. химии. - 2001. - Т.47. - С.288-300). Инициирование реакции осуществляли водорастворимым 2,2'-азобис(2-метилпропионамидин)дигидрохлоридом (АБАП) (Fluka, Швейцария), который при t 37°C разлагается, образуя пероксильные радикалы. В пробу, содержащую 2,5 мкМ люминола (Serva, Германия) в фосфатном буфере pH 7,4 при постоянном перемешивании и t 37°C, вносили 50 мМ АБАП и измеряли кинетику ХЛ в течение 30 мин.
Изучаемые вещества вводили в среду инкубации за 1 мин перед инициированием реакции в широком диапазоне концентраций.
Результаты оценивали статистически в программе Statistica 6.0 с использованием t-критерия Стьюдента с поправкой Бонферони (t). Отличия от контроля во всех группах считали статистически значимыми при Р≤0,05. Для сравнительной оценки эффективности веществ рассчитывали величины ИК50 (концентрация вещества, ингибирующая реакцию на 50%). Расчет ИК50 проводили с помощью простого линейного регрессионного анализа, реализованного во встроенном пакете анализа программы Microsoft Excel 2000 с расчетом парного коэффициента корреляции R2. Достоверность регрессии оценивали с помощью двухфакторного дисперсионного анализа в программе «Statistica 6.0» (Stat Soft, США).
Результаты
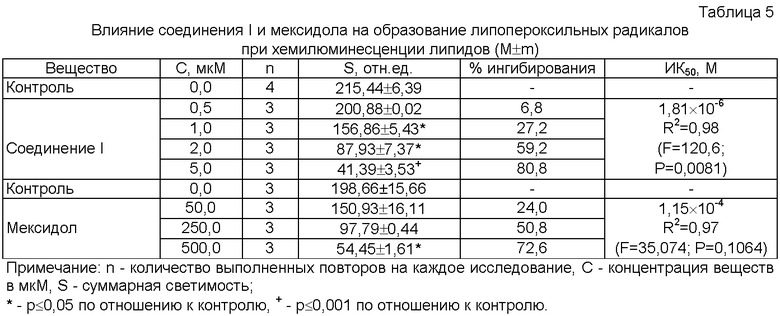
Исследуемое вещество I дозозависимо подавляло образование липопероксильных радикалов (Таблица 5) и по величине ИК50 почти на два порядка превосходило мексидол по активности. Соединение I почти в 15 раз превосходило мексидол по способности инактивировать активные формы кислорода в реакции Fe2+-индуцированной хемилюминесценции в присутствии люминола (Таблица 6). У соединения I отмечалась выраженная ингибирующая активность в отношении супероксидного радикала как в реакции с кверцетином (Таблица 7), так и при исследовании хемилюминесценции в системе ксантин-ксантиноксидаза в присутствии люцигенина (Таблица 8). Мексидол по способности к перехвату супероксида уступал соединению I более чем на порядок. Исследуемое соединение I дозозависимо угнетало образование пероксильных радикалов (Таблица 9), регистрируемых с помощью хемилюминесценции, сопровождающей термическое разложение АБАП, почти в десять раз превосходя мексидол по величине ИК50.
Таким образом, соединение I превосходило мексидол более чем в десять раз по способности перехватывать липопероксильный, супероксидный и другие активные формы кислорода и АБАП-радикалы.
Исследование гемореологических свойств соединения I in vitro и in vivo
Материалы и методы
Антиагрегантную активность веществ исследовали на двухканальном лазерном анализаторе агрегации тромбоцитов/счетчике (модель 220 LA) (НПФ "Биола", Москва) по методу (G.V.R.Born. Aggregation of blood platelets by adenosine diphosphate and its reversal. // Nature. - 1962. - Vol.194. - P.927-929) в модификации (З.А.Габбасов, Е.Г.Попов, И.Ю.Гаврилов и др. Новый высокочувствительный метод анализа агрегации тромбоцитов. // Лабораторное дело. - 1989. - №10. - С.15-18). Исследования "in vitro" проводили на богатой тромбоцитами плазме (В.А.Люсов, Ю.Б.Белоусов. Метод графической регистрации агрегации тромбоцитов и изменения ее при ишемической болезни сердца. // Кардиология. - 1971. - №8. - С.459-461). Количество тромбоцитов регистрировали с помощью счетчика тромбоцитов. В качестве индуктора использовали 5 мкМ динатриевую соль АДФ (Reanal, Венгрия). Антиагрегантную активность соединений изучали в диапазоне концентраций от 1×10-4 до 1×10-6 М. Уровень агрегации оценивали по величине максимальной амплитуды агрегатограммы. Расчет антиагрегационого действия изучаемых веществ проводили по формуле (А-В)×100/А, где А -уровень агрегации тромбоцитов нативной плазмы, В - уровень агрегации тромбоцитов плазмы после инкубации с исследуемым веществом. Препаратом сравнения служили мексидол и ацетилсалициловая кислота.
Исследование влияния соединения I и препарата сравнения мексидола на агрегацию тромбоцитов "in vivo" проводили в опытах на 30 интактных нелинейных крысах массой 220-260 г.
Соединение I вводили в дозах 30 мг/кг внутрижелудочно в течение 3-х дней, мексидол вводили в эквимолярной дозе. Контрольные животные получали растворитель (дистиллированная вода). Забор крови из брюшной аорты осуществляли под нембуталовым (40 мг/кг) наркозом через 2 часа после введения соединений. Агрегацию тромбоцитов изучали по описанной выше методике с расчетом степени максимальной агрегации и степени дезагрегации (как разность между максимальной агрегацией тромбоцитов и агрегацией на 5-й мин), и скорость агрегации тромбоцитов (по величине максимального наклона кривой), выраженные в процентах к контролю, при этом степень агрегации тромбоцитов в контроле принимали за 100%. Подсчет количества тромбоцитов проводили на счетчике модели 220LA (НПФ "Биола", Москва) (З.А.Габбасов и др., 1989).
Измерение вязкости крови проводили на реологическом анализаторе крови АКР-2 (Россия) (Н.А.Добровольский, Ю.М.Лопухин, А.С.Парфенов и др. Анализатор вязкости крови. // Реологические исследования в медицине: Сб. науч. тр. / М.: НЦХ РАМН, 1998. - С.45-51) при нескольких скоростях сдвига (от 200 до 5 с-1), моделирующих различную интенсивность кровотока в сосудах. При этом вязкость в области малых скоростей сдвига служит характеристикой агрегации эритроцитов, а в области более высоких скоростей сдвига - показателем их деформируемости. Все исследуемые образцы приводились к единому гематокриту 45 у.е., измеряемому на микрогемоцентрифуге МГЦ-8 (8000 об/мин, 2 мин). Исследования изучаемых соединений in vitro проводили в концентрациях от 1×10-4 до 1×10-6 М. Соединение I и препарат сравнения пентоксифиллин растворяли в физиологическом растворе, непосредственно перед исследованием, и 20 мкл раствора добавляли к исследуемой пробе перед термостатированием. В контрольные образцы вносили эквивалентное количество физиологического раствора (37°С). Кровь забирали из локтевой вены здоровых доноров и стабилизировали 3,8% раствором цитрата натрия в соотношении 1:9.
Изучение влияния соединения I на реологические свойства крови при реперфузионном поражении головного мозга проводили на 40 нелинейных крысах-самцах массой 240-280 г, наркотизированных хлоралгидратом в дозе 400 мг/кг. Измерение вязкости крови проводили как описано выше. Глобальную ишемию головного мозга воспроизводили билатеральной окклюзией общих сонной артерий в сочетании с контролируемой гипотензией (Методические указания по экспериментальному изучению перпаратов для лечения нарушений мозгового кровообращения и мигрени: Метод, рекомендации. / Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ; Сост.: Р.С.Мирзоян, А.С.Саратиков, М.Б.Плотников и др. - М., 2000. - 398 с.). Предварительно артериальное давление снижалось под влиянием забора крови из яремных вен до 50 мм рт.ст. (полученные образцы использовались для оценки исходных реологических показателей). Соединение I в дозе 10 мг/кг и пентоксифиллин в дозе 8 мг/кг вводили перорально за 30 мин до ишемии. Контрольным группам (ишемия - контроль и ложнооперированные животные) вводили физиологический раствор в аналогичном объеме. В качестве нормального контроля использовалась группа ложнооперированных животных. Через 1 час ишемии производили снятие лигатур с сонных артерий, что обеспечивало реперфузию головного мозга. Спустя час после реперфузии кровь забирали из нижней полой вены. Кровь стабилизировали 3,8% раствором цитрата натрия в соотношении 1:9.
Для изучения влияния веществ на оксидативный гемолиз эритроцитов забор крови производили из ушной вены кролика в пробирки с 3,8% раствором натрия цитрата в соотношении 1:9. Эритроциты трехкратно отмывали трис-NaCl-буфером pH 7,4, Суспензия эритроцитов в буфере приводилась к единому гематокриту 45 у.е. Соединение I и препарат сравнения мексидол вводили в эритроцитарную суспензию непосредственно перед термостатированием в дозах 10-4, 10-5 и 10-6 М. За основу был выбран метод (M.Tsuchiya, A.Asada, E.Kasahara et al. Antioxidant protection of propofol and its recycling in erythrocyte membranes. // Am. J. Resp. Crit. Care Med. - 2002. - Vol.165. - P.54-60) в нашей модификации. Гемолиз эритроцитов индуцировали 50 мМ водорастворимым 2,2'-азобис(2-метилпропионамидин)дигидрохлоридом (АБАП) (Fluka, Швейцария), который при t 37°C разлагается, образуя пероксильные радикалы. После инкубирования с разными интервалами времени образы центрифугировали при 1000 об/мин на центрифуге ОПН-3 (Россия) 10 мин и в супернатанте измеряли поглощение при 540 нм на СФ-46 (Ломо, Россия). Уровень гемолиза оценивали в процентах по отношению к абсолютному гемолизу эритроцитов в дистиллированной воде.
Статистическую обработку результатов экспериментов производили в пакете прикладных программ «Statistika 6.0» с использованием парного критерия Стьюдента при предварительной проверке выборки на нормальность распределения или критерия Манна-Уитни.
Результаты.
При изучении влияния соединения I и препаратов сравнения мексидола и ацетилсалициловой кислоты на агрегацию тромбоцитов in vitro, индуцированную 5 мкМ АДФ, было установлено (Таблица 10), что соединение I, ЭК50 которого составила 3,30×10-4 М, превосходило препараты сравнения по активности.
Было установлено, что соединение I обладает способностью дозозависимо ингибировать АДФ-индуцированную агрегацию тромбоцитов и в условиях целого организма (Таблица 11). Оно уменьшало как степень максимальной агрегации тромбоцитов, так и скорость образования агрегатов, а также проявляло дезагрегирующие свойства, практически не меняя количество тромбоцитов, что свидетельствует о том, что изменение способности тромбоцитов к агрегации связано не с изменением их числа, а с возникшей под действием соединения I гипореактивностью кровяных пластинок. Мексидол уступал соединению I как по влиянию на степень максимальной агрегации тромбоцитов и скорость образования агрегатов, так и по влиянию на дезагрегацию.
Соединение I дозозависимо снижало вязкость крови доноров при всех скоростях сдвига (Таблица 12). Так при скорости сдвига 200 сПз соединение I снижало вязкость крови на 4,24%, а пентоксифиллин - на 3,15%, что свидетельствует о влиянии соединений на пластичность мембраны эритроцитов. При снижении концентрации веществ в пробе при указанной скорости сдвига эффективность соединения I снижается и составляет 1,32%, а пентоксифиллин практически не оказывает влияния на вязкость крови. Со снижением скорости сдвига влияние соединения I на данный параметр увеличивается, являясь достоверным в концентрациях вещества 1×10-4 и
1×10-5 М. Препарат сравнения, в указанных концентрациях, оказывается практически не эффективным.
Таким образом, наибольший эффект соединения I на вязкость крови доноров проявляется при низких скоростях сдвига, что подтверждается статистически достоверными изменениями индекса агрегации.
Соединение I также достоверно снижало вязкость крови у крыс с экспериментальной ишемией головного мозга особенно при низких скоростях сдвига (Таблица 13) (на 30% по сравнению с ишемизированной группой животных), и его эффект был сравним с пентоксифиллином.
При инкубировании в течение 2 ч в присутствии гидрофильного радикального инициатора АБАП можно было наблюдать существенный гемолиз эритроцитов по сравнению с контролем, который составил 81% (Таблица 14) (p<0,05) по сравнению с 29% в контроле с буфером. Соединение I в максимальной дозе 100 мкМ в суспензию эритроцитов приводило к дозозависимому достоверному снижению гемолиза до 39,3%. Мексидол оказался менее эффективен, чем соединение I в соответствующих концентрациях.
Р=0,1188)
Создание фармацевтической композиции для получения таблеток
Разработана фармацевтическая композиция, содержащая в качестве действующего вещества - дигидробромид 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола и в качестве вспомогательных веществ коллидон, лактозу, поливинилпирролидон, тальк, кальция стеарат и натрия метабисульфит. Исследованы композиции при следующем соотношении ингредиентов, вес (г):
Для получения фармацевтической композиции используют метод прямого прессования смеси лекарственного вещества и вспомогательных веществ. Для этого отвешивают все ингредиенты из расчета на 100 кг таблеточной массы и просеивают через сито с диаметром отверстий 0,25 мм, после чего смешивают в смесителе в следующей последовательности: лактоза, натрия метабисульфит, соединение I, поливинилпирролидон низкомолекулярный медицинский, коллидон, тальк и кальция стеарат. Полученную смесь проверяют на однородность смешения: действующего вещества в таблеточной массе должно быть не менее 58,5% и не более 59,0%. При получении положительного результата таблеточную массу прессуют на таблеточном прессе типа РТМ-24М при давлении прессования 120 МПа.
С целью стандартизации таблеток согласно ОСТ 91500.05.001-00 выбраны следующие критерии: описание, подлинность, средняя масса и однородность по массе, тальк, распадаемость, посторонние примеси, микробиологическая чистота и количественное определение соединения I (Таблица 15).
Был разработан состав защитного пленочного покрытия, обеспечивающего стабильность при хранении и растворимость в желудке. Из пленкообразователей, обеспечивающих желудочно-растворимые покрытия, нами апробированы следующие: коллидон-30, плаздон S-630, метилцеллюлоза МЦ-16, а также их комбинации. В качестве фотозащитных добавок использованы: тартразин, метиловый оранжевый, двуокись титана и их комбинации. Нанесение покрытия проводили в дражировочном котле путем распыления растворов пленкообразователей с последующей сушкой при t не больше 60°С до увеличения средней массы таблеток в сухом виде на 5%. Состав покрытий приведен ниже (Таблица 16).
Качество нанесенных покрытий оценивали по следующим показателям:
1. Внешний вид (равномерность покрытия, качество).
2. Распадаемость (мин, вода 37°С).
3. Фотозащитные свойства (отсутствие изменения цвета после снятия покрытия у таблеток, хранившихся при облучении лампой дневного света 10 Вт в течение 10 суток).
4. Отклонение от средней массы (не более 5%).
Таблица 17 содержит результаты оценки качества покрытий.
Как следует из таблицы, оптимальными качествами обладает состав №4. Он экономически выгоден, прост в исполнении.
Предлагаемое соотношение действующих, вспомогательных веществ и покрытия является оптимальным, обеспечивает получение качественных таблетированных лекарственных препаратов соединения I и достижение необходимого терапевтического эффекта.
Создание фармацевтической композиции для получения лиофилизированного порошка для инъекций
Разработана фармацевтическая композиция, содержащая в качестве действующего вещества дигидробромида 2-(3,4-диоксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола и в качестве вспомогательных веществ поливинилпирролидон и лимонную кислоту. Исследованы композиции при следующем соотношении ингредиентов, вес (г):
Изучение биодоступности фармацевтической композиции
Исследование биодоступности фармацевтической композиции соединения I проводили для таблеток с фотозащитным пленочным покрытием в соответствии с «Методическими рекомендациями по доклиническому изучению фармакокинетики лекарственных средств» (А.А.Фирсов, В.П.Жердев и др. Методические указания по проведению доклинических исследований фармакокинетики фармакологических веществ и лекарственных средств. // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ: под общ. ред. Р.У.Хабриева. - 2-изд., перераб. и доп.- М.: ОАО «Издательство «Медицина»», 2005. - С.217-229).
Эксперименты по изучению фармакокинетики субстанции соединения I и ее фармацевтической композиции проводилось на 10 кроликах-самцах породы шиншилла массой 2,7-3,7 кг, содержавшихся в условиях вивария на стандартной диете. Накануне эксперимента кролики голодали в течение 12 часов без ограничения доступа к воде. Таблетки и субстанцию вводили животным внутрижелудочно через резиновый зонд. Субстанцию вводили в аналогичной дозе, содержащейся в таблетированных лекарственных формах. Кровь забирали из ушной вены самотеком перед введением препарата и затем через определенные временные интервалы после введения. Между экспериментами делали двухнедельный перерыв. В качестве стандарта использовали субстанцию в дозе 54 мг/кг. Забор проб крови производили через 0,5; 1; 1,5; 3; 6; 9 и 12 часов после введения.
Содержание соединения I определяли методом ВЭЖХ на жидкостном хроматографе «Gilson» серии 6000 (Франция) с флуоресцентным детектором на колонке С18 4,6×250 мм, 5 µм. Подвижная фаза составляет смесь ацетонитрила (60%) и ацетатного буфера с pH 5,0 (40%). Длина волны возбуждения 270 нм, длина волны эмиссии 330 и 410 нм. Чувствительность метода составляет для эноксифола 1 µг/мл и для продуктов его окисления 100 nг/мл. Идентификацию исследуемых веществ и расчет их концентрации проводили по методу абсолютных стандартов. Время удерживания для соединения I составило 4,4-4,8 мин, для продукта окисления - 5,8-6,0 мин.
Фармакокинетические параметры рассчитывали методом статистических моментов (В.К.Пиотровский. Метод статистических моментов и интегральное модельнонезависимые параметры фармакокинетики. // Фармакология и токсикология. - 1986. - №5. - т.49. - c.118-127).
Содержание соединения I в крови кроликов при введении субстанции и таблетки с фотозащитным покрытием в дозе 50 мг приведены на чертеже, где по оси абсцисс приведено время (час), по оси ординат - концентрация мкг/мл. Как видно из чертежа, при введении таблетки с фотозащитным покрытием фармакокинетическая кривая практически не отличается от таковой при введении субстанции.
Фармакокинетические параметры субстанции и таблетированной лекарственной формы эноксифола представлены в Таблица 18.
Относительная биодоступность (f отн.) таблетки с фотозащитным покрытием составляет 95%.
Таким образом, при проведении биофармацевтического анализа установлено, что таблетированная лекарственная форма является биоэквивалентной по отношению к субстанции и не препятствует высвобождению и всасыванию лекарственных веществ в желудочно-кишечном тракте. Таблетки соединения I с фотозащитным пленочным покрытием обладают высокой биологической доступностью (выше 90%). Фармакокинетические параметры при введении лекарственной формы практически не отличаются от таковых при введении субстанции.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИТРОМБОГЕННОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2440814C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАРИТМИЧЕСКИМИ И ГЕПАТОПРОТЕКТОРНЫМИ СВОЙСТВАМИ | 2011 |
|
RU2469720C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОГИПОКСИЧЕСКОЙ, АКТОПРОТЕКТОРНОЙ, НООТРОПНОЙ АКТИВНОСТЯМИ И ВЛИЯЮЩЕЕ НА ФИЗИЧЕСКУЮ РАБОТОСПОСОБНОСТЬ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2462245C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИРАДИКАЛЬНЫМИ, ЦЕРЕБРОПРОТЕКТОРНЫМИ И ПРОТИВОИШЕМИЧЕСКИМИ СВОЙСТВАМИ | 2010 |
|
RU2445090C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ КАРДИОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ, И ГАЛОГЕНИДЫ 1,3-ДИЗАМЕЩЕННЫХ 2-АМИНОБЕНЗИМИДАЗОЛИЯ | 2013 |
|
RU2526902C1 |
| КОРРЕКТОР ГЕМОРЕОЛОГИЧЕСКИХ НАРУШЕНИЙ ПРИ ЗАБОЛЕВАНИЯХ, ОСЛОЖНЕННЫХ СИНДРОМОМ ПОВЫШЕННОЙ ВЯЗКОСТИ КРОВИ | 2009 |
|
RU2406500C1 |
| СОЛИ 9-ЗАМЕЩЕННЫХ 2-ГАЛОГЕНФЕНИЛИМИДАЗО [1,2-a]БЕНЗИМИДАЗОЛОВ И ГАЛОГЕНИДЫ 1-ЗАМЕЩЕННЫХ 3-ГАЛОГЕНФЕНАЦИЛ-2-АМИНОБЕНЗИМИДАЗОЛИЯ, ОБЛАДАЮЩИЕ ГЕМОРЕОЛОГИЧЕСКИМИ СВОЙСТВАМИ | 2005 |
|
RU2290404C1 |
| СРЕДСТВО, ПРОЯВЛЯЮЩЕЕ АНТИАГРЕГАНТНУЮ И АНТИТРОМБОГЕННУЮ АКТИВНОСТИ | 2010 |
|
RU2453312C1 |
| ДИГИДРОХЛОРИД 1-(3-МОРФОЛИНОПРОПИЛ)-2-ФЕНИЛИМИДАЗО[1,2-a]-БЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТАГОНИСТА ПУРИНОВЫХ P2Y-РЕЦЕПТОРОВ, АНТИАГРЕГАНТНУЮ И АНТИТРОМБОТИЧЕСКУЮ АКТИВНОСТЬ | 2008 |
|
RU2391345C2 |
| АНТИТРОМБОТИЧЕСКОЕ СРЕДСТВО, ВЛИЯЮЩЕЕ НА РЕГУЛЯЦИЮ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ТРОМБОЦИТОВ | 2008 |
|
RU2377990C1 |

Изобретение относится к области медицины, в частности к фармации, и касается применения дигидробромид 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола при производстве лекарственного средства, обладающего противоишемическими, гемореологическими и антирадикальными свойствами, а также фармацевтической композиции, содержащей указанный активный компонент и обладающей указанными выше свойствами. Средство обладает высокой и не обладает выраженными побочными эффектами. 2 н. и 8 з.п. ф-лы, 18 табл., 1 ил.
1. Применение дигидробромида 2-(3,4-дигидроксифенил)-9-диэтиламино-этилимидазо[1,2-а]бензимидазола формулы
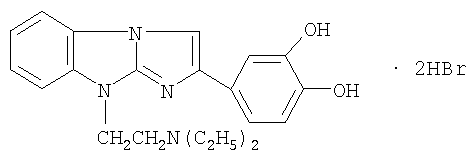
при производстве лекарственного средства, обладающего противоишемическими, гемореологическими и антирадикальными свойствами.
2. Фармацевтическая композиция, обладающая противоишемическими, гемореологическими и антирадикальными свойствами, содержащая дигидробромид 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола в эффективном количестве и фармацевтически приемлемый носитель.
3. Фармацевтическая композиция по п.2, отличающаяся тем, что носитель представляет собой вещество, выбранное из группы коллидон, лактоза, поливинилпирролидон, тальк, кальция стеарат, натрия метабисульфит и их комбинации.
4. Фармацевтическая композиция по любому из пп.2 или 3, отличающаяся тем, что содержит дигидробромид 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола в количестве 0,05-1,0 г на единичную дозу.
5. Фармацевтическая композиция по п.3, отличающаяся тем, что содержит следующее количественное соотношение компонентов, г:
6. Фармацевтическая композиция по п.2, отличающаяся тем, что она выполнена в виде лиофилизированного порошка для инъекций.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что в качестве носителя она содержит поливинилпирролидон и лимонную кислоту.
8. Фармацевтическая композиция по любому из пп.6 или 7, отличающаяся тем, что содержит дигидробромид 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола в количестве 0,01-2,0 г на единичную дозу.
9. Фармацевтическая композиция по п.7, отличающаяся тем, что содержит следующее количественное соотношение компонентов, г:
10. Фармацевтическая композиция по п.5, отличающаяся тем, что она выполнена в виде твердой лекарственной формы и покрыта защитным пленочным покрытием, содержащим следующее количественное соотношение компонентов, г:
| ПРОИЗВОДНЫЕ АМИДИНОВ, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2238939C2 |
| МУРАВЬЕВ И.А | |||
| Технология лекарств | |||
| - М.: Медицина, 1980, с.343-435 | |||
| ГИДРОБРОМИД 2-АМИНО-4-АЦЕТИЛ-8 -ГИДРОКСИ-3,8 -ДИГИДРОТИАЗОЛО[5,4-B]ИНДОЛА, ЗАЩИЩАЮЩИЙ ОТ ГИПОКСИИ | 2003 |
|
RU2281096C2 |
| ПРИМЕНЕНИЕ 7-БРОМИМИДАЗО[4,5-B]ИНДОЛ-2-ТИОНА ДЛЯ ЗАЩИТЫ ОРГАНИЗМА ОТ ВОЗДЕЙСТВИЯ ГИПОБАРИЧЕСКОЙ, ГЕМИЧЕСКОЙ И ГИПЕРКАПНИЧЕСКОЙ ГИПОКСИИ | 2005 |
|
RU2340341C2 |
Авторы
Даты
2010-06-20—Публикация
2008-05-12—Подача