Изобретение относится к области синтеза лекарственных соединений, а именно к способу получения неостигмина метилсульфата (йодида) следующей структурной формулы:
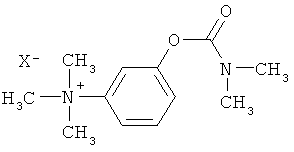
где Х-=I- - неостигмина йодид; 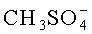 - неостигмина метилсульфат.
- неостигмина метилсульфат.
Соединения с приведенной выше формулой используются в терапевтической практике в качестве лекарственных средств для лечения миастении, при параличах, атрофии зрительного нерва, невритах и других заболеваниях.
Известен следующий способ синтеза неостигмина метилсульфата (йодида) [1]. В результате реакции ацилирования исходного диметиламинофенола фосгеном образуется соответствующий карбонилхлорид, который, в свою очередь, в результате взаимодействия с диметиламином преобразуется до
3-диметиламинофенилдиметилуретана. Целевой неостигмин метилсульфат (йодид) получают взаимодействием 3-диметиламинофенилдиметилуретана с диметилсульфатом или йодистым метилом соответственно. Общая схема процесса представлена на схеме 1:
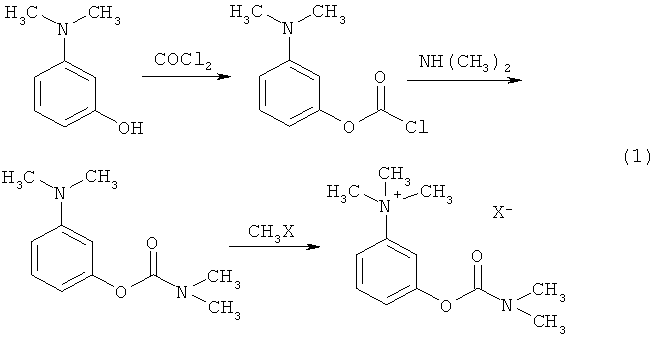
где Х-=I- - неостигмина йодид; 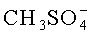 - неостигмина метилсульфат.
- неостигмина метилсульфат.
Недостатком данного способа является использование в качестве реагента фосгена - опасного, высокотоксичного вещества.
Также известен двухстадийный способ получения замещенных аналогов неостигмина [2]. На первой стадии путем взаимодействия 3-диметиламинофенола, гидрооксида калия и хлорангидрида метилфенилкарбомаиловой кислоты в среде спирта получают соответствующий эфир метилфенилкарбомаиловой кислоты (схема 2). На второй стадии получают непосредственно целевой неостигмин метилсульфат (йодид) в среде ацетона на холоду по схеме 3.
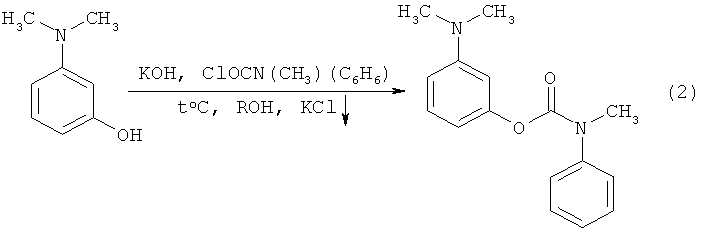
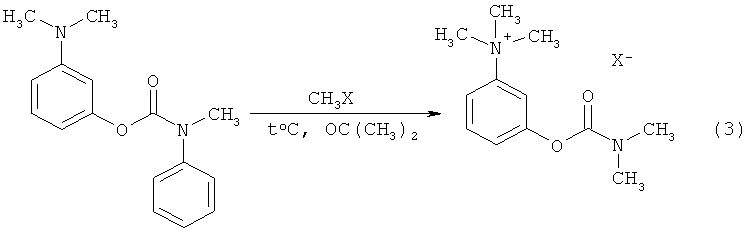
где Х-=I- - неостигмина йодид, 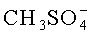 - неостигмина метилсульфат.
- неостигмина метилсульфат.
К недостаткам описанного способа можно отнести наличие трудоемких операций по горячему фильтрованию, дистилляции при пониженном давлении и перекристаллизации прекурсоров и целевого соединения. Кроме того, данный метод характеризуется низкой конверсией 3-диметиламинофенола и, как следствие, низким (до 47%) выходом конечного продукта.
Другой известный метод получения неостигмина метилсульфата (йодида) заключается во взаимодействии 3-диметиламинофенола с хлорангидридом диметилкарбомаиловой кислоты без использования растворителя при перемешивании и температуре реакционной смеси 120°С, с последующей перегонкой полученного 3-((диметилкарбомоилокси)фенил)-диметиламина при пониженном давлении. Далее, алкилированием 3-((диметилкарбомоилокси)фенил)-диметиламина получают соответствующие неостигмин метилсульфат (йодид) (схема 4) [3].
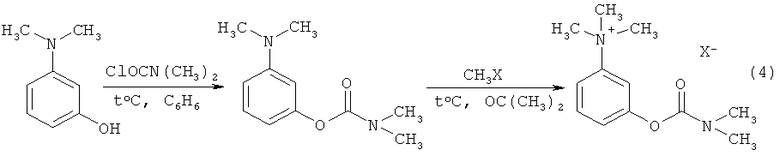
где Х-=I- - неостигмина йодид; 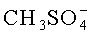 - неостигмина метилсульфат.
- неостигмина метилсульфат.
Недостатками приведенного способа являются: трудоемкая операция по дистилляции при пониженном давлении и низкая конверсия 3-диметиламинофенола, что приводит к низкому (до 55%) выходу конечного продукта.
Наиболее близким к настоящему изобретению является способ получения неостигмина метилсульфата (йодида), который заключается во взаимодействии исходного 3-диметиламинофенола с эквимольным количеством гидроксида калия и ацилировании полученного диметиламинофенолята калия хлорангидридом диметилкарбомаиловой кислоты в среде бензола с последующим алкилированием с образованием целевого неостигмина метилсульфата (йодида) (схема 5) [2].
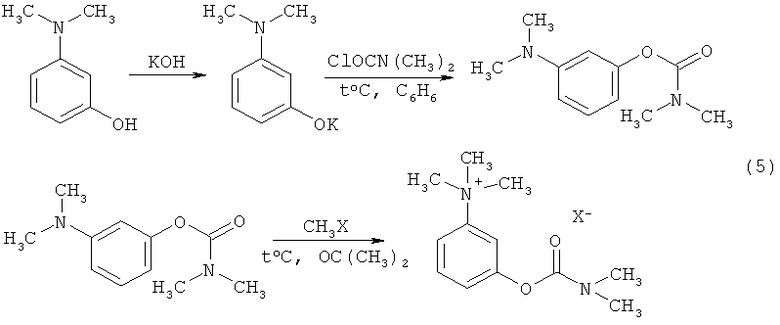
где X-=I- - неостигмина йодид, 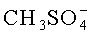 - неостигмина метилсульфат.
- неостигмина метилсульфат.
Недостатками данного способа являются: необходимость проведения дистилляции при пониженном давлении и перекристаллизации, а также низкая конверсия исходного 3-диметиламинофенола и низкий (до 40%) выход целевого неостигмина метилсульфата (йодида).
Задачей настоящего изобретения является разработка способа получения неостигмина метилсульфата (йодида) с увеличенным выходом и чистотой целевого продукта и уменьшенным количеством промежуточных стадий.
Технический результат, достигаемый в заявленном изобретении, заключается в увеличении конверсии промежуточных 3-диметиламинофенола и соответствующего фенолята до 100%, а также в исключении операций вакуумной перегонки и перекристаллизации 3-((диметилкарбомоил-окси)фенил)-диметиламина, что и приводит к увеличению выхода целевого неостигмина метилсульфата (йодида) до 88% и 84% соответственно.
Поставленная задача решается путем подбора оптимальных условий синтеза неостигмина метилсульфата (йодида).
Особенностью предлагаемого метода является использование 2,0-2,5-кратного мольного избытка металлического натрия и 1,5-кратного мольного избытка хлорангидрида диметилкарбомаиловой кислоты для достижения полной конверсии 3-диметиламинофенола и соответствующего фенолята, а также использование диэтилового эфира в качестве реакционной среды на стадии алкилирования для удаления из зоны реакции целевого продукта.
Пример 1. Синтез 3-((диметилкарбомоилокси)фенил)-диметиламина
В трехгорлую круглодонную колбу объемом 0,5 л, снабженную обратным холодильником и механической мешалкой, загружают 50 мл безводного толуола и 4,5 г (0,19 моль) металлического натрия, нагревают и после расплава натрия включают перемешивающее устройство. В колбу небольшими порциями загружают раствор 10,0 г (0,076 моль) 3-диметиламинофенола в 100 мл безводного толуола. Перемешивают 30 мин и охлаждают реакционную массу до комнатной температуры. Из капельной воронки загружают 12,2 г (0,114 моль) хлорангидрида диметилкарбомаиловой кислоты. Продолжают перемешивание до исчезновения осадка 3-диметиламинофенолята натрия. Окончание реакции контролируют методом тонкослойной хроматографии. После окончания реакции нагрев и перемешивание отводят, охлаждают реакционную массу и фильтруют от остатков металлического натрия. Фильтрат последовательно промывают 100 мл 2% (мас.) раствора гидроксида натрия и 100 мл воды, сушат над сульфатом натрия, затем концентрируют путем отгонки растворителя при пониженном давлении. Выход 3-((диметилкарбомоилокси)фенил)-диметиламина до 92%. Чистота и строение полученного соединения подтверждены методами ВЭЖХ, ЯМР- и масс-спектроскопии.
Пример 2. Синтез неостигмина метилсульфата
14,4 г (0,069 моль) 3-((диметилкарбомоилокси)фенил)-диметиламина растворяют в 70 мл безводного диэтилового эфира. К полученному раствору в инертной атмосфере приливают при перемешивании раствор 13,4 г (0,104 моль) диметилсульфата в 30 мл диэтилового эфира, выдерживают 24 часа. В инертной атмосфере отфильтровывают выпавший белый кристаллический осадок, промывают диэтиловым эфиром и просушивают при пониженном давлении и температуре 50°С. Выход целевого продукта 84% в пересчете на исходный 3-диметиламинофенол. Чистота и строение полученного соединения подтверждены методами ВЭЖХ, ЯМР- и масс-спектроскопии.
Пример 3. Синтез неостигмина йодида
3,0 г (0,014 моль) 3-((диметилкарбомоилокси)фенил)-диметиламина растворяют в 45 мл диэтилового эфира. К полученному эфирному раствору приливают при перемешивании 1,5-кратный мольный избыток йодистого метила (0,021 моль, 3 г), выдерживают 24 часа. В инертной атмосфере отфильтровывают выпавший белый кристаллический осадок, промывают диэтиловым эфиром и просушивают при пониженном давлении и температуре 50°С. Выход целевого продукта 88% в пересчете на исходный 3-диметиламинофенол. Чистота и строение полученного соединения подтверждены методами ВЭЖХ, ЯМР- и масс-спектроскопии.
Таким образом, использование 2,0-2,5-кратного мольного избытка металлического натрия и 1,5-кратного мольного избытка хлорангидрида диметилкарбомаиловой кислоты для достижения полной конверсии 3-диметиламинофенола и соответствующего фенолята, а также использование диэтилового эфира в качестве реакционной среды на стадии алкилирования для удаления из зоны реакции целевого продукта приводят к увеличению выхода и чистоты целевого продукта.
Литература
1. A.A.Al-Badr, M.Tariq Neostigmine. // Analytical profiles of drug substances. - 1987. - Volume 16. - P.421.
2. Пат. США №1905990 (04/1933). / John A.Aeschlimann, Basel (Schweiz). Disubstituted carbamic acid esters of phenols containing a basic constituent.
3. Пат. СН 208883 А (06/1940). / F.H.OFFMANN-LA ROCHE & Co. Aktiengesellschaft, Basel (Schweiz). Verfahren zur Darstellung des Dimethylcarbaminsaureesters des m-Dimethylaminophenols.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ N-МЕТИЛ-4-БЕНЗИЛКАРБАМИДОПИРИДИНИЯ ЙОДИДА | 2010 |
|
RU2429230C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОНТУРАЦЕТАМА ИЗ ФЕНИБУТА | 2024 |
|
RU2827339C1 |
| СПОСОБ ПОЛУЧЕНИЯ С-ФОСФОРИЛИРОВАННЫХ АЛКИЛАМИДИНОВ | 2007 |
|
RU2334752C1 |
| СПОСОБ АЦИЛИРОВАНИЯ АМИНОВ | 2010 |
|
RU2442770C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛИРОВАННОГО ИНДОЛА И (2-НИТРОФЕНИЛ)-АЦЕТАЛЬДЕГИД | 1991 |
|
RU2054417C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛ 1,2,4-ОКСАДИАЗОЛ-5-КАРБОКСИЛАТОВ | 2012 |
|
RU2512293C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АЛКОКСИПЕНТАНОНОВ-2 | 1999 |
|
RU2171797C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ 3,4-ДИАЛКОКСИ-2,5-ТИОФЕНДИКАРБОНОВОЙ КИСЛОТЫ | 2021 |
|
RU2778232C1 |
| Способ получения катионных красителей аминотриазолового ряда | 1981 |
|
SU981330A1 |
| ИМИДАЗОЛИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА ИЛИ ИХ СОЛИ | 1993 |
|
RU2110514C1 |
Изобретение относится к области химии и фармацевтики, а именно к улучшенному способу получения йодида или метилсульфата неостигмина, которые находят применение в качестве лекарственных средств. Способ включает получение 3-диметиламинофенолята натрия, его последующее взаимодействие с хлорангидридом диметилкарбомаиловой кислоты и взаимодействие полученного 3-((диметилкарбомаилокси)фенил)-диметиламина с соответствующим алкилирующим агентом (йодметан или диметилсульфат). Способ характеризуется тем, что целевые соединения получают взаимодействием 3-диметиламинофенола с 2,0-2,5-кратным мольным избытком металлического натрия в среде толуола при кипении, добавлением 1,5-кратного мольного избытка хлорангидрида диметилкарбомаиловой кислоты, промыванием толуольного фильтрата раствором натриевой щелочи и водой, упариванием растворителя и выдерживанием 3-((диметилкарбомаилокси)фенил)-диметиламина с соответствующим алкилирующим агентом в течение 24 часов в среде абсолютного диэтилового эфира. Способ позволяет увеличить конверсию 3-диметиламинофенола, а также повысить выход и чистоту целевого продукта. 3 пр.
Способ получения йодида или метилсульфата неостигмина, включающий получение 3-диметиламинофенолята натрия, последующее его взаимодействие с хлорангидридом диметилкарбомаиловой кислоты и взаимодействие полученного 3-((диметилкарбомаилокси)фенил)-диметиламина с соответствующим алкилирующим агентом (йодметан, диметилсульфат), отличающийся тем, что целевое соединение получают взаимодействием 3-диметиламинофенола с 2,0-2,5-кратным мольным избытком металлического натрия в среде толуола при кипении, добавлением 1,5-кратного мольного избытка хлорангидрида диметилкарбомаиловой кислоты, промыванием толуольного фильтрата раствором натриевой щелочи и водой, упариванием растворителя и выдерживанием 3-((диметилкарбомаилокси)фенил)-диметиламина с соответствующим алкилирующим агентом в течение 24 ч в среде абсолютного диэтилового эфира.
| US 1905990, 25.04.1933 | |||
| 0 |
|
SU208883A1 | |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| ВСЕСОЮЗНАЯ \ПРИВОД высоковольтного | 0 |
|
SU342237A1 |
| СПОСОБ ПОЛУЧЕНИЯ N-МЕТИЛKAPBAAIATA | 0 |
|
SU309512A1 |
Авторы
Даты
2012-08-10—Публикация
2010-07-23—Подача