Изобретение относится к области медицинской биотехнологии и предназначено для получения инактивированных (ИГВ) и живых (ЖГВ) гриппозных вакцин, моновалентной или в составе 3-компонентной в целях иммунизации населения против потенциально пандемического вируса гриппа А подтипа Н7. Полученный вакцинный штамм относится к семейству Orthomyxoviridae, род Influenzavirus А.
Вирусы гриппа, циркулирующие среди животных, создают угрозу здоровью человека из-за способности непосредственного инфицирования его и еще большую - при реассортации с вирусами человека. Одним из наиболее опасных в настоящее время является вирус птичьего гриппа A/H7N9, способный при тесном контакте передаваться человеку и, подобно A/H5N1, вызывать тяжелую форму заболевания: 36% из зарегистрированных случаев заболевания людей гриппом A/H7N9 имели летальный исход [Lei Zhou et al., 2017].
Однако в отличие от A/H5N1 вирусы A/H7N9 не вызывают болезнь или смерть у птиц и такая бессимптомная инфекция снижает настороженность у человека. Наблюдения свидетельствуют о том, что вирус A/H7N9 не передается от человека человеку, хотя обладает большей, чем A/H5N1, трансмиссивностью от животного к человеку, то есть представляет большую угрозу трансформации в пандемический штамм. Результаты нескольких исследований указывают на способность вирусов A/H7N9 активно размножаться в органах мышей, хорьков и приматов, а также в клетках, выстилающих эпителий дыхательных путей человека [Bao L. 2014; Jurre Y. 2014]. Периодически регистрируются вспышки гриппа птиц подтипа Н7, сопровождающиеся инфицированием людей. Это обусловливает актуальность получения вакцинных штаммов против вируса A/H7N9.
Необходимость разработки противопандемических мер, в том числе и для борьбы с вирусами птичьего гриппа, отражена в приказе Роспотребнадзора РФ [Приказ №40 от 28.12.2004]. В «Глобальном плане ВОЗ по подготовке к борьбе с гриппом» до начала пандемии национальным органам рекомендуется испытывать и лицензировать пандемические вакцины, а также поддерживать развитие производства и обмена прототипами сезонных и пандемических вакцин для возможного целевого их применения. В связи с этим актуальными являются исследования по подготовке вакцинных препаратов против вирусов гриппа подтипов A/H7N9, а также испытания этих вакцинных препаратов на животных моделях.
В настоящее время работы по созданию вакцин против пандемических вирусов гриппа ведутся во всем мире, ряд вакцин прошли или проходят испытания на приматах и людях. В США в Национальном институте аллергии и инфекционных заболеваний (NIAID) разработана ЖГВ на основе реассортантов птичьих вирусов субтипа A/H7(H7N3, H7N9, H7N7) и донора аттенуации A/Ann Arbor/6/60 са). В России в НИИ экспериментальной медицины подготовлена ЖГВ из вакцинных штаммов, содержащих поверхностные белки вирусов A/H7N9, A/H7N3 и A/H2N2 и внутренние белки вируса-донора А/Ленинград/134/17/57. Патенты на вакцинные штаммы Н7: патент на изобретение РФ №2507256 (опубл. 20.02.2014), патент РФ №2563351 (опубл. 20.09.2015).
Все представленные штаммы получены методом обратной генетики.
Задачей, на решение которой направлено заявляемое изобретение, являлось получение реассортанта на основе вируса гриппа A/H7N9 и собственного донора генов внутренних белков А/Гонконг/1/68/162/35 методом классической генетической реассортации для производства инактивированных и живых гриппозных вакцин.
Для получения реассортанта на основе вируса A/H7N9 в качестве донора генов внутренних белков мы использовали разработанный в ФГБУ «НИИ гриппа» Минздрава России универсальный донор А/Гонконг/1/68/162/35 (H3N2) [патент №2511431 от 25.07.2011], который ориентирован на получение реассортантных штаммов как для живой (ЖГВ), так и для инактивированной (ИГВ) гриппозных вакцин. Соответственно, полученный реассортант может использоваться для производства обоих типов вакцин.
Получение штамма вируса гриппа RA-35 (А/Shanghai/HК/6:2(H7N9)
Штамм вируса гриппа RA-35 (A/Shanghai/ГК/6:2(H7N9) получен методом классической генетической реассортации на основе холодоадаптированного штамма А/Гонконг/1/68/162/35 (H3N2) и рекомбинантного вируса A/Shanghai/2/2013(H7N9)-PR8-IDCDC, полученного методом обратной генетики (Центр по контролю и профилактике инфекционных болезней (CDC), Атланта, США). При получении штамма было проведено 6 пассажей в 10-12-дневных развивающихся куриных эмбрионах.
Штамм представляет собой реассортант с формулой генома 6:2. Состав генома: 6 генов внутренних и неструктурных белков (РВ2, РВ1, PA, NP, М и NS) от вируса А/Гонконг/1/68/162/35 (H3N2) и 2 гена (НА и NA) от вируса дикого типа.
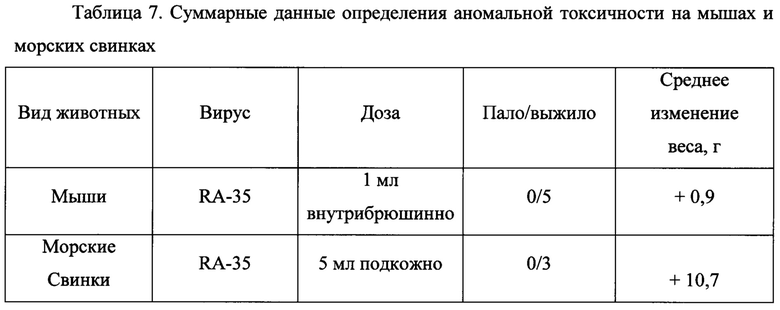
Анализ штамма для подтверждения состава генома был выполнен с использованием рестрикционного анализа ДНК-копий сегментов РНК, полученных с помощью обратно-транскриптазной полимеразно-цепной реакции (ОТ-ПЦР). Полученные с помощью ОТ-ПЦР ДНК-копии сегментов РВ2, РВ1, PA, NP, М и NS вирусов А/Гонконг/1/68/162/35 и A/Shanghai/2/2013(H7N9)-PR8-IDCDC (обозначены на фиг. 1 как НК и Shan) обрабатывали эндонуклеазами рестрикции EcoRI, HindIII, BamHI, PstI, Bsa29I и BslFI соответственно. Рестрикционный анализ ДНК-копий сегментов РНК на фиг. 1 показал, что реассортант RA-35 имеет состав генома 6:2.
Антигенное соответствие гемагглютинина реассортанта RA-35 родительскому штамму было подтверждено в реакции торможения гемагглютинации (РТГА).
При исследовании антигенной специфичности в РТГА было показано, что штамм RA-35 не реагировал с гетерологичными типоспецифическими сыворотками. Реассортант A/Shanghai/НК/6:2 (H7N9) реагировал со специфическими иммунными крысиными сыворотками типа A/H7N9 и A/H7N3 (табл. 2).
Показано, что вакцинный кандидат RA-35 антигенно идентичен родительскому штамму дикого типа.
Кроме того, было проведено полногеномное секвенирование полученного реассортанта. Результаты секвенирования подтвердили сохранность у реассортанта RA-35 всего комплекса мутаций генов, унаследованных от штамма-донора и кодирующих негликозилированные белки (табл. 3).
Выявленные нуклеотидные и аминокислотные замены в генах реассортанта RA-35, кодирующих поверхностные белки, представлены в таблицах 4, 5.

Примечание: Жирным шрифтом выделены мутации, приводящие к замене аминокислоты, * - замена встречается в других вариантах последовательностей дикого вируса, имеющихся в базе данных

Характеристика полученного штамма
Пример 1. Репродуктивные свойства штамма RA-35 (А/Shanghai/HK/6:2 (H7N9)
Штамм вируса гриппа RA-35 тестировали на инфекционную активность путем заражения развивающихся куриных эмбрионов 10-дневного возраста в соответствии с Методическими указаниями 3.3.2.1758-03 "Методы определения показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа". Готовили десятикратные падающие разведения вируссодержащей аллантоисной жидкости. Каждым разведением начиная с 10-4 до 10-10 заражали по 4 куриных эмбриона. Инкубировали 48 часов при температуре 32°C. Наличие вируса определяли в РГА, инфекционную активность вируса рассчитывали по методу Рида и Менча. Аналогичным образом определяли инфекционную активность в культуре клеток MDCK.
Штамм вируса гриппа A/Shanghai/ГК/6:2(H7N9) показал высокую репродуктивную активность в РКЭ. Гемагглютинирующая активность реассортанта RA-35 - 1:1024, инфекционная активность в РКЭ составила 9,25 lgЭИД50/0,2 мл. Репродуктивные свойства штамма вируса гриппа RA-35 в куриных эмбрионах и в культуре клеток MDCK представлены в таблице 6.
Пример 2. Заявляемый вакцинный штамм RA-35 безвреден для мышей и морских свинок.
Тестирование штамма вируса гриппа RA-35 на безвредность (аномальную токсичность) для лабораторных животных проводили на двух видах животных: линейных белых мышах Balb/c, самках, массой 18-20 г (5 шт.), и морских свинках обоего пола массой 250-350 г (3 шт.). В исследованиях использовали здоровых животных, на которых ранее не проводили какие-либо испытания. Испытания проводили в соответствии с методическими указаниями МУК 4.1/4.2.588-96.
В течение периода наблюдения (7 суток) после заражения все животные остались живы, и ни у одного из них не были выявлены видимые признаки заболевания. Масса каждого животного в день окончания наблюдения не уменьшилась по сравнению с исходной. Ни у одной морской свинки не развился некроз или абсцесс в месте введения.
Пример 3. Вакцинный штамм RA-35 иммуногеннен для мышей.
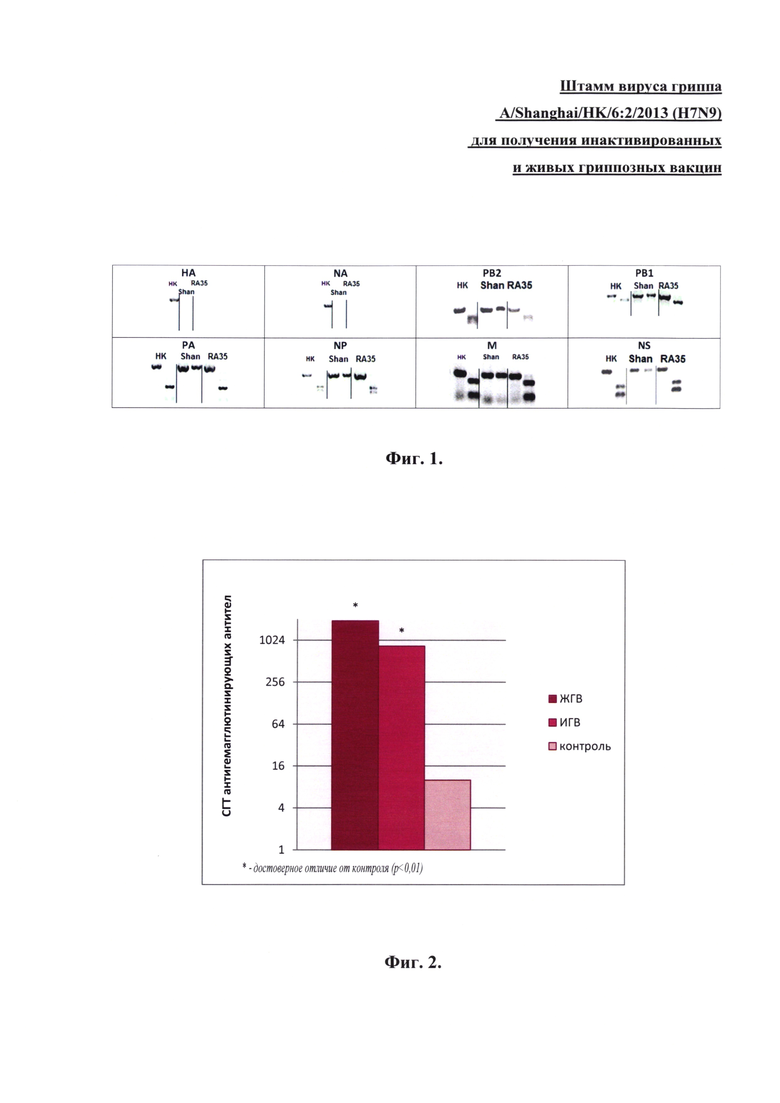
На основе реассортантных штаммов были подготовлены вакцинные препараты живой и инактивированной гриппозных вакцин (ЖГВ и ИГВ соответственно). Для получения ЖГВ накопленный вирусный материал реассортантных вирусов разводили фосфатно-солевым буфером (ФСБ) до концентрации 6,5 lgЭИД50/мл. Препараты ИГВ получали методом изопикнического центрифугирования в градиенте плотности сахарозы. Инактивацию проводили 0,02% формалином. Содержание НА в вакцинных препаратах оценивали методом электрофореза в полиакриламидном геле с последующей денситометрией. Препараты ИГВ содержали 15 мкг НА на дозу (0,5 мл). В качестве адъюванта использовали гидроксид алюминия - 500 мкг на дозу.
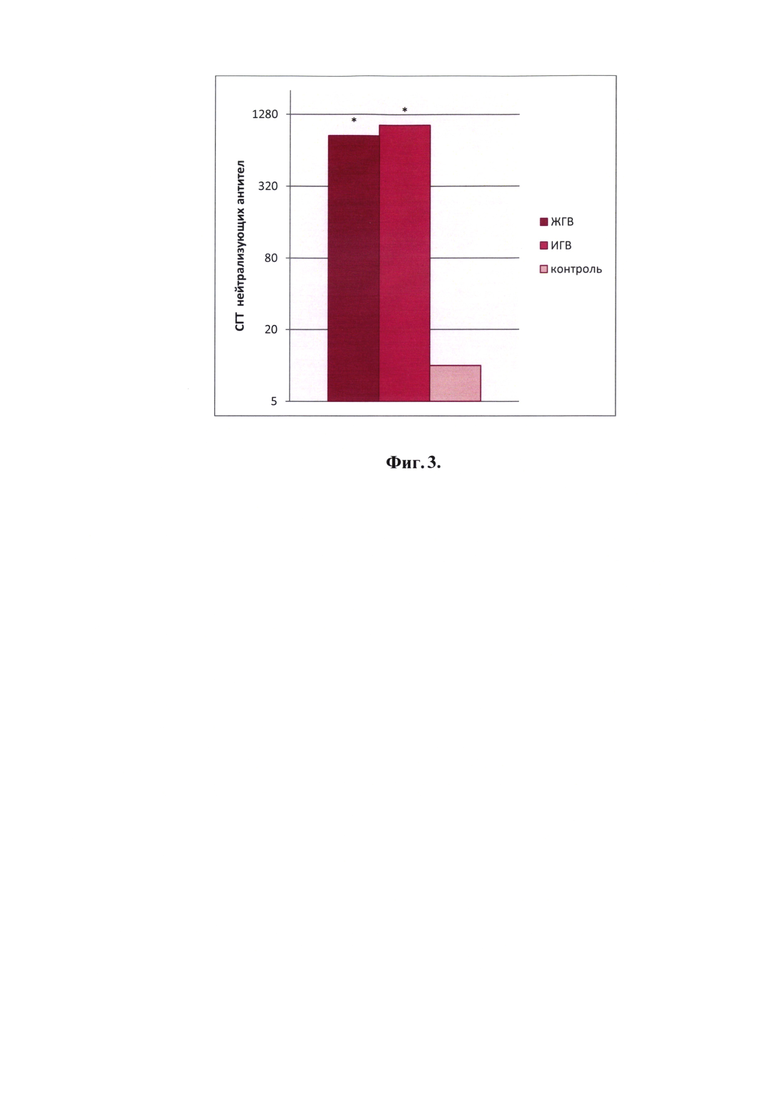
Препараты ЖГВ и ИГВ использовали для иммунизации мышей и исследования иммуногенности. Данные по содержанию антигемагглютинирующих и нейтрализующих антител к вирусам гриппа в сыворотках крови мышей, иммунизированных препаратами ЖГВ и ИГВ реассортантных штаммов (фиг. 2, 3), демонстрируют достоверное (р<0,05) повышение уровня антигемагглютинирующих и вируснейтрализующих антител по сравнению с контрольными животными.
Иммуногенность штамма вируса гриппа RA-35 A/Shanghai/ГК/6:2(H7N9)
После иммунизации мышей ЖГВ и ИГВ на основе реассортантного вируса RA-35 (A/Shanghai/ГК/6:2(H7N9) в сыворотках крови были выявлены антигемагглютинирующие (фиг. 2) и вируснейтрализующие (фиг. 3) антитела в титрах, достаточных для формирования защитного иммунитета.
Пример 4. Вакцинный штамм RA-35 обладает свойствами температурочувствительности и холодоадаптированности.
Донор А/Гонконг/1/68/162/35 является универсальным, то есть обладает как высокой репродуктивностью, так и маркерами аттенуации к человеку - ts-, са-фенотип. Донор ориентирован на получение реассортантных штаммов как для живой, так и для инактивированной гриппозных вакцин.
Реассортанты на основе донора А/Гонконг/1/68/162/35 также наследуют ts-, са-фенотип и приобретают более высокую инфекционную, гемаггютинирующую и репродуктивную активность.
Полученный реассортант RA-35 наследовал от штамма-донора А/Гонконг/1/68/162/35 ts-, са-фенотип - способность хорошо репродуцироваться при пониженной температуре и почти полную потерю способности к репродукции при повышенной температуре (табл. 8).
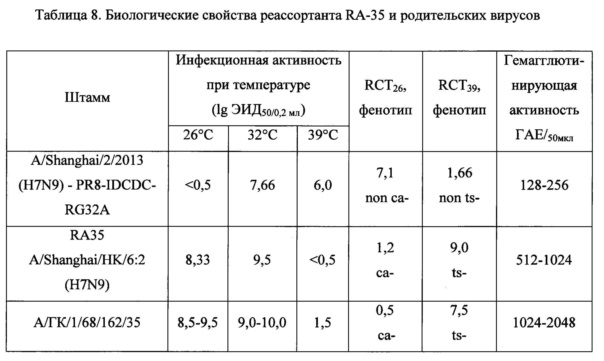
При 5-кратном пассировании при температуре 32°C в системе РКЭ степень температурочувствительности и холодоадаптированности, а также уровень репродукции не изменялись. Таким образом, реассортантный штамм удовлетворяет требованиям температурочувствительности и холодовой адаптации, предъявляемым к вакцинным штаммам для ЖГВ, и требованиям высокой репродуктивности для ИГВ.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм вируса гриппа A/HK/HK/6:2/2016 (H9N2) для получения инактивированных и живых гриппозных вакцин | 2018 |
|
RU2702833C1 |
| Штамм вируса гриппа A/UNL/HK/2:6/2017 (H5N8) для получения инактивированных и живых гриппозных вакцин | 2018 |
|
RU2702834C1 |
| Штамм вируса гриппа А/Япония/ГК/6:2/2014 (H2N2) для получения инактивированных и живых гриппозных вакцин | 2017 |
|
RU2644670C1 |
| ШТАММ ВИРУСА ГРИППА А/Гонконг/1/68/162/35 (H3N2)-УНИВЕРСАЛЬНЫЙ ДОНОР ВНУТРЕННИХ ГЕНОВ ДЛЯ РЕАССОРТАНТОВ И РЕАССОРТАНТНЫЕ ШТАММЫ А/СПБ/ГК/09 (H1N1) И А/НК/Astana/6:2/2010 (H5N1), ПОЛУЧЕННЫЕ НА ЕГО ОСНОВЕ | 2011 |
|
RU2511431C2 |
| ШТАММ ВИРУСА ГРИППА ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ И ИНАКТИВИРОВАННОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2011 |
|
RU2464309C1 |
| ВАКЦИННЫЙ ШТАММ ВИРУСА ГРИППА А(Н3N2)-А/8/Perth/16/2009 ДЛЯ ПРОИЗВОДСТВА ИНАКТИВИРОВАННОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2010 |
|
RU2458124C2 |
| ШТАММ ВИРУСА ГРИППА ГКВ 2389 ДЛЯ ПОЛУЧЕНИЯ ЖИВОЙ ИНТРАНАЗАЛЬНОЙ И ИНАКТИВИРОВАННОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2006 |
|
RU2318871C1 |
| ШТАММ ВИРУСА ГРИППА А/17/MALLARD/НИДЕРЛАНДЫ/00/95(H7N3) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ И ПРОИЗВОДСТВА ИНАКТИВИРОВАННОЙ ГРИППОЗНЫХ ВАКЦИН | 2012 |
|
RU2507256C2 |
| РЕАССОРТАНТНЫЙ ШТАММ ВИРУСА ГРИППА RN9/13-HUMAN A(H6N9) ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К НЕЙРАМИНИДАЗЕ ПРИ ГРИППОЗНОЙ ИНФЕКЦИИ И ВАКЦИНАЦИИ | 2014 |
|
RU2587629C1 |
| Реассортантный штамм вируса гриппа RN2/14-human A(H6N2) для определения антител к нейраминидазе при гриппозной инфекции и вакцинации | 2019 |
|
RU2716416C1 |
Изобретение относится к области медицинской биотехнологии и касается штамма вируса гриппа. Представлен штамм вируса гриппа А/Shanghai/НК/6:2/2013 (H7N9), депонированный в Государственную коллекцию вирусов ФГБУ «ФНИЦЭМ им. Н.Ф. Гамалеи» Минздрава России под №2833. Штамм получен методом классической генетической реассортации на основе холодоадаптированного штамма А/Гонконг/1/68/162/35(H3N2) и рекомбинантного вируса A/Shanghai/2/2013(H7N9)-PR8-IDCDC. От донора штамм унаследовал гены, кодирующие внутренние негликозилированные белки РВ1, РВ2, PA, NP, MP и NS. Гены, кодирующие поверхностные белки вируса - НА и NA, штамм унаследовал от вируса дикого типа (A/Shanghai/2/2013(H7N9)-PR8-IDCDC). Штамм генетически стабилен при 5-кратном пассировании в 10-дневных развивающихся куриных эмбрионах и пригоден для производства моновалентной вакцины и вакцины трехкомпонентной (в качестве одного из составляющих). Может применяться в целях иммунизации населения против вирусов гриппа А подтипов Н7. 3 ил., 8 табл., 4 пр.
Штамм вируса гриппа A/Shanghai/HK/6:2/2013 RA-35 (H7N9), депонированный в Государственную коллекцию вирусов ФГБУ «ФНИЦЭМ им. Н.Ф. Гамалеи» Минздрава России под №2833, для получения инактивированных и живых гриппозных вакцин против потенциально пандемического штамма вируса гриппа А (H7N9).
| ШТАММ ВИРУСА ГРИППА А/17/Ануи/2013/61 (H7N9) ДЛЯ ПРОИЗВОДСТВА ЖИВОЙ ИНТРАНАЗАЛЬНОЙ ГРИППОЗНОЙ ВАКЦИНЫ | 2013 |
|
RU2563351C2 |
| ШТАММ ВИРУСА ГРИППА А/Гонконг/1/68/162/35 (H3N2)-УНИВЕРСАЛЬНЫЙ ДОНОР ВНУТРЕННИХ ГЕНОВ ДЛЯ РЕАССОРТАНТОВ И РЕАССОРТАНТНЫЕ ШТАММЫ А/СПБ/ГК/09 (H1N1) И А/НК/Astana/6:2/2010 (H5N1), ПОЛУЧЕННЫЕ НА ЕГО ОСНОВЕ | 2011 |
|
RU2511431C2 |
| JORGEN DE JONGE et al., H7N9 Live Attenuated Influenza Vaccine Is Highly Immunogenic, Prevents Virus Replication, and Protects Against Severe Bronchopneumonia in Ferrets, Molecular Therapy May 2016, Vol.24, No.5, pp.991-1002. | |||
Авторы
Даты
2018-08-17—Публикация
2017-04-05—Подача