Уровень техники
Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности к способу получения L-аминокислоты с использованием бактерии семейства Enterobacteriacea, которая содержит белок, полученный из бактерии, принадлежащей роду Pantoea, и белку, способному придавать устойчивость к цистеину.
Предшествующий уровень техники
Традиционно L-аминокислоты в промышленном масштабе могут быть получены методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников, или их мутантов. Обычно микроорганизмы модифицированы для того, чтобы увеличить продукцию L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, например, путем трансформации микроорганизма рекомбинантной ДНК (см., например, патент США 4278765). Другие методы основаны на повышении активности ферментов, вовлеченных в биосинтез аминокислот, и/или уменьшении чувствительности целевого фермента к ингибированию продуцируемой L-аминокислотой по типу обратной связи (см., например, патенты США 4346170; 5661012 и 6040160).
Описан новый микробиологический штамм, пригодный для ферментативного получения L-цистеина, L-цистина, N-ацетилсерина, который образуется в результате неферментативной реакции конверсии О-ацетил-L-серина, и/или производных тиазолидина. Такой новый штамм имеет избыточную экспрессию, по крайней мере, одного из генов, кодирующих белок, который обеспечивает секрецию из клетки антибиотиков или других токсичных для микроорганизма веществ (ЕР 0885962).
Хромосомный фрагмент был идентифицирован в банке генов Escherichia coli по способности увеличивать выход цистеина в промышленном штамме-продуценте. Субклонирование и генетический анализ показали, что за это увеличение отвечает открытая рамка считывания, кодирующая продукт длиной 299 аминокислот, названный Orf299. Orf299 был синтезирован с помощью системы промоторов для Т7-полимеразы, и было показано, что он обладает свойствами интегрального мембранного белка. Такие результаты дополнительно указывают на то, что ORF299 кодирует экспортную помпу, ответственную за выведение различных метаболитов цистеинового пути (Dassler Т. et al, Mol. Microbiol.; 36(5):1101-12(2000).
Было обнаружено, что усиление экспрессии открытой рамки считывания гена yfiK в промышленном штамме-продуценте Е. coli способно увеличивать его продукцию цистеина. Продукт гена yfiK представляет собой интегральный мембранный белок с шестью предсказанными трансмембранными спиралями и относится к RhtB-семейству экспортных белков. Избыточная продукция YfiK за счет введения плазмиды приводит к значительной и параллельной секреции О-ацетил-L-серина и цистеина в культуральную жидкость только в том случае, если организм содержит не чувствительную к ингибированию цистеином по типу обратной связи трансацетилазу. При добавлении в среду избытка О-ацетил-L-серина указанное условие наличия при секреции цистеина устойчивой к ингибированию по типу обратной связи серинтрансацетилазы может быть исключено как в трансформантах, несущих yfiK, так и в клетках дикого типа. Делеционный мутант yfiK не имел каких-либо фенотипических нарушений и был способен экспортировать О-ацетил-L-серин и цистеин, в случае, когда он был трансформирован плазмидой, несущей ранее охарактеризованный ydeD вместо экспортера О-ацетил-L-серина/цистеина. Поскольку двойной мутант ydeD-yfiK демонстрировал такой же результат, предполагается, что YfiK и YdeD действуют независимо. Необходимость клетки регулировать размер внутреннего пула О-ацетил-L-серина через синтез экспортных белков может быть связана с тем, что данное вещество (при добавлении извне) ингибирует рост. Избыточная экспрессия любого из генов ydeD или yfiK ослабляет ингибирование и увеличивает устойчивость к азасерину, который является аналогом О-ацетил-L-серина (Franke I et.al., J Bacteriol.; 185(4):1161-6(2003)).
Объединение цитохрома bd и периплазматических цитохромов Е. coli требует АТФ-связывающий кассетный транспортер CydDC, субстрат которого неизвестен. Сравнение с помощью двухмерного SDS-PAGE периплазмы из штаммов дикого типа и cydD мутанта выявило, что последний был лишен некоторых транспортных связывающих белков периплазмы, несмотря на то, что ни один мажорный белок не отсутствовал в периплазме мутанта cydD. CydDC экспортирует из цитоплазмы в периплазму аминокислоту цистеин, для которого далее, с помощью обращенных мембранных везикул с радиомеченным цистеином может быть показано, что транспорт внутрь осуществляется АТФ-зависимым несопряженным способом. Были описаны новые плейотропные фенотипы мутанта cydD, в том числе появление чувствительности к бензилпенициллину и дитиотреитолу и потеря подвижности. Оба этих фенотипа согласуются с периплазматическими дефектами при формировании дисульфидных связей. Наличие экзогенного цистеина было способно восстановить эти фенотипы и оказывать влияние на уровень периплазматических цитохромов с-типа в штаммах cydD и дикого типа, но не восстанавливать уровень цитохрома d. Согласно функции CydDC, являющегося экспортером цистеина, рост мутанта cydD был гиперчувствителен к высокой концентрации цистеина и продуцировал более высокий цитоплазматический уровень цистеина, чем мутант дефектный по ORF299, кодирующей главный посредник суперсемейства. Двойной мутант cydD ORF299 был высокочувствителен к цистеину и имел повышенный уровень цитоплазматического цистеина, в то время как избыточная экспрессия CydDC придавала устойчивость к его высокой внутриклеточной концентрации. По-видимому, CydDC отвечает за экспорт цистеина, который является ключевым для окислительно-восстановительного гомеостаза в периплазме (Pittman M.S. et al., J Biol Chem.; 277(51):49841-9(2002)).
Кроме YdeD и YfiK, которые были ранее определены как белки, экспортирующие L-цистеин в Е. coli, было проанализировано влияние 33 предполагаемых генов лекарственных транспортеров Е. coli на экспорт L-цистеина и их избыточной продукции. Избыточная экспрессия генов acrD, acrEF, bcr, cusA, emrAB, emrKY, ybjYZ и yojIH снимала ингибирование роста клеток Е. coli, которые имели нарушенный ген tnaA, L-цистеином. Ген tnaA является главным цистеиндесульфогидразным геном. Было обнаружено, что после культивирования в присутствии L-цистеина избыточная экспрессия восьми вышеперечисленных генов снижает внутриклеточный уровень L-цистеина. Исследование транспорта аминокислот показало, что избыточная экспрессия Bcr, обеспечивающего устойчивость к бицикломицину и тетрациклину, в частности, способствует экспорту L-цистеина, направляемому за счет энергии, которая генерируется протонным градиентом. Когда штамм Е. coli с нарушенным геном tnaA, экспрессирующий поврежденный ген cysE, был трансформирован плазмидой, несущей ген bcr, полученный трансформант продуцировал больше L-цистеина, чем клетки, несущие только вектор. Анализ репортерных генов дал основания полагать, что ген bcr конститутивно экспрессируется на высоком уровне. Такие результаты показывают, что обеспечивающий множественную лекарственную устойчивость транспортер Bcr главного семейства посредников, вовлечен в экспорт L-цистеина и его избыточную продукцию в сконструированных методами генетической инженерии клетках Е. coli (Yamada S. et al., Appl Environ Microbiol.; 72(7):4735-42(2006)).
Но в настоящее время нет данных об использовании для продукции L-аминокислот бактерии, содержащей белок, полученный из бактерии рода Pantoea и который способен придавать бактерии устойчивость к ингибированию L-цистеином.
Описание изобретения
Цели настоящего изобретения могут включать увеличение продуктивности продуцирующих L-аминокислоты штаммов и предоставление способа получения неароматических или ароматических L-аминокислот с использованием указанных штаммов.
Данные цели были достигнуты за счет обнаружения того факта, что активность белка, придающего бактерии устойчивость к ингибированию роста L-цистеином, может приводить к увеличению продукции L-аминокислот, таких как L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, L-пролин, L-аргинин, L-фенилаланин, L-тирозин и L-триптофан.
Настоящее изобретение предоставляет бактерию семейства Enterobacteriaceae, обладающую повышенной способностью к продукции аминокислот, таких как L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, L-пролин, L-аргинин, L-фенилаланин, L-тирозин и L-триптофан.
Целью настоящего изобретения является предоставление белка, способного придавать бактерии устойчивость к ингибированию роста L-цистеином, отличающийся тем, что указанный белок выбран из группы, состоящей из:
(A) белка, представленного в SEQ ID NO: 2; или его варианта и
(B) белка, представленного в SEQ ID NO: 4; или его варианта.
Также целью настоящего изобретения является предоставление фрагмента ДНК, кодирующего описанный выше белок.
Также целью настоящего изобретения является предоставление бактерии семейства Enterobacteriaceae, содержащей описанный выше фрагмент ДНК.
Также целью настоящего изобретения является предоставление описанной выше бактерии, которая трансформирована вышеупомянутым фрагментом ДНК.
Также целью настоящего изобретения является предоставление описанной выше бактерии, в которой экспрессия вышеупомянутого фрагмента ДНК усилена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, которая способна продуцировать L-аминокислоты.
Также целью настоящего изобретения является предоставление описанной выше бактерии, которая принадлежит к роду Escherichia.
Также целью настоящего изобретения является предоставление описанной выше бактерии, которая принадлежит к роду Pantoea.
Также целью настоящего изобретения является предоставление способа получения L-аминокислоты, включающего культивирование описанной выше бактерии в питательной среде, и выделение указанной L-аминокислоты из культуральной жидкости.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором указанная L-аминокислота выбрана из группы, включающей ароматическую L-аминокислоту и неароматическую L-аминокислоту.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором ароматическая L-аминокислота выбрана из группы, включающей L-фенилаланин, L-тирозин и L-триптофан.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором неароматическая L-аминокислота выбрана из группы, включающей L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновую кислоту, L-глутамин, L-глутаминовую кислоту, L-пролин, L-аргинин и О-ацетил-L-серин.
Настоящее изобретение более детально описано ниже.
Подробное описание наилучшего способа осуществления изобретения
1. Бактерия согласно настоящему изобретению
Бактерия может представлять собой бактерию - продуцент L-аминокислоты, принадлежащую к семейству Enterobacteriaceae, отличающуюся тем, что указанная бактерия содержит белок, полученный из бактерии, принадлежащей к роду Pantoea, и указанный белок способен придавать устойчивость к ингибированию роста L-цистеином.
Термин "бактерия - продуцент L-аминокислоты" может обозначать бактерию, которая имеет способность к продукции и выделению L-аминокислоты в среду, когда такая бактерия культивируется в среде.
Термин "бактерия - продуцент L-аминокислоты" может также обозначать бактерию, которая способна производить и накапливать L-аминокислоту в среде в количестве большем, чем штамм дикого типа или родительский штамм Е. coli, такой как Е. coli K-12, и предпочтительно может обозначать, что микроорганизм способен накапливать в среде целевую L-аминокислоту в количестве не менее чем 0.5 г/л и более предпочтительно не менее чем 1.0 г/л. Термин «L-аминокислота» включает в себя L-аланин, L-аргинин, L-аспарагин, L-аспарагиновую кислоту, L-цистеин, L-глутаминовую кислоту, L-глутамин, L-глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин, L-валин и О-ацетил-L-серин.
Термин "ароматическая L-аминокислота" означает L-фенилаланин, L-тирозин и L-триптофан. Термин "неароматическая L-аминокислота" означает L-треонин, L-лизин, L-цистеин и производные L-цистеина, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновую кислоту, L-глутамин, L-глутаминовую кислоту, L-пролин, L-аргинин и О-ацетил-L-серин. L-треонин, L-лизин, L- цистеин, L-лейцин, L-гистидин, L-глутаминовая кислота, L-фенилаланин, L-триптофан, L-пролин, L-аргинин и О-ацетил-L-серин являюстя другими вариантами.
Некоторое количество продуцируемого бактерией L-цистеина за счет формирования дисульфидных связей может превратиться в среде в L-цистин. S-сульфоцистеин может быть получен в реакции между L-цистеином и тиосерной кислотой, которые присутствуют в среде (Szczepkowski Т. W., Nature, vol. 182 (1958)). Образующийся в среде S-сульфоцистеин может быть восстановлен в L-цистеин восстановителем, таким как дитиотриетол. Кроме того, для получения производного тиазолидина через промежуточный полутиокеталь L-цистеин, образующийся в бактериальных клетках, может быть сконденсирован кетоном, альдегидом или, например, пировиноградной кислотой, которая также присутствует в клетках (см. патент Японии 2992010). Производное тиазолидина и полутиокеталь могут сосуществовать как равновесная смесь. Когда тиазолидиновое производное цистеина производится в среде, L-цистеин может быть получен путем отбора производного тиазолидина из среды для того, чтобы нарушить равновесие между производным и L-цистеином так, чтобы L-цистеин продуцировался в избытке. Следовательно, способность производить L-цистеин не ограничивается способностью накапливать только L-цистеин в среде или клетках, но также включает способность накапливать в среде L-цистин или его производные, такие как S-сульфоцистеин, производное тиазолидина, полутиокеталь или их смесь в среде.
Некоторые производные L-цистеина, такие как γ-глутамилцистеин, глутатион, цистатионин, гомоцистеин, метионин и S-аденозилметионин, например, могут быть синтезированы из цистеина как важный исходный материал. Производные L-цистеина могут также включать метилцистеин, этилцистеин, карбоцистеин, сульфоцистеин, ацетилцистеин и другие. L-цистеин, полученный, как описано выше, может использоваться для получения таких производных L-цистеина.
Ферментативное производство этих соединений может быть осуществлено с использованием соответствующих микроорганизмов-продуцентов в качестве хозяйских штаммов, в сочетании со способностью продуцировать цистеин. Таким образом, способность продуцировать L-цистеин включает и вышеупомянутые соединения, такие как γ-глутамилцистеин, глутатион, цистатионин, гомоцистеин, метионин и S-аденозилметионин, которые производят цистеин как важный интермдиат.
Для того чтобы придать способность синтезировать из цистеина такие соединения, как γ-глутамилцистеин, глутатион, цистатионин, гомоцистеин, метионин и S-аденозилметионин, могут быть использованы хорошо известные методы селекции коринеформных бактерий или бактерий рода Escherichia (см. "Amino Acid Fermentation", Gakkai Shuppan Center (Ltd.), 1st Edition, published May 30, 1986, pp.77-100). Такие методы включают получение микроорганизма, имеющего свойства ауксотрофного мутанта, штамма, устойчивого к аналогу, или мутанта с нарушением метаболической регуляции или конструкцию рекомбинантного штамма, с избыточной экспрессией соответствующего фермента биосинтеза. Также эффективным для увеличения количества продукта может быть снижение активности ферментов, которые катализируют реакции, ответвляющиеся от основного пути, и/или вовлечены в деградацию соответствующих соединений или их инетермедиатов. В данном случае при селекции каждая бактерия-продуцент может быть наделена одним или несколькими вышеописанными свойствами. Экспрессия соответствующего фермента(ов) биосинтеза может быть усилена отдельно или в сочетании с одним или несколькими ферментами. К тому же, наделение такими свойствами, как ауксотрофная мутация, устойчивость к аналогу или мутация, нарушающая метаболическую регуляцию, могут сочетаться с методами усиления активности ферментов биосинтеза.
Термин "бактерия, которая имеет устойчивость к ингибированию роста L-цистеином" может означать бактерию, полученную из родительского бактериального штамма, который имеет такие генетические свойства, что может расти в среде, содержащей L-цистеин. Может быть использована твердая питательная среда.
Бактерия, которая имеет устойчивость к ингибированию роста цистеином, демонстрирует более благоприятный рост по сравнению с родительским штаммом, когда культивируется в среде, содержащей L-цистеин. Например, бактерия, которая может формировать колонии при выращивании при 34°C в течение 20 часов на чашках с минимальной средой М9, содержащей 50 мкМ или более или предпочтительно 200 мкМ L-цистеина, может быть устойчивой к L-цистеину.
Штаммы, несущие описанные выше гены, которые могут расти быстрее, чем контрольный штамм в среде, содержащей 50 мкМ L-цистеина, или, предпочтительно, 200 мкМ, показывают, что данный ген или локус генов могут придавать устойчивость к цистеину.
Семейство Enlerobacteriaceae включает бактерии, относящиеся к родам Escherichia, Enterobacfer, Erwinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и так далее. В особенности предпочтительны бактерии, отнесенные к семейству Enterobacteriaceae согласно классификации базы данных NCB1 (National Center for Biotechnology Information) database (http://www.ncbi.nlm.nih.gov/htbinpost/Taxonomy/wgetorg?mode=Tree&id=1236&lvl=3&keep=1&srchmode=1&unlock). Может быть использована бактерия, принадлежащая к роду Escherichia или Pantoea.
Термин «бактерия, принадлежащая к роду Escherichia» означает, что бактерия может быть отнесена к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. Среди примеров бактерий, принадлежащих к роду Escherichia, но не ограничивающихся ими, может быть упомянута бактерия Escherichia coli (E. coli).
Бактерия, принадлежащая к роду Escherichia, не ограничена каким-либо образом, при этом, например, может быть использована бактерия описанная Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Table 1).
Термин «бактерия, принадлежащая к роду Pantoea» означает, что бактерия может быть отнесена к роду Pantoea согласно системе классификации, известной специалисту в области микробиологии. Некоторые виды Enterobacter agglomerans недавно были переклассифицированы в Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или другие аналогичные, на основании нуклеотидного анализа последовательности 16S РНК, и др. (International Journal of Systematic Bacteriology, July 1989, 39(3), pp.337-345). Кроме того, некоторые бактерии рода Erwinia были переклассифицированы в Pantoea ananatis или Pantoea stewartii (International Journal of Systematic Bacteriology, Jan. 1993, 43(1), pp.162-173). Среди типичных штаммов бактерий Pantoea, но не ограничивающих их, могут быть упомянуты Pantoea ananatis, Pantoea stewartii, Pantoea agglomerans и Pantoea citrea. Конкретными примерами штаммов являются Pantoea ananatis AJ 13355 (FERM BP-6614, Европейский патент No. 0952221), Pantoea ananatis AJ 13356 (FERM BP-6615, Европейский патент No. 0952221), Pantoea ananatis AJ 13601 (FERM BP-7207, Европейский патент No. 0952221). В качестве примера способа осуществления настоящего изобретения штамм Pantoea ananatis SC17(0) может быть использован как λ-Red устойчивая бактерия (VKPM В-9246, патентная заявка России 2006134574).
Нуклеотидная последовательность гена c0011 из штамма Р. ananatis SC17 и аминокислотная последовательность белка, кодируемого геном c0011, представлены в SEQ ID NO: 1 и SEQ ID NO: 2 соответственно.
Нуклеотидная последовательность гена d0663 из штамма Р. ananatis SC17 и аминокислотная последовательность белка, кодируемого геном d0663, представлены в SEQ ID NO: 3 и SEQ ID NO: 4 соответственно.
Нуклеотидная последовательность гена с09478 из штамма Р. ananatis SC17 и аминокислотная последовательность белка, кодируемого геном с09478, представлены в SEQ ID NO: 5 и SEQ ID NO: 6 соответственно.
Поскольку у представителей различных родов и штаммов семейства Enterobacteriaceae возможны некоторые вариации в нуклеотидных последовательностях, гены c0011, d0663 и с09478 не ограничиваются генами, последовательности которых представлены в SEQ ID No:1, SEQ ID No:3 и SEQ ID No:5, и могут включать гены, гомологичные генам, представленным в SEQ ID No:1, SEQ ID No:3 и SEQ ID No:5.
Ген c0011 может кодировать предполагаемый трансмембранный белок из Klebsiella pneumoniae (GenBank Accession No. ABR77369.1), гипотетический белок KCO_01469 из Citrobacter koseri (GenBank Accession No. ABV 12602.1), пермеазу суперсемейства (DMT) из Acinetobacter baumannii (GenBank Accession No. ABO12139.2) и предполагаемый мембранный белок из Pseudomonas aerugmosa (GenBank Accession No. ABR86455.1). Ген d0663 может кодировать экспортер лизина (LYSE/YGGA) из Erwinia tasmaniensis (GenBank Accession No. CA095150.1), предполагаемый мембранный белок из Pectobacterium atrosepticum (GenBank Accession No. CAG76207.1), предполагаемый транспортный белок из Chromobacterium violaceum (GenBank Accession No. AAQ59575.1) и экспортер лизина (LYSE/YGGA) из Burkholderia vietnamiensis (GenBank Accession No. ABO58107.1).
Поэтому вариант белка, кодируемый генами c0011, d0663 и с09478, может быть представлен белком с гомологией не менее 80%, предпочтительно не менее 90% и наиболее предпочтительно не менее 95% по отношению к полным аминокислотным последовательностям, представленным в SEQ ID No:2, SEQ ID No:4 и SEQ ID No:6, соответственно, при условии, что белок наделяется устойчивостью к цистеину. Термин «вариант белка» означает белки с изменениями в последовательностях, будь то делеции, вставки, добавления или замены аминокислот. Количество изменений в варианте белка зависит от положения или типа аминокислотного остатка в третичной структуре белка. Возможно от 1 до 30, предпочтительно от 1 до 15, более предпочтительно от 1 до 5 изменений в последовательностях, представленных в SEQ ID No:2, SEQ ID No:4 и SEQ ID No:6. Эти изменения в вариантах белка могут иметь место в областях белка, которые некритичны для функционирования белка. Такие изменения допускаются благодаря тому, что некоторые аминокислоты имеют высокую гомологию друг к другу, поэтому такие изменения не влияют на третичную структуру или активность.
Гомология между двумя аминокислотными последовательностями может быть установлена с использованием известных методов, например, компьютерной программы BLAST 2.0, которая считает три параметра: счет, идентичность и сходство.
Замена, делеция, вставка или добавление одного или нескольких аминокислотных остатков будут представлять собой консервативную(ые) мутацию(и) при условии, что активность фермента при этом сохраняется. Примером консервативной мутации является консервативная замена. Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val or Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, Ile или Leu.
Кроме того, гены c0011, d0663 и с09478 могут быть представлены вариантами, которые гибридизуются при жестких условиях с нуклеотидной последовательностью, представленной в SEQ ID No:1, SEQ ID No:3 и SEQ ID No:5 соответственно или с зондами, которые могут быть синтезированы на основе указанных нуклеотидных последовательностей, при условии, что указанные варианты кодируют функциональный белок. «Жесткие условия» включают такие условия, при которых специфические гибриды, например, гибриды со степенью гомологии не менее 60%, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90%, наиболее предпочтительно не менее 95%, образуются, а неспецифические гибриды, например, гибриды со степенью гомологии ниже вышеуказанной - не образуются. Практическим примером жестких условий является однократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей, соответствующей стандартным условиям отмывки при гибридизации по Саузерну, например, 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°C. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, рекомендуется производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N+ (Amersham) при жестких условиях составляет 15 минут. Предпочтительна двухтрехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно она составляет от 100 п.н. до 1 т.п.н.
Усиление экспрессии генов c0011, d0663 и с09478 может быть достигнуто за счет увеличения числа копий генов c0011, d0663 и с09478, изменения регуляторных последовательностей генов c0011, d0663 и с09478, амплификации гена, кодирующего регуляторный фактор, ответственный за усиление экспрессии генов c0011, d0663 и с09478 соответственно или за счет нарушения или снижения экспрессии гена, кодирующего регуляторный фактор, ответственный за подавление экспрессии генов c0011, d0663 и с09478 соответственно, с использованием методов трансформации или гомологичной рекомбинации.
Например, фрагмент рекомбинантной ДНК может быть приготовлен путем лигирования фрагмента, содержащего гены c0011, d0663 и с09478 с вектором, предпочтительно многокопийным вектором, который может реплицироваться в микроорганизме-хозяине, и полученный вектор может быть введен в микроорганизм-хозяин.
Также число копий генов c0011, d0663 и с09478 может быть увеличено путем интеграции нескольких копий гена в хромосомную ДНК микроорганизма. Интеграция множественных копий генов c0011, d0663 и с09478 в хромосомную ДНК микроорганизма может быть осуществлена с помощью гомологичной рекомбинации нацеливанием на последовательность, существующую в хромосомной ДНК в нескольких копиях. Могут быть использованы повторяющаяся ДНК и инвертированные повторы на концах транспозонов. Или же, как описано в JP2-109985A, возможно ввести гены c0011, d0663 и с09478 в транспозон, что позволит их перенести так, что несколько копий гена будут интегрированы в хромосомную ДНК. Интеграция генов c0011, d0663 и с09478 в хромосому может быть подтверждена с помощью зонда, который имеет часть последовательности c0011, d0663 и с09478 генов.
Усиление экспрессии генов c0011, d0663 и с09478 может быть также достигнуто за счет замены регуляторной последовательности, включающей промоторы генов c0011, d0663 и с09478 на хромосомную ДНК или плазмиду с более сильным промотором, как описано в заявке РСТ WO 00/18935. Например, могут быть использованы lac-промотор, trp-промотор, trc-промотор, PL-промотор и другие, известные как сильные промоторы. Кроме того, можно ввести несколько нуклеотидных замен в промоторные районы генов так, что промоторы станут сильнее. Способ оценки силы промоторов и примеры сильных промоторов описаны в книге Goldstein et al. (Prokaryotic promoters in biotechnology. Biotechnol. Annu. Rev., 1995, 1, 105-128). К тому же, известно, что спейсерные последовательности между сайтом связывания рибосомы (RBS-ribosome binding site) и инициирующим трансляцию кодоном, особенно несколько нуклеотидов до инициирующего кодона, оказывают существенное влияние на эффективность трансляции. Вследствие этого такая последовательность может быть изменена. Регулирующие экспрессию последовательности генов c0011, d0663 и с09478 могут быть определены с использованием вектора для идентификации промотора или программы для генетического анализа, такой как GENETYX. Экспрессия может быть также улучшена за счет продления срока жизни РНК. Кроме того, активность фермента также может быть увеличена за счет предотвращения деградации фермента.
Для того чтобы усилить активность белка, кодируемого генами c0011, d0663 и с09478, в указанные гены может быть введена мутация, усиливающая экспорт L-аминокислот. Примерами мутаций, которые увеличивают активность белков, кодируемых генами c0011, d0663 и с09478 (белки С0011, D0663 и С09478), могут служить мутация в последовательности промотора, увеличивающая транскрипцию генов c0011, d0663 и с09478, и мутация в кодирующем районе гена c0011, d0663 и с09478, увеличивающая специфическую активность белков С0011, D0663 и С09478.
Методами получения плазмидной ДНК, разрезания и лигирования ДНК, трансформации, выбора олигонуклеотидов в качестве праймеров и подобными им могут являться обычные методы, хорошо известные специалисту в данной области. Эти методы описаны, например, в книге Sambrook, J., Fritsch, E.F., and Maniatis, Т., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
Бактерия-продуцент L-аминокислоты
Может быть использована бактерия, способная к продукции ароматических или неароматических L-аминокислот.
Бактерия может быть получена путем введения гена, который кодирует белок, способный придавать бактерии, имеющей способность производить L-аминокислоты, устойчивость к цистеину. С другой стороны, бактерия может быть получена путем придания способности производить L-аминокислоты бактерии, которая уже содержит белок, придающий ей устойчивость к цистеину.
Бактерия-продуцент L-треонина
Примеры родительского штамма для получения бактерии-продуцента L-треонина включают, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е. coli TDH-6/pVIC40 (ВКПМ В-3996) (патенты США 5175107 и 5705371), штамм Е. coli 472T23/pYN7 (ATCC 98081) (патент США 5631157), штамм Е. coli NRRL-21593 (патент США 5939307), штамм Е. coli FERM ВР-3756 (патент США 5474918), штаммы Е. coli FERM BP-3519 и FERM BP-3520 (патент США 5376538), штамм Е. coli MG442 (Гусятинер и др., Генетика, 14, 947-956 (1978)), штаммы Е. coli VL643 и VL2055 (Европейская патентная заявка ЕР 1149911 А) и подобные им.
Штамм TDH-6 является дефектным по гену thrC, способен ассимилировать сахарозу и содержит ген ilvA с мутацией типа "leaky". Указанный штамм содержит мутацию в гене rhtA, которая обуславливает устойчивость к высоким концентрациям треонина и гомосерина. Штамм В-3996 содержит плазмиду pVIC40, которая была получена путем введения в вектор, производный от вектора RSF1010, оперона thrA*BC, включающего мутантный ген thrA, кодирующий аспартокиназа-гомосериндегидрогеназу I, у которой существенно снижена чувствительность к ингибированию треонином по типу обратной связи. Штамм В-3996 был депонирован 19 ноября 1987 года во Всесоюзном научном центре антибиотиков (РФ, 117105, Москва, Нагатинская ул., 3-А) с инвентарным номером РИА 1867. Указанный штамм также был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (РФ, 117545, Москва, 1-й Дорожный проезд, 1) с инвентарным номером В-3996.
В качестве родительского штамма для получения бактерии-продуцента L-треонина согласно настоящему изобретению также может быть использован штамм E. coli ВКПМ В-5318 (Европейская заявка ЕР0593792 В). Штамм В-5318 является прототрофным относительно изолейцина, регуляторная область треонинового оперона на плазмиде pVIC40 заменена чувствительным к температуре С1 репрессором фага λ и промотором PR. Штамм ВКПМ В-5318 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) 3 мая 1990 г. с инвентарным номером ВКПМ В-5318.
Бактерия может быть дополнительно модифицирована таким образом, чтобы иметь повышенную экспрессию одного или нескольких следующих генов:
- мутантного гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи;
- гена thrB, кодирующего гомосеринкиназу;
- гена thrC, кодирующего треонинсинтазу;
- гена rhtA, предположительно кодирующего трансмембранный белок;
- гена asd, кодирующего аспартат-β-семиальдегиддегидрогеназу, и
- гена aspC, кодирующего аспартатаминотрансферазу (аспартаттрансаминазу).
Нуклеотидная последовательность гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I из Escherichia coli, известна (номера нуклеотидов с 337 по 2799 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990). Ген thrA расположен на хромосоме штамма Е. coli K-12 между генами thrL и thrB. Нуклеотидная последовательность гена thrB, кодирующего гомосеринкиназу из Escherichia coli, известна (номера нуклеотидов с 2801 по 3733 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990). Ген thrB расположен на хромосоме штамма Е. coli K-12 между генами thrA и thrC. Нуклеотидная последовательность гена thrC, кодирующего треонинсинтазу из Escherichia coli, известна (номера нуклеотидов с 3734 по 5020 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990). Ген thrC расположен на хромосоме штамма Е. coli K-12 между геном thrB и открытой рамкой считывания уааХ. Все три указанных гена функционируют как один треониновый оперон. Для усиления экспрессии треонинового оперона область аттенюатора, влияющего на транскрипцию, удаляется из оперона (заявки РСТ WO 2005/049808, WO 2003/097839).
Мутантный ген thrA, кодирующий аспартокиназу-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи, так же, как и гены thrB и thrC могут быть получены в виде единого оперона из хорошо известной плазмиды pVIC40, которая представлена в штамме-продуценте Е. coli ВКПМ В-3996. Плазмида pVIC40 подробно описана в патенте США 5705371.
Ген rhtA расположен на 18 минуте хромосомы Е. coli около оперона glnHPQ, который кодирует компоненты транспортной системы глутамина, ген rhtA идентичен ORF1 (ген ybiF, номера нуклеотидов с 764 по 1651 в последовательности с инвентарным номером ААА218541 в базе данных GenBank, gi:440181), расположен между генами рехВ и ompX. Участок ДНК, экспрессирующийся с образованием белка, кодируемого рамкой считывания ORF1, был назван геном rhtA (rht: resistance to homoserine and threonine). Также было показано, что мутация rhtA23 представляет собой замену А-на-G в положении -1 по отношению к старт кодону ATG (ABSTRACTS of 17th International Congress of Biochemistry and Molecular Biology in conjugation with 1997 Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract No. 457, EP 1013765 A).
Нуклеотидная последовательность гена asd из E. coli известна (номера нуклеотидов с 3572511 по 3571408 в последовательности с инвентарным номером NC_000913.1 в базе данных GenBank, gi; 16131307) и может быть получена с помощью ПЦР (полимеразная цепная реакция; ссылка на White, T.J. et al., Trends Genet., 5, 185 (1989)) с использованием праймеров, синтезированных на основе нуклеотидной последовательности указанного гена. Гены asd из других микроорганизмов могут быть получены сходным образом.
Также нуклеотидная последовательность гена aspC из E. coli известна (номера нуклеотидов с 983742 по 984932 в последовательности с инвентарным номером NC_000913.1 в базе данных GenBank, gi:16128895) и может быть получена с помощью ПЦР. Гены aspC из других микроорганизмов могут быть получены сходным образом.
Бактерия-продуцент L-лизина
Примеры бактерий-продуцентов L-лизина, принадлежащих к роду Escherichia, включают мутанты, обладающие устойчивостью к аналогу L-лизина. Аналог L-лизина ингибирует рост бактерий, принадлежащих к роду Escherichia, но это ингибирование полностью или частично снимается, когда в среде также присутствует L-лизин. Примеры аналога L-лизина включают, но не ограничиваются оксализином, лизингидроксаматом, S-(2-аминоэтил)-L-цистеином (АЕС), γ-метиллизном, α-хлорокапролактамом и так далее. Мутанты, обладающие устойчивостью к указанным аналогам лизина, могут быть получены путем обработки бактерий, принадлежащих к роду Escherichia, традиционными мутагенами. Конкретные примеры бактериальных штаммов, используемых для получения L-лизина, включают штамм Escherichia coli AJ11442 (PERM BP-1543, NRRL В-12185; смотри патент США 4346170) и штамм Escherichia coli VL611. В этих микроорганизмах аспартокиназа устойчива к ингибированию L-лизином по типу обратной связи.
Штамм WC196 может быть использован в качестве бактерии-продуцента L-лизина Escherichia coli. Данный бактериальный штамм был получен путем селекции фенотипа устойчивости к АЕС у штамма W3110, производного от штамма Escherichia coli K-12. Полученный штамм был назван Escherichia coli AJ13069 и был депонирован в Национальном Институте Биологических Наук и Человеческих Технологий, Агентство Промышленной Науки и Технологии (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology), в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония (National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan), 6 декабря 1994 года и получил инвентарный номер PERM P-14690. Затем было произведено международное депонирование этого штамма согласно условиям Будапештского Договора 29 сентября 1995 года, и штамм получил инвентарный номер PERM BP-5252 (смотри патент США 5827698).
Примеры родительских штаммов для получения бактерий, продуцирующих L-лизин, также включают штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-лизина. Примеры ферментов, вовлеченных в биосинтез L-лизина, включают, но не ограничиваются ими, дигидродипиколинатсинтазу (dapA), аспартокиназу (lysC), дигидродипиколинатредуктазу (dapB), диаминопимелатдекарбоксилазу (lysA), диаминопимелатдегидрогеназу (ddH) (патент США 6040160), фосфоенолпируваткарбоксилазу (ppc), аспартатсемиальдегиддегидрогеназу (asd), никотинамидадениндинуклеотидтрансгидрогеназу (pntAB) и аспартазу (aspA) (европейская заявка ЕР 1253195 А). Кроме того, родительские штаммы могут иметь повышенный уровень экспрессии гена, вовлеченного в процесс дыхания (суо) (европейская заявка ЕР 1170376 А), гена, кодирующего никотинамиднуклеотидтрансгидрогеназу (pntAB) (патент США 5830716), гена ybjE (заявка РСТ WO 2005/073390), или комбинации этих генов.
Примеры родительских штаммов для получения бактерий, продуцирующих L-лизин, также включают штаммы, в которых снижена или отсутствует активность ферментов, которые катализируют реакции образования отличных от L-лизина соединений, ответвляющихся от основного пути биосинтеза L-лизина. Примеры ферментов, которые катализируют реакции образования отличных от L-лизина соединений, ответвляющихся от основного пути биосинтеза L-лизина, включают гомосериндегидрогеназу, лизиндекарбоксилазу (патент США 5827698) и малатдегидрогеназу(заявка РСТ WO 2005/010175).
Бактерия-продуцент L-цистеина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-цистеина, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е. coli JM15, трансформированный различными аллелями гена cysE, кодирующими устойчивые к ингибированию по типу обратной связи серинацетилтрансферазы (патент США 6218168, патентная заявка РФ 2003121601); штамм Е. coli W3110, с повышенной экспрессией генов, кодирующих белок, способный к секреции соединений, токсичных для клетки (патент США 5972663); штаммы Е. coli, содержащие цистеиндесульфогидразу со сниженной активностью (патент Японии JP 11155571 A2); штамм Е. coli W3110 с повышенной активностью позитивного транскрипционного регулятора цистеинового регулона, кодируемого геном cysB (международная заявка РСТ WO 0127307 A1) и подобные им.
Бактерия-продуцент производных L-цистеина
Примеры родительских штаммов, используемых для получения бактерии-продуцента производных L-цистеина включают в себя, но не ограничиваются штаммами, описанными ниже. Способность производить γ-глутамилцистеин может быть достигнута, например, за счет усиления активности γ-глутамилцистеинсинтетазы и/или снижения активности глутатионсинтетазы. Способность производить глутатион может быть достигнута за счет усиления активности γ-глутамилцистеинсинтетазы и/или глутатионсинтетазы. Использование мутантных γ-глутамилцистеинсинтетаз, устойчивых к ингибированию глутатионом по типу обратной связи, также может придавать и/или улучшать способность к продукции глутатиона. Способы микробиологического производства глутатиона описаны в статье Yin и соавт. (Yin Li, Gongyuan Wei, Jian Chen. Appi Microbiol Biotechnol (2004) 66: 233-242). Способность продуцировать метионин может быть достигнута за счет придания ауксотрофности по L-треонину или устойчивости к норлейцину (открытая патентная заявка Японии 2000-139471). Инактивация репрессора метионина и/или усиление пути биосинтеза метионина (а именно гомосерин-O-сукцинилтрансферазы и цистатионин-γ-синтазы) могут быть также эффективны для придания и усиления способности производить метионин (открытая патентная заявка Японии 2000-139471). Кроме того, использование мутантных O-сукцинилтрансфераз, устойчивых к ингибированию метионином по типу обратной связи, также может быть эффективным для придания и усиления способности продуцировать метионин. В связи с тем, что цистатионин и гомоцистеин являются интермедиатами метионинового биосинтеза, часть способов продукции метионина, описанных выше, может применяться и для их продукции. Конкретные примеры улучшения продукции цистатионина описаны в открытой патентной заявке Японии 2003-010654 (использование ауксотрофов по метионину) и в открытой патентной заявке Японии 2005-16842 (добавление цистеина или гомосерина в питательные среды для продукции). Так как цистатионин является предшественником гомоцистеина, такие способы могут быть использованы для продукции гомоцистеина. Способность производить S-аденозилметионин может быть достигнута за счет увеличения активности метионинаденозилтрансферазы (Европейский патент 0647712, Европейский патент 1457569) и/или эффлюксного насоса (efflux pump) MdfA (патент США 7410789).
Бактерия-продуцент L-лейцина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-лейцина, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штаммы Е. coli, устойчивые к лейцину (например, штамм 57 (VKPM В-7386, патент США 6124121)) или аналогам лейцина, включающим, например, β-2-тиенилаланин, 3-гидроксилейцин, 4-азалейцин и 5,5,5-трифлуоролейцин (выложенные патентные заявки Японии 62-34397 и 8-70879), штаммы Е. coli, полученные с помощью генно-инженерных методов, описанных в заявке РСТ 96/06926; Е. coli штамм Н-9068 (JP 08-70879A) и подобные им.
Бактерия может быть улучшена путем усиления экспрессии одного или нескольких генов, вовлеченных в биосинтез L-лейцина. Примеры таких генов включают в себя гены оперона leuABCD и предпочтительно представлены мутантным геном leuA, кодирующим изопропилмалатсинтазу со снятым ингибированием L-лейцином по типу обратной связи (патент США 6403342). Кроме того, бактерия может быть улучшена путем усиления экспрессии одного или нескольких генов, кодирующих белки, которые экспортируют L-аминокислоту из бактериальной клетки. Примеры таких генов включают в себя гены b2682 и b2683 (гены ygaZH) (Европейская заявка 1239041 А2).
Бактерия-продуцент L-гистидина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-гистидина, включают в себя, но не ограничиваются бактериями-продуцентами L-гистидина, принадлежащими к роду Escherichia, такими как штамм Е. coli 24 (ВКПМ В-5945, патент РФ 2003677); штамм Е. coli 80 (ВКПМ В-7270, патент РФ 2119536); штаммы Е. coli NRRL B-12116-B12121 (патент США 4388405); штаммы Е. coli Н-9342 (FERM ВР-6675) и Н-9343 (FERM ВР-6676) (патент США 6344347); штамм Е. coli Н-9341 (FERM ВР-6674) (Европейский патент 1085087); штамм Е. coli AI80/pFM201 (патент США 6258554) и подобные им.
Примеры родительских штаммов для получения бактерий, продуцирующих L-гистидин, также включают штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-гистидина. Примеры таких генов включают гены, кодирующие АТФ-фосфорибозилтрансферазу (hisG), фосфорибозил-АМФ-циклогидролазу (hisi), фосфорибозил-АТФ-фосфогидролазу (hisIE), фосфорибозилформимино-5-аминоимидазолкарбоксамидриботидизомеразу (hisA), амидотрансферазу (hisH), гистидинолфосфатаминотрансферазу (hisC), гистидинолфосфатазу (hisB), гистидинолдегидрогеназу (hisD) и т.д.
Известно, что ферменты биосинтеза L-гистидина, кодируемые генами hisG и hisBHAFI, ингибируются L-гистидином, поэтому способность к продукции L-гистидина также может быть значительно усилена введением мутации, придающей устойчивость к ингибированию по типу обратной связи, в ген АТФ-фосфорибозидтрансферазы (патенты РФ 2003677 и 2119536).
Специфические примеры штаммов, обладающих способностью к продукции L-гистидина, включают Е. coli FERM-P 5038 и 5048, в которые был введен вектор, содержащий ДНК, кодирующую фермент биосинтеза L-гистидина (заявка Японии 56-005099 А), штаммы E. coli, в которые введен ген rht, для экспорта аминокислоты (европейская заявка ЕР 1016710 А), штамм Е. coli 80, которому придана устойчивость к сульфагуанидину, DL-1,2,4-триазол-3-аланину и стрептомицину (ВКПМ В-7270, патент РФ 2119536) и т.д.
Бактерия-продуцент L-глутаминовой кислоты
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-глутаминовой кислоты, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е. coli VL334thrC+ (Европейский патент ЕР 1172433). Штамм Е. coli VL334 (ВКПМ В-1641) является ауксотрофом по L-изолейцину и L-треонину с мутациями в генах thrC и ilvA (патент США 4278765). В этот штамм была перенесена природная аллель гена thrC методом общей трансдукции с использованием бактериофага Р1, выращенного на клетках природного штамма Е. coli K12 (ВКПМ В-7). В результате был получен штамм, ауксотроф по L-изолейцину, VL334thrC+ (ВКПМ В-8961), обладающий способностью к продукции L-глутаминовой кислоты.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-глутаминовой кислоты, включают в себя, но не ограничиваются ими, штаммы, лишенные по активности α-котоглутаратдегидрогеназы, или штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-глутаминовой кислоты. Примеры генов, вовлеченных в биосинтез L-глутаминовой кислоты, включают гены, кодирующие глутаматдегидрогеназу (gdhA), глутаминсинтетазу (glnA), глутаматсинтетазу (gltAB), изоцитратдегидрогеназу (icdA), аконитатгидратазу (acnA, acnB), цитратсинтазу (gltA), фосфоенолпируваткарбоксилазу (ррс), пируваткарбоксилазу (pyc), пируватдегидрогеназу (aceEF, lpdA), пируваткиназу (pykA, pykF), фосфоенолпируватсинтазу (ppsA), енолазу (eno), фосфоглицеромутазу (pgmA, pgmI), фосфоглицераткиназу (pgk), глицеральдегид-3-фосфатдегидрогеназу (gapA), триозофосфатизомеразу (tpiA), фруктозобифосфатальдолазу (fbp), фосфофруктокиназу (pfkA, pfkB) и глюкозофосфатизомеразу (pgi).
Примеры штаммов, модифицированных таким образом, что усилена экспрессия гена цитратсинтетазы, гена фосфоенолпируваткарбоксилазы и/или гена глутаматдегидрогеназы, включают описанные в Европейских заявках ЕР 1078989 А, ЕР 955368 А и ЕР 952221 А.
Примеры штаммов, модифицированных таким образом, что экспрессия гена цитратсинтетазы и/или гена фосфоенолпируваткарбоксилазы снижена, и/или лишенные активности α-котоглутаратдегидрогеназы, включают описанные в Европейских заявках ЕР 1078989 А, ЕР 955368 А и ЕР 952221 А.
Примеры родительских штаммов для получения продуцирующих L-глутаминовую кислоту бактерий также включают штаммы, в которых снижена или отсутствует активность ферментов, которые катализируют синтез отличных от L-глутаминовой кислоты соединений, ответвляющихся от основного пути биосинтеза L-глутаминовой кислоты. Примеры таких ферментов включают изоцитратлиазу (асеА), α-кетоглутаратдегидрогеназу (sucA), фосфотрансацетилазу (pta), ацетаткиназу (ack), синтазу ацетогидроксикислот (ilvG), ацетолактатсинтазу (ilvI), форматацетилтрансферазу (pfl), лактатдегидрогеназу (ldh) и глутаматдекарбоксилазу (gadAB). Бактерии, принадлежащие к роду Escherichia, лишенные активности α-кетоглутаратдегидрогеназы или обладающие сниженной активностью α-кетоглутаратдегидрогеназы и способы их получения описаны в патентах США 5378616 и 5573945. Конкретно примеры таких штаммов включают в себя следующие штаммы:
Е. coli W3110sucA::Kmr
E. coli AJ12624 (FERM BP-3853)
E. coli AJ12628 (FERM BP-3854)
E. coli AJ12949 (FERM BP-4881)
Штамм E. coli W3110sucA::Kmr был получен в результате разрушения гена α-кетоглутаратдегидрогеназы (далее называемого "ген sucA") в штамме E.coli W3110. У этого штамма активность α-кетоглутаратдегидрогеназы отсутствует полностью.
Другие примеры бактерии-продуцента L-глутаминовой кислоты включают в себя бактерии, принадлежащие к роду Escherichia и обладающие устойчивостью к антиметаболитам аспарагиновой кислоты. Эти штаммы также могут быть лишены активности α-кетоглутаратдегидрогеназы, например, штамм AJ13199 (FERM BP-5807) (патент США 5908768) или штамм FERM P-12379, дополнительно обладающий низкой активностью по расщеплению L-глутаминовой кислоты (патент США 5393671); штамм E. coli AJ13138 (FERM BP-5565) (патент США 6110714) и подобные им.
Примеры бактерии-продуцента L-глутаминовой кислоты включают в себя мутантные штаммы, принадлежащие к роду Pantoea, которые лишены активности α-кетоглутаратдегидрогеназы или имеют сниженную активность α-кетоглутаратдегидрогеназы и могут быть получены описанным выше способом. Примерами таких штаммов являются штамм Pantoea ananatis AJ13356 (патент США 6331419), штамм Pantoea ananatis AJ13356, депонированный в Национальном Институте Биологических Наук и Человеческих Технологий, Агентство Промышленной Науки и Технологии, Министерство Международной Торговли и Промышленности (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry) (в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония - National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan) 19 февраля, 1998 и получивший инвентарный номер FERM P-16645. Затем было произведено международное депонирование этого штамма согласно условиям Будапештского Договора от 11 января 1999 г., и штамм получил инвентарный номер FERM BP-6615. Штамм Pantoea ananatis AJ13356 не имеет активности α-кетоглютаратдегидногеназы в результате разрушения гена αKGDH-E1 субъединицы (sucA). Вышеупомянутый штамм при выделении был идентифицирован как Enterobacter agglomerans и депонирован как штамм Enterobacter agglomerans AJ13356. Тем не менее, позднее он был классифицирован как Pantoea ananatis на основе нуклеотидной последовательности 16S рРНК и других доказательств, Несмотря на то, что штамм AJ13356, был депонирован в указанный выше депозитарий как Enterobacter agglomerans, для целей данного описания он будет упоминаться как Pantoea ananatis.
Бактерия-продуцент L-фенилаланина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-фенилаланина, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм E. coli AJ12739 (tyrA::Tn10, tyrR) (ВКМП В-8197); штамм E. coli HW1089 (АТСС-55371), содержащий мутантный ген pheA34 (патент США 5354672); мутантный штамм E. coli MWEC101-b (KR8903681); штаммы E. coli NRRLB-12141, NRRLB-12145, NRRLB-12146 и NRRLB-12147 (патент США 4407952) и подобные им. Также в качестве родительских штаммов могут быть использованы бактерии, принадлежащие к роду Escherichia, - продуценты L-фенилаланина, такие как штамм E. coli K-12 [W3110(tyrA)/pPHAB] (FERM BP-3566), штамм E.coli K-12 [W3110(tyrA)/pPHAD] (FERM BP-12659), штамм E.coli K-12 [W3110(tyrA)/pPHATerm] (FERM BP-12662) и штамм E.coli K-12 [W3110(tyrA)/pBR-aroG4, рАСМАВ], названный как AJ12604 (FERM BP-3579) (Европейский патент ЕР 488424 В1). Кроме того, также могут быть использованы бактерии-продуценты L-фенилаланина, принадлежащие к роду Escherichia с повышенной активностью белков, кодируемых геном уеаА или геном yddG (патентные заявки США 2003/0148473 А1 и 2003/0157667 А1).
Бактерия-продуцент L-триптофана
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-триптофана, включают в себя, но не ограничиваются бактериями-продуцентами L-триптофана, принадлежащими к роду Escherichia, такими как штаммы Е. coli JP4735/pMU3028 (DSM10122) и JP6015/pMU91 (DSM10123), лишенные активности триптофанил-тРНК синтетазы, кодируемой мутантным геном trpS (патент США 5756345); штамм Е. coli SV164 (pGH5), содержащий аллель serA, кодирующий фосфоглицератдегидрогеназу, не ингибируемую серином по типу обратной связи и аллель trpE, кодирующий антранилатсинтазу, не ингибируемую триптофаном по типу обратной связи (патент США 6180373); штаммы Е. coli AGX17 (pGX44) (NRRL В-12263) и AGX6(pGX50)aroP (NRRL В-12264), в которых отсутствует активность триптофаназы (патент США 4371614); штамм Е. coli AGX17/pGX50,pACKG4-pps, в котором усилена способность к синтезу фосфоенолпирувата (заявка РСТ WO 9708333, патент США 6319696), и подобные им. Также могут быть использованы бактерии- продуценты L-триптофана, принадлежащие к роду Escherichia, в которых увеличена активность белка, кодируемого геном yedA или геном yddG (заявки на патент США 2003/0148473 А1 и 2003/0157667 А1).
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-триптофана, также включают в себя штаммы, в которых увеличена активность одного или нескольких ферментов, выбранных из группы, состоящей из антранилатсинтазы, фосфоглицератдегидрогеназы, и триптофансинтазы. И антранилатсинтаза, и фосфоглицератдегидрогеназа подвержены ингибированию L-триптофаном и L-серином по типу обратной связи, так что в эти ферменты могут быть введены мутации, снижающие чувствительность к ингибированию по типу обратной связи. Специфические примеры штаммов с такой мутацией включают штамм SV164 Е. coli, у которого антранилатсинтаза не чувствительна к ингибированию по типу обратной связи, и штамм-трансформант, полученный введением в Е. coli SV164 плазмиды pGH5 (заявка РСТ WO 94/08031), которая содержит мутантный ген serA, кодирующий фосфоглицератдегидрогеназу, которая не чувствительна к ингибированию по типу обратной связи.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-триптофана, также включают в себя штаммы, в которые введен триптофановый оперон, содержащий ген, кодирующий антранилатсинтазу, которая не чувствительна к ингибированию по типу обратной связи (заявка Японии 57-71397 А, заявка Японии 62-244382 А, патент США 4371614). Кроме того, способность к продукции L-триптофана может быть придана путем усиления экспрессии гена (из триптофанового оперона trpBA), кодирующего триптофансинтазу. Триптофансинтаза состоит из двух субъединиц α и β, которые кодируются trpA и trpB соответственно. Кроме того, способность к продукции L-триптофана может быть увеличена усилением экспрессии оперона изоцитратлиазы-малатсинтазы (заявка РСТ WO 2005/103275).
Бактерия-продуцент L-пролина
Примеры бактерий-продуцентов L-пролина, используемых в качестве родительского штамма, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е. coli 702ilvA (ВКПМ В-8012), дефицитного по гену ilvA и способного к продукции L-пролина (Европейский патент ЕР 1172433). Бактерия может быть улучшена путем усиления экспрессии одного или нескольких генов, вовлеченных в биосинтез L-пролина. Предпочтительно примеры таких генов для бактерий-продуцентов L-пролина включают ген proB, кодирующий глутаматкиназу со сниженной регуляцией L-пролином по типу обратной связи (патент Германии 3127361). Кроме того, бактерия может быть улучшена путем усиления экспрессии одного или нескольких генов, кодирующих белки, экскретирующие L-аминокислоту из бактериальной клетки. Примерами таких генов являются гены b2682 и b2683 (ygaZH гены) (Европейская патентная заявка ЕР 1239041 А2).
Примеры бактерий, принадлежащих к роду Escherichia и обладающих способностью к продукции L-пролина, включают следующие штаммы Е. coli: NRRL В-12403 и NRRL В-12404 (патент Великобритании GB 2075056), ВКПМ В-8012 (патентная заявка РФ 2000124295), плазмидные мутанты, описанные в патенте Германии DE 3127361, плазмидные мутанты, описанные у Bloom F.R. et al (The 15th Miami winter symposium, 1983, p.34), и подобные им.
Бактерия-продуцент L-аргинина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-аргинина, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е. coli 237 (ВКПМ В-7925) и его производные, содержащие мутантную N-ацетилглутаматсинтазу (патентная заявка РФ 2001112869), штамм Е. coli 382 (ВКПМ В-7926) (Европейская патентная заявка ЕР 1170358 А1), штамм-продуцент аргинина, в который введен ген argA, кодирующий N-ацетилглутаматсинтетазу (Европейская патентная заявка ЕР1170361А1), и подобные им.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-аргинина, также включают в себя штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-аргинина. Примеры таких генов включают гены, кодирующие N-ацетилглутамилфосфатредуктазу (argC), орнитинацетилтрансферазу (argJ), N-ацетилглутаматкиназу (argB), ацетилорнитинтрансаминазу (argD), орнитинкарбамоилтрансферазу (argF), синтетазу аргининсукциниловой кислоты (argG), лиазу аргининсукциниловой кислоты (argH) и карбамоилфосфатсинтетазу (carAB).
Бактерия-продуцент L-валина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-валина, включают в себя бактерии, принадлежащие к роду Escherichia, такие как Н-81 (ВКПМ В-8066), NRRL B-12287 and NRRL В-12288 (патент США 4391907), ВКПМ В-4411 (патент США 5658766), ВКПМ В-7707 (европейская патентная заявка ЕР 1016710 А2) или подобные им.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-валина, включают в себя штаммы, модифицированные с целью сверхэкспрессии оперона ilvGMEDA (патент США 5998178). Желательно удалить область оперона ilvGMEDA, которая необходима для ослабления экспрессии, для того чтобы экспрессия оперона не ослаблялась образующимся L-валином. Далее желательно разрушить в опероне ген ilvA для того, чтобы снизить активность треониндеаминазы.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-валина, также включают в себя мутантные штаммы, имеющие мутацию аминоацил-тРНК-синтетазы (патент США 5658766). Например, может использоваться штамм E. coli VL1970, который имеет мутацию в гене ileS, кодирующем изолейцин-тРНК-синтетазу. Штамм E. coli VL1970 депонирован в Российской Национальной Коллекции Промышленных Микроорганизмов (ВКПМ) (Россия, 117545, Москва, 1-й Дорожный проезд, 1) 24 июня 1988 г. с инвентарным номером ВКПМ В-4411.
Далее, в качестве родительских штаммов также могут использоваться мутантные штаммы, для роста которых требуется липоевая кислота, и/или с недостаточным количеством Н+-АТФазы (заявка РСТ WO 96/06926).
Бактерия-продуцент L-изолейцина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-изолейцина, включают в себя, но не ограничиваются ими, мутантные штаммы с устойчивостью к 6-диметиламинопурину (заявка Японии 5-304969 А), мутантные штаммы с устойчивостью к аналогу изолейцина, такому как тиаизолейцин и гидроксамат изолейцина, и мутантные штаммы, дополнительно имеющие устойчивость к DL-этионину и/или гидроксамату аргинина (заявка Японии 5-130882А). Кроме того, в качестве родительских штаммов также могут использоваться рекомбинантные штаммы, трансформированные генами, кодирующими белки, вовлеченные в биосинтез L-изолейцина, такие как треониндеаминаза и ацетогидроксатсинтаза (заявка Японии 2-458А, патент Франции 0356739 и патент США 5998178).
2. Способ согласно настоящему изобретению
Способом является способ получения L-аминокислоты, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью получения продукции и накопления L-аминокислоты в питательной среде и выделения L-аминокислоты из культуральной жидкости.
Выращивание, выделение и очистка L-аминокислоты из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием бактерии.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. Этанол используется в качестве источника углерода. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин и дрожжевой экстракт.
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°C, предпочтительно в пределах от 30 до 38°C. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем L-аминокислота может быть выделена и очищена методами ионообменной хроматографии, концентрирования и/или кристаллизации.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1. Усиленная экспрессия гена c0011 и генов локуса d0663-c09478.
1-1. Клонирование гена с0011 из штамма Р. ananatis SC17.
Фрагмент ДНК, содержащий примерно 300 п.н. до и 200 п.н. после открытой рамки считывания с0011, был получен методом ПЦР с геномной ДНК штамма Р. ananatis SC17 и праймерами P1 (SEQ ID NO: 7) и Р2 (SEQ ID NO: 8), с использованием ДНК-полимеразы PrimeSTAR (Takara Bio Inc.) (5 сек при 98°C, 10 сек при 55°C, 4 мин при 72°C - 30 циклов после 5 мин при 94°C). Полученный 1.4 т.п.н. Фрагмент ДНК был клонирован в плазмиду pSTV29 (Takara Bio Inc.) по BamHI сайтам, сконструированным на 5'-конце каждого праймера, полученная в результате плазмида pSTV-c0011PF содержала ген с0011, ориентированный в том же направлении, что и lacZ-промотор плазмиды pSTV29.
1-2. Клонирование генов локуса d0663-c09478 из штамма Р. ananatis SC17.
Фрагмент ДНК, содержащий приблизительно от 200 п.н. после открытой рамки считывания d0663 до 200 п.н. после открытой рамки считывания с09478, был получен методом ПЦР с геномной ДНК штамма Р. ananatis SC17 и праймерами P3 (SEQ ID NO: 9) и P4 (SEQ ID NO: 10), с использованием ДНК-полимеразы PrimeSTAR (Takara Bio Inc.) (5 сек при 98°C, 10 сек при 55°C, 3 мин при 72°C - 30 циклов после 5 мин при 94°C). Полученный 2,6 т.п.н. фрагмент ДНК был клонирован в pSTV29 (Takara Bio Inc.) по BamHI сайтам, сконструированным на 5'-конце каждого праймера, полученная в результате плазмида pSTV-PA36ccd содержала ген с09478, ориентированный в том же направлении, что и lacZ-промотор в pSTV29.
1-3. Влияние c0011 и d0663-c09478 на устойчивость к цистеину.
Для того чтобы оценить влияние гена с0011 и локуса генов, содержащего два гена d0663 и с09478, на устойчивость к цистеину, в штамм Е. coli MG1655 (АТСС47076) были введены плазмиды pSTV-c0011PF и pSTV-PA36ccd, и соответствующий вектор pSTV29 в качестве контроля, каждый трансформант выращивался на минимальной среде М9 (Sambrook et al., Molecular cloning, 3rd edition, 2001 Cold Spring Harbor Laboratory Press), содержащей токсичную концентрацию цистеина. Каждую ночную культуру, выращенную при 34°C в пробирках, содержащих 3 мл минимальной среды М9 с добавлением 0.4% глюкозы (среда M9Glc), разводили в соотношении 1:100 в свежей среде М901с, содержащей 50 мкМ цистеина в 3 мл, и выращивали в течение ночи при 34°C в пробирках с перемешиванием. Затем клетки пересевали в 4 мл свежей среды M9Glc в пробирки, содержащие 0 и 200 µM цистеина до начальной оптической OD660, равной 0.007. OD660 нм измерялась автоматически в инкубаторе TN-1506 (Advantec Toyo, Tokyo, Japan). Для поддержания плазмид в среду добавляли 25 мг/л хлорамфеникола. Полученные кривые роста представлены на Фиг.1. Как видно из Фиг.1, штаммы, несущие плазмиду pSTV-c0011PF и pSTV-PA36ccd, росли быстрее в присутствии 200 µМ цистеина, чем контрольный штамм, несущий вектор pSTV29, эти данные свидетельствуют о том, что указанные ген/локус генов придают устойчивость к цистеину. Такие результаты, вероятно, могут быть объяснены выведением цистеина за счет c0011 и d0663, при котором токсичные эффекты межклеточного цистеина ослаблены, поскольку предсказание вторичной структуры указанных белков дает основания предполагать, что они обладают множественными трансмембранными спиралями, которые типичны для транспортеров, способных транспортировать мелкие молекулы через мембрану.
Пример 2. Влияние c0011 на ферментативную продукцию цистеина.
2-1. Конструкция плазмиды для избыточной экспрессии c0011.
Для избыточной экспрессии c0011 были использованы два типа экспрессионных плазмид с разной силой промотора - плазмиды pMIV-Pnlp0 и pNIV-Pnlp23. Указанные плазмиды содержали сильный промотор nlp0 (или nlp23 промотор) и rrnB терминатор так, чтобы гены-мишени могли быть клонированы между этими элементами, формируя единицу экспрессии. Промотор "Pnlp0" (SEQ ID NO: 11) был получен из промотора гена nlpD из Е. coli K-12, промоторы "Pnlp23" (SEQ ID NO: 12) и"Pnlp8" (SEQ ID NO: 13) (см. далее для дополнительных сведений) являются вариантами с различной силой промоторной активности. Полная схема конструкции экспрессионных плазмид описана ниже (см. Справочный пример 1), как конструкция плазмиды pMIV-Pnlp0-YeaS3, в которой ген yeaS из штамма Е. coli K-12 клонирован между nlp0-промотором и rrnB-терминатором по уникальным сайтам рестрикции SalI и XbaI, сконструированным в начале и в конце открытой рамки считывания соответственно. Для того чтобы получить экспрессионную плазмиду для гена с0011 на основе плазмиды pMIV-Pnlp0, может быть использована аналогичная конструкция с сайтами SalI и XbaI для замены гена yeaS в pMIV-Pnlp0-YeaS3 на ген c0011, так что в итоге получится pMIV-Pnlp0-c0011. Также pMIV-Pnlp23-c0011 может быть получена с помощью аналогичного подхода с использованием SalI и XbaI в силу того, что базовые структуры двух этих плазмид исключают наличие каких-либо нуклеотидных замен в промоторном районе.
ДНК-фрагмент, содержащий открытую рамку считывания c0011, был получен методом ПЦР с геномной ДНК штамма Р. ananatis SC17 и праймерами Р5 (SEQ ID NO: 14) и Р6 (SEQ ID NO: 15), с использованием ДНК-полимеразы PrimeSTAR (Takara Bio Inc.) (5 сек при 98°C, 5 сек при 55°C, 90 сек при 72°C - 30 циклов после 5 мин при 94°C). Полученный фрагмент ДНК был клонирован в pMIV-Pnlp0 и pMIV-Pnlp23 по сайтам SalI и XbaI, сконструированным на 5'-конце каждого праймера, для получения плазмид pMIV-Pnlp0-c0011 и pMIV-Pnlp23-c0011 соответственно. В качестве контрольного пустого вектора в соответствии со стандартной методикой использовалась плазмида pMIV-5JS (заявка Японии JP2008-99668).
2-2. Конструирование штамма-продуцента цистеина.
Чтобы получить штаммы Е. coli и Р. ananatis, способные к ферментативному производству цистеина, была сконструирована плазмида, несущая ген cysEX, который кодирует мутантную устойчивую к регуляции по типу обратной связи О-ацетил-L-сульфгидрилазу (US 20050112731 A1), являющуюся ключевым фактором для производства цистеина. Для этого в качестве исходного материала была использована плазмида pACYC-DE1, содержащая гены cysEX wydeD (US 5972663 A). Конструкция pACYC-DE1 описана в патентной заявке Японии JP2005-137369 как конструкция pACYC-DES (данная плазмида содержит три гена cysEX, ydeD и serA5 (US 6180373)), исключение этапа клонирования serAS в плазмиду приводит к получению плазмиды, содержащей только cysEX и ydeD гены. Затем pACYC-DE1 была обработана рестриктазой MluI и подвергалась самолигированию с целью удаления 330 п.н. района внутри открытой рамки считывания ydeD, в результате была получена pACYC-E1. Таким образом, введение плазмиды pACYC-E1, содержащей только cysEX, приводило к получению самого простого штамма-продуцента цистеина. Штаммы Е. coli MG1655 и Р. ananatis SC17 были трансформированы плазмидой pACYC-E1 с целью получения штаммов MG1655/pACYC-E1 и SC17/pACYC-E1 соответственно, которые использовались в качестве базовых штаммов-продуцентов для ферментативной продукции цистеина.
2-3. Эффект c0011 на продукцию цистеина в Е. coli
Чтобы оценить влияние усиленной экспрессии c0011 на продукцию цистеина, в штамм-продуцент цистеина MG1655/pACYC-E1 были введены pMIV-Pnlp0-c0011, pMIV-Pnlp23-c0011 и pMIV-5JS (контроль). Продуктивность полученных штаммов исследовали в сравнительных экспериментах по их способности к ферментативной продукции цистеина. Компоненты среды для экспериментов по ферментации приведены ниже. Состав среды для ферментации был следующим (конечная концентрация):
Компонент 1:
Компонент 2:
Компонент 3:
Компонент 4:
Компонент 5:
Компонент 6:
Компонент 7:
Компонент 8:
Каждый компонент готовился как концентрированный раствор 10х (компонент 1), 1000х (компонент 2), 100/6х (компонент 3), 100х (компонент 5), 350/4х (компонент 6), 1000x(компонент 7) и 10x (компонент 8) соответственно. Условия стерилизации: автоклавирование при 110°C в течение 30 минут (компоненты 1, 2, 3, 5 и 8), стерилизация сухим жаром при 180°C более 5 часов (компонент 4) и стерилизация фильтрацией (компоненты 6 и 7).
Ферментацию проводили следующим образом. Каждый штамм-продуцент (MG1655/pACYC-E1), содержащий pMIV-Pnlp0-c0011, pMIV-Pnlp23-c0011 и pMIV-5JS высевался штрихом на LB чашку и выращивался при 34°C в течение ночи. Брали полную петлю клеток (клетки снимали с 7 см поверхности полностью выросшей плашечной культуры, используя 10-микролитровую петлю (blue loop NUNC)) и высевали в 2 мл среды для ферментации в пробирки (внутренний диаметр 23 мм; все пробирки имели длину 200 мм) для инициации культивирования. Культивирование с перемешиванием проводили при 32°C и затем останавливали, когда весь сахар был израсходован (от 21 до 24 часов в зависимости от образцов). Количество произведенных в жидкой среде производных цистеина измеряли стандартным методом, описанным Gaitonde, M.K. (Biochem J.; 104(2):627-33(1967)). Для поддержания плазмид в течение культивирования в среду добавляли 25 мг/л хлорамфеникола и 20 мг/л тетрациклина.
Количество производных цистеина и выход относительно израсходованного сахара с соответствующими значениями стандартных отклонений (четыре независимые пробирочные ферментации) представлены в Таблице 1. Как видно из Таблицы 1, усиленная экспрессия c0011 приводит к увеличению продукции цистеина в Е. coli, которая, вероятно, обусловлена способностью белка С0011 экскретировать цистеин.
2-4. Влияние c0011 на продукцию цистеина в Р. ananatis.
Чтобы оценить влияние усиленной экспрессии c0011 на продукцию цистеина Р. ananatis, в штамм-продуцент цистеина SC17/pACYC-El были введены pMIV-Pnlp0-с0011, pMIV-Pnlp23-c0011 и pMIV-5JS (контроль). Культивирование осуществлялось, как описано в эксперименте для Е. coli, за исключением времени культивирования, которое составило 18 часов. Количество производных цистеина и выход относительно израсходованного сахара с соответствующими значениями стандартных отклонений для данных по каждому штамму (четыре независимые пробирочные ферментации) представлены в Таблице 2. Как видно из Таблицы 2, усиленная экспрессия c0011 приводит к увеличению продукции цистеина в Р. ananatis.
Пример 3. Влияние c0011 на ферментативную продукцию аминокислот.
3-1. Влияние c0011 на продукцию аминокислот в E. coli
Чтобы оценить влияние усиленной экспрессии c0011 на продукцию других отличных от цистеина аминокислот, в штамм MG1655 были введены pMIV-Pnlp0-с0011, pMIV-Pnlp23-c0011 и pMIV-5JS (контроль). Продуктивность полученных штаммов исследовали в сравнительных экспериментах по способности к ферментативной продукции аминокислот. Культивирование осуществлялось, как описано в эксперименте для продукции цистеина Е. coli, за исключением времени культивирования, которое составило 19-24.5 часов. Для поддержания плазмид в течение культивирования в среду добавляли 25 мг/л хлорамфеникола. Количественный анализ продуцируемых аминокислот в культуральной жидкости проводили с использованием Amino Acid Analyzer L-8900 (HITACHI). Количество аминокислот с соответствующими стандартными отклонениями для данных по каждому штамму (четыре независимые пробирочные ферментации) представлены в Таблице 3. Как видно из Таблицы 3, усиленная экспрессия c0011 приводит к увеличению продукции валина, лейцина, изолейцина, треонина, аланина, глутамата, гистидина и глицина в Е. coli.
3-2. Влияние c0011 на продукцию аминокислот в Р. ananatis
Чтобы оценить влияние усиленной экспрессии c0011 на продукцию других, отличных от цистеина аминокислот, в штамм SC17 были введены pMIV-Pnlp0-с0011, pMIV-Pnlp23-c0011 и pMIV-5JS (контроль). Продуктивность полученных штаммов исследовали в сравнительных экспериментах по их способности к ферментативной продукции аминокислот. Культивирование осуществлялось, как описано в эксперименте для продукции цистеина в Е. coli, за исключением начальной концентрации, составлявшей 60 г/л, и времени культивирования, которое составило 16 часов. Для поддержания плазмид в течение культивирования в среду добавляли 25 мг/л хлорамфеникола. Количественный анализ продуцируемых аминокислот в культуральной жидкости проводили с использованием Amino Acid Analyzer L-8900 (HITACHI). Количество аминокислот с соответствующими значениями стандартных отклонений для данных по каждому штамму (четыре независимые пробирочные ферментации) представлены в Таблице 4. Как видно из Таблицы 4, усиленная экспрессия c0011 приводит к увеличению продукции валина, лейцина, изолейцина в Р. ananatis, результаты по продукции этих аминокислот аналогичны и для Е. coli.
Пример 4. Влияние d0663 и d0663-c09478 локуса на ферментативную продукцию цистеина
4-1. Конструкция плазмиды для усиленной экспрессии d0663 и d0663-c09478 локуса
Фрагмент ДНК, содержащий приблизительно от 200 п.н. после открытой рамки считывания d0663 до 200 п.н. после открытой рамки считывания с09478, был получен с помощью ПЦР с геномной ДНК штамма Р. ananatis SC17 и праймерами Р3 и Р4 с использованием ДНК-полимеразы PrimeSTAR DNA (Takara Bio Inc.) (5 сек при 98°C, 10 сек при 55°C, 3 мин при 72°C - 30 циклов после 5 мин при 94°C). Фрагмент ДНК, содержащий около 300 п.н. до и 200 п.н. после открытой рамки считывания d0663, был получен с помощью ПЦР с геномной ДНК штамма Р. ananatis SC17 и праймерами Р3 и Р7 (SEQ ID NO: 16) с использованием ДНК-полимеразы PrimeSTAR DNA (Takara Bio Inc.) (5 сек при 98°C, 10 сек при 55°C, 3 мин при 72°C - 30 циклов после 5 мин при 94°C). Полученный 2.6 т.п.н. фрагмент ДНК, содержащий открытые рамки считывания d0663 и с09478, и 1.1 т.п.н. фрагмент, содержащий открытую рамку считывания d0663, были клонированы в pACYC177 (NIPPON GENE CO., LTD., Tokyo, Japan) по BamHI. сайтам, сконструированным на 5'-конце каждого праймера, чтобы получить плазмиды pACYC-PA36ccd и pACYC-d0663F соответственно, в которых с09478 в pACYC-PA36ccd и d0663 в pACYC-d0663F соответственно, были ориентированы в том же направлении, что и ген Kmr в плазмиде pACYC177.
Кроме того, для d0663 была сконструирована экспрессионная плазмида на основе pMIV-Pnlp8 (см. Пример 2-1 и Пример 4-2). Фрагмент ДНК, содержащий открытую рамку считывания гена d0663, был получен методом ПЦР с геномной ДНК штамма Р. ananatis SC17 и праймерами Р8 (SEQ ID NO: 17) и Р9 (SEQ ID NO: 18), с использованием ДНК-полимеразы PrimeSTAR DNA (Takara Bio Inc.) (5 сек при 98°C, 5 сек при 55°C, 90 сек при 72°C - 30 циклов после 5 мин при 94°C). Для конструирования плазмиды pMIV-Pnlp8-d0663, полученный фрагмент ДНК был клонирован в pMIV-Pnlp8 по сайтам SalI и XbaI, сконструированным на 5'-конце каждого праймера. В ходе эксперимента были получены два варианта клонов из pMIV-Pnlp8-d0663, которые придавали Е. coli более высокую степень устойчивости к цистеину (см. Пример 1 для устойчивости к цистеину), чем первоначально сконструированная pMIV-Pnlp8-d0663. Согласно секвенированию плазмид мутации были расположены не в открытой рамке считывания d0663 непосредственно, а за несколько нуклеотидов до инициирующего кодона d0663, что повышает вероятность трансляционных изменений, приводящих к увеличению уровня экспрессии. Замена основания одного мутанта представляла собой C(-3)G (3-й нуклеотид "G" перед стартовым кодоном был заменен "С"), а другого - С(-4)А; эти варианты плазмид были названы pMIV-Pnlp8-d0663(-3) и pMIV-Pnlp8-d0663(-4) соответственно и использовались как высокоактивные экспрессионные плазмиды d0663. Указанные мутанты могут быть сконструированы хорошо известным методом сайт-направленного мутагенеза с использованием также и pMIV-Pnlp8-d0663 в качестве исходного материала. В качестве контрольного пустого вектора в соответствии со стандартной методикой использовалась плазмида pMIV-5JS (заявка Японии JP2008-99668).
4-2. Конструирование штаммов-продуцентов цистеина
MG1655/pACYC-E1, описанный в Примере 2-2, использовался как штамм Е. coli, способный к ферментативной продукции цистеина.
В качестве штаммов-продуцентов цистеина Р. ananatis были сконструированы SC17/pMIV-CysE5 и EYPSGint1M2. Полная схема конструкции описана ниже.
Плазмида pMIV-CysE5 содержит мутантный аллель устойчивой к регуляции по типу обратной связи О-ацетил-L-серин сульфигидрилазы (US 20050112731 A1), кодируемый cysES, являющийся ключевым фактором для производства цистеин. Фрагмент ДНК, содержащий аллель cysES был получен методом ПЦР с pMW-PompC-cysE5 (EP 1650296 A1) в качестве матрицы и праймерами Р10 (SEQ ID NO: 19) и P11 (SEQ ID NO: 20) (30 сек при 94°C, 30 сек при 57°C, I мин при 72°C - 27 циклов и затем 7 мин при 72°C). Полученный 0.7 т.п.н. фрагмент ДНК, содержащий cysES, был клонирован в pMIV-PompC по сайтам SalI и XbaI, сконструированным на 5'-конце каждого праймера, для получения плазмиды pMIV-CysE5. Плазмида pMIV-PompC была сконструирована с помощью клонирования 0.3 т.п.н. фрагмента, содержащего промоторный район гена ompC из Е. coli K-12 в pMIV-5JS (JP2008-99668) по сайтам SalI и PaeI, который был получен методом ПЦР с геномной ДНК Е. coli MG1655 и праймерами Р12 (SEQ ID NO: 21) и Р13 (SEQ ID NO: 22) и обработан рестриктазами SalI и PaeI перед лигированием. pMIV-CysE5 была введена в Р. ananatis SC17 для получения штамма-продуцента цистеина SC17/ pMIV-CysE5.
Конструкция штамма EYPSGint1M2 описана в Справочном примере 1.
4-3. Влияние d0663 на продукцию цистеина Е. coli
Чтобы оценить влияние усиленной экспрессии d0663 на продукцию цистеина, в штамм-продуцент цистеина MG1655/pACYC-E1 были введены pMIV-Pnlp8-d0663(-3), pMIV-Pnlp8-d0663(-4) и pMIV-5JS (контроль). Продуктивность полученных штаммов исследовали в сравнительных экспериментах по их способности к ферментативной продукции цистеина. Культивирование осуществлялось, как описано в эксперименте с c0011 в Е. coli (см. Пример 2-3) за исключением времени культивирования, которое составляло 19 часов. Для поддержания плазмид в течение культивирования в среду добавляли 25 мг/л хлорамфеникола и 20 мг/л тетрациклина. Количество производных цистеина и выход относительно израсходованного сахара с соответствующими значениями стандартных отклонений для данных по каждому штамму (четыре независимые пробирочные ферментации) представлены в Таблице 5. Как видно из Таблицы 5, усиленная экспрессия d0663 приводит к увеличению продукции цистеина в Е. coli.
4-4. Влияние d0663 и локуса d0663-c09478 на продукцию цистеина в Р. ananatis
Чтобы оценить влияние усиленной экспрессии d0663 и локуса d0663-c09478 на продукцию цистеина, в штамм-продуцент цистеина SC17/pMIV-CysE5 были введены pACYC-d0663F, pACYC-PA36ccd (содержит 2 открытые рамки считывания d0663 и с09478) и pACYC177 (контроль). Продуктивность полученных штаммов исследовали в сравнительных экспериментах по их способности к ферментативной продукции цистеина. Культивирование осуществлялось, как описано в эксперименте с c0011 в Е. coli (см. Пример 2-3), за исключением начальной концентрации, составлявшей 60 г/л, и времени культивирования, составлявшего 16-20 часов. Для поддержания плазмид в течение культивирования в среду добавляли 25 мг/л хлорамфеникола и 20 мг/л канамицина. Количество производных цистеина и выход относительно израсходованного сахара с соответствующими значениями стандартных отклонений для данных по каждому штамму (четыре независимые пробирочные ферментации) представлены в Таблице 6. Как видно из Таблицы 6, усиленная экспрессия d0663 приводит к увеличению продукции цистеина в Р. ananatis. Было обнаружено, что добавление с09478 усиливает эффект d0663, pACYC-PA36ccd характеризуется удвоенной продукцией цистеина по сравнению с продукцией pACYC-d0663F.
Такие же эксперименты были выполнены с EYPSGint1M2 в качестве штамма-продуцента цистеина. Таким же образом были введены плазмиды pACYC-d0663F, pACYC-PA36ccd (содержит две открытые рамки считывания, d0663 и с09478) и pACYC177 (контроль), и продуктивность полученных штаммов исследовали, как описано в экспериментах по продукции цистеина с c0011 в Е. coli (см. Пример 2-3). Для поддержания плазмид в течение культивирования в среду добавляли 20 мг/л канамицина. Количество производных цистеина и выход относительно израсходованного сахара с соответствующими значениями стандартных отклонений для данных по каждому штамму (четыре независимые пробирочные ферментации) представлены в Таблице 7. Как видно из Таблицы 7, усиленная экспрессия d0663 приводит к увеличению продукции цистеина в Р. ananatis, которая увеличивалсь еще сильнее при добавлении с09478.
Пример 5. Влияние d0663 на ферментативную продукцию аминокислот
5-1. Влияние d0663 на продукцию аминокислот в Р. ananatis
Чтобы оценить влияние усиленной экспрессии d0663 на продукцию аминокислот, в штамм Р. ananatis SC17 были введены pMIV-Pnlp8-d0663(-3), pMIV-Pnlp8-d0663(-4) и pMIV-5JS (контроль). Продуктивность полученных штаммов исследовали в сравнительных экспериментах по их способности к ферментативной продукции аминокислот. Культивирование осуществлялось, как описано в эксперименте для продукции цистеина с c0011 в Е. coli (см. Пример 2-3), за исключением начальной концентрации глюкозы, составлявшей 60 г/л, и времени культивирования, которое составило 18 часов. Для поддержания плазмид в течение культивирования в среду добавляли 25 мг/л хлорамфеникола. Количественный анализ продуцируемых аминокислот в культуральной жидкости проводили с использованием Amino Acid Analyzer L-8900 (HITACHI). Количество аминокислот с соответствующими значениями стандартных отклонений для данных по каждому штамму (четыре независимые пробирочные ферментации) представлены в Таблице 8. Как видно из Таблицы 8, усиленная экспрессия d0663 приводит к увеличению продукции валина, лейцина, изолейцина и треонина.
Пример 6. Влияние предполагаемых Cys-экспортеров на ферментативную продукцию L-валина в Е. coli
6-1. Влияние d0663(-4) на продукцию L-валина в Е. coli
Чтобы оценить влияние усиленной экспрессии d0663(-4) на продукцию валина, в штамм-продуцент валина Н81 были введены pMIV-Pnlp8-d0663 (-4) и pMIV-5JS (контроль). Продуктивность полученных штаммов исследовали в сравнительных экспериментах по их способности к ферментативной продукции L-валина. Клетки из пробирок для длительного хранения (хранившиеся в 25% глицероле, 0.9% NaCl при -70°C) высевались на L-агар (дрожжевой экстракт - 5 г/л, пептон - 10 г/л, NaCl - 5 г/л, агар - 15 г/л). Для штаммов с плазмидой в L-агар добавляли соответствующий антибиотик (Ар - 100 мг/л, Km - 40 мг/л). Клетки, собранные примерно с 0.5 см2 поверхности чашки, высевали на среду для ферментации (2 мл) и выращивали при 32°C в течение 72 часов. Состав среды для ферментации был следующим: сахароза - 60 г/л, (NH4)2SO4 - 15 г/л, KH2PO4 - 1.5 г/л, MgSO4 - 1 г/л, тиамин - 0.1 г/л, Mameno (TN) - 0.4 г/л, СаСО3 - 25 г/л, рН 7.0 (KOH), соответствующие антибиотики (Km 50 мг/л; Ар 100 мг/л) добавлялись в среду.
Количественный анализ продуцируемого валина в культуральной жидкости проводили с использованием Amino Acid Analyzer L-8900 (HITACHI). Количество валина с соответствующими значениями стандартных отклонений для данных по каждому штамму (четыре независимые пробирочные ферментации) представлены в Таблице 9. Как видно из Таблицы 9, усиленная экспрессия d0663(-4) приводит к увеличению продукции L-валина в Е. coli.
6-2. Влияние c0011 на продукцию L-валина в Е. coli
Чтобы оценить влияние усиленной экспрессии c0011 на продукцию L-валина, в штамм-продуцент валина Н81 была введена плазмида pMIV-Pnlp23-c0011. Продуктивность полученного штамма вместе с родительским штаммом Н81 исследовали в сравнительных экспериментах по их способности к ферментативной продукции L-валина с использованием культивирования с добавлением субстрата (fed-batch) в ферментерах Marubishi.
Клетки высевали на L-arap (дрожжевой экстракт - 5 г/л, пептон- 10 г/л, NaCl - 5 г/л, агар - 15 г/л). Для штамма с плазмидой в L-агар добавляли подходящий антибиотик (Ар - 100 мг/л, Km - 40 мг/л). Клетки, собранные примерно с 0.5 см2 поверхности чашки, высевали в L-бульон (триптон - 10 г/л, дрожжевой экстракт - 5 г/л, NaCl - 5 г/л) (60 мл) и выращивали при 37°C в течение 20 часов при 240 об/мин. Затем 40 мл посевной культуры переносили в 360 мл среды для ферментации в jar-ферментеры и культивировали при 37°C в течение 20 часов сначала с перемешиванием при 1200 об/мин, а после 18 часов культивирования - при 900 об/мин.
Состав ферментационной среды был следующим: глюкоза - 30 г/л, MgSO4 7H2O - 0.4 г/л, Mameno (TN) - 0.4 г/л, (NH4)2SO4 - 5.0 г/л, KH2PO4 - 3.0 г/л, FeSO4 7Н2О - 0.02 г/л, MnSO4 5H2O - 0.02 г/л, тиамин - 0.4 мг/л, пеногаситель - 0.1 мг/л, рН 6.6 (KOH). Смесь для подпитки (глюкоза - 140g, Н2О - 100 мл, концентрированный нашатырный спирт - 53 мл) добавлялись автоматически для поддержания рН, равным 6.6.
Данные по продукции валина представлены в Таблице 10. Как видно из Таблицы 10, усиленная экспрессия c0011 увеличивает продукцию валина в Е. coli.
Пример 7. Влияние d0663 на продукцию О-ацетил-L-серина в Е. coli
Чтобы оценить влияние усиленной экспрессии d0663 на продукцию О-ацетил-L-серина, в штамм-продуцент цистеина MG1655/pACYC-E1 были введены плазмиды pMIV-Pnlp8-d0663(-3) и pMIV-5JS (контроль). Поскольку штамм MG1655/pACYC-E1 содержал плазмиду с устойчивым к ингибированию по типу обратной связи мутантным CysE, указанный штамм был пригоден для продукции О-ацетил-L-серина. Продуктивность полученных штаммов исследовали в сравнительных экспериментах по их способности к ферментативной продукции О-ацетил-L-серина. Культивирование осуществлялось, как описано в эксперименте для продукции цистеина с c0011 в Е. coli (см. Пример 2), за исключением времени культивирования, которое составляло 26 часов. Для поддержания плазмид в течение культивирования в среду добавляли 25 мг/л хлорамфеникола и 12.5 мг/л тетрациклина. Чтобы конвертировать полученный О-ацетил-L-серин в N-ацетилсерин (NAS) при щелочном рН, образцы разводили 200 мМ Tris/HCl (pH 9.0). Полученный NAS анализировали с помощью ВЭЖХ. Условия для HPLC были следующими: колонка: Inertsil ODS-3 (GL science), скорость потока: 1.0 мл/мин, температура колонки: 40°C, детектор: UV210MM, объем образца: 10:1, буфер: 0.1М K2PO4-H3PO4 (рН 2.2) 5 мМ 1-октансульфоната натрия. Количество О-ацетил-L-серина и выход относительно израсходованного сахара с соответствующими значениями стандартных отклонений для трех экспериментов по каждому штамму представлены в Таблице 11. Полученные данные позволяют предположить, что усиленной экспрессия d0663 увеличивает продукцию О-ацетил-L-серина в Е. coli.
Пример 8. Влияние c0011 на продукцию О-ацетил-L-серина в Е. coli
Чтобы оценить влияние усиленной экспрессии c0011 на продукцию О-ацетил-L-серина, в штамм-продуцент цистеина/О-ацетил-L-серина MG1655/pACYC-E1 были введены плазмиды pMIV-Pnlp23-c0011 и pMIV-5JS (контроль). Культивирование и анализ осуществлялись, как описано в эксперименте для продукции О-ацетил-L-серина штаммом, в котором усилена экспрессия d0663 (см. Пример 7). Продуктивность полученных штаммов исследовали в сравнительных экспериментах по их способности к ферментативной продукции О-ацетил-L-серина. Количество О-ацетил-L-серина и выход относительно израсходованного сахара с соответствующими значениями стандартных отклонений для трех экспериментов по каждому штамму представлены в Таблице 12. Полученные данные позволяют предположить, что усиленная экспрессия c0011 увеличивает продукцию O-ацетил-L-серина в Е. coli.
Справочный пример 1. Конструирование штамма с усиленной экспрессией гена cysM
1. Конструирование штамма Р. ananatis EYPS 1976(s)
Фрагмент ДНК, содержащий промотор гена nlpD из Е. coli, был получен методом ПЦР. Для ПЦР использовали хромосомную ДНК из штамма Е. coli MG1655(ATCC 700926) в качестве матрицы и праймеры Р14 (SEQ ID No:23) и P15 (SEQ ID No:24). Праймер P14 (SEQ ID No:23) содержал сайт для рестриктазы SalI на 5'-конце. Праймер P15 (SEQ ID No:24) содержал сайт для рестриктазы PaeI на 5'-конце. Условия для ПЦР были следующими: денатурация 3 мин при 95°C; условия для 20 первых циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для 25 последующих циклов: 20 сек при 94°C, 20 сек при 55°C, 15 сек при 72°C; финальная элонгация: 5 мин при 72°C. Амплифицированный фрагмент длиной около 0,2 т.п.н. очищали с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывался эндонуклеазами PaeI и SalI. Полученный ДНК-фрагмент лигировался с плазмидой pMIV-5JS (конструкция плазмиды pMIV-5JS описана в Европейском патенте ЕР 1942183 В1), предварительно обработанной эндонуклеазами PaeI и SalI. Смесь для лигирования инкубировали при 4°C в течение ночи и затем использовали для трансформации штамма Е. coli MG1655 методом элетропорации. Трансформанты высевались на LB-агар с ампициллином (50 мг/л), чашки инкубировали при 37°C в течение ночи до образования различимых индивидуальных колоний. Плазмиды выделяли из полученных трансформантов и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала промотор гена nlpD E. coli и была названа pMIV-Pnlp0.
Фрагмент ДНК, содержащий терминатор гена rrnB из E. coli, был получен с помощью ПЦР. Для ПЦР использовали хромосомную ДНК из штамма E. coli MG1655 в качестве матрицы и праймеры Р16 (SEQ ID No:25) и P17 (SEQ ID No:26). Праймер P16 (SEQ ID No:25) содержал сайт для рестриктазы XbaI на 5'-конце. Праймер Р17 (SEQ ID No:26) содержал сайт для рестриктазы BamHI на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 25 циклов: 20 сек при 94°C, 20 сек при 59°C, 15 сек при 72°C; финальная элонгация: 5 мин при 72°C. Амплифицированный фрагмент длиной около 0,3 т.п.н. очищали с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывался эндонуклеазами BamHI и XbaI. Полученный ДНК-фрагмент лигировали с плазмидой pMIV-Pnlp0, предварительно обработанной эндонуклеазами BamHI и XbaI. Смесь для лигирования инкубировали в течение ночи при 4°C и затем использовали для трансформации штамма E. coli MG1655 методом электропорации. Полученные трансформанты высевались на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°C до образования различимых индивидуальных колоний. Плазмиды выделяли из полученных трансформантов и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала терминатор гена rrnB E. coli и была названа pMIV-Pnlp0-ter.
Фрагмент ДНК, содержащий ген yeaS из E. coli, был получен с помощью ПЦР. Для ПЦР использовались хромосомная ДНК штамма E. coli MG1655 в качестве матрицы и праймеры Р18 (SEQ ID No:27) и P19 (SEQ ID No:28). Праймер P18 (SEQ ID No:27) содержал сайт для рестриктазы SalI на 5'-конце Праймер Р19 (SEQ ID No:28) содержал сайт для рестриктазы XbaI на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 25 циклов: 20 сек при 94°C, 20 сек при 55°C, 15 сек при 72°C; финальная элонгация: 5 мин при 72°C. Амплифицированный ДНК-фрагмент длиной около 0,7 т.п.н. очищался с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывался эндонуклеазами SalI и XbaI. Полученный ДНК-фрагмент лигировали с плазмидой pMIV-Pnlp0-ter, предварительно обработанной эндонуклеазами SalI и XbaI. Смесь для лигирования инкубировали в течение ночи при 4°C и затем использовали для трансформации штамма Е. coli MG1655 методом электропорации. Полученные трансформанты высевались на LB-агар, содержащий ампициллин (50 мг/л), чашки инкубировали в течение ночи при 37°C до образования различимых индивидуальных колоний. Плазмиды выделяли из полученных трансформантов и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала ген yeaS из Е. coli и была названа pMIV-Pnlp0-yeaS3.
Затем была выполнена рандомизация района -10 промотора Pnlp и отбор промотора Pnlp8. 3'-конец промотора Pnlp был получен с помощью ПЦР-амплификации. Для ПЦР использовали плазмиду pMIV-Pnlp0 в качестве матрицы и праймеры Р14 (SEQ ID No:23) и Р20 (SEQ ID No:29). Праймер Р20 содержит случайные нуклеотиды, указанные в последовательности SEQ ID NO: 29 обозначением "n" (для А, или G, или С, или Т), и содержит сайт для рестриктазы BglII на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 25 циклов: 20 сек при 94°C, 20 сек при 60°C, 15 сек при 72°C; финальная элонгация: 5 мин при 72°C. 5'-конец промотора Pnlp был получен с помощью ПЦР-амплификации. Для ПЦР использовали плазмиду pMIV-Pnlp0 в качестве матрицы и праймеры Р15 (SEQ ID No:24) и Р21 (SEQ ID No:30). Праймер Р21 содержит случайные нуклеотиды, указанные в последовательности SEQ ID NO: 30 обозначением "n" (для А, или G, или С, или Т), и сайт для рестриктазы BglII на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 25 циклов: 20 сек при 94°C, 20 сек при 60°C, 15 сек при 72°C; финальная элонгация: 5 минут при 72°C. Оба амплифицированных ДНК-фрагмента очищали с помощью агарозного гель-электрофореза. Затем очищенные фрагменты обрабатывали эндонуклеазой BglII с последующим логированием фрагментов в эквимолярном соотношении. Смесь для логирования инкубировали в течение ночи при 4°C и затем использовали в качестве матрицы для следующей реакции ПЦР с праймерами Р14 (SEQ ID No:23) и Р15 (SEQ ID No:24). Условия ПЦР были следующими: денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 12 циклов: 20 сек при 94°C, 20 сек при 60°C, 15 сек при 72°C; финальная элонгация: 5 мин при 72°C.
Амплифицированный фрагмент ДНК имел длину около 0,2 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывался эндонуклеазами PaeI и SalI. После этого полученный фрагмент ДНК лигировали с плазмидой pMIV-Pnlp0-yeaS3, предварительно обработанной эндонуклеазами PaeI и SalI. Смесь для лигирования инкубировали при 4°C в течение ночи и затем использовали для трансформации штамма Е. coli MG1655 методом электропорации. Трансформанты высевали на LB-агар, содержащий ампициллин (50 мг/л), чашки инкубировали при 37°C в течение ночи до образования различимых индивидуальных колоний. Плазмиды выделяли из полученных трансформантов и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала промотор Pnlp8 и была названа pMIV-Pnlp8-yeaS7.
Затем плазмида pMIV-Pnlp8-yeaS7 обрабатывалась эндонуклеазой HindIII с последующей очисткой и добавлением большого фрагмента ДНК-полимеразы I (фрагмент Кленова). Полученный ДНК-фрагмент очищался и обрабатывался эндонуклеазой NcoI.
Полученный после очистки фрагмент ДНК лигировали в эквимолярном соотношении с плазмидой pMT-Pomp-cysE5 (pMT-Pomp-cysE5 была получена из pMIV-Pomp-cysE5 путем клонирования фрагмента XbaI-Eco88I, обработанного фрагментом Кленова, из pACYC-184 (tet-R) по PvuI сайту плазмиды pMIV-Pomp-cysE5; плазмида pMIV-Pomp-cysE5 была получена путем субклонирования фрагмента PaeI+SacI из pMW-Pomp-cysE5 (см. заявку РСТ WO 2005007841),no тем же сайтам плазмиды pMIV-5JS), предварительно обработанной эндонуклеазами SmaI и NcoI. Смесь для лигирования инкубировали при 4°C в течение ночи и затем использовали для трансформации штамма Е. coli MG1655 методом электропорации. Трансформанты высевались на LB-агар, содержащий ампициллин (50 мг/л), чашки инкубировали в течение ночи при 37°C до образования различимых индивидуальных колоний. Плазмиды выделялись из полученных трансформантов и анализировались с помощью рестрикционного анализа. Полученная плазмида содержала ген cysE5 и была названа pMIV-EY2. Для подтверждения исправности cysES аллеля в полученном трансформанте была измерена ферментативная активность серинацетилтрансферазы.
Следующим этапом была интеграция генов cysE5 и yeaS в хромосому штамма Р. ananatis SC17 (патент США 6596517). Плазмида рМН10 (Зименков Д. и др., Биотехнология, 6, 1-22 (2004)) была использована для трансформации штамма Р. ananatis SC17 методом электропорации. Трансформанты высевали на LB-агар, содержащий канамицин (20 мг/л), чашки инкубировали при 30°C в течение ночи до образования различимых индивидуальных колоний. Полученный штамм SC17/pMH10 дважды пересевали. После этого с помощью метода электропорации проводилась трансформация штамма SC17/pMH10 Р. ananatis (этот штамм растет при 30°C) плазмидой pMIV-EY2. Трансформанты подвергали тепловому шоку при высокой температуре (42°C, 20 минут) и высевали на LB-агар, содержащий хлорамфеникол (20 мг/л), чашки инкубировали при 39°C в течение ночи до образования различимых индивидуальных колоний. Около 50 клонов пересевались при 39°C, и каждый из них засевали в 1 мл LA-среды и инкубировали при 39°C в течение 48 часов. После инкубирования все 50 вариантов тестировались на утрату плазмид рМН10 и pMIV-EY2, и отбирались варианты, устойчивые к хлорамфениколу (20 мг/л), но чувствительные к канамицину (20 мг/л) и ампициллину (50 мг/л). Желаемые интегранты были идентифицированы с помощью ПЦР анализа с использованием праймеров Р14 и Р19. Полученные линии штаммов были названы EY01-EY50, все из них были проверены на способность производить цистеин в пробирках для ферментации. Для дальнейших экспериментов был отобран наилучший продуцент-штамм EY19.
Чтобы избавить штамм Р. ananatis EY19 от устойчивости к хлорамфениколу, EY19 был трансформирован плазмидой pMT-Int-Xis2 (WO 2005/010175) методом электропорации. Трансформанты высевали на LB-агар с тетрациклином (10 мг/л), чашки инкубировали в течение ночи при 30°C до образования различимых индивидуальных колоний. Требуемые трансформанты были идентифицированы за счет отбора вариантов, чувствительных к хлорамфениколу (20 мг/л). Такой «вылеченный» штамм был назван EY19(s).
Следующим этапом была замена у штамма EY19(s) промоторного района cysPTWA-генов промоторным районом Pnlp8. ПЦР была выполнена с использованием плазмиды pMIV-Pnlp8-yeaS7 в качестве матрицы и праймеров Р14 and P15. Условия ПЦР были следующими: денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 20 циклов: 20 сек при 94°C, 20 сек при 59°C, 15 сек при 72°C; финальная элонгация: 5 мин при 72°C. Амплифицированный ДНК-фрагмент размером около 0,2 т.п.н. очищали с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывался фрагментом Кленова. После этого полученный ДНК-фрагмент лигировали в эквимолярном соотношении с плазмидой pMW118-(λattL-Kmr-λattR) (EP 2100957 A1), предварительно обработанной эндонуклеазой XbaI и фрагментом Кленова. Смесь для лигирования инкубировали в течение ночи при 4°C и затем использовали для трансформации штамма Е. coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар, содержащий канамицин (20 мг/л), чашки инкубировали в течение ночи при 37°C до образования различимых индивидуальных колоний. Плазмиды выделяли из полученных трансформантов и анализировали с помощью рестрикционного анализа. Полученная плазмида, содержащая промотор Pnlp, была названа pMW-Km-Pnlp8. Затем проводилась ПЦР с использованием плазмиды pMW-Km-Pnlp8 в качестве матрицы и праймерами Р22 (SEQ ID No:31) и Р23 (SEQ ID No:32). Условия ПЦР были следующими; денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 30 циклов: 20 сек при 94°C, 20 сек при 54°C, 90 сек при 72°C; финальная элонгация: 5 мин при 72°C. Полученный ДНК-фрагмент длиной около 1,6 т.п.н. очищали с помощью агарозного гель-электрофореза и использовали для трансформации штамма Р. ananatis SC17(0) методом электропорации. Трансформанты высевали на LB-агар, содержащий канамицин (20 мг/л), чашки инкубировали в течение ночи при 34°C до образования различимых индивидуальных колоний. Необходимые трансформанты были идентифицированы с помощью ПЦР с праймерами Р24 (SEQ ID No:33) и Р25 (SEQ ID No:34). Полученный штамм был назван SC17-Pnlp8-PTWA. Из штамма SC17-Pnlp8-PTWA выделяли хромосомную ДНК, 10 мкг которой использовали для трансформации штамма Р. ananatis EY19(s) методом электропорации. Трансформанты высевали на LB-агар, содержащий канамицин (20 мг/л), чашки инкубировали в течение ночи при 34°C до образования различимых индивидуальных колоний. Трансформанты были идентифицированы с помощью ПЦР с праймерами Р24 и Р25. Полученный штамм был назван EYP197. Чтобы избавиться от устойчивости штамма Р. ananatis EY19 к канамицину, штамм EY19 был трансформирован плазмидой pMT-Int-Xis2 методом электропорации. Полученные трансформанты высевали на LB-агар с тетрациклином (10 мг/л), чашки инкубировали в течение ночи при 30°C до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы отбором вариантов, чувствительных к канамицину (20 мг/л). Такой «вылеченный» штамм был назван EY197(s).
Мутация N348A была введена с помощью сайт-специфического мутаганеза. Для этого 3'-конец гена serA (с мутацией) был получен с помощью ПЦР-амплификации хромосомной ДНК штамма SC17 с праймерами Р26 (SEQ ID No:35) и Р27 (SEQ ID No:36), a 5'-конец гена serA был получен ПЦР-амплификацией хромосомной ДНК штамма SC17 с праймерами Р28 (SEQ ID No:37) и Р29 (SEQ ID No:38). Оба праймера Р27 (SEQ ID No:36) и Р29 (SEQ ID No:38) содержали сайт для рестриктазы SmaI на 5'-конце. Условия для первой ПЦР были следующими: денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 25 циклов: 20 сек при 94°C, 20 сек при 60°C, 60 сек при 72°C; финальная элонгация: 5 мин при 72°C. Условия для второй ПЦР были следующими: денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 20 циклов: 20 сек при 94°C, 20 сек при 60°C, 20 сек при 72°C; финальная элонгация: 5 мин при 72°C. Оба амплифицированных ДНК-фрагмента очищали с помощью агарозного гель-электрофореза и обрабатывали экзонуклеазой SmaI. Далее полученные ДНК-фрагменты лигировали в эквимолярном соотношении. Смесь для лигирования инкубировали в течение ночи при 4°C и использовали в качестве матрицы для последующей ПЦР (с праймерами Р26 и Р28). Праймер Р26 (SEQ ID No:35) содержит сайт для рестриктазы SalI на 5'-конце. Праймер Р28 (SEQ ID No:37) содержит сайт для рестриктазы XbaI на 5'-конце. Условия для ПЦР были следующими: денатурация 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 сек при 50°C, 40 сек при 72°C; условия для последующих 15 циклов: 20 сек при 94°C, 20 сек при 60°C, 75 сек при 72°C; финальная элонгация: 5 мин при 72°C. Амплифицированный ДНК-фрагмент длиной около 1,3 т.п.н. очищали с помощью агарозного гель-электрофореза. Полученный фрагмент обрабатывался эндонуклеазами SalI и XbaI. После рестрикции ДНК-фрагмент лигировали в эквимолярном соотношении с плазмидой pMIV-PnlpS-ter, предварительно обработанной теми же эндонуклеазами SalI и XbaI. Смесь для лигирования инкубировали в течение ночи при 4°C и затем использовали для трансформации штамма Е. coli MG1655 методом электропорации. Трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°C до образования различимых индивидуальных колоний. Плазмиды выделяли из полученных трансформантов и анализировали с помощью секвенирования. Полученная плазмида, содержащая ген serA с мутацией N348A, была названа pMIV-Pnlp8-serA348.
Следующим этапом была интеграция аллеля serA348 в хромосому штамма Р. ananatis SC17. ДНК плазмиды pMIV-Pnlp8-serA348 была использована для трансформации штамма Р. ananatis SC17/pMH10 (этот штамм растет при 30°C) методом электропорации. Полученные трансформанты подвергали тепловому шоку (20 мин при 42°C) и высевали на LB-агар с хлорамфениколом (20 мг/л), чашки инкубировали в течение ночи при 39°C до образования различимых индивидуальных колоний. Около 50 клонов пересевали при 39°C и каждый из них засевали в 1 мл LA-среды и инкубировали в течение 48 часов при 39°C. После инкубирования все 50 вариантов тестировали на отсутствие плазмид рМН10 и pMIV-Pnlp8-serA348 и отбирали варианты, устойчивые к хлорамфениколу (20 мг/л), но чувствительные к канамицину (20 мг/л) и ампициллину (50 мг/л). Необходимые интегранты были идентифицированы с помощью ПЦР анализа с праймерами Р14 и Р28. Во всех полученных вариантах была измерена активность PGD, и вариант с наибольшей активностью, названный SC17int-serA348, был отобран для последующих экспериментов.
Следующим этапом был перенос интегрированной копии serA348 в штамм EYP197(s).
Из штамма SC17int-serA348 выделяли хромосомную ДНК, 10 мкг которой использовали для трансформации штамма Р. ananatis EYP197(s) методом электропорации. Полученные трансформанты высевались на LB-агар с хлорамфениколом (20 мг/л), чашки инкубировали в течение ночи при 34°C до образования различимых индивидуальных колоний. Необходимые трансформанты были идентифицированы ПЦР-анализом с праймерами Р14 и Р28. Полученный штамм был назван EYPS1976.
Чтобы избавиться от устойчивости штамма Р. ananatis EYPS1976 к хлорамфениколу, штамм EYPS1976 был трансформирован плазмидой pMT-Int-Xis2 методом электропорации. Трансформанты высевались на LB-агар с тетрациклином (10 мг/л), чашки инкубировали в течение ночи при 30°C до образования различимых индивидуальных колоний. Необходимые трансформанты были идентифицированы отбором вариантов, чувствительных к хлорамфениколу (20 мг/л). Такой «вылеченный» штамм был назван EY1976(s).
2. Конструкция штамма EYPSGint1M2
Штамм EYPSGintlM2 был получен путем интеграции гена cysMvt3 E. coli в хромосому EYPS1976(s). На первом этапе ввели cysM3a счет мини-Mu интеграции плазмиды pMIV-Pnlp1-cysM (Справочный пример 2) в хромосому штамма SC17 с использованием µ-транспозазы, содержащейся в плазмиде рМН10 (как описано выше). Полученная конструкция (int(Pnlp1-cysM)) была перенесена из штамма SC17 в штамм EYPS1976(s) методом хромосомной трансформации с использованием CmR маркера для селекции. Штамм был назван EYPSGint1M2 и после вылечивания от маркера устойчивости к антибиотику использовался для дальнейших экспериментов.
Справочный пример 2. Конструкция плазмиды pMIV-Pnlp1-cysM
Промоторный район гена nlpD из Р. ananatis был амплифицирован методом ПЦР с праймерами Р30 (SEQ ID NO: 39) и Р31 (SEQ ID NO: 40) и хромосомной ДНК штамма SC17 в качестве матрицы. Полученный ДНК-фрагмент длиной около 0,2 т.п.н. очищали с помощью агарозного гель-электрофореза и обрабатывали эндонуклеазами PaeI и SalI и далее лигировали с плазмидой pMIV-5JS, предварительно обработанной теми же эндонуклеазами.
Терминаторный район гена rrnB из Е. coli был амплифицирован методом ПЦР с примерами Р32 (SEQ ID NO: 41) и Р33 (SEQ ID NO: 42) и хромосомной ДНК штамма MG1655 в качестве матрицы. Полученный ДНК-фрагмент длиной около 0,25 т.п.н. очищали с помощью агарозного гель-электрофореза и обрабатывали эндонуклеазами XbaI и BamHI и далее лигировали с полученной на предыдущем этапе плазмидой, предварительно обработанной теми же эндонуклеазами.
Ген cysM из Е. coli был амплифицирован методом ПЦР с примерами Р34 (SEQ ID NO: 43) и Р35 (SEQ ID NO: 44) и хромосомной ДНК штамма MG1655 в качестве матрицы. Полученный ДНК-фрагмент длиной около 1,1 т.п.н. очищали с помощью агарозного гель-электрофореза и обрабатывали эндонуклеазами SalI and XbaI и далее лигировали полученной на предыдущем этапе плазмидой, предварительно обработанной теми же эндонуклеазами. Таким образом была получена плазмида pMIV-Pnlp1-cysM.
Хотя указанное изобретение описано в деталях со ссылкой на Наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть внесены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения. Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения
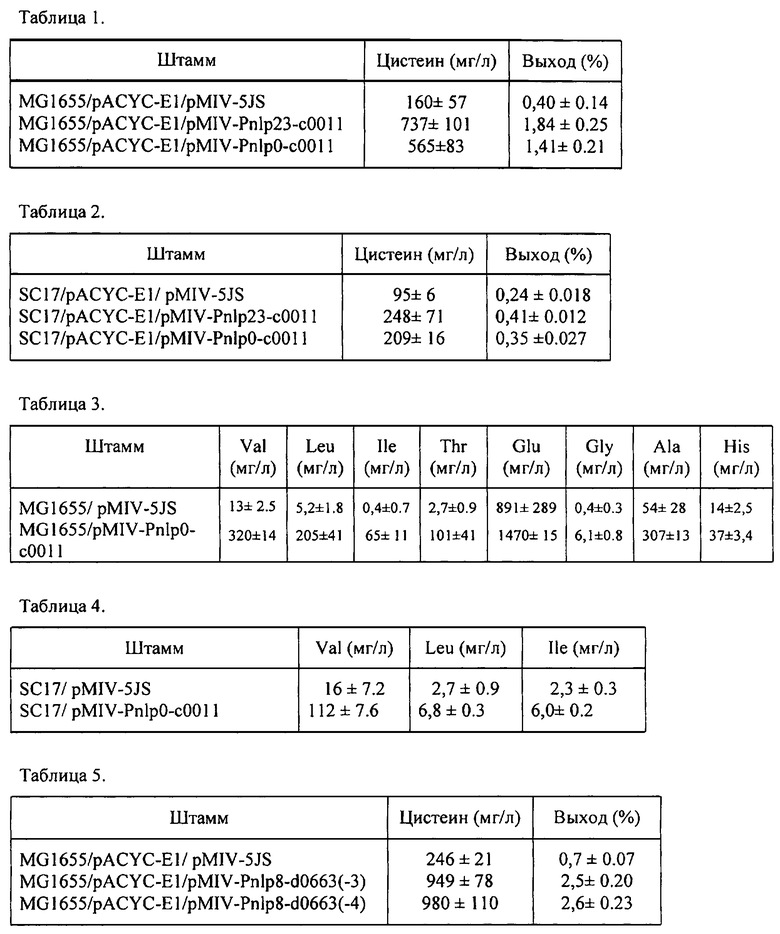























Настоящее изобретение относится к области биохимии. Представлен белок, способный придавать бактерии семейства Enterobacteriaceae устойчивость к ингибированию роста L-цистеином и выбранный из группы, состоящей из: (а) белка, представленного в SEQ ID NO: 2 или его варианта; и (в) белка, представленного в SEQ ID NO: 4 или его варианта; а также представлен фрагмент ДНК, кодирующий указанный белок. Описана бактерия-продуцент L-аминокислоты семейства Enterobacteriaceae, содержащая указанный фрагмент ДНК. Предложен способ получения L-аминокислоты, включающий культивирование указанной бактерии в питательной среде и выделение указанной L-аминокислоты из культуральной жидкости. Изобретение позволяет увеличить выход продуцируемой L-аминокислоты. 4 н. и 8 з.п. ф-лы, 12 табл., 1 ил., 8 пр.
1. Белок, способный придавать бактерии семейства Enterobacteriaceae устойчивость к ингибированию роста L-цистеином, отличающийся тем, что указанный белок выбран из группы, состоящей из:
(A) белка, представленного в SEQ ID NO: 2, или его варианта, содержащего делецию, вставку, добавление или замену одного или нескольких аминокислотных остатков и обладающего активностью белка, представленного в SEQ ID NO: 2; и
(B) белка, представленного в SEQ ID NO: 4, или его варианта, содержащего делецию, вставку, добавление или замену одного или нескольких аминокислотных остатков и обладающего активностью белка, представленного в SEQ ID NO: 4.
2. Фрагмент ДНК, кодирующий белок по п.1.
3. Бактерия-продуцент L-аминокислоты семейства Enterobacteriaceae, содержащая фрагмент ДНК по п.2.
4. Бактерия по п.3, отличающаяся тем, что указанная бактерия трансформирована фрагментом ДНК по п.2.
5. Бактерия по п.3, отличающаяся тем, что в указанной бактерии экспрессия указанного фрагмента ДНК усилена.
6. Бактерия по п.3, отличающаяся тем, что указанная бактерия принадлежит к роду Escherichia.
7. Бактерия по п.6, отличающаяся тем, что указанная бактерия принадлежит к виду Escherichia coli.
8. Бактерия по п.3, отличающаяся тем, что указанная бактерия принадлежит к роду Pantoea.
9. Бактерия по п.8, отличающаяся тем, что указанная бактерия принадлежит к виду Pantoea ananatis.
10. Способ получения L-аминокислоты, включающий культивирование бактерии по любому из пп.3-9 в питательной среде и выделение указанной L-аминокислоты из культуральной жидкости.
11. Способ по п.10, отличающийся тем, что указанная L-аминокислота есть неароматическая L-аминокислота.
12. Способ по п.11, отличающийся тем, что указанная неароматическая L-аминокислота выбрана из группы, включающей L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновую кислоту, L-глутамин, L-глутаминовую кислоту, L-пролин, L-аргинин и О-ацетил-L-серин.
| ФРАГМЕНТ ДНК RHTC, КОДИРУЮЩИЙ СИНТЕЗ БЕЛКА RHTC, ПРИДАЮЩЕГО ПОВЫШЕННУЮ УСТОЙЧИВОСТЬ К L-ТРЕОНИНУ БАКТЕРИЯМ ESCHERICHIA COLI, И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 1998 |
|
RU2148642C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ, ШТАММ Escherichia coli - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2001 |
|
RU2215782C2 |
| Устройство для перемещения и подачи на рабочую позицию поддонов с изделиями | 1984 |
|
SU1239041A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| WO 00/08196 A2, 17.02.2000. | |||
Авторы
Даты
2012-09-10—Публикация
2010-01-15—Подача