ТЕХНИЧЕСКАЯ ОБЛАСТЬ
Данное изобретение относится к фармацевтической композиции, содержащей производное пиразина или его соль и один или более из ингибиторов нейраминидазы, которая применима для лечения (например, терапии или предупреждения) вирусных заболеваний. Кроме того, данное изобретение относится к способу использования производного пиразина или его соли и ингибитора(ов) нейраминидазы в комбинации для лечения (например, терапии или предупреждения) гриппа.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Инфекция, вызываемая вирусом гриппа (далее называемая гриппом), часто является смертельным заболеванием. В последние годы появились такие вирусы, как вирус птичьего гриппа, которые проявляют сильную патогенность у людей. Есть угроза пандемии птичьего гриппа.
Однако лекарственных средств, применимых при гриппе, значительно меньше, чем антимикробных средств или тому подобных. Например, амантадин и озельтамивир, применяемые в настоящее время, имеют проблемы, такие как устойчивость к ним.
Способ применения средств против вируса гриппа в комбинации обсуждался с целью снижения лекарственной резистентности вируса гриппа, повышения терапевтических эффектов и/или снижения побочных эффектов и т.д. Однако число лекарственных средств, используемых в комбинации, ограничено, и они не всегда дают удовлетворительный эффект.
Например, ингибиторы нейраминидазы известны как лекарственные средства, которые оказывают действие на вирус гриппа. Нейраминидаза, которая является выступающим гликопротеином, обнаруженным на поверхности вируса гриппа, необходима для инфицирования вирусом гриппа клеток гортани или бронхов и пролиферации с распространением на соседствующие с ними клетки. Ингибирование нейраминидазы может подавлять распространение такого вируса гриппа на соседние клетки. Например, ингибитор нейраминидазы озельтамивир превращается in vivo в свою активную форму, GS-4071, которая проявляет противовирусное действие так, что она подавляет нейраминидазу вируса гриппа (непатентный документ 1). Озельтамивир и занамивир коммерчески доступны в качестве ингибиторов нейраминидазы. Такие лекарственные средства до сих пор разрабатывались и изучались.
С другой стороны, известно производное пиразина, обладающее противовирусной активностью (патентный документ 1). Это производное пиразина, как известно, проявляет противовирусное действие на внутриклеточное рибозилфосфорилирование так, что подавляет вирусную РНК-полимеразу (патентный документ 2).
Однако до сих пор не были известны ни фармацевтическая композиция, содержащая ингибитор нейраминидазы и производное пиразина, ни способ использования ингибитора нейраминидазы и производного пиразина в комбинации.
ПАТЕНТНЫЙ ДОКУМЕНТ 1: Описание WO00/10569
ПАТЕНТНЫЙ ДОКУМЕНТ 2: Описание WO03/015798
НЕПАТЕНТНЫЙ ДОКУМЕНТ 1: Japanese Journal of Clinical Medicine, 2003, vol. 61, p. 1975-1979
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Существовала потребность в фармацевтической композиции, которая обладает сильной противовирусной активностью, меньшими побочными эффектами и применима для лечения (например, терапии или предупреждения) гриппа, и в способе лечения гриппа.
СРЕДСТВА РЕШЕНИЯ ПРОБЛЕМ
Данное изобретение было осуществлено путем обнаружения того, что фармацевтическая композиция, содержащая производное пиразина, представленное следующей общей формулой [1] или его соль и один или более из ингибиторов нейраминидазы:
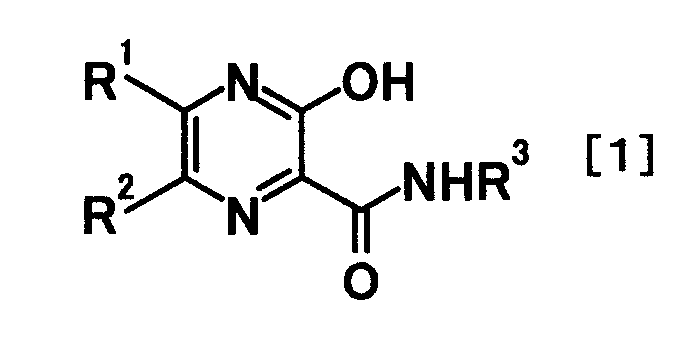
где R1 и R2 являются одинаковыми или разными, и каждый представляет атом водорода или атом галогена; и R3 представляет атом водорода или защитную группу для аминогруппы,
обладает сильной активностью против вируса гриппа и применима для лечения гриппа, и что способ использования этих соединений в комбинации применим в качестве способа лечения гриппа.
ПРЕИМУЩЕСТВА ИЗОБРЕТЕНИЯ
Фармацевтическая композиция, содержащая производное пиразина или его соль и один или более из ингибиторов нейраминидазы, обладает синергистической сильной активностью против вируса гриппа и применима для лечения (например, терапии или предупреждения) гриппа. Способ использования этих соединений в комбинации применим в качестве способа лечения (например, терапии или предупреждения) гриппа.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее данное изобретение будет описано в деталях.
В данном описании, если не указано иначе, атом галогена означает атомы фтора, хлора, брома и йода; ацильная группа означает, например, формильную группу, линейную или разветвленную С2-12 алканоильную группу (например, ацетил, пропионил, бутирил, изовалерил и пивалоил), арил-С1-6-алкилкарбонильную группу (например, бензилкарбонильную), циклическую углеводородную карбонильную группу (например, бензоильную и нафтоильную), гетероциклическую карбонильную группу (например, никотиноильную, теноильную, пирролидинокарбонильную и фуроильную), сукцинильную группу, глютарильную группу, малеоильную группу, фталоильную группу и линейную или разветвленную α-аминоалканоильную группу (которая может быть защищенной на N-конце), полученную из аминокислот (примеры аминокислот включают глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновую кислоту, глютаминовую кислоту, аспарагин, глютамин, аргинин, лизин, гистидин, гидроксилизин, фенилаланин, тирозин, триптофан, пролин и гидроксипролин); алкилоксикарбонильная группа означает, например, линейную или разветвленную С2-12-алкилоксикарбонильную группу, такую как метоксикарбонил, этоксикарбонил, 1,1-диметилпропоксикарбонил, изопропоксикарбонил, 2-этилгексилоксикарбонил, трет-бутоксикарбонил и трет-пентилоксикарбонил; аралкилоксикарбонильная группа означает, например, арил-С1-6-алкилоксикарбонильную группу, такую как бензилоксикарбонильная и фенетилоксикарбонильная группы; арилоксикарбонильная группа означает, например, фенилоксикарбонильную группу; аралкильная группа означает, например, арил-С1-6-алкильную группу, такую как бензильная, дифенилметильная, тритильная, фенетильная и нафтилметильная; алкоксиалкильная группа означает, например, С1-6-алкилокси-С1-6-алкильную группу, такую как метоксиметил и 1-этоксиэтил; аралкилоксиалкильная группа означает, например, арил-С1-6-алкилокси-С1-6-алкильную группу, такую как бензилоксиметил и фенетилоксиметил; арилтиогруппа означает, например, фенилтиогруппу; алкилсульфонильная группа означает, например, С1-6-алкилсульфонильную группу, такую как метилсульфонил, этилсульфонил и пропилсульфонил; арилсульфонильная группа означает, например, бензолсульфонильную, толуолсульфонильную и нафталенсульфонильную группы; диалкиламиноалкилиденовая группа означает, например, N,N-диметиламинометиленовую и N,N-диэтиламинометиленовую группы; аралкилиденовая группа означает, например, бензилиденовую и нафтилметиленовую группы; азотосодержащая гетероциклическая алкилиденовая группа означает, например, 3-гидрокси-4-пиридилметиленовую группу; циклоалкилиденовая группа означает, например, циклопентилиденовую и циклогексилиденовую группы; диарилфосфорильная группа означает, например, дифенилфосфорильную группу; диаралкилфосфорильная группа означает, например, дибензилфосфорильную группу; кислородосодержащая гетероциклическая алкильная группа означает, например, 5-метил-2-оксо-2Н-1,3-диоксол-4-илметильную группу; и замещенная силильная группа означает, например, триметилсилильную, триэтилсилильную и трибутилсилильную группы.
Термин «защитная группа для аминогруппы» охватывает все группы, возможные в качестве обычных групп, защищающих аминогруппу. Их примеры, включают группы, описанные в W. Greene et al., Protective Groups in Organic Synthesis, 3rd ed., p. 494-653, 1999, John Wiley & Sons, Inc. Их конкретные примеры включают ацильную группу, алкилоксикарбонильную группу, аралкилоксикарбонильную группу, арилоксикарбонильную группу, аралкильную группу, алкоксиалкильную группу, аралкилоксиалкильную группу, арилтиогруппу, алкилсульфонильную группу, арилсульфонильную группу, диалкиламиноалкилиденовую группу, аралкилиденовую группу, азотосодержащую гетероциклическую алкилиденовую группу, циклоалкилиденовую группу, диарилфосфорильную группу, диаралкилфосфорильную группу, содержащую кислород гетероциклическую алкильную группу и замещенную силильную группу.
Примеры соли соединения общей формулы [1], применимой по данному изобретению, могут включать обычно известные соли гидроксильных групп.
Их примеры могут включать: соли щелочных металлов, таких как натрий и калий; соли щелочноземельных металлов, таких как кальций и магний; соли аммония и соли с содержащими азот органическими основаниями, такими как триметиламин, триэтиламин, трибутиламин, N-метилпиперидин, N-метилморфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N-бензил-β-фенетиламин, 1-эфенамин и N,N'-дибензилэтилендиамин.
Желательные примеры соли включают фармакологически приемлемые соли. Предпочтительна соль натрия.
Желательные примеры соединения общей формулы [1], используемые в данном изобретении включают следующие соединения:
Соединения, представляемые общей формулой [1], где R1 является атомом водорода, R2 является атомом фтора и R3 является атомом водорода.
Соединение общей формулы [1], используемое по данному изобретению, получают с помощью комбинации методов, известных сами по себе специалистам в данной области, и могут быть получены, например, по способу получения, описанному в патентном документе 1.
Примеры ингибитора нейраминидазы, используемого по данному изобретению, включают сами соединения или их метаболиты in vivo, обладающие подавляющим действием на нейраминидазу, такие как озельтамивир, занамивир, перамивир, CS8958 и фрунет (FRUNET). Предпочтительны озельтамивир и занамивир. Более предпочтителен озельтамивир.
Путь введения фармацевтической композиции данного изобретения конкретно не ограничивается, и ее можно вводить внутривенно, перорально, внутримышечно, подкожно, путем ингаляции, путем впрыскивания или другими путями введения. Кроме того, производное пиразина, представляемое общей формулой [1], или его соль можно вводить с ингибитором нейраминидазы одновременно или в особом порядке.
Фармацевтическая композиция данного изобретения применима для лечения (например, терапии или профилактики) гриппа.
Фармацевтическая композиция данного изобретения дает возможность лечения (например, терапии или профилактики) более тяжелых случаев гриппа. Кроме того, отдельные используемые лекарственные средства проявляют сильное действие против вируса гриппа, даже когда их применяют в сниженном количестве. Поэтому их соответствующие побочные эффекты могут быть снижены.
Когда используют фармацевтическую композицию данного изобретения, она может быть соответственно обычно смешана с фармацевтическими вспомогательными веществами, используемыми при изготовлении лекарственных средств, такими как вспомогательное средство, носитель и разбавитель. Такие препараты можно вводить перорально или парентерально в такой форме, как таблетка, капсула, порошок, сироп, гранулы, пилюля, суспензия, эмульсия, раствор, порошковый препарат, суппозиторий, глазные капли, капли в нос, ушные капли, пластырь, мазь или препарат для инъекций, обычным способом. Кроме того, способ введения, доза и частота введения могут быть выбраны в соответствии с возрастом, весом тела и симптоматикой у пациента. Ее можно вводить взрослому перорально или парентерально (например, путем инъекции, внутривенного вливания и ректально) в виде от одной до нескольких дробных доз при дозировке от 0,01 до 1000 мг/кг в сутки.
ПРИМЕРЫ
Затем данное изобретение будет описано со ссылками на примеры испытаний. Однако они не предназначены для ограничения данного изобретения.
6-Фтор-3-гидрокси-2-пиразинкарбоксамид (далее называемый Т-705) был выбран в качестве опытного соединения. GS-4071, который является активной in vivo формой озельтамивира, и занамивир были выбраны в качестве ингибиторов нейраминидазы. В этом контексте GS-4071, использованный при данных испытаниях, получали путем экстрагирования из тамифлю (Tamiflu; промышленно выпускаемый лекарственный препарат), с последующим гидролизом по общепринятому методу.
Пример испытания 1
Т-705 выбрано в качестве испытуемого соединения. GS-4071 был выбран в качестве ингибитора нейраминидазы.
(1) Культура клеток MDCK
Клетки почки собаки Madin-Darby (Madin-Darby Canine Kidney; далее называемые MDCK), культивированные в условиях при 37°С в атмосфере с 5% диоксида углерода в среде Игла МЕМ, дополненной 10% эмбриональной бычьей сыворотки, в культуральном растворе разобщали методом с использованием этилендиаминтетрауксусной кислоты-трипсина и суспендировали в той же среде, которая указана выше. Полученную суспензию клеток, которая содержала 2×104 клеток в 100 мкл, засевали, в свою очередь, в лунки 96-луночной планшеты. Клетки культивировали в течение ночи в условиях при 37°С в атмосфере с 5% диоксида углерода с получением монослоя клеток MDCK.
(2) Инфицирование вирусом гриппа и добавление лекарственных средств
Средой для испытания была среда, полученная путем добавления обработанного L-1-тосиламидо-2-фенилэтилхлорметилкетоном (ТФХК; TPCK) трипсина в концентрации 3 мкг/мл в среду Игла МЕМ, содержащую 1% бычьего сывороточного альбумина, с добавлением 60 мкг/мл канамицина и четырехкратную по отношению к обычной концентрацию витаминов.
Клетки MDCK, полученные в разделе (1), промывали средой Игла МЕМ после удаления надосадочной жидкости культуры. Затем в каждую лунку добавляли следующие средства: 100 мкл среды Игла МЕМ, содержащей бычий сывороточный альбумин и витамины в двухкратной концентрации по отношению к среде для испытаний; 50 мкл раствора с вирусом гриппа (PR/8 (H1N1)), доведенного до 4,0×103 БОЕ/мл средой Игла МЕМ, содержащей обработанный ТФХК трипсин в четырехкратной концентрации среды для испытаний; и 50 мкл среды Игла МЕМ, содержащей Т-705 или GS-4071 в четырехкратной по отношению к целевой концентрации (целевая концентрация Т-705 (мкг/мл): 0,0156; 0,0313; 0,0625; 0,125; 0,25; 0,5; 1; 2 и 4; и целевая концентрация GS-4071 (мкг/мл): 0,00313; 0,00625; 0,0125; 0,025; 0,05; 0,1; 0,2; 0,4 и 0,8) или содержащую Т-705/GS-4071 (в весовой концентрации с отношением 5:1) смесь в четырехкратной по отношению к целевой концентрации.
После добавления лекарственных средств клетки культивировали в условиях при 35°С в течение 2 суток с содержанием в атмосфере 5% двуокиси углерода.
(3) Исследование с поглощением нейтрального красного
Цитопатический эффект (ЦПЭ), наблюдаемый при пролиферации вируса гриппа оценивали методами, описанными в J. Virol. Methods, 2002, vol. 106, p. 71-79 и Proc. Natl. Acad. Sci., 1998, vol. 95, p. 8874-8849.
После завершения культивирования в каждую лунку добавляли 0,033% раствор нейтрального красного, разбавленный фосфатным буфером Дульбекко, не содержащим кальция/магния в объеме 100 мкл. Планшету оставляли стоять при 35°С в условиях содержания 5% диоксида углерода в окружающей атмосфере. Через два часа растворы из лунок удаляли аспирацией. После двухкратного промывания 100 мкл фосфатного буфера Дульбекко, не содержащего кальция/магния, в каждую лунку добавляли 100 мкл смешанного раствора буфера (рН 4,2; состоящего из 0,1 моль/л цитрата натрия и 0,1 моль/л соляной кислоты) и этанола в соотношении 1:1 по объему. Планшету оставляли стоять при комнатной температуре, защищенной от света. Тридцатью минутами позднее измеряли поглощение (540 нм) с использованием считывающего устройства для микропланшет (BIO-RAD Model 550). Неинфицированные контроли получали добавлением вместо раствора с вирусом гриппа 50 мкл среды Игла МЕМ, содержащей обработанный ТФХК трипсин в четырехкратной концентрации по отношению к среде для испытания и подвергали тем же процедурам, что и процедуры для испытуемой группы, с последующим измерением поглощения. Что касается контроля, лунки без посева клеток MDCK подвергали тем же процедурам, что и для неинфицированных контролей, с последующим измерением поглощения. Использовали восемь лунок на каждую концентрацию. Использовали среднее значение, и числовое значение получено путем вычитания поглощения в контроле из значения, значения измерения для последующего вычисления поглощения. Значение, получаемое путем вычитания поглощения инфицированных контролей из значения неинфицированных контролей, использовали как значение полного подавления пролиферации вируса. Степень подавления пролиферации вируса при каждом испытании рассчитывали по следующей формуле:
Степень подавления пролиферации вируса = [(Поглощение при одном лекарственном средстве или комбинации лекарственных средств) - (Поглощение у инфицированного контроля)]/[(Поглощение у неинфицированного контроля) - (Поглощение у инфицированного контроля)]
Анализ эффектов комбинации
По концентрациям отдельных лекарственных средств и двух лекарственных средств, используемых в комбинации, соотношению лекарственных средств в комбинации и степени подавления пролиферации вируса, используя выпуск 8.2 SAS (SAS Institute Japan Ltd.) по методу среднего эффекта Chou et al. Из методов, представленных в Advanced Enzyme Regulation, 1984, vol. 22, p. 27-55, использовали уравнение для лекарственных средств, механизмы действия которых полностью независимы один от другого (не взаимоисключающие лекарственные средства) для расчета значения CI. Комбинированные эффекты определяли на основе значения CI при 50% подавлении пролиферации вируса в соответствии с описанием в статье Taira et al. [Acta Medica Okayama., 2006, vol. 60, p. 25-34), где CI≤0,8 представляет синергизм, 0,8<CI<1,2 представляет аддитивность, и 1,2 ≤ представляет антагонизм.
Степень подавления пролиферации вируса Т-705, используемым отдельно, GS-4071, используемым отдельно, и комбинацией этих лекарственных средств представлена в Таблице 1. Результаты анализа с использованием этих значений представлены в Таблице 2.
Т-705
GS-4071
Т-705 и GS-4071
(мкг/мл)
подавления
(мкг/мл)
подавления
(мкг/мл)
подавления
в комбинации
(Т-705: GS-4071)
При комбинированном применении Т-705 и GS-4071 (активная форма озельтамивира in vivo) проявляли более сильные синергистические подавляющие эффекты на пролиферацию вируса, чем проявляющиеся при применении одного лекарственного средства.
Пример испытания 2
Т-705 был выбран в качестве испытуемого соединения. Занамивир был выбран в качестве ингибитора нейрминидазы. Испытание проводили таким же образом, что и при способе, описанном в примере испытания 1.
Степень подавления пролиферации вируса Т-705, применяемым отдельно, занамивиром, применяемым отдельно, и комбинацией этих лекарственных средств, представлены в Таблице 3. Результаты анализа с использованием этих значений, представлены в Таблице 4.
Т-705
занамивира
Т-705 и занамивира
(мкг/мл)
подавления
(мкг/мл)
подавления
(мкг/мл)
подавления
в комбинации
(Т-705:занамивир)
При комбинированном применении Т-705 и занамивир проявляли более сильные синергистические подавляющие эффекты на пролиферацию вируса, чем эффекты, проявляющиеся при введении одного лекарственного средства.
Пример испытания 3
Т-705 был выбран в качестве испытуемого соединения. GS-4071 был выбран в качестве ингибитора нейраминидазы. Испытание проводили таким же образом, что и при способе, описанном в примере испытания 1, используя в качестве вируса гриппа Victoria/3/75 (H3N2).
Степень подавления пролиферации вируса Т-705, используемым отдельно, GS-4071, используемым отдельно, и комбинацией этих лекарственных средств, представлена в Таблице 5. Результаты анализа с использованием этих значений представлены в Таблице 6.
Т-705
GS-4071
Т-705 и GS-4071
(мкг/мл)
подавления
(мкг/мл)
подавления
(мкг/мл)
подавления
в комбинации
При комбинированном применении Т-705 и GS-4071 (активная форма озельтамивира in vivo) проявляли более сильные синергистические подавляющие эффекты на пролиферацию вируса, чем проявляющиеся при применении одного лекарственного средства.
Пример испытания 4
Т-705 был выбран в качестве испытуемого соединения. Занамивир был выбран в качестве ингибитора нейрминидазы. Испытание проводили таким же образом, что и при способе, описанном в примере испытания 3.
Степень подавления пролиферации вируса Т-705, применяемым отдельно, занамивиром, применяемым отдельно, и комбинацией этих лекарственных средств, представлены в Таблице 7. Результаты анализа с использованием этих значений, представлены в Таблице 8.
Т-705
занамивира
Т-705 и занамивира
(мкг/мл)
подавления
(мкг/мл)
подавления
(мкг/мл)
подавления
в комбинации
При комбинированном применении Т-705 и занамивир проявляли более сильные синергистические подавляющие эффекты на пролиферацию вируса, чем проявляющиеся при применении одного лекарственного средства.
Как видно из результатов, при комбинированном применении производного пиразина общей формулы [1] или его соли и разных ингибиторов нейраминидазы проявляется синергистическая активность против вируса гриппа, и оно эффективно для лечения (например, терапии или профилактики) гриппа.
ВОЗМОЖНОСТЬ ПРИМЕНЕНИЯ В ПРОМЫШЛЕННОСТИ
Фармацевтическая композиция, содержащая производное пиразина или его соль и один или более из ингибиторов нейраминидазы, обладает высокой синергистической активностью против вируса гриппа и применима для лечения (например, терапии или профилактики) гриппа. Способ использования этих соединений в комбинации применим в качестве способа лечения (например, терапии или профилактики) гриппа.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПЕПТИД И ИНГИБИТОР ВИРУСНОЙ НЕЙРАМИНИДАЗЫ | 2011 |
|
RU2596785C2 |
| ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ГРИППА, ХАРАКТЕРИЗУЮЩИЙСЯ ТЕМ, ЧТО В НЕМ ОБЪЕДИНЕНЫ ИНГИБИТОР КЭП-ЗАВИСИМОЙ ЭНДОНУКЛЕАЗЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРОТИВ ГРИППА | 2016 |
|
RU2745071C2 |
| ПРОИЗВОДНОЕ 1,3-АДАМАНТАНДИУКСУСНОЙ КИСЛОТЫ И ЕГО ПРОТИВОВИРУСНАЯ АКТИВНОСТЬ | 2013 |
|
RU2553991C1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2599792C1 |
| ПРИМЕНЕНИЕ 1,7,7-ТРИМЕТИЛБИЦИКЛО[2.2.1]ГЕПТАН-2-ИЛИДЕН-АМИНОЭТАНОЛА В КАЧЕСТВЕ ИНГИБИТОРА РЕПРОДУКЦИИ ВИРУСА ГРИППА | 2013 |
|
RU2530554C1 |
| Способы лечения гриппа | 2018 |
|
RU2769317C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ПОЛИМЕРАЗЫ | 2011 |
|
RU2599013C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ ПОЛИМЕРАЗЫ | 2011 |
|
RU2718690C2 |
| Способ этиопатогенетического лечения больных гриппом | 2019 |
|
RU2721876C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЗАЩИТЫ ОТ ПРИСУТСТВУЮЩИХ В ВОЗДУХЕ ПАТОГЕНОВ И РАЗДРАЖИТЕЛЕЙ | 2017 |
|
RU2773149C2 |
Изобретение относится к фармацевтической комбинации и к ее применению для лечения инфекции, вызванной вирусом гриппа. Заявленная композиция содержит производное пиразина формулы
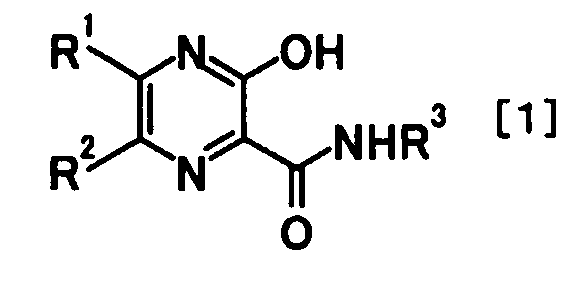
где R1 и R2 являются одинаковыми или разными, и каждый представляет атом водорода или атом галогена; и R3 представляет атом водорода или защитную группу для аминогруппы или его соль, и ингибитор нейраминидазы. Ингибитор нейраминидазы выбран из озельтамивира, занамивира, перамивира или CS-8958. Изобретение обеспечивает получение комбинации, которая обладает сильной противовирусной активностью, меньшими побочными эффектами и применима для лечения гриппа. 2 н. и 10 з.п. ф-лы, 8 табл., 4 пр.
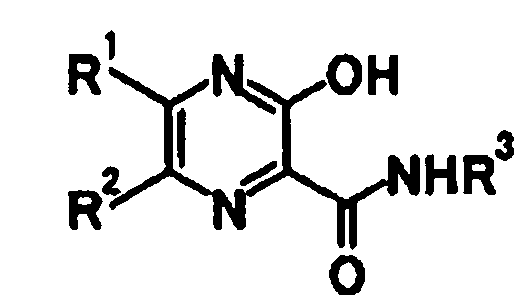
1. Фармацевтическая комбинация для лечения инфекции, вызванной вирусом гриппа, содержащая производное пиразина, общей формулы, или его соль
 ,
,
где R1 и R2 являются одинаковыми или разными, и каждый представляет атом водорода или атом галогена; и R3 представляет атом водорода и один или более из ингибиторов нейраминидазы, где ингибитором нейраминидазы является озельтамивир, занамивир, перамивир или CS-8958.
2. Фармацевтическая комбинация по п.1, где R1 представляет атом водорода, R2 представляет атом фтора и R3 представляет атом водорода.
3. Фармацевтическая комбинация по п.1 или 2, где ингибитором нейраминидазы является озельтамивир.
4. Фармацевтическая комбинация по п.1 или 2, где ингибитором нейраминидазы является занамивир.
5. Фармацевтическая комбинация по п.1 или 2, где ингибитором нейраминидазы является перамивир.
6. Фармацевтическая комбинация по п.1 или 2, где ингибитором нейраминидазы является CS-8958.
7. Применение комбинации производного пиразина следующей общей формулы или его соли
[Формула 2]
 ,
,
где R1 и R2 являются одинаковыми или разными, и каждый представляет атом водорода или атом галогена; и R3 представляет атом водорода и одного или более ингибиторов нейраминидазы, где ингибитором нейраминидазы является озельтамивир, занамивир, перамивир или CS-8958, для лечения инфекции, вызываемой вирусом гриппа.
8. Применение по п.7, где R1 представляет атом водорода, R2 представляет атом фтора, и R3 представляет атом водорода.
9. Применение по п.7 или 8, где ингибитором нейраминидазы является озельтамивир.
10. Применение по п.7 или 8, где ингибитором нейраминидазы является занамивир.
11. Применение по п.7 или 8, где ингибитором нейраминидазы является перамивир.
12. Применение по п.7 или 8, где ингибитором нейраминидазы является CS-8958.
| GOVORKOVA E.A | |||
| «Neuraminidase Inhibitor-Rimantadine Combinations Exert Additive and Synergistic Anti-Influenza Virus Effects in MDCK Cells», Antimicrobial agents and chemotherapy, vol.48, №126 2004, pp.4855-4863 | |||
| АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ КАРБОКСАМИДА ИЛИ ИХ СОЛИ И ПРОТИВОВИРУСНЫЕ СРЕДСТВА, ВКЛЮЧАЮЩИЕ ИХ | 1999 |
|
RU2224520C2 |
| M.VON ITZSTEIN «Sialic acids and sialic acid-recognising proteins: Drug discovery target and | |||
Авторы
Даты
2012-10-10—Публикация
2008-02-14—Подача