ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к молекуле нуклеиновой кислоты, которая кодирует F-белок респираторно-синцитиального вируса или фрагмент указанного белка, а также к ее экспрессии в клетке человека, к вариантам молекулы указанной нуклеиновой кислоты с оптимизированным содержанием кодонов, а также их применению в составе вирусных векторов или плазмидных векторов в качестве вакцины.
УРОВЕНЬ ТЕХНИКИ
Еще в 1957 году у детей с тяжелыми заболеваниями нижних дыхательных путей был выявлен вирус, названный респираторно-синцитиальным вирусом (RSV, или РСВ). Данное название относится к характеристике вируса, который вызывает заболевания дыхательных путей и формирует синцитии в условиях in vitro.
РСВ относится к семейству парамиксовирусов, подсемейству пневмовирусов. Так же, как и другие представители этого семейства, РСВ имеет несегментированный, непрерывный РНК геном в ориентации (-) цепи. Геном РСВ имеет размер 15222 основания и находится в комплексе сделками в форме нуклеокапсида.
Вирусный геном кодирует несколько вирусных белков. В их числе мембранные белки, известные как G-белки РСВ и F-белки РСВ. G-белок ответственен за специфическое прикрепление вирусной частицы к поверхности клетки, а F-белок вызывает слияние вируса с клеточной мембраной. F-белок синтезируется в форме полипептида-предшественника F0 и содержит на N-конце сигнальный пептид, необходимый для транспорта комплекса транслокации к мембране эндоплазматического ретикулума. После того как аминокислотная цепь проникает через мембрану, гидрофобная последовательность на С-конце молекулы осуществляет заякоривание белка F0 в мембране, и сигнальный пептид отщепляется. После этого белок подвергается гликозилированию во время его транспорта через аппарат Гольджи. В аппарате Гольджи также происходит расщепление белка F0 на две части - амино-концевую часть F2 и белок F1. Сайт расщепления находится между сегментом, состоящим из основных аминокислот, и гидрофобным доменом. Этот гидрофобный домен размером приблизительно 25 аминокислот образует, после расщепления, N-конец белка F1 и опосредует слияние вируса с клеточной мембраной, которое следует за присоединением вируса к поверхности клетки. Белок F2 остается соединенным с белком F1 через дисульфидный мостик.
Антитела, направленные против данного пептида, входящего в состав белка F1 и опосредующего слияние, могут предотвращать поглощение вируса клеткой и за счет этого обладают нейтрализующим эффектом.
Инфекция вирусом РСВ является высоко контагиозной; в миллилитре слюны содержится до 106 инфекционных вирусных частиц. Вирус передается главным образом воздушно-капельным путем и при прямом контакте инфицированных субъектов. Дети в особенности подвержены заражению в течение зимних месяцев года.
РСВ считается основной инфекционной проблемой первого года жизни. Младенцы в возрасте от шести недель до полугода являются основной группой риска. В возрасте четырех лет у 80% детей присутствуют антитела против вируса.
Тем не менее, повторные инфекции, приводящие к легким формам болезни, также развиваются в более позднем возрасте в результате снижения концентрации антител. Особенно частыми являются внутрибольничные инфекции в больницах, детских садах и клиниках.
Инкубационный период РСВ составляет приблизительно 4-5 дней. Заболевание проявляется в виде гриппозных инфекций с лихорадкой и насморком и представляет угрозу для жизни от легкой до серьезной. Также обычно наблюдают инфекции глотки (фарингиты), трахеи (трахеиты), а также бронхов (бронхиты).
После воздушно-капельной инфекции верхних дыхательных путей вирус воспроизводится в клетках слизистых оболочек и оттуда может проникнуть в течение одного или двух дней в нижние дыхательные пути.
Вакцина против РСВ на настоящий момент неизвестна. Вирусы, убитые формалином, минимально эффективны в этом отношении, так как F-белок разрушается при указанном химическом воздействии, и антитела образуются лишь против G-белка. Хотя такие антитела и способны нейтрализовать вирус, они не могут, тем не менее, препятствовать распространению вирусов через клеточные контакты. Проводится пассивная иммунизация путем применения иммуноглобулинов, однако она связана со значительными затратами и поэтому непригодна для профилактической иммунизации больших групп населения.
Таким образом, продолжает существовать потребность в создании эффективной вакцины против РСВ.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к молекуле нуклеиновой кислоты, которая содержит последовательность нуклеотидов, кодирующую F-белок респираторно-синцитиального вируса (РСВ) или его иммуногенный фрагмент, а также полинуклеотидам, производным указанной молекулы нуклеиновой кислоты, содержание кодонов в которых оптимизировали для эффективной экспрессии F-белка РСВ в клетке-хозяине. В одном из вариантов реализации настоящего изобретения, последовательность нуклеотидов, которая кодирует F-белок РСВ, содержит последовательность нуклеотидов SEQ ID NO:1 или ее фрагмент. Последовательность нуклеотидов, которая по содержанию кодонов была оптимизирована для экспрессии F-белка в человеческой клетке-хозяине, например, может содержать последовательность нуклеотидов SEQ ID NO: 2 или ее фрагмент.
В одном из вариантов реализации настоящего изобретения, последовательность нуклеотидов, которая кодирует F-белок РСВ, состоит из последовательности нуклеотидов SEQ ID NO: 1 или ее фрагмента. В альтернативном варианте, последовательность нуклеотидов, которая кодирует F-белок РСВ, состоит из последовательности нуклеотидов SEQ ID NO: 2 с оптимизированным содержанием кодонов или ее фрагмента.
Другие аспекты данного изобретения охватывают молекулы полипептидов, полученные путем экспрессии молекул нуклеиновых кислот в соответствии с настоящим изобретением. В одном из вариантов реализации настоящего изобретения, указанные полипептиды содержат или состоят из аминокислотной последовательности SEQ ID NO: 3 или ее фрагмента.
Настоящее изобретение также далее относится к вектору, который содержит молекулу нуклеиновой кислоты, согласно настоящему изобретению. Молекулы нуклеиновой кислоты, согласно настоящему изобретению, могут входить в состав вектора в форме (экспрессионной) кассеты, которая, кроме последовательности нуклеотидов, согласно настоящему изобретению, может также включать последовательность, контролирующую транскрипцию и/или трансляцию, например промотор, функционально связанный с указанной последовательностью нуклеиновой кислоты. Еще одним дальнейшим аспектом настоящего изобретения являются клетки, содержащие указанный вектор.
В предпочтительном варианте реализации настоящего изобретения, используемый вектор представляет собой вирусный вектор или плазмиду. Особенно предпочтительным является вектор на основе аденовируса, в котором E1-участок по меньшей мере частично удален таким образом, что данный вектор становится неспособным к репликации. Дополнительно, также может быть удален и Е3-участок.
В одном из вариантов реализации настоящего изобретения, аденовирусный вектор содержит последовательность нуклеотидов, согласно настоящему изобретению, в форме экспрессионной кассеты, в которой последовательность нуклеотидов, кодирующая F-белок РСВ, функционально связана с подходящим промотором, например с промотором CMV. Промотор, который применяют в аденовирусном векторе, предпочтительно представляет собой регулируемый промотор, такой как, например, тетрациклиновый промотор, для того, чтобы избежать экспрессии F-белка в клетках, продуцирующих аденовирус. Во всех клетках, не содержащих систему регуляции, промотор активен и экспрессирует F-белок РСВ. Такой аденовирусный вектор можно применять как векторную вакцину.
В дальнейших вариантах реализации настоящее изобретение также охватывает плазмидные векторы, которые содержат последовательности нуклеотидов согласно настоящему изобретению. В одном из вариантов реализации, указанные плазмидные векторы можно применять как челночные векторы, и для этого они содержат участок нуклеиновой кислоты, который делает возможной гомологичную рекомбинацию с подходящей каркасной плазмидой, которая, например, содержит большую часть вирусного генома. Особенно предпочтительной является ситуация, когда челночный вектор содержит аденовирусные последовательности, причем указанные последовательности способствуют гомологичной рекомбинации с другой плазмидой, которая содержит большую часть аденовирусного генома. Таким путем, например, можно создавать вышеупомянутые аденовирусные векторные вакцины.
Еще в одном варианте реализации настоящего изобретения, оно относится к иммуногенной композиции, которая содержит последовательности нуклеотидов SEQ ID NO: 1 или 2, или их фрагменты, в соответствии с настоящим изобретением. В одной из таких композиций последовательность нуклеотидов, согласно настоящему изобретению, может также присутствовать в форме вышеуказанных векторов, предпочтительно, в форме аденовирусной векторной вакцины. Указанный вектор способствует транспорту молекул нуклеиновых кислот, согласно настоящему изобретению, в клетку человека и экспрессии соответствующего белка. При этом белок экспрессируется в количестве, достаточном для того, чтобы вызвать требуемый иммунный ответ.
Альтернативно, указанные иммуногенные композиции могут также содержать белки, кодируемые указанными последовательностями нуклеотидов.
В зависимости от желаемого типа применения указанные иммуногенные композиции могут также содержать фармацевтически допустимый носитель и, при необходимости, другие наполнители.
Еще один аспект настоящего изобретения относится к применению молекул нуклеиновых кислот, векторов или белков согласно настоящему изобретению для приготовления композиции вакцины для вакцинации субъекта против заболеваний, вызываемых инфекцией РСВ. Субъектом предпочтительно является человек.
Настоящее изобретение также относится к способу получения F-белка РСВ, причем указанный способ включает экспрессию молекулы нуклеиновой кислоты, согласно настоящему изобретению, в подходящей клетке-хозяине. В предпочтительном варианте реализации указанного способа, содержание кодонов в указанной молекуле нуклеиновой кислоты, согласно настоящему изобретению, оптимизировано для экспрессии в клетке-хозяине.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фиг.1 представлены результаты количественной ОТ-ПЦР для РСВ, в пробах РНК, выделенной из бронхоальвеолярного лаважа (БАЛ) мышей, которых иммунизировали различными конструкциями плазмидной ДНК. Числа над скобками обозначают статистическую значимость различий между единичными результатами сравниваемых групп (использован тест Тьюки).
На Фиг.2 представлены результаты количественной ОТ-ПЦР для РСВ, в пробах РНК, выделенной из бронхоальвеолярного лаважа (БАЛ) мышей, которых иммунизировали различными конструкциями, после инфицирования РСВ. Число копий РСВ при количественной ОТ-ПЦР, стандартизованное путем определения количества РНК, показано для РНК, выделенной из полученных проб БАЛ. Индивидуальные значения, полученные для 6 мышей (черные символы), а также средние значения (поперечные полоски) представлены для каждого варианта.
На Фиг.3 представлены результаты ELISA (твердофазного иммуноферментного анализа) с использованием IgG антител. Пробы сыворотки, полученные перед первой иммунизацией (prä), после второй иммунизации (post) и после введения вирусных частиц (контрольного заражения - приблизительно 1×107 iE (infektiöse Einheiten; инфекционных частиц) РСВ, выделенных из интраназальных бляшек) в день гибели мышей, иммунизированных различными композициями ((AdV-Fsyn: синтетический F-белок, получаемый с РСВ-кодирующей нуклеиновой кислоты с оптимизированным содержанием кодонов, находящийся в составе аденовирусного вектора; AdV-Ova: аденовирусный вектор с нуклеиновой кислотой, кодирующей овальбумин; pcDFsyn ED: плазмида, кодирующая эктодомен синтетического (с оптимизированным содержанием кодонов в соответствующей ДНК) F-белка РСВ)), или неиммунизированных мышей, были протестированы с помощью ELISA с IgG-антителами с использованием антител IgG1- и IgG2a, специфичных к РСВ. Интенсивность абсорбции при длине волны 405 нм соответствует титру антител в крови мышей. Показаны каждое из индивидуальных значений, полученных для 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.4 показаны результаты реакции нейтрализации. Были получены серийные разведения проб сыворотки, полученных перед первой иммунизацией (prä), после второй иммунизации (post) и после введения вирусных частиц в день гибели мышей (nC), и затем серия разведении была протестирована в реакции нейтрализации с нейтрализующими антителами против РСВ. В каждом случае приведено наибольшее значение разведения сыворотки, при котором инфекция РСВ ингибировалась за счет нейтрализирующих антител на 50% (IC50). Показаны каждое из индивидуальных значений, полученных для 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.5 показаны результаты количественной ОТ-ПЦР для РСВ в пробах РНК, выделенных из бронхоальвеолярного лаважа (БАЛ) мышей, иммунизированных посредством различных способов введения аденовирусного вектора, согласно настоящему изобретению, причем указанный аденовирусный вектор содержал молекулу нуклеиновой кислоты с оптимизированным содержанием кодонов, кодирующую F-белок РСВ. Число копий РСВ, определенной посредством количественной ОТ-ПЦР, стандартизованное путем определения количества РНК, показано для РНК, выделенной из проб БАЛ, отобранных в день гибели. Показаны также каждое из индивидуальных значений, полученных для 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.6 показаны результаты количественной ОТ-ПЦР для РСВ в пробах РНК, выделенных из гомогената легких мышей, иммунизированных аденовирусным вектором различными способами, согласно настоящему изобретению, причем указанный аденовирусный вектор содержал молекулу нуклеиновой кислоты с оптимизированным содержанием кодонов, кодирующую F-белок РСВ. Показаны результаты количественной ОТ-ПЦР для РНК, выделенной из гомогената легких, полученного в день гибели мышей. Число копий РСВ при количественной ОТ-ПЦР, стандартизованное путем определения количества РНК, преобразовано в соответствии с содержанием РНК в пробах. Показаны также каждое из индивидуальных значений, полученных для 5 (*) или 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.7 показаны результаты ELISA с IgG-антителами для мышей, иммунизированных аденовирусным вектором различными способами, соответствующим настоящему изобретению, причем указанный аденовирусный вектор содержал молекулу нуклеиновой кислоты с оптимизированным содержанием кодонов, кодирующую F-белок РСВ. Пробы сыворотки, полученные перед первой иммунизацией (prä), после первой иммунизации (post I), после второй иммунизации (post II) и, после введения вирусных частиц, в день гибели мышей (nC) тестировали с помощью ELISA с IgG-антителами с использованием антител IgG1 и IgG2a, специфичных к РСВ. Интенсивность абсорбции при длине волны 405 нм соответствует титру антител в крови мышей. Показаны каждое из индивидуальных значений, полученных для 5 (*) или 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.8 показаны результаты реакции нейтрализации для мышей, иммунизированных аденовирусным вектором различными способами, соответствующим настоящему изобретению, причем указанный аденовирусный вектор содержал молекулу нуклеиновой кислоты с оптимизированным содержанием кодонов, кодирующую F-белок РСВ. Получали серийные разведения проб сыворотки, полученных перед первой иммунизацией (prä), после первой иммунизации (post I), после второй иммунизации (post II) и, после введения вирусных частиц, в день гибели мышей (nC), и затем серия разведении была протестирована в реакции нейтрализации с нейтрализующими антителами против РСВ. Приведены наибольшие значения разведения для каждой сыворотки, при которых инфекция РСВ ингибировалась на 50% (IC50). Показаны каждое из индивидуальных значений, полученных для 5 (*) или 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.9 показаны результаты количественной ОТ-ПЦР для РСВ в пробах РНК, выделенных из бронхоальвеолярного лаважа (БАЛ) мышей, иммунизированных путем подкожного введения аденовирусного вектора, согласно настоящему изобретению, причем указанный аденовирусный вектор содержал молекулу нуклеиновой кислоты, с оптимизированным содержанием кодонов, кодирующую F-белок РСВ (AdV-Fsyn), в различных дозировках (при возрастающих дозировках). Число копий РСВ при количественной ОТ-ПЦР, стандартизованное путем определения количества РНК, показано для проб РНК из БАЛ, полученных в день гибели мышей. Показаны каждое из индивидуальных значений, полученных для 5 (*) или 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.10 показаны результаты количественной ОТ-ПЦР для РСВ на пробах РНК, выделенной из гомогената легких мышей, иммунизированных путем подкожного введения аденовирусного вектора, согласно настоящему изобретению, причем указанный аденовирусный вектор содержал молекулу нуклеиновой кислоты с оптимизированным содержанием кодонов, кодирующую F-белок РСВ (AdV-Fsyn), в различных дозировках (при возрастающих дозировках). Показаны результаты количественной ОТ-ПЦР для проб РНК, выделенной из гомогената легких, полученного в день гибели мышей. Число копий РСВ при количественной ОТ-ПЦР, стандартизованное путем определения количества РНК, преобразовано в соответствии с содержанием РНК в пробах. Показаны каждое из индивидуальных значений, полученных для 5 (*) или 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.11 показаны результаты ELISA с IgG-антителами в отношении мышей, иммунизированных путем подкожного введения аденовирусного вектора, согласно настоящему изобретению, причем указанный аденовирусный вектор содержал молекулу нуклеиновой кислоты с оптимизированным содержанием кодонов, кодирующую F-белок РСВ (AdV-Fsyn), в различных дозировках (при возрастающих дозах). Пробы сыворотки, полученные перед первой иммунизацией (prä), после первой иммунизации (post I), после второй иммунизации (post II) и, после введения вирусных частиц, в день гибели мышей (nC), были протестированы с помощью ELISA с IgG-антителами с использованием антител IgG1 и IgG2a, специфичных к РСВ. Интенсивность абсорбции при длине волны 405 нм соответствует титру антител в крови мышей. Показаны каждое из индивидуальных значений, полученных для 5 (*) или 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.12 демонстрируется результат реакции нейтрализации для мышей, иммунизированных путем подкожного введения аденовирусного вектора, согласно настоящему изобретению, причем указанный аденовирусный вектор содержал молекулу нуклеиновой кислоты с оптимизированным содержанием кодонов, кодирующую F-белок РСВ (AdV-Fsyn), в различных дозировках (при возрастающих дозировках). Получали серийные разведения пробы сыворотки, полученные перед первой иммунизацией (prä), после первой иммунизации (post I), после второй иммунизации (post II) и, после введения вирусных частиц, в день гибели мышей (nC), и затем серию разведений протестировали в реакции нейтрализации с нейтрализующими антителами против РСВ. Приведены наибольшие значения для каждого разведения сыворотки, при которых инфекция РСВ ингибировалась на 50% (IC50). Показаны каждое из индивидуальных значений, полученных для 5 (*) или 6 мышей (черные символы), а также средние значения (поперечные полоски).
На Фиг.13 приведена карта челночной плазмиды, в которой клонировали молекулу нуклеиновой кислоты с оптимизированным содержанием кодонов, кодирующая F-белок, по рестрикционным сайтам HindIII и XhoI; или челночной плазмиды, которую использовали для встраивания молекулы нуклеиновой кислоты с оптимизированным содержанием кодонов, кодирующей F-белок, и которая содержит тетрациклинзависимый промотор (pS-DP-delta). Данный промотор выключен при помощи генетического переключающего элемента в клетках 293TRex-cells(Invitrogen).
На Фиг.14 показаны различия в экспрессии pFwt (экспрессионной плазмиды с последовательностью ДНК, кодирующей F-белок РСВ дикого типа), pIFwt (экспрессионной плазмиды с последовательностью ДНК, кодирующей F-белок РСВ дикого типа, с дополнительным интроном перед открытой рамкой считывания), pFsyn (экспрессионной плазмиды с последовательностью ДНК с оптимизированным содержанием кодонов, кодирующей F-белок РСВ) и pIFsyn (экспрессионной плазмиды с последовательностью ДНК с оптимизированным содержанием кодонов, кодирующей F-белок РСВ, с дополнительным интроном перед открытой рамкой считывания) после трансфекции в клетки Нер2, лизиса клеток спустя 48 часов после трансфекции, разделения белков клеточного лизата путем гель-электрофореза, переноса на нитроцеллюлозную мембрану и детекции с помощью специфических антител (Ab: анти-PCB-F; pcDNA3.1: плазмида без встроенного гена (пустая плазмида); Нер2: клетки без плазмиды; RSV: клетки, инфицированные РСВ (положительный контроль); kD: молекулярный вес в килодальтонах).
На Фиг.15 показаны результаты анализа интенсивности экспрессии. Экспрессию конструкции с оптимизированным содержанием кодонов, кодирующей F-белок РСВ, с интроном перед открытой рамкой считывания (pIFsyn), путем серийных разведении (от 1:102 до 1:104) клеточных лизатов сравнивали с экспрессией плазмиды с последовательностью дикого типа с интроном перед открытой рамкой считывания (pIFwt) в неразведенном клеточном лизате (1:1). Количество белка, полученного при экспрессии конструкции с оптимизированным содержанием кодонов, при разведении в 1000 раз (1:103) достоверно больше, чем количество белка, полученного с плазмиды с исходной последовательностью (kDa=молекулярный вес в килодальтонах).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом своем аспекте настоящее изобретение относится к молекуле нуклеиновой кислоты, которая, содержит последовательность нуклеотидов, кодирующую F-белок респираторно-синцитиального вируса (РСВ) или фрагмент указанного белка, причем указанная последовательность нуклеотидов содержит SEQ ID NO:1 или ее фрагмент. Данная последовательность отличается от известных последовательностей, кодирующих F-белок РСВ, поскольку имеет нуклеотидную замену в кодирующей последовательности. Эта замена приводит к образованию измененной аминокислотной последовательности F-белка РСВ, в которой в положении 241 находится валин вместо аланина. Такую молекулу нуклеиновой кислоты можно применять в качестве вакцины или в качестве компонента вакцинной композиции.
Термин «фрагмент» по отношению к нуклеиновой кислоте относится к части нуклеотидной последовательности, которая укорочена с 3'- и/или 5'-конца по сравнению с указанной нуклеиновой кислотой. В частности, такие фрагменты имеют размер по меньшей мере 30, предпочтительно по меньшей мере 60, и еще более предпочтительно по меньшей мере 100 нуклеотидов, и кодируют часть F-белка РСВ, обладающую достаточной иммуногенностью, чтобы вызывать иммунный ответ в организме.
Термины «иммуноген» или «иммуногенность» относятся к способности вещества, например пептида или белка, вызывать иммунный ответ в организме. Иммуногенность вещества можно определить, например, путем обнаружения антител.
С другой стороны, изобретение ориентировано на использование синтетических молекулы нуклеиновой кислоты, образованных из указанной молекулы нуклеиновой кислоты, причем указанные синтетические молекулы нуклеиновой кислоты оптимизированы по содержанию кодонов для экспрессии в организме-хозяине, в ткани-хозяине или клетке-хозяине.
Термин «синтетический» по отношению к нуклеиновой кислоте означает, в пределах настоящего изобретения, что данная молекула нуклеиновой кислоты не существует в природе. Синтетическая молекула нуклеиновой кислоты может быть, например, оптимизирована по содержанию кодонов.
Выражение «оптимизированная по содержанию кодонов» по отношению к нуклеиновой кислоте обозначает молекулу нуклеиновой кислоты, последовательность которой искусственно изменена таким образом, что повышен уровень ее экспрессии в организме-хозяине, т.е. образуется большее количество белка, который кодирует данная молекула нуклеиновой кислоты.
Ранее, попытки вызвать экспрессию F-белка респираторно-синцитиального вируса (РСВ) путем трансфекции экспрессионных плазмид, зависимых от полимеразы II, не приводили к успеху.
Клетки эукариот отличаются от клеток прокариот более выраженной компартментализацией внутриклеточного пространства для обеспечения прохождения сложных ферментативных реакций, необходимых для эффективной экспрессии белков, клеточного метаболизма и/или деления клетки. Ключевой особенностью репликации любого вируса является адаптация к клетке-хозяину и, в частности, к системе экспрессии клетки-хозяина. РНК-вирусы, которые реплицируются в цитоплазме клеток, являющихся их хозяевами, эволюционно развивались в условиях, существующих в цитоплазме клеток-хозяев. Так, собственная система транскрипции этих вирусов включает РНК-зависимую РНК-полимеразу, которая осуществляет синтез мРНК на матрице геномной РНК. По этой причине цитоплазматические РНК-вирусы не приспособлены к сложной среде ядра эукариотической клетки-хозяина. Таким образом, неэффективную экспрессию вирусных генов под контролем эукариотических промоторов можно объяснить отсутствием в этих генах элементов, необходимых для стабилизации пре-мРНК, процессинга мРНК и/или экспорта мРНК из ядра. Эффективной экспрессии вирусных генов можно достичь, изменив кодоны в вирусных генах на кодоны, более часто используемые в клетке-хозяине.
Для этой цели на основе последовательности нуклеиновой кислоты SEQ ID NO:1, согласно настоящему изобретению, была получена синтетическая последовательность, оптимизированная по содержанию кодонов, которая транслируется в идентичную белковую последовательность, но в которой присутствуют альтернативные варианты кодонов. В соответствии с данным изобретением, способ оптимизации кодонов включает следующие этапы: идентификация позиций кодонов в определенной открытой рамке считывания; сравнение частоты использования определенного кодона в организме-хозяине; в случае, если такой кодон используется не часто, замещение данного кодона кодоном, оптимальным для экспрессии; повторение этого процесса в отношении всего фрагмента гена; проверка новой последовательности гена в отношении отсутствия нежелательных последовательностей, которые могли появиться в результате замены кодонов, таких как, например, сайты полиаденилирования, нежелательные сайты рестрикции, сайты распознавания сплайсинга интронов и т.д.; сборка синтетических фрагментов гена и тестирование экспрессии в организме-хозяине или в клетке-хозяине.
Одним из примеров синтетической последовательности нуклеиновой кислоты, полученной в соответствии с указанным способом и оптимизированной по содержанию кодонов для экспрессии в клетках человека, содержит последовательность нуклеотидов SEQ ID NO:2 или состоит из указанной последовательности. В настоящем изобретении также рассматривают фрагменты указанной последовательности нуклеотидов, кодирующие части F-белка РСВ.
Применение нуклеотидной последовательности SEQ ID NO:2 позволило авторам настоящего изобретения добиться увеличения уровня экспрессии F-белка РСВ в клетках человека в 1000 раз, по сравнению с уровнем экспрессии, наблюдаемой при использовании последовательности дикого типа SEQ ID NO:1.
После оптимизации содержания кодонов последовательность встраивают в экспрессионную кассету, которая дополнительно содержит последовательности, способствующие эффективной экспрессии кодируемого белка в клетке-хозяине, предпочтительно в клетке человека. Такая экспрессионная кассета может содержать последовательность нуклеотидов, оптимизированную по содержанию кодонов, функционально связанную с последовательностями контроля транскрипции и трансляции, например с последовательностями промотора и/или терминатора.
Термин «кассета» или «экспрессионная кассета» относится к последовательностям нуклеотидов, согласно настоящему изобретению, которые содержат последовательности нуклеотидов, которые будут экспрессироваться. Благодаря наличию сайтов рестрикции на 5'- и 3'-концах последовательностей данную кассету/экспрессионную кассету можно легко встроить в вектор или плазмиду, а также удалить или переместить. Кроме кодирующей последовательности нуклеотидов, экспрессионная кассета обычно содержит последовательности контроля транскрипции и трансляции, например последовательности промотора и/или терминатора транскрипции, которые функционально связаны с последовательностью нуклеотидов и которые способствуют ее экспрессии в клетке-хозяине.
Термин «промотор» в настоящей заявке относится к участку цепи ДНК, который распознает РНК-полимераза. После того как РНК-полимераза распознает промоторный участок, образуется инициирующий комплекс, включающий связанную РНК-полимеразу, и начинается транскрипция. Существуют дополнительные регуляторы инициирующего комплекса, например активирующие последовательности (энхансеры) или ингибирущие последовательности(сайленсеры).
Подходящим промотором для осуществления экспрессии последовательностей нуклеотидов, согласно настоящему изобретению, является, например, CMV (промотор цитомегаловируса). Данный промотор может быть соединен с последовательностью нуклеотидов, согласно настоящему изобретению, в экспрессионной кассете для экспрессии в клетках человека.
В вектор можно встроить указанную экспрессионную кассету, содержащую последовательность нуклеотидов, согласно настоящему изобретению, соединенную с дополнительными последовательностями, необходимыми для экспрессии в клетке-хозяине.
Термин «вектор» относится к средствам, с помощью которых молекулы ДНК можно переносить в организм, или ткань, или клетку-хозяин. Существуют различные типы векторов, которые включают, например, плазмиды, космиды, вирусы, например аденовирусы, и бактериофаги.
Вектор, полученный таким образом, также входит в объем настоящего изобретения. Вектор предпочтительно представляет собой плазмидный или вирусный вектор, в частности аденовирусный вектор.
Аденовирусный вектор, который содержит последовательность нуклеотидов, в соответствии с настоящим изобретением, может включать участок, содержащий нефункциональный ген Е1, чтобы не допустить репликации вируса и выработки инфекционных вирусных частиц в клетке-хозяине. Предпочтительно, участок, содержащий ген Е1, удален или замещен вставкой экспрессионной кассеты. Дополнительно, такой вектор может также не иметь участка, содержащего ген Е3, который в норме ответственен за взаимодействие с иммунной системой хозяина. Такие рекомбинантные аденовирусы, например, описанные в патенте US 5,922,576, можно размножать в известных клеточных линиях («упаковочные линии»), например, 293-, 911- или PerC.6 клетки, которые экспрессируют вирусный ген Е1.
Для того чтобы получить такой аденовирусный вектор, экспрессионную кассету, которая содержит последовательность нуклеотидов, в соответствии с настоящим изобретением, можно встроить в плазмидный вектор, например, используя подходящие сайты рестрикции. Такой плазмидный вектор может содержать нуклеотидные последовательности аденовируса, которые обеспечивают гомологичную рекомбинацию с подходящей (каркасной) плазмидой, содержащей большую часть генома аденовируса. За счет рекомбинации можно затем получить аденовирусную челночную плазмиду, содержащую последовательность нуклеотидов, в соответствии с настоящим изобретением, в форме экспрессионной кассеты. Такая аденовирусная челночная плазмида способна, например, обеспечивать регулируемую экспрессию встроенной в нее нуклеотидной последовательности, в соответствии с настоящим изобретением. Указанным способом может быть получено большое количество аденовирусных векторов. Затем такие аденовирусные векторы можно использовать в качестве вакцинирующих векторов.
Для создания аденовирусных векторов, экспрессирующих F-белок, можно заменить промотор CMV на регулируемый промотор. При наличии такого промотора вектор можно поддерживать в клетках, которые содержат систему регуляции экспрессии F-белка РСВ, например, экспрессионную систему, регулируемую тетрациклином (клетки 293TRex). Например, клетки 293TRex используют для продукции и поддержания аденовирусного вектора.
Регулируемые промоторы - это промоторы, которые приводят к измененной экспрессии трансгена, с которым они соединены, при воздействии некоторых веществ, например при действии антибиотиков или белков, которые связываются со специфичной последовательностью ДНК. К таким регулируемым промоторам относится, например, промотор CMV, имеющий сайты связывания репрессора - тетрациклина (тетрациклин-регулируемый промотор), промотор, регулирующий экспрессию в зависимости от присутствия стероида экдизона, а также другие регулируемые экспрессионные системы.
Настоящее изобретение, таким образом, также в одном из своих аспектов относится к плазмидам, например описанным выше челночным плазмидам и аденовирусным векторам, содержащим нуклеотидные последовательности, согласно настоящему изобретению. Аденовирусный вектор должен предпочтительно содержать нуклеотидную последовательность SEQ ID NO:2 или фрагмент этой последовательности в форме экспрессионной кассеты с промотором, например промотором CMV. Особенно предпочтителен для настоящего изобретения аденовирусный вектор AdV-Fsyn.
Стандартные молекулярно-биологические подходы, которые применяют для приготовления и очистки конструкций ДНК, в соответствии с настоящим изобретением для приготовления аденовирусов и аденовирусных векторов, а также челночных плазмид, известны специалистам в данной области.
Аденовирусные векторы или плазмиды, которые содержат последовательность нуклеотидов, в соответствии с настоящим изобретением, можно применять в отношении субъекта, например человека, для того, чтобы вызвать иммунный ответ против РСВ.
Соответственно, в одном из своих дальнейших аспектов настоящее изобретение относится к иммуногенным композициям, которые содержат последовательности нуклеотидов SEQ ID NO:1 или 2, в соответствии с настоящим изобретением, или фрагменты данных последовательностей. В одной из таких композиций, последовательность нуклеотидов, в соответствии с настоящим изобретением, может быть представлена в форме вышеупомянутых плазмид или векторов, предпочтительно в форме аденовирусного вектора. Один из таких векторов обеспечивает транспорт молекул нуклеиновой кислоты, в соответствии с настоящим изобретением, в клетки человека, и экспрессию белка, который он кодирует. При этом белок экспрессируется в количестве, достаточном для того, чтобы вызвать соответствующий иммунный ответ.
Альтернативно, иммуногенные композиции могут также содержать белок, который кодируют указанные последовательности нуклеотидов.
В зависимости от желательного типа применения, иммуногенные композиции могут также содержать фармацевтически приемлемый носитель и/или наполнитель. Среди других веществ, наполнители также включают известные адъюванты.
Указанные иммуногенные композиции можно вводить различными способами, которые известны специалисту в данной области и которые включают, например, пероральные дозированные формы, например таблетки, капсулы, порошки, гранулы, растворы, суспензии, сиропы и эмульсии, или, альтернативно, инъекции, например внутривенные, внутрибрюшинные, подкожные или внутримышечные инъекции. Также возможно применение путем ингаляций или интраназально. Все указанные способы применения известны специалисту в данной области. Предпочтительными способами применения являются оральный, интраназальный, ингаляционный, а также подкожные или внутримышечные инъекции.
Способы приготовления иммуногенных композиций в форме, подходящей для требуемого типа применения, известны специалисту в данной области и, например, приведены в Remington: the Science and Practice of Pharmacy ("Remington's Pharmaceutical Sciences") of Gennaro A.R., 20th Edition 2000: Williams & Wilkins PA, USA. Например, молекулы нуклеиновой кислоты, в соответствии с настоящим изобретением, можно помещать в физиологически приемлемые растворы, например в стерильный физиологический раствор или в стерильный буферный раствор.
Также настоящее изобретение относится к использованию молекул нуклеиновой кислоты, плазмид, векторов или белков, в соответствии с настоящим изобретением, для приготовления композиций вакцин с целью вакцинации субъекта против заболеваний, вызываемых инфекцией РСВ. Данный субъект предпочтительно представляет собой человека. Осуществлять вакцинацию можно, например, по протоколу «прайм-буст».
Количество ДНК для осуществления экспрессии, которую вводят реципиенту при вакцинации, зависит в том числе от силы используемого промотора и иммуногенности продукта экспрессируемого гена. В общем случае, для введения иммунологически или профилактически эффективной дозы плазмидной векторной вакцины, при инъекции непосредственно в мышечную ткань, обычно применяют дозировку от 1 нг до 100 мг, предпочтительно от приблизительно 10 мкг до 300 мкг. Эффективной дозировкой для аденовирусов является приблизительно 106-1012 частиц, предпочтительно 107-1011 частиц.
Настоящее изобретение также относится к способу получения F-белка РСВ, при котором осуществляют экспрессию молекулы нуклеиновой кислоты, в соответствии с настоящим изобретением, в подходящей клетке-хозяине. В предпочтительном варианте реализации указанного способа молекула нуклеиновой кислоты, в соответствии с настоящим изобретением, оптимизирована по содержанию кодонов для экспрессии в указанной клетке-хозяине. Данный способ включает трансфекцию последовательности нуклеиновой кислоты, в соответствии с настоящим изобретением, например, в форме плазмиды в подходящую клетку-хозяин, экспрессию F-белка РСВ в указанной клетке-хозяине и, при необходимости, выделение и очистку F-белка из клеток. Способ предпочтительно является способом in vitro.
Дальнейший аспект настоящего изобретения относится к молекуле полипептида, полученной в результате экспрессии молекулы нуклеиновой кислоты SEQ ID NO:1 или 2, в соответствии с настоящим изобретением, или фрагмента данных молекул. В одном из вариантов реализации настоящего изобретения, указанный полипептид содержит или состоит из аминокислотной последовательности SEQ ID NO:3 или фрагмента указанной последовательности. Как уже отмечалось выше, указанная молекула полипептида может также входить в состав иммуногенных композиций, в соответствии с настоящим изобретением, и может быть использована для вакцинации.
Термин «фрагмент» по отношению к полипептиду обозначает белки, укороченные с C- и/или N-концов. Образованные в результате этого пептиды предпочтительно являются иммуногенными и имеют размер по меньшей мере 10 или более аминокислот, предпочтительно 20 или более аминокислот, и еще более предпочтительно 30 или более аминокислот.
Нижеследующие примеры приведены для более детальной иллюстрации настоящего изобретения и ни в коем случае не могут рассматриваться как его ограничение.
ПРИМЕРЫ
Пример 1: Культивирование РСВ
Пассаж РСВ осуществляли с применением клеток Нер2, инфицированные клетки хранили при -80°C. Клетки Hep2 или 293Т инфицировали путем добавления клеточного супернатанта, содержащего РСВ. Через 2 часа после добавления вируса супернатанты удаляли, к клеткам добавляли среду DMEM, содержащую 0.5% сыворотки эмбрионов телят (FCS) и 100 мкг/мл пенициллина G и сульфата стрептомицина.
Пример 2: Конструирование экспрессионной плазмиды RSV-F
Для конструирования экспрессионной плазмиды RSV-F цитоплазматическую РНК выделяли из клеток Нер2, инфицированных РСВ, используя Qiagen Rneasy® Minikit. После осуществления обратной транскрипции (ThermoScript™ RT-PCR system, Invitrogen) кДНК РСВ амплифицировали путем ПЦР (праймеры: прямой 5'-[GATCCAAGCTTCCACC]ATGGAGTTGC CAATCCTCAAA; обратный: 5'-[TCGACCTCGAG]TTAGTTACTAAATGCAATATTATTTATACC), используя Platinum® Taq DNA Polymerase (Invitrogen). Фрагмент размером 1,7 т.п.н. клонировали в векторе pcDNA3.1(+) (Invitrogen).
Оптимизацию содержания кодонов в открытой рамке считывания (ORF) дикого типа проводили в фирме Geneart (Regensburg, Germany). Затем синтезированные олигонуклеотиды лигировали друг с другом, и полученный фрагмент клонировали в плазмиде pUC57 и секвенировали.
Оптимизированную по содержанию кодонов рамку считывания клонировали в векторе pcDNA3.1(+) (Invitrogen) и pl векторе посредством рестрикции HindIII/XhoI. Делецию стоп-кодона открытой рамки считывания RSV-F вносили путем ПЦР-мутагенеза. Последовательность всех плазмид была подтверждена путем их секвенирования (Genterprise, Mainz, Germany).
Пример 3: Трансфекция клеток
Клетки 293Т и Нер2 культивировали в среде Игла, модифицированной Дульбекко (DMEM, Invitrogen) с добавлением 10% сыворотки эмбрионов телят (Invitrogen), пенициллина G и сульфата стрептомицина до конечной концентрации 100 мкг/мл. Трансфекцию клеток проводили в 25 см2 флаконах при добавлении 5 мкг плазмидной ДНК, приготовленной согласно примеру 2 посредством кальций-фосфатного совместного осаждения, как описано DuBridge et al. (DuBridge et al. (1987) Analysis of mutation in human cells by using an Epstein-Barr virus shuttle system. Mol. Cell Biol., 7, 379-387).
Пример 4: Гомологичная рекомбинация с использованием электропорации и приготовление электрокомпетентных бактерий BJ5183
Для приготовления рекомбинантных аденовирусных векторов использовали способ гомологичной рекомбинации. Посредством электропорации клетки бактерий были ко-трансформированы линеаризованным челночным вектором (Фиг.13) и аденовирусным вектором (pAdEasy-1; Q BIOgene, Carlsbad, CA USA). Благодаря наличию гомологичных участков в плазмиде в бактериях BJ5183 происходила рекомбинация; получающаяся в результате рекомбинации плазмида содержала ген устойчивости к канамицину, поэтому положительные клоны было возможно отобрать на чашке с агаром LBKan. Подобная векторная система, например, также доступна под названием AdEasy™ в фирме Q BIOgene (Carlsbad, СА, USA).
Для приготовления электрокомпетентных бактерий штамма BJ5183 (т.е. бактерий, способных подвергаться трансформации посредством электропорации) свежую колонию или бактерии из замороженной аликвоты культивировали в течение ночи в 10 мл среды LB со стрептомицином; затем такую предварительную культуру использовали для инокуляции культуры объемом 1 л. Бактерии выращивали при 37°C на горизонтальном шейкере (качалке) при 200-220 об/мин до достижения оптической плотности 0.6-0.8 (приблизительно 3 часа). После этого клетки собирали путем центрифугирования и инкубировали в течение 60 минут на льду. После инкубирования клетки осаждали центрифугированием при 2,600 g, при 4°C в течение 10 минут, а затем промывали 1 л ледяной воды с добавлением 10% глицерина и осаждали центрифугированием в течение 30 минут. После повторения этапа промывки клетки ресуспендировали в остаточном объеме 20 мл, переносили в контейнер объемом 50 мл и еще раз осаждали центрифугированием в течение 10 минут. Наконец, клетки ресуспендировали в остаточном объеме 3-5 мл, распределяли по аликвотам, замораживали в жидком азоте и хранили при -80°C.
Для осуществления гомологичной рекомбинации 40 мкл замороженной аликвоты бактерий BJ51831 оттаивали на льду в охлажденной кювете для электропорации и добавляли в кювету приблизительно 100 нг плазмидной ДНК аденовируса и приблизительно 1 мкг плазмидной ДНК челночного вектора. Электропорацию проводили при напряжении 2500 В. После добавления 300 мкл среды SOC бактерии инкубировали при 37°C в течение 1 часа на шейкере и затем рассевали на чашки LBKan, где бактерии росли в течение ночи.
ДНК выделяли в количестве, достаточном для анализа, из растущих клонов и оценивали. При обнаружении факта прохождения рекомбинации вектором повторно трансформировали бактерии штамма DH5α, чтобы предотвратить дальнейшие рекомбинационные события. В этом случае, 1 мкл ДНК добавляли к 50 мкл бактерий DH5α и проводили электропорацию.
Пример 5: Предварительное выделение плазмидной ДНК, клонированной in vitro или полученной в результате рекомбинации в бактериях BJ5183
Штаммы Escherichia coli XL2-Blue (Stratagene) и DH5α (Invitrogen) использовали для предварительного выделения плазмидной ДНК, клонированной in vitro или полученной в результате рекомбинации в бактериях BJ5183. Благодаря наличию гена устойчивости в использованных плазмидах было возможно проводить отбор на соответствующем антибиотике (ампициллин или канамицин). Трансформированные бактерии отбирали на чашках с агарозной средой LB и в жидкой культуре LB с добавлением соответствующего антибиотика. 3 мл культур после роста в течение ночи при 37°C на горизонтальном шейкере использовали в качестве предварительной культуры для предварительного выделения плазмид. Для выделения большего количества ДНК 100 мл или 250 мл среды LB инкубировали с 1 мл предварительной культуры в стерильных колбах Эрленмейера при 37°C в течение ночи на горизонтальном шейкере при 200-220 об/мин.
Пример 6: Трансфекция клеток с использованием кальций-фосфатного способа
Для выращивания аденовирусных векторов необходимо осуществить трансфекцию приготовленных аденовирусных плазмид (после линеаризации путем расщепления PacI и последующей очистки путем экстракции фенолом/хлороформом) в клетки T-REx™-293 (Invitrogen). Для этого использовали способ кальций-фосфатного совместного осаждения, при котором ДНК связывается с мембраной клетки посредством солевых комплексов и затем поглощается клеткой.
За 1 день перед трансфекцией, 800,000 клеток T-REx отобрали из культуры на логарифмической стадии роста, посеяли в 5 мл жидкой культуры в чистые стерильные флаконы 25 см2 и инкубировали в течение ночи при 37°C в инкубаторе.
К моменту трансфекции клетки были конфлюэнтны на 50%. За 1-4 часа перед трансфекцией культуральную среду заменяли на свежую культуральную среду. 15-20 мкг ДНК с 169 мкл стерильной воды были подготовлены на льду для трансфекции. К ним добавляли 31 мкл 2 мМ CaCl2 и осторожно перемешивали. К смеси H2O-ДНК-CaCl2 при комнатной температуре добавляли по капле 250 мкл 2х буферного раствора HBS. После последующего инкубирования в течение 10 минут при комнатной температуре наблюдали формирование легкого осадка. После этого смесь для трансфекции перемешивали еще раз и вносили по каплям в культуральную среду.
Среду меняли максимум через 18 часов инкубирования в инкубаторе, поскольку CaCl2 может быть токсичен для клеток.
Плазмиду с AdV-eGFP (аденовирусный вектор, который зкспрессирует белок eGFP) в каждом случае вносили параллельно посредством трансформации во вторую колбу с клеточной культурой, для того, чтобы можно было оценивать успешность трансфекции и развитие продукции аденовирусов по росту флуоресценции инфицированных клеток с использованием флуоресцентного микроскопа. Как правило, все клетки полностью подвергались лизису через одну неделю, и тогда супернатант с полученными аденовирусами отбирали и использовали для следующей инфекции для дальнейшего роста аденовирсных векторов.
Пример 7: Выращивание аденовирусов
Аденовирусные векторы выращивали в клетках T-REx™ 293 (Invitrogen). Выбор данной клеточной линии был обусловлен тем, что наличие в данных клетках тетрациклин-регулируемой системы экспрессии позволяет культивировать аденовирусы, которые экспрессируют гены, продукты которых являются токсичными для клетки, например, такие, как белок слияния РСВ. Например, при культивировании аденовирусов в других клеточных линиях экспрессия F-белка РСВ приводит к образованию синцитиев в клеточной культуре, что снижает продукцию вирусных частиц. Напротив, в клетках T-REx экспрессия F-белка РСВ при воспроизводстве вирусов супрессирована в отсутствие тетрациклина, поэтому в данных клетках образуется значительно больше вирусных частиц.
Выращивание аденовирусов в клетках T-REx проводили в течение множественных циклов инфекции. При каждом первом пассаже инфицировали 75 см2 культуральную колбу, при каждом последующем пассаже инфицировали 175 см2 культуральную колбу. Для инфекции в подходящий объем свежей среды вносили 3-8 мл супернатанта клеточной культуры, собранной на предыдущем пассаже. На временной точке начала пассирования клеточные культуры были конфлюэнтны приблизительно на 75%. В первые четыре часа после добавления вирусных частиц клетки регулярно перемешивали, чтобы увеличить частоту инфекции. После этого проводили смену среды (10-15 мл среды в 75 см2 колбе, 20 мл среды в 175 см2 колбе).
Развитие инфекции оценивали каждый день по ЦПЭ (цитопатическому эффекту), проявлявшемуся в форме разделения клеток. Вирусные частицы собирали после 3-6 дней, как только все клетки оказывались инфицированными и вымывались в раствор. В это время супернатант клеточной культуры удаляли и клетки поочередно замораживали при -80°C и подвергали оттаиванию при 25°C в водяной бане, повторяя процедуру трижды, чтобы из клеток, которые еще не разрушились, также высвободились произведенные ими вирусные частицы. После трех циклов замораживания/оттаивания клеточные остатки осаждали центрифугированием при 1000 g и 4°C в течение 10 минут. Супернатант, содержащий аденовирусы, хранили при -80°C и использовали для последующих инфекций.
Аденовирусные векторы пассировали на клетках T-REx до тех пор, пока не достигался максимально возможный титр (определяемый согласно способу ЕГП (единиц переноса гена), см. ниже), в идеале составляющий по меньшей мере 1010 ЕГП/мл. Тогда, для того, чтобы получить достаточное количество начального материала для последующей вирусной очистки, инфицировали 2-3 175 см2 культуральные колбы, а затем взятым оттуда супернатантом инфицировали 5 или 10 175 см2 культуральных колб.
Пример 8: Очистка и концентрирование проб аденовирусов
Очистку и концентрирование проб аденовирусов проводили с использованием набора Vivapure® AdenoPACK™ 100 kit (Sartorius) в по протоколу производителя. Авторам изобретения удалось достичь увеличения концентрации в 1000 раз. Этап смены буфера проводили на стадии финальной концентрации, и восстановленные аденовирусные частицы отбирали в буфере для хранения.
Пример 9: Определение титра аденовирусных частиц в препаратах
Для определения титра аденовирусных векторов использовали два различных способа.
При определении титра способом ЕОЧ (единицы оптических частиц) титр аденовирусных проб рассчитывали, определяя концентрацию ДНК путем фотометрии. Таким образом, определяли наличие всех ДНК-содержащих вирусных частиц, включая дефектные частицы, не способные инфицировать клетки или не несущие целевой ген. Преимуществами способа ЕОЧ являются его быстрота и воспроизводимость.
При определении титра способом ЕОЧ приготовляли серию разведений аденовирусных проб, например разведения 1:2, 1:5, 1:10, 1:20, 1:25 и 1:50. В соответствии с настоящим изобретением, для разведения очищенных аденовирусных проб использовали буфер для лизирования вирионов (0.1% SDS, 10 мМ Tris-HCl pH 7.4, 1 мМ ЭДТА в воде). Для каждой стадии разведения приготовляли бланковый раствор, представлявший собой аналогично разведенный в буфере для лизирования вирионов буфер для хранения (10% глицерин в фосфатно-солевом буфере Дюльбекко) (вместо аденовирусных проб). Абсорбцию при длине волны λ=260 нм (OD260) определяли после температурной инактивации препаратов, содержащих вирусы, при температуре 56°C в течение 10 минут, причем в каждом случае фотометр вначале калибровали по бланковому раствору. Значение ЕОЧ определяли исходя из значений OD260 по нижеследующей формуле, в которой значение коэффициента затухания (экстинкции) было выбрано равным 1.1×1012 [74]:
ЕОЧ/мл = OD260 × разведение пробы × 1.1×1012
В настоящей работе ЕОЧ определяли как среднее значений, полученных для индивидуальных разведений.
Поскольку при определении ЕОЧ (как описано выше) детектируются также дефектные частицы, проводили определение ЕПГ (единиц переноса гена); другими словами, определяли численность фракции инфекционных и способных к переносу генов (т.е. желаемых) частиц аденовирусных векторов среди частиц, определенных способом ЕОЧ, при серийном разведении клеток 293А с последующим специфическим иммуноцитохимическим окрашиванием F-белка РСВ, который экспрессируется в инфицированных клетках.
Осуществляли титрование культуры клеток 293А. На данном этапе 96-луночный планшет типа F, содержащий приблизительно 10,000 клеток 293А (в 100 мкл среды) в каждой лунке, помещали в инкубатор и культивировали. На следующий день планшет для титрования инфицировали. На данном этапе препарат аденовирусов добавляли в первую лунку планшета в разведении 1:1000 (10 мкл предварительно разведенного в соотношении 1:100 препарата добавляли к 100 мкл среды в первой лунке) и затем серийно разводили в 10 раз в последующих лунках по горизонтали (в каждом случае 10 мкл из одной лунки переносили в следующую). Серии разведений были сделаны в 3-5 повторениях. В 2-3 серии при этом не вносили препараты вирусов и использовали как негативный контроль, при аналогичном разведении.
Специфичное иммуноцитохимическое окрашивание F-белка РСВ проводили через 2-3 дня после инфекции планшета для титрования. Окрашивание было возможно в случае тестирования аденовирусного вектора Adv-Fsyn (аденовирусный вектор, содержащий нуклеотидную последовательность SEQ ID NO: 2), поскольку инфицированные данным вектором клетки зкспрессируют F-белок РСВ на клеточной поверхности.
На первом этапе окрашивания планшета для титрования удаляли среду и клетки фиксировали в течение 10 минут путем добавления 100 мкл 80% этанола в каждую лунку. После удаления этанола планшет высушивали на воздухе. После этого в каждую лунку для регидратации добавляли 200 мкл раствора PBS-T0.05% (0.05% (v/v) Tween 20 в фосфатном буфере) и выдерживали 5 минут. После удаления жидкости из лунок в каждую лунку добавляли 100 мкл первичного антитела 18F12, разведенного в соотношении 1:250 в растворе PBS-T0.05%. Затем планшет инкубировали при 37°C в течение 1 часа. Таким образом, на данном этапе антитела 18F12, выработанные против F-белка РСВ, должны связываться с молекулами F-белка РСВ, экспрессированными на поверхности инфицированных клеток. Несвязавшиеся антитела удаляли путем трехкратного промывания раствором PBS-T0.05%. Антитела кролика против Ig мыши Р0260 (Dako), который связывается с моноклональными антителами 18F12, использовали для детекции первичных антител в качестве связанного с ферментом вторичного антитела, при разведении 1:400 в растворе PBS-T0.05%. В каждую лунку данного раствора помещали 100 мкл, затем планшет еще раз инкубировали при 37°C в течение 1 часа. Затем, после трехкратной промывки раствором PBS-T0.05%, осуществляли реакцию окрашивания за счет активности фермента, связанного со вторичным антителом, путем добавления в каждую лунку 100 мкл окрашивающего раствора (200 мкл АЭК (3-амино-9-этилкарбазол, разведенный в 96% этаноле до концентрации 10 мг/мл) и 10 мкл H2O2 в 10 мкл фосфат-цитратного буфера). Реакция протекала при инкубировании планшета при 37°C в течение 30 минут, затем ее останавливали путем удаления окрашивающего раствора и добавления 100 мкл Н2О в каждую лунку.
Интерпретацию результатов окрашивания проводили под микроскопом, в каждой серии разведении оценивали число окрашенных клеток в последней лунке, где инфекция была видима за счет окрашивания, затем это число умножали на коэффициент разведения для данной лунки. Значение ЕПГ рассчитывали как среднее для ряда лунок.
Способ окрашивания, описанный выше, относится к определению титра препаратов аденовирусных векторов, экспрессирующих F-белок РСВ. Напротив, при определении титра препаратов AdV-eGFP окрашивание не проводили, и оценку планшета для титрования проводили посредством подсчета люминесцирующих зеленым цветом клеток при наблюдении под флуоресцентным микроскопом.
Пример 10: Изучение иммунизации на модели мышей BALB/c
В рамках первичного исследования иммунизации, проводили иммунизацию группы из 6 мышей BALB/c путем подкожного введения 1×108 ЕПГ (5×109 ЕОЧ) AdV-Fsyn. Вторичный иммунный ответ наблюдался на сроке после 4 недель. Для сравнения, группу из также 6 мышей иммунизировали путем подкожного введения плазмидной ДНК. В данном эксперименте использовали плазмиду pcDFsyn ED, кодирующую эктодомен синтетического F-белка РСВ, введение которой мышам BALB/c в предварительных экспериментах приводило к наилучшей защите после ДНК-иммунизации против РСВ (Фиг.1), по сравнению с плазмидами pcIFsyn и pcIFwt, кодирующими, соответственно, синтетический F-белок (полноразмерный) и F-белок РСВ дикого типа. В данном эксперименте FI-белок РСВ использовали в качестве контрольного варианта индукции иммунного ответа против РСВ, причем он являлся отличительной чертой PC-вирусов, которые были использованы для иммунизации и которые инактивировались под воздействием формалина. В контрольных группах, 6 мышей иммунизировали путем подкожного введения AdV-OVA (аденовирусный вектор, экспрессирующий овальбумин), и 3 мышей вообще не иммунизировали. Мышей инфицировали через 3 недели после вторичной иммунизации путем введения приблизительно 1×107 и.е. (инфекционных единиц) РСВ, очищенных из бляшек.
На 5 день после инфекции мышей умерщвляли под анестезией и собирали пробы БАЛ (бронхоальвеолярного лаважа). Из БАЛ выделяли вирусную РНК, и посредством количественной ОТ-ПЦР определяли содержание РНК РСВ, которое является мерой уровня защиты животных. Значительное количество частиц РСВ было отмечено в контрольных группах, среднее значение составило приблизительно 20,000 копий РСВ. После иммунизации pcDFsyn ED число копий РСВ существенно снижалось приблизительно в 55 раз (в среднем 360 копий на пробу БАЛ), а после иммунизации AdV-Fsyn у всех мышей указанной группы не удалось обнаружить частицы РСВ, что свидетельствует о снижении количества частиц РСВ по меньшей мере приблизительно в 400 раз, поскольку предельно возможное количество частиц, определяемое путем ОТ-ПЦР, составляет 50 копий. Таким образом, после вакцинации pcDFsyn ED животные оказываются в некоторой степени защищены от РСВ, хотя репликация РСВ в легких мышей лишь ингибирована, но не полностью предотвращается. Напротив, после вакцинации AdV-Fsyn животные оказываются полностью защищены от РСВ, поскольку у них больше невозможно обнаружить РСВ (Фиг.2).
В ходе эксперимента кровь брали у мышей на 0 неделе (перед первой иммунизацией) и 7 неделе (после второй иммунизации), а также в день умерщвления мышей, и из проб крови приготовляли сыворотку. В данном первичном исследовании иммунизации дополнительный забор крови после первой и второй иммунизации не проводился.
Титр специфичных к РСВ IgG1- и IgG2a-антител в крови мышей определяли путем анализа проб сыворотки способом ELISA. Поскольку стандартизация результатов ELISA до сих пор невозможна, результаты эксперимента можно сравнивать только в пределах групп одного эксперимента по иммунизации. В данном эксперименте все пробы оценивали одновременно на одном планшете для проведения ELISA.
Перед иммунизацией во всех группах мышей не были обнаружены специфичные, к PCB IgG1 или IgG2a-антитела. В контрольных группах титр антител оставался столь же низким в течение хода эксперимента. В отличие от контрольных групп, у мышей, которым вводили AdV-Fsyn или pcDFsynED, выявили явное увеличение титра РСВ-специфичных антител после второй иммунизации и в день гибели.
Титр антител IgG1 в обеих группах возрастал сходным образом, а титр антител IgG2a после вакцинации AdV-Fsyn возрастал во много раз сильнее, чем после вакцинации pcDFsynED. Двойная иммунизация AdV-Fsyn, таким образом, вызывает более сильный иммунный ответ по сравнению с системным образованием специфичных к РСВ IgG-антител и, в данном случае, вызывает выработку большего количества IgG2a, чем последующая двойная иммунизация pcDFsynED (Фиг.3). Тот факт, что у мышей, которым вводили AdV-Fsyn, титр антител IgG2a возрастает во много раз сильнее, чем антител IgG1, указывает на то, что после иммунизации AdV-Fsyn имеет место TH1-иммунный ответ, который может рассматриваться как частично позитивный, поскольку обострение заболевания, наблюдавшееся в 1960-х годах при иммунизации РСВ, инактивированными формалином, первоначально приписывали смещению иммунного ответа в пользу TH2-ответа.
Сыворотку крови мышей дополнительно исследовали путем реакции нейтрализации для обнаружения нейтрализующих антител против РСВ. Нейтрализующие антитела отсутствовали во всех группах мышей в начале эксперимента. Нейтрализующие антитела против РСВ не были обнаружены ни в одной из проб сыворотки, полученных от мышей контрольных групп, в то время как иммунизация мышей AdV-Fsyn или pcDFsynED приводила к образованию нейтрализующих антител. В данном эксперименте после вакцинации AdV-Fsyn наблюдали увеличение титра антител приблизительно в 13 раз по сравнению с вакцинацией pcDFsynED, таким образом, и в этом эксперименте иммунизация AdVsyn была более успешна, чем вакцинация pcDFsynED. По сравнению с пробами сыворотки, взятыми после второй иммунизации, наблюдали небольшое снижение титра нейтрализующих антител в каждой пробе в день умерщвления мышей, т.е. через некоторое время после введения РСВ, что можно объяснить расходованием данных антител в ходе инфекции (Фиг.4).
Таким образом, в экспериментах по изучению иммунизации показано превосходство AdV-Fsyn над pcDFsynED (индукция более высокого титра антител, специфичных к РСВ, сниженное количество РСВ в легких и, соответственно, лучшая защита мышей).
Пример 11: Иммунизация при помощи AdV-Fsyn посредством различных путей введения
Данный эксперимент планировался, чтобы исследовать влияние различных способов введения AdV-Fsyn на иммунизацию. В ходе эксперимента три группы из 6 мышей BALB/c подвергли иммунизации 1×108 ЕПГ (5×109 ЕОЧ) Adv-Fsyn, при этом вакцину вводили интраназально в первой группе, внутримышечно во второй группе и подкожно в третьей группе. Четвертую группу, также из 6 мышей BALB/c, не подвергали иммунизации и использовали как отрицательный контроль.
Временные точки для вакцинаций, забора крови и умерщвления мышей были заимствованы из первого исследования иммунизации (см. пример 10). В день умерщвления (5 дней после инфекции) у мышей отбирали БАЛ. После выделения вирусной РНК из БАЛ определяли содержание РНК РСВ посредством количественной ОТ-ПЦР, чтобы сделать вывод о степени защиты животных после вакцинации. В контрольной группе неиммунизированных мышей содержание РСВ было очень высоким, в то время как все три группы мышей, иммунизированных AdV-Fsyn, демонстрировали высокую степень защиты. За исключением одной мыши из группы животных, вакцинацию которых проводили внутримышечно, у которой РСВ был обнаружен в БАЛ в количестве 88 копий, ни в каких других пробах БАЛ РСВ не обнаружили, что свидетельствовало о том, что все мыши оказались очень хорошо защищены после вакцинации AdV-Fsyn, независимо от способа введения (наблюдали снижение числа РСВ по меньшей мере в 160 раз во всех трех группах мышей) (Фиг.5).
Хотя с использованием количественной ОТ-ПЦР, осуществленной на пробах РНК, выделенных из БАЛ мышей, не удалось выявить различий в количестве РСВ в легких мышей из различных групп, дополнительно была выделена РНК из тотального гомогената легких, которые были отобраны в день умерщвления животных. Данные пробы РНК также тестировали путем количественной ОТ-ПЦР на содержание РСВ, для того чтобы получить второе значение количества РСВ в легких мышей, и, таким образом, определить степень защиты мышей от РСВ. В этом эксперименте результаты количественной ОТ-ПЦР были преобразованы относительно содержания РНК в пробе выделенной РНК, поскольку при выделении РНК в препарате содержится тотальная РНК, а не только вирусная. Таким способом в контрольной неиммунизированной группе с использованием количественной ОТ-ПЦР было определено содержание РСВ в количестве приблизительно 160,000 копий/мкг РНК. Способ определения количества РСВ на основе препаратов РНК, выделенных из гомогената легких, таким образом, является значительно более чувствительным по сравнению со способом, основанным на выделении РНК из БАЛ, в котором обнаруживали РСВ в среднем приблизительно 8,000 копий на пробу БАЛ. Соответствующие отличия также наблюдали в группах иммунизированных мышей. Наилучшая защита достигалась после интраназальной иммунизации с использованием AdV-Fsyn. В данном эксперименте количество РСВ у всех мышей оказалось ниже уровня 50 копий, предельно выявляемых при использовании количественной ОТ-ПЦР. При преобразовании этого результата в соответствии с содержанием РНК в пробах, это означает, что животные, вакцинацию которых проводили интраназально, демонстрируют очень низкое содержание РНК РСВ. Даже если рассмотреть вариант, при котором в количественной ОТ-ПЦР выявлено 50 копий РСВ, 1 животное является полностью защищенным, в то время как другие 5 животных содержат 1-5 копий/мкг РНК. Таким образом, при интраназальной иммунизации достигается очень хорошая, практически полная защита от РСВ, при которой количество РСВ снижено приблизительно в 70,000 раз. Напротив, после внутримышечной и подкожной вакцинации с использованием AdV-Fsyn оказалось возможным обнаружить РСВ посредством количественной ОТ-ПЦР. В каждой группе, только 2 животных, имевших 2 копии РСВ/мкг РНК, можно считать очень хорошо защищенными, в то время как каждые из остальных 4 животных демонстрировали среднее количество РСВ, равное приблизительно 570 копиям/мкг РНК после внутримышечной вакцинации (снижение приблизительно в 280 раз), или равное приблизительно 275 копиям/мкг РНК после подкожной вакцинации (снижение/приблизительное 580 раз), соответственно (Фиг.6). При иммунизации с использованием AdV-Fsyn, интраназальный путь введения, таким образом, является наиболее подходящим для того, чтобы вызывать высокий уровень защиты от РСВ.
Пробы сыворотки крови мышей, полученные в ходе эксперимента, тестировали путем ELISA с использованием антител IgG и осуществляли реакцию нейтрализации, для того, чтобы обнаружить выработку системных антител, специфичных к РСВ.
До иммунизации во всех группах мышей было невозможно обнаружить антитела IgG1 или IgG2a, специфичные к РСВ. В контрольной группе титр антител оставался столь же низким, даже в более поздних пробах сыворотки. В отличие от контроля, в трех группах мышей, подвергнутых вакцинации с использованием AdV-Fsyn, наблюдали явное возрастание титра специфичных к РСВ антител IgG1 и IgG2a. В данном случае, возрастание титра зависело от способа введения AdV-Fsyn, поскольку титр антител у мышей, подвергнутых вакцинации интраназально (i.n.), внутримышечно (i.m.) и подкожно (s.c.), различался во всех случаях. В основном, довольно сильно варьировал титр антител IgG2a, подкожная иммунизация приводила к возрастанию количества антител IgG2a, во много раз большему, чем интраназальная и внутримышечная иммунизация. Напротив, варьирование титра IgG1 было не столь выражено, поскольку выработка антител IgG1 у мышей всех групп оказалась более слабой, чем выработка антител IgG2a. Несмотря на это было очевидно, что подкожная иммунизация вызывает наиболее слабое возрастание количества IgG1. Та же ситуация может быть продемонстрирована на основании результатов первого исследования иммунизации, в котором подкожная вакцинация с использованием AdV-Fsyn вызывала возрастание титра антител, значительно более выраженное для IgG2a, чем для IgG1, что свидетельствует о наличии TH1-опосредованного иммунного ответа. Тот же результат был получен и во втором эксперименте при подкожной вакцинации. Напротив, при внутримышечной и интраназальной иммунизации с использованием AdV-Fsyn соотношение IgG2a/IgG1 было ниже. Хотя при внутримышечной вакцинации антител IgG2a образовывалось больше, чем антител IgG1, при интраназальной иммунизации соотношение IgG2a и IgG1 было практически выровнено (Фиг.7). TH1-опосредованный путь, таким образом, сильнее активируется в иммунном ответе против РСВ при подкожной иммунизации. Однако соотношение TH1 (IgG2a) и TH2 (IgG1) также выровнено при интраназальной вакцинации, что свидетельствует в данном случае о балансе между TH1- и TH2-ответами. Таким образом, в соответствии с распределением классов IgG антител, при всех трех способах введения не наблюдается дополнительного TH2-ответа, который имеет значение при вакцинации против РСВ.
Более того, дальнейшее возрастание титра антител, относящихся к обоим классам IgG, имело место в пробах сыворотки, взятых после второй иммунизации, по сравнению с пробами сыворотки, взятыми после первой иммунизации, у всех трех групп мышей, иммунизированных с использованием AdV-Fsyn, причем возрастание титра было наименьшим при интраназальной иммунизации и наибольшим при подкожной иммунизации (Фиг.7). Можно заключить, таким образом, что вакцинация с использованием AdV-Fsyn, вызывающая дальнейшее возрастание титра антител, существенна для выработки качественного иммунитета против РСВ.
Также еще раз было продемонстрировано путем реакции нейтрализации, что вакцинация с использованием AdV-Fsyn вызывает очень сильный специфический ответ за счет выработки сывороточных антител против РСВ; перед первой иммунизацией было невозможно обнаружить нейтрализующие антитела против РСВ во всех группах мышей, титр данных антител не возрастал в контрольной группе неиммунизированных мышей, однако в трех группах мышей, подвергнутых вакцинации с использованием AdV-Fsyn, наблюдали сильное возрастание титра нейтрализующих антител, специфичных к РСВ. Так же, как и в случае ELISA с использованием IgG, а также при количественной ОТ-ПЦР РСВ (гомогената легких), в данном эксперименте наблюдались различия в зависимости от способа введения. Например, интраназальная иммунизация приводила к наиболее сильному увеличению нейтрализующей активности, причем титр возрастал приблизительно в 200 раз. Также, возрастание титра после интраназальной иммунизации было в 10 раз больше, чем после внутримышечной вакцинации (в данном эксперименте наблюдали возрастание титра приблизительно в 20 раз), и в 6 раз выше, чем после подкожной вакцинации (в данном эксперименте наблюдали возрастание титра приблизительно в 35 раз). Таким образом, было показано, что иммунизация с использованием AdV-Fsyn вызывает очень хороший ответ, выражающийся в выработке нейтрализующих антител против РСВ, независимо от способа введения (интраназально, внутримышечно, подкожно), причем в случае интраназального способа наблюдается наиболее сильный ответ (Фиг.8).
Далее в данном эксперименте, так же, как и ранее с использованием ELISA, было показано, что вторичная иммунизация вызывает дальнейшее возрастание количества антител. Нейтрализующая активность сыворотки значительно увеличивалась после вторичной иммунизации по сравнению с сывороткой, полученной после первой иммунизации, причем более сильное увеличение наблюдали в группе животных, иммунизированных интраназально (приблизительно в 14 раз), и наиболее слабое увеличение наблюдали в группе животных, иммунизированных подкожно (приблизительно в 2 раза) (Фиг.8).
В целом, результаты реакции нейтрализации демонстрируют большую аналогию с результатами количественной ОТ-ПЦР на РНК, выделенной из гомогената легких, чем с результатами ELISA. Например, титр выработанных нейтрализующих антител, специфичных к РСВ, соответствует снижению количества РСВ в легких, но не титру специфичных к РСВ антител, выявленных в тесте ELISA. Эти результаты позволяют сделать вывод, что в тесте ELISA выявляются не только нейтрализующие антитела, специфичные к РСВ, но также и другие антитела, выработанные против РСВ, но не являющиеся нейтрализующими. Поскольку нейтрализующие антитела, специфичные к РСВ, вносят существенный вклад в выработку защиты против РСВ, что становится ясно из корреляции между титром нейтрализующих антител и снижением количества РСВ в легких, при оценке степени защиты, возникающей после вакцинации, следует полагаться на результаты реакции нейтрализации, нежели на результаты теста ELISA.
Очевидно, наилучший результат вакцинации был достигнут в исследовании иммунизации при интраназальной иммунизации, так как после интраназальной иммунизации с использованием AdV-Fsyn, с одной стороны, наблюдали наибольший титр нейтрализующих антител и, с другой стороны, количество РСВ в легких было сильнее всего (почти полностью) снижено. Интраназальный способ введения, таким образом, является предпочтительным при вакцинации с использованием AdV-Fsyn по протоколу «прайм-буст».
Пример 12: Подкожная иммунизация с использованием AdV-Fsyn в различных дозировках (увеличение дозы)
В данном эксперименте изучали влияние дозы вакцины на иммунизацию при подкожном введении AdV-Fsyn. Для этого четыре группы мышей, по 6 мышей BALB/c в каждой, были подвергнуты иммунизации путем подкожного введения AdV-Fsyn в дозировках от 2×105 до 2×108 ЕПГ (от 1×107 до 1×1010 ЕОЧ). Пятую группу мышей, также состоящую из 6 мышей BALB/c, не подвергали иммунизации (негативный контроль). Временные точки для вакцинаций, отбора крови и умерщвления мышей были аналогичны указанным моментам времени для первого исследования иммунизации (см. пример 10).
В день умерщвления (5 дней после инфекции) собирали БАЛ и гомогенат легких мышей. После выделения вирусной РНК из БАЛ и тотальной РНК из гомогената легких проводили количественную ОТ-ПЦР, чтобы определить количество РСВ в выделенных пробах РНК и сделать вывод о степени защиты животных после вакцинации. В пробах РНК, выделенных из БАЛ, а также в пробах РНК, выделенных из гомогенатов легких, количество РСВ было очень высоким в случае неиммунизированных мышей контрольной группы, причем определение количества копий РСВ снова было явно более чувствительным в случае проб РНК, выделенных из гомогената легких.
Во всех четырех группах мышеи, подвергнутых иммунизации, наблюдали хорошую защиту, при определении способом количественной ОТ-ПЦР при анализе проб РНК, выделенных из БАЛ, поскольку ни у одной мыши не наблюдали детектируемых количеств РСВ (что соответствует снижению их численности по меньшей мере приблизительно в 95 раз) (Фиг.9).
Напротив, при определении количества РСВ при более чувствительной количественной ОТ-ПЦР при анализе проб РНК, выделенных из гомогената легких, оказалось возможно обнаружить РСВ даже у иммунизированных мышей, причем число копий РСВ было сопоставимо во всех четырех группах мышей, подвергнутых иммунизации. Например, во всех группах мышей, подвергнутых иммунизации, количество РСВ снижалось приблизительно в 340 раз, с числа копий в среднем около 47,000 до в среднем около 140 копий (Фиг.10). Все иммунизированные мыши, таким образом, оказались защищены в сходной степени, независимо от дозы вакцины, хотя наблюдаемая защита оказалась хорошей, но не полной. Это означает, что защита, вызываемая подкожной вакцинацией AdV-Fsyn, является ограниченной и не может быть далее увеличена посредством увеличения дозы вакцины. Таким образом, с одной стороны, низкая дозировка вакцины является столь же эффективной, как и высокая дозировка, при подкожной вакцинации для развития хорошей защиты. С другой стороны, подкожный способ введения не является оптимальным для вакцинации с использованием AdV-Fsyn, поскольку в данном эксперименте (в отличие от интраназальной вакцинации в предыдущем эксперименте) наблюдается лишь ограниченная защита, вызванная вакцинацией.
Пробы сыворотки крови мышей, полученные в ходе эксперимента, тестировали путем ELISA с использованием антител IgG и осуществляли реакцию нейтрализации, для того, чтобы обнаружить выработку системных антител, специфичных к РСВ.
До проведения иммунизации, IgG1 или IgG2a антитела, специфичные к РСВ, было невозможно выявить путем теста ELISA во всех группах мышей. Также в течение эксперимента не было выявлено возрастания титра антител в группе неиммунизированных животных. Напротив, в четырех группах мышей, вакцинацию которых проводили путем подкожного введения AdV-Fsyn, наблюдали явное возрастание титра антител IgG1, а также IgG2, специфичных к РСВ. В данном эксперименте - в отличие от количественной ОТ-ПЦР на РСВ - наблюдаемое возрастание титра зависело от дозы вакцины. В случае IgG1 антител наблюдали лишь минимальные различия между группами мышей, поскольку, как было ранее показано в исследованиях иммунизации, при подкожной вакцинации титр вырабатываемых IgG1 антител невысок ввиду того, что иммунный ответ развивается по TH1-опосредованному механизму. Возрастание титра антител IgG1, специфичных к РСВ, во всех четырех группах, таким образом, оказалось одинаково слабым. Чуть более сильное возрастание титра можно вызвать лишь введением очень большой дозы вакцины. Напротив, в отношении IgG2a антител для четырех групп мышей было показано явно варьирующее возрастание титра, зависящее от дозы вакцины, так что прямая зависимость между дозой вакцины и возрастанием титра здесь также имеет место. Например, титр возрастал по-разному, в зависимости от дозы вакцины, не только после первой, но и после второй иммунизации. Хотя после первой иммунизации титр возрастал от одного значения дозы до следующего (от группы мышей до следующей группы) относительно линейно, другими словами, приблизительно в той же степени в каждой группе по отношению к предыдущей, после вторичной иммунизации наблюдали экспоненциальную зависимость, поскольку вторичная иммунизация при низкой дозе оказывала только слабое действие на возрастание титра, но при высокой дозе возрастание титра являлось значительным. Таким образом, подкожная иммунизация с использованием AdV-Fsyn вызывает дозозависимое возрастание титра антител, специфичных к РСВ, в отличие от влияния на количество РСВ, определенного в соответствии с методикой количественной ОТ-ПЦР.
Хотя вторичная иммунизация при высокой дозировке приводила к сильному возрастанию титра, вряд ли любое увеличение титра может быть вызвано введением низких дозировок при вторичной иммунизации, так что, поскольку обсуждается титр антител, специфичных к РСВ, определенный в соответствии с методом ELISA, видимо, вторичная иммунизация имеет смысл при двух наиболее высоких дозировках (Фиг.11).
Также была проведена реакция нейтрализации для нейтрализующих антител, специфичных к РСВ. Титр антител было невозможно обнаружить в группах до иммунизации и неиммунизированной контрольной группе. Напротив, после подкожной вакцинации AdV-Fsyn образовывались нейтрализующие антитела. В данном эксперименте, в реакции нейтрализации наблюдали другую картину, чем при анализе методом ELISA. В данном случае явную зависимость выработки нейтрализующих антител от дозы наблюдали уже после первой иммунизации, причем титр возрастал экспоненциально с ростом дозы. Например, титр при дозе 2×105 ЕПГ (1×107 ЕОЧ) возрастал приблизительно в 2.6 раза, при дозе 2×106 ЕПГ (1×108 ЕОЧ) возрастал приблизительно в 3.3 раза; при дозе 2×107 ЕПГ (1×109 ЕОЧ) возрастал приблизительно в 21 раз; при дозе 2×108 ЕПГ (1×1010 ЕОЧ) возрастал приблизительно в 36 раз.
Таким образом, несмотря на то, что в тесте ELISA после первичной иммунизации наблюдали лишь незначительный эффект в зависимости от увеличения дозы, нейтрализующие антитела активнее вырабатываются при введении высоких доз вакцины, чем низких доз. Напротив, после вторичной иммунизации, в реакции нейтрализации (в отличие от ELISA) зависимость от дозы более не прослеживалась. Во всех группах иммунизированных животных титр антител возрастал независимо от дозы вакцины и достигал максимального значения после вторичной иммунизации, причем в каждом случае наибольшее разведение сыворотки, при котором инфекция РСВ подавлялась нейтрализующими антителами на 50% (IC50), составляло в среднем 1:295. Это означает, что при двукратной подкожной иммунизации AdV-Fsyn может быть достигнуто лишь одно максимальное значение титра нейтрализующих антител, и оно не может быть впоследствии увеличено путем повышения дозы. Данный результат согласуется с результатом, полученным методом количественной ОТ-ПЦР при анализе проб РНК, выделенных из гомогената легких, поскольку в данном случае также наблюдали сравнительно хорошую защиту (сходное снижение количества РСВ) во всех группах иммунизированных мышей, независимо от дозы вакцины, что еще раз демонстрирует, что антитела, выявляемые в реакции нейтрализации, вносят существенный вклад в защиту от инфекции РСВ. Таким образом, результат реакции нейтрализации показывает, так же, как и результат количественной ОТ-ПЦР при определении количества РСВ, что хорошая защита от инфекции РСВ может быть достигнута посредством двукратной подкожной иммунизации AdV-Fsyn при использовании низких доз вакцины, и эта защита далее уже не может быть увеличена путем повышения дозы вакцины. Как можно видеть из реакции нейтрализации, тем не менее, вторичная иммунизация представляется абсолютно необходимой для того, чтобы при введении низких доз вакцины вызвать столь же хорошую защиту, как и при введении высоких доз вакцины (Фиг.12).
Соответственно, при двукратной подкожной иммунизации с использованием AdV-Fsyn может быть достигнута лишь ограниченная защита, поскольку максимум защиты, определяемый по снижению количества РСВ в легких и повышению титра нейтрализующих антител, не может быть далее увеличен, даже путем увеличения дозы. Данный результат подкрепляет вывод, сделанный из предыдущего исследования иммунизации, о том, что предпочтительным способом введения является интраназальный способ. Далее, поскольку после вторичной иммунизации во всех группах мышей достигался сходный титр нейтрализующих антител, и количество РСВ в легких также снижалось до сходного уровня, вероятно, при подкожной иммунизации с использованием AdV-Fsyn низкая доза AdV-Fsyn является значимой для успешности вакцинации, при выборе стратегии «прайм-буст».
Пример 13: Увеличение экспрессии F-белка РСВ при использовании последовательностей, оптимизированных по содержанию кодонов
После включения (трансфекции) экспрессионных плазмид pFwt (экспрессионной плазмиды с последовательностью ДНК, кодирующей F-белок РСВ дикого типа), pIFwt (экспрессионной плазмиды с последовательностью ДНК, кодирующей F-белок РСВ дикого типа, с дополнительным интроном перед открытой рамкой считывания), pFsyn (экспрессионной плазмиды с последовательностью ДНК с оптимизированным содержанием кодонов, кодирующей F-белок РСВ) и pIFsyn (экспрессионной плазмиды с последовательностью ДНК с оптимизированным содержанием кодонов, кодирующей F-белок РСВ, с дополнительным интроном перед открытой рамкой считывания) в клетки Нер2, данные клетки подвергали лизису в течение последующих 48 часов. Белки из клеточного лизата разделяли посредством гель-электрофореза в соответствии с их размером и затем переносили на нитроцеллюлозную мембрану.
В клеточных лизатах определяли количество экспрессирующегося F-белка РСВ (Фиг.14). В качестве контроля использовали плазмиду, не несущую дополнительный ген (пустая плазмида, pcDNA3.1), клетки без плазмиды (Нер2) и клетки, инфицированные РСВ (позитивный контроль: RSV). Результаты демонстрируют, что экспрессия белка достигается лишь при использовании последовательностей с оптимизированным содержанием кодонов (при сравнении pFwt или pIFwt с pFsyn или pIFsyn).
Экспрессию конструкции с оптимизированным содержанием кодонов (pIFsyn) сравнивали посредством серийных разведении (от 1:102 до 1:104) клеточных лизатов с экспрессией плазмиды, несущей исходную последовательность (pIFwt) в неразведенном клеточном лизате (1:1) (Фиг.15). Количество F-белка РСВ, выработанного в результате экспрессии конструкции с оптимизированным содержанием кодонов при разведении в 1000 раз (1:103), было достоверно выше, чем количество данного белка, выработанного в результате экспрессии плазмиды с исходной последовательностью (kDa=молекулярный вес в килодальтонах).
Данные результаты демонстрируют, что использование последовательности нуклеиновой кислоты SEQ ID NO: 2 с оптимизированным содержанием кодонов, в соответствии с настоящим изобретением, позволяет неожиданно сильно увеличить экспрессию F-белка РСВ в клетках (Фиг.14, Фиг.15). В отличие от известных примеров, когда экспрессия возрастает обычно в 50 раз, и максимально в 100 раз, в случае использования нуклеотидной последовательности в соответствии с настоящим изобретением наблюдают увеличение экспрессии F-белка РСВ более чем в 1000 раз. В отличие от других вирусных белков, например белка VSV-G, повышения экспрессии F-белка РСВ невозможно добиться путем простого добавления интрона перед открытой рамкой считывания.





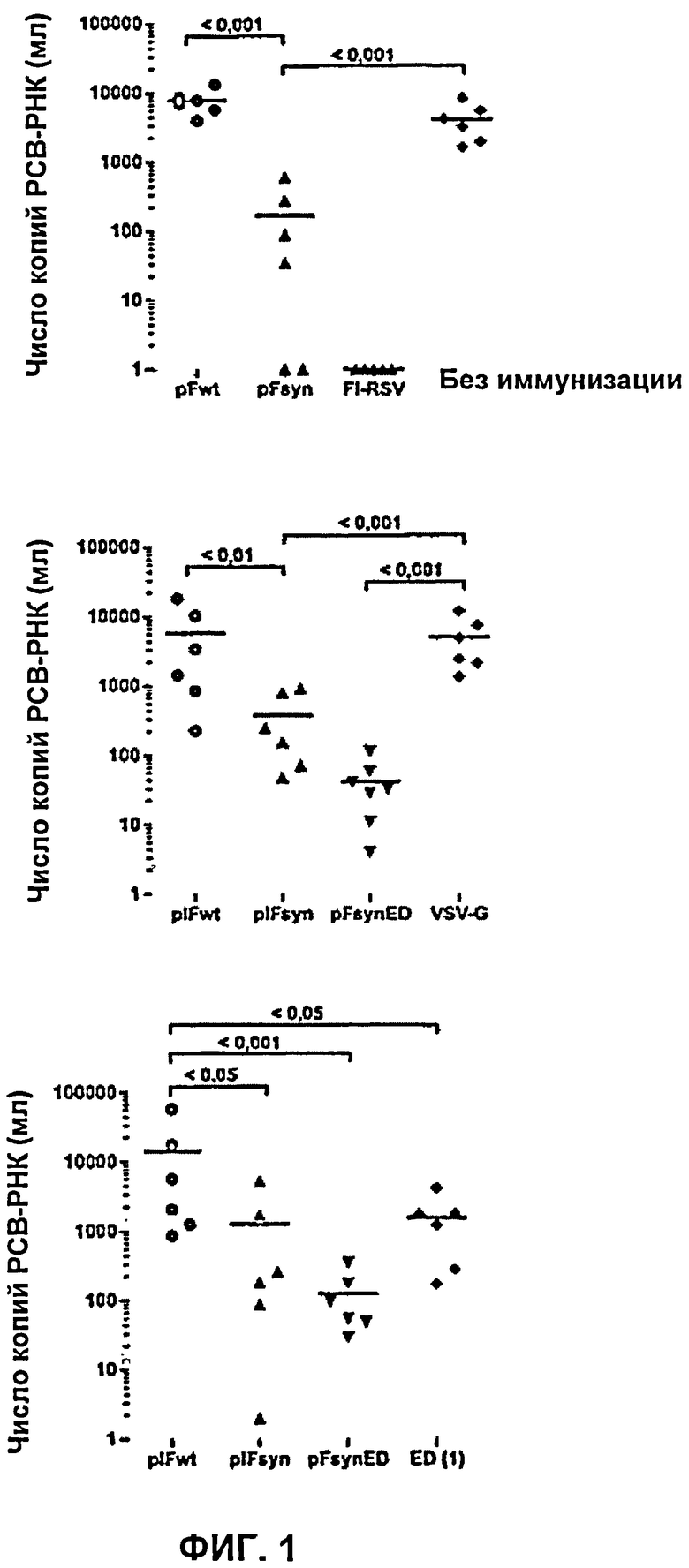
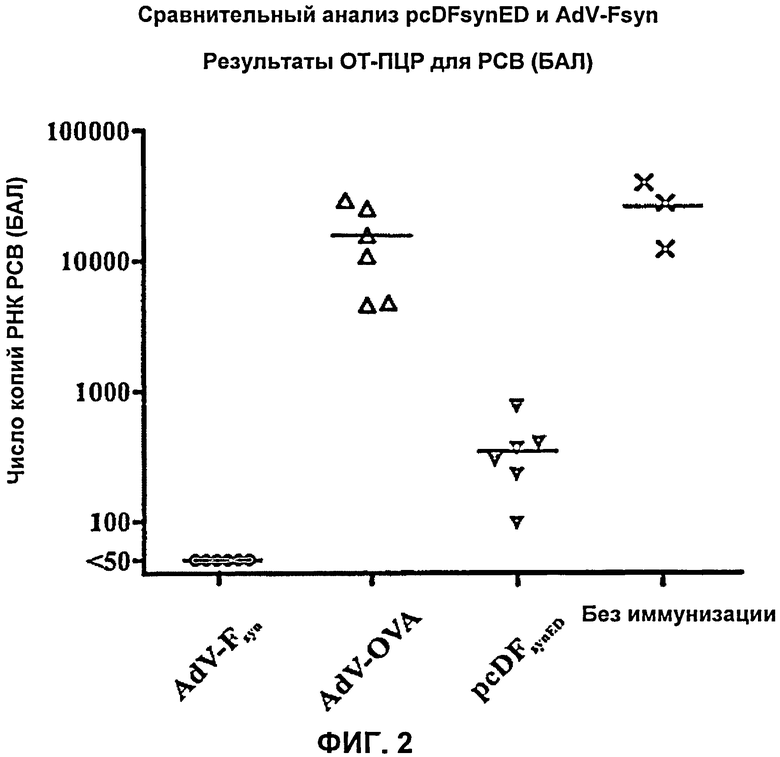
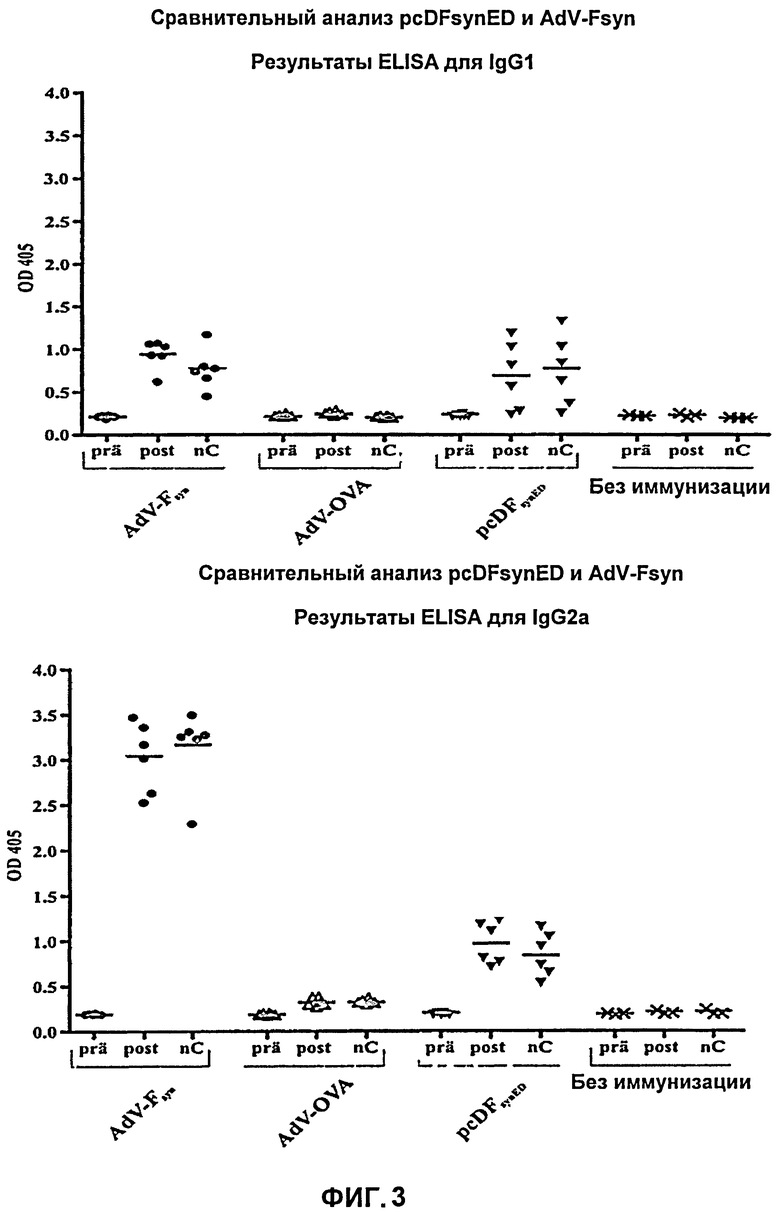
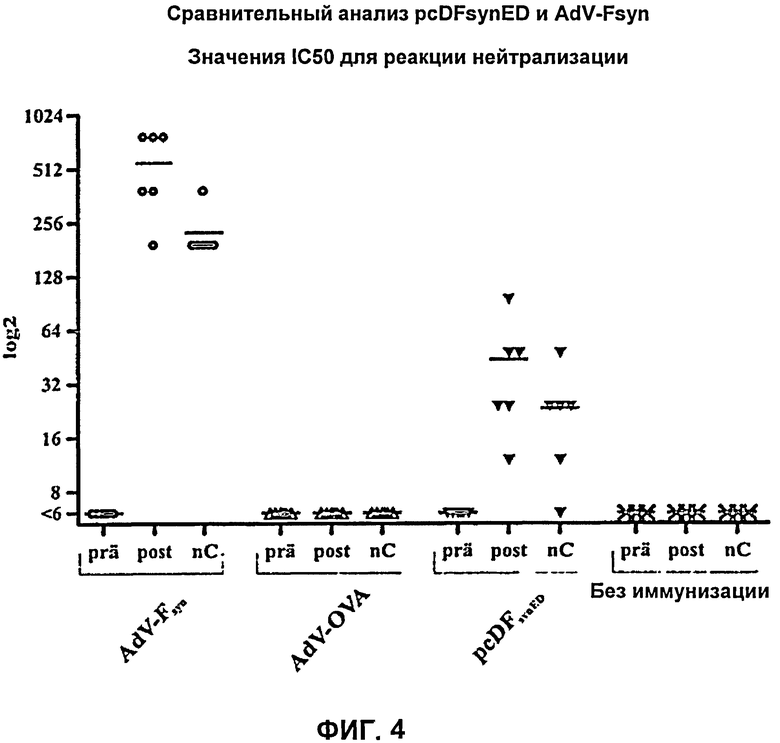
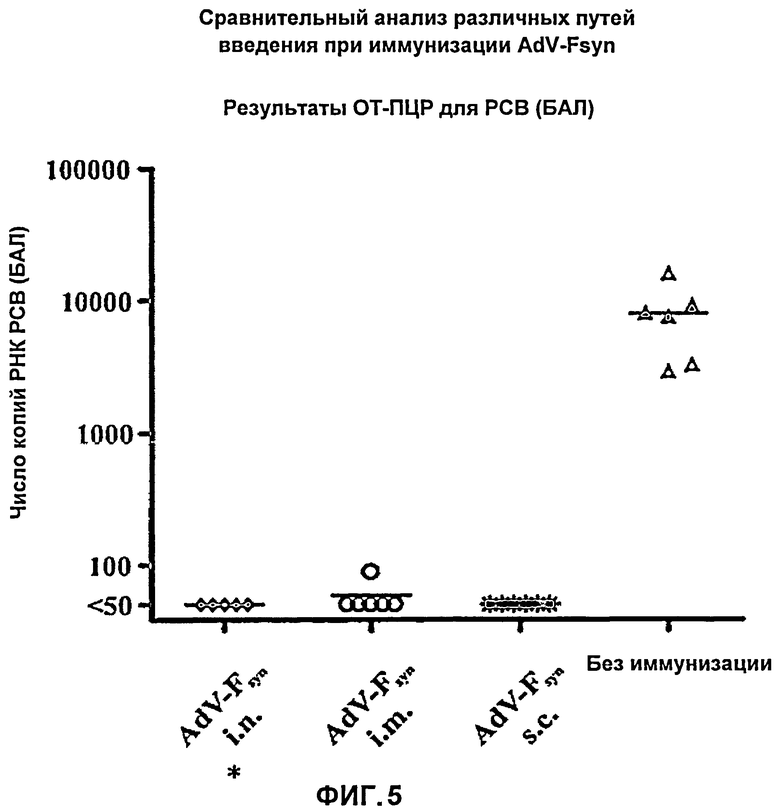
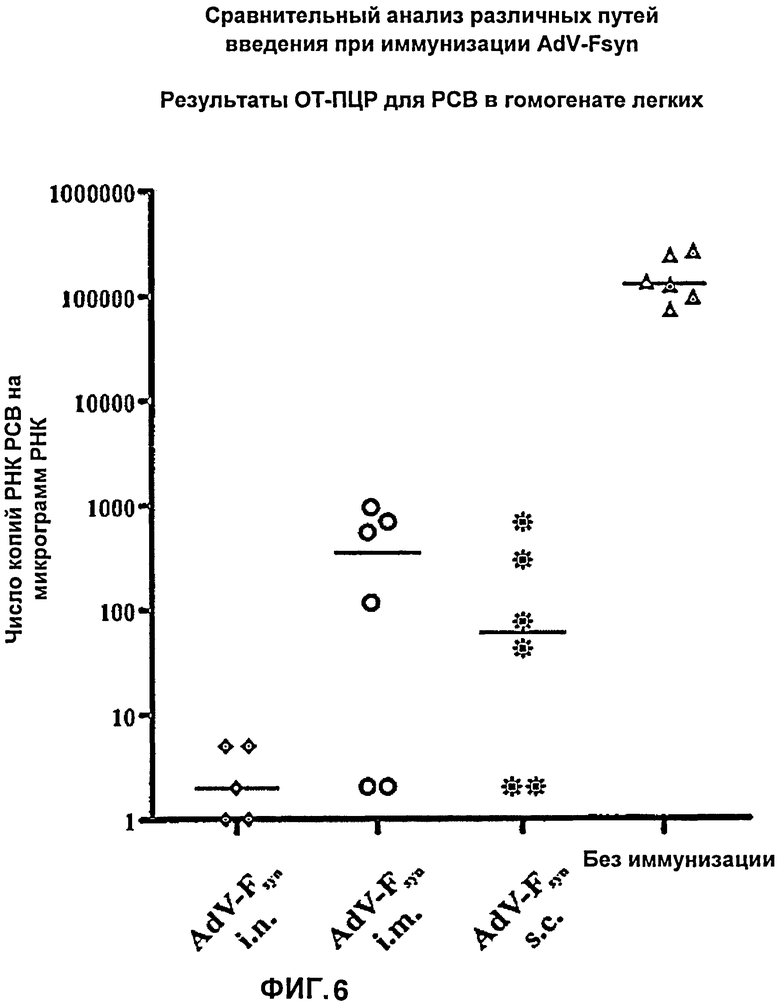
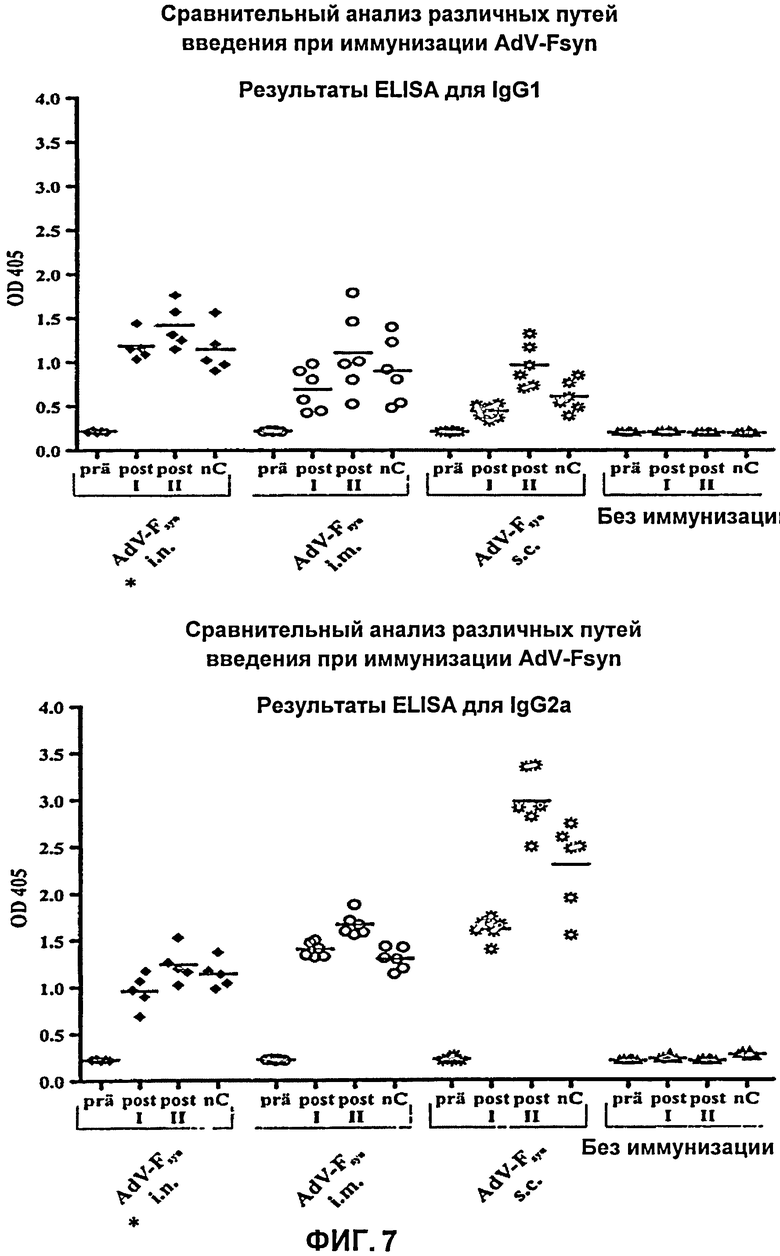
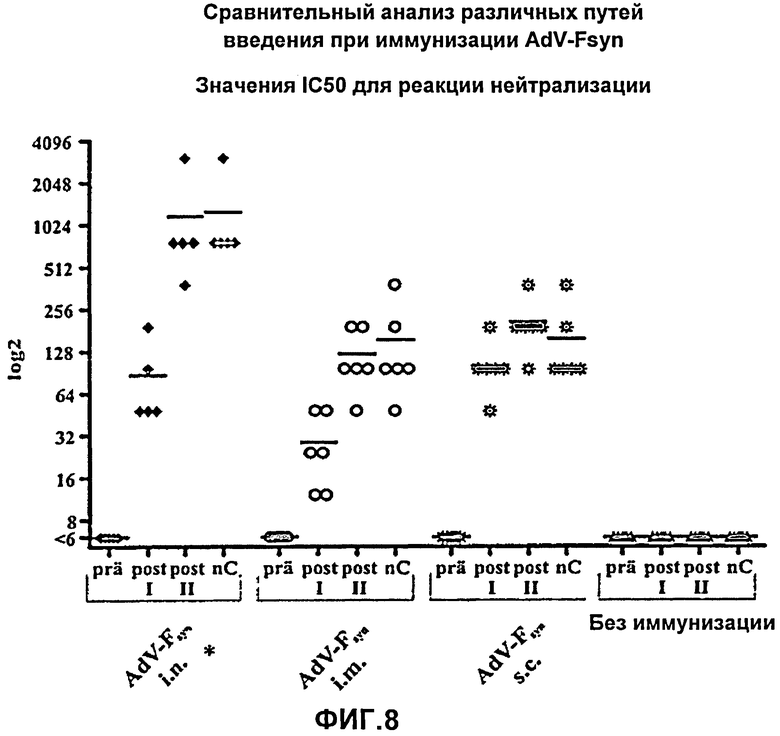
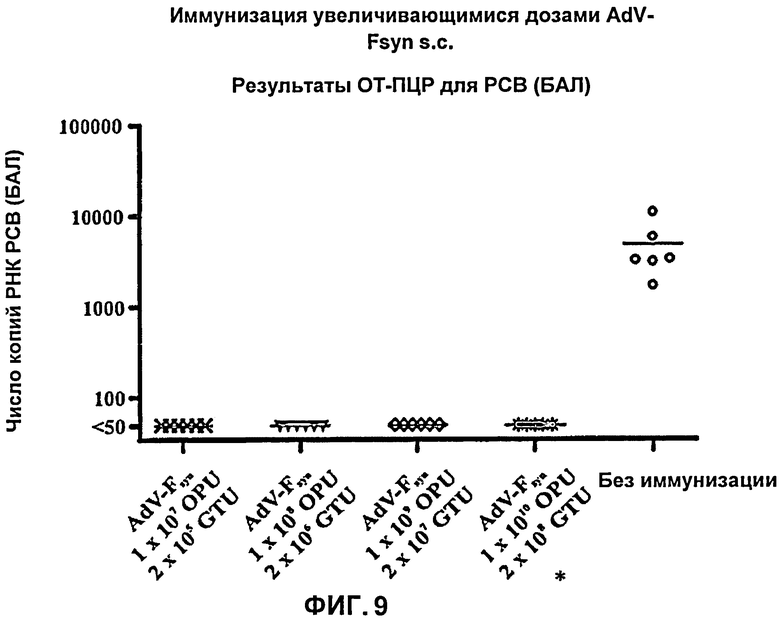
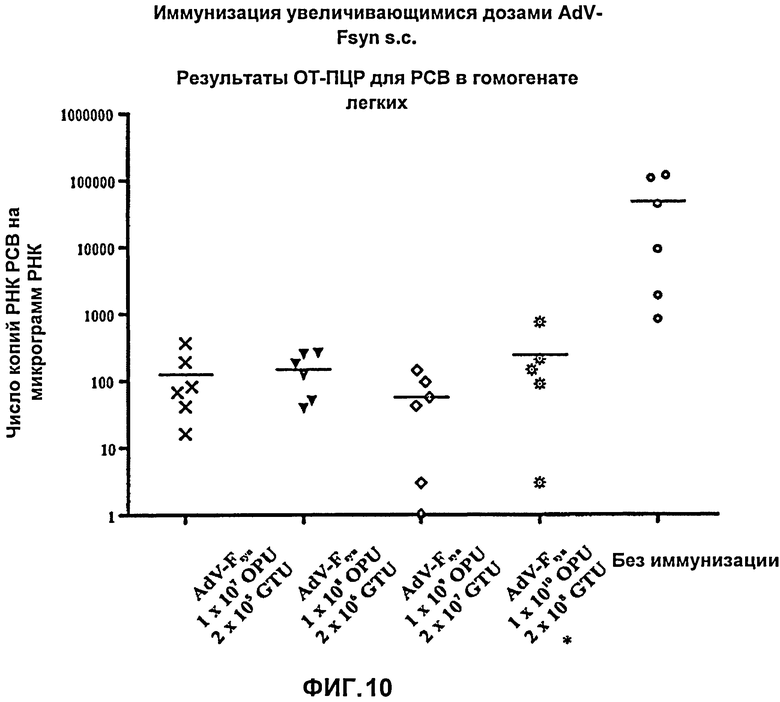
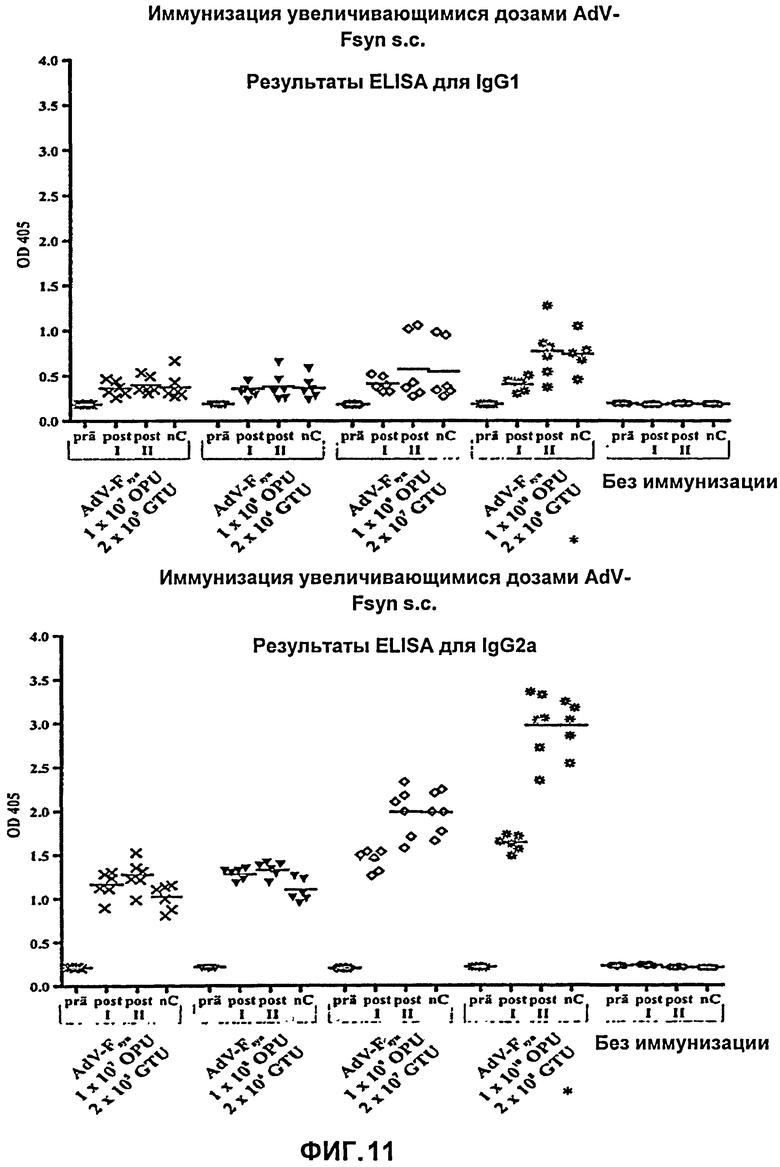
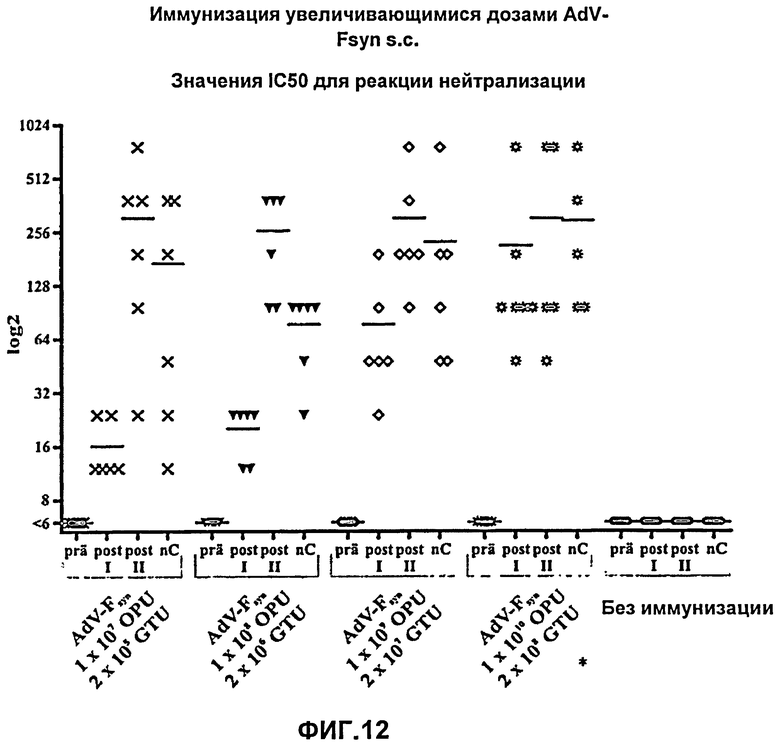
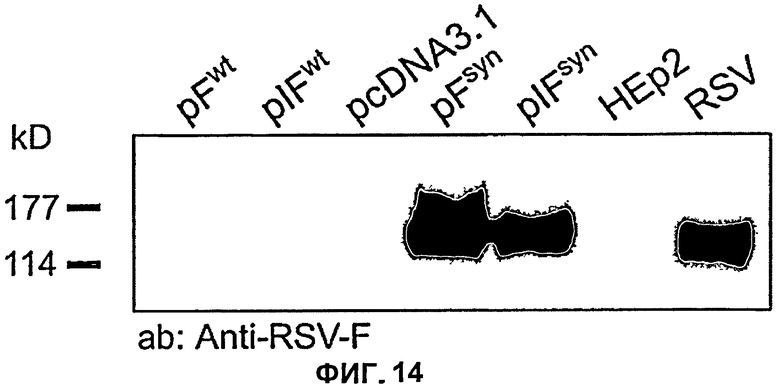

Изобретение относится к области биотехнологии и вирусологии. Раскрыта молекула нуклеиновой кислоты, которая кодирует F-белок респираторно-синцитиального вируса или фрагмент указанного белка, оптимизированная для экспрессии в клетке человека. Также раскрыты вектор и композиция, которые содержат указанную молекулу нуклеиновой кислоты. Изобретение может быть использовано для получения вакцины против респираторно-синцитиального вируса и ее использования в медицине. 5 н. и 3 з.п. ф-лы, 15 ил., 13 пр.
1. Молекула нуклеиновой кислоты, которая содержит последовательность нуклеотидов, кодирующую F-белок респираторно-синцитиального вируса (РСВ) или фрагмент указанного белка, характеризующаяся тем, что указанная последовательность нуклеотидов содержит SEQ ID NO:1 или фрагмент указанной последовательности, содержащие кодоны, оптимизированные для экспрессии в клетках человека.
2. Молекула нуклеиновой кислоты по п.1, отличающаяся тем, что молекула нуклеиновой кислоты содержит нуклеотидную последовательность SEQ ID NO:2 или фрагмент указанной последовательности.
3. Вектор для экспрессии F-белка респираторно-синцитиального вируса (РСВ) или фрагмента указанного белка в клетках человека, содержащий молекулу нуклеиновой кислоты по пп.1 и 2.
4. Вектор по п.3, отличающийся тем, что указанный вектор представляет собой вирусный вектор или плазмидный вектор.
5. Вектор по п.4, отличающийся тем, что указанный вирусный вектор является аденовирусным вектором и содержит (а) молекулу нуклеиновой кислоты по пп.1 и 2 и (б) последовательности контроля транскрипции и/или трансляции, функционально связанные с молекулой нуклеиновой кислоты.
6. Композиция, иммуногенная по отношению к респираторно-синцитиальному вирусу (РСВ), содержащая молекулу нуклеиновой кислоты по любому из пп.1 и 2 или вектор по любому из пп.3-5, и фармацевтически приемлемый носитель.
7. Способ получения вакцины для вакцинации субъекта против заболевания, вызванного инфекцией респираторно-синцитиального вируса, включающий:
обеспечение молекулы нуклеиновой кислоты по любому из пп.1 и 2 или вектора по любому из пп.3-5;
приготовление препарата вакцины, который содержит указанную молекулу нуклеиновой кислоты или указанный вектор и подходящий носитель.
8. Способ получения F-белка респираторно-синцитиального вируса, который включает (а) осуществление трансфекции клетки-хозяина молекулой нуклеиновой кислоты по пп.1 и 2, (б) экспрессию молекулы нуклеиновой кислоты в указанной клетке-хозяине и (в) выделение белка, полученного на стадии (б).
| DU R.P | |||
| et al., "A prototype recombinant vaccine against respiratory syncytial virus and parainfluenza virus type 3", Biotechnology (N Y) | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| TANG R.S | |||
| et al., "Parainfluenza virus type 3 expressing the native or soluble fusion (F) Protein of Respiratory Syncytial Virus (RSV) confers protection from RSV infection in African | |||
Авторы
Даты
2012-10-20—Публикация
2007-12-18—Подача