Изобретение относится к области медицины и касается противоопухолевого средства, предназначенного для лечения злокачественных (малигнизированных) асцитов.
Злокачественный (малигнизированный) асцит - это патологическое накопление жидкости в брюшной полости, развивающееся вследствие опухолевого поражения брюшины. Асцит вызывает значительный дискомфорт и приводит к различным функциональным нарушениям у пациентов в запущенных стадиях онкологического заболевания и является сложной клинической проблемой. Малигнизированный асцит составляет примерно 10% среди всех случаев асцита и наиболее часто развивается при раке молочной железы, яичников, желудка, поджелудочной железы и толстой кишки.
В настоящее время имеется огромный арсенал химиотерапевтических препаратов, применяемых для лечения злокачественных заболеваний различных групп: алкилирующие препараты, цитостатики, антиметаболиты, противоопухолевые антибиотики, алкалоиды и другие биологические активные вещества растительного происхождения, а также ферментные и гормональные препараты (Машковский М.Д. Лекарственные средства. М., Медицина, 1984, часть 2, стр.425-475). Однако, несмотря на достигнутые успехи в химиотерапии злокачественных опухолей, поиск новых веществ, обладающих противоопухолевым действием, продолжается, поскольку все имеющиеся противоопухолевые препараты, как правило, затрагивают и нормальные ткани, обладают высокой токсичностью, вызывают побочные эффекты, связанные или не связанные с основным механизмом подавления размножения клеток: тошноту, рвоту, потерю аппетита, понос, снижение количества лейкоцитов, тромбоцитов и эритроцитов в крови, стоматит, сердечно-сосудистые расстройства, временную утрату волосяного покрова и другие. В некоторых случаях это ограничивает дозировку либо даже заставляет приостановить или прекратить лечение.
Наиболее близким по технической сущности к заявляемому является соединение джасплакинолид (jasplakinolide) (см. Jasplakinolide - An Actin-Specific Reagent that Promotes Actin Polymerization, Methods in Molecular Biology, 2001, Volume 161, Part III, 109-120) - природный продукт, выделяемый из морских губок и имеющий противогрибковую и противораковую активности. Джасплакинолид связывается с белком, отвечающим за стабильность клетки и включенного в механизм клеточного деления, что является перспективным для разработки новых противоопухолевых препаратов.
Задача данного изобретения заключается в расширении арсенала средств, пригодных для лечения злокачественных асцитных опухолей и не токсичных для нормальных клеток и в целом для всего организма.
Экспериментальным путем было установлено, что для решения этой задачи перспективным является давно известное вещество - дофамин.
Дофамин - 3,4-диоксифенилэтиламин, окситирамин, C6H3(OH)2CH2CH2(NH2), промежуточный продукт биосинтеза катехоламинов, образующийся в результате декарбоксилирования диоксифенилаланина (ДОФА). Ряд органов и тканей (печень, легкие, кишечник и др.) содержат преимущественно дофамин. Наряду с адреналином и норадреналином дофамин в небольших количествах секретируется надпочечниками, что свидетельствует о возможной самостоятельной гормональной функции дофамина. В центральной нервной системе дофамин содержится преимущественно в двигательных центрах, выполняя функцию медиатора. Дофамин обладает рядом фармакологических свойств, характерных для гормональных и адренергических веществ. Однако возможность использования его в качестве цитотоксического средства для лечения злокачественных асцитов не описана.
Техническим результатом, достигаемым при реализации изобретения, является обнаружение нового неочевидного свойства известного вещества - дофамина. Технический результат достигается тем, что известный дофамин общей формулы C6H3(OH)2CH2CH2(NH2) применяют в качестве средства для лечения злокачественных асцитов.
Возможность использования дофамина для лечения злокачественных асцитов была подтверждена на асцитной карциноме Эрлиха мышей. Было показано, что недельный курс ежедневных внутрибрюшинных инъекций дофамина (ДА) концентрацией 10-2 М и 10-1 М снижает, соответственно, в 10 и 30 раз по сравнению с контролем (инъекции физраствора) суммарное количество и уменьшает на 27% и на 59% диаметр клеток в асцитной карциноме Эрлиха мышей.
Сущность изобретения поясняется графическими материалами, где на
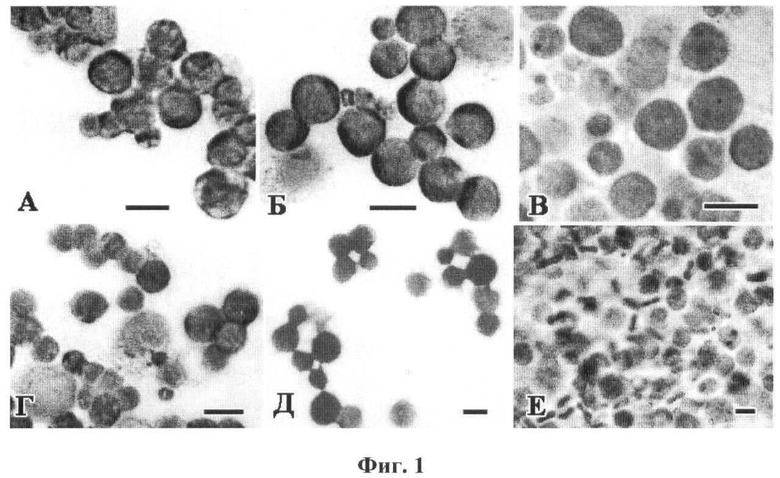
фиг.1 представлено влияние ДА на морфологию клеток перевиваемой асцитной карциномы Эрлиха (АКЭ), выявляемую в световом микроскопе (при увеличении ×50) на 6-е сутки после введения дофамина в брюшную полость, как описано в примере, где А-В - вид опухолевых клеток из асцита интактных (А, В) и контрольной (Б) мышей на мазках (А, Б) и в гистологическом срезе (В). Г-Д - вид опухолевых клеток после воздействия ДА концентрацией 0,017 М (Г), 0,17 М (Д) и 10-2 М (Е) на мазках (Г, Д) и в гистологическом срезе (Е). Масштаб 20 мкм (А-В), 15 мкм (Г) и 10 мкм (Д, Е).
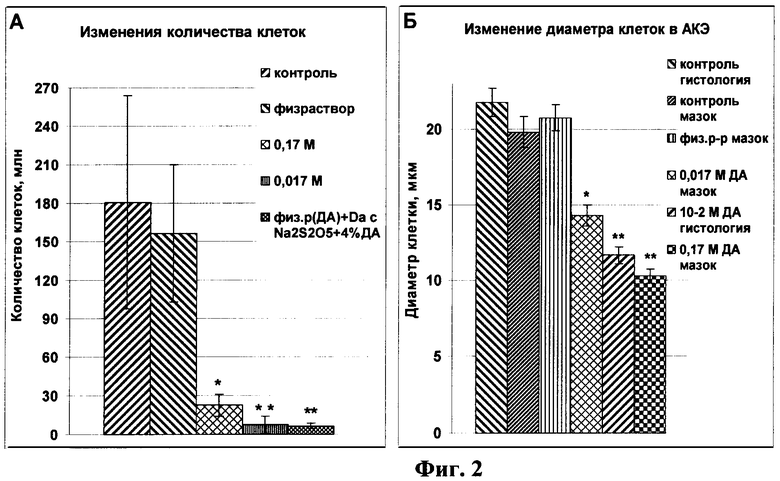
На фиг.2 представлены морфометрические данные по количеству и размерам клеток в асците интактных, контрольных и подопытных мышей, где А - количество опухолевых клеток, Б - диаметр опухолевых клеток, * - достоверное отличие от контроля при Р<0,05, ** - достоверное отличие от контроля и от подопытных значений, полученных при воздействиях ДА меньшей концентрацией при Р<0,05.
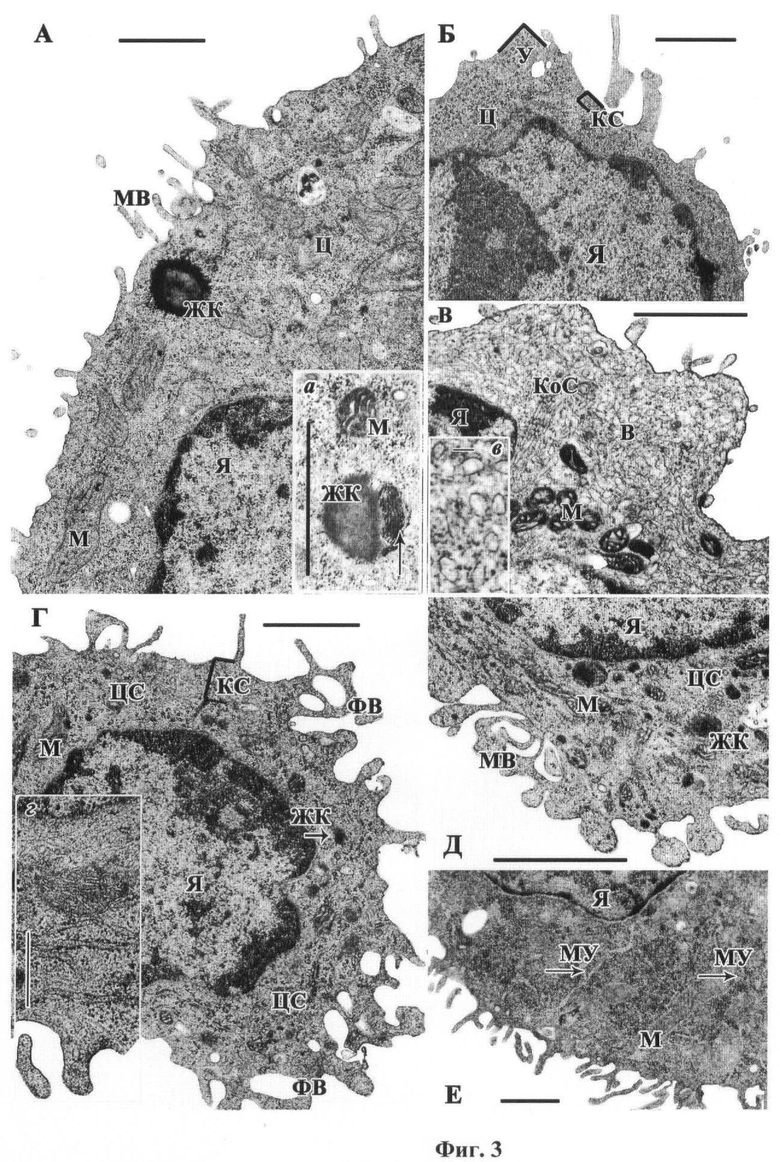
На фиг.3 показано влияние ДА на ультраструктуру клеток АКЭ, выявляемую в просвечивающем электронном микроскопе (при увеличении ×10000), где А-В - вид опухолевых клеток из асцита интактных (А, Б) и контрольных (В) мышей в ультратонких срезах. На вставках (а, в) даны изображения участков клеток, показывающие частичное рассасывание содержимого аденогранулы (а) и вакуолярную дистрофию клетки (в). Г-Е - вид опухолевых клеток после воздействия ДА концентрацией 10-1 М. Обозначения: MB - микровилли, Ц - цитозоль, Я - ядро, М - митохондрия, ЖК - жировая капля (аденогранула), (стрелка указывает на начало рассасывания содержимого гранулы). КС - кортикальный слой, МУ - муаровый узор. У - угловатость, КоС - кольчатая слоистость (annulate lamella), ФВ - фагоцитарная вакуоль. Масштабная линейка на рис.3А, а, Б, Г, г, Д, Е = 1 мкм, на рис 3в = 0,1 мкм.
Пример
В экспериментах использовали 140 самцов беспородных мышей линии SHK возрастом около 3 месяцев, весом 28-36 г, 20 из них - для пассирования опухоли. Работу с животными осуществляли в соответствии с международно признанными правилами и этическими нормами. Объектом исследования был штамм ELD перевиваемой асцитной карциномы Эрлиха (АКЭ). Инокуляцию опухоли производили инъекцией в брюшную полость мыши 106 клеток АКЭ в 0,1 мл физиологического раствора (ФР) для инфузий. Величина инокулята была выбрана в предварительных экспериментах с учетом ранее описанной методологии работы с АКЭ (Е.В.Инжеваткин. Практикум по экспериментальной онкологии на примере асцитной карциномы Эрлиха: Метод. разработка. Красноярск. 2004. 10 с.) и результатов предшествующих опытов, проведенных нами в условиях in vitro на культурах клеток (Мошков Д.А., Абрамова М.Б. и др. // Бюл. эксперим. биологии и медицины. 2010. Т.149, №3, С.335-339).
Дофамин (ДА) вводили мышам с инокулированной АКЭ внутрибрюшинно в объеме 1 мл через 18 часов после инокуляции опухоли и далее в течение 6 суток инъецировали ДА 2 раза в день с интервалом между инъекциями 5 час. Для этого использовали аптечный препарат ДА из ампул, содержащих 4% (или примерно 0,2 М) раствор с метабисульфитом (Pedrosa R., Soares-da-Siva P. et al. // Br. J. Pharmacol. 2002. Vol.137, N8. P.1305-1313, ОАО «Биохимик», РФ и Orion, Pharma, Финляндия), разбавленный аптечным физиологическим раствором (ФР) для инъекций до рабочих концентраций 0,02 М, 10-1 М, 10-2 М или неразведенный. Контрольным мышам инъецировали одновременно с инъекцией ДА равный по объему ФР. Часть мышей с перевитой опухолью оставляли интактными до конца эксперимента. По завершении экспериментов мышей забивали методом цервикальной дислокации, извлекали асцитную жидкость в пенициллиновые флаконы; отбирали пробы для подсчета количества клеток с помощью камеры Горяева, а оставшиеся асциты использовали для морфологического анализа клеток в мазках, в гистологических и ультратонких срезах. Статистическую обработку результатов проводили в программе Microsoft Excel (Microsoft Office 2003). Значимость различий данных определяли при помощи t-теста Стьюдента. Количественные данные представлены значениями среднего арифметического ± ошибка среднего при уровне значимости доверительного интервала 0,05.
Подсчет клеток в асците выявил (фиг.2), что в интактных и контрольных группах мышей злокачественных клеток в асците было в 10 раз больше по сравнению с подопытными группами, получавшими инъекции ДА в концентрации 0,02 М, 10-2 М, и более чем 25 раз больше, чем у мышей, получавших инъекции ДА в концентрации 10-1 М, или неразведенный. Размер клеток, выделенных из асцита подопытных мышей, по сравнению с интактными и контрольными мышами, при замерах на мазках и в гистологических срезах оказался меньше на четверть и на половину, в зависимости от концентраций ДА. Известно, что изменение объема клеток АКЭ прямо обусловлено степенью полимеризации цитозольного актина и формированием Ф-актинового цитоскелета (Pedersen S.F., Hoffmann E.K. et al. // Comp Biochem Physiol A Mol Integr Physiol. 2001. Vol.130, N.3. P.385-399). Цитологические (гистологические, ультраструктурные) исследования (фиг.1, 3) подтвердили, что дофамин вызывает полимеризацию актина и нарушение цитоскелета у злокачественных клеток.
Анализ гистологического строения клеток АКЭ, выявляемого на тотальных препаратах (мазках) и в толстых срезах, показывает, что опухолевые клетки имеют округлую форму и примерно одинаковый размер (фиг.1). Клетки опухоли интактных и контрольных животных на мазках имеют четкие контуры, цитоплазма у них плотная без заметных вакуолей или включений, контрольные препараты характеризовались несколько большей пропорцией поврежденных клеток, чем интактные, причина чего не выяснялась. В срезах они имеют несколько размытые контуры, различную плотность и более вариабельный размер, все это зависит от уровня среза индивидуальных клеток. При всех прочих равных условиях клетки АКЭ мышей, подвергнутые действию ДА, как на мазках, так и в срезах визуально имеют заметно меньший диаметр, и он более вариабелен в пределах одного кадра.
По результатам электронно-микроскопических исследований (фиг.3А, Б) ультраструктура клеток асцитов, взятых из интактных и контрольных мышей, идентична описанной ранее ультраструктуре клеток классического «дикого» штамма АКЭ (Roth J., Li W.P., Knibbs R.N. et al. // Proc Natl Acad Sci USA. 1994. Vol.91, N.24. P.11353-11357).
Как видно из фиг 3А, Б, поверхность округлых или имеющих заметно угловатую форму клеток опухоли интактных мышей по всему периметру покрыта частично деформированными узкими и короткими микроворсинками. Сразу под плазматической мембраной располагается узкий кортикальный слой, составленный из параллельно расположенных актиновых нитей. Кортикальный слой неравномерный, в виде островков, между ними цитозоль выходит непосредственно к мембране. Изредка под мембраной встречаются фагоцитозные вакуоли небольшого размера. Остальную часть цитоплазмы занимают многочисленные митохондрии ортодоксальной конформации, с продольными или поперечными кристами и светлым матриксом, очень редкие фрагменты одиночных цистерн шероховатого ретикулума и бесчисленные свободно лежащие рибосомы. Одним из идентификационных признаков клеток АКЭ являются округлые осмиофильные аденогранулы (липидные капли), рудимент секретируемого эпителия молочной железы, из которых произошел этот тип раковых клеток. Их заполненный или опорожненный полностью или частично вид (фиг.3, вставка а) свидетельствует о включении гранул в метаболизм карциномных клеток. В ядрах интактных клеток АКЭ хроматин сильно сконденсирован, ядрышки очень крупные. Ультраструктура клеток асцита контрольных и интактных мышей идентична. Главная особенность тех и других заключается в том, что они не содержат заметного Ф-актинового цитоскелета. Это отчетливо видно на живых по ультраструктурным признакам, но частично поврежденных клетках, в которых матрикс достаточно хорошо просматривается из-за потери части рибосом. Цитоплазма таких клеток претерпевает сильную вакуольную дистрофию и актиновые нити цитоскелета присутствуют только в кортикальном слое (фиг.3В, вставка в).
Иной вид имели раковые клетки, подвергаемые периодическим воздействиям ДА. Микровилли повреждаются, становятся существенно шире и длиннее или же приобретают грибовидную форму с ярко выраженной тонкой ножкой и широкой округлой головкой, внутри них часто располагаются крупные вакуоли, свидетельствующие о возросшей фагоцитарной активности клеток (фиг.3Г, Д). Кортикальный слой становится гораздо толще, чем в контроле. Размер и осмиофильность аденогранул уменьшается, почти все они имеют следы рассасывания содержимого, митохондрии приобретают конденсированную конформацию, с набухшими кристами и темным матриксом, рибосомы большей частью исчезают, и цитозоль в целом существенно просветляется. Отчетливо видно, что вся толща цитоплазмы от плазматической мембраны до ядра заполнена густой сетью актиновых нитей (фиг.3 вставка г, Д). Кроме того, в цитоплазме клеток отмечается формирование муаровых узоров (фиг.3Е), таких же, как в культивируемых клетках после хронического действия ДА (Парнышкова Е.Ю., Лавровская В.П. и др. // Морфология. 2011. Т.140, №6. 00-00), вызванное неравномерной конденсацией цитоплазмы из-за массовой полимеризации Г-актина под действием ДА. Ядра клеток не изменяются от действия ДА, но часто встречаются апоптозные тела вместо ядер, свидетельствующие о повышенной гибели клеток. Наблюдаются значительные изменения структуры поверхности (Г), заполнение всего пространства между плазматической мембраной и ядерной оболочкой сетью актиновых филаментов (г), возникновение грибовидных микровиллей (Д).
Таким образом, установлено, что ДА в условиях in vivo оказывает на клетки АКЭ цитотоксическое действие, схожее с ранее выявленным эффектом на культивированных фибробластоподобных и раковых клетках в условиях in vitro. Ультраструктурные особенности клеток АКЭ, подвергнутых действию ДА, свидетельствуют о том, что механизм его цитотоксичности заключается во взаимодействии с цитозольным Г-актином, судя по схожести эффектов ДА на АКЭ, на культивируемые клетки разного типа и на модельные системы, в том числе на выделенный Г-актин (Мошков Д.А., Павлик Л.Л., Шубина B.C., Парнышкова Е.Ю. и др. // Биофизика. 2010. Т.55, №5, С.850-856).
В частности, заметная деформация микровиллей и расширение кортикального слоя, сформированных преимущественно филаментозным актином, появление в цитозоле обширной сети, образованной нитями, которые мы идентифицируем как актиновые филаменты по их диаметру и локализации в местах, ранее занятых исключительно Г-актином, а также обнаруженное впервые существенное уменьшение размера клеток под действием ДА.
Эксперименты, проведенные на животных, показали, что онкотерапевтически эффективная концентрация ДА для АКЭ, привитой животным, на порядок выше той, которая считалась летальной для клеток АКЭ в культуре, возможно, в связи с объемным характером АКЭ и двухмерностью культур клеток, выращиваемых в чашках. Дальнейшее наблюдение за группой животных, получавших только в течение 6 суток дофамин (так как проведенное исследование не ставило задачу вылечить животных) в концентрации 10-1 М или неразведенный, показало, что они прожили на 2 месяца дольше, чем контрольные животные.
Все изложенное показывает, что дофамин, который является природным веществом, синтезируемом в организме, может рассматриваться как прототип нового класса соединений (Takeuchi H., Ara G. // Cancer Chemother. Pharmacol. 1998. Vol.42, N.6. P.491-496), обладающих противораковой активностью, действующих на основе прямого воздействия на Г-актин как на терапевтическую мишень клеток, патологически высокое содержание которого свойственно для раковых клеток, в частности для клеток асцитных опухолей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РАКОВЫМ КЛЕТКАМ ЧЕЛОВЕКА В КУЛЬТУРЕ | 2011 |
|
RU2453309C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОПУХОЛИ ТЕЛА МАТКИ ДЛЯ ИССЛЕДОВАНИЯ ЕЕ РЕГИОНАРНОГО ЛИМФАТИЧЕСКОГО РУСЛА | 2002 |
|
RU2220459C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ РАКА ЯИЧНИКА В ЭКСПЕРИМЕНТЕ У КРЫС | 2020 |
|
RU2743219C1 |
| СПОСОБ ЛЕЧЕНИЯ АСЦИТНОЙ ФОРМЫ РАКА | 2015 |
|
RU2595864C1 |
| Способ получения сыворотки против опухоли Эрлиха | 1975 |
|
SU563752A1 |
| СПОСОБ ЭРАДИКАЦИИ СТВОЛОВЫХ ИНИЦИИРУЮЩИХ РАКОВЫХ КЛЕТОК | 2013 |
|
RU2542410C1 |
| ЭНДОГЕННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОЛУЧЕННАЯ НА ОСНОВЕ ЦЕЛЕНАПРАВЛЕННОЙ АКТИВАЦИИ ГУМОРАЛЬНЫХ МЕДИАТОРОВ НЕРВНЫХ ОКОНЧАНИЙ КОРЫ ГОЛОВНОГО МОЗГА | 2003 |
|
RU2244928C2 |
| Способ ингибирования роста опухоли у млекопитающего | 2018 |
|
RU2713153C1 |
| ЭФИРЫ ОКТА-4,5-КАРБОНОВОЙ КИСЛОТЫ ФТАЛОЦИАНИНА КОБАЛЬТА, ИХ КОМПЛЕКСЫ ВКЛЮЧЕНИЯ С ПРОПИЛЕНГЛИКОЛЕВЫМ ЭФИРОМ β-ЦИКЛОДЕКСТРИНА И СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2000 |
|
RU2172319C1 |
| Способ разрушения асцитных клеток опухоли с помощью магнитных нанодисков и аптамеров в условиях переменного электромагнитного поля | 2023 |
|
RU2814394C1 |
Изобретение относится к медицине и представляет собой применение дофамина в качестве цитотоксического средства для лечения злокачественных асцитных опухолей. Изобретение обеспечивает расширение арсенала средств, пригодных для лечения злокачественных асцитных опухолей и не токсичных для нормальных клеток и в целом для всего организма. 3 ил.
Применение дофамина в качестве цитотоксического средства для лечения злокачественных асцитных опухолей.
| Holzinger A | |||
| "Jasplakinolide: an actin-specific reagent that promotes actin polymerization" | |||
| Methods Mol Biol | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2008 |
|
RU2361587C1 |
| ПРОТИВООПУХОЛЕВЫЕ И ИММУНОМОДУЛИРУЮЩИЕ СРЕДСТВА И СПОСОБЫ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ, КОЖНЫХ ЗАБОЛЕВАНИЙ И ТРОФИЧЕСКИХ ЯЗВ | 1994 |
|
RU2035182C1 |
| US 20090226431 A1, 10.09.2009 | |||
| US 2003223999 A1, 04.12.2003. | |||
Авторы
Даты
2012-10-27—Публикация
2011-10-12—Подача