Изобретение относится к области клеточной биологии и биофизики и может быть использовано в фармакологии для разработки противораковых средств.
Известно (БСЭ, http://bse.sci-lib.com/article 121178.html), что цитостатические средства (от цито… и греч. statikós - способный останавливать, останавливающий) это различные по химической структуре лекарственные вещества, блокирующие деление клеток. Механизмы подавления определенных этапов клеточного деления этими препаратами различны. Так, алкилирующие средства (например, эмбихин, циклофосфан) непосредственно взаимодействуют с ДНК; антиметаболиты подавляют обмен веществ в клетке, вступая в конкуренцию с нормальными метаболитами-предшественниками нуклеиновых кислот (антагонисты фолиевой кислоты - метотрексат; пуринов - 6-меркаптопурин, тиогуанин; пиримидинов - 5-фторурацил, цитозин-арабинозид). Некоторые противоопухолевые антибиотики (например, хризомаллин, рубомицин) блокируют синтез нуклеиновых кислот, а алкалоиды растительного происхождения (например, винкристин) - расхождение хромосом при делении клеток. Конечный эффект цитостатических средств - избирательное подавление делящихся клеток. Способность цитостатических средств подавлять размножение клеток используется преимущественно в химиотерапии злокачественных опухолей. Однако противоопухолевые средства затрагивают и нормальные ткани. Кроме того, многие противоопухолевые средства оказывают токсическое действие и вызывают побочные эффекты, связанные или не связанные с основным механизмом подавления размножения клеток: тошноту, рвоту, потерю аппетита, понос, снижение количества лейкоцитов, тромбоцитов и эритроцитов в крови, стоматит, сердечно-сосудистые расстройства, временную утрату волосяного покрова и другие. В некоторых случаях это ограничивает дозировку либо даже заставляет приостановить или прекратить лечение.
Наиболее близким по технической сущности к заявляемому является соединение джасплакинолид (jasplakinolide) (см. Jasplakinolide- An Actin-Specific Reagent that Promotes Actin Polymerization, Methods in Molecular Biology, 2001, Volume 161, Part III, 109-120) - природный продукт, выделяемый из морских губок и имеющий противогрибковую и противораковую активности. Джасплакинолид связывается с белком, отвечающим за стабильность клетки и включенного в механизм клеточного деления, что является перспективным для разработки новых противоопухолевых препаратов.
Однако джасплакинолид проникает в клетку только после растворения в спирте или диметилсульфоксиде и проявляет неоднозначный, часто противоположный эффект на внутриклеточный актин, что ограничивает его применение.
В связи с этим стоит задача поиска средств, с одной стороны, высокоэффективных для борьбы с раковыми заболеваниями, а с другой стороны, не токсичных для нормальных клеток и в целом для всего организма.
Экспериментальным путем было установлено, что для решения этой задачи перспективным является давно известное вещество - дофамин.
Дофамин - 3,4-диоксифенилэтиламин, окситирамин, C6H3(OH)2CH2CH2(NH2), промежуточный продукт биосинтеза катехоламинов, образующийся в результате декарбоксилирования диоксифенилаланина (ДОФА). Ряд органов и тканей (печень, легкие, кишечник и др.) содержат преимущественно дофамин. Наряду с адреналином и норадреналином дофамин в небольших количествах секретируется надпочечниками, что свидетельствует о возможной самостоятельной гормональной функции дофамина. В центральной нервной системе дофамин содержится преимущественно в двигательных центрах, выполняя функцию медиатора. Дофамин обладает рядом фармакологических свойств, характерных для гормональных и адренергических веществ. Однако возможность использования его в качестве цитотоксического средства не описана.
Техническим результатом, достигаемым при реализации изобретения, является обнаружение нового неочевидного свойства известного вещества - дофамина и его синтетического аналога - замещенного 3,4-дигидро-2(1H)-пиримидинтиона.
Технический результат достигается тем, что известный дофамин общей формулы C6H3(OH)2CH2CH2(NH2) или его синтетический аналог - замещенный 3,4-дигидро-2(1Н)-пиримидинтион (далее пиримидинтион) применяют в качестве цитотоксического средства по отношению к раковым клеткам человека в культуре.
Сущность изобретения поясняется графическими материалами, где
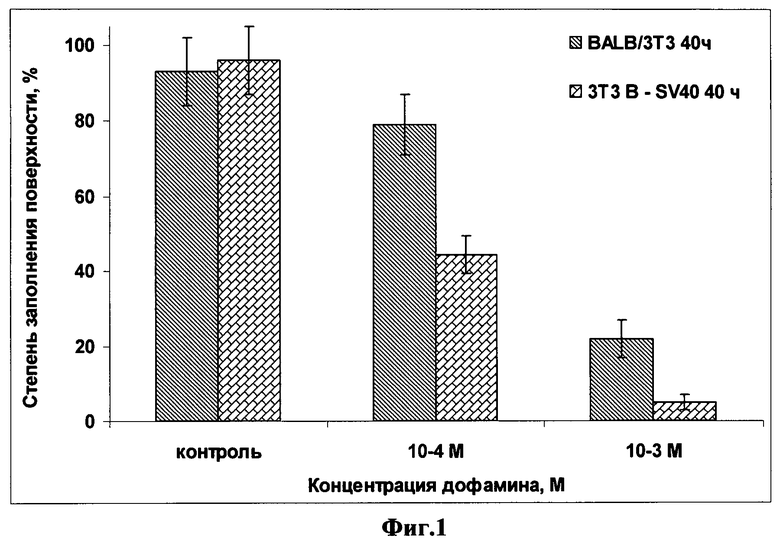
на фиг.1 представлена зависимость формирования монослоя культуры раковых клеток BALB/3T3 clone A31 и 3T3B-Sv40 от срока инкубации и концентрации дофамина в среде;
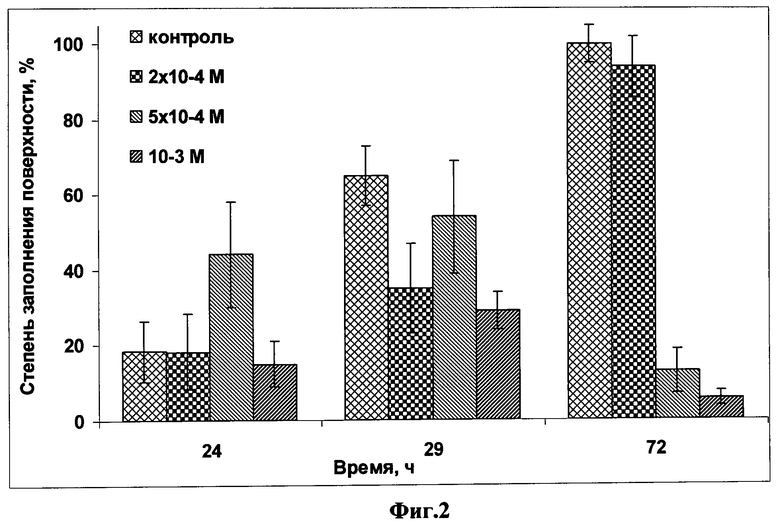
на фиг.2 - зависимость формирования монослоя культуры раковых клеток НЕр-2 от срока инкубации и концентрации в среде дофамина;
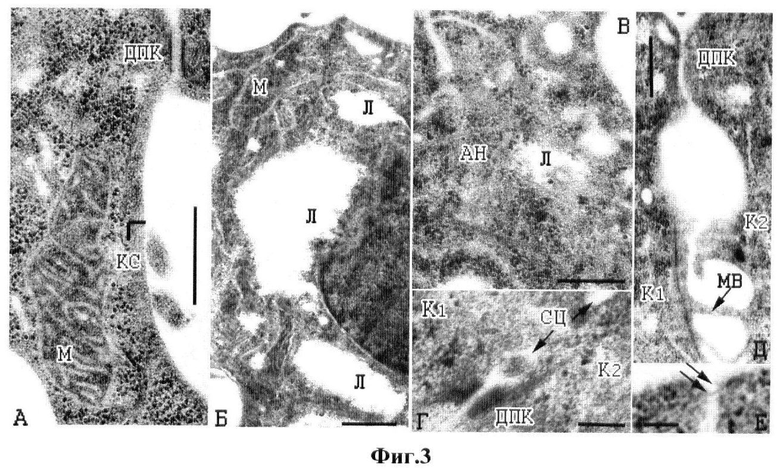
на фиг.3 - ультраструктура раковых клеток НЕр-2 после 3-суточной инкубации с дофамином в концентрации 2×10-4 М, где A - контрольная раковая клетка, часть поверхности с десмосомоподобным контактом (ДПК) и кортикальным слоем (КС); митохондрия (М); Б-Е - раковые клетки, подвергнутые действию дофамина. Б - обзорный вид, видны муаровые узоры (М) и лизисные лакуны (Л); В - участок цитозоля в глубине клетки при большем увеличении, видны многочисленные актиновые филаменты (АН), ассоциированные с лакунами (Л); Г-Е - повреждения контактов двух соседних клеток со слиянием части цитоплазмы (СЦ) в области десмосомоподобных контактов (Г), со слиянием смежных микроворсинок (MB) (Д), шунтирование двух клеток через плазматические мембраны актиновым мостиком (стрелки). Масштаб: А - 1 мкм; Б-Д - 0,5 мкм; Е - 0,1 мкм;
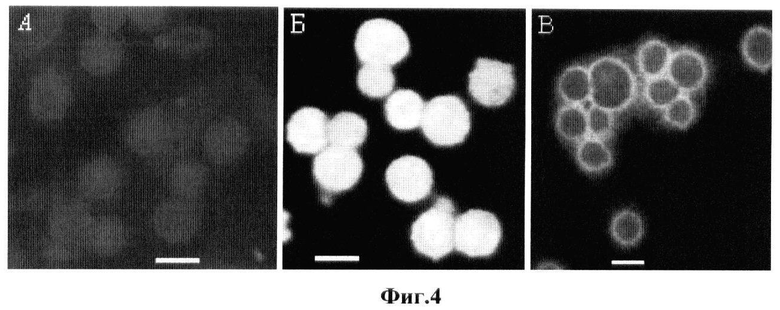
на фиг.4 - цитохимическая визуализация дофамина в клетках культуры Нер-2 в контроле и после воздействия дофамина и галоперидола, окрашенных по реакции Фалька, где А - контрольные клетки НЕр-2; Б - клетки Нер-2+10 мМ галоперидол + дофамин в концентрации 10-3 М. В - клетки НЕр-2+10 мМ галоперидол;
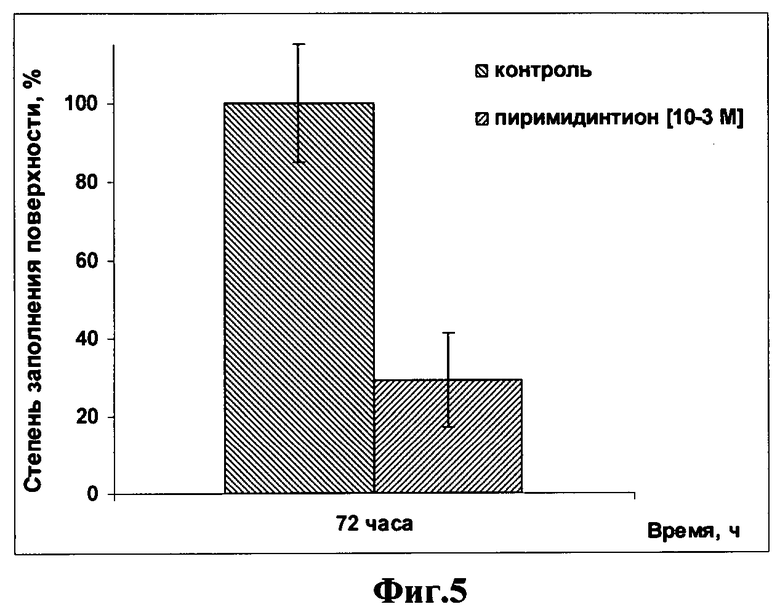
на фиг.5 - зависимость формирования монослоя культуры раковых клеток НЕр-2 от срока инкубации и концентрации в среде пиримидинтиона.
Пример 1. Для исследования цитотоксического действия дофамина брали культуру клеток BALB/3T3 clone A31 эмбриона мыши, являющихся нормальными клетками со свойственной им дифференцировкой актинового цитоскелета, и линию этих клеток - 3T3B-SV40, зараженных патогенным вирусом SV-40, в результате чего они малигнизируются с характерным для них патологически недифференцированным цитоскелетом. Исследовали действие дофамина на эти две культуры, связанные общим происхождением, но качественно различные по свойствам.
Клеточные культуры, полученные из Российской коллекции клеточных культур (Институт цитологии РАН, г.Санкт-Петербург), культивировали в 5 мл чашках Петри при 37°C и 5% CO2 в среде, содержащей RPMI-1640 и DMEM в соотношении 1:1 с добавлением 10% сыворотки крупного рогатого скота и гентамицина (80 мкг/мл) для обеспечения стерильности. Чтобы исключить побочный эффект окисления дофамина (Orion, Pharma, Финляндия) в культуральную среду добавляли антиоксидант - метабисульфит натрия в концентрации 200 мкМ (Pedrosa, Soares-da-Siva, 2002).
Для оценки действия дофамина на клетки дофамин вносили в клеточную суспензию одновременно с посевом (до распластывания клеток на дне чашки). При этом конечные концентрации дофамина были 1,0×10-4 М, 1,0×10-3 M. Выживаемость клеток, которые вносили в количестве 150000 на 2 мл среды (чашку Петри), оценивали через 40 часов после посева и результаты приведены на фиг.1, на которой представлена зависимость формирования монослоя культуры раковых клеток BALB/3T3 clone A31 и 3T3B-Sv40 от срока инкубации и концентрации в среде дофамина.
Как видно из фиг.1, дофамин оказывает на клетки цитотоксическое действие, пропорционально усиливающееся с увеличением концентрации дофамина. Видно, что количество контрольных клеток прогрессивно возрастает, достигая через 40 часов максимального значения, 100%-ного заполнения монослоем всей поверхности дна чашки Петри. Культивирование обоих клонов клеток в среде, содержащей дофамин концентрацией 1×10-4 M, вызывает ослабление их роста, более выраженное, двукратное, у культуры опухолевых клеток 3T3B-SV40, чем у ее нормального прототипа BALB/3T3 clone A31 (конфлуентность составила 40% и 80%, соответственно). Воздействие на клетки дофамина в концентрации 1×10-3 M оказывало еще больший негативный эффект. И в этом случае цитотоксический эффект дофамина на клетки культуры 3T3B-SV40 был более выраженным, чем у клеток BALB/3T3 clone A31. Выживаемость опухолевых клеток спустя 40 часов, судя по значениям конфлуентности, составила 2%, что в 5 раз ниже, чем та, которая характерна в этих же условиях для нормальных клеток (степень заполнения 20%). При сравнении же с контролем, жизнеспособность нормальных клеток падала в 5 раз, а опухолевых клеток - в 50 раз, соответственно.
Пример 2. Исследовали влияние дофамина на клетки рака гортани НЕр-2, полученные из Российской коллекции клеточных культур (Институт цитологии РАН, г.Санкт-Петербург).
Клетки, взятые в количестве 100000 на 2 мл среды (чашку Петри), культивировали в 5 мл чашках Петри при 37°C и 5% CO2 в среде, содержащей RPMI-1640 и DMEM в соотношении 1:1 с добавлением 10% сыворотки крупного рогатого скота и гентамицина (80 мкг/мл) для обеспечения стерильности. Чтобы исключить побочный эффект окисления дофамина (Orion, Pharma, Финляндия) в культуральную среду добавляли антиоксидант - метабисульфит натрия в концентрации 200 мкМ (Pedrosa, Soares-da-Siva, 2002).
Для оценки действия дофамина на клетки рака гортани НЕр-2 его вносили в клеточную суспензию одновременно с посевом (до распластывания клеток на дне чашки). При этом конечные концентрации дофамина были 1,5×10-4 M, 1,6×10-4 М, 2,0×10-4 М, 5,0×10-4 М, 1,0×10-3 М и 5,0×10-3 М. Выживаемость клеток оценивали через 3 суток после посева.
Динамику состояния клеток культуры изучали через 24 и 29 часов, 48 и 72 часа после посева. Зависимость формирования монослоя культуры раковых клеток НЕр-2 от срока инкубации и концентрации в среде дофамина представлена на фиг.2. Как видно из фиг.2 жизнеспособность клеток при действии дофамина в концентрации 2,0×10-4 М по сравнению с контролем, принятой за 100%, практически не изменялась, при концентрации дофамина 5,0×10-4 М снижается до 12%, а в концентрации 1,0×10-3 М снижается до 5,4%, то есть в 8,3 и в 18,5 раза, соответственно. При концентрации дофамина 2,0×10-4 М на 72 часу культивирования культура восстанавливалась и по плотности достигала контрольного значения, а при концентрации 5,0×10-4 M и 1×10-3 M ее плотность резко падала практически до нуля, что свидетельствует о массовой гибели клеток.
Для исследования ультраструктурных изменений в клетках под действием дофамина готовили препараты для микроскопии, которые фиксировали и обрабатывали следующим образом (Мошков Д.А. «Адаптация и структура нейрона», М.: Наука. (1985): 200 стр.).
Клетки отмывали от культуральной среды и фиксировали, при этом фиксаторы (как альдегиды, так и осмиевую кислоту) разводили на 0.1 М какодилатном буфере (рН 7.4), при этом использовали смесь глутаральдегида и параформа (формальдегида). Затем их дофиксировали в 1%-ном растворе четырехокиси осмия на какодилатном буфере (рН 7.4) в течение 1 ч. Далее препараты обезвоживали в растворах спиртов возрастающей концентрации и заливали в эпоксидную смолу Эпон-812 в тех же сосудах, в которых проводили культивирование. Клетки изучали непосредственно в залитом монослое в световом микроскопе NU-2E (Carl Zeiss), снабженном цифровым фотоаппаратом Nikon CoolPix 995, и в электронном микроскопе Tesia BS-500 после их ультратонкой резки с помощью ультратома ЕМ UC6 (Leica). Результаты микроскопических исследований ультраструктуры представлены на фиг.3. Были выявлены детали повреждений клеток, наблюдаемых под световым микроскопом. Как видно на представленных фотографиях (при увеличении X14000), цитоплазма контрольных клеток плотная из-за множества свободных рибосом и крупных вытянутых митохондрий, имеющих темный электронно-плотный матрикс. Характерной особенностью контрольных клеток НЕр-2 (А) является весьма узкий кортикальный слой, представляющий собой скопление под плазматической мембраной актиновых нитей, располагающихся вдоль ее профиля, а также отсутствие в глубине цитоплазмы протяженных актиновых нитей, свидетельствующее о преимущественно глобулярной форме актина в цитозоле. Это не типично для распластанных клеток, которые, как известно, имеют мощные пучки актиновых нитей в виде стресс-волокон (Фултон А. «Цитоскелет: Архитектура и хореография клетки», М.: Мир, 1987, 120 стр.). Воздействие дофамина существенно изменяет ультратонкую структуру клеток НЕр-2. Они округляются, поверхность их сглаживается за счет исчезновения или слияния микровиллей, профили ядер становятся извилистыми, внутри цитоплазмы образуются обширные прозрачные лакуны, представляющие собой лизированные области (Б). Также в цитоплазме формируются четко выраженные муаровые структуры, возникающие из-за нерегулярной конденсации актиновых филаментов (Б). Существенно, что у раковых клеток процессы формирования лизированных лакун и муарового рисунка сопряжены с появлением здесь же длинных актиновых нитей (В), что предполагает вовлечение вызванной дофамином полимеризации актина в образование указанных повреждений. Более детальное исследование ультраструктурных изменений в клетках НЕр-2 показало, что слияние соседних клеток друг с другом происходит различными путями. Это либо врастание отдельных микроворсинок в цитоплазму соседней клетки с расплавлением и утратой мембран в зоне контакта, таким образом, микроворсинка становится узкой цитоплазматической перемычкой между ними (Д). Либо слияние происходит в зоне расположения десмосомоподобных контактов, изначально богатых филаментозным актином (Г). Наконец, выявлены одиночные актиновые мостики между контактирующими клетками (Е), вдоль которых также может осуществляться патологический обмен субстратами.
Также исследовали цитохимическую визуализацию дофамина внутри клеток НЕр-2. Для этого клетки НЕр-2 инкубировали в культуральной среде с дофамином в концентрации 10-3 М в течение 30 минут и 5 ч в чашках Петри при 37°C в атмосфере 95% O2 и 5% CO2, на дно которых помещали покровное стекло, к которому клетки прикреплялись в процессе инкубации. По окончании инкубации клеток в присутствии дофамина неприкрепленные клетки осаждали центрифугированием и осадок трижды отмывали от дофамина ресуспендированием в среде DМЕМ. Промытые клетки наносили в виде мазка на предметное стекло и изучали под флуоресцентным микроскопом (AXIO Imager Zl (Carl Zeiss) при увеличении Х40). Клетки, прикрепившиеся к покровному стеклу, изучали прямо на нем, промыв их трехкратным погружением в среду DМЕМ.
В качестве контроля использовали клетки НЕр-2, инкубированные без дофамина. В качестве контроля для установления влияния дофаминовых рецепторов на проникновение дофамина внутрь клеток исследовали клетки, предварительно подвергнутые действию галоперидола - блокатора дофаминовых рецепторов, а также клетки, инкубированные в присутствии совместного действия галоперидола и дофамина. Галоперидол (аптечный раствор для инъекций) использовали в концентрации 10 мкМ. Концентрацию галоперидола рассчитывали так, чтобы была гарантирована блокада всех дофаминовых рецепторов при максимально размножившейся культуре. Цитохимическую реакцию на биогенные амины осуществляли по методу Фалька (Lindvall О., Björklund A., Falck В., Svensson L.A. Letters to the editor: New principles for microspectrofluorometric differentiation between DOPA, dopamine and noradrenaline J Histochem Cytochem. 1975, v.23, №9, p.697-699), для чего полученные мазки и монослои клеток высушивали 2 сут. над концентрированной серной кислотой и нагревали до 80°C над параформальдегидом. Изохинолины, образовавшиеся в процессе конденсации катехоламинов и паров формальдегида, визуализировали по флуоресценции при 490-500 нм (λех=330, 375 нм) с помощью микроскопа AXIO Imager Z1 (Carl Zeiss, ФРГ). Полученные результаты представлены на фиг.4. Как видно из фиг.4, флуоресцентная микроскопия клеток НЕр-2, применяемая для визуализации дофамина в цитозоле, выявляемого цитохимической реакцией Фалька, показала, что в норме катехоламинов внутри клеток практически нет, о чем свидетельствует почти полное отсутствие люминесценции (А). Инкубация клеток в среде, содержащей дофамин в комбинации с галоперидолом, приводит к многократному росту интенсивности свечения по всему объему клеток, показывающему содержание дофамина в высокой концентрации в цитоплазме и ядрах (Б). Высокий уровень люминесценции не позволил различить свечение поверхности клеток на фоне цитоплазмы. Однако в препаратах клеток НЕр-2, подвергнутых действию одного галоперидола (В), заметная люминесценция выявлена исключительно на периферии клеток, в полном соответствии с представлением о его блокаде дофаминовых рецепторов, расположенных на плазматической мембране, благодаря лигандным взаимодействиям.
Пример 3. Исследовали влияние дигидропиримидинтиона - синтетического аналога дофамина на клетки рака гортани НЕр-2.
Клетки НЕр-2 культивировали в 5 мл чашках Петри при 37°C и 5% CO2 в среде, содержащей RPMI-1640 и DMEM в соотношении 1:1 с добавлением 10% сыворотки крупного рогатого скота и гентамицина (80 мкг/мл) для обеспечения стерильности. Замещенный 3,4-дигидро-2(1Н)-пиримидинтион (пиримидинтион), синтезированный на основе дофамина и любезно предоставленный профессором, д.х.н. А.С.Фисюком (ОмГУ), применяли в 100%-ном растворе диметилсульфоксида в концентрации 10-3 М. Для оценки действия пиримидинтиона на клетки НЕр-2 его вносили в клеточную суспензию одновременно с посевом (до распластывания клеток на дне чашки). Выживаемость клеток оценивали спустя 3 суток после посева. Зависимость формирования монослоя культуры раковых клеток НЕр-2 от срока инкубации и концентрации в среде пиримидинтиона представлена на фиг.5. Как видно из фиг.5, действие пиримидинтиона в концентрации 1,0×10-3М снижает жизнеспособность клеток до 31% или в 3,2 раза по сравнению с контролем.
Приведенные примеры 2, 3 показывают, что раковые клетки НЕр-2 подвержены цитотоксическому действию дофамина и пиримидинтиона, которое усиливается с ростом концентрации этих веществ и длительностью культивирования (фиг.2, 5). Установлено, что наибольший эффект дофамина, а также пиримидинтиона - его синтетического аналога по морфологическому и функциональному действию на клетки, наблюдается через 72 часа инкубации, при этом введение в среду метабисульфита не сказывалось на жизнеспособности клеток НЕр-2. Жизнеспособность клеток при действии дофамина в концентрации 2,0×10-4 М по сравнению с контролем, принятой за 100%, практически не изменялась, в концентрации 5,0×10-4 М снижает ее до 12%, а в концентрации 1,0×10-3 M - до 5,4%, то есть в 8,3 и в 18,5 раза, соответственно. Для сравнения действие пиримидинтиона в концентрации 1,0×10-3 М снижает жизнеспособность клеток до 31% или в 3,2 раза.
Таким образом приведенные примеры показывают, что дофамин и пиримидинтион оказывают цитотоксический эффект на раковые клетки. Использование дофамина и пиримидинтиона в этом качестве обещает быть не только эффективным, но и избирательным. Предположительно это связано с преимущественной чувствительностью к дофамину первичных малигнизированных и метастазных клеток, богатых глобулярным актином. В целом, дофамин можно рассматривать как проникающий препарат с полимеризующим актин механизмом действия, близкий к уже известным веществам с такими же свойствами, бициклогептапептиду фаллоидину (Виланд Т., Фаульштих X. Фаллоидин. В кн. «Итоги и перспективы развития биоорганической химии и молекулярной биологии». Москва, «Наука», 1978, с.98-110) и циклодепсипептиду джасплакинолиду (Holzinger A. «Jasplakinolide. An Actin-Specific Reagent that Promotes Actin Polymerization». In Cytoskeleton Methods and Protocols, Ray H. Gavin, ed., SpringerLink. 2001, v.161, pt.3, p.109-120). Вместе с тем, дофамин по действию на клетки отличается от них. Фаллоидин в клетку не проникает, его инъецируют (Cooper J.A. Effects of cytochalasin and phalloidin on actin. J. Cell Biol. 1987, v.105, №4, p.1473-1478). Джасплакинолид, используемый и как противоопухолевый препарат (Takeuchi H., Ara G., Sausville E., Teicher В. Jasplakinolide: interaction with radiation and hyperthermia in human prostate carcinoma and Lewis lung carcinoma. Cancer Chemother. Pharmacol. 1998, v.42, №6, p.491-496), проникает в клетку только после растворения в спирте или диметилсульфоксиде, что ограничивает его применение. В то же время дофамин легко проникает в клетку, проявляет одинаковые свойства in vitro и in vivo и прямо визуализируется в клетке, что делает его не только перспективным в качестве цитотоксического средства, но и для исследований в клеточной биологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ АСЦИТНЫХ ОПУХОЛЕЙ | 2011 |
|
RU2464974C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕХМЕРНЫХ МАТРИЦ ДЛЯ ТКАНЕПОДОБНЫХ СТРУКТУР ИЗ КЛЕТОК ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2008 |
|
RU2396342C1 |
| Средство, обладающее противоклоногенной активностью в отношении опухолевых клеток человека | 2016 |
|
RU2648820C2 |
| Способ оценки площади эукариотических клеток, адгезированных на непрозрачных поверхностях | 2018 |
|
RU2700631C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФИБРОБЛАСТОПОДОБНЫХ КЛЕТОК ИЗ ПУПОЧНОГО КАНАТИКА НОВОРОЖДЕННОГО | 2008 |
|
RU2384618C2 |
| СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИОФАГОВ, СПЕЦИФИЧНО СВЯЗЫВАЮЩИХСЯ С КЛЕТКАМИ-МИШЕНЯМИ И ПРЕДНАЗНАЧЕННЫХ ДЛЯ ТЕРАПЕВТИЧЕСКИХ ЦЕЛЕЙ | 2003 |
|
RU2263146C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕХМЕРНЫХ СТРУКТУР КЛЕТОК МЛЕКОПИТАЮЩИХ С ИСПОЛЬЗОВАНИЕМ ПОЛИМЕРОВ 2,5-ДИГИДРОКСИБЕНЗОЙНОЙ КИСЛОТЫ | 2019 |
|
RU2742689C1 |
| КЛЕТОЧНАЯ ЛИНИЯ ЭМБРИОНАЛЬНОЙ РАБДОМИОСАРКОМЫ ЧЕЛОВЕКА 862 RMSar KDD | 2020 |
|
RU2737248C1 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ПРОДУКЦИЮ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА В КЛЕТКАХ СИСТЕМЫ МОНОНУКЛЕАРНЫХ ФАГОЦИТОВ | 2010 |
|
RU2438676C1 |
| СПОСОБ ПРЕДИФФЕРЕНЦИРОВКИ СТРОМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК КОСТНОГО МОЗГА В ТИРОЗИНГИДРОКСИЛАЗА-ПОЗИТИВНЫЕ КЛЕТКИ | 2014 |
|
RU2567671C1 |
Изобретение относится к области клеточной биологии. Дофамин и/или его синтетические аналоги, в частности замещенный 3,4-дигидро-2(1Н)-пиримидинтион, применяют в качестве цитотоксического средства по отношению к раковым клеткам человека в культуре. Предложенные вещества могут найти применение в медицине как основа для разработки лекарственных форм препаратов, используемых для терапии злокачественных новообразований. 5 ил., 3 пр.
Применение дофамина и/или его синтетических аналогов, в частности замещенного 3,4-дигидро-2(1Н)-пиримидинтиона, в качестве цитотоксического средства по отношению к раковым клеткам человека в культуре.
| Jasplakinolide - An Actin-Specific Reagent That Promotes Actin Polimerization, Methods in Molecular Biology, 2001, vol.161, part III, 109-120 | |||
| ВИЛАНД Т | |||
| и др | |||
| Итоги и перспективы развития биоорганической химии и молекулярной биологии | |||
| - М.: Наука, 1978, с.98-110 | |||
| ШУБИНА B.C | |||
| и др | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| - Цитология, 2009, т.51, №12, с.996-1004. | |||
Авторы
Даты
2012-06-20—Публикация
2011-05-11—Подача